دوره 33، شماره 7 - ( مهر 1404 )
جلد 33 شماره 7 صفحات 9204-9193 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Parvini Kohneh Shahri M. Role of HOXA10 and HOXA11 Genes in Endometrial Development and Infertility in the Polycystic Ovary Syndrome. JSSU 2025; 33 (7) :9193-9204
URL: http://jssu.ssu.ac.ir/article-1-6489-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6489-fa.html
پروینی کهنه شهری مریم. نقش ژنهای HOXA10 و HOXA11 در تکوین آندومتر و ناباروری در سندرم تخمدان پلیکیستیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (7) :9193-9204
متن کامل [PDF 1251 kb]
(179 دریافت)
| چکیده (HTML) (462 مشاهده)
متن کامل: (175 مشاهده)
مقدمه
سندرم تخمدان پلیکیستیک (PCOS) یکی از شایعترین و شناختهشدهترین اختلال غدد درونریز در میان زنان در سنین باروری است که تقریباً 5 تا 10 درصد از جمعیت را تحت تأثیر قرار میدهد (1). افزایش سطح آندروژنها، پرمویی، آکنه، اختلالات متابولیکی، التهاب مزمن خفیف، مقاومت به انسولین، عدم تخمکگذاری به دلیل اختلال در عملکرد فولیکولی، افزایش تعداد فولیکولهای کیستی، تغییر در مورفولوژی تخمدان و ناهنجاریهای آندومتر رحم بهویژه هایپرپلازی رحم از ویژگیهای اصلی این سندرم هستند (5-2). ناباروری ناشی از عدم تخمکگذاری شایعترین تظاهر بالینی این بیماری است. علاوه بر تخمدانها و عدم تخمکگذاری، آندومتر رحم نیز تحتتأثیر PCOS قرار میگیرد و در ناباروری نقش دارد (6,7). زنان مبتلا به PCOS به دلیل عدم تعادل هورمونهای استروئیدی بهویژه استروژن و عدم تخمکگذاری منظم که میتواند منجر به ضخیم شدن مداوم پوشش رحم شود، در معرض خطر ابتلا به هیپرپلازی آندومتر، کاهش میزان بارداری و سرطان آندومتر قرار دارند (10-8). عوامل ژنتیکی و ژنومی از عوامل کلیدی در ایجاد بیماریهای مختلف انسانی، از جمله PCOS و اختلالات متعدد آندومتر هستند. ژنهای هومئوتیک مانند ژنهای هومئوباکس (HOX/Hox) به دلیل اثرات کنترلیشان بر اندامزایی و عملکرد رحم در بزرگسالان مورد مطالعه قرار گرفتهاند (11).
روش بررسی
در مطالعه حاضر، در ابتدا یک جستجوی جامع در منابع علمی در پایگاه NCBI (https://www.ncbi.nlm.nih.gov) با استفاده از کلیدواژههای ژنهای HOXA10 و HOXA11، PCOS، تکوین آندومتر رحم و ناباروری انجام شد. سپس مقالات مروری و تحقیقی چاپ شده از سال 2000 تا 2025 با رویکرد نقش ژنهای HOXA10 و HOXA11 در تکوین آندومتر و ناباروری حاصل از عدم پذیرش آندومتر در PCOS بررسی شدند. در نهایت مجموعه گسترده ای از دادههای مرتبط با عملکردهای مهم ژن¬های HOXA10 و HOXA11 در تکوین سیستم تولیدمثلی و نیز مشکلات ناباروری حاصل از عدم پذیرش آندومتر در بیماری PCOS به دلیل اختلال در بیان صحیح این ژن¬ها گردآوری شدند.
ژنهای هومئوباکس (HOX/Hox): ژنهای HOX برای اولین بار در دروزوفیلا شناسایی، توالییابی و کلون شدند، جایی که به عنوان «تنظیمکنندههای اصلی هویت تکوینی» شناخته شدند (11,12). خانواده ژن HOX یک خانواده فاکتور رونویسی بسیار حفاظت شده است که نقش حیاتی در رشد و تکوین جنین دارند. آنها به زیرگروهی از ژنهای هومئوباکس تعلق دارند و بر روی کروموزومها در خوشههایی به نام خوشههای HOX قرار گرفتهاند. چندین ژن HOX در هر خوشه یافت میشوند که بیان آنها از نظر مکانی و زمانی کنترل میشود. سی و نه ژن HOX عملکردی بهطور گسترده در سراسر خوشههای HOX انسانی پراکنده شدهاند. این ژنها بر اساس همولوژی موقعیتی و شباهت توالی بین خوشهها، به ۱۳ گروه موازی تقسیم میشوند (13). در مورد بدن انسان، چهار خوشه مجزا: HOXA، HOXB، HOXC و HOXD، روی کروموزومهای7p15.2 (HOXA), 17q21.32 (HOXB), 12q13.13 (HOXC), 2q31.1 (HOXD) یافت میشوند (12, 11) (شکل 1).
ژنهای هومئوباکس HOXA در دوران جنینی بیان میشوند که برای الگودهی محور بدن ضروری است. تعیین هویت موقعیتی اندامهای در حال تشکیل در امتداد محور قدامی- خلفی یا سری- دمی بدن جنین یکی از عملکردهای اصلی ژنهای HOX است. آنها بر بیان ژنهای هدف پاییندستی که اندامزایی، مهاجرت و تمایز سلولی را کنترل میکنند، تأثیر میگذارند (14-16). هومئوباکس، یک توالی ۱۸۰ جفت بازی بسیار حفاظت شده است که در ژنهای HOX یافت میشود (18, 17). آنها فاکتورهای رونویسی حاوی یک موتیف متصلشونده به DNA به نام هومئودومین را کد میکنند. هومئودومین یک موتیف پروتئینی با ۶۰ اسید آمینه است. این اتصال به تنظیم فعالیت ژنهای دیگر کمک میکند. از آنجاییکه ژنهای HOX به عنوان تعدیلکنندههای رونویسی عمل میکنند، اتصال این هومئودومین به DNA بیان بسیاری از ژنهای هدف پاییندست با اثرات تکوینی را کنترل میکند (17, 12). علاوه بر داشتن اثرات کنترل کنندهگی اندامزایی در بدن جنین، ژنهای HOX به دلیل تاثیر مثبت بر عملکرد رحم در بزرگسالان مورد مطالعه قرار گرفتهاند. این ژنها نقش محوری در توسعه و عملکرد سیستم تولیدمثل، به ویژه در پذیرش آندومتر، لانهگزینی و باروری دارند (20, 19). بنابراین، اختلال در تنظیم ژن HOX می-تواند عامل بروز انواع اختلالات انسانی، مانند بدخیمیها، بهویژه سرطان خون، سرطان سینه و ریه، و ناهنجاریهای مادرزادی، بهویژه ناهنجاریهای اندام باشد (20, 19).
تمرکز ویژه بر ژنهای HOXA10 و HOXA11: خوشه ژنهای HOXA/Hoxa نقش مهمی در تمایز مورفولوژیکی دستگاه تولیدمثل زنان، تغییرات چرخهای آندومتر و لانهگزینی جنین دارند.(21). ژنهای HOXA10 و HOXA11 متعلق به خانواده وسیعتر خوشه ژنی HOXA هستند که رشد جنینی را هماهنگ میکنند و نقش حیاتی در رشد و تکوین دستگاه تناسلی زنان در طول جنینزایی دارند (20, 19). ژنهای HOXA تمایز مجاری مولرین به ساختارهای تناسلی بالغ را تنظیم میکنند. در پستانداران، HOXA9 در لوله فالوپ (Fallopian tube) بیان میشود و در تکوین لوله فالوپ نقش دارد. HOXA10 در ابتدا در اپیتلیوم لومینال و غدهای آندومتر بیان میشود و بعداً بیان آن به استروما محدود می-شود. HOXA11 در غدد و اپیتلیوم گردن رحم (Cervix) بیان میشود اگرچه در تنه رحم نیز بیان میشود. HOXA13 در واژن (Vagina) بیان میشود و در تکوین بخشهای انتهایی دستگاه تولیدمثلی زنانه نقش دارد (22). بیشترین میزان بیان این ژنها در آندومتر رحم گزارش شده است (24, 23) (شکل2). در رابطه با سلامت باروری، ژنهای HOXA10 و HOXA11 نقش حیاتی در پذیرش آندومتر بهویژه در طول دوره لانهگزینی ایفا میکنند (25). آنها به یکپارچگی ساختاری و عملکردی آندومتر کمک میکنند و آمادگی آن را برای لانهگزینی موفق جنین تضمین میکنند (26, 11). الگوهای بیان همپوشانی HOXA10 و HOXA11 هر دوی این ژنها را به ملزومات آرایش و تمایز رحم از جمله تمایز عملکردی آندومتر تبدیل میکند. کاهش بیان HOXA10 و HOXA11 موجب کاهش میزان لانهگزینی و در نهایت ناباروری میشود (24, 23). بهطور خاص، ژن HOXA10 یک جزء ذاتی از لانهگزینی، دسیدوالیزاسیون و تعدیل ایمنی در رحم بالغ است (27). تمایز استرومایی و دسیدوالیزاسیون فرآیندی است که با سیگنالینگ پروژسترون آغاز شده و توسط HOXA10 و HOXA11 تنظیم میشود. این فرآیند شامل بازسازی گسترده ماتریکس خارج سلولی (ECM)، افزایش بیان نشانگرهای دسیدوالی PRL و IGFBP1 و ایجاد یک محیط ایمنی پیش از لانهگزینی است (28, 21). پروتئین HOXA10 سنتز متالوپروتئینازهای ماتریکس (MMPs)، اینتگرینها (از جمله اینتگرین β3) و سیتوکینهایی مانند فاکتور مهارکننده لوسمی (LIF) را تعدیل میکند. این عناصر تهاجم تروفوبلاست را تقویت میکنند، بازسازی ماتریکس خارج سلولی (ECM) را بهبود میبخشند و چسبندگی سلولی را تقویت میکنند (19,20). از سوی دیگر، HOXA11 تنظیم ایمونولوژیکی و رشد اپیتلیال غدهای را تقویت میکند. این پروتئین ژنهایی را که برای بلوغ سلولهای استرومایی دسیدوال ضروری هستند، مانند پرولاکتین (PRL) و پروتئین متصل شونده به فاکتور رشد شبه انسولین 1 (IGFBP1) کنترل میکند. علاوه بر این، آزادسازی مواد شیمیایی تعدیلکننده سیستم ایمنی را افزایش میدهد و در نتیجه محیطی ایمنی را فراهم میکند که برای لانهگزینی جنینها مفید است (29).
علاوه بر نقشهایشان در دسیدوالیزاسیون سلولهای استرومایی، HOXA10 و HOXA11 از طریق مکانیسمهای مولکولی متمایزی که اساساً با اثرات آنها بر استروما متفاوت است، بر اپیتلیوم آندومتر برای دستیابی به لانهگزینی موفق نیز تأثیر میگذارند. در اپیتلیوم آندومتر، این ژنها در درجه اول مولکولهای چسبندگی سلولی مانند اینتگرین β3 و مسیرهای سیگنالینگ سیتوکین مانند LIF و IL-6 را تنظیم میکنند که برای ایجاد یک سطح اپیتلیال پذیرا برای اتصال جنین ضروری هستند. اختلال در بیان این ژن¬ها باعث شکست مکرر لانهگزینی و نتایج نامطلوب در روند باروری میشود (21,28). HOXA10 از طریق تنظیم ژنهای پاییندست، مستقیماً در جنینزایی رحم و لانهگزینی جنین نقش دارد. تغییر بیان این ژن باعث ناهنجاریهای رشدی رحم و اختلال در رشد آندومتر میشود. کاهش بیان HOXA10 با کاهش ضخامت و یکپارچگی آندومتر مرتبط است، بنابراین لانهگزینی را مختل میکند و منجر به ناباروری زنان میشود (30، 26، 11). الگوهای بیان این ژن ارتباط نزدیکی با چرخه قاعدگی دارد و برای بارداری موفق ضروری است. اختلال در بیان HOXA با مشکلات مختلف باروری مرتبط بوده و آن را به یک نشانگر بالقوه برای ارزیابی سلامت باروری زنان تبدیل میکند. (26, 19).
نقش HOXA10 و HOXA11 در عملکرد رحم و چرخه قاعدگی: ژنهای HOXA10 و HOXA11 الگوهای بیان پویایی را در طول چرخه قاعدگی نشان میدهند که با تغییرات هورمونی که آندومتر را برای لانهگزینی آماده میکنند، همسو است. در دستگاه تولیدمثلی بزرگسالان، استرادیول و پروژسترون بیان HOXA10 و HOXA11 را تنظیم میکنند که بر رشد، تمایز و پذیرش رحم تأثیر میگذارد. این هورمونهای استروئیدی به گیرندههای آندومتر خود متصل میشوند و رونویسی HOXA10 را فعال میکنند که به نوبه خود تمایز سلولی را تنظیم میکند و در نتیجه آندومتر پذیرای لانهگزینی جنین میشود (31). الگوهای بیان این ژن¬ها در طول چرخه قاعدگی، بهویژه در طول دوره لانهگزینی، متفاوت است. از آنجاییکه بیان HOXA10 و HOXA11 در طول چرخه قاعدگی وابسته به مرحله است، بهنظر میرسد که هم عملکرد مستقل و هم عملکرد مشترک استرادیول و پروژسترون بیان این ژنها را تنظیم میکند (32, 31).
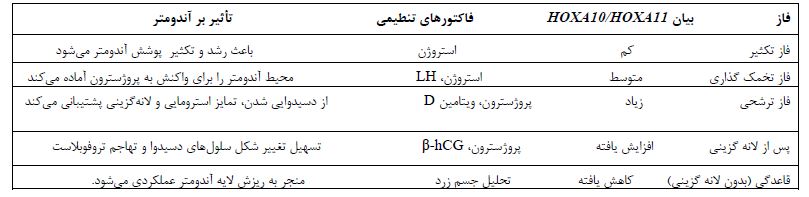
در طول چرخه قاعدگی طبیعی، سطح بیان آنها در فاز تکثیر نسبتاً پایین است. با افزایش سطح استرادیول، رشد و تکثیر پوشش آندومتر را القا میکنند و باعث افزایش خفیف HOXA10 میشوند. اثرات ترکیبی استرادیول و LH موجب افزایش قابلتوجه بیان HOXA10 در طول چرخه تخمکگذاری میشود (33). پس از آن، رحم برای تغییرات ناشی از پروژسترون که در طول فاز ترشحی رخ میدهد، آماده میشود. در این مرحله، پروژسترون ترشح شده از جسم زرد به هورمون غالب تبدیل میشود و بهصورت سینرژیک با استرادیول عمل میکند. بیان HOXA10 و HOXA11 از اواسط فاز ترشحی به اوج خود میرسد که همزمان با دوره پذیرش رحم و پنجره لانهگزینی است (26، 21). (شکل 3، جدول 1). کاهش قابلتوجه بیان mRNAی HOXA10 در طول فاز ترشحی چرخه قاعدگی میتواند منجر به شکست در لانهگزینی و از دست رفتن زودهنگام باروری شود (26).
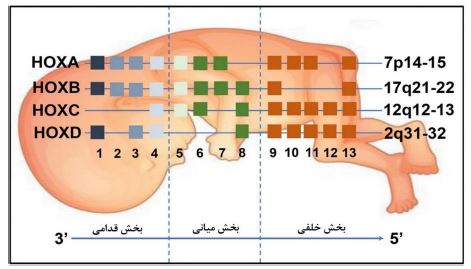
شکل 1: خوشههای ژنی HOX انسانی. 39 ژنهای HOX در چهار خوشه کروموزومی سازماندهی شدهاند: HOXA، HOXB، HOXC و HOXD (14).
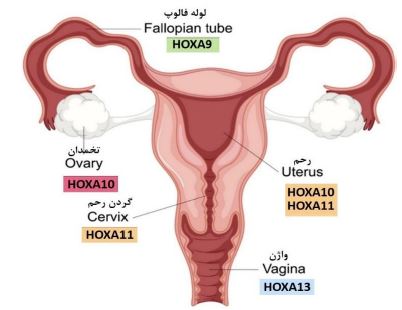
شکل 2: جایگاههای بیان ژنهای HOXA در رحم
جدول 1: بیان ژن HOXA10/HOXA11 در طول چرخه قاعدگی
.JPG)
شکل 3: بیان پویای ژنهای HOXA10 و HOXA11 در طول چرخه قاعدگی.
تعامل هورمونی استرادیول (E2) و پروژسترون (P4) در طول مراحل تکثیر، تخمکگذاری و ترشح، که باعث افزایش تنظیم متوالی HOXA10 و HOXA11 میشود.
ارتباط بین PCOS و اختلال در بیان ژنهای HOXA10 و HOXA11: PCOS یکی از علل مهم ناباروری است. در زنان مبتلا به PCOS، میزان سقط خودبهخودی افزایش و میزان لقاح کاهش مییابد (34). ژنهای HOXA10 و HOXA11 مسئول تشکیل رحم هستند (35). PCOS با تغییر بیان ژنهای HOXA10 و HOXA11 مرتبط است. جهشها یا تغییر بیان HOXA10 منجر به ناباروری یا کمباروری از طریق ایجاد اختلال در عملکرد آندومتر میشوند (36). اختلال عملکرد آندومتر با نقص در دسیدوالیزاسیون، اختلال در سیگنالینگ پروژسترون، تکثیر مداوم سلولی و سطح بالای نشانگرهای التهابی مرتبط است (6). این تغییرات مربوط به بیان متفاوت ژن در طول مراحل تکثیر و ترشح چرخه قاعدگی است (37). در PCOS، کاهش شاخصهای آندومتری که همگی برای رشد و عملکرد اندومتر ضروری در نظر گرفته میشوند از جمله بیان ژنهای HOXA10 وHOXA11 (38,39)، شاخصهای دسیدوالیزاسیون مانند پروتئین متصلشونده به فاکتور رشد شبه انسولین 1 (IGFBP-1) (6,40)، پروتئینهای نشانگر پذیرش آندومتر مانند فاکتور مهارکننده لوسمی (LIF)، پروتئین اندومتر مرتبط با پروژسترون (PAEP) و گلوتاتیون پراکسیداز 3 (GPX3) گزارش شده است (41, 37). بیان HOXA10 تحت تأثیر هورمونهای استروئیدی، بهویژه استروژن، قرار میگیرد. در زنان PCOS ترشح بیش از حد آندروژن، بیان HOXA10 را در طول مرحله ترشحی چرخه قاعدگی کاهش میدهد. مطالعات متعددی تغییر بیان HOXA10 آندومتر را در بیماران مبتلا به سندرم تخمدان پلیکیستیک، شکست مکرر لانهگزینی و سقط مکرر نشان دادهاند که میتواند دلیل لانهگزینی ناقص مشاهده شده در این بیماران باشد (42). نشان داده شده است که تستوسترون، هورمونی که اغلب در PCOS افزایش مییابد، مستقیماً بیان HOXA10 را در سلولهای گرانولوزا کاهش میدهد (43). کاهش بیان HOXA10 همچنین با متابولیسم غیرطبیعی لیپید، بهویژه سنتز کلسترول، مرتبط است و ممکن است بر پروفایل کلی لیپید در زنان مبتلا به PCOS تأثیر بگذارد. مشخص شده است که HOXA10 ژنهای دخیل در سنتز کلسترول را در سلولهای استرومایی آندومتر تنظیم میکند. بیان HOXA10 در زنان مبتلا به PCOS همبستگی مثبتی با سطح کلسترول HDL و همبستگی منفی با کلسترول تام (TC)، تریگلیسیرید (TG) و کلسترول LDL دارد (42،44). درک تعامل بین HOXA10، هورمونهای استروئیدی و متابولیسم لیپید برای توسعه درمانهای هدفمند برای مشکلات تولیدمثلی و متابولیکی مرتبط با PCOS بسیار مهم است. یافته¬های مولکولی نقش اساسی این ژن¬ها را در سلامت تولیدمثل و اختلال در تنظیم آنها را در بروز مشکلات دخیل در ناباروری برجسته میکند.
ارزیابی بیان ژنهای HOXA10 و HOXA11 پتانسیل فوقالعادهای را به عنوان یک تکنیک تشخیصی برای ارزیابی پذیرش آندومتر نشان داده است (26). اوزدمیر و همکاران نشان دادند که استفاده از روش مرسوم عکسبرداری رحم هیستروسالپینگوگرافی HSG ((Hysterosalpingography با افزایش بیان ژنهای HOXA10 و HOXA11 در اندومتر رحم، باروری را در زنان نابارور بهبود میبخشد. در مقایسه با افراد سالم، سطح بیان این ژنها در آندومتر بیماران نابارور قبل از انجام HSG بهطور قابلتوجهی پایینتر بود. پس از انجام HSG، سطح بیان این ژن¬ها بهطور قابلتوجهی افزایش یافت. افزایش بیان HOXA10 بیشتر از HOXA11 بود (45). مطالعه دیگری نشان داد که برداشتن لاپاراسکوپی آندومتریوما، بیان mRNA مربوط به HOXA-10 و HOXA-11 را در آندومتر در حوالی لانهگزینی افزایش میدهد که نشاندهنده بهبود پذیرش آندومتر است (46). در مطالعه کارا و همکاران کاهش بیان ژن¬های HOXA-10 و HOXA-11 در بیماران PCOS در مقایسه با افراد سالم گزارش شد که ممکن است در ناباروری مرتبط با PCOS نقش داشته باشد (34). سرمیک و همکاران نیز در مطالعه خود کاهش بیان ژن HOXA-10 را در بیماران مبتلا به PCOS در مقایسه با افرا سالم نشان دادند (39). یافتههای اولیه نشان میدهد که متفورمین و رژیم غذایی با کربوهیدرات کنترلشده، عملکرد آندومتر را در بیماران PCOS بهبود میبخشند، که تا حدودی با کاهش سطح متیلاسیون پروموتور ژن HOXA10 و بیان ژنهای دخیل در پذیرش آندومتر و سیگنالینگ انسولین همراه است (47). در زنان مبتلا به PCOS، بیان HOXA10 در سلولهای استرومایی با درمان متفورمین در مقایسه با سطح آن قبل از درمان افزایش یافت (48). ویتامین D از طریق گیرنده خود (VDR) میتواند مستقیماً بر بیان HOXA10 در آندومتر تأثیر بگذارد که ممکن است بر نتایج تولیدمثلی زنان مبتلا به PCOS که تحت القای تخمکگذاری (OI ,Ovulation Induction) قرار میگیرند، تأثیر بگذارد. مطالعات نشان میدهد که سطح بالاتر ویتامین D با افزایش بیان HOXA10 در آندومتر مرتبط است و بهطور بالقوه بر میزان لانهگزینی و بارداری در بیماران PCOS که تحت القای تخمکگذاری قرار میگیرند، تأثیر میگذارد (50, 49, 26). با این وجود، دادههای متناقضی در مورد نقش احتمالی ژنهای HOXA10 و HOXA11 در لانهگزینی وجود دارد. برخی از گزارش دادهاند که بیان HOXA-10 و HOXA-11 منجر به افزایش در طول دوره لانهگزینی میشود (51, 27). برعکس، کائو و همکارانش هیچ تغییری مشاهده نکردند (52). یافتههای متناقضی نیز در مورد بیان HOXA10 در هیپرپلازی آندومتر وجود دارد که با تکثیر غیرطبیعی بافت آندومتر تعریف میشود. گرچه دادههای بالینی کمی در مورد ارتباط HOXA10 با هیپرپلازی آندومتر وجود دارد، تحقیقات تجربی به وضوح نشان میدهد که کاهش بیان این ژن در ایجاد هیپرپلازی نقش دارد (53). به دلیل محدودیتهای مدلهای انسانی و حیوانی، میزان تاثیر ژن HOXA10 در هیپرپلازی اندومتر در حد متوسط در نظر گرفته میشوند (35).
نتیجهگیری
نتایج مطالعات متعددی که در این مقاله بررسی شد، اهمیت حیاتی ژنهای HOXA10 و HOXA11 را در تکوین، تمایز و عملکرد آندومتر بهویژه در دوره باروری زنان نشان میدهد. این دو ژن، که بیان آنها بهطور دقیق تحت تأثیر هورمونهای جنسی استروژن و پروژسترون تنظیم میشود، در مرحله ترشحی چرخه قاعدگی به اوج خود میرسند؛ زمانی که رحم باید برای لانهگزینی جنین آماده باشد. HOXA10 و HOXA11 تنظیمکنندههای کلیدی رشد و پذیرش اندومتر، به ویژه در طول لانهگزینی هستند. بیان مناسب آنها برای بارداری موفق ضروری است و اختلال در تنظیم آنها با ناباروری و اختلالات زنان مرتبط است. شکست در لانهگزینی میتواند مسئول ناباروری در بیماران مبتلا به PCOS باشد. بنابراین، میتوان گفت که بررسی الگوی بیان این ژنها نهتنها در درک بهتر مکانیسمهای پاتوفیزیولوژیک PCOS نقش دارد، بلکه میتواند بهعنوان یک نشانگر زیستی بالقوه برای تشخیص زودهنگام اختلالات لانهگزینی یا حتی هدفی برای مداخلات درمانی مورد توجه قرار گیرد. مطالعات آینده با تمرکز بر اصلاح بیان ژنهای HOXA و بهینهسازی پاسخ آندومتر به هورمونها میتواند مسیرهای درمانی جدید و مؤثری را برای بهبود باروری در زنان مبتلا به PCOS فراهم سازد.
حامی مالی: دانشگاه آزاد اسلامی، واحد ارومیه
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
سندرم تخمدان پلیکیستیک (PCOS) یکی از شایعترین و شناختهشدهترین اختلال غدد درونریز در میان زنان در سنین باروری است که تقریباً 5 تا 10 درصد از جمعیت را تحت تأثیر قرار میدهد (1). افزایش سطح آندروژنها، پرمویی، آکنه، اختلالات متابولیکی، التهاب مزمن خفیف، مقاومت به انسولین، عدم تخمکگذاری به دلیل اختلال در عملکرد فولیکولی، افزایش تعداد فولیکولهای کیستی، تغییر در مورفولوژی تخمدان و ناهنجاریهای آندومتر رحم بهویژه هایپرپلازی رحم از ویژگیهای اصلی این سندرم هستند (5-2). ناباروری ناشی از عدم تخمکگذاری شایعترین تظاهر بالینی این بیماری است. علاوه بر تخمدانها و عدم تخمکگذاری، آندومتر رحم نیز تحتتأثیر PCOS قرار میگیرد و در ناباروری نقش دارد (6,7). زنان مبتلا به PCOS به دلیل عدم تعادل هورمونهای استروئیدی بهویژه استروژن و عدم تخمکگذاری منظم که میتواند منجر به ضخیم شدن مداوم پوشش رحم شود، در معرض خطر ابتلا به هیپرپلازی آندومتر، کاهش میزان بارداری و سرطان آندومتر قرار دارند (10-8). عوامل ژنتیکی و ژنومی از عوامل کلیدی در ایجاد بیماریهای مختلف انسانی، از جمله PCOS و اختلالات متعدد آندومتر هستند. ژنهای هومئوتیک مانند ژنهای هومئوباکس (HOX/Hox) به دلیل اثرات کنترلیشان بر اندامزایی و عملکرد رحم در بزرگسالان مورد مطالعه قرار گرفتهاند (11).
روش بررسی
در مطالعه حاضر، در ابتدا یک جستجوی جامع در منابع علمی در پایگاه NCBI (https://www.ncbi.nlm.nih.gov) با استفاده از کلیدواژههای ژنهای HOXA10 و HOXA11، PCOS، تکوین آندومتر رحم و ناباروری انجام شد. سپس مقالات مروری و تحقیقی چاپ شده از سال 2000 تا 2025 با رویکرد نقش ژنهای HOXA10 و HOXA11 در تکوین آندومتر و ناباروری حاصل از عدم پذیرش آندومتر در PCOS بررسی شدند. در نهایت مجموعه گسترده ای از دادههای مرتبط با عملکردهای مهم ژن¬های HOXA10 و HOXA11 در تکوین سیستم تولیدمثلی و نیز مشکلات ناباروری حاصل از عدم پذیرش آندومتر در بیماری PCOS به دلیل اختلال در بیان صحیح این ژن¬ها گردآوری شدند.
ژنهای هومئوباکس (HOX/Hox): ژنهای HOX برای اولین بار در دروزوفیلا شناسایی، توالییابی و کلون شدند، جایی که به عنوان «تنظیمکنندههای اصلی هویت تکوینی» شناخته شدند (11,12). خانواده ژن HOX یک خانواده فاکتور رونویسی بسیار حفاظت شده است که نقش حیاتی در رشد و تکوین جنین دارند. آنها به زیرگروهی از ژنهای هومئوباکس تعلق دارند و بر روی کروموزومها در خوشههایی به نام خوشههای HOX قرار گرفتهاند. چندین ژن HOX در هر خوشه یافت میشوند که بیان آنها از نظر مکانی و زمانی کنترل میشود. سی و نه ژن HOX عملکردی بهطور گسترده در سراسر خوشههای HOX انسانی پراکنده شدهاند. این ژنها بر اساس همولوژی موقعیتی و شباهت توالی بین خوشهها، به ۱۳ گروه موازی تقسیم میشوند (13). در مورد بدن انسان، چهار خوشه مجزا: HOXA، HOXB، HOXC و HOXD، روی کروموزومهای7p15.2 (HOXA), 17q21.32 (HOXB), 12q13.13 (HOXC), 2q31.1 (HOXD) یافت میشوند (12, 11) (شکل 1).
ژنهای هومئوباکس HOXA در دوران جنینی بیان میشوند که برای الگودهی محور بدن ضروری است. تعیین هویت موقعیتی اندامهای در حال تشکیل در امتداد محور قدامی- خلفی یا سری- دمی بدن جنین یکی از عملکردهای اصلی ژنهای HOX است. آنها بر بیان ژنهای هدف پاییندستی که اندامزایی، مهاجرت و تمایز سلولی را کنترل میکنند، تأثیر میگذارند (14-16). هومئوباکس، یک توالی ۱۸۰ جفت بازی بسیار حفاظت شده است که در ژنهای HOX یافت میشود (18, 17). آنها فاکتورهای رونویسی حاوی یک موتیف متصلشونده به DNA به نام هومئودومین را کد میکنند. هومئودومین یک موتیف پروتئینی با ۶۰ اسید آمینه است. این اتصال به تنظیم فعالیت ژنهای دیگر کمک میکند. از آنجاییکه ژنهای HOX به عنوان تعدیلکنندههای رونویسی عمل میکنند، اتصال این هومئودومین به DNA بیان بسیاری از ژنهای هدف پاییندست با اثرات تکوینی را کنترل میکند (17, 12). علاوه بر داشتن اثرات کنترل کنندهگی اندامزایی در بدن جنین، ژنهای HOX به دلیل تاثیر مثبت بر عملکرد رحم در بزرگسالان مورد مطالعه قرار گرفتهاند. این ژنها نقش محوری در توسعه و عملکرد سیستم تولیدمثل، به ویژه در پذیرش آندومتر، لانهگزینی و باروری دارند (20, 19). بنابراین، اختلال در تنظیم ژن HOX می-تواند عامل بروز انواع اختلالات انسانی، مانند بدخیمیها، بهویژه سرطان خون، سرطان سینه و ریه، و ناهنجاریهای مادرزادی، بهویژه ناهنجاریهای اندام باشد (20, 19).
تمرکز ویژه بر ژنهای HOXA10 و HOXA11: خوشه ژنهای HOXA/Hoxa نقش مهمی در تمایز مورفولوژیکی دستگاه تولیدمثل زنان، تغییرات چرخهای آندومتر و لانهگزینی جنین دارند.(21). ژنهای HOXA10 و HOXA11 متعلق به خانواده وسیعتر خوشه ژنی HOXA هستند که رشد جنینی را هماهنگ میکنند و نقش حیاتی در رشد و تکوین دستگاه تناسلی زنان در طول جنینزایی دارند (20, 19). ژنهای HOXA تمایز مجاری مولرین به ساختارهای تناسلی بالغ را تنظیم میکنند. در پستانداران، HOXA9 در لوله فالوپ (Fallopian tube) بیان میشود و در تکوین لوله فالوپ نقش دارد. HOXA10 در ابتدا در اپیتلیوم لومینال و غدهای آندومتر بیان میشود و بعداً بیان آن به استروما محدود می-شود. HOXA11 در غدد و اپیتلیوم گردن رحم (Cervix) بیان میشود اگرچه در تنه رحم نیز بیان میشود. HOXA13 در واژن (Vagina) بیان میشود و در تکوین بخشهای انتهایی دستگاه تولیدمثلی زنانه نقش دارد (22). بیشترین میزان بیان این ژنها در آندومتر رحم گزارش شده است (24, 23) (شکل2). در رابطه با سلامت باروری، ژنهای HOXA10 و HOXA11 نقش حیاتی در پذیرش آندومتر بهویژه در طول دوره لانهگزینی ایفا میکنند (25). آنها به یکپارچگی ساختاری و عملکردی آندومتر کمک میکنند و آمادگی آن را برای لانهگزینی موفق جنین تضمین میکنند (26, 11). الگوهای بیان همپوشانی HOXA10 و HOXA11 هر دوی این ژنها را به ملزومات آرایش و تمایز رحم از جمله تمایز عملکردی آندومتر تبدیل میکند. کاهش بیان HOXA10 و HOXA11 موجب کاهش میزان لانهگزینی و در نهایت ناباروری میشود (24, 23). بهطور خاص، ژن HOXA10 یک جزء ذاتی از لانهگزینی، دسیدوالیزاسیون و تعدیل ایمنی در رحم بالغ است (27). تمایز استرومایی و دسیدوالیزاسیون فرآیندی است که با سیگنالینگ پروژسترون آغاز شده و توسط HOXA10 و HOXA11 تنظیم میشود. این فرآیند شامل بازسازی گسترده ماتریکس خارج سلولی (ECM)، افزایش بیان نشانگرهای دسیدوالی PRL و IGFBP1 و ایجاد یک محیط ایمنی پیش از لانهگزینی است (28, 21). پروتئین HOXA10 سنتز متالوپروتئینازهای ماتریکس (MMPs)، اینتگرینها (از جمله اینتگرین β3) و سیتوکینهایی مانند فاکتور مهارکننده لوسمی (LIF) را تعدیل میکند. این عناصر تهاجم تروفوبلاست را تقویت میکنند، بازسازی ماتریکس خارج سلولی (ECM) را بهبود میبخشند و چسبندگی سلولی را تقویت میکنند (19,20). از سوی دیگر، HOXA11 تنظیم ایمونولوژیکی و رشد اپیتلیال غدهای را تقویت میکند. این پروتئین ژنهایی را که برای بلوغ سلولهای استرومایی دسیدوال ضروری هستند، مانند پرولاکتین (PRL) و پروتئین متصل شونده به فاکتور رشد شبه انسولین 1 (IGFBP1) کنترل میکند. علاوه بر این، آزادسازی مواد شیمیایی تعدیلکننده سیستم ایمنی را افزایش میدهد و در نتیجه محیطی ایمنی را فراهم میکند که برای لانهگزینی جنینها مفید است (29).
علاوه بر نقشهایشان در دسیدوالیزاسیون سلولهای استرومایی، HOXA10 و HOXA11 از طریق مکانیسمهای مولکولی متمایزی که اساساً با اثرات آنها بر استروما متفاوت است، بر اپیتلیوم آندومتر برای دستیابی به لانهگزینی موفق نیز تأثیر میگذارند. در اپیتلیوم آندومتر، این ژنها در درجه اول مولکولهای چسبندگی سلولی مانند اینتگرین β3 و مسیرهای سیگنالینگ سیتوکین مانند LIF و IL-6 را تنظیم میکنند که برای ایجاد یک سطح اپیتلیال پذیرا برای اتصال جنین ضروری هستند. اختلال در بیان این ژن¬ها باعث شکست مکرر لانهگزینی و نتایج نامطلوب در روند باروری میشود (21,28). HOXA10 از طریق تنظیم ژنهای پاییندست، مستقیماً در جنینزایی رحم و لانهگزینی جنین نقش دارد. تغییر بیان این ژن باعث ناهنجاریهای رشدی رحم و اختلال در رشد آندومتر میشود. کاهش بیان HOXA10 با کاهش ضخامت و یکپارچگی آندومتر مرتبط است، بنابراین لانهگزینی را مختل میکند و منجر به ناباروری زنان میشود (30، 26، 11). الگوهای بیان این ژن ارتباط نزدیکی با چرخه قاعدگی دارد و برای بارداری موفق ضروری است. اختلال در بیان HOXA با مشکلات مختلف باروری مرتبط بوده و آن را به یک نشانگر بالقوه برای ارزیابی سلامت باروری زنان تبدیل میکند. (26, 19).
نقش HOXA10 و HOXA11 در عملکرد رحم و چرخه قاعدگی: ژنهای HOXA10 و HOXA11 الگوهای بیان پویایی را در طول چرخه قاعدگی نشان میدهند که با تغییرات هورمونی که آندومتر را برای لانهگزینی آماده میکنند، همسو است. در دستگاه تولیدمثلی بزرگسالان، استرادیول و پروژسترون بیان HOXA10 و HOXA11 را تنظیم میکنند که بر رشد، تمایز و پذیرش رحم تأثیر میگذارد. این هورمونهای استروئیدی به گیرندههای آندومتر خود متصل میشوند و رونویسی HOXA10 را فعال میکنند که به نوبه خود تمایز سلولی را تنظیم میکند و در نتیجه آندومتر پذیرای لانهگزینی جنین میشود (31). الگوهای بیان این ژن¬ها در طول چرخه قاعدگی، بهویژه در طول دوره لانهگزینی، متفاوت است. از آنجاییکه بیان HOXA10 و HOXA11 در طول چرخه قاعدگی وابسته به مرحله است، بهنظر میرسد که هم عملکرد مستقل و هم عملکرد مشترک استرادیول و پروژسترون بیان این ژنها را تنظیم میکند (32, 31).
در طول چرخه قاعدگی طبیعی، سطح بیان آنها در فاز تکثیر نسبتاً پایین است. با افزایش سطح استرادیول، رشد و تکثیر پوشش آندومتر را القا میکنند و باعث افزایش خفیف HOXA10 میشوند. اثرات ترکیبی استرادیول و LH موجب افزایش قابلتوجه بیان HOXA10 در طول چرخه تخمکگذاری میشود (33). پس از آن، رحم برای تغییرات ناشی از پروژسترون که در طول فاز ترشحی رخ میدهد، آماده میشود. در این مرحله، پروژسترون ترشح شده از جسم زرد به هورمون غالب تبدیل میشود و بهصورت سینرژیک با استرادیول عمل میکند. بیان HOXA10 و HOXA11 از اواسط فاز ترشحی به اوج خود میرسد که همزمان با دوره پذیرش رحم و پنجره لانهگزینی است (26، 21). (شکل 3، جدول 1). کاهش قابلتوجه بیان mRNAی HOXA10 در طول فاز ترشحی چرخه قاعدگی میتواند منجر به شکست در لانهگزینی و از دست رفتن زودهنگام باروری شود (26).

شکل 1: خوشههای ژنی HOX انسانی. 39 ژنهای HOX در چهار خوشه کروموزومی سازماندهی شدهاند: HOXA، HOXB، HOXC و HOXD (14).

شکل 2: جایگاههای بیان ژنهای HOXA در رحم
جدول 1: بیان ژن HOXA10/HOXA11 در طول چرخه قاعدگی

.JPG)
شکل 3: بیان پویای ژنهای HOXA10 و HOXA11 در طول چرخه قاعدگی.
تعامل هورمونی استرادیول (E2) و پروژسترون (P4) در طول مراحل تکثیر، تخمکگذاری و ترشح، که باعث افزایش تنظیم متوالی HOXA10 و HOXA11 میشود.
ارتباط بین PCOS و اختلال در بیان ژنهای HOXA10 و HOXA11: PCOS یکی از علل مهم ناباروری است. در زنان مبتلا به PCOS، میزان سقط خودبهخودی افزایش و میزان لقاح کاهش مییابد (34). ژنهای HOXA10 و HOXA11 مسئول تشکیل رحم هستند (35). PCOS با تغییر بیان ژنهای HOXA10 و HOXA11 مرتبط است. جهشها یا تغییر بیان HOXA10 منجر به ناباروری یا کمباروری از طریق ایجاد اختلال در عملکرد آندومتر میشوند (36). اختلال عملکرد آندومتر با نقص در دسیدوالیزاسیون، اختلال در سیگنالینگ پروژسترون، تکثیر مداوم سلولی و سطح بالای نشانگرهای التهابی مرتبط است (6). این تغییرات مربوط به بیان متفاوت ژن در طول مراحل تکثیر و ترشح چرخه قاعدگی است (37). در PCOS، کاهش شاخصهای آندومتری که همگی برای رشد و عملکرد اندومتر ضروری در نظر گرفته میشوند از جمله بیان ژنهای HOXA10 وHOXA11 (38,39)، شاخصهای دسیدوالیزاسیون مانند پروتئین متصلشونده به فاکتور رشد شبه انسولین 1 (IGFBP-1) (6,40)، پروتئینهای نشانگر پذیرش آندومتر مانند فاکتور مهارکننده لوسمی (LIF)، پروتئین اندومتر مرتبط با پروژسترون (PAEP) و گلوتاتیون پراکسیداز 3 (GPX3) گزارش شده است (41, 37). بیان HOXA10 تحت تأثیر هورمونهای استروئیدی، بهویژه استروژن، قرار میگیرد. در زنان PCOS ترشح بیش از حد آندروژن، بیان HOXA10 را در طول مرحله ترشحی چرخه قاعدگی کاهش میدهد. مطالعات متعددی تغییر بیان HOXA10 آندومتر را در بیماران مبتلا به سندرم تخمدان پلیکیستیک، شکست مکرر لانهگزینی و سقط مکرر نشان دادهاند که میتواند دلیل لانهگزینی ناقص مشاهده شده در این بیماران باشد (42). نشان داده شده است که تستوسترون، هورمونی که اغلب در PCOS افزایش مییابد، مستقیماً بیان HOXA10 را در سلولهای گرانولوزا کاهش میدهد (43). کاهش بیان HOXA10 همچنین با متابولیسم غیرطبیعی لیپید، بهویژه سنتز کلسترول، مرتبط است و ممکن است بر پروفایل کلی لیپید در زنان مبتلا به PCOS تأثیر بگذارد. مشخص شده است که HOXA10 ژنهای دخیل در سنتز کلسترول را در سلولهای استرومایی آندومتر تنظیم میکند. بیان HOXA10 در زنان مبتلا به PCOS همبستگی مثبتی با سطح کلسترول HDL و همبستگی منفی با کلسترول تام (TC)، تریگلیسیرید (TG) و کلسترول LDL دارد (42،44). درک تعامل بین HOXA10، هورمونهای استروئیدی و متابولیسم لیپید برای توسعه درمانهای هدفمند برای مشکلات تولیدمثلی و متابولیکی مرتبط با PCOS بسیار مهم است. یافته¬های مولکولی نقش اساسی این ژن¬ها را در سلامت تولیدمثل و اختلال در تنظیم آنها را در بروز مشکلات دخیل در ناباروری برجسته میکند.
ارزیابی بیان ژنهای HOXA10 و HOXA11 پتانسیل فوقالعادهای را به عنوان یک تکنیک تشخیصی برای ارزیابی پذیرش آندومتر نشان داده است (26). اوزدمیر و همکاران نشان دادند که استفاده از روش مرسوم عکسبرداری رحم هیستروسالپینگوگرافی HSG ((Hysterosalpingography با افزایش بیان ژنهای HOXA10 و HOXA11 در اندومتر رحم، باروری را در زنان نابارور بهبود میبخشد. در مقایسه با افراد سالم، سطح بیان این ژنها در آندومتر بیماران نابارور قبل از انجام HSG بهطور قابلتوجهی پایینتر بود. پس از انجام HSG، سطح بیان این ژن¬ها بهطور قابلتوجهی افزایش یافت. افزایش بیان HOXA10 بیشتر از HOXA11 بود (45). مطالعه دیگری نشان داد که برداشتن لاپاراسکوپی آندومتریوما، بیان mRNA مربوط به HOXA-10 و HOXA-11 را در آندومتر در حوالی لانهگزینی افزایش میدهد که نشاندهنده بهبود پذیرش آندومتر است (46). در مطالعه کارا و همکاران کاهش بیان ژن¬های HOXA-10 و HOXA-11 در بیماران PCOS در مقایسه با افراد سالم گزارش شد که ممکن است در ناباروری مرتبط با PCOS نقش داشته باشد (34). سرمیک و همکاران نیز در مطالعه خود کاهش بیان ژن HOXA-10 را در بیماران مبتلا به PCOS در مقایسه با افرا سالم نشان دادند (39). یافتههای اولیه نشان میدهد که متفورمین و رژیم غذایی با کربوهیدرات کنترلشده، عملکرد آندومتر را در بیماران PCOS بهبود میبخشند، که تا حدودی با کاهش سطح متیلاسیون پروموتور ژن HOXA10 و بیان ژنهای دخیل در پذیرش آندومتر و سیگنالینگ انسولین همراه است (47). در زنان مبتلا به PCOS، بیان HOXA10 در سلولهای استرومایی با درمان متفورمین در مقایسه با سطح آن قبل از درمان افزایش یافت (48). ویتامین D از طریق گیرنده خود (VDR) میتواند مستقیماً بر بیان HOXA10 در آندومتر تأثیر بگذارد که ممکن است بر نتایج تولیدمثلی زنان مبتلا به PCOS که تحت القای تخمکگذاری (OI ,Ovulation Induction) قرار میگیرند، تأثیر بگذارد. مطالعات نشان میدهد که سطح بالاتر ویتامین D با افزایش بیان HOXA10 در آندومتر مرتبط است و بهطور بالقوه بر میزان لانهگزینی و بارداری در بیماران PCOS که تحت القای تخمکگذاری قرار میگیرند، تأثیر میگذارد (50, 49, 26). با این وجود، دادههای متناقضی در مورد نقش احتمالی ژنهای HOXA10 و HOXA11 در لانهگزینی وجود دارد. برخی از گزارش دادهاند که بیان HOXA-10 و HOXA-11 منجر به افزایش در طول دوره لانهگزینی میشود (51, 27). برعکس، کائو و همکارانش هیچ تغییری مشاهده نکردند (52). یافتههای متناقضی نیز در مورد بیان HOXA10 در هیپرپلازی آندومتر وجود دارد که با تکثیر غیرطبیعی بافت آندومتر تعریف میشود. گرچه دادههای بالینی کمی در مورد ارتباط HOXA10 با هیپرپلازی آندومتر وجود دارد، تحقیقات تجربی به وضوح نشان میدهد که کاهش بیان این ژن در ایجاد هیپرپلازی نقش دارد (53). به دلیل محدودیتهای مدلهای انسانی و حیوانی، میزان تاثیر ژن HOXA10 در هیپرپلازی اندومتر در حد متوسط در نظر گرفته میشوند (35).
نتیجهگیری
نتایج مطالعات متعددی که در این مقاله بررسی شد، اهمیت حیاتی ژنهای HOXA10 و HOXA11 را در تکوین، تمایز و عملکرد آندومتر بهویژه در دوره باروری زنان نشان میدهد. این دو ژن، که بیان آنها بهطور دقیق تحت تأثیر هورمونهای جنسی استروژن و پروژسترون تنظیم میشود، در مرحله ترشحی چرخه قاعدگی به اوج خود میرسند؛ زمانی که رحم باید برای لانهگزینی جنین آماده باشد. HOXA10 و HOXA11 تنظیمکنندههای کلیدی رشد و پذیرش اندومتر، به ویژه در طول لانهگزینی هستند. بیان مناسب آنها برای بارداری موفق ضروری است و اختلال در تنظیم آنها با ناباروری و اختلالات زنان مرتبط است. شکست در لانهگزینی میتواند مسئول ناباروری در بیماران مبتلا به PCOS باشد. بنابراین، میتوان گفت که بررسی الگوی بیان این ژنها نهتنها در درک بهتر مکانیسمهای پاتوفیزیولوژیک PCOS نقش دارد، بلکه میتواند بهعنوان یک نشانگر زیستی بالقوه برای تشخیص زودهنگام اختلالات لانهگزینی یا حتی هدفی برای مداخلات درمانی مورد توجه قرار گیرد. مطالعات آینده با تمرکز بر اصلاح بیان ژنهای HOXA و بهینهسازی پاسخ آندومتر به هورمونها میتواند مسیرهای درمانی جدید و مؤثری را برای بهبود باروری در زنان مبتلا به PCOS فراهم سازد.
حامی مالی: دانشگاه آزاد اسلامی، واحد ارومیه
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Tay CT, Garrad R, Mousa A, Bahri M, Joham A, Teede H. Polycystic Ovary Syndrome (PCOS): International Collaboration to Translate Evidence and Guide Future Research. J Endocrinol 2023; 257(3): e220232.
2- Yavuz O, Akdöner A, Mankan KA, Gündoğan K, Okyay RE, Doğan ÖE. Evaluation of the Incidence of Congenital Uterine Anomalies in Polycystic Ovarian Syndrome: Tertiary Center Experience. Front Med 2025; 12: 1582100.
3- Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO. The Prevalence and Features of the Polycystic Ovary Syndrome in an Unselected Population. J Clin Endocrinol Metab 2004; 89(6): 2745-9.
4- Bostani RJ, Kohneshahri MP. Polycystic Ovarian Syndrome: Clinical Features, Genetics of Disease, and Diagnosis Criteria. JSSU 2021; 29(6): 3785-810. [Persian]
5- Ghafari A, Maftoohi M, Samarin ME, Barani S, Banimohammad M, Samie R. The Last Update on Polycystic Ovary Syndrome (PCOS), Diagnosis Criteria, and Novel Treatment. Endocrine and Metabolic Sci 2025; 17: 100228.
6- Piltonen T, Chen J, Khatun M, Kangasniemi M, Liakka A, Spitzer T, et al. Endometrial Stromal Fibroblasts from Women with Polycystic Ovary Syndrome Have Impaired Progesterone-Mediated Decidualization, Aberrant Cytokine Profiles and Promote Enhanced Immune Cell Migration in Vitro. Human Reprod 2015; 30(5): 1203-15.
7- Giudice LC. Endometrium in PCOS: Implantation and Predisposition to Endocrine CA. Best Pract Res Clin Endocrinol Metab 2006; 20(2): 235-44.
8- Barry JA, Azizia MM, Hardiman PJ. Risk of Endometrial, Ovarian and Breast Cancer in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis. Hum Reprod Update 2014; 20(5): 748-58.
9- Agarwal R, Stanczyk FZ, Mandelbaum R, Paulson RJ, McGinnis LK, Winer SA. Prevalence of Endometrial Hyperplasia and Carcinoma in Women with Polycystic Ovarian Syndrome. F&S Reports 2025; 6(3): 394-8.
10- Anania C. The PCOS-Endometrial Cell Atlas. Nature Genetics 2025; 57(4): 774.
11- Du H, Taylor HS. The Role of Hox Genes in Female Reproductive Tract Development, Adult Function, And Fertility. Cold Spring Harb Perspect Med 2016; 6(1): a023002.
12- Taylor HS. The Role of HOX Genes in the Development and Function of the Female Reproductive Tract. Semin Reprod Med 2000;18(1):81-9.
13- Fang W, Li K, Ma S, Wei F, Hu Y. Natural Selection and Convergent Evolution of the HOX Gene Family in Carnivora. Front Ecol Evol 2023; 11: 1107034.
14- Wang L, Cao L, Sun H, Wang J. Role of HOXA1-4 in the Development of Genetic and Malignant Diseases. Biomarker Res 2024; 12.
15- Mallo M. Reassessing the Role of Hox Genes during Vertebrate Development and Evolution. Trends Genet 2018; 34(3): 209-17.
16- McGinnis W, Levine M. A Blueprint Most Wonderful, the Homeobox Discovery. Development 2024; 151(6): dev202512.
17- McGinnis W, Krumlauf R. Homeobox Genes and Axial Patterning. Cell 1992; 68(2): 283-302.
18- Duverger O, Morasso MI. Role of Homeobox Genes in the Patterning, Specification, and Differentiation of Ectodermal Appendages in Mammals. J Cell Physiol 2008; 216(2): 337-46.
19- Makker A, Goel MM, Nigam D, Bhatia V, Mahdi AA, Das V, et al. Endometrial Expression of Homeobox Genes and Cell Adhesion Molecules in Infertile Women with Intramural Fibroids During Window of Implantation. Reprod Sci 2017; 24(3): 435-44.
20- He B, Ni Zl, Kong Sb, Lu Jh, Wang Hb. Homeobox Genes for Embryo Implantation: From Mouse to Human. Animal Model Exp Med 2018; 1(1): 14-22.
21- Daftary GS, Taylor HS. Endocrine Regulation of HOX Genes. Endocr Rev 2006; 27(4): 331-55.
22- Taylor HS, Vanden Heuvel GB, Igarashi P. A Conserved Hox Axis in the Mouse and Human Female Reproductive System: Late Establishment and Persistent Adult Expression of the Hoxa Cluster Genes. Biol Reprod 1997; 57(6): 1338-45.
23- Ashary N, Laheri S, Modi D. Homeobox Genes in Endometrium: From Development to Decidualization. Int J Dev Biol 2020; 64(1-2-3): 227-37.
24- Pîrlog L-M, Pătrășcanu A-A, Ona M-D, Cătană A, Rotar IC. HOXA10 and HOXA11 in Human Endometrial Benign Disorders: Unraveling Molecular Pathways and their Impact on Reproduction. Biomolecules 2025; 15(4): 563.
25- Xu B, Geerts D, Bu Z, Ai J, Jin L, Li Y, et al. Regulation of Endometrial Receptivity by the Highly Expressed HOXA9, HOXA11 and HOXD10 HOX-Class Homeobox Genes. Hum Reprod 2014; 29(4): 781-90.
26- Ekanayake DL, Małopolska MM, Schwarz T, Tuz R, Bartlewski PM. The Roles and Expression of HOXA/Hoxa10 Gene: A Prospective Marker of Mammalian Female Fertility? Reprod Biol 2022; 22(2): 100647.
27- Lu Z, Hardt J, Kim J. Global Analysis of Genes Regulated by HOXA10 in Decidualization Reveals a Role in Cell Proliferation. Mol Hum Reprod 2008; 14(6): 357-66.
28- Hou L, Xu B, Mohankumar KM, Goffin V, Perry JK, Lobie PE, et al. The Prolactin Receptor Mediates HOXA1-Stimulated Oncogenicity in Mammary Carcinoma Cells. Int J Oncol 2012; 41(6): 2285-95.
29- Bi Y, Huang W, Yuan L, Chen S, Liao S, Fu X, et al. HOXA10 Improves Endometrial Receptivity by Upregulating E-Cadherin. Biol Reprod 2022; 106(5): 992-9.
30- Zanatta A, Rocha AM, Carvalho FM, Pereira RM, Taylor HS, Motta EL, et al. The Role of the Hoxa10/HOXA10 Gene in the Etiology of Endometriosis and Its Related Infertility: A Review. J Assist Reprod Genet 2010; 27(12): 701-10.
31- Taylor HS, Arici A, Olive D, Igarashi P. HOXA10 is Expressed in Response to Sex Steroids at the Time of Implantation in the Human Endometrium. J Clin Invest 1998; 101(7): 1379-84.
32- Benson GV, Lim H, Paria B, Satokata I, Dey SK, Maas RL. Mechanisms of Reduced Fertility in Hoxa-10 Mutant Mice: Uterine Homeosis and Loss of Maternal Hoxa-10 Expression. Development 1996; 122(9): 2687-96.
33- Blitek A, Kiewisz J, Waclawik A, Kaczmarek MM, Ziecik AJ. Effect of Steroids on HOXA10 Mrna and Protein Expression and Prostaglandin Production in the Porcine Endometrium. J Reprod Develop 2010; 56(6): 643-8.
34- Kara M, Ozcan SS, Aran T, Kara O, Yilmaz N. Evaluation of Endometrial Receptivity by Measuring HOXA-10, HOXA-11, and Leukemia Inhibitory Factor Expression in Patients with Polycystic Ovary Syndrome. Gynecol Minim Invasive Ther 2019; 8(3): 118-22.
35- Mishra A, Modi D. Role of HOXA10 in Pathologies of the Endometrium. Rev Endocr Metab Disord 2025; 26(1): 81-96 .
36- Connell M, Owen C, Segars J. Genetic Syndromes and Genes Involved in the Development of the Female Reproductive Tract: A Possible Role for Gene Therapy. J Genet Syndr Gene Ther 2013; 4: 127.
37- Bellver J, Simón C. Implantation Failure of Endometrial Origin: What is New? Curr Opin Obstet Gynecol 2018; 30(4): 229-36.
38- Senturk S, Celik O, Dalkilic S, Hatirnaz S, Celik N, Unlu C, et al. Laparoscopic Ovarian Drilling Improves Endometrial Homeobox Gene Expression in PCOS. Reprod Sci 2020; 27(2): 675-80.
39- Cermik D, Selam B, Taylor HS. Regulation of HOXA-10 Expression by Testosterone in Vitro and in the Endometrium of Patients with Polycystic Ovary Syndrome. J Clin Endocrinol Metabol 2003; 88(1): 238-43.
40- Piltonen TT. Polycystic Ovary Syndrome: Endometrial Markers. Best Practice Res Clin Obstet Gynaecol 2016; 37: 66-79.
41- Savaris RF, Groll JM, Young SL, DeMayo FJ, Jeong JW, Hamilton AE, et al. Progesterone Resistance in PCOS Endometrium: A Microarray Analysis in Clomiphene Citrate-Treated and Artificial Menstrual Cycles. J Clin Endocrinol Metab 2011; 96(6): 1737-46.
42- Yu M, Tang J, Huang Y, Guo C, Du P, Li N, et al. HOXA10 Regulates the Synthesis of Cholesterol in Endometrial Stromal Cells. Front Endocrinol 2022; 13: 852671.
43- He H, Li T, Yin D, Liu R, Chen Q, Wang J, et al. HOXA10 Expression is Decreased by Testosterone in Luteinized Granulosa Cells in Vitro. Mol Med Rep 2012; 6(1): 51-6.
44- Liu Z, Guo Y, Lian F, Wang K, Sun Z, Wang Y, et al. Expression of HOXA10 Gene in Women with Polycystic Ovarian Syndrome and Its Correlation Analysis with Lipid Metabolism. Minerva Endocrinol 2019; 44(4): 413-5.
45- Ozdemir F, Demir MB, Kutuk S, Karaman E, Muderris II, Celik O, et al. Impact of Hysterosalpingography on Endometrial HOXA-10 and HOXA-11 Mrna Expression: A Clinical Trial. Medicine (Baltimore) 2025; 104(19): e42393.
46- Celik O, Unlu C, Otlu B, Celik N, Caliskan E. Laparoscopic Endometrioma Resection Increases Peri-Implantation Endometrial HOXA-10 and HOXA-11 Mrna Expression. Fertil Steril 2015; 104(2): 356-65.
47- García-Gómez E, Gómez-Viais YI, Cruz-Aranda MM, Martínez-Razo LD, Reyes-Mayoral C, Ibarra-González L, et al. The Effect of Metformin and Carbohydrate-Controlled Diet on DNA Methylation and Gene Expression in the Endometrium of Women with Polycystic Ovary Syndrome. Int J Molecular Sci 2023; 24(7): 6857.
48- Ohara M, Yoshida-Komiya H, Ono-Okutsu M, Yamaguchi-Ito A, Takahashi T, Fujimori K. Metformin Reduces Androgen Receptor and Upregulates Homeobox A10 Expression in Uterine Endometrium in Women with Polycystic Ovary Syndrome. Reprod Biol Endocrinol 2021; 19(1): 77.
49- Shilpasree A, Kulkarni VB, Shetty P, Bargale A, Goni M, Oli A, et al. Induction of Endometrial HOXA 10 Gene Expression by Vitamin D and Its Possible Influence on Reproductive Outcome of PCOS Patients Undergoing Ovulation Induction Procedure. Indian J Endocrinol Metab 2022; 26(3): 252-8.
50- Wang K, Dong F, Ma S, Bu Z. The Association between Vitamin D Deficiency and Clinical Pregnancy Rate in IVF Patients with Different Ages. Front Endocrinol (Lausanne) 2025; 15: 1485238.
51- Skrzypczak J, Wirstlein P, Mikolajczyk M. Could the Defects in the Endometrial Extracellular Matrix During the Implantation Be a Cause for Impaired Fertility? Am J Reprod Immunol 2007; 57(1): 40-8.
52- Kao L, Tulac S, Lobo Sa, Imani B, Yang J, Germeyer A, et al. Global Gene Profiling in Human Endometrium During the Window of Implantation. Endocrinology 2002; 143(6): 2119-38.
53- Zhong G, Wang Y, Liu X. Expression of HOXA10 in Endometrial Hyperplasia and Adenocarcinoma and Regulation by Sex Hormones in Vitro. Int J Gynecological Cancer 2011; 21(5): 800-5.
1- Tay CT, Garrad R, Mousa A, Bahri M, Joham A, Teede H. Polycystic Ovary Syndrome (PCOS): International Collaboration to Translate Evidence and Guide Future Research. J Endocrinol 2023; 257(3): e220232.
2- Yavuz O, Akdöner A, Mankan KA, Gündoğan K, Okyay RE, Doğan ÖE. Evaluation of the Incidence of Congenital Uterine Anomalies in Polycystic Ovarian Syndrome: Tertiary Center Experience. Front Med 2025; 12: 1582100.
3- Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO. The Prevalence and Features of the Polycystic Ovary Syndrome in an Unselected Population. J Clin Endocrinol Metab 2004; 89(6): 2745-9.
4- Bostani RJ, Kohneshahri MP. Polycystic Ovarian Syndrome: Clinical Features, Genetics of Disease, and Diagnosis Criteria. JSSU 2021; 29(6): 3785-810. [Persian]
5- Ghafari A, Maftoohi M, Samarin ME, Barani S, Banimohammad M, Samie R. The Last Update on Polycystic Ovary Syndrome (PCOS), Diagnosis Criteria, and Novel Treatment. Endocrine and Metabolic Sci 2025; 17: 100228.
6- Piltonen T, Chen J, Khatun M, Kangasniemi M, Liakka A, Spitzer T, et al. Endometrial Stromal Fibroblasts from Women with Polycystic Ovary Syndrome Have Impaired Progesterone-Mediated Decidualization, Aberrant Cytokine Profiles and Promote Enhanced Immune Cell Migration in Vitro. Human Reprod 2015; 30(5): 1203-15.
7- Giudice LC. Endometrium in PCOS: Implantation and Predisposition to Endocrine CA. Best Pract Res Clin Endocrinol Metab 2006; 20(2): 235-44.
8- Barry JA, Azizia MM, Hardiman PJ. Risk of Endometrial, Ovarian and Breast Cancer in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis. Hum Reprod Update 2014; 20(5): 748-58.
9- Agarwal R, Stanczyk FZ, Mandelbaum R, Paulson RJ, McGinnis LK, Winer SA. Prevalence of Endometrial Hyperplasia and Carcinoma in Women with Polycystic Ovarian Syndrome. F&S Reports 2025; 6(3): 394-8.
10- Anania C. The PCOS-Endometrial Cell Atlas. Nature Genetics 2025; 57(4): 774.
11- Du H, Taylor HS. The Role of Hox Genes in Female Reproductive Tract Development, Adult Function, And Fertility. Cold Spring Harb Perspect Med 2016; 6(1): a023002.
12- Taylor HS. The Role of HOX Genes in the Development and Function of the Female Reproductive Tract. Semin Reprod Med 2000;18(1):81-9.
13- Fang W, Li K, Ma S, Wei F, Hu Y. Natural Selection and Convergent Evolution of the HOX Gene Family in Carnivora. Front Ecol Evol 2023; 11: 1107034.
14- Wang L, Cao L, Sun H, Wang J. Role of HOXA1-4 in the Development of Genetic and Malignant Diseases. Biomarker Res 2024; 12.
15- Mallo M. Reassessing the Role of Hox Genes during Vertebrate Development and Evolution. Trends Genet 2018; 34(3): 209-17.
16- McGinnis W, Levine M. A Blueprint Most Wonderful, the Homeobox Discovery. Development 2024; 151(6): dev202512.
17- McGinnis W, Krumlauf R. Homeobox Genes and Axial Patterning. Cell 1992; 68(2): 283-302.
18- Duverger O, Morasso MI. Role of Homeobox Genes in the Patterning, Specification, and Differentiation of Ectodermal Appendages in Mammals. J Cell Physiol 2008; 216(2): 337-46.
19- Makker A, Goel MM, Nigam D, Bhatia V, Mahdi AA, Das V, et al. Endometrial Expression of Homeobox Genes and Cell Adhesion Molecules in Infertile Women with Intramural Fibroids During Window of Implantation. Reprod Sci 2017; 24(3): 435-44.
20- He B, Ni Zl, Kong Sb, Lu Jh, Wang Hb. Homeobox Genes for Embryo Implantation: From Mouse to Human. Animal Model Exp Med 2018; 1(1): 14-22.
21- Daftary GS, Taylor HS. Endocrine Regulation of HOX Genes. Endocr Rev 2006; 27(4): 331-55.
22- Taylor HS, Vanden Heuvel GB, Igarashi P. A Conserved Hox Axis in the Mouse and Human Female Reproductive System: Late Establishment and Persistent Adult Expression of the Hoxa Cluster Genes. Biol Reprod 1997; 57(6): 1338-45.
23- Ashary N, Laheri S, Modi D. Homeobox Genes in Endometrium: From Development to Decidualization. Int J Dev Biol 2020; 64(1-2-3): 227-37.
24- Pîrlog L-M, Pătrășcanu A-A, Ona M-D, Cătană A, Rotar IC. HOXA10 and HOXA11 in Human Endometrial Benign Disorders: Unraveling Molecular Pathways and their Impact on Reproduction. Biomolecules 2025; 15(4): 563.
25- Xu B, Geerts D, Bu Z, Ai J, Jin L, Li Y, et al. Regulation of Endometrial Receptivity by the Highly Expressed HOXA9, HOXA11 and HOXD10 HOX-Class Homeobox Genes. Hum Reprod 2014; 29(4): 781-90.
26- Ekanayake DL, Małopolska MM, Schwarz T, Tuz R, Bartlewski PM. The Roles and Expression of HOXA/Hoxa10 Gene: A Prospective Marker of Mammalian Female Fertility? Reprod Biol 2022; 22(2): 100647.
27- Lu Z, Hardt J, Kim J. Global Analysis of Genes Regulated by HOXA10 in Decidualization Reveals a Role in Cell Proliferation. Mol Hum Reprod 2008; 14(6): 357-66.
28- Hou L, Xu B, Mohankumar KM, Goffin V, Perry JK, Lobie PE, et al. The Prolactin Receptor Mediates HOXA1-Stimulated Oncogenicity in Mammary Carcinoma Cells. Int J Oncol 2012; 41(6): 2285-95.
29- Bi Y, Huang W, Yuan L, Chen S, Liao S, Fu X, et al. HOXA10 Improves Endometrial Receptivity by Upregulating E-Cadherin. Biol Reprod 2022; 106(5): 992-9.
30- Zanatta A, Rocha AM, Carvalho FM, Pereira RM, Taylor HS, Motta EL, et al. The Role of the Hoxa10/HOXA10 Gene in the Etiology of Endometriosis and Its Related Infertility: A Review. J Assist Reprod Genet 2010; 27(12): 701-10.
31- Taylor HS, Arici A, Olive D, Igarashi P. HOXA10 is Expressed in Response to Sex Steroids at the Time of Implantation in the Human Endometrium. J Clin Invest 1998; 101(7): 1379-84.
32- Benson GV, Lim H, Paria B, Satokata I, Dey SK, Maas RL. Mechanisms of Reduced Fertility in Hoxa-10 Mutant Mice: Uterine Homeosis and Loss of Maternal Hoxa-10 Expression. Development 1996; 122(9): 2687-96.
33- Blitek A, Kiewisz J, Waclawik A, Kaczmarek MM, Ziecik AJ. Effect of Steroids on HOXA10 Mrna and Protein Expression and Prostaglandin Production in the Porcine Endometrium. J Reprod Develop 2010; 56(6): 643-8.
34- Kara M, Ozcan SS, Aran T, Kara O, Yilmaz N. Evaluation of Endometrial Receptivity by Measuring HOXA-10, HOXA-11, and Leukemia Inhibitory Factor Expression in Patients with Polycystic Ovary Syndrome. Gynecol Minim Invasive Ther 2019; 8(3): 118-22.
35- Mishra A, Modi D. Role of HOXA10 in Pathologies of the Endometrium. Rev Endocr Metab Disord 2025; 26(1): 81-96 .
36- Connell M, Owen C, Segars J. Genetic Syndromes and Genes Involved in the Development of the Female Reproductive Tract: A Possible Role for Gene Therapy. J Genet Syndr Gene Ther 2013; 4: 127.
37- Bellver J, Simón C. Implantation Failure of Endometrial Origin: What is New? Curr Opin Obstet Gynecol 2018; 30(4): 229-36.
38- Senturk S, Celik O, Dalkilic S, Hatirnaz S, Celik N, Unlu C, et al. Laparoscopic Ovarian Drilling Improves Endometrial Homeobox Gene Expression in PCOS. Reprod Sci 2020; 27(2): 675-80.
39- Cermik D, Selam B, Taylor HS. Regulation of HOXA-10 Expression by Testosterone in Vitro and in the Endometrium of Patients with Polycystic Ovary Syndrome. J Clin Endocrinol Metabol 2003; 88(1): 238-43.
40- Piltonen TT. Polycystic Ovary Syndrome: Endometrial Markers. Best Practice Res Clin Obstet Gynaecol 2016; 37: 66-79.
41- Savaris RF, Groll JM, Young SL, DeMayo FJ, Jeong JW, Hamilton AE, et al. Progesterone Resistance in PCOS Endometrium: A Microarray Analysis in Clomiphene Citrate-Treated and Artificial Menstrual Cycles. J Clin Endocrinol Metab 2011; 96(6): 1737-46.
42- Yu M, Tang J, Huang Y, Guo C, Du P, Li N, et al. HOXA10 Regulates the Synthesis of Cholesterol in Endometrial Stromal Cells. Front Endocrinol 2022; 13: 852671.
43- He H, Li T, Yin D, Liu R, Chen Q, Wang J, et al. HOXA10 Expression is Decreased by Testosterone in Luteinized Granulosa Cells in Vitro. Mol Med Rep 2012; 6(1): 51-6.
44- Liu Z, Guo Y, Lian F, Wang K, Sun Z, Wang Y, et al. Expression of HOXA10 Gene in Women with Polycystic Ovarian Syndrome and Its Correlation Analysis with Lipid Metabolism. Minerva Endocrinol 2019; 44(4): 413-5.
45- Ozdemir F, Demir MB, Kutuk S, Karaman E, Muderris II, Celik O, et al. Impact of Hysterosalpingography on Endometrial HOXA-10 and HOXA-11 Mrna Expression: A Clinical Trial. Medicine (Baltimore) 2025; 104(19): e42393.
46- Celik O, Unlu C, Otlu B, Celik N, Caliskan E. Laparoscopic Endometrioma Resection Increases Peri-Implantation Endometrial HOXA-10 and HOXA-11 Mrna Expression. Fertil Steril 2015; 104(2): 356-65.
47- García-Gómez E, Gómez-Viais YI, Cruz-Aranda MM, Martínez-Razo LD, Reyes-Mayoral C, Ibarra-González L, et al. The Effect of Metformin and Carbohydrate-Controlled Diet on DNA Methylation and Gene Expression in the Endometrium of Women with Polycystic Ovary Syndrome. Int J Molecular Sci 2023; 24(7): 6857.
48- Ohara M, Yoshida-Komiya H, Ono-Okutsu M, Yamaguchi-Ito A, Takahashi T, Fujimori K. Metformin Reduces Androgen Receptor and Upregulates Homeobox A10 Expression in Uterine Endometrium in Women with Polycystic Ovary Syndrome. Reprod Biol Endocrinol 2021; 19(1): 77.
49- Shilpasree A, Kulkarni VB, Shetty P, Bargale A, Goni M, Oli A, et al. Induction of Endometrial HOXA 10 Gene Expression by Vitamin D and Its Possible Influence on Reproductive Outcome of PCOS Patients Undergoing Ovulation Induction Procedure. Indian J Endocrinol Metab 2022; 26(3): 252-8.
50- Wang K, Dong F, Ma S, Bu Z. The Association between Vitamin D Deficiency and Clinical Pregnancy Rate in IVF Patients with Different Ages. Front Endocrinol (Lausanne) 2025; 15: 1485238.
51- Skrzypczak J, Wirstlein P, Mikolajczyk M. Could the Defects in the Endometrial Extracellular Matrix During the Implantation Be a Cause for Impaired Fertility? Am J Reprod Immunol 2007; 57(1): 40-8.
52- Kao L, Tulac S, Lobo Sa, Imani B, Yang J, Germeyer A, et al. Global Gene Profiling in Human Endometrium During the Window of Implantation. Endocrinology 2002; 143(6): 2119-38.
53- Zhong G, Wang Y, Liu X. Expression of HOXA10 in Endometrial Hyperplasia and Adenocarcinoma and Regulation by Sex Hormones in Vitro. Int J Gynecological Cancer 2011; 21(5): 800-5.
نوع مطالعه: مروری |
موضوع مقاله:
زیست شناسی
دریافت: 1404/5/12 | پذیرش: 1404/6/17 | انتشار: 1404/7/15
دریافت: 1404/5/12 | پذیرش: 1404/6/17 | انتشار: 1404/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







