دوره 33، شماره 9 - ( آذر 1404 )
جلد 33 شماره 9 صفحات 9418-9409 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Naderi A, Saremi A, Afarinesh Khaki M R. 12 Weeks of Endurance and Resistance Exercise on Acetylcholine Levels and Pain Threshold of Male Alzheimer Rat. JSSU 2025; 33 (9) :9409-9418
URL: http://jssu.ssu.ac.ir/article-1-6488-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6488-fa.html
نادری آزاده، صارمی عباس، آفرینش خاکی محمدرضا. اثربخشی ۱۲ هفته ورزش استقامتی و مقاومتی بر سطح استیلکولین و آستانه درد موشهای نر آلزایمری. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (9) :9409-9418
متن کامل [PDF 729 kb]
(102 دریافت)
| چکیده (HTML) (182 مشاهده)
متن کامل: (75 مشاهده)
مقدمه
آلزایمر یکی از شایعترین بیماریهای پیش رونده عصبی است که با اختلالات شناختی، تغییرات رفتاری و در نهایت مرگ سلولهای عصبی همراه است (1). این بیماری بر برخی از عملکردهای عصبی از جمله درد نیز تأثیر میگذارد (2). یکی از مهمترین سیستمهای نورولوژیک درگیر در آلزایمر، سیستم کولینرژیک است که نقش بارزی در پردازش حافظه، یادگیری و تنظیم درد دارد بیماری آلزایمر با کاهش شدید عملکرد سیستم کولینرژیک مشخص میشود (3). نورونهای کولینرژیک که اصلیترین منبع عصبدهی کولینرژیک قشر مغز محسوب میشوند، یکی از اولین ساختارهای آسیبدیده در این بیماری هستند (1). رابطه پیچیدهای بین تجمع آمیلوئید بتا (Aβ) و اختلال سیستم کولینرژیک وجود دارد (4). آمیلوئید بتا میتواند مستقیماً با انتقال دهنده کولین واکنش داده و آزادسازی استیل کولین را مختل نماید (5). مطالعات تغییرات کولینرژیک قابلتوجهی را در بیماری آلزایمر از جمله کاهش ۵۰ % در تراکم پایانههای عصبی کولینرژیک بر اثرافزایش آمیلوئیدبتا را در قشر مغز را نشان میدهد (5). این تغییرات حتی قبل از تشکیل پلاکهای آمیلوئیدی کامل رخ میدهند (6). استیلکولین نقش پیچیدهای در تنظیم درد دارد (6). فعالسازی مستقیم گیرندههای کولینرژیک یا افزایش عمل استیلکولین از طریق مهار آنزیم استیلکولیناستراز، درد را در جوندگان و انسان کاهش میدهد (7). مطالعه مروری نشان داده است که اختلال در ادراک درد در آلزایمر ممکن است به دلیل تغییرات فیزیولوژیک گیرندههای کولینرژیک انتقال درد در سطح نخاعی باشد (8). از سوی دیگر، ورزش بهویژه تمرینات استقامتی و مقاومتی، بهعنوان راهکاری غیردارویی برای بهبود عملکرد عصبی ـ عضلانی و شناختی در مدلهای حیوانی و انسانی مورد توجه قرار گرفته است. مطالعات نشان دادهاند که ورزش میتواند محتوای استیلکولین و تراکم گیرندههای آن را در عضلات و اعصاب محیطی موشها افزایش دهد و به بازآرایی سودمند محلهای اتصال عصبی ـ عضلانی منجر شود (9). ورزش استقامتی آزادسازی بتا آندورفین و دیگر پپتیدهای اپیوئیدی را تحریک میکند که پس از فعالیتهای شدید ترشح این مواد افزایش مییابند که موجب افزایش آستانه حس درد میشود (9). همچنین افزایش پپتیدهای اپیوئیدی درونریز پس از تمرین نیز میتواند دلیلی برای بالا رفتن تحمل درد بین ورزشکاران باشد (10) .همچنین مطالعات افزایش فاکتورهای رشد عصب (Nerve groth factor) را دراثر ورزش در بیماران مبتلا به آلزایمر و پارکیسون نشان داده اندکه باعث بالا رفتن آستانه درد میشود (11). با اینحال، شواهد درباره برتری نسبی نوع ورزش و شیوه تمرینی، بهویژه در شرایط پاتولوژیک آلزایمر و بر شاخصهای درد، هنوز ناکافی و بعضاً متناقض است (12). همچنین در مورد شدت و پروتکل ورزشی موثر بر شرایط پاتولوژیکی آلزایمر در مراحل مختلف بیماری ابهام زیادی وجود دارد. لذا هدف این مطالعه مقایسه دوازده هفته ورزش استقامتی و مقاومتی بر سطح استیل کولین و آستانه درد موشهای نر آلزایمری می باشد.
روش بررسی
در این تحقیق تجربی با طرح پسآزمون و کنترل شده با گروه شاهد از ۴۰ سر رت نر از نژاد ویسـتار بـا سـن 10-8 هفتـهای بـا میـانگین وزنـی 30±230 گرم استفاده شـد. معیار ورود رتها به مطالعه جنس نر و سن 10-8 هفته بود. و معیار خروج ابتلا به بیماری عفونی در طول برنامه بود. تمامی حیوانات در طی دوره پژوهش در محیطی با دمای ۲۴-۲۰ درجه سانتیگراد، رطوبت ۴۵-۵۵ درصد و نور مناسب ۱۲ ساعت روشنایی و ۱۲ ساعت تاریکی نگهداری شدند. همچنین دسترسی آزاد و کافی به آب و غذای مخصوص حیوانات بود. همه گروه ها تحت رژیم غذایی یکسان و استاندارد (مجموع کالری غذا 75 کیلو کالری و درصد کالری غذا از چربی 3/2 درصد و از پروتئین 7 درصد) قرار گرفتند (13). رتها از مرکز حیوانات دانشکده تهیه و پس از انتقال به آزمایشگاه در قفسهای پلیکربنات شفاف، ساخت شرکت رازی نگهداری شدند. آلاینـدههای هـوا بـا توجـه بـه شـاخصهای اسـتاندارد در وضـعیت سـالم قرارداشـت. همچنین برای ایجاد تهویه و جریان مناسب هوا از دو دسـتگاه تهویه هوا بدون صدا استفاده شد، پس از آشنایی با رتها با محیط جدید و نحوه تمرین ورزشی با قرار گرفتن در محیط تمرین، رتها بهصورت تصادفی به 4 گروه 10 تایی، به شرح مقابل تقسیم شدند: (مقاومتی که تمرین مقاومتی به مدت 12 هفته را انجام دادند،کنترل آلزایمری که هیچ تمرینی انجام نمی دادند، سالم، استقامتی که تمرین استقامتی رابه مدت 12 هفته انجام دادند).
برنامه تمرین: تمرین استقامتی بهصورت شنا در آب در استخر ویژه موش به ابعاد ۸۰×۵۰×۵۰ سانتیمتر، دارای موج ساز آب و آب با دمای ۳۰ تا ۳۳ درجه سانتیگراد انجام شد. دوره تمرین به مدت ۱۲ هفته و ۵ روز در هفته بود. در هفته اول زمان تمرین با ۱۵ دقیقه شروع شد، از هفته دوم تا پنجم در هر هفته ده دقیقه به زمان تمرین شنا افزوده گردید (هفته دوم ۲۰ دقیقه، هفته سوم ۳۰ دقیقه، هفته چهارم ۴۰ دقیقه، هفته پنجم ۵۰ دقیقه). از هفته ششم تا هفته نهم مدتزمان تمرین ۶۰ دقیقه یکبار در روز بود. از هفته دهم تا دوازدهم تمرین شنا به مدت ۶۰ دقیقه و دو بار در روز در داخل استخر اجرا گردید (14). تمرین مقاومتی به مدت ۱۲ هفته و ۵ روز در هفته و بهصورت بالارفتن همراه با وزنههای متصل به دم موشها از نردبانی به طول یک متر با ۲۶ پله و زاویه ۸۵ درجه نسبت به زمین، انجام گرفت. وزنه متصل به دم هر حیوان در هفته اول و دوم ۵۰ تا ۶۰ درصد، هفته سوم تا پنجم ۷۰ تا ۹۰ درصد، هفته ششم تا هشتم ۱۰۰ تا ۱۱۰ درصد، هفته نهم و دهم ۱۲۰ تا ۱۳۰ درصد، و هفته یازدهم و دوازدهم ۱۴۰ تا ۱۵۰ درصد وزن بدن بود. هر جلسه تمرینی شامل ۳ ست ۴ تکراری بود، استراحت بین هر تکرار ۳۰ تا ۶۰ ثانیه و بین هر ست ۱۲۰ تا ۱۵۰ ثانیه بود (15). مدت و شدت ورزش در هر دو برنامه تمرین استقامتی (۸۰ درصد حداکثر اکسیژن مصرفی) و تمرین مقاومتی (۸۰ درصد حداکثر ظرفیت حمل ارادی) تقریباً ایزوکالریک و یکسان بود (15).
روش القای آلزایمر: یک هفته بعد از قرارگرفتن در محیط، در رتهای موردمطالعه القای آلزایمر بهصورت ذیل اعمال گردید: مقدار ۸ میلیگرم بهازای هر کیلوگرم از وزن بدن، تری متیل تین کلراید به همراه ۲۰۰ میکرولیتر نرمال سالین بهعنوان حلال ترکیب شد و بهصورت تکدوز به روش درون صفاقی به موشها تزریق شد (15). پس از گذشت مدت زمان 3 روز، علایم رفتاری که ناشی از تخریب ناحیه هیپوکمپ اتفاق افتاد و برخی نشانههای رفتاری آلزایمر مشاهده گردید. این نشانههای کلینیکی شامل: لرزش عضلات، بالارفتن درجه حرارت بدن، حالت تهوع، تشنج، پیچش دم، رفتارپرخاشگرانه، خودگاز گرفتن بوده است این نشانه ها با مشاهده مستقیم رفتار رتها مورد بررسی قرار گرفت (16).
نمونه خون و اندازهگیری متغیرهای آزمایشگاهی: ۴۸ ساعت پس از پایان برنامه تمرینی، موشها توسط گازپتنوباربیتال سدیم ساخت شرکت سیگما آلدریچ بیهوش شدند. برای اندازهگیری پارامترهای بیوشیمیایی نمونه خونی مستقیماً از قلب به مقدار ۵ سیسی جمعآوری شد و به لولههای ژلدار منتقل گردید. سپس سرم توسط سانتریفیوژ مدل ۵۸۰۴ ساخت شرکت اپندورف ۱۰۰۰ دور در دقیقه به مدت چهار دقیقه جدا شده و در میکروتیوب به فریزر ۲۰- درجه انتقال داده شد. برای سنجش استیلکولین از کیـت الایزا ساخت شرکت zellBio محصول کشـور آلمان بـا شـماره کاتـالوگ ZB-Ac-96 و میزان حساسیت یک میکروگرم در میلیلیتـر طبـق دستورالعملهای شرکت تولیدکننده، استفاده شـد. تمام سرم جمعآوریشده تا زمان تجزیهوتحلیل در دمای ۸۰- درجه سانتیگراد نگهداری شدند
اندازهگیری آستانه درد
آزمون تیلفیلیک: پس از پایان مداخله برای اندازهگیری تغییر آستانه درد حرارتی از آزمون تیلفلیک استفاده شد. در این آزمون به ثلث میانی دم حیوان به مدت 10 ثانیه اشعه نوری تابانده شده و ایجاد حرارت در دم میکند. حیوان در اثر احساس گرما دم خود را از مسیر نور خارج میکند و نور به چشم الکترونیکی دستگاه برخورد کرده و باعث توقف زمان میشود. زمان پاسخ بین شروع محرک و عکسالعمل حیوان بهعنوان معیاری برای سنجش درد در آزمون تیلفیلیک محسوب میشود. درد ایجاد شده در این آزمون درد کوتاه و زودگذر است و چنانچه حیوان تا مدت 10 ثانیه پس از تابش نور سوزان، دم خود را نکشد، بهمنظور جلوگیری از آسیب بافتی محرک قطع میشود (17).
آزمونهات پلیت: دستگاه هاتپلیت در واقع یک صفحه است که بهوسیله جریان الکتریسیته داغ میشود. موشها بهصورت جداگانه در صفحه داغ در دمای 0/2 ± ۵۵ درجه سانتیگراد قرار گرفتند و زمان لیسیدن پنجههای عقب یا تلاش برای پریدن از داخل لیوان بهعنوان دوره تأخیر ثبت شد. زمان قطع ۶۰ ثانیه بود تا از آسیبدیدن بافت جلوگیری شود (۱۸).
تجزیه و تحلیل آماری
برای آمار توصیفی از میانگین و انحراف معیار استفاده شد و جهت آمار استنباطی و بررسی فرضیات پژوهش از آزمون آنوای یکسویه و برای مقایسات درونگروهی از آزمون تعقیبی تی سه دانت و توکی استفاده گردید. تمام تجزیه و تحلیلها تحت نرمافزارversion 16 SPSS و در سطح معنیداری 0/05> P انجام شدند.
نتایج
نتایج و مقایسه بینگروهی متغیر استیلکولین در نمودار ۱ آمده است. نتایج بینگروهی و مقایسه بینگروهی آنالیز واریانس یکراهه نشان داد که بین گروههای موردبررسی اختلاف معنیدار وجود دارد (F=41/25, P=0/001). سپس نتایج تی سه دانت نشان داد پس از دوره مداخله سطح استیلکولین در گروه تمرین استقامتی بهطور معنیداری بیشتر از گروه تمرین مقاومتی (0/02=P)، گروه کنترل آلزایمری (0/002=P) و گروه کنترل سالم (0/05=P) بود (نمودار ۱). نتایج و مقایسه بینگروهی آستانه درد با تست تیل فیلیک در نمودار ۲ آمده نتایج و مقایسه بینگروهی تحلیل واریانس یکطرفه نشان داد که بین گروههای مورد بررسی اختلاف معنادار وجود دارد(F=24/75, P=0/001). سپس نتایج توکی نشان داد که پس از دوره مداخله زمان تأخیر در آزمون تیل فیلیک در گروه ورزش استقامتی (0/001=P) اختلاف معناداری با گروه کنترل آلزایمری (0/06=P) داشتند و گروه آلزایمری شده با تمرین قدرتی (0/06=P) اختلاف معناداری با گروه آلزایمری شده نداشت. (نمودار ۲). نتایج و مقایسه بینگروهی آستانه درد با تست هات پلیت در نمودار ۳ آمده نتایج و مقایسه بینگروهی تحلیل واریانس یکطرفه نشان داد که بین گروههای مورد بررسی اختلاف معنادار وجود دارد (F=23/75, P=0/001). سپس نتایج توکی نشان داد که پس از دوره مداخله زمان تأخیر در آزمون هات پلیت در گروه آلزایمری شده با ورزش استقامتی (0/002=P) اختلاف معناداری با گروه آلزایمری (0/07=P) داشتند و گروه آلزایمری شده با تمرین مقاومتی (0/06=P) اختلاف معناداری با گروه آلزایمری شده نداشت. (نمودار ۳).
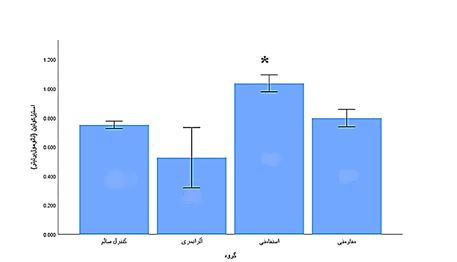
نمودار 1: سطح سرمی استیل کولین در گروههای مورد مطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری
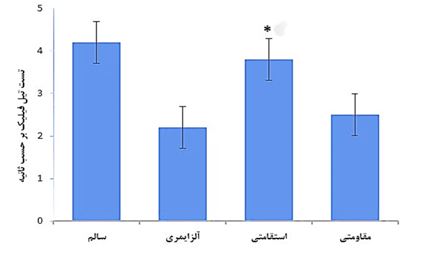
نمودار ۲: آستانه درد با تست تیل فیلیک گروههای مورد مطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری
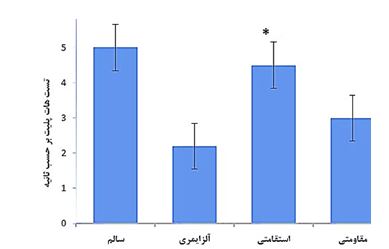
نمودار ۳: آستانه درد با تستهات پلیت گروههای موردمطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری
بحث
آلزایمر بیماری عصبی پیشرونده است که بر اثر انباشت پلاک های آملوئید تخریب سلولهای عصبی را سبب میشود که تغییرات آستانه درد و کاهش انتقال دهندههای عصبی از عوارض این بیماری است (18). یافته های این مطالعه نشان داد که 12 هفته تمرین استقامتی باعث افزایش آستانهدرد و افزایش سطح استیلکولین در موشهای آلزایمری شد، که افزایش میزان استیلکولین در گروه استقامتی معنیداری بیشتری را به گروه تمرین قدرتی نشان داد و ازطرفی افزایش آستانه درد در گروه قدرتی معنیدار نبود. در این مطالعه با بررسیهای انجام شده در پایان هر دو تست (هاتپلیت، تیلفلیک) مشخص گردید آلزایمر القا شده توسط تزریق درون صفاقی تری متیل تین کلراید (TMT ) آستانه درد را بهطور معناداری کاهش داد و با نتایج برخی پژوهشها همسو بود (20, 19) که این افت میتواند به علت استرس اکسیداتیو و اختلال در عملکرد میتوکندری باشد که مانع سنتز ATP لازم برای ساخت استیلکولین میشود (21). تجمع پلاکهای آمیلوئید و نوروفیبریلهای تائو در بیماری آلزایمر باعث تخریب برگشتناپذیر نورونها و کاهش استیلکولین میشود (22). همچنین آسیب به مناطقی از مغز که مسئول پردازش درد هستند، در بیماری آلزایمر بیتأثیر نیستند فعالیت بدنی موجب آزادسازی میانجیهای عصبی معینی در مغز میشود که درد جسمانی و ذهنی را تخفیف و تسکین میدهند. مشخص شده است که اثرات ورزش بر روی مغز از طریق مکانیسمهای متعددی شامل: نورونزایی و رهایی آندورفین اعمال میشود (23). از طرفی مطالعات نشان میدهند که فعالیت بدنی منظم، به ویژه تمرینهای استقامتی و مقاومتی، میتواند کاهش سطوح استیلکولین و اختلالات کولینرژیک مرتبط با بیماری آلزایمر را تعدیل کند (24). در مطالعه که فرضی و همکاران در سال 2019 انجام دادند اعلام کردند هشت هفته تمرین هوازی باعث کاهش استیل کولین استراز و افزایش استیلکولین می شود که این افزایش در گروه مقاومتی نسبت به گروه استقامی کمتر بود (18). در مطالعه دیگری که هوتالا و همکاران در سال 2006 انجام دادند در گروه هوازی کاهش استیلکولین استراز و افزایش استیلکولین را مشاهده کردند که با نتایج مطالعه حاضر همسو است (25). که میتواند به دلیل تحریک طولانیمدت جریان خون مغزی، افزایش فاکتور رشد نورونی (NGF)، کاهش استیلکولین استراز، ایجاد نوروژنژنز، بازسازی نورونها، افزایش استیلکولین و بهبود حافظه فضایی در اثر تمرین استقامتی باشد (24). از طرف دیگر پاز و همکاران در سال 2019 تغییر معناداری را درمیزان استیلکولین پلاسمایی سالمندان بعد از دوازده هفته تمرین مقاومتی مشاهده نکردند (26). که با نتایج حاصل از این مطالعه نا همسو است. در مطالعه حاضر بعد از دوازده هفته افزایش استیلکولین در گروه مقاومتی معنادار بودکه این ناهمسویی میتواند به دلیل شدت تمرین، نوع تمرین وتناوب تمرین و نوع آزمودنی ها باشد همچنین می تواند به این دلیل باشد که اثرتمرین مقاومتی خستگی محیطی ناشی از کاهش استیلکولین بیشتر از اثر مرکزی باشد (27). از طرف دیگرتحقیقات نشان میدهند که ورزش تاثیر قابلتوجهی بر آستانه درد در موشهای آلزایمری دارد. این یافتهها اهمیت خاصی در زمینه مدیریت درد در بیماری آلزایمر دارد. در مطالعهای که توسط الماسی و همکاران در سال 2025 بر روی موشهای نر آلزایمری انجام شد، تمرین استقامتی به صورت معنیداری آستانه درد را در آزمونهای تیل فیلیک، و فرمالین افزایش داد (28). که همسو با مطالعه حاضر است. تمرین استقامتی باعث افزایش جریان خون مغزی میشود، بهویژه تمرین در آب نسبت به تمرینات زمینی جریان خون مغزی بیشتری ایجاد میکند ورزش استقامتی سطوح نشانگرهای التهابی را در موشهای آلزایمری کاهش میدهد این کاهش التهاب نقش مهمی در بهبود آستانه درد دارد، زیرا التهاب مزمن یکی از عوامل کلیدی در تشدید درد نوروپاتیک است (29). در مطالعه ای که توسط جعفر زاده و همکاران در سال 2012 انجام شد. اعلام کردند هشت هفته تمرین مقاومتی در موشهای آلزایمری باعث بهبود معنیدار آستانه درد شده است (30). که با مطالعه حاضر ناهمسو است چرا که دوازه هفته تمرین مقاومتی در مطالعه حاضر تاثیر معناداری بر آستانه درد موشهای آلزایمری نداشت. که این همسویی میتواند به علت ماهیت تمرین و نوع نژاد موشها و جنسیت موشها و نوع آزمون سنجش درد در موش های آلزایمری باشد به علت شدت یا مدت تمرین و نوع آزمون سنجش درد در موش های آلزایمری باشد. این مطالعه مانند هر مطالعه دیگری با محدودیتهایی روبهرو بود از جمله آنها نوع آزمودنیها بود با توجه به اینکه این مطالعه بر روی رتها انجام شده است که ممکن است تعمیم نتایج تحقیق به انسان را تحتتاثیر قرار دهد، مدت مطالعه نیز از محدودیتهای دیگر بود. استفاده از مدتزمان طولانیتر ممکن است نتایج متفاوتی را حاصل کند. همچنین کاهش یا افزایش تناوب جلسات تمرینی در طی یک هفته و یا تغییر مدت و شدت تمرینات ورزشی در هر جلسه تمرین نیز ممکن است بر نتایج یافتههای این پژوهش اثرگذار باشند.
نتیجهگیری
یافتههای این بررسی نشان داد که ورزش استقامتی و مقاومتی بهخصوص تمرین استقامتی فزاینده نقش مؤثری در افزایش عوامل کولینرژیک از جمله استیلکولین و آستانه درد موشهای آلزایمری دارد؛ چرا که افزایش آستانه درد میتواند کیفیت زندگی افراد مبتلا به آلزایمر را بهبود بخشد بنابراین ورزش بهعنوان یک مداخله مهم و کمهزینه میتواند نقش مهمی در بهبود کیفیت زندگی سالمندان ایفا کند؛ لذا تحقیقات پژوهشگران آینده بایستی که این محدودیتها را در بررسیهای خود مدنظر قرار دهند. تحقیقات آینده میتوانند بر تعیین پروتکلهای بهینه ورزشی و ارزیابی اثرات طولانیمدت تمرینات بر آستانه درد در بیماران آلزایمری متمرکز شوند.
سپاسگزاری
با تشکر از همه عزیزانی که در انجام این طرح یاریگر ما بودند.
حامی مالی: مرکز تحقیقات علوم اعصاب کرمان
تعارض در منافع: تعارض منافعی وجود ندارد.
ملاحظات اخلاقی
در تمـامی مراحل مطالعه حاضر از اصول اخلاقی مورد تأیید کمیتـه اخلاق حیوانات شـماره مرجـع:IR.IAU.B.REC.1402.022 پیروی شده است.
مشارکت نویسندگان
عباس صارمی در ارائه ایده، محمد رضا آفرینش خاکی در طراحی مطالعه، آزاده نادری در جمعآوری دادهها و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
آلزایمر یکی از شایعترین بیماریهای پیش رونده عصبی است که با اختلالات شناختی، تغییرات رفتاری و در نهایت مرگ سلولهای عصبی همراه است (1). این بیماری بر برخی از عملکردهای عصبی از جمله درد نیز تأثیر میگذارد (2). یکی از مهمترین سیستمهای نورولوژیک درگیر در آلزایمر، سیستم کولینرژیک است که نقش بارزی در پردازش حافظه، یادگیری و تنظیم درد دارد بیماری آلزایمر با کاهش شدید عملکرد سیستم کولینرژیک مشخص میشود (3). نورونهای کولینرژیک که اصلیترین منبع عصبدهی کولینرژیک قشر مغز محسوب میشوند، یکی از اولین ساختارهای آسیبدیده در این بیماری هستند (1). رابطه پیچیدهای بین تجمع آمیلوئید بتا (Aβ) و اختلال سیستم کولینرژیک وجود دارد (4). آمیلوئید بتا میتواند مستقیماً با انتقال دهنده کولین واکنش داده و آزادسازی استیل کولین را مختل نماید (5). مطالعات تغییرات کولینرژیک قابلتوجهی را در بیماری آلزایمر از جمله کاهش ۵۰ % در تراکم پایانههای عصبی کولینرژیک بر اثرافزایش آمیلوئیدبتا را در قشر مغز را نشان میدهد (5). این تغییرات حتی قبل از تشکیل پلاکهای آمیلوئیدی کامل رخ میدهند (6). استیلکولین نقش پیچیدهای در تنظیم درد دارد (6). فعالسازی مستقیم گیرندههای کولینرژیک یا افزایش عمل استیلکولین از طریق مهار آنزیم استیلکولیناستراز، درد را در جوندگان و انسان کاهش میدهد (7). مطالعه مروری نشان داده است که اختلال در ادراک درد در آلزایمر ممکن است به دلیل تغییرات فیزیولوژیک گیرندههای کولینرژیک انتقال درد در سطح نخاعی باشد (8). از سوی دیگر، ورزش بهویژه تمرینات استقامتی و مقاومتی، بهعنوان راهکاری غیردارویی برای بهبود عملکرد عصبی ـ عضلانی و شناختی در مدلهای حیوانی و انسانی مورد توجه قرار گرفته است. مطالعات نشان دادهاند که ورزش میتواند محتوای استیلکولین و تراکم گیرندههای آن را در عضلات و اعصاب محیطی موشها افزایش دهد و به بازآرایی سودمند محلهای اتصال عصبی ـ عضلانی منجر شود (9). ورزش استقامتی آزادسازی بتا آندورفین و دیگر پپتیدهای اپیوئیدی را تحریک میکند که پس از فعالیتهای شدید ترشح این مواد افزایش مییابند که موجب افزایش آستانه حس درد میشود (9). همچنین افزایش پپتیدهای اپیوئیدی درونریز پس از تمرین نیز میتواند دلیلی برای بالا رفتن تحمل درد بین ورزشکاران باشد (10) .همچنین مطالعات افزایش فاکتورهای رشد عصب (Nerve groth factor) را دراثر ورزش در بیماران مبتلا به آلزایمر و پارکیسون نشان داده اندکه باعث بالا رفتن آستانه درد میشود (11). با اینحال، شواهد درباره برتری نسبی نوع ورزش و شیوه تمرینی، بهویژه در شرایط پاتولوژیک آلزایمر و بر شاخصهای درد، هنوز ناکافی و بعضاً متناقض است (12). همچنین در مورد شدت و پروتکل ورزشی موثر بر شرایط پاتولوژیکی آلزایمر در مراحل مختلف بیماری ابهام زیادی وجود دارد. لذا هدف این مطالعه مقایسه دوازده هفته ورزش استقامتی و مقاومتی بر سطح استیل کولین و آستانه درد موشهای نر آلزایمری می باشد.
روش بررسی
در این تحقیق تجربی با طرح پسآزمون و کنترل شده با گروه شاهد از ۴۰ سر رت نر از نژاد ویسـتار بـا سـن 10-8 هفتـهای بـا میـانگین وزنـی 30±230 گرم استفاده شـد. معیار ورود رتها به مطالعه جنس نر و سن 10-8 هفته بود. و معیار خروج ابتلا به بیماری عفونی در طول برنامه بود. تمامی حیوانات در طی دوره پژوهش در محیطی با دمای ۲۴-۲۰ درجه سانتیگراد، رطوبت ۴۵-۵۵ درصد و نور مناسب ۱۲ ساعت روشنایی و ۱۲ ساعت تاریکی نگهداری شدند. همچنین دسترسی آزاد و کافی به آب و غذای مخصوص حیوانات بود. همه گروه ها تحت رژیم غذایی یکسان و استاندارد (مجموع کالری غذا 75 کیلو کالری و درصد کالری غذا از چربی 3/2 درصد و از پروتئین 7 درصد) قرار گرفتند (13). رتها از مرکز حیوانات دانشکده تهیه و پس از انتقال به آزمایشگاه در قفسهای پلیکربنات شفاف، ساخت شرکت رازی نگهداری شدند. آلاینـدههای هـوا بـا توجـه بـه شـاخصهای اسـتاندارد در وضـعیت سـالم قرارداشـت. همچنین برای ایجاد تهویه و جریان مناسب هوا از دو دسـتگاه تهویه هوا بدون صدا استفاده شد، پس از آشنایی با رتها با محیط جدید و نحوه تمرین ورزشی با قرار گرفتن در محیط تمرین، رتها بهصورت تصادفی به 4 گروه 10 تایی، به شرح مقابل تقسیم شدند: (مقاومتی که تمرین مقاومتی به مدت 12 هفته را انجام دادند،کنترل آلزایمری که هیچ تمرینی انجام نمی دادند، سالم، استقامتی که تمرین استقامتی رابه مدت 12 هفته انجام دادند).
برنامه تمرین: تمرین استقامتی بهصورت شنا در آب در استخر ویژه موش به ابعاد ۸۰×۵۰×۵۰ سانتیمتر، دارای موج ساز آب و آب با دمای ۳۰ تا ۳۳ درجه سانتیگراد انجام شد. دوره تمرین به مدت ۱۲ هفته و ۵ روز در هفته بود. در هفته اول زمان تمرین با ۱۵ دقیقه شروع شد، از هفته دوم تا پنجم در هر هفته ده دقیقه به زمان تمرین شنا افزوده گردید (هفته دوم ۲۰ دقیقه، هفته سوم ۳۰ دقیقه، هفته چهارم ۴۰ دقیقه، هفته پنجم ۵۰ دقیقه). از هفته ششم تا هفته نهم مدتزمان تمرین ۶۰ دقیقه یکبار در روز بود. از هفته دهم تا دوازدهم تمرین شنا به مدت ۶۰ دقیقه و دو بار در روز در داخل استخر اجرا گردید (14). تمرین مقاومتی به مدت ۱۲ هفته و ۵ روز در هفته و بهصورت بالارفتن همراه با وزنههای متصل به دم موشها از نردبانی به طول یک متر با ۲۶ پله و زاویه ۸۵ درجه نسبت به زمین، انجام گرفت. وزنه متصل به دم هر حیوان در هفته اول و دوم ۵۰ تا ۶۰ درصد، هفته سوم تا پنجم ۷۰ تا ۹۰ درصد، هفته ششم تا هشتم ۱۰۰ تا ۱۱۰ درصد، هفته نهم و دهم ۱۲۰ تا ۱۳۰ درصد، و هفته یازدهم و دوازدهم ۱۴۰ تا ۱۵۰ درصد وزن بدن بود. هر جلسه تمرینی شامل ۳ ست ۴ تکراری بود، استراحت بین هر تکرار ۳۰ تا ۶۰ ثانیه و بین هر ست ۱۲۰ تا ۱۵۰ ثانیه بود (15). مدت و شدت ورزش در هر دو برنامه تمرین استقامتی (۸۰ درصد حداکثر اکسیژن مصرفی) و تمرین مقاومتی (۸۰ درصد حداکثر ظرفیت حمل ارادی) تقریباً ایزوکالریک و یکسان بود (15).
روش القای آلزایمر: یک هفته بعد از قرارگرفتن در محیط، در رتهای موردمطالعه القای آلزایمر بهصورت ذیل اعمال گردید: مقدار ۸ میلیگرم بهازای هر کیلوگرم از وزن بدن، تری متیل تین کلراید به همراه ۲۰۰ میکرولیتر نرمال سالین بهعنوان حلال ترکیب شد و بهصورت تکدوز به روش درون صفاقی به موشها تزریق شد (15). پس از گذشت مدت زمان 3 روز، علایم رفتاری که ناشی از تخریب ناحیه هیپوکمپ اتفاق افتاد و برخی نشانههای رفتاری آلزایمر مشاهده گردید. این نشانههای کلینیکی شامل: لرزش عضلات، بالارفتن درجه حرارت بدن، حالت تهوع، تشنج، پیچش دم، رفتارپرخاشگرانه، خودگاز گرفتن بوده است این نشانه ها با مشاهده مستقیم رفتار رتها مورد بررسی قرار گرفت (16).
نمونه خون و اندازهگیری متغیرهای آزمایشگاهی: ۴۸ ساعت پس از پایان برنامه تمرینی، موشها توسط گازپتنوباربیتال سدیم ساخت شرکت سیگما آلدریچ بیهوش شدند. برای اندازهگیری پارامترهای بیوشیمیایی نمونه خونی مستقیماً از قلب به مقدار ۵ سیسی جمعآوری شد و به لولههای ژلدار منتقل گردید. سپس سرم توسط سانتریفیوژ مدل ۵۸۰۴ ساخت شرکت اپندورف ۱۰۰۰ دور در دقیقه به مدت چهار دقیقه جدا شده و در میکروتیوب به فریزر ۲۰- درجه انتقال داده شد. برای سنجش استیلکولین از کیـت الایزا ساخت شرکت zellBio محصول کشـور آلمان بـا شـماره کاتـالوگ ZB-Ac-96 و میزان حساسیت یک میکروگرم در میلیلیتـر طبـق دستورالعملهای شرکت تولیدکننده، استفاده شـد. تمام سرم جمعآوریشده تا زمان تجزیهوتحلیل در دمای ۸۰- درجه سانتیگراد نگهداری شدند
اندازهگیری آستانه درد
آزمون تیلفیلیک: پس از پایان مداخله برای اندازهگیری تغییر آستانه درد حرارتی از آزمون تیلفلیک استفاده شد. در این آزمون به ثلث میانی دم حیوان به مدت 10 ثانیه اشعه نوری تابانده شده و ایجاد حرارت در دم میکند. حیوان در اثر احساس گرما دم خود را از مسیر نور خارج میکند و نور به چشم الکترونیکی دستگاه برخورد کرده و باعث توقف زمان میشود. زمان پاسخ بین شروع محرک و عکسالعمل حیوان بهعنوان معیاری برای سنجش درد در آزمون تیلفیلیک محسوب میشود. درد ایجاد شده در این آزمون درد کوتاه و زودگذر است و چنانچه حیوان تا مدت 10 ثانیه پس از تابش نور سوزان، دم خود را نکشد، بهمنظور جلوگیری از آسیب بافتی محرک قطع میشود (17).
آزمونهات پلیت: دستگاه هاتپلیت در واقع یک صفحه است که بهوسیله جریان الکتریسیته داغ میشود. موشها بهصورت جداگانه در صفحه داغ در دمای 0/2 ± ۵۵ درجه سانتیگراد قرار گرفتند و زمان لیسیدن پنجههای عقب یا تلاش برای پریدن از داخل لیوان بهعنوان دوره تأخیر ثبت شد. زمان قطع ۶۰ ثانیه بود تا از آسیبدیدن بافت جلوگیری شود (۱۸).
تجزیه و تحلیل آماری
برای آمار توصیفی از میانگین و انحراف معیار استفاده شد و جهت آمار استنباطی و بررسی فرضیات پژوهش از آزمون آنوای یکسویه و برای مقایسات درونگروهی از آزمون تعقیبی تی سه دانت و توکی استفاده گردید. تمام تجزیه و تحلیلها تحت نرمافزارversion 16 SPSS و در سطح معنیداری 0/05> P انجام شدند.
نتایج
نتایج و مقایسه بینگروهی متغیر استیلکولین در نمودار ۱ آمده است. نتایج بینگروهی و مقایسه بینگروهی آنالیز واریانس یکراهه نشان داد که بین گروههای موردبررسی اختلاف معنیدار وجود دارد (F=41/25, P=0/001). سپس نتایج تی سه دانت نشان داد پس از دوره مداخله سطح استیلکولین در گروه تمرین استقامتی بهطور معنیداری بیشتر از گروه تمرین مقاومتی (0/02=P)، گروه کنترل آلزایمری (0/002=P) و گروه کنترل سالم (0/05=P) بود (نمودار ۱). نتایج و مقایسه بینگروهی آستانه درد با تست تیل فیلیک در نمودار ۲ آمده نتایج و مقایسه بینگروهی تحلیل واریانس یکطرفه نشان داد که بین گروههای مورد بررسی اختلاف معنادار وجود دارد(F=24/75, P=0/001). سپس نتایج توکی نشان داد که پس از دوره مداخله زمان تأخیر در آزمون تیل فیلیک در گروه ورزش استقامتی (0/001=P) اختلاف معناداری با گروه کنترل آلزایمری (0/06=P) داشتند و گروه آلزایمری شده با تمرین قدرتی (0/06=P) اختلاف معناداری با گروه آلزایمری شده نداشت. (نمودار ۲). نتایج و مقایسه بینگروهی آستانه درد با تست هات پلیت در نمودار ۳ آمده نتایج و مقایسه بینگروهی تحلیل واریانس یکطرفه نشان داد که بین گروههای مورد بررسی اختلاف معنادار وجود دارد (F=23/75, P=0/001). سپس نتایج توکی نشان داد که پس از دوره مداخله زمان تأخیر در آزمون هات پلیت در گروه آلزایمری شده با ورزش استقامتی (0/002=P) اختلاف معناداری با گروه آلزایمری (0/07=P) داشتند و گروه آلزایمری شده با تمرین مقاومتی (0/06=P) اختلاف معناداری با گروه آلزایمری شده نداشت. (نمودار ۳).

نمودار 1: سطح سرمی استیل کولین در گروههای مورد مطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری

نمودار ۲: آستانه درد با تست تیل فیلیک گروههای مورد مطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری

نمودار ۳: آستانه درد با تستهات پلیت گروههای موردمطالعه. اختلاف میانگینها در سطح کمتر از 0/05 معنیدار است.
*: تفاوت معنیدار نسبت به گروه کنترل آلزایمری
بحث
آلزایمر بیماری عصبی پیشرونده است که بر اثر انباشت پلاک های آملوئید تخریب سلولهای عصبی را سبب میشود که تغییرات آستانه درد و کاهش انتقال دهندههای عصبی از عوارض این بیماری است (18). یافته های این مطالعه نشان داد که 12 هفته تمرین استقامتی باعث افزایش آستانهدرد و افزایش سطح استیلکولین در موشهای آلزایمری شد، که افزایش میزان استیلکولین در گروه استقامتی معنیداری بیشتری را به گروه تمرین قدرتی نشان داد و ازطرفی افزایش آستانه درد در گروه قدرتی معنیدار نبود. در این مطالعه با بررسیهای انجام شده در پایان هر دو تست (هاتپلیت، تیلفلیک) مشخص گردید آلزایمر القا شده توسط تزریق درون صفاقی تری متیل تین کلراید (TMT ) آستانه درد را بهطور معناداری کاهش داد و با نتایج برخی پژوهشها همسو بود (20, 19) که این افت میتواند به علت استرس اکسیداتیو و اختلال در عملکرد میتوکندری باشد که مانع سنتز ATP لازم برای ساخت استیلکولین میشود (21). تجمع پلاکهای آمیلوئید و نوروفیبریلهای تائو در بیماری آلزایمر باعث تخریب برگشتناپذیر نورونها و کاهش استیلکولین میشود (22). همچنین آسیب به مناطقی از مغز که مسئول پردازش درد هستند، در بیماری آلزایمر بیتأثیر نیستند فعالیت بدنی موجب آزادسازی میانجیهای عصبی معینی در مغز میشود که درد جسمانی و ذهنی را تخفیف و تسکین میدهند. مشخص شده است که اثرات ورزش بر روی مغز از طریق مکانیسمهای متعددی شامل: نورونزایی و رهایی آندورفین اعمال میشود (23). از طرفی مطالعات نشان میدهند که فعالیت بدنی منظم، به ویژه تمرینهای استقامتی و مقاومتی، میتواند کاهش سطوح استیلکولین و اختلالات کولینرژیک مرتبط با بیماری آلزایمر را تعدیل کند (24). در مطالعه که فرضی و همکاران در سال 2019 انجام دادند اعلام کردند هشت هفته تمرین هوازی باعث کاهش استیل کولین استراز و افزایش استیلکولین می شود که این افزایش در گروه مقاومتی نسبت به گروه استقامی کمتر بود (18). در مطالعه دیگری که هوتالا و همکاران در سال 2006 انجام دادند در گروه هوازی کاهش استیلکولین استراز و افزایش استیلکولین را مشاهده کردند که با نتایج مطالعه حاضر همسو است (25). که میتواند به دلیل تحریک طولانیمدت جریان خون مغزی، افزایش فاکتور رشد نورونی (NGF)، کاهش استیلکولین استراز، ایجاد نوروژنژنز، بازسازی نورونها، افزایش استیلکولین و بهبود حافظه فضایی در اثر تمرین استقامتی باشد (24). از طرف دیگر پاز و همکاران در سال 2019 تغییر معناداری را درمیزان استیلکولین پلاسمایی سالمندان بعد از دوازده هفته تمرین مقاومتی مشاهده نکردند (26). که با نتایج حاصل از این مطالعه نا همسو است. در مطالعه حاضر بعد از دوازده هفته افزایش استیلکولین در گروه مقاومتی معنادار بودکه این ناهمسویی میتواند به دلیل شدت تمرین، نوع تمرین وتناوب تمرین و نوع آزمودنی ها باشد همچنین می تواند به این دلیل باشد که اثرتمرین مقاومتی خستگی محیطی ناشی از کاهش استیلکولین بیشتر از اثر مرکزی باشد (27). از طرف دیگرتحقیقات نشان میدهند که ورزش تاثیر قابلتوجهی بر آستانه درد در موشهای آلزایمری دارد. این یافتهها اهمیت خاصی در زمینه مدیریت درد در بیماری آلزایمر دارد. در مطالعهای که توسط الماسی و همکاران در سال 2025 بر روی موشهای نر آلزایمری انجام شد، تمرین استقامتی به صورت معنیداری آستانه درد را در آزمونهای تیل فیلیک، و فرمالین افزایش داد (28). که همسو با مطالعه حاضر است. تمرین استقامتی باعث افزایش جریان خون مغزی میشود، بهویژه تمرین در آب نسبت به تمرینات زمینی جریان خون مغزی بیشتری ایجاد میکند ورزش استقامتی سطوح نشانگرهای التهابی را در موشهای آلزایمری کاهش میدهد این کاهش التهاب نقش مهمی در بهبود آستانه درد دارد، زیرا التهاب مزمن یکی از عوامل کلیدی در تشدید درد نوروپاتیک است (29). در مطالعه ای که توسط جعفر زاده و همکاران در سال 2012 انجام شد. اعلام کردند هشت هفته تمرین مقاومتی در موشهای آلزایمری باعث بهبود معنیدار آستانه درد شده است (30). که با مطالعه حاضر ناهمسو است چرا که دوازه هفته تمرین مقاومتی در مطالعه حاضر تاثیر معناداری بر آستانه درد موشهای آلزایمری نداشت. که این همسویی میتواند به علت ماهیت تمرین و نوع نژاد موشها و جنسیت موشها و نوع آزمون سنجش درد در موش های آلزایمری باشد به علت شدت یا مدت تمرین و نوع آزمون سنجش درد در موش های آلزایمری باشد. این مطالعه مانند هر مطالعه دیگری با محدودیتهایی روبهرو بود از جمله آنها نوع آزمودنیها بود با توجه به اینکه این مطالعه بر روی رتها انجام شده است که ممکن است تعمیم نتایج تحقیق به انسان را تحتتاثیر قرار دهد، مدت مطالعه نیز از محدودیتهای دیگر بود. استفاده از مدتزمان طولانیتر ممکن است نتایج متفاوتی را حاصل کند. همچنین کاهش یا افزایش تناوب جلسات تمرینی در طی یک هفته و یا تغییر مدت و شدت تمرینات ورزشی در هر جلسه تمرین نیز ممکن است بر نتایج یافتههای این پژوهش اثرگذار باشند.
نتیجهگیری
یافتههای این بررسی نشان داد که ورزش استقامتی و مقاومتی بهخصوص تمرین استقامتی فزاینده نقش مؤثری در افزایش عوامل کولینرژیک از جمله استیلکولین و آستانه درد موشهای آلزایمری دارد؛ چرا که افزایش آستانه درد میتواند کیفیت زندگی افراد مبتلا به آلزایمر را بهبود بخشد بنابراین ورزش بهعنوان یک مداخله مهم و کمهزینه میتواند نقش مهمی در بهبود کیفیت زندگی سالمندان ایفا کند؛ لذا تحقیقات پژوهشگران آینده بایستی که این محدودیتها را در بررسیهای خود مدنظر قرار دهند. تحقیقات آینده میتوانند بر تعیین پروتکلهای بهینه ورزشی و ارزیابی اثرات طولانیمدت تمرینات بر آستانه درد در بیماران آلزایمری متمرکز شوند.
سپاسگزاری
با تشکر از همه عزیزانی که در انجام این طرح یاریگر ما بودند.
حامی مالی: مرکز تحقیقات علوم اعصاب کرمان
تعارض در منافع: تعارض منافعی وجود ندارد.
ملاحظات اخلاقی
در تمـامی مراحل مطالعه حاضر از اصول اخلاقی مورد تأیید کمیتـه اخلاق حیوانات شـماره مرجـع:IR.IAU.B.REC.1402.022 پیروی شده است.
مشارکت نویسندگان
عباس صارمی در ارائه ایده، محمد رضا آفرینش خاکی در طراحی مطالعه، آزاده نادری در جمعآوری دادهها و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Tavakoli R, Jalili S. The Predictors of Omega-3 Supplements Consumption Based on the Constructs of the Health Belief Model in the Elderly Alzheimer Prevention. Tolooebehdasht 2022; 20(6): 100-15.
2- Samadi Taherghorabi M, Shakerini I. Effectiveness of Neurofeedback on Working Memory and Cognitive Flexibility in Patients with Mild Depression: A Clinical Trial. JGUMS 2022; 30(4): 290-303.
3- Mokhtarkia S, Edalatmanesh MA. Effect of Trans-Cinnamic Acid on Cognitive Deficit, Cell Density of CA1/CA3 Regions, and Cholinergic Activity of Hippocampus in Trimethylettin Model of Alzheimer's Disease. J Ilam Uni Med Sci 2023; 31(1): 1-12. [Persian]
4- Yeganeh Hashemi, Sarmi Abbas. Study of the Effect of 12 Weeks of Resistance Training with Sumac Supplementation on Inflammatory Indicators and Apoptosis of Male Alzheimer's Mice. Scientific Research Monthly of the University of Medical Sciences of Shahid Saduki Yazd 2025; 32)12(: 45-54. [Persian]
5- Valenzuela PL, Castillo-García A, Morales JS, de la Villa P, Hampel H, Emanuele E, et al. Exercise Benefits on Alzheimer’s Disease: State-of-the-Science. Ageing Res Rev 2020; 62: 101108.
6- Kaeidi A, Rahmani MR, Hassanshahi J. The Protective Effect of Carvacrol and Thymol as Main Polyphenolic Compounds of Thyme on Some Biologic Systems in Disease Condition: A Narrative Review. Journal of Rafsanjan University of Medical Sciences 2020; 19(1): 81-96.
7- Haratian Z, Valizadegan F, Seyedalipour B. Protective Effects of "Ziziphus Jujuba" Fruit Extract on Morphine-Induced Hippocampal Oxidative Stress and Spatial Memory Impairment in Rats. Journal of Animal Research (Iranian Journal of Biology) 2020; 33(3): 244-56.
8- Koltyn KF. Analgesia Following Exercise: A Review. Sports Med 2000; 29(2): 85-98.
9- Janal MN, Colt EW, Clark WC, Glusman M. Pain Sensitivity, Mood and Plasma Endocrine Levels in Man Following Long-Distance Running: Effects of Naloxone 1984; 19(1): 13-25.
10- Smith MA, Yancey DL. Sensitivity to the Effects of Opioids in Rats with Free Access to Exercise Wheels: µ-Opioid Tolerance and Physical Dependence. Psychopharmacology 2003; 168(4): 426-34.
11- Ganji F, Barari A, Abdi A. Effects of Ganoderma Extraction and Eight-Week Endurance Exercises on Plasma Values Neurotrophic Factors Based on Brain and Nerve Growth in Men with Parkinson's. RJMS 2021; 27(12): 120-30.
12- Sadeqpur M, Ghazanfari F, Rezaei F. Effectiveness of Transcranial Direct Current Stimulation (Tdcs) on Pain Intensity, Anxiety and Depression in Patients with Rheumatoid Arthritis. The Journal of Shahid Sadoughi University of Medical Sciences 2025; 32(12): 8534-48.
13- Yu F. Guiding Research and Practice: A Conceptual Model for Aerobic Exercise Training in Alzheimer’s Disease. American Journal of Alzheimer's Disease & Other Dementias 2011; 26(3): 184-94.
14- Yeganeh Hashemi A, Saremi A, Afarinesh Khaki M. The Effect of a Period of Endurance Training Along with Sumac Extract Supplementation on Inflammatory and Apoptotic Factors in Alzheimer's Male Rats. Cell and Tissue Journal 2024; 15(2): 97-112.
15- Zare M, Edalatmanesh MA, Zar A. Effect of Eight Weeks of Endurance Training on Hippocampal Levels of Tumor Necrosis Factor Alpha Female Rats with Alzheimerâ S Disease. Pars Journal of Medical Sciences 2022; 13(4): 57-62.
16- Malekzadeh S, Edalatmanesh MA, Mehrabani D, Shariati M. Drugs Induced Alzheimer’s Disease in Animal Model. Galen Medical Journal 2017; 6(3): 185-96.[Persian]
17- Ness T, Gebhart G. Centrifugal Modulation of the Rat Tail Flick Reflex Evoked by Graded Noxious Heating of the Tail. Brain Res 1986; 386(1-2): 41-52.
18- Farzi MA, Sadigh-Eteghad S, Ebrahimi K, Talebi M. Exercise Improves Recognition Memory and Acetylcholinesterase Activity in the Beta Amyloid-Induced Rat Model of Alzheimer’s Disease. Ann Neurosci 2019; 25(3): 121-25.
19- Koltyn KF. Analgesia Following Exercise. Sports Med 2000; 29(2): 85-98.
20- Baydas G, Canatan H, Turkoglu A. Comparative Analysis of the Protective Effects of Melatonin and Vitamin E on Streptozocin‐Induced Diabetes Mellitus. J Pineal Res 2002; 32(4): 225-30.
21- Kingwell BA, Tran B, Cameron JD, Jennings GL, Dart AM. Enhanced Vasodilation to Acetylcholine in Athletes Is Associated with Lower Plasma Cholesterol. Am J Physiol 1996; 270(6 Pt 2): H2008-13.
22- Liu HL, Zhao G, Zhang H, Shi LD. Long-Term Treadmill Exercise Inhibits the Progression of Alzheimer's Disease-Like Neuropathology in the Hippocampus of APP/PS1 Transgenic Mice. Behav Brain Res 2013; 256: 261-72.
23- Naderi A, Alaei H, Sharifi M, Hoseini M. The Comparison between Effect of Short-Term and Mid-Term Exercise on the Enthusiasm of the Male Rats to Self-Administer Morphine. Iranian Journal of Basic Medical Sciences 2007; 4(9): 272-80.
24- Fecik MJ, Nunes PT, Vetreno RP, Savage LM. Voluntary Wheel Running Exercise Rescues Behaviorally-Evoked Acetylcholine Efflux in the Medial Prefrontal Cortex and Epigenetic Changes in Chat Genes Following Adolescent Intermittent Ethanol Exposure. PLoS 2024; 19(10): e0311405.
25- Hautala AJ, Rankinen T, Kiviniemi AM, Makikallio TH, Huikuri HV, Bouchard C, et al. Heart Rate Recovery after Maximal Exercise is Associated with Acetylcholine Receptor M2 (CHRM2) Gene Polymorphism. Am J Physiol Heart Circ Physiol 2006; 291(1): H459-66.
26- Paz JC, West MP. Acute care handbook for physical therapists e-book. Elsevier Health Sciences; 2019 Oct 12.
27- Hall JM, Savage LM. Exercise Leads to the Re-Emergence of the Cholinergic/Nestin Neuronal Phenotype Within the Medial Septum/Diagonal Band and Subsequent Rescue of both Hippocampal Ach Efflux and Spatial Behavior. Exp Neurol 2016; 278: 62-75.
28- Almasi E, Heidarianpour A, Keshvari M. The Interactive Effects of Different Exercises and Hawthorn Consumption on the Pain Threshold of TMT-Induced Alzheimer Male Rats. J Physiol Sci 2024; 74(1): 36.
29- Habibi A, Taheri A, Habibi S. Attenuation of Some Inflammatory Markers by Endurance Training in the Spinal Cord of Rats with Diabetic Neuropathic Pain. Contrast Media Mol Imaging 2022; 12(3): 349.
30- Jafarzadeh G, Shakerian S, Farbood Y, Ghanbarzadeh M. Effects of Eight Weeks of Resistance Exercises on Neurotrophins and Trk Receptors in Alzheimer Model Male Wistar Rats. BCN 2021; 12(3): 349-60
1- Tavakoli R, Jalili S. The Predictors of Omega-3 Supplements Consumption Based on the Constructs of the Health Belief Model in the Elderly Alzheimer Prevention. Tolooebehdasht 2022; 20(6): 100-15.
2- Samadi Taherghorabi M, Shakerini I. Effectiveness of Neurofeedback on Working Memory and Cognitive Flexibility in Patients with Mild Depression: A Clinical Trial. JGUMS 2022; 30(4): 290-303.
3- Mokhtarkia S, Edalatmanesh MA. Effect of Trans-Cinnamic Acid on Cognitive Deficit, Cell Density of CA1/CA3 Regions, and Cholinergic Activity of Hippocampus in Trimethylettin Model of Alzheimer's Disease. J Ilam Uni Med Sci 2023; 31(1): 1-12. [Persian]
4- Yeganeh Hashemi, Sarmi Abbas. Study of the Effect of 12 Weeks of Resistance Training with Sumac Supplementation on Inflammatory Indicators and Apoptosis of Male Alzheimer's Mice. Scientific Research Monthly of the University of Medical Sciences of Shahid Saduki Yazd 2025; 32)12(: 45-54. [Persian]
5- Valenzuela PL, Castillo-García A, Morales JS, de la Villa P, Hampel H, Emanuele E, et al. Exercise Benefits on Alzheimer’s Disease: State-of-the-Science. Ageing Res Rev 2020; 62: 101108.
6- Kaeidi A, Rahmani MR, Hassanshahi J. The Protective Effect of Carvacrol and Thymol as Main Polyphenolic Compounds of Thyme on Some Biologic Systems in Disease Condition: A Narrative Review. Journal of Rafsanjan University of Medical Sciences 2020; 19(1): 81-96.
7- Haratian Z, Valizadegan F, Seyedalipour B. Protective Effects of "Ziziphus Jujuba" Fruit Extract on Morphine-Induced Hippocampal Oxidative Stress and Spatial Memory Impairment in Rats. Journal of Animal Research (Iranian Journal of Biology) 2020; 33(3): 244-56.
8- Koltyn KF. Analgesia Following Exercise: A Review. Sports Med 2000; 29(2): 85-98.
9- Janal MN, Colt EW, Clark WC, Glusman M. Pain Sensitivity, Mood and Plasma Endocrine Levels in Man Following Long-Distance Running: Effects of Naloxone 1984; 19(1): 13-25.
10- Smith MA, Yancey DL. Sensitivity to the Effects of Opioids in Rats with Free Access to Exercise Wheels: µ-Opioid Tolerance and Physical Dependence. Psychopharmacology 2003; 168(4): 426-34.
11- Ganji F, Barari A, Abdi A. Effects of Ganoderma Extraction and Eight-Week Endurance Exercises on Plasma Values Neurotrophic Factors Based on Brain and Nerve Growth in Men with Parkinson's. RJMS 2021; 27(12): 120-30.
12- Sadeqpur M, Ghazanfari F, Rezaei F. Effectiveness of Transcranial Direct Current Stimulation (Tdcs) on Pain Intensity, Anxiety and Depression in Patients with Rheumatoid Arthritis. The Journal of Shahid Sadoughi University of Medical Sciences 2025; 32(12): 8534-48.
13- Yu F. Guiding Research and Practice: A Conceptual Model for Aerobic Exercise Training in Alzheimer’s Disease. American Journal of Alzheimer's Disease & Other Dementias 2011; 26(3): 184-94.
14- Yeganeh Hashemi A, Saremi A, Afarinesh Khaki M. The Effect of a Period of Endurance Training Along with Sumac Extract Supplementation on Inflammatory and Apoptotic Factors in Alzheimer's Male Rats. Cell and Tissue Journal 2024; 15(2): 97-112.
15- Zare M, Edalatmanesh MA, Zar A. Effect of Eight Weeks of Endurance Training on Hippocampal Levels of Tumor Necrosis Factor Alpha Female Rats with Alzheimerâ S Disease. Pars Journal of Medical Sciences 2022; 13(4): 57-62.
16- Malekzadeh S, Edalatmanesh MA, Mehrabani D, Shariati M. Drugs Induced Alzheimer’s Disease in Animal Model. Galen Medical Journal 2017; 6(3): 185-96.[Persian]
17- Ness T, Gebhart G. Centrifugal Modulation of the Rat Tail Flick Reflex Evoked by Graded Noxious Heating of the Tail. Brain Res 1986; 386(1-2): 41-52.
18- Farzi MA, Sadigh-Eteghad S, Ebrahimi K, Talebi M. Exercise Improves Recognition Memory and Acetylcholinesterase Activity in the Beta Amyloid-Induced Rat Model of Alzheimer’s Disease. Ann Neurosci 2019; 25(3): 121-25.
19- Koltyn KF. Analgesia Following Exercise. Sports Med 2000; 29(2): 85-98.
20- Baydas G, Canatan H, Turkoglu A. Comparative Analysis of the Protective Effects of Melatonin and Vitamin E on Streptozocin‐Induced Diabetes Mellitus. J Pineal Res 2002; 32(4): 225-30.
21- Kingwell BA, Tran B, Cameron JD, Jennings GL, Dart AM. Enhanced Vasodilation to Acetylcholine in Athletes Is Associated with Lower Plasma Cholesterol. Am J Physiol 1996; 270(6 Pt 2): H2008-13.
22- Liu HL, Zhao G, Zhang H, Shi LD. Long-Term Treadmill Exercise Inhibits the Progression of Alzheimer's Disease-Like Neuropathology in the Hippocampus of APP/PS1 Transgenic Mice. Behav Brain Res 2013; 256: 261-72.
23- Naderi A, Alaei H, Sharifi M, Hoseini M. The Comparison between Effect of Short-Term and Mid-Term Exercise on the Enthusiasm of the Male Rats to Self-Administer Morphine. Iranian Journal of Basic Medical Sciences 2007; 4(9): 272-80.
24- Fecik MJ, Nunes PT, Vetreno RP, Savage LM. Voluntary Wheel Running Exercise Rescues Behaviorally-Evoked Acetylcholine Efflux in the Medial Prefrontal Cortex and Epigenetic Changes in Chat Genes Following Adolescent Intermittent Ethanol Exposure. PLoS 2024; 19(10): e0311405.
25- Hautala AJ, Rankinen T, Kiviniemi AM, Makikallio TH, Huikuri HV, Bouchard C, et al. Heart Rate Recovery after Maximal Exercise is Associated with Acetylcholine Receptor M2 (CHRM2) Gene Polymorphism. Am J Physiol Heart Circ Physiol 2006; 291(1): H459-66.
26- Paz JC, West MP. Acute care handbook for physical therapists e-book. Elsevier Health Sciences; 2019 Oct 12.
27- Hall JM, Savage LM. Exercise Leads to the Re-Emergence of the Cholinergic/Nestin Neuronal Phenotype Within the Medial Septum/Diagonal Band and Subsequent Rescue of both Hippocampal Ach Efflux and Spatial Behavior. Exp Neurol 2016; 278: 62-75.
28- Almasi E, Heidarianpour A, Keshvari M. The Interactive Effects of Different Exercises and Hawthorn Consumption on the Pain Threshold of TMT-Induced Alzheimer Male Rats. J Physiol Sci 2024; 74(1): 36.
29- Habibi A, Taheri A, Habibi S. Attenuation of Some Inflammatory Markers by Endurance Training in the Spinal Cord of Rats with Diabetic Neuropathic Pain. Contrast Media Mol Imaging 2022; 12(3): 349.
30- Jafarzadeh G, Shakerian S, Farbood Y, Ghanbarzadeh M. Effects of Eight Weeks of Resistance Exercises on Neurotrophins and Trk Receptors in Alzheimer Model Male Wistar Rats. BCN 2021; 12(3): 349-60
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1404/5/12 | پذیرش: 1404/6/24 | انتشار: 1404/9/15
دریافت: 1404/5/12 | پذیرش: 1404/6/24 | انتشار: 1404/9/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







