دوره 33، شماره 5 - ( مرداد 1404 )
جلد 33 شماره 5 صفحات 9013-9003 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bakhtiari Dehbalaei S, Poroun N, Ghahramani M, Zokaei A, Ghahramani M. Effect of Aerobic Training on Inflammatory Markers in Parkinson ’s Disease: A Systematic Review. JSSU 2025; 33 (5) :9003-9013
URL: http://jssu.ssu.ac.ir/article-1-6404-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6404-fa.html
بختیاری ده بالایی سمیه، پرون نسرین، قهرمانی مهران، ذکایی عبدالحمید، قهرمانی محمد. تاثیر تمرینات هوازی بر نشانگرهای التهابی در بیماران پارکینسون: یک مرور سیستماتیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (5) :9003-9013
متن کامل [PDF 925 kb]
(241 دریافت)
| چکیده (HTML) (661 مشاهده)
متن کامل: (320 مشاهده)
مقدمه
سازمان بهداشت جهانی بیماری پارکینسون Parkinson’s disease (PD) را به عنوان سریعترین بیماری عصبی در حال رشد در سرتاسر جهان معرفی کرده (1) و پس از بیماری آلزایمر دومین بیماری تخریبکننده عصبی بهشمار میرود (2). مشخص شده است که در بیماری پارکینسون، ناحیهای در مغز به نام ماده سیاه پارس کامپکتا Substantia nigra pars compacta (SNpc) و نورونهای دوپامینرژیک موجود در آن مورد تأثیر قرار میگیرد (3). مسیر دوپامینرژیک، یکی از چهار مسیر اصلی نورونی در مغز و مسئول اصلی ایجاد حرکت در بدن است که از راه آن میانجی عصبی دوپامین از یک طرف مغز به طرف دیگر منتقل میشود (4). پس از تخریب 60 درصد نورونهای دوپامینرژیک در ماده سیاه پارس کامپکتا نشانههای اولیه بیماری پارکینسون آشکار میگردد (5). مشخصههای کلی این بیماری شامل نقص حرکتی، لرزش عضلانی در هنگام استراحت، کندی حرکت به دلیل سفتی عضلانی، سختی عضلات و ناتوانی در حفظ قامت است (7،6). پژوهشها نشان دادهاند که علائم غیرحرکتی مانند یبوست، اختلالات بویایی و افسردگی، ممکن است چند سال زودتر از نقص حرکتی نمایان گردد (8). بهطور معمول با گذشت زمان، شرایط بیماری وخیمتر شده و بیشتر جنبههای زندگی افراد مبتلا مورد تأثیر قرار می¬گیرد به¬طوری که بیشتر بیماران از راه رفتن، کاهش طول گام، بلندشدن از روی صندلی، فقدان انرژی و نیاز به صرف انرژی اضافی برای انجام کارهای روزانه رنج می-برند (5). مشخص شده است که التهاب یکی از مکانیسمهای زیربنایی پاتوفیزیولوژی و پیشرفت بیماری پارکینسون است (9). محتملترین عامل ایجاد بیماری پارکینسون تجمع آلفا- سینوکلئین Alpha-synuclein است که موجب فعالسازی میکروگلیا و آستروسیتها شده و التهاب عصبی مزمن را بههمراه دارد (10). در طی فرآیندهای التهاب عصبی، میکروگلیا سایتوکینهای پیشالتهابی از جمله فاکتور نکروزی تومور- آلفا Tumor necrosis factor alpha (TNF-α)، اینترلوکین- 1 بتا Interleukin-1 beta (IL-1β)، اینترلوکین-6 (IL-6) و اینترفرون گاما Interferon-gamma (IFN-γ) تولید میکند. همینطور، آستروسیتها دو پروتئین شامل پروتئین اسیدی فیبریلهای گلیال Glial fibrils acidic protein (GFAP) و پروتئین بتا S100، تولید میکند که نشانگرهای التهاب عصبی در نظر گرفته میشوند (11). افزونبراین، فنوتیپهای میکروگلیا در مغز میانی با سایر بخشهای دستگاه عصبی مرکزی یکسان نیست، و ممکن است پیامدهای بیشتری برای آسیبپذیری نورونهای دوپامینرژیک در بیماری پارکینسون داشته باشد (12). در نتیجه آلفا- سینوکلئین تجمعیافته، میکروگلیای پیشالتهابی را از راه گیرندههای ایمنی غیرفعال و مشارکت آبشارهای سیگنالدهی درون سلولی القا میکند (13). فعال شدن پیش-التهابی میکروگلیا قادر است نورونها، بهویژه نورونهای دوپامینرژیک را از بین ببرد (14) (شکل 1). ماده سیاه پارس کامپکتا نسبت به سایر نواحی مغز حاوی میکروگلیای بیشتر و آستروسیت کمتری میباشد و بیشتر در معرض التهاب عصبی قرار دارد. به همین دلیل در بیماریهای تحلیل برنده عصبی بیشتر دچار آسیب میشود (15). بنابراین، مهار واسطههای التهابی ناشی از فعالسازی میکروگلیا یک رویکرد مؤثر و درمانی برای کاهش پیشرفت بیماریهای تخریب کننده عصبی است (16).
در شرایط فیزیولوژیکی، افزایش سایتوکینهای پیشالتهابی با القا تولید سایتوکینهای ضدالتهابی مانند IL-10 و TGF-β از التهاب مخرب جلوگیری میکند (17). در بیماری پارکینسون، تعادل بین سایتوکینهای پیشالتهابی و ضدالتهابی مختل شده و باعث التهاب مزمن عصبی میشود. علاوه بر التهاب عصبی، افزایش نفوذپذیری سد خونی مغزی Blood barrier brain در پارکینسون دیده شده است (19،18). سد خونی مغزی از ورود پاتوژنها و سلولهای ایمنی به داخل پارانشیم مغز جلوگیری میکند. در نتیجه حضور سایتوکینهای پیشالتهابی، ممکن است سد خونی مغزی آسیبپذیر شود، و منجر به تماس گستردهتر بین دستگاه عصبی مرکزی و محیطی شود (20، 19). همچنین، وجود التهاب عصبی، آسیب سد خونی مغزی و افزایش التهاب سیستمیک در بیماری پارکینسون، نشان میدهد که بین التهاب محیطی و عصبی ارتباط نزدیکی وجود دارد (21). در یک فراتحلیل شامل 2654 آزمودنی (1547 بیمار مبتلا به پارکینسون و 1107 آزمودنی سالم) نشان داد، سطوح IL-6، TNF-α، IL-1β، IL-2 و IL-10 در خون بیماران پارکینسونی در مقایسه با آزمودنی¬های سالم بیشتر بود که نشان دهنده نقش احتمالی فعالسازی ایمنی محیطی در گسترش بیماری پارکینسون است (22). همینطور، استفاده از داروهای غیراستروئیدی ضدالتهابی از جمله ایبوپروفن، با کاهش خطر بیماری پارکینسون همراه بود که از ارتباط التهاب با این بیماری حمایت میکند (23). التهاب عصبی که یک پاسخ فیزیولوژیکی محافظتی در مغز است، دستگاه عصبی مرکزی را نیز مورد تأثیر قرار میدهد. در واقع، التهاب عصبی یک واکنش قوی است که از مغز در برابر عوامل مضر درونی و بیرونی محافظت میکند. بااینحال، ترشح بیش از حد واسطه-های التهابی به دستگاه عصبی مرکزی آسیب میرساند. التهاب عصبی را میتوان به دو نوع تقسیم کرد: محافظت کننده عصبی و تخریب کننده عصبی. هنگامی که اثر آسیب برای مدت کوتاهی ادامه داشته باشد، التهاب عصبی موجب محافظت عصبی میشود. در مقابل، زمانی که در طولانیمدت ادامه یابد، با آثار مضر بر دستگاه عصبی مرکزی منجر به تخریب عصبی میشود (24). گرچه نشانگرهای زیستی بیماری پارکینسون بهخوبی شناسایی شده است، اما روشهای دارویی و غیردارویی برای درمان و کاهش سرعت پیشرفت این بیماری کمتر مورد توجه قرار گرفته است. درمان فعلی برای بیماری پارکینسون بیشتر مبتنی بر جایگزینی دوپامین است که کنترل کافی علائم حرکتی را به دنبال دارد، اما از پیشرفت تخریب عصبی که منجر به پیشرفت بیماری میشود، جلوگیری نمی¬کند (25). درواقع، داروهای در دسترس برای درمان بیماری پارکینسون، تنها بهصورت موقتی سبب بهبود علائم بیماری میشوند و روشهای درمانی که پیشرفت بیماری را متوقف کنند، هنوز کارایی کافی را ندارند (26). ضمن اینکه بروز مقاومت دارویی موجب پیشرفت بیماری شده و نتایج ناشی از درمان را محدود میکند (27). در عین حال، گزارش شده است که سبک زندگی غیرفعال یا انجام ناکافی فعالیت بدنی میتواند سبب بروز علائم بیماری پارکینسون در بخشهای حرکتی و پیشحرکتی مغز، ایجاد پیری زودرس در سنین جوانی و بروز بیماری¬های با منشأ عصبی در سنین پایین شود (28). از طرفی، نتایج حاصل از مطالعات حیوانی (29،30) و انسانی (31،32) نشان میدهد که تمرین هوازی از راه ایجاد تغییرات ساختاری و عملکردی در دستگاه عصبی مرکزی با ترمیم و محفاظت عصبی همراه است (33،34). از آنجایی که فعالیت ورزشی شدید میتواند از راه افزایش فشار اکسایشی روند درمان بیماری پارکینسون را معکوس کند (35)، مطالعات در جستجوی یافتن شدت و مدت مناسب پروتکل-های تمرینی برای کمک به درمان این بیماری هستند. در مطالعه مروری حاضر تلاش میشود که تغییرات نشانگرهای التهابی بیماران پارکینسونی در پاسخ به تمرینات ورزشی بررسی شود.
روشبررسی
این پژوهش از نوع مرور سیستماتیک بود که در آن آثار تمرینات ورزشی (اعم از تداومی و تناوبی) بر نشانگرهای پیشالتهابی و ضدالتهابی در بیماران مبتلا به بیماری پارکینسون اجرا گردید. برای دسترسی به مقالات علمی دو پژوهشگر بهصورت مجزا جستجو را در پایگاههای اطلاعاتی Pubmed، Springer، Hindawi و Scopus به زبان انگلیسی از ابتدای ماه ژانویه سال 2010 تا انتهای ماه دسامبر سال 2024 میلادی و پایگاه¬های اطلاعاتی جهاد دانشگاهی (SID) و Magiran به زبان فارسی از ابتدای بهمن ماه سال 1388 تا انتهای اسفند ماه سال 1403 شمسی انجام دادند. جستوجو با استفاده از واژههای استاندارد سیستم MeSH صورت گرفت. جستجو در پایگاههای انگلیسی زبان با استفاده از کلید واژههای Parkinson’s disease، Aerobic training، Endurance training، Neuroinflammation و Cytokine و در پایگاههای فارسی از کلید واژه¬های بیماری پارکینسون، تمرین هوازی، تمرین استقامتی، التهاب عصبی و سایتوکاین استفاده شد. معیارهای ورود مقالات به این مطالعه شامل 1) مقالات، اصیل علمی- پژوهشی باشند، 2) آزمودنیها فقط مبتلا به بیماری پارکینسون باشند و 3) تنها آثار تمرینات هوازی بلندمدت بر نشانگرهای التهابی بررسی شده باشد، 4) طول دوره تمرینات بیش از چهار هفته باشد. در جستجوی اولیه تعداد 962 یافت شد که پس از بررسی تعداد 894 مقاله تکراری با توجه به عنوان و چکیده آنها حذف گردید. در غربالگری مرحله دوم نیز طبق معیارهای ورود، تعداد 53 غیرمرتبط با موضوع پژوهش از محدوده بررسی خارج شد و در نهایت 15 مقاله تجزیه و تحلیل گردید.
نتایج
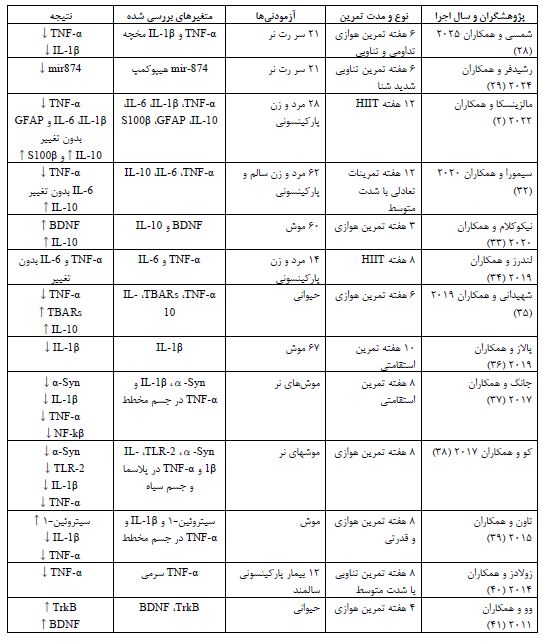
از بین 962 مطالعه مورد بررسی در پایگاههای اطلاعاتی داخلی و خارجی در 15 سال اخیر و پس از اعمال معیارهای ورودی و خروجی، تعداد 15 مقاله مرور شد. در تمام این مطالعات آثار انواع گوناگون تمرین هوازی (تناوبی، تداومی و استقامتی) یا قدرتی را بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون را بررسی کرده¬اند. نوع آزمودنی¬ها در پنج مطالعه انسانی و در 10 مطالعه حیوانی (موش یا رت) بود. سایتوکاین TNF-α در 11 مطالعه ارزیابی شده بود که پرکاربردترین نشانگر التهابی محسوب می¬شود. همچنین، IL-1β در هشت و IL-10 در شش پژوهش بررسی شده بود. در مجموع، تجزیه و تحلیل مطالعات نشان داد که تمرین هوازی در کاهش نشانگرهای پیش¬التهابی (از قبیل TNF-α و IL-1β) و افزایش نشانگرهای ضدالتهابی (مانند IL-10) در بیماران پارکینسونی بهویژه مدل حیوانی موثر است. با این-وجود، در مورد اثربخشی آثار انواع مختلف تمرینات هوازی مثل تداومی و تناوبی بر نشانگرهای التهابی مطالعات چندانی صورت نگرفته و به مطالعات بیشتری در این زمینه نیاز هست. جدول 1 خلاصه مطالعات انجام گرفته در مورد آثار تمرینات ورزشی بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون آورده شده است.
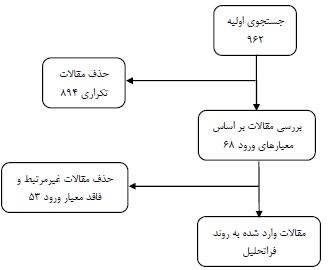
شکل 1: مراحل انتخاب مقالات در پژوهش حاضر
جدول 1: آثار تمرینات ورزشی بر نشانگرهای التهابی در بیماران پارکینسون
بحث
پژوهش¬هایی که به بررسی اثر تمرین ورزشی بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون پرداختهاند، اندک هستند. همینطور به دلیل عملکردهای متنوع عوامل التهابی، تفسیر و تعیین سازگاری نشانگرهای التهابی ناشی از تمرینات ورزشی دشوار است. مشخص شده است که فعالیت ورزشی با تعدیل سیستمهای متعدد دخیل در تنظیم التهاب عصبی میتواند ترمیم عصبی را بهبود بخشد (42). افزونبر این، فعالیت ورزشی از راه کاهش سایتوکینهای پیشالتهابی در گردش مانند IL-1β و TNF-α (40، 32، 2)، و افزایش سایتوکینهای ضدالتهابی مثل IL-10 (35، 33، 2) تغییرات متابولیکی را اعمال می¬کند. به این ترتیب، میتواند سطوح آلفا- سینوکلئین و آپوپتوز عصبی را کمتر کند، در نتیجه التهاب و اختلال عملکرد میتوکندری را برای بازگرداندن عملکرد حرکتی در بیماران مبتلا به پارکینسون کاهش میدهد (44، 43). همینطور، فعالیت ورزشی منظم، سنتز انتقال دهنده¬های عصبی مانند دوپامین و عوامل نوروتروفیک مشتق از سلول گلیال Glial cell-derived neurotrophic factors (GDNF)، عوامل نوروتروفیک مشتق شده از مغز Brain-derived neurotrophic factors (BDNF) و فاکتور رشد شبه انسولین-1 Insulin-like growth factor-1 (IGF-1) را تحریک میکند. بنابراین، فعالیت ورزشی پتانسیل افزایش سطوح عوامل آنتیاکسیدانی و ضد-التهابی در دستگاه عصبی مرکزی و در نتیجه اعمال آثار محافظت کننده عصبی در بیماران پارکینسونی را دارد (46، 45) (شکل 2). گرچه در برخی مطالعات با آزمودنیهای انسانی، به دنبال تمرینات هوازی تداومی (34) و تناوبی شدید (47) سطح سرمی TNF-α تغییری نشان نداد. در چندین مطالعه گزارش دادهاند که شناسایی آلفا-سینوکلئین توسط TRL-2 منجر به تولید سایتوکینهای پیش¬التهابی از قبیل IL-1β و TNF-α میشود که نوروتوکسیک هستند (50، 49، 48). بنابراین، پیشنهاد شده است که آلفا- سینوکلئین یک عامل اتصال بالقوه TRL-2 است و این تعامل بین آلفا- سینوکلئین و TRL-2 نقش مهمی در شروع التهاب عصبی دارد (47، 46). بهطور مشابهی، تمرین استقامتی علاوه بر کاهش سیگنالدهی TRL-2 منجر به سرکوب آلفا- سینوکلئین شد که اثر محافظت کننده عصبی و ضدالتهابی این نوع تمرین را نشان میدهد (37). گزارش شده است که تمرین ورزشی بر روی نوارگردان بر التهاب ناشی از سایتوکین-های پیشالتهابی اثر دارد که ممکن است بهواسطه سنتز اکسید نیتریک که در انتقال عصبی سلولهای عصبی نقش دارد و به کاهش پارامترهای التهابی کمک میکند؛ مرتبط باشد (36). عامل رونویسی هستهای- کاپا بی (NF-κB) Nuclear transcription factor-kB نقش مهمی در ایجاد یک محیط عصبی التهابی، تنظیم بیان ژن سایتوکینهای پیشالتهابی مانند IL-1β و TNF-α ایفا میکند (49). مطالعات با مدلهای حیوانی PD افزایش سطح NF-kB و در نتیجه فراتنظیمی سایتوکینهای پیشالتهابی (IL-1β و TNF-α) را نشان دادهاند. با اینحال، حیوانات درگیر در تمرینات ورزشی کاهش سطح NF-kB را نشان دادند، که با آثار محافظت کننده عصبی و کاهش پیشالتهابی فعالیت ورزشی همخوانی دارد. بنابراین، تمرین ورزشی در پیشگیری از مرگ سلولی نورونهای دوپامینرژیک مشارکت دارد (47، 45). یافتههای پژوهشی نشان داده است که انقباضهای عضلانی در خلال فعالیت ورزشی موجب افزایش تولید IL-6 می¬شود و این مایوکاین تولید سایتوکین¬های ضـدالتهابی مانند گیرنده مخـالف IL-1 (IL-1ra) و IL-10 را تحریک کرده و همچنین سبب مهار تولید سایتوکین¬های پیش¬التهابی از قبیل TNF-α میشود. گزارش شده است که IL-10 سایتوکاین دارای خاصیت ضدالتهابی میباشد و نقش بالقوه آن در کاهش التهاب و بهبود و بازسازی بافت نشان داده شده است (61). به دنبال تمرینات هوازی افزایش میزان IL-10 در جسم مخطط (35 ،33)، ماده سیاه پارس کامپکتا (35) و سرم (2) بیماران مبتلا به پارکینسون گزارش شده است که آثار ضدالتهابی این نوع تمرین را نشان میدهد. RNAهای غیرکدکننده Non-coding RNA از دیگر نشانگرهای زیستی اثرگذار بر بیماری پارکینسون هستند (51). گروهی از RNAها، به نام miRNA نقش مهمی در تنظیم بیان ژن دارند (50). برای نمونه، mir-874 در افزایش التهاب عصبی (29) و سمیت سلولی و اتوفاژی (51) نقش دارد و با آسیب به نورونهای دوپامینرژیک موجب پیشرفت بیماری پارکینسون میشود. به-تازگی گزارش شده است که شش هفته تمرین تناوبی شدید شنا با کاهش معنادار این نشانگر التهابی در بافت هیپوکمپ رتهای مبتلا به پارکینسون همراه است (29).
نتیجهگیری
در مجموع نتایج مطالعات بررسی شده نشان داد که پروتکلهای گوناگون تمرین هوازی اعم از تداومی و تناوبی در کاهش نشانگرهای نشانگرهای پیشالتهابی مانند آلفا- سینوکلئین، IL-1β و TNF-α و NF-kB و بیماران پارکینسونی بهویژه در سطح بافتی موثر است. همینطور، تمرینات هوازی بهبود در پارامترهای ضدالتهابی مانند افزایش سطوح BDNF، TGF-β1 و β-NGF به دنبال داشت. گرچه در مورد مقایسه انواع مختلف این نوع تمرین ورزشی مثل تداومی و تناوبی مطالعات چندانی صورت نگرفته و به مطالعات بیشتری در این زمینه نیاز هست. در ضمن بیشتر مطالعات بر روی بیماران مبتلا به پارکینسون بر دوره پس از بیماری متمرکز شدهاند، و به نقش پیشگیرانه تمرین ورزشی پیش از بروز بیماری کمتر توجه شده است.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
سازمان بهداشت جهانی بیماری پارکینسون Parkinson’s disease (PD) را به عنوان سریعترین بیماری عصبی در حال رشد در سرتاسر جهان معرفی کرده (1) و پس از بیماری آلزایمر دومین بیماری تخریبکننده عصبی بهشمار میرود (2). مشخص شده است که در بیماری پارکینسون، ناحیهای در مغز به نام ماده سیاه پارس کامپکتا Substantia nigra pars compacta (SNpc) و نورونهای دوپامینرژیک موجود در آن مورد تأثیر قرار میگیرد (3). مسیر دوپامینرژیک، یکی از چهار مسیر اصلی نورونی در مغز و مسئول اصلی ایجاد حرکت در بدن است که از راه آن میانجی عصبی دوپامین از یک طرف مغز به طرف دیگر منتقل میشود (4). پس از تخریب 60 درصد نورونهای دوپامینرژیک در ماده سیاه پارس کامپکتا نشانههای اولیه بیماری پارکینسون آشکار میگردد (5). مشخصههای کلی این بیماری شامل نقص حرکتی، لرزش عضلانی در هنگام استراحت، کندی حرکت به دلیل سفتی عضلانی، سختی عضلات و ناتوانی در حفظ قامت است (7،6). پژوهشها نشان دادهاند که علائم غیرحرکتی مانند یبوست، اختلالات بویایی و افسردگی، ممکن است چند سال زودتر از نقص حرکتی نمایان گردد (8). بهطور معمول با گذشت زمان، شرایط بیماری وخیمتر شده و بیشتر جنبههای زندگی افراد مبتلا مورد تأثیر قرار می¬گیرد به¬طوری که بیشتر بیماران از راه رفتن، کاهش طول گام، بلندشدن از روی صندلی، فقدان انرژی و نیاز به صرف انرژی اضافی برای انجام کارهای روزانه رنج می-برند (5). مشخص شده است که التهاب یکی از مکانیسمهای زیربنایی پاتوفیزیولوژی و پیشرفت بیماری پارکینسون است (9). محتملترین عامل ایجاد بیماری پارکینسون تجمع آلفا- سینوکلئین Alpha-synuclein است که موجب فعالسازی میکروگلیا و آستروسیتها شده و التهاب عصبی مزمن را بههمراه دارد (10). در طی فرآیندهای التهاب عصبی، میکروگلیا سایتوکینهای پیشالتهابی از جمله فاکتور نکروزی تومور- آلفا Tumor necrosis factor alpha (TNF-α)، اینترلوکین- 1 بتا Interleukin-1 beta (IL-1β)، اینترلوکین-6 (IL-6) و اینترفرون گاما Interferon-gamma (IFN-γ) تولید میکند. همینطور، آستروسیتها دو پروتئین شامل پروتئین اسیدی فیبریلهای گلیال Glial fibrils acidic protein (GFAP) و پروتئین بتا S100، تولید میکند که نشانگرهای التهاب عصبی در نظر گرفته میشوند (11). افزونبراین، فنوتیپهای میکروگلیا در مغز میانی با سایر بخشهای دستگاه عصبی مرکزی یکسان نیست، و ممکن است پیامدهای بیشتری برای آسیبپذیری نورونهای دوپامینرژیک در بیماری پارکینسون داشته باشد (12). در نتیجه آلفا- سینوکلئین تجمعیافته، میکروگلیای پیشالتهابی را از راه گیرندههای ایمنی غیرفعال و مشارکت آبشارهای سیگنالدهی درون سلولی القا میکند (13). فعال شدن پیش-التهابی میکروگلیا قادر است نورونها، بهویژه نورونهای دوپامینرژیک را از بین ببرد (14) (شکل 1). ماده سیاه پارس کامپکتا نسبت به سایر نواحی مغز حاوی میکروگلیای بیشتر و آستروسیت کمتری میباشد و بیشتر در معرض التهاب عصبی قرار دارد. به همین دلیل در بیماریهای تحلیل برنده عصبی بیشتر دچار آسیب میشود (15). بنابراین، مهار واسطههای التهابی ناشی از فعالسازی میکروگلیا یک رویکرد مؤثر و درمانی برای کاهش پیشرفت بیماریهای تخریب کننده عصبی است (16).
در شرایط فیزیولوژیکی، افزایش سایتوکینهای پیشالتهابی با القا تولید سایتوکینهای ضدالتهابی مانند IL-10 و TGF-β از التهاب مخرب جلوگیری میکند (17). در بیماری پارکینسون، تعادل بین سایتوکینهای پیشالتهابی و ضدالتهابی مختل شده و باعث التهاب مزمن عصبی میشود. علاوه بر التهاب عصبی، افزایش نفوذپذیری سد خونی مغزی Blood barrier brain در پارکینسون دیده شده است (19،18). سد خونی مغزی از ورود پاتوژنها و سلولهای ایمنی به داخل پارانشیم مغز جلوگیری میکند. در نتیجه حضور سایتوکینهای پیشالتهابی، ممکن است سد خونی مغزی آسیبپذیر شود، و منجر به تماس گستردهتر بین دستگاه عصبی مرکزی و محیطی شود (20، 19). همچنین، وجود التهاب عصبی، آسیب سد خونی مغزی و افزایش التهاب سیستمیک در بیماری پارکینسون، نشان میدهد که بین التهاب محیطی و عصبی ارتباط نزدیکی وجود دارد (21). در یک فراتحلیل شامل 2654 آزمودنی (1547 بیمار مبتلا به پارکینسون و 1107 آزمودنی سالم) نشان داد، سطوح IL-6، TNF-α، IL-1β، IL-2 و IL-10 در خون بیماران پارکینسونی در مقایسه با آزمودنی¬های سالم بیشتر بود که نشان دهنده نقش احتمالی فعالسازی ایمنی محیطی در گسترش بیماری پارکینسون است (22). همینطور، استفاده از داروهای غیراستروئیدی ضدالتهابی از جمله ایبوپروفن، با کاهش خطر بیماری پارکینسون همراه بود که از ارتباط التهاب با این بیماری حمایت میکند (23). التهاب عصبی که یک پاسخ فیزیولوژیکی محافظتی در مغز است، دستگاه عصبی مرکزی را نیز مورد تأثیر قرار میدهد. در واقع، التهاب عصبی یک واکنش قوی است که از مغز در برابر عوامل مضر درونی و بیرونی محافظت میکند. بااینحال، ترشح بیش از حد واسطه-های التهابی به دستگاه عصبی مرکزی آسیب میرساند. التهاب عصبی را میتوان به دو نوع تقسیم کرد: محافظت کننده عصبی و تخریب کننده عصبی. هنگامی که اثر آسیب برای مدت کوتاهی ادامه داشته باشد، التهاب عصبی موجب محافظت عصبی میشود. در مقابل، زمانی که در طولانیمدت ادامه یابد، با آثار مضر بر دستگاه عصبی مرکزی منجر به تخریب عصبی میشود (24). گرچه نشانگرهای زیستی بیماری پارکینسون بهخوبی شناسایی شده است، اما روشهای دارویی و غیردارویی برای درمان و کاهش سرعت پیشرفت این بیماری کمتر مورد توجه قرار گرفته است. درمان فعلی برای بیماری پارکینسون بیشتر مبتنی بر جایگزینی دوپامین است که کنترل کافی علائم حرکتی را به دنبال دارد، اما از پیشرفت تخریب عصبی که منجر به پیشرفت بیماری میشود، جلوگیری نمی¬کند (25). درواقع، داروهای در دسترس برای درمان بیماری پارکینسون، تنها بهصورت موقتی سبب بهبود علائم بیماری میشوند و روشهای درمانی که پیشرفت بیماری را متوقف کنند، هنوز کارایی کافی را ندارند (26). ضمن اینکه بروز مقاومت دارویی موجب پیشرفت بیماری شده و نتایج ناشی از درمان را محدود میکند (27). در عین حال، گزارش شده است که سبک زندگی غیرفعال یا انجام ناکافی فعالیت بدنی میتواند سبب بروز علائم بیماری پارکینسون در بخشهای حرکتی و پیشحرکتی مغز، ایجاد پیری زودرس در سنین جوانی و بروز بیماری¬های با منشأ عصبی در سنین پایین شود (28). از طرفی، نتایج حاصل از مطالعات حیوانی (29،30) و انسانی (31،32) نشان میدهد که تمرین هوازی از راه ایجاد تغییرات ساختاری و عملکردی در دستگاه عصبی مرکزی با ترمیم و محفاظت عصبی همراه است (33،34). از آنجایی که فعالیت ورزشی شدید میتواند از راه افزایش فشار اکسایشی روند درمان بیماری پارکینسون را معکوس کند (35)، مطالعات در جستجوی یافتن شدت و مدت مناسب پروتکل-های تمرینی برای کمک به درمان این بیماری هستند. در مطالعه مروری حاضر تلاش میشود که تغییرات نشانگرهای التهابی بیماران پارکینسونی در پاسخ به تمرینات ورزشی بررسی شود.
روشبررسی
این پژوهش از نوع مرور سیستماتیک بود که در آن آثار تمرینات ورزشی (اعم از تداومی و تناوبی) بر نشانگرهای پیشالتهابی و ضدالتهابی در بیماران مبتلا به بیماری پارکینسون اجرا گردید. برای دسترسی به مقالات علمی دو پژوهشگر بهصورت مجزا جستجو را در پایگاههای اطلاعاتی Pubmed، Springer، Hindawi و Scopus به زبان انگلیسی از ابتدای ماه ژانویه سال 2010 تا انتهای ماه دسامبر سال 2024 میلادی و پایگاه¬های اطلاعاتی جهاد دانشگاهی (SID) و Magiran به زبان فارسی از ابتدای بهمن ماه سال 1388 تا انتهای اسفند ماه سال 1403 شمسی انجام دادند. جستوجو با استفاده از واژههای استاندارد سیستم MeSH صورت گرفت. جستجو در پایگاههای انگلیسی زبان با استفاده از کلید واژههای Parkinson’s disease، Aerobic training، Endurance training، Neuroinflammation و Cytokine و در پایگاههای فارسی از کلید واژه¬های بیماری پارکینسون، تمرین هوازی، تمرین استقامتی، التهاب عصبی و سایتوکاین استفاده شد. معیارهای ورود مقالات به این مطالعه شامل 1) مقالات، اصیل علمی- پژوهشی باشند، 2) آزمودنیها فقط مبتلا به بیماری پارکینسون باشند و 3) تنها آثار تمرینات هوازی بلندمدت بر نشانگرهای التهابی بررسی شده باشد، 4) طول دوره تمرینات بیش از چهار هفته باشد. در جستجوی اولیه تعداد 962 یافت شد که پس از بررسی تعداد 894 مقاله تکراری با توجه به عنوان و چکیده آنها حذف گردید. در غربالگری مرحله دوم نیز طبق معیارهای ورود، تعداد 53 غیرمرتبط با موضوع پژوهش از محدوده بررسی خارج شد و در نهایت 15 مقاله تجزیه و تحلیل گردید.
نتایج
از بین 962 مطالعه مورد بررسی در پایگاههای اطلاعاتی داخلی و خارجی در 15 سال اخیر و پس از اعمال معیارهای ورودی و خروجی، تعداد 15 مقاله مرور شد. در تمام این مطالعات آثار انواع گوناگون تمرین هوازی (تناوبی، تداومی و استقامتی) یا قدرتی را بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون را بررسی کرده¬اند. نوع آزمودنی¬ها در پنج مطالعه انسانی و در 10 مطالعه حیوانی (موش یا رت) بود. سایتوکاین TNF-α در 11 مطالعه ارزیابی شده بود که پرکاربردترین نشانگر التهابی محسوب می¬شود. همچنین، IL-1β در هشت و IL-10 در شش پژوهش بررسی شده بود. در مجموع، تجزیه و تحلیل مطالعات نشان داد که تمرین هوازی در کاهش نشانگرهای پیش¬التهابی (از قبیل TNF-α و IL-1β) و افزایش نشانگرهای ضدالتهابی (مانند IL-10) در بیماران پارکینسونی بهویژه مدل حیوانی موثر است. با این-وجود، در مورد اثربخشی آثار انواع مختلف تمرینات هوازی مثل تداومی و تناوبی بر نشانگرهای التهابی مطالعات چندانی صورت نگرفته و به مطالعات بیشتری در این زمینه نیاز هست. جدول 1 خلاصه مطالعات انجام گرفته در مورد آثار تمرینات ورزشی بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون آورده شده است.

شکل 1: مراحل انتخاب مقالات در پژوهش حاضر
جدول 1: آثار تمرینات ورزشی بر نشانگرهای التهابی در بیماران پارکینسون

بحث
پژوهش¬هایی که به بررسی اثر تمرین ورزشی بر نشانگرهای التهابی در بیماران مبتلا به پارکینسون پرداختهاند، اندک هستند. همینطور به دلیل عملکردهای متنوع عوامل التهابی، تفسیر و تعیین سازگاری نشانگرهای التهابی ناشی از تمرینات ورزشی دشوار است. مشخص شده است که فعالیت ورزشی با تعدیل سیستمهای متعدد دخیل در تنظیم التهاب عصبی میتواند ترمیم عصبی را بهبود بخشد (42). افزونبر این، فعالیت ورزشی از راه کاهش سایتوکینهای پیشالتهابی در گردش مانند IL-1β و TNF-α (40، 32، 2)، و افزایش سایتوکینهای ضدالتهابی مثل IL-10 (35، 33، 2) تغییرات متابولیکی را اعمال می¬کند. به این ترتیب، میتواند سطوح آلفا- سینوکلئین و آپوپتوز عصبی را کمتر کند، در نتیجه التهاب و اختلال عملکرد میتوکندری را برای بازگرداندن عملکرد حرکتی در بیماران مبتلا به پارکینسون کاهش میدهد (44، 43). همینطور، فعالیت ورزشی منظم، سنتز انتقال دهنده¬های عصبی مانند دوپامین و عوامل نوروتروفیک مشتق از سلول گلیال Glial cell-derived neurotrophic factors (GDNF)، عوامل نوروتروفیک مشتق شده از مغز Brain-derived neurotrophic factors (BDNF) و فاکتور رشد شبه انسولین-1 Insulin-like growth factor-1 (IGF-1) را تحریک میکند. بنابراین، فعالیت ورزشی پتانسیل افزایش سطوح عوامل آنتیاکسیدانی و ضد-التهابی در دستگاه عصبی مرکزی و در نتیجه اعمال آثار محافظت کننده عصبی در بیماران پارکینسونی را دارد (46، 45) (شکل 2). گرچه در برخی مطالعات با آزمودنیهای انسانی، به دنبال تمرینات هوازی تداومی (34) و تناوبی شدید (47) سطح سرمی TNF-α تغییری نشان نداد. در چندین مطالعه گزارش دادهاند که شناسایی آلفا-سینوکلئین توسط TRL-2 منجر به تولید سایتوکینهای پیش¬التهابی از قبیل IL-1β و TNF-α میشود که نوروتوکسیک هستند (50، 49، 48). بنابراین، پیشنهاد شده است که آلفا- سینوکلئین یک عامل اتصال بالقوه TRL-2 است و این تعامل بین آلفا- سینوکلئین و TRL-2 نقش مهمی در شروع التهاب عصبی دارد (47، 46). بهطور مشابهی، تمرین استقامتی علاوه بر کاهش سیگنالدهی TRL-2 منجر به سرکوب آلفا- سینوکلئین شد که اثر محافظت کننده عصبی و ضدالتهابی این نوع تمرین را نشان میدهد (37). گزارش شده است که تمرین ورزشی بر روی نوارگردان بر التهاب ناشی از سایتوکین-های پیشالتهابی اثر دارد که ممکن است بهواسطه سنتز اکسید نیتریک که در انتقال عصبی سلولهای عصبی نقش دارد و به کاهش پارامترهای التهابی کمک میکند؛ مرتبط باشد (36). عامل رونویسی هستهای- کاپا بی (NF-κB) Nuclear transcription factor-kB نقش مهمی در ایجاد یک محیط عصبی التهابی، تنظیم بیان ژن سایتوکینهای پیشالتهابی مانند IL-1β و TNF-α ایفا میکند (49). مطالعات با مدلهای حیوانی PD افزایش سطح NF-kB و در نتیجه فراتنظیمی سایتوکینهای پیشالتهابی (IL-1β و TNF-α) را نشان دادهاند. با اینحال، حیوانات درگیر در تمرینات ورزشی کاهش سطح NF-kB را نشان دادند، که با آثار محافظت کننده عصبی و کاهش پیشالتهابی فعالیت ورزشی همخوانی دارد. بنابراین، تمرین ورزشی در پیشگیری از مرگ سلولی نورونهای دوپامینرژیک مشارکت دارد (47، 45). یافتههای پژوهشی نشان داده است که انقباضهای عضلانی در خلال فعالیت ورزشی موجب افزایش تولید IL-6 می¬شود و این مایوکاین تولید سایتوکین¬های ضـدالتهابی مانند گیرنده مخـالف IL-1 (IL-1ra) و IL-10 را تحریک کرده و همچنین سبب مهار تولید سایتوکین¬های پیش¬التهابی از قبیل TNF-α میشود. گزارش شده است که IL-10 سایتوکاین دارای خاصیت ضدالتهابی میباشد و نقش بالقوه آن در کاهش التهاب و بهبود و بازسازی بافت نشان داده شده است (61). به دنبال تمرینات هوازی افزایش میزان IL-10 در جسم مخطط (35 ،33)، ماده سیاه پارس کامپکتا (35) و سرم (2) بیماران مبتلا به پارکینسون گزارش شده است که آثار ضدالتهابی این نوع تمرین را نشان میدهد. RNAهای غیرکدکننده Non-coding RNA از دیگر نشانگرهای زیستی اثرگذار بر بیماری پارکینسون هستند (51). گروهی از RNAها، به نام miRNA نقش مهمی در تنظیم بیان ژن دارند (50). برای نمونه، mir-874 در افزایش التهاب عصبی (29) و سمیت سلولی و اتوفاژی (51) نقش دارد و با آسیب به نورونهای دوپامینرژیک موجب پیشرفت بیماری پارکینسون میشود. به-تازگی گزارش شده است که شش هفته تمرین تناوبی شدید شنا با کاهش معنادار این نشانگر التهابی در بافت هیپوکمپ رتهای مبتلا به پارکینسون همراه است (29).
نتیجهگیری
در مجموع نتایج مطالعات بررسی شده نشان داد که پروتکلهای گوناگون تمرین هوازی اعم از تداومی و تناوبی در کاهش نشانگرهای نشانگرهای پیشالتهابی مانند آلفا- سینوکلئین، IL-1β و TNF-α و NF-kB و بیماران پارکینسونی بهویژه در سطح بافتی موثر است. همینطور، تمرینات هوازی بهبود در پارامترهای ضدالتهابی مانند افزایش سطوح BDNF، TGF-β1 و β-NGF به دنبال داشت. گرچه در مورد مقایسه انواع مختلف این نوع تمرین ورزشی مثل تداومی و تناوبی مطالعات چندانی صورت نگرفته و به مطالعات بیشتری در این زمینه نیاز هست. در ضمن بیشتر مطالعات بر روی بیماران مبتلا به پارکینسون بر دوره پس از بیماری متمرکز شدهاند، و به نقش پیشگیرانه تمرین ورزشی پیش از بروز بیماری کمتر توجه شده است.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- McGinley JL, Nakayama Y. Exercise for People with Parkinson's Disease: Updates and Future Considerations. Phys Ther Res 2024; 27(2): 67-75.
2- Malczynska-Sims P, Chalimoniuk M, Wronski Z, Marusiak J, Sulek A. High-Intensity Interval Training Modulates Inflammatory Response in Parkinson's Disease. Aging Clin Exp Res 2022; 34(9): 2243- 176.
3- LaHue SC, Comella CL, Tanner CM. The Bestmedicine? The Influence of Physical Activity and Inactivity on Parkinson’s Disease. Mov Disord 2016; 31(10): 1444-54.
4- Salgado S, Williams N, Kotian R, Salgado M. An Evidence-Based Exercise Regimen for Patients with Mild to Moderate Parkinson’s Disease. Brain Sci 2013; 3(1): 87-100.
5- Cho HS, Shin M-, Song W, Jun TW, Lim BV, Kim YP, et al. Treadmill Exercise Alleviates Short-Term Memory Impairment in 6-Hydroxydopamine-Induced Parkinson’s Rats. J Exerc Rehabil 2013; 9(3): 354-61.
6- Goes A, Souza L, Del Fabbro L, De Gomes M, Boeira S, Jesse C. Neuroprotective Effects of Swimming Training in a Mouse Model of Parkinson’s Disease Induced by 6-Hydroxydopamine. Neuroscience 2014; 256: 61-71.
7- Zhang W, Wang T, Pei Z, Miller DS, Wu X, Block ML, et al. Aggregated Alpha-Synuclein Activates Microglia: A Process Leading to Disease Progression in Parkinson's Disease. FASEB J 2005; 19(6): 533-42.
8- Herrmann M, Vos P, Wunderlich MT, de Bruijn CH, Lamers KJ. Release of Glial Tissue-Specific Proteins after Acute Stroke: A Comparative Analysis of Serum Concentrations of Protein S-100B and Glial Fibrillary Acidic Protein. Stroke 2000; 31(11): 2670-77.
9- Surmeier DJ, Obeso JA, Halliday GM. Selective Neuronal Vulnerability in Parkinson Disease. Nat Rev Neurosci 2017; 18(2): 101-13.
10- Kam TI, Hinkle JT, Dawson TM, Dawson VL. Microglia and Astrocyte Dysfunction in Parkinson's Disease. Neurobiol Dis 2020; 144: 105028.
11- Pajares M, I Rojo A, Manda G, Boscá L, Cuadrado A. Inflammation in Parkinson's Disease: Mechanisms and Therapeutic Implications. Cells 2020; 9(7): 1687.
12- Shabab T, Khanabdali R, Moghadamtousi SZ, Kadir HA, Mohan G. Neuroinflammation Pathways: A General Review. Int J Neurosci 2017; 127(7): 624-33.
13- Tang Y, Le W. Differential Roles of M1 And M2 Microglia in Neurodegenerative Diseases. Mol Neurobiol 2016; 53(2): 1181-194.
14- Wang Q, Liu Y, Zhou J. Neuroinflammation in Parkinson's Disease and Its Potential as Therapeutic Target. Transl Neurodegener 2015; 4: 19.
15- Kortekaas R, Leenders KL, Van Oostrom JC, Vaalburg W, Bart J, Willemsen AT, et al. Blood-Brain Barrier Dysfunction in Parkinsonian Midbrain in Vivo. Ann Neurol 2005; 57(2): 176-9.
16- Ohlin KE, Sebastianutto I, Adkins CE, Lundblad C, Lockman PR, Cenci MA. Impact of L-DOPA Treatment on Regional Cerebral Blood Flow and Metabolism in the Basal Ganglia in a Rat Model of Parkinson's Disease. Neuroimage 2012; 61(1): 228-39.
17- Ferrari CC, Tarelli R. Parkinson's Disease and Systemic Inflammation. Parkinsons Dis 2011; 2011: 436813.
18- Kim W, Noh H, Lee Y, Jeon J, Shanmugavadivu A, McPhie DL, et al. Mir-126 Regulates Growth Factor Activities and Vulnerability to Toxic Insult in Neurons. Mol Neurobiol 2016; 53(1): 95-108.
19- Alcalay RN. Cytokines as Potential Biomarkers of Parkinson Disease. JAMA Neurol 2016; 73(11): 1282-84.
20- Shastri A, Bonifati DM, Kishore U. Innate Immunity and Neuroinflammation. Mediators Inflamm 2013; 2013: 342931.
21- Carta AR, Pisanu A, Carboni E. Do PPAR-Gamma Agonists Have a Future in Parkinson's Disease Therapy? Parkinsons Dis 2011; 2011: 689181.
22- Gerecke KM, Jiao Y, Pani A, Pagala V, Smeyne RJ. Exercise Protects Against MPTP-Induced Neurotoxicity in Mice. Brain Res 2010; 1341: 72-83.
23- Fisher BE, Li Q, Nacca A, Salem GJ, Song J, Yip J, et al. Treadmill Exercise Elevates Striatal Dopamine D2 Receptor Binding Potential in Patients with Early Parkinson's Disease. Neuroreport 2013; 24(10): 509-14.
24- Johansson ME, Cameron IGM, Van der Kolk NM, de Vries NM, Klimars E, Toni I, et al. Aerobic Exercise Alters Brain Function and Structure in Parkinson's Disease: A Randomized Controlled Trial. Ann Neurol 2022; 91(2): 203-16.
25- Kaagman DGM, van Wegen EEH, Cignetti N, Rothermel E, Vanbellingen T, Hirsch MA. Effects and Mechanisms of Exercise on Brain-Derived Neurotrophic Factor (BDNF) Levels and Clinical Outcomes in People with Parkinson's Disease: A Systematic Review and Meta-Analysis. Brain Sci 2024; 14(3): 194.
26- Rotondo R, Proietti S, Perluigi M, Padua E, Stocchi F, Fini M, et al. Physical Activity and Neurotrophic Factors as Potential Drivers of Neuroplasticity in Parkinson's Disease: A Systematic Review and Meta-Analysis. Ageing Res Rev 2023; 92: 102089.
27- Rezaee Z, Marandi M, Alaei H, Esfarjani F. The Effect of Exercise on Parkinson's Disease. Shefaye Khatam 2020; 9(1): 189-99. [Persian]
28- Shamsi Z, Taheri Kalani A, Nikseresht M, Bakhtiari Dehbalaei S, Shamsi L. Comparison the Effect of Continuous and Interval Aerobic Training on IL-1 and TNF-Α Expression in Cerebellum of Parkinson's Model Rats. Journal of Shahid Sadoughi University of Medical Sci 2025; 32(11): 8414-24. [Persian]
29- Rashidfard S, moghadasi M, Edalatmanesh MA, Hojati S. The Effect of High Intensity Interval Swimming on DJ-1 and Mir-874 Gene Expression of Hippocampal Cells in Rats with Parkinson’s Disease. J Appl Health Studies Sport Physiol 2024; 11(1): 251-60. [Persian]
30- Leem YH, Park JS, Park JE, Kim DY, Kim HS. Neurogenic Effects of Rotarod Walking Exercise in Subventricular Zone, Subgranular Zone, and Substantia Nigra in MPTP-Induced Parkinson’s Disease Mice. Sci Rep 2022; 12(1): 10544.
31- Soke F, Kocer B, Fidan I, Keskinoglu P, Guclu-Gunduz A. Effects of Task-Oriented Training Combined with Aerobic Training on Serum BDNF, GDNF, IGF-1, VEGF, TNF-Α, and IL-1β Levels in People with Parkinson's Disease: A Randomized Controlled Study. Exp Gerontol 2021; 150: 111384.
32- Szymura J, Kubica J, Wiecek M, Pera J. The Immunomodulary Effects of Systematic Exercise in Older Adults and People with Parkinson's Disease. J Clin Med 2020; 9(1): 184.
33- Nikokalam Nazif N, Khosravi M, Ahmadi R, Bananej M, Majd A. Effect of Treadmill Exercise on Catalepsy and the Expression of the BDNF Gene in 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine -Induced Parkinson in Male NMRI Mice. Iran J Basic Med Sci 2020; 23(4): 483-93.
34- Landers MR, Navalta JW, Murtishaw AS, Kinney JW, Pirio Richardson S. A High-Intensity Exercise Boot Camp for Persons with Parkinson Disease: A Phase II, Pragmatic, Randomized Clinical Trial of Feasibility, Safety, Signal of Efficacy, And Disease Mechanisms. J Neurol Phys Ther 2019; 43(1): 12-25.
35- Shahidani S, Rajaei Z, Alaei H. Pretreatment with Crocin Along with Treadmill Exercise Ameliorates Motor and Memory Deficits in Hemiparkinsonian Rats by Anti-Inflammatory and Antioxidant Mechanisms. Metab Brain Dis 2019; 34(2): 459-68.
36- Palasz E, Niewiadomski W, Gasiorowska A, Mietelska-Porowska A, Niewiadomska G. Neuroplasticity and Neuroprotective Effect of Treadmill Training in the Chronic Mouse Model of Parkinson's Disease. Neural Plast 2019; 2019: 8215017.
37- Jang Y, Koo JH, Kwon I, Kang EB, Um HS, Soya H, et al. Neuroprotective Effects of Endurance Exercise Against Neuroinflammation in MPTP-Induced Parkinson's Disease Mice. Brain Res 2017; 1655: 186-93.
38- Koo JH, Jang YC, Hwang DJ, Um HS, Lee NH, Jung JH, et al. Treadmill Exercise Produces Neuroprotective Effects in A Murine Model of Parkinson's Disease by Regulating the TLR2/Myd88/NF-Κb Signaling Pathway. Neuroscience 2017; 356: 102-13.
39- Tuon T, Souza PS, Santos MF, Pereira FT, Pedroso GS, Luciano TF, et al. Physical Training Regulates Mitochondrial Parameters and Neuroinflammatory Mechanisms in an Experimental Model of Parkinson's Disease. Oxid Med Cell Longev 2015; 2015: 261809.
40- Zoladz JA, Majerczak J, Zeligowska E, Mencel J, Jaskolski A, Jaskolska A, et al. Moderate-Intensity Interval Training Increases Serum Brain-Derived Neurotrophic Factor Level and Decreases Inflammation in Parkinson's Disease Patients. J Physiol Pharmacol 2014; 65(3): 441-48.
41- Wu SY, Wang TF, Yu L, Jen CJ, Chuang JI, Wu FS, et al. Running Exercise Protects the Substantia Nigra Dopaminergic Neurons Against Inflammation-Induced Degeneration Via the Activation of BDNF Signaling Pathway. Brain Behav Immun 2011; 25(1): 135-46.
42- de Almeida EJR, Ibrahim HJ, Chitolina Schetinger MR, de Andrade CM, Cardoso AM. Modulation of Inflammatory Mediators and Microglial Activation through Physical Exercise in Alzheimer's and Parkinson's Diseases. Neurochem Res 2022; 47(11): 3221-40.
43- Koo JH, Cho JY, Lee UB. Treadmill Exercise Alleviates Motor Deficits and Improves Mitochondrial Import Machinery in an MPTP-Induced Mouse Model of Parkinson's Disease. Exp Gerontol 2017; 89: 20-9.
44- Spielman LJ, Little JP, Klegeris A. Physical Activity and Exercise Attenuate Neuroinflammation in Neurological Diseases. Brain Res Bull 2016; 125: 19-29.
45- Tuon T, Valvassori SS, Lopes-Borges J, Luciano T, Trom CB, Silva LA, et al. Physical Training Exerts Neuroprotective Effects in The Regulation of Neurochemical Factors in an Animal Model of Parkinson's Disease. Neuroscience 2012; 227: 305-12.
46- Daniele SG, Béraud D, Davenport C, Cheng K, Yin H, Maguire-Zeiss KA. Activation of Myd88-Dependent TLR1/2 Signaling by Misfolded Α-Synuclein, A Protein Linked to Neurodegenerative Disorders. Sci Signal 2015; 8(376): ra45.
47- Dzamko N, Gysbers A, Perera G, Bahar A, Shankar A, Gao J, et al. Toll-Like Receptor 2 Is Increased in Neurons in Parkinson's Disease Brain and May Contribute to Alpha-Synuclein Pathology. Acta Neuropathol 2017; 133(2): 303-19.
48- Dimatelis JJ, Hendricks S, Hsieh J, Vlok NM, Bugarith K, Daniels WM, Russell VA. Exercise Partly Reverses the Effect of Maternal Separation on Hippocampal Proteins in 6-Hydroxydopamine-Lesioned Rat Brain. Exp Physiol 2013; 98(1): 233-44.
49- Singh SS, Rai SN, Birla H, Zahra W, Rathore AS, Singh SP. NF-Κb-Mediated Neuroinflammation in Parkinson's Disease and Potential Therapeutic Effect of Polyphenols. Neurotox Res 2020; 37(3): 491-507.
50- Chen Y, Zheng J, Su L, Chen F, Zhu R, Chen X, et al. Increased Salivary Micrornas that Regulate Dj-1 Gene Expression as Potential Markers for Parkinson’s Disease. Front Aging Neurosci 2020; 12: 210.
51- Zhao J, Li H, Chang N. Lncrna HOTAIR Promotes MPP+-Induced Neuronal Injury in Parkinson's Disease by Regulating the Mir-874-5p/ATG10 Axis. EXCLI J 2020; 19: 1141-53.
1- McGinley JL, Nakayama Y. Exercise for People with Parkinson's Disease: Updates and Future Considerations. Phys Ther Res 2024; 27(2): 67-75.
2- Malczynska-Sims P, Chalimoniuk M, Wronski Z, Marusiak J, Sulek A. High-Intensity Interval Training Modulates Inflammatory Response in Parkinson's Disease. Aging Clin Exp Res 2022; 34(9): 2243- 176.
3- LaHue SC, Comella CL, Tanner CM. The Bestmedicine? The Influence of Physical Activity and Inactivity on Parkinson’s Disease. Mov Disord 2016; 31(10): 1444-54.
4- Salgado S, Williams N, Kotian R, Salgado M. An Evidence-Based Exercise Regimen for Patients with Mild to Moderate Parkinson’s Disease. Brain Sci 2013; 3(1): 87-100.
5- Cho HS, Shin M-, Song W, Jun TW, Lim BV, Kim YP, et al. Treadmill Exercise Alleviates Short-Term Memory Impairment in 6-Hydroxydopamine-Induced Parkinson’s Rats. J Exerc Rehabil 2013; 9(3): 354-61.
6- Goes A, Souza L, Del Fabbro L, De Gomes M, Boeira S, Jesse C. Neuroprotective Effects of Swimming Training in a Mouse Model of Parkinson’s Disease Induced by 6-Hydroxydopamine. Neuroscience 2014; 256: 61-71.
7- Zhang W, Wang T, Pei Z, Miller DS, Wu X, Block ML, et al. Aggregated Alpha-Synuclein Activates Microglia: A Process Leading to Disease Progression in Parkinson's Disease. FASEB J 2005; 19(6): 533-42.
8- Herrmann M, Vos P, Wunderlich MT, de Bruijn CH, Lamers KJ. Release of Glial Tissue-Specific Proteins after Acute Stroke: A Comparative Analysis of Serum Concentrations of Protein S-100B and Glial Fibrillary Acidic Protein. Stroke 2000; 31(11): 2670-77.
9- Surmeier DJ, Obeso JA, Halliday GM. Selective Neuronal Vulnerability in Parkinson Disease. Nat Rev Neurosci 2017; 18(2): 101-13.
10- Kam TI, Hinkle JT, Dawson TM, Dawson VL. Microglia and Astrocyte Dysfunction in Parkinson's Disease. Neurobiol Dis 2020; 144: 105028.
11- Pajares M, I Rojo A, Manda G, Boscá L, Cuadrado A. Inflammation in Parkinson's Disease: Mechanisms and Therapeutic Implications. Cells 2020; 9(7): 1687.
12- Shabab T, Khanabdali R, Moghadamtousi SZ, Kadir HA, Mohan G. Neuroinflammation Pathways: A General Review. Int J Neurosci 2017; 127(7): 624-33.
13- Tang Y, Le W. Differential Roles of M1 And M2 Microglia in Neurodegenerative Diseases. Mol Neurobiol 2016; 53(2): 1181-194.
14- Wang Q, Liu Y, Zhou J. Neuroinflammation in Parkinson's Disease and Its Potential as Therapeutic Target. Transl Neurodegener 2015; 4: 19.
15- Kortekaas R, Leenders KL, Van Oostrom JC, Vaalburg W, Bart J, Willemsen AT, et al. Blood-Brain Barrier Dysfunction in Parkinsonian Midbrain in Vivo. Ann Neurol 2005; 57(2): 176-9.
16- Ohlin KE, Sebastianutto I, Adkins CE, Lundblad C, Lockman PR, Cenci MA. Impact of L-DOPA Treatment on Regional Cerebral Blood Flow and Metabolism in the Basal Ganglia in a Rat Model of Parkinson's Disease. Neuroimage 2012; 61(1): 228-39.
17- Ferrari CC, Tarelli R. Parkinson's Disease and Systemic Inflammation. Parkinsons Dis 2011; 2011: 436813.
18- Kim W, Noh H, Lee Y, Jeon J, Shanmugavadivu A, McPhie DL, et al. Mir-126 Regulates Growth Factor Activities and Vulnerability to Toxic Insult in Neurons. Mol Neurobiol 2016; 53(1): 95-108.
19- Alcalay RN. Cytokines as Potential Biomarkers of Parkinson Disease. JAMA Neurol 2016; 73(11): 1282-84.
20- Shastri A, Bonifati DM, Kishore U. Innate Immunity and Neuroinflammation. Mediators Inflamm 2013; 2013: 342931.
21- Carta AR, Pisanu A, Carboni E. Do PPAR-Gamma Agonists Have a Future in Parkinson's Disease Therapy? Parkinsons Dis 2011; 2011: 689181.
22- Gerecke KM, Jiao Y, Pani A, Pagala V, Smeyne RJ. Exercise Protects Against MPTP-Induced Neurotoxicity in Mice. Brain Res 2010; 1341: 72-83.
23- Fisher BE, Li Q, Nacca A, Salem GJ, Song J, Yip J, et al. Treadmill Exercise Elevates Striatal Dopamine D2 Receptor Binding Potential in Patients with Early Parkinson's Disease. Neuroreport 2013; 24(10): 509-14.
24- Johansson ME, Cameron IGM, Van der Kolk NM, de Vries NM, Klimars E, Toni I, et al. Aerobic Exercise Alters Brain Function and Structure in Parkinson's Disease: A Randomized Controlled Trial. Ann Neurol 2022; 91(2): 203-16.
25- Kaagman DGM, van Wegen EEH, Cignetti N, Rothermel E, Vanbellingen T, Hirsch MA. Effects and Mechanisms of Exercise on Brain-Derived Neurotrophic Factor (BDNF) Levels and Clinical Outcomes in People with Parkinson's Disease: A Systematic Review and Meta-Analysis. Brain Sci 2024; 14(3): 194.
26- Rotondo R, Proietti S, Perluigi M, Padua E, Stocchi F, Fini M, et al. Physical Activity and Neurotrophic Factors as Potential Drivers of Neuroplasticity in Parkinson's Disease: A Systematic Review and Meta-Analysis. Ageing Res Rev 2023; 92: 102089.
27- Rezaee Z, Marandi M, Alaei H, Esfarjani F. The Effect of Exercise on Parkinson's Disease. Shefaye Khatam 2020; 9(1): 189-99. [Persian]
28- Shamsi Z, Taheri Kalani A, Nikseresht M, Bakhtiari Dehbalaei S, Shamsi L. Comparison the Effect of Continuous and Interval Aerobic Training on IL-1 and TNF-Α Expression in Cerebellum of Parkinson's Model Rats. Journal of Shahid Sadoughi University of Medical Sci 2025; 32(11): 8414-24. [Persian]
29- Rashidfard S, moghadasi M, Edalatmanesh MA, Hojati S. The Effect of High Intensity Interval Swimming on DJ-1 and Mir-874 Gene Expression of Hippocampal Cells in Rats with Parkinson’s Disease. J Appl Health Studies Sport Physiol 2024; 11(1): 251-60. [Persian]
30- Leem YH, Park JS, Park JE, Kim DY, Kim HS. Neurogenic Effects of Rotarod Walking Exercise in Subventricular Zone, Subgranular Zone, and Substantia Nigra in MPTP-Induced Parkinson’s Disease Mice. Sci Rep 2022; 12(1): 10544.
31- Soke F, Kocer B, Fidan I, Keskinoglu P, Guclu-Gunduz A. Effects of Task-Oriented Training Combined with Aerobic Training on Serum BDNF, GDNF, IGF-1, VEGF, TNF-Α, and IL-1β Levels in People with Parkinson's Disease: A Randomized Controlled Study. Exp Gerontol 2021; 150: 111384.
32- Szymura J, Kubica J, Wiecek M, Pera J. The Immunomodulary Effects of Systematic Exercise in Older Adults and People with Parkinson's Disease. J Clin Med 2020; 9(1): 184.
33- Nikokalam Nazif N, Khosravi M, Ahmadi R, Bananej M, Majd A. Effect of Treadmill Exercise on Catalepsy and the Expression of the BDNF Gene in 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine -Induced Parkinson in Male NMRI Mice. Iran J Basic Med Sci 2020; 23(4): 483-93.
34- Landers MR, Navalta JW, Murtishaw AS, Kinney JW, Pirio Richardson S. A High-Intensity Exercise Boot Camp for Persons with Parkinson Disease: A Phase II, Pragmatic, Randomized Clinical Trial of Feasibility, Safety, Signal of Efficacy, And Disease Mechanisms. J Neurol Phys Ther 2019; 43(1): 12-25.
35- Shahidani S, Rajaei Z, Alaei H. Pretreatment with Crocin Along with Treadmill Exercise Ameliorates Motor and Memory Deficits in Hemiparkinsonian Rats by Anti-Inflammatory and Antioxidant Mechanisms. Metab Brain Dis 2019; 34(2): 459-68.
36- Palasz E, Niewiadomski W, Gasiorowska A, Mietelska-Porowska A, Niewiadomska G. Neuroplasticity and Neuroprotective Effect of Treadmill Training in the Chronic Mouse Model of Parkinson's Disease. Neural Plast 2019; 2019: 8215017.
37- Jang Y, Koo JH, Kwon I, Kang EB, Um HS, Soya H, et al. Neuroprotective Effects of Endurance Exercise Against Neuroinflammation in MPTP-Induced Parkinson's Disease Mice. Brain Res 2017; 1655: 186-93.
38- Koo JH, Jang YC, Hwang DJ, Um HS, Lee NH, Jung JH, et al. Treadmill Exercise Produces Neuroprotective Effects in A Murine Model of Parkinson's Disease by Regulating the TLR2/Myd88/NF-Κb Signaling Pathway. Neuroscience 2017; 356: 102-13.
39- Tuon T, Souza PS, Santos MF, Pereira FT, Pedroso GS, Luciano TF, et al. Physical Training Regulates Mitochondrial Parameters and Neuroinflammatory Mechanisms in an Experimental Model of Parkinson's Disease. Oxid Med Cell Longev 2015; 2015: 261809.
40- Zoladz JA, Majerczak J, Zeligowska E, Mencel J, Jaskolski A, Jaskolska A, et al. Moderate-Intensity Interval Training Increases Serum Brain-Derived Neurotrophic Factor Level and Decreases Inflammation in Parkinson's Disease Patients. J Physiol Pharmacol 2014; 65(3): 441-48.
41- Wu SY, Wang TF, Yu L, Jen CJ, Chuang JI, Wu FS, et al. Running Exercise Protects the Substantia Nigra Dopaminergic Neurons Against Inflammation-Induced Degeneration Via the Activation of BDNF Signaling Pathway. Brain Behav Immun 2011; 25(1): 135-46.
42- de Almeida EJR, Ibrahim HJ, Chitolina Schetinger MR, de Andrade CM, Cardoso AM. Modulation of Inflammatory Mediators and Microglial Activation through Physical Exercise in Alzheimer's and Parkinson's Diseases. Neurochem Res 2022; 47(11): 3221-40.
43- Koo JH, Cho JY, Lee UB. Treadmill Exercise Alleviates Motor Deficits and Improves Mitochondrial Import Machinery in an MPTP-Induced Mouse Model of Parkinson's Disease. Exp Gerontol 2017; 89: 20-9.
44- Spielman LJ, Little JP, Klegeris A. Physical Activity and Exercise Attenuate Neuroinflammation in Neurological Diseases. Brain Res Bull 2016; 125: 19-29.
45- Tuon T, Valvassori SS, Lopes-Borges J, Luciano T, Trom CB, Silva LA, et al. Physical Training Exerts Neuroprotective Effects in The Regulation of Neurochemical Factors in an Animal Model of Parkinson's Disease. Neuroscience 2012; 227: 305-12.
46- Daniele SG, Béraud D, Davenport C, Cheng K, Yin H, Maguire-Zeiss KA. Activation of Myd88-Dependent TLR1/2 Signaling by Misfolded Α-Synuclein, A Protein Linked to Neurodegenerative Disorders. Sci Signal 2015; 8(376): ra45.
47- Dzamko N, Gysbers A, Perera G, Bahar A, Shankar A, Gao J, et al. Toll-Like Receptor 2 Is Increased in Neurons in Parkinson's Disease Brain and May Contribute to Alpha-Synuclein Pathology. Acta Neuropathol 2017; 133(2): 303-19.
48- Dimatelis JJ, Hendricks S, Hsieh J, Vlok NM, Bugarith K, Daniels WM, Russell VA. Exercise Partly Reverses the Effect of Maternal Separation on Hippocampal Proteins in 6-Hydroxydopamine-Lesioned Rat Brain. Exp Physiol 2013; 98(1): 233-44.
49- Singh SS, Rai SN, Birla H, Zahra W, Rathore AS, Singh SP. NF-Κb-Mediated Neuroinflammation in Parkinson's Disease and Potential Therapeutic Effect of Polyphenols. Neurotox Res 2020; 37(3): 491-507.
50- Chen Y, Zheng J, Su L, Chen F, Zhu R, Chen X, et al. Increased Salivary Micrornas that Regulate Dj-1 Gene Expression as Potential Markers for Parkinson’s Disease. Front Aging Neurosci 2020; 12: 210.
51- Zhao J, Li H, Chang N. Lncrna HOTAIR Promotes MPP+-Induced Neuronal Injury in Parkinson's Disease by Regulating the Mir-874-5p/ATG10 Axis. EXCLI J 2020; 19: 1141-53.
نوع مطالعه: مروری |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/12/15 | پذیرش: 1404/2/16 | انتشار: 1404/5/15
دریافت: 1403/12/15 | پذیرش: 1404/2/16 | انتشار: 1404/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







