دوره 33، شماره 3 - ( خرداد 1404 )
جلد 33 شماره 3 صفحات 8870-8860 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.PIAU.R.1400.010
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Salehi S S, Eizadi M, Sedaghaty S, Kazemzadeh Y, Mirzayan Shanjani S. Improvement of Fasting Glucose in Response to Resistance Training with Emphasis on the Expression of Hepatic PGC1α and HNF4α Genes in Type 2 Diabetic Rats. JSSU 2025; 33 (3) :8860-8870
URL: http://jssu.ssu.ac.ir/article-1-6354-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6354-fa.html
صالحی سیدصادق، ایزدی مجتبی، صداقتی سعید، کاظمزاده یاسر، میرزایان شانجانی ساناز. بهبود گلوکز ناشتا در پاسخ به تمرینات مقاومتی با تاکید بر بیان ژنهای PGC1α وHNF4α کبدی در رتهای دیابتی نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (3) :8860-8870
متن کامل [PDF 977 kb]
(231 دریافت)
| چکیده (HTML) (786 مشاهده)
References:
1- Zhang X, Yang S, Chen J, Su Z. Unraveling the Regulation of Hepatic Gluconeogenesis. Front Endocrinol (Lausanne) 2019; 9: 802.
2- Yoon JC, Pere Puigserver, Guoxun Chen, Jerry Donovan, Zhidan Wu, James Rhee, et al Control of Hepatic Gluconeogenesis through the Transcriptional Coactivator PGC-1α. Nature. 2001; 413(6852): 131-8.
3- Knudsen JG, Biensø RS, Hassing HA, Jakobsen AH, Pilegaard H. Exercise-Induced Regulation of Key Factors in Substrate Choice and Gluconeogenesis in Mouse Liver. Mol Cell Biochem 2015; 403(1-2): 209-17.
4- Shi SQ, Ansari TS, McGuinness OP, Wasserman DH, Johnson CH. Circadian Disruption Leads to Insulin Resistance and Obesity. Curr Biol 2013; 23(5): 372-81.
5- Sepa-Kishi DM, Katsnelson G, Bikopoulos G, Iqbal A, Ceddia RB. Cold Acclimation Reduces Hepatic Protein Kinase B and AMP-Activated Protein Kinase Phosphorylation and Increases Gluconeogenesis in Rats. Physiol Rep 2018; 6(5): e13592.
6- Besseiche A, Riveline JP, Gautier JF, Bréant B, Blondeau B. Metabolic Roles of PGC-1α and Its Implications for Type 2 Diabetes. Diabetes Metab 2015; 41(5): 347-57.
7- Herzig S, Long F, Jhala US, Hedrick S, Quinn R, Bauer A, et al. CREB Regulates Hepatic Gluconeogenesis through the Coactivator PGC-1. Nature 2001; 413(6852): 179-83.
8- Handschin C, Lin J, Rhee J, Peyer AK, Chin S, Wu PH, Meyer UA, Spiegelman BM. Nutritional Regulation of Hepatic Heme Biosynthesis and Porphyria through PGC-1alpha. Cell 2005; 122(4): 505-15.
9- Koo SH, Satoh H, Herzig S, Lee CH, Hedrick S, Kulkarni R, et al. PGC-1 Promotes Insulin Resistance in Liver Through PPAR-Alpha-Dependent Induction of TRB-3. Nat Med 2004; 10(5): 530-4.
10- Galicia-Garcia U, Benito-Vicente A, Jebari S, Larrea-Sebal A, Siddiqi H, Uribe KB, et al. Pathophysiology of Type 2 Diabetes Mellitus. Int J Mol Sci 2020; 21(17): 6275.
11- Yadegari E, Abdolali Banaeifar A, Azarbaijani MA, Arshadi A. The Effect of Aerobic Exercise on Gene Expression of Hepatocyte Nuclear Factor-4α (HNF-4α) and Insulin Resistance in Type 2 Diabetic Rats. Sport Physiology & Management Investigations 2018; 10(3): 73-84.
12- Ghahramani M, Banaei Far AA, Arshadi S, Sohaily SH. Effect of Aerobic Training on Expression of PGC1α & PECPK Genes of Hepatocytes of STZ Induced Diabetics Male Rats. Studies in Medical Sciences 2019; 30(10): 791-802. [Persian]
13- Yazdanpazhooh S, Banaeifar A, Arshadi S, Eizadi M. Six Weeks Resistance Training Effect on FTO Expression in Type II Diabetic Rats. IJDO 2018; 10(4): 216-22. [Persian]
14- Novelli E L, Diniz Y S, Galhardi C M, Ebaid G M, Rodrigues H G, Mani F, et al. Anthropometrical Parameters and Markers of Obesity in Rats. Lab Anim 2007; 41(1): 111-19.
15- Daryanoosh F, Tanideh N, Bazgir B, Alizadeh H. Effect of Aerobic Trainings on Heart’s Functioned and Structure in Diabetic Sprague-Dawely Albino Species Male Rats. Res Applied Exercise Physiology 2010; 6(12): 59-72.
16- Eizadi M, Ravasi AA, Soory R, Baesi K, Choobineh S. The Effect of Three Months of Resistance Training on TCF7L2 Expression in Pancreas Tissues of Type 2 Diabetic Rats. Avicenna J Med Biochem 2016; 4(1): 34014.
17- Maltais ML, Perreault K, Courchesne-Loyer A, Lagacé JC, Barsalani R, Dionne IJ. Effect of Resistance Training and Various Sources of Protein Supplementation on Body Fat Mass and Metabolic Profile in Sarcopenic Overweight Older Adult Men: A Pilot Study. Int J Sport Nutr Exerc Metab 2016; 26(1): 71-7.
18- Vancea DM, Vancea JN, Pires MI, Reis MA, Moura RB, Dib SA. Effect of Frequency of Physical Exercise on Glycemic Control and Body Composition in Type 2 Diabetic Patients. Arq Bras Cardiol 2009; 92(1): 23-30.
19- Ligtenberg PC, Hoekstra JB, Bol E, Zonderland ML, Erkelens DW. Effects of Physical Training on Metabolic Control in Elderly Type 2 Diabetes Mellitus Patients. Clin Sci (Lond) 1997; 93(2): 127-35.
20- Glans F, Eriksson KF, Segerström A, Thorsson O, Wollmer P, Groop L. Evaluation of the Effects of Exercise on Insulin Sensitivity in Arabian and Swedish Women with Type 2 Diabetes. Diabetes Res Clin Pract 2009; 85(1): 69-74.
21- Soori R, Rashidi M, Choobineh S, Ravasi AA, Baesi K, Rashidy-Pour A. Effects of 12 Weeks Resistant Training on MTNR1B Gene Expression in the Pancreas and Glucose and Insulin Levels in Type 2 Diabetic Rats. Koomesh 2017; 19(1): 46-55.
22- Lopes WA, Leite N, da Silva LR, Brunelli DT, Gáspari AF, Radominski RB, et al. Effects of 12 Weeks of Combined Training Without Caloric Restriction on Inflammatory Markers in Overweight Girls. J Sports Sci 2016; 34(20): 1902-12.
23- Steckling FM, Farinha JB, Santos DL, Bresciani G, Mortari JA, Stefanello ST, et al. High Intensity Interval Training Reduces the Levels of Serum Inflammatory Cytokine on Women with Metabolic Syndrome. Exp Clin Endocrinol Diabetes 2016; 124(10): 597-601.
24- Király MA, Bates HE, Yue JT, Goche-Montes D, Fediuc S, Park E, et al. Attenuation of Type 2 Diabetes Mellitus in the Male Zucker Diabetic Fatty Rat: The Effects of Stress and Non-Volitional Exercise. Metabolism 2007; 56(6): 732-44.
25- Kibenge MT, Chan CB. The Effects of High-Fat Diet on Exercise-Induced Changes in Metabolic Parameters in Zucker Fa/Fa Rats. Metabolism 2002; 51(6): 708-15.
26- Delghingaro-Augusto V, Décary S, Peyot ML, Latour MG, Lamontagne J, Paradis-Isler N, et al. Voluntary Running Exercise Prevents Β-Cell Failure in Susceptible Islets of the Zucker Diabetic Fatty Rat. Am J Physiol Endocrinol Metab 2012; 302(2): 254-64.
27- Boden G, Chen X, Stein TP. Gluconeogenesis in Moderately and Severely Hyperglycemic Patients with Type 2 Diabetes Mellitus. Am J Physiol Endocrinol Metab 2001; 280(1): 23-30.
28- Basu R, Barosa C, Jones J, Dube S, Carter R, Basu A, Rizza RA. Pathogenesis of Prediabetes: Role of the Liver in Isolated Fasting Hyperglycemia and Combined Fasting and Postprandial Hyperglycemia. J Clin Endocrinol Metab 2013; 98(3): 409-17.
29- Kalhan SC, Ghosh A. Dietary Iron, Circadian Clock, and Hepatic Gluconeogenesis. Diabetes 2015; 64(4): 1091-3.
30- Yadegari E, Banaeifar AA, Azarbayjani MA, Arshadi S. The Effects of High Intensity Interval Training on HNF-4 Α Gene Expression in Liver Tissue of Type 2 Diabetic Male Wistar Rats. Iranian J Diabetes & Obesity 2018; 10(4): 210-5.
متن کامل: (190 مشاهده)
مقدمه
دیابت نوع 2 به عنوان شایعترین اختلال متابولیکی یک بیماری چند علتی است که شدت آن در پاسخ به نقص ترشح انسولین، مقاومت انسولین یا افزایش رهایی گلوکز کبدی متاثر میشود (1،2). در طول گرسنگیهای کوتاهمدت، رهایی گلوکز کبدی عمدتاً بهواسطه تجزیه گلیکوژن به گلوکز طی فرایند گلوکوژنولیز کبدی تسریع میشود. از طرفی، بهدنبال گرسنگیهای طولانیمدت که با تخلیه ذخایر گلیکوژن کبدی همراه است بخش عمدهای از گلوکز خون توسط فرایند گلوکونئوژنز کبدی تامین میشود و گلوکونئوژنز به عنوان مهمترین فرایند موثر در حفظ گلوکز گردش خون ایفای نقش میکند (1). از طرفی، مشابه با گرسنگیهای طولانیمدت، فرآیند گلوکونئوژنز همچنین در حضور دیابت نوع 2 بویژه دیابتیهای چاق مختل میشود و افزایش فعالیت و بیان آنزیمهای گلوکونئوژنیکی عامل اصلی افزایش رهایی گلوکز کبدی در این بیماران است (2). از اینرو، شناخت مکانیسمهای مولکولی تنظیم گلوکونئوژنز کبدی از مهمترین کاندیداهای حفظ گلوکز خون بهویژه در درمان دیابت مورد توجه قرار گرفته است. گلوکونئوژنز توسط عوامل متعددی نظیر تغذیه، انرژی دریافتی، ورزش و استرس دستکاری میشود که توسط ترشح و فعالیت برخی مولکولها میانجی میشود (5-3). تنظیم گلوکونئوژنز در مراحل چندگانهای نظیر ترشح هورمون، رونویسی ژن و مکانیسمهای پس ترجمهای انجام میگیرد. در پاسخ به محرکهای خارجی، علیرغم اینکه پیامرسانی هورمونهای تنظیمکننده مسیرهای گلوکونئوژنیک نظیر انسولین، گلوکاگون و گلوکوکورتیکوئیدها متاثر میشوند همچنین رونویسی ژنی و بیان ژنهای دخیل در فرآیند گلوکونئوژنز که رهایی گلوکز کبدی را کنترل میکنند نیز متاثر میشوند. بهطوریکه فعالیت یا بیان آنزیمهایی نظیر phosphoenolpyruvate carboxykinase (PEPCK) نقش کلیدی را در فرآیند گلوکونئوژنز بازی میکند (1). از طرفی، میزان فعالیت و رونویسی پروموتور PEPCK نیازمند فعالشدن رسپتورهای گلوکوکورتیکوئیدی و رونویسیhepatocyte nuclear factor 4 a lpha (HNF-4α) توسط Peroxisome proliferator-activated receptor- γ coactivator (PGC-1α) است. این شواهد به نقش موثر PGC-1α و HNF-4α در تنظیم ژنهای گلوکونئوژنیک کبدی اشاره دارد (2). PGC-1α یکی از فاکتورهای رونویسی درگیر در متابولیسم انرژی است. PGC-1α که دارای فعالیت استیلترانسفرازی است یک کوفاکتور کلیدی HNF4α در فعالکردن برخی ژنهای گلوکونئوژنیکی نظیر PEPCK و glucose-6-phosphatase (G6Pase) است (2). بیان کبدی آن همچنین در شرایط گرسنگی در موشهای دیابتی به شدت افزایش مییابد (6). تحت شرایط گرسنگی افزایش PGC-1α همراه با برخی فاکتورهای رونویسی گلوکونئوژنیکی دیگر نظیر forkhead box O1 (FOXO1) و HNF4α به افزایش فعالیت و بیان ژنهای گلوکونئوژنیک نظیر PEPCK و G6Pase منجر میشود (7). مطالعات ژنتیکی آشکار نمودهاند که حذف PGC-1α کبدی به کاهش بیان ژنهایی کدینگ آنزیمهای گلوکونئوژنیک منجر میشود (8،9). با این وجود، در دیابتیهای نوع 1 و آن دسته از دیابتیهای نوع 2 که با کاهش ترشح انسولین بهواسطه تخریب سلولهای بتا روبهرو هستند کاهش ترشح انسولین یا کاهش سطوح انسولین سیستیمیک و بافتهای هدف نظیر کبد به افزایش بیان PGC1α و HNF4α و افزایش فعالیت و بیان آنزیم گلوکونئوژنیکی PEPCK منجر میشود و پیامد آن تسریع گلوکونئوژنز و افزایش رهایی گلوکز کبدی میباشد که عامل اصلی هر دو هیپرگلیسمی ناشتا و پس غذایی در این بیماران است (10،2). بر پایه این شواهد، انتظار میرود افزایش سطوح انسولین و کاهش فعالیت و بیان آنزیم گلوکونئوژنیکی PGC1α و HNF4α در هپاتوسیتهای این بیماران بهواسطه محرکهای بیرونی و درونی با مهار گلوکونئوژنز و کاهش رهایی گلوکز کبدی به جریان خون همراه باشد. در این میان، نقش فعالیت بدنی یا تمرینات ورزشی به تنهایی یا توام با مداخلههای دارویی و رژیم غذایی همراه مطرح بوده است. در این زمینه اگرچه مطالعات ورزشی با اهداف مذکور انجام نگرفته اما تاکنون مداخلات ورزشی که فاکتورهای رونویسی ژنتیکی یا واریانتهای آنها را به نفع کاهش سطوح گلوکز خون در دیابتیها یا سایر بیماریهای مرتبط با مقاومت انسولین یا هایپرگلیسمی تغییر دهد گزارش شده است. برای مثال، برخی مطالعات اثر تمرینات ورزشی بر بیان عوامل رونویسی نظیر PGC1α و HNF4α در موشهای آزمایشگاهی دیابتی یا غیر دیابتی را گزارش نمودهاند که در این بین یافتههای متناقض نیز به چشم میخورد. بهطوری که در برخی مطالعات، تمرینات هوازی 10 و 12 هفتهای با کاهش بیان این ژنهای گلوکونئوژنیکی در بافت کبد رتهای دیابتی نوع 2 همراه بودهاند (12،11) اما القای دیابت نوع 2 در مطالعات مذکور در پاسخ به تزریق نیکوتین آمید و STZ انجام گرفته است نه بهواسطه رژیم غذایی پرچرب و ایجاد مقاومت انسولین (HFD+STZ). با این وجود، مطالعهای که اثر تمرینات مقاومتی بر بیان این مولفهها در رتهای دیابتی نوع 2 چاق را اندازهگیری نمود قابل مشاهده نیست. بر پایه این مفروضات، مطالعه حاضر با هدف تعیین اثر تمرینات مقاومتی بر بیان ژنهای گلوکونئوژنیکی مذکور (PGC1α و HNF4α) و سطوح گلوکز در پاسخ به تمرین مقاومتی در رتهایی دیابتی نوع 2 چاق شده توسط رژیم غذایی پر چرب و STZ انجام گرفت.
روش بررسی
نوع مطالعه و جامعه آماری: جامعه آماری مطالعه تجربی حاضر (IR.IAU.PIAU.R.1400.010) را رتهای نر ویستار حیوانخانه دانشگاه علوم پزشکی بقیهالله تشکیل می-دهند. از بین آنها 21 سر رت نر ویستار 10 هفتهای با وزن 10±220 گرم خریداری و در ادامه توسط 6 هفته رژیم غذایی پرچرب چاق شدند (13). شاخص توده بدنی بالاتر از 68 درصد گرم بر سانتیمتر مربع به عنوان معیار تشخیص چاقی در نظر گرفته شد (14). بین آنها، 7 رت بهعنوان گروه غیر دیابتی در نظر گرفته شد و 14 سر توسط تزریق درون صفاقی استرپتوزوتوسین (STZ) دیابتی نوع 2 (6 هفته رژیم غذایی پرچرب+تزریق STZ) شدند. نهایتاً رتهای مورد مطالعه به گروههای 7 تایی: 1) غیر دیابتی، 2) دیابتی کنترل، 3) دیابتی مقاومتی تفسیم شدند.
شیوه القای دیابت نوع 2: برای القای دیابت نوع 2، از ابتدای هفته یازدهم به مدت 6 هفته از رژیم غذایی پرچرب استفاده شده سپس تزریق محلول تازه تهیه شده STZ در بافر سیترات با 4/5=PH نیز بهصورت داخل صفاقی با دوز 25 میلیگرم بر کیلوگرم انجام گرفت (15). جهت تهیه غذای پرچرب، به غذای استاندارد رتهای صحرایی که از شرکت خوراک پارسدام خریداری گردید 1% پودر کلسترول و 1% روغن ذرت 100% خالص اضافه شد (13). یک هفته پس از القای دیابت، گلوکز خون ناشتا اندازهگیری و قند خون بین 150 تا 400 میلیگرم بر دسیلیتر بهعنوان معیاری برای اطمینان از ابتلای موشها به دیابت نوع 2 در نظر گرفته شد (16).
نگهداری رتها: کلیه رتها در اطاقی به ابعاد 1/60 در 2/20 متر در شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 عصر و شروع خاموشی 6 صبح)، دما (3±22 سانتیگراد)، و رطوبت (50-30 درصد) نگهداری شدند. تعداد سه تا پنج عدد موش در قفسهایی از جنس پلکسی گلاس با درب توری و به ابعاد 25 در 27 در 43 سانتی متر به گونهای نگهداری شدند که آزادانه به آب و غذای استاندارد پرچرب دسترسی داشته باشند (16).
پروتکل تمرین مقاومتی: برنامه تمرینات مقاومتی در رتهای گروه دیابتی مقاومتی از هفته شانزدهم شروع و برای مدت 6 هفته ادامه یافت. بهطوری که الگوی توزیع شدت تمرین با افزایش تدریجی اعمال مقاومت به صورت بستن وزنه به دم رتها معادل درصدهای متفاوتی از وزن بدن بود که به تعداد 5 جلسه در هفته در قالب 5 ست با 4 تکرار در هر دوره اجرا شد (جدول 1) فواصل استراحتی بین ستها 3 دقیقه و فواصل استراحتی بین تکرارها در هر دوره 45 ثانیه بود (13).
نمونهگیری خون و آنالیز بیان ژن: 48 ساعت پس از آخرین جلسه تمرینی، رت های مورد مطالعه پس از یک ناشتایی شبانه (10 تا 12 ساعت) تشریح شدند. جهت بیهوش کردن رتها، از تزریق داخل صفاقی مخلوط کتامین 10% و زایلازین 2% استفاده شد. سپس با شکافتن قفسه سینه حیوان، نمونه خون بهطور مستقیم از قلب حیوان با هدف اندازهگیری گلوکز ناشتا و انسولین سرم گرفته شد. غلظت گلوکز به روش آنزیمی رنگسنجی با فنآوری گلوکزاکسیداز و با استفاده از کیت گلوکز شرکت پارسآزمون-تهران اندازهگیری شد. ضریب تغییرات درون آزمون و برون آزمون گلوکز به ترتیب 1/74 و 1/19 درصد و حساسیت اندازهگیری 5 میلیگرم بر دسیلیتر بود. انسولین سرم به روش الایزا و مطابق با استانداردهای کیت تجاری (Demeditec Diagnostic insulin ELIZA) ساخت کشور آلمان اندازهگیری شد. ضریب تغییرات درونآزمون و برونآزمون انسولین به ترتیب 2/6 و 2/88 درصد و حساسیت اندازهگیری 1/76 بود. همچنین بافت کبد استخراج شده و بلافاصله پس از شستشو در سرم فیزیولوژیک در میکروتیوبهای 1/8 میلیلیتری در ازت غوطه ور شده و جهت آنالیز بیان ژن به انستیتو پاستور تهران منتقل شدند. استخراج RNA توسط کیت تجاری RNeasy mini kit شرکت QIAGEN انجام گرفت. تعیین gene mRNA توسط RT-Real time PCR توسط سیستم روتروژن 6000 با استفاده از کیت تک مرحلهای تاکارا (One Step SYBR TAKARA) مطابق با دستورالعمل کیت انجام گرفت. جهت مطالعه ویژگی پرایمرها از دماهای 50 تا 99 درجه سانتیگراد برای تهیه منحنی ذوب استفاده گردید. الگوی توالی پرایمرها در جدول 2 گزارش شده است. از RNA Polymrase II به عنوان ژن کنترل استفاده گردید.
تجزیه وتحلیل آماری
به منظور بررسی توزیع طبیعی دادهها در بین گروهها از آزمون کولموگروف -اسمیرنوف استفاده شد. همچنین برای مقایسه میانگینها از روش آماری یکسویه و تست تعقیبی Tukey در سطح معنیداری P<0.05 استفاده گردید. آنالیز آماری در محیط نرمافزارversion 16 SPSS انجام گرفت.
نتایج
الگوی تغییرات وزن بدن در شرایط قبل و بعد از مداخله ورزشی در گروههای مورد مطالعه در جدول 3 ارائه شدهاند. بر پایه نتایج آزمون آنوای یکسویه، علیرغم عدم اختلاف معنیدار وزن بدن بین گروه¬های مورد مطالعه در شرایط قبل از مداخله (0/831 = P)، پس از مطالعه اختلاف معنیداری بین گروهها مشاهده شد (0/001=P). بهطوری که بر پایه آزمون تعقیبی Tukey، وزن رتهای گروه دیابتی مقاومتی به میزان معنیداری بالاتر از گروه غیر دیابتی (0/042=P) و دیابتی کنترل (0/001=P) بود. الگوی تغییرات درونگروهی همچنین در جدول 3 خلاصه شده است.
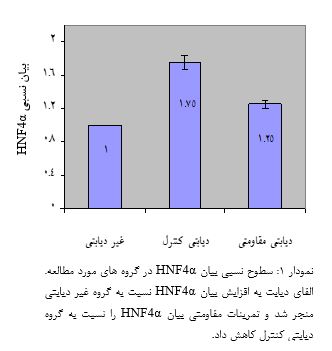
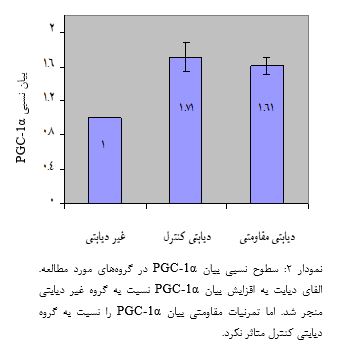
نتایج آزمون آنوای یک¬طرفه همچنین بیانگر اختلاف معنیدار سطوح گلوکز ناشتا، انسولین سرم و مقاومت انسولین بین گروههای مورد مطالعه است (0/001= P). از طرفی، بر پایه یافتههای آزمون تعقیبی Tukey، القای دیابت نوع 2 به افزایش معنیدار سطوح گلوکز ناشتا و مقاومت انسولین همچنین کاهش معنیدار انسولین سرم در گروه دیابتی کنترل نسبت به گروه غیر دیابتی منجر شد (0/001= P) و تمرینات مقاومتی به کاهش معنیدار گلوکز (0/001=P) و مقاومت انسولین (0/001=P) و افزایش معنیدار انسولین سرم (0/043= P) در گروه دیابتی مقاومتی نسبت به دیابتی کنترل منجر شد. نتایج آزمون آنوای یکطرفه همچنین بیانگر اختلاف معنیداری در بیان هر دو HNF4α و PGC-1α کبدی بین گروههاست (0/001=P، جدول 5). از طرفی، بر پایه یافتههای آزمون تعقیبی Tukey، القای دیابت نوع 2 به افزایش بیان HNF4α در گروه دیابتی کنترل نسبت به گروه غیردیابتی منجر شد (0/001=P). اما تمرین مقاومتی بیان HNF4α را در گروه دیابتی مقاومتی به میزان معنیداری نسبت به دیابتی کنترل کاهش داد (0/001=P، نمودار 1). با این وجود، علیرغم اینکه القای دیابت نوع 2 به افزایش بیان PGC-1α در گروه دیابتی کنترل نسبت به گروه غیردیابتی منجر شد (0/001=P) اما تمرین مقاومتی به تغییر معنیداری در بیان PGC-1α در گروه دیابتی مقاومتی نسبت به گروه دیابتی کنترل منجر نشد (0/353=P، نمودار 2).
جدول 1: الگوی توزیع شدت تمرین مقاومتی بر پایه اعمال وزنه بر حسب درصد وزن بدن در طول دوره تمرینی
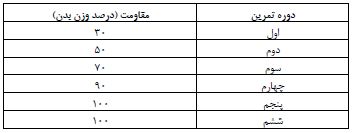
جدول 2: توالی پرایمرهای مورد استفاده در پژوهش
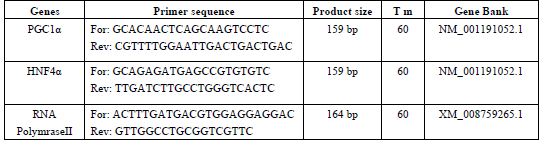
جدول 3: وزن بدن در شرایط قبل و بعد از مداخله تمرینی در گروههای مورد مطالعه (انحراف امعیار±میانگین)
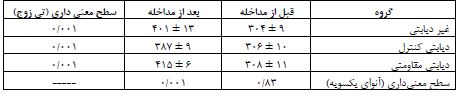
جدول 4: سطوح گلوکز ناشتا، انسولین سرم و مقاومت انسولین در گروههای مورد مطالعه (انحراف معیار±میانگین)
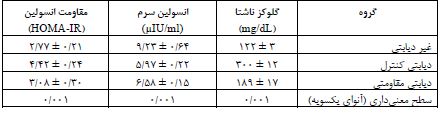
جدول 5: تغییرات بیان HNF4α و PGC-1α کبدی در پاسخ به القای دیابت و مداخله تمرینی نسبت به گروه چاق کنترل (انحرافمعیار±میانگین)

بحث
کاهش بیان HNF4α در پاسخ به تمرینات مقاومتی در رتهای دیابتی از یافتههای اصلی مطالعه حاضر است. به عبارتی، القای دیابت نوع 2 به موشهای چاق سالم به افزایش بیان HNF4α در هپاتوسیتهای کبدی منجر میشود و تمرینات مقاومتی 6 هفتهای به تعداد 5 جلسه در هفته توسط رتهای دیابتی شده به کاهش معنیدار بیان آن نسبت به گروه دیابتی کنترل که در دوره تمرینی شرکت نداشتهاند منجر میشود. این در حالی است که اگرچه القای دیابت نوع 2 به افزایش بیان PGC-1α در سلولهای کبدی منجر شد اما بیان آن در پاسخ به تمرینات مقاومتی نسبت به گروه کنترل دستخوش معنیداری نشد. جدا از تغییرات ژنتیکی، تمرینات مقاومتی همچنین به کاهش گلوکز ناشتا و افزایش انسولین سرم در گروه دیابتی مقاومتی نسبت به گروه دیابتی کنترل منجر شد. این در حالی است که مالتایس و همکاران در سال 2016 اشاره نمودهاند که علیرغم کاهش توده چربی بدن اما 4 ماه تمرین مقاومتی به تغییری در سطوح گلوکز در مردان سالمند دارای اضافهوزن منجر نشد (17). در مطالعه دیگری نیز عدم تغییر هموگلوبین گلیکوزیله متعاقب 20 هفته تمرین ورزشی گزارش شد (18). عدم تغییر گلوکز ناشتا همچنین به دنبال 6 هفته تمرین هوازی با شدت 60 تا 80 درصد VO2max گزارش شده است (19). با این وجود، در تایید یافتههای ما، گلانز و همکاران در سال 2009 بهبود گلوکز ناشتا در دیابتیهای نوع 2 را متعاقب 6 ماه تمرین مقاومتی و هوازی گزارش نمودهاند (20). سوری همکاران در سال 2017 نیز کاهش معنیدار گلوکز متعاقب 12 هفته تمرین مقاومتی در رتهای دیابتی نوع 2 را گزارش شد (21). جدا از پاسخهای ژنتیکی، برخی محققان بهبود گلوکز در بیماران دیابتی در پاسخ به تمرینات ورزشی را به کاهش مقاومت انسولین نسبت دادهاند. در این راستا، یافتههای آماری آشکار نمود که اجرای تمرینات مقاومتی به کاهش معنیدار مقاومت انسولین در رتهای دیابتی نسبت به گروه دیابتی کنترل که در برنامه تمرینی شرکت نداشتهاند منجر میشود. در این راستا، لوپز و همکاران در سال 2016 کاهش معنیدار مقاومت انسولین را متعاقب 12 هفته تمرین ترکیبی در دختران دارای اضافهوزن گزارش نمودهاند (22). استگلینگ و همکاران در سال 2016 نیز بهبود گلوکز و HbA1C متعاقب 12 هفته تمرینات اینتروال شدید (High intensity interval training: HIIT) به تعداد 3 جلسه در هفته با شدت 70 تا 90 درصد ضربان قلب بیشینه را به بهبود عملکرد انسولین نسبت دادهاند (23). کاهش گلوکز ناشتا در رتهای تمرین دیده در مطالعه حاضر را شاید هم بتوان به افزایش انسولین در پاسخ به تمرینات مقاومتی نسبت داد. چراکه مطالعات آزمایشگاهی روی موشهای دیابتی نشان دادهاند که آنها از توده سلولهای بتای کمتری نسبت به موشهای سالم برخوردارند (24). با این وجود، میزان رهایی انسولین از سلولهای پانکراس در موشهای دیابتی ورزیده به مراتب بیشتر از موشهای دیابتی کمتحرک و غیرفعال میباشد (25). بهطوری که ذخایر انسولین جزایر در موشهای تمرین کرده به مراتب بیشتر از موشهای کمتحرک است (26). در این راستا، ایزدی و همکاران در سال 2016، کاهش گلوکز ناشتا متعاقب تمرینات مقاومتی در رتهای دیابتی نوع 2 را به افزایش ترشح انسولین از سلولهای بتای پانکراس در پاسخ به این شیوه تمرینی نسبت دادهاند (16). جدا از فرآیندهای مذکور، برخی مطالعات نیز اثر مداخلههای تمرینی بر سطوح پروتئین یا بیان عوامل رونویسی موثر در تولید و رهایی گلوکز کبدی را ارزیابی نمودهاند. بهطوری که افزایش تولید گلوکز از مسیرهای غیرکربوهیدارات در فرایند گلوکونئوژنز کبدی همچنین تسریع در فرآیند گلیکولیز نهایتا به افزایش رهایی گلوکز کبدی بهویژه در بیماران دیابتی منتهی میشود (28،27). در این زمینه، یافتههای مطالعه حاضر آشکار نمود که بیان HNF4α کبدی در پاسخ به تمرینات مقاومتی کاهش مییابد. با این وجود، بیان PGC-1α اگرچه میل به کاهش داشت اما این کاهش به لحاظ آماری غیر معنیدار بود. این در حالی است که PGC-1a به عنوان یک فعالکننده رونویسی، در تعدادی از فرآیندهای بیولوژیکی نظیر مسیر گلوکونئوژنز کبدی نقش دارد بهطوری که بواسطه تاثیر بر بیان PEPCK، فروکتوز-1،6 بیس فسفاتاز و G6Pase از طریق عوامل رونویسی واسطهای نظیر HNF-4α و FOKO1 به تسریع سرعت گلوکونئوژنز کبدی منجر میشود (29). ورزش بهواسطه فسفوریلاسیون Akt، باعث کاهش HNF-4α و متعاقباً کاهش PEPCK کبدی میشود که نقش مهمی در سرکوب گلوکونئوژنز کبدی ایفا میکند. در این زمینه اگرچه کمتر مطالعهای اثر تمرینات مقاومتی بر بیان HNF-4α در رتهای دیابتی را دنبال نموده است اما همراستا با مطالعه حاضر، یادگاری و همکارانش در سال 1397 کاهش بیان ژن HNF-4α کبدی توام با کاهش گلوکز و افزایش انسولین سرم متعاقب 12 هفته تمرین هوازی را گزارش نمودهاند (11). کاهش بیان ژن HNF-4α کبدی توام با کاهش گلوکز و افزایش انسولین سرم متعاقب تمرینات تناوبی همچنین توسط این محققان گزارش شده است (30). در این زمینه، اشاره شده است که PGC-1α از طریق HNF-4α و FOKO1 رونویسی آنزیمهای گلوکونئوژنزی نظیر PEPCK و G6Pase را کنترل کند (29). بر پایه این شواهد، اینگونه نتیجهگیری میشود که کاهش بیان HNF-4α وابسته به تمرینات مقاومتی بهواسطه مهار ژنهای گلوکونئوژنیکی کاهش رهایی گلوکز کبدی وابسته به گلوکونئوژنز در رتهای دیابتی نوع 2 را بهدنبال دارد.
نتیجهگیری
اجرای تمرینات مقاومتی با بهبود گلوکز ناشتا در رتهای دیابتی نوع 2 همراه است. بر پایه شواهد موجود، بهبود گلوکز را شاید بتوان به کاهش بیان HNF4α کبدی در پاسخ به این شیوه تمرینی نسبت داد. چراکه مطالعات ژنتیکی به نقش مهارکنندگی کاهش بیان HNF4α بر ژنهای گلوکونئوژنیکی کبدی و بهدنبال آن کاهش سرعت گلوکونئوژنز کبدی تاکید دارند. از طرفی، کاهش مقاومت انسولین کل بدن در پاسخ به تمرینات مقاومتی نیز به نوعی کاهش گلوکز را بهدنبال دارد. علیرغم شواهد مذکور، شناخت مکانیسمهای اصلی عهده دار تغییر در مسیرهای سیگنالیگ گلوکونئوژنز کبدی در پاسخ به تمرینات ورزشی نیازمند مطالعات بیشتر است.
سپاسگزاری
این مقاله مستخرج از رساله دکتری گروه فیزیولوژی ورزشی دانشگاه آزاد اسلامی اسلامشهر است. نویسندگان مقاله از آزمایشگاه ژنتیک انستیتو پاستور در آنالیز بیان ژن تقدیر و تشکر مینمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد پرند تایید شده است (کد اخلاق: IR.IAU.PIAU.R.1400.010)
مشارکت نویسندگان
مجتبی ایزدی در ارائه ایده، مجتبی ایزدی، سعید صداقتی، حسین شیروانی، سیدصادق صالحی در طراحی مطالعه، سید صادق صالحی در جمعآوری دادهها، .یاسر کاظم زاده و ساناز میرزایان شانجانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
دیابت نوع 2 به عنوان شایعترین اختلال متابولیکی یک بیماری چند علتی است که شدت آن در پاسخ به نقص ترشح انسولین، مقاومت انسولین یا افزایش رهایی گلوکز کبدی متاثر میشود (1،2). در طول گرسنگیهای کوتاهمدت، رهایی گلوکز کبدی عمدتاً بهواسطه تجزیه گلیکوژن به گلوکز طی فرایند گلوکوژنولیز کبدی تسریع میشود. از طرفی، بهدنبال گرسنگیهای طولانیمدت که با تخلیه ذخایر گلیکوژن کبدی همراه است بخش عمدهای از گلوکز خون توسط فرایند گلوکونئوژنز کبدی تامین میشود و گلوکونئوژنز به عنوان مهمترین فرایند موثر در حفظ گلوکز گردش خون ایفای نقش میکند (1). از طرفی، مشابه با گرسنگیهای طولانیمدت، فرآیند گلوکونئوژنز همچنین در حضور دیابت نوع 2 بویژه دیابتیهای چاق مختل میشود و افزایش فعالیت و بیان آنزیمهای گلوکونئوژنیکی عامل اصلی افزایش رهایی گلوکز کبدی در این بیماران است (2). از اینرو، شناخت مکانیسمهای مولکولی تنظیم گلوکونئوژنز کبدی از مهمترین کاندیداهای حفظ گلوکز خون بهویژه در درمان دیابت مورد توجه قرار گرفته است. گلوکونئوژنز توسط عوامل متعددی نظیر تغذیه، انرژی دریافتی، ورزش و استرس دستکاری میشود که توسط ترشح و فعالیت برخی مولکولها میانجی میشود (5-3). تنظیم گلوکونئوژنز در مراحل چندگانهای نظیر ترشح هورمون، رونویسی ژن و مکانیسمهای پس ترجمهای انجام میگیرد. در پاسخ به محرکهای خارجی، علیرغم اینکه پیامرسانی هورمونهای تنظیمکننده مسیرهای گلوکونئوژنیک نظیر انسولین، گلوکاگون و گلوکوکورتیکوئیدها متاثر میشوند همچنین رونویسی ژنی و بیان ژنهای دخیل در فرآیند گلوکونئوژنز که رهایی گلوکز کبدی را کنترل میکنند نیز متاثر میشوند. بهطوریکه فعالیت یا بیان آنزیمهایی نظیر phosphoenolpyruvate carboxykinase (PEPCK) نقش کلیدی را در فرآیند گلوکونئوژنز بازی میکند (1). از طرفی، میزان فعالیت و رونویسی پروموتور PEPCK نیازمند فعالشدن رسپتورهای گلوکوکورتیکوئیدی و رونویسیhepatocyte nuclear factor 4 a lpha (HNF-4α) توسط Peroxisome proliferator-activated receptor- γ coactivator (PGC-1α) است. این شواهد به نقش موثر PGC-1α و HNF-4α در تنظیم ژنهای گلوکونئوژنیک کبدی اشاره دارد (2). PGC-1α یکی از فاکتورهای رونویسی درگیر در متابولیسم انرژی است. PGC-1α که دارای فعالیت استیلترانسفرازی است یک کوفاکتور کلیدی HNF4α در فعالکردن برخی ژنهای گلوکونئوژنیکی نظیر PEPCK و glucose-6-phosphatase (G6Pase) است (2). بیان کبدی آن همچنین در شرایط گرسنگی در موشهای دیابتی به شدت افزایش مییابد (6). تحت شرایط گرسنگی افزایش PGC-1α همراه با برخی فاکتورهای رونویسی گلوکونئوژنیکی دیگر نظیر forkhead box O1 (FOXO1) و HNF4α به افزایش فعالیت و بیان ژنهای گلوکونئوژنیک نظیر PEPCK و G6Pase منجر میشود (7). مطالعات ژنتیکی آشکار نمودهاند که حذف PGC-1α کبدی به کاهش بیان ژنهایی کدینگ آنزیمهای گلوکونئوژنیک منجر میشود (8،9). با این وجود، در دیابتیهای نوع 1 و آن دسته از دیابتیهای نوع 2 که با کاهش ترشح انسولین بهواسطه تخریب سلولهای بتا روبهرو هستند کاهش ترشح انسولین یا کاهش سطوح انسولین سیستیمیک و بافتهای هدف نظیر کبد به افزایش بیان PGC1α و HNF4α و افزایش فعالیت و بیان آنزیم گلوکونئوژنیکی PEPCK منجر میشود و پیامد آن تسریع گلوکونئوژنز و افزایش رهایی گلوکز کبدی میباشد که عامل اصلی هر دو هیپرگلیسمی ناشتا و پس غذایی در این بیماران است (10،2). بر پایه این شواهد، انتظار میرود افزایش سطوح انسولین و کاهش فعالیت و بیان آنزیم گلوکونئوژنیکی PGC1α و HNF4α در هپاتوسیتهای این بیماران بهواسطه محرکهای بیرونی و درونی با مهار گلوکونئوژنز و کاهش رهایی گلوکز کبدی به جریان خون همراه باشد. در این میان، نقش فعالیت بدنی یا تمرینات ورزشی به تنهایی یا توام با مداخلههای دارویی و رژیم غذایی همراه مطرح بوده است. در این زمینه اگرچه مطالعات ورزشی با اهداف مذکور انجام نگرفته اما تاکنون مداخلات ورزشی که فاکتورهای رونویسی ژنتیکی یا واریانتهای آنها را به نفع کاهش سطوح گلوکز خون در دیابتیها یا سایر بیماریهای مرتبط با مقاومت انسولین یا هایپرگلیسمی تغییر دهد گزارش شده است. برای مثال، برخی مطالعات اثر تمرینات ورزشی بر بیان عوامل رونویسی نظیر PGC1α و HNF4α در موشهای آزمایشگاهی دیابتی یا غیر دیابتی را گزارش نمودهاند که در این بین یافتههای متناقض نیز به چشم میخورد. بهطوری که در برخی مطالعات، تمرینات هوازی 10 و 12 هفتهای با کاهش بیان این ژنهای گلوکونئوژنیکی در بافت کبد رتهای دیابتی نوع 2 همراه بودهاند (12،11) اما القای دیابت نوع 2 در مطالعات مذکور در پاسخ به تزریق نیکوتین آمید و STZ انجام گرفته است نه بهواسطه رژیم غذایی پرچرب و ایجاد مقاومت انسولین (HFD+STZ). با این وجود، مطالعهای که اثر تمرینات مقاومتی بر بیان این مولفهها در رتهای دیابتی نوع 2 چاق را اندازهگیری نمود قابل مشاهده نیست. بر پایه این مفروضات، مطالعه حاضر با هدف تعیین اثر تمرینات مقاومتی بر بیان ژنهای گلوکونئوژنیکی مذکور (PGC1α و HNF4α) و سطوح گلوکز در پاسخ به تمرین مقاومتی در رتهایی دیابتی نوع 2 چاق شده توسط رژیم غذایی پر چرب و STZ انجام گرفت.
روش بررسی
نوع مطالعه و جامعه آماری: جامعه آماری مطالعه تجربی حاضر (IR.IAU.PIAU.R.1400.010) را رتهای نر ویستار حیوانخانه دانشگاه علوم پزشکی بقیهالله تشکیل می-دهند. از بین آنها 21 سر رت نر ویستار 10 هفتهای با وزن 10±220 گرم خریداری و در ادامه توسط 6 هفته رژیم غذایی پرچرب چاق شدند (13). شاخص توده بدنی بالاتر از 68 درصد گرم بر سانتیمتر مربع به عنوان معیار تشخیص چاقی در نظر گرفته شد (14). بین آنها، 7 رت بهعنوان گروه غیر دیابتی در نظر گرفته شد و 14 سر توسط تزریق درون صفاقی استرپتوزوتوسین (STZ) دیابتی نوع 2 (6 هفته رژیم غذایی پرچرب+تزریق STZ) شدند. نهایتاً رتهای مورد مطالعه به گروههای 7 تایی: 1) غیر دیابتی، 2) دیابتی کنترل، 3) دیابتی مقاومتی تفسیم شدند.
شیوه القای دیابت نوع 2: برای القای دیابت نوع 2، از ابتدای هفته یازدهم به مدت 6 هفته از رژیم غذایی پرچرب استفاده شده سپس تزریق محلول تازه تهیه شده STZ در بافر سیترات با 4/5=PH نیز بهصورت داخل صفاقی با دوز 25 میلیگرم بر کیلوگرم انجام گرفت (15). جهت تهیه غذای پرچرب، به غذای استاندارد رتهای صحرایی که از شرکت خوراک پارسدام خریداری گردید 1% پودر کلسترول و 1% روغن ذرت 100% خالص اضافه شد (13). یک هفته پس از القای دیابت، گلوکز خون ناشتا اندازهگیری و قند خون بین 150 تا 400 میلیگرم بر دسیلیتر بهعنوان معیاری برای اطمینان از ابتلای موشها به دیابت نوع 2 در نظر گرفته شد (16).
نگهداری رتها: کلیه رتها در اطاقی به ابعاد 1/60 در 2/20 متر در شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 عصر و شروع خاموشی 6 صبح)، دما (3±22 سانتیگراد)، و رطوبت (50-30 درصد) نگهداری شدند. تعداد سه تا پنج عدد موش در قفسهایی از جنس پلکسی گلاس با درب توری و به ابعاد 25 در 27 در 43 سانتی متر به گونهای نگهداری شدند که آزادانه به آب و غذای استاندارد پرچرب دسترسی داشته باشند (16).
پروتکل تمرین مقاومتی: برنامه تمرینات مقاومتی در رتهای گروه دیابتی مقاومتی از هفته شانزدهم شروع و برای مدت 6 هفته ادامه یافت. بهطوری که الگوی توزیع شدت تمرین با افزایش تدریجی اعمال مقاومت به صورت بستن وزنه به دم رتها معادل درصدهای متفاوتی از وزن بدن بود که به تعداد 5 جلسه در هفته در قالب 5 ست با 4 تکرار در هر دوره اجرا شد (جدول 1) فواصل استراحتی بین ستها 3 دقیقه و فواصل استراحتی بین تکرارها در هر دوره 45 ثانیه بود (13).
نمونهگیری خون و آنالیز بیان ژن: 48 ساعت پس از آخرین جلسه تمرینی، رت های مورد مطالعه پس از یک ناشتایی شبانه (10 تا 12 ساعت) تشریح شدند. جهت بیهوش کردن رتها، از تزریق داخل صفاقی مخلوط کتامین 10% و زایلازین 2% استفاده شد. سپس با شکافتن قفسه سینه حیوان، نمونه خون بهطور مستقیم از قلب حیوان با هدف اندازهگیری گلوکز ناشتا و انسولین سرم گرفته شد. غلظت گلوکز به روش آنزیمی رنگسنجی با فنآوری گلوکزاکسیداز و با استفاده از کیت گلوکز شرکت پارسآزمون-تهران اندازهگیری شد. ضریب تغییرات درون آزمون و برون آزمون گلوکز به ترتیب 1/74 و 1/19 درصد و حساسیت اندازهگیری 5 میلیگرم بر دسیلیتر بود. انسولین سرم به روش الایزا و مطابق با استانداردهای کیت تجاری (Demeditec Diagnostic insulin ELIZA) ساخت کشور آلمان اندازهگیری شد. ضریب تغییرات درونآزمون و برونآزمون انسولین به ترتیب 2/6 و 2/88 درصد و حساسیت اندازهگیری 1/76 بود. همچنین بافت کبد استخراج شده و بلافاصله پس از شستشو در سرم فیزیولوژیک در میکروتیوبهای 1/8 میلیلیتری در ازت غوطه ور شده و جهت آنالیز بیان ژن به انستیتو پاستور تهران منتقل شدند. استخراج RNA توسط کیت تجاری RNeasy mini kit شرکت QIAGEN انجام گرفت. تعیین gene mRNA توسط RT-Real time PCR توسط سیستم روتروژن 6000 با استفاده از کیت تک مرحلهای تاکارا (One Step SYBR TAKARA) مطابق با دستورالعمل کیت انجام گرفت. جهت مطالعه ویژگی پرایمرها از دماهای 50 تا 99 درجه سانتیگراد برای تهیه منحنی ذوب استفاده گردید. الگوی توالی پرایمرها در جدول 2 گزارش شده است. از RNA Polymrase II به عنوان ژن کنترل استفاده گردید.
تجزیه وتحلیل آماری
به منظور بررسی توزیع طبیعی دادهها در بین گروهها از آزمون کولموگروف -اسمیرنوف استفاده شد. همچنین برای مقایسه میانگینها از روش آماری یکسویه و تست تعقیبی Tukey در سطح معنیداری P<0.05 استفاده گردید. آنالیز آماری در محیط نرمافزارversion 16 SPSS انجام گرفت.
نتایج
الگوی تغییرات وزن بدن در شرایط قبل و بعد از مداخله ورزشی در گروههای مورد مطالعه در جدول 3 ارائه شدهاند. بر پایه نتایج آزمون آنوای یکسویه، علیرغم عدم اختلاف معنیدار وزن بدن بین گروه¬های مورد مطالعه در شرایط قبل از مداخله (0/831 = P)، پس از مطالعه اختلاف معنیداری بین گروهها مشاهده شد (0/001=P). بهطوری که بر پایه آزمون تعقیبی Tukey، وزن رتهای گروه دیابتی مقاومتی به میزان معنیداری بالاتر از گروه غیر دیابتی (0/042=P) و دیابتی کنترل (0/001=P) بود. الگوی تغییرات درونگروهی همچنین در جدول 3 خلاصه شده است.
نتایج آزمون آنوای یک¬طرفه همچنین بیانگر اختلاف معنیدار سطوح گلوکز ناشتا، انسولین سرم و مقاومت انسولین بین گروههای مورد مطالعه است (0/001= P). از طرفی، بر پایه یافتههای آزمون تعقیبی Tukey، القای دیابت نوع 2 به افزایش معنیدار سطوح گلوکز ناشتا و مقاومت انسولین همچنین کاهش معنیدار انسولین سرم در گروه دیابتی کنترل نسبت به گروه غیر دیابتی منجر شد (0/001= P) و تمرینات مقاومتی به کاهش معنیدار گلوکز (0/001=P) و مقاومت انسولین (0/001=P) و افزایش معنیدار انسولین سرم (0/043= P) در گروه دیابتی مقاومتی نسبت به دیابتی کنترل منجر شد. نتایج آزمون آنوای یکطرفه همچنین بیانگر اختلاف معنیداری در بیان هر دو HNF4α و PGC-1α کبدی بین گروههاست (0/001=P، جدول 5). از طرفی، بر پایه یافتههای آزمون تعقیبی Tukey، القای دیابت نوع 2 به افزایش بیان HNF4α در گروه دیابتی کنترل نسبت به گروه غیردیابتی منجر شد (0/001=P). اما تمرین مقاومتی بیان HNF4α را در گروه دیابتی مقاومتی به میزان معنیداری نسبت به دیابتی کنترل کاهش داد (0/001=P، نمودار 1). با این وجود، علیرغم اینکه القای دیابت نوع 2 به افزایش بیان PGC-1α در گروه دیابتی کنترل نسبت به گروه غیردیابتی منجر شد (0/001=P) اما تمرین مقاومتی به تغییر معنیداری در بیان PGC-1α در گروه دیابتی مقاومتی نسبت به گروه دیابتی کنترل منجر نشد (0/353=P، نمودار 2).
جدول 1: الگوی توزیع شدت تمرین مقاومتی بر پایه اعمال وزنه بر حسب درصد وزن بدن در طول دوره تمرینی

جدول 2: توالی پرایمرهای مورد استفاده در پژوهش

جدول 3: وزن بدن در شرایط قبل و بعد از مداخله تمرینی در گروههای مورد مطالعه (انحراف امعیار±میانگین)

جدول 4: سطوح گلوکز ناشتا، انسولین سرم و مقاومت انسولین در گروههای مورد مطالعه (انحراف معیار±میانگین)

جدول 5: تغییرات بیان HNF4α و PGC-1α کبدی در پاسخ به القای دیابت و مداخله تمرینی نسبت به گروه چاق کنترل (انحرافمعیار±میانگین)



بحث
کاهش بیان HNF4α در پاسخ به تمرینات مقاومتی در رتهای دیابتی از یافتههای اصلی مطالعه حاضر است. به عبارتی، القای دیابت نوع 2 به موشهای چاق سالم به افزایش بیان HNF4α در هپاتوسیتهای کبدی منجر میشود و تمرینات مقاومتی 6 هفتهای به تعداد 5 جلسه در هفته توسط رتهای دیابتی شده به کاهش معنیدار بیان آن نسبت به گروه دیابتی کنترل که در دوره تمرینی شرکت نداشتهاند منجر میشود. این در حالی است که اگرچه القای دیابت نوع 2 به افزایش بیان PGC-1α در سلولهای کبدی منجر شد اما بیان آن در پاسخ به تمرینات مقاومتی نسبت به گروه کنترل دستخوش معنیداری نشد. جدا از تغییرات ژنتیکی، تمرینات مقاومتی همچنین به کاهش گلوکز ناشتا و افزایش انسولین سرم در گروه دیابتی مقاومتی نسبت به گروه دیابتی کنترل منجر شد. این در حالی است که مالتایس و همکاران در سال 2016 اشاره نمودهاند که علیرغم کاهش توده چربی بدن اما 4 ماه تمرین مقاومتی به تغییری در سطوح گلوکز در مردان سالمند دارای اضافهوزن منجر نشد (17). در مطالعه دیگری نیز عدم تغییر هموگلوبین گلیکوزیله متعاقب 20 هفته تمرین ورزشی گزارش شد (18). عدم تغییر گلوکز ناشتا همچنین به دنبال 6 هفته تمرین هوازی با شدت 60 تا 80 درصد VO2max گزارش شده است (19). با این وجود، در تایید یافتههای ما، گلانز و همکاران در سال 2009 بهبود گلوکز ناشتا در دیابتیهای نوع 2 را متعاقب 6 ماه تمرین مقاومتی و هوازی گزارش نمودهاند (20). سوری همکاران در سال 2017 نیز کاهش معنیدار گلوکز متعاقب 12 هفته تمرین مقاومتی در رتهای دیابتی نوع 2 را گزارش شد (21). جدا از پاسخهای ژنتیکی، برخی محققان بهبود گلوکز در بیماران دیابتی در پاسخ به تمرینات ورزشی را به کاهش مقاومت انسولین نسبت دادهاند. در این راستا، یافتههای آماری آشکار نمود که اجرای تمرینات مقاومتی به کاهش معنیدار مقاومت انسولین در رتهای دیابتی نسبت به گروه دیابتی کنترل که در برنامه تمرینی شرکت نداشتهاند منجر میشود. در این راستا، لوپز و همکاران در سال 2016 کاهش معنیدار مقاومت انسولین را متعاقب 12 هفته تمرین ترکیبی در دختران دارای اضافهوزن گزارش نمودهاند (22). استگلینگ و همکاران در سال 2016 نیز بهبود گلوکز و HbA1C متعاقب 12 هفته تمرینات اینتروال شدید (High intensity interval training: HIIT) به تعداد 3 جلسه در هفته با شدت 70 تا 90 درصد ضربان قلب بیشینه را به بهبود عملکرد انسولین نسبت دادهاند (23). کاهش گلوکز ناشتا در رتهای تمرین دیده در مطالعه حاضر را شاید هم بتوان به افزایش انسولین در پاسخ به تمرینات مقاومتی نسبت داد. چراکه مطالعات آزمایشگاهی روی موشهای دیابتی نشان دادهاند که آنها از توده سلولهای بتای کمتری نسبت به موشهای سالم برخوردارند (24). با این وجود، میزان رهایی انسولین از سلولهای پانکراس در موشهای دیابتی ورزیده به مراتب بیشتر از موشهای دیابتی کمتحرک و غیرفعال میباشد (25). بهطوری که ذخایر انسولین جزایر در موشهای تمرین کرده به مراتب بیشتر از موشهای کمتحرک است (26). در این راستا، ایزدی و همکاران در سال 2016، کاهش گلوکز ناشتا متعاقب تمرینات مقاومتی در رتهای دیابتی نوع 2 را به افزایش ترشح انسولین از سلولهای بتای پانکراس در پاسخ به این شیوه تمرینی نسبت دادهاند (16). جدا از فرآیندهای مذکور، برخی مطالعات نیز اثر مداخلههای تمرینی بر سطوح پروتئین یا بیان عوامل رونویسی موثر در تولید و رهایی گلوکز کبدی را ارزیابی نمودهاند. بهطوری که افزایش تولید گلوکز از مسیرهای غیرکربوهیدارات در فرایند گلوکونئوژنز کبدی همچنین تسریع در فرآیند گلیکولیز نهایتا به افزایش رهایی گلوکز کبدی بهویژه در بیماران دیابتی منتهی میشود (28،27). در این زمینه، یافتههای مطالعه حاضر آشکار نمود که بیان HNF4α کبدی در پاسخ به تمرینات مقاومتی کاهش مییابد. با این وجود، بیان PGC-1α اگرچه میل به کاهش داشت اما این کاهش به لحاظ آماری غیر معنیدار بود. این در حالی است که PGC-1a به عنوان یک فعالکننده رونویسی، در تعدادی از فرآیندهای بیولوژیکی نظیر مسیر گلوکونئوژنز کبدی نقش دارد بهطوری که بواسطه تاثیر بر بیان PEPCK، فروکتوز-1،6 بیس فسفاتاز و G6Pase از طریق عوامل رونویسی واسطهای نظیر HNF-4α و FOKO1 به تسریع سرعت گلوکونئوژنز کبدی منجر میشود (29). ورزش بهواسطه فسفوریلاسیون Akt، باعث کاهش HNF-4α و متعاقباً کاهش PEPCK کبدی میشود که نقش مهمی در سرکوب گلوکونئوژنز کبدی ایفا میکند. در این زمینه اگرچه کمتر مطالعهای اثر تمرینات مقاومتی بر بیان HNF-4α در رتهای دیابتی را دنبال نموده است اما همراستا با مطالعه حاضر، یادگاری و همکارانش در سال 1397 کاهش بیان ژن HNF-4α کبدی توام با کاهش گلوکز و افزایش انسولین سرم متعاقب 12 هفته تمرین هوازی را گزارش نمودهاند (11). کاهش بیان ژن HNF-4α کبدی توام با کاهش گلوکز و افزایش انسولین سرم متعاقب تمرینات تناوبی همچنین توسط این محققان گزارش شده است (30). در این زمینه، اشاره شده است که PGC-1α از طریق HNF-4α و FOKO1 رونویسی آنزیمهای گلوکونئوژنزی نظیر PEPCK و G6Pase را کنترل کند (29). بر پایه این شواهد، اینگونه نتیجهگیری میشود که کاهش بیان HNF-4α وابسته به تمرینات مقاومتی بهواسطه مهار ژنهای گلوکونئوژنیکی کاهش رهایی گلوکز کبدی وابسته به گلوکونئوژنز در رتهای دیابتی نوع 2 را بهدنبال دارد.
نتیجهگیری
اجرای تمرینات مقاومتی با بهبود گلوکز ناشتا در رتهای دیابتی نوع 2 همراه است. بر پایه شواهد موجود، بهبود گلوکز را شاید بتوان به کاهش بیان HNF4α کبدی در پاسخ به این شیوه تمرینی نسبت داد. چراکه مطالعات ژنتیکی به نقش مهارکنندگی کاهش بیان HNF4α بر ژنهای گلوکونئوژنیکی کبدی و بهدنبال آن کاهش سرعت گلوکونئوژنز کبدی تاکید دارند. از طرفی، کاهش مقاومت انسولین کل بدن در پاسخ به تمرینات مقاومتی نیز به نوعی کاهش گلوکز را بهدنبال دارد. علیرغم شواهد مذکور، شناخت مکانیسمهای اصلی عهده دار تغییر در مسیرهای سیگنالیگ گلوکونئوژنز کبدی در پاسخ به تمرینات ورزشی نیازمند مطالعات بیشتر است.
سپاسگزاری
این مقاله مستخرج از رساله دکتری گروه فیزیولوژی ورزشی دانشگاه آزاد اسلامی اسلامشهر است. نویسندگان مقاله از آزمایشگاه ژنتیک انستیتو پاستور در آنالیز بیان ژن تقدیر و تشکر مینمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد پرند تایید شده است (کد اخلاق: IR.IAU.PIAU.R.1400.010)
مشارکت نویسندگان
مجتبی ایزدی در ارائه ایده، مجتبی ایزدی، سعید صداقتی، حسین شیروانی، سیدصادق صالحی در طراحی مطالعه، سید صادق صالحی در جمعآوری دادهها، .یاسر کاظم زاده و ساناز میرزایان شانجانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Zhang X, Yang S, Chen J, Su Z. Unraveling the Regulation of Hepatic Gluconeogenesis. Front Endocrinol (Lausanne) 2019; 9: 802.
2- Yoon JC, Pere Puigserver, Guoxun Chen, Jerry Donovan, Zhidan Wu, James Rhee, et al Control of Hepatic Gluconeogenesis through the Transcriptional Coactivator PGC-1α. Nature. 2001; 413(6852): 131-8.
3- Knudsen JG, Biensø RS, Hassing HA, Jakobsen AH, Pilegaard H. Exercise-Induced Regulation of Key Factors in Substrate Choice and Gluconeogenesis in Mouse Liver. Mol Cell Biochem 2015; 403(1-2): 209-17.
4- Shi SQ, Ansari TS, McGuinness OP, Wasserman DH, Johnson CH. Circadian Disruption Leads to Insulin Resistance and Obesity. Curr Biol 2013; 23(5): 372-81.
5- Sepa-Kishi DM, Katsnelson G, Bikopoulos G, Iqbal A, Ceddia RB. Cold Acclimation Reduces Hepatic Protein Kinase B and AMP-Activated Protein Kinase Phosphorylation and Increases Gluconeogenesis in Rats. Physiol Rep 2018; 6(5): e13592.
6- Besseiche A, Riveline JP, Gautier JF, Bréant B, Blondeau B. Metabolic Roles of PGC-1α and Its Implications for Type 2 Diabetes. Diabetes Metab 2015; 41(5): 347-57.
7- Herzig S, Long F, Jhala US, Hedrick S, Quinn R, Bauer A, et al. CREB Regulates Hepatic Gluconeogenesis through the Coactivator PGC-1. Nature 2001; 413(6852): 179-83.
8- Handschin C, Lin J, Rhee J, Peyer AK, Chin S, Wu PH, Meyer UA, Spiegelman BM. Nutritional Regulation of Hepatic Heme Biosynthesis and Porphyria through PGC-1alpha. Cell 2005; 122(4): 505-15.
9- Koo SH, Satoh H, Herzig S, Lee CH, Hedrick S, Kulkarni R, et al. PGC-1 Promotes Insulin Resistance in Liver Through PPAR-Alpha-Dependent Induction of TRB-3. Nat Med 2004; 10(5): 530-4.
10- Galicia-Garcia U, Benito-Vicente A, Jebari S, Larrea-Sebal A, Siddiqi H, Uribe KB, et al. Pathophysiology of Type 2 Diabetes Mellitus. Int J Mol Sci 2020; 21(17): 6275.
11- Yadegari E, Abdolali Banaeifar A, Azarbaijani MA, Arshadi A. The Effect of Aerobic Exercise on Gene Expression of Hepatocyte Nuclear Factor-4α (HNF-4α) and Insulin Resistance in Type 2 Diabetic Rats. Sport Physiology & Management Investigations 2018; 10(3): 73-84.
12- Ghahramani M, Banaei Far AA, Arshadi S, Sohaily SH. Effect of Aerobic Training on Expression of PGC1α & PECPK Genes of Hepatocytes of STZ Induced Diabetics Male Rats. Studies in Medical Sciences 2019; 30(10): 791-802. [Persian]
13- Yazdanpazhooh S, Banaeifar A, Arshadi S, Eizadi M. Six Weeks Resistance Training Effect on FTO Expression in Type II Diabetic Rats. IJDO 2018; 10(4): 216-22. [Persian]
14- Novelli E L, Diniz Y S, Galhardi C M, Ebaid G M, Rodrigues H G, Mani F, et al. Anthropometrical Parameters and Markers of Obesity in Rats. Lab Anim 2007; 41(1): 111-19.
15- Daryanoosh F, Tanideh N, Bazgir B, Alizadeh H. Effect of Aerobic Trainings on Heart’s Functioned and Structure in Diabetic Sprague-Dawely Albino Species Male Rats. Res Applied Exercise Physiology 2010; 6(12): 59-72.
16- Eizadi M, Ravasi AA, Soory R, Baesi K, Choobineh S. The Effect of Three Months of Resistance Training on TCF7L2 Expression in Pancreas Tissues of Type 2 Diabetic Rats. Avicenna J Med Biochem 2016; 4(1): 34014.
17- Maltais ML, Perreault K, Courchesne-Loyer A, Lagacé JC, Barsalani R, Dionne IJ. Effect of Resistance Training and Various Sources of Protein Supplementation on Body Fat Mass and Metabolic Profile in Sarcopenic Overweight Older Adult Men: A Pilot Study. Int J Sport Nutr Exerc Metab 2016; 26(1): 71-7.
18- Vancea DM, Vancea JN, Pires MI, Reis MA, Moura RB, Dib SA. Effect of Frequency of Physical Exercise on Glycemic Control and Body Composition in Type 2 Diabetic Patients. Arq Bras Cardiol 2009; 92(1): 23-30.
19- Ligtenberg PC, Hoekstra JB, Bol E, Zonderland ML, Erkelens DW. Effects of Physical Training on Metabolic Control in Elderly Type 2 Diabetes Mellitus Patients. Clin Sci (Lond) 1997; 93(2): 127-35.
20- Glans F, Eriksson KF, Segerström A, Thorsson O, Wollmer P, Groop L. Evaluation of the Effects of Exercise on Insulin Sensitivity in Arabian and Swedish Women with Type 2 Diabetes. Diabetes Res Clin Pract 2009; 85(1): 69-74.
21- Soori R, Rashidi M, Choobineh S, Ravasi AA, Baesi K, Rashidy-Pour A. Effects of 12 Weeks Resistant Training on MTNR1B Gene Expression in the Pancreas and Glucose and Insulin Levels in Type 2 Diabetic Rats. Koomesh 2017; 19(1): 46-55.
22- Lopes WA, Leite N, da Silva LR, Brunelli DT, Gáspari AF, Radominski RB, et al. Effects of 12 Weeks of Combined Training Without Caloric Restriction on Inflammatory Markers in Overweight Girls. J Sports Sci 2016; 34(20): 1902-12.
23- Steckling FM, Farinha JB, Santos DL, Bresciani G, Mortari JA, Stefanello ST, et al. High Intensity Interval Training Reduces the Levels of Serum Inflammatory Cytokine on Women with Metabolic Syndrome. Exp Clin Endocrinol Diabetes 2016; 124(10): 597-601.
24- Király MA, Bates HE, Yue JT, Goche-Montes D, Fediuc S, Park E, et al. Attenuation of Type 2 Diabetes Mellitus in the Male Zucker Diabetic Fatty Rat: The Effects of Stress and Non-Volitional Exercise. Metabolism 2007; 56(6): 732-44.
25- Kibenge MT, Chan CB. The Effects of High-Fat Diet on Exercise-Induced Changes in Metabolic Parameters in Zucker Fa/Fa Rats. Metabolism 2002; 51(6): 708-15.
26- Delghingaro-Augusto V, Décary S, Peyot ML, Latour MG, Lamontagne J, Paradis-Isler N, et al. Voluntary Running Exercise Prevents Β-Cell Failure in Susceptible Islets of the Zucker Diabetic Fatty Rat. Am J Physiol Endocrinol Metab 2012; 302(2): 254-64.
27- Boden G, Chen X, Stein TP. Gluconeogenesis in Moderately and Severely Hyperglycemic Patients with Type 2 Diabetes Mellitus. Am J Physiol Endocrinol Metab 2001; 280(1): 23-30.
28- Basu R, Barosa C, Jones J, Dube S, Carter R, Basu A, Rizza RA. Pathogenesis of Prediabetes: Role of the Liver in Isolated Fasting Hyperglycemia and Combined Fasting and Postprandial Hyperglycemia. J Clin Endocrinol Metab 2013; 98(3): 409-17.
29- Kalhan SC, Ghosh A. Dietary Iron, Circadian Clock, and Hepatic Gluconeogenesis. Diabetes 2015; 64(4): 1091-3.
30- Yadegari E, Banaeifar AA, Azarbayjani MA, Arshadi S. The Effects of High Intensity Interval Training on HNF-4 Α Gene Expression in Liver Tissue of Type 2 Diabetic Male Wistar Rats. Iranian J Diabetes & Obesity 2018; 10(4): 210-5.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/9/27 | پذیرش: 1403/10/2 | انتشار: 1404/3/15
دریافت: 1403/9/27 | پذیرش: 1403/10/2 | انتشار: 1404/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







