دوره 32، شماره 11 - ( بهمن 1403 )
جلد 32 شماره 11 صفحات 8424-8414 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shamsi Z, Taheri Kalani A, Nikseresht M, Bakhtiari Dehbalaei S, Shamsi L. Comparison the Effect of Continuous and Interval Aerobic Training on IL-1 and TNF-α Expression in Cerebellum of Parkinson's Model Rats. JSSU 2025; 32 (11) :8414-8424
URL: http://jssu.ssu.ac.ir/article-1-6282-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6282-fa.html
شمسی زهرا، طاهری کلانی عبدالحسین، نیک سرشت محمود، بختیاری ده بالائی سمیه، شمسی لیلا. مقایسه اثر تمرین هوازی تداومی و تناوبی بر بیان IL-1 و TNF-α در بافت مخچه رتهای مدل پارکینسونی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (11) :8414-8424
متن کامل [PDF 812 kb]
(314 دریافت)
| چکیده (HTML) (909 مشاهده)
متن کامل: (206 مشاهده)
مقدمه
بیماری پارکینسون (Parkinson's disease) یکی از اختلالهای رایج تحلیل برنده عصبی میباشد که تغییرات پاتولوژیک ناشی از آن ناحیهای در مغز به نام ماده سیاه پارس کامپکتا (Substantia nigra pars compacta= SNPc) را مورد تأثیر قرار میدهد که سرشار از نورونهای دوپامینرژیک (Dopaminergic) است (1). SNPc ناحیهای از مغز است که نسبت به نواحی دیگر آن حاوی میکروگلیای بیشتر و استروسیتهای کمتر میباشد و بیشتر در معرض التهاب نورونی قرار دارد. به همین دلیل در بیماریهای تحلیل برنده عصبی آسیب بیشتری میبیند (2). مسیر دوپامینرژیک، مسئول ایجاد حرکت در بدن است که از راه آن ناقل عصبی دوپامین (Dopamine) از یک طرف مغز به طرف دیگر آن حرکت میکند (3). بنابراین با از بین رفتن سلولهای ترشح-کننده دوپامین در مغز میانی، سطح این ناقل عصبی کاهش یافته و ناتوانی حرکتی را به دنبال دارد (4). این بیماری با اختلالهای حرکتی زیادی از قبیل سفتی عضلانی، لرزش عضلانی در زمان استراحت، آکینزی (Akinesis) یا مشکل در شروع حرکات، برادی کینزی (Bradykinesia) یا آهسته بودن حرکات، ضعف در حفظ تعادل، کاهش حرکات خودبه خودی و کاهش حرکات ناخودآگاه طبیعی بدن مانند تغییر حالات چهره به هنگام صحبت کردن همراه است (5). یکی از محتملترین عوامل ایجاد بیماری پارکینسون تجمع آلفا سینوکلئین (Alpha-synuclein= α-syn) میباشد که شامل فعال شدن میکروگلیا و آستروسیتها است و منجر به التهاب عصبی مزمن میشود (6). در طی فرآیندهای التهاب عصبی، میکروگلیا سایتوکینهای پیش التهابی مانند فاکتور نکروزی تومور آلفا (Tumor necrosis factor alpha= TNF-α)، اینترلوکین-1 بتا (Interleukin-1 beta= IL-1β)، اینترلوکین-6 (IL-6) و اینترفرون گاما (Interferon-gamma= INF-γ) تولید میکند. با فعالسازی میکروگلیا، افزایش سطح سایتوکین¬های پیش التهابی منجر به فعالشدن آستروسیتها و افزایش تولید سایتوکینهای پیش التهابی توسط آن سلولها میشود. آستروسیتها، نیز همانند میکروگلیا، میتوانند از راه تولید سایتوکینهای پیش التهابی و گونههای اکسیژن فعال (Reactive oxygen species= ROS) منجر به مرگ سلول شوند (8، 7). در شرایط فیزیولوژیکی، افزایش سایتوکینهای پیش التهابی با القا تولید سایتوکینهای ضد التهابی مانند IL-10 و TGF-β از التهاب مخرب جلوگیری میکند (9). در بیماری پارکینسون، تعادل بین سایتوکینهای پیش التهابی و ضد التهابی مختل شده و باعث التهاب مزمن عصبی میشود. علاوه بر التهاب عصبی، افزایش نفوذپذیری سد خونی مغزی در پارکینسون دیده شده است (10، 7). سد خونی مغزی از ورود پاتوژنها و سلولهای ایمنی به داخل پارانشیم مغز جلوگیری میکند. افزایش سایتوکینهای پیش التهابی در مغز سد خونی مغزی را آسیبپذیر کرده و منجر به تماس گستردهتر بین دستگاه عصبی مرکزی و محیطی میشود (11،10). علاوه بر التهاب عصبی، آسیب سد خونی مغزی و افزایش التهاب سیستمیک در بیماری پارکینسون گزارش شده است که بیانگر ارتباط نزدیک بین التهاب محیطی و التهاب عصبی است (12). دهه گذشته بینش جدیدی در مورد اهمیت فعالیت بدنی در بیماری پارکینسون به ارمغان آورده است. اگرچه برنامههای ورزشی برای بیماران پارکینسونی به طور عمده بر تمرینات هوازی و مقاومتی تأکید شده است، در سالهای اخیر اهمیت تمرینات تناوبی شدید (High-intensity interval training) در برنامههای توانبخشی بیماری پارکینسون مشخص شده است (14، 13). با اینکه، برخی از پژوهشگران نشان دادهاند که یک جلسه فعالیت ورزشی با شدت بالا ممکن است اثر پیشالتهابی داشته باشد، اما بهنظر میرسد که HIIT در طولانیمدت ممکن است مزایای متفاوتی در سطح پایه عوامل التهابی ایجاد نماید (15، 13). در این زمینه نشان داده شده است که HIIT از راه تعدیل سطوح سایتوکینهای التهابی بر التهاب در بیماران پارکینسون تأثیر میگذارد (16، 1). گزارش شده است که 12 هفته HIIT موجب کاهش سطوح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی گردید (1). همینطور، 8 هفته هوازی سطوح TNF-α و IL-1β را در پلاسما و جسم سیاه رتهای مدل پارکینسونی کاهش داد (16). گرچه، در پژوهش دیگری گزارش شد که 8 هفته HIIT بر سطوح سرمی TNF-α و IL-6 در بیماران پارکینسونی اثر معناداری ندارد (17). با اینکه آثار سودمند HIIT بر سطح التهاب سیستمیک در آزمودنیهای انسانی نشان داده شده است؛ اما شواهدی از این نتایج در سطح بافتی در مدل حیوانی وجود ندارد. همچنین، اثربخشی HIIT در مقایسه با تمرینات هوازی تداومی مورد بررسی قرار نگرفته است. با توجه به نتایج متناقض و محدود پیشین، هدف پژوهش حاضر مقایسه آثار دو نوع تمرین هوازی تناوبی و تداومی بر سطح پروتئینهای IL-1 و TNF-α در بافت مخچه و تعادل در رتهای مدل پارکینسونی بود.
روش بررسی
این پژوهش از نوع تجربی با شیوه آزمایشگاهی بود که در آن از 28 سر رت نر نژاد ویستار در دامنه سنی 12 تا 14 هفته و وزن 180 تا 250 گرم استفاده شد. حیوانات در قفسهای پلیکربنات (چهار سر در هر قفس) در شرایط کنترل شده محیطی با میانگین دمای 2±22 درجه سانتیگراد، رطوبت 5±50 درصد و چرخه روشنایی/ تاریکی 12:12 ساعت با دسترسی آزاد به آب و غذای ویژهی حیوانات آزمایشگاهی نگهداری شدند. حیوانات بهطور تصادفی به چهار گروه (7 سر در هر گروه) به شرح زیر تقسیم شدند: 1) کنترل سالم که به مدت 6 هفته در قفس های پلی کربنات نگهداری شده و در طول دوره مداخله هیچگونه فعالیتی نداشتند، 2) گروه کنترل پارکینسون که با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شدند و در طی انجام پروتکل شش هفتهای هیچگونه فعالیتی نداشتند، 3) گروه تمرین تداومی؛ این گروه با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شده و در ادامه به مدت شش هفته به اجرای تمرینات تداومی پرداختند و 4) گروه تمرین تناوبی؛ این گروه نیز با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شده و سپس و به مدت شش هفته تمرینات تناوبی را اجرا کردند.
روش القای پارکینسون: بیماری پارکینسون تجربی با تزریق درون صفاقی روتنون در رتها القا گردید. بدین منظور، روزانه دوز دو میلیگرم/ کیلوگرم روتنون و به مدت 28 روز به حیوانات تزریق شد. مقدار تعیین شده روتنون برای هر رت در 200 میکرولیتر روغن زیتون یا آفتابگردان حل و به صورت درون صفاقی تزریق گردید (18).
روش بررسی القای پارکینسون: برای تأیید القای پارکینسون در رتها، از آزمون چرخشی دو هفته پس از تزریق روتنون استفاده گردید. در این آزمون با گرفتن رت از محدوده دو سانتیمتری محل اتصال دم به بدن، بالا آورده شد به طوری که بینی حیوان دو سانتیمتر بالاتر از سطح اتکایش قرار گیرد. در این حالت اگر رت نتواند تعادلش را حفظ و به طرفین چرخش کند به عنوان نشانه پارکینسونی شدن در نظر گرفته شد (19). جهت اطمینان از ابتلا شدن حیوانات به پارکینسون، این آزمون بر روی گروه کنترل سالم نیز اجرا شد و نتایج آن با گروههای بیمار مقایسه گردید.
روش بررسی تعادل: ارزیابی فعالیت تعادلی حیوانات با استفاده از آزمون روتارود (Rotarod) صورت گرفت. ابتدا به هر حیوان دو بار فرصت عادت کردن و تطابق با دستگاه اندازه-گیری داده شد. حیوان روی میله افقی چرخنده به قطر سه سانتیمتر که سرعت حرکت آن متغیر بود، با سرعت اولیه پنج دور در دقیقه قرار گرفت و سپس سرعت چرخش میله طی مدت پنج دقیقه به تدریج تا 25 دور در دقیقه افزایش یافت. معیار اصلی برای تعادل در حیوانات سرعت 25 دور در دقیقه بود. مدت زمان حفظ تعادل و باقیماندن روی میله برای هر حیوان ثبت شد. این آزمون سه بار با فواصل 30 دقیقهای تکرار شد و میانگین آنها برای هر حیوان در نظر گرفته شد (20).
پروتکل تمرین هوازی تناوبی: برنامه تمرین هوازی تناوبی مطابق جدول 1 طی شش هفته و هر هفته پنج جلسه به اجرا درآمد. این پروتکل در هفته اول با سرعت 10 متر در دقیقه و دو نوبت 7:30 دقیقهای انجام گرفت که در هفته ششم به شش نوبت 6:40 دقیقهای با سرعت 20 متر در دقیقه رسید. فواصل استراحتی فعال بین نوبتهای تمرینی به صورت یک به یک چهارم (یعنی به ازاء هر چهار دقیقه تمرین یک دقیقه استراحت فعال) شامل دویدن با سرعت سه متر بر دقیقه بود (21).
پروتکل تمرین هوازی تداومی: برنامه تمرین هوازی تداومی در شش هفته و هر هفته پنج جلسه اجرا گردید (جدول 2). این برنامه در هفته اول با سرعت 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هر هفته دو متر در دقیقه افزایش یافت. به مدت تمرین نیز هر هفته 5 دقیقه افزوده شد بهطوری که از 15 دقیقه در هفته اول به 40 دقیقه در هفته ششم رسید (21).
روش بافتبرداری و اندازهگیری متغیرها: بافتبرداری 48 ساعت پس از آخرین جلسه تمرینی و به دنبال 12 ساعت ناشتایی انجام گرفت. ابتدا، موشها با ترکیب کتامین زایلازین به ترتیب با دوز 100 و 10 میلیگرم بر کیلوگرم بیهوش شدند. سپس، با جدا کردن کل مغز و خارج کردن آن از کاسه جمجمه، بافت مخچه از سایر بخشهای مغز جدا و در یخچال مخصوص با دمای 70- درجه نگهداری شد. در ادامه، بافت مخچه با استفاده از بافر ریپا (RIPA) هموژن شده و پس از هموژنایز و سانتریفیوژ برای اندازهگیری سطح پروتئین¬های مورد نظر آماده گردید. برای تعیین مقدار پروتئینهای IL-1 و TNF-α در بافت مخچه حیوانات از روش برادفورد استفاده شد. بدین منظور مقدار 20 میکرولیتر نمونه هموژن بافتی (نمونه) و 20 میکرولیتر آب مقطر (بلانک) به صورت دو بار تکرار در چاهکهای پلیت 96 خانه اضافه شد. سپس به نمونهها و بلانک مقدار 40 میکرولیتر معرف برادفورد و 140 میکرولیتر آب مقطر اضافه شد و پس از مخلوط نمودن با استفاده از دستگاه پلیت ریدر (Plate Reader) مدل Bioteck ساخت آمریکا جذب نمونهها در طول موج 495 نانومتر مشخص گردید. بهمنظور تعیین غلظت پروتئین در نمونهها از منحنی استاندارد پروتئین سرم آلبومین گاوی با غلظتهای 2، 5، 10، 20، 50 و 100 میکروگرم بر میلیلیتر استفاده شد. پس از رسم منحنی استاندارد تغییرات جذب نمونههای استاندارد در برابر غلظت آنها، فرمول خط استخراج شد و با استفاده از فرمول خط، غلظت نمونههای مجهول محاسبه گردید.
تجزیه و تحلیل آماری
دادهها بر اساس میانگین ± انحراف استاندارد گزارش شد. آزمون شاپیرو- ویلک جهت تعیین طبیعی بودن توزیع دادهها بهکار رفت. برای تجزیه و تحلیل دادههای این پژوهش از آزمون تحلیل واریانس یک طرفه (ANOVA) استفاده گردید. در صورت وجود اختلاف بین گروهها جهت تعیین محل تفاوت آزمون تعقیبی LSD به کار رفت. دادههای گردآوری شده توسط نرم¬افزارversion 16 SPSS در سطح معناداری 0/05>P مورد تجزیه و تحلیل قرار گرفت.
نتایج
در جدول 3 میانگین و انحراف استاندارد وزن بدن و مخچه حیوانات در پایان مداخله آورده شده است. نتایج نشان داد که وزن بدن در گروههای پارکینسون (0/0001=P)، پارکینسون+ تمرین تداومی (0/039=P) و پارکینسون+ تمرین تناوبی (0/001=P) نسبت به گروه کنترل سالم کاهش معناداری داشت. همچنین، در میزان وزن بدن گروه پارکینسون+ تمرین تداومی در مقایسه با کنترل سالم کاهش معناداری دیده شد (0/037=P). بااین وجود، بین میزان وزن مخچه در چهار گروه تفاوت معناداری وجود نداشت (0/768=P).
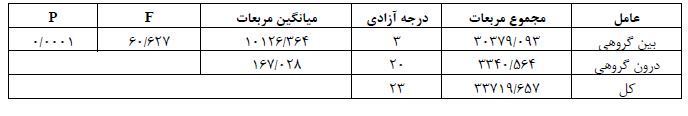
تحلیل داده ها با آزمون های ANOVA یک طرفه (جدول 4) و تعقیبی LSD نشان داد، میزان پروتئین IL-1 در بافت مخچه گروه کنترل در مقایسه با سایر گروه ها به طور معناداری کمتر بود (0/0001=P). همچنین، میزان پروتئین IL-1 در گروه پارکینسون نسبت به گروههای پارکینسون+ تمرین تداومی (0/0001=P) و پارکینسون+ تمرین تناوبی (0/0001=P) افزایش معناداری را نشان داد. هرچند، بین دو گروه پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی تفاوت معناداری وجود نداشت (0/062=P) (شکل 1).
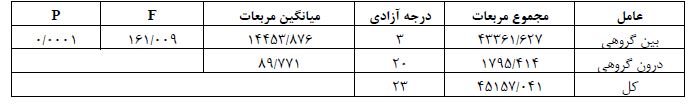
همچنین، نتایج آزمون ANOVA یک طرفه (جدول 5) و تعقیبی LSD بیانگر کاهش معنادار میزان پروتئین TNF-α در بافت مخچه گروه کنترل نسبت به سایر گروهها بود (0/0001=P). همین طور، میزان پروتئین TNF-α در گروه پارکینسون در مقایسه با گروههای پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P) و در گروه پارکینسون+ تمرین تداومی نسبت به پارکینسون+ تمرین تناوبی افزایش معناداری دیده شد (0/007=P) (شکل 2).
جدول1: پروتکل تمرین هوازی تناوبی
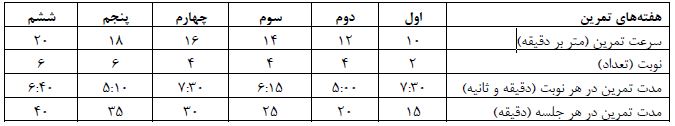
جدول 2: پروتکل تمرین هوازی تداومی

هر دو گروه تمرینی در ابتدای هر جلسه تمرینی به مدت 3 دقیقه با سرعت 1 متر در دقیقه دویدند و سپس برای رسیدن به سرعت مورد نظر به ازای هر دقیقه، 2 متر در دقیقه به سرعت نوارگردان افزوده شد.
جدول 3: میانگین و انحراف معیار وزن بدن و مخچه (گرم) حیوانات در پایان دوره پژوهش

* تغییر معنادار در مقایسه با گروه کنترل سالم (0/039=P)
# تغییر معنادار نسبت به گروه پارکینسون+ تمرین تداومی (0/037=P)
جدول 4: نتایج تحلیل واریانس یکطرفه جهت مقایسه میزان پروتئین IL-1 در بافت مخچه بین گروه¬ها
جدول 5: نتایج تحلیل واریانس یک¬طرفه جهت مقایسه میزان پروتئین TNF-α در بافت مخچه بین گروه¬ها
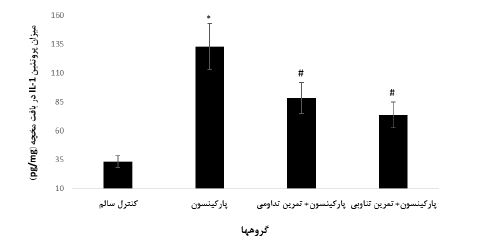
شکل 1: میزان پروتئین IL-1 در بافت مخچه گروههای مورد بررسی
* افزایش معنادار در مقایسه با گروههای کنترل سالم، پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P)
# افزایش معنادار نسبت به گروه کنترل سالم (0/0001=P)
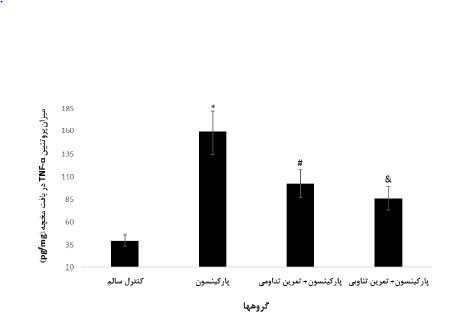
شکل 2: میزان پروتئین TNF-α در بافت مخچه گروههای مورد بررسی
* افزایش معنادار در مقایسه با گروههای کنترل، پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P)
# افزایش معنادار نسبت به گروه کنترل سالم و پارکینسون+ تمرین تناوبی (0/007=P)
ƍ افزایش معنادار نسبت به گروه کنترل سالم (0/0001=P)
بحث
نتایج پژوهش حاضر نشان داد که القای پارکینسون با افزایش معنادار سطح پروتئین IL-1 و TNF-α در بافت مخچه رتها همراه بود. هر دو نوع تمرین تداومی و تناوبی موجب کاهش معنادار پروتئین IL-1 و TNF-α نسبت به گروه پارکینسون شد. هرچند، میزان کاهش TNF-α به دنبال تمرین تناوبی در مقایسه با تمرین تداومی به طور معناداری بیشتر بود. پژوهشهای پیشین نیز همسو با نتایج ما سطوح بالای IL1β، IL-2 و TNFα را در سرم و مایع مغزی نخاعی بیماران پارکینسونی نشان دادهاند (23، 22). در این زمینه گزارش شده است که سطح سرمی IL-6 و هپسیدین (Hepcidin) (هورمونی پپتیدی است که مسئول هموستاز آهن و یک نشانگر التهابی است) در بیماران پارکینسونی در مقایسه با همتایان سالم بهطور معناداری بیشتر بود (24). همچنین، مشاهده فنوتیپ پیش التهابی محیطی و کاهش نسبت لنفوسیت CD4+ به CD8+ در بیماران پارکینسونی نسبت به همتایان سالم، از این ایده حمایت میکند که التهاب سیستمیک مرکزی در تخریب عصبی این بیماری نقش اساسی دارد (25). مشخص شده است که التهاب محیطی از راه سد خونی مغزی یا دستگاه عصبی خودمختار (عصب واگ) بر سطح مغز اثر دارد و میتواند میکروگلیای غیرفعال را به حالت فعال تبدیل کند که منجر به تحریک پاسخهای قوی برای حفظ فرآیندهای عصبی میشود (12). در گروههای مبتلا به پارکینسون در مقایسه با کنترل سالم کاهش وزن بدن دیده شد که ممکن است ناشی از اختلال در عملکرد دستگاه گوارش، رفتارهای خوردن، مشکل در بلعیدن خوراک و افزایش هزینه انرژی باشد (26). کاهش معنادار میزان پروتئینهای IL-1 و TNF-α در بافت مخچه رتها پس از شش هفته تمرین تداومی و تناوبی از دیگر یافتههای پژوهش حاضر بود. گرچه میزان کاهش TNF-α در گروه تمرین تناوبی نسبت به تمرین تداومی بیشتر بود. همسو با این نتایج به دنبال تمرینات تناوبی در دو شدت متوسط و بالا کاهش نشانگرهای التهابی با آزمودنیهای حیوانی (28، 27) و انسانی (29، 16، 1) مبتلا به پارکینسون گزارش شده است. همسو با نتایج ما، گزارش شد که هشت هفته تمرین استقامتی موجب کاهش میزان پروتئینهای IL-1 و TNF-α در جسم مخطط موشهای مدل پارکینسونی شد (27). همچنین، دنبال هشت هفته تمرین هوازی و قدرتی در موشهای پارکینسونی کاهش مشابه و معناداری در میزان IL-1 و TNF-α جسم مخطط گزارش گردید (28). به نظر میرسد، مشابهت طول دوره مداخله، آزمودنیها و پروتکل تمرینی دلیل همسویی نتایج باشد. همینطور، نشان داده شد که 12 هفته تمرین تناوبی شدید با کاهش سطح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی همراه است (1). بهطور مشابهی، گزارش گردید که 12 هفته تمرین تعادلی موجب کاهش سطح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی میشود (29). با اینکه در این دو مطالعه نوع آزمودنی و سطح اندازهگیری سایتوکینها متفاوت است، اما نتایج مشابهی به دست آمد. رشیدفرد و همکاران در سال 2024، نیز نشان دادند که شش هفته تمرین تناوبی شدید شنا موجب کاهش معنادار بیان ژن mir-874 (یک نشانگر التهابزا) در هیپوکامپ رتهای پارکینسونی میشود (30). با توجه به نتایج پژوهش حاضر و دیگر مطالعات انجام شده در این زمینه میتوان گفت مداخلههای ورزشی (هوازی تناوبی و تداومی، قدرتی و تعادلی) در کاهش سایتوکینهای پیش التهابی در سطح بافت و گردش خون بیماران پارکینسونی مؤثر است. همینطور، با توجه به کاهش بیشتر TNF-α در گروه تمرین تناوبی در مقایسه با تمرین تداومی، به نظر میرسد که نوع تمرین عاملی مؤثر در تغییر میزان این سایتوکین التهابی است. گرچه، برای اظهار نظر قطعی به مطالعات بیشتری نیاز هست. یافتههای پژوهشی نشان داده است که انقباضهای عضلانی در هنگام فعالیت ورزشی موجب افزایش تولید IL-6 میشود و این مایوکاین تولید سایتوکینهای ضـد التهابی مانند گیرنده مخـالف IL-1 (IL-1ra) و IL-10 را تحریک کرده و هم-چنین سبب مهار تولید سایتوکینهای پیش التهـابی از قبیل TNF-α میشود. گزارش شده است که IL-10 سایتوکاین دارای خاصیت ضـد التهـابی میباشد و نقش بالقوه آن در کاهش التهاب و بهبود و بازسازی بافت نشان داده شده است (31). در واقع، احتمال دارد که کاهش معنادار سطح پروتئین-های IL-1 و TNF-α در بافت مخچه رتها در اثر نقش مهارکنندگی IL-6 بوده باشد. گرچه، این فرضیه برای تأیید نیاز به مطالعات بیشتری دارد. در پژوهش حاضر سطح IL-6 اندازهگیری نشد و از جمله محدودیتهای آن به شمار میرود. در مقابل و بر خلاف نتایج ما، پس از هشت هفته تمرین تنـاوبی شدید تغییری معناداری در سطح IL-6 و TNF-α سرمی بیماران پارکینسونی دیده نشد. گـرچه در این مطالعه افزایش نسبت IL-10 به TNF-α گزارش گردید، که نشان میدهد تمرین تناوبی قادر به ایجاد محیطی ضد التهابی در سطح سرمی بیماران پارکینسونی است. از نتایج این مطالعه، چنین برداشت میشود که جهت درک جامعی از آثار تمرینات ورزشی بر محیط التهابی آزمودنیها بایستی تغییرات نشانگرهای با خاصیت التهابزا و ضد التهابی ارزیابی گردد (17). تفاوت در نوع اندازهگیری سایتوکینها و آزمودنیها ممکن است دلیل تناقض نتایج ما با پژوهش ذکر شده باشد.
نتیجهگیری
نتایج به دست آمده در این پژوهش نشانگر کاهش میزان سایتوکینهای پیش التهابی (IL-1 و TNF-α) مخچه پس از شش هفته تمرین تناوبی و تداومی در رتهای مدل پارکینسونی بود. گرچه، تأثیر تمرین هوازی تناوبی در مقایسه با تداومی بیشتر بود. بنابراین، میتوان گفت که نوع تمرین هوازی در تعدیل التهاب در بافت مخچه رتهای پارکینسونی اثرگذار است. طبق این نتایج، اجرای تمرینات هوازی میتواند مداخله غیردارویی مؤثری جهت کندکردن روند پیشرفت و کاهش عوارض بیماریهای تخریب کننده عصبی باشد که التهاب در پاتوژنز آنها نقش اساسی دارد. هرچند، برای نتیجهگیری دقیقتر به پژوهشهای بیشتری در این زمینه نیاز است.
سپاسگزاری
مقاله حاضر بخشی از پایاننامه دانشجویی میباشد. از همه کسانی که ما را در اجرای این پژوهش پشتیبانی کردند، تشکر و قدردانی مینماییم.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در این پژوهش همه موازین اخلاقی در مورد کار با حیوانات آزمایشگاهی طبق بیانیه هلسینکی رعایت شده و با شناسه IR.IAU.ILAM.REC.1403.072 به تأیید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد ایلام رسیده است.
مشارکت نویسندگان
همه نویسندگان در ارائه ایده، طراحی مطالعه، جمع¬آوری داده¬ها و تجزیه و تحلیل دادهها بهطور یکسان مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سئوالات مرتبط با مقاله سهیم هستند.
بیماری پارکینسون (Parkinson's disease) یکی از اختلالهای رایج تحلیل برنده عصبی میباشد که تغییرات پاتولوژیک ناشی از آن ناحیهای در مغز به نام ماده سیاه پارس کامپکتا (Substantia nigra pars compacta= SNPc) را مورد تأثیر قرار میدهد که سرشار از نورونهای دوپامینرژیک (Dopaminergic) است (1). SNPc ناحیهای از مغز است که نسبت به نواحی دیگر آن حاوی میکروگلیای بیشتر و استروسیتهای کمتر میباشد و بیشتر در معرض التهاب نورونی قرار دارد. به همین دلیل در بیماریهای تحلیل برنده عصبی آسیب بیشتری میبیند (2). مسیر دوپامینرژیک، مسئول ایجاد حرکت در بدن است که از راه آن ناقل عصبی دوپامین (Dopamine) از یک طرف مغز به طرف دیگر آن حرکت میکند (3). بنابراین با از بین رفتن سلولهای ترشح-کننده دوپامین در مغز میانی، سطح این ناقل عصبی کاهش یافته و ناتوانی حرکتی را به دنبال دارد (4). این بیماری با اختلالهای حرکتی زیادی از قبیل سفتی عضلانی، لرزش عضلانی در زمان استراحت، آکینزی (Akinesis) یا مشکل در شروع حرکات، برادی کینزی (Bradykinesia) یا آهسته بودن حرکات، ضعف در حفظ تعادل، کاهش حرکات خودبه خودی و کاهش حرکات ناخودآگاه طبیعی بدن مانند تغییر حالات چهره به هنگام صحبت کردن همراه است (5). یکی از محتملترین عوامل ایجاد بیماری پارکینسون تجمع آلفا سینوکلئین (Alpha-synuclein= α-syn) میباشد که شامل فعال شدن میکروگلیا و آستروسیتها است و منجر به التهاب عصبی مزمن میشود (6). در طی فرآیندهای التهاب عصبی، میکروگلیا سایتوکینهای پیش التهابی مانند فاکتور نکروزی تومور آلفا (Tumor necrosis factor alpha= TNF-α)، اینترلوکین-1 بتا (Interleukin-1 beta= IL-1β)، اینترلوکین-6 (IL-6) و اینترفرون گاما (Interferon-gamma= INF-γ) تولید میکند. با فعالسازی میکروگلیا، افزایش سطح سایتوکین¬های پیش التهابی منجر به فعالشدن آستروسیتها و افزایش تولید سایتوکینهای پیش التهابی توسط آن سلولها میشود. آستروسیتها، نیز همانند میکروگلیا، میتوانند از راه تولید سایتوکینهای پیش التهابی و گونههای اکسیژن فعال (Reactive oxygen species= ROS) منجر به مرگ سلول شوند (8، 7). در شرایط فیزیولوژیکی، افزایش سایتوکینهای پیش التهابی با القا تولید سایتوکینهای ضد التهابی مانند IL-10 و TGF-β از التهاب مخرب جلوگیری میکند (9). در بیماری پارکینسون، تعادل بین سایتوکینهای پیش التهابی و ضد التهابی مختل شده و باعث التهاب مزمن عصبی میشود. علاوه بر التهاب عصبی، افزایش نفوذپذیری سد خونی مغزی در پارکینسون دیده شده است (10، 7). سد خونی مغزی از ورود پاتوژنها و سلولهای ایمنی به داخل پارانشیم مغز جلوگیری میکند. افزایش سایتوکینهای پیش التهابی در مغز سد خونی مغزی را آسیبپذیر کرده و منجر به تماس گستردهتر بین دستگاه عصبی مرکزی و محیطی میشود (11،10). علاوه بر التهاب عصبی، آسیب سد خونی مغزی و افزایش التهاب سیستمیک در بیماری پارکینسون گزارش شده است که بیانگر ارتباط نزدیک بین التهاب محیطی و التهاب عصبی است (12). دهه گذشته بینش جدیدی در مورد اهمیت فعالیت بدنی در بیماری پارکینسون به ارمغان آورده است. اگرچه برنامههای ورزشی برای بیماران پارکینسونی به طور عمده بر تمرینات هوازی و مقاومتی تأکید شده است، در سالهای اخیر اهمیت تمرینات تناوبی شدید (High-intensity interval training) در برنامههای توانبخشی بیماری پارکینسون مشخص شده است (14، 13). با اینکه، برخی از پژوهشگران نشان دادهاند که یک جلسه فعالیت ورزشی با شدت بالا ممکن است اثر پیشالتهابی داشته باشد، اما بهنظر میرسد که HIIT در طولانیمدت ممکن است مزایای متفاوتی در سطح پایه عوامل التهابی ایجاد نماید (15، 13). در این زمینه نشان داده شده است که HIIT از راه تعدیل سطوح سایتوکینهای التهابی بر التهاب در بیماران پارکینسون تأثیر میگذارد (16، 1). گزارش شده است که 12 هفته HIIT موجب کاهش سطوح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی گردید (1). همینطور، 8 هفته هوازی سطوح TNF-α و IL-1β را در پلاسما و جسم سیاه رتهای مدل پارکینسونی کاهش داد (16). گرچه، در پژوهش دیگری گزارش شد که 8 هفته HIIT بر سطوح سرمی TNF-α و IL-6 در بیماران پارکینسونی اثر معناداری ندارد (17). با اینکه آثار سودمند HIIT بر سطح التهاب سیستمیک در آزمودنیهای انسانی نشان داده شده است؛ اما شواهدی از این نتایج در سطح بافتی در مدل حیوانی وجود ندارد. همچنین، اثربخشی HIIT در مقایسه با تمرینات هوازی تداومی مورد بررسی قرار نگرفته است. با توجه به نتایج متناقض و محدود پیشین، هدف پژوهش حاضر مقایسه آثار دو نوع تمرین هوازی تناوبی و تداومی بر سطح پروتئینهای IL-1 و TNF-α در بافت مخچه و تعادل در رتهای مدل پارکینسونی بود.
روش بررسی
این پژوهش از نوع تجربی با شیوه آزمایشگاهی بود که در آن از 28 سر رت نر نژاد ویستار در دامنه سنی 12 تا 14 هفته و وزن 180 تا 250 گرم استفاده شد. حیوانات در قفسهای پلیکربنات (چهار سر در هر قفس) در شرایط کنترل شده محیطی با میانگین دمای 2±22 درجه سانتیگراد، رطوبت 5±50 درصد و چرخه روشنایی/ تاریکی 12:12 ساعت با دسترسی آزاد به آب و غذای ویژهی حیوانات آزمایشگاهی نگهداری شدند. حیوانات بهطور تصادفی به چهار گروه (7 سر در هر گروه) به شرح زیر تقسیم شدند: 1) کنترل سالم که به مدت 6 هفته در قفس های پلی کربنات نگهداری شده و در طول دوره مداخله هیچگونه فعالیتی نداشتند، 2) گروه کنترل پارکینسون که با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شدند و در طی انجام پروتکل شش هفتهای هیچگونه فعالیتی نداشتند، 3) گروه تمرین تداومی؛ این گروه با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شده و در ادامه به مدت شش هفته به اجرای تمرینات تداومی پرداختند و 4) گروه تمرین تناوبی؛ این گروه نیز با استفاده از روتنون به صورت داخل صفاقی به پارکینسون مبتلا شده و سپس و به مدت شش هفته تمرینات تناوبی را اجرا کردند.
روش القای پارکینسون: بیماری پارکینسون تجربی با تزریق درون صفاقی روتنون در رتها القا گردید. بدین منظور، روزانه دوز دو میلیگرم/ کیلوگرم روتنون و به مدت 28 روز به حیوانات تزریق شد. مقدار تعیین شده روتنون برای هر رت در 200 میکرولیتر روغن زیتون یا آفتابگردان حل و به صورت درون صفاقی تزریق گردید (18).
روش بررسی القای پارکینسون: برای تأیید القای پارکینسون در رتها، از آزمون چرخشی دو هفته پس از تزریق روتنون استفاده گردید. در این آزمون با گرفتن رت از محدوده دو سانتیمتری محل اتصال دم به بدن، بالا آورده شد به طوری که بینی حیوان دو سانتیمتر بالاتر از سطح اتکایش قرار گیرد. در این حالت اگر رت نتواند تعادلش را حفظ و به طرفین چرخش کند به عنوان نشانه پارکینسونی شدن در نظر گرفته شد (19). جهت اطمینان از ابتلا شدن حیوانات به پارکینسون، این آزمون بر روی گروه کنترل سالم نیز اجرا شد و نتایج آن با گروههای بیمار مقایسه گردید.
روش بررسی تعادل: ارزیابی فعالیت تعادلی حیوانات با استفاده از آزمون روتارود (Rotarod) صورت گرفت. ابتدا به هر حیوان دو بار فرصت عادت کردن و تطابق با دستگاه اندازه-گیری داده شد. حیوان روی میله افقی چرخنده به قطر سه سانتیمتر که سرعت حرکت آن متغیر بود، با سرعت اولیه پنج دور در دقیقه قرار گرفت و سپس سرعت چرخش میله طی مدت پنج دقیقه به تدریج تا 25 دور در دقیقه افزایش یافت. معیار اصلی برای تعادل در حیوانات سرعت 25 دور در دقیقه بود. مدت زمان حفظ تعادل و باقیماندن روی میله برای هر حیوان ثبت شد. این آزمون سه بار با فواصل 30 دقیقهای تکرار شد و میانگین آنها برای هر حیوان در نظر گرفته شد (20).
پروتکل تمرین هوازی تناوبی: برنامه تمرین هوازی تناوبی مطابق جدول 1 طی شش هفته و هر هفته پنج جلسه به اجرا درآمد. این پروتکل در هفته اول با سرعت 10 متر در دقیقه و دو نوبت 7:30 دقیقهای انجام گرفت که در هفته ششم به شش نوبت 6:40 دقیقهای با سرعت 20 متر در دقیقه رسید. فواصل استراحتی فعال بین نوبتهای تمرینی به صورت یک به یک چهارم (یعنی به ازاء هر چهار دقیقه تمرین یک دقیقه استراحت فعال) شامل دویدن با سرعت سه متر بر دقیقه بود (21).
پروتکل تمرین هوازی تداومی: برنامه تمرین هوازی تداومی در شش هفته و هر هفته پنج جلسه اجرا گردید (جدول 2). این برنامه در هفته اول با سرعت 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هر هفته دو متر در دقیقه افزایش یافت. به مدت تمرین نیز هر هفته 5 دقیقه افزوده شد بهطوری که از 15 دقیقه در هفته اول به 40 دقیقه در هفته ششم رسید (21).
روش بافتبرداری و اندازهگیری متغیرها: بافتبرداری 48 ساعت پس از آخرین جلسه تمرینی و به دنبال 12 ساعت ناشتایی انجام گرفت. ابتدا، موشها با ترکیب کتامین زایلازین به ترتیب با دوز 100 و 10 میلیگرم بر کیلوگرم بیهوش شدند. سپس، با جدا کردن کل مغز و خارج کردن آن از کاسه جمجمه، بافت مخچه از سایر بخشهای مغز جدا و در یخچال مخصوص با دمای 70- درجه نگهداری شد. در ادامه، بافت مخچه با استفاده از بافر ریپا (RIPA) هموژن شده و پس از هموژنایز و سانتریفیوژ برای اندازهگیری سطح پروتئین¬های مورد نظر آماده گردید. برای تعیین مقدار پروتئینهای IL-1 و TNF-α در بافت مخچه حیوانات از روش برادفورد استفاده شد. بدین منظور مقدار 20 میکرولیتر نمونه هموژن بافتی (نمونه) و 20 میکرولیتر آب مقطر (بلانک) به صورت دو بار تکرار در چاهکهای پلیت 96 خانه اضافه شد. سپس به نمونهها و بلانک مقدار 40 میکرولیتر معرف برادفورد و 140 میکرولیتر آب مقطر اضافه شد و پس از مخلوط نمودن با استفاده از دستگاه پلیت ریدر (Plate Reader) مدل Bioteck ساخت آمریکا جذب نمونهها در طول موج 495 نانومتر مشخص گردید. بهمنظور تعیین غلظت پروتئین در نمونهها از منحنی استاندارد پروتئین سرم آلبومین گاوی با غلظتهای 2، 5، 10، 20، 50 و 100 میکروگرم بر میلیلیتر استفاده شد. پس از رسم منحنی استاندارد تغییرات جذب نمونههای استاندارد در برابر غلظت آنها، فرمول خط استخراج شد و با استفاده از فرمول خط، غلظت نمونههای مجهول محاسبه گردید.
تجزیه و تحلیل آماری
دادهها بر اساس میانگین ± انحراف استاندارد گزارش شد. آزمون شاپیرو- ویلک جهت تعیین طبیعی بودن توزیع دادهها بهکار رفت. برای تجزیه و تحلیل دادههای این پژوهش از آزمون تحلیل واریانس یک طرفه (ANOVA) استفاده گردید. در صورت وجود اختلاف بین گروهها جهت تعیین محل تفاوت آزمون تعقیبی LSD به کار رفت. دادههای گردآوری شده توسط نرم¬افزارversion 16 SPSS در سطح معناداری 0/05>P مورد تجزیه و تحلیل قرار گرفت.
نتایج
در جدول 3 میانگین و انحراف استاندارد وزن بدن و مخچه حیوانات در پایان مداخله آورده شده است. نتایج نشان داد که وزن بدن در گروههای پارکینسون (0/0001=P)، پارکینسون+ تمرین تداومی (0/039=P) و پارکینسون+ تمرین تناوبی (0/001=P) نسبت به گروه کنترل سالم کاهش معناداری داشت. همچنین، در میزان وزن بدن گروه پارکینسون+ تمرین تداومی در مقایسه با کنترل سالم کاهش معناداری دیده شد (0/037=P). بااین وجود، بین میزان وزن مخچه در چهار گروه تفاوت معناداری وجود نداشت (0/768=P).
تحلیل داده ها با آزمون های ANOVA یک طرفه (جدول 4) و تعقیبی LSD نشان داد، میزان پروتئین IL-1 در بافت مخچه گروه کنترل در مقایسه با سایر گروه ها به طور معناداری کمتر بود (0/0001=P). همچنین، میزان پروتئین IL-1 در گروه پارکینسون نسبت به گروههای پارکینسون+ تمرین تداومی (0/0001=P) و پارکینسون+ تمرین تناوبی (0/0001=P) افزایش معناداری را نشان داد. هرچند، بین دو گروه پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی تفاوت معناداری وجود نداشت (0/062=P) (شکل 1).
همچنین، نتایج آزمون ANOVA یک طرفه (جدول 5) و تعقیبی LSD بیانگر کاهش معنادار میزان پروتئین TNF-α در بافت مخچه گروه کنترل نسبت به سایر گروهها بود (0/0001=P). همین طور، میزان پروتئین TNF-α در گروه پارکینسون در مقایسه با گروههای پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P) و در گروه پارکینسون+ تمرین تداومی نسبت به پارکینسون+ تمرین تناوبی افزایش معناداری دیده شد (0/007=P) (شکل 2).
جدول1: پروتکل تمرین هوازی تناوبی

جدول 2: پروتکل تمرین هوازی تداومی

هر دو گروه تمرینی در ابتدای هر جلسه تمرینی به مدت 3 دقیقه با سرعت 1 متر در دقیقه دویدند و سپس برای رسیدن به سرعت مورد نظر به ازای هر دقیقه، 2 متر در دقیقه به سرعت نوارگردان افزوده شد.
جدول 3: میانگین و انحراف معیار وزن بدن و مخچه (گرم) حیوانات در پایان دوره پژوهش

* تغییر معنادار در مقایسه با گروه کنترل سالم (0/039=P)
# تغییر معنادار نسبت به گروه پارکینسون+ تمرین تداومی (0/037=P)
جدول 4: نتایج تحلیل واریانس یکطرفه جهت مقایسه میزان پروتئین IL-1 در بافت مخچه بین گروه¬ها

جدول 5: نتایج تحلیل واریانس یک¬طرفه جهت مقایسه میزان پروتئین TNF-α در بافت مخچه بین گروه¬ها


شکل 1: میزان پروتئین IL-1 در بافت مخچه گروههای مورد بررسی
* افزایش معنادار در مقایسه با گروههای کنترل سالم، پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P)
# افزایش معنادار نسبت به گروه کنترل سالم (0/0001=P)

شکل 2: میزان پروتئین TNF-α در بافت مخچه گروههای مورد بررسی
* افزایش معنادار در مقایسه با گروههای کنترل، پارکینسون+ تمرین تداومی و پارکینسون+ تمرین تناوبی (0/0001=P)
# افزایش معنادار نسبت به گروه کنترل سالم و پارکینسون+ تمرین تناوبی (0/007=P)
ƍ افزایش معنادار نسبت به گروه کنترل سالم (0/0001=P)
بحث
نتایج پژوهش حاضر نشان داد که القای پارکینسون با افزایش معنادار سطح پروتئین IL-1 و TNF-α در بافت مخچه رتها همراه بود. هر دو نوع تمرین تداومی و تناوبی موجب کاهش معنادار پروتئین IL-1 و TNF-α نسبت به گروه پارکینسون شد. هرچند، میزان کاهش TNF-α به دنبال تمرین تناوبی در مقایسه با تمرین تداومی به طور معناداری بیشتر بود. پژوهشهای پیشین نیز همسو با نتایج ما سطوح بالای IL1β، IL-2 و TNFα را در سرم و مایع مغزی نخاعی بیماران پارکینسونی نشان دادهاند (23، 22). در این زمینه گزارش شده است که سطح سرمی IL-6 و هپسیدین (Hepcidin) (هورمونی پپتیدی است که مسئول هموستاز آهن و یک نشانگر التهابی است) در بیماران پارکینسونی در مقایسه با همتایان سالم بهطور معناداری بیشتر بود (24). همچنین، مشاهده فنوتیپ پیش التهابی محیطی و کاهش نسبت لنفوسیت CD4+ به CD8+ در بیماران پارکینسونی نسبت به همتایان سالم، از این ایده حمایت میکند که التهاب سیستمیک مرکزی در تخریب عصبی این بیماری نقش اساسی دارد (25). مشخص شده است که التهاب محیطی از راه سد خونی مغزی یا دستگاه عصبی خودمختار (عصب واگ) بر سطح مغز اثر دارد و میتواند میکروگلیای غیرفعال را به حالت فعال تبدیل کند که منجر به تحریک پاسخهای قوی برای حفظ فرآیندهای عصبی میشود (12). در گروههای مبتلا به پارکینسون در مقایسه با کنترل سالم کاهش وزن بدن دیده شد که ممکن است ناشی از اختلال در عملکرد دستگاه گوارش، رفتارهای خوردن، مشکل در بلعیدن خوراک و افزایش هزینه انرژی باشد (26). کاهش معنادار میزان پروتئینهای IL-1 و TNF-α در بافت مخچه رتها پس از شش هفته تمرین تداومی و تناوبی از دیگر یافتههای پژوهش حاضر بود. گرچه میزان کاهش TNF-α در گروه تمرین تناوبی نسبت به تمرین تداومی بیشتر بود. همسو با این نتایج به دنبال تمرینات تناوبی در دو شدت متوسط و بالا کاهش نشانگرهای التهابی با آزمودنیهای حیوانی (28، 27) و انسانی (29، 16، 1) مبتلا به پارکینسون گزارش شده است. همسو با نتایج ما، گزارش شد که هشت هفته تمرین استقامتی موجب کاهش میزان پروتئینهای IL-1 و TNF-α در جسم مخطط موشهای مدل پارکینسونی شد (27). همچنین، دنبال هشت هفته تمرین هوازی و قدرتی در موشهای پارکینسونی کاهش مشابه و معناداری در میزان IL-1 و TNF-α جسم مخطط گزارش گردید (28). به نظر میرسد، مشابهت طول دوره مداخله، آزمودنیها و پروتکل تمرینی دلیل همسویی نتایج باشد. همینطور، نشان داده شد که 12 هفته تمرین تناوبی شدید با کاهش سطح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی همراه است (1). بهطور مشابهی، گزارش گردید که 12 هفته تمرین تعادلی موجب کاهش سطح سرمی TNF-α و افزایش IL-10 در بیماران پارکینسونی میشود (29). با اینکه در این دو مطالعه نوع آزمودنی و سطح اندازهگیری سایتوکینها متفاوت است، اما نتایج مشابهی به دست آمد. رشیدفرد و همکاران در سال 2024، نیز نشان دادند که شش هفته تمرین تناوبی شدید شنا موجب کاهش معنادار بیان ژن mir-874 (یک نشانگر التهابزا) در هیپوکامپ رتهای پارکینسونی میشود (30). با توجه به نتایج پژوهش حاضر و دیگر مطالعات انجام شده در این زمینه میتوان گفت مداخلههای ورزشی (هوازی تناوبی و تداومی، قدرتی و تعادلی) در کاهش سایتوکینهای پیش التهابی در سطح بافت و گردش خون بیماران پارکینسونی مؤثر است. همینطور، با توجه به کاهش بیشتر TNF-α در گروه تمرین تناوبی در مقایسه با تمرین تداومی، به نظر میرسد که نوع تمرین عاملی مؤثر در تغییر میزان این سایتوکین التهابی است. گرچه، برای اظهار نظر قطعی به مطالعات بیشتری نیاز هست. یافتههای پژوهشی نشان داده است که انقباضهای عضلانی در هنگام فعالیت ورزشی موجب افزایش تولید IL-6 میشود و این مایوکاین تولید سایتوکینهای ضـد التهابی مانند گیرنده مخـالف IL-1 (IL-1ra) و IL-10 را تحریک کرده و هم-چنین سبب مهار تولید سایتوکینهای پیش التهـابی از قبیل TNF-α میشود. گزارش شده است که IL-10 سایتوکاین دارای خاصیت ضـد التهـابی میباشد و نقش بالقوه آن در کاهش التهاب و بهبود و بازسازی بافت نشان داده شده است (31). در واقع، احتمال دارد که کاهش معنادار سطح پروتئین-های IL-1 و TNF-α در بافت مخچه رتها در اثر نقش مهارکنندگی IL-6 بوده باشد. گرچه، این فرضیه برای تأیید نیاز به مطالعات بیشتری دارد. در پژوهش حاضر سطح IL-6 اندازهگیری نشد و از جمله محدودیتهای آن به شمار میرود. در مقابل و بر خلاف نتایج ما، پس از هشت هفته تمرین تنـاوبی شدید تغییری معناداری در سطح IL-6 و TNF-α سرمی بیماران پارکینسونی دیده نشد. گـرچه در این مطالعه افزایش نسبت IL-10 به TNF-α گزارش گردید، که نشان میدهد تمرین تناوبی قادر به ایجاد محیطی ضد التهابی در سطح سرمی بیماران پارکینسونی است. از نتایج این مطالعه، چنین برداشت میشود که جهت درک جامعی از آثار تمرینات ورزشی بر محیط التهابی آزمودنیها بایستی تغییرات نشانگرهای با خاصیت التهابزا و ضد التهابی ارزیابی گردد (17). تفاوت در نوع اندازهگیری سایتوکینها و آزمودنیها ممکن است دلیل تناقض نتایج ما با پژوهش ذکر شده باشد.
نتیجهگیری
نتایج به دست آمده در این پژوهش نشانگر کاهش میزان سایتوکینهای پیش التهابی (IL-1 و TNF-α) مخچه پس از شش هفته تمرین تناوبی و تداومی در رتهای مدل پارکینسونی بود. گرچه، تأثیر تمرین هوازی تناوبی در مقایسه با تداومی بیشتر بود. بنابراین، میتوان گفت که نوع تمرین هوازی در تعدیل التهاب در بافت مخچه رتهای پارکینسونی اثرگذار است. طبق این نتایج، اجرای تمرینات هوازی میتواند مداخله غیردارویی مؤثری جهت کندکردن روند پیشرفت و کاهش عوارض بیماریهای تخریب کننده عصبی باشد که التهاب در پاتوژنز آنها نقش اساسی دارد. هرچند، برای نتیجهگیری دقیقتر به پژوهشهای بیشتری در این زمینه نیاز است.
سپاسگزاری
مقاله حاضر بخشی از پایاننامه دانشجویی میباشد. از همه کسانی که ما را در اجرای این پژوهش پشتیبانی کردند، تشکر و قدردانی مینماییم.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در این پژوهش همه موازین اخلاقی در مورد کار با حیوانات آزمایشگاهی طبق بیانیه هلسینکی رعایت شده و با شناسه IR.IAU.ILAM.REC.1403.072 به تأیید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد ایلام رسیده است.
مشارکت نویسندگان
همه نویسندگان در ارائه ایده، طراحی مطالعه، جمع¬آوری داده¬ها و تجزیه و تحلیل دادهها بهطور یکسان مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سئوالات مرتبط با مقاله سهیم هستند.
References:
1- Malczynska-Sims P, Chalimoniuk M, Wronski Z, Marusiak J, Sulek A. High-Intensity Interval Training Modulates Inflammatory Response in Parkinson's Disease. Aging Clin Exp Res 2022; 34(9): 2165-76.
2- Bloem BR, Okun MS, Klein C. Parkinson's Disease. Lancet. 2021; 397(10291): 2284-303.
3- Lahue SC, Comella CL, Tanner CM. The Best Medicine? The Influence of Physical Activity and Inactivity on Parkinson’s Disease. Mov Disord 2016; 31(10): 1444-54.
4- Reuter I, Mehnert S, Leone P, Kaps M, Oechsner M, Engelhardt M. Effects of a Flexibility and Relaxation Programme, Walking, and Nordic Walking on Parkinson's Disease. J Aging Res 2011; 2: 232-73.
5- Mcginley JL, Nakayama Y. Exercise for People with Parkinson's Disease: Updates and Future Considerations. Phys Ther Res 2024; 27(2): 67-75.
6- Ye H, Robak LA, Yu M, Cykowski M, Shulman JM. Genetics and Pathogenesis of Parkinson's Syndrome. Annu Rev Pathol 2023; 18: 95-121.
7- Wang Q, Liu Y, Zhou J. Neuroinflammation in Parkinson's Disease and Its Potential as Therapeutic Target. Transl Neurodegener 2015; 4:19.
8- Calabrese V, Santoro A, Monti D, Crupi R, Di Paola R, Latteri S, et al. Aging and Parkinson's Disease: Inflammaging, Neuroinflammation and Biological Remodeling as Key Factors in Pathogenesis. Free Radic Biol Med 2018; 115: 80-91.
9- Tang Y, Le W. Differential Roles of M1 and M2 Microglia in Neurodegenerative Diseases. Mol Neurobiol 2016; 53(2): 1181-94.
10- Shabab T, Khanabdali R, Moghadamtousi SZ, Kadir HA, Mohan G. Neuroinflammation Pathways: A General Review. Int J Neurosci 2017; 127(7): 624-33.
11- Ohlin KE, Sebastianutto I, Adkins CE, Lundblad C, Lockman PR, Cenci MA. Impact of L-DOPA Treatment on Regional Cerebral Blood Flow and Metabolism in the Basal Ganglia in a Rat Model of Parkinson's Disease. Neuroimage 2012; 61(1): 228-39.
12- De Almeida EJR, Ibrahim HJ, Chitolina Schetinger MR, De Andrade CM, Cardoso AM. Modulation of Inflammatory Mediators and Microglial Activation through Physical Exercise in Alzheimer's and Parkinson's Diseases. Neurochem Res 2022; 47(11): 3221-40.
13- O'Callaghan A, Harvey M, Houghton D, Gray WK, Weston KL, Oates LL, et al. Comparing the Influence of Exercise Intensity on Brain-Derived Neurotrophic Factor Serum Levels in People with Parkinson's Disease: A Pilot Study. Aging Clin Exp Res 2020; 32(9): 1731-38.
14- Martignon C, Pedrinolla A, Ruzzante F, Giuriato G, Laginestra FG, Bouça-Machado R, et al. Guidelines on Exercise Testing and Prescription for Patients at Different Stages of Parkinson's Disease. Aging Clin Exp Res 2021; 33(2): 221-46.
15- Małczyńska-Sims P, Chalimoniuk M, Sułek A. The Effect of Endurance Training on Brain-Derived Neurotrophic Factor and Inflammatory Markers in Healthy People and Parkinson's Disease. Narrat Rev Front Physiol 2020; 11: 578981.
16- Koo JH, Jang YC, Hwang DJ, Um HS, Lee NH, Jung JH, et al. Treadmill Exercise Produces Neuroprotective Effects in a Murine Model of Parkinson's Disease by Regulating the TLR2/Myd88/NF-Κb Signaling Pathway. Neuroscience 2017; 356: 102-13.
17- Landers MR, Navalta JW, Murtishaw AS, Kinney JW, Pirio Richardson S. A High-Intensity Exercise Boot Camp for Persons with Parkinson Disease: A Phase II, Pragmatic, Randomized Clinical Trial of Feasibility, Safety, Signal of Efficacy, and Disease Mechanisms. J Neurol Phys Ther 2019; 43(1): 12-25.
18- Zhang ZN, Zhang JS, Xiang J, Yu ZH, Zhang W, Cai M, et al. Subcutaneous Rotenone Rat Model of Parkinson's Disease: Dose Exploration Study. Brain Res 2017; 1655: 104-13.
19- Hubrecht R, Kirkwood J. UFAW Handbook on the Care and Management of Laboratory and Other Research Animals. 8th Ed. John Wiley & Sons; 2010: 276-310.
20- Razavinasab M, Shamsizadeh A, Shabani M, Nazeri M, Allahtavakoli M, Asadi-Shekaari M, et al. Pharmacological Blockade of TRPV1 Receptors Modulates the Effects of 6-OHDA on Motor and Cognitive Functions in aRat Model of Parkinson's Disease. Fundam Clin Pharmacol 2013; 27(6): 632-40.
21- Moradi S, Habibi AH, Tabande MR, Shakerian S. Comparison of Nitric Oxide Changes in Hippocampal Tissue and Pain Sensation in Male Rats Parkinson's Model Following 6 Weeks of Continuous and Intermittent Training. JSSU Med Sci 2020; 28(3): 2502-14. [Persian]
22- Brodacki B, Staszewski J, Toczyłowska B, Kozłowska E, Drela N, Chalimoniuk M, et al. Serum Interleukin (IL-2, IL-10, IL-6, IL-4), Tnfalpha, and Infgamma Concentrations are Elevated in Patients with Atypical and Idiopathic Parkinsonism. Neurosci Lett 2008; 441(2): 158-62.
23- Diaz K, Kohut ML, Russell DW, Stegemöller EL. Peripheral Inflammatory Cytokines and Motor Symptoms in Persons with Parkinson's Disease. Brain Behav Immun Health 2022; 21: 100442.
24- Kwiatek-Majkusiak J, Geremek M, Koziorowski D, Tomasiuk R, Szlufik S, et al. Serum Levels of Hepcidin and Interleukin-6 in Parkinson's Disease. Acta Neurobiol Exp 2020; 80(3): 297-304.
25- Hu Y, Zhang K, Zhang T, Wang J, Chen F, Qin W, et al. Exercise Reverses Dysregulation of T-Cell Related Function in Blood Leukocytes of Patients with Parkinson’s Disease. Front Neurol 2019; 10: 1389.
26- Eisinger RS, Okun MS, Cernera S, Cagle J, Beke M, Ramirez-Zamora A, et al. Weight and Survival After Deep Brain Stimulation for Parkinson's Disease. Parkinsonism Relat Disord 2023; 115: 105810.
27- Jang Y, Koo JH, Kwon I, Kang EB, Um HS, Soya H, et al. Neuroprotective Effects of Endurance Exercise Against Neuroinflammation in MPTP-Induced Parkinson's Disease Mice. Brain Res 2017; 1655: 186-93.
28- Tuon T, Souza PS, Santos MF, Pereira FT, Pedroso GS, Luciano TF, et al. Physical Training Regulates Mitochondrial Parameters and Neuroinflammatory Mechanisms in an Experimental Model of Parkinson's Disease. Oxid Med Cell Longev 2015; 2015: 261809.
29- Szymura J, Kubica J, Wiecek M, Pera J. The Immunomodulary Effects of Systematic Exercise in Older Adults and People with Parkinson's Disease. J Clin Med 2020; 9(1): 184.
30- Rashidfard S, Moghadasi M, Edalatmanesh MA, Hojati S. The Effect of High Intensity Interval Swimming on DJ-1 and Mir-874 Gene Expression of Hippocampal Cells in Rats with Parkinson’s Disease. J Appl Health Stud Sport Physiol 2024; 11(1): 251-60. [Persian]
31- Porro C, Cianciulli A, Panaro MA. The Regulatory Role of IL-10 in neurodegenerative diseases. Biomolecules 2020; 10(7): 1017.
1- Malczynska-Sims P, Chalimoniuk M, Wronski Z, Marusiak J, Sulek A. High-Intensity Interval Training Modulates Inflammatory Response in Parkinson's Disease. Aging Clin Exp Res 2022; 34(9): 2165-76.
2- Bloem BR, Okun MS, Klein C. Parkinson's Disease. Lancet. 2021; 397(10291): 2284-303.
3- Lahue SC, Comella CL, Tanner CM. The Best Medicine? The Influence of Physical Activity and Inactivity on Parkinson’s Disease. Mov Disord 2016; 31(10): 1444-54.
4- Reuter I, Mehnert S, Leone P, Kaps M, Oechsner M, Engelhardt M. Effects of a Flexibility and Relaxation Programme, Walking, and Nordic Walking on Parkinson's Disease. J Aging Res 2011; 2: 232-73.
5- Mcginley JL, Nakayama Y. Exercise for People with Parkinson's Disease: Updates and Future Considerations. Phys Ther Res 2024; 27(2): 67-75.
6- Ye H, Robak LA, Yu M, Cykowski M, Shulman JM. Genetics and Pathogenesis of Parkinson's Syndrome. Annu Rev Pathol 2023; 18: 95-121.
7- Wang Q, Liu Y, Zhou J. Neuroinflammation in Parkinson's Disease and Its Potential as Therapeutic Target. Transl Neurodegener 2015; 4:19.
8- Calabrese V, Santoro A, Monti D, Crupi R, Di Paola R, Latteri S, et al. Aging and Parkinson's Disease: Inflammaging, Neuroinflammation and Biological Remodeling as Key Factors in Pathogenesis. Free Radic Biol Med 2018; 115: 80-91.
9- Tang Y, Le W. Differential Roles of M1 and M2 Microglia in Neurodegenerative Diseases. Mol Neurobiol 2016; 53(2): 1181-94.
10- Shabab T, Khanabdali R, Moghadamtousi SZ, Kadir HA, Mohan G. Neuroinflammation Pathways: A General Review. Int J Neurosci 2017; 127(7): 624-33.
11- Ohlin KE, Sebastianutto I, Adkins CE, Lundblad C, Lockman PR, Cenci MA. Impact of L-DOPA Treatment on Regional Cerebral Blood Flow and Metabolism in the Basal Ganglia in a Rat Model of Parkinson's Disease. Neuroimage 2012; 61(1): 228-39.
12- De Almeida EJR, Ibrahim HJ, Chitolina Schetinger MR, De Andrade CM, Cardoso AM. Modulation of Inflammatory Mediators and Microglial Activation through Physical Exercise in Alzheimer's and Parkinson's Diseases. Neurochem Res 2022; 47(11): 3221-40.
13- O'Callaghan A, Harvey M, Houghton D, Gray WK, Weston KL, Oates LL, et al. Comparing the Influence of Exercise Intensity on Brain-Derived Neurotrophic Factor Serum Levels in People with Parkinson's Disease: A Pilot Study. Aging Clin Exp Res 2020; 32(9): 1731-38.
14- Martignon C, Pedrinolla A, Ruzzante F, Giuriato G, Laginestra FG, Bouça-Machado R, et al. Guidelines on Exercise Testing and Prescription for Patients at Different Stages of Parkinson's Disease. Aging Clin Exp Res 2021; 33(2): 221-46.
15- Małczyńska-Sims P, Chalimoniuk M, Sułek A. The Effect of Endurance Training on Brain-Derived Neurotrophic Factor and Inflammatory Markers in Healthy People and Parkinson's Disease. Narrat Rev Front Physiol 2020; 11: 578981.
16- Koo JH, Jang YC, Hwang DJ, Um HS, Lee NH, Jung JH, et al. Treadmill Exercise Produces Neuroprotective Effects in a Murine Model of Parkinson's Disease by Regulating the TLR2/Myd88/NF-Κb Signaling Pathway. Neuroscience 2017; 356: 102-13.
17- Landers MR, Navalta JW, Murtishaw AS, Kinney JW, Pirio Richardson S. A High-Intensity Exercise Boot Camp for Persons with Parkinson Disease: A Phase II, Pragmatic, Randomized Clinical Trial of Feasibility, Safety, Signal of Efficacy, and Disease Mechanisms. J Neurol Phys Ther 2019; 43(1): 12-25.
18- Zhang ZN, Zhang JS, Xiang J, Yu ZH, Zhang W, Cai M, et al. Subcutaneous Rotenone Rat Model of Parkinson's Disease: Dose Exploration Study. Brain Res 2017; 1655: 104-13.
19- Hubrecht R, Kirkwood J. UFAW Handbook on the Care and Management of Laboratory and Other Research Animals. 8th Ed. John Wiley & Sons; 2010: 276-310.
20- Razavinasab M, Shamsizadeh A, Shabani M, Nazeri M, Allahtavakoli M, Asadi-Shekaari M, et al. Pharmacological Blockade of TRPV1 Receptors Modulates the Effects of 6-OHDA on Motor and Cognitive Functions in aRat Model of Parkinson's Disease. Fundam Clin Pharmacol 2013; 27(6): 632-40.
21- Moradi S, Habibi AH, Tabande MR, Shakerian S. Comparison of Nitric Oxide Changes in Hippocampal Tissue and Pain Sensation in Male Rats Parkinson's Model Following 6 Weeks of Continuous and Intermittent Training. JSSU Med Sci 2020; 28(3): 2502-14. [Persian]
22- Brodacki B, Staszewski J, Toczyłowska B, Kozłowska E, Drela N, Chalimoniuk M, et al. Serum Interleukin (IL-2, IL-10, IL-6, IL-4), Tnfalpha, and Infgamma Concentrations are Elevated in Patients with Atypical and Idiopathic Parkinsonism. Neurosci Lett 2008; 441(2): 158-62.
23- Diaz K, Kohut ML, Russell DW, Stegemöller EL. Peripheral Inflammatory Cytokines and Motor Symptoms in Persons with Parkinson's Disease. Brain Behav Immun Health 2022; 21: 100442.
24- Kwiatek-Majkusiak J, Geremek M, Koziorowski D, Tomasiuk R, Szlufik S, et al. Serum Levels of Hepcidin and Interleukin-6 in Parkinson's Disease. Acta Neurobiol Exp 2020; 80(3): 297-304.
25- Hu Y, Zhang K, Zhang T, Wang J, Chen F, Qin W, et al. Exercise Reverses Dysregulation of T-Cell Related Function in Blood Leukocytes of Patients with Parkinson’s Disease. Front Neurol 2019; 10: 1389.
26- Eisinger RS, Okun MS, Cernera S, Cagle J, Beke M, Ramirez-Zamora A, et al. Weight and Survival After Deep Brain Stimulation for Parkinson's Disease. Parkinsonism Relat Disord 2023; 115: 105810.
27- Jang Y, Koo JH, Kwon I, Kang EB, Um HS, Soya H, et al. Neuroprotective Effects of Endurance Exercise Against Neuroinflammation in MPTP-Induced Parkinson's Disease Mice. Brain Res 2017; 1655: 186-93.
28- Tuon T, Souza PS, Santos MF, Pereira FT, Pedroso GS, Luciano TF, et al. Physical Training Regulates Mitochondrial Parameters and Neuroinflammatory Mechanisms in an Experimental Model of Parkinson's Disease. Oxid Med Cell Longev 2015; 2015: 261809.
29- Szymura J, Kubica J, Wiecek M, Pera J. The Immunomodulary Effects of Systematic Exercise in Older Adults and People with Parkinson's Disease. J Clin Med 2020; 9(1): 184.
30- Rashidfard S, Moghadasi M, Edalatmanesh MA, Hojati S. The Effect of High Intensity Interval Swimming on DJ-1 and Mir-874 Gene Expression of Hippocampal Cells in Rats with Parkinson’s Disease. J Appl Health Stud Sport Physiol 2024; 11(1): 251-60. [Persian]
31- Porro C, Cianciulli A, Panaro MA. The Regulatory Role of IL-10 in neurodegenerative diseases. Biomolecules 2020; 10(7): 1017.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/6/28 | پذیرش: 1403/9/4 | انتشار: 1403/11/15
دریافت: 1403/6/28 | پذیرش: 1403/9/4 | انتشار: 1403/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







