دوره 31، شماره 12 - ( اسفند 1402 )
جلد 31 شماره 12 صفحات 7335-7321 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Moradi M, Hamedani S. Modeling the Interaction between the Isoniazid Anti-Tuberculosis Drug and Functionalized Carbon Nanotubes for Medical Applications: A Quantum Chemical Study. JSSU 2024; 31 (12) :7321-7335
URL: http://jssu.ssu.ac.ir/article-1-6138-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6138-fa.html
مرادی محدثه، همدانی شهلا. مدلسازی برهمکنش بین داروی ضد سل ایزونیازید و نانولولههای کربنی عاملدار برای کاربردهای پزشکی: یک مطالعه شیمیایی کوانتومی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (12) :7321-7335
متن کامل [PDF 1342 kb]
(543 دریافت)
| چکیده (HTML) (1245 مشاهده)
References:
1- Bhushan B. Springer handbook of nanotechnology: Springer; 2017.
2- Khan DR. The Use of Nanocarriers for Drug Delivery in Cancer Therapy. J Cancer Sci Ther 2010; 2(3): 58-62.
3- Hughes G A. Nanostructure-Mediated Drug Delivery. Nanomedicine in Cancer 2017; 1: 47-72.
4- Kim J, Conway A, Chauhan A. Extended Delivery of Ophthalmic Drugs by Silicone Hydrogel Contact Lenses. Biomaterials 2008; 29(14): 2259-69.
5- Aminu N, Bello I, Umar NM, Tanko N, Aminu A, Audu MM. The Influence Of Nanoparticulate Drug Delivery Systems In Drug Therapy. J Drug Deliv Sci Technol 2020; 60:101961.
6- Goldberg M, Langer R, Jia X. Nanostructured Materials for Applications in Drug Delivery and Tissue Engineering. Biomater Sci 2007; 18(3): 241-68.
7- Foldvari M, Bagonluri M. Carbon Nanotubes as Functional Excipients for Nanomedicines: II. Drug Delivery and Biocompatibility Issues. Nanomedicine: NBM 2008; 4(3): 183-200.
8- Jena SK, Chakraverty S, Malikan M, Tornabene F. Effects of Surface Energy and Surface Residual Stresses on Vibrothermal Analysis of Chiral, Zigzag, and Armchair Types of Swcnts Using Refined Beam Theory. Mech Based Des Struct 2022; 50(5): 1565-79.
9- Francis AP, Devasena T. Toxicity of Carbon Nanotubes: A Review. Toxicol Ind Health 2018; 34: 200-10.
10- Mahajan S, Patharkar A, Kuche K, Maheshwari R, Deb PK, Kalia K, et al. Functionalized Carbon Nanotubes as Emerging Delivery System for the Treatment of Cancer. Int J Pharm 2018; 548(1): 540-58.
11- He H, Pham-Huy LA, Dramou P, Xiao D, Zuo P, Pham-Huy C. Carbon Nanotubes: Applications in Pharmacy and Medicine. Biomed Res Int 2013; 2013: 578290.
12- Al-Qattan MN, Deb PK, Tekade RK. Molecular Dynamics Simulation Strategies for Designing Carbonnanotube- Based Targeted Drug Delivery. Drug Discov Today 2018 ;23(2): 235-50.
13- Wang P, Pradhan K, Zhong XB, Ma X. Isoniazid Metabolism and Hepatotoxicity. Acta Pharm Sin B 2016; 6(5): 384-92.
14- Li M, Wei Y, Zhang G, Wang F, Li M, Soleymanabadi H. A DFT Study on the Detection of Isoniazid Drug by Pristine, Si and Al Doped C70 Fullerenes. Physica E Low Dimens Syst Nanostruct 2020; 118: 113878.
15- Rezaei-Sameti M, Moradi F. Interaction of Isoniazid Drug with the Pristine and Ni-Doped of (4, 4) Armchair Gannts: A First Principle Study. J Incl Phenom Macrocycl Chem. 2017; 88: 209-18.
16- Zarei Z, Emami A, Moghadami M, Kashkooli GS, Pirbonyeh N. Molecular Characterization of Isoniazid and Rifampicin Target Genes in Multi-Drug Resistant Mycobacterium Tuberculosis Isolates from Southwest of Iran. Gene Rep 2017; 6: 19-25.
17- Vemula SL, Gupta MT. Isoniazid Nano-Drug Delivery Systems Targeting Macrophages for the Treatment of Tuberculosis. Journal of Preventive, Diagnostic and Treatment Strategies in Medicine 2022; 1(2): 96-104.
18- Frisch A, Nielsen AB, Holder AJ, Gauss View Users Manual; Gaussian Inc, 2000.
19- Frisch MJ, Trucks GW, Schlegel HB, Scuseria GE, Robb MA, Cheeseman JR, Scalmani G, Barone V, Mennucci B, Petersson GA, et al. Gaussian 09, Revision A.01. Gaussian, Inc.; Wallingford, CT, USA: 2009.
20- Konig FB, Schonbohm J, Bayles D. AIM 2000-A Program to Analyze and Visualize Atoms in Molecules. J Comput Chem 2001; 22: 545-59.
21- Hamedani Sh, Hamedani E. Boron Nitride Nanotubes as Novel Vectors for Drug Delivery of Amino Acids: A First Principles Simulation. CHINESE J STRUC CHEM 2017; 36(9): 1562-7.
22- Rozas I, Alkorta I, Elguero J. Behavior of Ylides Containing N, O, and C Atoms as Hydrogen Bond Acceptors. J Am Chem Soc 2000; 122(45): 11154-61.
23- Popelier PL. Quantum Molecular Similarity. 1. BCP Space. J Phys Chem A 1999; 103(15): 2883-90.Ahmed SA, Rahman AA, Elsayed KN, Abd El-Mageed HR, Mohamed HS, Ahmed SA. Cytotoxic Activity, Molecular Docking, Pharmacokinetic Properties and Quantum Mechanics Calculations of the Brown Macroalga Cystoseira Trinodis Compounds. J Biomol Struct Dyn 2021; 39(11): 3855-73.
24- Shadi M, Hamedani Sh. A DFT Approach to the Adsorption of the Levodopa Anti-Neurodegenerative Drug on Pristine and Al-Doped Boron Nitride Nanotubes as a Drug Delivery Vehicle. Struct Chem 2023; 34(3): 905-14.
25- Abd El-Mageed HR, Taha M. Exploring the Intermolecular Interaction of Serine and Threonine Dipeptides with Gold Nanoclusters and Nanoparticles of Different Shapes and Sizes By Quantum Mechanics and Molecular Simulations. J Mol Liq 2019; 296: 111903.
26- El-Mageed HA, Mustafa F, Abdel-Latif MK. Boron Nitride Nanoclusters, Nanoparticles and Nanotubes as a Drug Carrier for Isoniazid Anti-Tuberculosis Drug, Computational Chemistry Approaches. J Biomol Struct Dyn 2022; 40(1): 226-35.
27- Wang Q, Zhang P, Ansari MJ, Aldawsari MF, Alalaiwe AS, Kaur J, et al. Electrostatic Interaction Assisted Ca-Decorated C20 Fullerene Loaded to Anti-Inflammatory Drugs to Manage Cardiovascular Disease Risk in Rheumatoid Arthritis Patients. J Mol Liq 2022; 350: 118564.
28- Felegari Z, Hamedani Sh. Adsorption Properties and Quantum Molecular Descriptors of the Anticancer Drug Cytophosphane on the Armchair Single-Walled Carbon Nanotubes: A DFT Study. Lett Org Chem 2022; 19(11): 1034-41.
29- Pearson RG. The Principle of Maximum Hardness. Acc Chem Res 1993; 26(5): 250-5.
30- Cao Y, Khan A, Mirzaei H, Khandoozi SR, Javan M, Lup AN, et al. Investigations of Adsorption Behavior and Anti-Cancer Activity of Curcumin on Pure and Platinum-Functionalized B12N12 Nanocages. J Mol Liq 2021; 334: 116516.
31- Karimzadeh S, Safaei B, Jen T-C. Theorical investigation of adsorption mechanism of doxorubicin anticancer drug on the pristine and functionalized single-walled carbon nanotube surface as a drug delivery vehicle: A DFT study. J. Mol. Liq 2021; 322:114890.
32- Sheikhpour M, Delorme V, Kasaeian A, Amiri V, Masoumi M, Sadeghinia M, et al. An Effective Nano Drug Delivery and Combination Therapy for the Treatment of Tuberculosis. Sci. Rep 2022; 12(1): 9591.
33- Zomorodbakhsh S, Abbasian Y, Naghinejad M, Sheikhpour M. The Effects Study of Isoniazid Conjugated Multi-Wall Carbon Nanotubes Nanofluid on Mycobacterium Tuberculosis. Int J Nanomedicine 2020; 15: 5901-9.
34- Mirali M, Jafariazar Z, Mirzaei M. Loading Tacrine Alzheimer's Drug at the Carbon Nanotube: DFT Approach. Lab-in-Silico 2021; 2(1): 3-8.
35- Ravaei I, Haghighat M, Azami SM. A DFT, AIM and NBO Study of Isoniazid Drug Delivery by Mgo Nanocage. Appl Surf Sci 2019; 469: 103-12.
36- Gnatyuk OP, Dovbeshko GI, Yershov A, Karakhim SO, Ilchenko O, Posudievsky OY. 2D-BN Nanoparticles as a Spectroscopic Marker and Drug Delivery System with Protection Properties. RSC advances 2018; 8(53): 30404-11.
متن کامل: (894 مشاهده)
مقدمه
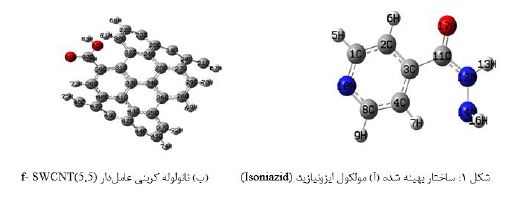
نانوفناوری پزشکی بررسی روش هایی به منظور تشخیص، پیشگیری و یا درمان بیماری ها از طریق ترمیم بافتهای آسیب دیده در سطوح مولکولی است. در حالت کلی فراتر از آسان شدن استفاده بهینه از دارو، نانوفناوری میتواند فرمولاسیون و مسیرهایی برای رسانش دارو فراهم کند که منجر به تولید داروهایی اختصاصیتر با اثر بخشی بیشتر و عارضههای جانبی کمتر شود (3-1). اصلیترین مزیت سامانه های رهایش دارو، افزایش اثرات درمانی دارو بدون القاء عوارض جانبی بر روی اندامک ها، بافتها و سلولهای سالم می باشد. در حال حاضر سیستمهای دارورسانی مبتنی بر حاملهای نانویی در سیستمها توزیع دارو موجود بوده و استفاده از آن ها در دارورسانی روز به روز در حال افزایش است (5,4). یکی از جدیدترین و پیشرفتهترین انواع سیستم های رهایش دارو، سیستمهایی است که از نانوحاملهای کربنی در طراحی آنها استفاده شده است. از مزایای کاربرد نانوحاملهای کربنی در سیستمهای دارورسانی، میتوان افزایش نفوذ دارو در سلولهای هدف، افزایش حلالیت دارو، کاهش نوسانات، حفظ غلظت دارو برای مدت مشخص، تنظیم سرعت رهایش دارو را نام برد (6). علی رغم مزایای ذکر شده در خصوص نانولولههای کربنی برای انتقال هدفمند دارو، مانند دارا بودن نسبت سطح به حجم بالا، زیستسازگاری بالا، جذب سریع مولکولی، اثربخشی بیشتر و .....، مواردی مانند سمیت مربوط به کاربردهای زیست پزشکی آنها امروزه بحث برانگیز است (7). یکی از راههایی که برای کاهش سمیت نانولولههای کربنی پیشنهاد شده، استفاده از پوشش بر روی سطح نانولولهها با تکنیک عاملدار کردن میباشد. تحقیقات انجام شده نشان میدهد که قرار گرفتن در معرض نانولولههای کربنی بهطور قابلتوجهی باعث کاهش میزان تکثیر سلولها شده و با تاثیر بر چرخه سلولی، منجر به آپوپتوز میشود. سطوح جانبی نانولولهها بسیار آبگریز میباشد، اتصال گروههای عاملی با کاهش هیدروفوبیسیته سطحی و محلول ساختن نانولولههای کربنی سبب کاهش سمیت و آسیبرسانی به سلولهای موجودات زنده میشود (12-8). بهطور کلی، نانولولههای کربنیهای عاملدار دارای توانایی حمل مولکولهای مورد نظر، در سراسر غشای سیتوپلاسمی و غشای هستهای بدون ایجاد اثر سمی هستند. پس از رسیدن به سلول هدف، دو امکان برای تحویل دارو وجود دارد: دارو بدون ورود نانولوله وارد سلولها میشود یا دارو و نانولوله هر دو وارد سلولها میشوند. روش دوم مؤثرتر از روش اول است، زیرا پس از ورود به سلولها، محیط درون سلولی کمپلکس دارو-نانولوله کربنی ((Carbon Nanotube, CNT، را تخریب میکند و مولکولهای دارو را داخل سلولها آزاد میکند، در حالیکه در روش اول، محیط خارج سلولی به تجزیه کونژوگههای حامل دارو کمک میکند و دارو پس از عبور از غشای لیپیدی وارد سلولها میشود، در نتیجه امکان تجزیه دارو در طی این نفوذ به خودی خود وجود دارد. از آنجا که رسانش دارو توسط نانوحاملها باعث تشدید اثر زیستی آن میشود، در نتیجه بررسی نظری فرایند جذب دارو برای کنترل رسانش و بهینهسازی نانودارو موثر میباشد. در این پژوهش برهم کنش داروی درمانی بیماری سل، ایزونیازید با نانو لوله کربنی تک دیواره شکل صندلی (5,5) عاملدار شده با گروه کربوکسیل(functionalized SWCNT by carboxyl functional group) مطالعه شد. باسیل سل (Tuberculosis, TB) یکی از شایعترین و کشندهترین بیماریهای عفونی است که توسط مایکوباکتریوم توبرکلوزیس (Mycobacterium tuberculosis) ایجاد می شود (13). مایکوباکتریوم توبرکلوزیس با سایر باکتریها متفاوت است زیرا به جای هر20 تا 40 دقیقه، مانند برخی باکتریهای دیگر، هر 24 ساعت یک بار به آرامی تکثیر مییابد. یکی از ویژگیهای اصلی مایکوباکتریوم توبرکلوزیس ساختار دیواره سلولی منحصر به فرد آن است که یک سد غیرقابل نفوذ در برابر ترکیبات و داروها ایجاد میکند. ایزونیکوتینیک هیدرازید و اتامبوتول، دو تا از موثرترین داروهای ضد سل، به ترتیب سنتز اسیدهای مایکولیک و آرابینوگالاکتان را هدف قرار میدهند و اهمیت دیواره سلولی مایکوباکتری را در بیولوژی M.tuberculosis برجسته میکنند. مقاومت دارویی یک مشکل رایج در طول درمان طولانیمدت است که باعث شکست درمان میشود و منجر به بیماری پیشرونده میشود. تحویل داروی ایزونیازید بهطور مستقیم به محل موردنظر با استفاده از نانوحاملهای خاص ممکن است یک استراتژی بالقوه برای کاهش عوارض جانبی و همچنین سمیت آن باشد. علیرغم استفاده گسترده و اثرات کارآمد ایزونیازید در درمان سل، عوارض جانبی شدیدی مانند نوروپاتی محیطی و سمیت کبدی ایجاد کند که دوزهای قابل استفاده بالینی را محدود میکند، بنابراین، میتواند کارایی درمانی را افزایش داده و سمیت دارو را کاهش دهد. از سوی دیگر، هنگامیکه باکتریها با آنتیبیوتیک درمان میشوند، مقاومت دارویی افزایش مییابد و غلظتهای بالاتر آنتیبیوتیک برای اثرگذاری بر باکتری مورد نیاز است. از این رو، سیستمی که تحویل دوزهای بالای دارو به محلهای باکتری را تسهیل کند، بسیار مطلوب است. ایزونیکوتینیک هیدرازید
(Iso Nicotinic Hydrazide, INH) که با نام ایزونیازید شناخته می شود، یک ترکیب آلی و اولین دارو در پیشگیری و درمان سل است و دارای اثربخشی بالا و اثر ضد باکتری قوی است. مکانیسم عمل ایزونیازید شامل مهار تولید مایکولیک اسید می باشد که یک بخش اساسی و ضروری در دیواره سلولی مایکوباکتر است. در صورت مصرف این دارو به تنهایی، مقاومت به سرعت رخ میدهد. مقاومت در سطح بالا در ارتباط با حذف ژن katG است که کد کننده آنزیم کاتالازپراکسیداز است، آنزیمی که در فعالسازی ایزونیازید دخالت دارد. ایزونیازید به خودی خود برای سلول باکتری سمی نیست، اما به عنوان یک پیش دارو عمل می کند و توسط آنزیم مایکوباکتریال KatG فعال میشود (16-14). در درمان با آنتیبیوتیک، مقاومت باکتری نسبت به دارو افزایش مییابد و غلظتهای بیشتری از آنتیبیوتیک برای تاثیر بر روی باکتریها مورد نیاز است. از اینرو، سیستمی که امکان رساندن دوزهای بالای دارو را فراهم نمایند بسیار مطلوب است. پزشکی نانو دارای پتانسیل قابلتوجهی برای پیشرفت در زمینه تشخیص، درمان و پیشگیری از بیماریهای عفونی است. همراه با استفاده از فناوری نانو، تحویل دارو های آب دوست و آب گریز، دارورسانی داخل سلولی ماکرومولکولها و رساندن هدفمند داروها به سلولها یا بافتهای خاص بدن انسان امکانپذیر شده است. سیستمهای دارورسانی قادرند مقدار نسبتاً زیادی از مولکولهای دارو را بدون مشکل رهاسازی زودهنگام تحویل دهند و عوارض جانبی و همچنین سمیت دارو را کاهش داده و اثربخشی درمان را افزایش دهند (17). از طرفی روش تئوری تابعیت چگال که به عنوان یکی از روشهای محاسباتی برای همبستگی الکترونی توسعه یافته است، یک ابزار تحقیقاتی ارزشمند است که میتواند در تایید نتایج حاصل از آنالیز آزمایشات یا تمایز بین احتمالاتی که ناتمام مانده اند، موثر باشد. این پژوهش، با استفاده از روش تئوری تابعیت چگال امکان استفاده از نانو لوله کربنی تک دیواره صندلی عاملدار با گروه کربوکسیل را به عنوان حامل داروی ایزونیازید مورد بررسی قرار میدهد. همچنین بررسی اثر جذب دارو بر روی ویژگیهای الکترونی و پایداری نانولوله کربنی نیز یکی از هدفهای اصلی این پژوهش بهشمار میآید.
روش بررسی
در محاسبات تئوری تابعیت چگالی، نخست ساختار نانولوله کربنی تک دیواره عاملدار توسط نرمافزار نانوتیوب مولدر (Nanotube Modeler) طراحی شد. سپس فایل ورودی همه کمپلکسها )نانولوله کربنی عاملدار و دارو( توسط نرمافزار گوس ویو (GaussView 6.0)تهیه شده و با استفاده از نرمافزار گوسین(Gaussian 09) بهینه شد (19,۱۸). تمام محاسبات انجام شده در مقاله حاضر، با استفاده از روش تئوری تابعیت چگالی (Density Functional Theory, DFT) در سطح B3LYP/6-31G** انجام شده است .به منظور بررسی ماهیت پیوندها و تعیین مقادیر مولفههای توپولوژی از قبیل چگالی الکترونی، لاپلاسین چگالی الکترونی، چگالی انرژی جنبشی الکترونی و چگالی انرژی پتانسیل در کمپلکس نانولوله/ ایزونیازید، از نظریه کوانتومی اتمها در مولکول ها(Quantum Theory of Atoms in Molecules, QTAIM) و نرمافزارAIM 2000 استفاده شد (20). افزون بر این، از آنالیز اوربیتالهای پیوندی طبیعی(Natural bond orbital, NBO) برای محاسبه انرژی اختلال و بررسی پایداری کمپلکس ناشی از انتقال بار استفاده شد (21). قدرت برهم کنشهای غیرکووالانسی توسط توصیفگرهای انرژی، پارامترهای هندسی، پارامترهای توپولوژیکی، تغییر انرژی آزاد گیبس و انرژی انتقال بار در مکان های اتصال تخمین زده شد. هم چنین از تجزیه و تحلیل اوربیتالهای جبهه ای HOMO و LUMO به منظور نشان دادن انتقالهای الکترونی درون کمپلکس استفاده شد و از نتایج آنها واکنشپذیری مولکول ارزیابی شد. شایان ذکر است، برای بررسی امکان پذیری ترمودینامیکی جذب دارو بر روی نانولوله کربنی عاملدار پارامترهای ترمودینامیکی توسط معادلات زیر محاسبه شد:
ΔGad = G(Iso drug /f-SWCNT) – [G(Iso drug) + G(f-SWCNT)] (1)
ΔHad = H(Iso drug /f-SWCNT) – [H(Iso drug) + H(f-SWCNT)] (2)
ΔSad = S(Iso drug /f-SWCNT) – [S(Iso drug) + S(f-SWCNT)] (3)
نتایج
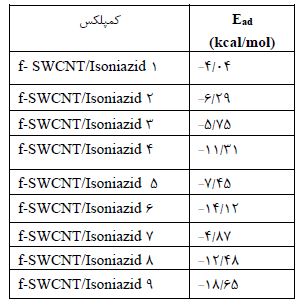
بهینه سازی ساختارها و تحلیل توابع ترمودینامیکی: نخست مولکول ایزونیازید (Iso) و نانو لوله کربنی صندلی عاملدار functionalized SWCNT در سطح محاسباتی B3LYP/6-31G** بهینه شدند، تا پایدارترین ساختارشان تعیین شود (شکل ۱). سپس به منظور یافتن پایدارترین پیکربندی برای کمپلکس f-SWCNT/Isoniazid، پس از بهینهسازی ساختارهای اولیه، مولکول دارو از جهتهای مختلف به نانولوله عاملدار نزدیک و انرژی الکترونی ساختار آنها در سطح 6-31G** تعیین و ساختارهای تعادلی بهینه بهدست آمدند. از میان همه کمپلکسهای بهینه شده، ساختار پایدارتر، کمپلکس 9 f-SWCNT/Isoniazid انتخاب شده و مورد بررسی قرار گرفت (شکل 2). سپس انرژی جذب کمپلکس ها با استفاده از رابطه زیر محاسبه و در جدول ۱ گزارش شد.
Ead = E(f-SWCNT/Isoniazid)) – [E(Isoniazid)+ E(f- SWCNT)] +EBSSE (4)
که Eadانرژی جذب مولکول ایزونیازید بر روی نانولوله کربنی، E(f-SWCNT/Isoniazid))، انرژی الکترونی کل سامانه مولکول دارو و نانولوله است و EIsoniazid و Ef-SWCNT به ترتیب انرژیهای الکترونی کل مولکول دارو و نانولوله و EBSSEانرژی ناشی ازخطای انطباق مجموعه پایه میباشد.
مطابق جدول1 انرژی جذب برای پایدارترین کمپلکس
)9(f-SWCNT/Isoniazid ، 18/65- کیلوکالری برمول است. مقدار انرژی جذب بیانگر پایداری کمپلکس نسبت به مولکولهای منفرد است. همچنین فرایند جذب، با برهم کنش به نسبت خوبی میان دارو و نانولوله کربنی همراه است که به دلیل عاملدار بودن نانولوله تک دیواره میباشد. بنابراین میتوان ادعا کرد که فرایند جذب دارو توسط نانولوله کربنی عاملدار ((5,5 از نظر انرژی گرماده بوده، هم چنین این مقدار انرژی، بیانگر جذب فیزیکی دارو توسط نانولوله کربنی عاملدار است. برای ارزیابی امکانپذیری ترمودینامیکی جذب دارو، محاسبات فرکانس بر روی ساختار بهینه شده کمپلکس با استفاده از روش B3LYP ومجموعه پایه6-31G** در دمای 298/15 کلوین و فشار 1 اتمسفر انجام شدکه نتایج آن در جدول 2 گزارش شده است. مقادیر ΔGad و ΔSad، به ترتیب 7/405- و 31/020- کیلوکالری بر مول بوده و این مقادیر انرژی، گویای کاهش واکنشپذیری و افزایش پایداری دارو بوده و نشان میدهد فرایند جذب منظم و خودبهخود بوده است.
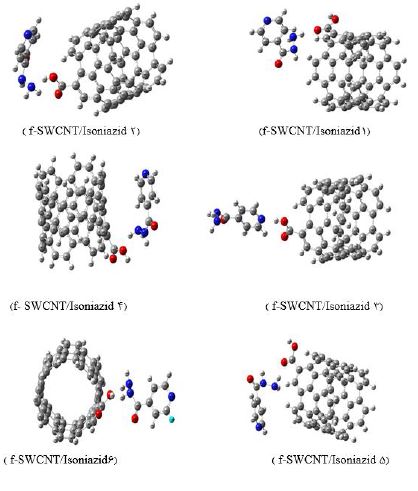
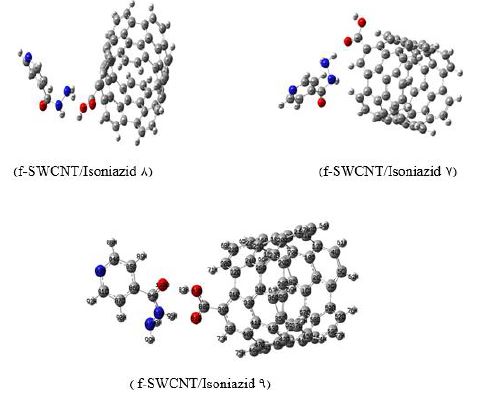
شکل2: پیکربندی های مختلف کمپلکس ایزونیازید/ نانولوله کربنی عاملدار، بهینه شده با روش B3LYP/6-31G**
جدول 1: انرژیهای جذب (Ead)، ایزونیازید بعد از جذب توسط نانو لوله کربنی تک دیواره
جدول2: پارامترهای ترمودینامیکی مولکول ایزونیازید بعد از جذب توسط نانو لوله کربنی عاملدار در سطح محاسباتی B3LYP/6-31G**

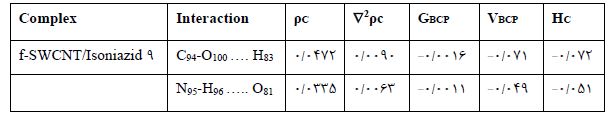
تجزیه و تحلیل نظری اتمها در مولکول ها (QTAIM): نظریه کوانتومی اتم ها در مولکول ها (Quantum Theory of Atoms in Molecules, QTAIM) ابزار مناسبی برای بررسی برهم کنشهای گوناگون بهویژه پیوند هیدروژنی بین مولکولی و درون مولکولی است. یکی از برتریهای این نظریه آن است که میتوان اطلاعاتی درباره تغییر توزیع الکترون و تشکیل پیوند یا کمپلکس به دست آورد. در نظریه اتمها در مولکول مفهوم پیوند شیمیایی و قدرت پیوند برحسب تابع چگالی الکترون بیان میشود. این نظریه از ویژگیهای مکان شناسی چگالی الکترون استفاده میکند و به این وسیله پیوند شیمیایی را از روش مسیر پیوند و نقطه بحرانی پیوند (Bond Critical Point, BCP) تعریف مینماید. در این بخش از پژوهش، با استفاده از نظریه QTAIM، مسیر پیوند بین مولکولی و توصیفگرهای متناسب نقاط بحرانی مانند چگالی الکترونی (ρBCP Electron density,)، لاپلاسین (2ρc Laplacian of charge density, )، چگالی انرژی الکترونی در نقطه بحرانی(HC The total electron energy density at BCP,)، چگالی انرژی جنبشی (Kinetic energy density, GBCP) و چگالی انرژی پتانسیل الکترونی (Potential energy density, VBCP) تجزیه و تحلیل شد. این پارامترها برای کمپلکس ایزونیازید-نانولوله کربنی عاملدار، )9 f-SWCNT/Isoniazid) در جدول 3 گردآوری شده است و گراف آن در شکل 3 به نمایش گذاشته شده است.
بر اساس نتیجهها، مقادیر مثبت 2ρcحاکی از حضور بر هم کنشهای ضعیف واندروالسی و برهم کنشهای لایه- بسته مانند پیوند هیدروژنی دارد. همچنین بر اساس طبقهبندی روزاس و همکاران 00 نشان دهنده پیوند هیدروژنی ضعیف، 0>Hc، 2c>0 نشان دهنده پیوند هیدروژنی متوسط و 0>Hc، 2c<0 نشان دهنده پیوند هیدروژنی قوی میباشد (24-22) .با توجه به مولفههای توپولوژیکی در نقاط بحرانی پیوند در جدول 3، مولکول دارو در فاز گازی در دو نقطه با گروه عاملی نانولوله پیوند برقرار کرده است. بررسی ویژگیهای دانسیته الکترونی در این نقاط نشان میدهد برهمکنشها دارای مقادیر مثبت 2cو مقدار منفی HC بوده، همچنین برهم کنش با کاهشی درچگالی همراه بوده که نشان میدهد پیوند دارو با نانولوله از نوع پیوند هیدروژنی است.
تجزیه و تحلیل اوربیتالهای مولکولی: اوربیتالهای طبیعی پیوند (Natural Bond Orbitals, NBO)، ابزار موثری برای مطالعه برهم کنشهای بین و درون مولکولی و انتقال بار بین مولکولها است (25). شاخص مهم در محاسباتNBO ، تعیین انرژی پایداری بهدست آمده از عدم استقرار الکترونE(2) است که از تجزیه و تحلیل نظریه اختلال مرتبه دوم بهدست میآید. این مقدار با میزان انتقال بار جفت الکترون تنهای گروه پروتون گیرنده به اوربیتال ضدپیوندی متعلق به گروه پروتون دهنده متناسب است که به عنوان یک عامل مهم در تشکیل پیوند بین مولکولی دخالت دارد (26).
برای هر اوربیتال دهنده (i) و پذیرنده (j)، انرژی اختلال مرتبه دوم E(2) مربوط به جابجایی الکترون i → j از رابطه زیر محاسبه میشود:
(5)
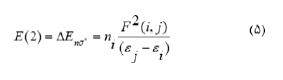
که ni عدد اشغال اربیتال دهنده i ام، iε و jε عناصر قطری (انرژی اربیتالها) و Fi,j عناصر غیر قطری ماتریس میباشد. در برهم کنش دارو و نانولوله، جابجایی بار با استفاده از آنالیز اوربیتالهای طبیعی بررسی شد. نتایج در جدول 4 گزارش شده است.
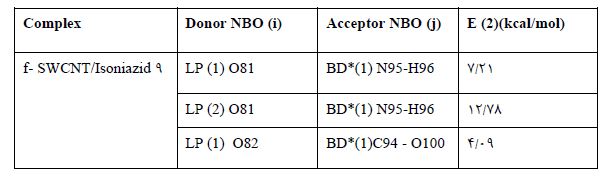
مطابق جدول 4، بیشترین انرژی¬ رزنانس ناشی از انتقال الکترون از سوی گروه عاملی COOH نانولوله کربنی به سمت مولکول ایزونیازید بوده است. درکمپلکس
9f-SWCNT/Isoniazid ، بیشترین انرژی انتقال بار
E(2) =12.78 kcal/mol مربوط به انتقال الکترون از جفت الکترون غیر پیوندی اتم اکسیژن گروه عاملی نانولوله LP(2) O81 ، به سمت اوربیتال ضد پیوندی مولکول دارو BD*(1) N95-H96، در پیوند O81……N95-H96بوده است. این مشاهده ها با نتایج انرژی جذب و پارامترهای هندسی در توافق کامل است و بیانگر برهم کنش فیزیکی بین مولکول دارو و گروه عاملی نانولوله کربنی میباشد.

شکل 3: گراف مربوط به کمپلکس ایزونیازید-نانولوله کربنی عاملدار، )9 f-SWCNT/Isoniazid) در فاز گاز. (دایرههای بزرگ اشاره به اتمها و دایرههای کوچک اشاره به نقاط بحرانی دارد).
جدول 3: پارامترهای توپولوژیکی حاصل از محاسبات QTAIM برای کمپلکس ایزونیازید-نانولوله عاملدار در فاز گاز (تمامی پارامترها در واحد اتمی هستند).
جدول 4: پارامترهای تجزیه و تحلیل NBO کمپلکس ایزونیازید-نانولوله کربنی عاملدار در سطح B3LYP/6-31G**
تجزیه و تحلیل اوربیتالهای جبههای: اوربیتالهای مولکولی به عنوان یکی از پارامترهای اساسی در واکنش های شیمیایی شناخته میشوند. انرژی بالاترین اوربیتال مولکولی اشغال شده (Highest Occupied Molecular Orbital, HOMO) بهطور مستقیم با انرژی یونش مرتبط است در حالیکه انرژی پایینترین اوربیتال مولکولی اشغال نشده(Lowest Unoccupied Molecular Orbital, LUMO) با الکترون خواهی مرتبط است و سختی شیمیایی مربوط به شکاف انرژی بین این دو اوربیتال مولکولی است. نکته حائز اهمیت اختلاف انرژی بین اوربیتالهای مولکولی جبههای میباشد زیرا نقش اساسی در پدیده انتقال بار دارد و به درک پایداری سینتیکی کمک میکند و از لحاظ شیمی کوانتومی نیز پارامتر مهمی بهشمار میآید، زیرا اختلاف انرژی بین این دو تراز نشان دهنده فعالیت شیمیایی و زیستی مولکول موردنظرخواهد بود و منجر به تغییر در بار جزیی و ممان دوقطبی مولکول میشود (28-27). برای بررسی واکنشپذیری مولکولها، محاسبات مرتبط با توصیفگرهای مولکولی شامل شکاف انرژی بین دو اوربیتال (Energy Gap, Eg)، پتانسیل یونیزاسیون (Ionization Potential, I)، الکترونخواهی(Electron Affinity, A) ، پتانسیل شیمیایی (Chemical Potential, µ)، سختی شیمیایی(Chemical Hardness, η) ، الکتروفیلیسیتی (Electrophilicity, w) و نرمی شیمیایی (Chemical Softness, S) برای تمام ساختارهای مورد مطالعه در فاز گاز و در سطح B3LYP/6-31G** انجام شد (32-29). از معادلات زیر برای محاسبه توصیفگرهای مولکولی استفاده شد:
Eg= ELUMO- EHOMO (6)
I= -EHOMO (7)
A= -ELUMO (8)
η = (9)
µ = - χ = (10)
(11)
(12)
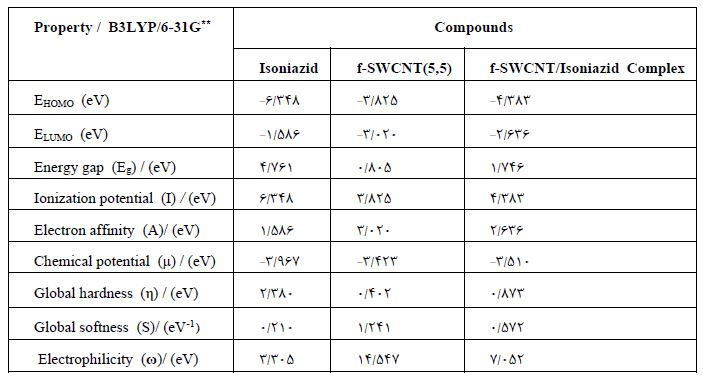
افزون بر این، اختلاف انرژی بین اوربیتالهای مولکولی جبههای بر قدرت پیوند نیز تأثیرگذار است. به عبارت دیگر، شکاف انرژی بیشتر کمپلکس با انرژی برهم کنش بین مولکولی بیشتر همراه است. وقتی که این پارامتر افزایش می یابد، برهم کنش دهنده-پذیرنده الکترون رخ می دهد و یک پیوند بین مولکولی ایجاد می شود. توصیفگرهای مولکولی کوانتومی برای کمپلکس ایزونیازید/ نانولوله کربنی محاسبه و در جدول 5 گردآوری شد. نتایج بیانگرآن بود که پس از جذب مولکول دارو بر روی نانولوله عاملدار گپ انرژی اوربیتال ها در کمپلکس به مقدار جزئی افزایش یافته است، از طرفی، واکنش پذیری یک مولکول به گپ انرژی آن مرتبط و رابطه عکس دارد، پس با جذب مولکول، واکنشپذیری دارو کمتر شده و پایداری سینتیکی آن تا رسیدن به بافت بیمار بیشتر شده است. از آنجا که پایداری مولکول به فاکتور سختی ارتباط دارد و سختی یک ابزار مفیدی برای درک و تفسیر واکنشپذیری شیمیایی مولکول مورد مطالعه بهشمار میرود. توصیفگرهای کوانتومی با انجام فرایند جذب دستخوش تغییر و تحول میشوند. بدین صورت که پس از فرایند جذب، پتانسیل شیمیایی در کمپلکس افزایش خواهد یافت در حالیکه الکتروفیلی و نرمی کاهش مییابد. همچنین تجزیه و تحلیل اوربیتالهای مولکولی جبههای برای کمپلکس 9 f-SWCNT/Isoniazid صورت گرفته است و تصویر آن در شکل4 منعکس شده است. همان گونه که دیده میشود چگالی الکترون اوربیتال مولکولی HOMO بر روی نانولوله کربنی و چگالی الکترون LUMO بر روی مولکول داروی ایزونیازید تجمع یافته است و انتقال بار از سوی نانولوله به سمت مولکول دارو را به روشنی نشان می دهد.
.JPG)
شکل 4: دیاگرام اوربیتال مولکولی هومو و لومو و نمودار DOSبرای کمپلکس ایزونیازید-نانولوله کربنی عامل دار
جدول 5: توصیفگرهای مولکولی برای ایزونیازید، نانولوله کربنی عاملدار و کمپلکس ایزونیازید-نانولوله کربنی عاملدار
بحث
امروزه نانوساختارهای کربنی به عنوان حاملهای نانویی با داشتن اندازه کوچک، نسبت سطح به حجم بزرگ، داشتن،π-π گروههای عاملی (فعال)، خواص سطح ویژه بالا، تجمع برهم کنشهای آبگریز، سازگاری با سلولهای زنده و همچنین برهم کنش مناسب این ترکیبات با مولکولهای دارویی در سیستمهای جدید رسانش دارویی بسیار مورد توجه هستند. در سال 2022، شیخی و همکارانش مطالعهای به منظور ارزیابی یک نانو دارورسانی برای درمان سل انجام دادند. در این مطالعه نانولوله کربنی چند جداره کونژوگه با ایزونیازید و فلوکستین برای افزایش کارایی دارورسانی در کنار حذف مقاومت دارویی در شرایط آزمایشگاهی طراحی شد. نتایج نشان داد که این سیستمهای تحویل نانودارو برای فلوکستین در دوزهای بسیار پایینتر مؤثر هستند (33). در تحقیقات دیگری که توسط زمردبخش و همکارانش در سال 2020 صورت پذیرفت، محاسبات اصول اولیه به منظور بررسی اثر نانولولههای کربنی چند جداره مزدوج ایزونیازید بر مایکوباکتریوم توبرکلوزیس با استفاده از روش (Density Functional Theory, DFT) انجام شد. شناسایی نانو داروی بهدست آمده با طیفسنجی رامان، تبدیل فوریه فروسرخ (FTIR)، میکروسکوپ الکترونی عبوری (TEM) و میکروسکوپ الکترونی روبشی انجام شد. بررسی اثر ضد باکتریایی مربوطه بر روی دو سویه مایکوباکتریوم توبرکلوزیس انجام شد. اثر MWCNTهای کونژوگه با ایزونیازید در غلظتهای پایین بسیار بهتر از داروی خالص در همه سویهها بود. از آنجاییکه یکی از مکانیسمهای ضد میکروبی اصلی MWCNTها از طریق تخریب دیواره سلولی باکتری است، علاوه بر اثرات ضد میکروبی آن، دارورسانی ایزونیازید را در دوزهای کمتر نسبت به دارو به تنهایی افزایش داد. بنابراین، نانوسیال حاوی MWCNTهای کونژوگه با ایزونیازید، نسبت به دارو به تنهایی، اثر کشنده بهتری بر روی انواع سویههای مایکوباکتریوم توبرکلوزیس داشت (34). در سال 2021، میرعلی و همکاران مطالعهای به منظور میزان جذب داروی تاکرین بر روی نانولولههای کربنی انجام دادند. نتایج نشان داد که تاکرین میتواند برروی نانولوله کربنی بارگیری شود و میتواند از برهم کنش با سایر مواد در امان بماند زیرا توزیعهای مداری مولکولی مرزی از تاکرین به نانولولههای کربنی در کمپلکس منتقل شدند. هم چنین، در نتایج حاصل از محاسبات خواص مولکولی نیز مشاهده شد که با کاهش سختی و شکاف انرژی برای کمپلکس دارو-نانولوله در مقایسه با تاکرین خالص، برهمکنش بین تاکرین و نانولوله افزایش یافته است. نرمی بیشتر کمپلکس سبب واکنشپذیری بیشتر آن نسبت به داروی خالص شده و درنتیجه دارای خاصیت بارگذاری مناسبتری برای عملکرد دارویی است (35). در تائید یافتههای پژوهش حاضر، روائی و همکاران (2018) در خصوص رسانش داروی ایزونیازید توسط نانو قفسها مطالعاتی انجام دادند، نتایج تحقیق حاکی از آن بود در اثر برهم کنش مولکول دارو با نانو قفس دوپ شده با آلومینیوم(Al‑doped nanocage)، الکترونها از زوج الکترون ایزونیازید به اربیتالهای ریدبرگ اتم آلومینیوم منتقل شدهاند. همچنین خواص الکترونی نانو قفس دوپه شده بعد از جذب دارو حدود 47% تغییر می کند، این تغییرات در مقادیر شکاف انرژی باعث انتشار فلورسانس پس از تداخلات دارویی با نانوقفس دوپ شده با Al میشود، که بسیار حساس است و میتواند به مسیر دارو توسط اسپکتروفتومتر در بدن کمک کند (36). همچنین ساختار و خواص الکترونیکی B12N12 عاملدار شده با داروی سلکوکسیب توسط Gnatyuk و همکاران (2018)، با محاسبات تئوری تابع چگالی (DFT) مورد مطالعه قرار گرفت. نتایج نشان داد که نانوخوشه B12N12 به عنوان یک حامل زیست پزشکی برای داروی سلکوکسیب مناسب است (37). با توجه به روند مورد نظر در این پژوهش، طبیعی است که رهیافتهایی برای ادامه و نوآوریهایی در این نوع مطالعات ارائه گردد. بر این مبنا پیشنهاد میشود که مطالعات آتی از نانوکنها، نانوقفسها و یا نانولولههای بورنیترید به عنوان حامل داروی ایزونیازید استفاده و نتایج بررسی شود، تا امکان طراحی دارویی آن و کاربرد بهتر دارو در آینده تسهیل یابد. امید است با انجام پژوهشهای کاربردی در زمینه طراحی نانوحاملها و گذراندن مراحل آزمایشگاهی آنها، ساختارهای کربنی بتوانند به عنوان یک حامل داروی امیدوارکننده بتواند انگیزهای را برای محققان ایجاد کند.
نتیجهگیری
پژوهش حاضر، با هدف تعیین میزان جذب داروی ایزونیازید بر روی نانولوله کربنی صندلی عاملدارشده با گروه کربوکسیل در سطح محاسباتی B3LYP/6-31G** انجام شد. نتایج DFT نشان داد که داروی ایزونیازید تمایل به جذب فیزیکی بر روی گروه عاملی نانولوله کربنی داشته و برخی از پارامترهای هندسی دارو و نانولوله در اثر فرایند جذب و برهم کنش بین مولکولی دستخوش تغییر شدهاند. به عنوان نمونه پس از فرایند جذب طول پیوند دارو در قسمت اتصال به گروه عاملی نانولوله بلندتر شده است که نشان دهنده برهم کنش گروه عاملی نانولوله با دارو بوده است. از دیدگاه نظریه QTAIM برهم کنش بین مولکولی بین دارو و نانولوله ایجاد شده است و مهمترین آن پیوند هیدروژنی است زیرا مقدار چگالی الکترونی بیشتری دارد. طبق تجزیه و تحلیل NBO، انتقال بار از سوی نانولوله به سوی دارو صورت گرفته است. نتایج نشان دادکه چگالی الکترون HOMO بر روی نانولوله مستقر بوده در حالیکه چگالی الکترون LUMO بر روی دارو قرار گرفته و پس از فرایند جذب، مقدار اختلاف انرژی بین دو اوربیتال مولکولی افزایش پیدا کرده است که این تغییرها منجر به افزایش هدایت الکتریکی کمپلکس پس از فرایند جذب میشود. افزون بر این، توصیفگرهای کوانتومی در اثر فرایند جذب تغییر کرده اند بدین صورت که فاکتور سختی در فاز گاز افزایش یافته در حالیکه شاخص الکترون دوستی و نرمی کاهش یافتهاند. بنابراین با جذب مولکول دارو، واکنشپذیری دارو کمتر شده و پایداری سینتیکی آن تا رسیدن به بافت بیمار بیشتر شده است. از نقطهنظر سطوح انرژی بر اساس روش DFT دریافتیم که نانولولههای کربنی در شرایط in vitalبهتر عمل میکنند. بنابراین از نتایج بهدستآمده مشخص میشود که نانولوله کربنی عاملدار میتواند به عنوان جاذب مناسب و حسگر خوبی برای داروی ضد سل ایزونیازید عمل کند.
سپاسگزاری
مقاله حاضر استخراج شده از پایاننامه دکتری حرفهای در رشته داروسازی است که به عنوان طرح تحقیقاتی توسط معاونت پژوهشی دانشکده داروسازی دانشگاه علوم پزشکی آزاد اسلامی تهران مصوب شده است. مراتب قدردانی خود را از همکارانی که در انجام این تحقیق ما را یاری رساندند، اعلام میداریم.
حامی مالی: این پژوهش با هزینه نویسندگان انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پژوهش با کد اخلاق IR.IAU.PS.REC.1400.399 مورد تاییدکمیته اخلاق دانشگاه آزاد اسلامی واحد علوم پزشکی تهران قرار گرفته است.
مشارکت نویسندگان
شهلا همدانی در ارائه ایده و طراحی مطالعه، محدثه مرادی در جمعآوری دادهها، شهلا همدانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
نانوفناوری پزشکی بررسی روش هایی به منظور تشخیص، پیشگیری و یا درمان بیماری ها از طریق ترمیم بافتهای آسیب دیده در سطوح مولکولی است. در حالت کلی فراتر از آسان شدن استفاده بهینه از دارو، نانوفناوری میتواند فرمولاسیون و مسیرهایی برای رسانش دارو فراهم کند که منجر به تولید داروهایی اختصاصیتر با اثر بخشی بیشتر و عارضههای جانبی کمتر شود (3-1). اصلیترین مزیت سامانه های رهایش دارو، افزایش اثرات درمانی دارو بدون القاء عوارض جانبی بر روی اندامک ها، بافتها و سلولهای سالم می باشد. در حال حاضر سیستمهای دارورسانی مبتنی بر حاملهای نانویی در سیستمها توزیع دارو موجود بوده و استفاده از آن ها در دارورسانی روز به روز در حال افزایش است (5,4). یکی از جدیدترین و پیشرفتهترین انواع سیستم های رهایش دارو، سیستمهایی است که از نانوحاملهای کربنی در طراحی آنها استفاده شده است. از مزایای کاربرد نانوحاملهای کربنی در سیستمهای دارورسانی، میتوان افزایش نفوذ دارو در سلولهای هدف، افزایش حلالیت دارو، کاهش نوسانات، حفظ غلظت دارو برای مدت مشخص، تنظیم سرعت رهایش دارو را نام برد (6). علی رغم مزایای ذکر شده در خصوص نانولولههای کربنی برای انتقال هدفمند دارو، مانند دارا بودن نسبت سطح به حجم بالا، زیستسازگاری بالا، جذب سریع مولکولی، اثربخشی بیشتر و .....، مواردی مانند سمیت مربوط به کاربردهای زیست پزشکی آنها امروزه بحث برانگیز است (7). یکی از راههایی که برای کاهش سمیت نانولولههای کربنی پیشنهاد شده، استفاده از پوشش بر روی سطح نانولولهها با تکنیک عاملدار کردن میباشد. تحقیقات انجام شده نشان میدهد که قرار گرفتن در معرض نانولولههای کربنی بهطور قابلتوجهی باعث کاهش میزان تکثیر سلولها شده و با تاثیر بر چرخه سلولی، منجر به آپوپتوز میشود. سطوح جانبی نانولولهها بسیار آبگریز میباشد، اتصال گروههای عاملی با کاهش هیدروفوبیسیته سطحی و محلول ساختن نانولولههای کربنی سبب کاهش سمیت و آسیبرسانی به سلولهای موجودات زنده میشود (12-8). بهطور کلی، نانولولههای کربنیهای عاملدار دارای توانایی حمل مولکولهای مورد نظر، در سراسر غشای سیتوپلاسمی و غشای هستهای بدون ایجاد اثر سمی هستند. پس از رسیدن به سلول هدف، دو امکان برای تحویل دارو وجود دارد: دارو بدون ورود نانولوله وارد سلولها میشود یا دارو و نانولوله هر دو وارد سلولها میشوند. روش دوم مؤثرتر از روش اول است، زیرا پس از ورود به سلولها، محیط درون سلولی کمپلکس دارو-نانولوله کربنی ((Carbon Nanotube, CNT، را تخریب میکند و مولکولهای دارو را داخل سلولها آزاد میکند، در حالیکه در روش اول، محیط خارج سلولی به تجزیه کونژوگههای حامل دارو کمک میکند و دارو پس از عبور از غشای لیپیدی وارد سلولها میشود، در نتیجه امکان تجزیه دارو در طی این نفوذ به خودی خود وجود دارد. از آنجا که رسانش دارو توسط نانوحاملها باعث تشدید اثر زیستی آن میشود، در نتیجه بررسی نظری فرایند جذب دارو برای کنترل رسانش و بهینهسازی نانودارو موثر میباشد. در این پژوهش برهم کنش داروی درمانی بیماری سل، ایزونیازید با نانو لوله کربنی تک دیواره شکل صندلی (5,5) عاملدار شده با گروه کربوکسیل(functionalized SWCNT by carboxyl functional group) مطالعه شد. باسیل سل (Tuberculosis, TB) یکی از شایعترین و کشندهترین بیماریهای عفونی است که توسط مایکوباکتریوم توبرکلوزیس (Mycobacterium tuberculosis) ایجاد می شود (13). مایکوباکتریوم توبرکلوزیس با سایر باکتریها متفاوت است زیرا به جای هر20 تا 40 دقیقه، مانند برخی باکتریهای دیگر، هر 24 ساعت یک بار به آرامی تکثیر مییابد. یکی از ویژگیهای اصلی مایکوباکتریوم توبرکلوزیس ساختار دیواره سلولی منحصر به فرد آن است که یک سد غیرقابل نفوذ در برابر ترکیبات و داروها ایجاد میکند. ایزونیکوتینیک هیدرازید و اتامبوتول، دو تا از موثرترین داروهای ضد سل، به ترتیب سنتز اسیدهای مایکولیک و آرابینوگالاکتان را هدف قرار میدهند و اهمیت دیواره سلولی مایکوباکتری را در بیولوژی M.tuberculosis برجسته میکنند. مقاومت دارویی یک مشکل رایج در طول درمان طولانیمدت است که باعث شکست درمان میشود و منجر به بیماری پیشرونده میشود. تحویل داروی ایزونیازید بهطور مستقیم به محل موردنظر با استفاده از نانوحاملهای خاص ممکن است یک استراتژی بالقوه برای کاهش عوارض جانبی و همچنین سمیت آن باشد. علیرغم استفاده گسترده و اثرات کارآمد ایزونیازید در درمان سل، عوارض جانبی شدیدی مانند نوروپاتی محیطی و سمیت کبدی ایجاد کند که دوزهای قابل استفاده بالینی را محدود میکند، بنابراین، میتواند کارایی درمانی را افزایش داده و سمیت دارو را کاهش دهد. از سوی دیگر، هنگامیکه باکتریها با آنتیبیوتیک درمان میشوند، مقاومت دارویی افزایش مییابد و غلظتهای بالاتر آنتیبیوتیک برای اثرگذاری بر باکتری مورد نیاز است. از این رو، سیستمی که تحویل دوزهای بالای دارو به محلهای باکتری را تسهیل کند، بسیار مطلوب است. ایزونیکوتینیک هیدرازید
(Iso Nicotinic Hydrazide, INH) که با نام ایزونیازید شناخته می شود، یک ترکیب آلی و اولین دارو در پیشگیری و درمان سل است و دارای اثربخشی بالا و اثر ضد باکتری قوی است. مکانیسم عمل ایزونیازید شامل مهار تولید مایکولیک اسید می باشد که یک بخش اساسی و ضروری در دیواره سلولی مایکوباکتر است. در صورت مصرف این دارو به تنهایی، مقاومت به سرعت رخ میدهد. مقاومت در سطح بالا در ارتباط با حذف ژن katG است که کد کننده آنزیم کاتالازپراکسیداز است، آنزیمی که در فعالسازی ایزونیازید دخالت دارد. ایزونیازید به خودی خود برای سلول باکتری سمی نیست، اما به عنوان یک پیش دارو عمل می کند و توسط آنزیم مایکوباکتریال KatG فعال میشود (16-14). در درمان با آنتیبیوتیک، مقاومت باکتری نسبت به دارو افزایش مییابد و غلظتهای بیشتری از آنتیبیوتیک برای تاثیر بر روی باکتریها مورد نیاز است. از اینرو، سیستمی که امکان رساندن دوزهای بالای دارو را فراهم نمایند بسیار مطلوب است. پزشکی نانو دارای پتانسیل قابلتوجهی برای پیشرفت در زمینه تشخیص، درمان و پیشگیری از بیماریهای عفونی است. همراه با استفاده از فناوری نانو، تحویل دارو های آب دوست و آب گریز، دارورسانی داخل سلولی ماکرومولکولها و رساندن هدفمند داروها به سلولها یا بافتهای خاص بدن انسان امکانپذیر شده است. سیستمهای دارورسانی قادرند مقدار نسبتاً زیادی از مولکولهای دارو را بدون مشکل رهاسازی زودهنگام تحویل دهند و عوارض جانبی و همچنین سمیت دارو را کاهش داده و اثربخشی درمان را افزایش دهند (17). از طرفی روش تئوری تابعیت چگال که به عنوان یکی از روشهای محاسباتی برای همبستگی الکترونی توسعه یافته است، یک ابزار تحقیقاتی ارزشمند است که میتواند در تایید نتایج حاصل از آنالیز آزمایشات یا تمایز بین احتمالاتی که ناتمام مانده اند، موثر باشد. این پژوهش، با استفاده از روش تئوری تابعیت چگال امکان استفاده از نانو لوله کربنی تک دیواره صندلی عاملدار با گروه کربوکسیل را به عنوان حامل داروی ایزونیازید مورد بررسی قرار میدهد. همچنین بررسی اثر جذب دارو بر روی ویژگیهای الکترونی و پایداری نانولوله کربنی نیز یکی از هدفهای اصلی این پژوهش بهشمار میآید.
روش بررسی
در محاسبات تئوری تابعیت چگالی، نخست ساختار نانولوله کربنی تک دیواره عاملدار توسط نرمافزار نانوتیوب مولدر (Nanotube Modeler) طراحی شد. سپس فایل ورودی همه کمپلکسها )نانولوله کربنی عاملدار و دارو( توسط نرمافزار گوس ویو (GaussView 6.0)تهیه شده و با استفاده از نرمافزار گوسین(Gaussian 09) بهینه شد (19,۱۸). تمام محاسبات انجام شده در مقاله حاضر، با استفاده از روش تئوری تابعیت چگالی (Density Functional Theory, DFT) در سطح B3LYP/6-31G** انجام شده است .به منظور بررسی ماهیت پیوندها و تعیین مقادیر مولفههای توپولوژی از قبیل چگالی الکترونی، لاپلاسین چگالی الکترونی، چگالی انرژی جنبشی الکترونی و چگالی انرژی پتانسیل در کمپلکس نانولوله/ ایزونیازید، از نظریه کوانتومی اتمها در مولکول ها(Quantum Theory of Atoms in Molecules, QTAIM) و نرمافزارAIM 2000 استفاده شد (20). افزون بر این، از آنالیز اوربیتالهای پیوندی طبیعی(Natural bond orbital, NBO) برای محاسبه انرژی اختلال و بررسی پایداری کمپلکس ناشی از انتقال بار استفاده شد (21). قدرت برهم کنشهای غیرکووالانسی توسط توصیفگرهای انرژی، پارامترهای هندسی، پارامترهای توپولوژیکی، تغییر انرژی آزاد گیبس و انرژی انتقال بار در مکان های اتصال تخمین زده شد. هم چنین از تجزیه و تحلیل اوربیتالهای جبهه ای HOMO و LUMO به منظور نشان دادن انتقالهای الکترونی درون کمپلکس استفاده شد و از نتایج آنها واکنشپذیری مولکول ارزیابی شد. شایان ذکر است، برای بررسی امکان پذیری ترمودینامیکی جذب دارو بر روی نانولوله کربنی عاملدار پارامترهای ترمودینامیکی توسط معادلات زیر محاسبه شد:
ΔGad = G(Iso drug /f-SWCNT) – [G(Iso drug) + G(f-SWCNT)] (1)
ΔHad = H(Iso drug /f-SWCNT) – [H(Iso drug) + H(f-SWCNT)] (2)
ΔSad = S(Iso drug /f-SWCNT) – [S(Iso drug) + S(f-SWCNT)] (3)
نتایج
بهینه سازی ساختارها و تحلیل توابع ترمودینامیکی: نخست مولکول ایزونیازید (Iso) و نانو لوله کربنی صندلی عاملدار functionalized SWCNT در سطح محاسباتی B3LYP/6-31G** بهینه شدند، تا پایدارترین ساختارشان تعیین شود (شکل ۱). سپس به منظور یافتن پایدارترین پیکربندی برای کمپلکس f-SWCNT/Isoniazid، پس از بهینهسازی ساختارهای اولیه، مولکول دارو از جهتهای مختلف به نانولوله عاملدار نزدیک و انرژی الکترونی ساختار آنها در سطح 6-31G** تعیین و ساختارهای تعادلی بهینه بهدست آمدند. از میان همه کمپلکسهای بهینه شده، ساختار پایدارتر، کمپلکس 9 f-SWCNT/Isoniazid انتخاب شده و مورد بررسی قرار گرفت (شکل 2). سپس انرژی جذب کمپلکس ها با استفاده از رابطه زیر محاسبه و در جدول ۱ گزارش شد.
Ead = E(f-SWCNT/Isoniazid)) – [E(Isoniazid)+ E(f- SWCNT)] +EBSSE (4)
که Eadانرژی جذب مولکول ایزونیازید بر روی نانولوله کربنی، E(f-SWCNT/Isoniazid))، انرژی الکترونی کل سامانه مولکول دارو و نانولوله است و EIsoniazid و Ef-SWCNT به ترتیب انرژیهای الکترونی کل مولکول دارو و نانولوله و EBSSEانرژی ناشی ازخطای انطباق مجموعه پایه میباشد.
مطابق جدول1 انرژی جذب برای پایدارترین کمپلکس
)9(f-SWCNT/Isoniazid ، 18/65- کیلوکالری برمول است. مقدار انرژی جذب بیانگر پایداری کمپلکس نسبت به مولکولهای منفرد است. همچنین فرایند جذب، با برهم کنش به نسبت خوبی میان دارو و نانولوله کربنی همراه است که به دلیل عاملدار بودن نانولوله تک دیواره میباشد. بنابراین میتوان ادعا کرد که فرایند جذب دارو توسط نانولوله کربنی عاملدار ((5,5 از نظر انرژی گرماده بوده، هم چنین این مقدار انرژی، بیانگر جذب فیزیکی دارو توسط نانولوله کربنی عاملدار است. برای ارزیابی امکانپذیری ترمودینامیکی جذب دارو، محاسبات فرکانس بر روی ساختار بهینه شده کمپلکس با استفاده از روش B3LYP ومجموعه پایه6-31G** در دمای 298/15 کلوین و فشار 1 اتمسفر انجام شدکه نتایج آن در جدول 2 گزارش شده است. مقادیر ΔGad و ΔSad، به ترتیب 7/405- و 31/020- کیلوکالری بر مول بوده و این مقادیر انرژی، گویای کاهش واکنشپذیری و افزایش پایداری دارو بوده و نشان میدهد فرایند جذب منظم و خودبهخود بوده است.



شکل2: پیکربندی های مختلف کمپلکس ایزونیازید/ نانولوله کربنی عاملدار، بهینه شده با روش B3LYP/6-31G**
جدول 1: انرژیهای جذب (Ead)، ایزونیازید بعد از جذب توسط نانو لوله کربنی تک دیواره

جدول2: پارامترهای ترمودینامیکی مولکول ایزونیازید بعد از جذب توسط نانو لوله کربنی عاملدار در سطح محاسباتی B3LYP/6-31G**

تجزیه و تحلیل نظری اتمها در مولکول ها (QTAIM): نظریه کوانتومی اتم ها در مولکول ها (Quantum Theory of Atoms in Molecules, QTAIM) ابزار مناسبی برای بررسی برهم کنشهای گوناگون بهویژه پیوند هیدروژنی بین مولکولی و درون مولکولی است. یکی از برتریهای این نظریه آن است که میتوان اطلاعاتی درباره تغییر توزیع الکترون و تشکیل پیوند یا کمپلکس به دست آورد. در نظریه اتمها در مولکول مفهوم پیوند شیمیایی و قدرت پیوند برحسب تابع چگالی الکترون بیان میشود. این نظریه از ویژگیهای مکان شناسی چگالی الکترون استفاده میکند و به این وسیله پیوند شیمیایی را از روش مسیر پیوند و نقطه بحرانی پیوند (Bond Critical Point, BCP) تعریف مینماید. در این بخش از پژوهش، با استفاده از نظریه QTAIM، مسیر پیوند بین مولکولی و توصیفگرهای متناسب نقاط بحرانی مانند چگالی الکترونی (ρBCP Electron density,)، لاپلاسین (2ρc Laplacian of charge density, )، چگالی انرژی الکترونی در نقطه بحرانی(HC The total electron energy density at BCP,)، چگالی انرژی جنبشی (Kinetic energy density, GBCP) و چگالی انرژی پتانسیل الکترونی (Potential energy density, VBCP) تجزیه و تحلیل شد. این پارامترها برای کمپلکس ایزونیازید-نانولوله کربنی عاملدار، )9 f-SWCNT/Isoniazid) در جدول 3 گردآوری شده است و گراف آن در شکل 3 به نمایش گذاشته شده است.
بر اساس نتیجهها، مقادیر مثبت 2ρcحاکی از حضور بر هم کنشهای ضعیف واندروالسی و برهم کنشهای لایه- بسته مانند پیوند هیدروژنی دارد. همچنین بر اساس طبقهبندی روزاس و همکاران 0
تجزیه و تحلیل اوربیتالهای مولکولی: اوربیتالهای طبیعی پیوند (Natural Bond Orbitals, NBO)، ابزار موثری برای مطالعه برهم کنشهای بین و درون مولکولی و انتقال بار بین مولکولها است (25). شاخص مهم در محاسباتNBO ، تعیین انرژی پایداری بهدست آمده از عدم استقرار الکترونE(2) است که از تجزیه و تحلیل نظریه اختلال مرتبه دوم بهدست میآید. این مقدار با میزان انتقال بار جفت الکترون تنهای گروه پروتون گیرنده به اوربیتال ضدپیوندی متعلق به گروه پروتون دهنده متناسب است که به عنوان یک عامل مهم در تشکیل پیوند بین مولکولی دخالت دارد (26).
برای هر اوربیتال دهنده (i) و پذیرنده (j)، انرژی اختلال مرتبه دوم E(2) مربوط به جابجایی الکترون i → j از رابطه زیر محاسبه میشود:
(5)
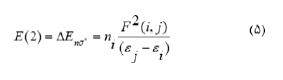
که ni عدد اشغال اربیتال دهنده i ام، iε و jε عناصر قطری (انرژی اربیتالها) و Fi,j عناصر غیر قطری ماتریس میباشد. در برهم کنش دارو و نانولوله، جابجایی بار با استفاده از آنالیز اوربیتالهای طبیعی بررسی شد. نتایج در جدول 4 گزارش شده است.
مطابق جدول 4، بیشترین انرژی¬ رزنانس ناشی از انتقال الکترون از سوی گروه عاملی COOH نانولوله کربنی به سمت مولکول ایزونیازید بوده است. درکمپلکس
9f-SWCNT/Isoniazid ، بیشترین انرژی انتقال بار
E(2) =12.78 kcal/mol مربوط به انتقال الکترون از جفت الکترون غیر پیوندی اتم اکسیژن گروه عاملی نانولوله LP(2) O81 ، به سمت اوربیتال ضد پیوندی مولکول دارو BD*(1) N95-H96، در پیوند O81……N95-H96بوده است. این مشاهده ها با نتایج انرژی جذب و پارامترهای هندسی در توافق کامل است و بیانگر برهم کنش فیزیکی بین مولکول دارو و گروه عاملی نانولوله کربنی میباشد.

شکل 3: گراف مربوط به کمپلکس ایزونیازید-نانولوله کربنی عاملدار، )9 f-SWCNT/Isoniazid) در فاز گاز. (دایرههای بزرگ اشاره به اتمها و دایرههای کوچک اشاره به نقاط بحرانی دارد).
جدول 3: پارامترهای توپولوژیکی حاصل از محاسبات QTAIM برای کمپلکس ایزونیازید-نانولوله عاملدار در فاز گاز (تمامی پارامترها در واحد اتمی هستند).

جدول 4: پارامترهای تجزیه و تحلیل NBO کمپلکس ایزونیازید-نانولوله کربنی عاملدار در سطح B3LYP/6-31G**

تجزیه و تحلیل اوربیتالهای جبههای: اوربیتالهای مولکولی به عنوان یکی از پارامترهای اساسی در واکنش های شیمیایی شناخته میشوند. انرژی بالاترین اوربیتال مولکولی اشغال شده (Highest Occupied Molecular Orbital, HOMO) بهطور مستقیم با انرژی یونش مرتبط است در حالیکه انرژی پایینترین اوربیتال مولکولی اشغال نشده(Lowest Unoccupied Molecular Orbital, LUMO) با الکترون خواهی مرتبط است و سختی شیمیایی مربوط به شکاف انرژی بین این دو اوربیتال مولکولی است. نکته حائز اهمیت اختلاف انرژی بین اوربیتالهای مولکولی جبههای میباشد زیرا نقش اساسی در پدیده انتقال بار دارد و به درک پایداری سینتیکی کمک میکند و از لحاظ شیمی کوانتومی نیز پارامتر مهمی بهشمار میآید، زیرا اختلاف انرژی بین این دو تراز نشان دهنده فعالیت شیمیایی و زیستی مولکول موردنظرخواهد بود و منجر به تغییر در بار جزیی و ممان دوقطبی مولکول میشود (28-27). برای بررسی واکنشپذیری مولکولها، محاسبات مرتبط با توصیفگرهای مولکولی شامل شکاف انرژی بین دو اوربیتال (Energy Gap, Eg)، پتانسیل یونیزاسیون (Ionization Potential, I)، الکترونخواهی(Electron Affinity, A) ، پتانسیل شیمیایی (Chemical Potential, µ)، سختی شیمیایی(Chemical Hardness, η) ، الکتروفیلیسیتی (Electrophilicity, w) و نرمی شیمیایی (Chemical Softness, S) برای تمام ساختارهای مورد مطالعه در فاز گاز و در سطح B3LYP/6-31G** انجام شد (32-29). از معادلات زیر برای محاسبه توصیفگرهای مولکولی استفاده شد:
Eg= ELUMO- EHOMO (6)
I= -EHOMO (7)
A= -ELUMO (8)
η = (9)
µ = - χ = (10)
(11)
(12)
افزون بر این، اختلاف انرژی بین اوربیتالهای مولکولی جبههای بر قدرت پیوند نیز تأثیرگذار است. به عبارت دیگر، شکاف انرژی بیشتر کمپلکس با انرژی برهم کنش بین مولکولی بیشتر همراه است. وقتی که این پارامتر افزایش می یابد، برهم کنش دهنده-پذیرنده الکترون رخ می دهد و یک پیوند بین مولکولی ایجاد می شود. توصیفگرهای مولکولی کوانتومی برای کمپلکس ایزونیازید/ نانولوله کربنی محاسبه و در جدول 5 گردآوری شد. نتایج بیانگرآن بود که پس از جذب مولکول دارو بر روی نانولوله عاملدار گپ انرژی اوربیتال ها در کمپلکس به مقدار جزئی افزایش یافته است، از طرفی، واکنش پذیری یک مولکول به گپ انرژی آن مرتبط و رابطه عکس دارد، پس با جذب مولکول، واکنشپذیری دارو کمتر شده و پایداری سینتیکی آن تا رسیدن به بافت بیمار بیشتر شده است. از آنجا که پایداری مولکول به فاکتور سختی ارتباط دارد و سختی یک ابزار مفیدی برای درک و تفسیر واکنشپذیری شیمیایی مولکول مورد مطالعه بهشمار میرود. توصیفگرهای کوانتومی با انجام فرایند جذب دستخوش تغییر و تحول میشوند. بدین صورت که پس از فرایند جذب، پتانسیل شیمیایی در کمپلکس افزایش خواهد یافت در حالیکه الکتروفیلی و نرمی کاهش مییابد. همچنین تجزیه و تحلیل اوربیتالهای مولکولی جبههای برای کمپلکس 9 f-SWCNT/Isoniazid صورت گرفته است و تصویر آن در شکل4 منعکس شده است. همان گونه که دیده میشود چگالی الکترون اوربیتال مولکولی HOMO بر روی نانولوله کربنی و چگالی الکترون LUMO بر روی مولکول داروی ایزونیازید تجمع یافته است و انتقال بار از سوی نانولوله به سمت مولکول دارو را به روشنی نشان می دهد.
.JPG)
شکل 4: دیاگرام اوربیتال مولکولی هومو و لومو و نمودار DOSبرای کمپلکس ایزونیازید-نانولوله کربنی عامل دار
جدول 5: توصیفگرهای مولکولی برای ایزونیازید، نانولوله کربنی عاملدار و کمپلکس ایزونیازید-نانولوله کربنی عاملدار

بحث
امروزه نانوساختارهای کربنی به عنوان حاملهای نانویی با داشتن اندازه کوچک، نسبت سطح به حجم بزرگ، داشتن،π-π گروههای عاملی (فعال)، خواص سطح ویژه بالا، تجمع برهم کنشهای آبگریز، سازگاری با سلولهای زنده و همچنین برهم کنش مناسب این ترکیبات با مولکولهای دارویی در سیستمهای جدید رسانش دارویی بسیار مورد توجه هستند. در سال 2022، شیخی و همکارانش مطالعهای به منظور ارزیابی یک نانو دارورسانی برای درمان سل انجام دادند. در این مطالعه نانولوله کربنی چند جداره کونژوگه با ایزونیازید و فلوکستین برای افزایش کارایی دارورسانی در کنار حذف مقاومت دارویی در شرایط آزمایشگاهی طراحی شد. نتایج نشان داد که این سیستمهای تحویل نانودارو برای فلوکستین در دوزهای بسیار پایینتر مؤثر هستند (33). در تحقیقات دیگری که توسط زمردبخش و همکارانش در سال 2020 صورت پذیرفت، محاسبات اصول اولیه به منظور بررسی اثر نانولولههای کربنی چند جداره مزدوج ایزونیازید بر مایکوباکتریوم توبرکلوزیس با استفاده از روش (Density Functional Theory, DFT) انجام شد. شناسایی نانو داروی بهدست آمده با طیفسنجی رامان، تبدیل فوریه فروسرخ (FTIR)، میکروسکوپ الکترونی عبوری (TEM) و میکروسکوپ الکترونی روبشی انجام شد. بررسی اثر ضد باکتریایی مربوطه بر روی دو سویه مایکوباکتریوم توبرکلوزیس انجام شد. اثر MWCNTهای کونژوگه با ایزونیازید در غلظتهای پایین بسیار بهتر از داروی خالص در همه سویهها بود. از آنجاییکه یکی از مکانیسمهای ضد میکروبی اصلی MWCNTها از طریق تخریب دیواره سلولی باکتری است، علاوه بر اثرات ضد میکروبی آن، دارورسانی ایزونیازید را در دوزهای کمتر نسبت به دارو به تنهایی افزایش داد. بنابراین، نانوسیال حاوی MWCNTهای کونژوگه با ایزونیازید، نسبت به دارو به تنهایی، اثر کشنده بهتری بر روی انواع سویههای مایکوباکتریوم توبرکلوزیس داشت (34). در سال 2021، میرعلی و همکاران مطالعهای به منظور میزان جذب داروی تاکرین بر روی نانولولههای کربنی انجام دادند. نتایج نشان داد که تاکرین میتواند برروی نانولوله کربنی بارگیری شود و میتواند از برهم کنش با سایر مواد در امان بماند زیرا توزیعهای مداری مولکولی مرزی از تاکرین به نانولولههای کربنی در کمپلکس منتقل شدند. هم چنین، در نتایج حاصل از محاسبات خواص مولکولی نیز مشاهده شد که با کاهش سختی و شکاف انرژی برای کمپلکس دارو-نانولوله در مقایسه با تاکرین خالص، برهمکنش بین تاکرین و نانولوله افزایش یافته است. نرمی بیشتر کمپلکس سبب واکنشپذیری بیشتر آن نسبت به داروی خالص شده و درنتیجه دارای خاصیت بارگذاری مناسبتری برای عملکرد دارویی است (35). در تائید یافتههای پژوهش حاضر، روائی و همکاران (2018) در خصوص رسانش داروی ایزونیازید توسط نانو قفسها مطالعاتی انجام دادند، نتایج تحقیق حاکی از آن بود در اثر برهم کنش مولکول دارو با نانو قفس دوپ شده با آلومینیوم(Al‑doped nanocage)، الکترونها از زوج الکترون ایزونیازید به اربیتالهای ریدبرگ اتم آلومینیوم منتقل شدهاند. همچنین خواص الکترونی نانو قفس دوپه شده بعد از جذب دارو حدود 47% تغییر می کند، این تغییرات در مقادیر شکاف انرژی باعث انتشار فلورسانس پس از تداخلات دارویی با نانوقفس دوپ شده با Al میشود، که بسیار حساس است و میتواند به مسیر دارو توسط اسپکتروفتومتر در بدن کمک کند (36). همچنین ساختار و خواص الکترونیکی B12N12 عاملدار شده با داروی سلکوکسیب توسط Gnatyuk و همکاران (2018)، با محاسبات تئوری تابع چگالی (DFT) مورد مطالعه قرار گرفت. نتایج نشان داد که نانوخوشه B12N12 به عنوان یک حامل زیست پزشکی برای داروی سلکوکسیب مناسب است (37). با توجه به روند مورد نظر در این پژوهش، طبیعی است که رهیافتهایی برای ادامه و نوآوریهایی در این نوع مطالعات ارائه گردد. بر این مبنا پیشنهاد میشود که مطالعات آتی از نانوکنها، نانوقفسها و یا نانولولههای بورنیترید به عنوان حامل داروی ایزونیازید استفاده و نتایج بررسی شود، تا امکان طراحی دارویی آن و کاربرد بهتر دارو در آینده تسهیل یابد. امید است با انجام پژوهشهای کاربردی در زمینه طراحی نانوحاملها و گذراندن مراحل آزمایشگاهی آنها، ساختارهای کربنی بتوانند به عنوان یک حامل داروی امیدوارکننده بتواند انگیزهای را برای محققان ایجاد کند.
نتیجهگیری
پژوهش حاضر، با هدف تعیین میزان جذب داروی ایزونیازید بر روی نانولوله کربنی صندلی عاملدارشده با گروه کربوکسیل در سطح محاسباتی B3LYP/6-31G** انجام شد. نتایج DFT نشان داد که داروی ایزونیازید تمایل به جذب فیزیکی بر روی گروه عاملی نانولوله کربنی داشته و برخی از پارامترهای هندسی دارو و نانولوله در اثر فرایند جذب و برهم کنش بین مولکولی دستخوش تغییر شدهاند. به عنوان نمونه پس از فرایند جذب طول پیوند دارو در قسمت اتصال به گروه عاملی نانولوله بلندتر شده است که نشان دهنده برهم کنش گروه عاملی نانولوله با دارو بوده است. از دیدگاه نظریه QTAIM برهم کنش بین مولکولی بین دارو و نانولوله ایجاد شده است و مهمترین آن پیوند هیدروژنی است زیرا مقدار چگالی الکترونی بیشتری دارد. طبق تجزیه و تحلیل NBO، انتقال بار از سوی نانولوله به سوی دارو صورت گرفته است. نتایج نشان دادکه چگالی الکترون HOMO بر روی نانولوله مستقر بوده در حالیکه چگالی الکترون LUMO بر روی دارو قرار گرفته و پس از فرایند جذب، مقدار اختلاف انرژی بین دو اوربیتال مولکولی افزایش پیدا کرده است که این تغییرها منجر به افزایش هدایت الکتریکی کمپلکس پس از فرایند جذب میشود. افزون بر این، توصیفگرهای کوانتومی در اثر فرایند جذب تغییر کرده اند بدین صورت که فاکتور سختی در فاز گاز افزایش یافته در حالیکه شاخص الکترون دوستی و نرمی کاهش یافتهاند. بنابراین با جذب مولکول دارو، واکنشپذیری دارو کمتر شده و پایداری سینتیکی آن تا رسیدن به بافت بیمار بیشتر شده است. از نقطهنظر سطوح انرژی بر اساس روش DFT دریافتیم که نانولولههای کربنی در شرایط in vitalبهتر عمل میکنند. بنابراین از نتایج بهدستآمده مشخص میشود که نانولوله کربنی عاملدار میتواند به عنوان جاذب مناسب و حسگر خوبی برای داروی ضد سل ایزونیازید عمل کند.
سپاسگزاری
مقاله حاضر استخراج شده از پایاننامه دکتری حرفهای در رشته داروسازی است که به عنوان طرح تحقیقاتی توسط معاونت پژوهشی دانشکده داروسازی دانشگاه علوم پزشکی آزاد اسلامی تهران مصوب شده است. مراتب قدردانی خود را از همکارانی که در انجام این تحقیق ما را یاری رساندند، اعلام میداریم.
حامی مالی: این پژوهش با هزینه نویسندگان انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پژوهش با کد اخلاق IR.IAU.PS.REC.1400.399 مورد تاییدکمیته اخلاق دانشگاه آزاد اسلامی واحد علوم پزشکی تهران قرار گرفته است.
مشارکت نویسندگان
شهلا همدانی در ارائه ایده و طراحی مطالعه، محدثه مرادی در جمعآوری دادهها، شهلا همدانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Bhushan B. Springer handbook of nanotechnology: Springer; 2017.
2- Khan DR. The Use of Nanocarriers for Drug Delivery in Cancer Therapy. J Cancer Sci Ther 2010; 2(3): 58-62.
3- Hughes G A. Nanostructure-Mediated Drug Delivery. Nanomedicine in Cancer 2017; 1: 47-72.
4- Kim J, Conway A, Chauhan A. Extended Delivery of Ophthalmic Drugs by Silicone Hydrogel Contact Lenses. Biomaterials 2008; 29(14): 2259-69.
5- Aminu N, Bello I, Umar NM, Tanko N, Aminu A, Audu MM. The Influence Of Nanoparticulate Drug Delivery Systems In Drug Therapy. J Drug Deliv Sci Technol 2020; 60:101961.
6- Goldberg M, Langer R, Jia X. Nanostructured Materials for Applications in Drug Delivery and Tissue Engineering. Biomater Sci 2007; 18(3): 241-68.
7- Foldvari M, Bagonluri M. Carbon Nanotubes as Functional Excipients for Nanomedicines: II. Drug Delivery and Biocompatibility Issues. Nanomedicine: NBM 2008; 4(3): 183-200.
8- Jena SK, Chakraverty S, Malikan M, Tornabene F. Effects of Surface Energy and Surface Residual Stresses on Vibrothermal Analysis of Chiral, Zigzag, and Armchair Types of Swcnts Using Refined Beam Theory. Mech Based Des Struct 2022; 50(5): 1565-79.
9- Francis AP, Devasena T. Toxicity of Carbon Nanotubes: A Review. Toxicol Ind Health 2018; 34: 200-10.
10- Mahajan S, Patharkar A, Kuche K, Maheshwari R, Deb PK, Kalia K, et al. Functionalized Carbon Nanotubes as Emerging Delivery System for the Treatment of Cancer. Int J Pharm 2018; 548(1): 540-58.
11- He H, Pham-Huy LA, Dramou P, Xiao D, Zuo P, Pham-Huy C. Carbon Nanotubes: Applications in Pharmacy and Medicine. Biomed Res Int 2013; 2013: 578290.
12- Al-Qattan MN, Deb PK, Tekade RK. Molecular Dynamics Simulation Strategies for Designing Carbonnanotube- Based Targeted Drug Delivery. Drug Discov Today 2018 ;23(2): 235-50.
13- Wang P, Pradhan K, Zhong XB, Ma X. Isoniazid Metabolism and Hepatotoxicity. Acta Pharm Sin B 2016; 6(5): 384-92.
14- Li M, Wei Y, Zhang G, Wang F, Li M, Soleymanabadi H. A DFT Study on the Detection of Isoniazid Drug by Pristine, Si and Al Doped C70 Fullerenes. Physica E Low Dimens Syst Nanostruct 2020; 118: 113878.
15- Rezaei-Sameti M, Moradi F. Interaction of Isoniazid Drug with the Pristine and Ni-Doped of (4, 4) Armchair Gannts: A First Principle Study. J Incl Phenom Macrocycl Chem. 2017; 88: 209-18.
16- Zarei Z, Emami A, Moghadami M, Kashkooli GS, Pirbonyeh N. Molecular Characterization of Isoniazid and Rifampicin Target Genes in Multi-Drug Resistant Mycobacterium Tuberculosis Isolates from Southwest of Iran. Gene Rep 2017; 6: 19-25.
17- Vemula SL, Gupta MT. Isoniazid Nano-Drug Delivery Systems Targeting Macrophages for the Treatment of Tuberculosis. Journal of Preventive, Diagnostic and Treatment Strategies in Medicine 2022; 1(2): 96-104.
18- Frisch A, Nielsen AB, Holder AJ, Gauss View Users Manual; Gaussian Inc, 2000.
19- Frisch MJ, Trucks GW, Schlegel HB, Scuseria GE, Robb MA, Cheeseman JR, Scalmani G, Barone V, Mennucci B, Petersson GA, et al. Gaussian 09, Revision A.01. Gaussian, Inc.; Wallingford, CT, USA: 2009.
20- Konig FB, Schonbohm J, Bayles D. AIM 2000-A Program to Analyze and Visualize Atoms in Molecules. J Comput Chem 2001; 22: 545-59.
21- Hamedani Sh, Hamedani E. Boron Nitride Nanotubes as Novel Vectors for Drug Delivery of Amino Acids: A First Principles Simulation. CHINESE J STRUC CHEM 2017; 36(9): 1562-7.
22- Rozas I, Alkorta I, Elguero J. Behavior of Ylides Containing N, O, and C Atoms as Hydrogen Bond Acceptors. J Am Chem Soc 2000; 122(45): 11154-61.
23- Popelier PL. Quantum Molecular Similarity. 1. BCP Space. J Phys Chem A 1999; 103(15): 2883-90.Ahmed SA, Rahman AA, Elsayed KN, Abd El-Mageed HR, Mohamed HS, Ahmed SA. Cytotoxic Activity, Molecular Docking, Pharmacokinetic Properties and Quantum Mechanics Calculations of the Brown Macroalga Cystoseira Trinodis Compounds. J Biomol Struct Dyn 2021; 39(11): 3855-73.
24- Shadi M, Hamedani Sh. A DFT Approach to the Adsorption of the Levodopa Anti-Neurodegenerative Drug on Pristine and Al-Doped Boron Nitride Nanotubes as a Drug Delivery Vehicle. Struct Chem 2023; 34(3): 905-14.
25- Abd El-Mageed HR, Taha M. Exploring the Intermolecular Interaction of Serine and Threonine Dipeptides with Gold Nanoclusters and Nanoparticles of Different Shapes and Sizes By Quantum Mechanics and Molecular Simulations. J Mol Liq 2019; 296: 111903.
26- El-Mageed HA, Mustafa F, Abdel-Latif MK. Boron Nitride Nanoclusters, Nanoparticles and Nanotubes as a Drug Carrier for Isoniazid Anti-Tuberculosis Drug, Computational Chemistry Approaches. J Biomol Struct Dyn 2022; 40(1): 226-35.
27- Wang Q, Zhang P, Ansari MJ, Aldawsari MF, Alalaiwe AS, Kaur J, et al. Electrostatic Interaction Assisted Ca-Decorated C20 Fullerene Loaded to Anti-Inflammatory Drugs to Manage Cardiovascular Disease Risk in Rheumatoid Arthritis Patients. J Mol Liq 2022; 350: 118564.
28- Felegari Z, Hamedani Sh. Adsorption Properties and Quantum Molecular Descriptors of the Anticancer Drug Cytophosphane on the Armchair Single-Walled Carbon Nanotubes: A DFT Study. Lett Org Chem 2022; 19(11): 1034-41.
29- Pearson RG. The Principle of Maximum Hardness. Acc Chem Res 1993; 26(5): 250-5.
30- Cao Y, Khan A, Mirzaei H, Khandoozi SR, Javan M, Lup AN, et al. Investigations of Adsorption Behavior and Anti-Cancer Activity of Curcumin on Pure and Platinum-Functionalized B12N12 Nanocages. J Mol Liq 2021; 334: 116516.
31- Karimzadeh S, Safaei B, Jen T-C. Theorical investigation of adsorption mechanism of doxorubicin anticancer drug on the pristine and functionalized single-walled carbon nanotube surface as a drug delivery vehicle: A DFT study. J. Mol. Liq 2021; 322:114890.
32- Sheikhpour M, Delorme V, Kasaeian A, Amiri V, Masoumi M, Sadeghinia M, et al. An Effective Nano Drug Delivery and Combination Therapy for the Treatment of Tuberculosis. Sci. Rep 2022; 12(1): 9591.
33- Zomorodbakhsh S, Abbasian Y, Naghinejad M, Sheikhpour M. The Effects Study of Isoniazid Conjugated Multi-Wall Carbon Nanotubes Nanofluid on Mycobacterium Tuberculosis. Int J Nanomedicine 2020; 15: 5901-9.
34- Mirali M, Jafariazar Z, Mirzaei M. Loading Tacrine Alzheimer's Drug at the Carbon Nanotube: DFT Approach. Lab-in-Silico 2021; 2(1): 3-8.
35- Ravaei I, Haghighat M, Azami SM. A DFT, AIM and NBO Study of Isoniazid Drug Delivery by Mgo Nanocage. Appl Surf Sci 2019; 469: 103-12.
36- Gnatyuk OP, Dovbeshko GI, Yershov A, Karakhim SO, Ilchenko O, Posudievsky OY. 2D-BN Nanoparticles as a Spectroscopic Marker and Drug Delivery System with Protection Properties. RSC advances 2018; 8(53): 30404-11.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







