دوره 33، شماره 7 - ( مهر 1404 )
جلد 33 شماره 7 صفحات 9215-9205 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bandad S, Habibian M. Effect of High-Intensity Interval Training and Fisetin on the Gene Expression of NLRP3 and IL18 in Kidney Tissue of Mice with Type 2 Diabetes. JSSU 2025; 33 (7) :9205-9215
URL: http://jssu.ssu.ac.ir/article-1-6450-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6450-fa.html
بنداد شیما، حبیبیان معصومه. تاثیر تمرینات تناوبی شدید و فیستین بر بیان ژنی NLRP3 و IL18 در بافت کلیه موشهای مبتلا به دیابت نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (7) :9205-9215
متن کامل [PDF 1311 kb]
(162 دریافت)
| چکیده (HTML) (390 مشاهده)
متن کامل: (96 مشاهده)
مقدمه
افزایش شیوع چاقی در سراسر جهان با همزمانی شیوع دیابت نوع2 همراه است و تجمع بیش از حد چربی بدن میتواند باعث دیابت نوع 2 شود (1). در چاقی، انرژی اضافی منجر به یک محیط استرسزا مزمن و در نتیجه هیپرتروفی بافت چربی میشود تا زمانیکه سلولهای چربی به حد انبساط خود برسند. تجمع بیش از حد گونههای لیپید سمی به صورت غیرطبیعی در اندامهای مختلف از جمله بافت کلیه، باعث ایجاد یک اثر مضر به نام سمیت چربی میشود (2). فرآیندهای التهابی در پاتوفیزیولوژی بیماری کلیوی دیابتی نیز مشارکت دارد. چنین حالت التهابی خفیف عمدتاً با افزایش سایتوکینهای پیشالتهابی، کموکاینها، مولکولهای چسبان، فاکتورهای رونویسی و نفوذ سلولهای ایمنی مشخص میشود (3). نفروپاتی از عوارض میکروواسکولار دیابت شیرین است و علت اصلی بیماریهای کلیوی در مرحله نهایی محسوب میشود (4). بروز فیبروز بینابینی کلیه، با تغییرات پاتولوژیک مشخص میشود، به طوریکه لولههای کلیوی طبیعی و ساختارهای بینابینی کلیوی با مقدار زیادی ماتریکس خارج سلولی رسوب شده جایگزین میشوند و درجه فیبروز بر عملکرد کلیه تأثیر میگذارد (5). اینترلوکین18 (IL-18) یک سایتوکین پیشالتهابی قوی است و سطوح سرمی آن پیشبینی کننده اختلال عملکرد کلیوی اولیه است (6). این سایتوکین از مونوسیت ها/ماکروفاژهای فعال ترشح میشود و تولید سایر سایتوکاینهای التهابی از جمله فاکتور نکروز تومور آلفا (TNF-α) را تحریک میکند. IL-18 اساساً در اپیتلیوم لولهای کلیه بیان میشود (4). مطالعات قبلی نشان دادند که IL-18 میتواند در پاتوژنز بیماریهای کلیوی مزمن مرتبط با دیابت و کمخونی کلیوی در بیماران مبتلا به دیابت نوع2 نقش داشته باشد (7). سطح سرمی بالاتر IL-18 (7،8)، کاهش میزان فیلتراسیون گلومرولی (7) و همبستگی آن با پارامترهای چربی، گلیسمی و التهابی در افراد دیابتی گزارش شده است (8). اینفلامازوم پروتئین گیرنده شبه NOD 3 (NLRP3) یک پروتئین کمپلکس است که به عنوان تنظیمکننده حیاتی در پاتوژنز بیماری کلیوی دیابتیک درنظر گرفته میشود (9) و نقش مهمی در بیماریهای التهابی متابولیک مختلف، مانند آترواسکلروز و دیابت دارد (10). فعال شدن NLRP3، به ویژه هنگام تحریک توسط متابولیتهای غیرطبیعی گلوکز و لیپیدها، میتواند ترشح سایتوکاینهای پیشالتهابی IL-18 را تشدید کند و با ایجاد آبشارهای التهابی منجر به شروع آسیب حاد کلیه، فیبروز و بیماری مزمن کلیوی شود (10،11). ماکروفاژهای کلیوی دارای تمام اجزای اینفلامازوم NLRP3 هستند که پس از فعال شدن،پیروپتوز را القا میکنند. بنابراین بررسی اینفلامازوم NLRP3 و اجزای سیگنالینگ آن میتواند عوامل درمانی بالقوهای را علیه بیماری کلیوی آشکار سازد (11). مشاهده شده است که بسیاری از محصولات طبیعی دارای خواص ضدالتهابی عالی هستند و ممکن است با مهار NLRP3، بیماری کلیوی دیابتی را کاهش دهند (9). فیستین یک فلاونوئید طبیعی با اثرات ضد التهابی، آنتیاکسیدانی، ضد توموری است که عمدتاً در میوهها و سبزیجات مختلف مانند سیب، خرمالو، انگور، توت فرنگی، خیار و پیاز یافت میشود (10) و نقش مهمی در کاهش گلوکز و چربی خون دارد (12،13). گزارشهای گستردهای مبنی بر تأثیر فیستین در بهبود انواع مختلف آسیبهای کلیوی منتشر شده است. با اینحال، مکانیسمهای عملکرد آن در برابر آسیب کلیوی ناشی از دیابت مرتبط با چاقی هنوز مشخص نیست (12،14). امروزه تمرین ورزشی یک رویکرد ایمن و غیردارویی در پیشگیری و کاهش عوارض ناشی از آسیب کلیوی دیابتی محسوب میشود (3). مشاهده شده است که تمرینات تناوبی شدید (HIIT) در مقایسه با سایر روشهای ورزشی با توسعه بهتری در حساسیت به انسولین، تراکم میتوکندری، آنزیمهای اکسایشی، عملکرد ایمنی و برونده قلبی همراه بوده است (16،15). این تمرینات یک گزینه مناسب برای کنترل و بهبود هیپرگلیسمی، ترکیب بدن، تنظیم فشارخون و بهبود پروفایل چربی در افراد مبتلا به دیابت نوع 2 است (17). اما محققین دیگر گزارش دادند که HIIT اگرچه هموستاز گلوکز را در موشهای مبتلا به دیابت نوع2 بهبود بخشید ولی منجر به فیبروز و آسیب کلیوی شد (18). مشخص شده است که سبک زندگی بیتحرک با افزایش بروز دیابت مرتبط است در حالیکه تمرین ورزشی کنترل متابولیک را بهبود میبخشد و ممکن است به پیشگیری از عوارض بیماریهای مزمن مختلف کمک کند (3). بهعلاوه شرکت در فعالیتهای ورزشی منظم، به عنوان یک عامل جایگزین برای بهبود پاسخهای متابولیک سلولی و حساسیت به انسولین، برای تسکین دیابت تجویز میشود (19). با این وجود اثربخشی ورزش به عوامل مختلفی از جمله شدت و مدت زمان بستگی دارد و تأثیر تمرینات ورزشی از جمله HIIT بر مهار یا کاهش مکانیسمهای پاتوفیزیولوژیکی درگیر در ایجاد و پیشرفت بیماری کلیوی دیابتی مشخص نیست (3). این در حالی است که علیرغم درمانهای دارویی موجود به منظور هدف قرار دادن کنترل گلوگز خون، بروز بیماری کلیوی دیابتی همچنان در حال افزایش است. بنابراین، استراتژیهای جدید برای جلوگیری یا کاهش پیشرفت بیماری کلیوی دیابتی و اثرات آن بر اندامهای بدن اهمیت بسیاری دارد. لذا با توجه به نقش NLRP-3 و IL-18 در پاتوژنز کلیوی دیابت نوع2، درک بهتر از مکانیسم غیردارویی مانند استفاده از فلاونوئید طبیعی فیستین و HIIT در درمان این بیماری ضروری بهنظر میرسد. این مطالعه نیز با هدف بررسی تاثیر HIIT و فیستین بر بیان ژنی پروتئینهای التهابی NLRP3 و IL-18 در بافت کلیه موشهای مبتلا به دیابت نوع 2 انجام شده است.
روش بررسی
این مطالعه، یک تحقیق تجربی است و در یک طرح پس آزمون همراه با گروه کنترل انجام شد. در ابتدا 30 سر موش نرنژاد C57bl/6 4 هفتهای با میانگین وزن 2±14 گرم از موسسه بیوتکنولوژی رویان اصفهان خریداری شد و بهطور تصادفی، به 2 گروه اصلی کنترل سالم با رژیم غذایی نرمال (6 سر) و رژیم غذایی پرچرب (24 سر) تقسیم شدند. در طول مدت آزمایش، تمامی حیوانات در دمای کنترل شده 21 درجه سانتیگراد (2±) و رطوبت 65% (5%±) در قفسهای مخصوص از جنس پلکسی گلاس با درب توری و ابعاد 25 در 27 در 14 سانتیمتر نگهداری شدند (سه سر رت در هر قفس) و آزادانه به آب و غذا دسترسی داشتند. دیابت نوع 2 با مصرف رژیم غذایی پرچرب (شامل 45% چربی، 35% کربوهیدرات و 20% پروتئین) القا شد. بدین منظور رژیم غذایی موشها با غذای معمولی و پرچرب شروع شد و بهتدریج طی 2 هفته به غذای پرچرب تغییر کرد تا حیوانات با این رژیم غذایی غنی از چربی سازگار شدند. سپس 16 هفته تیمار با رژیم غذایی پرچرب ادامه داشت. پس از 16 هفته نمونه خونی از دم موشها اخذ شد و سطح بالای گلوکز 250 میلیگرم/دسیلیتر نشان دهنده القای دیابت نوع 2 بوده است (20،21). پس از تایید القا دیابت نوع 2 موشهای دیابتیشده بهطور تصادفی به 4 گروه دیابت-کنترل، دیابت-تمرین، دیابت-فیستین و دیابت-تمرین–فیستین (ترکیبی) تقسیم شدند (6 سر در هر گروه) و رژیم غذایی غنی از چربی برای تمامی گروههای دیابتی ادامه داشت و گروه کنترل هم تحت مداخلهای قرار نگرفت. در تمامی دوره تحقیق حیوانات توسط یک نفر جابه جا و دستکاری شدند. مراقبت از حیوانات نیز مطابق با دستورالعملهای و پروتکلهای اخلاقی بود. پس از حل کردن پودر فیستین (hanghai Yuanye Bio-Technology Co) در حلال دیمتیلسولفید، مکمل فیستین تهیه شد و روزانه با دوز 20 میلیگرم به ازای هر کیلوگرم وزن بدن بهصورت درونصفاقی به مدت 8 هفته به موشهای گروههای دیابت-فیستین و ترکیبی تزریق شد (22). یک هفته قبل از شروع پروتکل، حیوانات با چگونگی اجرای تمرینات بهصورت دویدن روی نوارگردان با سرعت 5 متر/ دقیقه، به مدت 10 تا 20 دقیقه در روز، و 5 روز در هفته آشنا شدند. برنامه تمرینی شامل 5 دقیقه گرم کردن، برنامه اصلی (16 تا 40 دقیقه) و 5 دقیقه سرد کردن بود. HIITشامل وهلههای 2 دقیقهای دویدن روی نوارگردان با شدت 80 درصد توان هوازی حداکثر با وهلههای استراحت دو دقیقهای با شدت 50 درصد توان هوازی حداکثر و 2 تکرار در هفته اول بود که در هفته به چهارم به 8 وهله 2 دقیقهای با شدت 110 درصد توان هوازی حداکثر با وهلههای استراحت دو دقیقهای با شدت 50 درصد توان هوازی حداکثر و 8 تکرار رسید که تا هفته هشتم ثابت بود. برای تعیین توان هوازی، در ابتدا حیوانات با سرعت 8 متر در دقیقه روی نوارگردان شروع به دویدن کردند بهطوریکه با افزایش سرعت 2متر/دقیقه در هر یک دقیقه، به سرعت 20 متر بر دقیقه رسیده و 5 دقیقه با این سرعت دویدند. در مرحله بعد حیوانات به مدت 10دقیقه با سرعت به 25 متر در دقیقه، دویدند. در انتها سرعت نوارگردان به 30 متر در دقیقه افزایش داده شد و حیوانات تا رسیدن به واماندگی دویدند. عدم واکنش موشها به سه بار شوک الکتریکی تعبیه شده در ابتدای نوارگردان رسیدن به واماندگی در نظر گرفته شد که به حالت خوابیدن به پشت باقی میماندند (23).
48 ساعت پس از آخرین مداخلههای تمرینی و مکملدهی، حیوانات با تزریق داخل صفاقی مخلوط کتامین 11 درصد (دوز 51 میلیگرم بر کیلوگرم) و زایلوزین 2 درصد (دوز 11 میلیگرم بر کیلوگرم) بیهوش شدند. سپس قفسه سینه حیوان شکافته شده و نمونه خونی برای اندازهگیری گلوگز خون در پایان پروتکل، بهطور مستقیم از قلب حیوان گرفته شد. در ادامه کلیه جدا شد و پس از شستشو در سرم فیزیولوژیک در نیتروژن مایع فریرز شد. سطوح قند خون ناشتا (FBS) با استفاده از یک گلوکومتر Alpha TRAK و نوارهای استاندارد آن (Zoetis، ایالات متحده) اندازهگیری شد. بیان ژنهای NLRP3 و IL-18 به روش کمی Real-Time PCR تعیین شد. پس از استخراج (Ribonucleic Acid)RNA با غلظت و خلوص بالا، مراحل سنتز (Complementary DNA)cDNA انجام شد. ساخت cDNA از روی RNA الگو با استفاده از آنزیم رونوشت بردار معکوس و دو نوع پرایمر هگزامرهای تصادفی و الیگو dT و کیت Revert Aid First strand cDNA synthesis محصول شرکت تجاری Takara آلمان انجام شد. پرایمرهای موردنظر جهت بررسی ژنهای در نظر گرفته شده در این آزمایش توسط نرمافزار BeaconDesigner و Oligo7 طراحی شدند (جدول 1). از B2m به عنوان ژن کنترل استفاده شد. بهعلاوه نسبت بیان هر ژن با استفاده از روش چرخه آستانه CT (2-CTΔΔ)با فرمول محاسبه شد.
تجزیه و تحلیل آماری:
برای توصیف دادهها از شاخصهای مرکزی و پراکندگی استفاده شد. هم چنین طبیعی بودن توزیع دادهها با استفاده از آزمون شاپیرو ویلک و تجانس واریانسها با استفاده از آزمون لون بررسی شد. سپس از آزمون تحلیل واریانس یکراهه و آزمون تعقیبی بن فرونی برای مقایسه بیان ژنها در گروه های پژوهش استفاده شد. تمامی تجزیه و تحلیل آماری با استفاده از نرمافزارversion 16 SPSS در سطوح معناداری 0/05>P انجام شد.
جدول1: توالی پرایمر متغیرهای تحقیق

نتایج
نتایج نشان داد که بین بیان ژنی NLRP3 (P<0/001 ؛ F=116/557) و IL-18 (P<0/001 ؛ F=173/228) در بافت کلیه و سطوح سرمی گلوگز (P<0/001 ؛ F=157/358) گروههای مختلف تفاوت معناداری وجود دارد. همچنین القای دیابت منجر به افزایش بیان ژنی NLRP3 (P<0/001) و IL-18(P<0/001) بافت کلیه و افزایش سطوح سرمی گلوگز (P<0/001) در موشهای مبتلا به دیابت نوع 2 در مقایسه با گروه کنترل سالم شد. همچنین اختلاف معناداری بین بیان ژنی NLRP3 (به ترتیب P=0/004 , P=0/004 , p<0/001؛ شکل1)، IL-18 (به ترتیب P<0/001 , P<0/001 , p<0/001؛ شکل2) بافت کلیه و سطوح سرمی گلوگز (به ترتیب P<0/001 , P<0/001 , p<0/001؛ شکل3 )گروههای دیابت-تمرین، دیابت-فیستین و دیابت-تمرین–فیستین با گروه دیابت مشاهده شد. به علاوه بین مقادیر بیان ژنی NLRP3 گروههای دیابت-تمرین (0/001>P)، دیابت-فیستین (0/001>P) با گروه کنترل سالم اختلاف معناداری وجود داشت اما بین گروههای دیابت- تمرین– فیستین و کنترل این اختلاف معنادار نبوده است (0/326=P). در مقایسه مقادیر بیان ژنی IL-18 و سطوح سرمی گلوگز نیز اختلاف معناداری بین گروههای دیابت- تمرین، دیابت- فیستین و دیابت-تمرین–فیستین با گروه کنترل مشاهده شد (0/001>P). همچنین اختلاف معناداری بین بیان ژنی NLRP3 گروههای دیابت-تمرین و دیابت-فیسیتن وجود داشت (0/001>P) اما بین بیان ژنی IL-18 بافت کلیه (0/284=P) و سطوح سرمی گلوگز (0/805=P) گروههای دیابت-تمرین و دیابت-فیسیتن تفاوت معناداری مشاهده نشد. با این وجود تاثیر مداخله ترکیبی در کاهش بیان ژنی NLRP3 (به ترتیب0/001>P و0/001>P) و IL-18 (به ترتیب0/001>P و0/001>P) بافت کلیه و کاهش سطوح سرمی گلوگز (به ترتیب0/001>P و 0/001>P) در مقایسه با دو مداخله دیگر بهطور معناداری بالاتر بود.
.JPG)
شکل 1: مقایسه بیان ژنی NLRP3بافت کلیه در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین
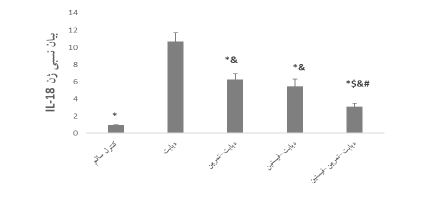
شکل 2: مقایسه بیان ژنی IL-18 بافت کلیه در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین
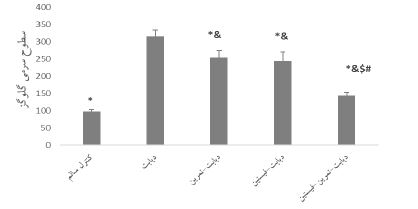
شکل 3: مقایسه سطوح سرمی گلوگز در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین
بحث
مطالعه حاضر با هدف بررسی تاثیر HIIT و فیستین بر بیان ژنی NLRP3 و IL18 در بافت کلیه موشها با استفاده از یک مدل القای دیابت نوع 2 از طریق مصرف غذای پرچرپ انجام شد. نتایج نشان داد که القای دیابت با افزایش بیان ژنی NLRP3 و IL-18 در بافت کلیه و افزایش سطوح سرمی گلوگز در موشهای مبتلا به دیابت نوع 2 در مقایسه با گروه سالم شد. مشابه با یافتههای تحقیق حاضر ایسکندر و همکاران در سال 2023 نشان دادند که القای دیابت، با افزایش سطوح IL-18 در بافت کلیه همراه بوده است (4). در یک مطالعه اخیر نیز نشان داده شد که NLRP3 با مهار اتوفاژی در پودوسیتها، آسیب کلیوی را در مدل موشهای نفروپاتی دیابتی واسطهگری میکند (24). یانگ و همکاران (23) در یک مطالعه بر روی 153 بیمار مبتلا به دیابت نوع 2 با سطوح مختلف نفروپاتی دیابتی نشان دادند که سطوح NLRP3 و IL-18 در همه رده ها به طور قابل توجهی بالاتر از افراد سالم بوده است و همبستگی مثبت و معناداری بین مقادیر NLRP3 و IL-18 با مراحل نفروپاتی دیابتی وجود داشته است (25). فعال شدن اینفلامازوم ناشی از گلوکز، تمایز سلولهای اپیتلیال توبولی کلیوی را افزایش میدهد، که نشان میدهد اینفلامازوم NLRP3 نقش کلیدی در تمایز سلولهای اپیتلیال دارد (26). بهعلاوه یافتههای تحقیق حاضر نشان داد که 8 هفته تیمار با فیستین منجر به کاهش بیان ژنی NLRP3 و IL-18 بافت کلیه و کاهش سطوح سرمی گلوگز نسبت به گروه دیابت شده است. در این راستا دانگ و همکاران در سال 2022 در بررسی مکانیسمهای فیستین در آسیب پودوسیت ناشی از نفروپاتی دیابتی نشان دادند که فیستین آسیب پودوسیت ناشی از گلوکز بالا و نفروپاتی دیابتی ناشی از استرپتوزوتوسین را در موشها بهبود بخشید که با مهار بیان NLRP3 همراه بوده است (12). بهعلاوه در یک مطالعه دیگر گزارش شده است که 16 هفته تیمار با رژیم غذایی پرچرب با افزایش قابلتوجه وزن بدن، مقاومت به انسولین و عدم تحمل گلوکز قابلتوجه در موشهای C57BL/6 همراه بود در حالیکه تیمار با فیستین به کاهش سایتوکاینهای پیشالتهابی از جمله IL-1β ،TNF-α و IL-18 و کاهش بیان NLRP3 و مهار سیگنالینگ فاکتور هستهای κB (NF-κB) منجر شد (27). رن و همکاران در سال 2020 نشان دادند که تزریق لیپوپلیساکارید به موشهای نر C57BL/6 J، منجر به تولید سایتوکاینهای پیش التهابی و پروتئینهای مرتبط با التهاب در کلیهها شد. با اینحال، فیستین با مهار بیان کلیوی IL-6، IL-1β، TNF-α پاسخ التهابی را بهبود بخشید (14). در شرایط هایپرگلیسمی، سلولهای سیستم ایمنی طبیعی و ثانویه، سایتوکینهای التهابی را سنتز و ترشح میکنند و فیستین از طریق تغییرات اپیژنتیکی شامل فاکتور هستهای کاپا B (NF-κB)، تولید سایتوکاین ناشی از هایپرگلیسمی را در مونوسیتها مهار میکند (13). گزارش شده است که فیستین فعال شدن اینفلامازوم NLRP3 و بلوغ بعدی اینترلوکین 1بتا (IL-1β) را کاهش میدهد و میتواند از تجمع میتوکندریهای آسیب دیده و تولید بیش از حد گونههای اکسیژن فعال (ROS) میتوکندری جلوگیری نماید (28). از جمله یافتههای مهم دیگر در تحقیق حاضر، تاثیر HIIT در تنظیم منفی بیان ژنی NLRP3 و IL-18 بافت کلیه و کاهش سطوح سرمی گلوگز بوده است. اما مداخله ترکیبی HIIT و فیستین با کاهش بیشتر التهاب کلیه بواسطه کاستن قابل توجه بیان ژنی NLRP3 و IL-18 منجر شد که نشان دهنده اثرات سینرژی یا همافزایی این دو مداخله در کاهش التهاب بافت کلیه در شرایط دیابت نوع 2 است. با این وجود تاثیر مداخله تمرینی در تنظیم منفی NLRP3 در مقایسه با فیستین بهطور معناداری بالاتر بود. مشابه با یافتههای تحقیق حاضر محققین نشان دادند که 8 هفته تمرین هوازی (5 روز در هفته و به مدت 60 دقیقه دویدن در روز) منجر به کاهش سطوح IL-18، کاهش فسفوریلاسیون NF-κB p65 و همچنین کاهش بیان NLRP3 در بافت کلیه موشهای db/db دیابتی شد (29). همچنین فاطمی و همکاران در سال2022 در بررسی اثر شدتهای مختلف تمرینی بر بیان ژنNLRP-3 بافت پانکراس موشهای دیابتی نشان دادند که هر دو نوع تمرین تناوبی با شدت متوسط (شامل 13 وهله 4 دقیقهای دویدن؛ با شدت 70-65 % سرعت بیشینه) و HIIT (شامل 10 وهله 4 دقیقهای دویدن؛ با شدت 90-85 % سرعت بیشینه) منجر به کاهش معنادار بیان اینفلامازوم NLRP3 بافت پانکراس و همچنین کاهش گلوگز در مقایسه با گروه دیابتی شد به طوریکه HIIT به کاهش بیشتر این ژن منتج شد (30). همچنین خدایی و همکاران در سال 2024 گزارش دادند که القا دیابت با افزایش سطوح NLRP3 بافت قلبی موشهای صحرایی مبتلا به دیابت نوع دوم همراه بود که به دنبال8 هفته HIIT (شامل 6 تا 12 تناوب دو دقیقهای با شدت 90 درصد سرعت بیشینه همراه با دوره یک دقیقهای با شدت 10 درصد سرعت بیشینه دویدن روی نوارگردان و 5 بار در هفته) کاهش یافت (16). بهعلاوه کاهش معنادار بیان ژنی پروتئین NLRP-3 بافت چربی احشایی، پس از 8 هفته تمرین استقامتی با شدت متوسط و زیاد نیز توسط محققین دیگر گزارش شده است (31). تمرین ورزشی با افزایش برونده قلبی و انقباض عروق کلیوی باعث ایجاد تنش برشی ودر نتیجه تولید نیتریک اکسید میشود. افزایش سطح نیتریک اکسید نیز بهواسطه کاهش فیبروز منجر به افزایش رگزایی و بهبود عملکرد اندوتلیال میگردد (3). شواهد اخیر نشان میدهد که کمپلکس التهابی NLRP3 و فاکتورهای پاییندست آن، IL-1β و IL-18، در موشهای فاقد NLRP3 بهطور قابلتوجهی کاهش یافتهاند، که تأکید میکند NLRP3 برای تولید سایتوکاین التهابی ضروری است (26). بنابراین HIIT ممکن است از طریق کاهش اینفلازوم NLRP3 و در نتیجه تنظیم منفی IL-18 در بافت کلیه، به بهبود عملکرد کلیه در مقابل آسیب ناشی از دیابت نوع 2 کمک نماید و همزمانی HIIT با مصرف فیستین با تقویت این اثرات همراه است. از جمله محدودیتهای مطالعه حاضر میتوان به نبود مطالعات مربوط به اثر HIIT و یا سایر تمرینات ورزشی بر مسیرNLRP3/IL-18 بافت کلیه دیابتی اشاره نمود. لذا پیشنهاد میشود در مطالعات دیگر تاثیر انواع تمرینات ورزشی بر مسیر التهابی فوق بررسی شود.
نتیجهگیری
نتایج حاصل از تحقیق حاضر نشان میدهد که القای دیابت نوع 2 با آسیب کلیوی بهواسطه افزایش پروتئینهای التهابی NLRP3 و IL-18 همراه بوده است و مداخلههای تمرینی HIIT و فیستین هر یک بهتنهایی میتوانند منجر به تنظیم منفی بیان ژنی NLRP3 و IL-18 و در نتیجه بهبود عملکرد کلیه شوند. اما مداخله ترکیبی HIIT و فیستین ممکن است تاثیر بیشتری در کاهش التهاب بافت کلیه از طریق مهار بیان ژنی محور NLRP3/IL-18 ، در مقایسه با دو مداخله دیگر داشته باشد. با توجه به اثرات متبت مکمل فیستین بهنظر میرسد نیاز بیشتری به انجام تحقیقات در این زمینه وجود دارد تا مکانیسم های احتمالی مشخص گردد.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد گرایش فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد قائمشهر است. بدینوسیله از کلیه افرادی که در این تحقیق ما را یاری نمودند تشکر و قدردانی می شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پژوهش توسط کمیته تخصصی اخلاق در پژوهشهای زیستی دانشگاه آزاد واحد ساری تصویب شد(کد اخلاق: IR.IAU.SARI.REC.1403.329).
مشارکت نویسندگان
معصومه حبیبیان در ارائه ایده، معصومه حبیبیان در طراحی مطالعه، شیما بنداد در جمعآوری دادهها، معصومه حبیبیان و شیما بنداد در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
افزایش شیوع چاقی در سراسر جهان با همزمانی شیوع دیابت نوع2 همراه است و تجمع بیش از حد چربی بدن میتواند باعث دیابت نوع 2 شود (1). در چاقی، انرژی اضافی منجر به یک محیط استرسزا مزمن و در نتیجه هیپرتروفی بافت چربی میشود تا زمانیکه سلولهای چربی به حد انبساط خود برسند. تجمع بیش از حد گونههای لیپید سمی به صورت غیرطبیعی در اندامهای مختلف از جمله بافت کلیه، باعث ایجاد یک اثر مضر به نام سمیت چربی میشود (2). فرآیندهای التهابی در پاتوفیزیولوژی بیماری کلیوی دیابتی نیز مشارکت دارد. چنین حالت التهابی خفیف عمدتاً با افزایش سایتوکینهای پیشالتهابی، کموکاینها، مولکولهای چسبان، فاکتورهای رونویسی و نفوذ سلولهای ایمنی مشخص میشود (3). نفروپاتی از عوارض میکروواسکولار دیابت شیرین است و علت اصلی بیماریهای کلیوی در مرحله نهایی محسوب میشود (4). بروز فیبروز بینابینی کلیه، با تغییرات پاتولوژیک مشخص میشود، به طوریکه لولههای کلیوی طبیعی و ساختارهای بینابینی کلیوی با مقدار زیادی ماتریکس خارج سلولی رسوب شده جایگزین میشوند و درجه فیبروز بر عملکرد کلیه تأثیر میگذارد (5). اینترلوکین18 (IL-18) یک سایتوکین پیشالتهابی قوی است و سطوح سرمی آن پیشبینی کننده اختلال عملکرد کلیوی اولیه است (6). این سایتوکین از مونوسیت ها/ماکروفاژهای فعال ترشح میشود و تولید سایر سایتوکاینهای التهابی از جمله فاکتور نکروز تومور آلفا (TNF-α) را تحریک میکند. IL-18 اساساً در اپیتلیوم لولهای کلیه بیان میشود (4). مطالعات قبلی نشان دادند که IL-18 میتواند در پاتوژنز بیماریهای کلیوی مزمن مرتبط با دیابت و کمخونی کلیوی در بیماران مبتلا به دیابت نوع2 نقش داشته باشد (7). سطح سرمی بالاتر IL-18 (7،8)، کاهش میزان فیلتراسیون گلومرولی (7) و همبستگی آن با پارامترهای چربی، گلیسمی و التهابی در افراد دیابتی گزارش شده است (8). اینفلامازوم پروتئین گیرنده شبه NOD 3 (NLRP3) یک پروتئین کمپلکس است که به عنوان تنظیمکننده حیاتی در پاتوژنز بیماری کلیوی دیابتیک درنظر گرفته میشود (9) و نقش مهمی در بیماریهای التهابی متابولیک مختلف، مانند آترواسکلروز و دیابت دارد (10). فعال شدن NLRP3، به ویژه هنگام تحریک توسط متابولیتهای غیرطبیعی گلوکز و لیپیدها، میتواند ترشح سایتوکاینهای پیشالتهابی IL-18 را تشدید کند و با ایجاد آبشارهای التهابی منجر به شروع آسیب حاد کلیه، فیبروز و بیماری مزمن کلیوی شود (10،11). ماکروفاژهای کلیوی دارای تمام اجزای اینفلامازوم NLRP3 هستند که پس از فعال شدن،پیروپتوز را القا میکنند. بنابراین بررسی اینفلامازوم NLRP3 و اجزای سیگنالینگ آن میتواند عوامل درمانی بالقوهای را علیه بیماری کلیوی آشکار سازد (11). مشاهده شده است که بسیاری از محصولات طبیعی دارای خواص ضدالتهابی عالی هستند و ممکن است با مهار NLRP3، بیماری کلیوی دیابتی را کاهش دهند (9). فیستین یک فلاونوئید طبیعی با اثرات ضد التهابی، آنتیاکسیدانی، ضد توموری است که عمدتاً در میوهها و سبزیجات مختلف مانند سیب، خرمالو، انگور، توت فرنگی، خیار و پیاز یافت میشود (10) و نقش مهمی در کاهش گلوکز و چربی خون دارد (12،13). گزارشهای گستردهای مبنی بر تأثیر فیستین در بهبود انواع مختلف آسیبهای کلیوی منتشر شده است. با اینحال، مکانیسمهای عملکرد آن در برابر آسیب کلیوی ناشی از دیابت مرتبط با چاقی هنوز مشخص نیست (12،14). امروزه تمرین ورزشی یک رویکرد ایمن و غیردارویی در پیشگیری و کاهش عوارض ناشی از آسیب کلیوی دیابتی محسوب میشود (3). مشاهده شده است که تمرینات تناوبی شدید (HIIT) در مقایسه با سایر روشهای ورزشی با توسعه بهتری در حساسیت به انسولین، تراکم میتوکندری، آنزیمهای اکسایشی، عملکرد ایمنی و برونده قلبی همراه بوده است (16،15). این تمرینات یک گزینه مناسب برای کنترل و بهبود هیپرگلیسمی، ترکیب بدن، تنظیم فشارخون و بهبود پروفایل چربی در افراد مبتلا به دیابت نوع 2 است (17). اما محققین دیگر گزارش دادند که HIIT اگرچه هموستاز گلوکز را در موشهای مبتلا به دیابت نوع2 بهبود بخشید ولی منجر به فیبروز و آسیب کلیوی شد (18). مشخص شده است که سبک زندگی بیتحرک با افزایش بروز دیابت مرتبط است در حالیکه تمرین ورزشی کنترل متابولیک را بهبود میبخشد و ممکن است به پیشگیری از عوارض بیماریهای مزمن مختلف کمک کند (3). بهعلاوه شرکت در فعالیتهای ورزشی منظم، به عنوان یک عامل جایگزین برای بهبود پاسخهای متابولیک سلولی و حساسیت به انسولین، برای تسکین دیابت تجویز میشود (19). با این وجود اثربخشی ورزش به عوامل مختلفی از جمله شدت و مدت زمان بستگی دارد و تأثیر تمرینات ورزشی از جمله HIIT بر مهار یا کاهش مکانیسمهای پاتوفیزیولوژیکی درگیر در ایجاد و پیشرفت بیماری کلیوی دیابتی مشخص نیست (3). این در حالی است که علیرغم درمانهای دارویی موجود به منظور هدف قرار دادن کنترل گلوگز خون، بروز بیماری کلیوی دیابتی همچنان در حال افزایش است. بنابراین، استراتژیهای جدید برای جلوگیری یا کاهش پیشرفت بیماری کلیوی دیابتی و اثرات آن بر اندامهای بدن اهمیت بسیاری دارد. لذا با توجه به نقش NLRP-3 و IL-18 در پاتوژنز کلیوی دیابت نوع2، درک بهتر از مکانیسم غیردارویی مانند استفاده از فلاونوئید طبیعی فیستین و HIIT در درمان این بیماری ضروری بهنظر میرسد. این مطالعه نیز با هدف بررسی تاثیر HIIT و فیستین بر بیان ژنی پروتئینهای التهابی NLRP3 و IL-18 در بافت کلیه موشهای مبتلا به دیابت نوع 2 انجام شده است.
روش بررسی
این مطالعه، یک تحقیق تجربی است و در یک طرح پس آزمون همراه با گروه کنترل انجام شد. در ابتدا 30 سر موش نرنژاد C57bl/6 4 هفتهای با میانگین وزن 2±14 گرم از موسسه بیوتکنولوژی رویان اصفهان خریداری شد و بهطور تصادفی، به 2 گروه اصلی کنترل سالم با رژیم غذایی نرمال (6 سر) و رژیم غذایی پرچرب (24 سر) تقسیم شدند. در طول مدت آزمایش، تمامی حیوانات در دمای کنترل شده 21 درجه سانتیگراد (2±) و رطوبت 65% (5%±) در قفسهای مخصوص از جنس پلکسی گلاس با درب توری و ابعاد 25 در 27 در 14 سانتیمتر نگهداری شدند (سه سر رت در هر قفس) و آزادانه به آب و غذا دسترسی داشتند. دیابت نوع 2 با مصرف رژیم غذایی پرچرب (شامل 45% چربی، 35% کربوهیدرات و 20% پروتئین) القا شد. بدین منظور رژیم غذایی موشها با غذای معمولی و پرچرب شروع شد و بهتدریج طی 2 هفته به غذای پرچرب تغییر کرد تا حیوانات با این رژیم غذایی غنی از چربی سازگار شدند. سپس 16 هفته تیمار با رژیم غذایی پرچرب ادامه داشت. پس از 16 هفته نمونه خونی از دم موشها اخذ شد و سطح بالای گلوکز 250 میلیگرم/دسیلیتر نشان دهنده القای دیابت نوع 2 بوده است (20،21). پس از تایید القا دیابت نوع 2 موشهای دیابتیشده بهطور تصادفی به 4 گروه دیابت-کنترل، دیابت-تمرین، دیابت-فیستین و دیابت-تمرین–فیستین (ترکیبی) تقسیم شدند (6 سر در هر گروه) و رژیم غذایی غنی از چربی برای تمامی گروههای دیابتی ادامه داشت و گروه کنترل هم تحت مداخلهای قرار نگرفت. در تمامی دوره تحقیق حیوانات توسط یک نفر جابه جا و دستکاری شدند. مراقبت از حیوانات نیز مطابق با دستورالعملهای و پروتکلهای اخلاقی بود. پس از حل کردن پودر فیستین (hanghai Yuanye Bio-Technology Co) در حلال دیمتیلسولفید، مکمل فیستین تهیه شد و روزانه با دوز 20 میلیگرم به ازای هر کیلوگرم وزن بدن بهصورت درونصفاقی به مدت 8 هفته به موشهای گروههای دیابت-فیستین و ترکیبی تزریق شد (22). یک هفته قبل از شروع پروتکل، حیوانات با چگونگی اجرای تمرینات بهصورت دویدن روی نوارگردان با سرعت 5 متر/ دقیقه، به مدت 10 تا 20 دقیقه در روز، و 5 روز در هفته آشنا شدند. برنامه تمرینی شامل 5 دقیقه گرم کردن، برنامه اصلی (16 تا 40 دقیقه) و 5 دقیقه سرد کردن بود. HIITشامل وهلههای 2 دقیقهای دویدن روی نوارگردان با شدت 80 درصد توان هوازی حداکثر با وهلههای استراحت دو دقیقهای با شدت 50 درصد توان هوازی حداکثر و 2 تکرار در هفته اول بود که در هفته به چهارم به 8 وهله 2 دقیقهای با شدت 110 درصد توان هوازی حداکثر با وهلههای استراحت دو دقیقهای با شدت 50 درصد توان هوازی حداکثر و 8 تکرار رسید که تا هفته هشتم ثابت بود. برای تعیین توان هوازی، در ابتدا حیوانات با سرعت 8 متر در دقیقه روی نوارگردان شروع به دویدن کردند بهطوریکه با افزایش سرعت 2متر/دقیقه در هر یک دقیقه، به سرعت 20 متر بر دقیقه رسیده و 5 دقیقه با این سرعت دویدند. در مرحله بعد حیوانات به مدت 10دقیقه با سرعت به 25 متر در دقیقه، دویدند. در انتها سرعت نوارگردان به 30 متر در دقیقه افزایش داده شد و حیوانات تا رسیدن به واماندگی دویدند. عدم واکنش موشها به سه بار شوک الکتریکی تعبیه شده در ابتدای نوارگردان رسیدن به واماندگی در نظر گرفته شد که به حالت خوابیدن به پشت باقی میماندند (23).
48 ساعت پس از آخرین مداخلههای تمرینی و مکملدهی، حیوانات با تزریق داخل صفاقی مخلوط کتامین 11 درصد (دوز 51 میلیگرم بر کیلوگرم) و زایلوزین 2 درصد (دوز 11 میلیگرم بر کیلوگرم) بیهوش شدند. سپس قفسه سینه حیوان شکافته شده و نمونه خونی برای اندازهگیری گلوگز خون در پایان پروتکل، بهطور مستقیم از قلب حیوان گرفته شد. در ادامه کلیه جدا شد و پس از شستشو در سرم فیزیولوژیک در نیتروژن مایع فریرز شد. سطوح قند خون ناشتا (FBS) با استفاده از یک گلوکومتر Alpha TRAK و نوارهای استاندارد آن (Zoetis، ایالات متحده) اندازهگیری شد. بیان ژنهای NLRP3 و IL-18 به روش کمی Real-Time PCR تعیین شد. پس از استخراج (Ribonucleic Acid)RNA با غلظت و خلوص بالا، مراحل سنتز (Complementary DNA)cDNA انجام شد. ساخت cDNA از روی RNA الگو با استفاده از آنزیم رونوشت بردار معکوس و دو نوع پرایمر هگزامرهای تصادفی و الیگو dT و کیت Revert Aid First strand cDNA synthesis محصول شرکت تجاری Takara آلمان انجام شد. پرایمرهای موردنظر جهت بررسی ژنهای در نظر گرفته شده در این آزمایش توسط نرمافزار BeaconDesigner و Oligo7 طراحی شدند (جدول 1). از B2m به عنوان ژن کنترل استفاده شد. بهعلاوه نسبت بیان هر ژن با استفاده از روش چرخه آستانه CT (2-CTΔΔ)با فرمول محاسبه شد.
تجزیه و تحلیل آماری:
برای توصیف دادهها از شاخصهای مرکزی و پراکندگی استفاده شد. هم چنین طبیعی بودن توزیع دادهها با استفاده از آزمون شاپیرو ویلک و تجانس واریانسها با استفاده از آزمون لون بررسی شد. سپس از آزمون تحلیل واریانس یکراهه و آزمون تعقیبی بن فرونی برای مقایسه بیان ژنها در گروه های پژوهش استفاده شد. تمامی تجزیه و تحلیل آماری با استفاده از نرمافزارversion 16 SPSS در سطوح معناداری 0/05>P انجام شد.
جدول1: توالی پرایمر متغیرهای تحقیق

نتایج
نتایج نشان داد که بین بیان ژنی NLRP3 (P<0/001 ؛ F=116/557) و IL-18 (P<0/001 ؛ F=173/228) در بافت کلیه و سطوح سرمی گلوگز (P<0/001 ؛ F=157/358) گروههای مختلف تفاوت معناداری وجود دارد. همچنین القای دیابت منجر به افزایش بیان ژنی NLRP3 (P<0/001) و IL-18(P<0/001) بافت کلیه و افزایش سطوح سرمی گلوگز (P<0/001) در موشهای مبتلا به دیابت نوع 2 در مقایسه با گروه کنترل سالم شد. همچنین اختلاف معناداری بین بیان ژنی NLRP3 (به ترتیب P=0/004 , P=0/004 , p<0/001؛ شکل1)، IL-18 (به ترتیب P<0/001 , P<0/001 , p<0/001؛ شکل2) بافت کلیه و سطوح سرمی گلوگز (به ترتیب P<0/001 , P<0/001 , p<0/001؛ شکل3 )گروههای دیابت-تمرین، دیابت-فیستین و دیابت-تمرین–فیستین با گروه دیابت مشاهده شد. به علاوه بین مقادیر بیان ژنی NLRP3 گروههای دیابت-تمرین (0/001>P)، دیابت-فیستین (0/001>P) با گروه کنترل سالم اختلاف معناداری وجود داشت اما بین گروههای دیابت- تمرین– فیستین و کنترل این اختلاف معنادار نبوده است (0/326=P). در مقایسه مقادیر بیان ژنی IL-18 و سطوح سرمی گلوگز نیز اختلاف معناداری بین گروههای دیابت- تمرین، دیابت- فیستین و دیابت-تمرین–فیستین با گروه کنترل مشاهده شد (0/001>P). همچنین اختلاف معناداری بین بیان ژنی NLRP3 گروههای دیابت-تمرین و دیابت-فیسیتن وجود داشت (0/001>P) اما بین بیان ژنی IL-18 بافت کلیه (0/284=P) و سطوح سرمی گلوگز (0/805=P) گروههای دیابت-تمرین و دیابت-فیسیتن تفاوت معناداری مشاهده نشد. با این وجود تاثیر مداخله ترکیبی در کاهش بیان ژنی NLRP3 (به ترتیب0/001>P و0/001>P) و IL-18 (به ترتیب0/001>P و0/001>P) بافت کلیه و کاهش سطوح سرمی گلوگز (به ترتیب0/001>P و 0/001>P) در مقایسه با دو مداخله دیگر بهطور معناداری بالاتر بود.
.JPG)
شکل 1: مقایسه بیان ژنی NLRP3بافت کلیه در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین

شکل 2: مقایسه بیان ژنی IL-18 بافت کلیه در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین

شکل 3: مقایسه سطوح سرمی گلوگز در گروههای مختلف پژوهش
*: تفاوت نسبت به گروه دیابت، &: تفاوت نسبت به گروه کنترل سالم، #: تفاوت نسبت به گروه دیابت-تمرین، $: تفاوت نسبت به گروه دیابت-فیستین
بحث
مطالعه حاضر با هدف بررسی تاثیر HIIT و فیستین بر بیان ژنی NLRP3 و IL18 در بافت کلیه موشها با استفاده از یک مدل القای دیابت نوع 2 از طریق مصرف غذای پرچرپ انجام شد. نتایج نشان داد که القای دیابت با افزایش بیان ژنی NLRP3 و IL-18 در بافت کلیه و افزایش سطوح سرمی گلوگز در موشهای مبتلا به دیابت نوع 2 در مقایسه با گروه سالم شد. مشابه با یافتههای تحقیق حاضر ایسکندر و همکاران در سال 2023 نشان دادند که القای دیابت، با افزایش سطوح IL-18 در بافت کلیه همراه بوده است (4). در یک مطالعه اخیر نیز نشان داده شد که NLRP3 با مهار اتوفاژی در پودوسیتها، آسیب کلیوی را در مدل موشهای نفروپاتی دیابتی واسطهگری میکند (24). یانگ و همکاران (23) در یک مطالعه بر روی 153 بیمار مبتلا به دیابت نوع 2 با سطوح مختلف نفروپاتی دیابتی نشان دادند که سطوح NLRP3 و IL-18 در همه رده ها به طور قابل توجهی بالاتر از افراد سالم بوده است و همبستگی مثبت و معناداری بین مقادیر NLRP3 و IL-18 با مراحل نفروپاتی دیابتی وجود داشته است (25). فعال شدن اینفلامازوم ناشی از گلوکز، تمایز سلولهای اپیتلیال توبولی کلیوی را افزایش میدهد، که نشان میدهد اینفلامازوم NLRP3 نقش کلیدی در تمایز سلولهای اپیتلیال دارد (26). بهعلاوه یافتههای تحقیق حاضر نشان داد که 8 هفته تیمار با فیستین منجر به کاهش بیان ژنی NLRP3 و IL-18 بافت کلیه و کاهش سطوح سرمی گلوگز نسبت به گروه دیابت شده است. در این راستا دانگ و همکاران در سال 2022 در بررسی مکانیسمهای فیستین در آسیب پودوسیت ناشی از نفروپاتی دیابتی نشان دادند که فیستین آسیب پودوسیت ناشی از گلوکز بالا و نفروپاتی دیابتی ناشی از استرپتوزوتوسین را در موشها بهبود بخشید که با مهار بیان NLRP3 همراه بوده است (12). بهعلاوه در یک مطالعه دیگر گزارش شده است که 16 هفته تیمار با رژیم غذایی پرچرب با افزایش قابلتوجه وزن بدن، مقاومت به انسولین و عدم تحمل گلوکز قابلتوجه در موشهای C57BL/6 همراه بود در حالیکه تیمار با فیستین به کاهش سایتوکاینهای پیشالتهابی از جمله IL-1β ،TNF-α و IL-18 و کاهش بیان NLRP3 و مهار سیگنالینگ فاکتور هستهای κB (NF-κB) منجر شد (27). رن و همکاران در سال 2020 نشان دادند که تزریق لیپوپلیساکارید به موشهای نر C57BL/6 J، منجر به تولید سایتوکاینهای پیش التهابی و پروتئینهای مرتبط با التهاب در کلیهها شد. با اینحال، فیستین با مهار بیان کلیوی IL-6، IL-1β، TNF-α پاسخ التهابی را بهبود بخشید (14). در شرایط هایپرگلیسمی، سلولهای سیستم ایمنی طبیعی و ثانویه، سایتوکینهای التهابی را سنتز و ترشح میکنند و فیستین از طریق تغییرات اپیژنتیکی شامل فاکتور هستهای کاپا B (NF-κB)، تولید سایتوکاین ناشی از هایپرگلیسمی را در مونوسیتها مهار میکند (13). گزارش شده است که فیستین فعال شدن اینفلامازوم NLRP3 و بلوغ بعدی اینترلوکین 1بتا (IL-1β) را کاهش میدهد و میتواند از تجمع میتوکندریهای آسیب دیده و تولید بیش از حد گونههای اکسیژن فعال (ROS) میتوکندری جلوگیری نماید (28). از جمله یافتههای مهم دیگر در تحقیق حاضر، تاثیر HIIT در تنظیم منفی بیان ژنی NLRP3 و IL-18 بافت کلیه و کاهش سطوح سرمی گلوگز بوده است. اما مداخله ترکیبی HIIT و فیستین با کاهش بیشتر التهاب کلیه بواسطه کاستن قابل توجه بیان ژنی NLRP3 و IL-18 منجر شد که نشان دهنده اثرات سینرژی یا همافزایی این دو مداخله در کاهش التهاب بافت کلیه در شرایط دیابت نوع 2 است. با این وجود تاثیر مداخله تمرینی در تنظیم منفی NLRP3 در مقایسه با فیستین بهطور معناداری بالاتر بود. مشابه با یافتههای تحقیق حاضر محققین نشان دادند که 8 هفته تمرین هوازی (5 روز در هفته و به مدت 60 دقیقه دویدن در روز) منجر به کاهش سطوح IL-18، کاهش فسفوریلاسیون NF-κB p65 و همچنین کاهش بیان NLRP3 در بافت کلیه موشهای db/db دیابتی شد (29). همچنین فاطمی و همکاران در سال2022 در بررسی اثر شدتهای مختلف تمرینی بر بیان ژنNLRP-3 بافت پانکراس موشهای دیابتی نشان دادند که هر دو نوع تمرین تناوبی با شدت متوسط (شامل 13 وهله 4 دقیقهای دویدن؛ با شدت 70-65 % سرعت بیشینه) و HIIT (شامل 10 وهله 4 دقیقهای دویدن؛ با شدت 90-85 % سرعت بیشینه) منجر به کاهش معنادار بیان اینفلامازوم NLRP3 بافت پانکراس و همچنین کاهش گلوگز در مقایسه با گروه دیابتی شد به طوریکه HIIT به کاهش بیشتر این ژن منتج شد (30). همچنین خدایی و همکاران در سال 2024 گزارش دادند که القا دیابت با افزایش سطوح NLRP3 بافت قلبی موشهای صحرایی مبتلا به دیابت نوع دوم همراه بود که به دنبال8 هفته HIIT (شامل 6 تا 12 تناوب دو دقیقهای با شدت 90 درصد سرعت بیشینه همراه با دوره یک دقیقهای با شدت 10 درصد سرعت بیشینه دویدن روی نوارگردان و 5 بار در هفته) کاهش یافت (16). بهعلاوه کاهش معنادار بیان ژنی پروتئین NLRP-3 بافت چربی احشایی، پس از 8 هفته تمرین استقامتی با شدت متوسط و زیاد نیز توسط محققین دیگر گزارش شده است (31). تمرین ورزشی با افزایش برونده قلبی و انقباض عروق کلیوی باعث ایجاد تنش برشی ودر نتیجه تولید نیتریک اکسید میشود. افزایش سطح نیتریک اکسید نیز بهواسطه کاهش فیبروز منجر به افزایش رگزایی و بهبود عملکرد اندوتلیال میگردد (3). شواهد اخیر نشان میدهد که کمپلکس التهابی NLRP3 و فاکتورهای پاییندست آن، IL-1β و IL-18، در موشهای فاقد NLRP3 بهطور قابلتوجهی کاهش یافتهاند، که تأکید میکند NLRP3 برای تولید سایتوکاین التهابی ضروری است (26). بنابراین HIIT ممکن است از طریق کاهش اینفلازوم NLRP3 و در نتیجه تنظیم منفی IL-18 در بافت کلیه، به بهبود عملکرد کلیه در مقابل آسیب ناشی از دیابت نوع 2 کمک نماید و همزمانی HIIT با مصرف فیستین با تقویت این اثرات همراه است. از جمله محدودیتهای مطالعه حاضر میتوان به نبود مطالعات مربوط به اثر HIIT و یا سایر تمرینات ورزشی بر مسیرNLRP3/IL-18 بافت کلیه دیابتی اشاره نمود. لذا پیشنهاد میشود در مطالعات دیگر تاثیر انواع تمرینات ورزشی بر مسیر التهابی فوق بررسی شود.
نتیجهگیری
نتایج حاصل از تحقیق حاضر نشان میدهد که القای دیابت نوع 2 با آسیب کلیوی بهواسطه افزایش پروتئینهای التهابی NLRP3 و IL-18 همراه بوده است و مداخلههای تمرینی HIIT و فیستین هر یک بهتنهایی میتوانند منجر به تنظیم منفی بیان ژنی NLRP3 و IL-18 و در نتیجه بهبود عملکرد کلیه شوند. اما مداخله ترکیبی HIIT و فیستین ممکن است تاثیر بیشتری در کاهش التهاب بافت کلیه از طریق مهار بیان ژنی محور NLRP3/IL-18 ، در مقایسه با دو مداخله دیگر داشته باشد. با توجه به اثرات متبت مکمل فیستین بهنظر میرسد نیاز بیشتری به انجام تحقیقات در این زمینه وجود دارد تا مکانیسم های احتمالی مشخص گردد.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد گرایش فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد قائمشهر است. بدینوسیله از کلیه افرادی که در این تحقیق ما را یاری نمودند تشکر و قدردانی می شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پژوهش توسط کمیته تخصصی اخلاق در پژوهشهای زیستی دانشگاه آزاد واحد ساری تصویب شد(کد اخلاق: IR.IAU.SARI.REC.1403.329).
مشارکت نویسندگان
معصومه حبیبیان در ارائه ایده، معصومه حبیبیان در طراحی مطالعه، شیما بنداد در جمعآوری دادهها، معصومه حبیبیان و شیما بنداد در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1-Klein S, Gastaldelli A, Yki-Järvinen H, Scherer PE. Why does Obesity Cause Diabetes? Cell Metab 2022; 34(1): 11-20.
2-Martinez-Garcia C, Izquierdo-Lahuerta A, Vivas Y, Velasco I, Yeo TK, Chen S, et al. Renal Lipotoxicity-Associated Inflammation and Insulin Resistance Affects Actin Cytoskeleton Organization in Podocytes. PLoS One 2015; 10(11): e0142291.
3- Amaral LSB, Souza CS, Lima HN, Soares TJ. Influence of Exercise Training on Diabetic Kidney Disease: A Brief Physiological Approach. Exp Biol Med (Maywood) 2020; 245(13): 1142-54.
4- Iskender H, Dokumacioglu E, Hayirli A, Kapakin KAT, Bolat I, Kirman EM. Effects of Oleanolic Acid Administration on Renal NF-kB, IL-18, IL-6, YKL-40, and KIM-1 in Experimental Diabetic Rats. Iran J Basic Med Sci 2023; 26(10): 1188-93.
5- Kakuta Y, Satoh S, Watarai Y, Aikawa A, Tanabe K, Harada H, et al. Successful Desensitization of T Cell Flow Cytometry Crossmatch Positive Renal Transplant Recipients Using Plasmapheresis and Super High-Dose Intravenous Immunoglobulin. Transplant Direct 2017; 4(1): e336.
6- Araki S, Haneda M, Koya D, Sugimoto T, Isshiki K, Chin-Kanasaki M, et al. Predictive Impact of Elevated Serum Level of IL-18 for Early Renal Dysfunction in Type 2 Diabetes: An Observational Follow-up Study. Diabetologia 2007; 50(4): 867-73.
7- Pchelin I, Shishkin A, Vasilkova V, Hudiakova N, Kulibaba T, Slepykh L, et al. FP522 Interleukin-18 and Renal Anemia in Patients with Type 2 Diabetes Mellitus and Early Stages of Chronic Kidney Disease. Nephrology Dialysis Transplantation 2019; 34(Supplement_1): gfz106.FP522.
8- Zaharieva E, Kamenov Z, Velikova T, Tsakova A, El-Darawish Y, Okamura H. Interleukin-18 Serum Level is Elevated in Type 2 Diabetes and Latent Autoimmune Diabetes. Endocr Connect 2018; 7(1): 179-85.
9- Wang Y, Sui Z, Wang M, Liu P. Natural Products in Attenuating Renal Inflammation via Inhibiting the NLRP3 Inflammasome in Diabetic Kidney Disease. Front Immunol 2023; 14: 1196016.
10- Zhao W, Zhou L, Novák P, Shi X, Lin CB, Zhu X, et al. Metabolic Dysfunction in the Regulation of the NLRP3 Inflammasome Activation: A Potential Target for Diabetic Nephropathy. J Diabetes Res 2022; 2022: 2193768.
11- Islamuddin M, Qin X. Renal Macrophages and NLRP3 Inflammasomes in Kidney Diseases and Therapeutics. Cell Death Discov 2024; 10: 229.
12- Dong W, Jia C, Li J, Zhou Y, Luo Y, Liu J, et al. Fisetin Attenuates Diabetic Nephropathy-Induced Podocyte Injury By Inhibiting NLRP3 Inflammasome. Front Pharmacol 2022; 13: 783706.
13- Prasath GS, Pillai SI, Subramanian SP. Fisetin Improves Glucose Homeostasis Through the Inhibition of Gluconeogenic Enzymes in Hepatic Tissues of Streptozotocin Induced Diabetic Rats. Eur J Pharmacol 2014; 740: 248-54.
14- Ren Q, Guo F, Tao S, Huang R, Ma L, Fu P. Flavonoid Fisetin Alleviates Kidney Inflammation and Apoptosis Via Inhibiting Src-Mediated NF-Κb P65 and MAPK Signaling Pathways in Septic AKI Mice. Biomed Pharmacother 2020; 122: 109772.
15- Jabardo-Camprubí G, Donat-Roca R, Sitjà-Rabert M, Milà-Villarroel R, Bort-Roig J. Drop-out Ratio between Moderate to High-Intensity Physical Exercise Treatment by Patients with, or at Risk of, Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Physiol Behav 2020; 215: 112786.
16- Khodaei, O, Bolboli, L, Siakkohian, M, Bagaei, B. The Effect of 8-Weeks of High Intensity Interval Training (HIIT) Along with L-Cysteine Consumption on the Level of NLRP3 in the Heart Tissue of Rats with Type 2 Diabetes. JAHSSP 2024; 12(In Press):1-10. [Persian]
17- Wormgoor SG, Dalleck LC, Zinn C, Harris NK. Effects of High-Intensity Interval Training on People Living with Type 2 Diabetes: A Narrative Review. Can J Diabetes 2017; 41(5): 536-47.
18- Zheng L, Qin R, Rao Z, Xiao W. High-Intensity Interval Training Induces Renal Injury and Fibrosis in Type 2 Diabetic Mice. Life Sci 2023; 324: 121740.
19- Colberg SR. Physical Activity, Insulin Action, And Diabetes Prevention and Control. Curr Diabetes Rev 2007; 3(3): 176-84.
20- Rahimi G, Heydari S, Rahimi B, Abedpoor N, Niktab I, Safaeinejad Z, et al. A Combination of Herbal Compound (SPTC) Along with Exercise or Metformin more Efficiently Alleviated Diabetic Complications through Down-regulation of Stress Oxidative Pathway upon Activating Nrf2-Keap1 Axis in AGE Rich Diet-Induced Type 2 Diabetic Mice. Nutr Metab 2021; 18:1-14.
21 Haghparast Azad M, Niktab I, Dastjerdi S, Abedpoor N, Rahimi G, Safaeinejad Z, et al. The Combination of Endurance Exercise and SGTC (Salvia–Ginseng–Trigonella–Cinnamon) Ameliorate Mitochondrial Markers’ Overexpression With Sufficient ATP Production in the Skeletal Muscle of Mice Fed AGEs-Rich High-Fat Diet. Nutr Metab 2022; 19(1): 17.
22- Qian X, Lin S, Li J, Jia C, Luo Y, Fan R, et al. Fisetin Ameliorates Diabetic Nephropathy‐Induced Podocyte Injury by Modulating Nrf2/HO‐1/GPX4 Signaling Pathway. Evid Based Complement Alternat Med 2023; 2023: 9331546.
23- Khoramipour K, Rajizadeh MA, Akbari Z, Arjmand M. The Effect of High-Intensity Interval Training on Type 2 Diabetic Muscle: A Metabolomics-Based Study. Heliyon 2024; 10(15): e34917.
24- Hou Y, Lin S, Qiu J, Sun W, Dong M, Xiang Y, et al. NLRP3 Inflammasome Negatively Regulates Podocyte Autophagy in Diabetic Nephropathy. Biochem Biophys Res Commun 2020; 521(3): 791-8.
25- Yang M, Wang X, Han Y, Li C, Wei L, Yang J, et al. Targeting the NLRP3 Inflammasome in Diabetic Nephropathy. Curr Med Chem 2021; 28(42): 8810-24.
26- Huang G, Zhang Y, Zhang Y, Ma Y. Chronic Kidney Disease and NLRP3 Inflammasome: Pathogenesis, Development and Targeted Therapeutic Strategies. Biochem Biophys Rep 2022; 33: 101417.
27- Ge C, Xu M, Qin, Y, Gu, T, Lou, D, Li Q, et al. Fisetin Supplementation Prevents High Fat Diet-Induced Diabetic Nephropathy by Repressing Insulin Resistance and RIP3-Regulated Inflammation. Food Funct 2019; 10(5): 2970-85.
28- Molagoda IMN, Athapaththu AMGK, Choi YH, Park C, Jin CY, Kang CH, et al. Fisetin Inhibits NLRP3 Inflammasome by Suppressing TLR4/MD2-Mediated Mitochondrial ROS Production. Antioxidants (Basel) 2021; 10(8): 1215.
29- Zhou Z, Ying C, Zhou X, Shi Y, Xu J, Zhu Y, Wang M, Li Y, Li X, Xiang J. Aerobic Exercise Training Alleviates Renal Injury in Db/Db Mice through Inhibiting Nox4-Mediated NLRP3 Inflammasome Activation. Exp Gerontol 2022; 168: 111934.
30- Fatemi SA, Frzaneh Hesari A, Dadban shahamat M. NLRP-3 Expression in Pancreatic Tissue Following Moderate and High Intensity Interval Training with Liposomal Alpha-Lipoic Acid Supplement in Diabetic Rats. JSSU 2022; 30(2): 4593-606. [Persian]
31- Abbasi A, Faramarzi M, Ghatreh Samani M, Bbanitalebi E. The Effect of Different Intensities of Endurance Training on NLRP-3 Inflammasome Protein Expression in Visceral Adipose Tissue, SerumG glucose Levels and Insulin in Streptozotocin-induced Diabetic Rats. JME 2017; 7(1): 1-19. [Persian]
1-Klein S, Gastaldelli A, Yki-Järvinen H, Scherer PE. Why does Obesity Cause Diabetes? Cell Metab 2022; 34(1): 11-20.
2-Martinez-Garcia C, Izquierdo-Lahuerta A, Vivas Y, Velasco I, Yeo TK, Chen S, et al. Renal Lipotoxicity-Associated Inflammation and Insulin Resistance Affects Actin Cytoskeleton Organization in Podocytes. PLoS One 2015; 10(11): e0142291.
3- Amaral LSB, Souza CS, Lima HN, Soares TJ. Influence of Exercise Training on Diabetic Kidney Disease: A Brief Physiological Approach. Exp Biol Med (Maywood) 2020; 245(13): 1142-54.
4- Iskender H, Dokumacioglu E, Hayirli A, Kapakin KAT, Bolat I, Kirman EM. Effects of Oleanolic Acid Administration on Renal NF-kB, IL-18, IL-6, YKL-40, and KIM-1 in Experimental Diabetic Rats. Iran J Basic Med Sci 2023; 26(10): 1188-93.
5- Kakuta Y, Satoh S, Watarai Y, Aikawa A, Tanabe K, Harada H, et al. Successful Desensitization of T Cell Flow Cytometry Crossmatch Positive Renal Transplant Recipients Using Plasmapheresis and Super High-Dose Intravenous Immunoglobulin. Transplant Direct 2017; 4(1): e336.
6- Araki S, Haneda M, Koya D, Sugimoto T, Isshiki K, Chin-Kanasaki M, et al. Predictive Impact of Elevated Serum Level of IL-18 for Early Renal Dysfunction in Type 2 Diabetes: An Observational Follow-up Study. Diabetologia 2007; 50(4): 867-73.
7- Pchelin I, Shishkin A, Vasilkova V, Hudiakova N, Kulibaba T, Slepykh L, et al. FP522 Interleukin-18 and Renal Anemia in Patients with Type 2 Diabetes Mellitus and Early Stages of Chronic Kidney Disease. Nephrology Dialysis Transplantation 2019; 34(Supplement_1): gfz106.FP522.
8- Zaharieva E, Kamenov Z, Velikova T, Tsakova A, El-Darawish Y, Okamura H. Interleukin-18 Serum Level is Elevated in Type 2 Diabetes and Latent Autoimmune Diabetes. Endocr Connect 2018; 7(1): 179-85.
9- Wang Y, Sui Z, Wang M, Liu P. Natural Products in Attenuating Renal Inflammation via Inhibiting the NLRP3 Inflammasome in Diabetic Kidney Disease. Front Immunol 2023; 14: 1196016.
10- Zhao W, Zhou L, Novák P, Shi X, Lin CB, Zhu X, et al. Metabolic Dysfunction in the Regulation of the NLRP3 Inflammasome Activation: A Potential Target for Diabetic Nephropathy. J Diabetes Res 2022; 2022: 2193768.
11- Islamuddin M, Qin X. Renal Macrophages and NLRP3 Inflammasomes in Kidney Diseases and Therapeutics. Cell Death Discov 2024; 10: 229.
12- Dong W, Jia C, Li J, Zhou Y, Luo Y, Liu J, et al. Fisetin Attenuates Diabetic Nephropathy-Induced Podocyte Injury By Inhibiting NLRP3 Inflammasome. Front Pharmacol 2022; 13: 783706.
13- Prasath GS, Pillai SI, Subramanian SP. Fisetin Improves Glucose Homeostasis Through the Inhibition of Gluconeogenic Enzymes in Hepatic Tissues of Streptozotocin Induced Diabetic Rats. Eur J Pharmacol 2014; 740: 248-54.
14- Ren Q, Guo F, Tao S, Huang R, Ma L, Fu P. Flavonoid Fisetin Alleviates Kidney Inflammation and Apoptosis Via Inhibiting Src-Mediated NF-Κb P65 and MAPK Signaling Pathways in Septic AKI Mice. Biomed Pharmacother 2020; 122: 109772.
15- Jabardo-Camprubí G, Donat-Roca R, Sitjà-Rabert M, Milà-Villarroel R, Bort-Roig J. Drop-out Ratio between Moderate to High-Intensity Physical Exercise Treatment by Patients with, or at Risk of, Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Physiol Behav 2020; 215: 112786.
16- Khodaei, O, Bolboli, L, Siakkohian, M, Bagaei, B. The Effect of 8-Weeks of High Intensity Interval Training (HIIT) Along with L-Cysteine Consumption on the Level of NLRP3 in the Heart Tissue of Rats with Type 2 Diabetes. JAHSSP 2024; 12(In Press):1-10. [Persian]
17- Wormgoor SG, Dalleck LC, Zinn C, Harris NK. Effects of High-Intensity Interval Training on People Living with Type 2 Diabetes: A Narrative Review. Can J Diabetes 2017; 41(5): 536-47.
18- Zheng L, Qin R, Rao Z, Xiao W. High-Intensity Interval Training Induces Renal Injury and Fibrosis in Type 2 Diabetic Mice. Life Sci 2023; 324: 121740.
19- Colberg SR. Physical Activity, Insulin Action, And Diabetes Prevention and Control. Curr Diabetes Rev 2007; 3(3): 176-84.
20- Rahimi G, Heydari S, Rahimi B, Abedpoor N, Niktab I, Safaeinejad Z, et al. A Combination of Herbal Compound (SPTC) Along with Exercise or Metformin more Efficiently Alleviated Diabetic Complications through Down-regulation of Stress Oxidative Pathway upon Activating Nrf2-Keap1 Axis in AGE Rich Diet-Induced Type 2 Diabetic Mice. Nutr Metab 2021; 18:1-14.
21 Haghparast Azad M, Niktab I, Dastjerdi S, Abedpoor N, Rahimi G, Safaeinejad Z, et al. The Combination of Endurance Exercise and SGTC (Salvia–Ginseng–Trigonella–Cinnamon) Ameliorate Mitochondrial Markers’ Overexpression With Sufficient ATP Production in the Skeletal Muscle of Mice Fed AGEs-Rich High-Fat Diet. Nutr Metab 2022; 19(1): 17.
22- Qian X, Lin S, Li J, Jia C, Luo Y, Fan R, et al. Fisetin Ameliorates Diabetic Nephropathy‐Induced Podocyte Injury by Modulating Nrf2/HO‐1/GPX4 Signaling Pathway. Evid Based Complement Alternat Med 2023; 2023: 9331546.
23- Khoramipour K, Rajizadeh MA, Akbari Z, Arjmand M. The Effect of High-Intensity Interval Training on Type 2 Diabetic Muscle: A Metabolomics-Based Study. Heliyon 2024; 10(15): e34917.
24- Hou Y, Lin S, Qiu J, Sun W, Dong M, Xiang Y, et al. NLRP3 Inflammasome Negatively Regulates Podocyte Autophagy in Diabetic Nephropathy. Biochem Biophys Res Commun 2020; 521(3): 791-8.
25- Yang M, Wang X, Han Y, Li C, Wei L, Yang J, et al. Targeting the NLRP3 Inflammasome in Diabetic Nephropathy. Curr Med Chem 2021; 28(42): 8810-24.
26- Huang G, Zhang Y, Zhang Y, Ma Y. Chronic Kidney Disease and NLRP3 Inflammasome: Pathogenesis, Development and Targeted Therapeutic Strategies. Biochem Biophys Rep 2022; 33: 101417.
27- Ge C, Xu M, Qin, Y, Gu, T, Lou, D, Li Q, et al. Fisetin Supplementation Prevents High Fat Diet-Induced Diabetic Nephropathy by Repressing Insulin Resistance and RIP3-Regulated Inflammation. Food Funct 2019; 10(5): 2970-85.
28- Molagoda IMN, Athapaththu AMGK, Choi YH, Park C, Jin CY, Kang CH, et al. Fisetin Inhibits NLRP3 Inflammasome by Suppressing TLR4/MD2-Mediated Mitochondrial ROS Production. Antioxidants (Basel) 2021; 10(8): 1215.
29- Zhou Z, Ying C, Zhou X, Shi Y, Xu J, Zhu Y, Wang M, Li Y, Li X, Xiang J. Aerobic Exercise Training Alleviates Renal Injury in Db/Db Mice through Inhibiting Nox4-Mediated NLRP3 Inflammasome Activation. Exp Gerontol 2022; 168: 111934.
30- Fatemi SA, Frzaneh Hesari A, Dadban shahamat M. NLRP-3 Expression in Pancreatic Tissue Following Moderate and High Intensity Interval Training with Liposomal Alpha-Lipoic Acid Supplement in Diabetic Rats. JSSU 2022; 30(2): 4593-606. [Persian]
31- Abbasi A, Faramarzi M, Ghatreh Samani M, Bbanitalebi E. The Effect of Different Intensities of Endurance Training on NLRP-3 Inflammasome Protein Expression in Visceral Adipose Tissue, SerumG glucose Levels and Insulin in Streptozotocin-induced Diabetic Rats. JME 2017; 7(1): 1-19. [Persian]
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1404/3/1 | پذیرش: 1404/4/16 | انتشار: 1404/7/15
دریافت: 1404/3/1 | پذیرش: 1404/4/16 | انتشار: 1404/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







