دوره 33، شماره 8 - ( آبان 1404 )
جلد 33 شماره 8 صفحات 9316-9304 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shiri S, Khezri S, Rostamkhani N. Investigating the Effect of Walnut Extract on the Toxicity Caused by the Effect of Tartrazine Artificial Food Coloring on the Levels of Liver Enzymes in Male Rats. JSSU 2025; 33 (8) :9304-9316
URL: http://jssu.ssu.ac.ir/article-1-6421-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6421-fa.html
شیری صفی اله، خضری شیوا، رستمخانی نسیم. بررسی اثر عصاره گردو بر سمیت ناشی از تاثیر رنگ خوراکی مصنوعی تارترازین بر روی سطوح آنزیمهای کبدی در موشهای صحرایی نر. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (8) :9304-9316
واژههای کلیدی: بررسی اثر گردو بر سمیت ناشی از تارترازین
متن کامل [PDF 649 kb]
(136 دریافت)
| چکیده (HTML) (268 مشاهده)
متن کامل: (52 مشاهده)
مقدمه
افزودنیهای غذایی به ترکیباتی گفته میشوند که به منظور افزایش دوام غذا، جذاب نمودن ظاهر غذا، خوش طعم کردن غذا، ارتقای ارزش غذایی و پیشگیری از فاسد شدن، به مواد غذایی مختلف اضافه میشوند (1). تارترازین به دلیل طعم و عطر آن بهعنوان یک رنگ خوراکی مصنوعی به صورت گستردهای در محصولات غذایی مورد استفاده قرار میگیرد (2). بســیاری از رنــگهــای مصــنوعی دارای عــوارض خطرناک برای بدن میباشند و در این رابطـه یکـی از خطرناکترین گروه رنـگهـای مصـنوعی رنـگهـای آزو با ســاختار شــیمیایی (AZO R−N=N−R) معرفی شدهاند کـه میتواننـد اثـرات نـامطلوبی بـر سلامت انسان داشته باشند (3). رنـگ زرد تـــــارترازین (E102) بـــــا فرمـــــول مولکـــــولی (C16H9N4Na3O9S2) یک مونوآزو مـیباشـد (4). در مطالعه جونالاگادا و همکاران در سال 2004، 2٪ رنگهای مورد استفاده در صنایع غذایی شامل ترکیبی از رنگهای مجاز و غیر مجاز و 8٪ آن شامل رنگ غیر مجاز بود (5). این ترکیبات علاوه بر اثر سمیت بر روی بدن انسان، ممکن است با عوارض مختلف از جمله آسم، کهیر، سقط جنین، بیشفعالی کودکان، سرطانزایی، کاهش ضریب هوشی کودکان، واکنشهای آنافیلاکتیک، تضعیف و سرکوب سیستم ایمنی بدن، ایجاد فشارخون و همچنین تأثیر بر عملکرد کبد همراه باشند (6). برخی از مطالعات، تارترازین را به عنوان یک عامل بالقوه برای القای استرس اکسیداتیو با تولید گونههای اکسیژن فعال (ROS)، اختلال در تعادل پرواکسیدانی و آنتیاکسیدانی و ایجاد التهاب در کبد موشها گزارش کردهاند (7). همچنین مطالعه هلال و همکاران در سال 2000 نشان داده است که مصرف رنگ خوراکی مصنوعی بهطور قابلتوجهی آســپارتات آمینوترانــسفراز (AST) سرم را افزایش میدهد. همه رنگها به استثنای رنگ زرد غروب آفتاب بهطور قابلتوجهی بیلیروبین کل سرم را افزایش میدهند (8). با توجه به عوارض گسترده استفاده از رنگهای خوراکی، لزوم استفاده از آنتیآکسیدانها برای جلوگیری از عوارض رنگها امری ضروری میباشد. امروزه جوامع بشری بیشتر طالب آن هستند که بهجای استفاده از داروهای سنتز شده با اثرات مضر، از گیاهان برای درمان استفاده کنند (9). گیاهان دارویی با توجه به تاریخچه مصرف طولانی میتوانند به عنوان مواد طبیعی با سمیت و عوارض جانبی حداقل مورد استفاده قرار بگیرند (10). گیاه گردو یکی از قدیمیترین گونههای گیاهی در کره زمین است که بهطور وسیعی از آن در دنیا استفاده میشود. نتایج مطالعه پریرا و همکاران نشان داد که گردو به عنوان ترکیبـی بـا ویژگیهای آنتیاکسیدانی و ضد میکروبی می¬تواند مطرح باشد (11). بر اساس نتایج مطالعات پاندارش و همکارن در سال 2018 آسیب به DNA یکی از عوارض جانبی مصرف مواد سمی مانند رنگهای خوراکی مصنوعی است که میتواند منجر به تغییرات ژنتیکی و افزایش خطر ابتلا به بیماریها شود. آنتیاکسیدانهای قوی در عصاره گردو میتوانند با محافظت از DNA در برابر آسیبهای اکسیداتیو، خطر این تغییرات را کاهش دهند (12). نتایج مطالعه کیم و همکارانش در سال 2021 نشان داد که عصارههای فنلی و لیپیدی ترکیبات گردو و رژیم غذایی غنیشده با گردو بهطور مداوم اثرات بسیار مفیدی بر روی متابولیسم و عملکرد کبد دارد. پلیفنولهای موجود در عصاره گرد و میتوانند با تقویت ساختار غشاهای سلولی، از آسیبها جلوگیری کرده و به حفظ عملکرد طبیعی سلولها کمک کنند (13). مطالعات ارائه شده از بررسی بیرینو و همکاران در سال 2024 نشان داد که بین مصرف رنگهای غذایی مصنوعی و انواع عوارض جانبی سلامتی، از بیشفعالی و اختلالات رفتاری گرفته تا واکنشهای آلرژیک ارتباط مستقیمی وجود دارد (14). مقدار روغن مغـز گـردو در واریتـههـای متفـاوت آن بـین 61/67 الی72/41 درصد تخمین زده شده است که 62 تـا 75 درصـد آن را اسیدهای چرب غیر اشباعی تشکیل میدهند (15). اسیدهای فنلی و فلاونوئیدها دو گروه عمده ترکیبهای فنلی موجود در گردو میباشند (16). ترکیبات فنلی طیف وسیعی از خواص فیزیولوژیکی مانند ضد آلرژی، ضد میکروب، آنتیاکسیدان، ضد انعقاد، ضد التهاب، اثرات محافظتی و گشاد کنندگی عروق را دارند و میتوانند یک عامل تعیین کننده عمده در پتانسیل آنتیاکسیدانی غذاها باشند. پلیفنولهای موجود در عصاره گردو با داشتن خواص ضد التهابی میتواند سطح مولکولهای التهابی مانند سیتوکینها را کاهش دهد (17). این کاهش در التهاب به بازسازی سلولهای کبدی، بهبود عملکرد کبد و جلوگیری از آسیبهای بلندمدت کمک میکند. این ترکیبات نهتنها از سلولهای کبدی در برابر آسیبهای اکسیداتیو محافظت میکنند، بلکه میتوانند فرآیندهای بازسازی و ترمیم سلولی را نیز تقویت کنند. این ویژگی بهویژه در مواردیکه کبد تحت تأثیر رنگهای خوراکی مصنوعی دچار آسیب شده است، حائز اهمیت است. این امر به محافظت بیشتر کبد در برابر سموم و مواد مضر مانند رنگهای خوراکی مصنوعی کمک میکند (18). شواهد نشان میدهد که کبد یکی از اندامهای حیاتی بدن است که در تنظیم بسیاری از پدیدههای فیزیولوژیک دارای اهمیت است و اختلال در عملکرد آن باعث میشود انواعی از بیماریهای مختلف ایجاد شود. با توجه به اینکه آنزیمها در همه بافتها از جمله کبد فعالیت دارند با اندازهگیری آنزیمهایی همچون آلانـینآمینوترانـسفراز (ALT)، آســپارتاتآمینوترانــسفراز (AST)، آلکــالینفــسفاتاز (ALP)، گاماگلوتامیلترانسفراز (GGT) و مارکر زیستی بیلیروبین توتال (B.T) میتوان به آسیبهای سلولی و اختلال در فعالیتهای متابولیکی بدن پی برد. مطالعات پیشین نشان میدهد که تارترازین باعث التهاب کبد و القای استرس اکسیداتیو میشود (7). با توجه به اینکه تابهحال مطالعهای مبنی بر بررسی عصاره گردو بر آنزیمهای کبدی و برخی شاخصهای التهابی در کبد متاثر از رنگ خوراکی مصنوعی تارترازین انجام نگرفته است، لذا هدف پژوهش حاضر بررسی اثر عصاره گردو بر سمیت ناشی از تأثیر رنگ خوراکی مصنوعی تارترازین بر روی سطوح آنزیم¬های کبدی در موشهای صحرایی نر میباشد.
روش بررسی
در این مطالعه تجربی از 32 سر موش صحرائی نر بالغ نژاد ویستار به وزن 180 الی 200 گرم استفاده شد. حیوانات در شرایط استاندارد در قفسهای چهارتایی در دمای 1±23 درجه سانتیگراد و شرایط نوری 12 ساعت روشنایی و 12 ساعت تاریکی نگهداری شدند. حیوانات بهطور مناسب و کافی، به آب و غذای مخصوص رتها دسترسی داشتند و شیشههای آب آنها روزانه کنترل و تمیز میشدند. در انجام این آزمایشات، منشور و موازین اخلاق در پژوهش رعایت شده است 32 سر موش صحرایی نر بهصورت تصادفی ساده و یک سوکور در 4 گروه 8 تایی تقسیم شدند: 1) گروه کنترل، این گروه از موشها نرمالسالین را بهمدت 30 روز از طریق گاواژ دریافت نمودند، 2) گروه دریافتکننده رنگ غذای تارترازین (mg/kg15) به مدت 30 روز از طریق گاواژ (10)، 3) گروه دریافت کننده عصاره هیدروالکی گردو (g/kg0/2) به مدت 30 روز از طریق گاواژ (19) و 4)گروه دریافتکننده رنگ غذای تارترازین (mg/kg15) به همراه عصاره گردو (g/kg0/2) بهمدت 30 روز از طریق گاواژ. پس از پایان دوره تیمار (روز 31)، موشها پس از توزین، با استفاده از ترکیب کتامین (50 میلیگرم بر کیلوگرم)-زایلزین (10 میلیگرم بر کیلوگرم) بهصورت عمیق بیهوش شده (20) و خون از قلب جمعآوری شد. نمونههای خونی نیم ساعت پس از قرار گرفتن در دمای اتاق به مدت 10 دقیقه با دورrpm3500 در دقیقه سانتریفیوژ شدند. سپس سرم هر لولـه جهت اندازهگیری میزان آنزیمهای کبدی همچون ALT، ALP ،AST، GGT و مارکر زیستی بیلیروبین توتال (B.T) مورد استفاده قرار گرفتند. جهت سنجش آنزیمهای ALT (کد PI009)،ALP (کد PI007)، AST (کد PI023)، GGT (کد PI011) و بیلی روبین توتال (B.T) (PI003) از کیتهای ساخت شرکت دلتا درمان پارت استفاده گردید. اندازهگیری ALPباروش آنزیمی، کالریمتری p-Nitrophenylphosphate.DGKC ، ALT و AST با روش آنزیمی، کالریمتریNADH.Kinetic UV.IFCC ،GGT با روش آنزیمی، کالریمتری Carboxy substrate.Kinetic و بیلی روبین توتال با روش کالریمتری DPD صورت گرفت. جهت تهیه عصاره هیدروالکلی گردو، مغز گردوهای مرغوب و سالم تهیه گردید، بعد از آن به کمک آسیاب برقی پودر آن تهیه شد. پانصد گرم از پودر بهدست آمده را بهوسیله ترازوی دیجیتال وزن کرده و به یک بشر 1000 سی سی انتقال یافت. در مرحله بعد به این پودرخشک شده الکل اتانول 70 درصد اضافه شد و به دنبال آن به مدت 48 ساعت این محلول در داخل یخچال قرار گرفت. بعد از گذشت این مدت از کاغذ صافی عبور داده شد. عصاره الکلی بهدست آمده در لولههای سانتریفیوژ پلی پروپیلن 50 میلیلیتر ریخته شد و دستگاه سانتریفیوژ با سرعت 3500 دور بر دقیقه به مدت 15 دقیقه لوله ها را چرخاند تا ذرات معلق در آن جدا شود. بعد از سانتریفیوژ مایع رویی بهدست آمده خارج گردید و در آون با دمای 50 درجه سانتیگراد قرار گرفت تا در نهایت شیره غلیظی باقی بماند. عصاره هیدروالکلی مغز گردو برحسب مقدار مورد نیاز روزانه در آب مقطر حل شد تا در تیمار حیوانات مورد استفاده قرار بگیرد (21).
تجزیه و تحلیل آماری
در این مطالعه جهت بررسی نرمال بودن توزیع دادهها، از آزمون شاپیرو-ویلک استفاده شد و در نهایت تغییرات بین فاکتورهای بیوشیمیایی در میان گروه¬های مختلف آزمایشی توسط نرمافزار SPSS version 16 ، آزمون ANOVA یکطرفه و آزمون تعقیبی توکی تجزیه و تحلیل شدند. مقدار (0/05>p) معنیدار در نظر گرفته شد. تمام دادهها به صورت انحراف معیار ± میانگین SD)± Mean) نشان داده شدند.
نتایج
نتایج حاصل از بررسی سطح سرمی آسپارتات آمینوترانسفراز(AST) در گروههای آزمایشی: مقایسه میانگین میزان آنزیم آسپارتات آمینوترانسفراز نشان داد گروه دریافت کننده گردو تفاوت معنیداری با گروه کنترل دارد (P=0/042). در گروه دریافت کننده تارترازین میزان آنزیم AST افزایش یافت ولی با گروه کنترل تفاوت معنیداری نداشت. استفاده از عصاره هیدروالکلی گردو در گروه دریافتکننده عصاره گردو باعث کاهش معنی¬دار این آنزیم در مقایسه با گروه دریافتکننده تارترازین شد (P=0/002). همچنین میزان آنزیم ASTدر گروه دریافت کننده همزمان تارترازین و گردو کاهش معنیداری در مقایسه با گروه تارترازین داشت(P=0/01). ولی اختلاف معنیداری با گروه کنترل مشاهده نشد (P>0/05) (نمودار 1).
نتایج حاصل از بررسی سطح سرمی آلانین آمینوترانسفراز(ALT) در گروههای آزمایشی: نتایج حاصل از بررسی نمودار (2) نشان داد که میانگین میزان آنزیم ALTدر گروهی که فقط عصاره گردو مصرف کرده بودند کمتر از گروه کنترل بود (P=0/005).در گروه دریافتکننده تارترازین مقدار این آنزیم در مقایسه با گروه دریافتکننده عصاره گردو افزایش یافت (P=0/01). همچنین نتایج حاصل از بررسی داده¬ها نشان داد که بین گروه مصرفکننده همزمان عصاره تارترازین و گردو در مقایسه با گروه دریافتکننده عصاره گردو اختلاف آماری معنیداری وجود دارد(P=0/045). ولی هیچ اختلاف معنیداری بین گروه مصرفکننده همزمان عصاره تارترازین و گردو در مقایسه با گروه دریافتکننده تارترازین، مشاهده نشد (05/0 نتایج حاصل از بررسی سطح سرمی گاماگلوتامین ترانسفراز(GGT) در گروه¬های آزمایشی: میانگین میزان آنزیم GGT در گروه دریافت کننده تارترازین بهطور معنیداری در مقایسه با گروه کنترل افزایش یافت (P=0/01).مصرف عصاره گردو تغییر معنیداری در میزان این آنزیم در مقایسه با گروه کنترل ایجاد نکرد. ولی باعث کاهش معنیدار آنزیم GGT در مقایسه با گروه تاترازین شد(P=0/009). همچنین میزان این آنزیم در گروه دریافتکننده همزمان تارترازین و گردو کاهش معنیداری در مقایسه با گروه تارترازین داشت (P=0/01). ولی اختلاف معنی¬داری با گروه کنترل مشاهده نشد (نمودار 4).
نتایج حاصل از بررسی سطح سرمی بیلیروبین توتال ((B.Tدر گروههای آزمایشی: نتایج حاصل از بررسی نمودار میزان بیلیروبین توتال (B.T) نشان داد که در گروه دریافت کننده تارترازین افزایش معنی¬داری در این متغیر در مقایسه با گروه کنترل دیده میشود (P=0/004). همچنین در گروه دریافتکننده عصاره گردو میزان بیلی روبین توتال در مقایسه با گروه دریافتکننده تارترازین کاهش معنیداری یافت (P=0/003). نتایج حاصل از این بررسی نشان داد که بین گروه دریافتکننده همزمان تارترازین و گردو در مقایسه با گروه دریافتکننده تارترازین اختلاف آماری معنی¬داری مشاهده گردید (P=0/005). (نمودار 5).
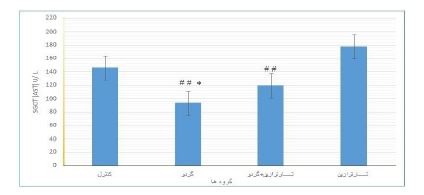
نمودار1: مقایسه میزانAST در گروههای کنترل و تیمار
* نشاندهنده اختلاف معنیدار با گروه کنترل در سطح (P<0/05).
##نشاندهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
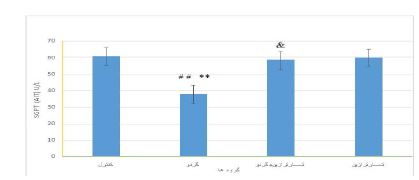
نمودار2: مقایسه میزان ALTدر سرم خون در گروههای کنترل و تیمار
** نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
##نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
& نشان دهنده اختلاف معنیدار با گروه گردو در سطح (P<0/05).
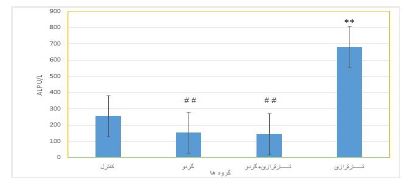
نمودار 3: مقایسه میزانALP در گروههای کنترل و تیمار
**نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
##نشان دهنده اختلاف بسیار معنیدار با گروه رنگ تارترازین در سطح (P<0/01).
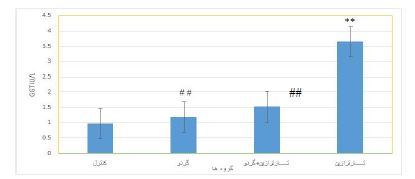
نمودار4: مقایسه میزانGGT در سرم خون در گروههای کنترل و تیمار
**نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
## نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
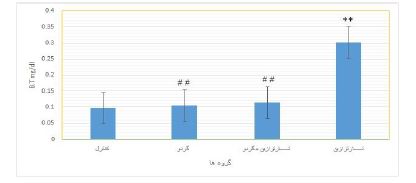
نمودار 5: مقایسه میزان بیلیروبین توتال (B.T) در سرم خون در گروههای کنترل و تیمار
** نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
## نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
بحث
یافتههای تحقیق حاضر نشان داد که تارترازین سبب افزایش معنیدار میزان آنزیمهای ALP ،GGT و بیلیروبین توتال نسبت به گروه کنترل گردید. مصرف عصاره گردو بهتنهایی باعث کاهش معنی¬دار میزان آنزیمهای AST وALT نسبت به گروه کنترل شد. میزان آنزیمهای AST، ALP، GGT و B.T در گروهی که همزمان تارترازین و عصاره گردو مصرف کرده بودند نسبت به گروه تارترازین بهطور معنیدار کاهش یافت. یکی از مهمترین اعمال کبد نقش آن در سمزدایی مواد آلوده کننده محیطی و داروهای شیمیایی است (22). تمام اعمال کبد توسط آنزیمهایی مثل آسپارتاتآمینوترانسفراز و آلانینآمینوترانسفراز و آنزیم آلکالینفسفاتاز، گاماگلوتامین ترانسفراز و ... صورت میگیرند و تغییر در میزان این آنزیم¬ها جهت ارزیابی عملکرد کبد مورد استفاده قرار میگیرد (23). تارترازین به عنوان رنگ خوراکی مصنوعی کاربرد وسیعی در صنایع غذایی دارد. برخی از مطالعات قبلی تارترازین را به عنوان یک عامل بالقوه برای القای استرس اکسیداتیو با تولید گونههای اکسیژن فعال (ROS)، اختلال در تعادل پرواکسیدانی و آنتیاکسیدانی و ایجاد التهاب در کبد موشها گزارش کردهاند (7). استفاده از گیاهان دارویی به دلیل عوارض بسیار کمتر و دارا بودن ترکیباتی با خواص آنتیاکسیدانی زیاد، مورد توجه فراوانی قرار گرفته است . بر اساس نتایج بهدست آمده از پژوهش اساوا در سال 2007 دیده شد که گیاهان دارویی منابع غنیایی از آنتیاکسیدان¬ها میباشند که میتوانند ارگانها را از آسیبهای ناشی از وجود رادیکالهای آزاد حفظ نمایند (24). همانطور که پژوهشهای پیشین نشان می¬دهد مشتقات فنلی موجود درگردو دارای بالاترین خاصیت آنتیاکسیدانی هستند و می¬توانند از عملکرد رادیکال¬های آزاد جلوگیری نمایند (25). نقش کلیدی ترکیبهای فنلـی بـه عنـوان حـذف کنندههای رادیکالهـای آزاد در چنـدین مقالـه گـزارش شـده است. لازم به ذکر است که ترکیبات فنلی بهصورت موثری به عنوان دهنده هیدروژن و خنثی کننده اکسیژن تکی عمل نموده لـذا بـهعنـوان یک آنتیاکسیدان موثر عمل می¬کنند (26). یافتههای حاصل از مطالعه حاضر نشان داد که مصرف رنگ مصنوعی تارترازین می تواند فعالیت آنزیم¬های کبدی را بهطور جداگانه تغییر دهد. با مصرف تارترازین میزان آنزیم AST افزایش یافت ولی با گروه کنترل تفاوت معنی¬داری نداشت. استفاده همزمان تارترازین و گردو باعث کاهش معنیدار این آنزیم در مقایسه با گروه دریافت کننده تارترازین شد. بهنظر می¬رسد که رنگ با اثر مخربی که بر روی ساختار بافت کبدی بر جای می¬گذارد نقش موثری در بالا بردن میزان آنزیم کبدی AST بهخصوص در گروهی که صرفا رنگ تارترازین دریافت نموده¬اند ایفا می¬نماید. یافتههای بهدست آمده از این پژوهش مطابق با نتایج به¬دست آمده از پژوهش آبد الحکیم و همکارانش در سال 2018 می¬باشد که نشان دادند رنگهای خوراکی مصنوعی تارترازین میتوانند باعث افزایش شاخصهای التهابی و پیشرفت بیماریهای مزمن در بدن شوند (27). همچنین مطالعه هلال و همکاران در سال 2000 نشان داده است که مصرف رنگ خوراکی مصنوعی بهطور قابلتوجهی آســپارتات آمینوترانــسفراز (AST) سرم را افزایش میدهد (8) که مطابق با تحقیق حاضر بود. یکی از آنزیم¬های مهم کبدی که از لحاظ بالینی دارای ارزش فراوانی است آنزیم ALT می¬باشد که جهت اندازهگیری سطح آلانینآمینوترانسفراز در خون بهکار میرود. معمولاً زیاد بودن آنزیم ALT در آزمایش میتواند نشانه آسیب یا تحریک کبد باشد. یافته¬های حاصل از مطالعه حاضر نشان داد که کمترین میزان آنزیم ALT در گروه دریافت کننده عصاره گردو می-باشد. مقدار این آنزیم در گروهی که فقط عصاره گردو مصرف کرده بودند کمتر از گروه کنترل بود. با مصرف رنگ غذایی تارترازین سطح آنزیم ALT در مقایسه با گروه دریافت کننده عصاره گردو افزایش یافت. بهنظر میرسد که این موضوع میتواند به اثرات پیشگیری کننده و خواص آنتیاکسیدانی عصاره گردو باز گردد که با کمک ترکیبات موجود در آن از جمله ترکیبات پلیفنلی باعث افزایش ظرفیت آنتیاکسیدانی بدن، جلوگیری از پراکسیداسیون لیپیدها و کمک به بهبود عملکرد ارگان¬های مختلف بدن میشود (27). اثرات گردو بر کاهش آنزیمهای کبدی مشاهده شده در این پژوهش با یافته-های قبلی دیگر محققین همخوانی داشت. بهطوریکه در تحقیقات انجام گرفته توسط زنگنه و همکارانش در سال2018 ثابت گردید که عصاره هیدروالکلی برگ گردو به دلیل مهار آسیب کبدی و کاهش معنی¬دار در میزان آنزیمهای کبدی ALTو AST می¬تواند در درمان بیماری¬های کبدی مورد استفاده قرار گیرد (28). آلکالینفسفاتاز آنزیمی در خون است که به تجزیه پروتئینها کمک میکند. سطوح غیرمعمولALP ممکن است نشانه مشکلات کبدی باشد. همانگونه که گفته شد آسیب کبد باعث افزایش سطح ALP میشود. علاوه بر این آسیب و انسداد مجرای صفراوی نیز میتواند سبب افزایش این آنزیم کبدی گردد (29). یافته¬های حاصل از مطالعه حاضر نشان داد که میزان آنزیم ALP در گروه مصرف کننده رنگ غذایی تارترازین بهطور معنی داری در مقایسه با گروه کنترل افزایش داشته است و بیشترین مقدار را در میان تمامی گروه¬ها به خود اختصاص داده است. در این پژوهش مشاهده شد که مقدار آنزیم ALP با مصرف عصاره گردو کاهش معنیداری نسبت به گروه تارترازین می¬یابد. بهنظر می¬رسد که رنگ تارترازین با القای استرس اکسیداتیو منجر به تخریب بافت کبد میشود. یافته های بدست آمده از این پژوهش مطابق با نتایج به¬دست آمده از پژوهش الشهری در سال 2023 می¬باشد که نشان داد دریافت رنگهای مصنوعی مانند تارترازین باعث آسیب سلولهای کبدی شده و (30) نقش موثری در بالا بردن میزان آنزیم ALP کبدی دارد، همچنین بالا بودن مضاعف این آنزیم کبدی میتواند به علت اثرات تخریبی آن بر روی مجاری صفراوی نیز باشد (23). عصاره گردو می تواند به دلیل خواص آنتی اکسیدانی آن از اثرات تخریبی بر روی بافت¬های بدن و افزایش غیرطبیعی شاخصهای التهابی جلوگیری نماید (31). مطالعه انجام شده توسط شیمودا و همکارانش در سال 2008 ثابت نمود که عصاره اتانولی برگ درخت گردو می¬تواند فعالیت آنزیم ALP در موش¬های صحرایی دیابتی شده با آلوکسان را به صورت معنیداری کاهش دهد که با یافتههای به¬دست آمده از پژوهش حاضر همخوانی دارد (32). گردو دارای مقدار مناسبی توکوفرول هست و - γ توکوفرول بیشترین نوع توکـوفرول موجـود در آن بـه شـمار مـی¬رود (33). توکـوفرول توانایی بالایی در جـذب رادیکـال¬هـای آزاد اسید چرب دارد (34) و فعال¬ترین فرم زیستی ویتامین E است. عملکرد اصلی این آنتی¬اکسیدان به¬عنوان حذف کننده¬ رادیکالهای پروکسیل و مهار انتشار رادیکال¬های آزاد است. علاوه بر این، - γ توکوفرول با گونه¬های فعال اکسید نیتروژن و اکسیژن تکی برهمکنش داده و سبب حفظ یکپارچگی اسیدهای چرب اشباع نشده غشای سلولی، حفظ یکپارچگی سلولها، جلوگیری از التهاب و آسیب بافتی کبد و دیگر اندامها میشود (35). نتایج بهدست آمده در تحقیق حاضر موافق یافته های قبلی بود و عصاره گردو توانست میزان آنزیم ALP را در مقایسه با گروه تارترازین کاهش دهد. آنزیم گاماگلوتامین ترانسفراز (GGT) معمولاً در کبد، کلیه و پانکراس فعالیت میکند. اندازهگیری این آنزیم در خون جهت بررسی عملکرد کبد مورد استفاده قرار میگیرد. حساسیت GGT در مقایسه با تستهای آلکالین فسفاتاز و ترانس آمینازها، جهت تشخیص بیماریهای کبدی نظیر زردی ناشی از انسداد، التهاب مجاری صفرا والتهاب کیسه صفرا بالاتر است. بهطور معمول سطح GGT پایین است، اما در آسیبدیدگی کبد، ممکن است این میزان افزایش پیدا کند و در صورت انسداد مجاری صفراوی معمولا اولین آنزیم کبدی است که افزایش پیدا می¬کند. بنابراین آزمایش گاماگلوتامین ترانسفراز حساسترین تست آنزیم کبدی برای تشخیص مشکلات مجرای صفراوی است (36). بر طبق یافتههای حاصل از این پژوهش نشان داده شد که میزان آنزیم GGT در گروه دریافتکننده تارترازین افزایش معنیداری در مقایسه با گروه کنترل داشت ولی مصرف عصاره گردو باعث کاهش معنیدار این شاخص در مقایسه با گروه تارترازین شد. یافتههای گزارش شده قبلی موافق با یافتههای پژوهش حاضر بود. زمانی که پروتئین هموگلوبین در گلبولهای قرمز پیر تجزیه میشود، بیلیروبین در بدن تشکیل میشود. تجزیه گلبولهای قدیمی یک فرایند طبیعی و سالم است. بیلیروبین بعد از گردش در خون به کبد میرسد. و در کبد تجزیه، با صفرا ترکیب و در کیسه صفرا ذخیره میشود. سرانجام بیلیروبین توسط مدفوع و ادرار دفع میشود. گاهی کبد نمیتواند بیلیروبین بدن را پردازش کند. در نتیجه سبب افزایش بیلیروبین و انسداد یا التهاب کبد میگردد (37). نتایج حاصل از بررسی میزان بیلیروبین توتال (B.T) در پژوهش حاضر نشان داد که میزان این شاخص در گروه مصرف کننده تارترازین افزایش معنیداری نسبت به گروه کنترل داشت. این موضوع با یافتههای پژوهش هلال و همکاران در سال 2000 مطابقت دارد که نشان دادند رنگهای مصنوعی بهطور قابلتوجهی بیلیروبین کل سرم را افزایش میدهند (8). مصرف عصاره گردو باعث کاهش معنیدار این شاخص در مقایسه با گروه تارترازین شد. این کاهش میتواند به این علت باشد که گردو غنی از اسیدهای چرب ضروری نظیر امگا 3 و امگا 6 است و با خاصیت ضد التهابی میتوانند التهاب را کاهش دهند (38).
نتیجهگیری
نتایج پژهش حاضر نشان داد که رنگهای مصنوعی مثل تارترازین میتواند باعث افزایش آنزیمهای کبدی همچون AST، ALP، GGT و B.T شوند. بهنظر می¬رسد که رنگ تارترازین با القای استرس اکسیداتیو منجر به تخریب بافت کبد شده و منجر به افزایش آنزیمهای کبدی می شود. استفاده از گردو باعث کاهش سطح این آنزیمها شد. احتمالاً عصاره گردو به دلیل خواص آنتیاکسیدانی و ضد التهابی باعث این اثرات در کبد می شود. با توجه به محدودیتهای این مطالعه که تنها به بررسی آنزیمهای کبدی پرداخته است و پژوهش در یک دوز واحد انجام شده است، تحقیقات بیشتر بافتی و مولکولی جهت دستیابی به یافته های بیشتر و دقیق تر پیشنهاد میشود.
سپاسگزاری
نویسندگان این مقاله مراتب تشکر و قدردانی خود را از معاونت پژوهشی دانشگاه ارومیه به جهت حمایت و مساعدت در انجام این پایاننامه کارشناسی ارشد اعلام مینمایند.
حامی مالی: معاونت پژوهشی دانشگاه ارومیه
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مقاله توسط کمیته اخلاق دانشگاه ارومیه با کد IR-UU-AEC-3/90 تایید شده است.
مشارکت نویسندگان
صفی¬اله شیری در جمعآوری داده¬ها، شیوا خضری در طراحی مطالعه، نسیم رستمخانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
افزودنیهای غذایی به ترکیباتی گفته میشوند که به منظور افزایش دوام غذا، جذاب نمودن ظاهر غذا، خوش طعم کردن غذا، ارتقای ارزش غذایی و پیشگیری از فاسد شدن، به مواد غذایی مختلف اضافه میشوند (1). تارترازین به دلیل طعم و عطر آن بهعنوان یک رنگ خوراکی مصنوعی به صورت گستردهای در محصولات غذایی مورد استفاده قرار میگیرد (2). بســیاری از رنــگهــای مصــنوعی دارای عــوارض خطرناک برای بدن میباشند و در این رابطـه یکـی از خطرناکترین گروه رنـگهـای مصـنوعی رنـگهـای آزو با ســاختار شــیمیایی (AZO R−N=N−R) معرفی شدهاند کـه میتواننـد اثـرات نـامطلوبی بـر سلامت انسان داشته باشند (3). رنـگ زرد تـــــارترازین (E102) بـــــا فرمـــــول مولکـــــولی (C16H9N4Na3O9S2) یک مونوآزو مـیباشـد (4). در مطالعه جونالاگادا و همکاران در سال 2004، 2٪ رنگهای مورد استفاده در صنایع غذایی شامل ترکیبی از رنگهای مجاز و غیر مجاز و 8٪ آن شامل رنگ غیر مجاز بود (5). این ترکیبات علاوه بر اثر سمیت بر روی بدن انسان، ممکن است با عوارض مختلف از جمله آسم، کهیر، سقط جنین، بیشفعالی کودکان، سرطانزایی، کاهش ضریب هوشی کودکان، واکنشهای آنافیلاکتیک، تضعیف و سرکوب سیستم ایمنی بدن، ایجاد فشارخون و همچنین تأثیر بر عملکرد کبد همراه باشند (6). برخی از مطالعات، تارترازین را به عنوان یک عامل بالقوه برای القای استرس اکسیداتیو با تولید گونههای اکسیژن فعال (ROS)، اختلال در تعادل پرواکسیدانی و آنتیاکسیدانی و ایجاد التهاب در کبد موشها گزارش کردهاند (7). همچنین مطالعه هلال و همکاران در سال 2000 نشان داده است که مصرف رنگ خوراکی مصنوعی بهطور قابلتوجهی آســپارتات آمینوترانــسفراز (AST) سرم را افزایش میدهد. همه رنگها به استثنای رنگ زرد غروب آفتاب بهطور قابلتوجهی بیلیروبین کل سرم را افزایش میدهند (8). با توجه به عوارض گسترده استفاده از رنگهای خوراکی، لزوم استفاده از آنتیآکسیدانها برای جلوگیری از عوارض رنگها امری ضروری میباشد. امروزه جوامع بشری بیشتر طالب آن هستند که بهجای استفاده از داروهای سنتز شده با اثرات مضر، از گیاهان برای درمان استفاده کنند (9). گیاهان دارویی با توجه به تاریخچه مصرف طولانی میتوانند به عنوان مواد طبیعی با سمیت و عوارض جانبی حداقل مورد استفاده قرار بگیرند (10). گیاه گردو یکی از قدیمیترین گونههای گیاهی در کره زمین است که بهطور وسیعی از آن در دنیا استفاده میشود. نتایج مطالعه پریرا و همکاران نشان داد که گردو به عنوان ترکیبـی بـا ویژگیهای آنتیاکسیدانی و ضد میکروبی می¬تواند مطرح باشد (11). بر اساس نتایج مطالعات پاندارش و همکارن در سال 2018 آسیب به DNA یکی از عوارض جانبی مصرف مواد سمی مانند رنگهای خوراکی مصنوعی است که میتواند منجر به تغییرات ژنتیکی و افزایش خطر ابتلا به بیماریها شود. آنتیاکسیدانهای قوی در عصاره گردو میتوانند با محافظت از DNA در برابر آسیبهای اکسیداتیو، خطر این تغییرات را کاهش دهند (12). نتایج مطالعه کیم و همکارانش در سال 2021 نشان داد که عصارههای فنلی و لیپیدی ترکیبات گردو و رژیم غذایی غنیشده با گردو بهطور مداوم اثرات بسیار مفیدی بر روی متابولیسم و عملکرد کبد دارد. پلیفنولهای موجود در عصاره گرد و میتوانند با تقویت ساختار غشاهای سلولی، از آسیبها جلوگیری کرده و به حفظ عملکرد طبیعی سلولها کمک کنند (13). مطالعات ارائه شده از بررسی بیرینو و همکاران در سال 2024 نشان داد که بین مصرف رنگهای غذایی مصنوعی و انواع عوارض جانبی سلامتی، از بیشفعالی و اختلالات رفتاری گرفته تا واکنشهای آلرژیک ارتباط مستقیمی وجود دارد (14). مقدار روغن مغـز گـردو در واریتـههـای متفـاوت آن بـین 61/67 الی72/41 درصد تخمین زده شده است که 62 تـا 75 درصـد آن را اسیدهای چرب غیر اشباعی تشکیل میدهند (15). اسیدهای فنلی و فلاونوئیدها دو گروه عمده ترکیبهای فنلی موجود در گردو میباشند (16). ترکیبات فنلی طیف وسیعی از خواص فیزیولوژیکی مانند ضد آلرژی، ضد میکروب، آنتیاکسیدان، ضد انعقاد، ضد التهاب، اثرات محافظتی و گشاد کنندگی عروق را دارند و میتوانند یک عامل تعیین کننده عمده در پتانسیل آنتیاکسیدانی غذاها باشند. پلیفنولهای موجود در عصاره گردو با داشتن خواص ضد التهابی میتواند سطح مولکولهای التهابی مانند سیتوکینها را کاهش دهد (17). این کاهش در التهاب به بازسازی سلولهای کبدی، بهبود عملکرد کبد و جلوگیری از آسیبهای بلندمدت کمک میکند. این ترکیبات نهتنها از سلولهای کبدی در برابر آسیبهای اکسیداتیو محافظت میکنند، بلکه میتوانند فرآیندهای بازسازی و ترمیم سلولی را نیز تقویت کنند. این ویژگی بهویژه در مواردیکه کبد تحت تأثیر رنگهای خوراکی مصنوعی دچار آسیب شده است، حائز اهمیت است. این امر به محافظت بیشتر کبد در برابر سموم و مواد مضر مانند رنگهای خوراکی مصنوعی کمک میکند (18). شواهد نشان میدهد که کبد یکی از اندامهای حیاتی بدن است که در تنظیم بسیاری از پدیدههای فیزیولوژیک دارای اهمیت است و اختلال در عملکرد آن باعث میشود انواعی از بیماریهای مختلف ایجاد شود. با توجه به اینکه آنزیمها در همه بافتها از جمله کبد فعالیت دارند با اندازهگیری آنزیمهایی همچون آلانـینآمینوترانـسفراز (ALT)، آســپارتاتآمینوترانــسفراز (AST)، آلکــالینفــسفاتاز (ALP)، گاماگلوتامیلترانسفراز (GGT) و مارکر زیستی بیلیروبین توتال (B.T) میتوان به آسیبهای سلولی و اختلال در فعالیتهای متابولیکی بدن پی برد. مطالعات پیشین نشان میدهد که تارترازین باعث التهاب کبد و القای استرس اکسیداتیو میشود (7). با توجه به اینکه تابهحال مطالعهای مبنی بر بررسی عصاره گردو بر آنزیمهای کبدی و برخی شاخصهای التهابی در کبد متاثر از رنگ خوراکی مصنوعی تارترازین انجام نگرفته است، لذا هدف پژوهش حاضر بررسی اثر عصاره گردو بر سمیت ناشی از تأثیر رنگ خوراکی مصنوعی تارترازین بر روی سطوح آنزیم¬های کبدی در موشهای صحرایی نر میباشد.
روش بررسی
در این مطالعه تجربی از 32 سر موش صحرائی نر بالغ نژاد ویستار به وزن 180 الی 200 گرم استفاده شد. حیوانات در شرایط استاندارد در قفسهای چهارتایی در دمای 1±23 درجه سانتیگراد و شرایط نوری 12 ساعت روشنایی و 12 ساعت تاریکی نگهداری شدند. حیوانات بهطور مناسب و کافی، به آب و غذای مخصوص رتها دسترسی داشتند و شیشههای آب آنها روزانه کنترل و تمیز میشدند. در انجام این آزمایشات، منشور و موازین اخلاق در پژوهش رعایت شده است 32 سر موش صحرایی نر بهصورت تصادفی ساده و یک سوکور در 4 گروه 8 تایی تقسیم شدند: 1) گروه کنترل، این گروه از موشها نرمالسالین را بهمدت 30 روز از طریق گاواژ دریافت نمودند، 2) گروه دریافتکننده رنگ غذای تارترازین (mg/kg15) به مدت 30 روز از طریق گاواژ (10)، 3) گروه دریافت کننده عصاره هیدروالکی گردو (g/kg0/2) به مدت 30 روز از طریق گاواژ (19) و 4)گروه دریافتکننده رنگ غذای تارترازین (mg/kg15) به همراه عصاره گردو (g/kg0/2) بهمدت 30 روز از طریق گاواژ. پس از پایان دوره تیمار (روز 31)، موشها پس از توزین، با استفاده از ترکیب کتامین (50 میلیگرم بر کیلوگرم)-زایلزین (10 میلیگرم بر کیلوگرم) بهصورت عمیق بیهوش شده (20) و خون از قلب جمعآوری شد. نمونههای خونی نیم ساعت پس از قرار گرفتن در دمای اتاق به مدت 10 دقیقه با دورrpm3500 در دقیقه سانتریفیوژ شدند. سپس سرم هر لولـه جهت اندازهگیری میزان آنزیمهای کبدی همچون ALT، ALP ،AST، GGT و مارکر زیستی بیلیروبین توتال (B.T) مورد استفاده قرار گرفتند. جهت سنجش آنزیمهای ALT (کد PI009)،ALP (کد PI007)، AST (کد PI023)، GGT (کد PI011) و بیلی روبین توتال (B.T) (PI003) از کیتهای ساخت شرکت دلتا درمان پارت استفاده گردید. اندازهگیری ALPباروش آنزیمی، کالریمتری p-Nitrophenylphosphate.DGKC ، ALT و AST با روش آنزیمی، کالریمتریNADH.Kinetic UV.IFCC ،GGT با روش آنزیمی، کالریمتری Carboxy substrate.Kinetic و بیلی روبین توتال با روش کالریمتری DPD صورت گرفت. جهت تهیه عصاره هیدروالکلی گردو، مغز گردوهای مرغوب و سالم تهیه گردید، بعد از آن به کمک آسیاب برقی پودر آن تهیه شد. پانصد گرم از پودر بهدست آمده را بهوسیله ترازوی دیجیتال وزن کرده و به یک بشر 1000 سی سی انتقال یافت. در مرحله بعد به این پودرخشک شده الکل اتانول 70 درصد اضافه شد و به دنبال آن به مدت 48 ساعت این محلول در داخل یخچال قرار گرفت. بعد از گذشت این مدت از کاغذ صافی عبور داده شد. عصاره الکلی بهدست آمده در لولههای سانتریفیوژ پلی پروپیلن 50 میلیلیتر ریخته شد و دستگاه سانتریفیوژ با سرعت 3500 دور بر دقیقه به مدت 15 دقیقه لوله ها را چرخاند تا ذرات معلق در آن جدا شود. بعد از سانتریفیوژ مایع رویی بهدست آمده خارج گردید و در آون با دمای 50 درجه سانتیگراد قرار گرفت تا در نهایت شیره غلیظی باقی بماند. عصاره هیدروالکلی مغز گردو برحسب مقدار مورد نیاز روزانه در آب مقطر حل شد تا در تیمار حیوانات مورد استفاده قرار بگیرد (21).
تجزیه و تحلیل آماری
در این مطالعه جهت بررسی نرمال بودن توزیع دادهها، از آزمون شاپیرو-ویلک استفاده شد و در نهایت تغییرات بین فاکتورهای بیوشیمیایی در میان گروه¬های مختلف آزمایشی توسط نرمافزار SPSS version 16 ، آزمون ANOVA یکطرفه و آزمون تعقیبی توکی تجزیه و تحلیل شدند. مقدار (0/05>p) معنیدار در نظر گرفته شد. تمام دادهها به صورت انحراف معیار ± میانگین SD)± Mean) نشان داده شدند.
نتایج
نتایج حاصل از بررسی سطح سرمی آسپارتات آمینوترانسفراز(AST) در گروههای آزمایشی: مقایسه میانگین میزان آنزیم آسپارتات آمینوترانسفراز نشان داد گروه دریافت کننده گردو تفاوت معنیداری با گروه کنترل دارد (P=0/042). در گروه دریافت کننده تارترازین میزان آنزیم AST افزایش یافت ولی با گروه کنترل تفاوت معنیداری نداشت. استفاده از عصاره هیدروالکلی گردو در گروه دریافتکننده عصاره گردو باعث کاهش معنی¬دار این آنزیم در مقایسه با گروه دریافتکننده تارترازین شد (P=0/002). همچنین میزان آنزیم ASTدر گروه دریافت کننده همزمان تارترازین و گردو کاهش معنیداری در مقایسه با گروه تارترازین داشت(P=0/01). ولی اختلاف معنیداری با گروه کنترل مشاهده نشد (P>0/05) (نمودار 1).
نتایج حاصل از بررسی سطح سرمی آلانین آمینوترانسفراز(ALT) در گروههای آزمایشی: نتایج حاصل از بررسی نمودار (2) نشان داد که میانگین میزان آنزیم ALTدر گروهی که فقط عصاره گردو مصرف کرده بودند کمتر از گروه کنترل بود (P=0/005).در گروه دریافتکننده تارترازین مقدار این آنزیم در مقایسه با گروه دریافتکننده عصاره گردو افزایش یافت (P=0/01). همچنین نتایج حاصل از بررسی داده¬ها نشان داد که بین گروه مصرفکننده همزمان عصاره تارترازین و گردو در مقایسه با گروه دریافتکننده عصاره گردو اختلاف آماری معنیداری وجود دارد(P=0/045). ولی هیچ اختلاف معنیداری بین گروه مصرفکننده همزمان عصاره تارترازین و گردو در مقایسه با گروه دریافتکننده تارترازین، مشاهده نشد (05/0
نتایج حاصل از بررسی سطح سرمی بیلیروبین توتال ((B.Tدر گروههای آزمایشی: نتایج حاصل از بررسی نمودار میزان بیلیروبین توتال (B.T) نشان داد که در گروه دریافت کننده تارترازین افزایش معنی¬داری در این متغیر در مقایسه با گروه کنترل دیده میشود (P=0/004). همچنین در گروه دریافتکننده عصاره گردو میزان بیلی روبین توتال در مقایسه با گروه دریافتکننده تارترازین کاهش معنیداری یافت (P=0/003). نتایج حاصل از این بررسی نشان داد که بین گروه دریافتکننده همزمان تارترازین و گردو در مقایسه با گروه دریافتکننده تارترازین اختلاف آماری معنی¬داری مشاهده گردید (P=0/005). (نمودار 5).

نمودار1: مقایسه میزانAST در گروههای کنترل و تیمار
* نشاندهنده اختلاف معنیدار با گروه کنترل در سطح (P<0/05).
##نشاندهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).

نمودار2: مقایسه میزان ALTدر سرم خون در گروههای کنترل و تیمار
** نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
##نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
& نشان دهنده اختلاف معنیدار با گروه گردو در سطح (P<0/05).

نمودار 3: مقایسه میزانALP در گروههای کنترل و تیمار
**نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
##نشان دهنده اختلاف بسیار معنیدار با گروه رنگ تارترازین در سطح (P<0/01).

نمودار4: مقایسه میزانGGT در سرم خون در گروههای کنترل و تیمار
**نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
## نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).

نمودار 5: مقایسه میزان بیلیروبین توتال (B.T) در سرم خون در گروههای کنترل و تیمار
** نشان دهنده اختلاف بسیار معنیدار با گروه کنترل در سطح (P<0/01).
## نشان دهنده اختلاف بسیار معنیدار با گروه تارترازین در سطح (P<0/01).
بحث
یافتههای تحقیق حاضر نشان داد که تارترازین سبب افزایش معنیدار میزان آنزیمهای ALP ،GGT و بیلیروبین توتال نسبت به گروه کنترل گردید. مصرف عصاره گردو بهتنهایی باعث کاهش معنی¬دار میزان آنزیمهای AST وALT نسبت به گروه کنترل شد. میزان آنزیمهای AST، ALP، GGT و B.T در گروهی که همزمان تارترازین و عصاره گردو مصرف کرده بودند نسبت به گروه تارترازین بهطور معنیدار کاهش یافت. یکی از مهمترین اعمال کبد نقش آن در سمزدایی مواد آلوده کننده محیطی و داروهای شیمیایی است (22). تمام اعمال کبد توسط آنزیمهایی مثل آسپارتاتآمینوترانسفراز و آلانینآمینوترانسفراز و آنزیم آلکالینفسفاتاز، گاماگلوتامین ترانسفراز و ... صورت میگیرند و تغییر در میزان این آنزیم¬ها جهت ارزیابی عملکرد کبد مورد استفاده قرار میگیرد (23). تارترازین به عنوان رنگ خوراکی مصنوعی کاربرد وسیعی در صنایع غذایی دارد. برخی از مطالعات قبلی تارترازین را به عنوان یک عامل بالقوه برای القای استرس اکسیداتیو با تولید گونههای اکسیژن فعال (ROS)، اختلال در تعادل پرواکسیدانی و آنتیاکسیدانی و ایجاد التهاب در کبد موشها گزارش کردهاند (7). استفاده از گیاهان دارویی به دلیل عوارض بسیار کمتر و دارا بودن ترکیباتی با خواص آنتیاکسیدانی زیاد، مورد توجه فراوانی قرار گرفته است . بر اساس نتایج بهدست آمده از پژوهش اساوا در سال 2007 دیده شد که گیاهان دارویی منابع غنیایی از آنتیاکسیدان¬ها میباشند که میتوانند ارگانها را از آسیبهای ناشی از وجود رادیکالهای آزاد حفظ نمایند (24). همانطور که پژوهشهای پیشین نشان می¬دهد مشتقات فنلی موجود درگردو دارای بالاترین خاصیت آنتیاکسیدانی هستند و می¬توانند از عملکرد رادیکال¬های آزاد جلوگیری نمایند (25). نقش کلیدی ترکیبهای فنلـی بـه عنـوان حـذف کنندههای رادیکالهـای آزاد در چنـدین مقالـه گـزارش شـده است. لازم به ذکر است که ترکیبات فنلی بهصورت موثری به عنوان دهنده هیدروژن و خنثی کننده اکسیژن تکی عمل نموده لـذا بـهعنـوان یک آنتیاکسیدان موثر عمل می¬کنند (26). یافتههای حاصل از مطالعه حاضر نشان داد که مصرف رنگ مصنوعی تارترازین می تواند فعالیت آنزیم¬های کبدی را بهطور جداگانه تغییر دهد. با مصرف تارترازین میزان آنزیم AST افزایش یافت ولی با گروه کنترل تفاوت معنی¬داری نداشت. استفاده همزمان تارترازین و گردو باعث کاهش معنیدار این آنزیم در مقایسه با گروه دریافت کننده تارترازین شد. بهنظر می¬رسد که رنگ با اثر مخربی که بر روی ساختار بافت کبدی بر جای می¬گذارد نقش موثری در بالا بردن میزان آنزیم کبدی AST بهخصوص در گروهی که صرفا رنگ تارترازین دریافت نموده¬اند ایفا می¬نماید. یافتههای بهدست آمده از این پژوهش مطابق با نتایج به¬دست آمده از پژوهش آبد الحکیم و همکارانش در سال 2018 می¬باشد که نشان دادند رنگهای خوراکی مصنوعی تارترازین میتوانند باعث افزایش شاخصهای التهابی و پیشرفت بیماریهای مزمن در بدن شوند (27). همچنین مطالعه هلال و همکاران در سال 2000 نشان داده است که مصرف رنگ خوراکی مصنوعی بهطور قابلتوجهی آســپارتات آمینوترانــسفراز (AST) سرم را افزایش میدهد (8) که مطابق با تحقیق حاضر بود. یکی از آنزیم¬های مهم کبدی که از لحاظ بالینی دارای ارزش فراوانی است آنزیم ALT می¬باشد که جهت اندازهگیری سطح آلانینآمینوترانسفراز در خون بهکار میرود. معمولاً زیاد بودن آنزیم ALT در آزمایش میتواند نشانه آسیب یا تحریک کبد باشد. یافته¬های حاصل از مطالعه حاضر نشان داد که کمترین میزان آنزیم ALT در گروه دریافت کننده عصاره گردو می-باشد. مقدار این آنزیم در گروهی که فقط عصاره گردو مصرف کرده بودند کمتر از گروه کنترل بود. با مصرف رنگ غذایی تارترازین سطح آنزیم ALT در مقایسه با گروه دریافت کننده عصاره گردو افزایش یافت. بهنظر میرسد که این موضوع میتواند به اثرات پیشگیری کننده و خواص آنتیاکسیدانی عصاره گردو باز گردد که با کمک ترکیبات موجود در آن از جمله ترکیبات پلیفنلی باعث افزایش ظرفیت آنتیاکسیدانی بدن، جلوگیری از پراکسیداسیون لیپیدها و کمک به بهبود عملکرد ارگان¬های مختلف بدن میشود (27). اثرات گردو بر کاهش آنزیمهای کبدی مشاهده شده در این پژوهش با یافته-های قبلی دیگر محققین همخوانی داشت. بهطوریکه در تحقیقات انجام گرفته توسط زنگنه و همکارانش در سال2018 ثابت گردید که عصاره هیدروالکلی برگ گردو به دلیل مهار آسیب کبدی و کاهش معنی¬دار در میزان آنزیمهای کبدی ALTو AST می¬تواند در درمان بیماری¬های کبدی مورد استفاده قرار گیرد (28). آلکالینفسفاتاز آنزیمی در خون است که به تجزیه پروتئینها کمک میکند. سطوح غیرمعمولALP ممکن است نشانه مشکلات کبدی باشد. همانگونه که گفته شد آسیب کبد باعث افزایش سطح ALP میشود. علاوه بر این آسیب و انسداد مجرای صفراوی نیز میتواند سبب افزایش این آنزیم کبدی گردد (29). یافته¬های حاصل از مطالعه حاضر نشان داد که میزان آنزیم ALP در گروه مصرف کننده رنگ غذایی تارترازین بهطور معنی داری در مقایسه با گروه کنترل افزایش داشته است و بیشترین مقدار را در میان تمامی گروه¬ها به خود اختصاص داده است. در این پژوهش مشاهده شد که مقدار آنزیم ALP با مصرف عصاره گردو کاهش معنیداری نسبت به گروه تارترازین می¬یابد. بهنظر می¬رسد که رنگ تارترازین با القای استرس اکسیداتیو منجر به تخریب بافت کبد میشود. یافته های بدست آمده از این پژوهش مطابق با نتایج به¬دست آمده از پژوهش الشهری در سال 2023 می¬باشد که نشان داد دریافت رنگهای مصنوعی مانند تارترازین باعث آسیب سلولهای کبدی شده و (30) نقش موثری در بالا بردن میزان آنزیم ALP کبدی دارد، همچنین بالا بودن مضاعف این آنزیم کبدی میتواند به علت اثرات تخریبی آن بر روی مجاری صفراوی نیز باشد (23). عصاره گردو می تواند به دلیل خواص آنتی اکسیدانی آن از اثرات تخریبی بر روی بافت¬های بدن و افزایش غیرطبیعی شاخصهای التهابی جلوگیری نماید (31). مطالعه انجام شده توسط شیمودا و همکارانش در سال 2008 ثابت نمود که عصاره اتانولی برگ درخت گردو می¬تواند فعالیت آنزیم ALP در موش¬های صحرایی دیابتی شده با آلوکسان را به صورت معنیداری کاهش دهد که با یافتههای به¬دست آمده از پژوهش حاضر همخوانی دارد (32). گردو دارای مقدار مناسبی توکوفرول هست و - γ توکوفرول بیشترین نوع توکـوفرول موجـود در آن بـه شـمار مـی¬رود (33). توکـوفرول توانایی بالایی در جـذب رادیکـال¬هـای آزاد اسید چرب دارد (34) و فعال¬ترین فرم زیستی ویتامین E است. عملکرد اصلی این آنتی¬اکسیدان به¬عنوان حذف کننده¬ رادیکالهای پروکسیل و مهار انتشار رادیکال¬های آزاد است. علاوه بر این، - γ توکوفرول با گونه¬های فعال اکسید نیتروژن و اکسیژن تکی برهمکنش داده و سبب حفظ یکپارچگی اسیدهای چرب اشباع نشده غشای سلولی، حفظ یکپارچگی سلولها، جلوگیری از التهاب و آسیب بافتی کبد و دیگر اندامها میشود (35). نتایج بهدست آمده در تحقیق حاضر موافق یافته های قبلی بود و عصاره گردو توانست میزان آنزیم ALP را در مقایسه با گروه تارترازین کاهش دهد. آنزیم گاماگلوتامین ترانسفراز (GGT) معمولاً در کبد، کلیه و پانکراس فعالیت میکند. اندازهگیری این آنزیم در خون جهت بررسی عملکرد کبد مورد استفاده قرار میگیرد. حساسیت GGT در مقایسه با تستهای آلکالین فسفاتاز و ترانس آمینازها، جهت تشخیص بیماریهای کبدی نظیر زردی ناشی از انسداد، التهاب مجاری صفرا والتهاب کیسه صفرا بالاتر است. بهطور معمول سطح GGT پایین است، اما در آسیبدیدگی کبد، ممکن است این میزان افزایش پیدا کند و در صورت انسداد مجاری صفراوی معمولا اولین آنزیم کبدی است که افزایش پیدا می¬کند. بنابراین آزمایش گاماگلوتامین ترانسفراز حساسترین تست آنزیم کبدی برای تشخیص مشکلات مجرای صفراوی است (36). بر طبق یافتههای حاصل از این پژوهش نشان داده شد که میزان آنزیم GGT در گروه دریافتکننده تارترازین افزایش معنیداری در مقایسه با گروه کنترل داشت ولی مصرف عصاره گردو باعث کاهش معنیدار این شاخص در مقایسه با گروه تارترازین شد. یافتههای گزارش شده قبلی موافق با یافتههای پژوهش حاضر بود. زمانی که پروتئین هموگلوبین در گلبولهای قرمز پیر تجزیه میشود، بیلیروبین در بدن تشکیل میشود. تجزیه گلبولهای قدیمی یک فرایند طبیعی و سالم است. بیلیروبین بعد از گردش در خون به کبد میرسد. و در کبد تجزیه، با صفرا ترکیب و در کیسه صفرا ذخیره میشود. سرانجام بیلیروبین توسط مدفوع و ادرار دفع میشود. گاهی کبد نمیتواند بیلیروبین بدن را پردازش کند. در نتیجه سبب افزایش بیلیروبین و انسداد یا التهاب کبد میگردد (37). نتایج حاصل از بررسی میزان بیلیروبین توتال (B.T) در پژوهش حاضر نشان داد که میزان این شاخص در گروه مصرف کننده تارترازین افزایش معنیداری نسبت به گروه کنترل داشت. این موضوع با یافتههای پژوهش هلال و همکاران در سال 2000 مطابقت دارد که نشان دادند رنگهای مصنوعی بهطور قابلتوجهی بیلیروبین کل سرم را افزایش میدهند (8). مصرف عصاره گردو باعث کاهش معنیدار این شاخص در مقایسه با گروه تارترازین شد. این کاهش میتواند به این علت باشد که گردو غنی از اسیدهای چرب ضروری نظیر امگا 3 و امگا 6 است و با خاصیت ضد التهابی میتوانند التهاب را کاهش دهند (38).
نتیجهگیری
نتایج پژهش حاضر نشان داد که رنگهای مصنوعی مثل تارترازین میتواند باعث افزایش آنزیمهای کبدی همچون AST، ALP، GGT و B.T شوند. بهنظر می¬رسد که رنگ تارترازین با القای استرس اکسیداتیو منجر به تخریب بافت کبد شده و منجر به افزایش آنزیمهای کبدی می شود. استفاده از گردو باعث کاهش سطح این آنزیمها شد. احتمالاً عصاره گردو به دلیل خواص آنتیاکسیدانی و ضد التهابی باعث این اثرات در کبد می شود. با توجه به محدودیتهای این مطالعه که تنها به بررسی آنزیمهای کبدی پرداخته است و پژوهش در یک دوز واحد انجام شده است، تحقیقات بیشتر بافتی و مولکولی جهت دستیابی به یافته های بیشتر و دقیق تر پیشنهاد میشود.
سپاسگزاری
نویسندگان این مقاله مراتب تشکر و قدردانی خود را از معاونت پژوهشی دانشگاه ارومیه به جهت حمایت و مساعدت در انجام این پایاننامه کارشناسی ارشد اعلام مینمایند.
حامی مالی: معاونت پژوهشی دانشگاه ارومیه
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مقاله توسط کمیته اخلاق دانشگاه ارومیه با کد IR-UU-AEC-3/90 تایید شده است.
مشارکت نویسندگان
صفی¬اله شیری در جمعآوری داده¬ها، شیوا خضری در طراحی مطالعه، نسیم رستمخانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Rahimi S, Kiani M, Ezati P, Pourmohammadi B, Biabani J, Torabi H, et al. Prevalence of colors of used in Saffronal foods of Yazd using Thin Layer Choromotography (TLC) in 2015. Navidno 2016; 19(62): 1-7.
2- El Golli N, elbini I, Jrad A, Boudali I. Toxicity Induced after Subchronic Administration of the Synthetic Food Dye Tartrazine in Adult Rats, Role of Oxidative Stress. Recent Adv Biol Med 2016; 2: 20-8.
3- Rao Jasti P, Rao Vemila R. Risk assessment of synthetic food colours: a case study in Hyderabad, India. International Journal of Food Safety, Nutr Public Health 2008; 1(1): 68-87.
4- Leulescu M, Rotaru A, Palarie I, Moant A, Cioatera N, Popescu M, et al. Tartrazine: Physical, Thermal and Biophysical Properties of the Most Widely Employed Synthetic Yellow Food-Colouring Azo Dye. J Therm Anal Calorim 2018; 134: 209-31.
5- Jonnalagadda PR, Rao P, Bhat RV, Nadamuni Naidu A. Type, Extent and Use of Colours in Ready-To-Eat (RTE) Foods Prepared in the Non-Industrial Sector–A Case Study from Hyderabad, India. International Journal of Food Science & Technology 39(2): 125-31.
6- Molaei Tavani S, Nobari S, Ghasemi R, Mazloomi S. Survey the Authorized and Unauthorized Food Colorings Consumption in the Food Supply of Nazarabad Township in 1395. J Environ Health Eng 2017; 4(4): 299-306. [Persian]
7- El-Wahab HM, Moram GS. Toxic Effects of Some Synthetic Food Colorants And/or Flavor Additives on Male Rats. Toxicol Ind Health 2013; 29(2): 224-32.
8- Helal EGE, Zaahkouk SA, Mekkawy HA. Effect of Some Food Colorants (Synthetic and Natural products) of Young Albino Rats I Liver and KidneyFunctions. The Egyptian Journal of Hospital Medicine 2000; 1(1): 103-13.
9- Liu JP, Zhang M, Wang WY, Grimsgaard S. Chinese Herbal Medicines for Type 2 Diabetes Mellitus. Cochrane Database Syst Rev 2004; 2002(3): CD003642.
10- Amin KA, Abdel Hameid H, 2nd, Abd Elsttar AH. Effect of Food Azo Dyes Tartrazine and Carmoisine on Biochemical Parameters Related to Renal, Hepatic Function and Oxidative Stress Biomarkers in Young Male Rats. Food Chem Toxicol 2010; 48(10): 2994-9.
11- Zibaeenezhad MJ, Shamsnia SJ, Khorasani M. Walnut Consumption in Hyperlipidemic Patients. Angiology 2005; 56(5): 581-30.
12- Pandareesh MD, Chauhan V, Chauhan A. Walnut Supplementation in the Diet Reduces Oxidative Damage and Improves Antioxidant Status in Transgenic Mouse Model of Alzheimer's Disease. J Alzheimers Dis 2018; 64(4): 1295-305.
13- Kim MY, Choi SW. Can Walnut Serve as a Magic Bullet for the Management of Non-Alcoholic Fatty Liver Disease? Appl Sci 2021; 11(1): 218.
14- Birino de Oliveira Z, Vitória Silva da Costa D, Caroline da Silva dos Santos A, Quaresma da Silva Júnior A, Silva AL, et all. Synthetic Colors in Food: A Warning for Children’s Health. Int J Environ Res Public Health 2024; 21(6): 682.
15- Martinez ML, Mattea MA, Maestri DM. Varietal and Crop Year Effect on Lipid Composition of Walnut (Juglans Regia) Genotypes. JAOCS 2006; 83(9): 791-96.
16- SolarA, Colaric M, UsenikV, Stampar F. Seasonal Variations of Selected Flavonoids, Phenolic Acids and Quinones in Annual Shoots of Common Walnut (Juglans Regia L.). Plant Sci 2006; 170(3): 453-61.
17- Mateș L, Rusu ME, Popa DS. Phytochemicals and Biological Activities of Walnut Septum: A Systematic Review. Antioxid 2023; 12(3): 604.
18- BalasundramN, Sundram K, SammanS. Phenolic Compounds in Plants and Agri-Industrial by-Products: Antioxidant Activity, Occurrence, and Potential Uses. Anal Nutr Clin Method 2006: 99(1): 191-203.
19- Eidi A, Zarringhalam Moghadam J, Mortazavi P, Rezazadeh S, Olamafar S. Hepatoprotective Effects of Juglans Regia Extract Against Ccl4-Induced Oxidative Damage in Rats. Pharm Biol 2013; 51(5): 558-65.
20- ElBaset MA, Salem RS, Ayman F, Ayman N, Shaban N, Afifi SM, et al. Effect of Empagliflozin on Thioacetamide-Induced Liver Injury in Rats: Role of AMPK/SIRT-1/HIF-1α Pathway in Halting Liver Fibrosis. Antioxid 2022; 11(11): 2152.
21- Loizzo MR, Tundis R, Bonesi M, Menichini F, De Luca D, Colica C, et al. Evaluation of Citrus Aurantifolia Peel and Leaves Extracts for their Chemical Composition, Antioxidant and Anti-Cholinesterase Activities. J Sci Food Agr 2012; 92(15): 2960-7.
22- Hall JE. Guyton and Hall Textbook of Medical Physiology. 12th ed. philadelphia: Saunders; 2010: 999-1006.
23- Giannini EG, Testa R, Savarino V. Liver Enzyme Alteration: A Guide for Clinicians. CAMJ 2005; 172(3): 367-79.
24- Osawa T, Kato Y. Protective Role of Antioxidative Food Factors in Oxidative Stress Caused by Hyperglycemia. Ann N Y Acad Sci 2005; 1043: 440-51.
25- Soochan D, Keough V, Wanless I, Molinari M. Intra and Extra-Hepatic Cystadenoma of the Biliary Duct. Review of Literature and Radiological and Pathological Characteristics of a Very Rare Case. BMJ Case Rep 2012; bcr0120125497.
26- Shabbir MA, Nawaz MF, Tariq T, RafiqKhan M, Saeed H, Abdi G, et al. Astounding the Synergistic Interplay of Walnuts in Combating Inflammation and Oxidative Damage. J Funct Foods 2024; 119: 106292.
27- Abd-Elhakim YM, Hashem MM, El-Metwally AE, Anwar A, Abo-El-Sooud K, Moustafa GG, et al. Comparative Haemato-Immunotoxic Impacts of Long-Term Exposure to Tartrazine and Chlorophyll in Rats. Int Immunopharmacol 2018; 63: 145-54.
28- Zangeneh A, Zangeneh MM, Goodarzi, Najafi F, Hagh Nazari L. Protective Effects of Aqueous Extract of Internal Septum of Walnut Fruit on Diabetic Hepatopathy in Streptozotocin-Induced Diabetic Mice. SJKU Med Sci 2018; 23(1): 26-37.
29- Shipman KE. Interpreting an Isolated Raised Alkaline Phosphatase Level in an Asymptomatic Patient. BMJ 2013; 346: f976.
30- Alshehrei F M. Study the Effect of Tartrazine and Its Biodegradation Products on The Liver and Kidney of Female Albino Rats. J Microbiol Biotech Food Sci/Alshehrei 2023; 12(6) e9505.
31- Kamkar A, Shariatifar N, Jamshidi AH, Mohammadian M. Study of Antioxidant Function of the Water, Methanol and Ethanol Endemic Cuminum Cyminum L. and Cordariadraba L. in the in Vitro Systems. Intern Med Today 2010; 16(2): 37-44.
32- Shimoda H, Tanaka J, Kikuchi M, Fukuda T, Ito H, Hatano T, et al. Walnut Olyphenols Prevent Liver Damage Induced by Carbon Tetrachloride and D-Galactosamine: Hepatoprotective Hydrolyzable Tannins in the Kernel Pellicles of Walnut. J Agric Food Chem 2008; 56(12): 4444-9.
33- Maguire LS, O’Sullivan SM, Galvin K, O’Connor TP, O’Brien NM. Fatty Acid Profile, Squalene and Phytosterol Content of Walnuts, Almonds, Peanuts, Hazelnuts and the Macadamia Nut. Int J Food Sci Nutr 2004; 55(3): 171-8.
34- Shahin R, Nayebzadeh K, Alizadeh L, Mohammadi A. Antioxidant Effect of Tocopherol and TBHQ on Oil Oxidation Over the Shelf Life of Mayonnaise. Iran J Nutr Sci Food Technol 2014; 8(4): 227-36.
35- Ighodaro O, Akinloye O. First Line Defence Antioxidants-Superoxide Dismutase (SOD), Catalase (CAT) and Glutathione Peroxidase (GPX): Their Fundamental Role in the Entire Antioxidant Defence Grid. Alex J Med 2018; 54(4): 287-93.
36- Keillor JW, Castonguay R, Lherbet C. Gamma-Glutamyl Transpeptidase Substrate Specificity and Catalytic Mechanism. Methods Enzymol 2005; 401: 449-67.
37- Dwarka D, Thaver V, Naidu M, Baijnath H. New Insights into the Presence of Bilirubin in a Plant Species Strelitzia Nicolai (Strelitziaceae). Afr J Tradit Complement Altern Med 2017; 14(2): 253-62.
38- Soleimani S, Yousefzadi M, Arman M. Antioxidant Compounds with Antioxidant Properties in Seaweed and their Application in Various Industries. Plant Process Funct 2022; 0(1): 77-97
1- Rahimi S, Kiani M, Ezati P, Pourmohammadi B, Biabani J, Torabi H, et al. Prevalence of colors of used in Saffronal foods of Yazd using Thin Layer Choromotography (TLC) in 2015. Navidno 2016; 19(62): 1-7.
2- El Golli N, elbini I, Jrad A, Boudali I. Toxicity Induced after Subchronic Administration of the Synthetic Food Dye Tartrazine in Adult Rats, Role of Oxidative Stress. Recent Adv Biol Med 2016; 2: 20-8.
3- Rao Jasti P, Rao Vemila R. Risk assessment of synthetic food colours: a case study in Hyderabad, India. International Journal of Food Safety, Nutr Public Health 2008; 1(1): 68-87.
4- Leulescu M, Rotaru A, Palarie I, Moant A, Cioatera N, Popescu M, et al. Tartrazine: Physical, Thermal and Biophysical Properties of the Most Widely Employed Synthetic Yellow Food-Colouring Azo Dye. J Therm Anal Calorim 2018; 134: 209-31.
5- Jonnalagadda PR, Rao P, Bhat RV, Nadamuni Naidu A. Type, Extent and Use of Colours in Ready-To-Eat (RTE) Foods Prepared in the Non-Industrial Sector–A Case Study from Hyderabad, India. International Journal of Food Science & Technology 39(2): 125-31.
6- Molaei Tavani S, Nobari S, Ghasemi R, Mazloomi S. Survey the Authorized and Unauthorized Food Colorings Consumption in the Food Supply of Nazarabad Township in 1395. J Environ Health Eng 2017; 4(4): 299-306. [Persian]
7- El-Wahab HM, Moram GS. Toxic Effects of Some Synthetic Food Colorants And/or Flavor Additives on Male Rats. Toxicol Ind Health 2013; 29(2): 224-32.
8- Helal EGE, Zaahkouk SA, Mekkawy HA. Effect of Some Food Colorants (Synthetic and Natural products) of Young Albino Rats I Liver and KidneyFunctions. The Egyptian Journal of Hospital Medicine 2000; 1(1): 103-13.
9- Liu JP, Zhang M, Wang WY, Grimsgaard S. Chinese Herbal Medicines for Type 2 Diabetes Mellitus. Cochrane Database Syst Rev 2004; 2002(3): CD003642.
10- Amin KA, Abdel Hameid H, 2nd, Abd Elsttar AH. Effect of Food Azo Dyes Tartrazine and Carmoisine on Biochemical Parameters Related to Renal, Hepatic Function and Oxidative Stress Biomarkers in Young Male Rats. Food Chem Toxicol 2010; 48(10): 2994-9.
11- Zibaeenezhad MJ, Shamsnia SJ, Khorasani M. Walnut Consumption in Hyperlipidemic Patients. Angiology 2005; 56(5): 581-30.
12- Pandareesh MD, Chauhan V, Chauhan A. Walnut Supplementation in the Diet Reduces Oxidative Damage and Improves Antioxidant Status in Transgenic Mouse Model of Alzheimer's Disease. J Alzheimers Dis 2018; 64(4): 1295-305.
13- Kim MY, Choi SW. Can Walnut Serve as a Magic Bullet for the Management of Non-Alcoholic Fatty Liver Disease? Appl Sci 2021; 11(1): 218.
14- Birino de Oliveira Z, Vitória Silva da Costa D, Caroline da Silva dos Santos A, Quaresma da Silva Júnior A, Silva AL, et all. Synthetic Colors in Food: A Warning for Children’s Health. Int J Environ Res Public Health 2024; 21(6): 682.
15- Martinez ML, Mattea MA, Maestri DM. Varietal and Crop Year Effect on Lipid Composition of Walnut (Juglans Regia) Genotypes. JAOCS 2006; 83(9): 791-96.
16- SolarA, Colaric M, UsenikV, Stampar F. Seasonal Variations of Selected Flavonoids, Phenolic Acids and Quinones in Annual Shoots of Common Walnut (Juglans Regia L.). Plant Sci 2006; 170(3): 453-61.
17- Mateș L, Rusu ME, Popa DS. Phytochemicals and Biological Activities of Walnut Septum: A Systematic Review. Antioxid 2023; 12(3): 604.
18- BalasundramN, Sundram K, SammanS. Phenolic Compounds in Plants and Agri-Industrial by-Products: Antioxidant Activity, Occurrence, and Potential Uses. Anal Nutr Clin Method 2006: 99(1): 191-203.
19- Eidi A, Zarringhalam Moghadam J, Mortazavi P, Rezazadeh S, Olamafar S. Hepatoprotective Effects of Juglans Regia Extract Against Ccl4-Induced Oxidative Damage in Rats. Pharm Biol 2013; 51(5): 558-65.
20- ElBaset MA, Salem RS, Ayman F, Ayman N, Shaban N, Afifi SM, et al. Effect of Empagliflozin on Thioacetamide-Induced Liver Injury in Rats: Role of AMPK/SIRT-1/HIF-1α Pathway in Halting Liver Fibrosis. Antioxid 2022; 11(11): 2152.
21- Loizzo MR, Tundis R, Bonesi M, Menichini F, De Luca D, Colica C, et al. Evaluation of Citrus Aurantifolia Peel and Leaves Extracts for their Chemical Composition, Antioxidant and Anti-Cholinesterase Activities. J Sci Food Agr 2012; 92(15): 2960-7.
22- Hall JE. Guyton and Hall Textbook of Medical Physiology. 12th ed. philadelphia: Saunders; 2010: 999-1006.
23- Giannini EG, Testa R, Savarino V. Liver Enzyme Alteration: A Guide for Clinicians. CAMJ 2005; 172(3): 367-79.
24- Osawa T, Kato Y. Protective Role of Antioxidative Food Factors in Oxidative Stress Caused by Hyperglycemia. Ann N Y Acad Sci 2005; 1043: 440-51.
25- Soochan D, Keough V, Wanless I, Molinari M. Intra and Extra-Hepatic Cystadenoma of the Biliary Duct. Review of Literature and Radiological and Pathological Characteristics of a Very Rare Case. BMJ Case Rep 2012; bcr0120125497.
26- Shabbir MA, Nawaz MF, Tariq T, RafiqKhan M, Saeed H, Abdi G, et al. Astounding the Synergistic Interplay of Walnuts in Combating Inflammation and Oxidative Damage. J Funct Foods 2024; 119: 106292.
27- Abd-Elhakim YM, Hashem MM, El-Metwally AE, Anwar A, Abo-El-Sooud K, Moustafa GG, et al. Comparative Haemato-Immunotoxic Impacts of Long-Term Exposure to Tartrazine and Chlorophyll in Rats. Int Immunopharmacol 2018; 63: 145-54.
28- Zangeneh A, Zangeneh MM, Goodarzi, Najafi F, Hagh Nazari L. Protective Effects of Aqueous Extract of Internal Septum of Walnut Fruit on Diabetic Hepatopathy in Streptozotocin-Induced Diabetic Mice. SJKU Med Sci 2018; 23(1): 26-37.
29- Shipman KE. Interpreting an Isolated Raised Alkaline Phosphatase Level in an Asymptomatic Patient. BMJ 2013; 346: f976.
30- Alshehrei F M. Study the Effect of Tartrazine and Its Biodegradation Products on The Liver and Kidney of Female Albino Rats. J Microbiol Biotech Food Sci/Alshehrei 2023; 12(6) e9505.
31- Kamkar A, Shariatifar N, Jamshidi AH, Mohammadian M. Study of Antioxidant Function of the Water, Methanol and Ethanol Endemic Cuminum Cyminum L. and Cordariadraba L. in the in Vitro Systems. Intern Med Today 2010; 16(2): 37-44.
32- Shimoda H, Tanaka J, Kikuchi M, Fukuda T, Ito H, Hatano T, et al. Walnut Olyphenols Prevent Liver Damage Induced by Carbon Tetrachloride and D-Galactosamine: Hepatoprotective Hydrolyzable Tannins in the Kernel Pellicles of Walnut. J Agric Food Chem 2008; 56(12): 4444-9.
33- Maguire LS, O’Sullivan SM, Galvin K, O’Connor TP, O’Brien NM. Fatty Acid Profile, Squalene and Phytosterol Content of Walnuts, Almonds, Peanuts, Hazelnuts and the Macadamia Nut. Int J Food Sci Nutr 2004; 55(3): 171-8.
34- Shahin R, Nayebzadeh K, Alizadeh L, Mohammadi A. Antioxidant Effect of Tocopherol and TBHQ on Oil Oxidation Over the Shelf Life of Mayonnaise. Iran J Nutr Sci Food Technol 2014; 8(4): 227-36.
35- Ighodaro O, Akinloye O. First Line Defence Antioxidants-Superoxide Dismutase (SOD), Catalase (CAT) and Glutathione Peroxidase (GPX): Their Fundamental Role in the Entire Antioxidant Defence Grid. Alex J Med 2018; 54(4): 287-93.
36- Keillor JW, Castonguay R, Lherbet C. Gamma-Glutamyl Transpeptidase Substrate Specificity and Catalytic Mechanism. Methods Enzymol 2005; 401: 449-67.
37- Dwarka D, Thaver V, Naidu M, Baijnath H. New Insights into the Presence of Bilirubin in a Plant Species Strelitzia Nicolai (Strelitziaceae). Afr J Tradit Complement Altern Med 2017; 14(2): 253-62.
38- Soleimani S, Yousefzadi M, Arman M. Antioxidant Compounds with Antioxidant Properties in Seaweed and their Application in Various Industries. Plant Process Funct 2022; 0(1): 77-97
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1404/1/20 | پذیرش: 1404/4/16 | انتشار: 1404/8/15
دریافت: 1404/1/20 | پذیرش: 1404/4/16 | انتشار: 1404/8/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







