دوره 33، شماره 5 - ( مرداد 1404 )
جلد 33 شماره 5 صفحات 9060-9047 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Halali H, Mohammadi M. Investigating the Effects of Secondary Metabolites of Streptomyces Calvus Bacteria on Human Liver Cancer Cells (HCC). JSSU 2025; 33 (5) :9047-9060
URL: http://jssu.ssu.ac.ir/article-1-6406-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6406-fa.html
هلالی هاله، محمدی مهناز. بررسی اثرات متابولیتهای ثانویه باکتری استرپتومایسس کالووس بر سلولهای سرطانی کبد انسان(HCC). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (5) :9047-9060
متن کامل [PDF 1025 kb]
(206 دریافت)
| چکیده (HTML) (543 مشاهده)
References:
1- Jamali R, Jamali A. An Overview of Fatty Liver Disease. Feyz Medical Sciences Journal 2010; 14(2): 169-81. [Persian]
2- Taj Bakhsh S, Salehi S. Moazzami N. Screening of Streptomyces Products Using Cell Culture Technique in Order to Identify Antitumor Substances. Khilaj Fars Bio-Medical Research Institute 2008; 11(2): 115-8. [Persian]
3- Salam N, Jiao JY, Zhang XZ, Li WJ. Update on The Classification of Higher Ranks in the Phylum Actinobacteria. Int J Syst Evol Microbiol 2020; 70(2): 1331-355.
4- Namazi N, Larijani B, Azadbakht L. Alphalic Acid Supplement in Obesity Treatment: A Systematic Review and Meta-Analysis of Clinical Trials. Clin Nutr 2018; 37(2): 419-30.
5- Chen JJ, Xu L, Zhou Y, Han B. Natural Products from Actinomycetes Associated with Marine Organisms. Mar Drugs 2021; 19(11): 629.
6- Zanon E, Porrect A, Simioni P. Haemophilia and Cancer: A Literature Review. J Clin Med 2024; 13(6): 1770.
7- Kumar S, Solanki DS, Parihar K, Tak A, Gehlot P, Pathak R, Singh SK. Actinomycetes Isolates of Arid Zone of Indian thar Desert and Efficacy of their Bioactive Compounds Against Human Pathogenic Bacteria. Biol Future 2021; 72(4): 431-40.
8- Law J, Law L, Letchumanan V, Tan LT, Wong SH, Chan KG, et al. Anticancer Drug Discovery from Microbial Sources: The unique mangrove Streptomyces Molecules 2020; 25(22): 5365.
9- Marinelli L, Tenore GC, Novellino E. Probiotic Species in the Modulation of the Anticancer Immune Response. Semin Cancer Biol 2017; 46: 182-90.
10- Handbook and safety principles in the laboratory. Authored by the Artemia World Reference Center - Ghent University, Belgium.
11- Monfardi A. Complete Reference Book of Pagana Diagnostic and Laboratory Tests.
12- Saadati H. Theta book. A comprehensive guide to interpreting laboratory tests.
13- Stephen J Salipante, Keith R Jerome. Digital PCR—An Emerging Technology with Broad Applications in Microbiology. Clin Chem 2020; 66(1): 117-23.
14- Esmaeili M, Zand M. The Efficacy and Complications of Treatment Modalities in Patients with Liver Cancer: A Review Study Digestion. Govaresh 2020; 24: 206-16.
15- Donadon M, Solbiati L, et al. Hepatocellular Carcinoma. The Role of Interventional Oncology 2016; 34-50.
16- El-Ahmady El-Naggar N, DerazS V, Soliman H M, El-Deeb NM, El-Shweihy NM. Purification, Characterization and Amino Acid Content of Cholesterol Oxidase Produced by Streptomyces Aegyptia NEAE 102. BMC Microbiology 2017: 17: 76.
17- Potapenko K, Lisiutin G, Vasylieva N, Strashnova I, Franke R, PetrivN, et al. Antimicrobial and Anticancer Activity of Streptomyces Ambofaciens (Myt 8) and S. Globisporus ONU 1019 (Myt 11) Secondary Metabolites Isolated from the Odesa Bay, the Black Sea: An in Vitro Study. Biomedicine & Pharmacotherapy 2025; 186 :117981
18- Valipour B. Antitumor Activity of Cord Blood Stem Cell Derived CD 16 Positive NK Cells As an Immune Cell Therapy for Acute Lymphoblastic Leukemia (ALL). Faculty of Medicine. Tabriz University of Medical Science 2019.
19- NikBakht M, Omidi M, Amoozegar MA, Amini K. Investigating the Cytotoxicity of Treptomyces Koyangensis and Streptomyces Tunisiensis Secondary Metabolites Isolated from The Saline Soils of Garmsar City on Human Breast Cancer Cell Line (MCF-7, IBRC C10082). J Med Sci Islamic Azad University 2021; 31(4): 367-76. [Persian]
20- Koroshnia A, Zinli S, Irani S, Sadeghi A. Investigating the Effect of Cytotoxicity of Antagonist Actinomycete Strains on Colorectal Cancer Cell Line. NCMBJ 2021; 12(45): 51-61.
21- Lee CH, Lim H, Moon S, Shin C, Kim S, Kim BJ, et al. Novel Anticancer Agent, Isolated from Streptomyces Sp. Causes G1 Cell Cycle Arrest and Induces Apoptosis of Hela Cells. Cancer Sci 2007; 98(6): 795-812.
22- Khandros E, Huang P, Peslak SA, Sharma M, Abdulmalik O, Giardine BM, et al. Understanding Heterogeneity of Fetal Hemoglobin Induction through Comparative Analysis of F and an Erythroblasts. the Journal of the American Society of Hematology Blood 2020; 135(22): 1957-968.
23- Hayakawa Y, Nakagawa M, Kawai H, Tanabe K, Nakayama H, Shimazu A, et al. Spicamycin, A New Inducer of Differentiation of HL-60 Human Promyelocytic Leukemia Cells. J Antibiotics 1983; 36(7): 937-4.
24- Dave A, Parande F, Park EJ, Pezzuto JM. Phytochemicals and Cancer Chemoprevention. J Cancer Metastasis Treat 2020; 6: 46.
25- Sarkar FH, Li Y. Targeting Multiple Signal Pathways by Chemopreventive Agents for Cancer Prevention and Therapy. Acta pharmacologica Sinica 2007; 28(9): 1305-15.
متن کامل: (325 مشاهده)
مقدمه
کبد یکی از اعضاء مهم بدن است که سمزدایی از داروها، دفع محصولات زاید ناشی از تخریب و نوسازی گلبولهای قرمز خون بهصورت صفرا، تولید عوامل انعقادی خون، ذخیره قند بهصورت گلیکوژن و نیز تنظیم سوختوساز قند و چربی از مهمترین نقشهای آن در بدن میباشد. نقش کبد در جذب چربی و دفاع در مقابل میکروبها و سموم جذب شده از راه مواد غذایی را نیز نباید نادیده گرفت. از این عضو بهعنوان یکی از حیاتیترین اندامهای داخلی بدن یاد میشود (1). براساس نقش این اندام در تنظیم متابولیتها و سمزدایی، نارسایی در عملکردهای کبدی ممکن است موجب طیف وسیعی از اختلالات با سطوح متفاوتی از شدت و حتی مرگ و میر شود. با وجود پیشرفتهای فراوان در زمینه پیشگیری، غربالگری، تشخیص و درمان، میزان شیوع و مرگ و میر ناشی از آن همچنان در حال افزایش است. شیوع سرطان در کشورهای درحال توسعه بهویژه کشورهای آسیایی بیش از 10-5 برابر سایر کشورها است. میزان مرگ و میر ناشی از سرطان کبد در ایران طی سالهای 2015- 1990 بیش از چهار برابر افزایش داشته است (2). هپاتوسلولار کارسینوما (HCC) Hepatocellular Carcinoma شایع ترین نوع سرطان کبد با میزان شیوع 80-70 درصد است. این بدخیمی، سومین عامل مرگ و میر مرتبط با سرطان در جهان بوده است (3). برآوردها حاکی از آن است که برخی مناطق آسیایی از نظر شیوع و موارد جدید بیماری و مرگ مرتبط با آن، رتبه اول را در میان قارههای جهان به خود اختصاص میدهند. طبق تحقیقات آژانس بینالمللی سرطان و سازمان بهداشت جهانی، این بدخیمی علت بیش از 782000 مرگ در سال گزارش شده است و با نرخ بالای مرگ و میر به یکی از مشکلات بزرگ در حوزه سلامت جهان تبدیل شده است. در بسیاری از کشورهای جهان، میزان ابتلا به HCC در مردان 4-2 برابر بیشتر از زنان است (4). از جمله مهمترین عوامل افزایشدهنده ابتلا به این بدخیمی، اختلالات مزمن کبدی، ویروسهای هپاتوتروف نظیر ویروسهای هپاتیت B وC، بیماری کبد چرب غیر الکلی Non-alcoholic fatty liver disease (NAFLD)، سمومی مانند آفلاتوکسین و استئاتوهپاتیت غیر الکلیNon-alcoholic steatohepatitis (NASH) است (5). میکروارگانیسمها نقش بهسزایی را در تولید مواد مختلف میکروبی و بیولوژیکی در زندگی روزمره انسان و طبیعت دارا میباشند. مهمترین نقش آنها در صنایع داروسازی دامپزشکی، غذایی و دارویی میباشد (6). به عنوان مثال در تولید ضد قارچها، علفکشها، متابولیتهای فعال داروسازی و آنزیمهای مهم در صنایع غذایی نقش بهسزایی دارند. متابولیتهای ثانویه از لحاظ میکروبی برای سلامتی و تغذیه ما بسیار مهم میباشند. مهمترین متابولیتهای ثانویه آنتیبیوتیکها هستند، که دارای بیشترین اهمیت برای زندگی بشر میباشند (7). متابولیتهای میکروبی از جمله مهمترین ترکیبات شیمیدرمانی سرطان محسوب میشوند. متابولیتهایی همچون اکتینومایسینD، آنتراسایکلینها (شامل دونوروبیسین و دوکسوروبیسین)، میتوسانها (میتومایسینC) و آنتراسنونها (میترامایسین) که از باکتریهای جنس استرپتومایسس بهدست میآیند، در درمان انواع مختلفی از سرطانها مانند تومور ویلمز در کودکان، لوسمیها، سرطانهای ریه و سینه بهکار میروند (8). این ترکیبات که با نام آنتیبیوتیکهای ضد سرطان شناخته میشوند، فعالیت ضد سرطانی خود را از طریق برهمکنش با DNA انجام میدهند بهطوری که باعث مهار سنتز RNA و یا DNA میگردند (9). علاوه براین، اثرات ضدسرطانی سایر متابولیتهای بهدست آمده از باکتریهای جنس استرپتومایسس بهطور گستردهای در ردههای مختلف سلولهای سرطانی مورد بررسی قرار گرفته است و باعث مهار رشد، کاهش زیستایی میگردد. این امر اثبات شده است که برخی ریزسازوارهها توانایی تجمع اختصاصی در ریزمحیط تومور و حتی تکثیر در آن را دارند که این موضوع رویکرد شگرفی را برای درمان هدفمند سرطان بهوجود آورده است (4). باکتری درمانی سرطان دارای ویژگیهای منحصربهفرد نسبت به سایر روشهای درمانی است. باکتریهای مهندسی ژنتیکی شده میتوانند بهطور اختصاصی تومورها را هدف گرفته و مرگ سلولی قابل کنترلی را در سلولهای سرطانی القاء کنند. امروزه با پیشرفت علم زیستشناسی سلولی مولکولی و شناخت بهتر حیات سلولی این امکان فراهم شده است که برای بسیاری از مشکلات و محدودیتهای باکتری درمانی، نظیر سمّیت، پایداری و نیز ارتقاء کارایی هرچه بیشتر آن راهحل مناسبی یافت که در نهایت، منجر به تبدیل باکتری درمانی به یکی از روشهای قابل اعتماد برای درمان هدفمند سرطان گردد (9). هدف از این مطالعه بررسی اثرات ضد سرطانی متابولیتهای ثانویه، استرپتومایسس کالووس ایزوله ABRINW 673 بر رده سلول سرطانی Hep-G2 ( سرطان کبد انسان) است.
روش بررسی
باکتری استرپتومایسس کالووس ایزوله ABRINW673 از مرکز ملی ذخایر ژنتیکی و زیستی ایران تهیه شد و در محیط کشت Nutrient agar بهصورت خطی و به مدت 7 روز در دمای 29 درجه سانتیگراد کشت داده شد. پس از گذشت 7 روز، به منظور جداسازی متابولیتهای ثانویه، 2 میلیلیتر از باکتریهای موردنظر به 20 میلیلیتر محیط کشت مولر هینتون براث اضافه شدند و در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm125 قرار گرفتند. 36 ساعت بعد 1 میلیلیتر از سوسپانسیون حامل به ظرف جدید حاوی 150 میلیلیتر محیط مولر هینتون براث انتقال یافته و به مدت10-7 روز در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm70قرار گرفت. محیط کشت عمومی مولر هیتون براث جهت انجام واکنش تخمیری و تولید متابولیتهای ثانویه توسط باکتریها مورد استفاده قرار گرفت (10). رده سلولی Hep-G2 از مرکز ملی ذخایر ژنتیکی و زیستی ایران خریداری شد و به صورت یخ زده در نیتروژن مایع (191- درجه سانتیگراد) به آزمایشگاه انتقال یافت. برای کشت این سلولها ابتدا یخ زدایی صورت گرفت. بدین منظور تمامی وسایلی که بهصورت مستقیم در تماس با سلول میباشند باید استریل شوند (10). ابتدا فلاسک سلولی توسط میکروسکوپ نوری معکوس مورد بررسی قرار گرفت. تراکم سلولی 80-70 درصد بهترین بازه برای پاساژ دادن سلولی است. سپس فلاسک سلولی بهصورت استریل به زیر هودلامینار انتقال یافت. برای انجام پاساژ سلولی ابتدا محتویات درون فلاسک سلولی با استفاده از سرسمپلرهای استریل تخلیه شد و کف فلاسک با استفاده از محلول بافر فسفات سالین استریل شست و شو داده شد. محلول بافر فسفات سالین تخلیه گردید. تریپسین-EDETA استریل با دمای 37 درجه سانتیگراد به درون فلاسک تزریق شد و فلاسک سلولی به مدت 3-2 دقیقه درون انکوباتور 37 درجه سانتیگراد انتقال یافت. فلاسک سلولی به زیر میکروسکوپ نوری معکوس انتقال یافت و سلولها از نظر چسبندگی و معلق شدن بررسی گردید. برای خنثیکردن اثر تریپسینEDETA- محیط کشت حاوی 10 % سرم جنین گاوی به درون فلاسک افزوده شد. سپس، تمامی مایع درون فلاسک سلولی به فالکون استریل انتقال یافت و با دور rpm1500 به مدت 5 دقیقه سانتریفیوژ شد. مایع رویی فالکون تخلیه شد و سلول ها درون 1 میلیلیتر محیط کشت کامل حل شد. شمارش سلولی صورت گرفت و به میزان 3×106 سلول به درون هر فلاسک 75 T-انتقال یافت (10).
به منظور جداسازی متابولیتهای آنتیباکتریال، مقداری از باکتریهای خالص تهیه شده به محیط کشت مولر هینتون براث اضافه شده و در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm 125 به مدت 36 ساعت قرار گرفت. در مرحله بعد 1 میلیلیتر از سوسپانسیون حاصل به ظرف جدید حاوی محیط مولر هینتون براث انتقال یافته و همانند مرحله اول در انکوباتور شیکردار قرار گرفت. پس از 36 ساعت، تمامی محیط کشت در دور rpm 4000 به مدت 20 دقیقه سانتریفیوژ گردید. رسوب (بیومس) حاصل دور ریخته شده و مایع رویی از کاغذ صافی شماره 1 عبور داده شد. حلال آلی اتیل استات به نسبت 1:1 به مایع حاصل اضافه شد و به مدت 1 ساعت در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm 175 قرار گرفته و به شدت هم زده شد. مخلوط حاصل به دکانتور انتقال یافته و فاز مایع از فاز حلال جدا گردید. فاز حلال که حاوی ترکیبات آنتیباکتریال است در دمای 34 درجه سانتیگراد و در فشار پایین تغلیظ شد و فراکشنهای موجود در متابولیتها با استفاده از کروماتوگرافی HPLC مورد بررسی قرار گرفت (11). حلال اتیل استات در دمای اتاق تبخیر و پودر خشک بهدست آمده در دمای 4 درجه سانتیگراد نگهداری شد. به منظور تهیه غلظتهای مختلف، پودر حاصل در حلال دی متیل سولفوکساید (DMSO) حل شده و غلظتهای مختلف از آن تهیه گردید (10000-10 نانوگرم بر میلیلیتر) (11). جهت تیمار سلولها با متابولیتهای ثانویه حاصل از استرپتومایسس کالووس و بررسی اثرات آن از پلیتهای 96 چاهکی استریل استفاده گردید. این پلیتها با داشتن6 چاهک امکان بررسی اثرات یک ترکیب بر رشد سلولی را در زمانها و غلظتهای مختلف فراهم میکند. جهت تیمار سلولهای پس از 3 بار پاساژ متوالی سلولها و در مرحله رشد لگاریتمی، سلولها به میزان 104 سلول در پلیتهای 96 چاهکی تقسیم شدند و با محیط کشت RPMI-1640 حاوی 10% سرم جنین گاوی و 1% آنتیبیوتیکهای پنیسیلین و استرپتومایسین به مدت 24 ساعت کشت داده شدند. پس از 24 ساعت محیط رویی چاهکها تخلیه گردید و محیط کشت حاوی متابولیتهای ثانویه در غلظتهای 100 /500 /1000/ 2000 و 5000 به سلولها اضافه گردید و به مدت ،24 48، 72 به منظور بررسی اثر زمان بر سایتوتوکسیسیتی متابولیتهای ثانویه باکتریایی در شرایط یکسان انکوبه شدند. گروه کنترل فاقد عصاره باکتریایی با شرایط یکسان کشت داده شد و از بالاترین دوز دی متیل سولفوکساید فاقد عصاره باکتریایی بهعنوان کنترل منفی استفاده شد (11). آزمون MTT تست MTT جهت دستیابی به درصد زندهمانی ( 3-(4،5-dimethylthiazol-2-yl)-2،5-diphenyltetrazolium bromide یک سند رنگسنجی برای اندازهگیری میزان فعالیت آنزیم سوکسینات دهیدروژناز میتوکندریایی است که بهعنوان معیاری برای سنجش زنده بودن سلولها استفاده میشود. MTT نمک زرد رنگ ترازولیوم محلول در آب است که توسط سوکینات دهیدروژناز میتوکندریهای سلولهای زنده و فعال احیاء و به ترکیب رنگی فورمازان نامحلول تبدیل میشود که این رنگ با حلال آلی حل گشته و شدت رنگ در طول موج 570 نانومتر متناسب با میزان سلولهای زنده است. پس از تیمار سلولها با دوزهای 500 /1000/ 2000 / 5000 از متابولیتهای ثانویه در بازههای زمانی ،24، 48، 72 ساعت، محیط رویی سلولها تخلیه گردید. سپس 20 میکرولیتر معرف MTT با غلظت 5 میلیگرم در 1 میلیلیتر بافر فسفات سالین به هر چاهک اضافه گردید و سلولها 4 ساعت دیگر در 37 درجه سانتیگراد انکوبه شدند. کریستالهای MTT-Formazan تشکیل شده در 100 میکرولیتر دیمتیل سولفوکساید حل شد و به مدت 15 دقیقه شیک شدند. سپس جذب در 630-570 نانومتر با استفاده از (Biotek) ELISA Microplate Reader اندازهگیری شد. برای حذف خطا در آزمون برای هر غلظت در هر بازه زمانی به چاهک در نظر گرفته شد و آزمون MTT بصورت Triplicate انجام گرفت. غلظتی از متابولیتهای ثانویه مورد آزمایش که درصد حیات سلول را به نصف تقلیل داد به عنوان IC50 در نظر گرفته شد، این مقدار از روی نمودار با استفاده از نرمافزار Excel مایکروسافت تعیین گردید (11).
برای شمارش سلولی و بهدست آوردن زیستایی سلولها از رنگ تریپان بلو0/4 (w/v) استفاده میشود. محلول مورد استفاده برای تهیه تریپان بلو باید محلولی باشد که به سلولها شوک غلظت یا pH وارد نکند و لذا از بافر فسفات با pH فیزیولوژیک (7/47) برای تهیه رنگ تریپان بلو استفاده شد. به این ترتیب برای تهیه ml 20 تریپان بلو میزان 0/08 گرم از پودر تریپان بلو را در 20 میلیلیتر بافر فسفات اتوکلاو شده حل کرده و پس از حل شدن چندین بار از صافی عبور داده شد. تریپان بلو به هر دو سلول زنده و مرده وارد می شود ولی تنها سلولهای زنده بهدلیل داشتن فعالیت های حیاتی قادر به دفع رنگ تریپان بلو میباشند. به عبارت دیگر در این آزمون سلولهای زنده به رنگ سفید و سلولهای مرده به رنگ آبی در زیر میکروسکوپ دیده میشوند (11). برای بررسی اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر رشد وزیستایی سلول Hep-G2 از آزمون دفع تریپان بلو استفاده شد (11). تعیین آپوپتوز با استفاده از الکتروفورز ژل آگارز انجام شد (12). سپس آزمون قطعه قطعه شدن DNAانجام گرفت. یکی از ویژگیهای آپوپتوز قطعه قطعه شدن DNA ژنومی به قطعات الیگونوکلئوزومی با اختلاف اندازه180-200 جفت باز میباشد که این پدیده به آسانی با استفاده از ژل الکتروفورز معمولی قابل تشخیص است. در برخی از رده های سلولی در هنگام آپوپتوز این قطعات الیگونوکلئوزومی دیده نشده و DNA به حالت لکه (Smear) بر روی ژل الکتروفورز مشاهده میگردد (12). ژن claR یکی از ژنهای دسته ژنی بیوسنتزی آنتیبیوتیکی استرپتومایسس است. این ژن تولید متابولیت ثانویه را در استرپتومایسس بر عهده دارد. استخراج و تاثیر آن بر سلولهای Hep-G2 و بیان P53،Bcl2،Bax بررسی شد. کیت استخراج RNA باکتری از شرکتThermo Fisher Scientific : این کیت یک روش کارآمد و قابل اعتماد برای جداسازی RNA با خلوص بالا و یکنواخت از باکتری های گرم مثبت و گرم منفی است. این کیت از تکنولوژی ذرات مغناطیس استفاده میکند و محلول لایساتور خود را دارد که به لحاظ فعال سازی آنزیمی، پروتئینی و نوکلئیکی بهینه شده است. این کیت قابل خودکار سازی بوده و مناسب برای استفاده در آزمایشهای PCR، RT-PCR، microarray و ... است.
پرایمرها: با درنظر گرفتن خصوصیات ژن claR و ویژگیهای حامل، دو دست پرایمر اختصاصی با جایگاههای برش جهت دو آنزیم محدودالاثر BamHI و XbaI در دو انتهای قطعه ژن مورد نظر و یک جفت پرایمر اختصاصی برای تایید آن ها با نرم افزار OLIGO(version5، W.Rychlik) طراحی شد (جدول 1).PCR -RT با استفاده از آنزیم ترانس کریپتاز معکوس و پرایمرهای اختصاصی و نمونه RNA استخراج شده بر اساس برنامه زیر صورت گرفت:
دناتوره اولیه در دمای 94 درجه سانتیگراد به مدت 10 دقیقه و سپس 25 دوره به ترتیب با دمای دناتوره 94 درجه سانتی گراد به مدت 45 ثانیه و دمای چسبیدن 66 درجه سانتیگراد برای پرایمرهای داخلی claR1)) و دمای 62 درجه سانتیگراد برای پرایمرهای اختصاصی(claR2،claR3) به مدت 30 ثانیه و دمای تکثیر 72 درجه سانتیگراد به مدت 1 دقیقه انجام شد (جدول 2).
مطابق پروتکل، پس از پایان انجام کار، داده های بدست آمده از لحاظ منحنی ذوب بررسی و نمودارهای بدست آمده از لحاظ عدم بهدست آورده شد و نمودارهای حاصله رسم شد (13).
تجزیه و تحلیل آماری
تجزیه و تحلیل های آماری با استفاده از نرمافزارSPSS version 14 و آزمون Student T-test انجام شده است.
جدول 1: پرایمر های طراحی شده برای ژن claR

جدول 2: مواد لازم برای ساخت cDNA
نتایج
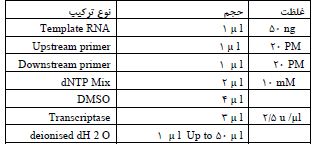
بررسیهای اولیه نشان داد که متابولیتهای حاصل از باکتری استرپتومایسس کالووس ایزوله ABRINW673 دارای خواص آنتیباکتریال قوی میباشد. با توجه به اینکه برخی از متابولیتهای بهدست آمده از باکتریهای جنس استرپتومایسس با خاصیت آنتی باکتریالی دارای خواص ضدسرطانی نیز میباشند، به منظور شناسایی ترکیبات ضدسرطان جدید اثرات ضدسرطانی متابولیتهای محلول در اتیل استات باکتری استرپتومایسس ایزوله 673 به صورت in vitro مورد بررسی و مطالعه قرار گرفت. اثرات مهار رشدی این متابولیتها در سلولHep-G2 با استفاده از آزمون دفع رنگ تریپان بلو و شمارش سلولی مورد بررسی قرار گرفت. نتایج حاصل از تیمار سلول های Hep-G2 با متابولیتهای محلول در اتیل استات باکتری استرپتومایسس ایزوله 673 نشان داد که این متابولیتها باعث مهار رشد سلول ها به صورت وابسته به غلظت و زمان می شود به طوری که در نمودار1 مشاهده می شود 48 ساعت پس از تیمار سلول ها با غلظت های ،10 ،100 ،200 ،500 700 و 1000 نانوگرم بر میلی لیتر متابولیتها، میزان رشد سلول ها نسبت به گروه کنترل به ترتیب 21/8 ،28/4 ،37/5 ،45/5 ،54/8 و 60/5درصد کاهش یافت. این حالت به صورت وابسته به زمان نیز قابل مشاهده بود. نتایج به صورت میانگین سه تکرار مستقل ± انحراف استاندارد (SD) نشان داده شده است.
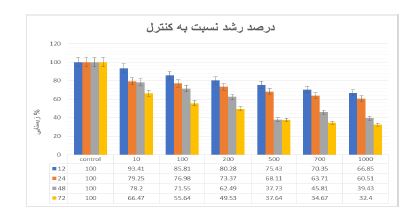
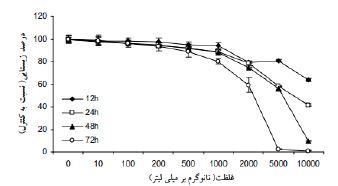
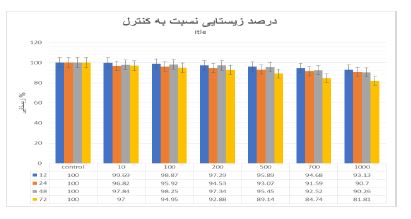
در نمودار2 پس از تیمار سلولهای Hep-G2 با غلظت 200 نانوگرم بر میلی لیتر متابولیتها برای مدت زمان 12 ،24، 48 و 72 ساعت، میزان مهار رشد به ترتیب برابر،19/2 ،26/6 37/5 و 50/4 درصد بوده است. علاوه براین، میزان) IC50 غلظتی از دارو که باعث مهار رشد 50 درصدی میگردد) 48 ساعت پس از تیمار با متابولیتهای محلول در اتیل استات برابر 570 نانوگرم بر میلیلیتر میباشد. نتایج حاصل از تیمار سلول های Hep-G2 با متابولیتهای ثانویه استرپتومایسس کالووس نشان داد که این متابولیتها باعث کاهش وابسته به غلظت و زمان در زیستایی سلولهای تیمار شده میگردد. همان طور که در نمودار 3 و4 مشاهده میشود متابولیتهای ثانویه استرپتومایسس در زمانهای 12 و 24 ساعت و در غلظتهای بالاتر از 1000 نانوگرم بر میلیلیتر باعث کاهش معنیدار در زیستایی سلولهای Hep-G2 میگردد. این در حالی است که در زمانهای بالاتر (48 و 72 ساعت) کاهش معنیدار در زیستایی سلولهای تیمار شده از غلظت 200 نانوگرم بر میلیلیتر آغاز میگردد. بهعنوان مثال، پس از تیمار سلولهای Hep-G2 با غلظت 2000 نانوگرم بر میلیلیتر متابولیت و پس از گذشت مدت زمان ،12 ،24 48 و 72 ساعت، میزان زیستایی سلولها به ترتیب 20/5، 21/7، 25/5 و 40/7 درصد کاهش یافت. همانطور که در نتایج آمده است، در این تحقیق اثرات غلظتهای مختلف متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر زیستایی سلولهای سرطانی با گروه کنترل مقایسه شده است، و بر اساس غلظت و زمان بیشترین اثردهی را بر روی سلولهای سرطانی داشته است. همانطور که در جداول و نمودارها مشخص است، هر چه زمان بیشتر و غلظت بیشتر شود ، اثر کشندگی بیشتر مشاهده شد و تجزیه و تحلیل آماری نشان داد، سمیت سلولی از نظر آماری معنیدار میباشد. بررسی تغییرات ریختشناسی سلولهای Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات و سلولهای کنترل نشان دهنده تغییرات قابل ملاحظه در ظاهر سلولهای تیمار شده با این متابولیتها میباشد. تغییرات ظاهری 12 ساعت پس از تیمار با متابولیتها و از غلظت 200 نانوگرم بر میلیلیتر آغاز گردید و در غلظتهای کم (10 ،100و 200 نانوگرم بر میلیلیتر) بهصورت وابسته به زمان افزایش یافت. همانطور که در شکل 1 نشان داده شده است، تغییرات ریختشناسی سلولها با استفاده از میکروسکوپ نوری (بزرگنمایی 40×) مورد بررسی قرار گرفت. فلشهای کوچک افزایش اندازه و دوکی شدن سلولها و فلشهای بزرگ تجمعات سلولی را نشان میدهند. اندازه برخی از سلولها نسبت به سلولهای کنترل افزایش یافته و ظاهری دوکی شکل پیدا کردند و تشکیل پای کاذب دادند. همچنین سلولهای تیمار شده با متابولیتها بههم چسبیده و تجمعات سلولی تشکیل دادند. بهمنظور اثبات القاء مرگ سلولی آپوپتوزی توسط متابولیتهای محلول در اتیل استات ایزوله 673 از آزمون قطعه قطعه شدن DNA استفاده شد. با غلظت (3000 نانو گرم) ml/µg3 و به مدت 48 ساعت تیمار گردید و اثرات آن بر قطعه قطعه شدن DNA با استفاده از الکتروفورز ژل آگارز مورد بررسی قرار گرفت همانطور که در شکل 2 نشان داده شده است متابولیتهای محلول در اتیل استات باعث تغییر در الگوی DNA ژنومی سلولهای Hep-G2 تیمار شده در مقایسه با سلولهای کنترل گردید. بهطوری که مشاهده میشود DNA ژنومی سلولهایHep-G2 تیمار شده با متابولیت محلول در اتر بهصورت لکه (Smear ) بر روی ژل الکتروفورز دیده میشود در حالیکه این حالت در سلولهای کنترل مشاهده نشد. بیان ژنهایی که توسط Real time PCR بررسی شده است، نشان داد، میزان بیان ژنP53 در اثر تیمار با متابولیتهای استرپتومایسس کالووس از 1 به 3 افزایش پیدا کرده ولی در BCL2 از 1 به نزدیک صفر کاهش یافته است. همچنین، میزان بیان ژن Bax پس از تیمار با متابولیت ثانویه باکتری از 1 به 2/5افزایش یافته است.

نمودار1: اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر رشد سلول های Hep-G2 با غلظت های متفاوت متابولیتهای محلول در اتیل استات
نمودار 2: درصد رشد سلول های Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات ایزوله 673
نمودار3: اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر زیستایی سلول های Hep-G2 با غلظتهای متفاوت متابولیتهای محلول در اتیل استات
نمودار 4: درصد زیستایی سلول های Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات ایزوله

شکل1: سلول ها با غلظت های 10- 1000 نانوگرم بر میلی لیتر متابولیتها به مدت 48 ساعت تیمار (بزرگنمایی 40×)

شکل2: اثر متابولیتهای استرپتومایسس کالووس محلول در اتیل استات بر Hep-G2
بحث
سرطان کبد بر اساس منشأ به دو گروه اولیه (منشاء کبدی) و ثانویه (متاستاز از نواحی دیگر بدن) تقسیم میشوند. هپاتوسلولارکارسینوما شایعترین سرطان کبدی است که در آن درگیری هپاتوسیت ها رخ داده است. هپاتوسلولارکارسینوما پنجمین سرطان رایج دنیا و شایعترین علت مرگ ناشی از سرطان معرفی شده است (14). هپاتوسلولارکارسینوما سرطانی بدخیم و مهاجم است و درصورت عدم اقدامات درمانی مناسب بیمار طی 3-6 ماه فوت میکند (6). درمان در سرطان کبد در دو گروه جراحی و غیرجراحی و پیامدهای ناشی از آن در دو بخش جسمی و روحی-روانی طبقهبندی میشوند (15). ترکیب شیوه های درمانی باعث افزایش اثربخشی آنها خواهد شد. پیامدهای جسمی و روحی-روانی متأثر از یکدیگر بوده و میتوانند اثرات یکدیگر را تقویت نمایند. اهمیت پیامدها تاجایی است که از آنها جهت تعیین میزان بقاء و ارزیابی کیفیت زندگی بیماران مبتلا به سرطان کبد استفاده میشود، از اینرو شناسایی و تشخیص زودهنگام این پیامدها لازم و ضروری است. جهت محقق شدن این امر شناسایی دقیق شیوههای درمانی، میزان اثربخشی و پیامدهای مربوط به آنها و بهرهگیری از گایدلاینهای استاندارد مخصوص بیماران مبتلا به سرطان کبد لازم است (16). با وجود پیشرفتهای فراوان در زمینه پیشگیری، غربالگری، تشخیص و درمان، میزان شیوع و مرگ و میر ناشی از آن همچنان در حال افزایش است. در سالهای اخیر تلاشهای بسیاری برای کشف ترکیبات شیمیدرمانی سرطان بهویژه از منابع طبیعی صورت گرفته است (14). در این راستا، امروزه اثرات ضد سرطانی متابولیتهای ثانویه حاصل از باکتریهای جنس استرپتومایسس گزارش شده است. در مطالعه حاضر اثرات متابولیتهای ثانویه حاصل از استرپتومایسس کالووس ایزوله ABRINW673 روی رده سلول سرطانی کبد Hep-G2 مورد بررسی قرار میگیرد. نتایج حاصل از مطالعه حاضر نشان داد که متابولیتهای ثانویه استرپتومایسس کالووس محلول در اتیل استات باعث مهار رشد رده سلول سرطانیHep-G2 میگردد. در مطالعه Potapenko و همکاران متابولیت استرپتوکوردین که از باکتری استرپتومایسس گونه KORDI -3238 بهدست آمده و به روشی مشابه با مطالعه حاضر و توسط حلال اتیل استات جداسازی شده است، باعث مهار رشد در چندین رده سلول انسانی از جمله MDA-MB-23 (سرطان سینه)، HCT-15 (سرطان کولون)، PC-3 (سرطان پروستات)، K-562 (لوسمی میلوئیدی مزمن). میزان IC50، در 48 ساعت پس از تیمار سلولهای فوق با این ترکیب به ترتیب برابر 7/5، 7/8، 3/2 و 8/6 میکروگرم بر میلیلیتر میباشد (17). در حالیکه نتایج حاصل از مطالعه حاضر نشان داد که 48 ساعت پس از تیمار سلولهای Hep-G2 با متابولیتهای محلول در اتیل استات میزان IC50 برابر 570 نانوگرم میباشد. با توجه به اینکه متابولیتهای حاصل از استرپتومایسس در محدوده غلظتهای مختلف باعث مهار رشد 50 درصدی سلولهای سرطانی میگردد، لذا این ترکیب را میتوان بهعنوان ترکیبی که دارای قدرت اثردهی بیشتر در غلظتهای پایین تر معرفی کرد. یافتههای اخیر نشان میدهد که بسیاری از ترکیبات شیمیدرمانی از طریق القای آپوپتوز منجر به مرگ سلولهای سرطانی میگردند. از آنجاییکه القای آپوپتوز روش مناسبی برای حذف سلولهای سرطانی است و اغلب سلولهای سرطانی دارای نقص در مکانیسم های آپوپتوزی خود میباشند بنابراین یافتن ترکیباتی که بتواند باعث القای آپوپتوز در سلولهای سرطانی گردد راهکار جالبی در کشف داروهای ضد سرطان میباشد (17). در مطالعه ولیپور و همکاران در سال 2019 ارزیابی تاثیر ضدسرطانزایی متابولیتهای حاصله از استرپتومایسس لویس بر ردههای سلولی -6 nalm و -4molt انجام شد. محققان از آزمایش MTT برای ارزیابی اثر سمیت سلولی استرپتومایسس لویس بر روی سلولهای فوق الذکر استفاده نمودند. آپوپتوز و تکثیر سلول های سرطانی نیز توسط فلوسایتومتری مورد بررسی قرار گرفت. روش PCR-RT در زمان واقعی بهصورت کمی (PCR-qRT) و وسترن بلات برای بررسی تأثیر متابولیتهای باکتری بر سطح mRNA و میزان بیان ژنهای 53P،Bax و 2 Bcl استفاده شد. در هر دو رده سلولی، متابولیتهای استخراج شده بهطور قابلتوجهی سبب مهار رشد سلولی و افزایش آپوپتوز شدند. یافته های این تحقیق نشان داد که متابولیتهای ثانویه استرپتومایسس لویس 111 levisABRIINW میتواند بهعنوان عامل ضدسرطان برای سلولهای حاد لوسمی لنفوبالستیک استفاده شود (18). Law و همکارانش در سال 2020 بر روی استرپتومایسسهای مشتق شده از منطقه حرا و تولید ترکیبات ضد سرطان از این میکروارگانیسم تاکید میکنند. جداسازی استرپتومایسسها از مناطق حرا و توصیف موفقیت آمیز ترکیب یاتولید عصارههای خام با فعالیت سیتوتوکسیک علیه ردههای سلولی سرطانی انسان در این بررسی گردآوری شد. انبوهی از متابولیتهای ثانویه فعال زیستی که توسط استرپتومایسسها تولید میشوند، پتانسیل بیودارویی زیادی را نشان داده اند. استرپتوکربازولهای Aو B، استرپتومایسس آمید C و نئوآنتیمایسینهای A و B ترکیبات با خواص ضدسرطانی استرپتومایسسهای مشتق شده از حرا هستند (7). نیکبخت و همکاران در سال 2021 سمیت سلولی متابولیتهای ثانویه استرپتومایسس koyangensis و استرپتومایسس tunisiensis جدا شده از خاک را بر روی رده سلولی سرطان پستان انسان (MCF-7،IBRC C10082) را بررسی کردند. جداسازی استرپتومایسسها از نمونه خاک به روش سریال دایلوشن انجام شد و برای شناسایی جدایههای استرپتومایسس بررسی میکروسکوپی و ماکروسکوپی و حضور دی آمینوپایملیک اسید (DAP) در دیواره سلولی آنها انجام شد. اثر ضد سرطانی با استفاده از روش MTT ارزیابی شد و جهت شناسایی استرپتومایسسها منتخب تعیین توالی 16SrRNA انجام شد. نتایج این مطالعه نشان داد که متابولیتهای ثانویه این استرپتومایسسها دارای اثر سمیت سلولی علیه رده سلولی سرطان پستان انسان MCF-7 هستند و متابولیت تولید شده توسط آنها بر آپوپتوز سلول سرطانی اثر میگذارد و در غلظتها و زمانهای متفاوت باعث جلوگیری از رشد سلول سرطانی میشود (19). کوروشنیا و همکاران در سال 2021 اثر سمیت سویههای اکتینومیستی انتاگونیست بر روی رده سلولی سرطان کولورکتال را بررسی کردند. نتایج این تحقیق نشان دادسویههای آنتاگونیست کاندیدهای خوبی برای بررسی اثرهای ضد سلولی هستند. فعالیت آنتاگونیستی 24 سویه اکتینومیست بر علیه سلولهای سرطانی بررسی شد. دو سویه منتخب که بیشترین فعالیت آنتاگونیستی را نشان دادند، از نظر تولید سیدروفور بررسی شدند. اثر سیتوتاکسیسیتی این دو سویه با استفاده از تست MTT در in vitro بر روی رده سلولی SW480 مورد سنجش قرار گرفته و درصد IC50 تعیین شد. نتایج این مطالعه اثبات کرد که متابولیتهای ثانویه اکتینومیستهای آنتاگونیست می توانند موجب مرگ سلولهای سرطانی شوند (20). اخیراً در مطالعهLee و همکاران متابولیتهای مختلف القاء کننده آپوپتوز از گونههای مختلف باکتری های استرپتومایسس بهدست آمده است که در این میان میتوان به متابولیتهای PCC (pure cytotoxic compound) و F-3-2-5 اشاره کرد که از باکتریهای استرپتومایسس. بهدست میآیند و باعث القای آپوپتوز به ترتیب در ردههای سلولی سرطان خون (THP-1، U-937، K-562، H-60) و سلول های HeLa (سرطان گردن رحم) میگردند (25). PCC در غلظت 30 نانوگرم بر میلیلیتر و در مدت زمان 48 ساعت و از طریق فعالسازی کاسپاز 3 و کاهش بیان پروتئین ضد آپوپتوزی Bcl-2 باعث القای آپوپتوز در ردههای سلولی سرطان خون میگردد (16). در سلولهای HeLa که با غلظت 80 میکرومولار متابولیت F-2-3-5 و در بازه زمانی بالاتر از 24 تیمار شده بود تراکم کروماتین، قطعه قطعه شدن DNA و وقوع آپوپتوز در سلولهای تیمار شده مشاهده گردید (21). در مطالعه حاضر نیز اثرات آپوپتوزی متابولیتهای ثانویه استرپتومایسس کالووس در سلول Hep-G2 در غلظت 3 میکروگرم بر میلیلیتر در مدت زمان 48 ساعت مورد بررسی قرار گرفت که نتایج حاصل حاکی از قطعه قطعه شدن DNA ژنومی و ایجاد تغییرات ریخت شناسی مرتبط با آپوپتوز از جمله جمع شدگی سلولها و ایجاد اجسام آپوپتوتیک در سلول Hep-G2 میباشد. Khandros و همکارانش در زمینه اثرات تمایزی متابولیتهای حاصل از باکتریهای جنس استرپتومایسس ترکیب میترامایسین و کرومومایسین گزارش کردهاند. این ترکیبات باعث القای تمایز اریتروئیدی در سلولهای 562K میگردند (22). همچنین ترکیب دیگری با نام اسپیکامایسین شناخته شده است که باعث القای فعالیت فاگوسیتی در سلولهای HL-60 (لوسمی پرومیلوسیتیک انسانی) میگردد (23). با توجه به مهار رشد سلولهای سرطانی توسط متابولیتهای ثانویه استرپتومایسس؛ اینطور بهنظر میرسد که این متابولیتها خواصی مشابه با ترکیبات chemopreventive داشته و می تواند از رشد سلولهای سرطانی جلوگیری کند. ترکیبات Chemopreventive در واقع ترکیبات طبیعی و یا سنتتیک می باشند که از سرطان زائی جلوگیری میکنند و به طور معمول اثرات خود را از طریق توقف عملکرد عوامل سرطان زا و یا مهار رشد سلولهای تومور نشان میدهند این ترکیبات بایستی دارای خاصیت توکسیک یا سمی نبوده و اثرات جانبی نداشته باشند (24). مطالعات vitro in و vivo in نشان داده است که ترکیبات Chemopreventive میتوانند باعث افزایش خواص ضد سرطانی ترکیبات شیمیدرمانی شوند و استفاده از این ترکیبات بههمراه داروهای شیمیدرمانی میتواند باعث کاهش اثرات توکسیک این داروها و بهبود نتایج درمان گردد. از این لحاظ و با توجه به در نظر گرفتن اثرات مهار رشدی متابولیتهای حاصل از استرپتومایسس کالووس و نیز اثرات تمایزی آنها میتوان این متابولیتها را در ترکیب با سایر داروهای شیمیدرمانی برای مطالعات بیشتر در درمان بیماران مبتلا به هپاتوسلولارکارسینوما بهکار گرفت (25).
نتیجهگیری
با توجه به اثرات متفاوت متابولیتهای ثانویه استرپتومایسس کالووس ایزوله ABRINW673 از جمله مهار زیستایی سلول های سرطانی Hep-G2 و مهار رشد رده سلول های سرطانی Hep-G2 در زمان و غلظتهای متفاوت، ایجاد تغییرات ریختشناسی سلولهای Hep-G2 مانند تغییر در سایز سلولها و ایجاد پاهای کاذب و دوکی شکل شدن سلولهای سرطانی و قطعه قطعه شدن DNA و القای آپوپتوز در Hep-G2 داشتهاند، میتوان این متابولیتها را بهعنوان ترکیبات جدید و موثر برای مطالعات بیشتر و استفاده در درمان بیماران مبتلا به هپاتوسلولارکارسینوما پیشنهاد داد.
سپاسگزاری
از تمام کسانی که ما را در این تحقیق یاری نمودند ، تشکر و قدردانی می نماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی تایید شده است (کد اخلاق IR.IAU.PIAU.REC.1403.015)
مشارکت نویسندگان
مهناز محمدی در ارائه ایده، در طراحی مطالعه، هاله هلالی در جمعآوری دادهها، در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
کبد یکی از اعضاء مهم بدن است که سمزدایی از داروها، دفع محصولات زاید ناشی از تخریب و نوسازی گلبولهای قرمز خون بهصورت صفرا، تولید عوامل انعقادی خون، ذخیره قند بهصورت گلیکوژن و نیز تنظیم سوختوساز قند و چربی از مهمترین نقشهای آن در بدن میباشد. نقش کبد در جذب چربی و دفاع در مقابل میکروبها و سموم جذب شده از راه مواد غذایی را نیز نباید نادیده گرفت. از این عضو بهعنوان یکی از حیاتیترین اندامهای داخلی بدن یاد میشود (1). براساس نقش این اندام در تنظیم متابولیتها و سمزدایی، نارسایی در عملکردهای کبدی ممکن است موجب طیف وسیعی از اختلالات با سطوح متفاوتی از شدت و حتی مرگ و میر شود. با وجود پیشرفتهای فراوان در زمینه پیشگیری، غربالگری، تشخیص و درمان، میزان شیوع و مرگ و میر ناشی از آن همچنان در حال افزایش است. شیوع سرطان در کشورهای درحال توسعه بهویژه کشورهای آسیایی بیش از 10-5 برابر سایر کشورها است. میزان مرگ و میر ناشی از سرطان کبد در ایران طی سالهای 2015- 1990 بیش از چهار برابر افزایش داشته است (2). هپاتوسلولار کارسینوما (HCC) Hepatocellular Carcinoma شایع ترین نوع سرطان کبد با میزان شیوع 80-70 درصد است. این بدخیمی، سومین عامل مرگ و میر مرتبط با سرطان در جهان بوده است (3). برآوردها حاکی از آن است که برخی مناطق آسیایی از نظر شیوع و موارد جدید بیماری و مرگ مرتبط با آن، رتبه اول را در میان قارههای جهان به خود اختصاص میدهند. طبق تحقیقات آژانس بینالمللی سرطان و سازمان بهداشت جهانی، این بدخیمی علت بیش از 782000 مرگ در سال گزارش شده است و با نرخ بالای مرگ و میر به یکی از مشکلات بزرگ در حوزه سلامت جهان تبدیل شده است. در بسیاری از کشورهای جهان، میزان ابتلا به HCC در مردان 4-2 برابر بیشتر از زنان است (4). از جمله مهمترین عوامل افزایشدهنده ابتلا به این بدخیمی، اختلالات مزمن کبدی، ویروسهای هپاتوتروف نظیر ویروسهای هپاتیت B وC، بیماری کبد چرب غیر الکلی Non-alcoholic fatty liver disease (NAFLD)، سمومی مانند آفلاتوکسین و استئاتوهپاتیت غیر الکلیNon-alcoholic steatohepatitis (NASH) است (5). میکروارگانیسمها نقش بهسزایی را در تولید مواد مختلف میکروبی و بیولوژیکی در زندگی روزمره انسان و طبیعت دارا میباشند. مهمترین نقش آنها در صنایع داروسازی دامپزشکی، غذایی و دارویی میباشد (6). به عنوان مثال در تولید ضد قارچها، علفکشها، متابولیتهای فعال داروسازی و آنزیمهای مهم در صنایع غذایی نقش بهسزایی دارند. متابولیتهای ثانویه از لحاظ میکروبی برای سلامتی و تغذیه ما بسیار مهم میباشند. مهمترین متابولیتهای ثانویه آنتیبیوتیکها هستند، که دارای بیشترین اهمیت برای زندگی بشر میباشند (7). متابولیتهای میکروبی از جمله مهمترین ترکیبات شیمیدرمانی سرطان محسوب میشوند. متابولیتهایی همچون اکتینومایسینD، آنتراسایکلینها (شامل دونوروبیسین و دوکسوروبیسین)، میتوسانها (میتومایسینC) و آنتراسنونها (میترامایسین) که از باکتریهای جنس استرپتومایسس بهدست میآیند، در درمان انواع مختلفی از سرطانها مانند تومور ویلمز در کودکان، لوسمیها، سرطانهای ریه و سینه بهکار میروند (8). این ترکیبات که با نام آنتیبیوتیکهای ضد سرطان شناخته میشوند، فعالیت ضد سرطانی خود را از طریق برهمکنش با DNA انجام میدهند بهطوری که باعث مهار سنتز RNA و یا DNA میگردند (9). علاوه براین، اثرات ضدسرطانی سایر متابولیتهای بهدست آمده از باکتریهای جنس استرپتومایسس بهطور گستردهای در ردههای مختلف سلولهای سرطانی مورد بررسی قرار گرفته است و باعث مهار رشد، کاهش زیستایی میگردد. این امر اثبات شده است که برخی ریزسازوارهها توانایی تجمع اختصاصی در ریزمحیط تومور و حتی تکثیر در آن را دارند که این موضوع رویکرد شگرفی را برای درمان هدفمند سرطان بهوجود آورده است (4). باکتری درمانی سرطان دارای ویژگیهای منحصربهفرد نسبت به سایر روشهای درمانی است. باکتریهای مهندسی ژنتیکی شده میتوانند بهطور اختصاصی تومورها را هدف گرفته و مرگ سلولی قابل کنترلی را در سلولهای سرطانی القاء کنند. امروزه با پیشرفت علم زیستشناسی سلولی مولکولی و شناخت بهتر حیات سلولی این امکان فراهم شده است که برای بسیاری از مشکلات و محدودیتهای باکتری درمانی، نظیر سمّیت، پایداری و نیز ارتقاء کارایی هرچه بیشتر آن راهحل مناسبی یافت که در نهایت، منجر به تبدیل باکتری درمانی به یکی از روشهای قابل اعتماد برای درمان هدفمند سرطان گردد (9). هدف از این مطالعه بررسی اثرات ضد سرطانی متابولیتهای ثانویه، استرپتومایسس کالووس ایزوله ABRINW 673 بر رده سلول سرطانی Hep-G2 ( سرطان کبد انسان) است.
روش بررسی
باکتری استرپتومایسس کالووس ایزوله ABRINW673 از مرکز ملی ذخایر ژنتیکی و زیستی ایران تهیه شد و در محیط کشت Nutrient agar بهصورت خطی و به مدت 7 روز در دمای 29 درجه سانتیگراد کشت داده شد. پس از گذشت 7 روز، به منظور جداسازی متابولیتهای ثانویه، 2 میلیلیتر از باکتریهای موردنظر به 20 میلیلیتر محیط کشت مولر هینتون براث اضافه شدند و در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm125 قرار گرفتند. 36 ساعت بعد 1 میلیلیتر از سوسپانسیون حامل به ظرف جدید حاوی 150 میلیلیتر محیط مولر هینتون براث انتقال یافته و به مدت10-7 روز در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm70قرار گرفت. محیط کشت عمومی مولر هیتون براث جهت انجام واکنش تخمیری و تولید متابولیتهای ثانویه توسط باکتریها مورد استفاده قرار گرفت (10). رده سلولی Hep-G2 از مرکز ملی ذخایر ژنتیکی و زیستی ایران خریداری شد و به صورت یخ زده در نیتروژن مایع (191- درجه سانتیگراد) به آزمایشگاه انتقال یافت. برای کشت این سلولها ابتدا یخ زدایی صورت گرفت. بدین منظور تمامی وسایلی که بهصورت مستقیم در تماس با سلول میباشند باید استریل شوند (10). ابتدا فلاسک سلولی توسط میکروسکوپ نوری معکوس مورد بررسی قرار گرفت. تراکم سلولی 80-70 درصد بهترین بازه برای پاساژ دادن سلولی است. سپس فلاسک سلولی بهصورت استریل به زیر هودلامینار انتقال یافت. برای انجام پاساژ سلولی ابتدا محتویات درون فلاسک سلولی با استفاده از سرسمپلرهای استریل تخلیه شد و کف فلاسک با استفاده از محلول بافر فسفات سالین استریل شست و شو داده شد. محلول بافر فسفات سالین تخلیه گردید. تریپسین-EDETA استریل با دمای 37 درجه سانتیگراد به درون فلاسک تزریق شد و فلاسک سلولی به مدت 3-2 دقیقه درون انکوباتور 37 درجه سانتیگراد انتقال یافت. فلاسک سلولی به زیر میکروسکوپ نوری معکوس انتقال یافت و سلولها از نظر چسبندگی و معلق شدن بررسی گردید. برای خنثیکردن اثر تریپسینEDETA- محیط کشت حاوی 10 % سرم جنین گاوی به درون فلاسک افزوده شد. سپس، تمامی مایع درون فلاسک سلولی به فالکون استریل انتقال یافت و با دور rpm1500 به مدت 5 دقیقه سانتریفیوژ شد. مایع رویی فالکون تخلیه شد و سلول ها درون 1 میلیلیتر محیط کشت کامل حل شد. شمارش سلولی صورت گرفت و به میزان 3×106 سلول به درون هر فلاسک 75 T-انتقال یافت (10).
به منظور جداسازی متابولیتهای آنتیباکتریال، مقداری از باکتریهای خالص تهیه شده به محیط کشت مولر هینتون براث اضافه شده و در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm 125 به مدت 36 ساعت قرار گرفت. در مرحله بعد 1 میلیلیتر از سوسپانسیون حاصل به ظرف جدید حاوی محیط مولر هینتون براث انتقال یافته و همانند مرحله اول در انکوباتور شیکردار قرار گرفت. پس از 36 ساعت، تمامی محیط کشت در دور rpm 4000 به مدت 20 دقیقه سانتریفیوژ گردید. رسوب (بیومس) حاصل دور ریخته شده و مایع رویی از کاغذ صافی شماره 1 عبور داده شد. حلال آلی اتیل استات به نسبت 1:1 به مایع حاصل اضافه شد و به مدت 1 ساعت در انکوباتور شیکردار با دمای 29 درجه سانتیگراد و دور حرکت rpm 175 قرار گرفته و به شدت هم زده شد. مخلوط حاصل به دکانتور انتقال یافته و فاز مایع از فاز حلال جدا گردید. فاز حلال که حاوی ترکیبات آنتیباکتریال است در دمای 34 درجه سانتیگراد و در فشار پایین تغلیظ شد و فراکشنهای موجود در متابولیتها با استفاده از کروماتوگرافی HPLC مورد بررسی قرار گرفت (11). حلال اتیل استات در دمای اتاق تبخیر و پودر خشک بهدست آمده در دمای 4 درجه سانتیگراد نگهداری شد. به منظور تهیه غلظتهای مختلف، پودر حاصل در حلال دی متیل سولفوکساید (DMSO) حل شده و غلظتهای مختلف از آن تهیه گردید (10000-10 نانوگرم بر میلیلیتر) (11). جهت تیمار سلولها با متابولیتهای ثانویه حاصل از استرپتومایسس کالووس و بررسی اثرات آن از پلیتهای 96 چاهکی استریل استفاده گردید. این پلیتها با داشتن6 چاهک امکان بررسی اثرات یک ترکیب بر رشد سلولی را در زمانها و غلظتهای مختلف فراهم میکند. جهت تیمار سلولهای پس از 3 بار پاساژ متوالی سلولها و در مرحله رشد لگاریتمی، سلولها به میزان 104 سلول در پلیتهای 96 چاهکی تقسیم شدند و با محیط کشت RPMI-1640 حاوی 10% سرم جنین گاوی و 1% آنتیبیوتیکهای پنیسیلین و استرپتومایسین به مدت 24 ساعت کشت داده شدند. پس از 24 ساعت محیط رویی چاهکها تخلیه گردید و محیط کشت حاوی متابولیتهای ثانویه در غلظتهای 100 /500 /1000/ 2000 و 5000 به سلولها اضافه گردید و به مدت ،24 48، 72 به منظور بررسی اثر زمان بر سایتوتوکسیسیتی متابولیتهای ثانویه باکتریایی در شرایط یکسان انکوبه شدند. گروه کنترل فاقد عصاره باکتریایی با شرایط یکسان کشت داده شد و از بالاترین دوز دی متیل سولفوکساید فاقد عصاره باکتریایی بهعنوان کنترل منفی استفاده شد (11). آزمون MTT تست MTT جهت دستیابی به درصد زندهمانی ( 3-(4،5-dimethylthiazol-2-yl)-2،5-diphenyltetrazolium bromide یک سند رنگسنجی برای اندازهگیری میزان فعالیت آنزیم سوکسینات دهیدروژناز میتوکندریایی است که بهعنوان معیاری برای سنجش زنده بودن سلولها استفاده میشود. MTT نمک زرد رنگ ترازولیوم محلول در آب است که توسط سوکینات دهیدروژناز میتوکندریهای سلولهای زنده و فعال احیاء و به ترکیب رنگی فورمازان نامحلول تبدیل میشود که این رنگ با حلال آلی حل گشته و شدت رنگ در طول موج 570 نانومتر متناسب با میزان سلولهای زنده است. پس از تیمار سلولها با دوزهای 500 /1000/ 2000 / 5000 از متابولیتهای ثانویه در بازههای زمانی ،24، 48، 72 ساعت، محیط رویی سلولها تخلیه گردید. سپس 20 میکرولیتر معرف MTT با غلظت 5 میلیگرم در 1 میلیلیتر بافر فسفات سالین به هر چاهک اضافه گردید و سلولها 4 ساعت دیگر در 37 درجه سانتیگراد انکوبه شدند. کریستالهای MTT-Formazan تشکیل شده در 100 میکرولیتر دیمتیل سولفوکساید حل شد و به مدت 15 دقیقه شیک شدند. سپس جذب در 630-570 نانومتر با استفاده از (Biotek) ELISA Microplate Reader اندازهگیری شد. برای حذف خطا در آزمون برای هر غلظت در هر بازه زمانی به چاهک در نظر گرفته شد و آزمون MTT بصورت Triplicate انجام گرفت. غلظتی از متابولیتهای ثانویه مورد آزمایش که درصد حیات سلول را به نصف تقلیل داد به عنوان IC50 در نظر گرفته شد، این مقدار از روی نمودار با استفاده از نرمافزار Excel مایکروسافت تعیین گردید (11).
برای شمارش سلولی و بهدست آوردن زیستایی سلولها از رنگ تریپان بلو0/4 (w/v) استفاده میشود. محلول مورد استفاده برای تهیه تریپان بلو باید محلولی باشد که به سلولها شوک غلظت یا pH وارد نکند و لذا از بافر فسفات با pH فیزیولوژیک (7/47) برای تهیه رنگ تریپان بلو استفاده شد. به این ترتیب برای تهیه ml 20 تریپان بلو میزان 0/08 گرم از پودر تریپان بلو را در 20 میلیلیتر بافر فسفات اتوکلاو شده حل کرده و پس از حل شدن چندین بار از صافی عبور داده شد. تریپان بلو به هر دو سلول زنده و مرده وارد می شود ولی تنها سلولهای زنده بهدلیل داشتن فعالیت های حیاتی قادر به دفع رنگ تریپان بلو میباشند. به عبارت دیگر در این آزمون سلولهای زنده به رنگ سفید و سلولهای مرده به رنگ آبی در زیر میکروسکوپ دیده میشوند (11). برای بررسی اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر رشد وزیستایی سلول Hep-G2 از آزمون دفع تریپان بلو استفاده شد (11). تعیین آپوپتوز با استفاده از الکتروفورز ژل آگارز انجام شد (12). سپس آزمون قطعه قطعه شدن DNAانجام گرفت. یکی از ویژگیهای آپوپتوز قطعه قطعه شدن DNA ژنومی به قطعات الیگونوکلئوزومی با اختلاف اندازه180-200 جفت باز میباشد که این پدیده به آسانی با استفاده از ژل الکتروفورز معمولی قابل تشخیص است. در برخی از رده های سلولی در هنگام آپوپتوز این قطعات الیگونوکلئوزومی دیده نشده و DNA به حالت لکه (Smear) بر روی ژل الکتروفورز مشاهده میگردد (12). ژن claR یکی از ژنهای دسته ژنی بیوسنتزی آنتیبیوتیکی استرپتومایسس است. این ژن تولید متابولیت ثانویه را در استرپتومایسس بر عهده دارد. استخراج و تاثیر آن بر سلولهای Hep-G2 و بیان P53،Bcl2،Bax بررسی شد. کیت استخراج RNA باکتری از شرکتThermo Fisher Scientific : این کیت یک روش کارآمد و قابل اعتماد برای جداسازی RNA با خلوص بالا و یکنواخت از باکتری های گرم مثبت و گرم منفی است. این کیت از تکنولوژی ذرات مغناطیس استفاده میکند و محلول لایساتور خود را دارد که به لحاظ فعال سازی آنزیمی، پروتئینی و نوکلئیکی بهینه شده است. این کیت قابل خودکار سازی بوده و مناسب برای استفاده در آزمایشهای PCR، RT-PCR، microarray و ... است.
پرایمرها: با درنظر گرفتن خصوصیات ژن claR و ویژگیهای حامل، دو دست پرایمر اختصاصی با جایگاههای برش جهت دو آنزیم محدودالاثر BamHI و XbaI در دو انتهای قطعه ژن مورد نظر و یک جفت پرایمر اختصاصی برای تایید آن ها با نرم افزار OLIGO(version5، W.Rychlik) طراحی شد (جدول 1).PCR -RT با استفاده از آنزیم ترانس کریپتاز معکوس و پرایمرهای اختصاصی و نمونه RNA استخراج شده بر اساس برنامه زیر صورت گرفت:
دناتوره اولیه در دمای 94 درجه سانتیگراد به مدت 10 دقیقه و سپس 25 دوره به ترتیب با دمای دناتوره 94 درجه سانتی گراد به مدت 45 ثانیه و دمای چسبیدن 66 درجه سانتیگراد برای پرایمرهای داخلی claR1)) و دمای 62 درجه سانتیگراد برای پرایمرهای اختصاصی(claR2،claR3) به مدت 30 ثانیه و دمای تکثیر 72 درجه سانتیگراد به مدت 1 دقیقه انجام شد (جدول 2).
مطابق پروتکل، پس از پایان انجام کار، داده های بدست آمده از لحاظ منحنی ذوب بررسی و نمودارهای بدست آمده از لحاظ عدم بهدست آورده شد و نمودارهای حاصله رسم شد (13).
تجزیه و تحلیل آماری
تجزیه و تحلیل های آماری با استفاده از نرمافزارSPSS version 14 و آزمون Student T-test انجام شده است.
جدول 1: پرایمر های طراحی شده برای ژن claR

جدول 2: مواد لازم برای ساخت cDNA

نتایج
بررسیهای اولیه نشان داد که متابولیتهای حاصل از باکتری استرپتومایسس کالووس ایزوله ABRINW673 دارای خواص آنتیباکتریال قوی میباشد. با توجه به اینکه برخی از متابولیتهای بهدست آمده از باکتریهای جنس استرپتومایسس با خاصیت آنتی باکتریالی دارای خواص ضدسرطانی نیز میباشند، به منظور شناسایی ترکیبات ضدسرطان جدید اثرات ضدسرطانی متابولیتهای محلول در اتیل استات باکتری استرپتومایسس ایزوله 673 به صورت in vitro مورد بررسی و مطالعه قرار گرفت. اثرات مهار رشدی این متابولیتها در سلولHep-G2 با استفاده از آزمون دفع رنگ تریپان بلو و شمارش سلولی مورد بررسی قرار گرفت. نتایج حاصل از تیمار سلول های Hep-G2 با متابولیتهای محلول در اتیل استات باکتری استرپتومایسس ایزوله 673 نشان داد که این متابولیتها باعث مهار رشد سلول ها به صورت وابسته به غلظت و زمان می شود به طوری که در نمودار1 مشاهده می شود 48 ساعت پس از تیمار سلول ها با غلظت های ،10 ،100 ،200 ،500 700 و 1000 نانوگرم بر میلی لیتر متابولیتها، میزان رشد سلول ها نسبت به گروه کنترل به ترتیب 21/8 ،28/4 ،37/5 ،45/5 ،54/8 و 60/5درصد کاهش یافت. این حالت به صورت وابسته به زمان نیز قابل مشاهده بود. نتایج به صورت میانگین سه تکرار مستقل ± انحراف استاندارد (SD) نشان داده شده است.
در نمودار2 پس از تیمار سلولهای Hep-G2 با غلظت 200 نانوگرم بر میلی لیتر متابولیتها برای مدت زمان 12 ،24، 48 و 72 ساعت، میزان مهار رشد به ترتیب برابر،19/2 ،26/6 37/5 و 50/4 درصد بوده است. علاوه براین، میزان) IC50 غلظتی از دارو که باعث مهار رشد 50 درصدی میگردد) 48 ساعت پس از تیمار با متابولیتهای محلول در اتیل استات برابر 570 نانوگرم بر میلیلیتر میباشد. نتایج حاصل از تیمار سلول های Hep-G2 با متابولیتهای ثانویه استرپتومایسس کالووس نشان داد که این متابولیتها باعث کاهش وابسته به غلظت و زمان در زیستایی سلولهای تیمار شده میگردد. همان طور که در نمودار 3 و4 مشاهده میشود متابولیتهای ثانویه استرپتومایسس در زمانهای 12 و 24 ساعت و در غلظتهای بالاتر از 1000 نانوگرم بر میلیلیتر باعث کاهش معنیدار در زیستایی سلولهای Hep-G2 میگردد. این در حالی است که در زمانهای بالاتر (48 و 72 ساعت) کاهش معنیدار در زیستایی سلولهای تیمار شده از غلظت 200 نانوگرم بر میلیلیتر آغاز میگردد. بهعنوان مثال، پس از تیمار سلولهای Hep-G2 با غلظت 2000 نانوگرم بر میلیلیتر متابولیت و پس از گذشت مدت زمان ،12 ،24 48 و 72 ساعت، میزان زیستایی سلولها به ترتیب 20/5، 21/7، 25/5 و 40/7 درصد کاهش یافت. همانطور که در نتایج آمده است، در این تحقیق اثرات غلظتهای مختلف متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر زیستایی سلولهای سرطانی با گروه کنترل مقایسه شده است، و بر اساس غلظت و زمان بیشترین اثردهی را بر روی سلولهای سرطانی داشته است. همانطور که در جداول و نمودارها مشخص است، هر چه زمان بیشتر و غلظت بیشتر شود ، اثر کشندگی بیشتر مشاهده شد و تجزیه و تحلیل آماری نشان داد، سمیت سلولی از نظر آماری معنیدار میباشد. بررسی تغییرات ریختشناسی سلولهای Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات و سلولهای کنترل نشان دهنده تغییرات قابل ملاحظه در ظاهر سلولهای تیمار شده با این متابولیتها میباشد. تغییرات ظاهری 12 ساعت پس از تیمار با متابولیتها و از غلظت 200 نانوگرم بر میلیلیتر آغاز گردید و در غلظتهای کم (10 ،100و 200 نانوگرم بر میلیلیتر) بهصورت وابسته به زمان افزایش یافت. همانطور که در شکل 1 نشان داده شده است، تغییرات ریختشناسی سلولها با استفاده از میکروسکوپ نوری (بزرگنمایی 40×) مورد بررسی قرار گرفت. فلشهای کوچک افزایش اندازه و دوکی شدن سلولها و فلشهای بزرگ تجمعات سلولی را نشان میدهند. اندازه برخی از سلولها نسبت به سلولهای کنترل افزایش یافته و ظاهری دوکی شکل پیدا کردند و تشکیل پای کاذب دادند. همچنین سلولهای تیمار شده با متابولیتها بههم چسبیده و تجمعات سلولی تشکیل دادند. بهمنظور اثبات القاء مرگ سلولی آپوپتوزی توسط متابولیتهای محلول در اتیل استات ایزوله 673 از آزمون قطعه قطعه شدن DNA استفاده شد. با غلظت (3000 نانو گرم) ml/µg3 و به مدت 48 ساعت تیمار گردید و اثرات آن بر قطعه قطعه شدن DNA با استفاده از الکتروفورز ژل آگارز مورد بررسی قرار گرفت همانطور که در شکل 2 نشان داده شده است متابولیتهای محلول در اتیل استات باعث تغییر در الگوی DNA ژنومی سلولهای Hep-G2 تیمار شده در مقایسه با سلولهای کنترل گردید. بهطوری که مشاهده میشود DNA ژنومی سلولهایHep-G2 تیمار شده با متابولیت محلول در اتر بهصورت لکه (Smear ) بر روی ژل الکتروفورز دیده میشود در حالیکه این حالت در سلولهای کنترل مشاهده نشد. بیان ژنهایی که توسط Real time PCR بررسی شده است، نشان داد، میزان بیان ژنP53 در اثر تیمار با متابولیتهای استرپتومایسس کالووس از 1 به 3 افزایش پیدا کرده ولی در BCL2 از 1 به نزدیک صفر کاهش یافته است. همچنین، میزان بیان ژن Bax پس از تیمار با متابولیت ثانویه باکتری از 1 به 2/5افزایش یافته است.

نمودار1: اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر رشد سلول های Hep-G2 با غلظت های متفاوت متابولیتهای محلول در اتیل استات

نمودار 2: درصد رشد سلول های Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات ایزوله 673

نمودار3: اثرات متابولیتهای حاصل از باکتری استرپتومایسس کالووس بر زیستایی سلول های Hep-G2 با غلظتهای متفاوت متابولیتهای محلول در اتیل استات

نمودار 4: درصد زیستایی سلول های Hep-G2 تیمار شده با متابولیتهای محلول در اتیل استات ایزوله

شکل1: سلول ها با غلظت های 10- 1000 نانوگرم بر میلی لیتر متابولیتها به مدت 48 ساعت تیمار (بزرگنمایی 40×)

شکل2: اثر متابولیتهای استرپتومایسس کالووس محلول در اتیل استات بر Hep-G2
بحث
سرطان کبد بر اساس منشأ به دو گروه اولیه (منشاء کبدی) و ثانویه (متاستاز از نواحی دیگر بدن) تقسیم میشوند. هپاتوسلولارکارسینوما شایعترین سرطان کبدی است که در آن درگیری هپاتوسیت ها رخ داده است. هپاتوسلولارکارسینوما پنجمین سرطان رایج دنیا و شایعترین علت مرگ ناشی از سرطان معرفی شده است (14). هپاتوسلولارکارسینوما سرطانی بدخیم و مهاجم است و درصورت عدم اقدامات درمانی مناسب بیمار طی 3-6 ماه فوت میکند (6). درمان در سرطان کبد در دو گروه جراحی و غیرجراحی و پیامدهای ناشی از آن در دو بخش جسمی و روحی-روانی طبقهبندی میشوند (15). ترکیب شیوه های درمانی باعث افزایش اثربخشی آنها خواهد شد. پیامدهای جسمی و روحی-روانی متأثر از یکدیگر بوده و میتوانند اثرات یکدیگر را تقویت نمایند. اهمیت پیامدها تاجایی است که از آنها جهت تعیین میزان بقاء و ارزیابی کیفیت زندگی بیماران مبتلا به سرطان کبد استفاده میشود، از اینرو شناسایی و تشخیص زودهنگام این پیامدها لازم و ضروری است. جهت محقق شدن این امر شناسایی دقیق شیوههای درمانی، میزان اثربخشی و پیامدهای مربوط به آنها و بهرهگیری از گایدلاینهای استاندارد مخصوص بیماران مبتلا به سرطان کبد لازم است (16). با وجود پیشرفتهای فراوان در زمینه پیشگیری، غربالگری، تشخیص و درمان، میزان شیوع و مرگ و میر ناشی از آن همچنان در حال افزایش است. در سالهای اخیر تلاشهای بسیاری برای کشف ترکیبات شیمیدرمانی سرطان بهویژه از منابع طبیعی صورت گرفته است (14). در این راستا، امروزه اثرات ضد سرطانی متابولیتهای ثانویه حاصل از باکتریهای جنس استرپتومایسس گزارش شده است. در مطالعه حاضر اثرات متابولیتهای ثانویه حاصل از استرپتومایسس کالووس ایزوله ABRINW673 روی رده سلول سرطانی کبد Hep-G2 مورد بررسی قرار میگیرد. نتایج حاصل از مطالعه حاضر نشان داد که متابولیتهای ثانویه استرپتومایسس کالووس محلول در اتیل استات باعث مهار رشد رده سلول سرطانیHep-G2 میگردد. در مطالعه Potapenko و همکاران متابولیت استرپتوکوردین که از باکتری استرپتومایسس گونه KORDI -3238 بهدست آمده و به روشی مشابه با مطالعه حاضر و توسط حلال اتیل استات جداسازی شده است، باعث مهار رشد در چندین رده سلول انسانی از جمله MDA-MB-23 (سرطان سینه)، HCT-15 (سرطان کولون)، PC-3 (سرطان پروستات)، K-562 (لوسمی میلوئیدی مزمن). میزان IC50، در 48 ساعت پس از تیمار سلولهای فوق با این ترکیب به ترتیب برابر 7/5، 7/8، 3/2 و 8/6 میکروگرم بر میلیلیتر میباشد (17). در حالیکه نتایج حاصل از مطالعه حاضر نشان داد که 48 ساعت پس از تیمار سلولهای Hep-G2 با متابولیتهای محلول در اتیل استات میزان IC50 برابر 570 نانوگرم میباشد. با توجه به اینکه متابولیتهای حاصل از استرپتومایسس در محدوده غلظتهای مختلف باعث مهار رشد 50 درصدی سلولهای سرطانی میگردد، لذا این ترکیب را میتوان بهعنوان ترکیبی که دارای قدرت اثردهی بیشتر در غلظتهای پایین تر معرفی کرد. یافتههای اخیر نشان میدهد که بسیاری از ترکیبات شیمیدرمانی از طریق القای آپوپتوز منجر به مرگ سلولهای سرطانی میگردند. از آنجاییکه القای آپوپتوز روش مناسبی برای حذف سلولهای سرطانی است و اغلب سلولهای سرطانی دارای نقص در مکانیسم های آپوپتوزی خود میباشند بنابراین یافتن ترکیباتی که بتواند باعث القای آپوپتوز در سلولهای سرطانی گردد راهکار جالبی در کشف داروهای ضد سرطان میباشد (17). در مطالعه ولیپور و همکاران در سال 2019 ارزیابی تاثیر ضدسرطانزایی متابولیتهای حاصله از استرپتومایسس لویس بر ردههای سلولی -6 nalm و -4molt انجام شد. محققان از آزمایش MTT برای ارزیابی اثر سمیت سلولی استرپتومایسس لویس بر روی سلولهای فوق الذکر استفاده نمودند. آپوپتوز و تکثیر سلول های سرطانی نیز توسط فلوسایتومتری مورد بررسی قرار گرفت. روش PCR-RT در زمان واقعی بهصورت کمی (PCR-qRT) و وسترن بلات برای بررسی تأثیر متابولیتهای باکتری بر سطح mRNA و میزان بیان ژنهای 53P،Bax و 2 Bcl استفاده شد. در هر دو رده سلولی، متابولیتهای استخراج شده بهطور قابلتوجهی سبب مهار رشد سلولی و افزایش آپوپتوز شدند. یافته های این تحقیق نشان داد که متابولیتهای ثانویه استرپتومایسس لویس 111 levisABRIINW میتواند بهعنوان عامل ضدسرطان برای سلولهای حاد لوسمی لنفوبالستیک استفاده شود (18). Law و همکارانش در سال 2020 بر روی استرپتومایسسهای مشتق شده از منطقه حرا و تولید ترکیبات ضد سرطان از این میکروارگانیسم تاکید میکنند. جداسازی استرپتومایسسها از مناطق حرا و توصیف موفقیت آمیز ترکیب یاتولید عصارههای خام با فعالیت سیتوتوکسیک علیه ردههای سلولی سرطانی انسان در این بررسی گردآوری شد. انبوهی از متابولیتهای ثانویه فعال زیستی که توسط استرپتومایسسها تولید میشوند، پتانسیل بیودارویی زیادی را نشان داده اند. استرپتوکربازولهای Aو B، استرپتومایسس آمید C و نئوآنتیمایسینهای A و B ترکیبات با خواص ضدسرطانی استرپتومایسسهای مشتق شده از حرا هستند (7). نیکبخت و همکاران در سال 2021 سمیت سلولی متابولیتهای ثانویه استرپتومایسس koyangensis و استرپتومایسس tunisiensis جدا شده از خاک را بر روی رده سلولی سرطان پستان انسان (MCF-7،IBRC C10082) را بررسی کردند. جداسازی استرپتومایسسها از نمونه خاک به روش سریال دایلوشن انجام شد و برای شناسایی جدایههای استرپتومایسس بررسی میکروسکوپی و ماکروسکوپی و حضور دی آمینوپایملیک اسید (DAP) در دیواره سلولی آنها انجام شد. اثر ضد سرطانی با استفاده از روش MTT ارزیابی شد و جهت شناسایی استرپتومایسسها منتخب تعیین توالی 16SrRNA انجام شد. نتایج این مطالعه نشان داد که متابولیتهای ثانویه این استرپتومایسسها دارای اثر سمیت سلولی علیه رده سلولی سرطان پستان انسان MCF-7 هستند و متابولیت تولید شده توسط آنها بر آپوپتوز سلول سرطانی اثر میگذارد و در غلظتها و زمانهای متفاوت باعث جلوگیری از رشد سلول سرطانی میشود (19). کوروشنیا و همکاران در سال 2021 اثر سمیت سویههای اکتینومیستی انتاگونیست بر روی رده سلولی سرطان کولورکتال را بررسی کردند. نتایج این تحقیق نشان دادسویههای آنتاگونیست کاندیدهای خوبی برای بررسی اثرهای ضد سلولی هستند. فعالیت آنتاگونیستی 24 سویه اکتینومیست بر علیه سلولهای سرطانی بررسی شد. دو سویه منتخب که بیشترین فعالیت آنتاگونیستی را نشان دادند، از نظر تولید سیدروفور بررسی شدند. اثر سیتوتاکسیسیتی این دو سویه با استفاده از تست MTT در in vitro بر روی رده سلولی SW480 مورد سنجش قرار گرفته و درصد IC50 تعیین شد. نتایج این مطالعه اثبات کرد که متابولیتهای ثانویه اکتینومیستهای آنتاگونیست می توانند موجب مرگ سلولهای سرطانی شوند (20). اخیراً در مطالعهLee و همکاران متابولیتهای مختلف القاء کننده آپوپتوز از گونههای مختلف باکتری های استرپتومایسس بهدست آمده است که در این میان میتوان به متابولیتهای PCC (pure cytotoxic compound) و F-3-2-5 اشاره کرد که از باکتریهای استرپتومایسس. بهدست میآیند و باعث القای آپوپتوز به ترتیب در ردههای سلولی سرطان خون (THP-1، U-937، K-562، H-60) و سلول های HeLa (سرطان گردن رحم) میگردند (25). PCC در غلظت 30 نانوگرم بر میلیلیتر و در مدت زمان 48 ساعت و از طریق فعالسازی کاسپاز 3 و کاهش بیان پروتئین ضد آپوپتوزی Bcl-2 باعث القای آپوپتوز در ردههای سلولی سرطان خون میگردد (16). در سلولهای HeLa که با غلظت 80 میکرومولار متابولیت F-2-3-5 و در بازه زمانی بالاتر از 24 تیمار شده بود تراکم کروماتین، قطعه قطعه شدن DNA و وقوع آپوپتوز در سلولهای تیمار شده مشاهده گردید (21). در مطالعه حاضر نیز اثرات آپوپتوزی متابولیتهای ثانویه استرپتومایسس کالووس در سلول Hep-G2 در غلظت 3 میکروگرم بر میلیلیتر در مدت زمان 48 ساعت مورد بررسی قرار گرفت که نتایج حاصل حاکی از قطعه قطعه شدن DNA ژنومی و ایجاد تغییرات ریخت شناسی مرتبط با آپوپتوز از جمله جمع شدگی سلولها و ایجاد اجسام آپوپتوتیک در سلول Hep-G2 میباشد. Khandros و همکارانش در زمینه اثرات تمایزی متابولیتهای حاصل از باکتریهای جنس استرپتومایسس ترکیب میترامایسین و کرومومایسین گزارش کردهاند. این ترکیبات باعث القای تمایز اریتروئیدی در سلولهای 562K میگردند (22). همچنین ترکیب دیگری با نام اسپیکامایسین شناخته شده است که باعث القای فعالیت فاگوسیتی در سلولهای HL-60 (لوسمی پرومیلوسیتیک انسانی) میگردد (23). با توجه به مهار رشد سلولهای سرطانی توسط متابولیتهای ثانویه استرپتومایسس؛ اینطور بهنظر میرسد که این متابولیتها خواصی مشابه با ترکیبات chemopreventive داشته و می تواند از رشد سلولهای سرطانی جلوگیری کند. ترکیبات Chemopreventive در واقع ترکیبات طبیعی و یا سنتتیک می باشند که از سرطان زائی جلوگیری میکنند و به طور معمول اثرات خود را از طریق توقف عملکرد عوامل سرطان زا و یا مهار رشد سلولهای تومور نشان میدهند این ترکیبات بایستی دارای خاصیت توکسیک یا سمی نبوده و اثرات جانبی نداشته باشند (24). مطالعات vitro in و vivo in نشان داده است که ترکیبات Chemopreventive میتوانند باعث افزایش خواص ضد سرطانی ترکیبات شیمیدرمانی شوند و استفاده از این ترکیبات بههمراه داروهای شیمیدرمانی میتواند باعث کاهش اثرات توکسیک این داروها و بهبود نتایج درمان گردد. از این لحاظ و با توجه به در نظر گرفتن اثرات مهار رشدی متابولیتهای حاصل از استرپتومایسس کالووس و نیز اثرات تمایزی آنها میتوان این متابولیتها را در ترکیب با سایر داروهای شیمیدرمانی برای مطالعات بیشتر در درمان بیماران مبتلا به هپاتوسلولارکارسینوما بهکار گرفت (25).
نتیجهگیری
با توجه به اثرات متفاوت متابولیتهای ثانویه استرپتومایسس کالووس ایزوله ABRINW673 از جمله مهار زیستایی سلول های سرطانی Hep-G2 و مهار رشد رده سلول های سرطانی Hep-G2 در زمان و غلظتهای متفاوت، ایجاد تغییرات ریختشناسی سلولهای Hep-G2 مانند تغییر در سایز سلولها و ایجاد پاهای کاذب و دوکی شکل شدن سلولهای سرطانی و قطعه قطعه شدن DNA و القای آپوپتوز در Hep-G2 داشتهاند، میتوان این متابولیتها را بهعنوان ترکیبات جدید و موثر برای مطالعات بیشتر و استفاده در درمان بیماران مبتلا به هپاتوسلولارکارسینوما پیشنهاد داد.
سپاسگزاری
از تمام کسانی که ما را در این تحقیق یاری نمودند ، تشکر و قدردانی می نماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی تایید شده است (کد اخلاق IR.IAU.PIAU.REC.1403.015)
مشارکت نویسندگان
مهناز محمدی در ارائه ایده، در طراحی مطالعه، هاله هلالی در جمعآوری دادهها، در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Jamali R, Jamali A. An Overview of Fatty Liver Disease. Feyz Medical Sciences Journal 2010; 14(2): 169-81. [Persian]
2- Taj Bakhsh S, Salehi S. Moazzami N. Screening of Streptomyces Products Using Cell Culture Technique in Order to Identify Antitumor Substances. Khilaj Fars Bio-Medical Research Institute 2008; 11(2): 115-8. [Persian]
3- Salam N, Jiao JY, Zhang XZ, Li WJ. Update on The Classification of Higher Ranks in the Phylum Actinobacteria. Int J Syst Evol Microbiol 2020; 70(2): 1331-355.
4- Namazi N, Larijani B, Azadbakht L. Alphalic Acid Supplement in Obesity Treatment: A Systematic Review and Meta-Analysis of Clinical Trials. Clin Nutr 2018; 37(2): 419-30.
5- Chen JJ, Xu L, Zhou Y, Han B. Natural Products from Actinomycetes Associated with Marine Organisms. Mar Drugs 2021; 19(11): 629.
6- Zanon E, Porrect A, Simioni P. Haemophilia and Cancer: A Literature Review. J Clin Med 2024; 13(6): 1770.
7- Kumar S, Solanki DS, Parihar K, Tak A, Gehlot P, Pathak R, Singh SK. Actinomycetes Isolates of Arid Zone of Indian thar Desert and Efficacy of their Bioactive Compounds Against Human Pathogenic Bacteria. Biol Future 2021; 72(4): 431-40.
8- Law J, Law L, Letchumanan V, Tan LT, Wong SH, Chan KG, et al. Anticancer Drug Discovery from Microbial Sources: The unique mangrove Streptomyces Molecules 2020; 25(22): 5365.
9- Marinelli L, Tenore GC, Novellino E. Probiotic Species in the Modulation of the Anticancer Immune Response. Semin Cancer Biol 2017; 46: 182-90.
10- Handbook and safety principles in the laboratory. Authored by the Artemia World Reference Center - Ghent University, Belgium.
11- Monfardi A. Complete Reference Book of Pagana Diagnostic and Laboratory Tests.
12- Saadati H. Theta book. A comprehensive guide to interpreting laboratory tests.
13- Stephen J Salipante, Keith R Jerome. Digital PCR—An Emerging Technology with Broad Applications in Microbiology. Clin Chem 2020; 66(1): 117-23.
14- Esmaeili M, Zand M. The Efficacy and Complications of Treatment Modalities in Patients with Liver Cancer: A Review Study Digestion. Govaresh 2020; 24: 206-16.
15- Donadon M, Solbiati L, et al. Hepatocellular Carcinoma. The Role of Interventional Oncology 2016; 34-50.
16- El-Ahmady El-Naggar N, DerazS V, Soliman H M, El-Deeb NM, El-Shweihy NM. Purification, Characterization and Amino Acid Content of Cholesterol Oxidase Produced by Streptomyces Aegyptia NEAE 102. BMC Microbiology 2017: 17: 76.
17- Potapenko K, Lisiutin G, Vasylieva N, Strashnova I, Franke R, PetrivN, et al. Antimicrobial and Anticancer Activity of Streptomyces Ambofaciens (Myt 8) and S. Globisporus ONU 1019 (Myt 11) Secondary Metabolites Isolated from the Odesa Bay, the Black Sea: An in Vitro Study. Biomedicine & Pharmacotherapy 2025; 186 :117981
18- Valipour B. Antitumor Activity of Cord Blood Stem Cell Derived CD 16 Positive NK Cells As an Immune Cell Therapy for Acute Lymphoblastic Leukemia (ALL). Faculty of Medicine. Tabriz University of Medical Science 2019.
19- NikBakht M, Omidi M, Amoozegar MA, Amini K. Investigating the Cytotoxicity of Treptomyces Koyangensis and Streptomyces Tunisiensis Secondary Metabolites Isolated from The Saline Soils of Garmsar City on Human Breast Cancer Cell Line (MCF-7, IBRC C10082). J Med Sci Islamic Azad University 2021; 31(4): 367-76. [Persian]
20- Koroshnia A, Zinli S, Irani S, Sadeghi A. Investigating the Effect of Cytotoxicity of Antagonist Actinomycete Strains on Colorectal Cancer Cell Line. NCMBJ 2021; 12(45): 51-61.
21- Lee CH, Lim H, Moon S, Shin C, Kim S, Kim BJ, et al. Novel Anticancer Agent, Isolated from Streptomyces Sp. Causes G1 Cell Cycle Arrest and Induces Apoptosis of Hela Cells. Cancer Sci 2007; 98(6): 795-812.
22- Khandros E, Huang P, Peslak SA, Sharma M, Abdulmalik O, Giardine BM, et al. Understanding Heterogeneity of Fetal Hemoglobin Induction through Comparative Analysis of F and an Erythroblasts. the Journal of the American Society of Hematology Blood 2020; 135(22): 1957-968.
23- Hayakawa Y, Nakagawa M, Kawai H, Tanabe K, Nakayama H, Shimazu A, et al. Spicamycin, A New Inducer of Differentiation of HL-60 Human Promyelocytic Leukemia Cells. J Antibiotics 1983; 36(7): 937-4.
24- Dave A, Parande F, Park EJ, Pezzuto JM. Phytochemicals and Cancer Chemoprevention. J Cancer Metastasis Treat 2020; 6: 46.
25- Sarkar FH, Li Y. Targeting Multiple Signal Pathways by Chemopreventive Agents for Cancer Prevention and Therapy. Acta pharmacologica Sinica 2007; 28(9): 1305-15.
نوع مطالعه: پژوهشي |
موضوع مقاله:
میکروبیولوژی
دریافت: 1403/12/16 | پذیرش: 1404/2/16 | انتشار: 1404/5/15
دریافت: 1403/12/16 | پذیرش: 1404/2/16 | انتشار: 1404/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







