دوره 33، شماره 9 - ( آذر 1404 )
جلد 33 شماره 9 صفحات 9400-9386 |
برگشت به فهرست نسخه ها
Ethics code: IR.ARAKU.REC.1401.128
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shariat Zadeh S M A, Emadi M, Moghadasi S. Study of the Stereological and Biochemical Effects of L-Carnitine on Testicular Tissue after Toxicity Induction by Silver Nanoparticles in Mice. JSSU 2025; 33 (9) :9386-9400
URL: http://jssu.ssu.ac.ir/article-1-6371-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6371-fa.html
شریعتزاده سید محمدعلی، عمادی مهدیه، مقدسی سمیرا. مطالعه اثر استریولوژیکی و بیوشیمیایی الکارنیتین بر بافت بیضه پس از القای سمیت توسط نانوذراتنقره در موش سوری. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (9) :9386-9400
متن کامل [PDF 825 kb]
(123 دریافت)
| چکیده (HTML) (181 مشاهده)
References:
1- Pathak UI, Gabrielsen JS, Lipshultz LI. Cutting-Edge Evaluation of Male Infertility. Urol Clin North Am. 2020; 47(2): 129-38.
2- Bhasin S, de Kretser DM, Baker HW. Clinical Review Pathophysiology and Natural History of Male Infertility. J Clin Endocrinol Metab 1994; 79(6): 1525-9.
3- Spira A, Multigner L. The Effect of Industrial and Agricultural Pollution on Human Spermatogenesis. Hum Reprod 1998; 13(8): 2041-2.
4- Petrelli G, Mantovani A. Environmental Risk Factors and Male Fertility and Reproduction. Contraception 2002; 65: 297-300.
5- Buzea C, Pacheco I, Robbie K. Nanomaterials and Nanoparticles: Sources and Toxicity. Biointerphases 2007; 2(4): MR17-71.
6- Gibbons B, Warner L. The Role of Antimicrobial Silver Nanotechnology. Medical Device and Diagnostic Industry Magazine 2005; 25: 164-9.
7- Tolaymat TM, EI Badawy AM, Genaidy A, Scheckel KG, Luxton TP, Suidan M. An Evidence-Based Environmentalperspective of Manufactured Silver Nanoparticle in Syntheses and Applications a Systematic Review and Critical Appraisalof Peer-Reviewed Scientific Papers. Sci Total Environ 2010; 408(5): 999-1006.
8- Morishita Y, Yoshioka Y, Satoh H, Nojiri N, Nagano K, Abe Y, et al. Distribution and Histologic Effects of Intravenously Administered Amorphous Nanosilica Particles in the Testes of Mice. Biochem Biophys Res Commun 2012; 420(2): 297-301.
9- Sudhahar V, Fukai T. Antioxidant Supplementation and Therapies. In: Tsukahara H, Kaneko K (eds). Studies on Pediatric Disorders. Oxidative Stress in Applied Basic Research and Clinical Practice. Springer, New York; 2014: 183-209.
10- Goto Y, Noda Y, Narimoto K, Umaoka Y, Mori T. Oxidative Stress on Mouse Embryo Development in Vitro. Free Radic Biol Med 1992; 13(1): 47-53.
11- Lenzi A, Sgrò P,Salacone P, Paoli D, Gilio B, Lombardo F. A Placebo-Controlled Doubleblind Randomized Trial of The Use of Combined Lcarnitine and L-Acetyl-Carnitine Treatment in Men with Asthenozoospermia. Fertil Steril 2004; 81(6): 1578-84.
12- Neuman SL, Lin TL, Heste PY. The Effect of Dietary Carnitine on Semen Traits of White Leghorn Roosters. Poult Sci 2002; 81(4): 495-503.
13- Palmero S, Bottazzi C, Costa M, Leone M, Fugassa E. Metabolic Effects of L-Carnitine on Prepubertal Rat Sertoli Cells. Horm Metab Res 2000; 32(3): 87-90.
14- Lafuente D, Garcia T, Blanco J, Sánchez D, Sirvent J,Domingo J. Effects of Oral Exposure to Silver Nanoparticles on the Sperm of Rats. Reprod Toxicol 2016; 60: 133-9.
15- Latendresse JR, Warbrittion AR, Jonassen H, Creasy DM. Fixation of Testes and Eyes Using a Modified Davidson's Fluid: Comparison with Bouin's Fluid and Conventional Davidson's Fluid. Toxicol path 2002; 30(4): 524-33.
16- Wick MR. The Hematoxylin and Eosin Stain in Anatomic Pathology—An Often-Neglected Focus of Quality Assurance in the Laboratory. Semin Diagn Pathol 2019; 36(5): 303-11.
17- Bancroft JD, Layton C. The Hematoxylins and Eosin. Edighth edition 2019: 1-573.
18- Noorafshan AJAoA-AA. Stereology As a Valuable Tool in the Toolbox of Testicular Research. Ann Anat 2012; 16: 57-66.
19- Buege JA, Aust SD. Microsomal lipid peroxidation. Methods Enzymol 1978; 52: 302-10.
20- Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation product; Malondialdehyde and 4-hydroxynonenal. Methods Enzymol 1990; 186: 407-21.
21- Saremi A, Changizi Ashtiani S, Kalantari A. The Combination of Vitamin E Supplementation and Intensive Exercise on Testicular Oxidative Stress and Spermatogenesis in Male Rats. Sport Physiology 2014; 6(23): 43-54.
22- Cömert ED, Gökmen V. Evolution of Food Antioxidants as A Core Topic of Food Science for A Century. Food Res Int 2018; 10: 576-93.
23- Benzie IF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a Measure of “Antioxidant Power the FRAP Assay. Anal Biochem 1996; 239: 70-6.
24- Shariatzadeh M, Soleimani Mehranjani, Solgi F, Maleki P. Stereological Study of te Protective Effect of Alpha Lipoic Acid on the Testis after Treatement with Silver Nanoparticles in the Nmri Mouse. Studies in Medical Sciences 2021; 31(12): 944-55. [persian]
25- Razi A, Talebi AR, Poorrajab F, Rezaie Zarchi S, Razavi Sheshdeh SAR, Shahmoradi Razi HR. Effects of Silver Nanoparticles on Sperm Parmeters and Reactive Oxygen Species in the Mouse Serum and Seminal Fluid. Cell &tissue 2015; 5(4): 393-400. [persian]
26- Ema M, Okuda H, Gamo M, Honda K. A Review of Reproductive and Developmental Toxicity of Silver Nanoparticles in Laboratory Animals. Reprod Toxicol 2017; 67: 149-64.
27- Zare Z, Eimani H, Mohammadi M, Mofid M, Dashtnavard H. The Effect of Orally Administered Lcarnitine on Testis Tissue Sperm Parameters and Daily Spermprouduction in Adult Mice. Yakhteh medical 2010; 11(4): 382-89. [persian]
28- Elsharkawy EE, Abd El-Nasser M, Kamaly HF. Silver Nanoparticles Testicular Toxicity in Rat. Environ Toxicol Pharmacol 2019; 70: 103194.
29- Zhang X-F, Choi Y-J, Han JW, Kim E, Park JH, Gurunathan S. Differential Nanoreprotoxicity of Silver Nanoparticles in Male Somatic Cells and Spermatogonial Stem Cells. Int J Nanomedicine 2015; 10: 1335.
30- SHariatzadeh SMA, CHerghi E, Bakhshi MR. The Study of Protective Effect of Royal Jelly on the Testis Tissue after Silver Nanoparticles-Induced Toxicity in the NMRI Mice. Feyz 2020; 24: 282-92. [persian]
31- Abdel-Emam R, Esraa A. Ameliorative Effect of L-Carnitine on Chronic Lead-Induced Reproductive Toxicity in Male Rats. Veterinar Medicine and Science 2021; 7: 1426-35.
32- Koohpeyma F, Gholizadeh F, Hafezi H, Hajiaghaui M, Siri M, Allahyari SH, et al. The Protective Effect of Lcarnitine on Tesosterone Synthesis Pathway and Spermatogenesis in Monosodium Glutamate Induced Rats. BMC Complement Med Ther 2022; 22: 269. [persian]
33- Moghanlo H, Shariatzadeh SMA. Beneficial Effects of Spirulina Platensis on Mice Testis Damaged by Silver Nanoparticle. Andrologia 2022; 54(11): e14606.
34- Kiani M, Parto P. Protective Effect of Lcarnitine on the Sperm Parameters of Adult Mice Treated with Ciprofloxacin. J Ardabil Univ Med Sci 2018; 17: 392-401.
35- Olugbodi J, David O, Oketa E, Lawal B, Okoli B, Mtunzi F. Silver Nanoparticles Stimulates Spermatogenesis Impairments and Hematological Alterations in Testisand Epididymis of Male Rats. J Molocules 2020; 28: 2-16
متن کامل: (59 مشاهده)
مقدمه
مشکلات باروری در انسانها روزبهروز در حال افزایش است. در واقع ناباروری و مشکلات فردی و اجتماعی ناشی از آن یکی از مشکلات اصلی است که زندگی زوجهای جوان را مختل کرده است. ناباروری و عدم توانایی فرد برای انجام طبیعی فرآیند تولیدمثل و صاحب فرزند شدن به عنوان یکی از تجربیات تلخ و دردآور زندگی است که با توجه به شرایط اجتماعی میتواند برای زوجها تبدیل به یک بحران اساسی شود (1). ناباروری بهعنوان عدم توانایی بچهدار شدن بعـد از حـداقل یـکسـال ازدواج بـدون اسـتفاده از وسـایل پیشـگیری اطـلاق میشود. در حدود 12-8 درصد از زوجها دچار ناباروی هستند، که در حدود 35 درصد ناباروریها مربوط به مردان و 25 درصد مربوط به زنان است (2). بسیاری از تحقیقات اثرات مضر عوامل محیطی از جمله مـواد سمی، تشعشعات و آفتکشها روی ناباروری مردان را نشـان داده و مشخص کـرده اسـت کـه آفتکشها و مواد سمی میتوانند باعث کاهش اسپرم در مردان شود (3.4). با توجه به تحقیقات صورت گرفته مواد شیمیایی و سمی با باروری مردان مرتبط است. یکی از این مواد شیمیایی نانوذراتنقره است. نانوذراتنقره یکی از ارزشمندترین محصولات نانوتکنولوژی است که در دنیای امروز در علوم مختلف همانند پزشکی و بیولوژی بهکار برده میشود. در حوزه پزشکی در مواردی همچون پوششی برای ترمیم زخمها، دندانپزشکی و تهیه ابزار جراحی مورد استفاده قرار میگیرد (5). نانوذراتنقره پرکابردترین نانوذرات است و میزان مصرف آن سالانه 55 تن است. علت اصلی کاربرد گسترده نانوذراتنقره خواص ضدمیکروبی آن است. این نانوذرات دارای خواص ضدباکتریایی، ضد ویروسی و ضدقارچی میباشد (6). نانوذرات با توجه به خطرات احتمالی برای سلامت انسان خطرزا هستند و با توجه به عبور نانوذرات از طریق موانع بیولوژیکی و نفوذ به بافتهای تولیدمثلی این امر بهخصوص در مورد سمیتشناسی تولیدمثلی ضروری است، زیرا این ذرات بر عملکرد سیستم تولیدمثلی و توانایی زنده ماندن اسپرم و تکوین جنین اثرگذار است بنابراین هر گونه کاستی در این زمینه بر بقای نسل و باروری اثرگذار میباشد (7). مطالعات انجام شده بر روی مدلهای حیوانی نشان دادهاند که نانوموادنقره توانایی عبور از سد خونی بیضه را دارند و در سلولهای سوماتیک و ژرمینال بیضه جمعآوری میگردند. تجمع قابلتوجهی از این مواد در سلولهای سرتولی و هستههای اسپرماتوسیت گزارش گردیده است. امروزه محققان بر این باورند که غنی کردن محیط اطراف اسپرم با آنتیاکسیدانها، احتمالاً منجر به حفاظت اسپرماتوزوا در برابر آسیبهای القاشده با استرس اکسیداتیو میشود (8). سیستم آنتیاکسیدانتی بدن در برابر آسیبهای ناشی از رادیکالهای آزاد بسیار کارآمد است و در واقع مواد آنتیاکسیدانتی با غیرفعال کردن و حذف گونههای اکسیژن فعال(ROS)، از سمیت بافت جلوگیری میکند (9). در واقع ترکیبات آنتیاکسیدانی میتوانند باعث محافظت اسپرماتوزوا در برابر ROS تولیدشده توسط اسپرماتوزوای غیرطبیعی، ممانعت از قطعهقطعه شدن DNA، بهبود کیفیت مایع منی در افراد سیگاری، کاهش آسیب سرما به اسپرماتوزوا، ممانعت از بلوغ اسپرم نابالغ و افزایش حرکت اسپرماتوزوا شوند (10). الکارنیتین برای اولین بار از گوشت گاو جدا گردید و این ماده از مشتقات اسیدآمینه لیزین و متیونین میباشد. الکارنیتین در برخی مواد غذایی مانند گوشت طیور، ماهی و برخی فراوردههای لبنی وجود دارد (11). برای بتااکسیداسیون اسیدهای چرب با زنجیره بلند در میتوکندری، الکارنیتین ضروری است. اسیدهای چرب قبل از آن که به میتوکندری وارد شوند باید فعال شوند مولکولهای زنجیره بلند استیلکوآ بدون وجود الکارنیتین توانایی عبور از غشای داخلی میتوکندری را ندارند. بعد از وارد شدن به داخل میتوکندری بتااکسیداسیون و تولید آدنوزینتریفسفات شروع میگردد (9،12). الکارنیتین یک شبهویتامین است که دارای ویژگیهای آنتیاکسیدانی و آنتیآپاپتوزیس در سیستم تناسلی نر میباشد و در واقع الکارنیتین در تنظیم عملکرد سلولهای سرتولی یک تنظیمکننده اساسی است و در رفع نواقص اسپرم موثر شناخته شده است (13). با توجه به اینکه نانوذرات نقره در زندگی روزمره کاربردهای فراوانی دارد و اثرات آن بر ناباروری غیر قابلچشمپوشی است، در این پژوهش بر آن شدیم اثر استریولوژیکی و بیوشیمیایی الکارنیتین بر بافت بیضه موشهای نژاد NMRI تیمار شده با نانوذراتنقره را مورد بررسی قرار دهیم.
روش بررسی
به منظورانجام این پژوهش تجربی 24 سر موش نر بالغ نژاد NMRI به میانگین وزنی 2± 32 گرم به شکل تصادفی از خانه حیوانات دانشگاه اراک تهیه شد و نگهداری گردید. موشها در اتاق حیوانات دانشگاه اراک در شرایط کنترل شده (دوره روشنایی 12 ساعت روشنایی/ تاریکی) و دمای 2±22 درجه سانتیگراد و 60-40 درصد رطوبت قرار داده شدند. برای سازگاری با محیط جدید، ضمن دسترسی راحت به آب و غذای مناسب و مطابق با قوانین نگهداری از حیوانات آزمایشگاهی، به مدت 2هفته موشهای موردنظر در قفسهای جداگانه نگهداری شدند تا سازگاری ایجاد گردد و استرس در حیوانات از بین برود. در مدت زمان تیمار نیز موشها در شرایط استاندارد نگهداری شدند و اصول کار آزمایشگاهی با حیوانات مطابق اصول کمیته ملی اخلاق حمایت از حیوانات آزمایشگاهی رعایت گردید. موشها بر اساس وزن به4 گروه تقسیم شدند یعنی میانگین وزنی در 4گروه برابر است: (1). گروه کنترل (2).گروه تیمار با نانوذراتنقره (500 میلیگرم/کیلوگرم وزن بدن/ روز) به شکل گاواژ (3). گروه تیمار با الکارنیتین (100 میلیگرم/کیلوگرم/ روز) به شکل گاواژ (4). گروه تیمار همزمان نانوذراتنقره و الکارنیتین به شکل گاواژ (12). تیمار در کلیه گروهها 35 روز انجام گرفت.
تشریح حیوانات: بعد از پایان یافتن مدت زمان تیمار یعنی 35روز، کل موشها تشریح گردیدند. برای تشریح، موشها با کتامینزایلازین (1 میلیگرم کتامین و 1/0 میلیگرم زایلازین) بیهوش شدند. پس از آن ناحیه شکم موش با استفاده از وسایل جراحی، شکافته گردید. خونگیری از بطن راست قلب موش به طور مستقیم توسط یک سرنگ استریل انجام شد. بعد از آن به منظور جداسازی سرم خون بهوسیله دستگاه سانتریفیوژ و به مدت زمان 15دقیقه و دور13000RPM سانتریفیوژگردیده و سرم جدا شده جهت بررسی فاکتورهای بیوشیمایی به فریزر 80- انتقال داده شد و نگهداری گردید. بعد از آن اسکروتوم باز شده و ناحیه دمی اپیدیدیم بیضه چپ را با قیچی استریل جدا کرده و به پلیت محتوی 5/1میلیلیتر محیط کشت (cat no .H -1318-1)Hamsʹ F10 در انکوباتور 37 درجه سانتیگراد انتقال داده تا پس از گذشت مدت زمان 5 دقیقه برای بررسی پارامترهای اسپرمی مورد استفاده قرار گیرد. اسمیرهایی از نمونههای اسپرم موش مطابق رنگآمیزی ائوزین-نیگروزین تهیه گردید. به این منظور محلول نیگروزین 10درصد و ائوزین 1درصد در نرمالسالین تهیه شده و سپس 20 میکرولیتر ائوزین و 10 میکرولیتر اسپرم در میکروتیوپ ریخته و ترکیب شده و بعد از آن 30 ثانیه در انکوباتور 37 درجه قرار داده شد. سپس 30 میکرولیتر رنگ نیگروزین نیز به آن اضافه شد و بعد از آن اسمیر از نمونه اسپرمها تهیه شدند. بیضه چپ جهت بررسیهای استریولوژی مورد استفاده قرار گرفت.
بررسی تعداد اسپرم: طبق دستورالعمل WHO شمارش اسپرم انجام گردید. سوسپانسیون اسپرمی شامل 100 میکرولیتر از اسپرم محیط کشت و 900 میکرولیتر از فیکساتیو اسپرمی تهیه شد. فیکساتیو اسپرمی از فرمالین 35درصد و بیکربنات سدیم تهیه گردید. برای انجام شمارش لام نئوبار مورد استفاده قرار گرفت. سپس 10 میکرولیتر از سوسپانسیون اسپرمی روی لام نئوبار ریخته شد. اسپرمهای طبیعی شامل ناحیه سر، تنه و دم که در چهار گوشه مربع و مرکز مربع مرکزی وجود داشتند، توسط میکروسکوپ نوری و با بزرگنمایی400× شمارش شدند. همچنین اسپرمهایی که با لبه سمت چپ و بالای مربعها برخورد کرده بودند نیز شمارش شدند (14،15).
ارزیابی ناهنجاریهای مورفولوژیکی اسپرم: اسمیرهای تهیه شده از ائوزین- نیگروزین (در زمان تشریح تهیه شد) برای بررسی ناهنجاریهای مورفولوژیکی اسپرم مورد استفاده قرار گرفت. با بزرگنمایی ×1000 میکروسکوپ نوری و شمارش 200اسپرم، درصد اسپرمهایی با مورفولوژی طبیعی گزارش شد. ناهنجاریهای اسپرم در سر، گردن، زائدهسیتوپلاسمی و دم مشاهده میشود (15).
بررسی تحرک اسپرم: مطابق بر دستورالعمل WHO بررسی تحرک اسپرم انجام گرفت. برای انجام این کار به مدت 10 دقیقه، کل وسایل لازم شامل لام نئوبار و لامل و سمپلر در انکوباتور37 درجه سانتیگراد قرار داده شدند. پس از آن 10میکرولیتر از سوسپانسون محیط کشت بر روی لام نئوبار ریخته شد و سپس با بزرگنمایی 400× میکروسکوپنوری، تحرک اسپرم مورد بررسی قرار گرفت. 5 میدان دید به شکل اتفاقی انتخاب گردیده و 200 اسپرم موش برای نشان دادن تحرک بررسی گردید و درصد اسپرمهای دارای حرکت ساکن، غیرپیشرونده، پیشرونده محاسبه گردید. اسپرمهای ساکن فاقد هر نوع حرکت هستند و اسپرمهای پیشرونده به شکل فعال در یک مسیر خطی مستقیم یا دایرهای شکل بزرگ حرکت میکنند. اسپرمهای غیرپیشرونده در یک مسیر دایرهای شکل کوچک حرکت نموده و فقط یک حرکت کوچک دارند و به سمت جلو حرکتی ندارند (15).
ارزیابی قابلیت حیات اسپرم: برای بررسی سلامت غشای هسته، حیات اسپرم مورد بررسی قرار گرفت.اسمیرهایی که در زمان تشریح تهیه شدند مورد استفاده قرار گرفتند به این صورت که در بزرگنمایی 1000× میکروسکوپ نوری برای هر موش 200 اسپرم شمارش گردید. اسپرمهایی که سر صورتی تیره داشتند، اسپرم مرده در نظر گرفته شدند زیرا با آسیب غشا هسته رنگ ائوزین توانایی نفوذ به سیتوپلاسم هسته را به دست آورده است اما اسپرمهایی با سر سفید رنگ، اسپرم زنده در نظر گرفته شدند زیرا به علت یکپارچه بودن غشا هسته و سالم بودن آن رنگ ائوزین اجازه ورود به سیتوپلاسم هسته را نداشته است. در پایان نتیجه شمارش به شکل درصد حیات یعنی اسپرمهای زنده گزارش شد (15).
بررسیهای استریولوژیکی: جهت بررسیهای استریولوژیکی، پس از خارج کردن بیضه چپ از بدن و وزن نمودن آن، حجم بیضه به روش غوطهورسازی محاسبه شد. پس از آن بافت بیضه در فیکساتیو تازه تهیه شده MDF (Modified Davidson Fluid) به مدت زمان 7 روز فیکس گردیده شد و طی این مدت 2بار فیکساتیو عوض شد (14).
فیکساتیو MDF از ترکیب 50 میلیلیتر آب مقطر،30 میلیلیتر فرمالین 37 درجه، 15 میلیلیتر الکل مطلق و 5 میلیلیتر اسیداستیکگلاسیال تهیه شد. پس از پایان یافتن مرحله تثبییت بافتی، برای برشگیری IUR از بافت بیضه، روش Orientatorمورد استفاده قرار گرفت. بعد از آن با استفاده از دستگاه پاساژ، پاساژ بافتی انجام گردید. سپس از آنها بلوکهای پارافینی تهیه شد و توسط دستگاه میکروتوم برشهای 5 و 20 میکرونی از این بلوکها تهیه گردید و بعد از آن با استفاده از رنگآمیزی هماتوکسیلین-ائوزین اسلایدها جهت بررسی استریولوژی آماده شد. برای محاسبه میزان چروکیدگی بافتی دو یا سه برش تروکار از برشهای IUR قبل از پاساژ بافتی تهیه و شعاع آنها اندازه گرفته شد. سپس بعد از مراحل پاساژ بافتی و رنگآمیزی شعاع آنها مجددا اندازهگیری شد و میزان چروکیدگی محاسبه گردید. برای محاسبه حجم کل بیضه، حجم بیضه در میزان چروکیدگی ضرب شد (18-16). برای محاسبه حجم لولههای منیساز و بافت بینابینی بهطور میانگین ۵ میدان دید از هر اسلاید ۵ میکرونی با میکروسکوپ Olympus12 DP و بزرگنمایی ۱۰۰ انتخاب شد و با قرار دادن بافت و نقاط برخوردکرده به لولههای منیساز و بافت بینابینی شمارش شد و بدین ترتیب چگالی حجمی هر یـک بـرآورد شـد. سپس با ضرب چگالی حجمی هر یک در حجم نهایی بیضه حجم هر یک محاسبه شد (17).
بررسیهای بیوشیمیایی: سرم خون از قلب موش تهیه و در فریزر 80- درجه سانتیگراد نگهداری شد و برای بررسیهای بیوشیمیایی و اندازهگیری میزان مالوندیآلدئید، سطح تستوسترون و ظرفیت آنتیاکسیدان تام مورد استفاده قرار گرفت.
بررسی میزان مالوندیآلدئید سرم: ابتدا معرف واکنش شامل تریکلرواستیکاسید 15درصد، تیوباریکاسید 375 درصد و اسیدکلریدریک 25 درصد تهیه گردید. سپس 100 میکرولیتر از سرم خون با 200 میکرولیتر از معرف، مخلوط شد و نمونهها به مدت 15 دقیقه در بنماری قرار گرفتند. بعد از خارج کردن نمونهها از بنماری، با آب سرد خنک شده و 10 دقیقه با دور g 1000سانتریفیوژ شدند. بعد از آن مایع رویی جدا گردیده و جذب آن در طول موج 532 نانومتر توسط دستگاه اسپکتوفوتومتر قرائت شد. غلظت مالوندیآلدئید با استفاده از ضریب خاموشی که 106×56/1میباشد محاسبه شد و بر حسب نانومول بر لیتر (nmol/l)گزارش شد (19،20).
بررسی میزان تستوسترون سرم خون: سنجش مقدار تستوسترون با روش الایزا و مطابق دستورالعمل کیت تهیه شده انجام شد.
CatNo.3725-300A.Accubind ELISA.Monobind.USA
برای سنجش میزان تستوسترون سرم، ابتدا نمونهها در چاهک ریخته شد و بعد از آن محلول تستوسترون و آنتیتستوسترون اضافه گردید و سپس به مدت 90 دقیقه در 37 درجه سانتیگراد انکوبه گردید. پس از آن چاهکها با آب دیونیزه شستشو شده و سوبسترا به هر یک از چاهکها اضافه گردید و به مدت 20 دقیقه انکوبه گردید. سپس محلول متوقف کننده اضافه گردید و واکنش متوقف شد و جذب آن با دستگاه الایزا در 450 نانومتر قرائت گردید (21).
اندازهگیری ظرفیت آنتیاکسیدان تام (Total Antioxidant capacity): با استفاده از کیت Naxifer TM Total Antioxidant capacity Assay Kit میزان ظرفیت آنتیاکسیدان بر اساس روش FRAP سنجیده شد. تغییر رنگ بهدست آمده بهوسیله میکروپلیت ریدر اندازهگیری گردید و در نهایت برای بهدست آوردن مقدار کمی ظرفیت آنتیاکسیدانی از استاندارد و نمودار حاصل استفاده گردد. ابتدا 5 میکرولیتر از نمونه استاندارد تهیه شده در چاهکهای پلیت 96 خانه ریخته شد. سپس به همه خانههای حاوی نمونه و یا استاندارد،250 میکرولیتر از محلول کار آماده شده اضافه گردید و سپس جذب نوری نمونهها بعد از 5 دقیقه در طول موج 593 (بین 570 تا630) نانومتر قرائت گردید (22).
تجزیه و تحلیل آماری
ابتدا از آزمون آماری Smirnov-Kolmogorov و Wilk-Shapiro به منظور نرمال بودن دادهها و آزمون آماری Levene جهت برابری واریانسها استفاده شد. در ادامه با در نظر گرفتن سطح معنیداری0/05> p از روش آنالیز واریانس یک طرفه(ANOVA )و تست آماری ( test Tukey )جهت تحلیل دادهها مورد استفاده قرار گرفت.
نتایج
در گروه الکارنیتین نسبت به گروه کنترل در وزن نهایی موشها، کاهش وزن معناداری مشاهده شدp=0/03) ). اما گروه تیمار با نانوذراتنقره نسبت به گروه کنترل تغییر معناداری را نداشته است (p=0/77). وزن موشها در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (P=0/96). اختلاف معناداری در وزن بیضه چپ در بین 4گروه آزمایشی مشاهده نشده است (p=0/19)(جدول1).
تعداد اسپرم: در گروه نانوذراتنقره، میانگین تعداد اسپرم نسبت به گروه کنترل و گروه الکارنیتین دارای کاهش معناداری شده است (p=0/001) گروه نانوذراتنقره و الکارنیتین در برابر گروه نانوذراتنقره دارای افزایش معناداری شده است (p=0/004). گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (P=0/99). (جدول2).
حیات اسپرم: میانگین حیات اسپرم در گروه نانوذراتنقره در مقایسه با میانگین گروه کنترل و گروه الکارنیتین کاهش معناداری را نشان داد (p=0/001). همچنین درصد حیات اسپرم در گروه تیمار همزمان نسبت به گروه نانوذراتنقره افزایش معناداری را نشان داد (p=0/03). در گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری را نشان نداد (p=0/39). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (p=0/59) (جدول2).
مورفولوژی طبیعی اسپرم: میزان مورفولوژی طبیعی در گروه نانوذراتنقره نسبت به گروه کنترل و الکارنیتین کاهش معناداری داشته است (p=0/001). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره میزان مورفولوژی طبیعی افزایش معناداری داشته است (p=0/001)(جدول2).
تحرک اسپرم: درصد اسپرمهای پیشرونده در گروه تیمار با نانوذراتنقره در مقایسه با گروه کنترل و الکارنیتین کاهش معناداری داشته است (p=0/001). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین درصداسپرمهای پیشرونده در مقایسه با گروه نانوذراتنقره افزایش معناداری داشته است (p=0/001)(جدول2). در گروه نانوذراتنقره میانگین اسپرمهای بدون حرکت و ساکن در مقایسه با گروههای دیگر،افزایش معناداری را نشان داد (p=0/001). اسپرمهای ساکن در گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است و به گروه کنترل نزدیک شده است (p=0/001)(جدول2). در گروه تیمار با الکارنیتین درصد اسپرمها با حرکت درجا در گروه الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است (p=0/01). ولی در مقایسه با گروه کنترل و گروه تیمار همزمان نانوذراتنقره و الکارنیتین تفاوت معناداری مشاهده نشد (p=0/68)(جدول2).
بررسیهای استریولوژیکی
بررسی کیفی هیستوپاتولوژیک بیضه: در گروه تیمار با نانوذراتنقره لولههای منیساز کاهش یافته و بافت بینابینی دچار افزایش شده بود (علامت ستاره). اپیتلیوم لولههای منیساز دچار ساختار نامنطم شده و پیوستگی خود را از دست دادهاند همچنین ارتفاع اپیتلیومزایشی نیز کاهش را نشان داد (علامت فلش). اسپرمها در لوله منیساز نسبت به گروه کنترل و دیگر گروهها کاهش داشته است. در گروه تیمار همزمان آثار تخریبی نانوذراتنقره توسط الکارنیتین تقریبا اصلاح شده بود. لولههای منیساز چیدمانی تقریبا مشابه گروه کنترل داشتند و حجم فضای بینابینی کاهش داشته است. اپتلیوم زایشی لولههای منیساز از ساختار نرمال و طبیعی برخوردار بودند. در گروه الکارنیتین لولههای منیساز همانند گروه کنترل بوده و دچار آسیب یا تغییری نشده است (شکل1).
حجم کل بافت بیضه، لولههای منیساز و بافت بینابینی
حجم کل بیضه: حجم کل بافت بیضه در بین گروههای آزمایشی اختلاف معناداری را نشان نداد (p=0/58).
حجم لوله منیساز: حجم لوله منیساز هیچ تفاوت معناداری را نشان نمیدهد (p=0/77).
حجم بافت بینابینی: حجم بافت بینابینی در گروه نانوذراتنقره افزایش معناداری در مقایسه با گروه کنترل داشت، همچنین حجم بافت بینابینی در گروه تیمار همزمان نانوذراتنقره و الکارنیتین کاهش معناداری در مقایسه با گروه نانوذراتنقره داشته است (p=0/036). حجم بافت بینابینی در گروه الکارنیتین کاهش معناداری در مقایسه با گروه نانوذراتنقره داشته است (p=0/005).(جدول3).
بررسیهای بیوشیمایی
بررسی میزان مالوندیآلدئید: میزان مالوندیآلدئید در گروه نانوذراتنقره افزایش معناداری در مقابل گروه کنترل (p=0/023) و گروه الکارنیتین (p=0/018) را نشان داد. گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است و به گروه کنترل تقریبا نزدیک شده است (p=0/01)(جدول4).
بررسی میزان آنتی اکسیدان تام: ظرفیت آنتیاکسیدان کل (TAC) در گروه نانوذراتنقره در برابر گروه کنترل کاهش معناداری را نشان میدهد (p=0/001). مقدار TACدر گروه تیمار همزمان نانوذراتنقره و الکارنیتین افزایش معناداری در برابر گروه نانوذراتنقره نشان میدهد (p=0/001)(جدول4).
بررسی میزان تستوسترون سرم خون: هورمون تستوسترون در گروه نانوذراتنقره نسبت به گروه کنترل (p=0/006) و گروه الکارنیتین کاهش معناداری داشته است (p=0/035). در گروه تیمار همزمان نسبت به گروه نانوذراتنقره افزایش معناداری دیده میشود (p=0/045)(جدول4).
جدول1: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین (100mg/kg.bw/d) در مدت 35 روز بر روی میانگین وزن موش و وزن بیضه
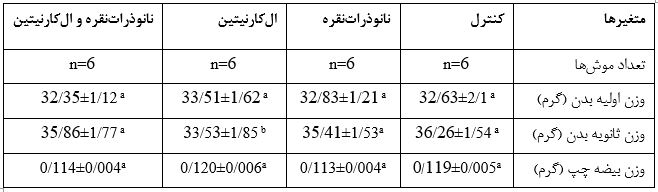
دادههای آماری بهوسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل mean± sdذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
جدول2: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین(100mg/kg.bw/d) به مدت 35 روز بر روی پارامترهای اسپرم موش نر نژاد
NMRI
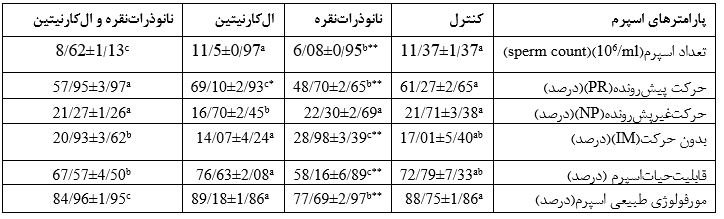
دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل Mean± SDذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.
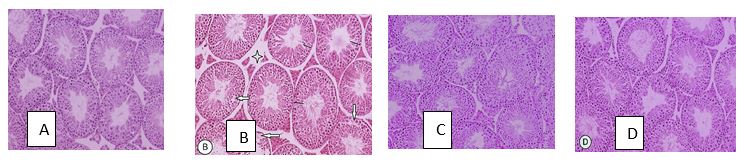
شکل1: تصویرهای میکروسکوپی از تاثیر نانوذراتنقره (500mg/kg.bw.d)و الکارنیتین (100mg/kg.bw.d) بر روی بافت بیضه موشهای NMRI به مدت 35 روز.
(A). درگروه کنترل، لولههای منیساز دارای ساختار منظم هستند و اپیتلیوم زایشی نیز مرتب است و در لومن تراکم اسپرم بالا است.(B). در گروه نانوذراتنقره، لولههای منیساز آرایش نامنظم داشته و حجم فضای بینابینی افزایش یافته است (علامت ستاره) و ارتفاع اپیتلیوم زایشی کم شده است.(C). در گروه تیمار الکارنیتین، لولههای منیساز آرایش طبیعی دارند.(D). در گروه تیمار همزمان تقریبا لولههای منیساز آرایش طبیعی و منظم دارند. تصاویر در ضخامت 5 میکرون و رنگآمیزی هماتوکسیلین -ائوزین تهیه گردیده است[بزرگنمایی ×200 ].
جدول3: بررسی اثر نانوذراتنقره (500میلیگرم/کیلوگرم وزن بدن/روز) و الکارنیتین (100میلیگرم/کیلوگرم وزن بدن/روز) به مدت 35 روز بر روی میانگین حجم کل بیضه، حجم لولههای منیساز، حجم بافت بینابینی(mm3 )در موشهای NMRI
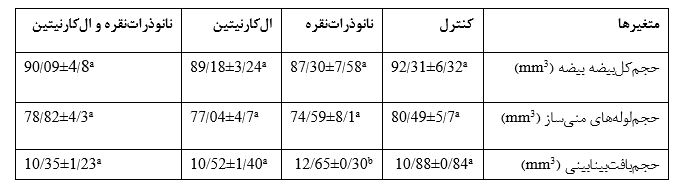
دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل mean± sdذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.
جدول4: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین(100mg/kg.bw/d) به مدت 35 روز بر روی میانگین ظرفیت آنتیاکسیدان کل و میزان غلظت مالوندیآلدئید به عنوان شاخص استرساکسیداتیو و میزان تستوسترون سرم در موشهای نر نژاد NMRI
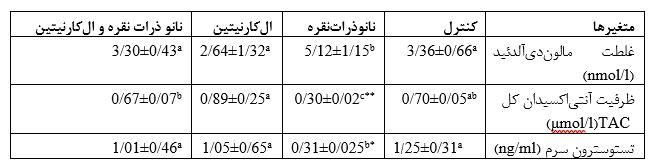
دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل Mean± SDذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.
بحث
در این پژوهش پارامترهای اسپرمی، وزن بیضه ، وزن موش، حجم کل بیضه و حجم بافت بینابینی وحجم لولههای منیساز، غلظت مالوندیآلدئید و ظرفیت آنتیاکسیدان تام و هورمون تستوسترون مورد بررسی قرار گرفتند. در این قسمت نتایج به دست آمده تفسیر میگردند. پامترهای اسپرمی یعنی تعداد، تحرک، مورفولوژی طبیعی و قابلیت حیات اسپرم درگروه نانوذراتنقره کاهش معناداری را در مقایسه با گروه کنترل نشان داد. در تحقیقات shariat zadeh و همکارانش در سال 2021، بر روی 24 سر موش نر بالغ نژاد NMRI و تیمار با نانوذراتنقره در دوز 500 mg/kg/day و آلفالیپویکاسید در دوز 100mg/kg/day به مدت 35روز و تجویز به شکل دهانی نشان داد که در گروه نانوذراتنقره، اسپرمهایی با حرکت پیشرونده در مقایسه با گروه کنترل کاهش داشته است. همچنین میانگین درصد اسپرمهای دارای مورفولوژی طبیعی نسبت به گروه کنترل کاهش معناداری داشته است. تعداد اسپرم نیز در گروه نانوذراتنقره در برابر گروه کنترل کاهش معناداری داشته است (23). بر اساس تحقیقات Razi و همکاران وی در سال 2021، تیمار موش نر بالغ با نانوذراتنقره در ابعاد 40 نانومتر و در دوزهای 50 و 100 و200 میکرولیتر و بهصورت دهانی در مدت زمان 5هفته نشان داده شد گروهی که بالاترین دوز مصرفی را دریافت کردند در مقایسه با گروه کنترل کاهش معناداری در تعداد اسپرم داشتهاند. همچنین با افزایش دوز مصرفی، درصد اسپرمهایی با حرکت پیشرونده سریع، کاهش معناداری نشان داد. با افزایش دوزمصرفی میزان اسپرمهایی با مورفولوژی غیرطبیعی افزایش یافت. همچنین با افزایش دوز نانوذراتنقره، قابلیت حیات نیز کاهش داشته است (24). بنابراین نانوذراتنقره با تشدید استرساکسیداتیو سبب کاهش کیفیت اسپرم میشود. برای بلوغ و ظرفیتیابی و تحرک اسپرم و همچنین واکنش آکروزومی و اتصال به زوناپلاسیدا و تخمک، میزان نرمال رادیکال آزاد لازم است اما با ایجاد استرساکسیداتیو سبب آسیب به اسپرم میشود. نانوذراتنقره با جمع شدن در اپیدیدیم از بلوغ اسپرمها ممانعت کرده و بر روی تعداد اسپرم اثرگذار است (25). در واقع الکارنیتین با برداشتن گلوکز بهوسیله سلولهای سرتولی بر تحریک بلوغ اسپرم اثر میگذارد. الکارنیتین میزان فاگوسیتوز گامتها را کاهش داده و به این طریق تعداد اسپرم را افزایش میدهد. بالاترین میزان الکارنیتین در اپیدیدیم است که در بلوغ و تحرک اسپرمها نقش دارد. الکارنیتین انتشار آنزیمهای سلولی و اکسیژن مصرفی را مهار میکند و به این شکل قابلیت زنده ماندن سلول را افزایش میدهد. در حقیقت ذخیره آندروژنیک الکارنیتین آزاد در اسپرم بالغ و انزال یافته ضمانتی برای قابلیت زنده ماندن اسپرم میباشد (26). در این پژوهش حجم بافت بینابینی در گروه نانوذراتنقره در مقایسه با گروه کنترل افزایش معناداری را نشان داد اما حجم کل بیضه و لولههای منیساز دچار تغییرات معناداری نشده است. در سال 2019،El-sharkawy و همکارانش نشان دادند که با تیمار نانوذراتنقره در ابعاد 34-9 نانومتر در طولانیمدت 6 ماه بهصورت 2 بار در هفته بر روی موشهای نر و با دوزmg/kg.bw 5 و 10 منجر به ایجاد تغییرات پاتولوژیک بیضه میشود. سلولهای سرتولی واکوئله شده و آتروفی لولههای منیساز را نشان داد. سلولهای اسپرماتوگونی ناهنجاریهای مورفولوژیکی را داشته است. در سال 2020، mohamadi و همکارانش اثر مکمل الکارنیتین در جیره جوجه خروسهای نابالغ را مورد بررسی قرار دادند. به این شکل که 12 قطعه خروس را در مدت زمان 22 هفته را با سطوح صفر و 250 میلیگرم بر کیلوگرم الکارنیتین در 6 تکرار مورد بررسی قرار دادند. نشان داده شد که سلولهای سرتولی به شکل معناداری افزایش داشته است. بنابراین بر میزان بافت بینابینی موثر است. شاخص اسپرماتوژنز بهطور معناداری نیز افزایش یافته بود (27). در واقع با کاهش سلولهای جنسی توسط نانوذراتنقره، افزایش بافت بینابینی رخ میدهد. نانوذراتنقره سبب ایجاد استرساکسیداتیو شده و به این روش سلولهای جنسی را از بین میبرد و سبب کاهش حجم اپیتلیوم زایشی میگردد. تاثیرات نانوذراتنقره به دوز مصرفی و مدت زمان تیمار و نوع تجویز و نوع حیوان وابسته است. در تجویز خوراکی جذب نانوذرات به کندی رخ میدهد و به این دلیل نتوانست در مدت زمان 35 روز بر روی حجم بیضه و لولههای منیساز تاثیری داشته باشد و حجم آن را کاهش نداد (28). حجم بافت بینابینی در گروه تیمار همزمان نانوذراتنقره و الکارنیتین، به سطح گروه کنترل نزدیک شده بود و در واقع الکارنیتین توانسته بود با اثر آنتیاکسیدانی خود از ایجاد استرساکسیداتیو جلوگیری کند و در نتیجه مانع از بینرفتن سلولهای لیدیگ شود و به این طریق حجم بافت بینابینی در این گروه به سطح گروه کنترل رسیده بود. وزن موشهای گروه الکارنیتین نسبت به گروه کنترل دچار کاهش شده است. در وزن موشهای گروه نانوذراتنقره تفاوت معناداری نشان داده نشده است. در بین 4 گروه، تفاوت معناداری در وزن بیضه مشاهده نشد. مطابق تحقیقات Shariatzadeh و همکارانش در سال 2020، تیمار موشهای نر نژادNMRI با نانوذراتنقره با ابعاد 40نانومتر و در دوزmg/kg/day 500 در مدت زمان 35 روز، در وزن موشها پس از پایان دوره تیمار اختلاف معناداری مشاهده نشده است اما میانگین وزن بیضه در گروه نانوذراتنقره نسبت به گروه کنترل کاهش معناداری را نشان میدهد (29). نانوذراتنقره سبب تغییر در وزن موش و بیضه نمیشود و تنها سبب ایجاد تغییر در عملکرد بیضه میشود. بنابراین میتوان این گونه استدلال کرد که نانوذراتنقره در مدت زمان کوتاه بر عملکرد دستگاه گوارش اثرگذار نیست و به این دلیل سبب ایجاد تغییر در وزن بدن و بیضه نمیشود (25). درگروه الکارنیتین کاهش وزن معنادار در مقایسه با گروه کنترل مشاهده شده اما بر وزن بیضه اثرگذار نبوده است. الکارنیتین در وزن بیضه بیاثر بود اما به دلیل نقش الکارنیتین در متابولیسم چربیها سبب کاهش وزن در موش شده است. الکارنیتین موجب کاهش تجمع لیپید در عضله شده و باعث کاهش درصد چربی بدن میگردد (26). در این پژوهش نشان داده شد که میزان MDA در گروه نانوذراتنقره نسبت به گروه کنترل بهطور معناداری افزایش یافته است. در سال2019، بر اساس تحقیقات El-sharkwy و همکارانش نشان داده شد که تیمار موش صحرایی نر با نانوذراتنقره در ابعاد 34-9 نانومتر و در دوزهای mg/kg.bw 5/36 وmg/kg.bw 13/4 و به صورت تجویز دهانی و در مدت زمان 6 ماه، سبب افزایش میزان مالوندیآلدئید و پراکسیداسیونلیپیدی در بیضه شده و میزان فعالیت SOD را کاهش داده است (27). تحقیقات shariat zadeh و همکارانش در سال 2021، بر روی 24سر موش نر بالغ نژاد NMRI و تیمار با نانوذراتنقره در دوز 500 mg/kg/day و آلفالیپویکاسید در دوز 100mg/kg/day به مدت 35روز و تجویز به شکل دهانی نشان داد که میزان مالوندیآلدئید در گروه نانوذراتنقره نسبت به گروه کنترل افزایش معناداری داشته است (23). Abdel-Emam و همکارانش در سال 2021، اثر درمانی الکارنیتین بر 30سر موش صحرایی نر بالغ نژاد ویستار که تحت سمیت استات سرب بودند را مورد بررسی قراردادند. دوز الکارنیتین mg/kg 100 بوده و به شکل تجویز دهانی و تیمار در مدت زمان 40 روز انجام شد. نتیجه نشان داد در گروه تیمار همزمان میزان MDA در مقایسه با گروه تیمار با استات سرب کاهش یافته و میزان TAC افزایش یافته است (30). بر اساس تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و 100 و مونوسدیمگلوتامات در دوز3 g/kg به موشهای صحرایی نر بالغ و بهصورت تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات، در هر دو دوز الکارنیتین سبب کاهش قابلتوجهی در سطح MDA نسبت به گروه مونوسدیمگلوتامات شده است (31). بنابراین نانوذراتنقره با کاهش سیالیت غشا اسپرم و همچنین پارامترهای اسپرمی سبب تشدید اثرات پراکسیداتیوی در مایع سمینال میشود. در واقع نانوذراتنقره با ایجاد اختلال در زنجیره تنفسی میتوکندریها و تحریک تولید ROS در بافتهای متفاوت سبب پراکسیداسیون لیپیدی در غشا میگردد (32). در این پژوهش در گروه تیمار همزمان نانوذراتنقره و الکارنیتین میزان مالوندیآلدئید نسبت به گروه نانوذراتنقره کاهش داشته است و سطح مالوندیآلدئید به گروه کنترل رسیده است. الکارنیتین با مداخله اسید آراشیدونیک تشکیلدهنده فسفولیپو و همچنین پروتئین کینازc باعث کاهش پراکسیداسیون لیپیدی و استرساکسیداتیو میشود (33). میزان TAC در گروه نانوذراتنقره نسبت به گروه کنترل کاهش یافت و در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه نانوذراتنقره میزانTAC افزایش معناداری را نشان داد. مطابق تحقیقات Shariat zadeh و همکارانش در سال 2020، تیمار موشهای نر نژادNMRI با نانوذراتنقره در ابعاد 40 نانومتر و در دوزmg/kg/day 500 در مدت زمان 35 روز، کاهش معناداری در ظرفیت آنتیاکسیدان کل گروه نانوذراتنقره نسبت به گروه کنترل نشان داده شد (29). مطابق تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و100 و مونوسدیمگلوتامات در دوز 3g/kg بر روی موشهای صحرایی نر بالغ و بهصورت تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات، میزان ظرفیت آنتیاکسیدان کل دچار افزایش معنادار شد. در گروه تیمار با الکارنیتین میزان آنتیاکسیدان در مقایسه با گروه کنترل افزایش داشته است اما از لحاظ آماری این افزایش معنادار نبوده است (31). در واقع نانوذراتنقره تنش استرساکسیداتیو را ایجاد کرده و فعالیت آنتیاکسیدانهای داخل بدن را کاهش میدهد. مطابق پژوهش حاضر، در گروه تیمار همزمان نانوذراتنقره+الکارنیتین در مقایسه با گروه نانوذراتنقره، میزان ظرفیت آنتیاکسیدان کل افزایش معناداری را نشان داد. در واقع الکارنیتین با حذف یونهای آهن و رادیکالهای آزاد سبب افزایش میزان آنتیاکسیدان کل میشود. همچنین با افزایشATP فعالیت آنزیمهای آنتیاکسیدانی را در سلول بهبود میبخشد (29). در این پژوهش، هورمون تستوسترون در گروه نانوذراتنقره نسبت به گروه کنترل دچار تغییر معناداری گردید. Olugbodi و همکارانش در سال 2020، اثر نانوذراتنقره را بر روی هورمونهای جنسی و پارامترهای اسپرمی در موش صحرایی نر مورد بررسی قرار دادند. به این ترتیب30 سر موش در مدت زمان 28روز بهصورت پوستی نانوذراتنقره را در دوزهای 0،10،50 میلیگرم بر کیلوگرم وزن بدن، دریافت کردند. نتیجه نشان داد که هورمون تستوسترون در موشهای دریافتکننده نانوذراتنقره متناسب با دوز دریافتی، نسبت به گروه کنترل کاهش داشته است (34). طبق تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و100 و همچنین مونوسدیمگلوتامات در دوز 3g/kg به موشهای صحرایی نر بالغ و به شکل تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات در هر دو دوز، الکارنیتین سبب افزایش تستوسترون به شکل معنادار نسبت به گروه مونوسدیمگلوتامات شده است و گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (31). در واقع نانوذراتنقره بر روی بیان ژن Star موثر میباشد، این پروتئین در منتقل کردن کلسترول به غشا داخل میتوکندری و همچنین افزایش دادن استروئیدسازی موثر است. بنابراین این احتمال وجود دارد که نانوذراتنقره با کاهشدادن بیان این ژن از انتقال کلسترول به غشا داخلی میتوکندری ممانعت کرده و در نتیجه از تبدیل شدن کلسترول به پرگننولون جلوگیری کرده و به این ترتیب میزان تستوسترون کاهش مییابد (35). در این پژوهش در گروه تیمار همزمان نانوذراتنقره و الکارنیتین افزایش معنادار تستوسترون نسبت به گروه نانوذراتنقره نشان داده شد. گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری را نشان نداشته است. واقع الکارنیتین با کاهش تخریب سلولهای لیدیگ میتواند سطح هورمون تستوسترون را افزایش دهد. پیشنهاد میشود مطالعات مولکولی تکمیلکننده صورت گیرد و همچنین تاثیر این دارو بر اعضای دیگر مانند کبد و کلیه و... انجام شود.
نتیجهگیری
نتایج این پژوهش نشان داد که نانوذراتنقره در ابعاد کوچک 20نانومتر باعث القای استرساکسیداتیو شده و در نتیجه مسمویت و اختلال در دستگاه تولیدمثلی نر را ایجاد میکند. آنالیز آماری دادهها نشان داد که نانوذراتنقره با کاهش کیفیت لولههای منیساز، تعداد سلولهای اسپرماتوژنیک و همچنین ایجاد اختلال در فرایند اسپرماتوژنز در بیضه سبب آپاپتوزیس سلولهای لولههای منیساز میگردند. همچنین اختلال در سطح هورمون جنسی تستوسترون دیده شد و در واقع کاهش داشته است. در کنار آسیبهای وارد شده به بافت بیضه، پارامترهای اسپرم یعنی تعداد، تحرک، مورفولوژی و حیات اسپرم نیز دچار کاهش شده است. اما الکارنیتین در گروه تیمار همزمان نانوذراتنقره و الکارنیتین، اثرات سمی ناشی از نانوذراتنقره را بهبود بخشیده و ظرفیت آنتیاکسیدانتام را دچار افزایش نموده است. بنابراین از پراکسیداسیون لیپیدی جلوگیری نمود. پس باید گفت که الکارنیتین مانع آسیبهای بافت بیضه شده و از تغییرات آن جلوگیری کرد. در واقع الکارنیتین با ایجاد تعادل در سطح هورمون تستوسترون، پارامترهای اسپرمی را در برابر سمیت ناشی از نانوذراتنقره بهبود بخشید.
سپاسگزاری
این مقاله حاصل پایاننامه دانشجویی بوده است. از کلیه افرادیکه در انجام این تحقیق ما را یاری دادند، تشکر و قدردانی میشود.
حامیمالی: معاونت پژوهشی و فناوری دانشگاه اراک
تعارضدرمنافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه اراک تایید شده است (کد اخلاق : IR.ARAKU.REC.1401.128).
مشارکت نویسندگان
دکتر سید محمدعلی شریعتزاده در ارائه ایده، دکتر سید محمدعلی شریعتزاده، سمیرا مقدسی، مهدیه عمادی در طراحی مطالعه، دکتر سید محمدعلی شریعتزاده، سمیرا مقدسی، مهدیه عمادی در جمعآوری دادهها، سمیرا مقدسی، مهدیه عمادی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
مشکلات باروری در انسانها روزبهروز در حال افزایش است. در واقع ناباروری و مشکلات فردی و اجتماعی ناشی از آن یکی از مشکلات اصلی است که زندگی زوجهای جوان را مختل کرده است. ناباروری و عدم توانایی فرد برای انجام طبیعی فرآیند تولیدمثل و صاحب فرزند شدن به عنوان یکی از تجربیات تلخ و دردآور زندگی است که با توجه به شرایط اجتماعی میتواند برای زوجها تبدیل به یک بحران اساسی شود (1). ناباروری بهعنوان عدم توانایی بچهدار شدن بعـد از حـداقل یـکسـال ازدواج بـدون اسـتفاده از وسـایل پیشـگیری اطـلاق میشود. در حدود 12-8 درصد از زوجها دچار ناباروی هستند، که در حدود 35 درصد ناباروریها مربوط به مردان و 25 درصد مربوط به زنان است (2). بسیاری از تحقیقات اثرات مضر عوامل محیطی از جمله مـواد سمی، تشعشعات و آفتکشها روی ناباروری مردان را نشـان داده و مشخص کـرده اسـت کـه آفتکشها و مواد سمی میتوانند باعث کاهش اسپرم در مردان شود (3.4). با توجه به تحقیقات صورت گرفته مواد شیمیایی و سمی با باروری مردان مرتبط است. یکی از این مواد شیمیایی نانوذراتنقره است. نانوذراتنقره یکی از ارزشمندترین محصولات نانوتکنولوژی است که در دنیای امروز در علوم مختلف همانند پزشکی و بیولوژی بهکار برده میشود. در حوزه پزشکی در مواردی همچون پوششی برای ترمیم زخمها، دندانپزشکی و تهیه ابزار جراحی مورد استفاده قرار میگیرد (5). نانوذراتنقره پرکابردترین نانوذرات است و میزان مصرف آن سالانه 55 تن است. علت اصلی کاربرد گسترده نانوذراتنقره خواص ضدمیکروبی آن است. این نانوذرات دارای خواص ضدباکتریایی، ضد ویروسی و ضدقارچی میباشد (6). نانوذرات با توجه به خطرات احتمالی برای سلامت انسان خطرزا هستند و با توجه به عبور نانوذرات از طریق موانع بیولوژیکی و نفوذ به بافتهای تولیدمثلی این امر بهخصوص در مورد سمیتشناسی تولیدمثلی ضروری است، زیرا این ذرات بر عملکرد سیستم تولیدمثلی و توانایی زنده ماندن اسپرم و تکوین جنین اثرگذار است بنابراین هر گونه کاستی در این زمینه بر بقای نسل و باروری اثرگذار میباشد (7). مطالعات انجام شده بر روی مدلهای حیوانی نشان دادهاند که نانوموادنقره توانایی عبور از سد خونی بیضه را دارند و در سلولهای سوماتیک و ژرمینال بیضه جمعآوری میگردند. تجمع قابلتوجهی از این مواد در سلولهای سرتولی و هستههای اسپرماتوسیت گزارش گردیده است. امروزه محققان بر این باورند که غنی کردن محیط اطراف اسپرم با آنتیاکسیدانها، احتمالاً منجر به حفاظت اسپرماتوزوا در برابر آسیبهای القاشده با استرس اکسیداتیو میشود (8). سیستم آنتیاکسیدانتی بدن در برابر آسیبهای ناشی از رادیکالهای آزاد بسیار کارآمد است و در واقع مواد آنتیاکسیدانتی با غیرفعال کردن و حذف گونههای اکسیژن فعال(ROS)، از سمیت بافت جلوگیری میکند (9). در واقع ترکیبات آنتیاکسیدانی میتوانند باعث محافظت اسپرماتوزوا در برابر ROS تولیدشده توسط اسپرماتوزوای غیرطبیعی، ممانعت از قطعهقطعه شدن DNA، بهبود کیفیت مایع منی در افراد سیگاری، کاهش آسیب سرما به اسپرماتوزوا، ممانعت از بلوغ اسپرم نابالغ و افزایش حرکت اسپرماتوزوا شوند (10). الکارنیتین برای اولین بار از گوشت گاو جدا گردید و این ماده از مشتقات اسیدآمینه لیزین و متیونین میباشد. الکارنیتین در برخی مواد غذایی مانند گوشت طیور، ماهی و برخی فراوردههای لبنی وجود دارد (11). برای بتااکسیداسیون اسیدهای چرب با زنجیره بلند در میتوکندری، الکارنیتین ضروری است. اسیدهای چرب قبل از آن که به میتوکندری وارد شوند باید فعال شوند مولکولهای زنجیره بلند استیلکوآ بدون وجود الکارنیتین توانایی عبور از غشای داخلی میتوکندری را ندارند. بعد از وارد شدن به داخل میتوکندری بتااکسیداسیون و تولید آدنوزینتریفسفات شروع میگردد (9،12). الکارنیتین یک شبهویتامین است که دارای ویژگیهای آنتیاکسیدانی و آنتیآپاپتوزیس در سیستم تناسلی نر میباشد و در واقع الکارنیتین در تنظیم عملکرد سلولهای سرتولی یک تنظیمکننده اساسی است و در رفع نواقص اسپرم موثر شناخته شده است (13). با توجه به اینکه نانوذرات نقره در زندگی روزمره کاربردهای فراوانی دارد و اثرات آن بر ناباروری غیر قابلچشمپوشی است، در این پژوهش بر آن شدیم اثر استریولوژیکی و بیوشیمیایی الکارنیتین بر بافت بیضه موشهای نژاد NMRI تیمار شده با نانوذراتنقره را مورد بررسی قرار دهیم.
روش بررسی
به منظورانجام این پژوهش تجربی 24 سر موش نر بالغ نژاد NMRI به میانگین وزنی 2± 32 گرم به شکل تصادفی از خانه حیوانات دانشگاه اراک تهیه شد و نگهداری گردید. موشها در اتاق حیوانات دانشگاه اراک در شرایط کنترل شده (دوره روشنایی 12 ساعت روشنایی/ تاریکی) و دمای 2±22 درجه سانتیگراد و 60-40 درصد رطوبت قرار داده شدند. برای سازگاری با محیط جدید، ضمن دسترسی راحت به آب و غذای مناسب و مطابق با قوانین نگهداری از حیوانات آزمایشگاهی، به مدت 2هفته موشهای موردنظر در قفسهای جداگانه نگهداری شدند تا سازگاری ایجاد گردد و استرس در حیوانات از بین برود. در مدت زمان تیمار نیز موشها در شرایط استاندارد نگهداری شدند و اصول کار آزمایشگاهی با حیوانات مطابق اصول کمیته ملی اخلاق حمایت از حیوانات آزمایشگاهی رعایت گردید. موشها بر اساس وزن به4 گروه تقسیم شدند یعنی میانگین وزنی در 4گروه برابر است: (1). گروه کنترل (2).گروه تیمار با نانوذراتنقره (500 میلیگرم/کیلوگرم وزن بدن/ روز) به شکل گاواژ (3). گروه تیمار با الکارنیتین (100 میلیگرم/کیلوگرم/ روز) به شکل گاواژ (4). گروه تیمار همزمان نانوذراتنقره و الکارنیتین به شکل گاواژ (12). تیمار در کلیه گروهها 35 روز انجام گرفت.
تشریح حیوانات: بعد از پایان یافتن مدت زمان تیمار یعنی 35روز، کل موشها تشریح گردیدند. برای تشریح، موشها با کتامینزایلازین (1 میلیگرم کتامین و 1/0 میلیگرم زایلازین) بیهوش شدند. پس از آن ناحیه شکم موش با استفاده از وسایل جراحی، شکافته گردید. خونگیری از بطن راست قلب موش به طور مستقیم توسط یک سرنگ استریل انجام شد. بعد از آن به منظور جداسازی سرم خون بهوسیله دستگاه سانتریفیوژ و به مدت زمان 15دقیقه و دور13000RPM سانتریفیوژگردیده و سرم جدا شده جهت بررسی فاکتورهای بیوشیمایی به فریزر 80- انتقال داده شد و نگهداری گردید. بعد از آن اسکروتوم باز شده و ناحیه دمی اپیدیدیم بیضه چپ را با قیچی استریل جدا کرده و به پلیت محتوی 5/1میلیلیتر محیط کشت (cat no .H -1318-1)Hamsʹ F10 در انکوباتور 37 درجه سانتیگراد انتقال داده تا پس از گذشت مدت زمان 5 دقیقه برای بررسی پارامترهای اسپرمی مورد استفاده قرار گیرد. اسمیرهایی از نمونههای اسپرم موش مطابق رنگآمیزی ائوزین-نیگروزین تهیه گردید. به این منظور محلول نیگروزین 10درصد و ائوزین 1درصد در نرمالسالین تهیه شده و سپس 20 میکرولیتر ائوزین و 10 میکرولیتر اسپرم در میکروتیوپ ریخته و ترکیب شده و بعد از آن 30 ثانیه در انکوباتور 37 درجه قرار داده شد. سپس 30 میکرولیتر رنگ نیگروزین نیز به آن اضافه شد و بعد از آن اسمیر از نمونه اسپرمها تهیه شدند. بیضه چپ جهت بررسیهای استریولوژی مورد استفاده قرار گرفت.
بررسی تعداد اسپرم: طبق دستورالعمل WHO شمارش اسپرم انجام گردید. سوسپانسیون اسپرمی شامل 100 میکرولیتر از اسپرم محیط کشت و 900 میکرولیتر از فیکساتیو اسپرمی تهیه شد. فیکساتیو اسپرمی از فرمالین 35درصد و بیکربنات سدیم تهیه گردید. برای انجام شمارش لام نئوبار مورد استفاده قرار گرفت. سپس 10 میکرولیتر از سوسپانسیون اسپرمی روی لام نئوبار ریخته شد. اسپرمهای طبیعی شامل ناحیه سر، تنه و دم که در چهار گوشه مربع و مرکز مربع مرکزی وجود داشتند، توسط میکروسکوپ نوری و با بزرگنمایی400× شمارش شدند. همچنین اسپرمهایی که با لبه سمت چپ و بالای مربعها برخورد کرده بودند نیز شمارش شدند (14،15).
ارزیابی ناهنجاریهای مورفولوژیکی اسپرم: اسمیرهای تهیه شده از ائوزین- نیگروزین (در زمان تشریح تهیه شد) برای بررسی ناهنجاریهای مورفولوژیکی اسپرم مورد استفاده قرار گرفت. با بزرگنمایی ×1000 میکروسکوپ نوری و شمارش 200اسپرم، درصد اسپرمهایی با مورفولوژی طبیعی گزارش شد. ناهنجاریهای اسپرم در سر، گردن، زائدهسیتوپلاسمی و دم مشاهده میشود (15).
بررسی تحرک اسپرم: مطابق بر دستورالعمل WHO بررسی تحرک اسپرم انجام گرفت. برای انجام این کار به مدت 10 دقیقه، کل وسایل لازم شامل لام نئوبار و لامل و سمپلر در انکوباتور37 درجه سانتیگراد قرار داده شدند. پس از آن 10میکرولیتر از سوسپانسون محیط کشت بر روی لام نئوبار ریخته شد و سپس با بزرگنمایی 400× میکروسکوپنوری، تحرک اسپرم مورد بررسی قرار گرفت. 5 میدان دید به شکل اتفاقی انتخاب گردیده و 200 اسپرم موش برای نشان دادن تحرک بررسی گردید و درصد اسپرمهای دارای حرکت ساکن، غیرپیشرونده، پیشرونده محاسبه گردید. اسپرمهای ساکن فاقد هر نوع حرکت هستند و اسپرمهای پیشرونده به شکل فعال در یک مسیر خطی مستقیم یا دایرهای شکل بزرگ حرکت میکنند. اسپرمهای غیرپیشرونده در یک مسیر دایرهای شکل کوچک حرکت نموده و فقط یک حرکت کوچک دارند و به سمت جلو حرکتی ندارند (15).
ارزیابی قابلیت حیات اسپرم: برای بررسی سلامت غشای هسته، حیات اسپرم مورد بررسی قرار گرفت.اسمیرهایی که در زمان تشریح تهیه شدند مورد استفاده قرار گرفتند به این صورت که در بزرگنمایی 1000× میکروسکوپ نوری برای هر موش 200 اسپرم شمارش گردید. اسپرمهایی که سر صورتی تیره داشتند، اسپرم مرده در نظر گرفته شدند زیرا با آسیب غشا هسته رنگ ائوزین توانایی نفوذ به سیتوپلاسم هسته را به دست آورده است اما اسپرمهایی با سر سفید رنگ، اسپرم زنده در نظر گرفته شدند زیرا به علت یکپارچه بودن غشا هسته و سالم بودن آن رنگ ائوزین اجازه ورود به سیتوپلاسم هسته را نداشته است. در پایان نتیجه شمارش به شکل درصد حیات یعنی اسپرمهای زنده گزارش شد (15).
بررسیهای استریولوژیکی: جهت بررسیهای استریولوژیکی، پس از خارج کردن بیضه چپ از بدن و وزن نمودن آن، حجم بیضه به روش غوطهورسازی محاسبه شد. پس از آن بافت بیضه در فیکساتیو تازه تهیه شده MDF (Modified Davidson Fluid) به مدت زمان 7 روز فیکس گردیده شد و طی این مدت 2بار فیکساتیو عوض شد (14).
فیکساتیو MDF از ترکیب 50 میلیلیتر آب مقطر،30 میلیلیتر فرمالین 37 درجه، 15 میلیلیتر الکل مطلق و 5 میلیلیتر اسیداستیکگلاسیال تهیه شد. پس از پایان یافتن مرحله تثبییت بافتی، برای برشگیری IUR از بافت بیضه، روش Orientatorمورد استفاده قرار گرفت. بعد از آن با استفاده از دستگاه پاساژ، پاساژ بافتی انجام گردید. سپس از آنها بلوکهای پارافینی تهیه شد و توسط دستگاه میکروتوم برشهای 5 و 20 میکرونی از این بلوکها تهیه گردید و بعد از آن با استفاده از رنگآمیزی هماتوکسیلین-ائوزین اسلایدها جهت بررسی استریولوژی آماده شد. برای محاسبه میزان چروکیدگی بافتی دو یا سه برش تروکار از برشهای IUR قبل از پاساژ بافتی تهیه و شعاع آنها اندازه گرفته شد. سپس بعد از مراحل پاساژ بافتی و رنگآمیزی شعاع آنها مجددا اندازهگیری شد و میزان چروکیدگی محاسبه گردید. برای محاسبه حجم کل بیضه، حجم بیضه در میزان چروکیدگی ضرب شد (18-16). برای محاسبه حجم لولههای منیساز و بافت بینابینی بهطور میانگین ۵ میدان دید از هر اسلاید ۵ میکرونی با میکروسکوپ Olympus12 DP و بزرگنمایی ۱۰۰ انتخاب شد و با قرار دادن بافت و نقاط برخوردکرده به لولههای منیساز و بافت بینابینی شمارش شد و بدین ترتیب چگالی حجمی هر یـک بـرآورد شـد. سپس با ضرب چگالی حجمی هر یک در حجم نهایی بیضه حجم هر یک محاسبه شد (17).
بررسیهای بیوشیمیایی: سرم خون از قلب موش تهیه و در فریزر 80- درجه سانتیگراد نگهداری شد و برای بررسیهای بیوشیمیایی و اندازهگیری میزان مالوندیآلدئید، سطح تستوسترون و ظرفیت آنتیاکسیدان تام مورد استفاده قرار گرفت.
بررسی میزان مالوندیآلدئید سرم: ابتدا معرف واکنش شامل تریکلرواستیکاسید 15درصد، تیوباریکاسید 375 درصد و اسیدکلریدریک 25 درصد تهیه گردید. سپس 100 میکرولیتر از سرم خون با 200 میکرولیتر از معرف، مخلوط شد و نمونهها به مدت 15 دقیقه در بنماری قرار گرفتند. بعد از خارج کردن نمونهها از بنماری، با آب سرد خنک شده و 10 دقیقه با دور g 1000سانتریفیوژ شدند. بعد از آن مایع رویی جدا گردیده و جذب آن در طول موج 532 نانومتر توسط دستگاه اسپکتوفوتومتر قرائت شد. غلظت مالوندیآلدئید با استفاده از ضریب خاموشی که 106×56/1میباشد محاسبه شد و بر حسب نانومول بر لیتر (nmol/l)گزارش شد (19،20).
بررسی میزان تستوسترون سرم خون: سنجش مقدار تستوسترون با روش الایزا و مطابق دستورالعمل کیت تهیه شده انجام شد.
CatNo.3725-300A.Accubind ELISA.Monobind.USA
برای سنجش میزان تستوسترون سرم، ابتدا نمونهها در چاهک ریخته شد و بعد از آن محلول تستوسترون و آنتیتستوسترون اضافه گردید و سپس به مدت 90 دقیقه در 37 درجه سانتیگراد انکوبه گردید. پس از آن چاهکها با آب دیونیزه شستشو شده و سوبسترا به هر یک از چاهکها اضافه گردید و به مدت 20 دقیقه انکوبه گردید. سپس محلول متوقف کننده اضافه گردید و واکنش متوقف شد و جذب آن با دستگاه الایزا در 450 نانومتر قرائت گردید (21).
اندازهگیری ظرفیت آنتیاکسیدان تام (Total Antioxidant capacity): با استفاده از کیت Naxifer TM Total Antioxidant capacity Assay Kit میزان ظرفیت آنتیاکسیدان بر اساس روش FRAP سنجیده شد. تغییر رنگ بهدست آمده بهوسیله میکروپلیت ریدر اندازهگیری گردید و در نهایت برای بهدست آوردن مقدار کمی ظرفیت آنتیاکسیدانی از استاندارد و نمودار حاصل استفاده گردد. ابتدا 5 میکرولیتر از نمونه استاندارد تهیه شده در چاهکهای پلیت 96 خانه ریخته شد. سپس به همه خانههای حاوی نمونه و یا استاندارد،250 میکرولیتر از محلول کار آماده شده اضافه گردید و سپس جذب نوری نمونهها بعد از 5 دقیقه در طول موج 593 (بین 570 تا630) نانومتر قرائت گردید (22).
تجزیه و تحلیل آماری
ابتدا از آزمون آماری Smirnov-Kolmogorov و Wilk-Shapiro به منظور نرمال بودن دادهها و آزمون آماری Levene جهت برابری واریانسها استفاده شد. در ادامه با در نظر گرفتن سطح معنیداری0/05> p از روش آنالیز واریانس یک طرفه(ANOVA )و تست آماری ( test Tukey )جهت تحلیل دادهها مورد استفاده قرار گرفت.
نتایج
در گروه الکارنیتین نسبت به گروه کنترل در وزن نهایی موشها، کاهش وزن معناداری مشاهده شدp=0/03) ). اما گروه تیمار با نانوذراتنقره نسبت به گروه کنترل تغییر معناداری را نداشته است (p=0/77). وزن موشها در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (P=0/96). اختلاف معناداری در وزن بیضه چپ در بین 4گروه آزمایشی مشاهده نشده است (p=0/19)(جدول1).
تعداد اسپرم: در گروه نانوذراتنقره، میانگین تعداد اسپرم نسبت به گروه کنترل و گروه الکارنیتین دارای کاهش معناداری شده است (p=0/001) گروه نانوذراتنقره و الکارنیتین در برابر گروه نانوذراتنقره دارای افزایش معناداری شده است (p=0/004). گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (P=0/99). (جدول2).
حیات اسپرم: میانگین حیات اسپرم در گروه نانوذراتنقره در مقایسه با میانگین گروه کنترل و گروه الکارنیتین کاهش معناداری را نشان داد (p=0/001). همچنین درصد حیات اسپرم در گروه تیمار همزمان نسبت به گروه نانوذراتنقره افزایش معناداری را نشان داد (p=0/03). در گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری را نشان نداد (p=0/39). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (p=0/59) (جدول2).
مورفولوژی طبیعی اسپرم: میزان مورفولوژی طبیعی در گروه نانوذراتنقره نسبت به گروه کنترل و الکارنیتین کاهش معناداری داشته است (p=0/001). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره میزان مورفولوژی طبیعی افزایش معناداری داشته است (p=0/001)(جدول2).
تحرک اسپرم: درصد اسپرمهای پیشرونده در گروه تیمار با نانوذراتنقره در مقایسه با گروه کنترل و الکارنیتین کاهش معناداری داشته است (p=0/001). در گروه تیمار همزمان نانوذراتنقره و الکارنیتین درصداسپرمهای پیشرونده در مقایسه با گروه نانوذراتنقره افزایش معناداری داشته است (p=0/001)(جدول2). در گروه نانوذراتنقره میانگین اسپرمهای بدون حرکت و ساکن در مقایسه با گروههای دیگر،افزایش معناداری را نشان داد (p=0/001). اسپرمهای ساکن در گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است و به گروه کنترل نزدیک شده است (p=0/001)(جدول2). در گروه تیمار با الکارنیتین درصد اسپرمها با حرکت درجا در گروه الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است (p=0/01). ولی در مقایسه با گروه کنترل و گروه تیمار همزمان نانوذراتنقره و الکارنیتین تفاوت معناداری مشاهده نشد (p=0/68)(جدول2).
بررسیهای استریولوژیکی
بررسی کیفی هیستوپاتولوژیک بیضه: در گروه تیمار با نانوذراتنقره لولههای منیساز کاهش یافته و بافت بینابینی دچار افزایش شده بود (علامت ستاره). اپیتلیوم لولههای منیساز دچار ساختار نامنطم شده و پیوستگی خود را از دست دادهاند همچنین ارتفاع اپیتلیومزایشی نیز کاهش را نشان داد (علامت فلش). اسپرمها در لوله منیساز نسبت به گروه کنترل و دیگر گروهها کاهش داشته است. در گروه تیمار همزمان آثار تخریبی نانوذراتنقره توسط الکارنیتین تقریبا اصلاح شده بود. لولههای منیساز چیدمانی تقریبا مشابه گروه کنترل داشتند و حجم فضای بینابینی کاهش داشته است. اپتلیوم زایشی لولههای منیساز از ساختار نرمال و طبیعی برخوردار بودند. در گروه الکارنیتین لولههای منیساز همانند گروه کنترل بوده و دچار آسیب یا تغییری نشده است (شکل1).
حجم کل بافت بیضه، لولههای منیساز و بافت بینابینی
حجم کل بیضه: حجم کل بافت بیضه در بین گروههای آزمایشی اختلاف معناداری را نشان نداد (p=0/58).
حجم لوله منیساز: حجم لوله منیساز هیچ تفاوت معناداری را نشان نمیدهد (p=0/77).
حجم بافت بینابینی: حجم بافت بینابینی در گروه نانوذراتنقره افزایش معناداری در مقایسه با گروه کنترل داشت، همچنین حجم بافت بینابینی در گروه تیمار همزمان نانوذراتنقره و الکارنیتین کاهش معناداری در مقایسه با گروه نانوذراتنقره داشته است (p=0/036). حجم بافت بینابینی در گروه الکارنیتین کاهش معناداری در مقایسه با گروه نانوذراتنقره داشته است (p=0/005).(جدول3).
بررسیهای بیوشیمایی
بررسی میزان مالوندیآلدئید: میزان مالوندیآلدئید در گروه نانوذراتنقره افزایش معناداری در مقابل گروه کنترل (p=0/023) و گروه الکارنیتین (p=0/018) را نشان داد. گروه تیمار همزمان نانوذراتنقره و الکارنیتین در مقایسه با گروه نانوذراتنقره کاهش معناداری داشته است و به گروه کنترل تقریبا نزدیک شده است (p=0/01)(جدول4).
بررسی میزان آنتی اکسیدان تام: ظرفیت آنتیاکسیدان کل (TAC) در گروه نانوذراتنقره در برابر گروه کنترل کاهش معناداری را نشان میدهد (p=0/001). مقدار TACدر گروه تیمار همزمان نانوذراتنقره و الکارنیتین افزایش معناداری در برابر گروه نانوذراتنقره نشان میدهد (p=0/001)(جدول4).
بررسی میزان تستوسترون سرم خون: هورمون تستوسترون در گروه نانوذراتنقره نسبت به گروه کنترل (p=0/006) و گروه الکارنیتین کاهش معناداری داشته است (p=0/035). در گروه تیمار همزمان نسبت به گروه نانوذراتنقره افزایش معناداری دیده میشود (p=0/045)(جدول4).
جدول1: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین (100mg/kg.bw/d) در مدت 35 روز بر روی میانگین وزن موش و وزن بیضه

دادههای آماری بهوسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل mean± sdذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
جدول2: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین(100mg/kg.bw/d) به مدت 35 روز بر روی پارامترهای اسپرم موش نر نژاد
NMRI

دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل Mean± SDذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.

شکل1: تصویرهای میکروسکوپی از تاثیر نانوذراتنقره (500mg/kg.bw.d)و الکارنیتین (100mg/kg.bw.d) بر روی بافت بیضه موشهای NMRI به مدت 35 روز.
(A). درگروه کنترل، لولههای منیساز دارای ساختار منظم هستند و اپیتلیوم زایشی نیز مرتب است و در لومن تراکم اسپرم بالا است.(B). در گروه نانوذراتنقره، لولههای منیساز آرایش نامنظم داشته و حجم فضای بینابینی افزایش یافته است (علامت ستاره) و ارتفاع اپیتلیوم زایشی کم شده است.(C). در گروه تیمار الکارنیتین، لولههای منیساز آرایش طبیعی دارند.(D). در گروه تیمار همزمان تقریبا لولههای منیساز آرایش طبیعی و منظم دارند. تصاویر در ضخامت 5 میکرون و رنگآمیزی هماتوکسیلین -ائوزین تهیه گردیده است[بزرگنمایی ×200 ].
جدول3: بررسی اثر نانوذراتنقره (500میلیگرم/کیلوگرم وزن بدن/روز) و الکارنیتین (100میلیگرم/کیلوگرم وزن بدن/روز) به مدت 35 روز بر روی میانگین حجم کل بیضه، حجم لولههای منیساز، حجم بافت بینابینی(mm3 )در موشهای NMRI

دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل mean± sdذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.
جدول4: بررسی اثر نانوذراتنقره (500 mg/kg.bw/d) و الکارنیتین(100mg/kg.bw/d) به مدت 35 روز بر روی میانگین ظرفیت آنتیاکسیدان کل و میزان غلظت مالوندیآلدئید به عنوان شاخص استرساکسیداتیو و میزان تستوسترون سرم در موشهای نر نژاد NMRI

دادههای آماری به وسیله آنالیز آماری واریانس یکطرفه (ANOVA) و آزمونهای مقایسهای Tukey test مورد بررسی قرار گرفتند. میانگین نتایج به شکل Mean± SDذکر شده است. تفاوت در میان گروهها در سطح معناداری کمتر از 05/0(p<0/05) در نظر گرفته شده است. در هر ردیف حروف a.b.c معناداری در سطح (p<0/05) را نشان میدهد.
*(یک ستاره) و **(دوستاره) به ترتیب نشانگر تفاوت معنیداری p<0/01 و p<0/001 است.
بحث
در این پژوهش پارامترهای اسپرمی، وزن بیضه ، وزن موش، حجم کل بیضه و حجم بافت بینابینی وحجم لولههای منیساز، غلظت مالوندیآلدئید و ظرفیت آنتیاکسیدان تام و هورمون تستوسترون مورد بررسی قرار گرفتند. در این قسمت نتایج به دست آمده تفسیر میگردند. پامترهای اسپرمی یعنی تعداد، تحرک، مورفولوژی طبیعی و قابلیت حیات اسپرم درگروه نانوذراتنقره کاهش معناداری را در مقایسه با گروه کنترل نشان داد. در تحقیقات shariat zadeh و همکارانش در سال 2021، بر روی 24 سر موش نر بالغ نژاد NMRI و تیمار با نانوذراتنقره در دوز 500 mg/kg/day و آلفالیپویکاسید در دوز 100mg/kg/day به مدت 35روز و تجویز به شکل دهانی نشان داد که در گروه نانوذراتنقره، اسپرمهایی با حرکت پیشرونده در مقایسه با گروه کنترل کاهش داشته است. همچنین میانگین درصد اسپرمهای دارای مورفولوژی طبیعی نسبت به گروه کنترل کاهش معناداری داشته است. تعداد اسپرم نیز در گروه نانوذراتنقره در برابر گروه کنترل کاهش معناداری داشته است (23). بر اساس تحقیقات Razi و همکاران وی در سال 2021، تیمار موش نر بالغ با نانوذراتنقره در ابعاد 40 نانومتر و در دوزهای 50 و 100 و200 میکرولیتر و بهصورت دهانی در مدت زمان 5هفته نشان داده شد گروهی که بالاترین دوز مصرفی را دریافت کردند در مقایسه با گروه کنترل کاهش معناداری در تعداد اسپرم داشتهاند. همچنین با افزایش دوز مصرفی، درصد اسپرمهایی با حرکت پیشرونده سریع، کاهش معناداری نشان داد. با افزایش دوزمصرفی میزان اسپرمهایی با مورفولوژی غیرطبیعی افزایش یافت. همچنین با افزایش دوز نانوذراتنقره، قابلیت حیات نیز کاهش داشته است (24). بنابراین نانوذراتنقره با تشدید استرساکسیداتیو سبب کاهش کیفیت اسپرم میشود. برای بلوغ و ظرفیتیابی و تحرک اسپرم و همچنین واکنش آکروزومی و اتصال به زوناپلاسیدا و تخمک، میزان نرمال رادیکال آزاد لازم است اما با ایجاد استرساکسیداتیو سبب آسیب به اسپرم میشود. نانوذراتنقره با جمع شدن در اپیدیدیم از بلوغ اسپرمها ممانعت کرده و بر روی تعداد اسپرم اثرگذار است (25). در واقع الکارنیتین با برداشتن گلوکز بهوسیله سلولهای سرتولی بر تحریک بلوغ اسپرم اثر میگذارد. الکارنیتین میزان فاگوسیتوز گامتها را کاهش داده و به این طریق تعداد اسپرم را افزایش میدهد. بالاترین میزان الکارنیتین در اپیدیدیم است که در بلوغ و تحرک اسپرمها نقش دارد. الکارنیتین انتشار آنزیمهای سلولی و اکسیژن مصرفی را مهار میکند و به این شکل قابلیت زنده ماندن سلول را افزایش میدهد. در حقیقت ذخیره آندروژنیک الکارنیتین آزاد در اسپرم بالغ و انزال یافته ضمانتی برای قابلیت زنده ماندن اسپرم میباشد (26). در این پژوهش حجم بافت بینابینی در گروه نانوذراتنقره در مقایسه با گروه کنترل افزایش معناداری را نشان داد اما حجم کل بیضه و لولههای منیساز دچار تغییرات معناداری نشده است. در سال 2019،El-sharkawy و همکارانش نشان دادند که با تیمار نانوذراتنقره در ابعاد 34-9 نانومتر در طولانیمدت 6 ماه بهصورت 2 بار در هفته بر روی موشهای نر و با دوزmg/kg.bw 5 و 10 منجر به ایجاد تغییرات پاتولوژیک بیضه میشود. سلولهای سرتولی واکوئله شده و آتروفی لولههای منیساز را نشان داد. سلولهای اسپرماتوگونی ناهنجاریهای مورفولوژیکی را داشته است. در سال 2020، mohamadi و همکارانش اثر مکمل الکارنیتین در جیره جوجه خروسهای نابالغ را مورد بررسی قرار دادند. به این شکل که 12 قطعه خروس را در مدت زمان 22 هفته را با سطوح صفر و 250 میلیگرم بر کیلوگرم الکارنیتین در 6 تکرار مورد بررسی قرار دادند. نشان داده شد که سلولهای سرتولی به شکل معناداری افزایش داشته است. بنابراین بر میزان بافت بینابینی موثر است. شاخص اسپرماتوژنز بهطور معناداری نیز افزایش یافته بود (27). در واقع با کاهش سلولهای جنسی توسط نانوذراتنقره، افزایش بافت بینابینی رخ میدهد. نانوذراتنقره سبب ایجاد استرساکسیداتیو شده و به این روش سلولهای جنسی را از بین میبرد و سبب کاهش حجم اپیتلیوم زایشی میگردد. تاثیرات نانوذراتنقره به دوز مصرفی و مدت زمان تیمار و نوع تجویز و نوع حیوان وابسته است. در تجویز خوراکی جذب نانوذرات به کندی رخ میدهد و به این دلیل نتوانست در مدت زمان 35 روز بر روی حجم بیضه و لولههای منیساز تاثیری داشته باشد و حجم آن را کاهش نداد (28). حجم بافت بینابینی در گروه تیمار همزمان نانوذراتنقره و الکارنیتین، به سطح گروه کنترل نزدیک شده بود و در واقع الکارنیتین توانسته بود با اثر آنتیاکسیدانی خود از ایجاد استرساکسیداتیو جلوگیری کند و در نتیجه مانع از بینرفتن سلولهای لیدیگ شود و به این طریق حجم بافت بینابینی در این گروه به سطح گروه کنترل رسیده بود. وزن موشهای گروه الکارنیتین نسبت به گروه کنترل دچار کاهش شده است. در وزن موشهای گروه نانوذراتنقره تفاوت معناداری نشان داده نشده است. در بین 4 گروه، تفاوت معناداری در وزن بیضه مشاهده نشد. مطابق تحقیقات Shariatzadeh و همکارانش در سال 2020، تیمار موشهای نر نژادNMRI با نانوذراتنقره با ابعاد 40نانومتر و در دوزmg/kg/day 500 در مدت زمان 35 روز، در وزن موشها پس از پایان دوره تیمار اختلاف معناداری مشاهده نشده است اما میانگین وزن بیضه در گروه نانوذراتنقره نسبت به گروه کنترل کاهش معناداری را نشان میدهد (29). نانوذراتنقره سبب تغییر در وزن موش و بیضه نمیشود و تنها سبب ایجاد تغییر در عملکرد بیضه میشود. بنابراین میتوان این گونه استدلال کرد که نانوذراتنقره در مدت زمان کوتاه بر عملکرد دستگاه گوارش اثرگذار نیست و به این دلیل سبب ایجاد تغییر در وزن بدن و بیضه نمیشود (25). درگروه الکارنیتین کاهش وزن معنادار در مقایسه با گروه کنترل مشاهده شده اما بر وزن بیضه اثرگذار نبوده است. الکارنیتین در وزن بیضه بیاثر بود اما به دلیل نقش الکارنیتین در متابولیسم چربیها سبب کاهش وزن در موش شده است. الکارنیتین موجب کاهش تجمع لیپید در عضله شده و باعث کاهش درصد چربی بدن میگردد (26). در این پژوهش نشان داده شد که میزان MDA در گروه نانوذراتنقره نسبت به گروه کنترل بهطور معناداری افزایش یافته است. در سال2019، بر اساس تحقیقات El-sharkwy و همکارانش نشان داده شد که تیمار موش صحرایی نر با نانوذراتنقره در ابعاد 34-9 نانومتر و در دوزهای mg/kg.bw 5/36 وmg/kg.bw 13/4 و به صورت تجویز دهانی و در مدت زمان 6 ماه، سبب افزایش میزان مالوندیآلدئید و پراکسیداسیونلیپیدی در بیضه شده و میزان فعالیت SOD را کاهش داده است (27). تحقیقات shariat zadeh و همکارانش در سال 2021، بر روی 24سر موش نر بالغ نژاد NMRI و تیمار با نانوذراتنقره در دوز 500 mg/kg/day و آلفالیپویکاسید در دوز 100mg/kg/day به مدت 35روز و تجویز به شکل دهانی نشان داد که میزان مالوندیآلدئید در گروه نانوذراتنقره نسبت به گروه کنترل افزایش معناداری داشته است (23). Abdel-Emam و همکارانش در سال 2021، اثر درمانی الکارنیتین بر 30سر موش صحرایی نر بالغ نژاد ویستار که تحت سمیت استات سرب بودند را مورد بررسی قراردادند. دوز الکارنیتین mg/kg 100 بوده و به شکل تجویز دهانی و تیمار در مدت زمان 40 روز انجام شد. نتیجه نشان داد در گروه تیمار همزمان میزان MDA در مقایسه با گروه تیمار با استات سرب کاهش یافته و میزان TAC افزایش یافته است (30). بر اساس تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و 100 و مونوسدیمگلوتامات در دوز3 g/kg به موشهای صحرایی نر بالغ و بهصورت تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات، در هر دو دوز الکارنیتین سبب کاهش قابلتوجهی در سطح MDA نسبت به گروه مونوسدیمگلوتامات شده است (31). بنابراین نانوذراتنقره با کاهش سیالیت غشا اسپرم و همچنین پارامترهای اسپرمی سبب تشدید اثرات پراکسیداتیوی در مایع سمینال میشود. در واقع نانوذراتنقره با ایجاد اختلال در زنجیره تنفسی میتوکندریها و تحریک تولید ROS در بافتهای متفاوت سبب پراکسیداسیون لیپیدی در غشا میگردد (32). در این پژوهش در گروه تیمار همزمان نانوذراتنقره و الکارنیتین میزان مالوندیآلدئید نسبت به گروه نانوذراتنقره کاهش داشته است و سطح مالوندیآلدئید به گروه کنترل رسیده است. الکارنیتین با مداخله اسید آراشیدونیک تشکیلدهنده فسفولیپو و همچنین پروتئین کینازc باعث کاهش پراکسیداسیون لیپیدی و استرساکسیداتیو میشود (33). میزان TAC در گروه نانوذراتنقره نسبت به گروه کنترل کاهش یافت و در گروه تیمار همزمان نانوذراتنقره و الکارنیتین نسبت به گروه نانوذراتنقره میزانTAC افزایش معناداری را نشان داد. مطابق تحقیقات Shariat zadeh و همکارانش در سال 2020، تیمار موشهای نر نژادNMRI با نانوذراتنقره در ابعاد 40 نانومتر و در دوزmg/kg/day 500 در مدت زمان 35 روز، کاهش معناداری در ظرفیت آنتیاکسیدان کل گروه نانوذراتنقره نسبت به گروه کنترل نشان داده شد (29). مطابق تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و100 و مونوسدیمگلوتامات در دوز 3g/kg بر روی موشهای صحرایی نر بالغ و بهصورت تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات، میزان ظرفیت آنتیاکسیدان کل دچار افزایش معنادار شد. در گروه تیمار با الکارنیتین میزان آنتیاکسیدان در مقایسه با گروه کنترل افزایش داشته است اما از لحاظ آماری این افزایش معنادار نبوده است (31). در واقع نانوذراتنقره تنش استرساکسیداتیو را ایجاد کرده و فعالیت آنتیاکسیدانهای داخل بدن را کاهش میدهد. مطابق پژوهش حاضر، در گروه تیمار همزمان نانوذراتنقره+الکارنیتین در مقایسه با گروه نانوذراتنقره، میزان ظرفیت آنتیاکسیدان کل افزایش معناداری را نشان داد. در واقع الکارنیتین با حذف یونهای آهن و رادیکالهای آزاد سبب افزایش میزان آنتیاکسیدان کل میشود. همچنین با افزایشATP فعالیت آنزیمهای آنتیاکسیدانی را در سلول بهبود میبخشد (29). در این پژوهش، هورمون تستوسترون در گروه نانوذراتنقره نسبت به گروه کنترل دچار تغییر معناداری گردید. Olugbodi و همکارانش در سال 2020، اثر نانوذراتنقره را بر روی هورمونهای جنسی و پارامترهای اسپرمی در موش صحرایی نر مورد بررسی قرار دادند. به این ترتیب30 سر موش در مدت زمان 28روز بهصورت پوستی نانوذراتنقره را در دوزهای 0،10،50 میلیگرم بر کیلوگرم وزن بدن، دریافت کردند. نتیجه نشان داد که هورمون تستوسترون در موشهای دریافتکننده نانوذراتنقره متناسب با دوز دریافتی، نسبت به گروه کنترل کاهش داشته است (34). طبق تحقیقات koohpeyma و همکارانش در سال2022، تجویز همزمان الکارنیتین در دوز 200mg/kg.b.w و100 و همچنین مونوسدیمگلوتامات در دوز 3g/kg به موشهای صحرایی نر بالغ و به شکل تجویز خوراکی در مدت زمان 6 ماه نشان داد که در گروه تیمار همزمان الکارنیتین و مونوسدیمگلوتامات در هر دو دوز، الکارنیتین سبب افزایش تستوسترون به شکل معنادار نسبت به گروه مونوسدیمگلوتامات شده است و گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری نداشته است (31). در واقع نانوذراتنقره بر روی بیان ژن Star موثر میباشد، این پروتئین در منتقل کردن کلسترول به غشا داخل میتوکندری و همچنین افزایش دادن استروئیدسازی موثر است. بنابراین این احتمال وجود دارد که نانوذراتنقره با کاهشدادن بیان این ژن از انتقال کلسترول به غشا داخلی میتوکندری ممانعت کرده و در نتیجه از تبدیل شدن کلسترول به پرگننولون جلوگیری کرده و به این ترتیب میزان تستوسترون کاهش مییابد (35). در این پژوهش در گروه تیمار همزمان نانوذراتنقره و الکارنیتین افزایش معنادار تستوسترون نسبت به گروه نانوذراتنقره نشان داده شد. گروه الکارنیتین نسبت به گروه کنترل تفاوت معناداری را نشان نداشته است. واقع الکارنیتین با کاهش تخریب سلولهای لیدیگ میتواند سطح هورمون تستوسترون را افزایش دهد. پیشنهاد میشود مطالعات مولکولی تکمیلکننده صورت گیرد و همچنین تاثیر این دارو بر اعضای دیگر مانند کبد و کلیه و... انجام شود.
نتیجهگیری
نتایج این پژوهش نشان داد که نانوذراتنقره در ابعاد کوچک 20نانومتر باعث القای استرساکسیداتیو شده و در نتیجه مسمویت و اختلال در دستگاه تولیدمثلی نر را ایجاد میکند. آنالیز آماری دادهها نشان داد که نانوذراتنقره با کاهش کیفیت لولههای منیساز، تعداد سلولهای اسپرماتوژنیک و همچنین ایجاد اختلال در فرایند اسپرماتوژنز در بیضه سبب آپاپتوزیس سلولهای لولههای منیساز میگردند. همچنین اختلال در سطح هورمون جنسی تستوسترون دیده شد و در واقع کاهش داشته است. در کنار آسیبهای وارد شده به بافت بیضه، پارامترهای اسپرم یعنی تعداد، تحرک، مورفولوژی و حیات اسپرم نیز دچار کاهش شده است. اما الکارنیتین در گروه تیمار همزمان نانوذراتنقره و الکارنیتین، اثرات سمی ناشی از نانوذراتنقره را بهبود بخشیده و ظرفیت آنتیاکسیدانتام را دچار افزایش نموده است. بنابراین از پراکسیداسیون لیپیدی جلوگیری نمود. پس باید گفت که الکارنیتین مانع آسیبهای بافت بیضه شده و از تغییرات آن جلوگیری کرد. در واقع الکارنیتین با ایجاد تعادل در سطح هورمون تستوسترون، پارامترهای اسپرمی را در برابر سمیت ناشی از نانوذراتنقره بهبود بخشید.
سپاسگزاری
این مقاله حاصل پایاننامه دانشجویی بوده است. از کلیه افرادیکه در انجام این تحقیق ما را یاری دادند، تشکر و قدردانی میشود.
حامیمالی: معاونت پژوهشی و فناوری دانشگاه اراک
تعارضدرمنافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه اراک تایید شده است (کد اخلاق : IR.ARAKU.REC.1401.128).
مشارکت نویسندگان
دکتر سید محمدعلی شریعتزاده در ارائه ایده، دکتر سید محمدعلی شریعتزاده، سمیرا مقدسی، مهدیه عمادی در طراحی مطالعه، دکتر سید محمدعلی شریعتزاده، سمیرا مقدسی، مهدیه عمادی در جمعآوری دادهها، سمیرا مقدسی، مهدیه عمادی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Pathak UI, Gabrielsen JS, Lipshultz LI. Cutting-Edge Evaluation of Male Infertility. Urol Clin North Am. 2020; 47(2): 129-38.
2- Bhasin S, de Kretser DM, Baker HW. Clinical Review Pathophysiology and Natural History of Male Infertility. J Clin Endocrinol Metab 1994; 79(6): 1525-9.
3- Spira A, Multigner L. The Effect of Industrial and Agricultural Pollution on Human Spermatogenesis. Hum Reprod 1998; 13(8): 2041-2.
4- Petrelli G, Mantovani A. Environmental Risk Factors and Male Fertility and Reproduction. Contraception 2002; 65: 297-300.
5- Buzea C, Pacheco I, Robbie K. Nanomaterials and Nanoparticles: Sources and Toxicity. Biointerphases 2007; 2(4): MR17-71.
6- Gibbons B, Warner L. The Role of Antimicrobial Silver Nanotechnology. Medical Device and Diagnostic Industry Magazine 2005; 25: 164-9.
7- Tolaymat TM, EI Badawy AM, Genaidy A, Scheckel KG, Luxton TP, Suidan M. An Evidence-Based Environmentalperspective of Manufactured Silver Nanoparticle in Syntheses and Applications a Systematic Review and Critical Appraisalof Peer-Reviewed Scientific Papers. Sci Total Environ 2010; 408(5): 999-1006.
8- Morishita Y, Yoshioka Y, Satoh H, Nojiri N, Nagano K, Abe Y, et al. Distribution and Histologic Effects of Intravenously Administered Amorphous Nanosilica Particles in the Testes of Mice. Biochem Biophys Res Commun 2012; 420(2): 297-301.
9- Sudhahar V, Fukai T. Antioxidant Supplementation and Therapies. In: Tsukahara H, Kaneko K (eds). Studies on Pediatric Disorders. Oxidative Stress in Applied Basic Research and Clinical Practice. Springer, New York; 2014: 183-209.
10- Goto Y, Noda Y, Narimoto K, Umaoka Y, Mori T. Oxidative Stress on Mouse Embryo Development in Vitro. Free Radic Biol Med 1992; 13(1): 47-53.
11- Lenzi A, Sgrò P,Salacone P, Paoli D, Gilio B, Lombardo F. A Placebo-Controlled Doubleblind Randomized Trial of The Use of Combined Lcarnitine and L-Acetyl-Carnitine Treatment in Men with Asthenozoospermia. Fertil Steril 2004; 81(6): 1578-84.
12- Neuman SL, Lin TL, Heste PY. The Effect of Dietary Carnitine on Semen Traits of White Leghorn Roosters. Poult Sci 2002; 81(4): 495-503.
13- Palmero S, Bottazzi C, Costa M, Leone M, Fugassa E. Metabolic Effects of L-Carnitine on Prepubertal Rat Sertoli Cells. Horm Metab Res 2000; 32(3): 87-90.
14- Lafuente D, Garcia T, Blanco J, Sánchez D, Sirvent J,Domingo J. Effects of Oral Exposure to Silver Nanoparticles on the Sperm of Rats. Reprod Toxicol 2016; 60: 133-9.
15- Latendresse JR, Warbrittion AR, Jonassen H, Creasy DM. Fixation of Testes and Eyes Using a Modified Davidson's Fluid: Comparison with Bouin's Fluid and Conventional Davidson's Fluid. Toxicol path 2002; 30(4): 524-33.
16- Wick MR. The Hematoxylin and Eosin Stain in Anatomic Pathology—An Often-Neglected Focus of Quality Assurance in the Laboratory. Semin Diagn Pathol 2019; 36(5): 303-11.
17- Bancroft JD, Layton C. The Hematoxylins and Eosin. Edighth edition 2019: 1-573.
18- Noorafshan AJAoA-AA. Stereology As a Valuable Tool in the Toolbox of Testicular Research. Ann Anat 2012; 16: 57-66.
19- Buege JA, Aust SD. Microsomal lipid peroxidation. Methods Enzymol 1978; 52: 302-10.
20- Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation product; Malondialdehyde and 4-hydroxynonenal. Methods Enzymol 1990; 186: 407-21.
21- Saremi A, Changizi Ashtiani S, Kalantari A. The Combination of Vitamin E Supplementation and Intensive Exercise on Testicular Oxidative Stress and Spermatogenesis in Male Rats. Sport Physiology 2014; 6(23): 43-54.
22- Cömert ED, Gökmen V. Evolution of Food Antioxidants as A Core Topic of Food Science for A Century. Food Res Int 2018; 10: 576-93.
23- Benzie IF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a Measure of “Antioxidant Power the FRAP Assay. Anal Biochem 1996; 239: 70-6.
24- Shariatzadeh M, Soleimani Mehranjani, Solgi F, Maleki P. Stereological Study of te Protective Effect of Alpha Lipoic Acid on the Testis after Treatement with Silver Nanoparticles in the Nmri Mouse. Studies in Medical Sciences 2021; 31(12): 944-55. [persian]
25- Razi A, Talebi AR, Poorrajab F, Rezaie Zarchi S, Razavi Sheshdeh SAR, Shahmoradi Razi HR. Effects of Silver Nanoparticles on Sperm Parmeters and Reactive Oxygen Species in the Mouse Serum and Seminal Fluid. Cell &tissue 2015; 5(4): 393-400. [persian]
26- Ema M, Okuda H, Gamo M, Honda K. A Review of Reproductive and Developmental Toxicity of Silver Nanoparticles in Laboratory Animals. Reprod Toxicol 2017; 67: 149-64.
27- Zare Z, Eimani H, Mohammadi M, Mofid M, Dashtnavard H. The Effect of Orally Administered Lcarnitine on Testis Tissue Sperm Parameters and Daily Spermprouduction in Adult Mice. Yakhteh medical 2010; 11(4): 382-89. [persian]
28- Elsharkawy EE, Abd El-Nasser M, Kamaly HF. Silver Nanoparticles Testicular Toxicity in Rat. Environ Toxicol Pharmacol 2019; 70: 103194.
29- Zhang X-F, Choi Y-J, Han JW, Kim E, Park JH, Gurunathan S. Differential Nanoreprotoxicity of Silver Nanoparticles in Male Somatic Cells and Spermatogonial Stem Cells. Int J Nanomedicine 2015; 10: 1335.
30- SHariatzadeh SMA, CHerghi E, Bakhshi MR. The Study of Protective Effect of Royal Jelly on the Testis Tissue after Silver Nanoparticles-Induced Toxicity in the NMRI Mice. Feyz 2020; 24: 282-92. [persian]
31- Abdel-Emam R, Esraa A. Ameliorative Effect of L-Carnitine on Chronic Lead-Induced Reproductive Toxicity in Male Rats. Veterinar Medicine and Science 2021; 7: 1426-35.
32- Koohpeyma F, Gholizadeh F, Hafezi H, Hajiaghaui M, Siri M, Allahyari SH, et al. The Protective Effect of Lcarnitine on Tesosterone Synthesis Pathway and Spermatogenesis in Monosodium Glutamate Induced Rats. BMC Complement Med Ther 2022; 22: 269. [persian]
33- Moghanlo H, Shariatzadeh SMA. Beneficial Effects of Spirulina Platensis on Mice Testis Damaged by Silver Nanoparticle. Andrologia 2022; 54(11): e14606.
34- Kiani M, Parto P. Protective Effect of Lcarnitine on the Sperm Parameters of Adult Mice Treated with Ciprofloxacin. J Ardabil Univ Med Sci 2018; 17: 392-401.
35- Olugbodi J, David O, Oketa E, Lawal B, Okoli B, Mtunzi F. Silver Nanoparticles Stimulates Spermatogenesis Impairments and Hematological Alterations in Testisand Epididymis of Male Rats. J Molocules 2020; 28: 2-16
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1403/11/4 | پذیرش: 1404/4/16 | انتشار: 1404/9/15
دریافت: 1403/11/4 | پذیرش: 1404/4/16 | انتشار: 1404/9/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







