دوره 33، شماره 5 - ( مرداد 1404 )
جلد 33 شماره 5 صفحات 9036-9025 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Taraz A, Moghadasi M, Mosalanezhad Z, Rashidfard S. Effect of Swimming Training with Hesperidin on Gene Expression Related Dopaminergic Neuron Survival in an Animal Model of Parkinson's Disease. JSSU 2025; 33 (5) :9025-9036
URL: http://jssu.ssu.ac.ir/article-1-6362-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6362-fa.html
تراز اسما، مقدسی مهرزاد، مصلی نژاد زهرا، رشیدفرد سمیه. اثر یک دوره تمرین شنا همراه با مصرف هسپریدین بر بیان ژنهای مرتبط با بقاء نورونهای دپامینرژیک در مدل حیوانی پارکینسون. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (5) :9025-9036
متن کامل [PDF 842 kb]
(186 دریافت)
| چکیده (HTML) (554 مشاهده)
متن کامل: (144 مشاهده)
مقدمه
پارکینسون یک اختلال نورودژنراتیو است که در آن، به دلیل عوامل ژنتیکی، محیطی و افزایش سن، نورونهای دوپامینرژیک تحتتأثیر قرار میگیرند (1). دو مکانیسم برای تخریب نورونهای دوپامینرژیک در بیماری پارکینسون مطرح شده است. اولین مکانیسم، تجمع تودههای پروتئینی به نام اجسام لویی (Lewy bodies) در نورونها است که بخش اصلی اجسام لویی را آلفا سینوکلئین (α-Syn) تشکیل میدهد (2). تجمع α-Syn گام اصلی در پاتوژنز بیماری پارکینسون بهشمار میرود (3). دومین مکانیسم، اختلال در عملکرد میتوکندریهای نورونهای دوپامینرژیک است (4). بر اساس این مکانیسم، کاهش پروتئینهای همچون DJ-1 (4) و افزایش پروتئینهایی از قبیل کیناز با توالی تکراری غنی از لوسین-2 (LRRK2) (5) موجب اختلال در عملکرد میتوکندری نورونهای دوپامینرژیک و تحلیل آنها میشود. پروتئین DJ-1، یک پروتئین چند عملکردی است که میتواند مسیرهای رونویسی و سیگنالی انتقالی را تنظیم کند، گونههای واکنشپذیر اکسیژن (ROS) Reactive oxygen spices را حذف نموده و به عنوان یک آنزیم عمل نماید (6)؛ پروتئینهای حساس به ردوکس را کددهی میکند، موجب کاهش بیان α-Syn در نورونهای دوپامینرژیک میشود و در نهایت میتواند با فعال کردن عامل دو وابسته به فاکتور هستهای اریتروئید-2 (Nrf2) موجب بایوژنز میتوکندری در نورونهای دوپامینرژیک شده حفظ و بقاء این نورونها را بهدنبال دارد (7). همچنین DJ-1 با تعدیل فعالیت برخی از سلولهای سیستم ایمنی بدن انسان شامل سلولهای بیگانهخوار (ماکروفاژها)، ماستسلها و سلولهای T از طریق مکانیسمهای وابسته به ROS و مکانیسمهای مستقل از ROS، عملکرد تنظیم سیستم ایمنی در بدن انسان را اعمال میکند (8). تمام این عملکردها، جزء واکنشهای ضد استرس اکسایشی این پروتئین محسوب میشوند (9) که میتواند در نهایت منجر به حفاظت از نرونهای دوپامینرژیک در بیماری پارکینسون گردد (10). از طرف دیگر، LRRK2 بهعنوان یک کیناز عمل میکند و جهش آن با اختلال در عملکرد میتوکندری، استرس اکسایشی و پاسخهای التهابی همراه است (11). مشخص شده است که جهش در LRRK2 از دو مسیر، یکی بهواسطه فعال کردن پروتئینکیناز فعالکننده میتوژن (MAPK) و دیگری به واسطه فعالکردن α-Syn موجب اختلال در عملکرد میتوکندری، ایجاد التهاب عصبی و افزایش استرس اکسایشی در نورونها و در نتیجه مرگ نورونهای دوپامینرژیک میگردد (12). افزایش سطح خونی و بیان ژن LRRK2، این پروتئین را به عنوان یکی از عوامل خطرزای بیماری پارکینسون معرفی کرده است (5). مطالعات در خصوص اثر فعالیت ورزشی بر تغییرات DJ-1 و LRRK2 در نمونههای مبتلا به پارکینسون بسیار محدود است. Zhou و همکاران در سال 2017 شاهد افزایش غلظت خونی و بیان ژن عضلانی DJ-1 در نمونههای حیوانی مبتلا به پارکینسون پس از یک هفته دویدن روی چرخ گردان بودند (13). Viana و همکاران در سال 2017 نیز گزارش کردهاند در موشهایی که 30 روز قبل از القاء و 11 روز پس از القاء پارکینسون فعالیت ورزشی هوازی داشتند، بیان ژن هیپوکامپی DJ-1 افزایش معنیداری داشته است (14). در خصوص اثر فعالیت ورزشی بر تغییرات LRRK2 در نمونههای مبتلا به پارکینسون تنها دو مطالعه به دست آمد. در اولین مطالعه اشاره شده است که اجرای 6 هفته دویدن روی چرخ گردان به صورت اختیاری، با کاهش LRRK2 موجب جلوگیری از کاهش نورونزایی در موشهای تراریخته میشود (15). در دیگر مطالعه، ارتباط معکوس بین میزان فعالیت جسمانی و جهش ژن LRRK2 در بیماران مبتلا به پارکینسون گزارش شده است (16). مطالعات نشان دادهاند که فعالیت ورزشی میتواند با افزایش عوامل نروتروفیک مشتق از گلیال و تعدیل التهاب عصبی در حفظ و بقاء سیستم دوپامینرژیک بیماران مبتلا به پارکینسون مؤثر باشد (17) اما حفظ و بقاء نورونهای دوپامینرژیک بر اثر فعالیت ورزشی و به واسطه تغییر در بیان ژنهای DJ-1 و LRRK2 تاکنون مورد بررسی قرار نگرفته است. علاوه بر این، مطالعات نشان دادهاند که اجرای تمرینات در آب بر خلاف تمرینات در خشکی، به دلیل خواص هیدرودینامیکی و ایجاد شرایط بیوزنی موجب کاهش صدمات ناشی از تمرین میشود (18)، لذا در مطالعه حاضر، تمرین شنا به عنوان یک شیوه تمرینی ایمن در نظر گرفته شد. از سویی با توجه به نقش رژیم غذایی در سلامت افراد و استفاده از آنتیاکسیدانهای طبیعی در کنار فعالیت ورزشی، این دو در کنار یکدیگر به عنوان موضوع مورد علاقه تحقیق اکثر محققین قرار گرفته است. هسپریدین با فرمول مولکولی C28H14O15 یکی از آنتیاکسیدانهای طبیعی است که به وفور در مرکباتی نظیر گریپفروت، لیمو و پرتقال یافت میشود (19). هسپریدین با داشتن خواص آنتیاکسیدانی و ضدالتهابی، سبب حفاظت نورونی میگردد و در نتیجه در پیشگیری و درمان بیماریهای ناشی از استرس اکسایشی مؤثر است (20). از شاخصترین مکانیسمهای متعدد محافظت نورونی هسپریدین میتوان به ممانعت از تشکیل ROS، کاهش آسیب غشاء و افزایش فعالیت آنزیمهای آنتی اکسیدانی اشاره کرد. نتایج مطالعات اخیر نشان داده است که ترکیباتی همچون هسپریدین در جلوگیری از بروز بیماریهای مزمن و تحلیل برنده عصبی، مانند آلزایمر و پارکینسون مؤثر است و یا دست کم میتواند شروع آنها را به تأخیر بیندازد (22،21). فرض مطالعه حاضر آن است که استفاده از آنتیاکسیدان هسپریدین در کنار فعالیت شنا بتواند بهواسطه کاهش استرس اکسایشی و با افزایش دادن DJ-1 و کاهش LRRK2، حفظ و بقاء نورونهای دوپامینرژیک را ارتقاء و بدین واسطه در بهبود بیماری پارکینسون مؤثر باشد. از آنجا که بر اساس اطلاعات ما تا کنون اثر این ماده آنتیاکسیدانی در کنار فعالیت ورزشی بر حفظ و بقاء نورونهای دوپامینرژیک در افراد مبتلا به پارکینسون بررسی نشده است، لذا مطالعه حاضر با هدف بررسی اثر یک دوره تمرین شنا همراه با مصرف هسپریدین بر بیان ژنهای مرتبط با بقاء نورونهای دپامینرژیک در مدل حیوانی پارکینسون اجرا شد.
روش بررسی
مطالعه حاضر جزء مطالعات تجربی با طرح پس آزمون با گروه کنترل بود. تعداد 25 سرموش نر صحرایی نژاد ویستار 8 تا 10 هفتهای و با میانگین وزن 10/6 ± 205 گرم از مرکز پرورش و تکثیر حیوانات آزمایشگاهی انستیتو رازی کرج خریداری و به آزمایشگاه حیوانی دانشگاه آزاد اسلامی واحد شیراز منتقل شدند. تعداد نمونه در هر گروه بر حسب قوانین برآورد حجم نمونه بر اساس مقدار درجه آزادی (20=df) و تعداد گروه (5=n) در نظر گرفته شد (23). به منظور سازگاری با محیط آزمایشگاه، حیوانات به مدت یک هفته درون قفسهای پلاستیکی در شرایط استاندارد (دمای 2 ± 23/2 درجه سانتیگراد و رطوبت نسبی 45 درصد) نگهداری شدند. دسترسی به آب و غذا در طول تحقیق آزادانه بود و چرخه خواب و بیداری 12/12 ساعت تاریکی- روشنایی حفظ شد. از تعداد 20 سرموش، 5 سرموش به عنوان گروه سالم در نظر گرفته شد و 20 سرموش دیگر با تزریق درون صفاقی ماده رزرپین (ساخت شرکت سیگما آلدریچ کشور هند) به میزان یک میلیگرم به ازای هر کیلوگرم وزن بدن، بیماری پارکینسون القاء شد. تزریق رزرپین به مدت پنج روز متوالی با یک برنامه منظم در شبانه روز انجام شد. پس از پایان دوره القاء و به منظور تأیید القاء بیماری، سه سر موش (یک موش سالم و دو موش تحت تزریق رزرپین) برای انجام عکسبرداری از بافت مغز انتخاب شدند. به منظور ارزیابی کیفی بافت هیپوکامپ در نواحی CA1 و CA3 سه سر موش ذکر شده با قرار گرفتن در دسیکاتور حاوی کلروفورم بهطور عمیق بیهوش شدند و بلافاصله پرفیوژن قلبی با جایگزینی فرمالین 10 درصد متعاقب شستشوی خون از بدن با کلرور سدیم انجام شد. در پایان، مغز با دقت از جمجمه خارج و پردازش بافتی صورت گرفت. پس از تهیه بلوکهای پارافینه، برشگیری از ناحیه هیپوکامپ مغز به کمک راهنمای اطلس پاکسینوس و واتسون انجام شد. با استفاده از رنگ هماتوکسیلین- ائوزین (H-E) رنگآمیزی اسلایدها انجام شد. مطالعات میکروسکوپی با استفاده از میکروسوپ نوری المپیکوس مدل GH2 ساخت کشور ژاپن صورت گرفت. لامها مورد مطالعه و مقایسه قرار گرفتهاند و از مقاطع به وسیله دستگاه فتومیکروسکوپ المپیکوس مدل DP 12-2 ساخت کشور ژاپن عکسبرداری شد. بزرگنمایی مجموع تصویرهای به دست آمده، با توجه به بزرگنمایی عدسی میکروسکوپ و دوربین تصویربرداری x40 بوده است (24). شکل 1 میکروگراف حاصل از نواحی CA1و CA3 هیپوکامپ را نشان میدهد. شکلهای A و B مربوط به موشهای سالم و شکلهای C و D مربوط به موشهای بیمار است. همانطور که فلشها نشان میدهد در نواحی CA1و CA3 موشهای بیمار، نورونهای تحلیلرفته، سیتوپلاسم رنگ نشده، هستههای متراکم یا قطعه قطعه شده و غشاء سلولی آسیب دیده مشخص است. علاوه بر این، در مقایسه با موشهای سالم، کاهش قابلتوجه تعداد سلولها در سطح مقطع مورد بررسی مشاهده میشود که این امر نشان دهنده وقوع مرگ سلولی گسترده در ناحیه CA1 و CA3 در موشهای القاء بیماری پارکینسون است. با حصول اطمینان از القاء بیماری پارکینسون، 18 سرموش باقیمانده (2 سرموش از گروه تزریق رزرپین طی آزمون اطمینان از القاء بیماری قربانی شدند) بهطور تصادفی در گروههای بیمار (4 سرموش)، هسپریدین (4 سرموش)، شنا (5 سرموش) و شنا+ هسپریدین (5 سرموش) قرار گرفتند. موشهای گروه شنا و گروه شنا + هسپریدین ابتدا به مدت یک هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتیمتر و ارتفاع 80 سانتیمتر) را پیش از شروع دوره تمرینات اصلی گذراندند. در روز اول این دوره، موشها با نهایت دقت و آرامش در استخر حیوانات قرار داده شدند و با سرعت دلخواه به مدت پنج دقیقه شنا کردند. در جلسات بعد و پس از آشناسازی کافی با تمرین شنا، برای آموزش شنای تناوبی، چند بار پس از یک دقیقه شنا حیوانات بهوسیله صفحه استراحت از آب بیرون آورده و مجدد در آب قرار داده میشدند. برنامه اصلی تمرین شنای تناوبی شدید شش هفته بود که سه روز در هفته و بهصورت یک روز در میان اجرا شد. در این شیوه تمرینی، بار اعمال شده در هفته اول وزنهای به میزان هفت درصد وزن بدن هر موش صحرایی بود که به دم آنها بسته و هر هفته به میزان یک درصد به وزن آن اضافه گردید؛ به طوری که، در هفته آخر موشها با وزنهای به میزان 12 درصد بدن خود تمرین شنا را انجام دادند (25). پس از هر جلسه تمرین در آب، موش های صحرایی با حوله خشک و به محل نگهداری منتقل میشدند. طی دوران مطالعه، نمونههای گروه کنترل سالم و گروه بیمار، هیچگونه برنامه تمرینی نداشتند. مشخصات برنامه تمرینی در جدول 1 نشان داده شده است. نمونههای گروههای هسپریدین و شنا + هسپریدین با یک برنامهریزی مشخص در معرض مصرف آنتیاکسیدان هسپریدین قرار داده شدند؛ بدین ترتیب که روزهایی که تمرین شنا نداشتند، مکمل هسپریدین به میزان 50 میلیگرم بر کیلوگرم وزن بدن موش از طریق گاواژ به این موشها خورانده شد (26). 48 ساعت بعد از آخرین جلسه تمرینی، با تزریق درون صفاقی کتامین (50 میلیگرم به ازای هر کیلوگرم وزن بدن) و زایلازین (3 میلیگرم به ازای هر کیلوگرم وزن بدن) نمونهها بیهوش شدند. بافت هیپوکامپ خارج و بلافاصله برای سنجشهای بعدی به آزمایشگاه منتقل و در دمای منهای 80 درجه سانتیگراد فریز شدند. پس از جداسازی بافت هیپوکامپ، مرحله جداسازی mRNA توسط کیت مخصوص FavorPrep™ Tissue Total RNA Mini Kit (Farvorgen Biotech, Changzhi Township, Taiwan) و بر اساس دستوالعمل کیت انجام شد. یک میکروگرم از RNA استخراج شده با کمک کیت RevertAaid™ First Strand cDNA Synthesis ، (Fermentas) طبق دستورالعمل کیت جهت سنتز CDNA استفاده شد. واکنش real-time PCR (qRT-PCR) با کمک آنزیم RealQ Plus 2x Master Mix Green (Ampliqon, Inc) و با استفاده از دستگاه applied Biosystems StepOne™ (USA) صورت گرفت. به منظور بررسی بیان ژنهای هدف DJ-1 و LRRK2 از ژن کنترل TBP استفاده شد. از آب به عنوان کنترل منفی واکنش PCR در هر دور از واکنش PCR برای هر ژن استفاده شد. مخلوط واکنش بر اساس پروتکل پیشنهادی آماده شد. برنامه زمانی- گرمایی دستگاه طبق مراحل زیر انجام شد. مرحله اول که منجر به واسرشته شدن (Denaturation) مولکولهای CDNA به صورت 95 درجه سانتیگراد به مدت 10 دقیقه، مرحله دوم 95 درجه سانتیگراد به مدت 15 ثانیه و 60 درجه سانتیگراد به مدت 1 دقیقه برای 40 چرخه متوالی بود و در مرحله آخر ضمن بررسی نمودار ذوب، محصولات توسط الکتروفورز در سطح ژل آگارز مورد ارزیابی قرار گرفت.
تجزیه و تحلیل دادهها
برای بررسی توزیع طبیعی دادهها از آزمون شاپیرو- ویلک استفاده شد. از آنجا که دادهها دارای توزیع طبیعی بودند، تغییرات متغیرهای مورد مطالعه توسط آزمون تحلیل واریانس یک راهه همراه با آزمون تعقیبی توکی و بررسی اثرات اصلی و اثر متقابل شنا و مصرف هسپریدین بر متغیرها، توسط تحلیل واریانس دوراهه بررسی شدند. تجزیه و تحلیل یافتهها با نرمافزارversion 16 SPSS و در سطح معنیداری p< 0/05 انجام شد.

شکل 1: ارزیابی هیستوپاتولوژیک القاء بیماری پارکینسون
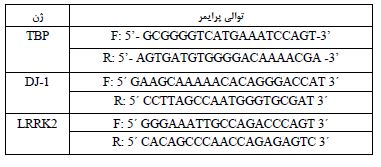
جدول 1: لیست پرایمرهای استفاده شده
نتایج
همانطور که در شکل 2 مشاهده میشود، نتایج آزمون تحلیل واریانس یک راهه نشان داد تفاوت معنیداری در بیان ژن DJ-1 بین نمونهها در گروههای تحقیق وجود دارد (0/0001=P و 166/22=F). با مشاهده نتایج آزمون تعقیبی توکی مشخص شد بیان ژن DJ-1 در گروه بیمار به طور معنیداری کمتر از گروه کنترل سالم بود (0/001>P). بیان ژن DJ-1 در گروههای هسپریدین، شنا و شنا + هسپریدین به طور معنیداری بیشتر از گروه بیمار (0/001>P) بود. همچنین نتایج نشان داد بیان ژن DJ-1 در گروههای شنا و شنا + هسپریدین بهطور معنیداری بیشتر از گروه هسپریدین به تنهایی بود بیان ژن این پروتئین در گروه شنا + هسپریدین به طور معنیداری بیشتر از گروه شنا بود (0/001>P). برای بررسی نحوه اثر تعاملی تمرین و هسپریدین بر بیان DJ-1 از آزمون آنالیز واریانس دو راهه استفاده شد. نتایج این آزمون نشان داد عامل تمرین (P=0/001، F=381/15 و اندازه اثر0/96) و هسپریدین (P=0/001، F=133/84 و اندازه اثر0/89) اثر معنیداری بر افزایش بیان ژن DJ-1 در موشهای صحرایی مبتلا به پارکینسون دارند. علاوه بر این تمرین و هسپریدین دارای اثر سینرژیستی بر افزایش بیان ژن DJ-1 در موشهای صحرایی مبتلا به بیماری پارکینسون دارد (P=0/001، F=32/86 و اندازه 0/67). نتایج آزمون آنالیز واریانس یک راهه نشان داد تفاوت معنیداری بر بیان LRRK2 در بافت هیپوکامپ موشهای صحرایی در گروههای مختلف تحقیق وجود دارد (0/001=P و 551/91=F، شکل 3). نتایج آزمون تعقیبی توکی نشان داد بیان ژن LRRK2 در گروه بیمار به طور معنیداری بیشتر از گروه سالم بود (0/001>P). همچنین، بیان ژن LRRK2 در گروههای هسپریدین، شنا و شنا + هسپریدین بهطور معنیداری کمتر از گروه بیمار (0/001>P). همچنین مشخص شد بیان ژن LRRK2 در گروههای شنا و شنا + هسپریدین بهطور معنیداری کمتر از گروه هسپریدین بود (0/001>P)، اما تفاوت معنیداری در گروههای شنا + هسپریدین و شنا مشاهده نشد (0/21=P). نتایج آزمون آنالیز واریانس دو راهه در خصوص نحوه اثر تعاملی تمرین و هسپریدین بر بیان LRRK2 در بافت هیپوکامپ نشان داد عامل تمرین (P=0/001، F=1313/21 و اندازه اثر 0/98) و هسپریدین (P=0/001، F=799/91 و اندازه اثر 0/98) اثر معنیداری بر کاهش بیان LRRK2 در بافت هیپوکامپ موشهای صحرایی مبتلا به پارکینسون دارند. علاوه بر این تمرین و هسپریدین دارای اثر سینرژیستی بر کاهش بیان LRRK2 در بافت هیپوکامپ دارد (P=0/001، F=613/89 و اندازه 0/97).

شکل 2. مقادیر بیان نسبی ژن DJ-1 در موشهای صحرایی گروههای مختلف
a (P<0/001) کاهش معنیدار نسبت به گروه سالم؛ b (P<0/001) افزایش معنیدار نسبت به گروه بیمار؛ c (P<0/001) افزایش معنیدار نسبت به گروه هسپریدین؛ d (P<0/001) افزایش معنیدار نسبت به گروه شنا.
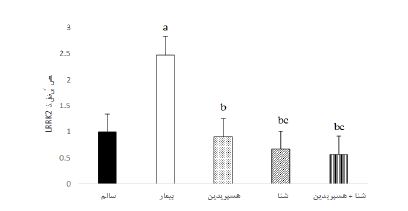
شکل 3: مقادیر بیان ژنی LRRK2 در بافت هیپوکامپ موشهای صحرایی در گروههای تحقیق
a (P<0/001) افزایش معنیدار نسبت به گروه سالم؛ b (P<0/001) کاهش معنیدار نسبت به گروه بیمار؛ c (P<0/001) کاهش معنیدار نسبت به گروه هسپریدین
بحث
مطالعه حاضر با هدف بررسی اثر یک دوره تمرین شنا همراه با مصرف هسپریدین بر بیان ژنهای مرتبط با بقاء نورونهای دپامینرژیک در مدل حیوانی پارکینسون انجام شد. نتایج این مطالعه داد بیان ژن هیپوکامپی DJ-1 در گروه بیمار نسبت به گروه سالم بهطور معنیداری پایینتر و بیان ژن هیپوکامپی LRRK2 در گروه بیمار نسبت به گروه سالم بهطور معنیداری بالاتر بود. همراستا با نتایج مطالعه حاضر، در دیگر مطالعات نیز کاهش DJ-1 (6) و افزایش LRRK2 (5،7) در نمونههای انسانی و حیوانی مبتلا به پارکینسون گزارش شده است. افزایش LRRK2 در 1 تا 6 درصد افراد مبتلا به پارکینسون بدون سابقه فامیلی و در 3 تا 19 درصد افراد مبتلا به پارکینسون به دلایل سابقه فامیلی و ژنتیکی گزارش شده است (27)؛ تا جاییکه از آن به عنوان یک شاخص معتبر بین پارکینسون ناشی از ژنتیک و پارکینسون ناشناخته در نظر گرفته میشود (5). مطالعات بالینی گذشته نیز نشان دادهاند به دلیل کاهش DJ-1 (4) و افزایش LRRK2 (5)، در عملکرد میتوکندری نورونهای دوپامینرژیک اختلال ایجاد شده و این موضوع یکی از مهمترین مکانیسمهای تحلیل این نوع نورونها در بیماری پارکینسون است. پروتئین DJ-1 نقشهای متعددی از جمله محافظت از نورونهای دوپامینرژیک در برابر ROS داشته و با کاهش ROS موجب بقاء این نوع نورونها میشود (6). علاوه بر این مشاهده شده است که این پروتئین موجب افزایش کارآیی میتوکندریها در نرونهای دوپامینرژیک میگردد (28). از سوی دیگر، جهش در LRRK2 به واسطه فعال کردن MAPK و α-Syn، موجب اختلال در عملکرد میتوکندری، ایجاد التهاب عصبی و افزایش استرس اکسایشی در نورونها شده و مرگ نورونهای دوپامینرژیک را به همراه دارد (12). از دیگر یافتههای مطالعه حاضر، افزایش بیان ژن DJ-1 بر اثر تمرین شنا بود. اگرچه مطالعات در خصوص اثر فعالیت ورزشی بر تغییرات DJ-1 در نمونههای پارکینسونی اندک است، اما همراستا با نتایج مطالعه حاضر، پیش از این نیز افزایش غلظت خونی و بیان ژن عضلانی DJ-1 در نمونههای حیوانی مبتلا به پارکینسون پس از یک هفته دویدن روی چرخگردان (13) و افزایش بیان ژن هیپوکامپی DJ-1 در موشهای پارکینسونی که فعالیت ورزشی هوازی داشتهاند (14) گزارش شده است. علت افزایش DJ-1 بر اثر فعالیت ورزشی به وضوح مشخص نیست اما از آنجا که افزایش ROS و التهاب در نورونها (29) و همچنین افزایش α-Syn (30) در کاهش DJ-1 مؤثر هستند، لذا ممکن است فعالیت به کار رفته در مطالعه حاضر توانسته باشد با ایجاد خاصیت ضد التهابی و آنتیاکسیدانی و همچنین به واسطه کاهش α-Syn موجب افزایش بیان ژن هیپوکامپی DJ-1 شده باشد. از دیگر نتایج مطالعه حاضر، کاهش بیان ژن LRRK2 بر اثر تمرین شنا بود. در همین راستا، کاهش بیان ژن LRRK2 در موشهای تراریخته LRRk2 G2019S پس از اجرای 6 هفته دویدن روی چرخ گردان (15) و ارتباط معکوس بین میزان انجام فعالیت جسمانی و جهش ژن LRRK2 گزارش شده است (16). مطالعات بالینی، علت افزایش LRRK2 در بیماران پارکینسونی را افزایش α-Syn، افزایش استرس اکسایشی، افزایش ROS و افزایش عوامل التهابی عنوان کردهاند (31)، لذا ممکن است کاهش این عوامل بر اثر تمرین شنای بهکار رفته در مطالعه حاضر موجب کاهش LRRK2 شده باشد. در کنار این موارد، ضریب همبستگی پیرسون نشان داد ارتباط معکوس و معنیدار بین بیان ژن DJ-1 و LRRK2 در مطالعه حاضر وجود دارد (0/006=p و 0/59-=r). از اینرو ممکن است تغییرات ایجاد شده هر یک از این دو ژن بر اثر تمرین، بر تغییرات ژن دیگر اثرگذار بوده باشد. در نهایت نتایج نشان داد اگرچه مکمل هسپریدین موجب افزایش معنیدار بیان ژن DJ-1 و کاهش بیان ژن LRRK2 در نمونهها شد، اما مصرف همزمان مکمل و تمرین اثر بیشتری در تغییرات این دو ژن داشت. اگرچه بر اساس اطلاعات ما تاکنون اثر مصرف همزمان مکمل هسپریدین و فعالیت ورزشی بر عوامل مؤثر بر مرگ یا بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون انجام نشده است، اما کاهش LRRK2، کاسپاز 3 و کاسپاز 9 همچنین تعدیل آنتیاکسیدانهای گلوتاتیون پراکسیداز، کاتالاز و سیستم آنتیاکسیدانی تام و افزایش دوپامین در گورخرماهی (Zebrafish) پارکینسونی شده با 6- هیدروکسیدوپامین به دنبال مصرف یک دوره هسپریدین گزارش شده است (32). در این مطالعه مشخص شد مصرف 28 روز هسپریدین با دوز 50 میلی گرم به ازای هر کیلو وزن بدن، موجب جلوگیری از مرگ نورونهای دوپامینرژیک، جلوگیری از افت فاکتورهای نوروتروفیک و کاهش واکنشهای التهابی عصبی میشود (32). اخیراً کاهش مؤلفههای استرس اکسایشی و بهبود ژنهای مؤثر در بایوژنز میتوکندری در تورونهای دوپامینرژیک پس از استفاده یک دوره هسپریدین در مگس سرکه مبتلا به پارکینسون گزارش شده است (33). همچنین Nagappan و Krishnamurthy دریافتند دریافت 50 میلیگرم هسپریدین به ازای هر کیلو وزن بدن و طی 24 روز متوالی موجب کاهش بیان ژن LRRK2 در بافت مغز موشهای مبتلا به پارکینسون میشود (34). این محققین اعلام کردند هسپریدین با توجه به خاصیت آنتیاکسیدانی خود، با کاهش بیان ژن LRRK2 موجب حفظ و بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون میشود (34). مطالعه حاضر با محدودیتهایی همراه بود. در این مطالعه تغییرات شاخصهای استرس اکسایشی، ظرفیت آنتیاکسیدانی و همچنین تغییرات α-Syn بررسی نشد. بررسی این شاخصها میتوانست مکانیسمهای مربوط به تغییرات بیان ژن DJ-1 و LRRK2 بر اثر تمرین شنا و مصرف مکمل هسپریدین را بهتر توضیح دهد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد تمرینات شنا و مکمل هسپریدین موجب افزایش بیان ژن DJ-1 و کاهش بیان ژن LRRK2 در هیپوکامپ نمونههای حیوانی مبتلا به پارکینسون میشود و اثر مصرف همزمان این مکمل و فعالیت شنا، اثرات به مراتب مطلوبتری دارد. لذا بهطور کلی بهنظر میرسد اجرای تمرینات شنا و مصرف هسپریدین به واسطه افزایش DJ-1 و کاهش LRRK2 در حفظ و بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون مؤثر باشد هرچند برای تعمیم این نتایج به نمونههای انسانی نیازمند مطالعات بیشتری است.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد دانشجو است. از کلیه پرسنل آزمایشگاه حیوانی دانشگاه آزاد اسلامی شیراز و آزمایشگاه هیستوپاتولوژی که در پیشبرد این مطالعه به نویسندگان کمک کردند تشکر و قدردانی میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
کلیه مراحل تحقیق به تأیید کمیته اخلاق معاونت پژوهشی دانشگاه آزاد اسلامی واحد شیراز رسید و کد اخلاق نیز با شماره IR.IAU.SHIRAZ.REC.1402.054 توسط این کمیته صادر گردید.
مشارکت نویسندگان
مهرزاد مقدسی و زهرا مصلینژاد در ارائه ایده، تمام نویسندگان در طراحی مطالعه، سمیه رشیدفرد و اسماء تراز در جمعآوری دادهها، مهرزاد مقدسی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
پارکینسون یک اختلال نورودژنراتیو است که در آن، به دلیل عوامل ژنتیکی، محیطی و افزایش سن، نورونهای دوپامینرژیک تحتتأثیر قرار میگیرند (1). دو مکانیسم برای تخریب نورونهای دوپامینرژیک در بیماری پارکینسون مطرح شده است. اولین مکانیسم، تجمع تودههای پروتئینی به نام اجسام لویی (Lewy bodies) در نورونها است که بخش اصلی اجسام لویی را آلفا سینوکلئین (α-Syn) تشکیل میدهد (2). تجمع α-Syn گام اصلی در پاتوژنز بیماری پارکینسون بهشمار میرود (3). دومین مکانیسم، اختلال در عملکرد میتوکندریهای نورونهای دوپامینرژیک است (4). بر اساس این مکانیسم، کاهش پروتئینهای همچون DJ-1 (4) و افزایش پروتئینهایی از قبیل کیناز با توالی تکراری غنی از لوسین-2 (LRRK2) (5) موجب اختلال در عملکرد میتوکندری نورونهای دوپامینرژیک و تحلیل آنها میشود. پروتئین DJ-1، یک پروتئین چند عملکردی است که میتواند مسیرهای رونویسی و سیگنالی انتقالی را تنظیم کند، گونههای واکنشپذیر اکسیژن (ROS) Reactive oxygen spices را حذف نموده و به عنوان یک آنزیم عمل نماید (6)؛ پروتئینهای حساس به ردوکس را کددهی میکند، موجب کاهش بیان α-Syn در نورونهای دوپامینرژیک میشود و در نهایت میتواند با فعال کردن عامل دو وابسته به فاکتور هستهای اریتروئید-2 (Nrf2) موجب بایوژنز میتوکندری در نورونهای دوپامینرژیک شده حفظ و بقاء این نورونها را بهدنبال دارد (7). همچنین DJ-1 با تعدیل فعالیت برخی از سلولهای سیستم ایمنی بدن انسان شامل سلولهای بیگانهخوار (ماکروفاژها)، ماستسلها و سلولهای T از طریق مکانیسمهای وابسته به ROS و مکانیسمهای مستقل از ROS، عملکرد تنظیم سیستم ایمنی در بدن انسان را اعمال میکند (8). تمام این عملکردها، جزء واکنشهای ضد استرس اکسایشی این پروتئین محسوب میشوند (9) که میتواند در نهایت منجر به حفاظت از نرونهای دوپامینرژیک در بیماری پارکینسون گردد (10). از طرف دیگر، LRRK2 بهعنوان یک کیناز عمل میکند و جهش آن با اختلال در عملکرد میتوکندری، استرس اکسایشی و پاسخهای التهابی همراه است (11). مشخص شده است که جهش در LRRK2 از دو مسیر، یکی بهواسطه فعال کردن پروتئینکیناز فعالکننده میتوژن (MAPK) و دیگری به واسطه فعالکردن α-Syn موجب اختلال در عملکرد میتوکندری، ایجاد التهاب عصبی و افزایش استرس اکسایشی در نورونها و در نتیجه مرگ نورونهای دوپامینرژیک میگردد (12). افزایش سطح خونی و بیان ژن LRRK2، این پروتئین را به عنوان یکی از عوامل خطرزای بیماری پارکینسون معرفی کرده است (5). مطالعات در خصوص اثر فعالیت ورزشی بر تغییرات DJ-1 و LRRK2 در نمونههای مبتلا به پارکینسون بسیار محدود است. Zhou و همکاران در سال 2017 شاهد افزایش غلظت خونی و بیان ژن عضلانی DJ-1 در نمونههای حیوانی مبتلا به پارکینسون پس از یک هفته دویدن روی چرخ گردان بودند (13). Viana و همکاران در سال 2017 نیز گزارش کردهاند در موشهایی که 30 روز قبل از القاء و 11 روز پس از القاء پارکینسون فعالیت ورزشی هوازی داشتند، بیان ژن هیپوکامپی DJ-1 افزایش معنیداری داشته است (14). در خصوص اثر فعالیت ورزشی بر تغییرات LRRK2 در نمونههای مبتلا به پارکینسون تنها دو مطالعه به دست آمد. در اولین مطالعه اشاره شده است که اجرای 6 هفته دویدن روی چرخ گردان به صورت اختیاری، با کاهش LRRK2 موجب جلوگیری از کاهش نورونزایی در موشهای تراریخته میشود (15). در دیگر مطالعه، ارتباط معکوس بین میزان فعالیت جسمانی و جهش ژن LRRK2 در بیماران مبتلا به پارکینسون گزارش شده است (16). مطالعات نشان دادهاند که فعالیت ورزشی میتواند با افزایش عوامل نروتروفیک مشتق از گلیال و تعدیل التهاب عصبی در حفظ و بقاء سیستم دوپامینرژیک بیماران مبتلا به پارکینسون مؤثر باشد (17) اما حفظ و بقاء نورونهای دوپامینرژیک بر اثر فعالیت ورزشی و به واسطه تغییر در بیان ژنهای DJ-1 و LRRK2 تاکنون مورد بررسی قرار نگرفته است. علاوه بر این، مطالعات نشان دادهاند که اجرای تمرینات در آب بر خلاف تمرینات در خشکی، به دلیل خواص هیدرودینامیکی و ایجاد شرایط بیوزنی موجب کاهش صدمات ناشی از تمرین میشود (18)، لذا در مطالعه حاضر، تمرین شنا به عنوان یک شیوه تمرینی ایمن در نظر گرفته شد. از سویی با توجه به نقش رژیم غذایی در سلامت افراد و استفاده از آنتیاکسیدانهای طبیعی در کنار فعالیت ورزشی، این دو در کنار یکدیگر به عنوان موضوع مورد علاقه تحقیق اکثر محققین قرار گرفته است. هسپریدین با فرمول مولکولی C28H14O15 یکی از آنتیاکسیدانهای طبیعی است که به وفور در مرکباتی نظیر گریپفروت، لیمو و پرتقال یافت میشود (19). هسپریدین با داشتن خواص آنتیاکسیدانی و ضدالتهابی، سبب حفاظت نورونی میگردد و در نتیجه در پیشگیری و درمان بیماریهای ناشی از استرس اکسایشی مؤثر است (20). از شاخصترین مکانیسمهای متعدد محافظت نورونی هسپریدین میتوان به ممانعت از تشکیل ROS، کاهش آسیب غشاء و افزایش فعالیت آنزیمهای آنتی اکسیدانی اشاره کرد. نتایج مطالعات اخیر نشان داده است که ترکیباتی همچون هسپریدین در جلوگیری از بروز بیماریهای مزمن و تحلیل برنده عصبی، مانند آلزایمر و پارکینسون مؤثر است و یا دست کم میتواند شروع آنها را به تأخیر بیندازد (22،21). فرض مطالعه حاضر آن است که استفاده از آنتیاکسیدان هسپریدین در کنار فعالیت شنا بتواند بهواسطه کاهش استرس اکسایشی و با افزایش دادن DJ-1 و کاهش LRRK2، حفظ و بقاء نورونهای دوپامینرژیک را ارتقاء و بدین واسطه در بهبود بیماری پارکینسون مؤثر باشد. از آنجا که بر اساس اطلاعات ما تا کنون اثر این ماده آنتیاکسیدانی در کنار فعالیت ورزشی بر حفظ و بقاء نورونهای دوپامینرژیک در افراد مبتلا به پارکینسون بررسی نشده است، لذا مطالعه حاضر با هدف بررسی اثر یک دوره تمرین شنا همراه با مصرف هسپریدین بر بیان ژنهای مرتبط با بقاء نورونهای دپامینرژیک در مدل حیوانی پارکینسون اجرا شد.
روش بررسی
مطالعه حاضر جزء مطالعات تجربی با طرح پس آزمون با گروه کنترل بود. تعداد 25 سرموش نر صحرایی نژاد ویستار 8 تا 10 هفتهای و با میانگین وزن 10/6 ± 205 گرم از مرکز پرورش و تکثیر حیوانات آزمایشگاهی انستیتو رازی کرج خریداری و به آزمایشگاه حیوانی دانشگاه آزاد اسلامی واحد شیراز منتقل شدند. تعداد نمونه در هر گروه بر حسب قوانین برآورد حجم نمونه بر اساس مقدار درجه آزادی (20=df) و تعداد گروه (5=n) در نظر گرفته شد (23). به منظور سازگاری با محیط آزمایشگاه، حیوانات به مدت یک هفته درون قفسهای پلاستیکی در شرایط استاندارد (دمای 2 ± 23/2 درجه سانتیگراد و رطوبت نسبی 45 درصد) نگهداری شدند. دسترسی به آب و غذا در طول تحقیق آزادانه بود و چرخه خواب و بیداری 12/12 ساعت تاریکی- روشنایی حفظ شد. از تعداد 20 سرموش، 5 سرموش به عنوان گروه سالم در نظر گرفته شد و 20 سرموش دیگر با تزریق درون صفاقی ماده رزرپین (ساخت شرکت سیگما آلدریچ کشور هند) به میزان یک میلیگرم به ازای هر کیلوگرم وزن بدن، بیماری پارکینسون القاء شد. تزریق رزرپین به مدت پنج روز متوالی با یک برنامه منظم در شبانه روز انجام شد. پس از پایان دوره القاء و به منظور تأیید القاء بیماری، سه سر موش (یک موش سالم و دو موش تحت تزریق رزرپین) برای انجام عکسبرداری از بافت مغز انتخاب شدند. به منظور ارزیابی کیفی بافت هیپوکامپ در نواحی CA1 و CA3 سه سر موش ذکر شده با قرار گرفتن در دسیکاتور حاوی کلروفورم بهطور عمیق بیهوش شدند و بلافاصله پرفیوژن قلبی با جایگزینی فرمالین 10 درصد متعاقب شستشوی خون از بدن با کلرور سدیم انجام شد. در پایان، مغز با دقت از جمجمه خارج و پردازش بافتی صورت گرفت. پس از تهیه بلوکهای پارافینه، برشگیری از ناحیه هیپوکامپ مغز به کمک راهنمای اطلس پاکسینوس و واتسون انجام شد. با استفاده از رنگ هماتوکسیلین- ائوزین (H-E) رنگآمیزی اسلایدها انجام شد. مطالعات میکروسکوپی با استفاده از میکروسوپ نوری المپیکوس مدل GH2 ساخت کشور ژاپن صورت گرفت. لامها مورد مطالعه و مقایسه قرار گرفتهاند و از مقاطع به وسیله دستگاه فتومیکروسکوپ المپیکوس مدل DP 12-2 ساخت کشور ژاپن عکسبرداری شد. بزرگنمایی مجموع تصویرهای به دست آمده، با توجه به بزرگنمایی عدسی میکروسکوپ و دوربین تصویربرداری x40 بوده است (24). شکل 1 میکروگراف حاصل از نواحی CA1و CA3 هیپوکامپ را نشان میدهد. شکلهای A و B مربوط به موشهای سالم و شکلهای C و D مربوط به موشهای بیمار است. همانطور که فلشها نشان میدهد در نواحی CA1و CA3 موشهای بیمار، نورونهای تحلیلرفته، سیتوپلاسم رنگ نشده، هستههای متراکم یا قطعه قطعه شده و غشاء سلولی آسیب دیده مشخص است. علاوه بر این، در مقایسه با موشهای سالم، کاهش قابلتوجه تعداد سلولها در سطح مقطع مورد بررسی مشاهده میشود که این امر نشان دهنده وقوع مرگ سلولی گسترده در ناحیه CA1 و CA3 در موشهای القاء بیماری پارکینسون است. با حصول اطمینان از القاء بیماری پارکینسون، 18 سرموش باقیمانده (2 سرموش از گروه تزریق رزرپین طی آزمون اطمینان از القاء بیماری قربانی شدند) بهطور تصادفی در گروههای بیمار (4 سرموش)، هسپریدین (4 سرموش)، شنا (5 سرموش) و شنا+ هسپریدین (5 سرموش) قرار گرفتند. موشهای گروه شنا و گروه شنا + هسپریدین ابتدا به مدت یک هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتیمتر و ارتفاع 80 سانتیمتر) را پیش از شروع دوره تمرینات اصلی گذراندند. در روز اول این دوره، موشها با نهایت دقت و آرامش در استخر حیوانات قرار داده شدند و با سرعت دلخواه به مدت پنج دقیقه شنا کردند. در جلسات بعد و پس از آشناسازی کافی با تمرین شنا، برای آموزش شنای تناوبی، چند بار پس از یک دقیقه شنا حیوانات بهوسیله صفحه استراحت از آب بیرون آورده و مجدد در آب قرار داده میشدند. برنامه اصلی تمرین شنای تناوبی شدید شش هفته بود که سه روز در هفته و بهصورت یک روز در میان اجرا شد. در این شیوه تمرینی، بار اعمال شده در هفته اول وزنهای به میزان هفت درصد وزن بدن هر موش صحرایی بود که به دم آنها بسته و هر هفته به میزان یک درصد به وزن آن اضافه گردید؛ به طوری که، در هفته آخر موشها با وزنهای به میزان 12 درصد بدن خود تمرین شنا را انجام دادند (25). پس از هر جلسه تمرین در آب، موش های صحرایی با حوله خشک و به محل نگهداری منتقل میشدند. طی دوران مطالعه، نمونههای گروه کنترل سالم و گروه بیمار، هیچگونه برنامه تمرینی نداشتند. مشخصات برنامه تمرینی در جدول 1 نشان داده شده است. نمونههای گروههای هسپریدین و شنا + هسپریدین با یک برنامهریزی مشخص در معرض مصرف آنتیاکسیدان هسپریدین قرار داده شدند؛ بدین ترتیب که روزهایی که تمرین شنا نداشتند، مکمل هسپریدین به میزان 50 میلیگرم بر کیلوگرم وزن بدن موش از طریق گاواژ به این موشها خورانده شد (26). 48 ساعت بعد از آخرین جلسه تمرینی، با تزریق درون صفاقی کتامین (50 میلیگرم به ازای هر کیلوگرم وزن بدن) و زایلازین (3 میلیگرم به ازای هر کیلوگرم وزن بدن) نمونهها بیهوش شدند. بافت هیپوکامپ خارج و بلافاصله برای سنجشهای بعدی به آزمایشگاه منتقل و در دمای منهای 80 درجه سانتیگراد فریز شدند. پس از جداسازی بافت هیپوکامپ، مرحله جداسازی mRNA توسط کیت مخصوص FavorPrep™ Tissue Total RNA Mini Kit (Farvorgen Biotech, Changzhi Township, Taiwan) و بر اساس دستوالعمل کیت انجام شد. یک میکروگرم از RNA استخراج شده با کمک کیت RevertAaid™ First Strand cDNA Synthesis ، (Fermentas) طبق دستورالعمل کیت جهت سنتز CDNA استفاده شد. واکنش real-time PCR (qRT-PCR) با کمک آنزیم RealQ Plus 2x Master Mix Green (Ampliqon, Inc) و با استفاده از دستگاه applied Biosystems StepOne™ (USA) صورت گرفت. به منظور بررسی بیان ژنهای هدف DJ-1 و LRRK2 از ژن کنترل TBP استفاده شد. از آب به عنوان کنترل منفی واکنش PCR در هر دور از واکنش PCR برای هر ژن استفاده شد. مخلوط واکنش بر اساس پروتکل پیشنهادی آماده شد. برنامه زمانی- گرمایی دستگاه طبق مراحل زیر انجام شد. مرحله اول که منجر به واسرشته شدن (Denaturation) مولکولهای CDNA به صورت 95 درجه سانتیگراد به مدت 10 دقیقه، مرحله دوم 95 درجه سانتیگراد به مدت 15 ثانیه و 60 درجه سانتیگراد به مدت 1 دقیقه برای 40 چرخه متوالی بود و در مرحله آخر ضمن بررسی نمودار ذوب، محصولات توسط الکتروفورز در سطح ژل آگارز مورد ارزیابی قرار گرفت.
تجزیه و تحلیل دادهها
برای بررسی توزیع طبیعی دادهها از آزمون شاپیرو- ویلک استفاده شد. از آنجا که دادهها دارای توزیع طبیعی بودند، تغییرات متغیرهای مورد مطالعه توسط آزمون تحلیل واریانس یک راهه همراه با آزمون تعقیبی توکی و بررسی اثرات اصلی و اثر متقابل شنا و مصرف هسپریدین بر متغیرها، توسط تحلیل واریانس دوراهه بررسی شدند. تجزیه و تحلیل یافتهها با نرمافزارversion 16 SPSS و در سطح معنیداری p< 0/05 انجام شد.

شکل 1: ارزیابی هیستوپاتولوژیک القاء بیماری پارکینسون
جدول 1: لیست پرایمرهای استفاده شده

نتایج
همانطور که در شکل 2 مشاهده میشود، نتایج آزمون تحلیل واریانس یک راهه نشان داد تفاوت معنیداری در بیان ژن DJ-1 بین نمونهها در گروههای تحقیق وجود دارد (0/0001=P و 166/22=F). با مشاهده نتایج آزمون تعقیبی توکی مشخص شد بیان ژن DJ-1 در گروه بیمار به طور معنیداری کمتر از گروه کنترل سالم بود (0/001>P). بیان ژن DJ-1 در گروههای هسپریدین، شنا و شنا + هسپریدین به طور معنیداری بیشتر از گروه بیمار (0/001>P) بود. همچنین نتایج نشان داد بیان ژن DJ-1 در گروههای شنا و شنا + هسپریدین بهطور معنیداری بیشتر از گروه هسپریدین به تنهایی بود بیان ژن این پروتئین در گروه شنا + هسپریدین به طور معنیداری بیشتر از گروه شنا بود (0/001>P). برای بررسی نحوه اثر تعاملی تمرین و هسپریدین بر بیان DJ-1 از آزمون آنالیز واریانس دو راهه استفاده شد. نتایج این آزمون نشان داد عامل تمرین (P=0/001، F=381/15 و اندازه اثر0/96) و هسپریدین (P=0/001، F=133/84 و اندازه اثر0/89) اثر معنیداری بر افزایش بیان ژن DJ-1 در موشهای صحرایی مبتلا به پارکینسون دارند. علاوه بر این تمرین و هسپریدین دارای اثر سینرژیستی بر افزایش بیان ژن DJ-1 در موشهای صحرایی مبتلا به بیماری پارکینسون دارد (P=0/001، F=32/86 و اندازه 0/67). نتایج آزمون آنالیز واریانس یک راهه نشان داد تفاوت معنیداری بر بیان LRRK2 در بافت هیپوکامپ موشهای صحرایی در گروههای مختلف تحقیق وجود دارد (0/001=P و 551/91=F، شکل 3). نتایج آزمون تعقیبی توکی نشان داد بیان ژن LRRK2 در گروه بیمار به طور معنیداری بیشتر از گروه سالم بود (0/001>P). همچنین، بیان ژن LRRK2 در گروههای هسپریدین، شنا و شنا + هسپریدین بهطور معنیداری کمتر از گروه بیمار (0/001>P). همچنین مشخص شد بیان ژن LRRK2 در گروههای شنا و شنا + هسپریدین بهطور معنیداری کمتر از گروه هسپریدین بود (0/001>P)، اما تفاوت معنیداری در گروههای شنا + هسپریدین و شنا مشاهده نشد (0/21=P). نتایج آزمون آنالیز واریانس دو راهه در خصوص نحوه اثر تعاملی تمرین و هسپریدین بر بیان LRRK2 در بافت هیپوکامپ نشان داد عامل تمرین (P=0/001، F=1313/21 و اندازه اثر 0/98) و هسپریدین (P=0/001، F=799/91 و اندازه اثر 0/98) اثر معنیداری بر کاهش بیان LRRK2 در بافت هیپوکامپ موشهای صحرایی مبتلا به پارکینسون دارند. علاوه بر این تمرین و هسپریدین دارای اثر سینرژیستی بر کاهش بیان LRRK2 در بافت هیپوکامپ دارد (P=0/001، F=613/89 و اندازه 0/97).

شکل 2. مقادیر بیان نسبی ژن DJ-1 در موشهای صحرایی گروههای مختلف
a (P<0/001) کاهش معنیدار نسبت به گروه سالم؛ b (P<0/001) افزایش معنیدار نسبت به گروه بیمار؛ c (P<0/001) افزایش معنیدار نسبت به گروه هسپریدین؛ d (P<0/001) افزایش معنیدار نسبت به گروه شنا.

شکل 3: مقادیر بیان ژنی LRRK2 در بافت هیپوکامپ موشهای صحرایی در گروههای تحقیق
a (P<0/001) افزایش معنیدار نسبت به گروه سالم؛ b (P<0/001) کاهش معنیدار نسبت به گروه بیمار؛ c (P<0/001) کاهش معنیدار نسبت به گروه هسپریدین
بحث
مطالعه حاضر با هدف بررسی اثر یک دوره تمرین شنا همراه با مصرف هسپریدین بر بیان ژنهای مرتبط با بقاء نورونهای دپامینرژیک در مدل حیوانی پارکینسون انجام شد. نتایج این مطالعه داد بیان ژن هیپوکامپی DJ-1 در گروه بیمار نسبت به گروه سالم بهطور معنیداری پایینتر و بیان ژن هیپوکامپی LRRK2 در گروه بیمار نسبت به گروه سالم بهطور معنیداری بالاتر بود. همراستا با نتایج مطالعه حاضر، در دیگر مطالعات نیز کاهش DJ-1 (6) و افزایش LRRK2 (5،7) در نمونههای انسانی و حیوانی مبتلا به پارکینسون گزارش شده است. افزایش LRRK2 در 1 تا 6 درصد افراد مبتلا به پارکینسون بدون سابقه فامیلی و در 3 تا 19 درصد افراد مبتلا به پارکینسون به دلایل سابقه فامیلی و ژنتیکی گزارش شده است (27)؛ تا جاییکه از آن به عنوان یک شاخص معتبر بین پارکینسون ناشی از ژنتیک و پارکینسون ناشناخته در نظر گرفته میشود (5). مطالعات بالینی گذشته نیز نشان دادهاند به دلیل کاهش DJ-1 (4) و افزایش LRRK2 (5)، در عملکرد میتوکندری نورونهای دوپامینرژیک اختلال ایجاد شده و این موضوع یکی از مهمترین مکانیسمهای تحلیل این نوع نورونها در بیماری پارکینسون است. پروتئین DJ-1 نقشهای متعددی از جمله محافظت از نورونهای دوپامینرژیک در برابر ROS داشته و با کاهش ROS موجب بقاء این نوع نورونها میشود (6). علاوه بر این مشاهده شده است که این پروتئین موجب افزایش کارآیی میتوکندریها در نرونهای دوپامینرژیک میگردد (28). از سوی دیگر، جهش در LRRK2 به واسطه فعال کردن MAPK و α-Syn، موجب اختلال در عملکرد میتوکندری، ایجاد التهاب عصبی و افزایش استرس اکسایشی در نورونها شده و مرگ نورونهای دوپامینرژیک را به همراه دارد (12). از دیگر یافتههای مطالعه حاضر، افزایش بیان ژن DJ-1 بر اثر تمرین شنا بود. اگرچه مطالعات در خصوص اثر فعالیت ورزشی بر تغییرات DJ-1 در نمونههای پارکینسونی اندک است، اما همراستا با نتایج مطالعه حاضر، پیش از این نیز افزایش غلظت خونی و بیان ژن عضلانی DJ-1 در نمونههای حیوانی مبتلا به پارکینسون پس از یک هفته دویدن روی چرخگردان (13) و افزایش بیان ژن هیپوکامپی DJ-1 در موشهای پارکینسونی که فعالیت ورزشی هوازی داشتهاند (14) گزارش شده است. علت افزایش DJ-1 بر اثر فعالیت ورزشی به وضوح مشخص نیست اما از آنجا که افزایش ROS و التهاب در نورونها (29) و همچنین افزایش α-Syn (30) در کاهش DJ-1 مؤثر هستند، لذا ممکن است فعالیت به کار رفته در مطالعه حاضر توانسته باشد با ایجاد خاصیت ضد التهابی و آنتیاکسیدانی و همچنین به واسطه کاهش α-Syn موجب افزایش بیان ژن هیپوکامپی DJ-1 شده باشد. از دیگر نتایج مطالعه حاضر، کاهش بیان ژن LRRK2 بر اثر تمرین شنا بود. در همین راستا، کاهش بیان ژن LRRK2 در موشهای تراریخته LRRk2 G2019S پس از اجرای 6 هفته دویدن روی چرخ گردان (15) و ارتباط معکوس بین میزان انجام فعالیت جسمانی و جهش ژن LRRK2 گزارش شده است (16). مطالعات بالینی، علت افزایش LRRK2 در بیماران پارکینسونی را افزایش α-Syn، افزایش استرس اکسایشی، افزایش ROS و افزایش عوامل التهابی عنوان کردهاند (31)، لذا ممکن است کاهش این عوامل بر اثر تمرین شنای بهکار رفته در مطالعه حاضر موجب کاهش LRRK2 شده باشد. در کنار این موارد، ضریب همبستگی پیرسون نشان داد ارتباط معکوس و معنیدار بین بیان ژن DJ-1 و LRRK2 در مطالعه حاضر وجود دارد (0/006=p و 0/59-=r). از اینرو ممکن است تغییرات ایجاد شده هر یک از این دو ژن بر اثر تمرین، بر تغییرات ژن دیگر اثرگذار بوده باشد. در نهایت نتایج نشان داد اگرچه مکمل هسپریدین موجب افزایش معنیدار بیان ژن DJ-1 و کاهش بیان ژن LRRK2 در نمونهها شد، اما مصرف همزمان مکمل و تمرین اثر بیشتری در تغییرات این دو ژن داشت. اگرچه بر اساس اطلاعات ما تاکنون اثر مصرف همزمان مکمل هسپریدین و فعالیت ورزشی بر عوامل مؤثر بر مرگ یا بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون انجام نشده است، اما کاهش LRRK2، کاسپاز 3 و کاسپاز 9 همچنین تعدیل آنتیاکسیدانهای گلوتاتیون پراکسیداز، کاتالاز و سیستم آنتیاکسیدانی تام و افزایش دوپامین در گورخرماهی (Zebrafish) پارکینسونی شده با 6- هیدروکسیدوپامین به دنبال مصرف یک دوره هسپریدین گزارش شده است (32). در این مطالعه مشخص شد مصرف 28 روز هسپریدین با دوز 50 میلی گرم به ازای هر کیلو وزن بدن، موجب جلوگیری از مرگ نورونهای دوپامینرژیک، جلوگیری از افت فاکتورهای نوروتروفیک و کاهش واکنشهای التهابی عصبی میشود (32). اخیراً کاهش مؤلفههای استرس اکسایشی و بهبود ژنهای مؤثر در بایوژنز میتوکندری در تورونهای دوپامینرژیک پس از استفاده یک دوره هسپریدین در مگس سرکه مبتلا به پارکینسون گزارش شده است (33). همچنین Nagappan و Krishnamurthy دریافتند دریافت 50 میلیگرم هسپریدین به ازای هر کیلو وزن بدن و طی 24 روز متوالی موجب کاهش بیان ژن LRRK2 در بافت مغز موشهای مبتلا به پارکینسون میشود (34). این محققین اعلام کردند هسپریدین با توجه به خاصیت آنتیاکسیدانی خود، با کاهش بیان ژن LRRK2 موجب حفظ و بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون میشود (34). مطالعه حاضر با محدودیتهایی همراه بود. در این مطالعه تغییرات شاخصهای استرس اکسایشی، ظرفیت آنتیاکسیدانی و همچنین تغییرات α-Syn بررسی نشد. بررسی این شاخصها میتوانست مکانیسمهای مربوط به تغییرات بیان ژن DJ-1 و LRRK2 بر اثر تمرین شنا و مصرف مکمل هسپریدین را بهتر توضیح دهد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد تمرینات شنا و مکمل هسپریدین موجب افزایش بیان ژن DJ-1 و کاهش بیان ژن LRRK2 در هیپوکامپ نمونههای حیوانی مبتلا به پارکینسون میشود و اثر مصرف همزمان این مکمل و فعالیت شنا، اثرات به مراتب مطلوبتری دارد. لذا بهطور کلی بهنظر میرسد اجرای تمرینات شنا و مصرف هسپریدین به واسطه افزایش DJ-1 و کاهش LRRK2 در حفظ و بقاء نورونهای دوپامینرژیک در نمونههای مبتلا به پارکینسون مؤثر باشد هرچند برای تعمیم این نتایج به نمونههای انسانی نیازمند مطالعات بیشتری است.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد دانشجو است. از کلیه پرسنل آزمایشگاه حیوانی دانشگاه آزاد اسلامی شیراز و آزمایشگاه هیستوپاتولوژی که در پیشبرد این مطالعه به نویسندگان کمک کردند تشکر و قدردانی میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
کلیه مراحل تحقیق به تأیید کمیته اخلاق معاونت پژوهشی دانشگاه آزاد اسلامی واحد شیراز رسید و کد اخلاق نیز با شماره IR.IAU.SHIRAZ.REC.1402.054 توسط این کمیته صادر گردید.
مشارکت نویسندگان
مهرزاد مقدسی و زهرا مصلینژاد در ارائه ایده، تمام نویسندگان در طراحی مطالعه، سمیه رشیدفرد و اسماء تراز در جمعآوری دادهها، مهرزاد مقدسی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Pitz V, Makarious MB, Bandres-Ciga S, Iwaki H, Singleton AB, Nalls M, et al. Analysis of Rare Parkinson’s Disease Variants in Millions of People. Npj Parkinson's Disease 2024; 10(11): 1-10.
2- Yang J, Luo S, Zhang J, Yu T, Fu Z, Zheng Y, et al. Exosome-Mediated Delivery of Antisense Oligonucleotides Targeting Alpha-Synuclein Ameliorates the Pathology in a Mouse Model of Parkinson’s Disease. Neurobiol Dis 2021; 148: 105218.
3- Miller KM, Mercado NM, Sortwell CE. Synucleinopathy-Associated Pathogenesis in Parkinson’s Disease and the Potential for Brain-Derived Neurotrophic Factor. npj Parkinson’s Dis 2021; 7: 35.
4- Rademacher K, Nakamura K. Role of Dopamine Neuron Activity in Parkinson's Disease Pathophysiology. Exp Neurol 2024, 373: 114645.
5- Sosero YL, Gan-Or Z. LRRK2 and Parkinson's Disease: From Genetics to Targeted Therapy. Ann Clin Transl Neurol 2023; 10(6): 850-64.
6- Tashiro S, Caaveiro JM, Nakakido M, Tanabe A, Nagatoishi S, Tamura Y, et al. Discovery and Optimization of Inhibitors of the Parkinson’s Disease Associated Protein DJ-1. ACS Chem Biol 2018; 13(9): 2783-93.
7- Sarkar A, Singh MP. A Complex Interplay of Dj-1, Lrrk2, And Nrf2 in the Regulation of Mitochondrial Function in Cypermethrin-Induced Parkinsonism. Mol Neurobiol 2024; 61(2): 953-70.
8- Zhang L, Wang J, Wang J, Yang B, He Q, Weng Q. Role Of DJ-1 In Immune and Inflammatory Diseases. Front Immunol 2020; 11: 994.
9- Tashiro S, Caaveiro JM, Nakakido M, Tanabe A, Nagatoishi S, Tamura Y, et al. Discovery and Optimization of Inhibitors of the Parkinson’s Disease Associated Protein DJ-1. ACS Chemic Biol 2018; 13(9): 2783-93.
10- Dolgacheva LP, Berezhnov AV, Fedotova EI, Zinchenko VP, Abramov AY. Role of DJ-1 in the Mechanism of Pathogenesis of Parkinson's Disease. J Bioenerg Biomembr 2019; 51(3): 175-88.
11- Rui Q, Ni H, Li D, Gao R, Chen G. The Role of LRRK2 in Neurodegeneration of Parkinson Disease. Curr Neuropharmacol 2018; 16(9): 1348-57.
12- Rui Q, Ni H, Li D, Gao R, Chen G. The Role of LRRK2 in Neurodegeneration of Parkinson Disease. Curr Neuropharmacol 2018; 16(9): 1348-57.
13- Zhou W, Barkow JC, Freed CR. Running Wheel Exercise Reduces Α-Synuclein Aggregation and Improves Motor and Cognitive Function in a Transgenic Mouse Model of Parkinson's Disease. PloS One 2017; 12(12): e0190160.
14- Viana SD, Pita IR, Lemos C, Rial D, Couceiro P, Rodrigues-Santos P, et al. The Effects of Physical Exercise on Nonmotor Symptoms and on Neuroimmune RAGE Network in Experimental Parkinsonism. J Appl Physiol 2017; 123(1): 161-71.
15- Winner B, Melrose HL, Zhao C, Hinkle KM, Yue M, Kent C, et al. Adult Neurogenesis and Neurite Outgrowth are Impaired in LRRK2 G2019S Mice. Neurobiol Diseas 2011; 41(3): 706-16.
16- Schootemeijer S, Coker D, Shelton JF, Chanoff E, Rowbotham HM, Darweesh SKL, et al. Exercise Knowledge, Barriers and Motivators among LRRK2 G2019S Mutation Carriers. Parkinson Relate Disord 2023; 113: 105497.
17- Sacheli MA, Neva JL, Lakhani B, Murray DK, Vafai N, Shahinfard E, et al. Exercise Increases Caudate Dopamine Release and Ventral Striatal Activation in Parkinson’s Disease. Mov Disord 2019; 34(12): 1891-900.
18- Nagle EF, Sanders ME, Franklin BA. Aquatic High Intensity Interval Training for Cardiometabolic Health: Benefits and Training Design. Am J Lifestyle Med 2017; 11(1): 64-76.
19- Pyrzynska K. Hesperidin: A Review on Extraction Methods, Stability and Biological Activities. Nutrients 2022; 14(12): 2387.
20- Sawikr Y, Yarla NS, Peluso I, Kamal MA, Aliev G, Bishayee A. Neuroinflammation in Alzheimer's Disease: The Preventive and Therapeutic Potential of Polyphenolic Nutraceuticals. Adv Protein Chem Struct Biol 2017; 108: 33-57.
21- Jung UJ, Kim SR. Beneficial Effects of Flavonoids Against Parkinson's Disease. J Med Food 2018; 21(5): 421-32.
22- Kim J, Wie M, Ahn M, Tanaka A, Matsuda H, Shin T. Benefits of Hesperidin in Central Nervous System Disorders: A Review. Anat Cell Biol 2019; 52(4): 369-77.
23- Alimohamadi Y, Sepandi M. Sample Size in Animal Studies (The Number of Laboratory Animals in A Research Study). Iran J Med Microbiol 2022; 16(2): 173-6.
24- Abdollahnejad Banaderi A, Rafiei Rad M, Edalatmanesh M A, Forozanfar M. The Impacts of Hesperidin on Motor-Cognitive Disorders, Oxidative Damage, and Cholinergic Function in the Hippocampus of a Parkinson's Disease Rat Model. Jundishapur J Nat Pharm Prod 2025; 20(1): e157180
25- Abbasi M, Kordi M, Daryanoosh F. The Effect of Eight Weeks of High-Intensity Interval Swimming Training on the Expression of PGC-1α and IL-6 Proteins and Memory Function in Brain Hippocampus in Rats with Non-Alcoholic Steatohepatitis Induced by High Fat Diet. J Appl Health Stud Sport Physiol 2023; [Persian]
26- Abdollahi H, Edalatmanesh MA, Hosseini SE, Forouzanfar M. The Influence of Hesperidin on Memory, Learning and Oxidative Stress Parameters in Rat Model of Utreoplacental Insufficiency. Feyz, J Kashan Univers Med Sci 2021; 25(1): 704-13. [Persian]
27- Artzi M, Even-Sapir E, Shacham HL, Thaler A, Urterger AO, Bressman S, et al. Dat-SPECT Assessment Depicts Dopamine Depletion Among Asymptomatic G2019S LRRK2 Mutation Carriers. PLoS One 2017; 12: e0175424.
28- Chen S, Annesley SJ, Jasim RA, Fisher PR. The Parkinson’s Disease-Associated Protein DJ-1 Protects Dictyostelium Cells from AMPK-Dependent Outcomes of Oxidative Stress. Cells 2021; 10(8): 1874.
29- Puspita L, Chung SY, Shim J. Oxidative Stress and Cellular Pathologies in Parkinson’s Disease. Mol Brain 2017; 10: 53.
30- Xu CY, Kang WY, Chen YM, Jiang TF, Zhang J, Zhang LN, et al. DJ-1 Inhibits Alpha-Synuclein Aggregation by Regulating Chaperone-Mediated Autophagy. Front Aging Neurosci 2017; 9: 308.
31- Tiwari PC, Pal R. The Potential Role of Neuroinflammation and Transcription Factors in Parkinson Disease. Dialog Clin Neurosci 2017; 19(1): 71-80.
32- Kesh S, Kannan RR, Sivaji K, Balakrishnan A. Hesperidin Downregulates Kinases Lrrk2 and Gsk3β in a 6-OHDA Induced Parkinson’s Disease Model. Neurosci Letter 2021; 740: 135426.
33- Adedara AO, Bressan GN, Dos Santos MM, Fachinetto R, Abolaji AO, Barbosa NV. Antioxidant Responses Driven by Hesperetin and Hesperidin Counteract Parkinson's Disease-Like Phenotypes in Drosophila Melanogaster. Neurotoxicol 2024; 101: 117-27.
34- Nagappan P, Krishnamurth V. Hesperidin A Bioflavonoid Modulates the Expression Levels of SNCA and PARKIN in 6-Hydroxydopamine Induced Neurotoxicity in Rats. Int J Pharm 2015; 5(1): 219-24.
1- Pitz V, Makarious MB, Bandres-Ciga S, Iwaki H, Singleton AB, Nalls M, et al. Analysis of Rare Parkinson’s Disease Variants in Millions of People. Npj Parkinson's Disease 2024; 10(11): 1-10.
2- Yang J, Luo S, Zhang J, Yu T, Fu Z, Zheng Y, et al. Exosome-Mediated Delivery of Antisense Oligonucleotides Targeting Alpha-Synuclein Ameliorates the Pathology in a Mouse Model of Parkinson’s Disease. Neurobiol Dis 2021; 148: 105218.
3- Miller KM, Mercado NM, Sortwell CE. Synucleinopathy-Associated Pathogenesis in Parkinson’s Disease and the Potential for Brain-Derived Neurotrophic Factor. npj Parkinson’s Dis 2021; 7: 35.
4- Rademacher K, Nakamura K. Role of Dopamine Neuron Activity in Parkinson's Disease Pathophysiology. Exp Neurol 2024, 373: 114645.
5- Sosero YL, Gan-Or Z. LRRK2 and Parkinson's Disease: From Genetics to Targeted Therapy. Ann Clin Transl Neurol 2023; 10(6): 850-64.
6- Tashiro S, Caaveiro JM, Nakakido M, Tanabe A, Nagatoishi S, Tamura Y, et al. Discovery and Optimization of Inhibitors of the Parkinson’s Disease Associated Protein DJ-1. ACS Chem Biol 2018; 13(9): 2783-93.
7- Sarkar A, Singh MP. A Complex Interplay of Dj-1, Lrrk2, And Nrf2 in the Regulation of Mitochondrial Function in Cypermethrin-Induced Parkinsonism. Mol Neurobiol 2024; 61(2): 953-70.
8- Zhang L, Wang J, Wang J, Yang B, He Q, Weng Q. Role Of DJ-1 In Immune and Inflammatory Diseases. Front Immunol 2020; 11: 994.
9- Tashiro S, Caaveiro JM, Nakakido M, Tanabe A, Nagatoishi S, Tamura Y, et al. Discovery and Optimization of Inhibitors of the Parkinson’s Disease Associated Protein DJ-1. ACS Chemic Biol 2018; 13(9): 2783-93.
10- Dolgacheva LP, Berezhnov AV, Fedotova EI, Zinchenko VP, Abramov AY. Role of DJ-1 in the Mechanism of Pathogenesis of Parkinson's Disease. J Bioenerg Biomembr 2019; 51(3): 175-88.
11- Rui Q, Ni H, Li D, Gao R, Chen G. The Role of LRRK2 in Neurodegeneration of Parkinson Disease. Curr Neuropharmacol 2018; 16(9): 1348-57.
12- Rui Q, Ni H, Li D, Gao R, Chen G. The Role of LRRK2 in Neurodegeneration of Parkinson Disease. Curr Neuropharmacol 2018; 16(9): 1348-57.
13- Zhou W, Barkow JC, Freed CR. Running Wheel Exercise Reduces Α-Synuclein Aggregation and Improves Motor and Cognitive Function in a Transgenic Mouse Model of Parkinson's Disease. PloS One 2017; 12(12): e0190160.
14- Viana SD, Pita IR, Lemos C, Rial D, Couceiro P, Rodrigues-Santos P, et al. The Effects of Physical Exercise on Nonmotor Symptoms and on Neuroimmune RAGE Network in Experimental Parkinsonism. J Appl Physiol 2017; 123(1): 161-71.
15- Winner B, Melrose HL, Zhao C, Hinkle KM, Yue M, Kent C, et al. Adult Neurogenesis and Neurite Outgrowth are Impaired in LRRK2 G2019S Mice. Neurobiol Diseas 2011; 41(3): 706-16.
16- Schootemeijer S, Coker D, Shelton JF, Chanoff E, Rowbotham HM, Darweesh SKL, et al. Exercise Knowledge, Barriers and Motivators among LRRK2 G2019S Mutation Carriers. Parkinson Relate Disord 2023; 113: 105497.
17- Sacheli MA, Neva JL, Lakhani B, Murray DK, Vafai N, Shahinfard E, et al. Exercise Increases Caudate Dopamine Release and Ventral Striatal Activation in Parkinson’s Disease. Mov Disord 2019; 34(12): 1891-900.
18- Nagle EF, Sanders ME, Franklin BA. Aquatic High Intensity Interval Training for Cardiometabolic Health: Benefits and Training Design. Am J Lifestyle Med 2017; 11(1): 64-76.
19- Pyrzynska K. Hesperidin: A Review on Extraction Methods, Stability and Biological Activities. Nutrients 2022; 14(12): 2387.
20- Sawikr Y, Yarla NS, Peluso I, Kamal MA, Aliev G, Bishayee A. Neuroinflammation in Alzheimer's Disease: The Preventive and Therapeutic Potential of Polyphenolic Nutraceuticals. Adv Protein Chem Struct Biol 2017; 108: 33-57.
21- Jung UJ, Kim SR. Beneficial Effects of Flavonoids Against Parkinson's Disease. J Med Food 2018; 21(5): 421-32.
22- Kim J, Wie M, Ahn M, Tanaka A, Matsuda H, Shin T. Benefits of Hesperidin in Central Nervous System Disorders: A Review. Anat Cell Biol 2019; 52(4): 369-77.
23- Alimohamadi Y, Sepandi M. Sample Size in Animal Studies (The Number of Laboratory Animals in A Research Study). Iran J Med Microbiol 2022; 16(2): 173-6.
24- Abdollahnejad Banaderi A, Rafiei Rad M, Edalatmanesh M A, Forozanfar M. The Impacts of Hesperidin on Motor-Cognitive Disorders, Oxidative Damage, and Cholinergic Function in the Hippocampus of a Parkinson's Disease Rat Model. Jundishapur J Nat Pharm Prod 2025; 20(1): e157180
25- Abbasi M, Kordi M, Daryanoosh F. The Effect of Eight Weeks of High-Intensity Interval Swimming Training on the Expression of PGC-1α and IL-6 Proteins and Memory Function in Brain Hippocampus in Rats with Non-Alcoholic Steatohepatitis Induced by High Fat Diet. J Appl Health Stud Sport Physiol 2023; [Persian]
26- Abdollahi H, Edalatmanesh MA, Hosseini SE, Forouzanfar M. The Influence of Hesperidin on Memory, Learning and Oxidative Stress Parameters in Rat Model of Utreoplacental Insufficiency. Feyz, J Kashan Univers Med Sci 2021; 25(1): 704-13. [Persian]
27- Artzi M, Even-Sapir E, Shacham HL, Thaler A, Urterger AO, Bressman S, et al. Dat-SPECT Assessment Depicts Dopamine Depletion Among Asymptomatic G2019S LRRK2 Mutation Carriers. PLoS One 2017; 12: e0175424.
28- Chen S, Annesley SJ, Jasim RA, Fisher PR. The Parkinson’s Disease-Associated Protein DJ-1 Protects Dictyostelium Cells from AMPK-Dependent Outcomes of Oxidative Stress. Cells 2021; 10(8): 1874.
29- Puspita L, Chung SY, Shim J. Oxidative Stress and Cellular Pathologies in Parkinson’s Disease. Mol Brain 2017; 10: 53.
30- Xu CY, Kang WY, Chen YM, Jiang TF, Zhang J, Zhang LN, et al. DJ-1 Inhibits Alpha-Synuclein Aggregation by Regulating Chaperone-Mediated Autophagy. Front Aging Neurosci 2017; 9: 308.
31- Tiwari PC, Pal R. The Potential Role of Neuroinflammation and Transcription Factors in Parkinson Disease. Dialog Clin Neurosci 2017; 19(1): 71-80.
32- Kesh S, Kannan RR, Sivaji K, Balakrishnan A. Hesperidin Downregulates Kinases Lrrk2 and Gsk3β in a 6-OHDA Induced Parkinson’s Disease Model. Neurosci Letter 2021; 740: 135426.
33- Adedara AO, Bressan GN, Dos Santos MM, Fachinetto R, Abolaji AO, Barbosa NV. Antioxidant Responses Driven by Hesperetin and Hesperidin Counteract Parkinson's Disease-Like Phenotypes in Drosophila Melanogaster. Neurotoxicol 2024; 101: 117-27.
34- Nagappan P, Krishnamurth V. Hesperidin A Bioflavonoid Modulates the Expression Levels of SNCA and PARKIN in 6-Hydroxydopamine Induced Neurotoxicity in Rats. Int J Pharm 2015; 5(1): 219-24.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/10/18 | پذیرش: 1403/12/11 | انتشار: 1404/5/15
دریافت: 1403/10/18 | پذیرش: 1403/12/11 | انتشار: 1404/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







