دوره 33، شماره 7 - ( مهر 1404 )
جلد 33 شماره 7 صفحات 9238-9227 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hor M, Rahaiee S, khanjani Jelodar S, Akbarzade Niaki M. Phytochemical Analysis and Biological Activity of Ricinus Communis: Investigating Antioxidant and Antibacterial Properties. JSSU 2025; 33 (7) :9227-9238
URL: http://jssu.ssu.ac.ir/article-1-6360-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6360-fa.html
حر مهدیه، رهایی سمیه، خانجانی جلودار صدیقه، اکبرزاده نیاکی ملیحه. تحلیل فیتوشیمیایی و فعالیت بیولوژیکی دانه کرچک (Ricinus communis): بررسی خواص آنتیاکسیدانی و ضد باکتریایی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (7) :9227-9238
متن کامل [PDF 1156 kb]
(149 دریافت)
| چکیده (HTML) (397 مشاهده)
متن کامل: (196 مشاهده)
مقدمه
گیاهان دارویی برای قرنها نقش مهمی در سلامت و تندرستی انسان ایفا کردهاند. آنها نه تنها منبعی از داروهای سنتی هستند، بلکه به عنوان پایه و اساس بسیاری از داروهای مدرن عمل میکنند. اهمیت این گیاهان در ترکیبات زیست فعال آنها نهفته است که دارای خواص درمانی مختلفی هستند که میتوانند بیماریها را تسکین یا حتی درمان کنند. از نظر تاریخی، گیاهان دارویی در فرهنگهای مختلف به دلیل خواص درمانی خود مورد استفاده قرار گرفتهاند. علیرغم پیشرفت در داروهای مصنوعی، بسیاری از داروهای مشتق شده از گیاهان همچنان در درمان بیماریها مرتبط و موثر هستند. بازار جهانی گیاهان دارویی قابلتوجه قرار گرفته است که نشان دهنده اهمیت پایدار آنها در سیستمهای مراقبتهای بهداشتی در سراسر جهان است (1). گیاهان دارویی حاوی مقدار زیادی از ترکیبات زیست فعال از جمله آلکالوئیدها، فلاونوئیدها، ترپنوئیدها و ترکیبات فنلی هستند. این متابولیتهای ثانویه مسئول اثرات فارماکولوژیک مشاهده شده در گونههای مختلف گیاهی هستند. به عنوان مثال، فلاونوئیدها به دلیل خواص آنتیاکسیدانی خود شناخته شدهاند که به مبارزه با استرس اکسیداتیو کمک میکند (2). کرچک (Ricinus communis) گیاه روغنی و دارویی از تیره فرفیون (Euphorbiaceae) میباشد که عموما در مناطق گرم پراکنش داشته است (3). کرچک بهصورت درختچههای با برگهای پنجهای است که در بسیاری از کشورهای آسیا، امریکای شمالی و مرکزی، آفریقا و اروپا بهعنوان گیاه زینتی کشت میشود (4). این گیاه در حال حاضر در بسیاری از مناطق آب و هوایی جهان بهویژه مناطق گرمسیری و نیمه گرمسیری میروید و دارای پراکندگی جهانی است؛ این گیاه بومی منطقه جنوب شرقی مدیترانه، شرق آفریقا و هند میباشد (3-5). این گیاه در ایران با نامهای مختلفی مانند بید انجیر و یا بزانجیر و در بسیاری از مناطق کشور از جمله شمال (گیلان و مازندران)، شرق (سیستان و بلوچستان و خراسان)، جنوب (خوزستان) و مرکز (یزد و قم) وجود داشته و حتی پرورش داده میشود (6). قسمتهای مختلف گیاه کرچک جهت مصارف دارویی استفاده میشود اما مشخصاً دانه کرچک که از آن روغن کرچک بهدست میآید نقش درمانی برجستهتری دارد. این دانهها حاوی چندین ترکیب زیست فعال از جمله ریسین و ریسینین، استروئیدها، ساپونینها، فلاونوئیدها، آلکالوئیدها و گلیکوزیدها میباشند که تأثیرات بیولوژیکی متعددی نظیر خاصیت آنتیاکسیدانی، ضد التهابی، ضد آسم، ضدمیکروبی، ضد دیابتی و تسکین دهندگی درد را سبب میشوند که به دلیل این ترکیبات غنی از ترکیبات فعال زیستی، توجه زیادی را به خود جلب کرده است (7،8). برای مثال، نتایج مطالعاتی که بر روی عصاره الکلی دانههای تخمیر شده گیاه کرچک انجام شده است، نشان میدهد که میکروارگانیسمهای کلبسیلا پنومونیه، استافیلوکوکوس اورئوس، اشریشیاکلی به میزان چشمگیری نسبت به این ماده حساساند (9). هدف از پژوهش حاضر، بررســــی فعـــــالیتهای آنتیاکسیدانی، ضد مـــیکروبی و محتــــــوای فــنلی و فلاونوئیدی دو عصاره مختلف متانولی و هگزانی دانه این گیاه با دو روش شیکر و سوکسله میباشد که از مناطق مازندران و قم جمعآوری شده است.
روش بررسی
تهیه نمونه گیاهی: دانههای گیاه کرچک از دو منطقه مختلف مازندران و قم تهیه شده است. نمونه کامل گیاهی و بذر این اکوتیپها به ترتیب با کد 1403-65 و 1403-66 در هرباریوم دانشگاه تخصصی فناوریهای نوین آمل ثبت و نگهداری شدهاند. ابتدا دانهها کاملا با آب شستشو داده شدند و در دمای اتاق خشک شدند. سپس پوسته آنها برداشته شد و در دمای 45 درجه سانتیگراد بهطور کامل خشک شده و با استفاده از دستگاه آسیاب برقی کاملا به پودر تبدیل شدند.
تهیه عصاره دانه کرچک: برای تهیه عصاره، از حلالهای مختلف متانولی و هگزانی 80% به دو روش همزنی و سوکسله استفاده شد: 1. روش همزنی: 33 گرم از نمونه و 100 میلیلیتر حلال در یک ارلن ریخته شد. سپس، ارلن به مدت 72 ساعت در دستگاه شیکر با دور 100 دور در دقیقه قرار گرفت (10). 2. سوکسله: 33 گرم نمونه خشک شده را داخل کاغذ صافی بستهبندی کرده و در قسمت محفظه استخراج دستگاه سوکسله قرار میدهیم و سپس به اندازه دو سوم حجم بالن، حلال ریخته و هیتر را روشن میکنیم تا حلال شروع به تبخیر شدن کند. قطرات حاصل شده از میعان حلال از طریق کندانسور روی دانه کرچک ریخته میشود. این فرآیند استخراج، زمانی پایان مییابد که حلال در قسمت محفظه استخراج کاملاً شفاف باشد (11). پس از بهدست آوردن عصاره از حلالهای موردنظر به دو روش یادشده، آنها بهوسیله کاغذ واتمن صاف گردیدند و جهت حذف حلال اضافی داخل دستگاه روتاری قرار گرفتند. سپس عصارههای حاصله توسط دستگاه خشککن انجمادی (Operon ساخت کشور جنوبی) خشک شده و به فرم پودر تبدیل شدند و تا زمان آنالیزدر دمای 4 درجه سانتیگراد نگهداری شدند.
تعیین فنول کل: محتوای فنل کل در عصارههای مختلف دانه کرچک بر اساس روش فولین سیوکالتیو انجام شد. بدین صورت که 100 میکرولیتر از هرکدام از عصارهها با 50 میکرولیتر فولین 2مولار مخلوط و در ادامه 1/85 میلی لیتر آب به آن اضافه شد و ورتکس گردید. سپس 300 میکرولیتر کربنات سدیم 20 درصد به آن اضافه شده و دوباره ورتکس گردید و با اضافه نمودن 1/7 میلیلیتر آب به حجم نهایی 4000 میکرولیتر رسید و بعد از ورتکس نهایی، 90 دقیقه در شرایط تاریکی قرار گرفت و جذب آن در 760 نانومتر خوانده شد. میزان فنل کل بهصورت میلیگرم اسید گالیک در گرم عصاره گیاهی گزارش شد (12).
تعیین فلاونوئید کل: محتوای فلاونوئید بر اساس روش رنگسنجی آلومینیوم کلرید انجام شد. بدین صورت که 500 میکرولیتر از عصارهها با 100 میکرولیتر کلرید آلومینیوم 10 درصد، 100 میکرولیتر استات پتاسیم 1 مولار و 4300 اتانول 80 درصد به حجم نهایی 5000 رسیده و پس از ورتکس به مدت 40 دقیقه در دمای اتاق گذاشته شد و جذب آن در 415 نانومتر اندازهگیری شد. جهت رسم منحنی استاندارد از 7 غلظت 200، 100، 50، 25، 10، 2/5، 1 میکروگرم بر میلیلیتر کوئرسیتین استفاده شد و میزان فلاونوئیدها بهصورت میلیگرم کوئرستین درگرم عصاره گیاهی مشخص گردید (13).
تعیین فعالیت آنتیاکسیدانی
روش ارزیابی میــــزان مهــــار رادیکــــال آزاد :( DPPH2, 2-diphenyl-1-picrylhydrazyl) در این روش 500 میکرولیتر از غلظتهای مختلف عصاره) 1000، 500، 250، 125 میکروگرم بر میلیلیتر) با 500 میکرولیتر از محلولDPPH مخلوط و با اضافه نمودن 1000 میکرولیتر متانول به حجم نهایی 2000 میکرولیتر رسید. سپس میکروتیوپها ورتکس و به مدت 30 دقیقه در تاریکی نگه داشته شدند. جذب در طول موج 517 نانومتر قرائت شد.
درصد مهار رادیکال DPPH با استفاده از معادله:
I (%) = (A0 −As)/A0×100
محاسبه گردید که در اینجاA0 جذب کنترل حاوی همه اجزای واکنشگر بدون نمونه و As جذب نـــمونه میباشد (14).
بررسی فعالیت ضد باکتریایی به روش دیسک دیفیوژن: در این مــــطالعه باکتریهای استافیلوکوکوس اورئــــوس (ATCC25923)، باسیلوس سرئوس (PTTC1015) و اشـــریشــــیاکلی (PTCC1399) تهیه شده از سازمان پژوهشهای علمی و صنعتی ایران (IROST) و سویه بالینی انتروکوکوس فکالیس، مورد استفاده قرار گرفت. برای باکتریهای گرم مثبت از آنتی بیوتیک ونکومایسین و برای باکتری گرم منفی از آنتی بیوتیک جنتامایسین بهعنوان کنترل استفاده شد. جهت سنجش خاصیت آنتی باکتریال عصاره دانه کرچک از روش دیسک دیفیوژن استفاده شد. به منظور استفاده از این روش ابتدا از سوسپانسیون نیم مک فارلند باکتریها بهصورت چمنی بر روی محیط کشت مولر هینتون کشت داده شد. آنگاه دیسکهای کاغذی قرار گرفته روی محیط کشت با غلظتهای مختلف عصاره شامل 400، 200، 100، 50 میلیگرم بر میلیلیتر بارگذاری شدند و پلیتهای تهیه شده به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفتند. در نهایت، نتایج تست بهصورت اندازه قطر هاله عدم رشد بر حسب میلیمتر گزارش گردید (15).
تعیین حداقل غلظت مهار کنندگی (MIC Minimum Inhibitory Concenteration) و حداقل غلظت کشندگی(MBC Minimum Inhibitory Concenteration): جهت تعیین حداقل غلظت بازدارندگی (MIC) از روش رقیق کردن در محیط مایع به روش میکرو Broth Micro dilution استفاده گردید. بدین منظور، 100 میکرولیتر محیط کشت مولر هینتون براث در چاهکهای پلیت 96 خانهای ریخته و سپس به اولین چاهک آزمایش 100 میکرولیتر محلول پایه عصاره با غلظت 200میلی گرم بر میلیلیتر اضافه شد. بعد از مخلوط نمودن محتویات چاهک اول، 100 میکرولیتر از آن برداشته و به چاهک بعدی اضافه گردید. از لوله آخر 100 میکرولیتر دور ریخته شد. سپس به همه چاهکها، 100میکرولیتر از سوسپانسیون آماده باکتری موردنظر (با تراکم CFU/mL 108×1.5) اضافه گردید و به مدت 18 ساعت در دمای 37 درجه سانتیگراد گرمخانه گذاری شد. همچنین سه چاهک حاوی آنتیبیوتیک آزیترومایسین (0/1میلیگرم در میلیلیتر) بهعنوان نمونه کنترل درنظر گرفته شد. اولین غلظتی که در آن هیچگونه کدورتی ناشی از رشد باکتری مشاهده نشد بهعنوان حداقل غلظت بازدارندگی (MIC) انتخاب شد. جهت تعیین حداقل غلظت کشندگی (MBC) نیز مقدار 50 میکرولیتر از غلظتهای فاقد کدورت، بر روی پلیتهای حاوی محیط کشت مولر هینتون آگار پخش و به مدت 24 ساعت گرمخانه گذاری گردید. کمترین غلظتی که در آن غلظت 99/9% باکتریها را بکشد به عنوان غلظت MBC انتخاب گردید (16).
تجزیه و تحلیل آماری
نتایــــج حاصل از بررسی به صورت میانگین ± ا نحراف معیار(Mean± SD ) بیان گردید و نــــمونهها در ســه تکرار بررسی شدند. این محاسبات با استفاده از نرمافزار آماری SPSS version 16 و مقایسه میانگینها با آزمون دانکن در ســــطح <0.05 P انجام گرفت.
نتایج
نتایج تجزیه واریانس نشان داد که اثر انواع حلال، روشهای مختلف عصارهگیری و اقلیمهای متفاوت برای فنل کل، فلاونوئید، آنالیزDPPH و خاصیت ضد باکتریال معــــنیدار (P<0.01) بودند.
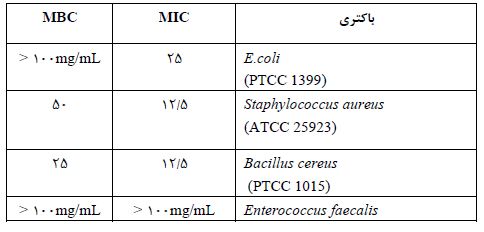
فنول کل: مقایسه میانگین تیمارها براساس جدول 1 نشان داد که بیشترین میزان فنل کل در حلال متانولی عصاره کرچک منطقه مازندران با میزان 1/95 ± 30/90 میلیگرم گالیکاسید به ازای گرم ماده خشک بهدست آمد. همچنین در بین روشهای مختلف عصارهگیری، بالاترین میزان فنل کل مربوط به روش شیکر برای کرچک منطقه مازندران با میزان 1/77± 31/09 میلیگرم گالیکاسید به ازای گرم ماده خشک بود و کمترین میزان فنل کل مربوط به روش عصارهگیری سوکسله برای کرچک منطقه قم با میــــزان 0/55± 25/04 میلیگرم گالیکاسید به ازای گرم ماده خشک بود. در بررسی مقایسه میانگیـــن اثرات متـــقابل حلال و روش عصارهگیری، تیمار حلال متانولی با روش عصارهگیری شیکر با مقدار33/0 ±86/33 میلیگرم گالیکاسید به ازای گرم ماده خشک، نسبت به سایر تیمارها بالاترین مقدار را دارا بوده است.
فلاونوئید کل: طبق جدول 1، مقایسه میانگین تیمارها نشان داد که بیشترین میزان فنل کل در حلال متانولی کرچک منطقه مازندران با میزان 1/26± 33/65 میلیگرم کوئرستین به ازای گرم ماده خشک بهدست آمد. همچنین در بین روشهای مختلف عصارهگیری، بالاترین میزان فنل کل مربوط به روش شیکر برای کرچک منطقه مازندران با میزان1/66± 31/26 میلیگرم کوئرستین به ازای گرم ماده خشک بود. در بررسی مقایسه میانگیـــن اثرات متـــقابل حلال و روش عصارهگیری، تیمار حلال متانولی با روش عصارهگیری شیکر با مقدار05/3 ±92/38 میلیگرم کوئرستین به ازای گرم ماده خشک، نسبت به تیمارهای دیگر، بالاترین مقدار را دارا بوده است.
میزان مهار رادیکال آزاد (DPPH): مطابق با نتایج حاصل از مقایسه میانگین تیمارها در جدول 1، بیشترین میزان مهار رادیکالهای آزاد مربــــوط به حلال متانولی عصاره کرچک گرفته شده از منطقه قم با میزان2/06± 41/95 بود. بیشترین میزان مهارکنندگی در بین روشهای عصارهگیری مربوط به روش شیکر برای کرچک منطقه مازندران با میزان 1/39± 38/09 و کمترین میزان مربوط به روش سوکسله برای کرچک منطقه مازندران به مقدار1/73± 32/31 بهدست آمد. در بررسی مقایسه میانگین اثرات متقابل حلال و روشهای عصاره گیری، بالاترین میزان مهارکنندگی مربوط به تیمار حلال متانولی با روش سوکسله برای منطقه قم به میزان 2/26± 45/81 نسبت به سایر تیمارها حاصل شد.
خاصیت ضد باکتریایی به روش دیسک دیفیوژن: همانطور که در جدول 2 دیده میشود، نتایج در آنالیز ضد باکتریایی نشان داد که عصاره متانولی شیکر منطقه قم در غلظتهای مختلف تاثیر چندانی بر مهار رشد باکتریهای مورد مطالعه نداشت. بالاترین میزان مهار رشد باکتریهای استافیلوکوکوس اورئوس و باسیلوس سرئوس بهوسیله عصاره متانولی شیکر منطقه مازندران با غلظت 400 میلیگرم بر میلیلیتر به ترتیب و قطر هاله عدم رشد 40/47± 15/33 و 0/84± 21/16 میلیمتر مشاهده شد. باکتری گرم منفی اشریشیاکلی نیز نسبت به غلظت بالای عصاره از خود حساسیت نشان داد و قطر هاله عدم رشد 05/2± 66/14 دیده شد. عصارههای متانولی و هگزانی مناطق مازندران و قم که بهوسیله روش سوکسله استخراج شده بودند هیچگونه اثری بر مهار رشد باکتریهای مورد مطالعه ما از خود نشان ندادند. همچنین عصاره هگزانی استخراج شده از روش شیکر مناطق مازندران و قم نیز اثر مهاری نداشتند. تعیین حداقل غلظت مهاری رشد (MIC) و حداقل غلظت کشندگی (MBC ): میزان MIC و MBC عصارههای متانولی و هگزانی دانه کرچک مناطق مازندران و قم در مقابل سویههای باکتریایی ذکر شده مورد ارزیابی قرار گرفت. نتایج حاکی از آن بود که تنها عصاره متانولی دانه کرچک منطقه مازندران که با روش همزنی بهدست آمده است، فعالیت بازدارندگی و کشندگی خوبی را در برابر باکتری¬ها داشته¬ است. به گونهای که کمترین مقدار MIC و MBC این عصاره با بالاترین فعالیت ضدباکتریایی در برابر باکتری گرم مثبت Bacillus cereus به ترتیب در غلظت¬های 5/12 و 25 میلیگرم بر میلیلیتر به ثبت رسید (جدول 3).
جدول 1: مقایسه میانگین تیمارها برای ترکیبات فنل کل، فلاونوئید و خاصیت آنتیاکسیدانی دانههای کرچک
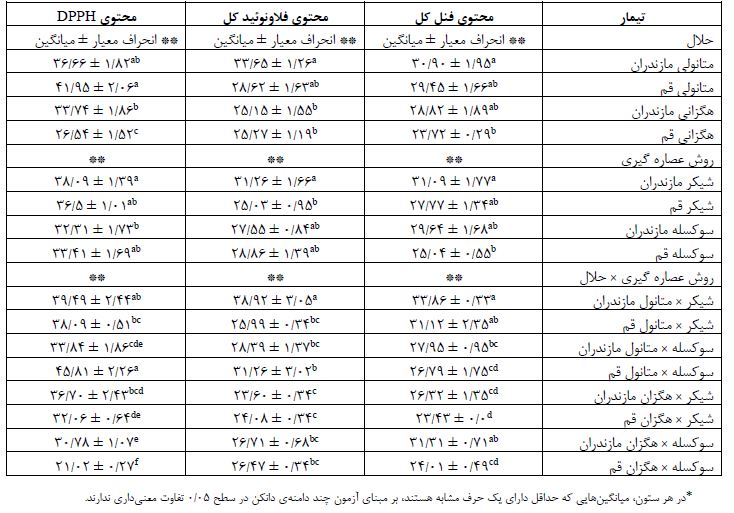
جدول 2: میانگین قطر هاله عدم رشد باکتریایی (برحسب میلیمتر) عصاره متانولی دانه کرچک مناطق مازندران و قم بهدست آمده به روش شیکر
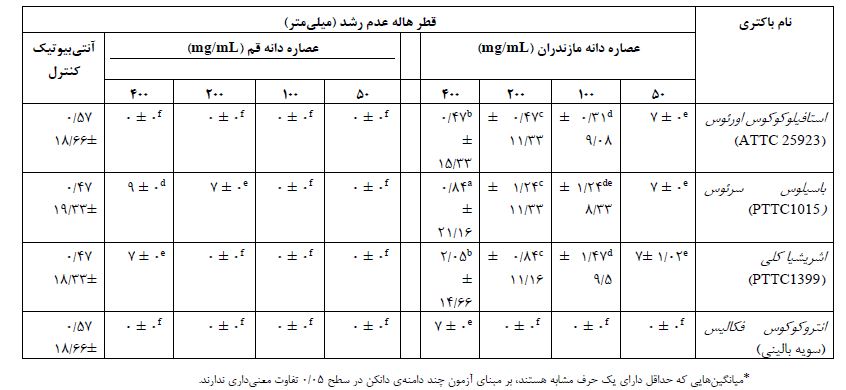
جدول 3: حداقل غلظت بازدارندگی و کشندگی عصاره متانولی دانه کرچک منطقه مازندران (بر حسب میلیگرم بر میلیلیتر)
بحث
شناسایی و بررسی ترکیبات سازنده گیاهان دارویی یکی از مهمترین مراحل مطالعه و پژوهش روی آنها است. استخراج این ترکیبات به یکسری عوامل بستگی دارد که از مهمترین آنها میتوان به نوع حلال، روش استخراج و جمع آوری آنها از مناطق مختلف اشاره کرد. هدف از این تحقیق استخراج ترکیبات زیستی از حلالهای گوناگون با قطبیتهای مختلف، توسط روشهای عصاره گیری متفاوت با شرایط اقلیمی مختلف بوده است. بر اساس نتایج حاصل از این آزمایش، میزان ترکیبات فنلی، فلاونوئیدی و خواص آنتیاکسیدانی تحت تاثیر حلالهای مختلف قرار گرفت و بهترین کارایی برای عصاره متانولی و ضعیفترین عملکرد برای عصاره هگزانی مشاهده شد. مطابق با نتایج این آزمایش، بیات و همکاران در سال 2018، اثر چهار حلال آبی، متانولی، اتانولی و هگزانی در استخراج گیاه دارویی برازمبل (Perovskia abrotanoides Karel.) را مورد بررسی قرار دادند که نتایج آن همانند آزمایشات ما نشان داد که عصاره حلال متانولی بهترین عملکرد را در فعالیت آنتیاکسیدانی و فنلی دارد و حلال هگزانی کارایی ضعیفتری دراین زمینه داشته است (17). همچنین اطهری و همکاران در سال 2019 خواص آنتیاکسیدانی، فنولی و ضدباکتریایی عصاره متانولی گیاه کرچک را مورد بررسی قرار دادند، نتایج نشان داد که عصاره متانولی فعالیت فنولی و آنتیاکسیدانی بالایی دارد و باعث مهار رشد باکتریهای استافیلوکوکوس اورئوس و اشریشیاکلی میشود (3). اسمعیلزاده بهابادی و همکاران در سال2016، به تاثیر حلالهای متانول، استون، اتیل استات، کلروفرم و هگزان بر خواص فنول و فلاونوئیدی و فعالیت آنتیاکسیدانی عصاره هندوانه ابوجهل (Citrullus colocynthis) پرداختند که نتایج پژوهش آنها نشان داد که حلال متانول بیشترین تاثیر را بهعنوان حلال برروی عصاره این هندوانه دارد و بهترین کارایی را بر تمامی فعالیتهای نامبرده از خود نشان داده است (18). مشیری و همکاران در سال 2023 به بررسی محتوای ترکیبات فنلی، فلاونوئیدی و فعالیت آنتیاکسیدانی عصاره آبی و متانولی صمغ آنغوزه (Frula assafoetida) پرداختند که در نتایج این آزمایشات هم، عصاره متانولی، خاصیت آنتیاکسیدانی بیشتری داشته است به گونهای که بالاترین درصد مهارکنندگی در غلظت 300 میکروگرم بر میلیلیتر از عصاره متانولی به میزان 90/7 درصد مشاهده شد (19). صوفیان و همکاران در سال 2022 اثر حلالهای مختلف بر استخراج ترکیبات فیتوشیمیایی گیاه دارویی چریش (Azadirachta indica A.Juss.) را مورد مطالعه قرار دادند و نتایح آنها نشان داد که حلال استونی بیشترین تاثیر را بر عصاره این گیاه داشته و حلال هگزانی عملکرد بسیار ضعیفی از خود نشان داده است (20). چنانچه در پژوهش ما نیز حلال هگزان ضعیفترین تاثیر بر استخراج ترکیبات زیست فعال داشته است. در بین روشهای استخراج که در آزمایش ما مورد استفاده قرار گرفتند عصاره بهدست آمده از شیکر نسبت به روش سوکسله بیشترین میزان فنول و فلاونوئید را از خود نشان داد و عصاره استخراجی از اثر متقابل حلال متانول و روش عصارهگیری سوکسله بالاترین فعالیت آنتیاکسیدانی را داشته است. ملائی و همکاران در سال 2022 تأثیر روشهای مختلف استخراج بر متابولیتها و خواص بیولوژیکی بذر گیاه چویل (Ferulago angulate) را مورد بررسی قرار دادند که در بین روشهای استخراج، عصارهای که از روش سوکسله بهدست آمد بیشترین میزان فنول، فلاونوئید و خاصیت آنتیاکسیدانی را دارا بود (21). مجیدایی و همکاران در سال 2019 به مقایسه اهمیت روشهای مختلف استخراج و نقش افزایش قطبیت حلال در محتوای تام فنل و فلاونوئیدی و میزان فعالیت آنتیاکسیدانی گیاه کما (Ferula persica) پرداختند که نتایج آن نشاندهنده این بود که عصارهای که از حلال متانول و روش سوکسله بهدست آمد بیشترین میزان ترکیبات زیستی را دارا بود (22). تفاوت بین نتایج بهدست آمده در قسمت خواص فنلی و فلاونوئیدی در تحقیقات ما و دیگران را میتوان به تفاوت بین ترکیبات زیستی و شیمیایی گیاهان، ساختار متفاوت واکنشهایی که دارند و همچنین شرایط اقلیمی که در آن رشد میکنند نسبت داد. در بررسیهای ما در زمینه تاثیر شرایط اقلیمی مختلف، عصاره کرچک منطقه مازندران بیشترین میزان فنل، فلاونوئید و خاصیت ضدباکتریایی را از خود نشان داد. مطابق نتایج ما سپهریفر و همکاران در سال 2008 به بررسی ترکیبات پلیفنلی، آنتوسیانینها و فلاونوئیدهای تام و خواص آنتیاکسیدانی گیاه دارویی قره قاط (Vaccinium Arctostaphylos L.) جمعآوری شده از چهار منطقه مختلف ایران پرداختند که در نهایت مشاهده شد که بیشترین فعالیت فنلی، آنتوسیانینی و آنتیاکسیدانی را گیاه منطقه مازندران داشت و در بررسی خاصیت ضدمیکروبی هم، عصاره متانولی بهدست آمده از روش شیکر که از منطقه مازندران برداشت شده بود بیشترین میزان این فعالیت را از خود نشان داده است (23). کریمی و همکاران در سال 2019 اثر ضد باکتریایی و آنتیاکسیدانی نانوامولسیون سنتز شده روغن کرچک را مورد آزمایش قرار دادند. نتایج نشان داد که روغن کرچک خواص آنتیاکسیدانی بالایی دارد و روی باکتری استافیلوکوکوس اورئوس اثر ضدمهاری به نسبت خوبی از خود نشان داده است (24). حناچی و همکاران در سال 2021 به سنجش میزان ترکیبات فنلی و فلاونوئیدی عصاره گیاهان بادرنجبویه (Melissa officialis) و اسطوخودوس (Lavandula angustifolia) با استفاده از حلالها و روشهای عصارهگیری مختلف و بررسی خواص ضدباکتریایی آنها پرداختند و نتایج آزمایشات آنها نیز نشان داد که عصاره متانولی گیاه اسطووخودوس بیشترین میزان ترکیبات فنولی را داراست و باکتری اشریشیاکلی با قطر هاله 19 میلیمتر بیشترین حساسیت را نسبت به حلالهای آبی و اتانولی داشته است. همچنین عصاره متانولی اسطوخودوس با قطر هاله 15 میلیمتر بهترین اثر را بر باکتری استافیلوکوکوس اورئوس داشته است (25). مطالعات نشان دادهاند که عصارههای متانولی و اتانولی دانه، برگ و ریشه گیاه کرچک دارای فعالیت ضدباکتریایی قابلتوجهی هستند. اثر مهاری عصاره روغنی این گیاه به دلیل حضور ترکیب سدیم رسینولئیک میباشد که به دیواره سلولی باکتری آسیب میرساند و باعث از بین رفتن اجزای سیتوپلاسمی و در نهایت مرگ سلول میشود. همچنین آزمایشات انجام شده در مورد فعالیت آنتیاکسیدانی گیاه کرچک نشان داده است که ترکیبات فلاونوئیدی آن دارای اثر آنتیاکسیدانی بیشتری نسبت به تاننها میباشد (26). بهنظر میرسد که فعالیت بالای آنتیاکسیدانی عصارههای متانولی با قابلیت نوع حلال، در استخراج ترکیبات فنلی ارتباط مستقیمی داشته باشد چرا که براساس شواهد موجود ارتباط مثبتی بین میزان ترکیبات فنلی و قدرت آنتیاکسیدانی گیاهان وجود دارد که از طریق عصارههای گیاهی آنها قابل استخراج است (27). همچنین دلیل کارایی بالای حلال متانول در استخراج ترکیبات آنتیاکسیدانی را میتوان به قطبیت این حلال نسبت داد (28).
نتیجهگیری
دراین پژوهش، میزان فنل کل، فلاونوئید، خاصیت آنتیاکسیدانی و ضدباکتریایی عصارههای متانولی و هگزانی دانه کرچک با دو روش استخراج متفاوت، جمعآوری شده از دو منطقه قم و مازندران انجام شد. نتایج نشان داد که حلال متانول با قطبیت بالای خود بازده خوبی در استخراج ترکیبات زیست فعال ازجمله ترکیبات آنتیاکسیدانی دارد. همچنین، عصاره متانولی دانه کرچک دارای اثرات ضد باکتریایی مناسبی بهویژه بر باکتریهای گرم مثبت مورد مطالعه دانه است. بهطور کلی، باتوجه به نتایج حاصله از آنالیز ضد باکتریایی و آنتیاکسیدانی ترکیبات زیست فعال دانه کرچک به نظر میرسد روش همزنی در استخراج ترکیبات زیست فعال نقش موثرتری داشته است. همچنین دانه کرچک متعلق به منطقه مازندران نسبت به منطقه قم، نتایج بهتری ارائه داد که میتواند حاکی از تفاوت شرایط اقلیمی دانهها باشد. بهطور کلی، هدف ما در این مقاله یافتن بهترین روش و حلال، استخراج ترکیبات زیست فعال دانه کرچک بوده که بتوانیم از نتایج آن، جهت انجام آنالیزهای بیشتر در مطالعات بعدی استفاده کنیم.
سپاسگزاری
این مقاله مســــتخرج از پایاننامه دانشجو بوده و نویــــسندگان مقاله کمال تشکر و قدردانی را از افراد شرکت کننده در این پژوهش دارند.
حامی مالی: دانشگاه تخصصی فناوریهای نوین آمل
تعارض در منافع: وجودندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه تخصصی فناوری های نوین آمل مورد تایید قرار گرفته است. IR.ASMT.REC.1403.007
مشارکت نویسندگان
سمیه رهایی در ارائه ایده، سمیه رهایی و صدیقه خانجانی جلودار در طراحی مطالعه، مهدیه حر در جمعآوری دادهها، ملیجه اکبرزاده در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
گیاهان دارویی برای قرنها نقش مهمی در سلامت و تندرستی انسان ایفا کردهاند. آنها نه تنها منبعی از داروهای سنتی هستند، بلکه به عنوان پایه و اساس بسیاری از داروهای مدرن عمل میکنند. اهمیت این گیاهان در ترکیبات زیست فعال آنها نهفته است که دارای خواص درمانی مختلفی هستند که میتوانند بیماریها را تسکین یا حتی درمان کنند. از نظر تاریخی، گیاهان دارویی در فرهنگهای مختلف به دلیل خواص درمانی خود مورد استفاده قرار گرفتهاند. علیرغم پیشرفت در داروهای مصنوعی، بسیاری از داروهای مشتق شده از گیاهان همچنان در درمان بیماریها مرتبط و موثر هستند. بازار جهانی گیاهان دارویی قابلتوجه قرار گرفته است که نشان دهنده اهمیت پایدار آنها در سیستمهای مراقبتهای بهداشتی در سراسر جهان است (1). گیاهان دارویی حاوی مقدار زیادی از ترکیبات زیست فعال از جمله آلکالوئیدها، فلاونوئیدها، ترپنوئیدها و ترکیبات فنلی هستند. این متابولیتهای ثانویه مسئول اثرات فارماکولوژیک مشاهده شده در گونههای مختلف گیاهی هستند. به عنوان مثال، فلاونوئیدها به دلیل خواص آنتیاکسیدانی خود شناخته شدهاند که به مبارزه با استرس اکسیداتیو کمک میکند (2). کرچک (Ricinus communis) گیاه روغنی و دارویی از تیره فرفیون (Euphorbiaceae) میباشد که عموما در مناطق گرم پراکنش داشته است (3). کرچک بهصورت درختچههای با برگهای پنجهای است که در بسیاری از کشورهای آسیا، امریکای شمالی و مرکزی، آفریقا و اروپا بهعنوان گیاه زینتی کشت میشود (4). این گیاه در حال حاضر در بسیاری از مناطق آب و هوایی جهان بهویژه مناطق گرمسیری و نیمه گرمسیری میروید و دارای پراکندگی جهانی است؛ این گیاه بومی منطقه جنوب شرقی مدیترانه، شرق آفریقا و هند میباشد (3-5). این گیاه در ایران با نامهای مختلفی مانند بید انجیر و یا بزانجیر و در بسیاری از مناطق کشور از جمله شمال (گیلان و مازندران)، شرق (سیستان و بلوچستان و خراسان)، جنوب (خوزستان) و مرکز (یزد و قم) وجود داشته و حتی پرورش داده میشود (6). قسمتهای مختلف گیاه کرچک جهت مصارف دارویی استفاده میشود اما مشخصاً دانه کرچک که از آن روغن کرچک بهدست میآید نقش درمانی برجستهتری دارد. این دانهها حاوی چندین ترکیب زیست فعال از جمله ریسین و ریسینین، استروئیدها، ساپونینها، فلاونوئیدها، آلکالوئیدها و گلیکوزیدها میباشند که تأثیرات بیولوژیکی متعددی نظیر خاصیت آنتیاکسیدانی، ضد التهابی، ضد آسم، ضدمیکروبی، ضد دیابتی و تسکین دهندگی درد را سبب میشوند که به دلیل این ترکیبات غنی از ترکیبات فعال زیستی، توجه زیادی را به خود جلب کرده است (7،8). برای مثال، نتایج مطالعاتی که بر روی عصاره الکلی دانههای تخمیر شده گیاه کرچک انجام شده است، نشان میدهد که میکروارگانیسمهای کلبسیلا پنومونیه، استافیلوکوکوس اورئوس، اشریشیاکلی به میزان چشمگیری نسبت به این ماده حساساند (9). هدف از پژوهش حاضر، بررســــی فعـــــالیتهای آنتیاکسیدانی، ضد مـــیکروبی و محتــــــوای فــنلی و فلاونوئیدی دو عصاره مختلف متانولی و هگزانی دانه این گیاه با دو روش شیکر و سوکسله میباشد که از مناطق مازندران و قم جمعآوری شده است.
روش بررسی
تهیه نمونه گیاهی: دانههای گیاه کرچک از دو منطقه مختلف مازندران و قم تهیه شده است. نمونه کامل گیاهی و بذر این اکوتیپها به ترتیب با کد 1403-65 و 1403-66 در هرباریوم دانشگاه تخصصی فناوریهای نوین آمل ثبت و نگهداری شدهاند. ابتدا دانهها کاملا با آب شستشو داده شدند و در دمای اتاق خشک شدند. سپس پوسته آنها برداشته شد و در دمای 45 درجه سانتیگراد بهطور کامل خشک شده و با استفاده از دستگاه آسیاب برقی کاملا به پودر تبدیل شدند.
تهیه عصاره دانه کرچک: برای تهیه عصاره، از حلالهای مختلف متانولی و هگزانی 80% به دو روش همزنی و سوکسله استفاده شد: 1. روش همزنی: 33 گرم از نمونه و 100 میلیلیتر حلال در یک ارلن ریخته شد. سپس، ارلن به مدت 72 ساعت در دستگاه شیکر با دور 100 دور در دقیقه قرار گرفت (10). 2. سوکسله: 33 گرم نمونه خشک شده را داخل کاغذ صافی بستهبندی کرده و در قسمت محفظه استخراج دستگاه سوکسله قرار میدهیم و سپس به اندازه دو سوم حجم بالن، حلال ریخته و هیتر را روشن میکنیم تا حلال شروع به تبخیر شدن کند. قطرات حاصل شده از میعان حلال از طریق کندانسور روی دانه کرچک ریخته میشود. این فرآیند استخراج، زمانی پایان مییابد که حلال در قسمت محفظه استخراج کاملاً شفاف باشد (11). پس از بهدست آوردن عصاره از حلالهای موردنظر به دو روش یادشده، آنها بهوسیله کاغذ واتمن صاف گردیدند و جهت حذف حلال اضافی داخل دستگاه روتاری قرار گرفتند. سپس عصارههای حاصله توسط دستگاه خشککن انجمادی (Operon ساخت کشور جنوبی) خشک شده و به فرم پودر تبدیل شدند و تا زمان آنالیزدر دمای 4 درجه سانتیگراد نگهداری شدند.
تعیین فنول کل: محتوای فنل کل در عصارههای مختلف دانه کرچک بر اساس روش فولین سیوکالتیو انجام شد. بدین صورت که 100 میکرولیتر از هرکدام از عصارهها با 50 میکرولیتر فولین 2مولار مخلوط و در ادامه 1/85 میلی لیتر آب به آن اضافه شد و ورتکس گردید. سپس 300 میکرولیتر کربنات سدیم 20 درصد به آن اضافه شده و دوباره ورتکس گردید و با اضافه نمودن 1/7 میلیلیتر آب به حجم نهایی 4000 میکرولیتر رسید و بعد از ورتکس نهایی، 90 دقیقه در شرایط تاریکی قرار گرفت و جذب آن در 760 نانومتر خوانده شد. میزان فنل کل بهصورت میلیگرم اسید گالیک در گرم عصاره گیاهی گزارش شد (12).
تعیین فلاونوئید کل: محتوای فلاونوئید بر اساس روش رنگسنجی آلومینیوم کلرید انجام شد. بدین صورت که 500 میکرولیتر از عصارهها با 100 میکرولیتر کلرید آلومینیوم 10 درصد، 100 میکرولیتر استات پتاسیم 1 مولار و 4300 اتانول 80 درصد به حجم نهایی 5000 رسیده و پس از ورتکس به مدت 40 دقیقه در دمای اتاق گذاشته شد و جذب آن در 415 نانومتر اندازهگیری شد. جهت رسم منحنی استاندارد از 7 غلظت 200، 100، 50، 25، 10، 2/5، 1 میکروگرم بر میلیلیتر کوئرسیتین استفاده شد و میزان فلاونوئیدها بهصورت میلیگرم کوئرستین درگرم عصاره گیاهی مشخص گردید (13).
تعیین فعالیت آنتیاکسیدانی
روش ارزیابی میــــزان مهــــار رادیکــــال آزاد :( DPPH2, 2-diphenyl-1-picrylhydrazyl) در این روش 500 میکرولیتر از غلظتهای مختلف عصاره) 1000، 500، 250، 125 میکروگرم بر میلیلیتر) با 500 میکرولیتر از محلولDPPH مخلوط و با اضافه نمودن 1000 میکرولیتر متانول به حجم نهایی 2000 میکرولیتر رسید. سپس میکروتیوپها ورتکس و به مدت 30 دقیقه در تاریکی نگه داشته شدند. جذب در طول موج 517 نانومتر قرائت شد.
درصد مهار رادیکال DPPH با استفاده از معادله:
I (%) = (A0 −As)/A0×100
محاسبه گردید که در اینجاA0 جذب کنترل حاوی همه اجزای واکنشگر بدون نمونه و As جذب نـــمونه میباشد (14).
بررسی فعالیت ضد باکتریایی به روش دیسک دیفیوژن: در این مــــطالعه باکتریهای استافیلوکوکوس اورئــــوس (ATCC25923)، باسیلوس سرئوس (PTTC1015) و اشـــریشــــیاکلی (PTCC1399) تهیه شده از سازمان پژوهشهای علمی و صنعتی ایران (IROST) و سویه بالینی انتروکوکوس فکالیس، مورد استفاده قرار گرفت. برای باکتریهای گرم مثبت از آنتی بیوتیک ونکومایسین و برای باکتری گرم منفی از آنتی بیوتیک جنتامایسین بهعنوان کنترل استفاده شد. جهت سنجش خاصیت آنتی باکتریال عصاره دانه کرچک از روش دیسک دیفیوژن استفاده شد. به منظور استفاده از این روش ابتدا از سوسپانسیون نیم مک فارلند باکتریها بهصورت چمنی بر روی محیط کشت مولر هینتون کشت داده شد. آنگاه دیسکهای کاغذی قرار گرفته روی محیط کشت با غلظتهای مختلف عصاره شامل 400، 200، 100، 50 میلیگرم بر میلیلیتر بارگذاری شدند و پلیتهای تهیه شده به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفتند. در نهایت، نتایج تست بهصورت اندازه قطر هاله عدم رشد بر حسب میلیمتر گزارش گردید (15).
تعیین حداقل غلظت مهار کنندگی (MIC Minimum Inhibitory Concenteration) و حداقل غلظت کشندگی(MBC Minimum Inhibitory Concenteration): جهت تعیین حداقل غلظت بازدارندگی (MIC) از روش رقیق کردن در محیط مایع به روش میکرو Broth Micro dilution استفاده گردید. بدین منظور، 100 میکرولیتر محیط کشت مولر هینتون براث در چاهکهای پلیت 96 خانهای ریخته و سپس به اولین چاهک آزمایش 100 میکرولیتر محلول پایه عصاره با غلظت 200میلی گرم بر میلیلیتر اضافه شد. بعد از مخلوط نمودن محتویات چاهک اول، 100 میکرولیتر از آن برداشته و به چاهک بعدی اضافه گردید. از لوله آخر 100 میکرولیتر دور ریخته شد. سپس به همه چاهکها، 100میکرولیتر از سوسپانسیون آماده باکتری موردنظر (با تراکم CFU/mL 108×1.5) اضافه گردید و به مدت 18 ساعت در دمای 37 درجه سانتیگراد گرمخانه گذاری شد. همچنین سه چاهک حاوی آنتیبیوتیک آزیترومایسین (0/1میلیگرم در میلیلیتر) بهعنوان نمونه کنترل درنظر گرفته شد. اولین غلظتی که در آن هیچگونه کدورتی ناشی از رشد باکتری مشاهده نشد بهعنوان حداقل غلظت بازدارندگی (MIC) انتخاب شد. جهت تعیین حداقل غلظت کشندگی (MBC) نیز مقدار 50 میکرولیتر از غلظتهای فاقد کدورت، بر روی پلیتهای حاوی محیط کشت مولر هینتون آگار پخش و به مدت 24 ساعت گرمخانه گذاری گردید. کمترین غلظتی که در آن غلظت 99/9% باکتریها را بکشد به عنوان غلظت MBC انتخاب گردید (16).
تجزیه و تحلیل آماری
نتایــــج حاصل از بررسی به صورت میانگین ± ا نحراف معیار(Mean± SD ) بیان گردید و نــــمونهها در ســه تکرار بررسی شدند. این محاسبات با استفاده از نرمافزار آماری SPSS version 16 و مقایسه میانگینها با آزمون دانکن در ســــطح <0.05 P انجام گرفت.
نتایج
نتایج تجزیه واریانس نشان داد که اثر انواع حلال، روشهای مختلف عصارهگیری و اقلیمهای متفاوت برای فنل کل، فلاونوئید، آنالیزDPPH و خاصیت ضد باکتریال معــــنیدار (P<0.01) بودند.
فنول کل: مقایسه میانگین تیمارها براساس جدول 1 نشان داد که بیشترین میزان فنل کل در حلال متانولی عصاره کرچک منطقه مازندران با میزان 1/95 ± 30/90 میلیگرم گالیکاسید به ازای گرم ماده خشک بهدست آمد. همچنین در بین روشهای مختلف عصارهگیری، بالاترین میزان فنل کل مربوط به روش شیکر برای کرچک منطقه مازندران با میزان 1/77± 31/09 میلیگرم گالیکاسید به ازای گرم ماده خشک بود و کمترین میزان فنل کل مربوط به روش عصارهگیری سوکسله برای کرچک منطقه قم با میــــزان 0/55± 25/04 میلیگرم گالیکاسید به ازای گرم ماده خشک بود. در بررسی مقایسه میانگیـــن اثرات متـــقابل حلال و روش عصارهگیری، تیمار حلال متانولی با روش عصارهگیری شیکر با مقدار33/0 ±86/33 میلیگرم گالیکاسید به ازای گرم ماده خشک، نسبت به سایر تیمارها بالاترین مقدار را دارا بوده است.
فلاونوئید کل: طبق جدول 1، مقایسه میانگین تیمارها نشان داد که بیشترین میزان فنل کل در حلال متانولی کرچک منطقه مازندران با میزان 1/26± 33/65 میلیگرم کوئرستین به ازای گرم ماده خشک بهدست آمد. همچنین در بین روشهای مختلف عصارهگیری، بالاترین میزان فنل کل مربوط به روش شیکر برای کرچک منطقه مازندران با میزان1/66± 31/26 میلیگرم کوئرستین به ازای گرم ماده خشک بود. در بررسی مقایسه میانگیـــن اثرات متـــقابل حلال و روش عصارهگیری، تیمار حلال متانولی با روش عصارهگیری شیکر با مقدار05/3 ±92/38 میلیگرم کوئرستین به ازای گرم ماده خشک، نسبت به تیمارهای دیگر، بالاترین مقدار را دارا بوده است.
میزان مهار رادیکال آزاد (DPPH): مطابق با نتایج حاصل از مقایسه میانگین تیمارها در جدول 1، بیشترین میزان مهار رادیکالهای آزاد مربــــوط به حلال متانولی عصاره کرچک گرفته شده از منطقه قم با میزان2/06± 41/95 بود. بیشترین میزان مهارکنندگی در بین روشهای عصارهگیری مربوط به روش شیکر برای کرچک منطقه مازندران با میزان 1/39± 38/09 و کمترین میزان مربوط به روش سوکسله برای کرچک منطقه مازندران به مقدار1/73± 32/31 بهدست آمد. در بررسی مقایسه میانگین اثرات متقابل حلال و روشهای عصاره گیری، بالاترین میزان مهارکنندگی مربوط به تیمار حلال متانولی با روش سوکسله برای منطقه قم به میزان 2/26± 45/81 نسبت به سایر تیمارها حاصل شد.
خاصیت ضد باکتریایی به روش دیسک دیفیوژن: همانطور که در جدول 2 دیده میشود، نتایج در آنالیز ضد باکتریایی نشان داد که عصاره متانولی شیکر منطقه قم در غلظتهای مختلف تاثیر چندانی بر مهار رشد باکتریهای مورد مطالعه نداشت. بالاترین میزان مهار رشد باکتریهای استافیلوکوکوس اورئوس و باسیلوس سرئوس بهوسیله عصاره متانولی شیکر منطقه مازندران با غلظت 400 میلیگرم بر میلیلیتر به ترتیب و قطر هاله عدم رشد 40/47± 15/33 و 0/84± 21/16 میلیمتر مشاهده شد. باکتری گرم منفی اشریشیاکلی نیز نسبت به غلظت بالای عصاره از خود حساسیت نشان داد و قطر هاله عدم رشد 05/2± 66/14 دیده شد. عصارههای متانولی و هگزانی مناطق مازندران و قم که بهوسیله روش سوکسله استخراج شده بودند هیچگونه اثری بر مهار رشد باکتریهای مورد مطالعه ما از خود نشان ندادند. همچنین عصاره هگزانی استخراج شده از روش شیکر مناطق مازندران و قم نیز اثر مهاری نداشتند. تعیین حداقل غلظت مهاری رشد (MIC) و حداقل غلظت کشندگی (MBC ): میزان MIC و MBC عصارههای متانولی و هگزانی دانه کرچک مناطق مازندران و قم در مقابل سویههای باکتریایی ذکر شده مورد ارزیابی قرار گرفت. نتایج حاکی از آن بود که تنها عصاره متانولی دانه کرچک منطقه مازندران که با روش همزنی بهدست آمده است، فعالیت بازدارندگی و کشندگی خوبی را در برابر باکتری¬ها داشته¬ است. به گونهای که کمترین مقدار MIC و MBC این عصاره با بالاترین فعالیت ضدباکتریایی در برابر باکتری گرم مثبت Bacillus cereus به ترتیب در غلظت¬های 5/12 و 25 میلیگرم بر میلیلیتر به ثبت رسید (جدول 3).
جدول 1: مقایسه میانگین تیمارها برای ترکیبات فنل کل، فلاونوئید و خاصیت آنتیاکسیدانی دانههای کرچک

جدول 2: میانگین قطر هاله عدم رشد باکتریایی (برحسب میلیمتر) عصاره متانولی دانه کرچک مناطق مازندران و قم بهدست آمده به روش شیکر

جدول 3: حداقل غلظت بازدارندگی و کشندگی عصاره متانولی دانه کرچک منطقه مازندران (بر حسب میلیگرم بر میلیلیتر)

بحث
شناسایی و بررسی ترکیبات سازنده گیاهان دارویی یکی از مهمترین مراحل مطالعه و پژوهش روی آنها است. استخراج این ترکیبات به یکسری عوامل بستگی دارد که از مهمترین آنها میتوان به نوع حلال، روش استخراج و جمع آوری آنها از مناطق مختلف اشاره کرد. هدف از این تحقیق استخراج ترکیبات زیستی از حلالهای گوناگون با قطبیتهای مختلف، توسط روشهای عصاره گیری متفاوت با شرایط اقلیمی مختلف بوده است. بر اساس نتایج حاصل از این آزمایش، میزان ترکیبات فنلی، فلاونوئیدی و خواص آنتیاکسیدانی تحت تاثیر حلالهای مختلف قرار گرفت و بهترین کارایی برای عصاره متانولی و ضعیفترین عملکرد برای عصاره هگزانی مشاهده شد. مطابق با نتایج این آزمایش، بیات و همکاران در سال 2018، اثر چهار حلال آبی، متانولی، اتانولی و هگزانی در استخراج گیاه دارویی برازمبل (Perovskia abrotanoides Karel.) را مورد بررسی قرار دادند که نتایج آن همانند آزمایشات ما نشان داد که عصاره حلال متانولی بهترین عملکرد را در فعالیت آنتیاکسیدانی و فنلی دارد و حلال هگزانی کارایی ضعیفتری دراین زمینه داشته است (17). همچنین اطهری و همکاران در سال 2019 خواص آنتیاکسیدانی، فنولی و ضدباکتریایی عصاره متانولی گیاه کرچک را مورد بررسی قرار دادند، نتایج نشان داد که عصاره متانولی فعالیت فنولی و آنتیاکسیدانی بالایی دارد و باعث مهار رشد باکتریهای استافیلوکوکوس اورئوس و اشریشیاکلی میشود (3). اسمعیلزاده بهابادی و همکاران در سال2016، به تاثیر حلالهای متانول، استون، اتیل استات، کلروفرم و هگزان بر خواص فنول و فلاونوئیدی و فعالیت آنتیاکسیدانی عصاره هندوانه ابوجهل (Citrullus colocynthis) پرداختند که نتایج پژوهش آنها نشان داد که حلال متانول بیشترین تاثیر را بهعنوان حلال برروی عصاره این هندوانه دارد و بهترین کارایی را بر تمامی فعالیتهای نامبرده از خود نشان داده است (18). مشیری و همکاران در سال 2023 به بررسی محتوای ترکیبات فنلی، فلاونوئیدی و فعالیت آنتیاکسیدانی عصاره آبی و متانولی صمغ آنغوزه (Frula assafoetida) پرداختند که در نتایج این آزمایشات هم، عصاره متانولی، خاصیت آنتیاکسیدانی بیشتری داشته است به گونهای که بالاترین درصد مهارکنندگی در غلظت 300 میکروگرم بر میلیلیتر از عصاره متانولی به میزان 90/7 درصد مشاهده شد (19). صوفیان و همکاران در سال 2022 اثر حلالهای مختلف بر استخراج ترکیبات فیتوشیمیایی گیاه دارویی چریش (Azadirachta indica A.Juss.) را مورد مطالعه قرار دادند و نتایح آنها نشان داد که حلال استونی بیشترین تاثیر را بر عصاره این گیاه داشته و حلال هگزانی عملکرد بسیار ضعیفی از خود نشان داده است (20). چنانچه در پژوهش ما نیز حلال هگزان ضعیفترین تاثیر بر استخراج ترکیبات زیست فعال داشته است. در بین روشهای استخراج که در آزمایش ما مورد استفاده قرار گرفتند عصاره بهدست آمده از شیکر نسبت به روش سوکسله بیشترین میزان فنول و فلاونوئید را از خود نشان داد و عصاره استخراجی از اثر متقابل حلال متانول و روش عصارهگیری سوکسله بالاترین فعالیت آنتیاکسیدانی را داشته است. ملائی و همکاران در سال 2022 تأثیر روشهای مختلف استخراج بر متابولیتها و خواص بیولوژیکی بذر گیاه چویل (Ferulago angulate) را مورد بررسی قرار دادند که در بین روشهای استخراج، عصارهای که از روش سوکسله بهدست آمد بیشترین میزان فنول، فلاونوئید و خاصیت آنتیاکسیدانی را دارا بود (21). مجیدایی و همکاران در سال 2019 به مقایسه اهمیت روشهای مختلف استخراج و نقش افزایش قطبیت حلال در محتوای تام فنل و فلاونوئیدی و میزان فعالیت آنتیاکسیدانی گیاه کما (Ferula persica) پرداختند که نتایج آن نشاندهنده این بود که عصارهای که از حلال متانول و روش سوکسله بهدست آمد بیشترین میزان ترکیبات زیستی را دارا بود (22). تفاوت بین نتایج بهدست آمده در قسمت خواص فنلی و فلاونوئیدی در تحقیقات ما و دیگران را میتوان به تفاوت بین ترکیبات زیستی و شیمیایی گیاهان، ساختار متفاوت واکنشهایی که دارند و همچنین شرایط اقلیمی که در آن رشد میکنند نسبت داد. در بررسیهای ما در زمینه تاثیر شرایط اقلیمی مختلف، عصاره کرچک منطقه مازندران بیشترین میزان فنل، فلاونوئید و خاصیت ضدباکتریایی را از خود نشان داد. مطابق نتایج ما سپهریفر و همکاران در سال 2008 به بررسی ترکیبات پلیفنلی، آنتوسیانینها و فلاونوئیدهای تام و خواص آنتیاکسیدانی گیاه دارویی قره قاط (Vaccinium Arctostaphylos L.) جمعآوری شده از چهار منطقه مختلف ایران پرداختند که در نهایت مشاهده شد که بیشترین فعالیت فنلی، آنتوسیانینی و آنتیاکسیدانی را گیاه منطقه مازندران داشت و در بررسی خاصیت ضدمیکروبی هم، عصاره متانولی بهدست آمده از روش شیکر که از منطقه مازندران برداشت شده بود بیشترین میزان این فعالیت را از خود نشان داده است (23). کریمی و همکاران در سال 2019 اثر ضد باکتریایی و آنتیاکسیدانی نانوامولسیون سنتز شده روغن کرچک را مورد آزمایش قرار دادند. نتایج نشان داد که روغن کرچک خواص آنتیاکسیدانی بالایی دارد و روی باکتری استافیلوکوکوس اورئوس اثر ضدمهاری به نسبت خوبی از خود نشان داده است (24). حناچی و همکاران در سال 2021 به سنجش میزان ترکیبات فنلی و فلاونوئیدی عصاره گیاهان بادرنجبویه (Melissa officialis) و اسطوخودوس (Lavandula angustifolia) با استفاده از حلالها و روشهای عصارهگیری مختلف و بررسی خواص ضدباکتریایی آنها پرداختند و نتایج آزمایشات آنها نیز نشان داد که عصاره متانولی گیاه اسطووخودوس بیشترین میزان ترکیبات فنولی را داراست و باکتری اشریشیاکلی با قطر هاله 19 میلیمتر بیشترین حساسیت را نسبت به حلالهای آبی و اتانولی داشته است. همچنین عصاره متانولی اسطوخودوس با قطر هاله 15 میلیمتر بهترین اثر را بر باکتری استافیلوکوکوس اورئوس داشته است (25). مطالعات نشان دادهاند که عصارههای متانولی و اتانولی دانه، برگ و ریشه گیاه کرچک دارای فعالیت ضدباکتریایی قابلتوجهی هستند. اثر مهاری عصاره روغنی این گیاه به دلیل حضور ترکیب سدیم رسینولئیک میباشد که به دیواره سلولی باکتری آسیب میرساند و باعث از بین رفتن اجزای سیتوپلاسمی و در نهایت مرگ سلول میشود. همچنین آزمایشات انجام شده در مورد فعالیت آنتیاکسیدانی گیاه کرچک نشان داده است که ترکیبات فلاونوئیدی آن دارای اثر آنتیاکسیدانی بیشتری نسبت به تاننها میباشد (26). بهنظر میرسد که فعالیت بالای آنتیاکسیدانی عصارههای متانولی با قابلیت نوع حلال، در استخراج ترکیبات فنلی ارتباط مستقیمی داشته باشد چرا که براساس شواهد موجود ارتباط مثبتی بین میزان ترکیبات فنلی و قدرت آنتیاکسیدانی گیاهان وجود دارد که از طریق عصارههای گیاهی آنها قابل استخراج است (27). همچنین دلیل کارایی بالای حلال متانول در استخراج ترکیبات آنتیاکسیدانی را میتوان به قطبیت این حلال نسبت داد (28).
نتیجهگیری
دراین پژوهش، میزان فنل کل، فلاونوئید، خاصیت آنتیاکسیدانی و ضدباکتریایی عصارههای متانولی و هگزانی دانه کرچک با دو روش استخراج متفاوت، جمعآوری شده از دو منطقه قم و مازندران انجام شد. نتایج نشان داد که حلال متانول با قطبیت بالای خود بازده خوبی در استخراج ترکیبات زیست فعال ازجمله ترکیبات آنتیاکسیدانی دارد. همچنین، عصاره متانولی دانه کرچک دارای اثرات ضد باکتریایی مناسبی بهویژه بر باکتریهای گرم مثبت مورد مطالعه دانه است. بهطور کلی، باتوجه به نتایج حاصله از آنالیز ضد باکتریایی و آنتیاکسیدانی ترکیبات زیست فعال دانه کرچک به نظر میرسد روش همزنی در استخراج ترکیبات زیست فعال نقش موثرتری داشته است. همچنین دانه کرچک متعلق به منطقه مازندران نسبت به منطقه قم، نتایج بهتری ارائه داد که میتواند حاکی از تفاوت شرایط اقلیمی دانهها باشد. بهطور کلی، هدف ما در این مقاله یافتن بهترین روش و حلال، استخراج ترکیبات زیست فعال دانه کرچک بوده که بتوانیم از نتایج آن، جهت انجام آنالیزهای بیشتر در مطالعات بعدی استفاده کنیم.
سپاسگزاری
این مقاله مســــتخرج از پایاننامه دانشجو بوده و نویــــسندگان مقاله کمال تشکر و قدردانی را از افراد شرکت کننده در این پژوهش دارند.
حامی مالی: دانشگاه تخصصی فناوریهای نوین آمل
تعارض در منافع: وجودندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه تخصصی فناوری های نوین آمل مورد تایید قرار گرفته است. IR.ASMT.REC.1403.007
مشارکت نویسندگان
سمیه رهایی در ارائه ایده، سمیه رهایی و صدیقه خانجانی جلودار در طراحی مطالعه، مهدیه حر در جمعآوری دادهها، ملیجه اکبرزاده در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Sofowora A, Ogunbodede E, Onayade A. The Role and Place of Medicinal Plants in the Strategies for Disease Prevention. Afr J Tradit Complement Altern Med 2013; 10(5): 210-29.
2- Miranda JJ. Medicinal Plants and their Traditional Uses in Different Locations. Phytomedicine 2021; 207-23.
3- Athari M, Azadfar E, Stiri SH, Nia AP, NematShahi MM. Study of Antioxidant Effect and Antimicrobial Properties Extract of Ricinus Communis and Its Effect on Soybean Oil Stability in Storage Conditions. Journal of Innovation in Food Science and Technology 2021; 14(52): 29-47. [Persian]
4- Gulluce M, Sahin F, Sokmen MÜ, Ozer H, Daferera D, Sokmen AT, et al. Antimicrobial and Antioxidant Properties of the Essential Oils and Methanol Extract from Mentha Longifolia L. ssp. longifolia. Food Chemistry 2007; 103(4): 1449-56.
5- Punchard NA, Kelly FJ. Free Radicals: A Practical Approach. Oxford University Press; 1996. (Oxford, 1996; online edn, Oxford Academic, 31 Oct. 2023)
6- Deng Y, Yang G, Yue J, Qian B, Liu Z, Wang D, Zhong Y, Zhao Y. Influences of Ripening Stages and Extracting Solvents on the Polyphenolic Compounds, Antimicrobial and Antioxidant Activities of Blueberry Leaf Extracts. Food Control 2014; 38: 184-91.
7- Jena J, Gupta AK. Ricinus Communis Linn: A Phytopharmacological Review. International Journal of Pharmacy and Pharmaceutical Sciences 2012; 4(4): 25-9.
8- Cheikhyoussef N, Cheikhyoussef A. Bioactive Phytochemicals from Castor (Ricinus Communis Linneo) Seed Oil Processing By-Products. Bioactive Phytochemicals from Vegetable Oil and Oilseed Processing By-products 2023; 703-22.
9- Jombo GT, Enenebeaku MN. Antibacterial Profile of Fermented Seed Extracts of Ricinus Communis: Findings from a Preliminary Analysis. Niger J Physiol Sci 2008; 23(1-2): 55-9.
10- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, And Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Journal of Ilam Uni Medical Sci 2019; 27(3): 91-100. [Persian]
11- Yu X, Tu X, Tao L, Daddam J, Li S, Hu F. Royal Jelly Fatty Acids: Chemical Composition, Extraction, Biological Activity, and Prospect. Journal of Functional Foods 2023; 111: 105868.
12- Shabaani M, Rahaiee S, Zare M. Evaluation of Antibacterial and Antioxidant Activities of Biosynthesized Zinc Oxide Nanoparticles Using Aqueous Extract of Eriobotrya Japonica Seeds. Journal of Ilam University of Medical Sci 2020; 28(5): 21-32. [Persian]
13- Cui H, Surendhiran D, Li C, Lin L. Biodegradable Zein Active Film Containing Chitosan Nanoparticle Encapsulated with Pomegranate Peel Extract for Food Packaging. Food Packaging and Shelf Life 2020; 24: 100511.
14- Lin SP, Kung HN, Tsai YS, Tseng TN, Hsu KD, Cheng KC. Novel Dextran Modified Bacterial Cellulose Hydrogel Accelerating Cutaneous Wound Healing. Cellulose 2017; 24: 4927-37.
15- Gupta M, Tomar RS, Kaushik S, Mishra RK, Sharma D. Effective Antimicrobial Activity of Green Zno Nano Particles of Catharanthus Roseus. Frontiers in Microbiology 2018; 9: 2030.
16- Parvekar P, Palaskar J, Metgud S, Maria R, Dutta S. The Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) of Silver Nanoparticles Against Staphylococcus Aureus. Biomater Investigat Dent 2020; 7(1): 105-9.
17- Bayat H, Noghondar MA, Aminifard MH. Determination and Comparison of Total Phenolic Content and Antioxidant Activity of Water, Methanolic, Ethanolic and Hexane Extracts from Different Parts of Perovskia Abrotanoides Karel. Journal of Innovation in Food Science & Technology 2022; 13(4): 1-11. [Persian]
18- Esmaeilzadeh Bahabadi S, Yosefzaei F. Effect of Different Solvents on Extraction of Phenolic and Flavonoid Compounds and Antioxidant Activity of Abu Jahl Watermelon Plant. Iranian J Food Sciand Industry 2018; 15(74): 13-320. [Persian]
19- Ghasemi M, Govahi M, Rajaei H. Evaluation of Antimicrobial and Antioxidant Activities of Aqueous and Hydroalcoholic Extracts of Ferula Gummosa Boiss Plant Gum: An In-Vitro Study. J Birjand Univ Med Sci 2023; 30(3): 243-56. [Persian]
20- Bidarnamani F, Rahimi M, Ranjbari AG, Soufiyan JA, Mohkami Z. Effect of Different Solvents on the Extraction of Phytochemical Compounds of Neem (Azadirachta Indica A. Juss). Journal of Medicinal Plants Research 2022; 10(1): 15-26. [Persian]
21- Mollaei S, Sedighi F, Hazrati S. Effect of Different Extraction Methods on The Metabolites and Biological Activities of Chaville Seeds (Ferulago Angulate). J Advanced Researches in Medicinal Plants 2022; 1(1): 1-10. [Persian]
22- Majidaee E, Hosseyni Talei SR, Gholamnezhad S, Ebrahimzadeh MA. Comparing The Effect of Different Extraction Methods and the Role of Solvent Polarity on Total Phenolic and Flavonoid Contents and Antioxidant Activities of Ferula Persica. J Mazandaran Univ Med Sci 2020; 30(188): 26-39. [Persian]
23- Sepehrifar R, Hasanloo T. Polyphenolics, Flavonoids and Anthocyanins Content and Antioxidant Activity of Qare-Qat (Vaccinium arctostaphylos L.) from different areas of Iran. Journal of Medicinal Plants 2010; 9(33): 66-74. [Persian]
24- Javanshir A, Karimi E, Homayoni Tabrizi M. Investigation of Antioxidant and Antibacterial Potential of Ricinus Communis L. Nano-Emulsion. Jundishapur Scientific Medical J 2020; 19(1): 1-9. [Persian]
25- Hanachi P, Ghorbani N, Sadeghi Ali Abadi H, Kiarostami K, Hosseini FS. Evaluation of Total Phenolic and Flavonoid Compounds of Lavandula Angustifolia and Melissa Officialis and their Antibacterial Properties Using Different Solvents and Extraction Methods. Navid No 2022; 25(82): 38-49. [Persian]
26- Singh PP, Chauhan SM. Activity Guided Isolation of Antioxidants from the Leaves of Ricinus Communis L. Food Chemistry 2009; 114(3): 1069-72.
27- Küçük M, Kolaylı S, Karaoğlu Ş, Ulusoy E, Baltacı C, Candan F. Biological Activities and Chemical Composition of Three Honeys of Different Types from Anatolia. Food Chemistry 2007; 100(2): 526-34.
28- Peschel W, Sánchez-Rabaneda F, Diekmann W, Plescher A, Gartzía I, Jiménez D, et al. An Industrial Approach in the Search of Natural Antioxidants from Vegetable and Fruit Wastes. Food Chemistry 2006; 97(1): 137-50
1- Sofowora A, Ogunbodede E, Onayade A. The Role and Place of Medicinal Plants in the Strategies for Disease Prevention. Afr J Tradit Complement Altern Med 2013; 10(5): 210-29.
2- Miranda JJ. Medicinal Plants and their Traditional Uses in Different Locations. Phytomedicine 2021; 207-23.
3- Athari M, Azadfar E, Stiri SH, Nia AP, NematShahi MM. Study of Antioxidant Effect and Antimicrobial Properties Extract of Ricinus Communis and Its Effect on Soybean Oil Stability in Storage Conditions. Journal of Innovation in Food Science and Technology 2021; 14(52): 29-47. [Persian]
4- Gulluce M, Sahin F, Sokmen MÜ, Ozer H, Daferera D, Sokmen AT, et al. Antimicrobial and Antioxidant Properties of the Essential Oils and Methanol Extract from Mentha Longifolia L. ssp. longifolia. Food Chemistry 2007; 103(4): 1449-56.
5- Punchard NA, Kelly FJ. Free Radicals: A Practical Approach. Oxford University Press; 1996. (Oxford, 1996; online edn, Oxford Academic, 31 Oct. 2023)
6- Deng Y, Yang G, Yue J, Qian B, Liu Z, Wang D, Zhong Y, Zhao Y. Influences of Ripening Stages and Extracting Solvents on the Polyphenolic Compounds, Antimicrobial and Antioxidant Activities of Blueberry Leaf Extracts. Food Control 2014; 38: 184-91.
7- Jena J, Gupta AK. Ricinus Communis Linn: A Phytopharmacological Review. International Journal of Pharmacy and Pharmaceutical Sciences 2012; 4(4): 25-9.
8- Cheikhyoussef N, Cheikhyoussef A. Bioactive Phytochemicals from Castor (Ricinus Communis Linneo) Seed Oil Processing By-Products. Bioactive Phytochemicals from Vegetable Oil and Oilseed Processing By-products 2023; 703-22.
9- Jombo GT, Enenebeaku MN. Antibacterial Profile of Fermented Seed Extracts of Ricinus Communis: Findings from a Preliminary Analysis. Niger J Physiol Sci 2008; 23(1-2): 55-9.
10- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, And Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Journal of Ilam Uni Medical Sci 2019; 27(3): 91-100. [Persian]
11- Yu X, Tu X, Tao L, Daddam J, Li S, Hu F. Royal Jelly Fatty Acids: Chemical Composition, Extraction, Biological Activity, and Prospect. Journal of Functional Foods 2023; 111: 105868.
12- Shabaani M, Rahaiee S, Zare M. Evaluation of Antibacterial and Antioxidant Activities of Biosynthesized Zinc Oxide Nanoparticles Using Aqueous Extract of Eriobotrya Japonica Seeds. Journal of Ilam University of Medical Sci 2020; 28(5): 21-32. [Persian]
13- Cui H, Surendhiran D, Li C, Lin L. Biodegradable Zein Active Film Containing Chitosan Nanoparticle Encapsulated with Pomegranate Peel Extract for Food Packaging. Food Packaging and Shelf Life 2020; 24: 100511.
14- Lin SP, Kung HN, Tsai YS, Tseng TN, Hsu KD, Cheng KC. Novel Dextran Modified Bacterial Cellulose Hydrogel Accelerating Cutaneous Wound Healing. Cellulose 2017; 24: 4927-37.
15- Gupta M, Tomar RS, Kaushik S, Mishra RK, Sharma D. Effective Antimicrobial Activity of Green Zno Nano Particles of Catharanthus Roseus. Frontiers in Microbiology 2018; 9: 2030.
16- Parvekar P, Palaskar J, Metgud S, Maria R, Dutta S. The Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) of Silver Nanoparticles Against Staphylococcus Aureus. Biomater Investigat Dent 2020; 7(1): 105-9.
17- Bayat H, Noghondar MA, Aminifard MH. Determination and Comparison of Total Phenolic Content and Antioxidant Activity of Water, Methanolic, Ethanolic and Hexane Extracts from Different Parts of Perovskia Abrotanoides Karel. Journal of Innovation in Food Science & Technology 2022; 13(4): 1-11. [Persian]
18- Esmaeilzadeh Bahabadi S, Yosefzaei F. Effect of Different Solvents on Extraction of Phenolic and Flavonoid Compounds and Antioxidant Activity of Abu Jahl Watermelon Plant. Iranian J Food Sciand Industry 2018; 15(74): 13-320. [Persian]
19- Ghasemi M, Govahi M, Rajaei H. Evaluation of Antimicrobial and Antioxidant Activities of Aqueous and Hydroalcoholic Extracts of Ferula Gummosa Boiss Plant Gum: An In-Vitro Study. J Birjand Univ Med Sci 2023; 30(3): 243-56. [Persian]
20- Bidarnamani F, Rahimi M, Ranjbari AG, Soufiyan JA, Mohkami Z. Effect of Different Solvents on the Extraction of Phytochemical Compounds of Neem (Azadirachta Indica A. Juss). Journal of Medicinal Plants Research 2022; 10(1): 15-26. [Persian]
21- Mollaei S, Sedighi F, Hazrati S. Effect of Different Extraction Methods on The Metabolites and Biological Activities of Chaville Seeds (Ferulago Angulate). J Advanced Researches in Medicinal Plants 2022; 1(1): 1-10. [Persian]
22- Majidaee E, Hosseyni Talei SR, Gholamnezhad S, Ebrahimzadeh MA. Comparing The Effect of Different Extraction Methods and the Role of Solvent Polarity on Total Phenolic and Flavonoid Contents and Antioxidant Activities of Ferula Persica. J Mazandaran Univ Med Sci 2020; 30(188): 26-39. [Persian]
23- Sepehrifar R, Hasanloo T. Polyphenolics, Flavonoids and Anthocyanins Content and Antioxidant Activity of Qare-Qat (Vaccinium arctostaphylos L.) from different areas of Iran. Journal of Medicinal Plants 2010; 9(33): 66-74. [Persian]
24- Javanshir A, Karimi E, Homayoni Tabrizi M. Investigation of Antioxidant and Antibacterial Potential of Ricinus Communis L. Nano-Emulsion. Jundishapur Scientific Medical J 2020; 19(1): 1-9. [Persian]
25- Hanachi P, Ghorbani N, Sadeghi Ali Abadi H, Kiarostami K, Hosseini FS. Evaluation of Total Phenolic and Flavonoid Compounds of Lavandula Angustifolia and Melissa Officialis and their Antibacterial Properties Using Different Solvents and Extraction Methods. Navid No 2022; 25(82): 38-49. [Persian]
26- Singh PP, Chauhan SM. Activity Guided Isolation of Antioxidants from the Leaves of Ricinus Communis L. Food Chemistry 2009; 114(3): 1069-72.
27- Küçük M, Kolaylı S, Karaoğlu Ş, Ulusoy E, Baltacı C, Candan F. Biological Activities and Chemical Composition of Three Honeys of Different Types from Anatolia. Food Chemistry 2007; 100(2): 526-34.
28- Peschel W, Sánchez-Rabaneda F, Diekmann W, Plescher A, Gartzía I, Jiménez D, et al. An Industrial Approach in the Search of Natural Antioxidants from Vegetable and Fruit Wastes. Food Chemistry 2006; 97(1): 137-50
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1403/10/17 | پذیرش: 1404/4/16 | انتشار: 1404/7/15
دریافت: 1403/10/17 | پذیرش: 1404/4/16 | انتشار: 1404/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







