دوره 33، شماره 3 - ( خرداد 1404 )
جلد 33 شماره 3 صفحات 8794-8761 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Davaripour A, Shahrousvand M, Mohammadi-Rovshandeh J, Davachi S M. A Review of the Application of Poly (Lactic-Co-Glycolic Acid) Copolymers in Bone Tissue Regenerative Medicine. JSSU 2025; 33 (3) :8761-8794
URL: http://jssu.ssu.ac.ir/article-1-6347-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6347-fa.html
داوریپور علیرضا، شهروسوند محسن، محمدی روشنده جمشید، دواچی سیدمحمد. مروری بر کاربرد کوپلیمرهای پلی (لاکتیک – کو - گلایکولیک اسید) در پزشکی بازساختی بافت استخوان. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (3) :8761-8794
متن کامل [PDF 2669 kb]
(223 دریافت)
| چکیده (HTML) (775 مشاهده)
متن کامل: (797 مشاهده)
مقدمه
استخوانها که ترکیبی از هیدروکسی آپاتایت (HA) و فیبرهای کلاژن هستند، به عنوان یکی از اجزای حیاتی بدن، نقشهای اساسی در حفاظت، حرکت، ذخیره مواد معدنی و تولید سلولهای خونی ایفا میکنند. در صورتیکه استخوانها دچار آسیب شوند، کیفیت زندگی فرد آسیب دیده دچار مشکل خواهد شد. بنابراین درمان نقایص استخوانی و بیماری مرتبط با آن همچنان یک چالش بالینی واقعی است (1). بهطور معمول، نقایص بزرگ استخوان ناشی از تروما، عفونت، شکستگی، تغییر شکل ستون فقرات، برداشتن تومور استخوان و غیره، نیاز به درمان جراحی با استفاده از پیوند اتوگرافت (autograft) استخوان دارند. با این وجود، استفاده از اتوگرافت هنوز به دلیل عوارض و در دسترس نبودن منابع اهداکننده، محدود است. از سوی دیگر آلوگرافتها (allograft) خطر تحریک سیستم ایمنی و انتقال بیماریهای عفونی را دارند (2). بنابراین، جایگزینی استخوان مصنوعی به عنوان یک استراتژی جایگزین بهینه، توجه روزافزونی را به خود جلب کرده است. بازسازی استخوان تحت یک فرآیند بیولوژیکی پیچیده است که با تشکیل لخته خون، پاسخ التهابی حاد و نئوواسکولاریزاسیون (neovascularization) و متعاقب آن بازسازی نهایی استخوان، همراه است (3). در چند دهه گذشته، مواد بازسازی استخوان در سه نسل اول، دوم و سوم تکامل یافته اند. بیومواد نسل اول، مواد زیستخنثی (bioinert) هستند که با فلزات و پلیمرهای مصنوعی خاص و بیوسرامیک¬ها نشان داده میشوند، نسل دوم بیومواد پلیمرهای زیستتخریبپذیر، مواد زیستفعال و قابل جذب زیستی هستند که با پلی استرها، فسفات کلسیم و شیشه بیواکتیو ترکیب میشوند. نسل سوم تمرکز بر مهندسی بازساختی بافتهای مورد نظر به کمک بیومواد و فاکتورهای موثر و سایر روشهای مهندسی شده است (4). مهندسی بافت بر اساس سه جزء اصلی سلولها، مولکولهای زیستی فعال و داربستها بنا شده است. سلولها اجزای بنیادی سازنده بافت هستند و نقش حیاتی در ترمیم و بازسازی آنها دارند. استفاده از سلولهای بنیادی، بهویژه سلولهای بنیادی جنینی و بالغ، در این زمینه بسیار مورد توجه قرار گرفته است (5). مولکولهای زیستی فعال شامل فاکتورهای رشد و سیگنالدهندههایی هستند که به سلولها کمک میکنند تا در جهت ترمیم و بازسازی بافت عمل کنند. داربستها ساختارهایی هستند که محیطی مناسب برای رشد سلولها فراهم میکنند. بنابراین داربستها باید دارای خواص مکانیکی متناسب با بافت موردنظر، زیستسازگاری و زیستتخریبپذیری باشند تا بتوانند بهطور مؤثر با بافتهای طبیعی تعامل داشته باشند (6). این داربستها غالباً از پلیمرها ساخته میشوند. در این میان، پلیمرهای زیستتخریبپذیر و زیستسازگار، از جمله انتخابهای اصلی محسوب میشوند (7،8). پلیمر پلی (لاکتیک-کو-گلایکولیک اسید) (PLGA) به دلیل اینکه مونومرهای آن پایه نفتی و فسیلی ندارند و کاملاً از محیطزیست مشتق میشوند، پلیمری زیستتخریبپذیر و زیستسازگار است. سرعت تخریب این پلیمر با تغییر نسبت مونومرهای سازنده آن قابل تنظیم است که این ویژگی میتواند علاوه بر زمان تخریب داربست، در کاربردهای دیگر هم مانند سامانه های رهایش دارو مورد توجه قرار گیرد. خواص مکانیکی، از جمله استحکام و مدول مناسب این پلیمر باعث میشود که مشابه استخوان و جایگزین مناسبی برای آن باشد. این پلیمر به دلایل گفته شده، مورد توجه بسیاری از محققان قرار گرفته است و همچنین مواد مبتنی بر PLGA توسط سازمان غذا و دارو (FDA) برای کاربردهای زیستپزشکی تایید شدهاند (9). تا به امروز، محصولات زیادی بر اساس PLGA تولید شده اند، مانند بخیه قابل جذب (Coated VICRYL®)، پلت فرم تحویل دارو (Triptorelin)، در ساخت قرص پلاویکس، پیچ استخوانی، و پیوند استخوان (OsteoScafTM) (13-10). در این مقاله مروری قصد داریم، فرآیند سنتز پلیمر PLGA و روشهای مختلف آن را بررسی کنیم و کاربرد آن در مهندسی بافت استخوان را مورد مطالعه قرار دهیم.
روش بررسی
جهت مرور و بررسی مطالعات و شواهد در دسترس در رابطه با کوپلیمرهای پلی (لاکتیک – کو - گلایکولیک اسید) و کاربرد آن در مهندسی بافت استخوان، پایگاههای اطلاعاتی Science Direct، PubMed و موتور جستجوی google scholar مورد استفاده قرار گرفت. در این تحقیق ازکلیدواژههای: استخوان، مهندسی بافت، پلی (لاکتیک-کو-گلایکولیک اسید) (PLGA) و داربست در بازه زمانی 1950 تا 2024 میلادی استفاده شده است. در مجموع 77 مقاله مروری و یا پژوهشی کامل برای تحریر این مقاله استفاده شده است.
سنتز مونومرها و پلیمر PLGA: از آنجاییکه خواص منحصربهفرد این پلیمر مرتبط به روش سنتز و نوع و ترکیب درصد مونومرهای آنها است، باید کلیاتی بهصورت خلاصه در مورد سنتز آن نیز دانسته شود. PLGA یک پلیمر آمورف آلیفاتیک زیستتخریبپذیر است که توسط دو روش بسپارش (Polymerization) تراکمی مستقیم و بسپارش حلقهگشا میتوان سنتز کرد. البته مونومرها در هر یک از این روشها متفاوت است. در روش بسپارش تراکمی مستقیم، مونومرها لاکتیک اسید و گلایکولیک اسید هستند. این در حالی است که مونومرها، در بسپارش حلقه گشا، لاکتاید و گلایکولاید هستند، که در ادامه به توضیح این مونومرها میپردازیم.
لاکتیک اسید (C3H6O3) یکی از رایجترین اسیدهای کربوکسیلیک موجود در طبیعت است. قندهای موجود در محصولات سلولزی مانند پنبه و ضایعات کشاورزی مورد استفاده برای تخمیر لاکتیک اسید شامل نشاسته، گلوکز، لاکتوز و مالتوز است که توسط ذرت و سیب زمینی تولید میشود (14). اسید لاکتیک از هیدرولیز، استریفیکاسیون، تقطیر و هیدرولیز به دست میآید (شکل1).
لاکتاید یک استر حلقوی شده در اثر آبگیری از دو مولکول اسید لاکتیک است که این فرآیند از طریق بسپارش تراکمی مولکول¬های لاکتیک اسید و سپس وابسپارش الیگومر تولید شده، انجام میشود. پس از تولید لاکتاید، برای استخراج مونومر لاکتاید، معمولاً از روشهای حرارتی و کاهش فشار استفاده میشود (15). طبق بررسی Pieter VanWouwe، سه روش اصلی برای تولید لاکتاید از لاکتیک اسید وجود دارد. روش اول شامل سنتز دو مرحلهای است که در آن اسید لاکتیک به الیگومر و سپس به حلقه دیمر تبدیل میشود. روش دوم، سنتز فاز گاز است که با تبخیر و واکنش بر روی بستر کاتالیزوری انجام میشود. روش سوم، فرآیند فاز مایع یک مرحلهای است که با استفاده از زئولیتها انرژی کمتری مصرف میکند و به نظر میرسد بهترین ویژگیهای هر دو روش قبلی را ترکیب کند (16).
گلایکولیک اسید (GA) یک آلفا هیدروکسی اسید دو کربنه با کاربردهای گسترده است. در صنعت نساجی به عنوان رنگزا و برنزهکننده، در صنایع غذایی به عنوان طعمدهنده و نگهدارنده، و در داروسازی به عنوان عامل مؤثر در مراقبت از پوست استفاده میشود (17). GAبه طور طبیعی توسط برخی باکتریهای اکسیدکننده آهن و گوگرد تولید میشود (18) یا از هیدرولیز گلیکولونیتریل توسط آنزیم نیتریلاز آلکالیژنس (شکل2) بهدست میآید.
گلایکولاید، یک دیاستر حلقوی از گلایکولیک اسید، مادهای کریستالی سفید رنگ است که در حلالهای آلی حل میشود و دارای نقطه ذوب ℃85 است (19). هیگینز و همکارانش فرآیند پلیمریزاسیون تراکمی اسید گلایکولیک را بررسی کردند. در این روش، حذف آب در دمای 200 درجه سانتیگراد و فشار اتمسفر انجام میشود. سپس دما به 220 درجه افزایش و فشار به 0/1 تا 0/7 کیلو پاسکال کاهش مییابد. گلایکولاید به عنوان محصول جانبی با بازده 14% تولید میشود. بر اساس شکل (3)، واکنش (2) عمدتاً در دمای حدود ℃200 رخ میدهد، بازده پایین گلایکولاید عمدتاً به دلیل دمای پایین وابسپارش (Depolymerization) الیگومرها است که موجب تغییر تعادل به سمت تشکیل پلی گلایکولیک اسید از طریق پلیمریزاسیون تراکمی میشود (20).
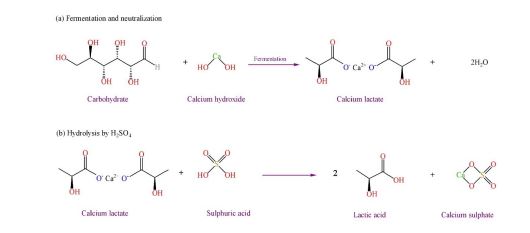
شکل1: تولید لاکتیک اسید از طریق فرآیند تخمیر و هیدرولیز.

شکل 2: فرآیند شیمیایی-آنزیمی سه مرحلهای برای تولید گلایکولیک اسید.
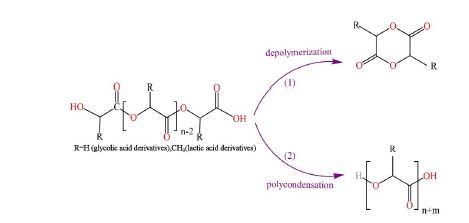
شکل 3: تبدیل برگشت پذیر الیگومرهای هیدروکسی کربوکسیلیک اسید: (1) وابسپارش (2) بسپارش تراکمی.
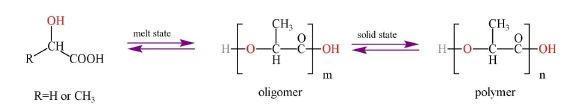
1.2 سنتز پلی لاکتیک کو گلایکولیک اسید (PLGA): PLGA یک پلیاستر آلیفاتیک است که بهطور کامل به دیاکسید کربن و آب تجزیه میشود و برای محیطزیست بیضرر و غیرسمی است. این پلیمر دارای سازگاری بیولوژیکی و قابلیت جذب عالی در بدن است، که آن را برای کاربردهایی مانند بخیههای پزشکی، مواد تثبیتکننده استخوان، میکروکرههای(Microsphere) دارورسانی و مهندسی بافت استخوان مناسب میسازد. PLGA از طریق دو روش پلیمریزاسیون تراکمی و حلقهگشا سنتز میشود، اما پلیمریزاسیون حلقهگشا نسبت به پلیمرزیزاسیون تراکمی برای تولید کوپلیمرهای با وزن مولکولی بالا کارآمدتر است و بهترین روش برای سنتز PLGA پلیمریزاسیون حلقه گشا هست. لاکتاید و گلیکولاید، به ترتیب با تجزیه حرارتی الیگومرهای لاکتیک اسید و گلایکولیک اسید تهیه میشوند و بهعنوان الیگومرها استفاده میشوند. روش پلیمریزاسیون تراکمی، خود به زیر دستههای دیگری نیز تقسیمبندی میشود. پلیمریزاسیون تراکمی میتواند در حالت محلول یا مذاب انجام شود، اما اگر پژوهشگر مجبور باشد از روش پلیمریزاسیون تراکمی برای سنتز استفاده کند از بین روشهای مختلف پلیمرزاسیون تراکمی، برای تولید پلیمرهای با وزن مولکولی بالا، روش "بسپارش تراکمی مذاب-جامد" به عنوان یک گزینه جدید معرفی شده است (شکل4)، که با این حال وزن مولکولی در این روش جدید نسبت به پلیمریزاسیون حلقه گشا پایین تر هست. در این روش، الیگومرها از مونومرها با حذف آب ساخته میشوند و سپس تحت فشار پایین و با کاتالیزورهایی مانند روی استات دیهیدرات پلیمریزه میشوند تا پلیمرهای با وزن مولکولی بالا تولید شود (21).
برای تولید پلیمر PLGA با وزن مولکولی بالا، استفاده از بسپارش حلقهگشا برای دیاسترهای حلقوی لاکتاید و گلایکولاید مؤثر است. در این فرآیند، حلقههای کوچک مولکولی به زنجیرههای بلند پلیمری تبدیل میشوند (شکل 5). این روش به دلیل توانایی در تولید پلیمرهای با وزن مولکولی بالا و کنترل دقیق بر ساختار مولکولی، بسیار مورد توجه است. دیاسترهای حلقوی تحت شرایط خاص و با کاتالیزورهایی مانند قلع یا تیتانیوم پلیمریزه میشوند. این روش امکان تولید PLGA با ویژگیهای زیستسازگاری و تخریبپذیری مطلوب را فراهم میکند و به تنظیم وزن مولکولی نهایی پلیمر کمک میکند، که برای طراحی داروهای تحویلی اهمیت دارد. در نتیجه، استفاده از روش بسپارش حلقهگشا برای تولید PLGA نه تنها زمان تولید را کاهش میدهد بلکه امکان دستیابی به پلیمرهایی با خواص مورد نیاز برای کاربردهای خاص را نیز فراهم میآورد (22،23)
شکل 4:روشهای سنتز گلایکولاید از طریق بسپارش الیگومرهای گلایکولیک اسید.

شکل 5: بسپارش حلقهگشا لاکتاید و گلایکولاید.
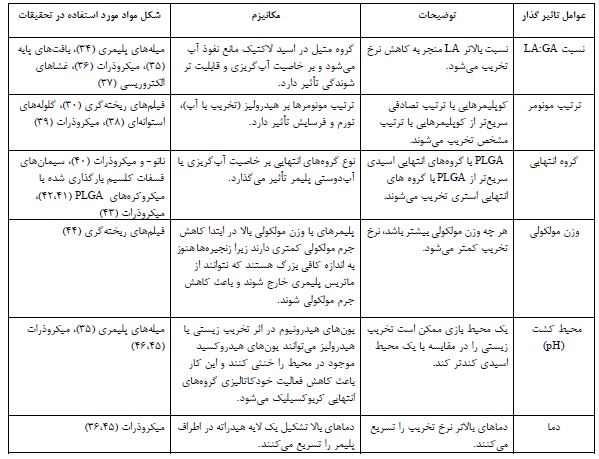
3. خواص فیزیکوشیمیایی و تخریبپذیری: خصوصیات فیزیکوشیمیایی پلیمرهای زیستی، از جمله PLGA، برای طراحی مواد زیستی مهم هستند. PLGA در وزنهای مولکولی و ترکیبات مختلفی عرضه میشود که بر ویژگیهای آن تأثیر دارد (24). PLGA برخلاف پلی لاکتیک و پلی گلایکولیک اسید، با حلالهای مختلفی حل میشود و قابلیت پردازش و محصور کردن زیستمولکولها را دارد (25). خواص فیزیکی PLGA به عوامل مختلفی از جمله وزن مولکولی اولیه مونومرها، نسبت LA:GA، زمان قرار گرفتن در معرض آب و دمای ذخیره (دمایی که PLGAبرای حفظ پایداری فیزیکی و شیمیایی خود در آن نگهداری میشود) بستگی دارد (26). متداولترین نوع PLGA (50:50) شامل 50% لاکتیک و 50% گلایکولیک است. نسبت مولی این اسیدها بر خواص و تخریبپذیری آن تأثیر مهمی در بازسازی استخوان دارد (27). بر خلاف اسید لاکتیک، اسید گلایکولیک فاقد گروه جانبی متیل است و آن را بسیار کریستالی میکند، اما این کریستالی در PLGA از بین میرود (28). گروههای انتهایی کربوکسیل آزاد PLGA را میتوان برای اصلاحات شیمیایی برای تعدیل سرعت تخریب یا خواص تحویل دارو استفاده کرد (29). PLGAبا هیدرولیز پیوندهای استری خود، از طریق فرسایش تودهای یا ناهمگن، در محیطهای آبی تخریب میشود (30). جدول 1 عوامل اصلی و مکانیسم های مربوط به تخریب ماده PLGA را فهرست کرده است. تخریب PLGA شامل چهار مرحله است: (الف) جذب آب: نفوذ آب به نواحی آمورف و اختلال در نیروهای واندروالس و پیوندهای هیدروژنی که دمای انتقال شیشهای (Tg) را کاهش میدهد. (ب) تخریب اولیه: شکست پیوندهای کووالانسی و کاهش وزن مولکولی که آغاز فرآیند تخریب را نشان میدهد. (ج) تخریب مداوم :گروههای کربوکسیلیک انتهایی کاتالیز میکنند و از دست رفتن جرم و یکپارچگی ساختاری PLGA آغاز میشود. (د) انحلال : قطعات به مولکولهای محلول در آب شکسته شده و لاکتیک اسید (LA) و گلایکولیک اسید (GA) به عنوان محصولات جانبی تولید میشوند (33-31).
جدول1: اثر متغیرهای متداول بر تخریبپذیری مواد زیستی مبتنی بر PLGA.
4. کاربرد های PLGA در مهندسی بافت استخوان: پلیمرهای زیستتخریبپذیر، به ویژه (PLGA)، در تحویل کنترلشده و هدفمند داروها نقش مهمی دارند. PLGA به عنوان یک "پلیمر هوشمند" شناخته میشود و سیستمهای دارورسانی مبتنی بر آن برای درمان بیماریها گزارش شدهاند. در سالهای اخیر، پلیمرهای غیرقابل جذب جای خود را به پلیمرهای قابل جذب و زیستتخریبپذیر دادهاند. پلیمرهای مصنوعی مانند پلیانیدریدها و پلییورتان استری نیز توسعه یافتهاند، اما پلیاسترهای آلیفاتیک ترموپلاستیک به دلیل خواص فیزیکی، شیمیایی و زیستی متنوع خود برتری دارند. (49-47). به طور ایدهآل، بیومتریالها موادی هستند که بهطور موقت یا دائمی بخشی از بدن میشوند تا عملکردهای طبیعی بافت یا اندامهای زنده را بازسازی، تقویت یا جایگزین کنند (50). این مواد نباید هیچ واکنش سیستمیک، ایمنی، سیتوتوکسیک، جهشزا، سرطانزا یا تراتوژنیک ایجاد کنند (51). پلیاسترهای زیستتخریبپذیر مصنوعی مانند پلیلاکتیک اسید و پلیگلایکولیک اسید از دهه 1970 به عنوان نخهای جراحی قابل جذب استفاده میشوند (52). پیشرفتهای اخیر شامل توسعه سیستمهای پلیمری جدید با پیوند بلوکها و ترکیب آنها با دیگر پلیمرها یا مونومرها است. این کوپلیمرها به گونهای طراحی شدهاند که خواص خاصی برای دستگاههای زیستپزشکی و سیستمهای دارورسانی فراهم کنند، از جمله دسترسی زیستی مشخص و نرخ رهایش کنترلشده، که به بهبود عملکرد درمانی کمک میکند (53). در میان کوپلیمرهای PLA و PGA، پلی (لاکتیک اسید-کو-گلایکولیک اسید) به عنوان یک پلیمر زیستسازگار و غیرسمی مهم با کاربردهای متعدد در دارورسانی، مهندسی بافت، و دستگاههای پزشکی و جراحی برجسته شده است. PLGA به دلیل خواص زیستتخریبپذیری، زیستسازگاری و رهایش پایدار خود، توسط سازمان غذا و داروی ایالات متحده (FDA) برای چندین کاربرد درمانی تأیید شده است (54). داربستهای مهندسی بافت غضروف باید دارای استحکام مکانیکی بالا و ساختار منافذ کنترلشده باشند تا میکرو محیطهای مناسبی برای بازسازی بافت فراهم کنند. غضروف مفصلی بافتی نازک و صاف است که سطح مفاصل دیارتروئید را پوشش میدهد و نقش مهمی در توزیع بار و کاهش اصطکاک حین حرکت دارد. این بافت فاقد عروق خونی است، که برای حمل مواد مغذی در طول بازسازی ضروری هستند (55،56). به همین دلیل، ترمیم نقصهای غضروفی دشوار است. درمانهای مختلفی مانند دارو، تکنیک میکروفراکتور، پیوند بافتی و پیوند خودی برای ترمیم آسیبهای غضروفی استفاده میشود. با وجود تأثیرات مثبت این درمانها، محدودیتهایی نیز دارند؛ بهعنوان مثال، درمان دارویی نیاز به دوره بهبودی طولانی دارد و تنها بهطور جزئی بافت آسیبدیده را به عملکرد طبیعی برمیگرداند (57). تکنیک میکروفراکتور برای ترمیم نقصهای کوچک غضروف مناسب است، اما پیوند خودی و بافتی با کمبود اهداکننده و ردایمنی مواجهاند (58،59). مهندسی بافت غضروف توسعه یافته و به عنوان یک روش جایگزین برای غلبه بر محدودیتهای این درمانها معرفی شده است (60،61).
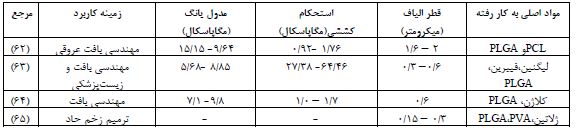
1.4. داربستهای الکتروریسی شده: روشهای مختلفی برای تولید الیاف وجود دارد که یکی از آنها الکتروریسی است. این روش مؤثر و کمهزینه، الیاف با قطرهای کوچک تولید میکند و در زمینههای محیط زیست و انرژی کاربرد دارد. ساختار آن مشابه ماتریکس خارجسلولی (ECM) است. با توجه به خواص پلیمر PLGA که در بخش مقدمه بیان شد، این پلیمر دارای جرم مولکولی گرهخوردگی حدود 10,000 گرم بر مول و جرم مولکولی بین 40,000 تا 50,000 گرم بر مول است که این مقادیر برای فرآیند الکتروریسی مناسب هستند. علاوه بر این، PLGA به راحتی در حلالهای آلی حل میشود و به دلیل ثابت دیالکتریک خوب این محلول، امکان تولید الیاف با قطر یکنواخت و مناسب فراهم میشود. در سال 2021 وی ژانگ و همکارانش (62) به ارزیابی ویژگیها و تأثیرات تخریب بر خواص ساختاری داربستهای نانوالیافی مبتنی (PLGA) و پلیکاپرولاکتون (PCL) پرداختند. شش داربست از طریق روش الکتروریسی تهیه شد. از این تعداد، سه داربست با استفاده از (PCL) در غلظت 15% (وزن/حجم) و سه داربست دیگر (PLGA) با در غلظت 10% (وزن/حجم) تولید گردید. زمانهای پردازش الکتروریسی برای این داربستها به ترتیب 30، 60 و 90 دقیقه بود. هر دو نوع داربست با افزایش زمان ریسندگی خواص مکانیکی بهتری نشان دادند و درصد کاهش وزن آنها به تدریج افزایش یافت که تأییدکننده قابلیت تخریب غشای متخلخل است. اندازه حفره و درصد تخلخل در طول تخریب بهطور قابلتوجهی کاهش یافت. ویژگی آبگریزی یا آبدوستی لایه غشایی بر کاربرد آن تأثیر دارد؛ غشاهای آبگریز برای جلوگیری از جذب مایع و داربستهای آبدوست برای نفوذ و تکثیر سلولها ضروری هستند. تمام نمونهها به دلیل استفاده از پلیمرهای آبگریز با وزن مولکولی بالا، آبگریز بودند (شکل 6-الف) و زاویههای تماس آنها بیشتر از °90 بود که این امر میتواند برای چسبندگی و تکثیر سلولها مشکلساز باشد. جالب است که غشاهای PLGA کمی بیشتر از غشاهای PCL آبگریز بودند. این مطالعه به بررسی کاهش وزن داربستهای الکتروریسی از PCL و PLGA در طول 12 هفته تخریب میپردازد (شکل 6-ب). تصاویر میکروسکوپ الکترونی روبشی (SEM) نشان دهنده وضعیت این ساختارها در طول 12 هفته در دمای اتاق هستند (شکل 6-ج). این تصاویر نشان میدهند که غشاءهای ساخته شده با روش الکتروریسی، یک شبکه بسیار متصل و دارای منافذ مناسب و سطحی نسبتاً صاف ایجاد کردهاند. همچنین، فرآیند تولید این غشاءها به گونهای بهبود یافته که هیچ مشکلی مانند ناپایداری جت الکتروریسی یا وجود دانههای (Beads) ناخواسته مشاهده نشده است. داربستهای موقتی باید نرخ تخریب ثابتی داشته باشند تا از رشد بافت حمایت کنند. در این مطالعه، نمونهها بهصورت هفتگی برداشت و وزنکشی شدند تا رطوبت از بین برود. تحقیقات نشان میدهد که پلیمرها در طول تخریب در دمای اتاق بیشتر بلوری میشوند، که بر نرخ تخریب تأثیر میگذارد. داربستهای PCL با زمان الکتروریسی 30 و 60 دقیقه کاهش وزن بیشتری نسبت به وزن اولیه خود در 12 هفته نشان دادند، اما داربستهای PCL با زمان 90 دقیقه تخریب کندتری داشتند. این کندی به محتوای بالای لاکتیک اسید در PLGA نسبت داده میشود که آن را آبگریزتر و کمتر مستعد تخریب در محلول PBS میکند. نتایج نشان داد که پیوند متقابل در داربستهای الکتروریسی شده خواص مکانیکی آنها را بهبود بخشیده و این خواص با تغییر روشهای تولید قابل تنظیم است. افزایش زمان ریسندگی منجر به تقویت خواص مکانیکی و آبگریزی غشاها شد. بهینهسازی برای افزایش آبدوستی و بلورینگی ضروری است تا از جمعشدگی در محلول PBS جلوگیری شود. این تحقیق مزایای تولید داربستهای با ساختار میکروسکوپی و خواص مناسب برای کاربردهای پزشکی را دارد، اما عدم ارائه دادههای بیولوژیکی و نیاز به تحقیقات بیشتر برای ارزیابی ایمنی از محدودیتهای آن است.
درسال 2023 محسن نوروزی و همکارانش (63)، داربستهای الکتروریسیشدهای تولید کردند که از محلول ۱۰% پلیلاکتیک-کو-گلیکولیک اسید و همچنین ترکیبهایی از PLGA با فیبرین و لیگنین ساخته شدهاند. این ترکیبها به صورت ترکیب محلولهای پلیمری 10% تهیه شدند. نسبتهای مورد استفاده لیگنین :PLGA و فیبرین: PLGA و لیگنین : فیبرین : PLGA به ترتیب ۹:۱، ۸:۲، ۷:۳، ۷:۲:۱، ۶:۲:۲ و ۵:۲:۳ بودند. همه داربستها دارای ساختار نانومقیاس یکنواخت بودند و قطر الیاف آنها بین 0/1 تا 2/5 میکرومتر متغیر بود، که بزرگترین قطر الیاف مربوط به داربستهای لیگنین/ PLGA بود. افزایش نسبت لیگنین در ترکیب باعث کاهش قطر الیاف و تغییر رنگ آنها به قهوهای شد (شکل 7-الف). همچنین، فیبرین آبگریزی داربستها را بهبود بخشید و ترکیب فیبرین، لیگنین یا فیبرین/ لیگنین ظرفیت جذب داربستها را تا 92% افزایش داد. از روز ۴۵ به بعد، داربستهای حاوی فیبرین شروع به تجزیه سریعتری کردند. در روز ۹۰، داربست 30% لیگنین / 20% فیبرین / PLGA بالاترین نسبت تجزیه (۸۲%) را نشان داد، در حالیکه داربست 10% لیگنین / PLGA کمترین نسبت تجزیه (51/4%) را داشت. همه داربستها درصد تخلخل بالای ۷۸% داشتند و افزایش فیبرین و کاهش لیگنین موجب افزایش تخلخل آنها شد. در زمینه سختی و استحکام کششی، داربست خالص PLGA بالاترین سختی و داربست ۱۰% لیگنین/ PLGA بالاترین استحکام کششی را داشتند. افزودن این ترکیبات طبیعی به تدریج استحکام کششی و کرنش شکست داربستها را کاهش داد. نتایج آزمایش MTT نشاندهنده جذب بالاتر در طول روزهای ۳ تا ۷ برای داربستهای PLGA، 10% فیبرین / PLGA و هر سه نوع لیگنین / PLGA بود. در روز 7، داربست 10% فیبرین/ PLGA بالاترین زندهمانی سلولی را نشان داد. تصاویر میکروسکوپ الکترونی وجود سلولهای بنیادی با شکلهای دوکی را نشان داد که بهخوبی به همه داربستها متصل شده و تکثیر یافتند (شکل 7-ب). در نهایت، از میان داربستها 10% لیگنین/ 20% فیبرین/ PLGA بهعنوان گزینه برتر انتخاب شد که ویژگیهای فیزیکی عالی و پاسخهای بیولوژیکی فعالی را به دلیل سیگنالهای فیزیکی-مکانیکی و ویژگیهای پیشرفته لیگنین ارائه میدهد. این ویژگیها آن را برای کاربردهای مهندسی بافت، پانسمان زخم، تحویل دارو و سایر کاربردهای زیستپزشکی مناسب میسازد. در سال 2023 آلدو گوزمان- سوریا و همکارانش (64)، داربستی با الیاف (PLGA) و کلاژن با استفاده از روش الکتروریسی تولید کردند و سپس از نظر چسبندگی و زندهمانی سلولهای سرطانی گردن رحم انسانی (HeLa) و فیبروبلاستهای NIH-3T3 برای کاربردهای بالقوه در بازسازی بافت ارزیابی کردند. همچنین، آزادسازی کلاژن در فیبروبلاستهای NIH-3T3 مورد بررسی قرار گرفت. مورفولوژی الیاف کلاژن/PLGA با استفاده از تصاویر SEM بررسی شد و نشان داده شد که قطر الیاف تا 0/6 میکرومتر کاهش یافت. تحلیل آزمونهای حرارتی و طیفسنجی تبدیل فوریه مادون قرمز (FTIR) نشان دادند که هم فرآیند الکتروریسی و هم ترکیب با PLGA به ثبات ساختاری کلاژن کمک میکنند. افزودن کلاژن به ماتریس PLGA باعث افزایش سختی مواد شد، بهطوری که مدول الاستیک ۳۸% و استحکام کششی ۷۰% نسبت به PLGA خالص افزایش یافت. در نهایت نشان داده شد الیاف PLGA و کلاژن / PLGA محیط مناسبی برای چسبندگی و رشد خطوط سلولی HeLa و NIH-3T3 فراهم کردند و تصاویر میکروسکوپ الکترونی نشان داد که سلولهای HeLa که شکل چندضلعی دارند و سلولهای NIH-3T3 که شکل کشیدهای دارند، بر روی هیدروژل کلاژن و الیاف داربست پخش شدهاند. این موضوع نشان میدهد که این سلولها به خوبی به سطح داربست چسبیدهاند (شکل 8-الف). در داربست کلاژن/ PLGA، تعداد سلولهای HeLa (3/05 ±31 سلول در هر ۲۰۰ میکرومتر مربع) نسبت به داربست خالص PLGA (54/5 ± 23 سلول) و کنترل هیدروژل کلاژن (3/56 ± 19 سلول) افزایش قابل توجهی داشت (شکل 8-ب). اما تعداد سلولهای NIH-3T3 در همه داربستها تقریباً مشابه بود (حدود 2/38 ± 15 سلول). نتایج نشان داد که ساختار الیافی و متخلخل این داربستها تأثیر مثبتی بر عملکرد زیستی آنها دارد و این مواد میتوانند به عنوان پشتیبانی مناسب برای بازسازی ماتریس خارجسلولی در مهندسی بافت مورد استفاده قرار گیرند. در سال 2023 گیریراج پاندی و همکارانش (65)، از تکنیک الکتروریسی برای طراحی و ساخت داربستهای نانویی قابل جذب زیستی از ترکیب پلی وینیل الکل (PVA)، ژلاتین و پلی (لاکتیک-کو-گلیکولیک اسید) استفاده کردند. این داربستها حاوی ترومبین (TMB) به عنوان عامل هموستاتیک و وانکومایسین (VCM) به عنوان عامل ضدباکتری بودند تا یک پلتفرم چندمنظوره برای کنترل خونریزی، جلوگیری از رشد باکتری و تسریع بهبود زخم ایجاد کنند. با استفاده از میکروسکوپ الکترونی، ویژگیهای ساختاری و قطر نانوالیاف بررسی شد و نتایج نشان داد که قطر نانوالیاف بین ۱۵۰ تا ۳۰۰ نانومتر است (شکل 9-الف). دادههای مربوط به شاخص تورم نشان داد که این نانوالیاف میتوانند مایعات اضافی زخم را به خوبی جذب کنند. اطلاعات مربوط به رهاسازی دارو نشان داد که نانوالیاف رفتار رهاسازی پایدار دارند. نتایج آزمایشها نشان دادند که داربستهای نانوالیافی نه تنها میتوانند باکتریها را از بین ببرند، بلکه همچنین قادر به جلوگیری از تشکیل بیوفیلم هستند. این ویژگی بسیار مهم، بهبود زخمها را تسریع کرده و خطر عفونت را کاهش میدهد. تصاویر SEM نشان داد که در گروه کنترل، باکتری S. aureus یک لایه بیوفیلم یکنواخت روی سطح داربستها تشکیل داده است همچنین پس از ۲۴ ساعت، تعداد باکتریهای موجود بر روی داربستهای نانوالیافی بارگذاری شده با وانکومایسین و ترومبین (VCM-TMB) بهطور قابلتوجهی کمتر بود (شکل 9-ب). در مدل حیوانی، پس از ۱۲ روز، مشاهده شد که داربستهای بارگذاری شده با VCM و TMB باعث تسریع در بهبود زخمها شدند. نتایج پاتولوژی بافتی نیز نشان دادند که در زخمهای درمان شده با این داربستها، تشکیل عروق جدید، بازسازی اپیدرم و کراتینه شدن بیشتر نسبت به گروه کنترل مشاهده شد.
در جدول 2 جمعبندی کلی از 4 مطالعهای که در زمینه داربستهای الکتروریسی شده انجام شده، مشاهده میشود.
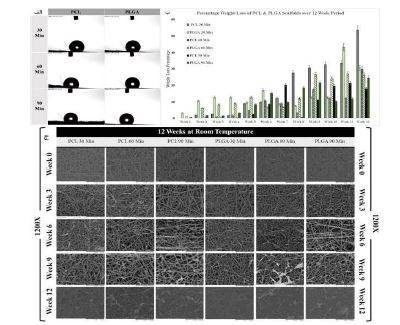
شکل 6- (الف) اندازه گیری زاویه تماس برای بررسی تر شوندگی هر دو داربست PClو PLGA(ب) تخریب و درصد کاهش وزن داربستهای PCL و PLGA طی 12 هفته (ج) تصاویر میکروسکوپ الکترونی روبشی از داربستهای الکتروریسی شده PCL و PLGA در هفتههای 0، 3، 6، 9 و 12 (دوره تخریب)؛ با میله مقیاس 50 میکرومتر (62).
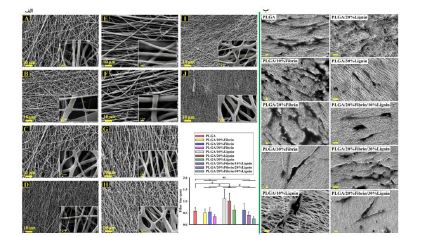
شکل 7-(الف) تصاویر SEM برای داربستهای نانوفیبری؛ (A) PLGA خالص، (B) %10 فیبرین/ PLGA، (C) %20 فیبرین/ PLGA، (D) %30 فیبرین / PLGA، (E) %10 لیگنین / PLGA، (F) %20 لیگنین / PLGA، (G) %30 لیگنین / PLGA، (H) %10 لیگنین/ 20% فیبرین/ PLGA، (I) %20 لیگنین/ %20 فیبرین/ PLGA، (J) 30% لیگنین/ 20% فیبرین/ PLGA (ب) تصاویر SEM از سلولهای h-ADSC که بر روی داربستهای نانوفیبری کشت داده شدهاند (63).
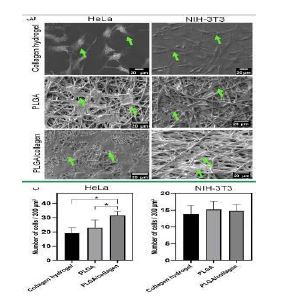
شکل 8-(الف) تصاویر SEM از سلولهای HeLa و NIH 3T3 که به مدت 48 ساعت به هیدروژل کلاژن، داربستهای PLGA، و داربست های کلاژنPLGA/ متصل شدهاند (پیکانها حضور سلولها بر روی داربستها را نشان میدهند). (ب) تعداد سلولهای HeLa و NIH 3T3 که به داربستها متصل شدهاند (64).

شکل 9-(الف) تصاویر SEM از نانوالیافهای دارونما (placebo)، بارگیری شده با VCM، بارگیری شده با VCM (0/5 %) و TMB، و بارگیری شده با VCM (1 %) و TMB، همراه با قطر مربوط به هر یک بهصورت نانومتر (nm). (ب) (a) آزمایش تشکیل بیوفیلم از نانوالیافهای VCM (0/5 %) - NF - TMB و VCM (1 %) - NF - TMB بر روی S.aureus پس از 24 ساعت. تصاویر SEM مربوطه از (b) کنترل منفی (-Ve)، (c) کنترل مثبت (+Ve)، (d) نانوالیاف VCM (0/5 %) - NF – TMB، (e) نانوالیاف VCM (1 %) - NF – TMB، (f) نمودار میلهای تشکیل بیوفیلم برای همه گروهها (65).
جدول 2: مقایسه و جمعبندی مقالات در زمینه داربستهای الکتروریسی شده
2.4. داربستهای تهیه شده به روش چاپگر سه بعدی
در دهههای اخیر، تولید افزایشی یا چاپ سهبعدی بهطور فزایندهای در مهندسی بافت و پزشکی ترمیمی بهکار رفته است. این روش به دلیل دقت بالا، سرعت نمونهسازی و قابلیت طراحی ساختارهای متنوع، مزایای زیادی دارد. تکنیکهای مختلفی مانند استریولیتوگرافی (Stereolithography)، بیوپرینتینگ جوهرافشان (Inkjet Bioprinting) و بیوپرینتینگ مبتنی بر اکستروژن(Extrusion-based Bioprinting) توسعه یافتهاند که هر کدام ویژگیهای خاص خود را دارند. بیوپرینتینگ مبتنی بر اکستروژن به دلیل توانایی چاپ مواد مختلف، به یکی از پرکاربردترین روشها تبدیل شده است. ترکیب این روش با تکنیکهای مختلف تصویربرداری بالینی امکان تولید مدلهای سهبعدی دقیقی از پیوندهای استخوانی را فراهم میکند. باتوجه به مزیت های پلیمر PLGA که در بخش مقدمه ذکر شد و همچنین دمای ذوب مناسب و استحکام مذاب خوب این پلیمر، گزینه مناسبی برای تهیه داربست به روش چاپ سهبعدی هست. در سال 2021 جوانا بابیلوتیا و همکارانش (66)، یک ماده کامپوزیتی PLGA-HA برای ساخت داربستهای چاپ سه بعدی برای مهندسی بافت استخوان تهیه کردند، هدف این تحقیق سنتز و شناسایی یک بیوماده مرکب شامل PLGA به همراه ۵% یا10% (وزنی) نانوذرات هیدروکسی آپاتایت (nHA) بود که برای ساخت داربستهای چاپ سهبعدی در مهندسی بافت استخوان طراحی شده است. در ابتدا، کیفیت چاپ با استفاده از PLGA و ترکیبات PLGA-HA ۵% و 10% ارزیابی شد. سپس، مواد با تکنیکهای مختلف شناسایی فیزیکی مورد بررسی قرار گرفتند. تخریب شیمیایی پلیمر در مراحل مختلف تولید بررسی شد. همچنین، تخریبپذیری بیولوژیکی داربستها در شرایط آزمایشگاهی ارزیابی شد که تغییرات در ویژگیهای مورفولوژیکی و فیزیکی و شیمیایی را نشان داد. سازگاری زیستی این مواد نیز در شرایط آزمایشگاهی و زنده مورد بررسی قرار گرفت و دو نوع سلول، شامل سلولهای استرومای مغز استخوان انسانی (hBMSCs) و سلولهای بنیادی مشتق از چربی انسانی (hADSCs) برای این آزمایشها استفاده شدند. آزمایشهای اولیه برای ارزیابی تمایز سلولی انجام شد تا امکان کاربردهای آینده این ماده مرکب در پیوند استخوان تأیید شود. این مطالعه به بررسی تأثیر شکلدهی فیلامنت و چاپ سهبعدی با استفاده از مدلسازی ذوبی (FDM) بر وزن مولکولی (Mw) و شاخص توزیع پراکندگی پلیمر (PDI)، پلی(لاکتیک-کو-گلایکولیک اسید) حاوی نانو-هیدروکسیآپاتیت میپردازد. نتایج نشان میدهد که شکلدهی PLGA به فیلامنتها منجر به کاهش تغییرات Mw شده است و تفاوت قابلتوجهی در Mw و PDI بین مواد بارگذاری شده و غیر بارگذاری شده وجود دارد. فرآیند چاپ تأثیر چندانی بر Mw و PDI نداشته، اما کاهش PDI پس از چاپ برای PLGA مشاهده شده است (شکل 10-الف). همچنین، تحلیل حرارتی (TGA) برای ارزیابی بارگذاری nHA پس از شکلدهی فیلامنت استفاده شده که نشان میدهد تخریب PLGA در دمای ℃300 تا ℃400 انجام میشود و افزودن nHA باعث افزایش دماهای تخریب به میزان ℃21/6 برای nHA 5% و ℃18/9 برای nHA 10% میشود که نشاندهنده وجود تعاملات شیمیایی بین PLGA و ذرات nHA است (شکل 10-ب). آزمایشهای کششی نشاندهنده عدم تغییر معنادار در مقاومت کششی بین مواد خالص PLGA و بارگذاری شده با nHA است، اما نمونههایی که دارای nHA10% بودند، نسبت به نمونههای با nHA 5%، مقاومت کششی کمتری نشان دادند و در این حالت مقاومت کششی از 0/7 مگاپاسکال به 0/4 مگاپاسکال کاهش یافتند، لازم به ذکر است زنده ماندن سلولی و فعالیت متابولیکی پایدار در دو نوع داربست از هفته اول تا سوم کشت سلولی مشاهده شد. تکثیر سلولی بالا و زنده ماندن سلولی نیز در این مدت به خوبی ثبت گردید. این نتایج نشاندهنده شرایط مطلوب برای رشد و توسعه سلولها در محیط کشت است (شکل 10-ج)، همچنین در این مطالعه فعالیت آنزیم آلکالین فسفاتاز (ALP) به عنوان نشانگر اولیه تمایز استئوبلاستی در دو نوع سلول بررسی شد. نتایج نشان داد که داربستهای (PLGA-HA 10%) نسبت به PLGA، رنگآمیزی شدیدتری را در هر دو نوع سلول ایجاد کردند. افزودن محیط استخوان زا (Osteoinductive) نیز فعالیت ALP را افزایش داد. برای ارزیابی رسوب کلسیم، از رنگ آلیزارین قرمز استفاده شد که پس از 21 روز، نتایج قابلتوجهی را نشان داد. داربستهای حاوی نانوهیدروکسی آپاتایت و محیط استخوان زا، معدنی شدن بیشتری را در هر دو نوع سلول ایجاد کردند. به طور خاص، داربستهای (PLGA-HA 10%) منجر به رسوب کلسیم بیشتری در سلولهای بنیادی مشتق از بافت چربی انسانی شدند، در حالیکه تفاوت معناداری در سلولهای بنیادی مشتق از مغز استخوان انسانی مشاهده نشد (شکل 10-د). در این تحقیق، داربستهای سهبعدی از ترکیب PLGA و HA با استفاده از روش FDM طراحی و ساخته شدند. این بیومواد به خوبی قابل چاپ بوده و هیچ تخریب شیمیایی معناداری در فرآیند تولید ایجاد نشده است. افزودن نانوهیدروکسی آپاتایت (nHA) تأثیر مثبتی بر تمایز استخوانی دارد و واکنش التهابی محدودی پس از کاشت زیرپوستی در موشها مشاهده شد. این تحقیق نشاندهنده پتانسیل بالای مواد ترکیبی PLGA-HA در ترمیم بافت استخوان است، اما نیاز به بررسی جامع خواص مکانیکی و تخریب زیستی طولانیمدت برای کاربردهای بالینی وجود دارد.
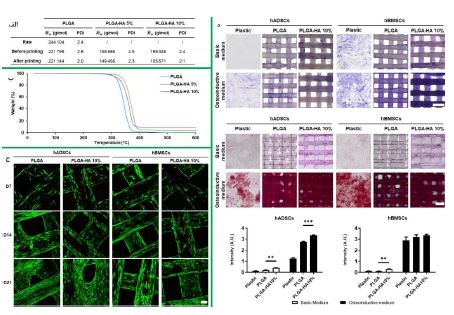
شکل 10: (الف) خصوصیات فیزیکوشیمیایی نمونههای PLGA-HA 10%، PLGA-HA 5% و PLGA قبل و بعد از چاپ. (ب) آزمون تحلیل حرارتی (TGA) با نرخ حرارتی ℃10 بر دقیقه برای هر سه نمونه. (ج) بررسی زنده ماندن و فعالیت سلولی در شرایط مختلف کشت پس از 7و14و21 روز کشت با اسفاده از میکروسکوپ فلورسنت. (د) ارزیابی پتانسیل تمایز استخوانی بر روی داربستها پس از 14و21 روز کشت سلولی و تعیین کمیت معدنی سازی داربستها (66).
در سال 2021 ماریون گرادول و همکارانش (67) به مطالعه پتانسیل پلیمرهای زیستجذبپذیر، بهویژه PLGA، در کاربردهای مهندسی بافت پرداختند، با وجود اینکه تعداد دستگاههای پزشکی چاپگر سهبعدی زیستجذبپذیر در بازار محدود است اما این تحقیق به بررسی قابلیت پردازش PLGA با درجه پزشکی از طریق دو فناوری ساخت افزایشی: تولید فیلامنت ذوب شده (FFF) و چاپ گرانول مستقیم (DPP) پرداخت تا مشخص شود کدام روش کمترین آسیب را به PLGA وارد میکند. در FFFفیلامنت به داخل نازل هدایت میشود و در دمای بالا (معمولاً بین ℃180 تا ℃220) ذوب میشود. دما باید به گونهای تنظیم شود که پلیمر به حالت مایع درآید اما از تجزیه یا تخریب آن جلوگیری شود. پس از ذوب شدن، پلیمر مایع از نازل خارج میشود و بر روی بستر چاپ قرار میگیرد. این فرآیند بهصورت لایه به لایه انجام میشود تا شکل نهایی ساخته شود. هر لایه پس از قرارگیری، به سرعت سرد شده و سخت میشود. در روش DDP به جای فیلامنت، گرانولهای پلیمر مانند PLGA مورد استفاده قرار میگیرند. این گرانولها معمولاً دارای اندازه و شکل یکنواخت هستند که باعث یکنواختی در فرآیند چاپ میشود. گرانولها به داخل یک اکسترودر (Extruder) تغذیه میشوند که در آنها تحت دما و فشار مناسب (معمولاً بین ℃160 تا ℃200) ذوب میشوند. این فرآیند معمولاً در دماهای پایینتری نسبت به FFF انجام میشود که احتمال آسیب به PLGA را کاهش میدهد.پس از ذوب شدن، پلیمر مایع از نازل خارج شده و بر روی بستر چاپ قرار میگیرد، مشابه با روش FFF این مرحله نیز به صورت لایه به لایه انجام میشود. این نتایج نشان داد که چاپ سه بعدی PLGA با استفاده از چاپگر DPP بهطور قابلتوجهی وزن مولکولی میانگین عددی (Mn) را تا 26% کاهش داد، در حالی که کاهش وزن مولکولی در روش FFF برابر با 19% بود. از میان تمام روشهای استریلسازی آزمایششده، اتیلن اکساید بهعنوان مناسبترین روش شناخته شد، زیرا تغییرات معناداری در خواص PLGA ایجاد نکرد. بر اساس مشاهدات، توصیه میشود که از چاپ FFF و استریلسازی با اتیلن اکساید برای تولید دستگاههای پزشکی PLGA استفاده شود. نمونههای PLGA بهطور متوالی از روشهای (DDP) و (FFF) چاپ شدند. با این حال، به دلیل رفتار ذوب PLGA در فرآیند اکستروژنDPP ، دستیابی به تکرارپذیری نسبت به فرآیند معمولی FFF دشوارتر بود. برای بررسی تکرارپذیری این دو روش تولید افزایشی، پنج دیسک دایرهای PLGA بهطور متوالی چاپ و وزن مولکولی آنها مورد ارزیابی قرار گرفت (شکل 11-الف). تحلیل وزن مولکولی برای هر نمونه در سه نقطه مختلف انجام شد و دادهها بهصورت میانگین و انحراف معیار ارائه گردید و مشخص شد که وزن مولکولی نهایی PLGA برای نمونههای چاپشده با DPP کمتر از نمونههای FFF است. آزمون میکروبیولوژیکی نشان داد که نمونهها بهطور مؤثر با استفاده از تابش گاما، تابش بتا و اتیلن اکسید استریل شدهاند، زیرا پس از ۴۸ ساعت هیچ کدری در محیط مشاهده نشد. نمونههای PLGA که با این روشها استریل شده بودند، با نمونههای غیر استریل از نظر وزن مولکولی مقایسه شدند. پس از استریلسازی، تمام نمونههای تابش گاما و بتا تغییراتی در وزن مولکولی اولیه خود نشان دادند. اما استریلسازی با اتیلن اکسید تأثیر قابل توجهی بر وزن مولکولی نداشت. به طور کلی، استریلسازی با تابش بتا تأثیر کمتری بر وزن مولکولی نسبت به تابش گاما داشت (شکل 11-ب).
این تحقیق بر شناسایی بهترین روش تولید افزودنی ذوب و فرآیند استریلسازی برای کاهش تخریب PLGA متمرکز است. نتایج نشان میدهد که فرآیند DDP منجر به تخریب شدید پلیمر میشود و تابش بتا و گاما نیز به سازه PLGA آسیب میزند. استریلسازی با اتیلن اکساید نیز ممکن است بر یکپارچگی مولکولی PLGA تأثیر منفی بگذارد. پیشنهاد میشود از روش سنتی ساخت فیلامنت ذوبشده و استریلسازی با اتیلن اکساید برای تولید دستگاههای پزشکی PLGA استفاده شود، در حالی که DDP گزینهای مناسب برای پلیاسترهای با پایداری حرارتی بیشتر مانند PCL است. FFF به عنوان روشی با تخریب کمتر شناخته میشود که خواص مطلوبتری برای کاربردهای پزشکی فراهم میکند. همچنین، نیاز به بررسی هزینههای تولید و تأیید نتایج در شرایط بالینی وجود دارد.
در سال 2022 تائو لیو و همکارانش (68)، برای بهبود خواص مکانیکی و زیستی پلیمر PLGA در مهندسی بافت استخوان از کلسیم سولفات (CaSO4) استفاده کردند. کلسیم سولفات یک ماده مناسب برای ترمیم استخوان است زیرا باعث ایجاد واکنشهای ایمنی در بدن نمیشوند و به طور کلی ایمن و بیخطر محسوب میشوند و با بافتهای اطراف خود به خوبی سازگار است. همچنین، این ماده میتواند به رشد و بازسازی استخوان کمک کند و به تدریج در بدن تجزیه میشود. در این تحقیق، برای رفع مشکلات PLGA در مهندسی بافت استخوان، داربستهای سهبعدی متخلخل PLGA/CaSO4 طراحی و تولید شدند. ابتدا پودرهای PLGA و CaSO4 با نسبتهای مختلف ( 0 ، 10، 20 و 30 درصد وزنی CaSO4 ) در دمای ℃۲۰۰ مخلوط شدند. سپس این مخلوط به چاپگر سهبعدی تزریق شد و داربستها به صورت لایه به لایه بر اساس مدل طراحی شده استخوان چاپ شدند. مشخص شد که داربستهای PLGA کمترین تنش فشاری را دارند، به این معنی که این داربستها در برابر فشار مقاومت کمی از خود نشان میدهند (شکل 12-الف). بررسیها نشان داد که افزودن CaSO4 خواص مکانیکی داربستهای PLGA را بهبود میبخشد و تنش فشاری داربست ها از مقدار 6/95 مگاپاسکال به 20/21 مگاپاسکال افزایش میدهد. تصاویر SEM نشان داد که اندازه ذرات کلسیم سولفات بین 2 تا 20 میکرومتر است و ذرات در حین تولید داربستها به طور یکنواخت در ماتریس داربست توزیع شدهاند و در یکدیگر تجمع نکردهاند (شکل 12-ب). این ویژگی بسیار مهم است زیرا تجمع ذرات میتواند منجر به ایجاد نقاط ضعیف یا عدم یکنواختی در ساختار داربست شود که ممکن است بر روی خواص مکانیکی و زیستی آن تأثیر منفی بگذارد. افزودن CaSO4 باعث بهبود قابل توجهی در مهاجرت و تمایز استخوانی سلولهای بنیادی مزانشیمی خرگوش شد. داربستهایی که ۲۰ درصد وزنی CaSO4 داشتند، بهترین خواص استخوانسازی را نشان دادند (شکل 12-ج). در نتیجه، افزودن کلسیم سولفات به داربستهای PLGA میتواند عملکرد آنها را بهطور قابلتوجهی بهبود بخشد و داربست PLGA/20%CaSO4 بهترین عملکرد کلی را نشان داده است. بنابراین، این نوع داربستها برای کاربردهای مهندسی بافت استخوان امیدوارکننده هستند.

شکل 11- (الف) مقایسه جرم نمونههای PLGA چاپ شده بر روی چاپگر FFF و PAM. (ب) تأثیر روشهای استریلسازی اتیلن اکسید و تابشهای بتا، آلفا و گاما بر ویژگیهای پلیمر PLGA (67).

شکل 12: (الف) عملکرد مکانیکی داربستهای چاپ شده سهبعدی (A) منحنیهای تنش-کرنش (B) تنش فشاری. دادهها بهصورت میانگین ارائه شدهاند. (ب) تصاویر SEM مورفولوژی ذراتCaSO4 . (ج) توانایی استخوانسازی داربستها در شرایط آزمایشگاهی (68).
3.4. داربستهای فومی و متخلخل: در زمینه مهندسی بافت غضروفی، از داربستهای متخلخل، ماتریسهای خارج سلولی و هیدروژلها به منظور تنظیم عملکرد سلولها و تسهیل فرآیند ترمیم بافت جدید بهرهبرداری میشود. داربستهای متخلخل سهبعدی اهمیت زیادی در ایجاد ساختارهای متخلخل مناسب برای فعالیت سلولی دارند. برای تولید این داربستهای متخلخل، روشهای گوناگونی وجود دارد که شامل تفکیک فازی، فومسازی گازی، خشک کردن انجمادی، ریختن حلال/ شستشوی ذرات و تولید افزودنی میشود. این روشها مشکلاتی دارند که شامل باقیمانده حلالهای سمی، ساختارهای بسته منافذ و تشکیل لایههای ناخواسته روی سطح داربستها میشود. تکنیک تولید افزودنی میتواند ساختارهای پیچیدهای از داربستها ایجاد کند، اما هزینه بالایی دارد و محدودیتهایی در مواد مصرفی دارد. علاوه بر کنترل مناسب ساختار منافذ، خواص مکانیکی قوی نیز لازم است تا فضاهای لازم برای تکثیر سلولها و ترشح ماتریس تا زمان ترمیم بافت جدید حفظ شود. هرچند داربستهای مبتنی بر پلیمرهای طبیعی مانند کلاژن و ژلاتین مزایای زیادی از جمله فعالیت زیستی بالا و سازگاری زیستی خوب دارند، اما خواص مکانیکی ضعیفی دارند. یکی از مختصههای فوم که میتواند روی تخلخل تاثیر چشمگیری بگذارد، کشش مذاب (Melt strain) است که به معنای تغییر شکل یا کشش مواد در حالت مذاب است. این پدیده در مواد پلیمری و دیگر مواد ذوب شده بسیار مهم است، زیرا میتواند تأثیر زیادی بر خواص مکانیکی و رفتار سیالاتی آنها داشته باشد. برای مثال زمانی که ماده پلیمری دارای کشش مذاب پایینی باشد، فرایند تشکیل حباب بسیار سخت خواهد شد و حباب ها به سرعت خالی میشوند و نمی توان به یک ساختار فومی و متخلخل دست یافت و از طرفی یکی از پارامترهای مهم برای ایجاد فومهای پایدار، سوسپانسیون هوا در پلیمر است، درنتیجه پلیمر باید دارای کشش سطحی مذاب بالایی داشته باشد همانطور که در بخش قبلی ذکر شد میدانیم پلیمر PLGA دارای استحکام مذاب خوبی است و این پلیمر یکی از برگزیدهها در میان پلیمرها است که دارای کشش سطحی خوبی است ( mN/m 44 - mN/m 42) (69).
در سال 2020 ژیوهوی وانگا و همکارانش (70)، داربستهای هیبریدی سهبعدی متخلخل با ترکیب مش PLGA و اسفنج کلاژن تهیه کردند که برای کنترل ساختار منافذ آنها از ذرات یخ استفاده کردند. ذرات یخ میتوانند به عنوان هستههایی عمل کنند که تشکیل بلورهای جدید یخ را آغاز میکنند. این ذرات یخ و بلورهای جدید یخ میتوانند منجر به ایجاد ساختارهای متخلخل مرتبط شوند، همچنین این ذرات یخ به راحتی با فرآیند خشککردن انجمادی حذف میشوند. با استفاده از ذرات یخ با اندازههای یکنواخت به عنوان الگوهای ایجاد منفذ برای کنترل ساختار کلی منافذ داربستها، میتوان ساختارهای متخلخل همگن و با اتصالات خوب را ایجاد کرد. الگوهای ذرات یخ میتوانند به تشکیل ساختارهای متخلخل باز در سطح داربستها کمک کنند. علاوه بر این، مش PLGA میتواند خواص مکانیکی داربستهای هیبریدی را تقویت کند. این داربستهای هیبریدی برای کشت سه بعدی کندروسیتهای مفصلی گاوی (BACs) استفاده شده و به طور زیرپوستی در موشهای بدون مو کاشته شدند تا تأثیرات مثبت آنها بر مهندسی بافت غضروف تأیید شود. در این مطالعه، یک روش برای تهیه داربستهای هیبریدی از کلاژن و PLGA با استفاده از ذرات یخ و محلول آبی کلاژن معرفی شده است. ابتدا، محلول ۲% وزنی کلاژن با حل کردن کلاژن نوع I در مخلوط اتانول و اسید استیک تهیه شد. سپس، ذرات یخ با پاشیدن آب به نیتروژن مایع تولید و در اندازههای مشخص الک شدند. برای ایجاد ذرات یخ برجسته، صفحات شیشهای با فیلم خاصی در رطوبتساز قرار گرفتند و به دمای ℃80- منتقل شدند. در نهایت، ترکیب ذرات یخ و محلول کلاژن در قالبهای سیلیکونی ریخته شد و پس از فرآیند بلورینگی و خشک کردن، داربستها به شکل شبکهای درآمدند. داربستهای تولید شده بهعنوان IC نامگذاری شدند و برای مقایسه، داربستهای بدون ذرات یخ نیز تهیه شدند که به آنها CC گفته میشود. میکروساختارهای این داربستها با استفاده از میکروسکوپ الکترونی روبشی (SEM) بررسی شد. داربستهای IC دارای حفرههای بزرگ کروی و متصل به یکدیگر در سطح بودند، در حالیکه حفرههای سطحی داربستهای CC به صورت تصادفی شکل گرفته و بیشتر آنها بسته بودند. تصاویر برشهای افقی و عمودی نشاندهنده ساختارهای حفرهای بزرگ و متصل در نواحی داخلی داربستهای IC بود، در حالیکه حفرهها در داربستهای CC نامنظم و تنها بهطور جزئی به هم متصل بودند. استفاده از قالب ذرات یخ برجسته موجب ایجاد حفرههای باز و کروی بر روی سطح داربستهای IC شد، در حالیکه داربستهای CC به دلیل عدم استفاده از این قالب، فاقد چنین ساختارهای متخلخل بودند (شکل 13-الف). مش PLGA نیز در مرکز هر دو نوع داربست مشاهده شد و در این مطالعه برای ایجاد ساختارهای حفرهای باز در هر دو طرف داربستهای IC قرار گرفت تا امکان کشت سلول فراهم شود. تصاویر برش عمودی نشان داد که مش PLGA به خوبی با لایههای اسفنج کلاژن ادغام شده است و تخلخل هر دو نوع داربست بیش از ۹۸% بود که تخلخل بالا و ساختار حفرهای متصل در داربستهای IC برای نفوذ و توزیع سلولها مفید است. پس از یک هفته کشت در آزمایشگاه، ساختارهای سلولی و داربستی به مدت ۸ هفته در زیر پوست ناحیه پشت موشهای بدون مو قرار داده شدند. ظاهر کلی ایمپلنتها نشاندهنده ویژگیهای غضروفی و رنگ سفید براق بود. رنگآمیزی HE نشان داد که در داربستهای IC، سلولها بهطور یکنواخت توزیع شدهاند و ماتریکس خارجسلولی (ECM) به خوبی رسوب کرده است. اما در داربستهای CC، توزیع سلولها ناهمگن بود و بیشتر آنها فقط در سطح قرار داشتند، که باعث ایجاد فضاهای خالی زیادی در قسمتهای داخلی داربست شد. رنگآمیزی با Safranin O نشان داد که ماتریکسهای غضروفی در داربستهای IC بهطور یکنواختتری شکل گرفتهاند. همچنین، رنگآمیزی ایمونو هیستوشیمیایی (IHC) برای کلاژن نوع II نشان داد که داربستهای IC رشد یکنواختتری از کلاژن نوع II را نسبت به داربستهای CC تسهیل کردهاند. در داربستهای CC، توزیع کلاژن نوع II ناهمگن بود و برخی فضاهای خالی در آنها وجود داشت. این نتایج نشان میدهد که ساختار حفرهای باز و متصل در داربستهای IC نه تنها توزیع یکنواخت سلولها را بهبود میبخشد، بلکه رشد یکنواخت سلولها و رسوب ماتریکسهای غضروفی را نیز تسهیل میکند. این ساختار حفرهای متصل میتواند نفوذ و حرکت سلولها را در سراسر داربست افزایش دهد و در نتیجه به بازسازی بهتر بافت نسبت به داربستهای CC منجر شود (شکل 13-ب). در این مطالعه، داربستهای هیبریدی کلاژن - PLGA با ترکیب مش PLGA و لایههای اسفنجی کلاژن ساخته شدند. این داربستها دارای حفرههای باز و متصل هستند که به توزیع یکنواخت سلولهای غضروفی و ماتریکسهای غضروفی کمک میکند و به رشد سلولها و بازسازی بافت مشابه غضروف با خواص مکانیکی بالا منجر میشود. نتایج نشان میدهند که این داربستها شرایط مناسبی برای ترشح ماتریکس خارجسلولی فراهم میکنند. با این حال، تحقیقات بیشتری برای ارزیابی اثرات بلندمدت و سازگاری زیستی این داربستها در شرایط واقعی ضروری است. مقایسه آنها با سایر روشها نیز میتواند به بهینهسازی طراحی کمک کند.
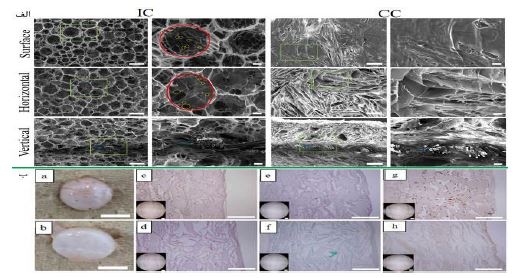
شکل13: (الف) تصاویر SEM شامل سطوح و مقاطع افقی و عمودی داربستهای IC و CC هستند. در این تصاویر، ستونهای سمت چپ با بزرگنمایی کم و ستونهای سمت راست با بزرگنمایی بالا نمایش داده شدهاند. همچنین، مربعهای سبز، پیکانهای آبی، دایرههای قرمز و دایرههای زرد به ترتیب نمایانگر مناطق بزرگنمایی، مش PLGA، منافذ کروی بزرگ و منافذ به هم پیوسته میباشند. (ب) تصاویر مربوط به ظاهر ناخالص (a,b)، رنگآمیزی با روش HE (c,d)، رنگآمیزی با Safranin O (e, f) ، و رنگآمیزی (IHC) برای شناسایی کلاژن نوع II(g,h) از ایمپلنتها پس از ۸ هفته از زمان کشت (70).
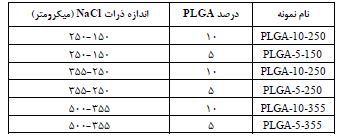
در سال 2021 یان زی و همکارانش (71)، به بررسی داربستهای کلاژنی با ساختارهای متخلخل و به هم پیوسته پرداختند. آنها از اسفنجهای (PLGA) به عنوان الگوهای موقتی استفاده کردند تا بتوانند اتصالپذیری داربستهای کلاژنی را به دقت کنترل کنند. این ساختارهای متخلخل در داربستها نقش مهمی در کنترل عملکرد سلولها در مهندسی بافت غضروف دارند. آنها شش نوع اسفنج PLGA با اندازههای مختلف حفره و تخلخل تولید کردند که این کار از طریق روش ریختن حلال و حذف ذرات انجام شد تا اتصالپذیری داربستهای کلاژنی تنظیم شود. بعد از حذف الگوهای PLGA ، یک شبکه متصل در سرتاسر داربستهای کلاژنی شکل گرفت. سپس، کندروسیتهای مفصلی گاوی در این داربستها کشت داده شدند تا تأثیر ساختارهای حفرهای بر توزیع سلول، تکثیر سلولی، ترشح ماتریس و بازسازی بافت غضروفی بررسی شود. نتایج نشان میدهد که طراحی مناسب این ساختارهای متخلخل میتواند به بهبود عملکرد سلولی و ترمیم بافت کمک کند. شش نوع الگوی PLGA با نسبتهای مختلف PLGA و NaCl و اندازههای متفاوت ذرات NaCl تهیه شدند. ترکیبهای خاص و نامگذاریهای مربوط به آنها در جدول 3 آمده است. در این مطالعه، پس از یک روز کشت، میزان زندهمانی و توزیع کندروسیتها در داربستهای کلاژنی الگوگیری شده با PLGA ارزیابی شد. رنگآمیزی زنده/ مرده نشان داد که تقریباً تمام کندروسیتها زنده بودند. رنگآمیزی DAPI توزیع سلولها را در مقاطع داربستها نشان داد؛ در داربستهای کنترل، سلولها بهطور متراکم بر روی سطح توزیع شده بودند، در حالی که در داربستهای PLGA، توزیع سلولها یکنواختتر بود. حفرههای تیره در نواحی مرکزی نشاندهنده حفرههای داربست و اتصال خوب آنها به نفوذ و توزیع یکنواخت سلولها کمک کرد. در میان تمامی داربستهای کلاژنی، داربستهای کلاژنی الگوگیری شده با اسفنج PLGA که با 10% وزنی PLGA و ذرات نمک بزرگ ساخته شده بودند، بیشترین یکنواختی در توزیع سلولها را نشان دادند. این یکنواختی احتمالاً به دلیل وجود حفرههای بزرگ و به هم پیوسته در این داربستها است. مشاهدات میکروسکوپ الکترونی نشان داد که سلولها به داربستها چسبیده و ساختار حفرهای آنها پس از یک روز کشت تغییر نکرده است. نتایج آزمون فشاری نشان داد که سازههای سلول/داربست ساخته شده از داربستهای کلاژنی الگوگیری شده با PLGA دارای مدول یانگ بالاتری نسبت به سازههای شاهد هستند. همچنین، سازههای Col-10-250 و Col-10-355 مدول یانگ بالاتری نسبت به Col-5-150 داشتند. بهطور کلی، بافتهایی که در داربستهای Col-10-150، Col-10-250 و Col-10- 355 تشکیل شدند، دارای مدول فشاری بالاتری نسبت به سایر داربستها، بهویژه داربست شاهد کلاژنی بودند. داربستهای کلاژنی با اتصالپذیری بالا با استفاده از الگوهای موقتی اسفنجی PLGA تهیه شدند. ساختار حفرهای این داربستها با کنترل تخلخل و اندازه حفرههای اسفنجی PLGA تنظیم شد. این داربستها، بهویژه نمونه Col-10-355، دارای اتصالپذیری بالا و کانالهای بزرگ در سرتاسر خود بودند. کندروسیتها بهطور یکنواخت در این داربستها چسبیده و توزیع شدند و نرخ تکثیر بالایی را نشان دادند، همچنین بیان بالایی از ژنهای غضروفی و ترشح ماتریس خارجسلولی غضروفی داشتند. داربستهای کلاژنی، بهخصوص Col-10-355، تشکیل بافت یکنواختی را با استحکام فشاری بالا تسهیل کردند. استفاده از اسفنجهای PLGA به عنوان الگوهای موقتی میتواند داربستهای متصل با حفرههای مناسب برای مهندسی بافت غضروف تولید کند و فعالیتهای سلولی ضروری را تقویت کند. این مطالعه به بررسی ساخت داربستهای کلاژنی با ساختار حفرهای متصل پرداخته است که با استفاده از الگوهای موقتی اسفنجی PLGA تهیه شدهاند. این تحقیق نشان میدهد که داربستهای تولیدشده میتوانند بهخوبی توزیع سلولها را تسهیل کرده و به رشد بافت غضروف کمک کنند. با این حال، مقاله میتواند در زمینههای مختلفی بهبود یابد، به عنوان مثال، عدم بررسی اثرات بلندمدت این داربستها بر روی بافتهای زنده یک نقطه ضعف محسوب میشود. همچنین، تحلیل دقیقتری از مکانیزمهای مولکولی و بیوشیمیایی تاثیرگذار بر فعالیتهای سلولی میتواند به درک بهتر عملکرد این داربستها کمک کند. در سال 2023، موذن حسن و همکارانش (72) در یک تحقیق، یک داربست کامپوزیتی منحصر به فرد تولید کردند که شامل نانو هیدروکسی آپاتایت آغشته شده با استرانسیوم و روی (Sr/Zn) و (PLGA) بود. این داربستها با استفاده از روش رسوب شیمیایی ساخته شدند و نسبتهای مختلفی از یونهای Sr/Zn (1%، 2/5% و 4%) داشتند. ابتدا، محلولهای حاوی دیآمونیوم فسفات و نیترات کلسیم تهیه میشود و محلول حاوی فسفات به آرامی به محلول کلسیم اضافه میشود. پس از هم زدن و نگهداری برای یک شب، رسوب حاصل فیلتر و شسته و در نهایت خشک و کلسینه میشود. در مرحله بعد، ترکیب Zn/Sr nHAp به محلول PLGA/DCM اضافه شده و پس از هم زدن و تبخیر حلال، مخلوط شسته و خشک میشود. این فرآیندها منجر به تولید هیدروکسی آپاتیت نانوکریستالی و ترکیبهای با خواص زیستسازگاری مناسب برای کاربردهای پزشکی میشود. فعالیت ضدباکتریایی این داربستها در برابر باکتری استافیلوکوکوس اورئوس (Staphylococcus aureus) با شمارش واحدهای تشکیل کلونی (CFU) پس از تماس مستقیم ارزیابی شد (شکل 14-الف). نتایج نشان داد که افزایش غلظت Zn2+ منجر به کاهش تعداد CFU بهصورت وابسته به دوز میشود و داربستها حاوی 4% یون روی بهترین خواص ضدباکتریایی را نشان داد. آزمون زندهمانی سلولی MTT نشان داد که آغشته شدن با Sr/Zn از تکثیر سلولهای استئوبلاست حمایت میکند بدون اینکه سمی باشد و بالاترین درصد آغشتگی در (4% Sr/Zn-nHAp-PLGA) برای رشد سلولها ایدهآل بود. این مطالعه همچنین به بررسی تأثیرات ضدباکتریایی (nHAp) دوپ شده با یون روی و استرانسیوم میپردازد. نتایج نشان میدهد که داربستهای حاوی Zn2+ بهطور قابلتوجهی تعداد باکتریها را کاهش میدهند و بالاترین درصد مهار رشد باکتری (بین 98/6% تا 99/7%) در غلظت 4% Zn مشاهده میشود. همچنین، افزودن PLGA به داربستها تأثیری بر فعالیت ضدباکتریایی Zn2+نداشت. آزمون MTT برای ارزیابی تکثیر سلولهای استئوبلاست در انواع مختلف داربستها و بررسی سازگاری سلولی آنها انجام شد (شکل 14-ب). تحقیقات قبلی نشان دادهاند که (nHAp) با سلولها سازگار است و تأثیر مثبتی بر رشد و تمایز استئوبلاستها دارد. در این مطالعه، nHAp به عنوان کنترل برای بررسی اثر آغشتگی با (Sr) و(Zn) استفاده شد. نتایج نشان داد که در روز دوم، تعداد سلولهای فعال متابولیکی در داربست های nHAp و nHAp-PLGA کمتر از داربستهای حاوی یونهای Sr و Zn بود، هرچند این تفاوت از نظر آماری معنیدار نبود. غلظت 4% یونهای Sr/Zn توانست زندهمانی سلولها را به مدت یک هفته حفظ کند و بالاترین تعداد سلولهای زنده را ارائه دهد. این نتایج نشان میدهد که داربستهای(4% Sr/Zn-nHAp-PLGA) برای افزایش تکثیر و زندهمانی سلولها مناسب هستند. این مطالعه به بررسی داربستهای کامپوزیتی جدید برای مهندسی بافت استخوان میپردازد که دارای فعالیت ضدباکتریایی و پتانسیل استخوانسازی بالایی هستند. این داربستها با آغشته شدن یونهای استرانسیوم و روی بهبود یافتهاند، اما عدم فعالیت ضدباکتریایی استرانسیوم و تأثیر منفی PLGA بر روی فعالیت ضدباکتریایی روی از معایب آنها به شمار میرود. برای بهینهسازی عملکرد، پیشنهاد میشود نسبت آغشتگی عناصر مورد بررسی قرار گیرد و تحقیقات بالینی برای ارزیابی ایمنی و کارایی این داربستها انجام شود. به طور کلی، این تحقیق نشاندهنده پیشرفتهای امیدوارکنندهای در مهندسی بافت استخوان است، اما نیاز به تحقیقات بیشتری برای تأیید کاربردهای بالینی آن دارد.
جدول 3: ترکیبهای خاص و نامگذاریهای مربوط به آنها.
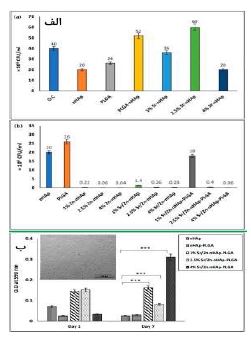
شکل 14: (الف)شمارش واحدهای تشکیل کلونی پس از 24 ساعت کشت با داربستهای مختلف. (ب) سنجش MTT برای استئوبلاستهای کشت شده به مدت 2 و 7 روز بر روی داربستهای مختلف و سلولهای استخوانی RObکشتشده با شکل خاص ستارهای تا میلهای خود که با پیکان قرمز نشان داده شدهاند (72).
4.4. میکرو و نانوذرات کروی: میکروکرهها به عنوان یک وسیله انتقال ایده آل اغلب برای محصور کردن عوامل بیوشیمیایی برای القای تشکیل استخوان مورد استفاده قرار میگیرند. با توجه به رفتار تخریب سریع PLGA، بارگذاری میکروکرههای PLGA در داربستها نیز میتواند برای تخلخل استفاده شود، بنابراین سرعت تخریب کلی داربست بهبود مییابد و باعث ترمیم استخوانی و عروق میشود. در سال2021 فو ژن یوان و همکارانش (73) میکروکرههای حساس به ماورای صوت (MPs) را از پلی (لاکتاید-کو-گلایکولیک اسید) حاوی کارتوژنین (KGN) تولید کردند و سپس آنها را تحت تأثیر امواج فراصوت قرار دادند. در این تحقیق، هیدروژلهای کندرویتین سولفات با کربوکسیمتیل کیتوسان (CMC-OCS) برای ساخت داربستهای ترکیبی استفاده شد. تهیه میکروذرههای PLGA حاوی کارتوژنین (KGN) با استفاده از روش امولسیون روغن در آب (O/W) و ترکیب آن با اختلاط اولیه غشایی انجام شده است. ابتدا، PLGA و KGN در حلالی شامل دیکلرومتان و دیمتیل سولفوکسید حل شده و سپس، این محلول به آرامی به یک محلول آبی حاوی پلیوینیلالکل اضافه میشود تا یک امولسیون دوگانه اولیه ایجاد شود. این امولسیون سپس تحت فشار نیتروژن از طریق غشا چندین بار عبور داده میشود. میکروذرهها با استفاده از سانتریفیوژ جمعآوری شده، سه بار با آب مقطر شسته میشوند و سپس به روش انجمادی خشک (Lyophilization) میشوند. این فرآیند منجر به تولید میکروذرههای PLGA حاوی کارتوژنین میشود که برای کاربردهای دارورسانی طراحی شدهاند. ویژگیهایی مانند شکل ظاهری، خواص مکانیکی، تخلخل و سمیت سلولی این داربستها مورد بررسی قرار گرفت. نتایج نشان داد که میکروکرهها پس از تابش امواج فراصوت تغییرات قابل توجهی را تجربه کرده و میتوانند خواص مکانیکی هیدروژل را بهبود دهند. این مطالعه همچنین نشان داد که با برش دو هیدروژل کامل و اتصال دوباره آنها، قابلیت ترمیم هیدروژلهای آسیبدیده بهوضوح قابل مشاهده است (شکل15-الف). رهایش KGN از این میکروکرهها به آرامی انجام میشود و میتواند غلظت آن را برای حداقل 28 روز حفظ کند. آزمایشهای رئولوژیکی نشان داد که مدول ذخیرهسازی و مدول اتلاف در هیدروژلهای CMC-OCS و CMC-OCS@KGN در دامنه کرنش 0/01% تا 5% ثابت باقی ماند، اما با افزایش تغییر شکل، ساختار هیدروژلها آسیب دید. همچنین، نسبت تورم هیدروژل@MPs کمتر از سایر هیدروژلها بود و رفتار رهایش KGN در گروههای مختلف متفاوت بود؛ بهطوری که در گروه CMC-OCS@KGN رهایش ناگهانی بیشتری مشاهده شد (شکل 15-ب). چسبندگی بالای این مواد باعث میشود که اتصال آنها به سرعت انجام گیرد و یکپارچگی محل ترمیم را حتی در برابر کششهای خارجی حفظ کند، همچنین سازگاری داربستها با سلولها از طریق ارزیابی زندهمانی و تکثیر سلولها با استفاده از آزمایش CCK-8 و رنگآمیزی LIVE/DEAD بررسی شد (شکل 15-ج). نتایج نشان داد که نسبت زندهمانی سلولها در تمام گروهها بیش از 90% بود که نشاندهنده سازگاری خوب سلولی برای همه نوع داربستها و استفاده از ماورای صوت است. هیچ تفاوت معناداری بین چهار گروه مشاهده نشد و تکثیر سلولهای بنیادی مزانشیمی مغز استخوان خرگوش (rBMMSCs) روی داربستها نیز با روش CCK-8 بررسی شد. هدف اصلی این تحقیق رهایش کنترلشده دارو است، به طوری که پیشبینی شده هیدروژل دارای ویژگیهای رهایش سریع باشد در حالیکه میکروکرهها رهایش آهستهتری دارند. بهطور کلی، به دلیل بهبود خواص مکانیکی و توانایی رهایش پایدار KGN، این هیدروژل قابل تزریق با خاصیت حساس به ماورای صوت یک سیستم امیدوارکننده برای مهندسی بافت غضروف است. استفاده از میکروکرههای حاوی کارتوژنین و هیدروژلهای قابل تزریق تحت تأثیر امواج فراصوت مزایا و معایبی دارد. یکی از مشکلات، افزایش دما و آسیب به بافتهای اطراف ناشی از این امواج است. همچنین، فشار ناشی از امواج میتواند به ساختارهای داخلی آسیب برساند و فرآیند حفرهسازی ممکن است به سلولها آسیب بزند. کنترل رهایش دارو نیز در برخی موارد دشوار است. بهینهسازی این سیستم نیازمند تحقیقات بیشتر بر روی پارامترهای امواج فراصوت و آزمایشهای بالینی برای ارزیابی ایمنی و اثربخشی آن است. همچنین، ترکیب سایر داروها با هیدروژلها میتواند به افزایش کارایی درمانی کمک کند.
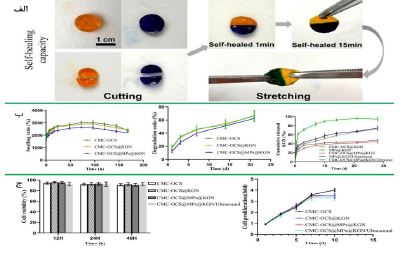
شکل 15: (الف) ظرفیت خود ترمیمی با برش هیدروژل و اتصال مجدد آنها به یکدیگر برای دستیابی به فصل مشترک بهبود یافته. (ب) نسبت تورم و نسبت تخریب سه داربست در زمانهای مختلف ورفتار رهایش تجمعی KGN (ج) سنجش سمیت سلولی و تکثیر سلولی در چهار گروه (73).
5.4. هیدوژلها: هیدروژلها شبکههای ویسکوالاستیک آبدوست هستند که از هموپلیمرها یا کوپلیمرها تشکیل شده و میتوانند به محرکهای محیطی مانند دما و pH پاسخ دهند. این ویژگیها هیدروژلها را برای درمانهای غیرجراحی و کمتهاجمی مناسب میسازد. در سالهای اخیر، هیدروژلهای چندمنظوره برای کاربردهای زیستپزشکی مانند تحویل دارو و مهندسی بافت توسعه یافتهاند. هیدروژلهای مورد استفاده در مهندسی بافت استخوان شامل هیالورونیک اسید، آلژینات و پلی اتیلن گلیکول (PEG) هستند. PLGA به عنوان یک پلیمر زیستی تأیید شده، معمولاً با PEG کوپلیمریزه میشود تا ژلهای حرارتی تشکیل دهد. این بخش بر کاربرد هیدروژلهای مبتنی بر PLGA در مهندسی بافت استخوان تمرکز دارد. بائومینگ یوان و همکارانش در سال 2022 (74) بررسی کردند که آیا پلیمر سه بلوک PLGA-PEG-PLGA حساس به دما میتواند نیازهای درمانی برای استئومیلیت را برآورده کند یا خیر و هچنین بهطور خاص، اثرات مخلوط کردن وانکومایسین، هیدروکسی آپاتایت و پلیمر سهبلوک PLGA-PEG-PLGA حساس به دما در یک محلول آبی بر ویژگیهای هیدروژل حاصل و قابلیت آن در درمان استئومیلیت مورد ارزیابی قرار گرفت. آنها هیدروژل حرارتی وانکومایسین PLGA-PEG-PLGA/ هیدروکسی آپاتایت را با نسبت LA/GA برابر ۱۵:۱ تهیه و مشخصهیابی کردند. ویژگیهای رئولوژیکی، خواص انتقال فاز محلول به ژل و مقدار غلظت بحرانی مایسل ترکیب PLGA-PEG-PLGA/HA تأیید کرد که این سیستم انتقال فاز حرارتی حساس به دما را تجربه میکند. همچنین، HA در ترکیب باعث افزایش مدول ذخیره و بهبود سازگاری سمیت سلولی میشود. مقدار CMC با رسم نسبت شدت فلورسانس و لگاریتم غلظت محاسبه شد. مقدار CMC برای کوپلیمر PLGA-PEG-PLGA حدود 1/75 میلیگرم بر میلیلیتر بود، در حالی که برای ترکیب PLGA-PEG-PLGA/HA این مقدار تقریباً 1/28 میلیگرم بر میلیلیتر بود. CMC کمی پایینتر در ترکیب نشان میدهد که HA تأثیر کمی بر رفتار خودآرایی PLGA-PEG-PLGA دارد و همچنین دمای ژلسازی را هنگام افزودن HA به کوپلیمر کاهش میدهد. تخریب هیدروژل ترکیبی در شرایط آزمایشگاهی شبیهسازی شده نشان داده است که هیدروژلهای پلیمری و ترکیبی پس از 33 روز بیش از 90% تخریب شدند (شکل 16-الف). پس از چهار هفته، میزان عفونت استخوان درشت نی (تیبیا) موشها در دو گروه درمانی کنترل شد و مقداری بهبود در استخوان مشاهده شد. با اینحال، ناحیه نقص استخوان در گروه درمانی وانکومایسینPLGA-PEG-PLGA بزرگتر از گروه وانکومایسین PLGA-PEG-PLGA/HA بود. بعد از ۸ هفته، هیچ نشانهای از عود عفونت استخوان تیبیا وجود نداشت. در هر دو گروه، اندازه نقص استخوان در ۸ هفته کوچکتر از ۴ هفته بعد از عمل بود که نشاندهنده پیشرفت در روند بهبود استخوان است. با اینحال، ناحیه نقص استخوان هنوز در گروه وانکومایسینPLGA-PEG-PLGA/HA کوچکتر از گروه وانکومایسینPLGA-PEG-PLGA بود (شکل 16-ب). نتایج ارزیابی تخریب درون تنی این هیدروژلها نیز نشان داده است که، ژل به تدریج در بافتهای رتها تخریب شده و در هفته پنجم بهطور کامل از بین رفته است، که نشان میدهد نرخ تخریب درونتنی بیشتر از نرخ تخریب در شرایط آزمایشگاهی بود (شکل 16-ج). نتایج هر دو نوع آزمایش تخریبپذیری تأیید کردند که این ترکیب خواص زیستتخریبپذیری خوبی دارد. همچنین، با توجه به زمان تخریب ژل (1 ماه) و زمان ترمیم استخوان (3 ماه)، ژل مانع فیزیکی برای فرآیند ترمیم استخوان نخواهد بود. نتایج رنگآمیزی HE و Masson از نمونههای استخوان در هر گروه را در هفتههای ۴ و ۸ نشان میدهد. در گروه کنترل، تعداد زیادی سلول التهابی به بافت استخوانی نفوذ کردند و در هفته ۸ هیچ بهبودی در پاسخ التهابی مشاهده نشد اما در گروههای حاوی کوپلیمر و ترکیب با وانکومایسین، فقط تعداد کمی سلول التهابی در هفته ۴ دیده شد که نشاندهنده کنترل عفونت است. همچنین، در هفته ۸ هیچ نشانهای از عود عفونت وجود نداشت که نشان میدهد اثر ضدعفونیکننده ترکیب حاوی وانکومایسین خوب بوده است (شکل 16-د). استئومیلیت یک عفونت استخوانی است که درمان آن دشوار است. برای درمان این بیماری، نیاز به کنترل عفونت و حذف بافتهای مرده وجود دارد، اما عوارض جانبی و مقاومت دارویی آنتیبیوتیکهای سیستمیک، استفاده از روشهای تحویل داروی موضعی را ضروری کرده است. سیمان استخوانی بارگذاری شده با آنتیبیوتیک به عنوان روش اصلی درمان شناخته میشود، اما این روش معایب خاص خود را دارد. به همین دلیل، از پلیمر کوپلیمر PLGA-PEG-PLGA با خواص ژلسازی حرارتی به عنوان حامل داروی آزادسازی پایدار استفاده شد. در سال 2020 سید محمد دواچی و همکارانش (75)، در مطالعه خود به درمان سینوزیت مزمن با استفاده از هیدروژلهای حاوی دارو پرداختند. یکی از روشهای مؤثر برای درمان این بیماری، استفاده از هیدروژلهایی است که داروها را به آرامی آزاد میکنند. در ابتدا، میکرو و نانوذراتی از (PLGA) بارگذاری شده با دگزامتازون (DEX) تهیه و مشخصهیابی شدند. تهیه نانوذرات PLGA بارگذاری شده با دگزامتازون با استفاده از روش امولسیون- نفوذ انجام شده است. ابتدا، پلیوینیل الکل در آب حل میشود و سپس دگزامتازون و PLGA در حلالهای مختلف حل شده و به محلول PVA اضافه میشوند. پس از ایجاد امولسیون و حذف حلالها، نانوذرات جدا و شسته میشوند. در نهایت، نانوذرات منجمد و خشک شده و در دمای ℃20- نگهداری میشوند. تهیه میکروذرات PLGA بارگذاری شده با دگزامتازون با استفاده از روش امولسیون روغن در آب و تبخیر حلال انجام میشود. دگزامتازون و PLGA در حلالهای مختلف حل شده و به محلول پلیوینیل الکل اضافه میشوند. مخلوط به مدت 60 دقیقه با همزن مغناطیسی هم زده میشود و سپس حلالها تبخیر میشوند. میکروذرات پس از سانتریفیوژ جدا و شسته شده، منجمد و در دمای ℃20- نگهداری میشوند. اندازه ذرات PLGA بارگذاری شده با دگزامتازون با استفاده از (SEM) بررسی شده است و نشان میدهد که ذرات کرهای و یکنواخت هستند. اندازه متوسط ذرات میکرو و نانو به ترتیب 2/02 میکرومتر و 105 نانومتر است (شکل 17-الف). نتایج نشان داد که نانوذرات دگزامتازون را در مدت 7 روز و میکروذرات آن را در مدت 22 روز آزاد میکنند (شکل 17-ب). به دلیل آزادسازی کندتر، میکروذرات PLGA بارگذاری شده با دگزامتازون برای این مطالعه انتخاب شدند. سپس، هیدروژلهایی بر پایه کیتوسان و پلیوینیلپیرولیدون (PVP) با نسبتهای وزنی مختلف تهیه شد و ساختار میکروذرات PLGA بهینهسازی شد. بررسیها نشان داد که میکروذرات به طور یکنواخت در هیدروژلها پراکنده شدهاند. هیدروژلهای حاصل دارای ویژگیهای مناسبی مانند استحکام مکانیکی خوب، ساختار متخلخل و فعالیت ضدباکتریایی بودند. همچنین، آزمایشها نشان دادند که این هیدروژلها بر روی سلولها اثر منفی ندارند و در هیدروژل با بالاترین محتوای PVP، 80% دارو پس از 30 روز آزاد شد. این هیدروژل به عنوان یک گزینه مناسب برای درمان سینوزیت مزمن و رینیت (Rhinitis) آلرژیک معرفی شده است. در سال 2022 پریسا قندفروشان و همکارانش (76)، به توسعه یک هیدروژل نانوکامپوزیتی برای ترمیم غضروف پرداختند. این هیدروژل از ژلاتین طبیعی و کوپلیمر PLGA-PEG-PLGAتشکیل شده است و با فاکتور رشد تبدیلکننده بتا-1 (TGF-β1) بارگیری شده است. هدف از این کار بهبود چسبندگی، زندهمانی و تمایز سلولی سلولهای بنیادی پالپ دندان انسان (hDPSCs) برای ترمیم غضروف است. از میکروسکوپ الکترونی روبشی برای بررسی اندازه و مورفولوژی ذرات و هیدروژل استفاده شده است. این هیدروژل دارای ساختار متخلخل با ابعاد منافذ حدود 202 میکرومتر است. در 9 روز اول، آزادسازی TGF- β1 از هر دو نانوذرات و هیدروژل به خوبی انجام شد. در انتهای 21 روز، آزادسازی TGF-β1 به ترتیب به 78% و 75% برای نانوذرات PLGA-PEG-PLGA و هیدروژل ژلاتین / PLGA -PEG- PLGA رسید. یکی از مشخصه های مهم هیدروژلها بتوانایی جذب آب میباشد، زیرا بافت غضروف طبیعی حدود 70-85 % وزن خود را آب تشکیل میدهد. جذب آب هیدروژلهای نانوکامپوزیتی در محیط PBS به مدت 120 ساعت بررسی شد. نتایج نشان داد که هیدروژلهای حاوی ژلاتین و PEG به دلیل ماهیت آبدوستی خود، جذب آب بالاتری دارند. افزودن نانوذرات PLGA-PEG- PLGA به هیدروژل ژلاتین باعث کاهش جذب آب شد، زیرا نانوذرات به عنوان پرکننده عمل میکنند و ساختار منافذ را متراکمتر میکنند. تجزیه هیدروژلهای ژلاتین، PLGA-PEG-PLGA و ژلاتین / PLGA-PEG-PLGA به مدت سه هفته در شرایط آزمایشگاهی بررسی شد. نتایج نشان داد که هیدروژلهای نانوکامپوزیتی از دست دادن وزن متوسطی در طول زمان داشتند (شکل 18-الف). بررسی چسبندگی و رشد سلولهای بنیادی پالپ دندان انسان (hDPSCs) بر روی هیدروژل نانوکامپوزیتی نشان داد که h-DPSCs به خوبی به هیدروژل چسبیدهاند و با هم در ارتباط هستند و منافذ هیدروژل نیز با سلولها پر شده است (شکل 18-ب). بهصورت کلی یافتهها نشان داد که هیدروژل نانوکامپوزیتی ژلاتین / PLGA-PEG-PLGA-TGF-β1 چسبندگی، زندهمانی و تمایز غضروفی سلولهای hDPSC را بهبود میبخشد. این هیدروژل میتواند پایهای برای استراتژیهای جدید و مؤثر برای درمان آسیبهای غضروف باشد.
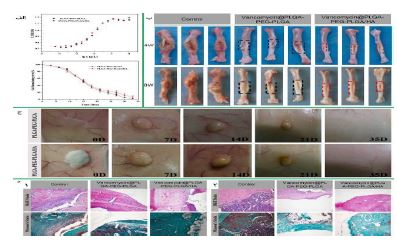
شکل16: (الف) منحنی تغییرات نسبت شدت فلورانس(I338/I336) با غلظت برای دو ترکیب و آزمون تخریب آزمایشگاهی دو ترکیب. (ب) عکسهای بهبود نقص استخوان تیبیا در موش صحرایی پس از 4 هفته و 8 هفته درمان. (ج) آزمون تخریب درونتنی با گذر زمان. (د) نتایج HE و Masson گروههای مختلف پس از 4 هفته و 8 هفته دبریدمان (74).
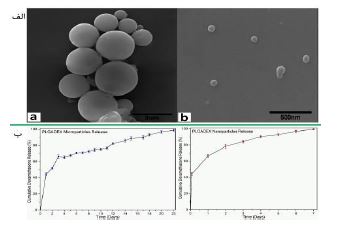
شکل 17: (الف) تصاویر SEM از (a) میکروذرات PLGADEX (b) نانوذرات PLGADEX. (ب) رهایش دگزامتازون در 7/4 PH = و دمای ℃37 برای میکروذرات PLGADEX و نانوذرات PLGADEX (75).
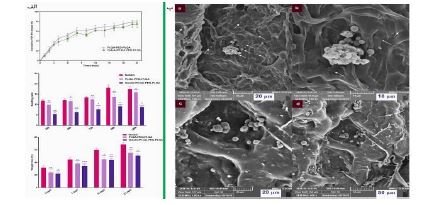
شکل 18: (الف) رهایش TGF-β1 برای نانوذرات PLGA-PEG-PLGA و هیدروژل ژلاتین / PLGA -PEG- PLGA و رفتار تورم داربست ها و تجزیه هیدروژلهای ژلاتین. (ب) تصاویر میکروسکوپ الکترونی روبشی از سلولهای hDPSCs پس از 14روز (a,b) و 18 روز (c,d) کشت روی هیدروژل ژلاتین / PLGA-PEG-PLGA-TGF-β1 (76).
نتیجهگیری
این مقاله به بررسی پتانسیل (پلی لاکتیک-کو-گلایکولیک اسید) در مهندسی بافت استخوان میپردازد و بر ویژگیهای زیستی و قابلیت تنظیم تخریب آن تأکید میکند. PLGA به اشکال مختلفی مانند داربستها، الیاف، هیدروژلها و میکروکرهها تقسیمبندی شده است. این پلیمر به عنوان یکی از مهمترین پلیمرهایزیستی در مهندسی بافت استخوان، به دلیل خواص منحصر به فرد خود، مورد توجه ویژهای قرار دارد. PLGA که از ترکیب دو مونومر لاکتیکاسید و گلایکولیک اسید تشکیل شده است، به دلیل قابلیت تخریبپذیری زیستی و سازگاری با بافتهای انسانی، در زمینههای مختلف پزشکی کاربرد دارد. سنتز PLGA معمولاً به دو روش اصلی انجام میشود: پلیمریزاسیون تراکمی و پلیمریزاسیون حلقه گشا که به دلیل نسبتهای مختلف ترکیبی از لاکتیک اسید و گلایکولیک اسید، این پلیمر خواص مکانیکی متنوعی دارد. این پلیمر میتواند به گونهای طراحی شود که زمان تخریب آن در بدن از چند هفته تا چند سال متغیر باشد. این ویژگی به پژوهشگران اجازه میدهد تا داربستهایی برای ترمیم بافتها ایجاد کنند که به تدریج تخریب شده و جای خود را به بافت جدید بدهند و به دلیل همین قابلیت، استفاده از PLGA در مهندسی بافت و همچنین توانایی آن در تحریک رشد سلولهای استخوانی بسیار مورد توجه قرار گرفته است. این پلیمر میتواند به عنوان داربست برای رشد سلولهای استخوانی عمل کند و با فراهم کردن محیطی مناسب، باعث تسریع فرآیند ترمیم استخوانها شود. علاوه بر این، PLGA میتواند به عنوان حامل داروهای مختلف نیز مورد استفاده قرار گیرد، که این امر به طور خاص در درمان بیماریها و آسیبهای استخوانی اهمیت دارد. با توجه به اینکه PLGA قابلیت کنترل رهایش دارو را دارد، میتواند به عنوان یک سیستم تحویل دارویی مؤثر عمل کند. پلیمر PLGA، علاوه بر مزایای بررسی شده در این مطالعه، دارای نقاط ضعفی نیز میباشد. از جمله معایب این پلیمر میتوان به خشک و شکننده بودن آن اشاره کرد که استفاده از آن را بیشتر در زمینههای مهندسی محدود میکند. با توجه به قیمت بالای این پلیمر، فرآیند تولید و در نتیجه محصولات و تجهیزات حاصل از آن نیز گرانقیمت هستند. پلیمر PLGA به دلیل تخریبپذیر بودن، شرایط نگهداری خاص و سختی دارد و حتی در شرایط مناسب، با گذشت زمان دچار تخریب شده و خواص اولیه خود را از دست میدهد. بنابراین، استفاده از این پلیمر در شرایط بهینه توصیه میشود.دستیابی به وزن مولکولی بسیار بالا در این پلیمر دشوار است و وجود ناخالصی در روش پلیمریزاسیون حلقهگشا میتواند مانع رسیدن به وزن مولکولی بالا شود. بهطور کلی، وزن مولکولی 50000 گرم بر مول، حداکثر وزن مولکولی برای PLGA است که به صورت تجاری در دسترس است. به منظور افزایش وزن مولکولی، پیشنهاد میشود که این پلیمر با گروههای ایزوسیانات واکنش داده و پلییورتانهایی بر پایه PLGA سنتز شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
استخوانها که ترکیبی از هیدروکسی آپاتایت (HA) و فیبرهای کلاژن هستند، به عنوان یکی از اجزای حیاتی بدن، نقشهای اساسی در حفاظت، حرکت، ذخیره مواد معدنی و تولید سلولهای خونی ایفا میکنند. در صورتیکه استخوانها دچار آسیب شوند، کیفیت زندگی فرد آسیب دیده دچار مشکل خواهد شد. بنابراین درمان نقایص استخوانی و بیماری مرتبط با آن همچنان یک چالش بالینی واقعی است (1). بهطور معمول، نقایص بزرگ استخوان ناشی از تروما، عفونت، شکستگی، تغییر شکل ستون فقرات، برداشتن تومور استخوان و غیره، نیاز به درمان جراحی با استفاده از پیوند اتوگرافت (autograft) استخوان دارند. با این وجود، استفاده از اتوگرافت هنوز به دلیل عوارض و در دسترس نبودن منابع اهداکننده، محدود است. از سوی دیگر آلوگرافتها (allograft) خطر تحریک سیستم ایمنی و انتقال بیماریهای عفونی را دارند (2). بنابراین، جایگزینی استخوان مصنوعی به عنوان یک استراتژی جایگزین بهینه، توجه روزافزونی را به خود جلب کرده است. بازسازی استخوان تحت یک فرآیند بیولوژیکی پیچیده است که با تشکیل لخته خون، پاسخ التهابی حاد و نئوواسکولاریزاسیون (neovascularization) و متعاقب آن بازسازی نهایی استخوان، همراه است (3). در چند دهه گذشته، مواد بازسازی استخوان در سه نسل اول، دوم و سوم تکامل یافته اند. بیومواد نسل اول، مواد زیستخنثی (bioinert) هستند که با فلزات و پلیمرهای مصنوعی خاص و بیوسرامیک¬ها نشان داده میشوند، نسل دوم بیومواد پلیمرهای زیستتخریبپذیر، مواد زیستفعال و قابل جذب زیستی هستند که با پلی استرها، فسفات کلسیم و شیشه بیواکتیو ترکیب میشوند. نسل سوم تمرکز بر مهندسی بازساختی بافتهای مورد نظر به کمک بیومواد و فاکتورهای موثر و سایر روشهای مهندسی شده است (4). مهندسی بافت بر اساس سه جزء اصلی سلولها، مولکولهای زیستی فعال و داربستها بنا شده است. سلولها اجزای بنیادی سازنده بافت هستند و نقش حیاتی در ترمیم و بازسازی آنها دارند. استفاده از سلولهای بنیادی، بهویژه سلولهای بنیادی جنینی و بالغ، در این زمینه بسیار مورد توجه قرار گرفته است (5). مولکولهای زیستی فعال شامل فاکتورهای رشد و سیگنالدهندههایی هستند که به سلولها کمک میکنند تا در جهت ترمیم و بازسازی بافت عمل کنند. داربستها ساختارهایی هستند که محیطی مناسب برای رشد سلولها فراهم میکنند. بنابراین داربستها باید دارای خواص مکانیکی متناسب با بافت موردنظر، زیستسازگاری و زیستتخریبپذیری باشند تا بتوانند بهطور مؤثر با بافتهای طبیعی تعامل داشته باشند (6). این داربستها غالباً از پلیمرها ساخته میشوند. در این میان، پلیمرهای زیستتخریبپذیر و زیستسازگار، از جمله انتخابهای اصلی محسوب میشوند (7،8). پلیمر پلی (لاکتیک-کو-گلایکولیک اسید) (PLGA) به دلیل اینکه مونومرهای آن پایه نفتی و فسیلی ندارند و کاملاً از محیطزیست مشتق میشوند، پلیمری زیستتخریبپذیر و زیستسازگار است. سرعت تخریب این پلیمر با تغییر نسبت مونومرهای سازنده آن قابل تنظیم است که این ویژگی میتواند علاوه بر زمان تخریب داربست، در کاربردهای دیگر هم مانند سامانه های رهایش دارو مورد توجه قرار گیرد. خواص مکانیکی، از جمله استحکام و مدول مناسب این پلیمر باعث میشود که مشابه استخوان و جایگزین مناسبی برای آن باشد. این پلیمر به دلایل گفته شده، مورد توجه بسیاری از محققان قرار گرفته است و همچنین مواد مبتنی بر PLGA توسط سازمان غذا و دارو (FDA) برای کاربردهای زیستپزشکی تایید شدهاند (9). تا به امروز، محصولات زیادی بر اساس PLGA تولید شده اند، مانند بخیه قابل جذب (Coated VICRYL®)، پلت فرم تحویل دارو (Triptorelin)، در ساخت قرص پلاویکس، پیچ استخوانی، و پیوند استخوان (OsteoScafTM) (13-10). در این مقاله مروری قصد داریم، فرآیند سنتز پلیمر PLGA و روشهای مختلف آن را بررسی کنیم و کاربرد آن در مهندسی بافت استخوان را مورد مطالعه قرار دهیم.
روش بررسی
جهت مرور و بررسی مطالعات و شواهد در دسترس در رابطه با کوپلیمرهای پلی (لاکتیک – کو - گلایکولیک اسید) و کاربرد آن در مهندسی بافت استخوان، پایگاههای اطلاعاتی Science Direct، PubMed و موتور جستجوی google scholar مورد استفاده قرار گرفت. در این تحقیق ازکلیدواژههای: استخوان، مهندسی بافت، پلی (لاکتیک-کو-گلایکولیک اسید) (PLGA) و داربست در بازه زمانی 1950 تا 2024 میلادی استفاده شده است. در مجموع 77 مقاله مروری و یا پژوهشی کامل برای تحریر این مقاله استفاده شده است.
سنتز مونومرها و پلیمر PLGA: از آنجاییکه خواص منحصربهفرد این پلیمر مرتبط به روش سنتز و نوع و ترکیب درصد مونومرهای آنها است، باید کلیاتی بهصورت خلاصه در مورد سنتز آن نیز دانسته شود. PLGA یک پلیمر آمورف آلیفاتیک زیستتخریبپذیر است که توسط دو روش بسپارش (Polymerization) تراکمی مستقیم و بسپارش حلقهگشا میتوان سنتز کرد. البته مونومرها در هر یک از این روشها متفاوت است. در روش بسپارش تراکمی مستقیم، مونومرها لاکتیک اسید و گلایکولیک اسید هستند. این در حالی است که مونومرها، در بسپارش حلقه گشا، لاکتاید و گلایکولاید هستند، که در ادامه به توضیح این مونومرها میپردازیم.
لاکتیک اسید (C3H6O3) یکی از رایجترین اسیدهای کربوکسیلیک موجود در طبیعت است. قندهای موجود در محصولات سلولزی مانند پنبه و ضایعات کشاورزی مورد استفاده برای تخمیر لاکتیک اسید شامل نشاسته، گلوکز، لاکتوز و مالتوز است که توسط ذرت و سیب زمینی تولید میشود (14). اسید لاکتیک از هیدرولیز، استریفیکاسیون، تقطیر و هیدرولیز به دست میآید (شکل1).
لاکتاید یک استر حلقوی شده در اثر آبگیری از دو مولکول اسید لاکتیک است که این فرآیند از طریق بسپارش تراکمی مولکول¬های لاکتیک اسید و سپس وابسپارش الیگومر تولید شده، انجام میشود. پس از تولید لاکتاید، برای استخراج مونومر لاکتاید، معمولاً از روشهای حرارتی و کاهش فشار استفاده میشود (15). طبق بررسی Pieter VanWouwe، سه روش اصلی برای تولید لاکتاید از لاکتیک اسید وجود دارد. روش اول شامل سنتز دو مرحلهای است که در آن اسید لاکتیک به الیگومر و سپس به حلقه دیمر تبدیل میشود. روش دوم، سنتز فاز گاز است که با تبخیر و واکنش بر روی بستر کاتالیزوری انجام میشود. روش سوم، فرآیند فاز مایع یک مرحلهای است که با استفاده از زئولیتها انرژی کمتری مصرف میکند و به نظر میرسد بهترین ویژگیهای هر دو روش قبلی را ترکیب کند (16).
گلایکولیک اسید (GA) یک آلفا هیدروکسی اسید دو کربنه با کاربردهای گسترده است. در صنعت نساجی به عنوان رنگزا و برنزهکننده، در صنایع غذایی به عنوان طعمدهنده و نگهدارنده، و در داروسازی به عنوان عامل مؤثر در مراقبت از پوست استفاده میشود (17). GAبه طور طبیعی توسط برخی باکتریهای اکسیدکننده آهن و گوگرد تولید میشود (18) یا از هیدرولیز گلیکولونیتریل توسط آنزیم نیتریلاز آلکالیژنس (شکل2) بهدست میآید.
گلایکولاید، یک دیاستر حلقوی از گلایکولیک اسید، مادهای کریستالی سفید رنگ است که در حلالهای آلی حل میشود و دارای نقطه ذوب ℃85 است (19). هیگینز و همکارانش فرآیند پلیمریزاسیون تراکمی اسید گلایکولیک را بررسی کردند. در این روش، حذف آب در دمای 200 درجه سانتیگراد و فشار اتمسفر انجام میشود. سپس دما به 220 درجه افزایش و فشار به 0/1 تا 0/7 کیلو پاسکال کاهش مییابد. گلایکولاید به عنوان محصول جانبی با بازده 14% تولید میشود. بر اساس شکل (3)، واکنش (2) عمدتاً در دمای حدود ℃200 رخ میدهد، بازده پایین گلایکولاید عمدتاً به دلیل دمای پایین وابسپارش (Depolymerization) الیگومرها است که موجب تغییر تعادل به سمت تشکیل پلی گلایکولیک اسید از طریق پلیمریزاسیون تراکمی میشود (20).

شکل1: تولید لاکتیک اسید از طریق فرآیند تخمیر و هیدرولیز.

شکل 2: فرآیند شیمیایی-آنزیمی سه مرحلهای برای تولید گلایکولیک اسید.

شکل 3: تبدیل برگشت پذیر الیگومرهای هیدروکسی کربوکسیلیک اسید: (1) وابسپارش (2) بسپارش تراکمی.
1.2 سنتز پلی لاکتیک کو گلایکولیک اسید (PLGA): PLGA یک پلیاستر آلیفاتیک است که بهطور کامل به دیاکسید کربن و آب تجزیه میشود و برای محیطزیست بیضرر و غیرسمی است. این پلیمر دارای سازگاری بیولوژیکی و قابلیت جذب عالی در بدن است، که آن را برای کاربردهایی مانند بخیههای پزشکی، مواد تثبیتکننده استخوان، میکروکرههای(Microsphere) دارورسانی و مهندسی بافت استخوان مناسب میسازد. PLGA از طریق دو روش پلیمریزاسیون تراکمی و حلقهگشا سنتز میشود، اما پلیمریزاسیون حلقهگشا نسبت به پلیمرزیزاسیون تراکمی برای تولید کوپلیمرهای با وزن مولکولی بالا کارآمدتر است و بهترین روش برای سنتز PLGA پلیمریزاسیون حلقه گشا هست. لاکتاید و گلیکولاید، به ترتیب با تجزیه حرارتی الیگومرهای لاکتیک اسید و گلایکولیک اسید تهیه میشوند و بهعنوان الیگومرها استفاده میشوند. روش پلیمریزاسیون تراکمی، خود به زیر دستههای دیگری نیز تقسیمبندی میشود. پلیمریزاسیون تراکمی میتواند در حالت محلول یا مذاب انجام شود، اما اگر پژوهشگر مجبور باشد از روش پلیمریزاسیون تراکمی برای سنتز استفاده کند از بین روشهای مختلف پلیمرزاسیون تراکمی، برای تولید پلیمرهای با وزن مولکولی بالا، روش "بسپارش تراکمی مذاب-جامد" به عنوان یک گزینه جدید معرفی شده است (شکل4)، که با این حال وزن مولکولی در این روش جدید نسبت به پلیمریزاسیون حلقه گشا پایین تر هست. در این روش، الیگومرها از مونومرها با حذف آب ساخته میشوند و سپس تحت فشار پایین و با کاتالیزورهایی مانند روی استات دیهیدرات پلیمریزه میشوند تا پلیمرهای با وزن مولکولی بالا تولید شود (21).
برای تولید پلیمر PLGA با وزن مولکولی بالا، استفاده از بسپارش حلقهگشا برای دیاسترهای حلقوی لاکتاید و گلایکولاید مؤثر است. در این فرآیند، حلقههای کوچک مولکولی به زنجیرههای بلند پلیمری تبدیل میشوند (شکل 5). این روش به دلیل توانایی در تولید پلیمرهای با وزن مولکولی بالا و کنترل دقیق بر ساختار مولکولی، بسیار مورد توجه است. دیاسترهای حلقوی تحت شرایط خاص و با کاتالیزورهایی مانند قلع یا تیتانیوم پلیمریزه میشوند. این روش امکان تولید PLGA با ویژگیهای زیستسازگاری و تخریبپذیری مطلوب را فراهم میکند و به تنظیم وزن مولکولی نهایی پلیمر کمک میکند، که برای طراحی داروهای تحویلی اهمیت دارد. در نتیجه، استفاده از روش بسپارش حلقهگشا برای تولید PLGA نه تنها زمان تولید را کاهش میدهد بلکه امکان دستیابی به پلیمرهایی با خواص مورد نیاز برای کاربردهای خاص را نیز فراهم میآورد (22،23)

شکل 4:روشهای سنتز گلایکولاید از طریق بسپارش الیگومرهای گلایکولیک اسید.

شکل 5: بسپارش حلقهگشا لاکتاید و گلایکولاید.
3. خواص فیزیکوشیمیایی و تخریبپذیری: خصوصیات فیزیکوشیمیایی پلیمرهای زیستی، از جمله PLGA، برای طراحی مواد زیستی مهم هستند. PLGA در وزنهای مولکولی و ترکیبات مختلفی عرضه میشود که بر ویژگیهای آن تأثیر دارد (24). PLGA برخلاف پلی لاکتیک و پلی گلایکولیک اسید، با حلالهای مختلفی حل میشود و قابلیت پردازش و محصور کردن زیستمولکولها را دارد (25). خواص فیزیکی PLGA به عوامل مختلفی از جمله وزن مولکولی اولیه مونومرها، نسبت LA:GA، زمان قرار گرفتن در معرض آب و دمای ذخیره (دمایی که PLGAبرای حفظ پایداری فیزیکی و شیمیایی خود در آن نگهداری میشود) بستگی دارد (26). متداولترین نوع PLGA (50:50) شامل 50% لاکتیک و 50% گلایکولیک است. نسبت مولی این اسیدها بر خواص و تخریبپذیری آن تأثیر مهمی در بازسازی استخوان دارد (27). بر خلاف اسید لاکتیک، اسید گلایکولیک فاقد گروه جانبی متیل است و آن را بسیار کریستالی میکند، اما این کریستالی در PLGA از بین میرود (28). گروههای انتهایی کربوکسیل آزاد PLGA را میتوان برای اصلاحات شیمیایی برای تعدیل سرعت تخریب یا خواص تحویل دارو استفاده کرد (29). PLGAبا هیدرولیز پیوندهای استری خود، از طریق فرسایش تودهای یا ناهمگن، در محیطهای آبی تخریب میشود (30). جدول 1 عوامل اصلی و مکانیسم های مربوط به تخریب ماده PLGA را فهرست کرده است. تخریب PLGA شامل چهار مرحله است: (الف) جذب آب: نفوذ آب به نواحی آمورف و اختلال در نیروهای واندروالس و پیوندهای هیدروژنی که دمای انتقال شیشهای (Tg) را کاهش میدهد. (ب) تخریب اولیه: شکست پیوندهای کووالانسی و کاهش وزن مولکولی که آغاز فرآیند تخریب را نشان میدهد. (ج) تخریب مداوم :گروههای کربوکسیلیک انتهایی کاتالیز میکنند و از دست رفتن جرم و یکپارچگی ساختاری PLGA آغاز میشود. (د) انحلال : قطعات به مولکولهای محلول در آب شکسته شده و لاکتیک اسید (LA) و گلایکولیک اسید (GA) به عنوان محصولات جانبی تولید میشوند (33-31).
جدول1: اثر متغیرهای متداول بر تخریبپذیری مواد زیستی مبتنی بر PLGA.

4. کاربرد های PLGA در مهندسی بافت استخوان: پلیمرهای زیستتخریبپذیر، به ویژه (PLGA)، در تحویل کنترلشده و هدفمند داروها نقش مهمی دارند. PLGA به عنوان یک "پلیمر هوشمند" شناخته میشود و سیستمهای دارورسانی مبتنی بر آن برای درمان بیماریها گزارش شدهاند. در سالهای اخیر، پلیمرهای غیرقابل جذب جای خود را به پلیمرهای قابل جذب و زیستتخریبپذیر دادهاند. پلیمرهای مصنوعی مانند پلیانیدریدها و پلییورتان استری نیز توسعه یافتهاند، اما پلیاسترهای آلیفاتیک ترموپلاستیک به دلیل خواص فیزیکی، شیمیایی و زیستی متنوع خود برتری دارند. (49-47). به طور ایدهآل، بیومتریالها موادی هستند که بهطور موقت یا دائمی بخشی از بدن میشوند تا عملکردهای طبیعی بافت یا اندامهای زنده را بازسازی، تقویت یا جایگزین کنند (50). این مواد نباید هیچ واکنش سیستمیک، ایمنی، سیتوتوکسیک، جهشزا، سرطانزا یا تراتوژنیک ایجاد کنند (51). پلیاسترهای زیستتخریبپذیر مصنوعی مانند پلیلاکتیک اسید و پلیگلایکولیک اسید از دهه 1970 به عنوان نخهای جراحی قابل جذب استفاده میشوند (52). پیشرفتهای اخیر شامل توسعه سیستمهای پلیمری جدید با پیوند بلوکها و ترکیب آنها با دیگر پلیمرها یا مونومرها است. این کوپلیمرها به گونهای طراحی شدهاند که خواص خاصی برای دستگاههای زیستپزشکی و سیستمهای دارورسانی فراهم کنند، از جمله دسترسی زیستی مشخص و نرخ رهایش کنترلشده، که به بهبود عملکرد درمانی کمک میکند (53). در میان کوپلیمرهای PLA و PGA، پلی (لاکتیک اسید-کو-گلایکولیک اسید) به عنوان یک پلیمر زیستسازگار و غیرسمی مهم با کاربردهای متعدد در دارورسانی، مهندسی بافت، و دستگاههای پزشکی و جراحی برجسته شده است. PLGA به دلیل خواص زیستتخریبپذیری، زیستسازگاری و رهایش پایدار خود، توسط سازمان غذا و داروی ایالات متحده (FDA) برای چندین کاربرد درمانی تأیید شده است (54). داربستهای مهندسی بافت غضروف باید دارای استحکام مکانیکی بالا و ساختار منافذ کنترلشده باشند تا میکرو محیطهای مناسبی برای بازسازی بافت فراهم کنند. غضروف مفصلی بافتی نازک و صاف است که سطح مفاصل دیارتروئید را پوشش میدهد و نقش مهمی در توزیع بار و کاهش اصطکاک حین حرکت دارد. این بافت فاقد عروق خونی است، که برای حمل مواد مغذی در طول بازسازی ضروری هستند (55،56). به همین دلیل، ترمیم نقصهای غضروفی دشوار است. درمانهای مختلفی مانند دارو، تکنیک میکروفراکتور، پیوند بافتی و پیوند خودی برای ترمیم آسیبهای غضروفی استفاده میشود. با وجود تأثیرات مثبت این درمانها، محدودیتهایی نیز دارند؛ بهعنوان مثال، درمان دارویی نیاز به دوره بهبودی طولانی دارد و تنها بهطور جزئی بافت آسیبدیده را به عملکرد طبیعی برمیگرداند (57). تکنیک میکروفراکتور برای ترمیم نقصهای کوچک غضروف مناسب است، اما پیوند خودی و بافتی با کمبود اهداکننده و ردایمنی مواجهاند (58،59). مهندسی بافت غضروف توسعه یافته و به عنوان یک روش جایگزین برای غلبه بر محدودیتهای این درمانها معرفی شده است (60،61).
1.4. داربستهای الکتروریسی شده: روشهای مختلفی برای تولید الیاف وجود دارد که یکی از آنها الکتروریسی است. این روش مؤثر و کمهزینه، الیاف با قطرهای کوچک تولید میکند و در زمینههای محیط زیست و انرژی کاربرد دارد. ساختار آن مشابه ماتریکس خارجسلولی (ECM) است. با توجه به خواص پلیمر PLGA که در بخش مقدمه بیان شد، این پلیمر دارای جرم مولکولی گرهخوردگی حدود 10,000 گرم بر مول و جرم مولکولی بین 40,000 تا 50,000 گرم بر مول است که این مقادیر برای فرآیند الکتروریسی مناسب هستند. علاوه بر این، PLGA به راحتی در حلالهای آلی حل میشود و به دلیل ثابت دیالکتریک خوب این محلول، امکان تولید الیاف با قطر یکنواخت و مناسب فراهم میشود. در سال 2021 وی ژانگ و همکارانش (62) به ارزیابی ویژگیها و تأثیرات تخریب بر خواص ساختاری داربستهای نانوالیافی مبتنی (PLGA) و پلیکاپرولاکتون (PCL) پرداختند. شش داربست از طریق روش الکتروریسی تهیه شد. از این تعداد، سه داربست با استفاده از (PCL) در غلظت 15% (وزن/حجم) و سه داربست دیگر (PLGA) با در غلظت 10% (وزن/حجم) تولید گردید. زمانهای پردازش الکتروریسی برای این داربستها به ترتیب 30، 60 و 90 دقیقه بود. هر دو نوع داربست با افزایش زمان ریسندگی خواص مکانیکی بهتری نشان دادند و درصد کاهش وزن آنها به تدریج افزایش یافت که تأییدکننده قابلیت تخریب غشای متخلخل است. اندازه حفره و درصد تخلخل در طول تخریب بهطور قابلتوجهی کاهش یافت. ویژگی آبگریزی یا آبدوستی لایه غشایی بر کاربرد آن تأثیر دارد؛ غشاهای آبگریز برای جلوگیری از جذب مایع و داربستهای آبدوست برای نفوذ و تکثیر سلولها ضروری هستند. تمام نمونهها به دلیل استفاده از پلیمرهای آبگریز با وزن مولکولی بالا، آبگریز بودند (شکل 6-الف) و زاویههای تماس آنها بیشتر از °90 بود که این امر میتواند برای چسبندگی و تکثیر سلولها مشکلساز باشد. جالب است که غشاهای PLGA کمی بیشتر از غشاهای PCL آبگریز بودند. این مطالعه به بررسی کاهش وزن داربستهای الکتروریسی از PCL و PLGA در طول 12 هفته تخریب میپردازد (شکل 6-ب). تصاویر میکروسکوپ الکترونی روبشی (SEM) نشان دهنده وضعیت این ساختارها در طول 12 هفته در دمای اتاق هستند (شکل 6-ج). این تصاویر نشان میدهند که غشاءهای ساخته شده با روش الکتروریسی، یک شبکه بسیار متصل و دارای منافذ مناسب و سطحی نسبتاً صاف ایجاد کردهاند. همچنین، فرآیند تولید این غشاءها به گونهای بهبود یافته که هیچ مشکلی مانند ناپایداری جت الکتروریسی یا وجود دانههای (Beads) ناخواسته مشاهده نشده است. داربستهای موقتی باید نرخ تخریب ثابتی داشته باشند تا از رشد بافت حمایت کنند. در این مطالعه، نمونهها بهصورت هفتگی برداشت و وزنکشی شدند تا رطوبت از بین برود. تحقیقات نشان میدهد که پلیمرها در طول تخریب در دمای اتاق بیشتر بلوری میشوند، که بر نرخ تخریب تأثیر میگذارد. داربستهای PCL با زمان الکتروریسی 30 و 60 دقیقه کاهش وزن بیشتری نسبت به وزن اولیه خود در 12 هفته نشان دادند، اما داربستهای PCL با زمان 90 دقیقه تخریب کندتری داشتند. این کندی به محتوای بالای لاکتیک اسید در PLGA نسبت داده میشود که آن را آبگریزتر و کمتر مستعد تخریب در محلول PBS میکند. نتایج نشان داد که پیوند متقابل در داربستهای الکتروریسی شده خواص مکانیکی آنها را بهبود بخشیده و این خواص با تغییر روشهای تولید قابل تنظیم است. افزایش زمان ریسندگی منجر به تقویت خواص مکانیکی و آبگریزی غشاها شد. بهینهسازی برای افزایش آبدوستی و بلورینگی ضروری است تا از جمعشدگی در محلول PBS جلوگیری شود. این تحقیق مزایای تولید داربستهای با ساختار میکروسکوپی و خواص مناسب برای کاربردهای پزشکی را دارد، اما عدم ارائه دادههای بیولوژیکی و نیاز به تحقیقات بیشتر برای ارزیابی ایمنی از محدودیتهای آن است.
درسال 2023 محسن نوروزی و همکارانش (63)، داربستهای الکتروریسیشدهای تولید کردند که از محلول ۱۰% پلیلاکتیک-کو-گلیکولیک اسید و همچنین ترکیبهایی از PLGA با فیبرین و لیگنین ساخته شدهاند. این ترکیبها به صورت ترکیب محلولهای پلیمری 10% تهیه شدند. نسبتهای مورد استفاده لیگنین :PLGA و فیبرین: PLGA و لیگنین : فیبرین : PLGA به ترتیب ۹:۱، ۸:۲، ۷:۳، ۷:۲:۱، ۶:۲:۲ و ۵:۲:۳ بودند. همه داربستها دارای ساختار نانومقیاس یکنواخت بودند و قطر الیاف آنها بین 0/1 تا 2/5 میکرومتر متغیر بود، که بزرگترین قطر الیاف مربوط به داربستهای لیگنین/ PLGA بود. افزایش نسبت لیگنین در ترکیب باعث کاهش قطر الیاف و تغییر رنگ آنها به قهوهای شد (شکل 7-الف). همچنین، فیبرین آبگریزی داربستها را بهبود بخشید و ترکیب فیبرین، لیگنین یا فیبرین/ لیگنین ظرفیت جذب داربستها را تا 92% افزایش داد. از روز ۴۵ به بعد، داربستهای حاوی فیبرین شروع به تجزیه سریعتری کردند. در روز ۹۰، داربست 30% لیگنین / 20% فیبرین / PLGA بالاترین نسبت تجزیه (۸۲%) را نشان داد، در حالیکه داربست 10% لیگنین / PLGA کمترین نسبت تجزیه (51/4%) را داشت. همه داربستها درصد تخلخل بالای ۷۸% داشتند و افزایش فیبرین و کاهش لیگنین موجب افزایش تخلخل آنها شد. در زمینه سختی و استحکام کششی، داربست خالص PLGA بالاترین سختی و داربست ۱۰% لیگنین/ PLGA بالاترین استحکام کششی را داشتند. افزودن این ترکیبات طبیعی به تدریج استحکام کششی و کرنش شکست داربستها را کاهش داد. نتایج آزمایش MTT نشاندهنده جذب بالاتر در طول روزهای ۳ تا ۷ برای داربستهای PLGA، 10% فیبرین / PLGA و هر سه نوع لیگنین / PLGA بود. در روز 7، داربست 10% فیبرین/ PLGA بالاترین زندهمانی سلولی را نشان داد. تصاویر میکروسکوپ الکترونی وجود سلولهای بنیادی با شکلهای دوکی را نشان داد که بهخوبی به همه داربستها متصل شده و تکثیر یافتند (شکل 7-ب). در نهایت، از میان داربستها 10% لیگنین/ 20% فیبرین/ PLGA بهعنوان گزینه برتر انتخاب شد که ویژگیهای فیزیکی عالی و پاسخهای بیولوژیکی فعالی را به دلیل سیگنالهای فیزیکی-مکانیکی و ویژگیهای پیشرفته لیگنین ارائه میدهد. این ویژگیها آن را برای کاربردهای مهندسی بافت، پانسمان زخم، تحویل دارو و سایر کاربردهای زیستپزشکی مناسب میسازد. در سال 2023 آلدو گوزمان- سوریا و همکارانش (64)، داربستی با الیاف (PLGA) و کلاژن با استفاده از روش الکتروریسی تولید کردند و سپس از نظر چسبندگی و زندهمانی سلولهای سرطانی گردن رحم انسانی (HeLa) و فیبروبلاستهای NIH-3T3 برای کاربردهای بالقوه در بازسازی بافت ارزیابی کردند. همچنین، آزادسازی کلاژن در فیبروبلاستهای NIH-3T3 مورد بررسی قرار گرفت. مورفولوژی الیاف کلاژن/PLGA با استفاده از تصاویر SEM بررسی شد و نشان داده شد که قطر الیاف تا 0/6 میکرومتر کاهش یافت. تحلیل آزمونهای حرارتی و طیفسنجی تبدیل فوریه مادون قرمز (FTIR) نشان دادند که هم فرآیند الکتروریسی و هم ترکیب با PLGA به ثبات ساختاری کلاژن کمک میکنند. افزودن کلاژن به ماتریس PLGA باعث افزایش سختی مواد شد، بهطوری که مدول الاستیک ۳۸% و استحکام کششی ۷۰% نسبت به PLGA خالص افزایش یافت. در نهایت نشان داده شد الیاف PLGA و کلاژن / PLGA محیط مناسبی برای چسبندگی و رشد خطوط سلولی HeLa و NIH-3T3 فراهم کردند و تصاویر میکروسکوپ الکترونی نشان داد که سلولهای HeLa که شکل چندضلعی دارند و سلولهای NIH-3T3 که شکل کشیدهای دارند، بر روی هیدروژل کلاژن و الیاف داربست پخش شدهاند. این موضوع نشان میدهد که این سلولها به خوبی به سطح داربست چسبیدهاند (شکل 8-الف). در داربست کلاژن/ PLGA، تعداد سلولهای HeLa (3/05 ±31 سلول در هر ۲۰۰ میکرومتر مربع) نسبت به داربست خالص PLGA (54/5 ± 23 سلول) و کنترل هیدروژل کلاژن (3/56 ± 19 سلول) افزایش قابل توجهی داشت (شکل 8-ب). اما تعداد سلولهای NIH-3T3 در همه داربستها تقریباً مشابه بود (حدود 2/38 ± 15 سلول). نتایج نشان داد که ساختار الیافی و متخلخل این داربستها تأثیر مثبتی بر عملکرد زیستی آنها دارد و این مواد میتوانند به عنوان پشتیبانی مناسب برای بازسازی ماتریس خارجسلولی در مهندسی بافت مورد استفاده قرار گیرند. در سال 2023 گیریراج پاندی و همکارانش (65)، از تکنیک الکتروریسی برای طراحی و ساخت داربستهای نانویی قابل جذب زیستی از ترکیب پلی وینیل الکل (PVA)، ژلاتین و پلی (لاکتیک-کو-گلیکولیک اسید) استفاده کردند. این داربستها حاوی ترومبین (TMB) به عنوان عامل هموستاتیک و وانکومایسین (VCM) به عنوان عامل ضدباکتری بودند تا یک پلتفرم چندمنظوره برای کنترل خونریزی، جلوگیری از رشد باکتری و تسریع بهبود زخم ایجاد کنند. با استفاده از میکروسکوپ الکترونی، ویژگیهای ساختاری و قطر نانوالیاف بررسی شد و نتایج نشان داد که قطر نانوالیاف بین ۱۵۰ تا ۳۰۰ نانومتر است (شکل 9-الف). دادههای مربوط به شاخص تورم نشان داد که این نانوالیاف میتوانند مایعات اضافی زخم را به خوبی جذب کنند. اطلاعات مربوط به رهاسازی دارو نشان داد که نانوالیاف رفتار رهاسازی پایدار دارند. نتایج آزمایشها نشان دادند که داربستهای نانوالیافی نه تنها میتوانند باکتریها را از بین ببرند، بلکه همچنین قادر به جلوگیری از تشکیل بیوفیلم هستند. این ویژگی بسیار مهم، بهبود زخمها را تسریع کرده و خطر عفونت را کاهش میدهد. تصاویر SEM نشان داد که در گروه کنترل، باکتری S. aureus یک لایه بیوفیلم یکنواخت روی سطح داربستها تشکیل داده است همچنین پس از ۲۴ ساعت، تعداد باکتریهای موجود بر روی داربستهای نانوالیافی بارگذاری شده با وانکومایسین و ترومبین (VCM-TMB) بهطور قابلتوجهی کمتر بود (شکل 9-ب). در مدل حیوانی، پس از ۱۲ روز، مشاهده شد که داربستهای بارگذاری شده با VCM و TMB باعث تسریع در بهبود زخمها شدند. نتایج پاتولوژی بافتی نیز نشان دادند که در زخمهای درمان شده با این داربستها، تشکیل عروق جدید، بازسازی اپیدرم و کراتینه شدن بیشتر نسبت به گروه کنترل مشاهده شد.
در جدول 2 جمعبندی کلی از 4 مطالعهای که در زمینه داربستهای الکتروریسی شده انجام شده، مشاهده میشود.

شکل 6- (الف) اندازه گیری زاویه تماس برای بررسی تر شوندگی هر دو داربست PClو PLGA(ب) تخریب و درصد کاهش وزن داربستهای PCL و PLGA طی 12 هفته (ج) تصاویر میکروسکوپ الکترونی روبشی از داربستهای الکتروریسی شده PCL و PLGA در هفتههای 0، 3، 6، 9 و 12 (دوره تخریب)؛ با میله مقیاس 50 میکرومتر (62).

شکل 7-(الف) تصاویر SEM برای داربستهای نانوفیبری؛ (A) PLGA خالص، (B) %10 فیبرین/ PLGA، (C) %20 فیبرین/ PLGA، (D) %30 فیبرین / PLGA، (E) %10 لیگنین / PLGA، (F) %20 لیگنین / PLGA، (G) %30 لیگنین / PLGA، (H) %10 لیگنین/ 20% فیبرین/ PLGA، (I) %20 لیگنین/ %20 فیبرین/ PLGA، (J) 30% لیگنین/ 20% فیبرین/ PLGA (ب) تصاویر SEM از سلولهای h-ADSC که بر روی داربستهای نانوفیبری کشت داده شدهاند (63).

شکل 8-(الف) تصاویر SEM از سلولهای HeLa و NIH 3T3 که به مدت 48 ساعت به هیدروژل کلاژن، داربستهای PLGA، و داربست های کلاژنPLGA/ متصل شدهاند (پیکانها حضور سلولها بر روی داربستها را نشان میدهند). (ب) تعداد سلولهای HeLa و NIH 3T3 که به داربستها متصل شدهاند (64).

شکل 9-(الف) تصاویر SEM از نانوالیافهای دارونما (placebo)، بارگیری شده با VCM، بارگیری شده با VCM (0/5 %) و TMB، و بارگیری شده با VCM (1 %) و TMB، همراه با قطر مربوط به هر یک بهصورت نانومتر (nm). (ب) (a) آزمایش تشکیل بیوفیلم از نانوالیافهای VCM (0/5 %) - NF - TMB و VCM (1 %) - NF - TMB بر روی S.aureus پس از 24 ساعت. تصاویر SEM مربوطه از (b) کنترل منفی (-Ve)، (c) کنترل مثبت (+Ve)، (d) نانوالیاف VCM (0/5 %) - NF – TMB، (e) نانوالیاف VCM (1 %) - NF – TMB، (f) نمودار میلهای تشکیل بیوفیلم برای همه گروهها (65).
جدول 2: مقایسه و جمعبندی مقالات در زمینه داربستهای الکتروریسی شده

2.4. داربستهای تهیه شده به روش چاپگر سه بعدی
در دهههای اخیر، تولید افزایشی یا چاپ سهبعدی بهطور فزایندهای در مهندسی بافت و پزشکی ترمیمی بهکار رفته است. این روش به دلیل دقت بالا، سرعت نمونهسازی و قابلیت طراحی ساختارهای متنوع، مزایای زیادی دارد. تکنیکهای مختلفی مانند استریولیتوگرافی (Stereolithography)، بیوپرینتینگ جوهرافشان (Inkjet Bioprinting) و بیوپرینتینگ مبتنی بر اکستروژن(Extrusion-based Bioprinting) توسعه یافتهاند که هر کدام ویژگیهای خاص خود را دارند. بیوپرینتینگ مبتنی بر اکستروژن به دلیل توانایی چاپ مواد مختلف، به یکی از پرکاربردترین روشها تبدیل شده است. ترکیب این روش با تکنیکهای مختلف تصویربرداری بالینی امکان تولید مدلهای سهبعدی دقیقی از پیوندهای استخوانی را فراهم میکند. باتوجه به مزیت های پلیمر PLGA که در بخش مقدمه ذکر شد و همچنین دمای ذوب مناسب و استحکام مذاب خوب این پلیمر، گزینه مناسبی برای تهیه داربست به روش چاپ سهبعدی هست. در سال 2021 جوانا بابیلوتیا و همکارانش (66)، یک ماده کامپوزیتی PLGA-HA برای ساخت داربستهای چاپ سه بعدی برای مهندسی بافت استخوان تهیه کردند، هدف این تحقیق سنتز و شناسایی یک بیوماده مرکب شامل PLGA به همراه ۵% یا10% (وزنی) نانوذرات هیدروکسی آپاتایت (nHA) بود که برای ساخت داربستهای چاپ سهبعدی در مهندسی بافت استخوان طراحی شده است. در ابتدا، کیفیت چاپ با استفاده از PLGA و ترکیبات PLGA-HA ۵% و 10% ارزیابی شد. سپس، مواد با تکنیکهای مختلف شناسایی فیزیکی مورد بررسی قرار گرفتند. تخریب شیمیایی پلیمر در مراحل مختلف تولید بررسی شد. همچنین، تخریبپذیری بیولوژیکی داربستها در شرایط آزمایشگاهی ارزیابی شد که تغییرات در ویژگیهای مورفولوژیکی و فیزیکی و شیمیایی را نشان داد. سازگاری زیستی این مواد نیز در شرایط آزمایشگاهی و زنده مورد بررسی قرار گرفت و دو نوع سلول، شامل سلولهای استرومای مغز استخوان انسانی (hBMSCs) و سلولهای بنیادی مشتق از چربی انسانی (hADSCs) برای این آزمایشها استفاده شدند. آزمایشهای اولیه برای ارزیابی تمایز سلولی انجام شد تا امکان کاربردهای آینده این ماده مرکب در پیوند استخوان تأیید شود. این مطالعه به بررسی تأثیر شکلدهی فیلامنت و چاپ سهبعدی با استفاده از مدلسازی ذوبی (FDM) بر وزن مولکولی (Mw) و شاخص توزیع پراکندگی پلیمر (PDI)، پلی(لاکتیک-کو-گلایکولیک اسید) حاوی نانو-هیدروکسیآپاتیت میپردازد. نتایج نشان میدهد که شکلدهی PLGA به فیلامنتها منجر به کاهش تغییرات Mw شده است و تفاوت قابلتوجهی در Mw و PDI بین مواد بارگذاری شده و غیر بارگذاری شده وجود دارد. فرآیند چاپ تأثیر چندانی بر Mw و PDI نداشته، اما کاهش PDI پس از چاپ برای PLGA مشاهده شده است (شکل 10-الف). همچنین، تحلیل حرارتی (TGA) برای ارزیابی بارگذاری nHA پس از شکلدهی فیلامنت استفاده شده که نشان میدهد تخریب PLGA در دمای ℃300 تا ℃400 انجام میشود و افزودن nHA باعث افزایش دماهای تخریب به میزان ℃21/6 برای nHA 5% و ℃18/9 برای nHA 10% میشود که نشاندهنده وجود تعاملات شیمیایی بین PLGA و ذرات nHA است (شکل 10-ب). آزمایشهای کششی نشاندهنده عدم تغییر معنادار در مقاومت کششی بین مواد خالص PLGA و بارگذاری شده با nHA است، اما نمونههایی که دارای nHA10% بودند، نسبت به نمونههای با nHA 5%، مقاومت کششی کمتری نشان دادند و در این حالت مقاومت کششی از 0/7 مگاپاسکال به 0/4 مگاپاسکال کاهش یافتند، لازم به ذکر است زنده ماندن سلولی و فعالیت متابولیکی پایدار در دو نوع داربست از هفته اول تا سوم کشت سلولی مشاهده شد. تکثیر سلولی بالا و زنده ماندن سلولی نیز در این مدت به خوبی ثبت گردید. این نتایج نشاندهنده شرایط مطلوب برای رشد و توسعه سلولها در محیط کشت است (شکل 10-ج)، همچنین در این مطالعه فعالیت آنزیم آلکالین فسفاتاز (ALP) به عنوان نشانگر اولیه تمایز استئوبلاستی در دو نوع سلول بررسی شد. نتایج نشان داد که داربستهای (PLGA-HA 10%) نسبت به PLGA، رنگآمیزی شدیدتری را در هر دو نوع سلول ایجاد کردند. افزودن محیط استخوان زا (Osteoinductive) نیز فعالیت ALP را افزایش داد. برای ارزیابی رسوب کلسیم، از رنگ آلیزارین قرمز استفاده شد که پس از 21 روز، نتایج قابلتوجهی را نشان داد. داربستهای حاوی نانوهیدروکسی آپاتایت و محیط استخوان زا، معدنی شدن بیشتری را در هر دو نوع سلول ایجاد کردند. به طور خاص، داربستهای (PLGA-HA 10%) منجر به رسوب کلسیم بیشتری در سلولهای بنیادی مشتق از بافت چربی انسانی شدند، در حالیکه تفاوت معناداری در سلولهای بنیادی مشتق از مغز استخوان انسانی مشاهده نشد (شکل 10-د). در این تحقیق، داربستهای سهبعدی از ترکیب PLGA و HA با استفاده از روش FDM طراحی و ساخته شدند. این بیومواد به خوبی قابل چاپ بوده و هیچ تخریب شیمیایی معناداری در فرآیند تولید ایجاد نشده است. افزودن نانوهیدروکسی آپاتایت (nHA) تأثیر مثبتی بر تمایز استخوانی دارد و واکنش التهابی محدودی پس از کاشت زیرپوستی در موشها مشاهده شد. این تحقیق نشاندهنده پتانسیل بالای مواد ترکیبی PLGA-HA در ترمیم بافت استخوان است، اما نیاز به بررسی جامع خواص مکانیکی و تخریب زیستی طولانیمدت برای کاربردهای بالینی وجود دارد.

شکل 10: (الف) خصوصیات فیزیکوشیمیایی نمونههای PLGA-HA 10%، PLGA-HA 5% و PLGA قبل و بعد از چاپ. (ب) آزمون تحلیل حرارتی (TGA) با نرخ حرارتی ℃10 بر دقیقه برای هر سه نمونه. (ج) بررسی زنده ماندن و فعالیت سلولی در شرایط مختلف کشت پس از 7و14و21 روز کشت با اسفاده از میکروسکوپ فلورسنت. (د) ارزیابی پتانسیل تمایز استخوانی بر روی داربستها پس از 14و21 روز کشت سلولی و تعیین کمیت معدنی سازی داربستها (66).
در سال 2021 ماریون گرادول و همکارانش (67) به مطالعه پتانسیل پلیمرهای زیستجذبپذیر، بهویژه PLGA، در کاربردهای مهندسی بافت پرداختند، با وجود اینکه تعداد دستگاههای پزشکی چاپگر سهبعدی زیستجذبپذیر در بازار محدود است اما این تحقیق به بررسی قابلیت پردازش PLGA با درجه پزشکی از طریق دو فناوری ساخت افزایشی: تولید فیلامنت ذوب شده (FFF) و چاپ گرانول مستقیم (DPP) پرداخت تا مشخص شود کدام روش کمترین آسیب را به PLGA وارد میکند. در FFFفیلامنت به داخل نازل هدایت میشود و در دمای بالا (معمولاً بین ℃180 تا ℃220) ذوب میشود. دما باید به گونهای تنظیم شود که پلیمر به حالت مایع درآید اما از تجزیه یا تخریب آن جلوگیری شود. پس از ذوب شدن، پلیمر مایع از نازل خارج میشود و بر روی بستر چاپ قرار میگیرد. این فرآیند بهصورت لایه به لایه انجام میشود تا شکل نهایی ساخته شود. هر لایه پس از قرارگیری، به سرعت سرد شده و سخت میشود. در روش DDP به جای فیلامنت، گرانولهای پلیمر مانند PLGA مورد استفاده قرار میگیرند. این گرانولها معمولاً دارای اندازه و شکل یکنواخت هستند که باعث یکنواختی در فرآیند چاپ میشود. گرانولها به داخل یک اکسترودر (Extruder) تغذیه میشوند که در آنها تحت دما و فشار مناسب (معمولاً بین ℃160 تا ℃200) ذوب میشوند. این فرآیند معمولاً در دماهای پایینتری نسبت به FFF انجام میشود که احتمال آسیب به PLGA را کاهش میدهد.پس از ذوب شدن، پلیمر مایع از نازل خارج شده و بر روی بستر چاپ قرار میگیرد، مشابه با روش FFF این مرحله نیز به صورت لایه به لایه انجام میشود. این نتایج نشان داد که چاپ سه بعدی PLGA با استفاده از چاپگر DPP بهطور قابلتوجهی وزن مولکولی میانگین عددی (Mn) را تا 26% کاهش داد، در حالی که کاهش وزن مولکولی در روش FFF برابر با 19% بود. از میان تمام روشهای استریلسازی آزمایششده، اتیلن اکساید بهعنوان مناسبترین روش شناخته شد، زیرا تغییرات معناداری در خواص PLGA ایجاد نکرد. بر اساس مشاهدات، توصیه میشود که از چاپ FFF و استریلسازی با اتیلن اکساید برای تولید دستگاههای پزشکی PLGA استفاده شود. نمونههای PLGA بهطور متوالی از روشهای (DDP) و (FFF) چاپ شدند. با این حال، به دلیل رفتار ذوب PLGA در فرآیند اکستروژنDPP ، دستیابی به تکرارپذیری نسبت به فرآیند معمولی FFF دشوارتر بود. برای بررسی تکرارپذیری این دو روش تولید افزایشی، پنج دیسک دایرهای PLGA بهطور متوالی چاپ و وزن مولکولی آنها مورد ارزیابی قرار گرفت (شکل 11-الف). تحلیل وزن مولکولی برای هر نمونه در سه نقطه مختلف انجام شد و دادهها بهصورت میانگین و انحراف معیار ارائه گردید و مشخص شد که وزن مولکولی نهایی PLGA برای نمونههای چاپشده با DPP کمتر از نمونههای FFF است. آزمون میکروبیولوژیکی نشان داد که نمونهها بهطور مؤثر با استفاده از تابش گاما، تابش بتا و اتیلن اکسید استریل شدهاند، زیرا پس از ۴۸ ساعت هیچ کدری در محیط مشاهده نشد. نمونههای PLGA که با این روشها استریل شده بودند، با نمونههای غیر استریل از نظر وزن مولکولی مقایسه شدند. پس از استریلسازی، تمام نمونههای تابش گاما و بتا تغییراتی در وزن مولکولی اولیه خود نشان دادند. اما استریلسازی با اتیلن اکسید تأثیر قابل توجهی بر وزن مولکولی نداشت. به طور کلی، استریلسازی با تابش بتا تأثیر کمتری بر وزن مولکولی نسبت به تابش گاما داشت (شکل 11-ب).
این تحقیق بر شناسایی بهترین روش تولید افزودنی ذوب و فرآیند استریلسازی برای کاهش تخریب PLGA متمرکز است. نتایج نشان میدهد که فرآیند DDP منجر به تخریب شدید پلیمر میشود و تابش بتا و گاما نیز به سازه PLGA آسیب میزند. استریلسازی با اتیلن اکساید نیز ممکن است بر یکپارچگی مولکولی PLGA تأثیر منفی بگذارد. پیشنهاد میشود از روش سنتی ساخت فیلامنت ذوبشده و استریلسازی با اتیلن اکساید برای تولید دستگاههای پزشکی PLGA استفاده شود، در حالی که DDP گزینهای مناسب برای پلیاسترهای با پایداری حرارتی بیشتر مانند PCL است. FFF به عنوان روشی با تخریب کمتر شناخته میشود که خواص مطلوبتری برای کاربردهای پزشکی فراهم میکند. همچنین، نیاز به بررسی هزینههای تولید و تأیید نتایج در شرایط بالینی وجود دارد.
در سال 2022 تائو لیو و همکارانش (68)، برای بهبود خواص مکانیکی و زیستی پلیمر PLGA در مهندسی بافت استخوان از کلسیم سولفات (CaSO4) استفاده کردند. کلسیم سولفات یک ماده مناسب برای ترمیم استخوان است زیرا باعث ایجاد واکنشهای ایمنی در بدن نمیشوند و به طور کلی ایمن و بیخطر محسوب میشوند و با بافتهای اطراف خود به خوبی سازگار است. همچنین، این ماده میتواند به رشد و بازسازی استخوان کمک کند و به تدریج در بدن تجزیه میشود. در این تحقیق، برای رفع مشکلات PLGA در مهندسی بافت استخوان، داربستهای سهبعدی متخلخل PLGA/CaSO4 طراحی و تولید شدند. ابتدا پودرهای PLGA و CaSO4 با نسبتهای مختلف ( 0 ، 10، 20 و 30 درصد وزنی CaSO4 ) در دمای ℃۲۰۰ مخلوط شدند. سپس این مخلوط به چاپگر سهبعدی تزریق شد و داربستها به صورت لایه به لایه بر اساس مدل طراحی شده استخوان چاپ شدند. مشخص شد که داربستهای PLGA کمترین تنش فشاری را دارند، به این معنی که این داربستها در برابر فشار مقاومت کمی از خود نشان میدهند (شکل 12-الف). بررسیها نشان داد که افزودن CaSO4 خواص مکانیکی داربستهای PLGA را بهبود میبخشد و تنش فشاری داربست ها از مقدار 6/95 مگاپاسکال به 20/21 مگاپاسکال افزایش میدهد. تصاویر SEM نشان داد که اندازه ذرات کلسیم سولفات بین 2 تا 20 میکرومتر است و ذرات در حین تولید داربستها به طور یکنواخت در ماتریس داربست توزیع شدهاند و در یکدیگر تجمع نکردهاند (شکل 12-ب). این ویژگی بسیار مهم است زیرا تجمع ذرات میتواند منجر به ایجاد نقاط ضعیف یا عدم یکنواختی در ساختار داربست شود که ممکن است بر روی خواص مکانیکی و زیستی آن تأثیر منفی بگذارد. افزودن CaSO4 باعث بهبود قابل توجهی در مهاجرت و تمایز استخوانی سلولهای بنیادی مزانشیمی خرگوش شد. داربستهایی که ۲۰ درصد وزنی CaSO4 داشتند، بهترین خواص استخوانسازی را نشان دادند (شکل 12-ج). در نتیجه، افزودن کلسیم سولفات به داربستهای PLGA میتواند عملکرد آنها را بهطور قابلتوجهی بهبود بخشد و داربست PLGA/20%CaSO4 بهترین عملکرد کلی را نشان داده است. بنابراین، این نوع داربستها برای کاربردهای مهندسی بافت استخوان امیدوارکننده هستند.

شکل 11- (الف) مقایسه جرم نمونههای PLGA چاپ شده بر روی چاپگر FFF و PAM. (ب) تأثیر روشهای استریلسازی اتیلن اکسید و تابشهای بتا، آلفا و گاما بر ویژگیهای پلیمر PLGA (67).

شکل 12: (الف) عملکرد مکانیکی داربستهای چاپ شده سهبعدی (A) منحنیهای تنش-کرنش (B) تنش فشاری. دادهها بهصورت میانگین ارائه شدهاند. (ب) تصاویر SEM مورفولوژی ذراتCaSO4 . (ج) توانایی استخوانسازی داربستها در شرایط آزمایشگاهی (68).
3.4. داربستهای فومی و متخلخل: در زمینه مهندسی بافت غضروفی، از داربستهای متخلخل، ماتریسهای خارج سلولی و هیدروژلها به منظور تنظیم عملکرد سلولها و تسهیل فرآیند ترمیم بافت جدید بهرهبرداری میشود. داربستهای متخلخل سهبعدی اهمیت زیادی در ایجاد ساختارهای متخلخل مناسب برای فعالیت سلولی دارند. برای تولید این داربستهای متخلخل، روشهای گوناگونی وجود دارد که شامل تفکیک فازی، فومسازی گازی، خشک کردن انجمادی، ریختن حلال/ شستشوی ذرات و تولید افزودنی میشود. این روشها مشکلاتی دارند که شامل باقیمانده حلالهای سمی، ساختارهای بسته منافذ و تشکیل لایههای ناخواسته روی سطح داربستها میشود. تکنیک تولید افزودنی میتواند ساختارهای پیچیدهای از داربستها ایجاد کند، اما هزینه بالایی دارد و محدودیتهایی در مواد مصرفی دارد. علاوه بر کنترل مناسب ساختار منافذ، خواص مکانیکی قوی نیز لازم است تا فضاهای لازم برای تکثیر سلولها و ترشح ماتریس تا زمان ترمیم بافت جدید حفظ شود. هرچند داربستهای مبتنی بر پلیمرهای طبیعی مانند کلاژن و ژلاتین مزایای زیادی از جمله فعالیت زیستی بالا و سازگاری زیستی خوب دارند، اما خواص مکانیکی ضعیفی دارند. یکی از مختصههای فوم که میتواند روی تخلخل تاثیر چشمگیری بگذارد، کشش مذاب (Melt strain) است که به معنای تغییر شکل یا کشش مواد در حالت مذاب است. این پدیده در مواد پلیمری و دیگر مواد ذوب شده بسیار مهم است، زیرا میتواند تأثیر زیادی بر خواص مکانیکی و رفتار سیالاتی آنها داشته باشد. برای مثال زمانی که ماده پلیمری دارای کشش مذاب پایینی باشد، فرایند تشکیل حباب بسیار سخت خواهد شد و حباب ها به سرعت خالی میشوند و نمی توان به یک ساختار فومی و متخلخل دست یافت و از طرفی یکی از پارامترهای مهم برای ایجاد فومهای پایدار، سوسپانسیون هوا در پلیمر است، درنتیجه پلیمر باید دارای کشش سطحی مذاب بالایی داشته باشد همانطور که در بخش قبلی ذکر شد میدانیم پلیمر PLGA دارای استحکام مذاب خوبی است و این پلیمر یکی از برگزیدهها در میان پلیمرها است که دارای کشش سطحی خوبی است ( mN/m 44 - mN/m 42) (69).
در سال 2020 ژیوهوی وانگا و همکارانش (70)، داربستهای هیبریدی سهبعدی متخلخل با ترکیب مش PLGA و اسفنج کلاژن تهیه کردند که برای کنترل ساختار منافذ آنها از ذرات یخ استفاده کردند. ذرات یخ میتوانند به عنوان هستههایی عمل کنند که تشکیل بلورهای جدید یخ را آغاز میکنند. این ذرات یخ و بلورهای جدید یخ میتوانند منجر به ایجاد ساختارهای متخلخل مرتبط شوند، همچنین این ذرات یخ به راحتی با فرآیند خشککردن انجمادی حذف میشوند. با استفاده از ذرات یخ با اندازههای یکنواخت به عنوان الگوهای ایجاد منفذ برای کنترل ساختار کلی منافذ داربستها، میتوان ساختارهای متخلخل همگن و با اتصالات خوب را ایجاد کرد. الگوهای ذرات یخ میتوانند به تشکیل ساختارهای متخلخل باز در سطح داربستها کمک کنند. علاوه بر این، مش PLGA میتواند خواص مکانیکی داربستهای هیبریدی را تقویت کند. این داربستهای هیبریدی برای کشت سه بعدی کندروسیتهای مفصلی گاوی (BACs) استفاده شده و به طور زیرپوستی در موشهای بدون مو کاشته شدند تا تأثیرات مثبت آنها بر مهندسی بافت غضروف تأیید شود. در این مطالعه، یک روش برای تهیه داربستهای هیبریدی از کلاژن و PLGA با استفاده از ذرات یخ و محلول آبی کلاژن معرفی شده است. ابتدا، محلول ۲% وزنی کلاژن با حل کردن کلاژن نوع I در مخلوط اتانول و اسید استیک تهیه شد. سپس، ذرات یخ با پاشیدن آب به نیتروژن مایع تولید و در اندازههای مشخص الک شدند. برای ایجاد ذرات یخ برجسته، صفحات شیشهای با فیلم خاصی در رطوبتساز قرار گرفتند و به دمای ℃80- منتقل شدند. در نهایت، ترکیب ذرات یخ و محلول کلاژن در قالبهای سیلیکونی ریخته شد و پس از فرآیند بلورینگی و خشک کردن، داربستها به شکل شبکهای درآمدند. داربستهای تولید شده بهعنوان IC نامگذاری شدند و برای مقایسه، داربستهای بدون ذرات یخ نیز تهیه شدند که به آنها CC گفته میشود. میکروساختارهای این داربستها با استفاده از میکروسکوپ الکترونی روبشی (SEM) بررسی شد. داربستهای IC دارای حفرههای بزرگ کروی و متصل به یکدیگر در سطح بودند، در حالیکه حفرههای سطحی داربستهای CC به صورت تصادفی شکل گرفته و بیشتر آنها بسته بودند. تصاویر برشهای افقی و عمودی نشاندهنده ساختارهای حفرهای بزرگ و متصل در نواحی داخلی داربستهای IC بود، در حالیکه حفرهها در داربستهای CC نامنظم و تنها بهطور جزئی به هم متصل بودند. استفاده از قالب ذرات یخ برجسته موجب ایجاد حفرههای باز و کروی بر روی سطح داربستهای IC شد، در حالیکه داربستهای CC به دلیل عدم استفاده از این قالب، فاقد چنین ساختارهای متخلخل بودند (شکل 13-الف). مش PLGA نیز در مرکز هر دو نوع داربست مشاهده شد و در این مطالعه برای ایجاد ساختارهای حفرهای باز در هر دو طرف داربستهای IC قرار گرفت تا امکان کشت سلول فراهم شود. تصاویر برش عمودی نشان داد که مش PLGA به خوبی با لایههای اسفنج کلاژن ادغام شده است و تخلخل هر دو نوع داربست بیش از ۹۸% بود که تخلخل بالا و ساختار حفرهای متصل در داربستهای IC برای نفوذ و توزیع سلولها مفید است. پس از یک هفته کشت در آزمایشگاه، ساختارهای سلولی و داربستی به مدت ۸ هفته در زیر پوست ناحیه پشت موشهای بدون مو قرار داده شدند. ظاهر کلی ایمپلنتها نشاندهنده ویژگیهای غضروفی و رنگ سفید براق بود. رنگآمیزی HE نشان داد که در داربستهای IC، سلولها بهطور یکنواخت توزیع شدهاند و ماتریکس خارجسلولی (ECM) به خوبی رسوب کرده است. اما در داربستهای CC، توزیع سلولها ناهمگن بود و بیشتر آنها فقط در سطح قرار داشتند، که باعث ایجاد فضاهای خالی زیادی در قسمتهای داخلی داربست شد. رنگآمیزی با Safranin O نشان داد که ماتریکسهای غضروفی در داربستهای IC بهطور یکنواختتری شکل گرفتهاند. همچنین، رنگآمیزی ایمونو هیستوشیمیایی (IHC) برای کلاژن نوع II نشان داد که داربستهای IC رشد یکنواختتری از کلاژن نوع II را نسبت به داربستهای CC تسهیل کردهاند. در داربستهای CC، توزیع کلاژن نوع II ناهمگن بود و برخی فضاهای خالی در آنها وجود داشت. این نتایج نشان میدهد که ساختار حفرهای باز و متصل در داربستهای IC نه تنها توزیع یکنواخت سلولها را بهبود میبخشد، بلکه رشد یکنواخت سلولها و رسوب ماتریکسهای غضروفی را نیز تسهیل میکند. این ساختار حفرهای متصل میتواند نفوذ و حرکت سلولها را در سراسر داربست افزایش دهد و در نتیجه به بازسازی بهتر بافت نسبت به داربستهای CC منجر شود (شکل 13-ب). در این مطالعه، داربستهای هیبریدی کلاژن - PLGA با ترکیب مش PLGA و لایههای اسفنجی کلاژن ساخته شدند. این داربستها دارای حفرههای باز و متصل هستند که به توزیع یکنواخت سلولهای غضروفی و ماتریکسهای غضروفی کمک میکند و به رشد سلولها و بازسازی بافت مشابه غضروف با خواص مکانیکی بالا منجر میشود. نتایج نشان میدهند که این داربستها شرایط مناسبی برای ترشح ماتریکس خارجسلولی فراهم میکنند. با این حال، تحقیقات بیشتری برای ارزیابی اثرات بلندمدت و سازگاری زیستی این داربستها در شرایط واقعی ضروری است. مقایسه آنها با سایر روشها نیز میتواند به بهینهسازی طراحی کمک کند.

شکل13: (الف) تصاویر SEM شامل سطوح و مقاطع افقی و عمودی داربستهای IC و CC هستند. در این تصاویر، ستونهای سمت چپ با بزرگنمایی کم و ستونهای سمت راست با بزرگنمایی بالا نمایش داده شدهاند. همچنین، مربعهای سبز، پیکانهای آبی، دایرههای قرمز و دایرههای زرد به ترتیب نمایانگر مناطق بزرگنمایی، مش PLGA، منافذ کروی بزرگ و منافذ به هم پیوسته میباشند. (ب) تصاویر مربوط به ظاهر ناخالص (a,b)، رنگآمیزی با روش HE (c,d)، رنگآمیزی با Safranin O (e, f) ، و رنگآمیزی (IHC) برای شناسایی کلاژن نوع II(g,h) از ایمپلنتها پس از ۸ هفته از زمان کشت (70).
در سال 2021 یان زی و همکارانش (71)، به بررسی داربستهای کلاژنی با ساختارهای متخلخل و به هم پیوسته پرداختند. آنها از اسفنجهای (PLGA) به عنوان الگوهای موقتی استفاده کردند تا بتوانند اتصالپذیری داربستهای کلاژنی را به دقت کنترل کنند. این ساختارهای متخلخل در داربستها نقش مهمی در کنترل عملکرد سلولها در مهندسی بافت غضروف دارند. آنها شش نوع اسفنج PLGA با اندازههای مختلف حفره و تخلخل تولید کردند که این کار از طریق روش ریختن حلال و حذف ذرات انجام شد تا اتصالپذیری داربستهای کلاژنی تنظیم شود. بعد از حذف الگوهای PLGA ، یک شبکه متصل در سرتاسر داربستهای کلاژنی شکل گرفت. سپس، کندروسیتهای مفصلی گاوی در این داربستها کشت داده شدند تا تأثیر ساختارهای حفرهای بر توزیع سلول، تکثیر سلولی، ترشح ماتریس و بازسازی بافت غضروفی بررسی شود. نتایج نشان میدهد که طراحی مناسب این ساختارهای متخلخل میتواند به بهبود عملکرد سلولی و ترمیم بافت کمک کند. شش نوع الگوی PLGA با نسبتهای مختلف PLGA و NaCl و اندازههای متفاوت ذرات NaCl تهیه شدند. ترکیبهای خاص و نامگذاریهای مربوط به آنها در جدول 3 آمده است. در این مطالعه، پس از یک روز کشت، میزان زندهمانی و توزیع کندروسیتها در داربستهای کلاژنی الگوگیری شده با PLGA ارزیابی شد. رنگآمیزی زنده/ مرده نشان داد که تقریباً تمام کندروسیتها زنده بودند. رنگآمیزی DAPI توزیع سلولها را در مقاطع داربستها نشان داد؛ در داربستهای کنترل، سلولها بهطور متراکم بر روی سطح توزیع شده بودند، در حالی که در داربستهای PLGA، توزیع سلولها یکنواختتر بود. حفرههای تیره در نواحی مرکزی نشاندهنده حفرههای داربست و اتصال خوب آنها به نفوذ و توزیع یکنواخت سلولها کمک کرد. در میان تمامی داربستهای کلاژنی، داربستهای کلاژنی الگوگیری شده با اسفنج PLGA که با 10% وزنی PLGA و ذرات نمک بزرگ ساخته شده بودند، بیشترین یکنواختی در توزیع سلولها را نشان دادند. این یکنواختی احتمالاً به دلیل وجود حفرههای بزرگ و به هم پیوسته در این داربستها است. مشاهدات میکروسکوپ الکترونی نشان داد که سلولها به داربستها چسبیده و ساختار حفرهای آنها پس از یک روز کشت تغییر نکرده است. نتایج آزمون فشاری نشان داد که سازههای سلول/داربست ساخته شده از داربستهای کلاژنی الگوگیری شده با PLGA دارای مدول یانگ بالاتری نسبت به سازههای شاهد هستند. همچنین، سازههای Col-10-250 و Col-10-355 مدول یانگ بالاتری نسبت به Col-5-150 داشتند. بهطور کلی، بافتهایی که در داربستهای Col-10-150، Col-10-250 و Col-10- 355 تشکیل شدند، دارای مدول فشاری بالاتری نسبت به سایر داربستها، بهویژه داربست شاهد کلاژنی بودند. داربستهای کلاژنی با اتصالپذیری بالا با استفاده از الگوهای موقتی اسفنجی PLGA تهیه شدند. ساختار حفرهای این داربستها با کنترل تخلخل و اندازه حفرههای اسفنجی PLGA تنظیم شد. این داربستها، بهویژه نمونه Col-10-355، دارای اتصالپذیری بالا و کانالهای بزرگ در سرتاسر خود بودند. کندروسیتها بهطور یکنواخت در این داربستها چسبیده و توزیع شدند و نرخ تکثیر بالایی را نشان دادند، همچنین بیان بالایی از ژنهای غضروفی و ترشح ماتریس خارجسلولی غضروفی داشتند. داربستهای کلاژنی، بهخصوص Col-10-355، تشکیل بافت یکنواختی را با استحکام فشاری بالا تسهیل کردند. استفاده از اسفنجهای PLGA به عنوان الگوهای موقتی میتواند داربستهای متصل با حفرههای مناسب برای مهندسی بافت غضروف تولید کند و فعالیتهای سلولی ضروری را تقویت کند. این مطالعه به بررسی ساخت داربستهای کلاژنی با ساختار حفرهای متصل پرداخته است که با استفاده از الگوهای موقتی اسفنجی PLGA تهیه شدهاند. این تحقیق نشان میدهد که داربستهای تولیدشده میتوانند بهخوبی توزیع سلولها را تسهیل کرده و به رشد بافت غضروف کمک کنند. با این حال، مقاله میتواند در زمینههای مختلفی بهبود یابد، به عنوان مثال، عدم بررسی اثرات بلندمدت این داربستها بر روی بافتهای زنده یک نقطه ضعف محسوب میشود. همچنین، تحلیل دقیقتری از مکانیزمهای مولکولی و بیوشیمیایی تاثیرگذار بر فعالیتهای سلولی میتواند به درک بهتر عملکرد این داربستها کمک کند. در سال 2023، موذن حسن و همکارانش (72) در یک تحقیق، یک داربست کامپوزیتی منحصر به فرد تولید کردند که شامل نانو هیدروکسی آپاتایت آغشته شده با استرانسیوم و روی (Sr/Zn) و (PLGA) بود. این داربستها با استفاده از روش رسوب شیمیایی ساخته شدند و نسبتهای مختلفی از یونهای Sr/Zn (1%، 2/5% و 4%) داشتند. ابتدا، محلولهای حاوی دیآمونیوم فسفات و نیترات کلسیم تهیه میشود و محلول حاوی فسفات به آرامی به محلول کلسیم اضافه میشود. پس از هم زدن و نگهداری برای یک شب، رسوب حاصل فیلتر و شسته و در نهایت خشک و کلسینه میشود. در مرحله بعد، ترکیب Zn/Sr nHAp به محلول PLGA/DCM اضافه شده و پس از هم زدن و تبخیر حلال، مخلوط شسته و خشک میشود. این فرآیندها منجر به تولید هیدروکسی آپاتیت نانوکریستالی و ترکیبهای با خواص زیستسازگاری مناسب برای کاربردهای پزشکی میشود. فعالیت ضدباکتریایی این داربستها در برابر باکتری استافیلوکوکوس اورئوس (Staphylococcus aureus) با شمارش واحدهای تشکیل کلونی (CFU) پس از تماس مستقیم ارزیابی شد (شکل 14-الف). نتایج نشان داد که افزایش غلظت Zn2+ منجر به کاهش تعداد CFU بهصورت وابسته به دوز میشود و داربستها حاوی 4% یون روی بهترین خواص ضدباکتریایی را نشان داد. آزمون زندهمانی سلولی MTT نشان داد که آغشته شدن با Sr/Zn از تکثیر سلولهای استئوبلاست حمایت میکند بدون اینکه سمی باشد و بالاترین درصد آغشتگی در (4% Sr/Zn-nHAp-PLGA) برای رشد سلولها ایدهآل بود. این مطالعه همچنین به بررسی تأثیرات ضدباکتریایی (nHAp) دوپ شده با یون روی و استرانسیوم میپردازد. نتایج نشان میدهد که داربستهای حاوی Zn2+ بهطور قابلتوجهی تعداد باکتریها را کاهش میدهند و بالاترین درصد مهار رشد باکتری (بین 98/6% تا 99/7%) در غلظت 4% Zn مشاهده میشود. همچنین، افزودن PLGA به داربستها تأثیری بر فعالیت ضدباکتریایی Zn2+نداشت. آزمون MTT برای ارزیابی تکثیر سلولهای استئوبلاست در انواع مختلف داربستها و بررسی سازگاری سلولی آنها انجام شد (شکل 14-ب). تحقیقات قبلی نشان دادهاند که (nHAp) با سلولها سازگار است و تأثیر مثبتی بر رشد و تمایز استئوبلاستها دارد. در این مطالعه، nHAp به عنوان کنترل برای بررسی اثر آغشتگی با (Sr) و(Zn) استفاده شد. نتایج نشان داد که در روز دوم، تعداد سلولهای فعال متابولیکی در داربست های nHAp و nHAp-PLGA کمتر از داربستهای حاوی یونهای Sr و Zn بود، هرچند این تفاوت از نظر آماری معنیدار نبود. غلظت 4% یونهای Sr/Zn توانست زندهمانی سلولها را به مدت یک هفته حفظ کند و بالاترین تعداد سلولهای زنده را ارائه دهد. این نتایج نشان میدهد که داربستهای(4% Sr/Zn-nHAp-PLGA) برای افزایش تکثیر و زندهمانی سلولها مناسب هستند. این مطالعه به بررسی داربستهای کامپوزیتی جدید برای مهندسی بافت استخوان میپردازد که دارای فعالیت ضدباکتریایی و پتانسیل استخوانسازی بالایی هستند. این داربستها با آغشته شدن یونهای استرانسیوم و روی بهبود یافتهاند، اما عدم فعالیت ضدباکتریایی استرانسیوم و تأثیر منفی PLGA بر روی فعالیت ضدباکتریایی روی از معایب آنها به شمار میرود. برای بهینهسازی عملکرد، پیشنهاد میشود نسبت آغشتگی عناصر مورد بررسی قرار گیرد و تحقیقات بالینی برای ارزیابی ایمنی و کارایی این داربستها انجام شود. به طور کلی، این تحقیق نشاندهنده پیشرفتهای امیدوارکنندهای در مهندسی بافت استخوان است، اما نیاز به تحقیقات بیشتری برای تأیید کاربردهای بالینی آن دارد.
جدول 3: ترکیبهای خاص و نامگذاریهای مربوط به آنها.


شکل 14: (الف)شمارش واحدهای تشکیل کلونی پس از 24 ساعت کشت با داربستهای مختلف. (ب) سنجش MTT برای استئوبلاستهای کشت شده به مدت 2 و 7 روز بر روی داربستهای مختلف و سلولهای استخوانی RObکشتشده با شکل خاص ستارهای تا میلهای خود که با پیکان قرمز نشان داده شدهاند (72).
4.4. میکرو و نانوذرات کروی: میکروکرهها به عنوان یک وسیله انتقال ایده آل اغلب برای محصور کردن عوامل بیوشیمیایی برای القای تشکیل استخوان مورد استفاده قرار میگیرند. با توجه به رفتار تخریب سریع PLGA، بارگذاری میکروکرههای PLGA در داربستها نیز میتواند برای تخلخل استفاده شود، بنابراین سرعت تخریب کلی داربست بهبود مییابد و باعث ترمیم استخوانی و عروق میشود. در سال2021 فو ژن یوان و همکارانش (73) میکروکرههای حساس به ماورای صوت (MPs) را از پلی (لاکتاید-کو-گلایکولیک اسید) حاوی کارتوژنین (KGN) تولید کردند و سپس آنها را تحت تأثیر امواج فراصوت قرار دادند. در این تحقیق، هیدروژلهای کندرویتین سولفات با کربوکسیمتیل کیتوسان (CMC-OCS) برای ساخت داربستهای ترکیبی استفاده شد. تهیه میکروذرههای PLGA حاوی کارتوژنین (KGN) با استفاده از روش امولسیون روغن در آب (O/W) و ترکیب آن با اختلاط اولیه غشایی انجام شده است. ابتدا، PLGA و KGN در حلالی شامل دیکلرومتان و دیمتیل سولفوکسید حل شده و سپس، این محلول به آرامی به یک محلول آبی حاوی پلیوینیلالکل اضافه میشود تا یک امولسیون دوگانه اولیه ایجاد شود. این امولسیون سپس تحت فشار نیتروژن از طریق غشا چندین بار عبور داده میشود. میکروذرهها با استفاده از سانتریفیوژ جمعآوری شده، سه بار با آب مقطر شسته میشوند و سپس به روش انجمادی خشک (Lyophilization) میشوند. این فرآیند منجر به تولید میکروذرههای PLGA حاوی کارتوژنین میشود که برای کاربردهای دارورسانی طراحی شدهاند. ویژگیهایی مانند شکل ظاهری، خواص مکانیکی، تخلخل و سمیت سلولی این داربستها مورد بررسی قرار گرفت. نتایج نشان داد که میکروکرهها پس از تابش امواج فراصوت تغییرات قابل توجهی را تجربه کرده و میتوانند خواص مکانیکی هیدروژل را بهبود دهند. این مطالعه همچنین نشان داد که با برش دو هیدروژل کامل و اتصال دوباره آنها، قابلیت ترمیم هیدروژلهای آسیبدیده بهوضوح قابل مشاهده است (شکل15-الف). رهایش KGN از این میکروکرهها به آرامی انجام میشود و میتواند غلظت آن را برای حداقل 28 روز حفظ کند. آزمایشهای رئولوژیکی نشان داد که مدول ذخیرهسازی و مدول اتلاف در هیدروژلهای CMC-OCS و CMC-OCS@KGN در دامنه کرنش 0/01% تا 5% ثابت باقی ماند، اما با افزایش تغییر شکل، ساختار هیدروژلها آسیب دید. همچنین، نسبت تورم هیدروژل@MPs کمتر از سایر هیدروژلها بود و رفتار رهایش KGN در گروههای مختلف متفاوت بود؛ بهطوری که در گروه CMC-OCS@KGN رهایش ناگهانی بیشتری مشاهده شد (شکل 15-ب). چسبندگی بالای این مواد باعث میشود که اتصال آنها به سرعت انجام گیرد و یکپارچگی محل ترمیم را حتی در برابر کششهای خارجی حفظ کند، همچنین سازگاری داربستها با سلولها از طریق ارزیابی زندهمانی و تکثیر سلولها با استفاده از آزمایش CCK-8 و رنگآمیزی LIVE/DEAD بررسی شد (شکل 15-ج). نتایج نشان داد که نسبت زندهمانی سلولها در تمام گروهها بیش از 90% بود که نشاندهنده سازگاری خوب سلولی برای همه نوع داربستها و استفاده از ماورای صوت است. هیچ تفاوت معناداری بین چهار گروه مشاهده نشد و تکثیر سلولهای بنیادی مزانشیمی مغز استخوان خرگوش (rBMMSCs) روی داربستها نیز با روش CCK-8 بررسی شد. هدف اصلی این تحقیق رهایش کنترلشده دارو است، به طوری که پیشبینی شده هیدروژل دارای ویژگیهای رهایش سریع باشد در حالیکه میکروکرهها رهایش آهستهتری دارند. بهطور کلی، به دلیل بهبود خواص مکانیکی و توانایی رهایش پایدار KGN، این هیدروژل قابل تزریق با خاصیت حساس به ماورای صوت یک سیستم امیدوارکننده برای مهندسی بافت غضروف است. استفاده از میکروکرههای حاوی کارتوژنین و هیدروژلهای قابل تزریق تحت تأثیر امواج فراصوت مزایا و معایبی دارد. یکی از مشکلات، افزایش دما و آسیب به بافتهای اطراف ناشی از این امواج است. همچنین، فشار ناشی از امواج میتواند به ساختارهای داخلی آسیب برساند و فرآیند حفرهسازی ممکن است به سلولها آسیب بزند. کنترل رهایش دارو نیز در برخی موارد دشوار است. بهینهسازی این سیستم نیازمند تحقیقات بیشتر بر روی پارامترهای امواج فراصوت و آزمایشهای بالینی برای ارزیابی ایمنی و اثربخشی آن است. همچنین، ترکیب سایر داروها با هیدروژلها میتواند به افزایش کارایی درمانی کمک کند.

شکل 15: (الف) ظرفیت خود ترمیمی با برش هیدروژل و اتصال مجدد آنها به یکدیگر برای دستیابی به فصل مشترک بهبود یافته. (ب) نسبت تورم و نسبت تخریب سه داربست در زمانهای مختلف ورفتار رهایش تجمعی KGN (ج) سنجش سمیت سلولی و تکثیر سلولی در چهار گروه (73).
5.4. هیدوژلها: هیدروژلها شبکههای ویسکوالاستیک آبدوست هستند که از هموپلیمرها یا کوپلیمرها تشکیل شده و میتوانند به محرکهای محیطی مانند دما و pH پاسخ دهند. این ویژگیها هیدروژلها را برای درمانهای غیرجراحی و کمتهاجمی مناسب میسازد. در سالهای اخیر، هیدروژلهای چندمنظوره برای کاربردهای زیستپزشکی مانند تحویل دارو و مهندسی بافت توسعه یافتهاند. هیدروژلهای مورد استفاده در مهندسی بافت استخوان شامل هیالورونیک اسید، آلژینات و پلی اتیلن گلیکول (PEG) هستند. PLGA به عنوان یک پلیمر زیستی تأیید شده، معمولاً با PEG کوپلیمریزه میشود تا ژلهای حرارتی تشکیل دهد. این بخش بر کاربرد هیدروژلهای مبتنی بر PLGA در مهندسی بافت استخوان تمرکز دارد. بائومینگ یوان و همکارانش در سال 2022 (74) بررسی کردند که آیا پلیمر سه بلوک PLGA-PEG-PLGA حساس به دما میتواند نیازهای درمانی برای استئومیلیت را برآورده کند یا خیر و هچنین بهطور خاص، اثرات مخلوط کردن وانکومایسین، هیدروکسی آپاتایت و پلیمر سهبلوک PLGA-PEG-PLGA حساس به دما در یک محلول آبی بر ویژگیهای هیدروژل حاصل و قابلیت آن در درمان استئومیلیت مورد ارزیابی قرار گرفت. آنها هیدروژل حرارتی وانکومایسین PLGA-PEG-PLGA/ هیدروکسی آپاتایت را با نسبت LA/GA برابر ۱۵:۱ تهیه و مشخصهیابی کردند. ویژگیهای رئولوژیکی، خواص انتقال فاز محلول به ژل و مقدار غلظت بحرانی مایسل ترکیب PLGA-PEG-PLGA/HA تأیید کرد که این سیستم انتقال فاز حرارتی حساس به دما را تجربه میکند. همچنین، HA در ترکیب باعث افزایش مدول ذخیره و بهبود سازگاری سمیت سلولی میشود. مقدار CMC با رسم نسبت شدت فلورسانس و لگاریتم غلظت محاسبه شد. مقدار CMC برای کوپلیمر PLGA-PEG-PLGA حدود 1/75 میلیگرم بر میلیلیتر بود، در حالی که برای ترکیب PLGA-PEG-PLGA/HA این مقدار تقریباً 1/28 میلیگرم بر میلیلیتر بود. CMC کمی پایینتر در ترکیب نشان میدهد که HA تأثیر کمی بر رفتار خودآرایی PLGA-PEG-PLGA دارد و همچنین دمای ژلسازی را هنگام افزودن HA به کوپلیمر کاهش میدهد. تخریب هیدروژل ترکیبی در شرایط آزمایشگاهی شبیهسازی شده نشان داده است که هیدروژلهای پلیمری و ترکیبی پس از 33 روز بیش از 90% تخریب شدند (شکل 16-الف). پس از چهار هفته، میزان عفونت استخوان درشت نی (تیبیا) موشها در دو گروه درمانی کنترل شد و مقداری بهبود در استخوان مشاهده شد. با اینحال، ناحیه نقص استخوان در گروه درمانی وانکومایسینPLGA-PEG-PLGA بزرگتر از گروه وانکومایسین PLGA-PEG-PLGA/HA بود. بعد از ۸ هفته، هیچ نشانهای از عود عفونت استخوان تیبیا وجود نداشت. در هر دو گروه، اندازه نقص استخوان در ۸ هفته کوچکتر از ۴ هفته بعد از عمل بود که نشاندهنده پیشرفت در روند بهبود استخوان است. با اینحال، ناحیه نقص استخوان هنوز در گروه وانکومایسینPLGA-PEG-PLGA/HA کوچکتر از گروه وانکومایسینPLGA-PEG-PLGA بود (شکل 16-ب). نتایج ارزیابی تخریب درون تنی این هیدروژلها نیز نشان داده است که، ژل به تدریج در بافتهای رتها تخریب شده و در هفته پنجم بهطور کامل از بین رفته است، که نشان میدهد نرخ تخریب درونتنی بیشتر از نرخ تخریب در شرایط آزمایشگاهی بود (شکل 16-ج). نتایج هر دو نوع آزمایش تخریبپذیری تأیید کردند که این ترکیب خواص زیستتخریبپذیری خوبی دارد. همچنین، با توجه به زمان تخریب ژل (1 ماه) و زمان ترمیم استخوان (3 ماه)، ژل مانع فیزیکی برای فرآیند ترمیم استخوان نخواهد بود. نتایج رنگآمیزی HE و Masson از نمونههای استخوان در هر گروه را در هفتههای ۴ و ۸ نشان میدهد. در گروه کنترل، تعداد زیادی سلول التهابی به بافت استخوانی نفوذ کردند و در هفته ۸ هیچ بهبودی در پاسخ التهابی مشاهده نشد اما در گروههای حاوی کوپلیمر و ترکیب با وانکومایسین، فقط تعداد کمی سلول التهابی در هفته ۴ دیده شد که نشاندهنده کنترل عفونت است. همچنین، در هفته ۸ هیچ نشانهای از عود عفونت وجود نداشت که نشان میدهد اثر ضدعفونیکننده ترکیب حاوی وانکومایسین خوب بوده است (شکل 16-د). استئومیلیت یک عفونت استخوانی است که درمان آن دشوار است. برای درمان این بیماری، نیاز به کنترل عفونت و حذف بافتهای مرده وجود دارد، اما عوارض جانبی و مقاومت دارویی آنتیبیوتیکهای سیستمیک، استفاده از روشهای تحویل داروی موضعی را ضروری کرده است. سیمان استخوانی بارگذاری شده با آنتیبیوتیک به عنوان روش اصلی درمان شناخته میشود، اما این روش معایب خاص خود را دارد. به همین دلیل، از پلیمر کوپلیمر PLGA-PEG-PLGA با خواص ژلسازی حرارتی به عنوان حامل داروی آزادسازی پایدار استفاده شد. در سال 2020 سید محمد دواچی و همکارانش (75)، در مطالعه خود به درمان سینوزیت مزمن با استفاده از هیدروژلهای حاوی دارو پرداختند. یکی از روشهای مؤثر برای درمان این بیماری، استفاده از هیدروژلهایی است که داروها را به آرامی آزاد میکنند. در ابتدا، میکرو و نانوذراتی از (PLGA) بارگذاری شده با دگزامتازون (DEX) تهیه و مشخصهیابی شدند. تهیه نانوذرات PLGA بارگذاری شده با دگزامتازون با استفاده از روش امولسیون- نفوذ انجام شده است. ابتدا، پلیوینیل الکل در آب حل میشود و سپس دگزامتازون و PLGA در حلالهای مختلف حل شده و به محلول PVA اضافه میشوند. پس از ایجاد امولسیون و حذف حلالها، نانوذرات جدا و شسته میشوند. در نهایت، نانوذرات منجمد و خشک شده و در دمای ℃20- نگهداری میشوند. تهیه میکروذرات PLGA بارگذاری شده با دگزامتازون با استفاده از روش امولسیون روغن در آب و تبخیر حلال انجام میشود. دگزامتازون و PLGA در حلالهای مختلف حل شده و به محلول پلیوینیل الکل اضافه میشوند. مخلوط به مدت 60 دقیقه با همزن مغناطیسی هم زده میشود و سپس حلالها تبخیر میشوند. میکروذرات پس از سانتریفیوژ جدا و شسته شده، منجمد و در دمای ℃20- نگهداری میشوند. اندازه ذرات PLGA بارگذاری شده با دگزامتازون با استفاده از (SEM) بررسی شده است و نشان میدهد که ذرات کرهای و یکنواخت هستند. اندازه متوسط ذرات میکرو و نانو به ترتیب 2/02 میکرومتر و 105 نانومتر است (شکل 17-الف). نتایج نشان داد که نانوذرات دگزامتازون را در مدت 7 روز و میکروذرات آن را در مدت 22 روز آزاد میکنند (شکل 17-ب). به دلیل آزادسازی کندتر، میکروذرات PLGA بارگذاری شده با دگزامتازون برای این مطالعه انتخاب شدند. سپس، هیدروژلهایی بر پایه کیتوسان و پلیوینیلپیرولیدون (PVP) با نسبتهای وزنی مختلف تهیه شد و ساختار میکروذرات PLGA بهینهسازی شد. بررسیها نشان داد که میکروذرات به طور یکنواخت در هیدروژلها پراکنده شدهاند. هیدروژلهای حاصل دارای ویژگیهای مناسبی مانند استحکام مکانیکی خوب، ساختار متخلخل و فعالیت ضدباکتریایی بودند. همچنین، آزمایشها نشان دادند که این هیدروژلها بر روی سلولها اثر منفی ندارند و در هیدروژل با بالاترین محتوای PVP، 80% دارو پس از 30 روز آزاد شد. این هیدروژل به عنوان یک گزینه مناسب برای درمان سینوزیت مزمن و رینیت (Rhinitis) آلرژیک معرفی شده است. در سال 2022 پریسا قندفروشان و همکارانش (76)، به توسعه یک هیدروژل نانوکامپوزیتی برای ترمیم غضروف پرداختند. این هیدروژل از ژلاتین طبیعی و کوپلیمر PLGA-PEG-PLGAتشکیل شده است و با فاکتور رشد تبدیلکننده بتا-1 (TGF-β1) بارگیری شده است. هدف از این کار بهبود چسبندگی، زندهمانی و تمایز سلولی سلولهای بنیادی پالپ دندان انسان (hDPSCs) برای ترمیم غضروف است. از میکروسکوپ الکترونی روبشی برای بررسی اندازه و مورفولوژی ذرات و هیدروژل استفاده شده است. این هیدروژل دارای ساختار متخلخل با ابعاد منافذ حدود 202 میکرومتر است. در 9 روز اول، آزادسازی TGF- β1 از هر دو نانوذرات و هیدروژل به خوبی انجام شد. در انتهای 21 روز، آزادسازی TGF-β1 به ترتیب به 78% و 75% برای نانوذرات PLGA-PEG-PLGA و هیدروژل ژلاتین / PLGA -PEG- PLGA رسید. یکی از مشخصه های مهم هیدروژلها بتوانایی جذب آب میباشد، زیرا بافت غضروف طبیعی حدود 70-85 % وزن خود را آب تشکیل میدهد. جذب آب هیدروژلهای نانوکامپوزیتی در محیط PBS به مدت 120 ساعت بررسی شد. نتایج نشان داد که هیدروژلهای حاوی ژلاتین و PEG به دلیل ماهیت آبدوستی خود، جذب آب بالاتری دارند. افزودن نانوذرات PLGA-PEG- PLGA به هیدروژل ژلاتین باعث کاهش جذب آب شد، زیرا نانوذرات به عنوان پرکننده عمل میکنند و ساختار منافذ را متراکمتر میکنند. تجزیه هیدروژلهای ژلاتین، PLGA-PEG-PLGA و ژلاتین / PLGA-PEG-PLGA به مدت سه هفته در شرایط آزمایشگاهی بررسی شد. نتایج نشان داد که هیدروژلهای نانوکامپوزیتی از دست دادن وزن متوسطی در طول زمان داشتند (شکل 18-الف). بررسی چسبندگی و رشد سلولهای بنیادی پالپ دندان انسان (hDPSCs) بر روی هیدروژل نانوکامپوزیتی نشان داد که h-DPSCs به خوبی به هیدروژل چسبیدهاند و با هم در ارتباط هستند و منافذ هیدروژل نیز با سلولها پر شده است (شکل 18-ب). بهصورت کلی یافتهها نشان داد که هیدروژل نانوکامپوزیتی ژلاتین / PLGA-PEG-PLGA-TGF-β1 چسبندگی، زندهمانی و تمایز غضروفی سلولهای hDPSC را بهبود میبخشد. این هیدروژل میتواند پایهای برای استراتژیهای جدید و مؤثر برای درمان آسیبهای غضروف باشد.

شکل16: (الف) منحنی تغییرات نسبت شدت فلورانس(I338/I336) با غلظت برای دو ترکیب و آزمون تخریب آزمایشگاهی دو ترکیب. (ب) عکسهای بهبود نقص استخوان تیبیا در موش صحرایی پس از 4 هفته و 8 هفته درمان. (ج) آزمون تخریب درونتنی با گذر زمان. (د) نتایج HE و Masson گروههای مختلف پس از 4 هفته و 8 هفته دبریدمان (74).

شکل 17: (الف) تصاویر SEM از (a) میکروذرات PLGADEX (b) نانوذرات PLGADEX. (ب) رهایش دگزامتازون در 7/4 PH = و دمای ℃37 برای میکروذرات PLGADEX و نانوذرات PLGADEX (75).

شکل 18: (الف) رهایش TGF-β1 برای نانوذرات PLGA-PEG-PLGA و هیدروژل ژلاتین / PLGA -PEG- PLGA و رفتار تورم داربست ها و تجزیه هیدروژلهای ژلاتین. (ب) تصاویر میکروسکوپ الکترونی روبشی از سلولهای hDPSCs پس از 14روز (a,b) و 18 روز (c,d) کشت روی هیدروژل ژلاتین / PLGA-PEG-PLGA-TGF-β1 (76).
نتیجهگیری
این مقاله به بررسی پتانسیل (پلی لاکتیک-کو-گلایکولیک اسید) در مهندسی بافت استخوان میپردازد و بر ویژگیهای زیستی و قابلیت تنظیم تخریب آن تأکید میکند. PLGA به اشکال مختلفی مانند داربستها، الیاف، هیدروژلها و میکروکرهها تقسیمبندی شده است. این پلیمر به عنوان یکی از مهمترین پلیمرهایزیستی در مهندسی بافت استخوان، به دلیل خواص منحصر به فرد خود، مورد توجه ویژهای قرار دارد. PLGA که از ترکیب دو مونومر لاکتیکاسید و گلایکولیک اسید تشکیل شده است، به دلیل قابلیت تخریبپذیری زیستی و سازگاری با بافتهای انسانی، در زمینههای مختلف پزشکی کاربرد دارد. سنتز PLGA معمولاً به دو روش اصلی انجام میشود: پلیمریزاسیون تراکمی و پلیمریزاسیون حلقه گشا که به دلیل نسبتهای مختلف ترکیبی از لاکتیک اسید و گلایکولیک اسید، این پلیمر خواص مکانیکی متنوعی دارد. این پلیمر میتواند به گونهای طراحی شود که زمان تخریب آن در بدن از چند هفته تا چند سال متغیر باشد. این ویژگی به پژوهشگران اجازه میدهد تا داربستهایی برای ترمیم بافتها ایجاد کنند که به تدریج تخریب شده و جای خود را به بافت جدید بدهند و به دلیل همین قابلیت، استفاده از PLGA در مهندسی بافت و همچنین توانایی آن در تحریک رشد سلولهای استخوانی بسیار مورد توجه قرار گرفته است. این پلیمر میتواند به عنوان داربست برای رشد سلولهای استخوانی عمل کند و با فراهم کردن محیطی مناسب، باعث تسریع فرآیند ترمیم استخوانها شود. علاوه بر این، PLGA میتواند به عنوان حامل داروهای مختلف نیز مورد استفاده قرار گیرد، که این امر به طور خاص در درمان بیماریها و آسیبهای استخوانی اهمیت دارد. با توجه به اینکه PLGA قابلیت کنترل رهایش دارو را دارد، میتواند به عنوان یک سیستم تحویل دارویی مؤثر عمل کند. پلیمر PLGA، علاوه بر مزایای بررسی شده در این مطالعه، دارای نقاط ضعفی نیز میباشد. از جمله معایب این پلیمر میتوان به خشک و شکننده بودن آن اشاره کرد که استفاده از آن را بیشتر در زمینههای مهندسی محدود میکند. با توجه به قیمت بالای این پلیمر، فرآیند تولید و در نتیجه محصولات و تجهیزات حاصل از آن نیز گرانقیمت هستند. پلیمر PLGA به دلیل تخریبپذیر بودن، شرایط نگهداری خاص و سختی دارد و حتی در شرایط مناسب، با گذشت زمان دچار تخریب شده و خواص اولیه خود را از دست میدهد. بنابراین، استفاده از این پلیمر در شرایط بهینه توصیه میشود.دستیابی به وزن مولکولی بسیار بالا در این پلیمر دشوار است و وجود ناخالصی در روش پلیمریزاسیون حلقهگشا میتواند مانع رسیدن به وزن مولکولی بالا شود. بهطور کلی، وزن مولکولی 50000 گرم بر مول، حداکثر وزن مولکولی برای PLGA است که به صورت تجاری در دسترس است. به منظور افزایش وزن مولکولی، پیشنهاد میشود که این پلیمر با گروههای ایزوسیانات واکنش داده و پلییورتانهایی بر پایه PLGA سنتز شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Zhu W, Li C, Yao M, Wang X, Wang J, Zhang W, et al. Advances in Osseointegration of Biomimetic Mineralized Collagen and Inorganic Metal Elements of Natural Bone for Bone Repair. Regen Biomater 2023; 10: rbad030.
2- Megafu M, Megafu E, Mian H, Singhal S, Lee A, Gladstone JN, et al. Fragile Statistical Findings in Randomized Controlled Trials Evaluating Autograft Versus Allograft Use in Anterior Cruciate Ligament Reconstruction: A Systematic Review. Arthroscopy 2024; 40(3):1009-18.
3- Finze R, Laubach M, Russo Serafini M, Kneser U, Medeiros Savi F. Histological and Immunohistochemical Characterization of Osteoimmunological Processes in Scaffold-Guided Bone Regeneration in an Ovine Large Segmental Defect Model. Biomedicines 2023; 11(10): 2781.
4- Nasiri-Tabrizi B, Basirun WJ, Yeong CH, Thein WM. Development of the Third Generation of Bioceramics: Doping Hydroxyapatite with S-, P-, D-, and F-Blocks Cations and their Potential Applications in Bone Regeneration and Void Filling. Ceramics International 2023; 49(5): 7142-79.
5- Szwed-Georgiou A, Płociński P, Kupikowska-Stobba B, Urbaniak MM, Rusek-Wala P, Szustakiewicz K, et al. Bioactive Materials for Bone Regeneration: Biomolecules and Delivery Systems. ACS Biomaterials Science & Engineering 2023; 9(9): 5222-54.
6- Shahrousvand M, Sadeghi GMM, Shahrousvand E, Ghollasi M, Salimi A. Superficial Physicochemical Properties of Polyurethane Biomaterials as Osteogenic Regulators in Human Mesenchymal Stem Cells Fates. Colloids and Surfaces B: Biointerfaces 2017; 156: 292-304.
7- Yadav S, Khan J, Yadav A. Applications of Scaffolds in Tissue Engineering: Current Utilization and Future Prospective. Current Gene Therapy 2024; 24(2): 94-109.
8- Shahrousvand M, Ghollasi M, Zarchi AAK, Salimi A. Osteogenic Differentiation of Hmscs on Semi-Interpenetrating Polymer Networks of Polyurethane/Poly (2‑Hydroxyethyl Methacrylate)/Cellulose Nanowhisker Scaffolds. Int J Biol Macromol 2019; 138: 262-71.
9- Garner J, Skidmore S, Overdorf G, Hadar J, Park H, Park K, et al. A New Analytical Method for Quantifying Acid-End-Cap PLGA in Sub-Milligram Quantities. Mol Pharm 2024; 22(1): 446-58.
10- Yeo YH, Jo SK, Kim MH, Lee SJ, Han SY, Park MH, et al. Fabrication of Atelocollagen-Coated Bioabsorbable Suture and the Evaluation of Its Regenerative Efficacy in Achilles’ Tendon Healing Using a Rat Experimental Model. Int J Biol Macromol 2024; 271: 132564.
11- Shafiee K, Bazraei S, Mashak A, Mobedi H. The Impact of Temperature on the Formation, Release Mechanism, and Degradation of PLGA-based In-Situ Forming Implants. Journal of Polymers and the Environment 2024: 32: 3591-608.
12- Shanmugavadivu A, Lavanya K, Selvamurugan N. Nanomaterials in Bone Tissue Engineering. Handbook of Nanomaterials, Volume 2: Elsevier; 2024; 321-57.
13- Hao L, Jiang Y, Zhang R, Zhang N, Yang Y, Gao Y, et al. Preparation and in Vivo/In Vitro Characterization of Ticagrelor PLGA Sustained-Release Microspheres for Injection. Designed Monomers and Polymers 2021; 24(1): 305-19.
14- Jem KJ, van der Pol JF, de Vos S. Microbial Lactic Acid, Its Polymer Poly (Lactic Acid), and their Industrial Applications. Plastics From Bacteria: Natural Functions and Applications 2010: 323-46.
15- Cunha B, Bahú J, Xavier L, Crivellin S, de Souza S, Lodi L, et al. Filho, RM; Schiavon, MIRB; Concha, VOC; et al. Lactide: Production Routes, Properties, and Applications. Bioengineering 2022, 9, 164. s Note: MDPI stays neutral with regard to jurisdictional claims in published …; 2022.
16- Van Wouwe P, Dusselier M, Vanleeuw E, Sels B. Lactide Synthesis and Chirality Control for Polylactic Acid Production. ChemSusChem 2016; 9(9): 907-21.
17- Yunhai S, Houyong S, Deming L, Qinghua L, Dexing C, Yongchuan Z. Separation of Glycolic Acid From Glycolonitrile Hydrolysate by Reactive Extraction with Tri-N-Octylamine. Separation and Purification Technology 2006; 49(1): 20-6.
18- Nancucheo I, Johnson DB. Production of Glycolic Acid by Chemolithotrophic Iron-And Sulfur-Oxidizing Bacteria and Its Role in Delineating and Sustaining Acidophilic Sulfide Mineral-Oxidizing Consortia. Applied and Environmental Microbiology 2010; 76(2): 461-7.
19- Schmitt EE, Epstein M, Polistina RA. Alpha-Glycolide and Methods for the Isolation Thereof. Google Patents; 1969.
20- Higgins N. Condensation Polymers of Hydroxyacetic Acid. US Patent 1950; 8.
21- Takahashi K, Taniguchi I, Miyamoto M, Kimura Y. Melt/Solid Polycondensation of Glycolic Acid to Obtain High-Molecular-Weight Poly (Glycolic Acid). Polymer 2000; 41(24): 8725-8.
22- Chabot F, Vert M, Chapelle S, Granger P. Configurational structures of lactic acid stereocopolymers as determined by 13C{1H} nmr. Polymer 1983; 24(1): 53-9.
23- Gilding D, Reed A. Biodegradable Polymers for Use in Surgery—Polyglycolic/Poly (Actic Acid) Homo-And Copolymers: 1. Polymer 1979; 20(12): 1459-64.
24- Jin S, Xia X, Huang J, Yuan C, Zuo Y, Li Y, et al. Recent Advances in PLGA-Based Biomaterials for Bone Tissue Regeneration. Acta Biomaterialia 2021; 127: 56-79.
25- Makadia HK, Siegel SJ. Poly Lactic-Co-Glycolic Acid (PLGA) as Biodegradable Controlled Drug Delivery Carrier. Polymers 2011; 3(3): 1377-97.
26- Houchin M, Topp E. Physical Properties of PLGA Films during Polymer Degradation. Journal of Applied Polymer Science 2009; 114(5): 2848-54.
27- Martins C, Sousa F, Araujo F, Sarmento B. Functionalizing PLGA and PLGA Derivatives for Drug Delivery and Tissue Regeneration Applications. Advanced Healthcare Materials 2018; 7(1): 1701035.
28- Machatschek R, Lendlein A. Fundamental Insights in PLGA Degradation from Thin Film Studies. Journal of Controlled Release 2020; 319: 276-84.
29- Villemin E, Ong YC, Thomas CM, Gasser G. Polymer Encapsulation of Ruthenium Complexes for Biological and Medicinal Applications. Nature Reviews Chemistry 2019; 3(4): 261-82.
30- Nowalk JA, Swisher JH, Meyer TY. Influence of Short-Range Scrambling of Monomer Order on the Hydrolysis Behaviors of Sequenced Degradable Polyesters. Macromolecules 2019; 52(12): 4694-702.
31- Danhier F, Ansorena E, Silva JM, Coco R, Le Breton A, Préat V. PLGA-Based Nanoparticles: An Overview of Biomedical Applications. Journal of Controlled Release 2012; 161(2): 505-22.
32- Go EJ, Kang EY, Lee SK, Park S, Kim JH, Park W, et al. An Osteoconductive PLGA Scaffold with Bioactive Β-TCP and Anti-Inflammatory Mg (OH) 2 To Improve in Vivo Bone Regeneration. Biomaterials Science 2020; 8(3): 937-48.
33- Engineer C, Parikh J, Raval A. Review on Hydrolytic Degradation Behavior of Biodegradable Polymers from Controlled Drug Delivery System. Trends In Biomaterials & Artificial Organs 2011; 25(2).
34- Wu XS, Wang N. Synthesis, Characterization, Biodegradation, and Drug Delivery Application of Biodegradable Lactic/Glycolic Acid Polymers. Part II: Biodegradation. J Biomater Sci Polym Ed 2001; 12(1): 21-34.
35- Sharma U, Concagh D, Core L, Kuang Y, You C, Pham Q, et al. The Development of Bioresorbable Composite Polymeric Implants with High Mechanical Strength. Nature Materials 2018; 17(1): 96-103.
36- Keles H, Naylor A, Clegg F, Sammon C. Investigation of Factors Influencing the Hydrolytic Degradation of Single PLGA Microparticles. Polymer Degradation and Stability 2015; 119: 228-41.
37- Shin HJ, Lee CH, Cho IH, Kim YJ, Lee YJ, Kim IA, et al. Electrospun PLGA Nanofiber Scaffolds for Articular Cartilage Reconstruction: Mechanical Stability, Degradation and Cellular Responses Under Mechanical Stimulation In Vitro. Journal of Biomaterials Science, Polymer Edition 2006; 17(1-2): 103-19.
38- Washington MA, Swiner DJ, Bell KR, Fedorchak MV, Little SR, Meyer TY. The Impact of Monomer Sequence and Stereochemistry on the Swelling and Erosion of Biodegradable Poly (Lactic-Co-Glycolic Acid) Matrices. Biomaterials 2017; 117: 66-76.
39- Li J, Rothstein SN, Little SR, Edenborn HM, Meyer TY. The Effect of Monomer Order on the Hydrolysis of Biodegradable Poly (Lactic-Co-Glycolic Acid) Repeating Sequence Copolymers. J American Chem Society 2012; 134(39): 16352-9.
40- Samadi N, Abbadessa A, Di Stefano A, Van Nostrum C, Vermonden T, Rahimian S, et al. The Effect of Lauryl Capping Group on Protein Release and Degradation of Poly (D, L-Lactic-Co-Glycolic Acid) Particles. J Controlled Release 2013; 172(2): 436-43.
41- Lanao RF, Leeuwenburgh S, Wolke J, Jansen J. In Vitro Degradation Rate of Apatitic Calcium Phosphate Cement with Incorporated PLGA Microspheres. Acta Biomaterialia 2011; 7(9): 3459-68.
42- Lanao RPF, Leeuwenburgh SC, Wolke JG, Jansen JA. Bone Response to Fast-Degrading, Injectable Calcium Phosphate Cements Containing PLGA Microparticles. Biomaterials 2011; 32(34): 8839-47.
43- Wang J, Helder L, Shao J, Jansen JA, Yang M, Yang F. Encapsulation and Release of Doxycycline from Electrospray-Generated PLGA Microspheres: Effect Of Polymer End Groups. International J Pharmaceutics 2019; 564: 1-9.
44- Grayson ACR, Cima MJ, Langer R. Size and Temperature Effects on Poly (Lactic-Co-Glycolic Acid) Degradation and Microreservoir Device Performance. Biomaterials 2005; 26(14): 2137-45.
45- D’Souza S, Faraj JA, Dorati R, DeLuca PP. Enhanced Degradation of Lactide‐co‐Glycolide Polymer with Basic Nucleophilic Drugs. Advances in Pharmaceutics 2015; 2015(1): 154239.
46- Zolnik BS, Burgess DJ. Effect of Acidic Ph on PLGA Microsphere Degradation and Release. Journal of Controlled Release 2007; 122(3): 338-44.
47- Biondi M, Ungaro F, Quaglia F, Netti PA. Controlled Drug Delivery in Tissue Engineering. Advanced Drug Delivery Rev 2008; 60(2): 229-42.
48- Deshpande AA, Heller J, Gurny R. Bioerodible Polymers for Ocular Drug Delivery. Critical Reviews™ in Therapeutic Drug Carrier Systems 1998; 15(4).
49- Acton QA. Boron Compounds—Advances in Research and Application: Scholarly Editions. ScholarlyEditions, Atlanta, GA, USA 2013.
50- Astete CE, Sabliov CM. Synthesis and characterization of PLGA nanoparticles. J Biomaterials Science, Polymer Edition 2006; 17(3): 247-89.
51- Hwang NS, Varghese S, Elisseeff J. Controlled Differentiation of Stem Cells. Advanced Drug Delivery Reviews 2008; 60(2): 199-214.
52- Khatri K, Goyal AK, Vyas SP. Potential of Nanocarriers in Genetic Immunization. Recent Patents on Drug Delivery & Formulation 2008; 2(1): 68-82.
53- Gupta A, Kumar V. New Emerging Trends in Synthetic Biodegradable Polymers–Polylactide: A Critique. European Polymer J 2007; 43(10): 4053-74.
54- Chaubal M. Polylactides/Glycolides-Excipients for Injectable Drug Delivery and Beyond. Drug Deliv Technol 2002; 2: 34-6.
55- Shi D, Xu X, Ye Y, Song K, Cheng Y, Di J, et al. Photo-Cross-Linked Scaffold with Kartogenin-Encapsulated Nanoparticles for Cartilage Regeneration. ACS Nano 2016; 10(1): 1292-9.
56- Huling J, Ko IK, Atala A, Yoo JJ. Fabrication of Biomimetic Vascular Scaffolds for 3D Tissue Constructs Using Vascular Corrosion Casts. Acta biomaterialia 2016; 32: 190-7.
57- Cai G, Liu W, He Y, Huang J, Duan L, Xiong J, Et Al. Recent Advances in Kartogenin for Cartilage Regeneration. Journal Of Drug Targeting 2019; 27(1): 28-32.
58- Wang C, Yue H, Huang W, Lin X, Xie X, He Z, et al. Cryogenic 3D Printing of Heterogeneous Scaffolds with Gradient Mechanical Strengths and Spatial Delivery of Osteogenic Peptide/TGF-Β1 for Osteochondral Tissue Regeneration. Biofabrication 2020; 12(2): 025030.
59- Lee K, Chen Y, Li X, Wang Y, Kawazoe N, Yang Y, et al. Solution Viscosity Regulates Chondrocyte Proliferation and Phenotype During 3D Culture. Journal of Materials Chemistry B 2019; 7(48): 7713-22.
60- Duan P, Pan Z, Cao L, Gao J, Yao H, Liu X, et al. Restoration of Osteochondral Defects by Implanting Bilayered Poly (Lactide-Co-Glycolide) Porous Scaffolds in Rabbit Joints for 12 and 24 Weeks. Journal of Orthopaedic Translation 2019; 19: 68-80.
61- Li Y, Liu Y, Xun X, Zhang W, Xu Y, Gu D. Three-Dimensional Porous Scaffolds with Biomimetic Microarchitecture and Bioactivity for Cartilage Tissue Engineering. ACS Applied Materials & Interfaces 2019; 11(40): 36359-70.
62- Bazgir M, Zhang W, Zhang X, Elies J, Saeinasab M, Coates P, et al. Degradation and Characterisation of Electrospun Polycaprolactone (PCL) and Poly (Lactic-Co-Glycolic Acid)(PLGA) Scaffolds For Vascular Tissue Engineering. Materials 2021; 14(17): 4773.
63- Norouzi M, Rafienia M, Hosseini S. Characterization and Biological Evaluation of New PLGA/Fibrin/Lignin Biocomposite Electrospun Scaffolds. Physica Scripta 2023; 98(9): 095506.
64- Guzmán-Soria A, Moreno-Serna V, Canales DA, García-Herrera C, Zapata PA, Orihuela PA. Effect of Electrospun PLGA/Collagen Scaffolds on Cell Adhesion, Viability, and Collagen Release: Potential Applications in Tissue Engineering. Polymers 2023; 15(5): 1079.
65- Pandey G, Pandey P, Arya DK, Kanaujiya S, Kapoor DD, Gupta RK, et al. Multilayered Nanofibrous Scaffold of Polyvinyl Alcohol/Gelatin/Poly (Lactic-Co-Glycolic Acid) Enriched with Hemostatic/Antibacterial Agents for Rapid Acute Hemostatic Wound Healing. International J Pharmaceutics 2023; 638: 122918.
66- Babilotte J, Martin B, Guduric V, Bareille R, Agniel R, Roques S, et al. Development and Characterization of a PLGA-HA Composite Material to Fabricate 3D-Printed Scaffolds for Bone Tissue Engineering. Materials Science and Engineering: C 2021; 118: 111334.
67- Gradwohl M, Chai F, Payen J, Guerreschi P, Marchetti P, Blanchemain N. Effects of Two Melt Extrusion Based Additive Manufacturing Technologies and Common Sterilization Methods on the Properties of a Medical Grade PLGA Copolymer. Polymers (basel) 13; 572: 2021.
68- Liu T, Li Z, Zhao L, Chen Z, Lin Z, Li B, et al. Customized Design 3D Printed PLGA/Calcium Sulfate Scaffold Enhances Mechanical And Biological Properties For Bone Regeneration. Frontiers in Bioengineering and Biotechnology 2022; 10: 874931.
69- Liu Z, Ramakrishna S, Ahmed I, Rudd C, Liu X. Rheological, Surface Tension and Conductivity Insights on the Electrospinnability of Poly (lactic-co-glycolic acid)-hyaluronic Acid Solutions and their Correlations with the Nanofiber Morphological Characteristics. Polymers 2022; 14(20): 4411.
70- Putri NRE, Wang X, Chen Y, Li X, Kawazoe N, Chen G. Preparation of PLGA-Collagen Hybrid Scaffolds with Controlled Pore Structures for Cartilage Tissue Engineering. Progress in Natural Science: Materials International 2020; 30(5): 642-50.
71- Xie Y, Lee K, Wang X, Yoshitomi T, Kawazoe N, Yang Y, et al. Interconnected Collagen Porous Scaffolds Prepared with Sacrificial PLGA Sponge Templates for Cartilage Tissue Engineering. Journal of Materials Chemistry B 2021; 9(40): 8491-500.
72- Hassan M, Khaleel A, Karam SM, Al-Marzouqi AH, Ur Rehman I, Mohsin S. Bacterial Inhibition and Osteogenic Potentials of Sr/Zn Co-Doped Nano-Hydroxyapatite-PLGA Composite Scaffold for Bone Tissue Engineering Applications. Polymers 2023; 15(6): 1370.
73- Yuan F-Z, Wang H-F, Guan J, Fu J-N, Yang M, Zhang J-Y, et al. Fabrication Of Injectable Chitosan-Chondroitin Sulfate Hydrogel Embedding Kartogenin-Loaded Microspheres As An Ultrasound-Triggered Drug Delivery System For Cartilage Tissue Engineering. Pharmaceutics 2021; 13(9): 1487.
74- Yuan B, Zhang Y, Wang Q, Ren G, Wang Y, Zhou S, et al. Thermosensitive Vancomycin@ PLGA-PEG-PLGA/HA Hydrogel as an All-In-One Treatment for Osteomyelitis. Int J Pharm 2022; 627: 122225.
75- Garakani SS, Davachi SM, Bagher Z, Esfahani AH, Jenabi N, Atoufi Z, et al. Fabrication of Chitosan/Polyvinylpyrrolidone Hydrogel Scaffolds Containing PLGA Microparticles Loaded with Dexamethasone for Biomedical Applications. Int J Biol Macro 2020; 164: 356-70.
76- Ghandforoushan P, Hanaee J, Aghazadeh Z, Samiei M, Navali AM, Khatibi A, et al. Novel Nanocomposite Scaffold Based on Gelatin/PLGA-PEG-PLGA Hydrogels Embedded with TGF-Β1 for Chondrogenic Differentiation of Human Dental Pulp Stem Cells in Vitro. International Journal of Biological Macromol 2022; 201: 270-87.
2- Megafu M, Megafu E, Mian H, Singhal S, Lee A, Gladstone JN, et al. Fragile Statistical Findings in Randomized Controlled Trials Evaluating Autograft Versus Allograft Use in Anterior Cruciate Ligament Reconstruction: A Systematic Review. Arthroscopy 2024; 40(3):1009-18.
3- Finze R, Laubach M, Russo Serafini M, Kneser U, Medeiros Savi F. Histological and Immunohistochemical Characterization of Osteoimmunological Processes in Scaffold-Guided Bone Regeneration in an Ovine Large Segmental Defect Model. Biomedicines 2023; 11(10): 2781.
4- Nasiri-Tabrizi B, Basirun WJ, Yeong CH, Thein WM. Development of the Third Generation of Bioceramics: Doping Hydroxyapatite with S-, P-, D-, and F-Blocks Cations and their Potential Applications in Bone Regeneration and Void Filling. Ceramics International 2023; 49(5): 7142-79.
5- Szwed-Georgiou A, Płociński P, Kupikowska-Stobba B, Urbaniak MM, Rusek-Wala P, Szustakiewicz K, et al. Bioactive Materials for Bone Regeneration: Biomolecules and Delivery Systems. ACS Biomaterials Science & Engineering 2023; 9(9): 5222-54.
6- Shahrousvand M, Sadeghi GMM, Shahrousvand E, Ghollasi M, Salimi A. Superficial Physicochemical Properties of Polyurethane Biomaterials as Osteogenic Regulators in Human Mesenchymal Stem Cells Fates. Colloids and Surfaces B: Biointerfaces 2017; 156: 292-304.
7- Yadav S, Khan J, Yadav A. Applications of Scaffolds in Tissue Engineering: Current Utilization and Future Prospective. Current Gene Therapy 2024; 24(2): 94-109.
8- Shahrousvand M, Ghollasi M, Zarchi AAK, Salimi A. Osteogenic Differentiation of Hmscs on Semi-Interpenetrating Polymer Networks of Polyurethane/Poly (2‑Hydroxyethyl Methacrylate)/Cellulose Nanowhisker Scaffolds. Int J Biol Macromol 2019; 138: 262-71.
9- Garner J, Skidmore S, Overdorf G, Hadar J, Park H, Park K, et al. A New Analytical Method for Quantifying Acid-End-Cap PLGA in Sub-Milligram Quantities. Mol Pharm 2024; 22(1): 446-58.
10- Yeo YH, Jo SK, Kim MH, Lee SJ, Han SY, Park MH, et al. Fabrication of Atelocollagen-Coated Bioabsorbable Suture and the Evaluation of Its Regenerative Efficacy in Achilles’ Tendon Healing Using a Rat Experimental Model. Int J Biol Macromol 2024; 271: 132564.
11- Shafiee K, Bazraei S, Mashak A, Mobedi H. The Impact of Temperature on the Formation, Release Mechanism, and Degradation of PLGA-based In-Situ Forming Implants. Journal of Polymers and the Environment 2024: 32: 3591-608.
12- Shanmugavadivu A, Lavanya K, Selvamurugan N. Nanomaterials in Bone Tissue Engineering. Handbook of Nanomaterials, Volume 2: Elsevier; 2024; 321-57.
13- Hao L, Jiang Y, Zhang R, Zhang N, Yang Y, Gao Y, et al. Preparation and in Vivo/In Vitro Characterization of Ticagrelor PLGA Sustained-Release Microspheres for Injection. Designed Monomers and Polymers 2021; 24(1): 305-19.
14- Jem KJ, van der Pol JF, de Vos S. Microbial Lactic Acid, Its Polymer Poly (Lactic Acid), and their Industrial Applications. Plastics From Bacteria: Natural Functions and Applications 2010: 323-46.
15- Cunha B, Bahú J, Xavier L, Crivellin S, de Souza S, Lodi L, et al. Filho, RM; Schiavon, MIRB; Concha, VOC; et al. Lactide: Production Routes, Properties, and Applications. Bioengineering 2022, 9, 164. s Note: MDPI stays neutral with regard to jurisdictional claims in published …; 2022.
16- Van Wouwe P, Dusselier M, Vanleeuw E, Sels B. Lactide Synthesis and Chirality Control for Polylactic Acid Production. ChemSusChem 2016; 9(9): 907-21.
17- Yunhai S, Houyong S, Deming L, Qinghua L, Dexing C, Yongchuan Z. Separation of Glycolic Acid From Glycolonitrile Hydrolysate by Reactive Extraction with Tri-N-Octylamine. Separation and Purification Technology 2006; 49(1): 20-6.
18- Nancucheo I, Johnson DB. Production of Glycolic Acid by Chemolithotrophic Iron-And Sulfur-Oxidizing Bacteria and Its Role in Delineating and Sustaining Acidophilic Sulfide Mineral-Oxidizing Consortia. Applied and Environmental Microbiology 2010; 76(2): 461-7.
19- Schmitt EE, Epstein M, Polistina RA. Alpha-Glycolide and Methods for the Isolation Thereof. Google Patents; 1969.
20- Higgins N. Condensation Polymers of Hydroxyacetic Acid. US Patent 1950; 8.
21- Takahashi K, Taniguchi I, Miyamoto M, Kimura Y. Melt/Solid Polycondensation of Glycolic Acid to Obtain High-Molecular-Weight Poly (Glycolic Acid). Polymer 2000; 41(24): 8725-8.
22- Chabot F, Vert M, Chapelle S, Granger P. Configurational structures of lactic acid stereocopolymers as determined by 13C{1H} nmr. Polymer 1983; 24(1): 53-9.
23- Gilding D, Reed A. Biodegradable Polymers for Use in Surgery—Polyglycolic/Poly (Actic Acid) Homo-And Copolymers: 1. Polymer 1979; 20(12): 1459-64.
24- Jin S, Xia X, Huang J, Yuan C, Zuo Y, Li Y, et al. Recent Advances in PLGA-Based Biomaterials for Bone Tissue Regeneration. Acta Biomaterialia 2021; 127: 56-79.
25- Makadia HK, Siegel SJ. Poly Lactic-Co-Glycolic Acid (PLGA) as Biodegradable Controlled Drug Delivery Carrier. Polymers 2011; 3(3): 1377-97.
26- Houchin M, Topp E. Physical Properties of PLGA Films during Polymer Degradation. Journal of Applied Polymer Science 2009; 114(5): 2848-54.
27- Martins C, Sousa F, Araujo F, Sarmento B. Functionalizing PLGA and PLGA Derivatives for Drug Delivery and Tissue Regeneration Applications. Advanced Healthcare Materials 2018; 7(1): 1701035.
28- Machatschek R, Lendlein A. Fundamental Insights in PLGA Degradation from Thin Film Studies. Journal of Controlled Release 2020; 319: 276-84.
29- Villemin E, Ong YC, Thomas CM, Gasser G. Polymer Encapsulation of Ruthenium Complexes for Biological and Medicinal Applications. Nature Reviews Chemistry 2019; 3(4): 261-82.
30- Nowalk JA, Swisher JH, Meyer TY. Influence of Short-Range Scrambling of Monomer Order on the Hydrolysis Behaviors of Sequenced Degradable Polyesters. Macromolecules 2019; 52(12): 4694-702.
31- Danhier F, Ansorena E, Silva JM, Coco R, Le Breton A, Préat V. PLGA-Based Nanoparticles: An Overview of Biomedical Applications. Journal of Controlled Release 2012; 161(2): 505-22.
32- Go EJ, Kang EY, Lee SK, Park S, Kim JH, Park W, et al. An Osteoconductive PLGA Scaffold with Bioactive Β-TCP and Anti-Inflammatory Mg (OH) 2 To Improve in Vivo Bone Regeneration. Biomaterials Science 2020; 8(3): 937-48.
33- Engineer C, Parikh J, Raval A. Review on Hydrolytic Degradation Behavior of Biodegradable Polymers from Controlled Drug Delivery System. Trends In Biomaterials & Artificial Organs 2011; 25(2).
34- Wu XS, Wang N. Synthesis, Characterization, Biodegradation, and Drug Delivery Application of Biodegradable Lactic/Glycolic Acid Polymers. Part II: Biodegradation. J Biomater Sci Polym Ed 2001; 12(1): 21-34.
35- Sharma U, Concagh D, Core L, Kuang Y, You C, Pham Q, et al. The Development of Bioresorbable Composite Polymeric Implants with High Mechanical Strength. Nature Materials 2018; 17(1): 96-103.
36- Keles H, Naylor A, Clegg F, Sammon C. Investigation of Factors Influencing the Hydrolytic Degradation of Single PLGA Microparticles. Polymer Degradation and Stability 2015; 119: 228-41.
37- Shin HJ, Lee CH, Cho IH, Kim YJ, Lee YJ, Kim IA, et al. Electrospun PLGA Nanofiber Scaffolds for Articular Cartilage Reconstruction: Mechanical Stability, Degradation and Cellular Responses Under Mechanical Stimulation In Vitro. Journal of Biomaterials Science, Polymer Edition 2006; 17(1-2): 103-19.
38- Washington MA, Swiner DJ, Bell KR, Fedorchak MV, Little SR, Meyer TY. The Impact of Monomer Sequence and Stereochemistry on the Swelling and Erosion of Biodegradable Poly (Lactic-Co-Glycolic Acid) Matrices. Biomaterials 2017; 117: 66-76.
39- Li J, Rothstein SN, Little SR, Edenborn HM, Meyer TY. The Effect of Monomer Order on the Hydrolysis of Biodegradable Poly (Lactic-Co-Glycolic Acid) Repeating Sequence Copolymers. J American Chem Society 2012; 134(39): 16352-9.
40- Samadi N, Abbadessa A, Di Stefano A, Van Nostrum C, Vermonden T, Rahimian S, et al. The Effect of Lauryl Capping Group on Protein Release and Degradation of Poly (D, L-Lactic-Co-Glycolic Acid) Particles. J Controlled Release 2013; 172(2): 436-43.
41- Lanao RF, Leeuwenburgh S, Wolke J, Jansen J. In Vitro Degradation Rate of Apatitic Calcium Phosphate Cement with Incorporated PLGA Microspheres. Acta Biomaterialia 2011; 7(9): 3459-68.
42- Lanao RPF, Leeuwenburgh SC, Wolke JG, Jansen JA. Bone Response to Fast-Degrading, Injectable Calcium Phosphate Cements Containing PLGA Microparticles. Biomaterials 2011; 32(34): 8839-47.
43- Wang J, Helder L, Shao J, Jansen JA, Yang M, Yang F. Encapsulation and Release of Doxycycline from Electrospray-Generated PLGA Microspheres: Effect Of Polymer End Groups. International J Pharmaceutics 2019; 564: 1-9.
44- Grayson ACR, Cima MJ, Langer R. Size and Temperature Effects on Poly (Lactic-Co-Glycolic Acid) Degradation and Microreservoir Device Performance. Biomaterials 2005; 26(14): 2137-45.
45- D’Souza S, Faraj JA, Dorati R, DeLuca PP. Enhanced Degradation of Lactide‐co‐Glycolide Polymer with Basic Nucleophilic Drugs. Advances in Pharmaceutics 2015; 2015(1): 154239.
46- Zolnik BS, Burgess DJ. Effect of Acidic Ph on PLGA Microsphere Degradation and Release. Journal of Controlled Release 2007; 122(3): 338-44.
47- Biondi M, Ungaro F, Quaglia F, Netti PA. Controlled Drug Delivery in Tissue Engineering. Advanced Drug Delivery Rev 2008; 60(2): 229-42.
48- Deshpande AA, Heller J, Gurny R. Bioerodible Polymers for Ocular Drug Delivery. Critical Reviews™ in Therapeutic Drug Carrier Systems 1998; 15(4).
49- Acton QA. Boron Compounds—Advances in Research and Application: Scholarly Editions. ScholarlyEditions, Atlanta, GA, USA 2013.
50- Astete CE, Sabliov CM. Synthesis and characterization of PLGA nanoparticles. J Biomaterials Science, Polymer Edition 2006; 17(3): 247-89.
51- Hwang NS, Varghese S, Elisseeff J. Controlled Differentiation of Stem Cells. Advanced Drug Delivery Reviews 2008; 60(2): 199-214.
52- Khatri K, Goyal AK, Vyas SP. Potential of Nanocarriers in Genetic Immunization. Recent Patents on Drug Delivery & Formulation 2008; 2(1): 68-82.
53- Gupta A, Kumar V. New Emerging Trends in Synthetic Biodegradable Polymers–Polylactide: A Critique. European Polymer J 2007; 43(10): 4053-74.
54- Chaubal M. Polylactides/Glycolides-Excipients for Injectable Drug Delivery and Beyond. Drug Deliv Technol 2002; 2: 34-6.
55- Shi D, Xu X, Ye Y, Song K, Cheng Y, Di J, et al. Photo-Cross-Linked Scaffold with Kartogenin-Encapsulated Nanoparticles for Cartilage Regeneration. ACS Nano 2016; 10(1): 1292-9.
56- Huling J, Ko IK, Atala A, Yoo JJ. Fabrication of Biomimetic Vascular Scaffolds for 3D Tissue Constructs Using Vascular Corrosion Casts. Acta biomaterialia 2016; 32: 190-7.
57- Cai G, Liu W, He Y, Huang J, Duan L, Xiong J, Et Al. Recent Advances in Kartogenin for Cartilage Regeneration. Journal Of Drug Targeting 2019; 27(1): 28-32.
58- Wang C, Yue H, Huang W, Lin X, Xie X, He Z, et al. Cryogenic 3D Printing of Heterogeneous Scaffolds with Gradient Mechanical Strengths and Spatial Delivery of Osteogenic Peptide/TGF-Β1 for Osteochondral Tissue Regeneration. Biofabrication 2020; 12(2): 025030.
59- Lee K, Chen Y, Li X, Wang Y, Kawazoe N, Yang Y, et al. Solution Viscosity Regulates Chondrocyte Proliferation and Phenotype During 3D Culture. Journal of Materials Chemistry B 2019; 7(48): 7713-22.
60- Duan P, Pan Z, Cao L, Gao J, Yao H, Liu X, et al. Restoration of Osteochondral Defects by Implanting Bilayered Poly (Lactide-Co-Glycolide) Porous Scaffolds in Rabbit Joints for 12 and 24 Weeks. Journal of Orthopaedic Translation 2019; 19: 68-80.
61- Li Y, Liu Y, Xun X, Zhang W, Xu Y, Gu D. Three-Dimensional Porous Scaffolds with Biomimetic Microarchitecture and Bioactivity for Cartilage Tissue Engineering. ACS Applied Materials & Interfaces 2019; 11(40): 36359-70.
62- Bazgir M, Zhang W, Zhang X, Elies J, Saeinasab M, Coates P, et al. Degradation and Characterisation of Electrospun Polycaprolactone (PCL) and Poly (Lactic-Co-Glycolic Acid)(PLGA) Scaffolds For Vascular Tissue Engineering. Materials 2021; 14(17): 4773.
63- Norouzi M, Rafienia M, Hosseini S. Characterization and Biological Evaluation of New PLGA/Fibrin/Lignin Biocomposite Electrospun Scaffolds. Physica Scripta 2023; 98(9): 095506.
64- Guzmán-Soria A, Moreno-Serna V, Canales DA, García-Herrera C, Zapata PA, Orihuela PA. Effect of Electrospun PLGA/Collagen Scaffolds on Cell Adhesion, Viability, and Collagen Release: Potential Applications in Tissue Engineering. Polymers 2023; 15(5): 1079.
65- Pandey G, Pandey P, Arya DK, Kanaujiya S, Kapoor DD, Gupta RK, et al. Multilayered Nanofibrous Scaffold of Polyvinyl Alcohol/Gelatin/Poly (Lactic-Co-Glycolic Acid) Enriched with Hemostatic/Antibacterial Agents for Rapid Acute Hemostatic Wound Healing. International J Pharmaceutics 2023; 638: 122918.
66- Babilotte J, Martin B, Guduric V, Bareille R, Agniel R, Roques S, et al. Development and Characterization of a PLGA-HA Composite Material to Fabricate 3D-Printed Scaffolds for Bone Tissue Engineering. Materials Science and Engineering: C 2021; 118: 111334.
67- Gradwohl M, Chai F, Payen J, Guerreschi P, Marchetti P, Blanchemain N. Effects of Two Melt Extrusion Based Additive Manufacturing Technologies and Common Sterilization Methods on the Properties of a Medical Grade PLGA Copolymer. Polymers (basel) 13; 572: 2021.
68- Liu T, Li Z, Zhao L, Chen Z, Lin Z, Li B, et al. Customized Design 3D Printed PLGA/Calcium Sulfate Scaffold Enhances Mechanical And Biological Properties For Bone Regeneration. Frontiers in Bioengineering and Biotechnology 2022; 10: 874931.
69- Liu Z, Ramakrishna S, Ahmed I, Rudd C, Liu X. Rheological, Surface Tension and Conductivity Insights on the Electrospinnability of Poly (lactic-co-glycolic acid)-hyaluronic Acid Solutions and their Correlations with the Nanofiber Morphological Characteristics. Polymers 2022; 14(20): 4411.
70- Putri NRE, Wang X, Chen Y, Li X, Kawazoe N, Chen G. Preparation of PLGA-Collagen Hybrid Scaffolds with Controlled Pore Structures for Cartilage Tissue Engineering. Progress in Natural Science: Materials International 2020; 30(5): 642-50.
71- Xie Y, Lee K, Wang X, Yoshitomi T, Kawazoe N, Yang Y, et al. Interconnected Collagen Porous Scaffolds Prepared with Sacrificial PLGA Sponge Templates for Cartilage Tissue Engineering. Journal of Materials Chemistry B 2021; 9(40): 8491-500.
72- Hassan M, Khaleel A, Karam SM, Al-Marzouqi AH, Ur Rehman I, Mohsin S. Bacterial Inhibition and Osteogenic Potentials of Sr/Zn Co-Doped Nano-Hydroxyapatite-PLGA Composite Scaffold for Bone Tissue Engineering Applications. Polymers 2023; 15(6): 1370.
73- Yuan F-Z, Wang H-F, Guan J, Fu J-N, Yang M, Zhang J-Y, et al. Fabrication Of Injectable Chitosan-Chondroitin Sulfate Hydrogel Embedding Kartogenin-Loaded Microspheres As An Ultrasound-Triggered Drug Delivery System For Cartilage Tissue Engineering. Pharmaceutics 2021; 13(9): 1487.
74- Yuan B, Zhang Y, Wang Q, Ren G, Wang Y, Zhou S, et al. Thermosensitive Vancomycin@ PLGA-PEG-PLGA/HA Hydrogel as an All-In-One Treatment for Osteomyelitis. Int J Pharm 2022; 627: 122225.
75- Garakani SS, Davachi SM, Bagher Z, Esfahani AH, Jenabi N, Atoufi Z, et al. Fabrication of Chitosan/Polyvinylpyrrolidone Hydrogel Scaffolds Containing PLGA Microparticles Loaded with Dexamethasone for Biomedical Applications. Int J Biol Macro 2020; 164: 356-70.
76- Ghandforoushan P, Hanaee J, Aghazadeh Z, Samiei M, Navali AM, Khatibi A, et al. Novel Nanocomposite Scaffold Based on Gelatin/PLGA-PEG-PLGA Hydrogels Embedded with TGF-Β1 for Chondrogenic Differentiation of Human Dental Pulp Stem Cells in Vitro. International Journal of Biological Macromol 2022; 201: 270-87.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







