دوره 33، شماره 2 - ( اردیبهشت 1404 )
جلد 33 شماره 2 صفحات 8697-8667 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nasiri M, Ali Asgari Z, Pezeshki Modarres M, Jafari Nodoushan M, Zamanlui Benisi S, Mohammadi Shabestari S. Advances and Challenges of Electrospun Nanofibrous Polymer Biomimetic Scaffolds in Cartilage Tissue Engineering. JSSU 2025; 33 (2) :8667-8697
URL: http://jssu.ssu.ac.ir/article-1-6258-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6258-fa.html
نصیری مهرسا، علی عسگری زهرا، پزشکی مدرس محمد، جعفری ندوشن میلاد، زمانلوی بنیسی سهیلا، محمدی شبستری سالار. پیشرفتها و چالشهای داربستهای زیست تقلید پلیمری نانو لیفی الکتروریسی شده در مهندسی بافت غضروف. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (2) :8667-8697
مهرسا نصیری 

 ، زهرا علی عسگری
، زهرا علی عسگری 

 ، محمد پزشکی مدرس
، محمد پزشکی مدرس 

 ، میلاد جعفری ندوشن
، میلاد جعفری ندوشن 

 ، سهیلا زمانلوی بنیسی*
، سهیلا زمانلوی بنیسی* 

 ، سالار محمدی شبستری
، سالار محمدی شبستری 




 ، زهرا علی عسگری
، زهرا علی عسگری 

 ، محمد پزشکی مدرس
، محمد پزشکی مدرس 

 ، میلاد جعفری ندوشن
، میلاد جعفری ندوشن 

 ، سهیلا زمانلوی بنیسی*
، سهیلا زمانلوی بنیسی* 

 ، سالار محمدی شبستری
، سالار محمدی شبستری 


متن کامل [PDF 1593 kb]
(305 دریافت)
| چکیده (HTML) (1106 مشاهده)
References:
1- Eltom A, Zhong G, Muhammad A. Scaffold Techniques and Designs in Tissue Ngineering Functions and Purposes: A Review. Adv Mater Sci Eng 2019; 2019: 3429527.
2- Ratner BD, Hoffman AS, Schoen FJ, Lemons JE. Biomaterials Science: An Introduction to Materials in Medicine. 2nd ed. San Diego: Elsevier Academic Press; 2004.
3- Rodríguez GB, Patrício TMF, Delgado López JM. Natural Polymers for Bone Repair in Bone Repair Biomaterials. 2nd edition. Regeneration and Clinical Applications: Woodhead Publishing; 2019: 199-232.
4- Meghdadi M, Mohammad S, Mohamad A, Modaress P, Irani S. Cold Atmospheric Plasma as A Promising Approach for Gelatin Immobilization on Poly (Ε-Caprolactone) Electrospun Scaffolds. Prog Biomater 2019; 8: 65-75.
5- Ito R, Morimoto N, Liem P, Nakamura Y, Kawai K, Taira T, et al. Adipogenesis Using Human Adipose Tissue-Derived Stromal Cells Combined with a Collagen/Gelatin Sponge Sustaining Release of Basic Fibroblast Growth Factor. Tissue Engineering and Regenerative Medicine 2012; 8(12): 1000-8.
6- Irani S, Tavakkoli S. Electrospun Nanofibrous Alginate Sulfate Scaffolds Promote Mesenchymal Stem Cells Differentiation to Chondrocytes. J Appl Polym Sci 2021; 138(8): 49868.
7- Liao J, Shi K, Ding Q, Qu Y, Luo F, Qian Z. Recent Developments in Scaffold-Guided Cartilage Tissue Regeneration. Journal of Biomedical Nanotechnology 2014; 10(10): 3085-104.
8- O’Brien FJ. Biomaterials & Scaffolds for Tissue Engineering. Mater Today 2011; 14(3): 88-95.
9- Dhandayuthapani B, Yoshida Y, Maekawa T, Kumar DS. Polymeric Scaffolds in Tissue Engineering Application: A Review. Int J Polym Sci 2011; 2011: 290602.
10- Cheung HY, Lau KT, Lu TP, Hui D. A Critical Review on Polymer-Based Bio-Engineered Materials for Scaffold Development. Compos Part B Eng 2007; 38(3): 291-300.
11- Velasco MA, Narváez-Tovar CA, Garzón-Alvarado DA. Design, Materials, and Mechanobiology of Biodegradable Scaffolds for Bone Tissue Engineering. Biomed Res Int 2015; 2015: 729076.
12- Ghasemi-Mobarakeh L, Prabhakaran MP, Balasubramanian P, Jin G, Valipouri A, Ramakrishna S. Advances in Electrospun Nanofibers for Bone and Cartilage Regeneration. J Nanosci Nanotechnol 2013; 13(7): 4656-71.
13- Rana D, Ratheesh G, Ramakrishna S, Ramalingam M. Nanofiber Composites in Cartilage Tissue Engineering. Elsevier Ltd; 2025; 325-44.
14- Karuppal R. Current Concepts in the Articular Cartilage Repair and Regeneration. J Orthop 2017; 14(2): A1-A3.
15- Kazemnejad S, Khanmohammadi M, Baheiraei N, Arasteh S. Current State of Cartilage Tissue Engineering Using Nanofibrous Scaffolds and Stem Cells. Avicenna J Med Biotechnol 2017; 9(2): 50-65.
16- Vinatier C, Guicheux J. Cartilage Tissue Engineering: From Biomaterials and Stem Cells to Osteoarthritis Treatments. Ann Phys Rehabil Med 2016; 59(3): 139-44.
17- Kazemnejad S, Khanmohammadi M, Baheiraei N, Arasteh S. Current State of Cartilage Tissue Engineering Using Nanofibrous Scaffolds and Stem Cells. Avicenna J Med Biotechnol 2017; 9(2): 50-65.
18- Sill TJ, von Recum HA. Electrospinning: Applications in Drug Delivery and Tissue Engineering. Biomaterials 2008; 29(13): 1989-2006.
19- Haider A, Haider S, Kang IK. A Comprehensive Review Summarizing the Effect of Electrospinning Parameters and Potential Applications of Nanofibers in Biomedical and Biotechnology. Arab J Chem 2018; 11(8): 1165-88.
20- Zamanlui S, Mahmoudifard M, Soleimani M, Bakhshandeh B, Vasei M, Faghihi S. Enhanced Chondrogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells on PCL/PLGA Electrospun with Different Alignment and Composition. Int J Polym Mater Polym Biomater 2018; 67(1): 50-60.
21- Shi X, Zhou W, Ma D, Ma Q, Bridges D. Electrospinning of Nanofibers and their Applications for Drug Delivery and Tissue Engineering. J Nanomater 2015; 2015: 140716.
22- Pham QP, Sharma U, Mikos AG. Electrospinning of Polymeric Nanofibers for Tissue Engineering Applications: A Review. Tissue Engineering 2006; 12(5): 1197-211.
23- Khorshidi S, Solouk A, Mirzadeh H, Mazinani S, Lagaron J, Sharifi S, et al. A Review of Key Challenges of Electrospun Scaffolds for Tissue-Engineering Applications. J Tissue Engineering and Regenerative Medicine 2015; 10: 715-38. [Persian]
24- Zhang Z, Hu J, Ma PX. Nanofiber-Based Delivery of Bioactive Agents and Stem Cells to Bone Sites. Adv Drug Deliv Rev 2012; 64(12): 1129-41.
25- Rnjak-Kovacina J, Weiss AS. Increasing the Pore Size of Electrospun Scaffolds. Tissue Eng Part B Rev 2011; 17(5): 365-72.
26- Murugan R, Ramakrishna S. Design Strategies of Tissue Engineering Scaffolds with Controlled Fiber Orientation. Tissue Eng 2007; 13(8): 1845-66.
27- Mahmoudifard M, Soleimani M, Hatamie S, Zamanlui S, Ranjbarvan P, Vossoughi M, et al. The Different Fate of Satellite Cells on Conductive Composite Electrospun Nanofibers with Graphene and Graphene Oxide Nanosheets. Biomed Mater 2016; 11(2): 025006. [Persian]
28- Hosseinzadeh S, Soleimani M, Vossoughi M, Ranjbarvan P, Hamedi S, Zamanlui S, et al. Study of Epithelial Differentiation and Protein Expression of Keratinocyte-Mesenchyme Stem Cell Co-Cultivation on Electrospun Nylon/B. Vulgaris Extract Composite Scaffold. Mater Sci Eng C. 2017; 75: 653-62.
29- Behtouei E, Zandi M, Askari F, Daemi H, Zamanlui S, Arabsorkhi Mishabi A, et al. Bead-Free and Tough Electrospun PCL/Gelatin/PGS Ternary Nanofibrous Scaffolds for Tissue Engineering Application. J Appl Polym Sci 2021; 139(2): 51471. [Persian]
30- Jiang T, Carbone EJ, Lo KWH, Laurencin CT. Electrospinning of Polymer Nanofibers for Tissue Regeneration. In: Elsevier Ltd; 2015; 46: 1-24.
31- Zhong S, Zhang Y, Lim CT. Fabrication of large pores in electrospun nanofibrous scaffolds for cellular infiltration: A review. Tissue Eng Part B Rev 2012; 18(2): 77-87.
32- Nisbet DR, Forsythe JS, Shen W, Finkelstein DI, Horne MK. Review Paper: A Review of the Cellular Response on Electrospun Nanofibers for Tissue Engineering. J Biomater Appl 2008; 24(1): 7-29.
33- Nemati S, Kim SJ, Shin YM, Shin H. Current Progress in Application of Polymeric Nanofibers to Tissue Engineering. Nano Converg 2019; 6(1): 1-17.
34- Jin GZ. Comparison of Chondrocyte Behaviors between Silk Microfibers and Polycaprolactone Microfibers in Tissue Engineering and Regenerative Medicine Applications. Bioengineering 2024; 11(12): 1209.
35- Hardingham T. Cartilage Tissue Regeneration. Electrospinning Tissue Regen 2011; 1: 111-26.
36- Zhao Z, Fan C, Chen F, Sun Y, Xia Y, Ji A, et al. Progress in Articular Cartilage Tissue Engineering: A Review on Therapeutic Cells and Macromolecular Scaffolds. Macromol Biosci 2020; 20(2): e1900278.
37- Rasheed T, Bilal M, Zhao Y, Raza A, Shah SZH, Iqbal HMN. Physiochemical Characteristics and Bone/Cartilage Tissue Engineering Potentialities of Protein-Based Macromolecules—A Review. Int J Biol Macromol 2019; 121: 13-22.
38- Zha F, Chen W, Zhang L, Yu D. Electrospun Natural Polymer and Its Composite Nanofibrous Scaffolds for Nerve Tissue Engineering. J Biomater Sci Polym Ed 2020; 31(4): 519-48.
39- Hanumantharao SN, Rao S. Multi-Functional Electrospun Nanofibers. Fibers 2019; 7(7): 66.
40- Yilmaz EN, Zeugolis DI. Electrospun Polymers in Cartilage Engineering—State of Play. Front Bioeng Biotechnol 2020; 8: 1-17.
41- Ding J, Zhang J, Li J, Li D, Xiao C, Xiao H, et al. Electrospun Polymer Biomaterials. Progress in Polymer science 2019; 90: 1-34.
42- Zamanlui S, Amirabad LM, Soleimani M, Faghihi S. Influence of Hydrodynamic Pressure on Chondrogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells Cultured in Perfusion System. Biologicals 2018; 56: 1-8.
43- Sharifi F, Irani S, Azadegan G, Pezeshki-Modaress M, Zandi M, Saeed M. Co-Electrospun Gelatin-Chondroitin Sulfate/Polycaprolactone Nanofibrous Scaffolds for Cartilage Tissue Engineering. Bioact Carbohydrates Diet Fibre 2020; 22: 100215.
44- Meghdadi M, Pezeshki-Modaress M, Irani S, Atyabi SM, Zandi M. Chondroitin Sulfate Immobilized PCL Nanofibers Enhance Chondrogenic Differentiation of Mesenchymal Stem Cells. Int J Biol Macromol 2019; 136: 616-24.
45- Honarpardaz A, Irani S, Pezeshki-Modaress M, Zandi M, Sadeghi A. Enhanced Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells on Gelatin/Glycosaminoglycan Electrospun Nanofibers with Different Amounts of Glycosaminoglycan. J Biomed Mater Res A 2019; 107(1): 38-48.
46- Ashraf R, Sofi HS, Malik A, Beigh MA, Hamid R, Sheikh FA. Recent Trends in the Fabrication of Starch Nanofibers: Electrospinning and Non-electrospinning Routes and Their Applications in Biotechnology. Appl Biochem Biotechnol 2019; 187(1): 47-74.
47- Matthews JA, Boland ED, Wnek GE, Simpson DG, Bowlin GL. Compatible Polymers Electrospinning of Collagen. J Bioact Compat Polym 2003; 18(2): 125-34.
48- Yao R, He J, Meng G, Jiang B, Wu F. Electrospun PCL/Gelatin Composite Fibrous Scaffolds: Mechanical Properties and Cellular Responses. J Biomater Sci Polym Ed 2016; 5063: 824-38.
49- Ho STB, Cool SM, Hui JH, Hutmacher DW. The Influence of Fibrin-Based Hydrogels on The Chondrogenic Differentiation of Human Bone Marrow Stromal Cells. Biomaterials. 2010; 31(1): 38-47.
50- Li Z, Liu P, Yang T, Qi You, Jiale Li, Zilin Wang, et al. Composite Poly(L-Lactic-Acid)/Silk Fibroin Scaffold Prepared by Electrospinning Promotes Chondrogenesis for Cartilage Tissue Engineering. J Biomater Appl 2015; 30(10): 1552-65.
51- Surucu S, Turkoglu Sasmazel H. Development of Core-Shell Coaxially Electrospun Composite PCL/Chitosan Scaffolds. Int J Biol Macromol 2016; 92: 321-28.
52- Rapa M, Darie-Nita RN, Preda P, Coroiu V, Tatia R, Vasile C, et al. PLA/Collagen Hydrolysate/Silver Nanoparticles Bionanocomposites for Potential Antimicrobial Urinary Drains. Polym Technol Mater 2019; 58(18): 2041-55.
53- Thorvaldsson A, Stenhamre H, Gatenholm P, Walkenström P. Electrospinning of Highly Porous Scaffolds for Cartilage Regeneration. Biomacromolecules 2008; 9(3): 1044-49.
54- Shields KJ, Beckman MJ, Bowlin GL, Wayne JS. Mechanical Properties and Cellular Proliferation of Electrospun Collagen Type II. Tissue Eng 2004; 10(9-10): 1510-17.
55- In KS, et al. Chitosan Nano-/Microfibrous Double-Layered Membrane with Rolled-Up Three-Dimensional Structures for Chondrocyte Cultivation. J Biomed Mater Res A 2009; 90A (2): 595-602.
56- Subramanian A, Vu D, Larsen GF, Lin HY. Preparation and Evaluation of the Electrospun Chitosan/PEO Fibers for Potential Applications in Cartilage Tissue Engineering. J Biomater Sci Polym Ed 2005; 16(7): 861-73.
57- Skotak M, Noriega S, Larsen G, Subramanian A. Electrospun Cross-Linked Gelatin Fibers with Controlled Diameter: The Effect of Matrix Stiffness on Proliferative and Biosynthetic Activity of Chondrocytes Cultured in Vitro. J Biomed Mater Res A 2010; 95(3): 828-36.
58- Ponticiello MS, Schinagl RM, Kadiyala S, Barry FP. Gelatin-Based Resorbable Sponge as A Carrier Matrix for Human Mesenchymal Stem Cells in Cartilage Regeneration Therapy. J Biomed Mater Res 2000; 52(2): 246-55.
59- Xu H, Cai S, Xu L, Yang Y. Water-Stable Three-Dimensional Ultrafine Fibrous Scaffolds from Keratin for Cartilage Tissue Engineering. Langmuir 2014; 30(28): 8461-70.
60- Rebelo R, Fernandes M, Fangueiro R. Biopolymers in Medical Implants: A Brief Review. Procedia Eng 2017; 200: 236-43.
61- Tuan RS, Chen AF, Klatt BA. Cartilage regeneration. J Am Acad Orthop Surg 2013; 21(5): 303-11.
62- Kulkarni AA, Rao PS. Synthesis of Polymeric Nanomaterials for Biomedical Applications. Woodhead Publishing Limited; 2013: 27-63.
63- Baek J, Chen X, Sovani S, Jin S, Grogan SP, Lima DDD. Meniscus Tissue Engineering Using a Novel Combination of Electrospun Scaffolds and Human Meniscus Cells Embedded Within an Extracellular Matrix Hydrogel. J Orthop Res 2015; 33(4): 572-83.
64- Zhou H, Green TB, Joo YL. The Thermal Effects on Electrospinning of Polylactic Acid Melts. Polymer (Guildf) 2006; 47(21): 7497-505.
65- Silva MLA, Martins A, Pinto A, Costa P, Fario S, Gomes M, et al. Cartilage Tissue Engineering Using Electrospun PCL Nanofiber Meshes and MSCs. Biomacromolecules 2010; 11(12): 3228-36.
66- Guimaires A, Martins A, Pinho ED, Faria S, Reis RL, Neves NM. Solving cell infiltration limitations of electrospun nanofiber meshes for tissue engineering applications. Nanomedicine 2010; 5(4): 539-54.
67- Kuo Y, Hung S, Hsu S. The Effect of Elastic Biodegradable Polyurethane Electrospun Nanofibers on the Differentiation of Mesenchymal Stem Cells. Colloids Surfaces B Biointerfaces 2014; 122: 414-22.
68- Shin HJ, Lee CH, Cho IH, Kim YJ, Lee YJ, Kim IA. Electrospun PLGA Nanofiber Scaffolds for Articular Cartilage Reconstruction: Mechanical Stability, Degradation and Cellular Responses Under Mechanical Stimulation in Vitro. J Biomater Sci Polym Ed 2006; 17(1-2): 103-19
69- Zhang Y, Yang F, Liu K, Shen H, Zhu Y, Zhang W, et al. The Impact of PLGA Scaffold Orientation on in Vitro Cartilage Regeneration. Biomaterials 2012; 33(10): 2926-35.
70- Lee JB, Yang DH, Ph D. Highly Porous Electrospun Nanofibers Enhanced by Ultrasonication for Improved Cellular Infiltration. Tissue Eng Part A 2011; 17: 21-22.
71- Janjanin S, Li W, Morgan M, Shanti R, Tuan R. Mold-Shaped, Nanofiber Scaffold-Based Cartilage Engineering Using. J Surg Sci 2008; 149: 1; 47-56.
72- Toyokawa N, Fujioka H, Kokubu T, Nagura I, Inui A, Sakata R, et al. Electrospun Synthetic Polymer Scaffold for Cartilage Repair without Cultured Cells in an Animal Model. Arthroscopy 2010; 26(3): 375-83.
73- Garrigues NW, Little D, Sanchez-Adams J, Ruch DS, Guilak F. Electrospun Cartilage-Derived Matrix Scaffolds for Cartilage Tissue Engineering. J Biomed Mater Res A 2014; 59784: 28-30.
74- Daemi H, Mashayekhi M, Pezeshki-Modaress M. Facile Fabrication of Sulfated Alginate Electrospun Nanofibers. Carbohydr Polym 2018; 198: 481-5.
75- Yang W, Fu J, Wang D, Wang T, Wang H, Jin S, He N. Study on Chitosan/Polycaprolactone Blending Vascular Scaffolds by Electrospinning. J Biomed Nanotechnol 2010; 6(3): 254-9.
76- Zahedi P, Rezaeian I, Jafari SH. In Vitro and in Vivo Evaluations of Phenytoin Sodium-Loaded Electrospun PVA, PCL, and their Hybrid Nanofibrous Mats for Use as Active Wound Dressings. J Mater Sci 2013; 48(8): 3147-59.
77- Irani S, Honarpardaz A, Choubini N, Pezeshki-Modaress M, Zandi M. Chondro-Inductive Nanofibrous Scaffold-Based Gelatin/Polyvinyl Alcohol/Chondroitin Sulfate for Cartilage Tissue Engineering. Polym Adv Technol 2020; 31(6): 1395-402.
78- Holland TA, Mikos AG. Advances in Drug Delivery for Articular Cartilage. J Control Release 2003; 86(1): 1-14.
79- Sharma C, Gautam S, Dinda AK, Mishra NC. Cartilage Tissue Engineering: Current Scenario and Challenges. Adv Mater Lett 2011; 2(2): 90-99.
80- Guntur AR, Rosen CJ. IGF-1 Regulation of Key Signaling Pathways in Bone. Bonekey Rep 2013; 2: 437.
81- Boushell MK, Mosher C, Suri G, Doty S, Strauss E, Hunziker E, Lu H. Polymeric Mesh and Insulin-Like Growth Factor 1 Delivery Enhance Cell Homing and Graft-Cartilage Integration. Ann N Y Acad Sci 2019; 1442(1): 138-52.
82- Mariani E, Pulsatelli L, Facchini A. Signaling pathways in cartilage repair. Int J Mol Sci. 2014;15(5):8667-8698. doi: 10.3390/ijms15058667.
83- Vayas R, Reyes R, Rodriguez-Evora M, Del Rosario C, Delgado A, Evora C. Evaluation of the effectiveness of a bMSC and BMP-2 polymeric trilayer system in cartilage repair. Biomed Mater. 2017;12(4). doi: 10.1088/1748-605X/aa6f1c.
84- Cai G, Liu W, He Y, Huang J, Duan L, Xiong J, et al. Recent advances in kartogenin for cartilage regeneration. J Drug Target 2018; 27(1): 28-32.
85- Huang X, Zhong L, Hendriks J, Post JN, Karperien M. The Effects of the WNT-Signaling Modulators BIO and PKF118-310 on the Chondrogenic Differentiation of Human Mesenchymal Stem Cells. Int J Mol Sci 2018; 19(2): 561.
86- Ham O, Youn Lee CH, Kim R, Lee J, Oh S, Young Lee M, et al. Therapeutic Potential of Differentiated Mesenchymal Stem Cells for Treatment of Osteoarthritis. Int J Mol Sci 2015; 16(7): 14961-78.
87- Zhou Y, Tao H, Li Y, Deng M, He B, Xia S, et al. Berberine Promotes Proliferation of Sodium Nitroprusside-Stimulated Rat Chondrocytes and Osteoarthritic Rat Cartilage Via Wnt/Β-Catenin Pathway. Eur J Pharmacol 2016; 789: 109-18.
88- Lima AC, Ferreira H, Reis RL, Neves NM. Biodegradable Polymers: An Update on Drug Delivery in Bone and Cartilage Diseases. Expert Opin Drug Deliv 2019; 16(8): 795-813.
89- Huebner KD, Shrive NG, Frank CB. Dexamethasone Inhibits Inflammation and Cartilage Damage in a New Model of Post-Traumatic Osteoarthritis. J Orthop Res 2014; 32(4): 566-72.
90- Huang K, Bao J peng, Jennings GJ, Wu L doing. The Disease-Modifying Effect of Dehydroepiandrosterone in Different Stages of Experimentally Induced Osteoarthritis: A Histomorphometric Study. BMC Musculoskelet Disord 2015; 16(1): 178.
91- Gao H, Peng L, Li C, Ji Q, Li P. Salidroside Alleviates Cartilage Degeneration through NF-Κb Pathway in Osteoarthritis Rats. Drug Des Devel Ther 2020; 14: 1445-54.
92- Cheleschi S, Calamia V, Fernandez-Moreno M, Biava M, Giordani A, Fioravanti A, et al. In Vitro Comprehensive Analysis of VA692 a New Chemical Entity for the Treatment of Osteoarthritis. Int Immunopharmacol 2018; 64: 86-100.
93- Ham O, Song B, Lee S, Choi E, Cha M, Lee C, et al. The role of microRNA-23b in the differentiation of MSC into chondrocyte by targeting protein kinase A signaling. Biomaterials 2012; 33(18): 4500-07.
94- Park K, Park JS, Woo DG, Yang HN, Chung HM, Park KH. The Use of Chondrogenic Differentiation Drugs to Induce Stem Cell Differentiation Using Double Bead Microsphere Structure. Biomaterials 2008; 29(16): 2490-500.
95- Sohier J, Moroni L, van Blitterswijk C, de Groot K, Bezemer JM. Critical Factors in the Design of Growth Factor Releasing Scaffolds for Cartilage Tissue Engineering. Expert Opin Drug Deliv 2008; 5(5): 543-66.
96- Augustyniak E, Trzeciak T, Richter M, Kaczmarczyk J, Suchorska W. The Role of Growth Factors in Stem Cell-Directed Chondrogenesis: A Real Hope for Damaged Cartilage Regeneration. Int Orthop 2015; 39(5): 995-1003.
97- Goonoo N, Bhaw-Luximon A. Mimicking Growth Factors: Role of Small Molecule Scaffold Additives in Promoting Tissue Regeneration and Repair. RSC Adv 2019; 9(32): 18124-46.
98- Merceron C, Portron S, Vignes-Colombeix C, Rederstorff E, Masson M, Lesoeur J, et.al. Pharmacological Modulation of Human Mesenchymal Stem Cell Chondrogenesis by A Chemically Oversulfated Polysaccharide of Marine Origin: Potential Application to Cartilage Repair. Stem Cells 2012; 30(3): 471-80.
99- Li T, Liu B, Chen K, Lou Y, Jiang Y, Zhang D. Small Molecule Compounds Promote the Proliferation of Chondrocytes and Chondrogenic Differentiation of Stem Cells in Cartilage Tissue Engineering. Biomed Pharmacother 2020; 131: 110652.
100- Publication A. The Journal of Veterinary Medical Science. Cell; 2011.Wu J, Sun J, Liu J. Evaluation of PHBV/Calcium Silicate Composite Scaffolds for Cartilage Tissue Engineering. Appl Surf Sci 2014; 317: 278-83.
101- Sadeghi A, Pezeshki-Modaress M, Zandi M. Electrospun Polyvinyl Alcohol/Gelatin/Chondroitin Sulfate Nanofibrous Scaffold: Fabrication and in Vitro Evaluation. Int J Biol Macromol 2018; 114: 1248-56.
102- Akbarzadeh M, Pezeshki-Modaress M, Zandi M. Biphasic, Tough Composite Core/Shell PCL/PVA-GEL Nanofibers for Biomedical Application. J Appl Polym Sci 2019; 137: 21; 48713. [Persian]
103- Kai D, Prabhakaran MP, Stahl B, Eblenkamp M, Wintermantel E, Ramakrishna S. Mechanical Properties and in Vitro Behavior of Nanofiber-Hydrogel Composites for Tissue Engineering Applications. Nanotechnology 2012; 23(9).
104- Nava MM, Draghi L, Giordano C, Pietrabissa R. The Effect of Scaffold Pore Size in Cartilage Tissue Engineering. J Appl Biomater Funct Mater 2016;14(3): e223-9.
105- Zhou Y, Chyu J, Zumwalt M. Recent Progress of Fabrication of Cell Scaffold by Electrospinning Technique for Articular Cartilage Tissue Engineering. Int J Biomater 2018; 2018: 1953636.
106- Levorson EJ, Raman Sreerekha P, Chennazhi KP, Kasper FK, Nair SV, Mikos AG. Fabrication and Characterization of Multiscale Electrospun Scaffolds for Cartilage Regeneration. Biomed Mater 2013; 8(1): 014103.
107- Beigi-Boroujeni S, Rajabi S, Rafati Ashteiani G, Dolatfarahi M, Özcan M. A Simple, Green Chemistry Technology for Fabrication of Tissue-Engineered Scaffolds Based on Mussel-Inspired 3D Centrifugal Spun. Mater Sci Eng C Mater Biol Appl 2021; 121: 111849.
متن کامل: (789 مشاهده)
مقدمه
اصطلاح مهندسی بافت اولین بار توسط پروفسور رابرت نرم Robert Nerem در سال1988در نشست همگانی زیست شناسی مولکولی و سلولی در دانشگاه UCLAUniversity of California, Los Angeles مطرح شد (1). مثلث مهندسی بافت شامل سلول، داربست و مولکول های پیام رسان میباشد. هدف اصلی مهندسی بافت بازگرداندن عملکرد بافت و اندامها با استفاده از راهبردهای بیولوژیکی و مهندسی در جهت حل مشکلات بالینی است (2). تکنیکهای جراحی مورد استفاده فعلی در بازسازی اندام و بافت تحت عنوان پیوند، واز طریق جابه جایی بافت یا اندام از محل اصلی با هدف ترمیم بخش آسیب دیده انجام میشود که به آن پیوند خودی یا اوتوگرفت Autograft نیز گفته میشود. به عنوان مثال میتوان به استفاده از ورید صافن Saphenous vein (یک سیاه رگ بزرگ زیر جلدی و سطحی در اندام تحتانی است) به عنوان پیوند بای پس bypass و یاتاندون پاتلا Patella tendon برای ترمیم رباط صلیبی قدامی Anterior cruciate ligament اشاره کرد. هر چند پیوند خود به عنوان استاندارد طلایی برای ترمیم شناخته میشود، با اینحال، این روش نمیتواند جایگزین تمام عملکردهای بافت اصلی شود. علاوه بر این، ایجاد عوارض جراحی در نواحی اهدا کننده از مشکلات اساسی در بازسازی بافت به این روش است (3). بنابراین، مهندسی بافت به عنوان یک راه کار جدید برای ترمیم بافت آسیب دیده بدن مطرح شده است. مهندسی بافت با استفاده مجدد از روند طبیعی رشد بافت، راهکاری برای ترمیم، حفظ و بهبود عملکرد بافت خواهد بود و در نهایت موجب تعویض کامل بافت آسیب دیده خواهد شد (2). در جستجوی راهکار جایگزین برای روشهای درمانی مرسوم ترمیم یا تعویض بافتها و اندامهای آسیب دیده بدن، راهحلهای امیدوار کنندهای از طریق مهندسی بافت ارائه شده است (2،4). داربستهای مهندسی بافت با پشتیبانی موقت از سلولها در هنگام شکلگیری ماتریس خارج سلولی Extracellular matrix (ECM) طبیعی، نقش مهمی در بازسازی بافت ایفا میکند. ECM طبیعی بدن ساختاری پیچیده، دینامیک و همچنین ویژه هر بافت دارد. ترکیبات پایه و اصلی آن شامل پروتئینهای لیفی با قطر500-50 نانومتر و زنجیرههای پلیساکاریدی است که هم عملکرد ساختاری و هم چسبندگی سلولی دارند. مهمترین هدف ساخت داربستهای مهندسی بافت تقلید از ECM بدن است که موجب ترمیم بافت آسیب دیده خواهد شد (5،6).
روش بررسی
در این مقاله مروری، یک جستجوی جامع در پایگاههای داده علمی شامل PubMed، Google Scholar و Scopus انجام شد تا تحقیقات مرتبط با داربستهای پلیمری نانو لیفی الکتروریسی شده برای مهندسی بافت غضروف جمعآوری شود. از کلمات کلیدی مانند الکتروریسی، داربستهای نانولیفی، مهندسی بافت غضروف و پلیمرهای زیستتقلید برای شناسایی مطالعات جدید، پیشرفتها و چالشهای موجود در این حوزه استفاده شد. مقالات بر اساس ارتباط، بهروز بودن و تأثیرگذاری آنها بر موضوع انتخاب شدند تا جدیدترین و مهمترین یافتهها در این مرور لحاظ شود. همچنین از منابع مقالات کلیدی برای گسترش بیشتر تحقیقات استفاده شد.
1.خواص داربستها برای کاربرد مهندسی بافت
داربستهای مهندسی بافت باید خواص مکانیکی Mechanical properties مناسب با بافت موردنظر، قابلیت پیامدهی مناسب برای هدایت رشد بافت و جلوگیری از رد پیوند را دارا باشند. همچنین داشتن شبکه متخلخل به هم پیوسته به منظور تغذیه مناسب سلول و دفع ضایعات سلولی به خارج داربست از خواص مهم داربستها بهشمار میآیند (2). هر یک از معیارها در طراحی داربست جهت مهاجرت، تکثیر و اتصال سلول اهمیت دارد. با اینحال، وجود همه این عوامل در یک داربست واحد دشوار است (7).
ساختار و مورفولوژی: ساختار و مورفولوژی داربستهای مهندسی بافت از اهمیت زیادی برخوردار است (2). داربست ساخته شده باید دارای تخلخل بالا و همچنین منافذ بهم پیوسته Interconnected pore باشد تا نفوذ سلولی و انتشار کافی مواد مغذی به درون سلول و ECM راتضمین کند (8). داشتن ساختار متخلخل به هم پیوسته برای خروج محصولات ناشی از فعل و انفعالات سلولی و همچنین تخریب داربست نیز ضروری است (2).
زیستسازگاری Biocompatibility: یکی از مهمترین ویژگیها در مورد سازههای مهندسی بافت زیستسازگاری است. سلول باید چسبندگی، عملکرد طبیعی و مهاجرت روی سطح داربست و به تدریج نفوذ به داخل داربست و در نهایت شروع تکثیر سلولی را به همراه داشته باشد تا ECM جدید ایجاد کند (8). داربستهای پلیمری باید دارای شیمی سطح مناسب برای چسبندگی، تکثیر و تمایز سلولی باشند. رفتارهای جذب و واجذب Desorption در چسبندگی سلول و تکثیر انواع مختلف سلولهای پستانداران بر روی پلیمرها، به ویژگیهای سطحی ماده، مانند ترشوندگی، نسبت آبدوستی/ آبگریزی، شیمی ماده، بار سطح و توزیع بار، زبری سطح و سختی Rigidity داربست ارتباط دارد (7).
زیست تخریبپذیری Biodegradability : داربست باید زیست تخریبپذیر باشد تا به سلول اجازه ساخت ECM جدید را بدهد و همچنین مواد حاصل از تخریب نیز نباید سمیت ایجاد کند. برای آنکه فرایند تخریب داربست همزمان با تشکیل بافت جدید صورت بگیرد، پاسخ التهابی، که همراه با نفوذ کنترل شده سلولهایی مانند ماکروفاژ باشد، مورد نیاز است (8). نرخ تخریب وابسته به ویژگیهای ذاتی پلیمر شامل ساختار شیمیایی، کریستالی/آمورف بودن، وزن مولکولی و دمای انتقال شیشه )Tg Glass Transition Temperature(متغیر است (9). برای تخریب شیمیایی داربستها دو روش مطرح است که شامل هیدرولیز شدن به واسطه آب و تخریب آنزیمی به واسطه عوامل زیستی مانند آنزیمها است (10).
خواص مکانیکی: ویژگیهای مکانیکی داربست مانند مدول الاستیسیته، استحکام کششی، چقرمگی شکستFracture toughness و خستگی Fatigue میبایستی از نظر آناتومیکی به بافت مورد نظر نزدیک باشد (11). این موضوع، چالشی برای کاربردهای استخوان و غضروف میباشد (8). همچنین لازم است داربستها ویژگی مکانیکی مورد نظر را تا پایان بازسازی بافت حفظ کنند؛ از آنجاییکه فرایند تخریب پلیمرها میتواند سبب کاهش خواص مکانیکی ذاتی آنها شود، بنابراین ارزیابی تأثیر تخریب زیست پلیمرهای استفاده شده در ساخت داربست بر خواص مکانیکی نمونه دارای اهمیت خواهد بود (9). دارا بودن خواص مکانیکی بالا برای یک داربست در تقابل با داشتن تخلخل بالا است. داشتن تخلخل بالا سبب کاهش شدید خواص مکانیکی داربست میشود و در نتیجه لازم است تا تعادل بین خواص مکانیکی و میزان تخلخل، به عنوان کلیدی، در موفقیت هر داربست در نظر گرفته شود (8).
فرایندپذیری: داربست باید با توجه به شکل و قالب مورد نظر، فرایندپذیری و شکلپذیری نسبتاً آسانی داشته باشد. همچنین زیست مواد مورد استفاده در ساخت داربست لازم است قابلیت تولید بهصورت یک محصول استریل را دارا باشند و یا داربست تولیدی، با روشهای متداول قابل استریل کردن باشد (2).
2.نقش مهندسی بافت در بازسازی غضروف
1-2- بافت غضروف
غضروف یک بافت پیوندی بسیار تخصصیافته با خصوصیات مکانیکی منحصربهفرد است که نقش مهمی در عملکرد حرکتی و ساختاری بدن ایفا میکند (12). غضروف به دلیل خواص نیمهسخت Semirigid خود، محکم و انعطافپذیر است، بهطوری که در برابر سایش و نیروهای فشاری مقاومت میکند. این ویژگیها باعث استحکام سطح بافت در برابر ضربه و کاهش اصطکاک بین استخوانها میشود (13). بافت غضروف از مایع سینوویال و سلولهای تخصصیافتهای به نام کندروسیت تشکیل شده است که در ماتریس خارجسلولی قرار دارند و نقش کلیدی در تولید و نگهداری آن دارند (12). ماتریس خارجسلولی غضروف عمدتاً شامل کلاژن و پروتئوگلیکانها است که هرکدام عملکرد و ساختار خاصی دارند. پروتئوگلیکانها دارای یک هسته پروتئینی و یک یا چند زنجیره جانبی گلیکوزامینوگلیکان هستند و در ساختار غضروف نقش مهمی ایفا میکنند. میزان بالای پروتئوگلیکانها باعث ایجاد فشار اسمزی تورمی در غضروف میشود که این ویژگی به بافت اجازه میدهد در برابر بارگذاریهای بیشتر از وزن بدن مقاومت کند (12،13). پروتئوگلیکانهای اصلی موجود در غضروف شامل آگریکان Aggrecan، فیبرومادولین Fibromodulin، دکورین Decorin و بیگلیکان Biglycan هستند. این ترکیبات نه تنها به ساختار مکانیکی غضروف کمک میکنند، بلکه در حفظ تعادل ماتریس خارجسلولی نیز مؤثر هستند. بهطور خاص، آگریکان یکی از پروتئوگلیکانهای اصلی است که در تعامل با فیبرهای کلاژن نوع II به ایجاد مقاومت مکانیکی غضروف کمک میکند (13). کلاژنها نیز یکی دیگر از اجزای حیاتی ماتریس خارجسلولی غضروف هستند. غضروفهای مفصلی دارای چند نوع کلاژن از جمله کلاژنهای نوع XI، IX،VI و II هستند. از این میان، کلاژن نوع II با تشکیل حدود ۹۰ الی ۹۵ درصد کل کلاژن موجود در غضروف، کلاژن اصلی محسوب میشود و نقش مهمی در استحکام بافت دارد (13). کندروسیتها، سلولهای بسیار تخصصیافتهای هستند که مسئول تولید، نگهداری و ترمیم ماتریس خارجسلولی میباشند. این سلولها از لحاظ متابولیکی بسیار فعال هستند و هر کدام یک نام اختصاصی کوچک برای خود ایجاد میکنند که برای ترمیم و بازسازی سریع ماتریس خارجسلولی ضروری است. نقش این سلولها در توسعه و نگهداری ساختار غضروف بسیار حیاتی است و هرگونه اختلال در عملکرد آنها میتواند منجر به تخریب بافت شود (13). بهطور کلی، بافت غضروف را میتوان به سه دسته هیالین، فیبری و الاستیک تقسیمبندی کرد که هر کدام خصوصیات و عملکردهای متفاوتی دارند. غضروف هیالین، که رایجترین نوع غضروف است، در مفاصل یافت میشود و نقش مهمی در کاهش اصطکاک و جذب شوک دارد. غضروف فیبری به دلیل داشتن فیبرهای کلاژن بیشتر، در تحمل فشارهای سنگین نقش دارد و غضروف الاستیک به دلیل داشتن فیبرهای الاستین بیشتر، خاصیت انعطافپذیری بیشتری دارد (13).
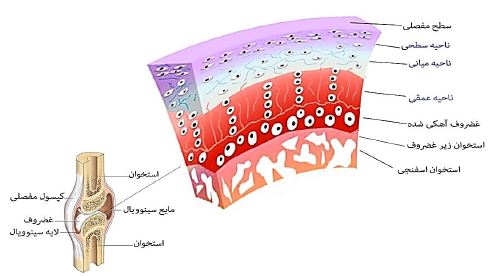
شکل 1 : ساختار آناتومیک و لایههای مختلف تشکیل دهنده بافت غضروف
2-2-بیماریهای غضروفی و روشهای درمان
التهاب مفاصل به دو شکل آرتریت روماتوئید و آرتروز میباشد. آرتریت روماتوئید یک بیماری خودایمنی است که در آن سیستم دفاعی به غضروفها حمله میکند و لایه استخوان زیرغضروفی را تخریب میکند. آرتروز یک بیماری تخریب کننده مفصلی است که با تخریب پیشرونده غضروف و افزایش تشکیل استخوان زیرغضروفی و بافت استخوانی جدید در حاشیه مفاصل همراه است. از علائم هر دو بیماری عواملی نظیر سفتی مفصل و درد میباشد (12،13).
روشهای درمان بهطور کلی شامل روشهایی مانند: آرتروسکوپی Arthroscopy ایجاد ترکهای کوچک Microfracture (14)، موزاییک پلاستی Autologous Chondrocyte Implantation (ACI) (14)، پیوند غضروف-استخوان (13) و نهایتاً روش مهندسی بافت میباشد. روش مهندسی بافت، به دلیل ظرفیت محدود بافت غضروف در ترمیم قسمت آسیب دیده از جراحی برای ترمیم نقصهای بوجود آمده استفاده میکنند. در این روش بافت بازسازی شده از لحاظ بیومکانیکی، بیوشیمیایی و ... نسبت به حالت اولیه بازدهی پایینی دارد به همین منظور در روشهای جدید از مهندسی بافت استفاده میکنند. مهندسی بافت بر روی ترکیب بهینه سلولها، داربستها و سیگنالینگ تمرکز دارد (15). یکی از اجزای مهم مهندسی بافت غضروف سلولها هستند که شامل سلولهای بنیادی مزانشیمی، پرتوان و جنینی میباشند. سلولهای غضروفی در بزرگسالان توانایی تشکیل ماتریس خارج سلولی را دارند که میتوانند از منابع مختلفی مثل دیواره بینی غضروف مفصلی گرفته شوند (16).
3- روشهای ساخت نانوالیاف
جدایش فازی یکی از روشهای ساخت نانوالیاف با ساختار سه بعدی و با ابعادی بسیار شبیه رشتههای کلاژنی ماتریس خارج سلولی (500-50 نانومتر) است. این روش بر پایه ناسازگاری فیزیکی پلیمرها و تمایل آنها برای جدایش فاز استوار است (13،17). جدایش فازی امکان ساخت داربست، با اشکال آناتومیک مورد انتظار را فراهم می کند. داربست ساخته شده توسط این روش دارای ظاهری متخلخل و اسفنجی با منافذ کروی در ابعاد میکرو میباشد (13،17). ساخت داربست به این روش ساده بوده و به ابزار پیچیدهای نیاز ندارد اما به ترکیب پلیمر- حلالهای مشخص محدود میشود. در این روش کنترل ابعاد الیاف دشوار است و خواص مکانیکی داربست با توجه به ساختار بسیار متخلخل برای کاربردهایی که نیاز به تحمل بار دارند، مناسب نیست (17).
خود چیدمانی: خود چیدمانی فرآیندی است که در آن اجزا در یک سیستم، به صورت خودبخودی، از طریق بر همکنش بهخصوص و/یا متأثر از محیط بهصورت غیرمستقیم آرایش مییابند (13،17). در ساخت نانوالیاف، خود چیدمانی فرآیندی است که در آن مولکولهای کوچک به عنوان بلوکهای اساسی ساختار، به شکل نانوالیاف به یکدیگر اضافه میشوند. این شیوه پیشرفت زیادی در ترمیم بافتهای مختلف آسیب دیده مانند غضروف، استخوان، عصب، قلب و رگ ایجاد کرده است. در خودآرائی، نیروهای بین مولکولی خواص و شکل نانو الیاف را تعیین میکنند. خواص مکانیکی ضعیف داربستهای نانولیفی پپتیدی ممکن است کاربرد آن ها را به مواردی که نیاز به تحمل بار ندارند محدود کند (17).
کشش: در این فرآیند یک میکروپیپت به قطر چند میکرومتر درون محلول پلیمری فرورفته و سپس با سرعت ثابت خارج میشود که منجر به تولید نانوالیاف میشود. این فرایند بسیار ساده است و برای مواد ویسکوالاستیک مناسب است که در هنگام ایجاد تغییر شکل زیاد آرایش یافتگی کافی برای تحمل تنشهای ایجاد شده هنگام کشش را دارا هستند. با این وجود، محدود به مقیاس آزمایشگاهی است و کنترلی روی ابعاد وجود ندارد و همچنین نیازمند یک مرحله اضافی مانند بافندگی هستند (17).
الکتروریسی: الکتروریسی فرآیندی است که توانایی تولید نانوالیاف با قطری در حدود 500-100 نانومتر را دارد. این روش به جهت توسعه نانوالیاف در کاربردهایی همچون تهیه داربست های مهندسی بافت و رهایش دارو از اهمیت ویژهای برخوردار است (18). در شکل 2، شماتیکی از فرآیند الکتروریسی و داربست تشکیل شده به تصویر کشیده شده است اجزای اصلی دستگاه شامل یک سرنگ حاوی محلول پلیمری، سوزن فلزی، منبع تغذیه و جمع کننده است. این فرآیند با انتقال بارهای الکتریکی توسط سوزن به محلول پلیمری آغاز میشود. که این امر باعث ناپایداری در محلول پلیمری و القاء بار در قطرات پلیمر میشود و نیروی بارهای همنام در جهت عکس نیروی کشش سطحی عمل میکنند که منجر به جریان محلول پلیمر در جهت میدان الکتریکی میشود. افزایش بیشتر بارها در میدان الکتریکی سبب تغییر در شکل قطرات از کروی به سمت مخروطی میگردد. در این مرحله، نانوالیاف بسیار ریز از مخروط تیلور خارج شده و بر روی جمع کننده که در فاصله بهینه واقع شده، جمع میشوند. در طی این مسیر دافعه متقابل شارژهای سطحی موجود، باعث بروز ناپایداری و خم شدن جت میشوند. این حرکت شلاق گونه Whipping motion به زنجیرهای پلیمر اجازه می دهد کشیده شده و از کنار یکدیگر سر بخورند و در نتیجه الیاف تا حدی نازک میشوند که میتوان به آن ها عنوان نانو الیاف را اطلاق کرد (19). الیاف پلیمری، با تبخیر حلال جامد شده و روی جمعکننده متصل به زمین جمع میشوند که به طور معمول الیاف به صورت تصادفی، شکل حصیری میگیرند ولی بسته به نوع کاربرد میتوان از اشکال مختلف جمع کننده مانند صفحه ثابت، مندرل چرخان یا حمام انعقاد استفاده نمود (18).
1-3-عوامل تاثیر گذار بر فرایند الکتروریسی
3-1-1-عوامل محلولی:
غلظت و گرانروی: برای تشکیل نانو الیاف به غلظت مناسبی از پلیمر نیاز است (18). غلظت محلول پلیمری باید به اندازه کافی بالا باشد تا گره خوردگی زنجیر پلیمر رخ دهد (18). اگر محلول خیلی رقیق باشد، الیاف پلیمر قبل از رسیدن به جمع کننده بدلیل اثرات تنش سطحی شکسته میشوند ونقص مهرهای رخ میدهد (18،19). اما اگر محلول بیش از حد غلیظ باشد، به دلیل گرانروی بالا الیاف تشکیل نمیشوند و کنترل سرعت جریان محلول در سرسوزن دشوار میشود. در بسیاری از آزمایشات نشان داده شده است که در محدوده بهینه غلظت پلیمر، قطر الیاف با افزایش غلظت پلیمر افزایش مییابد (18). هدایت الکتریکی محلول: هدایت محلول علاوه برتاثیر روی شکل گیری مخروط تیلور در کنترل قطر نانوالیاف به میزان 10 تا 100برابر تأثیر میگذارد (18). در محلول های با هدایت الکتریکی پایین، امکان تشکیل مخروط تیلور وجود ندارد و الکتروریسی اتفاق نمیافتد (19،20). محلولهای با هدایت بالا، ظرفیت حمل بار بیشتری نسبت به محلول های با هدایت کم دارند و افزایش هدایت محلول به مقدار زیاد نه تنها باعث افزایش بار روی سطح قطرات برای تشکیل مخروط تیلور میشود بلکه باعث کاهش قطر الیاف نیز میگردد. افزایش رسانایی فراتر از یک مقدار مشخص نیز مانع از شکلگیری مخروط تیلور و الکتروریسی میشود (18). هدایت یک محلول پلیمری را میتوان با افزودن نمک مناسب به محلول کنترل کرد. در برخی از مطالعات، مشاهده شده است که پس از افزودن نمک به محلول پلیمر، نه تنها سطح نانوالیاف صاف میشود، بلکه قطر نانو الیاف نیز نسبت به قبل از افزودن نمک کاهش مییابد (19).
فراریت حلال: انتخاب حلال میتواند بر روی تشکیل یا عدم تشکیل الیاف و همچنین میزان تخلخل و ایجاد مهره تأثیر بگذارد (18،19). برای انتخاب حلال مناسب دو نکته حائز اهمیت است. اول آن که برای الکتروریسی، ترجیح با حلالی است که بتواند پلیمر را کاملاً حل کند و دوم آن که نقطه جوش مناسبی داشته باشد. معمولاً از حلالهای نسبتاً فرار به دلیل نرخ تبخیر مناسب برای الکتروریسی استفاده میشود. در الکترورریسی از حلال های بسیار فرار به دلیل رسوب نانوالیاف برروی جمع کننده و ایجاد نقص مهرهای در الیاف، در اثر دمای جوش پایین و سرعت تبخیر زیاد استفاده نمیشود و همچنین حلالهای کمفرار بدلیل دمای جوش بالا و خشک شدن ناکافی لیف مطلوب نیستند (19).
2-1-3-عوامل فرایندی:
ولتاژ اعمالی: ولتاژ اعمال شده به محلول یک عامل مهم است. به این دلیل که تشکیل لیف تنها هنگامی اتفاق می افتد که ولتاژ اعمال شده از آستانه ولتاژ (در حدود KV / cm 1، که به محلول پلیمری مورد استفاده وابسته است) فراتر رود(7). این فرایند بدین صورت است که جریان مستقیم با ولتاژ بالا از منبع تغذیه از طریق سوزن فلزی به محلول وارد میشود و ولتاژ بحرانی باعث تغییر وضعیت از شکل قطرات کروی به مخروط تیلور میشود (18،19). این ولتاژ بالا به ساخت الیاف با قطرهای کوچک کمک میکند. کاهش ولتاژ اعمالی منجر به ساخت الیاف با قطر بزرگتر میشود و با ادامه کاهش ولتاژ، قَطره در نوک مخروط تیلور آویزان میشود (18). افزایش ولتاژ اعمال شده فراتر از مقدار بحرانی منجر به تشکیل نقص مهره Bead defect یا نانو الیاف مهره دار خواهد شد (18،19).
سرعت جریان: سرعت جریان محلول پلیمری از طریق نوک سوزن سبب تعیین مورفولوژی نانوالیاف الکتروریسی شده میشود (19). مشاهده شده است که قطر الیاف و اندازه منافذ با افزایش سرعت جریان افزایش مییابد. علاوه بر این، در سرعت بالا میزان قابل توجهی از نقایص مهرهای مشاهده میشود که دلیل آن عدم توانایی الیاف برای خشک شدن کامل، قبل از رسیدن به جمع کننده است. خشک شدن ناقص الیاف منجر به تشکیل الیاف روبان مانند Ribbon-like (یا مسطح) به جای الیاف با سطح مقطع دایرهای میشود (18،19). از آنجا که افزایش و کاهش در سرعت جریان بر شکلگیری و قطر نانوالیاف تأثیر میگذارد، برای حفظ تعادل بین محلول پلیمری در حال ترک از نازل و جایگزینی آن با محلول جدید در هنگام تشکیل جت، نرخ جریان بهینه پیشنهاد میشود. نانوالیاف الکتروریسی شده یکنواخت بدون مهره را میتوان از طریق یک سرعت جریان بحرانی برای یک محلول پلیمری تهیه کرد (19). مقدار این جریان بحرانی در هر سیستم پلیمری متفاوت است نرخ جریان پلیمر علاوه بر تخلخل الیاف و شکل الیاف، اندازه الیاف را هم تحت تأثیر قرار میدهد (19،20).
فاصله سوزن تا جمعکننده: فاصله بین سوزن تا جمعکننده نقش مهمی در تعیین موفولوژی نانوالیاف الکتروریسی شده ایفا میکند. این عامل با کنترل فاصله و به پیروی از آن مدت زمان برای تبخیر کافی حلال قبل از رسیدن نانوالیاف به جمعکننده میتواند از 10- 100 برابر بر اندازه و مورفولوژی نانوالیاف تاثیر بگذارد (3،19،21). مورفولوژی به آسانی از فاصله تأثیر میپذیرد چراکه به زمان جمع شدن، سرعت تبخیر و فواصل زمانی ناپایداریها و حرکات شلاقگونه وابسته است (19). گروههای تحقیقاتی متعددی تأثیر فاصله بین نوک سوزن و جمع کننده را مورد بررسی قرار داده و نتیجه گرفتهاند وقتی که این فاصله کم نگه داشته شود نانوالیاف با قطر بزرگ و معیوب تشکیل میشوند، در حالیکه با افزایش فاصله قطر نانوالیاف کاهش مییابد. با اینحال، مواردی وجود دارد که با تغییر فاصله بین سوزن فلزی و جمع کننده هیچ تأثیری در مورفولوژی نانوالیاف مشاهده نشده است (19،21). از اینرو، برای تهیه نانوالیاف الکتروریسی شده صاف و یکنواخت، باید یک فاصله خاص را حفظ نمود (19).
قطر سرسوزن: افزایش قطر سوزن بر مورفولوژی الیاف، خصوصاً قطر متوسط الیاف تأثیر نمیگذارد. با این وجود، کاهش قطر سوزن منجر به افزایش مقاومت در برابر قطر لیف میشود و در نتیجه میتوان نانوالیاف را با قطر بزرگتر و کوچکتر در طی مراحل ساخت بدست آورد. تجزیه و تحلیل آنها نشان داده به جز توزیع گسترده دامنه قطر لیف که با سوزن قطر کمتر دیده میشود، هیچ ارتباط معنیداری بین میانگین قطر نانوالیاف و قطر سوزن وجود ندارد (19).
شرایط محیطی: شرایط محیطی را میتوان به دما ورطوبت بیرون و درون دستگاه الکتروریسی نسبت داد. افزایش دما منجر به ساخت نانوالیاف با قطر کم میشود. که این کاهش قطر را میتوان به کاهش گرانروی محلول های پلیمری در اثر افزایش دما نسبت داد (20،22). با اینحال، دمای پایینتر میتواند باعث گرفتگی سوزن در طی مراحل ساخت شود. بنابراین، کنترل دما در طول ساخت فرایند میتواند بهطور قابلتوجهی به نتایج بهتر کمک کند. افزایش رطوبت معمولا تاثیری در شکل یا قطر نانوالیاف ندارد ولی در متخلخل کردن الیاف که نقش مهمی در چسبندگی و نفوذ سلول دارد موثر است. همچنین تأثیر رطوبت در پلیمرهای مختلف اثر متفاوتی را نشان میدهد. به عنوان مثال در سلولز استات و پلی وینیل پیرولیدون، افزایش رطوبت باعث میشود که متوسط قطر الیاف افزایش یابد. بنابراین، رطوبت با توجه به ماهیت و نوع پلیمری که برای ساخت نانوالیاف مورد استفاده قرار میگیرد، نیاز به بهینهسازی دارد (19).

شکل 2 : شماتیکی از فرایند الکتروریسی و کاربرد آن به عنوان داربست مهندسی بافت (20)
4- نانوالیاف برای ساخت داربست
1-4-انواع الکتروریسی
الکتروریسی ذوبی و محلولی: هنگام الکتروریسی پلیمر، معمولاً یکی از این دو روش، قابل استفاده است. پلیمر را میتوان در یک حلال مناسب حل کرد و الکتروریسی نمود یا میتوان پلیمر را بهطور مستقیم به حالت مذاب الکتروریسی کرد. بهطور کلی، الکتروریسی در حالت محلول منجر به طیف گستردهتری از اندازه الیاف میشود، در حالیکه الکتروریسی مذاب معمولاً به اندازههای در مقیاس میکرون محدود میشود. با این وجود مزایا و معایبی برای هر کدام از این دو روش وجود دارد. الکتروریسی مذاب نیاز به حلالهای آلی را برطرف میکند، که برای فرآیندهای صنعتی ایدهآل است. با اینحال، در الکتروریسی مذاب باید درجه حرارت بالا نگه داشته شود تا الکتروریسی امکانپذیر باشد، در حالیکه در روش محلولی، محلولهای پایدار معمولاً میتوانند در دمای اتاق الکتروریسی شوند. دمای بالا ممکن است مانع از استفاده حالت مذاب برای مهندسی بافت یا کاربردهای دارویی شود. استفاده از مذاب پلیمر همچنین مشکل تبخیر ناکافی حلال بین نوک سوزن و جمع کننده را از بین میبرد. با اینحال، پلیمر باید قادر باشد به اندازه کافی در این فاصله خنک شود تا بتواند الیاف استوانهای شکل را تولید کند (18).
الکتروریسی خیس Wet electrospinning: الکتروریسی خیس یکی از مدلهای بهبودیافته در فرآیند الکتروریسی است که از ترکیب تکنیک الکتروریسی و حمام انعقاد به جای جمعکننده استفاده میکند. برخلاف روش الکتروریسی معمول، که در آن از جمع کنندههای فلزی جامد برای جمعآوری الیاف استفاده میشود، در الکتروریسی خیس از یک جمع کننده مخزنی حاوی مایع به عنوان یک جمع کننده متصل به زمین استفاده میشود. با جمعآوری الیاف در محیط آبی، مایع میتواند به عنوان جداکننده بین الیاف عمل کرده و از متراکم شدن الیاف روی یکدیگر جلوگیری کند. علاوه بر این، به دلیل فاصله استریوسکوپی زیاد بین الیاف تولید شده، الیاف بهجای رشد در سطح میتوانند در ضخامت رشد کنند. استفاده از این تکنیک امکان افزایش بیشتر در اندازه منافذ داربست، با استفاده از یک پروژن پراکنده در حمام جمعکننده را انجامپذیر میسازد. در این فرآیند چگالی ظاهری و تخلخل نانوالیاف، بستگی به کشش سطحی حمام الکتروریسی خیس دارد. به عنوان مثال، با کاهش کشش سطحی حمام، چگالی ظاهری داربست کاهش و تخلخل داربست افزایش مییابد (23).
2-4-داربستهای الکتروریسی شده دو بعدی و سه بعدی
داربستهای الکتروریسی شده نانولیفی ساخته شده از زیست مواد گوناگونی در مهندسی بافت جهت ایجاد تمایز غضروف یا چسبندگی و رشد در شرایط آزمایشگاهی برای انواع مختلف سلولها از جمله سلولهای بنیادی مزانشیمی MSC Mesenchymal stem cells مورد استفاده قرار میگیرند (24). سلولها رفتارهای متفاوتی را در داربستهای سه بعدی و دو بعدی دارا هستند. برای مثال سلولهای غضروفی کندروسیت در کشت دو بعدی (مانند سطح پلیت کشت سلولی) دگرتمایزی Dedifferentiate پیدا میکنند اما هنگامیکه کشت سه بعدی (به عنوان مثال روی یک داربست متخلخل) داده میشوند فنوتیپ Phenotype خود را حفظ خواهد کرد (25). در یک داربست مهندسی شده موفق نهتنها باید قطر الیاف کنترل شده باشد بلکه جهتگیری آنها حائز اهمیت است. داربستهای نانولیفی تولید شده با الیاف موازی از روشهای الکتروریسی بسیار مورد توجه هستند. زیرا جهتگیری الیاف تاثیر مستقیم بر رفتار سلولی میگذارد (26) برای بافتهایی مانند قلب، اعصاب و عضلات خاصیت هدایت داربست مورد اهمیت میباشد افزودن گرافین و گرافین اکسید به پلیمرهای زیست فعال مانند PAN /PANI Polyacrylonitriie- Polyaniline موجب افزایش هدایتپذیری و زیستسازگاری خواهد شد و درحضور CSA Camphor sulfuric acid، پلیمر راحتتر در حلال (DMF) Dimethylformamide حل شده و هدایت افزایش مییابد. در نتیجه الیاف الکتروریسی شده CSA- PAN/PANI و G طی بررسیهای مختلف نشان داد داربستی با استحکام کششی بالا و زیست سازگار تولید خواهد کرد و سلولهای بنیادی میتوانند بر روی آن تکثیر و تمایز داشته باشد (27) همچنین مطالعات نشان داد کامپوزیت الیاف الکتروریسی شده ریشه چغندر قند و نایلون ۶۶ موجب افزایش چسبندگی، تکثیر و تمایز سلولهای بنیادی و کراتین انسانی به صورت کشت همزمان Co-culture به سلولهای اپیتلیال شده و برای مهندسی بافت پوست بسیار مناسب است (28) همچنین مطالعه بر روی ترکیب پلی گلیسرول سباسات Polyglycerol sebacate (PGS) که پلیاستری زیستسازگار و زیست تخریبپذیر است به همراه ژلاتین بهطور گسترده خاصیت الکتروریسی شدن را بهبود میبخشد اما به دلیل ناپایداری در محیط آبی بدن و خواص مکانیکی ضعیف این ترکیب به آن پلی کاپرولاکتون میافزایند در نتیجه استفاده از سلولهای گلیال (نوعی سلول در بافت عصب) در این داربست در محیط درون بطنی نشان داد که سلولهای گلیال C6 موش میتوانند تکثیر و تمایز داشته باشند و توانایی استفاده در مهندسی بافت عصب را دارا میباشد (29).
3-4- بهبود ابعاد منافذ در داربستهای نانو الیافی
سادهترین راهکار برای افزایش سایز منافذ داربستهای الکتروریسی شده، اصلاح عوامل فرآیندی میباشد زیرا بین قطر الیاف و سایز منافذ رابطه وجود دارد. هر چقدر قطر الیاف بیشتر شود سایز منافذ افزایش مییابد؛ این یک توافق تجربی برای دامنهای از پلیمرهای پر کاربرد در مهندسی بافت مانند پلی کاپرولاکتون و ژلاتین میباشد. بهعنوان مثال گزارش شده است افزایش 2/5 برابری قطر الیاف الکتروریسی شده پلی کاپرولاکتون موجب افزایش 2/25 برابری سایز منافذ میشود (25). الکتروریسی خیس نیز از دیگر روشهای افزایش سایز منافذ و ایجاد داربستهای نانولیفی سه بعدی است. در این روش معمولاً از یک حمام آب، الکل و یا متانول به عنوان جمعکننده متصل به زمین جهت جمعآوری الیاف تولید شده استفاده میشود. الیاف جمعآوری شده سپس با روش خشک کردن انجمادی استحکام و شکل پیدا میکند. از این روش برای افزایش سایز منافذ در پلی گلیکولیک اسید و همچنین ابریشم استفاده شده است (30). همچنین در طول فرآیند الکتروریسی مواد مختلفی از جمله پلیمرهای حل شونده در آب، ذرات نمک و کریستالهای یخ میتواند بهطور موقت با الیاف شکل گیرند و نقش عامل حذف شونده را اجرا کنند. در نتیجه منافذی بین الیاف الکتروریسی شده به وجود میآید که سایز این منافذ به اندازه ذرات فدا شونده Sacrificial component بستگی دارد (5). الکتروریسی (FLUF) Focused, low density, uncompressed nanofiber یکی دیگر از روشهای افزایش سایز منافذ میباشد که در آن یک قطعه فلزی داخل یک صفحه نارسانای نیم کروی جایگزین صفحات جمع کننده مسطح میگردد (25). همچنین یکی از روشهای دیگر برای افزایش سایز منافذ استفاده از لیزر میباشد. استفاده از روش لیزر بر روی نانوالیاف الکتروریسی شده اولین بار برای الیاف پلی کاپرولاکتون صورت گرفت. لیزری با شدت بالا و پرتوتابی Radiance فوق سریع بر روی سطح نانو الیاف الکتروریسی شده تابانده میشود و به خاطر گرمای فوق سریع ایجاد شده در محل هدف، الیاف ذوب شده و انرژی بالای لیزر موجب تخلخل در الیاف میشود (30).
5-کاربرد نانو الیاف الکتروریسی شده در مهندسی بافت غضروف
1-5- مزایای ساختارهای نانولیفی در بازسازی غضروف
در طی سالهای اخیر روش الکتروریسی به عنوان متداول ترین روش تولید نانوالیاف برای ساخت داربستهای نانولیفی با قابلیت ایجاد شرایط تمایزMSC به کندروسیتها یا بستری برای گسترش سلولهای کندروسیت موردتوجه قرار گرفته است. داربستهای الکتروریسی شده به دلیل توانایی تطبیق با معیارهای مورد نیاز برای بازسازی غضروف مانند ساختار مکانیکی مناسب، تسهیل مهاجرت، تکثیر و تمایز سلولی در مهندسی بافت غضروف پرکاربرد هستند (31). به علاوه، برخلاف سایر انواع داربست متداول که دارای ساختار متخلخل با منافذ محدود هستند، منافذی که از کنار هم قرار گرفتن نانوالیاف در الکتروریسی تشکیل میشوند کاملاً بههم پیوسته هستند و امکان تغذیه سلولهای کندروسیت را تأمین میکنند (32). اولین اتفاقی که بعد از کاشت سلول روی داربست صورت میگیرد، چسبندگی است که به خاطر نسبت سطح به حجم بالای نانو الیاف، شرایط بسیار مناسبی برای چسبندگی سلولها وجود دارد (25). میزان بازسازی در بافت آسیب دیده بستگی به در دسترس بودن منافذ بزرگ Macropores برای نفوذ سلولی دارد. کوچک بودن اندازه منافذ ایجاد شده در ساختارهای الکتروریسی شده یکی از معایب این داربستها است که موجب محدود شدن بازسازی بافت خواهد شد (33). مطالعات لی و همکارانش، نشان داده است الیاف پلیکاپرولاکتون الکتروریسی شده موجب افزایش فنوتیپ کندروسیتها نسبت به بافت کشت داده شده روی سطح پلیت کشت سلول پلیاستایرنی ((TCPS Tissue culture polystyrene خواهد شد. همچنین کندروسیتها حالت دوکی Spindle شکل خود را حفظ کرده و در مقابل، سلولهای کندروسیت در سیستم TCPS شکل صاف به خود میگیرند (34). برهم کنش سلول با الیاف به سرعت باعث تعامل لیگاند سطح سلول با پروتئینهایی مانند فیبرونکتین، ویترونکتین، کلاژن و لامینین میشود. همچنین به دلیل سه بعدی بودن سطح این داربستها بر رفتار سلولی تاثیرگذار هستند و در این نوع داربستها بیان پروتئین های کندروسیتی شامل کلاژن نوع ٢ و ۴ و اگریکان بیشتر خواهد شد (35).
2-5- زیست پلیمرها برای ساخت نانوالیاف
1-2-5-پلیمرهای طبیعی: بیشتر پلیمرهای طبیعی، زیست سازگار و قابل تجزیه هستند. با اینحال، پلیمرهای طبیعی معایبی همچون احتمال ایمنیزایی Immunogenicity و خواص مکانیکی پایین دارند (36). پلیمرهای طبیعی به سهدسته اصلی طبقهبندی میشوند: پلینوکلئوتیدها که از زنجیرههای نوکلئوتید ساخته میشوند، پلیآمیدها که از زنجیرههای پروتئین ساخته میشوند و در آخر پلیساکاریدها که از زنجیرههای قند تشکیل میشوند (13). نمونههایی از پروتئینها مانند ابریشم، کلاژن، ژلاتین، فیبرینوژن، الاستین، کراتین، اکتین و میوزین و پلی ساکاریدها مانند سلولز، آمیلوز، دکستران، کیتین و گلیکوزآمینوگلیکانها هستند (9). کلاژن نوع I و IV بیشترین کاربرد را در مهندسی بافت دارند (13). به عنوان یک ماده طبیعی کلاژن قابلیت جذب و زیستسازگاری عالی و ایمنیزایی کمی را داراست (37). ژلاتین از کلاژن دناتوره Denatured شده بهوجود میآید. این ماده در حالیکه زیستسازگاری و ترکیبات شیمیایی مشابه کلاژن دارد مزیت اقتصادی در مقایسه با کلاژن خالص به جهت قیمت تمام شده را داراست (29) و توانایی حمایت از رشد استئوبلاستها و بازسازی استخوان در مناطق معیوب را دارد (12). داربستهایی از جنس سلولز به دلیل پایداری عالی، زیستسازگاری مطلوب، بهرهوری زیست محیطی و تجدیدپذیری یک موضوع تحقیقاتی مناسب در زمینه داربستهای مهندسی بافت است (38). کیتوسان پلیمری است که از استیلزدایی کیتین بهدست میآید و کیتین از پوست خرچنگ بهدست میآید (13). این پلیمر به دلیل زیستسازگاری بالا، زیست تخریبپذیری، خاصیت ضد باکتریایی، کمهزینه بودن و خاصیت انعقادی خون به عنوان یک ماده کاربردی مناسب در نظر گرفته میشود (12). آلژیناتها که اسید آلژنیک نیز شناخته میشوند، پلیساکاریدهای آنیونی جدا شده از جلبکها هستند. آنها از دو مونوساکارید تکرار شونده، یعنی اسید گلوکورونیک l-glucuronic acid و اسید مانورونیک D-mannuronic acid تشکیل شدهاند. ازعوامل شیمیایی مانند ادتات (EDTA) Ethylenediaminetetraacetic acid یا از آنزیمها برای تخریب آلژینات کلسیم استفاده میشود (13). پکتین یک پلیساکارید گیاهی است که از گیاهان خوراکی غنی شده در واحدهای متیلاستر گالاکتورونیک اسید و گالاکتورونیک اسید بهدست میآید. فیبروئین ابریشم به عنوان یک ماده زیستی امیدوارکننده در مهندسی بافت استخوان مورد تحقیق قرار گرفتهاست زیرا چندین مورد مفید را به نمایش میگذارد و خواصی مانند زیستسازگاری مناسب، زیست تخریبپذیری، نفوذپذیری کافی اکسیژن و بخار آب و حداقل واکنش التهابی را دارا میباشد (12). هیالورونیک اسید از پرمصرف ترین مواد در ساخت داربستهای مهندسی بافت غضروف مفصلی است. در سالهای اخیر از هیالورونیک اسید تحت عنوان ژل برای داربستهای مهندسی بافت غضروف استفاده میشود. ژل هیالورونیک میتواند مرفولوژی کندروسیتها را حفظ کند و باعث تقویت سنتز ماتریکس غضروف در شرایط آزمایشگاهی شود. علاوه بر این، سازههای ژل هیالورونیک کندروسیت میتوانند به خوبی با غضروفهای طبیعی پس از ترشح ماتریس غضروفی در داخل بدن ادغام شوند (36). آگاروز از جلبکهای دریایی جدا شده و کاربردهای گستردهای در رهایش کنترل شده داروها دارد. یکی از ویژگیهای منحصر به فرد آگارز در بیوفابریکیشن Biofabrication است که توانایی تنظیم خصوصیات مکانیکی مناسب برای کاربردهای مهندسی بافت را دارا میباشد (13).
2-2-5-پلیمرهای مصنوعی: برخی از پلیمرهای مصنوعی که معمولاً در ساختارهای زیستی مورد استفاده قرار میگیرند شامل پلیگلیکولیک اسیدPGA، پلیلاکتیکاسید PLA، کوپلیمر آنها پلی لاکتیک کوگلیکولیک اسیدPLGA ، پلیآنیدرید، پلیپروپیلن فومارات، پلی کاپرولاکتون، پلیاتیلنگلیکول PEG و پلی یورتان هستند و از بین آنها اغلب PGA ، PLA و PLGA برای مهندسی بافت غضروف مورد استفاده قرار میگیرد (شکل -3) (13). بعضی از این پلیمرها قابل تجزیه هستند. پلیمرهای رسانا، مانند پلیآنیلیل Polyaniline و پلیپیرولPolypyrrole، پلیمرهای پیزوالکتریک مانند پلیوینیلیدین فلوراید Polyvinylidene fluoride مزیتهای افزوده برای داربست فراهم میکنند و میتوانند برای ایجاد محرک الکتریکی یا مکانیکی مورد استفاده قرار گیرند (39). استفاده از PLA به تنهایی برای داربستهای الکتروریسی در بازسازی غضروف به دلیل سرعت پایین پاکسازی مواد اسیدی حاصل از تخریب پلیمر که باعث تجمع آنها در بافت میشود مورد توجه قرار نگرفته است. به همین منظور اغلب به عنوان یک جزء برای ترکیب از آنها استفاده میشود. پلیگلایکولیکاسید، یک پلیاستر نیمه کریستالی است و به دلیل دوره تخریب نسبتاً سریع، پلیمری مناسب برای داربستها میباشند. یکی دیگر از پلیمرهای مصنوعی مبتنی بر پلیاستر، پلی کاپرولاکتون PCL است که بهطور گسترده در کاربردهای الکتروریسی غضروف مورد مطالعه قرار گرفته است. از آنجاییکه تخریب برای این پلیمر بسیار کندتر از PGA است (بیش از ۲۴ ماه) و احتمال تجمع محصولات تخریب اسیدی به دلیل سرعت پاکسازی پایین را از بین میبرد میتواند یک پلیمر ایدهآل باشد. علاوه بر این، فرآیندپذیری عالی در انواع حلالهای آلی و غیر آلی کاربرد آن را به عنوان ماده ترکیبی برای کاربردهای بافت غضروف افزایش میدهد (34).
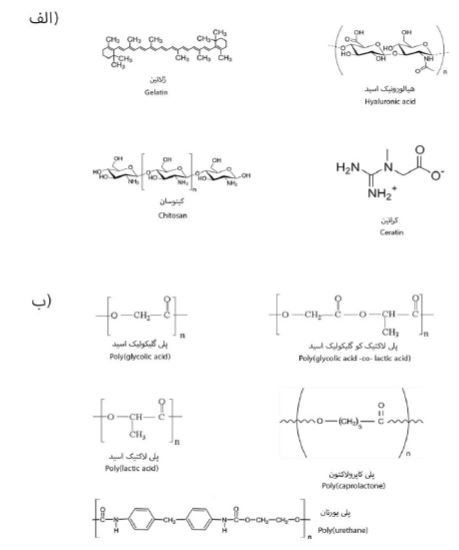
شکل3: فرمول ساختاری پلیمرهای طبیعی و سنتزی تخریب پذیر
6- مرور مطالعات انجام شده برای ترمیم غضروف با روش الکتروریسی
نقص غضروف مفصلی یک چالش بالینی است که منجر به بیماری آرتروز میشود (40). روشهای جراحی و سلول درمانی، نتوانستهاند یک راهکار مناسب ارائه دهند. به همین منظور ساخت داربستهای مشابه ماتریس خارج سلولی با کمک روش الکتروریسی میتواند راهگشا باشد (40). الکتروریسی یک ابزار قدرتمند برای ساخت داربستها میباشد زیرا ساده، ارزان، متنوع و قادر به ساختن ECM است (23). به تازگی، داربستهای نانولیفی برای مهندسی بافت مورد استفاده قرار گرفتهاند زیرا اعتقاد بر این است که داربستهای نانولیفی قادر به حفظ ویژگی های مشابه اجزای ماتریس خارج سلولی هستند (12،30). یکی از بزرگترین مزایای استفاده از الکتروریسی ظرفیت پردازش مواد مختلف برای تولید داربستها با خواص شیمیایی و مکانیکی متنوع است که میتواند به پاسخهای مختلف بیولوژیکی در سلولها منجر گردد (19). مطالعات نشان میدهد داربست با الیاف جهت دار، باعث افزایش توانایی ترمیم غضروف به واسطه افزایش چسبندگی، تکثیر و تمایز سلولهای کاشته شده میشود (41). اخیراً مشخص شده است که داربست کامپوزیتی پلیلاکتیککوگلیکولیکاسید/ فیبرویین ابریشم/PLLAPoly-l-lactic acid نسبت به داربست PLLA بدون SF چسبندگی، تکثیر و رشد کندروسیتها را بیشتر افزایش داده و این داربست را به عنوان ماده مناسب جهت کاربرد در مهندسی بافت غضروف معرفی میکند (15). در شرایط طبیعی بدن، کندروسیتها تحت دو عامل فشار و توپوگرافی سطح، غضروفسازی میکنند مطالعات نشان میدهد استفاده از دستگاه پرفیوژن بیوراکتور Perfusion bioreactor با اعمال فشار هیدرودینامیکی بر روی داربست الکتروریسی شده PCL/PLGA که در آن سلولهای MSC بارگذاری شده باشد در محیط کشت تمایزی Differentiating medium میتواند بیان کلاژن نوع ۲ و آگریکان را افزایش دهد و موجب تمایز MSC به کندروسیتها خواهد شد (42). در مطالعهای که از ترکیب پلی کاپرولاکتون/ژلاتین/ کیتوسان درون حلالهای استیک اسید و فرمیک اسید برای الکتروریسی و ساخت داربست مورد استفاده قرا گرفته بود نتایج تست MTT در رابطه با زیستسازگاری داربست نشان داد که سلولهای بنیادی توانایی تکثیر بالایی در این داربست پیدا خواهند کرد و همچنین چسبندگی سلولی و نیز تمایزتکثیر سلولی بالاتری نسبت به داربست PCL با کلاژن / ژلاتین خواهد داشت (43). ساخت داربست PCL محلول در فرمیک اسید و استیک اسید با اصلاح سطح و اتصال GAG نشان داد که این داربست نسبت به PCL، موجب افزایش آبدوستی سطح به دلیل پیوندهای کووالانسی GAG شده است. آزمون سمیت سلولی نشان داد این داربست در بازههای زمانی ۲۴/ ۴۸/ ٧٢ ساعت هیچگونه سمیت سلولی ایجاد نکرده و از وضعیت تکثیر سلولی حمایت می کند و نیز موجب تمایز سلولهای بنیادی به کندروسیتها خواهد شد (44). در مطالعهای که از داربست الکتروریسی شده پلیوینیلالکل/آلژینات سولفات PVA/ALG-S با نسبت وزنی 30 درصد استفاده شده است مشاهدات نشاندهنده میزان بالای منافذ در داربست با ساختاری تصادفی از PVA/ALG-S نسبت به PVA خالص و افزایش تکثیر و چسبندگی سلولی بوده است. همچنین آزمون MTT بیانگر زیستسازگاری و غیر سمی بودن این داربست برای سلولهای بنیادی نیز میباشد (6). ساخت داربست PCL اصلاح شده توسط اتصال ژلاتین با پیوندهای کوالانسی و اصلاح سطح توسط گروه های کربوکسیل و الکتروریسی آن نیز نتایج جالبی را در برداشت. تولید داربستی با منافذ بالا که این منافذ به یکدیگر پیوسته هستند. همچنین آزمون WCA (Water contact angle) آبدوست بودن سطح PCL برای چسبندگی بهتر داربست را نشان داد. نتایج آزمون MTT بیانگر زیستسازگاری بالای این داربست میباشد (4). در تولید داربستی که در آن ژلاتین با گلیکوزآمینوگلیکان حل شده در آب و الکتروریسی شده و توسط گلوتارالدهید در داربست اتصالات عرضی ایجاد گردیده، نتایج نشان داد در هیچکدام از داربستها در ۴ غلظت متفاوت از ژلاتین با عناوین (G0، G1، G2، G3) افزایش میزان GAG باعث کاهش قطر الیاف خواهد شد و داربست G3 آبدوستی بالاتری نسبت به نمونههای دیگر از خود نشان داد و داربست G3 از بالاترین میزان ترشح GAG برخوردار بوده است (45). در ساخت داربست نانولیفی PLGA / PCL به دو صورت الیاف تصادفی و موازی با استفاده از الکتروریسی، نتایج بیان میکند در تست MTT این داربست چه در آرایش تصادفی و چه موازی تکثیر hBMMCs وجود دارد و ایجاد سمیت نمیکند. این مطالعه بیان می دارد که بیشترین تکثیر سلولی از آبدوستی PLGA نشأت میگیرد. همچنین تصاویر SEM نشان داد با افزایش نسبت PCL قطر منافذ داربست نانولیفی افزایش مییابد داربست PLGA/PCL دارای منافذ به هم متصل میباشد. خواص مکانیکی داربست با الیاف موازی دارای خواص مکانیکی بالاتری میباشد (20). اگرچه نانوالیاف به دلیل تقلید از اجزای ماتریکس خارج سلولی مانند الیاف کلاژن مورد توجه هستند، اما اعتقاد بر این است که تراکم بالای نانوالیاف میتواند باعث افزایش محدودیت برای نفوذ سلول شود. بنابراین، ساخت داربستهای لیفی با دستگاههایی با پیکربندی چند نازله میتواند با تولید ترکیبی از میکروالیاف و نانوالیاف، هدف افزایش اندازه منافذ، بهبود تمایز سلولی و تولید ماتریس خارج سلولی را محقق سازد (15،46). ساخت داربست/PCL CDM الکتروریسی شده توسط حلال هگزافلوروایزوپروپانول نشان داد حضور CDM موجب تولید GAG و کلاژن نوع A110 خواهد شد (47). ساخت داربست ژلاتینPCL/ GEL الکتروریسی شده توسط حلال دی کلرومتان / متیل بنزن / اسید فرمیک / اتیل استر نشان داد داربست GEL/PCL با نسبت 2:1 و اتصالات عرضی ژلاتین دارای خواص مکانیکی مناسبی است وافزایش ژلاتین موجب حمایت داربست از پاسخهای بیولوژیک سلول خواهد شد (48). ساخت داربست کلاژن / PCL الکتروریسی شده توسط حلال HFP نشان داد کلاژن تأثیر زیادی بر آبدوستی داربست داشته و موجب تقویت ساختار مکانیکی داربست خواهد شد (49). ساخت داربست ابریشم / PLLA الکتروریسی شده توسط حلال اسید تری فلوئوراستیک / هگزافلوروئیزوپروپانول نشان داد که ابریشم در کنار PLLA، موجب چسبندگی سلولی، تکثیر و رشد بیشتر کندروسیت ها نسبت به PLLA بدون حضور ابریشم خواهد شد (50). ساخت داربست PCL / کیتوسان الکتروریسی شده توسط حلال کلروفرم / متانول / اسید تری فلوئوراستیک نشان داد بعد از 7 روز رشد و تکثیر سلولی مشاهده میشود و حضور کیتوسان آبدوست در کنار پلی کاپرولاکتون آبگریز به آبدوستی داربست کمک میکند (51). ساخت داربست کلاژن/ PLA الکتروریسی شده توسط حلال هگزافلوروئیزوپروپانول نشان داد کلاژن تاثیر زیادی بر آبدوستی داربست داشته و موجب تقویت ساختار مکانیکی داربست خواهد شد (52). ساخت داربست PLA/PCL الکتروریسی شده توسط حلال کلروفرم / دی متیل فرمامید نشان داد چسبندگی کندروسیتها روی داربست افزایش یافته و سطح بالایی از ماتریس خارج سلولی تولید میشود (53).
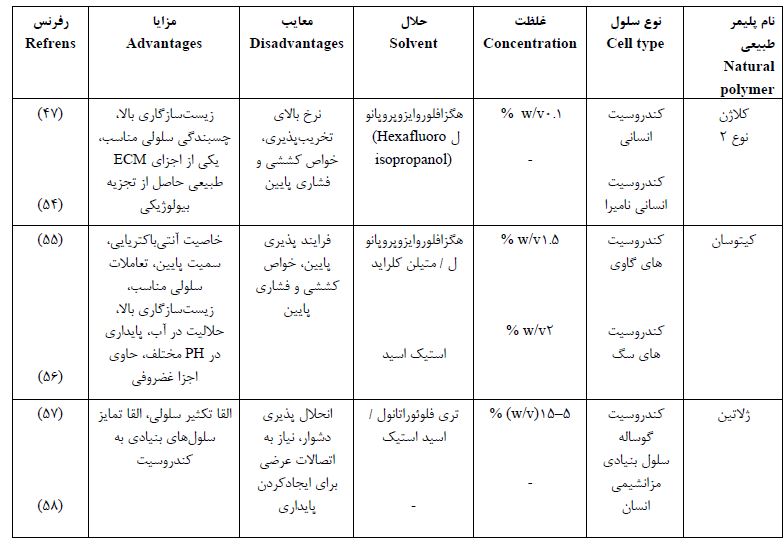
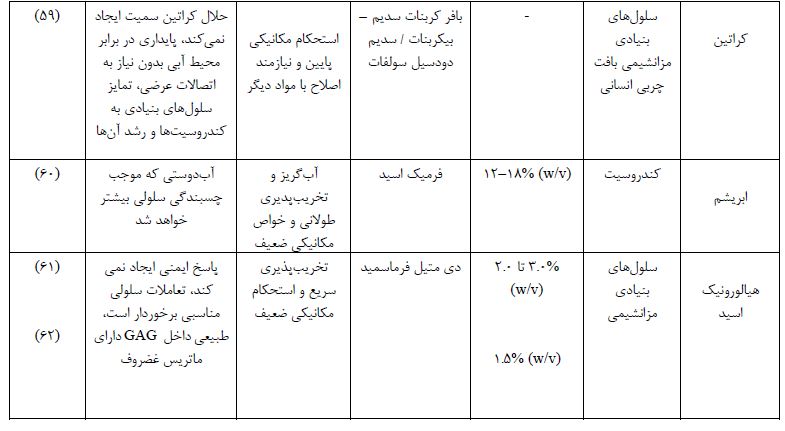
جدول 1 : پلیمر های طبیعی
جدول 2 : پلیمرهای سنتزی الکتروریسی شده در مهندسی بافت غضروف
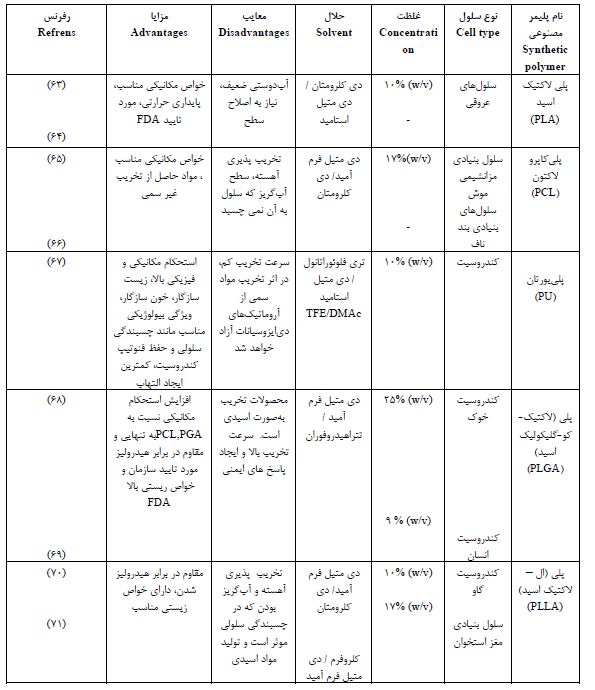
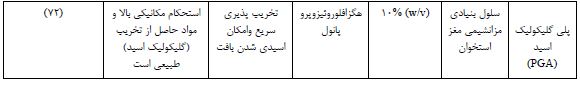
جدول3 : پلیمرهای کامپوزیت الکتروریسی شده در مهندسی بافت غضروف
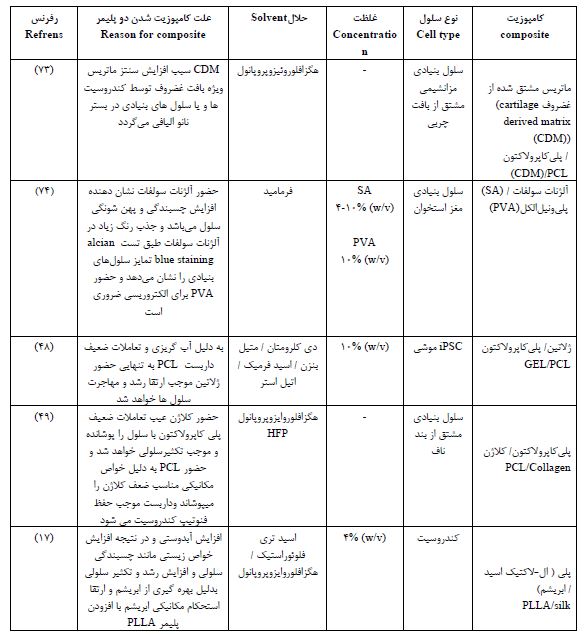
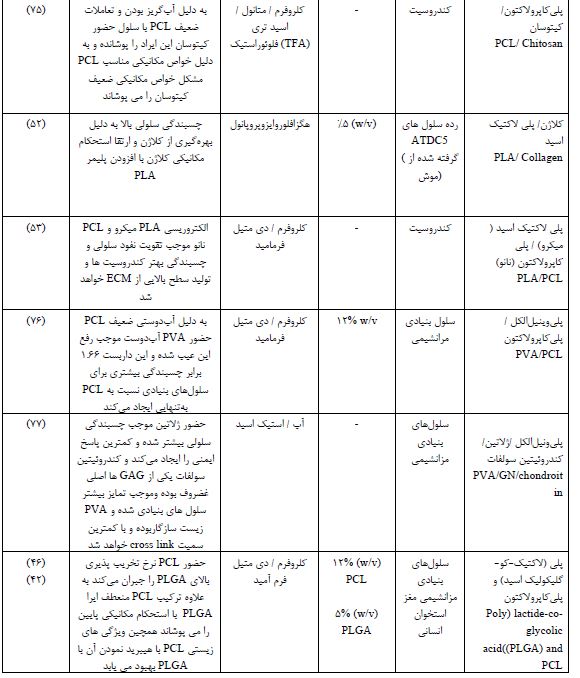
7- منابع سلولی
کندروسیتها، فیبروبلاستها، سلولهای بنیادی و سلولهایی که از لحاظ ژنتیکی اصلاح شدهاند همه در مهندسی بافت غضروف آزمایش شدهاند. با اینحال، سلولهای غضروفی و سلولهای بنیادی مزانشیمی بیشترین منابع سلولهای غضروفی برای ترمیم غضروف هستند (16). سلولهای غضـروفی بـالغ بـه دلیـل داشتن توانایی تشـکیل مـاتریس خـارج سـلولی میتوانند از منابع مختلفی مانند غضروف مفصلی، تیغه بینی، غضروف دندهای یا غضروف گوش جداسازی شده و در مهندسـی بافـت غضـروف مـورد اسـتفاده قـرار گیرند (16). استفاده از سلولهای غضروفی برای مهندسی بافت غضروف دارای اشکالات اندکی از جمله در دسترس بودن محدود منبع ماده، همراه با عوارض جانبی (و ایجاد عارضه در روند بهبود ناحیهای که بافت جدا شده است) میباشد (13). سلولهای غضروفی اولیه بالغ ماهیت فنوتیپی خود را در طی فرآیند تمایز زدایی در شرایط آزمایشگاهی از دست میدهند.به همین منظور استفاده از آنها بسیار محدود شدهاست (34). اگر از سلولهای بنیادی برای ترمیم استفاده شود، در نتیجه میتوان به دلیل توانایی تکثیر بالای این سلولها، هر اندازه از آسیب جدا شده از غضروف را ترمیم کرد. سلولهای بنیادی مزانشیمی با توجه به مهندسی بافت غضروف به عنوان یک خط اصلی ظاهر شده و پتانسیل کندروژنیک خوبی را نشان میدهد. منابع بهینه بافتها برای برداشت سلولهای بنیادی مزانشیمی، به دلیل دسترسی آسانتر و مقدار موجود در بافت، بهطور کلی در مغز استخوان و بافت چربی بوده است. سلولهای بنیادی مزانشیمی مشتق از چربی در مقایسه با سلولهای بنیادی مزانشیمی مشتق از مغز استخوان باعث ایجاد تمایز غضروفی ببیشتری میشوند. علاوه بر این، هنگام استفاده از بافت چربی در مقایسه با مغز استخوان، سلولهای بنیادی مزانشیمی بیشتری میتوانند در حجم مساوی از بافت جدا نمود و راندمان استخراج سلول بالاتر است (78).
8- رهایش مولکولهای پیامرسان مبتنی بر نانوالیاف برای بازسازی بافت غضروف
8-1-رهایش فاکتورهای رشد
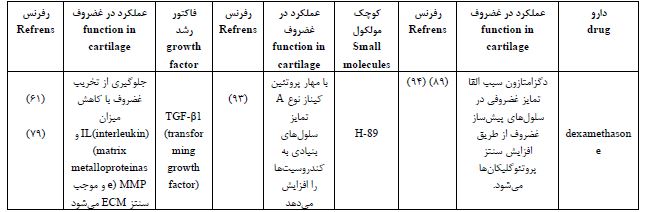
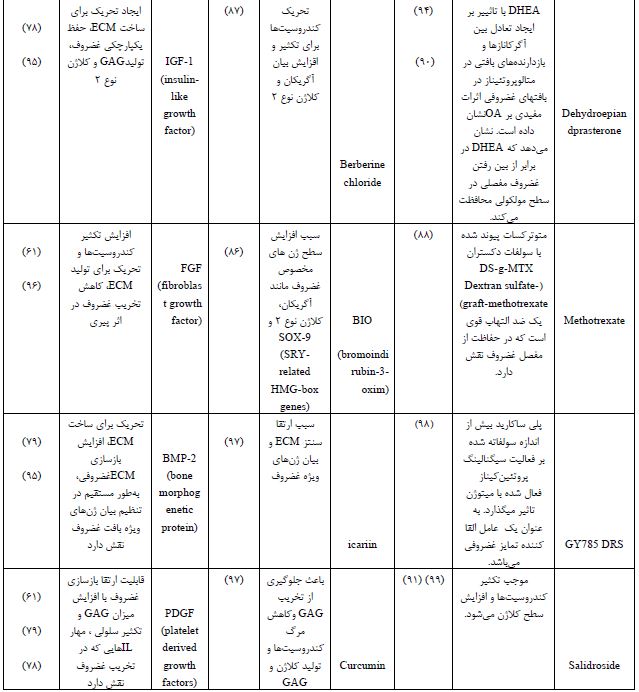
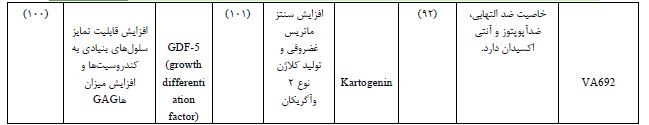
سایتوکاینها و فاکتورهای تمایزی که توسط سلولها ترشح میشوند و به عنوان مولکولهای پیامرسان نقش ایفا میکنند. اتصال فاکتورهای رشد به گیرنده شان، موجب آغاز پیامرسانی داخل سلولی (تکثیر، تمایز و مهاجرت) میشود. TGF- β1 Transforming growth factor beta 1 از جمله فاکتورهای تمایزی میباشد و شامل دو پروتئین CIF-A1 Cartilage-inducing factors و CIF-B1 بوده که موجب القا تمایز سلولهای بنیادی به غضروف و حفظ فنوتیپ کندروسیتها میگردد (78). بهرهگیری از TGF-β1 در داربست کیتوسان و کاشت آن در زانوی خرگوش پس از ۱۲ هفته، منجر به ترمیم بافت غضروف آسیب دیده و جایگزینی آن با غضروف شفاف گردید (79).
2 -IGF از طریق PI3K Phosphoinositide 3-kinases نقش مهمی در پیامدهی و اعمال سلولی نظیر رشد، متابولیسم سلولی دارد. موجب تنظیم عملکرد کندروسیتها خواهد شد (80). مطالعات بر روی داربست PCL/PLGA حاوی IGF-2 نسبت به داربست PCL/PLGA بدون1-IGF نشان داد حضور 1-IGF موجب افزایش مهاجرت سلولی و تولید کلاژن وGAG گردیده و ایجاد ماتریس غضروفی بسیار مستحکمتر نسبت به مش بدون فاکتور رشد طی هشت هفته در شرایط درونتنی خواهد شد(81).
2 BMP- در کلیه فازهای تشکیل غضروف دخیل میباشد و فعالیت آن از طریق 1-5-8 Smad و 4 Smad نوعی پروتئین که در رشد و بازسازی بافت نقش دارد، تنظیم میشود (82). مطالعات نشان داد استفاده از داربست PLGA و سلولهای بنیادی مزانشیمی مغز استخوان در حضور 5.8 میکروگرم 2 -BMP در مقایسه با PLGA و سلول، بدون 2 – BMP پس از ۲۴ هفته، هیچگونه هایپرتروفی و غضروفزایی را در پی نداشت (83).
8-2- رهایش کوچک مولکولها
*کوچک مولکولها، پلیپپتیدهای پروتئینی جایگزین فاکتورهای رشد هستند. جرم مولکولی پایین، پایداری بالا، عدم تحریک سیستم ایمنی، رهایش آسان آنها، از مزایای کوچک مولکولها میباشد. KGN Kartogenin با تنظیم فاکتورهای رونویسی CBFβ-RUNX1 موجب سنتز ماتریس غضروفی خواهد شد (84). جانسون و همکارانش، مشاهده کرد که KGN هیچگونه هایپرتروفی در کندروسیتها یا سلولهای بنیادی ایجاد نمیکند ولی موجب تنظیم و افزایش ترشح آگریکان و کلاژن نوع ۲ و نیز سبب مهار MMP خواهد شد این مطالعه نشان داد که KGN نهتنها موجب حفظ فنوتیپ کندروسیت بلکه از تخریب ماتریس غضروفی جلوگیری میکند (84). BIO با فعال سازی مولکول پیامرسان WNT موجب بیان ژنهای غضروفی میگردد (85). تحقیقات نشان داد استفاده از BIO به میزان 01/0 میکرولیتر موجب افزایش تمایز سلولی با افزایش سطح بیان ژنهایویژه غضروف مانند آگریکان، کلاژن نوع 2و SOX-9 در طول ۱۴ روز خواهد شد در حالیکه بدون حضور BIO این فرآیند در طول ۲۱ روز انجام میپذیرد (86). کلرید بربرین Chloride Berberine با فعالسازی مولکولهای پیامرسان catenin-β/Wnt و سنتز PCNA5، باعث افزایش سدیمنیتروپروساید در موش آزمایشگاهی شده و در نتیجه باعث ساخت مفصل غضروفی خواهد شد (87). بیشترین استراتژیهای دارو درمانی شامل مسکنها (مانند استامینوفن، پروپوکسیفن و ترامادول)، داروهای ضدالتهاب غیر استروئیدی NAIDS Non-steroidal anti-inflammatory drugs ، مانند ایبوپروفن و سلکوکسیب) و گلوکورتیکوئیدها (مانند پردنیزولون، دگزامتازون) میباشند. داروهای ضدروماتیسمی (مانند متوترکسات) و عوامل بیولوژیکی اولین رویکرد درمانی بیماری آرتروئیت روماتوئید به منظور تسکین آسیب مفصلی و کنترل روند بیماری هستند (88). دگزامتازون تمایز سلولهای غضروفی را در جمعیت سلولهای اولیه جدا شده از بافت غضروف و همچنین در سلولهای بنیادی مزانشیمی حفظ میکند (4). لیون و همکاران نشان دادند که دگزامتازون باعث تحریک تکثیر کندروسیتها میشود (89). DHEA میتواند به عنوان یک استراتژی اصلاح کننده بیماری برای محدود کردن پیشرفت OA مورد استفاده قرار گیرد (90). جو و همکاران نشان دادند که سلولهای غضروفی جدا شده از غضروف زانو انسان تحت تیمار DHEA، بیان ژن و سنتز پروتئین های غضروفی را متوقف میکند در حالیکه بیان ژن و سنتز پروتئین TIMP-1Tissue inhibitors of metalloproteinase-1را افزایش میدهد. DHEA از تخریب مفصل غضروفی جلوگیری نموده و مانع از پیشرفت OA با تعدیل کاتابولیک/آنابولیک غضروف، که شامل سیستم MMPs / TIMP-1 Matrix metalloproteinases و سیستم ADAMTS/TIMP-3 میباشد، میگردد (90). مطالعات نشان میدهد که سالیدروساید منجر به تکثیر سلولهای غضروفی و مهار آپوپتوز کندروسیت میشود، بهعلاوه سالیدروساید فیبروز کلاژن را نیز کاهش میدهد و التهاب و پاسخ ایمنی ناشی از ACLT Anterior cruciate ligament transection را در موشها از طریق مسیر NF-KB تعدیل میکند (91). VA692 دارای خاصیت ضدالتهابی مشابه سلکوکسیب است که یک مدولاسیون مناسبتر از IL-6 در رده سلولهای غضروفی اولیه در OA نشان میدهد (92).
جدول 4 : فاکتور های رشد، کوچک مولکول ها و داروهای متداول مورد استفاده در مهندسی بافت غضروف
نتیجهگیری
در دهههای اخیر، روشهای مبتنی بر مهندسی بافت، بهویژه با استفاده از نانوالیاف الکتروریسی شده، بهعنوان رویکردی موثر در بازسازی بافتهای غضروفی مطرح شدهاند. این روشها به دلیل ویژگیهای منحصربهفرد نانوالیاف، از جمله سطح تماس بالا، ساختار متخلخل، و امکان زیستتخریبپذیری، به طور قابلتوجهی توانستهاند محدودیتهای موجود در روشهای سنتی ترمیم بافتهای غضروفی را بهبود بخشند. ساختار متخلخل این داربستها، شرایطی را فراهم میکند که امکان تغذیه مناسب سلولها، دفع ضایعات متابولیکی، و ایجاد شبکهای برای انتشار اکسیژن و مواد مغذی به داخل بافت را میسر سازد. نانوالیاف الکتروریسی شده، با شباهت زیاد به ساختار ماتریکس خارج سلولی، نقش حیاتی در بهبود چسبندگی سلولی و ایجاد محیطی مناسب برای تکثیر و تمایز سلولهای بنیادی، بهویژه سلولهای بنیادی مزانشیمی، ایفا میکنند. این امر موجب میشود که نانوالیاف بتوانند بهطور موفقیتآمیزی در بازسازی بافتهای غضروفی و حتی در موارد پیچیدهتر، مانند ترمیم مفاصل آسیبدیده در بیماریهایی نظیر آرتروز، مورد استفاده قرار گیرند. علاوه بر این، بهرهگیری از پلیمرهای زیستتخریبپذیر، مانند پلیلاکتیک اسید و پلیکاپرولاکتون، و ترکیب آنها با پلیمرهای طبیعی نظیر کلاژن و ژلاتین، به افزایش کارایی و زیستسازگاری این داربستها کمک کرده است. بهویژه، داربستهای الکتروریسی شده ترکیبی، با ایجاد محیطی دینامیک و بهینه برای سلولهای غضروفی، میتوانند مقاومت مکانیکی و همچنین خواص زیستی لازم را برای بازسازی بافت فراهم کنند. در کنار این مزایا، فناوری رهایش کنترلشده فاکتورهای رشد، مانند TGF-β1 وIGF-1، و همچنین رهایش ترکیبات کوچک مولکول، نظیر KGN و BIO، از طریق نانوالیاف، روشی موثر برای تسریع فرآیند بازسازی بافت و بهبود کیفیت درمان به حساب میآید. این فناوریها، با ارائه شرایط ایدهآل برای تکثیر و تمایز سلولها و کاهش میزان التهاب و آسیب بافتی، توانستهاند نتایج مثبتی را در مطالعات آزمایشگاهی و بالینی به نمایش بگذارند.
10-چالشها و چشماندازها
پیشرفتهای زیادی در مهندسی بافت غضروف طی سالهای اخیر صورت گرفته است و تحقیقات گستردهای در راستای الکتروریسی نانوالیاف از زیست پلیمرها انجام شده است. نتایج بهوضوح توانایی قابلتوجه داربستهای الکتروریسی شده را در مهندسی بافت غضروف نشان دادهاند؛ ولی هنوز چالشهایی در بخشهای مختلف وجود دارد که به عنوان مثال میتوان به انتخاب پلیمر مناسب برای ساخت نانوالیاف، بهبود استحکام مکانیکی، زیستسازگاری، تنظیم مورفولوژی، آرایش یافتگی و شکل داربست اشاره کرد. نانوالیاف الکتروریسی شده بر پایه پلیمرهای طبیعی بهصورت کلی دارای خواص مکانیکی ضعیف و پایداری ساختاری نامناسب هستند. از طرف دیگر پلیمرهای سنتزی خواص مکانیکی خوبی دارند ولی از نظر زیستی توانایی پایینی در تنظیم رفتارهای سلولی مانند چسبندگی و تمایز دارند. تلاشهای زیادی صورت گرفته است تا کامپوزیتهای جدیدی بر پایه مزایای هر دو گروه پلیمرهای ذکر شده طراحی شود. پلیساکاریدهای سولفاته به عنوان پلیمرهای طبیعی به دلیل شباهت ساختاری به اجزای موجود در ECM بافت غضروف گزینه های مناسبی برای تنظیم رفتار سلولی بهخصوص بحث تمایز غضروفی در داربستهای الکتروریسی شده هستند. بهنظر میرسد ساختارهای بر پایه آمیزهها و یا کامپوزیتهای پلیمری حاوی پلیساکاریهای سولفاته پتانسیل مناسبی برای کاربرد مهندسی بافت غضروف دارا باشند (74،102). بهبود خواص مکانیکی داربستهای الکتروریسی شده برای کاربرد در بازسازی غضروف همواره دارای اهمیت بوده است. هرچند تلاشهای زیادی در این زمینه انجام شده است ولی هنوز خواص مکانیکی این داربستها پایینتر از میزان مورد نیاز است. یکی از روشهای اصلی بهبود خواص مکانیکی در داربستهای الکتروریسی شده، کامپوزیت کردن با افزودن نانوساختارها، ایجاد ساختار هسته پوسته و یا الکتروریسی همزمان است (43،103). تهیه ساختارهای الکتروریسی شده سه بعدی، به کمک روشهایی مانند الکتروریسی خیس، یکی از راهکارهای مورد توجه در مهندسی بافت غضروف است. این ساختارها میتوانند با هدف بهبود خواص مکانیکی و زیست فعالی پس از غوطهوری در یک هیدروژل، استحکام مکانیکی بهبودیافتهای را نشان دهند (104). هرچند هنوز مطالعات کافی در این حیطه صورت نگرفته است. هرچند داربستهای الکتروریسی شده دارای تخلخل بالایی هستند ولی یکی از معایب اصلی آنها ابعاد کوچک منافذ است زیرا سبب جلوگیری از نفوذ و مهاجرت سلولها و درنتیجه تکثیر آنها در داخل داربست نانولیفی میشود (105). روشهای مختلفی برای حل این مشکل پیشنهاد شده است مانند استفاده از الیاف فدا شونده، الیاف ترکیبی میکرو / نانو متری، اولتراسونیک کردن برای افزایش فاصله الیاف، شستشوی نمک و کریستالهای یخ (106،107). تاثیر مثبت استفاده از ساختارهای سه بعدی بر روی سرعت نفوذ سلولها و تکثیر سلولها به وسعت بررسی شده است و مورد تایید قرار گرفته است. همچنین قابلیت پایداری در آب و تشکیل بافت شبه غضروفی در این ساختارها مورد ارزیابی قرار گرفته است و مزیت آنها نسبت به ساختارهای دو بعدی اثبات شده است .غالب مطالعات انجام شده در طی سالهای گذشته با تمرکز بر زیستپلیمرهای مختلف و تاثیر عوامل جهت فرایند الکتروریسی بوده است ولی پیکربندی ساختاری آنها نمایش دهنده آرایش یافتگی سه بعدی ECM غضروف نیست. با توجه به اینکه غضروف یک بافت پیچیده با آرایشیافتگیهای متفاوت از ECM است، روشهای الکتروریسی که با هدف تقلید کردن این آرایش یافتگی در حال حاضر استفاده میشوند بیشتر محدود به روشهایی مانند چند لایهسازی است. ساختارهای لایه لایه مورد استفاده نیز به دلیل مشکلات ناشی از نبود یکپارچکی و یکنواختی بین لایهها از نظر کاربردهای پزشکی با نگرانیهای زیادی روبهرو خواهد بود. بنابراین بهنظر میرسد یک داربست نانولیفی با تغییرات تدریجی در ساختار و خواص مکانیکی می تواند گزینه بهتری برای باز سازی غضروف باشد (45). بحث دیگری که باید برای استفاده از داربست های الکتروریسی شده در مهندسی بافت غضروف در نظر گرفته شود، اندازه و شکل آنها ست. بیشتر مطالعات منتشر شده تا کنون محدود به اندازه آسیبهای غضروفی استوانهای با ضخامت کم بوده است. برای آنکه داربستهای الکتروریسی شده تطابق و نزدیکی بیشتری برای کاربرد مهندسی بافت غضروف پیدا کنند لازم است تا روشهای جدیدی برای افزایش مقیاس اندازه داربستها برای یک غضروف کامل با شکل مورد نیاز هر بیمار ایجاد شود (42). در نهایت میتوان گفت استفاده از داربستهای الکتروریسی شده در مهندسی بافت غضروف با وجود پیشرفتهای قابلتوجهی که در طی سالهای اخیر داشته است ولی هنوز با چالشهای جدی در حیطههای خواص بایومکانیکی و زیستی روبهرو است. زیستپلیمرهای جدیدتری نیاز است تا با درنظر گرفتن استحکام مکانیکی، زیستسازگاری و زیست تخریبپذیری مطالعه شوند و مورد ارزیابی قرار بگیرند. لازم است روشهای ساخت از نظر تجهیزات، تکرارپذیری و شرایط فرایندی با هدف زیست تقلیدپذیری بهتر و صرفه اقتصادی اصلاح شوند و بهبود پیدا کنند تا امکان کاربرد بالینی این محصولات مهیا شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
اصطلاح مهندسی بافت اولین بار توسط پروفسور رابرت نرم Robert Nerem در سال1988در نشست همگانی زیست شناسی مولکولی و سلولی در دانشگاه UCLAUniversity of California, Los Angeles مطرح شد (1). مثلث مهندسی بافت شامل سلول، داربست و مولکول های پیام رسان میباشد. هدف اصلی مهندسی بافت بازگرداندن عملکرد بافت و اندامها با استفاده از راهبردهای بیولوژیکی و مهندسی در جهت حل مشکلات بالینی است (2). تکنیکهای جراحی مورد استفاده فعلی در بازسازی اندام و بافت تحت عنوان پیوند، واز طریق جابه جایی بافت یا اندام از محل اصلی با هدف ترمیم بخش آسیب دیده انجام میشود که به آن پیوند خودی یا اوتوگرفت Autograft نیز گفته میشود. به عنوان مثال میتوان به استفاده از ورید صافن Saphenous vein (یک سیاه رگ بزرگ زیر جلدی و سطحی در اندام تحتانی است) به عنوان پیوند بای پس bypass و یاتاندون پاتلا Patella tendon برای ترمیم رباط صلیبی قدامی Anterior cruciate ligament اشاره کرد. هر چند پیوند خود به عنوان استاندارد طلایی برای ترمیم شناخته میشود، با اینحال، این روش نمیتواند جایگزین تمام عملکردهای بافت اصلی شود. علاوه بر این، ایجاد عوارض جراحی در نواحی اهدا کننده از مشکلات اساسی در بازسازی بافت به این روش است (3). بنابراین، مهندسی بافت به عنوان یک راه کار جدید برای ترمیم بافت آسیب دیده بدن مطرح شده است. مهندسی بافت با استفاده مجدد از روند طبیعی رشد بافت، راهکاری برای ترمیم، حفظ و بهبود عملکرد بافت خواهد بود و در نهایت موجب تعویض کامل بافت آسیب دیده خواهد شد (2). در جستجوی راهکار جایگزین برای روشهای درمانی مرسوم ترمیم یا تعویض بافتها و اندامهای آسیب دیده بدن، راهحلهای امیدوار کنندهای از طریق مهندسی بافت ارائه شده است (2،4). داربستهای مهندسی بافت با پشتیبانی موقت از سلولها در هنگام شکلگیری ماتریس خارج سلولی Extracellular matrix (ECM) طبیعی، نقش مهمی در بازسازی بافت ایفا میکند. ECM طبیعی بدن ساختاری پیچیده، دینامیک و همچنین ویژه هر بافت دارد. ترکیبات پایه و اصلی آن شامل پروتئینهای لیفی با قطر500-50 نانومتر و زنجیرههای پلیساکاریدی است که هم عملکرد ساختاری و هم چسبندگی سلولی دارند. مهمترین هدف ساخت داربستهای مهندسی بافت تقلید از ECM بدن است که موجب ترمیم بافت آسیب دیده خواهد شد (5،6).
روش بررسی
در این مقاله مروری، یک جستجوی جامع در پایگاههای داده علمی شامل PubMed، Google Scholar و Scopus انجام شد تا تحقیقات مرتبط با داربستهای پلیمری نانو لیفی الکتروریسی شده برای مهندسی بافت غضروف جمعآوری شود. از کلمات کلیدی مانند الکتروریسی، داربستهای نانولیفی، مهندسی بافت غضروف و پلیمرهای زیستتقلید برای شناسایی مطالعات جدید، پیشرفتها و چالشهای موجود در این حوزه استفاده شد. مقالات بر اساس ارتباط، بهروز بودن و تأثیرگذاری آنها بر موضوع انتخاب شدند تا جدیدترین و مهمترین یافتهها در این مرور لحاظ شود. همچنین از منابع مقالات کلیدی برای گسترش بیشتر تحقیقات استفاده شد.
1.خواص داربستها برای کاربرد مهندسی بافت
داربستهای مهندسی بافت باید خواص مکانیکی Mechanical properties مناسب با بافت موردنظر، قابلیت پیامدهی مناسب برای هدایت رشد بافت و جلوگیری از رد پیوند را دارا باشند. همچنین داشتن شبکه متخلخل به هم پیوسته به منظور تغذیه مناسب سلول و دفع ضایعات سلولی به خارج داربست از خواص مهم داربستها بهشمار میآیند (2). هر یک از معیارها در طراحی داربست جهت مهاجرت، تکثیر و اتصال سلول اهمیت دارد. با اینحال، وجود همه این عوامل در یک داربست واحد دشوار است (7).
ساختار و مورفولوژی: ساختار و مورفولوژی داربستهای مهندسی بافت از اهمیت زیادی برخوردار است (2). داربست ساخته شده باید دارای تخلخل بالا و همچنین منافذ بهم پیوسته Interconnected pore باشد تا نفوذ سلولی و انتشار کافی مواد مغذی به درون سلول و ECM راتضمین کند (8). داشتن ساختار متخلخل به هم پیوسته برای خروج محصولات ناشی از فعل و انفعالات سلولی و همچنین تخریب داربست نیز ضروری است (2).
زیستسازگاری Biocompatibility: یکی از مهمترین ویژگیها در مورد سازههای مهندسی بافت زیستسازگاری است. سلول باید چسبندگی، عملکرد طبیعی و مهاجرت روی سطح داربست و به تدریج نفوذ به داخل داربست و در نهایت شروع تکثیر سلولی را به همراه داشته باشد تا ECM جدید ایجاد کند (8). داربستهای پلیمری باید دارای شیمی سطح مناسب برای چسبندگی، تکثیر و تمایز سلولی باشند. رفتارهای جذب و واجذب Desorption در چسبندگی سلول و تکثیر انواع مختلف سلولهای پستانداران بر روی پلیمرها، به ویژگیهای سطحی ماده، مانند ترشوندگی، نسبت آبدوستی/ آبگریزی، شیمی ماده، بار سطح و توزیع بار، زبری سطح و سختی Rigidity داربست ارتباط دارد (7).
زیست تخریبپذیری Biodegradability : داربست باید زیست تخریبپذیر باشد تا به سلول اجازه ساخت ECM جدید را بدهد و همچنین مواد حاصل از تخریب نیز نباید سمیت ایجاد کند. برای آنکه فرایند تخریب داربست همزمان با تشکیل بافت جدید صورت بگیرد، پاسخ التهابی، که همراه با نفوذ کنترل شده سلولهایی مانند ماکروفاژ باشد، مورد نیاز است (8). نرخ تخریب وابسته به ویژگیهای ذاتی پلیمر شامل ساختار شیمیایی، کریستالی/آمورف بودن، وزن مولکولی و دمای انتقال شیشه )Tg Glass Transition Temperature(متغیر است (9). برای تخریب شیمیایی داربستها دو روش مطرح است که شامل هیدرولیز شدن به واسطه آب و تخریب آنزیمی به واسطه عوامل زیستی مانند آنزیمها است (10).
خواص مکانیکی: ویژگیهای مکانیکی داربست مانند مدول الاستیسیته، استحکام کششی، چقرمگی شکستFracture toughness و خستگی Fatigue میبایستی از نظر آناتومیکی به بافت مورد نظر نزدیک باشد (11). این موضوع، چالشی برای کاربردهای استخوان و غضروف میباشد (8). همچنین لازم است داربستها ویژگی مکانیکی مورد نظر را تا پایان بازسازی بافت حفظ کنند؛ از آنجاییکه فرایند تخریب پلیمرها میتواند سبب کاهش خواص مکانیکی ذاتی آنها شود، بنابراین ارزیابی تأثیر تخریب زیست پلیمرهای استفاده شده در ساخت داربست بر خواص مکانیکی نمونه دارای اهمیت خواهد بود (9). دارا بودن خواص مکانیکی بالا برای یک داربست در تقابل با داشتن تخلخل بالا است. داشتن تخلخل بالا سبب کاهش شدید خواص مکانیکی داربست میشود و در نتیجه لازم است تا تعادل بین خواص مکانیکی و میزان تخلخل، به عنوان کلیدی، در موفقیت هر داربست در نظر گرفته شود (8).
فرایندپذیری: داربست باید با توجه به شکل و قالب مورد نظر، فرایندپذیری و شکلپذیری نسبتاً آسانی داشته باشد. همچنین زیست مواد مورد استفاده در ساخت داربست لازم است قابلیت تولید بهصورت یک محصول استریل را دارا باشند و یا داربست تولیدی، با روشهای متداول قابل استریل کردن باشد (2).
2.نقش مهندسی بافت در بازسازی غضروف
1-2- بافت غضروف
غضروف یک بافت پیوندی بسیار تخصصیافته با خصوصیات مکانیکی منحصربهفرد است که نقش مهمی در عملکرد حرکتی و ساختاری بدن ایفا میکند (12). غضروف به دلیل خواص نیمهسخت Semirigid خود، محکم و انعطافپذیر است، بهطوری که در برابر سایش و نیروهای فشاری مقاومت میکند. این ویژگیها باعث استحکام سطح بافت در برابر ضربه و کاهش اصطکاک بین استخوانها میشود (13). بافت غضروف از مایع سینوویال و سلولهای تخصصیافتهای به نام کندروسیت تشکیل شده است که در ماتریس خارجسلولی قرار دارند و نقش کلیدی در تولید و نگهداری آن دارند (12). ماتریس خارجسلولی غضروف عمدتاً شامل کلاژن و پروتئوگلیکانها است که هرکدام عملکرد و ساختار خاصی دارند. پروتئوگلیکانها دارای یک هسته پروتئینی و یک یا چند زنجیره جانبی گلیکوزامینوگلیکان هستند و در ساختار غضروف نقش مهمی ایفا میکنند. میزان بالای پروتئوگلیکانها باعث ایجاد فشار اسمزی تورمی در غضروف میشود که این ویژگی به بافت اجازه میدهد در برابر بارگذاریهای بیشتر از وزن بدن مقاومت کند (12،13). پروتئوگلیکانهای اصلی موجود در غضروف شامل آگریکان Aggrecan، فیبرومادولین Fibromodulin، دکورین Decorin و بیگلیکان Biglycan هستند. این ترکیبات نه تنها به ساختار مکانیکی غضروف کمک میکنند، بلکه در حفظ تعادل ماتریس خارجسلولی نیز مؤثر هستند. بهطور خاص، آگریکان یکی از پروتئوگلیکانهای اصلی است که در تعامل با فیبرهای کلاژن نوع II به ایجاد مقاومت مکانیکی غضروف کمک میکند (13). کلاژنها نیز یکی دیگر از اجزای حیاتی ماتریس خارجسلولی غضروف هستند. غضروفهای مفصلی دارای چند نوع کلاژن از جمله کلاژنهای نوع XI، IX،VI و II هستند. از این میان، کلاژن نوع II با تشکیل حدود ۹۰ الی ۹۵ درصد کل کلاژن موجود در غضروف، کلاژن اصلی محسوب میشود و نقش مهمی در استحکام بافت دارد (13). کندروسیتها، سلولهای بسیار تخصصیافتهای هستند که مسئول تولید، نگهداری و ترمیم ماتریس خارجسلولی میباشند. این سلولها از لحاظ متابولیکی بسیار فعال هستند و هر کدام یک نام اختصاصی کوچک برای خود ایجاد میکنند که برای ترمیم و بازسازی سریع ماتریس خارجسلولی ضروری است. نقش این سلولها در توسعه و نگهداری ساختار غضروف بسیار حیاتی است و هرگونه اختلال در عملکرد آنها میتواند منجر به تخریب بافت شود (13). بهطور کلی، بافت غضروف را میتوان به سه دسته هیالین، فیبری و الاستیک تقسیمبندی کرد که هر کدام خصوصیات و عملکردهای متفاوتی دارند. غضروف هیالین، که رایجترین نوع غضروف است، در مفاصل یافت میشود و نقش مهمی در کاهش اصطکاک و جذب شوک دارد. غضروف فیبری به دلیل داشتن فیبرهای کلاژن بیشتر، در تحمل فشارهای سنگین نقش دارد و غضروف الاستیک به دلیل داشتن فیبرهای الاستین بیشتر، خاصیت انعطافپذیری بیشتری دارد (13).

شکل 1 : ساختار آناتومیک و لایههای مختلف تشکیل دهنده بافت غضروف
2-2-بیماریهای غضروفی و روشهای درمان
التهاب مفاصل به دو شکل آرتریت روماتوئید و آرتروز میباشد. آرتریت روماتوئید یک بیماری خودایمنی است که در آن سیستم دفاعی به غضروفها حمله میکند و لایه استخوان زیرغضروفی را تخریب میکند. آرتروز یک بیماری تخریب کننده مفصلی است که با تخریب پیشرونده غضروف و افزایش تشکیل استخوان زیرغضروفی و بافت استخوانی جدید در حاشیه مفاصل همراه است. از علائم هر دو بیماری عواملی نظیر سفتی مفصل و درد میباشد (12،13).
روشهای درمان بهطور کلی شامل روشهایی مانند: آرتروسکوپی Arthroscopy ایجاد ترکهای کوچک Microfracture (14)، موزاییک پلاستی Autologous Chondrocyte Implantation (ACI) (14)، پیوند غضروف-استخوان (13) و نهایتاً روش مهندسی بافت میباشد. روش مهندسی بافت، به دلیل ظرفیت محدود بافت غضروف در ترمیم قسمت آسیب دیده از جراحی برای ترمیم نقصهای بوجود آمده استفاده میکنند. در این روش بافت بازسازی شده از لحاظ بیومکانیکی، بیوشیمیایی و ... نسبت به حالت اولیه بازدهی پایینی دارد به همین منظور در روشهای جدید از مهندسی بافت استفاده میکنند. مهندسی بافت بر روی ترکیب بهینه سلولها، داربستها و سیگنالینگ تمرکز دارد (15). یکی از اجزای مهم مهندسی بافت غضروف سلولها هستند که شامل سلولهای بنیادی مزانشیمی، پرتوان و جنینی میباشند. سلولهای غضروفی در بزرگسالان توانایی تشکیل ماتریس خارج سلولی را دارند که میتوانند از منابع مختلفی مثل دیواره بینی غضروف مفصلی گرفته شوند (16).
3- روشهای ساخت نانوالیاف
جدایش فازی یکی از روشهای ساخت نانوالیاف با ساختار سه بعدی و با ابعادی بسیار شبیه رشتههای کلاژنی ماتریس خارج سلولی (500-50 نانومتر) است. این روش بر پایه ناسازگاری فیزیکی پلیمرها و تمایل آنها برای جدایش فاز استوار است (13،17). جدایش فازی امکان ساخت داربست، با اشکال آناتومیک مورد انتظار را فراهم می کند. داربست ساخته شده توسط این روش دارای ظاهری متخلخل و اسفنجی با منافذ کروی در ابعاد میکرو میباشد (13،17). ساخت داربست به این روش ساده بوده و به ابزار پیچیدهای نیاز ندارد اما به ترکیب پلیمر- حلالهای مشخص محدود میشود. در این روش کنترل ابعاد الیاف دشوار است و خواص مکانیکی داربست با توجه به ساختار بسیار متخلخل برای کاربردهایی که نیاز به تحمل بار دارند، مناسب نیست (17).
خود چیدمانی: خود چیدمانی فرآیندی است که در آن اجزا در یک سیستم، به صورت خودبخودی، از طریق بر همکنش بهخصوص و/یا متأثر از محیط بهصورت غیرمستقیم آرایش مییابند (13،17). در ساخت نانوالیاف، خود چیدمانی فرآیندی است که در آن مولکولهای کوچک به عنوان بلوکهای اساسی ساختار، به شکل نانوالیاف به یکدیگر اضافه میشوند. این شیوه پیشرفت زیادی در ترمیم بافتهای مختلف آسیب دیده مانند غضروف، استخوان، عصب، قلب و رگ ایجاد کرده است. در خودآرائی، نیروهای بین مولکولی خواص و شکل نانو الیاف را تعیین میکنند. خواص مکانیکی ضعیف داربستهای نانولیفی پپتیدی ممکن است کاربرد آن ها را به مواردی که نیاز به تحمل بار ندارند محدود کند (17).
کشش: در این فرآیند یک میکروپیپت به قطر چند میکرومتر درون محلول پلیمری فرورفته و سپس با سرعت ثابت خارج میشود که منجر به تولید نانوالیاف میشود. این فرایند بسیار ساده است و برای مواد ویسکوالاستیک مناسب است که در هنگام ایجاد تغییر شکل زیاد آرایش یافتگی کافی برای تحمل تنشهای ایجاد شده هنگام کشش را دارا هستند. با این وجود، محدود به مقیاس آزمایشگاهی است و کنترلی روی ابعاد وجود ندارد و همچنین نیازمند یک مرحله اضافی مانند بافندگی هستند (17).
الکتروریسی: الکتروریسی فرآیندی است که توانایی تولید نانوالیاف با قطری در حدود 500-100 نانومتر را دارد. این روش به جهت توسعه نانوالیاف در کاربردهایی همچون تهیه داربست های مهندسی بافت و رهایش دارو از اهمیت ویژهای برخوردار است (18). در شکل 2، شماتیکی از فرآیند الکتروریسی و داربست تشکیل شده به تصویر کشیده شده است اجزای اصلی دستگاه شامل یک سرنگ حاوی محلول پلیمری، سوزن فلزی، منبع تغذیه و جمع کننده است. این فرآیند با انتقال بارهای الکتریکی توسط سوزن به محلول پلیمری آغاز میشود. که این امر باعث ناپایداری در محلول پلیمری و القاء بار در قطرات پلیمر میشود و نیروی بارهای همنام در جهت عکس نیروی کشش سطحی عمل میکنند که منجر به جریان محلول پلیمر در جهت میدان الکتریکی میشود. افزایش بیشتر بارها در میدان الکتریکی سبب تغییر در شکل قطرات از کروی به سمت مخروطی میگردد. در این مرحله، نانوالیاف بسیار ریز از مخروط تیلور خارج شده و بر روی جمع کننده که در فاصله بهینه واقع شده، جمع میشوند. در طی این مسیر دافعه متقابل شارژهای سطحی موجود، باعث بروز ناپایداری و خم شدن جت میشوند. این حرکت شلاق گونه Whipping motion به زنجیرهای پلیمر اجازه می دهد کشیده شده و از کنار یکدیگر سر بخورند و در نتیجه الیاف تا حدی نازک میشوند که میتوان به آن ها عنوان نانو الیاف را اطلاق کرد (19). الیاف پلیمری، با تبخیر حلال جامد شده و روی جمعکننده متصل به زمین جمع میشوند که به طور معمول الیاف به صورت تصادفی، شکل حصیری میگیرند ولی بسته به نوع کاربرد میتوان از اشکال مختلف جمع کننده مانند صفحه ثابت، مندرل چرخان یا حمام انعقاد استفاده نمود (18).
1-3-عوامل تاثیر گذار بر فرایند الکتروریسی
3-1-1-عوامل محلولی:
غلظت و گرانروی: برای تشکیل نانو الیاف به غلظت مناسبی از پلیمر نیاز است (18). غلظت محلول پلیمری باید به اندازه کافی بالا باشد تا گره خوردگی زنجیر پلیمر رخ دهد (18). اگر محلول خیلی رقیق باشد، الیاف پلیمر قبل از رسیدن به جمع کننده بدلیل اثرات تنش سطحی شکسته میشوند ونقص مهرهای رخ میدهد (18،19). اما اگر محلول بیش از حد غلیظ باشد، به دلیل گرانروی بالا الیاف تشکیل نمیشوند و کنترل سرعت جریان محلول در سرسوزن دشوار میشود. در بسیاری از آزمایشات نشان داده شده است که در محدوده بهینه غلظت پلیمر، قطر الیاف با افزایش غلظت پلیمر افزایش مییابد (18). هدایت الکتریکی محلول: هدایت محلول علاوه برتاثیر روی شکل گیری مخروط تیلور در کنترل قطر نانوالیاف به میزان 10 تا 100برابر تأثیر میگذارد (18). در محلول های با هدایت الکتریکی پایین، امکان تشکیل مخروط تیلور وجود ندارد و الکتروریسی اتفاق نمیافتد (19،20). محلولهای با هدایت بالا، ظرفیت حمل بار بیشتری نسبت به محلول های با هدایت کم دارند و افزایش هدایت محلول به مقدار زیاد نه تنها باعث افزایش بار روی سطح قطرات برای تشکیل مخروط تیلور میشود بلکه باعث کاهش قطر الیاف نیز میگردد. افزایش رسانایی فراتر از یک مقدار مشخص نیز مانع از شکلگیری مخروط تیلور و الکتروریسی میشود (18). هدایت یک محلول پلیمری را میتوان با افزودن نمک مناسب به محلول کنترل کرد. در برخی از مطالعات، مشاهده شده است که پس از افزودن نمک به محلول پلیمر، نه تنها سطح نانوالیاف صاف میشود، بلکه قطر نانو الیاف نیز نسبت به قبل از افزودن نمک کاهش مییابد (19).
فراریت حلال: انتخاب حلال میتواند بر روی تشکیل یا عدم تشکیل الیاف و همچنین میزان تخلخل و ایجاد مهره تأثیر بگذارد (18،19). برای انتخاب حلال مناسب دو نکته حائز اهمیت است. اول آن که برای الکتروریسی، ترجیح با حلالی است که بتواند پلیمر را کاملاً حل کند و دوم آن که نقطه جوش مناسبی داشته باشد. معمولاً از حلالهای نسبتاً فرار به دلیل نرخ تبخیر مناسب برای الکتروریسی استفاده میشود. در الکترورریسی از حلال های بسیار فرار به دلیل رسوب نانوالیاف برروی جمع کننده و ایجاد نقص مهرهای در الیاف، در اثر دمای جوش پایین و سرعت تبخیر زیاد استفاده نمیشود و همچنین حلالهای کمفرار بدلیل دمای جوش بالا و خشک شدن ناکافی لیف مطلوب نیستند (19).
2-1-3-عوامل فرایندی:
ولتاژ اعمالی: ولتاژ اعمال شده به محلول یک عامل مهم است. به این دلیل که تشکیل لیف تنها هنگامی اتفاق می افتد که ولتاژ اعمال شده از آستانه ولتاژ (در حدود KV / cm 1، که به محلول پلیمری مورد استفاده وابسته است) فراتر رود(7). این فرایند بدین صورت است که جریان مستقیم با ولتاژ بالا از منبع تغذیه از طریق سوزن فلزی به محلول وارد میشود و ولتاژ بحرانی باعث تغییر وضعیت از شکل قطرات کروی به مخروط تیلور میشود (18،19). این ولتاژ بالا به ساخت الیاف با قطرهای کوچک کمک میکند. کاهش ولتاژ اعمالی منجر به ساخت الیاف با قطر بزرگتر میشود و با ادامه کاهش ولتاژ، قَطره در نوک مخروط تیلور آویزان میشود (18). افزایش ولتاژ اعمال شده فراتر از مقدار بحرانی منجر به تشکیل نقص مهره Bead defect یا نانو الیاف مهره دار خواهد شد (18،19).
سرعت جریان: سرعت جریان محلول پلیمری از طریق نوک سوزن سبب تعیین مورفولوژی نانوالیاف الکتروریسی شده میشود (19). مشاهده شده است که قطر الیاف و اندازه منافذ با افزایش سرعت جریان افزایش مییابد. علاوه بر این، در سرعت بالا میزان قابل توجهی از نقایص مهرهای مشاهده میشود که دلیل آن عدم توانایی الیاف برای خشک شدن کامل، قبل از رسیدن به جمع کننده است. خشک شدن ناقص الیاف منجر به تشکیل الیاف روبان مانند Ribbon-like (یا مسطح) به جای الیاف با سطح مقطع دایرهای میشود (18،19). از آنجا که افزایش و کاهش در سرعت جریان بر شکلگیری و قطر نانوالیاف تأثیر میگذارد، برای حفظ تعادل بین محلول پلیمری در حال ترک از نازل و جایگزینی آن با محلول جدید در هنگام تشکیل جت، نرخ جریان بهینه پیشنهاد میشود. نانوالیاف الکتروریسی شده یکنواخت بدون مهره را میتوان از طریق یک سرعت جریان بحرانی برای یک محلول پلیمری تهیه کرد (19). مقدار این جریان بحرانی در هر سیستم پلیمری متفاوت است نرخ جریان پلیمر علاوه بر تخلخل الیاف و شکل الیاف، اندازه الیاف را هم تحت تأثیر قرار میدهد (19،20).
فاصله سوزن تا جمعکننده: فاصله بین سوزن تا جمعکننده نقش مهمی در تعیین موفولوژی نانوالیاف الکتروریسی شده ایفا میکند. این عامل با کنترل فاصله و به پیروی از آن مدت زمان برای تبخیر کافی حلال قبل از رسیدن نانوالیاف به جمعکننده میتواند از 10- 100 برابر بر اندازه و مورفولوژی نانوالیاف تاثیر بگذارد (3،19،21). مورفولوژی به آسانی از فاصله تأثیر میپذیرد چراکه به زمان جمع شدن، سرعت تبخیر و فواصل زمانی ناپایداریها و حرکات شلاقگونه وابسته است (19). گروههای تحقیقاتی متعددی تأثیر فاصله بین نوک سوزن و جمع کننده را مورد بررسی قرار داده و نتیجه گرفتهاند وقتی که این فاصله کم نگه داشته شود نانوالیاف با قطر بزرگ و معیوب تشکیل میشوند، در حالیکه با افزایش فاصله قطر نانوالیاف کاهش مییابد. با اینحال، مواردی وجود دارد که با تغییر فاصله بین سوزن فلزی و جمع کننده هیچ تأثیری در مورفولوژی نانوالیاف مشاهده نشده است (19،21). از اینرو، برای تهیه نانوالیاف الکتروریسی شده صاف و یکنواخت، باید یک فاصله خاص را حفظ نمود (19).
قطر سرسوزن: افزایش قطر سوزن بر مورفولوژی الیاف، خصوصاً قطر متوسط الیاف تأثیر نمیگذارد. با این وجود، کاهش قطر سوزن منجر به افزایش مقاومت در برابر قطر لیف میشود و در نتیجه میتوان نانوالیاف را با قطر بزرگتر و کوچکتر در طی مراحل ساخت بدست آورد. تجزیه و تحلیل آنها نشان داده به جز توزیع گسترده دامنه قطر لیف که با سوزن قطر کمتر دیده میشود، هیچ ارتباط معنیداری بین میانگین قطر نانوالیاف و قطر سوزن وجود ندارد (19).
شرایط محیطی: شرایط محیطی را میتوان به دما ورطوبت بیرون و درون دستگاه الکتروریسی نسبت داد. افزایش دما منجر به ساخت نانوالیاف با قطر کم میشود. که این کاهش قطر را میتوان به کاهش گرانروی محلول های پلیمری در اثر افزایش دما نسبت داد (20،22). با اینحال، دمای پایینتر میتواند باعث گرفتگی سوزن در طی مراحل ساخت شود. بنابراین، کنترل دما در طول ساخت فرایند میتواند بهطور قابلتوجهی به نتایج بهتر کمک کند. افزایش رطوبت معمولا تاثیری در شکل یا قطر نانوالیاف ندارد ولی در متخلخل کردن الیاف که نقش مهمی در چسبندگی و نفوذ سلول دارد موثر است. همچنین تأثیر رطوبت در پلیمرهای مختلف اثر متفاوتی را نشان میدهد. به عنوان مثال در سلولز استات و پلی وینیل پیرولیدون، افزایش رطوبت باعث میشود که متوسط قطر الیاف افزایش یابد. بنابراین، رطوبت با توجه به ماهیت و نوع پلیمری که برای ساخت نانوالیاف مورد استفاده قرار میگیرد، نیاز به بهینهسازی دارد (19).

شکل 2 : شماتیکی از فرایند الکتروریسی و کاربرد آن به عنوان داربست مهندسی بافت (20)
4- نانوالیاف برای ساخت داربست
1-4-انواع الکتروریسی
الکتروریسی ذوبی و محلولی: هنگام الکتروریسی پلیمر، معمولاً یکی از این دو روش، قابل استفاده است. پلیمر را میتوان در یک حلال مناسب حل کرد و الکتروریسی نمود یا میتوان پلیمر را بهطور مستقیم به حالت مذاب الکتروریسی کرد. بهطور کلی، الکتروریسی در حالت محلول منجر به طیف گستردهتری از اندازه الیاف میشود، در حالیکه الکتروریسی مذاب معمولاً به اندازههای در مقیاس میکرون محدود میشود. با این وجود مزایا و معایبی برای هر کدام از این دو روش وجود دارد. الکتروریسی مذاب نیاز به حلالهای آلی را برطرف میکند، که برای فرآیندهای صنعتی ایدهآل است. با اینحال، در الکتروریسی مذاب باید درجه حرارت بالا نگه داشته شود تا الکتروریسی امکانپذیر باشد، در حالیکه در روش محلولی، محلولهای پایدار معمولاً میتوانند در دمای اتاق الکتروریسی شوند. دمای بالا ممکن است مانع از استفاده حالت مذاب برای مهندسی بافت یا کاربردهای دارویی شود. استفاده از مذاب پلیمر همچنین مشکل تبخیر ناکافی حلال بین نوک سوزن و جمع کننده را از بین میبرد. با اینحال، پلیمر باید قادر باشد به اندازه کافی در این فاصله خنک شود تا بتواند الیاف استوانهای شکل را تولید کند (18).
الکتروریسی خیس Wet electrospinning: الکتروریسی خیس یکی از مدلهای بهبودیافته در فرآیند الکتروریسی است که از ترکیب تکنیک الکتروریسی و حمام انعقاد به جای جمعکننده استفاده میکند. برخلاف روش الکتروریسی معمول، که در آن از جمع کنندههای فلزی جامد برای جمعآوری الیاف استفاده میشود، در الکتروریسی خیس از یک جمع کننده مخزنی حاوی مایع به عنوان یک جمع کننده متصل به زمین استفاده میشود. با جمعآوری الیاف در محیط آبی، مایع میتواند به عنوان جداکننده بین الیاف عمل کرده و از متراکم شدن الیاف روی یکدیگر جلوگیری کند. علاوه بر این، به دلیل فاصله استریوسکوپی زیاد بین الیاف تولید شده، الیاف بهجای رشد در سطح میتوانند در ضخامت رشد کنند. استفاده از این تکنیک امکان افزایش بیشتر در اندازه منافذ داربست، با استفاده از یک پروژن پراکنده در حمام جمعکننده را انجامپذیر میسازد. در این فرآیند چگالی ظاهری و تخلخل نانوالیاف، بستگی به کشش سطحی حمام الکتروریسی خیس دارد. به عنوان مثال، با کاهش کشش سطحی حمام، چگالی ظاهری داربست کاهش و تخلخل داربست افزایش مییابد (23).
2-4-داربستهای الکتروریسی شده دو بعدی و سه بعدی
داربستهای الکتروریسی شده نانولیفی ساخته شده از زیست مواد گوناگونی در مهندسی بافت جهت ایجاد تمایز غضروف یا چسبندگی و رشد در شرایط آزمایشگاهی برای انواع مختلف سلولها از جمله سلولهای بنیادی مزانشیمی MSC Mesenchymal stem cells مورد استفاده قرار میگیرند (24). سلولها رفتارهای متفاوتی را در داربستهای سه بعدی و دو بعدی دارا هستند. برای مثال سلولهای غضروفی کندروسیت در کشت دو بعدی (مانند سطح پلیت کشت سلولی) دگرتمایزی Dedifferentiate پیدا میکنند اما هنگامیکه کشت سه بعدی (به عنوان مثال روی یک داربست متخلخل) داده میشوند فنوتیپ Phenotype خود را حفظ خواهد کرد (25). در یک داربست مهندسی شده موفق نهتنها باید قطر الیاف کنترل شده باشد بلکه جهتگیری آنها حائز اهمیت است. داربستهای نانولیفی تولید شده با الیاف موازی از روشهای الکتروریسی بسیار مورد توجه هستند. زیرا جهتگیری الیاف تاثیر مستقیم بر رفتار سلولی میگذارد (26) برای بافتهایی مانند قلب، اعصاب و عضلات خاصیت هدایت داربست مورد اهمیت میباشد افزودن گرافین و گرافین اکسید به پلیمرهای زیست فعال مانند PAN /PANI Polyacrylonitriie- Polyaniline موجب افزایش هدایتپذیری و زیستسازگاری خواهد شد و درحضور CSA Camphor sulfuric acid، پلیمر راحتتر در حلال (DMF) Dimethylformamide حل شده و هدایت افزایش مییابد. در نتیجه الیاف الکتروریسی شده CSA- PAN/PANI و G طی بررسیهای مختلف نشان داد داربستی با استحکام کششی بالا و زیست سازگار تولید خواهد کرد و سلولهای بنیادی میتوانند بر روی آن تکثیر و تمایز داشته باشد (27) همچنین مطالعات نشان داد کامپوزیت الیاف الکتروریسی شده ریشه چغندر قند و نایلون ۶۶ موجب افزایش چسبندگی، تکثیر و تمایز سلولهای بنیادی و کراتین انسانی به صورت کشت همزمان Co-culture به سلولهای اپیتلیال شده و برای مهندسی بافت پوست بسیار مناسب است (28) همچنین مطالعه بر روی ترکیب پلی گلیسرول سباسات Polyglycerol sebacate (PGS) که پلیاستری زیستسازگار و زیست تخریبپذیر است به همراه ژلاتین بهطور گسترده خاصیت الکتروریسی شدن را بهبود میبخشد اما به دلیل ناپایداری در محیط آبی بدن و خواص مکانیکی ضعیف این ترکیب به آن پلی کاپرولاکتون میافزایند در نتیجه استفاده از سلولهای گلیال (نوعی سلول در بافت عصب) در این داربست در محیط درون بطنی نشان داد که سلولهای گلیال C6 موش میتوانند تکثیر و تمایز داشته باشند و توانایی استفاده در مهندسی بافت عصب را دارا میباشد (29).
3-4- بهبود ابعاد منافذ در داربستهای نانو الیافی
سادهترین راهکار برای افزایش سایز منافذ داربستهای الکتروریسی شده، اصلاح عوامل فرآیندی میباشد زیرا بین قطر الیاف و سایز منافذ رابطه وجود دارد. هر چقدر قطر الیاف بیشتر شود سایز منافذ افزایش مییابد؛ این یک توافق تجربی برای دامنهای از پلیمرهای پر کاربرد در مهندسی بافت مانند پلی کاپرولاکتون و ژلاتین میباشد. بهعنوان مثال گزارش شده است افزایش 2/5 برابری قطر الیاف الکتروریسی شده پلی کاپرولاکتون موجب افزایش 2/25 برابری سایز منافذ میشود (25). الکتروریسی خیس نیز از دیگر روشهای افزایش سایز منافذ و ایجاد داربستهای نانولیفی سه بعدی است. در این روش معمولاً از یک حمام آب، الکل و یا متانول به عنوان جمعکننده متصل به زمین جهت جمعآوری الیاف تولید شده استفاده میشود. الیاف جمعآوری شده سپس با روش خشک کردن انجمادی استحکام و شکل پیدا میکند. از این روش برای افزایش سایز منافذ در پلی گلیکولیک اسید و همچنین ابریشم استفاده شده است (30). همچنین در طول فرآیند الکتروریسی مواد مختلفی از جمله پلیمرهای حل شونده در آب، ذرات نمک و کریستالهای یخ میتواند بهطور موقت با الیاف شکل گیرند و نقش عامل حذف شونده را اجرا کنند. در نتیجه منافذی بین الیاف الکتروریسی شده به وجود میآید که سایز این منافذ به اندازه ذرات فدا شونده Sacrificial component بستگی دارد (5). الکتروریسی (FLUF) Focused, low density, uncompressed nanofiber یکی دیگر از روشهای افزایش سایز منافذ میباشد که در آن یک قطعه فلزی داخل یک صفحه نارسانای نیم کروی جایگزین صفحات جمع کننده مسطح میگردد (25). همچنین یکی از روشهای دیگر برای افزایش سایز منافذ استفاده از لیزر میباشد. استفاده از روش لیزر بر روی نانوالیاف الکتروریسی شده اولین بار برای الیاف پلی کاپرولاکتون صورت گرفت. لیزری با شدت بالا و پرتوتابی Radiance فوق سریع بر روی سطح نانو الیاف الکتروریسی شده تابانده میشود و به خاطر گرمای فوق سریع ایجاد شده در محل هدف، الیاف ذوب شده و انرژی بالای لیزر موجب تخلخل در الیاف میشود (30).
5-کاربرد نانو الیاف الکتروریسی شده در مهندسی بافت غضروف
1-5- مزایای ساختارهای نانولیفی در بازسازی غضروف
در طی سالهای اخیر روش الکتروریسی به عنوان متداول ترین روش تولید نانوالیاف برای ساخت داربستهای نانولیفی با قابلیت ایجاد شرایط تمایزMSC به کندروسیتها یا بستری برای گسترش سلولهای کندروسیت موردتوجه قرار گرفته است. داربستهای الکتروریسی شده به دلیل توانایی تطبیق با معیارهای مورد نیاز برای بازسازی غضروف مانند ساختار مکانیکی مناسب، تسهیل مهاجرت، تکثیر و تمایز سلولی در مهندسی بافت غضروف پرکاربرد هستند (31). به علاوه، برخلاف سایر انواع داربست متداول که دارای ساختار متخلخل با منافذ محدود هستند، منافذی که از کنار هم قرار گرفتن نانوالیاف در الکتروریسی تشکیل میشوند کاملاً بههم پیوسته هستند و امکان تغذیه سلولهای کندروسیت را تأمین میکنند (32). اولین اتفاقی که بعد از کاشت سلول روی داربست صورت میگیرد، چسبندگی است که به خاطر نسبت سطح به حجم بالای نانو الیاف، شرایط بسیار مناسبی برای چسبندگی سلولها وجود دارد (25). میزان بازسازی در بافت آسیب دیده بستگی به در دسترس بودن منافذ بزرگ Macropores برای نفوذ سلولی دارد. کوچک بودن اندازه منافذ ایجاد شده در ساختارهای الکتروریسی شده یکی از معایب این داربستها است که موجب محدود شدن بازسازی بافت خواهد شد (33). مطالعات لی و همکارانش، نشان داده است الیاف پلیکاپرولاکتون الکتروریسی شده موجب افزایش فنوتیپ کندروسیتها نسبت به بافت کشت داده شده روی سطح پلیت کشت سلول پلیاستایرنی ((TCPS Tissue culture polystyrene خواهد شد. همچنین کندروسیتها حالت دوکی Spindle شکل خود را حفظ کرده و در مقابل، سلولهای کندروسیت در سیستم TCPS شکل صاف به خود میگیرند (34). برهم کنش سلول با الیاف به سرعت باعث تعامل لیگاند سطح سلول با پروتئینهایی مانند فیبرونکتین، ویترونکتین، کلاژن و لامینین میشود. همچنین به دلیل سه بعدی بودن سطح این داربستها بر رفتار سلولی تاثیرگذار هستند و در این نوع داربستها بیان پروتئین های کندروسیتی شامل کلاژن نوع ٢ و ۴ و اگریکان بیشتر خواهد شد (35).
2-5- زیست پلیمرها برای ساخت نانوالیاف
1-2-5-پلیمرهای طبیعی: بیشتر پلیمرهای طبیعی، زیست سازگار و قابل تجزیه هستند. با اینحال، پلیمرهای طبیعی معایبی همچون احتمال ایمنیزایی Immunogenicity و خواص مکانیکی پایین دارند (36). پلیمرهای طبیعی به سهدسته اصلی طبقهبندی میشوند: پلینوکلئوتیدها که از زنجیرههای نوکلئوتید ساخته میشوند، پلیآمیدها که از زنجیرههای پروتئین ساخته میشوند و در آخر پلیساکاریدها که از زنجیرههای قند تشکیل میشوند (13). نمونههایی از پروتئینها مانند ابریشم، کلاژن، ژلاتین، فیبرینوژن، الاستین، کراتین، اکتین و میوزین و پلی ساکاریدها مانند سلولز، آمیلوز، دکستران، کیتین و گلیکوزآمینوگلیکانها هستند (9). کلاژن نوع I و IV بیشترین کاربرد را در مهندسی بافت دارند (13). به عنوان یک ماده طبیعی کلاژن قابلیت جذب و زیستسازگاری عالی و ایمنیزایی کمی را داراست (37). ژلاتین از کلاژن دناتوره Denatured شده بهوجود میآید. این ماده در حالیکه زیستسازگاری و ترکیبات شیمیایی مشابه کلاژن دارد مزیت اقتصادی در مقایسه با کلاژن خالص به جهت قیمت تمام شده را داراست (29) و توانایی حمایت از رشد استئوبلاستها و بازسازی استخوان در مناطق معیوب را دارد (12). داربستهایی از جنس سلولز به دلیل پایداری عالی، زیستسازگاری مطلوب، بهرهوری زیست محیطی و تجدیدپذیری یک موضوع تحقیقاتی مناسب در زمینه داربستهای مهندسی بافت است (38). کیتوسان پلیمری است که از استیلزدایی کیتین بهدست میآید و کیتین از پوست خرچنگ بهدست میآید (13). این پلیمر به دلیل زیستسازگاری بالا، زیست تخریبپذیری، خاصیت ضد باکتریایی، کمهزینه بودن و خاصیت انعقادی خون به عنوان یک ماده کاربردی مناسب در نظر گرفته میشود (12). آلژیناتها که اسید آلژنیک نیز شناخته میشوند، پلیساکاریدهای آنیونی جدا شده از جلبکها هستند. آنها از دو مونوساکارید تکرار شونده، یعنی اسید گلوکورونیک l-glucuronic acid و اسید مانورونیک D-mannuronic acid تشکیل شدهاند. ازعوامل شیمیایی مانند ادتات (EDTA) Ethylenediaminetetraacetic acid یا از آنزیمها برای تخریب آلژینات کلسیم استفاده میشود (13). پکتین یک پلیساکارید گیاهی است که از گیاهان خوراکی غنی شده در واحدهای متیلاستر گالاکتورونیک اسید و گالاکتورونیک اسید بهدست میآید. فیبروئین ابریشم به عنوان یک ماده زیستی امیدوارکننده در مهندسی بافت استخوان مورد تحقیق قرار گرفتهاست زیرا چندین مورد مفید را به نمایش میگذارد و خواصی مانند زیستسازگاری مناسب، زیست تخریبپذیری، نفوذپذیری کافی اکسیژن و بخار آب و حداقل واکنش التهابی را دارا میباشد (12). هیالورونیک اسید از پرمصرف ترین مواد در ساخت داربستهای مهندسی بافت غضروف مفصلی است. در سالهای اخیر از هیالورونیک اسید تحت عنوان ژل برای داربستهای مهندسی بافت غضروف استفاده میشود. ژل هیالورونیک میتواند مرفولوژی کندروسیتها را حفظ کند و باعث تقویت سنتز ماتریکس غضروف در شرایط آزمایشگاهی شود. علاوه بر این، سازههای ژل هیالورونیک کندروسیت میتوانند به خوبی با غضروفهای طبیعی پس از ترشح ماتریس غضروفی در داخل بدن ادغام شوند (36). آگاروز از جلبکهای دریایی جدا شده و کاربردهای گستردهای در رهایش کنترل شده داروها دارد. یکی از ویژگیهای منحصر به فرد آگارز در بیوفابریکیشن Biofabrication است که توانایی تنظیم خصوصیات مکانیکی مناسب برای کاربردهای مهندسی بافت را دارا میباشد (13).
2-2-5-پلیمرهای مصنوعی: برخی از پلیمرهای مصنوعی که معمولاً در ساختارهای زیستی مورد استفاده قرار میگیرند شامل پلیگلیکولیک اسیدPGA، پلیلاکتیکاسید PLA، کوپلیمر آنها پلی لاکتیک کوگلیکولیک اسیدPLGA ، پلیآنیدرید، پلیپروپیلن فومارات، پلی کاپرولاکتون، پلیاتیلنگلیکول PEG و پلی یورتان هستند و از بین آنها اغلب PGA ، PLA و PLGA برای مهندسی بافت غضروف مورد استفاده قرار میگیرد (شکل -3) (13). بعضی از این پلیمرها قابل تجزیه هستند. پلیمرهای رسانا، مانند پلیآنیلیل Polyaniline و پلیپیرولPolypyrrole، پلیمرهای پیزوالکتریک مانند پلیوینیلیدین فلوراید Polyvinylidene fluoride مزیتهای افزوده برای داربست فراهم میکنند و میتوانند برای ایجاد محرک الکتریکی یا مکانیکی مورد استفاده قرار گیرند (39). استفاده از PLA به تنهایی برای داربستهای الکتروریسی در بازسازی غضروف به دلیل سرعت پایین پاکسازی مواد اسیدی حاصل از تخریب پلیمر که باعث تجمع آنها در بافت میشود مورد توجه قرار نگرفته است. به همین منظور اغلب به عنوان یک جزء برای ترکیب از آنها استفاده میشود. پلیگلایکولیکاسید، یک پلیاستر نیمه کریستالی است و به دلیل دوره تخریب نسبتاً سریع، پلیمری مناسب برای داربستها میباشند. یکی دیگر از پلیمرهای مصنوعی مبتنی بر پلیاستر، پلی کاپرولاکتون PCL است که بهطور گسترده در کاربردهای الکتروریسی غضروف مورد مطالعه قرار گرفته است. از آنجاییکه تخریب برای این پلیمر بسیار کندتر از PGA است (بیش از ۲۴ ماه) و احتمال تجمع محصولات تخریب اسیدی به دلیل سرعت پاکسازی پایین را از بین میبرد میتواند یک پلیمر ایدهآل باشد. علاوه بر این، فرآیندپذیری عالی در انواع حلالهای آلی و غیر آلی کاربرد آن را به عنوان ماده ترکیبی برای کاربردهای بافت غضروف افزایش میدهد (34).

شکل3: فرمول ساختاری پلیمرهای طبیعی و سنتزی تخریب پذیر
6- مرور مطالعات انجام شده برای ترمیم غضروف با روش الکتروریسی
نقص غضروف مفصلی یک چالش بالینی است که منجر به بیماری آرتروز میشود (40). روشهای جراحی و سلول درمانی، نتوانستهاند یک راهکار مناسب ارائه دهند. به همین منظور ساخت داربستهای مشابه ماتریس خارج سلولی با کمک روش الکتروریسی میتواند راهگشا باشد (40). الکتروریسی یک ابزار قدرتمند برای ساخت داربستها میباشد زیرا ساده، ارزان، متنوع و قادر به ساختن ECM است (23). به تازگی، داربستهای نانولیفی برای مهندسی بافت مورد استفاده قرار گرفتهاند زیرا اعتقاد بر این است که داربستهای نانولیفی قادر به حفظ ویژگی های مشابه اجزای ماتریس خارج سلولی هستند (12،30). یکی از بزرگترین مزایای استفاده از الکتروریسی ظرفیت پردازش مواد مختلف برای تولید داربستها با خواص شیمیایی و مکانیکی متنوع است که میتواند به پاسخهای مختلف بیولوژیکی در سلولها منجر گردد (19). مطالعات نشان میدهد داربست با الیاف جهت دار، باعث افزایش توانایی ترمیم غضروف به واسطه افزایش چسبندگی، تکثیر و تمایز سلولهای کاشته شده میشود (41). اخیراً مشخص شده است که داربست کامپوزیتی پلیلاکتیککوگلیکولیکاسید/ فیبرویین ابریشم/PLLAPoly-l-lactic acid نسبت به داربست PLLA بدون SF چسبندگی، تکثیر و رشد کندروسیتها را بیشتر افزایش داده و این داربست را به عنوان ماده مناسب جهت کاربرد در مهندسی بافت غضروف معرفی میکند (15). در شرایط طبیعی بدن، کندروسیتها تحت دو عامل فشار و توپوگرافی سطح، غضروفسازی میکنند مطالعات نشان میدهد استفاده از دستگاه پرفیوژن بیوراکتور Perfusion bioreactor با اعمال فشار هیدرودینامیکی بر روی داربست الکتروریسی شده PCL/PLGA که در آن سلولهای MSC بارگذاری شده باشد در محیط کشت تمایزی Differentiating medium میتواند بیان کلاژن نوع ۲ و آگریکان را افزایش دهد و موجب تمایز MSC به کندروسیتها خواهد شد (42). در مطالعهای که از ترکیب پلی کاپرولاکتون/ژلاتین/ کیتوسان درون حلالهای استیک اسید و فرمیک اسید برای الکتروریسی و ساخت داربست مورد استفاده قرا گرفته بود نتایج تست MTT در رابطه با زیستسازگاری داربست نشان داد که سلولهای بنیادی توانایی تکثیر بالایی در این داربست پیدا خواهند کرد و همچنین چسبندگی سلولی و نیز تمایزتکثیر سلولی بالاتری نسبت به داربست PCL با کلاژن / ژلاتین خواهد داشت (43). ساخت داربست PCL محلول در فرمیک اسید و استیک اسید با اصلاح سطح و اتصال GAG نشان داد که این داربست نسبت به PCL، موجب افزایش آبدوستی سطح به دلیل پیوندهای کووالانسی GAG شده است. آزمون سمیت سلولی نشان داد این داربست در بازههای زمانی ۲۴/ ۴۸/ ٧٢ ساعت هیچگونه سمیت سلولی ایجاد نکرده و از وضعیت تکثیر سلولی حمایت می کند و نیز موجب تمایز سلولهای بنیادی به کندروسیتها خواهد شد (44). در مطالعهای که از داربست الکتروریسی شده پلیوینیلالکل/آلژینات سولفات PVA/ALG-S با نسبت وزنی 30 درصد استفاده شده است مشاهدات نشاندهنده میزان بالای منافذ در داربست با ساختاری تصادفی از PVA/ALG-S نسبت به PVA خالص و افزایش تکثیر و چسبندگی سلولی بوده است. همچنین آزمون MTT بیانگر زیستسازگاری و غیر سمی بودن این داربست برای سلولهای بنیادی نیز میباشد (6). ساخت داربست PCL اصلاح شده توسط اتصال ژلاتین با پیوندهای کوالانسی و اصلاح سطح توسط گروه های کربوکسیل و الکتروریسی آن نیز نتایج جالبی را در برداشت. تولید داربستی با منافذ بالا که این منافذ به یکدیگر پیوسته هستند. همچنین آزمون WCA (Water contact angle) آبدوست بودن سطح PCL برای چسبندگی بهتر داربست را نشان داد. نتایج آزمون MTT بیانگر زیستسازگاری بالای این داربست میباشد (4). در تولید داربستی که در آن ژلاتین با گلیکوزآمینوگلیکان حل شده در آب و الکتروریسی شده و توسط گلوتارالدهید در داربست اتصالات عرضی ایجاد گردیده، نتایج نشان داد در هیچکدام از داربستها در ۴ غلظت متفاوت از ژلاتین با عناوین (G0، G1، G2، G3) افزایش میزان GAG باعث کاهش قطر الیاف خواهد شد و داربست G3 آبدوستی بالاتری نسبت به نمونههای دیگر از خود نشان داد و داربست G3 از بالاترین میزان ترشح GAG برخوردار بوده است (45). در ساخت داربست نانولیفی PLGA / PCL به دو صورت الیاف تصادفی و موازی با استفاده از الکتروریسی، نتایج بیان میکند در تست MTT این داربست چه در آرایش تصادفی و چه موازی تکثیر hBMMCs وجود دارد و ایجاد سمیت نمیکند. این مطالعه بیان می دارد که بیشترین تکثیر سلولی از آبدوستی PLGA نشأت میگیرد. همچنین تصاویر SEM نشان داد با افزایش نسبت PCL قطر منافذ داربست نانولیفی افزایش مییابد داربست PLGA/PCL دارای منافذ به هم متصل میباشد. خواص مکانیکی داربست با الیاف موازی دارای خواص مکانیکی بالاتری میباشد (20). اگرچه نانوالیاف به دلیل تقلید از اجزای ماتریکس خارج سلولی مانند الیاف کلاژن مورد توجه هستند، اما اعتقاد بر این است که تراکم بالای نانوالیاف میتواند باعث افزایش محدودیت برای نفوذ سلول شود. بنابراین، ساخت داربستهای لیفی با دستگاههایی با پیکربندی چند نازله میتواند با تولید ترکیبی از میکروالیاف و نانوالیاف، هدف افزایش اندازه منافذ، بهبود تمایز سلولی و تولید ماتریس خارج سلولی را محقق سازد (15،46). ساخت داربست/PCL CDM الکتروریسی شده توسط حلال هگزافلوروایزوپروپانول نشان داد حضور CDM موجب تولید GAG و کلاژن نوع A110 خواهد شد (47). ساخت داربست ژلاتینPCL/ GEL الکتروریسی شده توسط حلال دی کلرومتان / متیل بنزن / اسید فرمیک / اتیل استر نشان داد داربست GEL/PCL با نسبت 2:1 و اتصالات عرضی ژلاتین دارای خواص مکانیکی مناسبی است وافزایش ژلاتین موجب حمایت داربست از پاسخهای بیولوژیک سلول خواهد شد (48). ساخت داربست کلاژن / PCL الکتروریسی شده توسط حلال HFP نشان داد کلاژن تأثیر زیادی بر آبدوستی داربست داشته و موجب تقویت ساختار مکانیکی داربست خواهد شد (49). ساخت داربست ابریشم / PLLA الکتروریسی شده توسط حلال اسید تری فلوئوراستیک / هگزافلوروئیزوپروپانول نشان داد که ابریشم در کنار PLLA، موجب چسبندگی سلولی، تکثیر و رشد بیشتر کندروسیت ها نسبت به PLLA بدون حضور ابریشم خواهد شد (50). ساخت داربست PCL / کیتوسان الکتروریسی شده توسط حلال کلروفرم / متانول / اسید تری فلوئوراستیک نشان داد بعد از 7 روز رشد و تکثیر سلولی مشاهده میشود و حضور کیتوسان آبدوست در کنار پلی کاپرولاکتون آبگریز به آبدوستی داربست کمک میکند (51). ساخت داربست کلاژن/ PLA الکتروریسی شده توسط حلال هگزافلوروئیزوپروپانول نشان داد کلاژن تاثیر زیادی بر آبدوستی داربست داشته و موجب تقویت ساختار مکانیکی داربست خواهد شد (52). ساخت داربست PLA/PCL الکتروریسی شده توسط حلال کلروفرم / دی متیل فرمامید نشان داد چسبندگی کندروسیتها روی داربست افزایش یافته و سطح بالایی از ماتریس خارج سلولی تولید میشود (53).
جدول 1 : پلیمر های طبیعی


جدول 2 : پلیمرهای سنتزی الکتروریسی شده در مهندسی بافت غضروف


جدول3 : پلیمرهای کامپوزیت الکتروریسی شده در مهندسی بافت غضروف


7- منابع سلولی
کندروسیتها، فیبروبلاستها، سلولهای بنیادی و سلولهایی که از لحاظ ژنتیکی اصلاح شدهاند همه در مهندسی بافت غضروف آزمایش شدهاند. با اینحال، سلولهای غضروفی و سلولهای بنیادی مزانشیمی بیشترین منابع سلولهای غضروفی برای ترمیم غضروف هستند (16). سلولهای غضـروفی بـالغ بـه دلیـل داشتن توانایی تشـکیل مـاتریس خـارج سـلولی میتوانند از منابع مختلفی مانند غضروف مفصلی، تیغه بینی، غضروف دندهای یا غضروف گوش جداسازی شده و در مهندسـی بافـت غضـروف مـورد اسـتفاده قـرار گیرند (16). استفاده از سلولهای غضروفی برای مهندسی بافت غضروف دارای اشکالات اندکی از جمله در دسترس بودن محدود منبع ماده، همراه با عوارض جانبی (و ایجاد عارضه در روند بهبود ناحیهای که بافت جدا شده است) میباشد (13). سلولهای غضروفی اولیه بالغ ماهیت فنوتیپی خود را در طی فرآیند تمایز زدایی در شرایط آزمایشگاهی از دست میدهند.به همین منظور استفاده از آنها بسیار محدود شدهاست (34). اگر از سلولهای بنیادی برای ترمیم استفاده شود، در نتیجه میتوان به دلیل توانایی تکثیر بالای این سلولها، هر اندازه از آسیب جدا شده از غضروف را ترمیم کرد. سلولهای بنیادی مزانشیمی با توجه به مهندسی بافت غضروف به عنوان یک خط اصلی ظاهر شده و پتانسیل کندروژنیک خوبی را نشان میدهد. منابع بهینه بافتها برای برداشت سلولهای بنیادی مزانشیمی، به دلیل دسترسی آسانتر و مقدار موجود در بافت، بهطور کلی در مغز استخوان و بافت چربی بوده است. سلولهای بنیادی مزانشیمی مشتق از چربی در مقایسه با سلولهای بنیادی مزانشیمی مشتق از مغز استخوان باعث ایجاد تمایز غضروفی ببیشتری میشوند. علاوه بر این، هنگام استفاده از بافت چربی در مقایسه با مغز استخوان، سلولهای بنیادی مزانشیمی بیشتری میتوانند در حجم مساوی از بافت جدا نمود و راندمان استخراج سلول بالاتر است (78).
8- رهایش مولکولهای پیامرسان مبتنی بر نانوالیاف برای بازسازی بافت غضروف
8-1-رهایش فاکتورهای رشد
سایتوکاینها و فاکتورهای تمایزی که توسط سلولها ترشح میشوند و به عنوان مولکولهای پیامرسان نقش ایفا میکنند. اتصال فاکتورهای رشد به گیرنده شان، موجب آغاز پیامرسانی داخل سلولی (تکثیر، تمایز و مهاجرت) میشود. TGF- β1 Transforming growth factor beta 1 از جمله فاکتورهای تمایزی میباشد و شامل دو پروتئین CIF-A1 Cartilage-inducing factors و CIF-B1 بوده که موجب القا تمایز سلولهای بنیادی به غضروف و حفظ فنوتیپ کندروسیتها میگردد (78). بهرهگیری از TGF-β1 در داربست کیتوسان و کاشت آن در زانوی خرگوش پس از ۱۲ هفته، منجر به ترمیم بافت غضروف آسیب دیده و جایگزینی آن با غضروف شفاف گردید (79).
2 -IGF از طریق PI3K Phosphoinositide 3-kinases نقش مهمی در پیامدهی و اعمال سلولی نظیر رشد، متابولیسم سلولی دارد. موجب تنظیم عملکرد کندروسیتها خواهد شد (80). مطالعات بر روی داربست PCL/PLGA حاوی IGF-2 نسبت به داربست PCL/PLGA بدون1-IGF نشان داد حضور 1-IGF موجب افزایش مهاجرت سلولی و تولید کلاژن وGAG گردیده و ایجاد ماتریس غضروفی بسیار مستحکمتر نسبت به مش بدون فاکتور رشد طی هشت هفته در شرایط درونتنی خواهد شد(81).
2 BMP- در کلیه فازهای تشکیل غضروف دخیل میباشد و فعالیت آن از طریق 1-5-8 Smad و 4 Smad نوعی پروتئین که در رشد و بازسازی بافت نقش دارد، تنظیم میشود (82). مطالعات نشان داد استفاده از داربست PLGA و سلولهای بنیادی مزانشیمی مغز استخوان در حضور 5.8 میکروگرم 2 -BMP در مقایسه با PLGA و سلول، بدون 2 – BMP پس از ۲۴ هفته، هیچگونه هایپرتروفی و غضروفزایی را در پی نداشت (83).
8-2- رهایش کوچک مولکولها
*کوچک مولکولها، پلیپپتیدهای پروتئینی جایگزین فاکتورهای رشد هستند. جرم مولکولی پایین، پایداری بالا، عدم تحریک سیستم ایمنی، رهایش آسان آنها، از مزایای کوچک مولکولها میباشد. KGN Kartogenin با تنظیم فاکتورهای رونویسی CBFβ-RUNX1 موجب سنتز ماتریس غضروفی خواهد شد (84). جانسون و همکارانش، مشاهده کرد که KGN هیچگونه هایپرتروفی در کندروسیتها یا سلولهای بنیادی ایجاد نمیکند ولی موجب تنظیم و افزایش ترشح آگریکان و کلاژن نوع ۲ و نیز سبب مهار MMP خواهد شد این مطالعه نشان داد که KGN نهتنها موجب حفظ فنوتیپ کندروسیت بلکه از تخریب ماتریس غضروفی جلوگیری میکند (84). BIO با فعال سازی مولکول پیامرسان WNT موجب بیان ژنهای غضروفی میگردد (85). تحقیقات نشان داد استفاده از BIO به میزان 01/0 میکرولیتر موجب افزایش تمایز سلولی با افزایش سطح بیان ژنهایویژه غضروف مانند آگریکان، کلاژن نوع 2و SOX-9 در طول ۱۴ روز خواهد شد در حالیکه بدون حضور BIO این فرآیند در طول ۲۱ روز انجام میپذیرد (86). کلرید بربرین Chloride Berberine با فعالسازی مولکولهای پیامرسان catenin-β/Wnt و سنتز PCNA5، باعث افزایش سدیمنیتروپروساید در موش آزمایشگاهی شده و در نتیجه باعث ساخت مفصل غضروفی خواهد شد (87). بیشترین استراتژیهای دارو درمانی شامل مسکنها (مانند استامینوفن، پروپوکسیفن و ترامادول)، داروهای ضدالتهاب غیر استروئیدی NAIDS Non-steroidal anti-inflammatory drugs ، مانند ایبوپروفن و سلکوکسیب) و گلوکورتیکوئیدها (مانند پردنیزولون، دگزامتازون) میباشند. داروهای ضدروماتیسمی (مانند متوترکسات) و عوامل بیولوژیکی اولین رویکرد درمانی بیماری آرتروئیت روماتوئید به منظور تسکین آسیب مفصلی و کنترل روند بیماری هستند (88). دگزامتازون تمایز سلولهای غضروفی را در جمعیت سلولهای اولیه جدا شده از بافت غضروف و همچنین در سلولهای بنیادی مزانشیمی حفظ میکند (4). لیون و همکاران نشان دادند که دگزامتازون باعث تحریک تکثیر کندروسیتها میشود (89). DHEA میتواند به عنوان یک استراتژی اصلاح کننده بیماری برای محدود کردن پیشرفت OA مورد استفاده قرار گیرد (90). جو و همکاران نشان دادند که سلولهای غضروفی جدا شده از غضروف زانو انسان تحت تیمار DHEA، بیان ژن و سنتز پروتئین های غضروفی را متوقف میکند در حالیکه بیان ژن و سنتز پروتئین TIMP-1Tissue inhibitors of metalloproteinase-1را افزایش میدهد. DHEA از تخریب مفصل غضروفی جلوگیری نموده و مانع از پیشرفت OA با تعدیل کاتابولیک/آنابولیک غضروف، که شامل سیستم MMPs / TIMP-1 Matrix metalloproteinases و سیستم ADAMTS/TIMP-3 میباشد، میگردد (90). مطالعات نشان میدهد که سالیدروساید منجر به تکثیر سلولهای غضروفی و مهار آپوپتوز کندروسیت میشود، بهعلاوه سالیدروساید فیبروز کلاژن را نیز کاهش میدهد و التهاب و پاسخ ایمنی ناشی از ACLT Anterior cruciate ligament transection را در موشها از طریق مسیر NF-KB تعدیل میکند (91). VA692 دارای خاصیت ضدالتهابی مشابه سلکوکسیب است که یک مدولاسیون مناسبتر از IL-6 در رده سلولهای غضروفی اولیه در OA نشان میدهد (92).
جدول 4 : فاکتور های رشد، کوچک مولکول ها و داروهای متداول مورد استفاده در مهندسی بافت غضروف



نتیجهگیری
در دهههای اخیر، روشهای مبتنی بر مهندسی بافت، بهویژه با استفاده از نانوالیاف الکتروریسی شده، بهعنوان رویکردی موثر در بازسازی بافتهای غضروفی مطرح شدهاند. این روشها به دلیل ویژگیهای منحصربهفرد نانوالیاف، از جمله سطح تماس بالا، ساختار متخلخل، و امکان زیستتخریبپذیری، به طور قابلتوجهی توانستهاند محدودیتهای موجود در روشهای سنتی ترمیم بافتهای غضروفی را بهبود بخشند. ساختار متخلخل این داربستها، شرایطی را فراهم میکند که امکان تغذیه مناسب سلولها، دفع ضایعات متابولیکی، و ایجاد شبکهای برای انتشار اکسیژن و مواد مغذی به داخل بافت را میسر سازد. نانوالیاف الکتروریسی شده، با شباهت زیاد به ساختار ماتریکس خارج سلولی، نقش حیاتی در بهبود چسبندگی سلولی و ایجاد محیطی مناسب برای تکثیر و تمایز سلولهای بنیادی، بهویژه سلولهای بنیادی مزانشیمی، ایفا میکنند. این امر موجب میشود که نانوالیاف بتوانند بهطور موفقیتآمیزی در بازسازی بافتهای غضروفی و حتی در موارد پیچیدهتر، مانند ترمیم مفاصل آسیبدیده در بیماریهایی نظیر آرتروز، مورد استفاده قرار گیرند. علاوه بر این، بهرهگیری از پلیمرهای زیستتخریبپذیر، مانند پلیلاکتیک اسید و پلیکاپرولاکتون، و ترکیب آنها با پلیمرهای طبیعی نظیر کلاژن و ژلاتین، به افزایش کارایی و زیستسازگاری این داربستها کمک کرده است. بهویژه، داربستهای الکتروریسی شده ترکیبی، با ایجاد محیطی دینامیک و بهینه برای سلولهای غضروفی، میتوانند مقاومت مکانیکی و همچنین خواص زیستی لازم را برای بازسازی بافت فراهم کنند. در کنار این مزایا، فناوری رهایش کنترلشده فاکتورهای رشد، مانند TGF-β1 وIGF-1، و همچنین رهایش ترکیبات کوچک مولکول، نظیر KGN و BIO، از طریق نانوالیاف، روشی موثر برای تسریع فرآیند بازسازی بافت و بهبود کیفیت درمان به حساب میآید. این فناوریها، با ارائه شرایط ایدهآل برای تکثیر و تمایز سلولها و کاهش میزان التهاب و آسیب بافتی، توانستهاند نتایج مثبتی را در مطالعات آزمایشگاهی و بالینی به نمایش بگذارند.
10-چالشها و چشماندازها
پیشرفتهای زیادی در مهندسی بافت غضروف طی سالهای اخیر صورت گرفته است و تحقیقات گستردهای در راستای الکتروریسی نانوالیاف از زیست پلیمرها انجام شده است. نتایج بهوضوح توانایی قابلتوجه داربستهای الکتروریسی شده را در مهندسی بافت غضروف نشان دادهاند؛ ولی هنوز چالشهایی در بخشهای مختلف وجود دارد که به عنوان مثال میتوان به انتخاب پلیمر مناسب برای ساخت نانوالیاف، بهبود استحکام مکانیکی، زیستسازگاری، تنظیم مورفولوژی، آرایش یافتگی و شکل داربست اشاره کرد. نانوالیاف الکتروریسی شده بر پایه پلیمرهای طبیعی بهصورت کلی دارای خواص مکانیکی ضعیف و پایداری ساختاری نامناسب هستند. از طرف دیگر پلیمرهای سنتزی خواص مکانیکی خوبی دارند ولی از نظر زیستی توانایی پایینی در تنظیم رفتارهای سلولی مانند چسبندگی و تمایز دارند. تلاشهای زیادی صورت گرفته است تا کامپوزیتهای جدیدی بر پایه مزایای هر دو گروه پلیمرهای ذکر شده طراحی شود. پلیساکاریدهای سولفاته به عنوان پلیمرهای طبیعی به دلیل شباهت ساختاری به اجزای موجود در ECM بافت غضروف گزینه های مناسبی برای تنظیم رفتار سلولی بهخصوص بحث تمایز غضروفی در داربستهای الکتروریسی شده هستند. بهنظر میرسد ساختارهای بر پایه آمیزهها و یا کامپوزیتهای پلیمری حاوی پلیساکاریهای سولفاته پتانسیل مناسبی برای کاربرد مهندسی بافت غضروف دارا باشند (74،102). بهبود خواص مکانیکی داربستهای الکتروریسی شده برای کاربرد در بازسازی غضروف همواره دارای اهمیت بوده است. هرچند تلاشهای زیادی در این زمینه انجام شده است ولی هنوز خواص مکانیکی این داربستها پایینتر از میزان مورد نیاز است. یکی از روشهای اصلی بهبود خواص مکانیکی در داربستهای الکتروریسی شده، کامپوزیت کردن با افزودن نانوساختارها، ایجاد ساختار هسته پوسته و یا الکتروریسی همزمان است (43،103). تهیه ساختارهای الکتروریسی شده سه بعدی، به کمک روشهایی مانند الکتروریسی خیس، یکی از راهکارهای مورد توجه در مهندسی بافت غضروف است. این ساختارها میتوانند با هدف بهبود خواص مکانیکی و زیست فعالی پس از غوطهوری در یک هیدروژل، استحکام مکانیکی بهبودیافتهای را نشان دهند (104). هرچند هنوز مطالعات کافی در این حیطه صورت نگرفته است. هرچند داربستهای الکتروریسی شده دارای تخلخل بالایی هستند ولی یکی از معایب اصلی آنها ابعاد کوچک منافذ است زیرا سبب جلوگیری از نفوذ و مهاجرت سلولها و درنتیجه تکثیر آنها در داخل داربست نانولیفی میشود (105). روشهای مختلفی برای حل این مشکل پیشنهاد شده است مانند استفاده از الیاف فدا شونده، الیاف ترکیبی میکرو / نانو متری، اولتراسونیک کردن برای افزایش فاصله الیاف، شستشوی نمک و کریستالهای یخ (106،107). تاثیر مثبت استفاده از ساختارهای سه بعدی بر روی سرعت نفوذ سلولها و تکثیر سلولها به وسعت بررسی شده است و مورد تایید قرار گرفته است. همچنین قابلیت پایداری در آب و تشکیل بافت شبه غضروفی در این ساختارها مورد ارزیابی قرار گرفته است و مزیت آنها نسبت به ساختارهای دو بعدی اثبات شده است .غالب مطالعات انجام شده در طی سالهای گذشته با تمرکز بر زیستپلیمرهای مختلف و تاثیر عوامل جهت فرایند الکتروریسی بوده است ولی پیکربندی ساختاری آنها نمایش دهنده آرایش یافتگی سه بعدی ECM غضروف نیست. با توجه به اینکه غضروف یک بافت پیچیده با آرایشیافتگیهای متفاوت از ECM است، روشهای الکتروریسی که با هدف تقلید کردن این آرایش یافتگی در حال حاضر استفاده میشوند بیشتر محدود به روشهایی مانند چند لایهسازی است. ساختارهای لایه لایه مورد استفاده نیز به دلیل مشکلات ناشی از نبود یکپارچکی و یکنواختی بین لایهها از نظر کاربردهای پزشکی با نگرانیهای زیادی روبهرو خواهد بود. بنابراین بهنظر میرسد یک داربست نانولیفی با تغییرات تدریجی در ساختار و خواص مکانیکی می تواند گزینه بهتری برای باز سازی غضروف باشد (45). بحث دیگری که باید برای استفاده از داربست های الکتروریسی شده در مهندسی بافت غضروف در نظر گرفته شود، اندازه و شکل آنها ست. بیشتر مطالعات منتشر شده تا کنون محدود به اندازه آسیبهای غضروفی استوانهای با ضخامت کم بوده است. برای آنکه داربستهای الکتروریسی شده تطابق و نزدیکی بیشتری برای کاربرد مهندسی بافت غضروف پیدا کنند لازم است تا روشهای جدیدی برای افزایش مقیاس اندازه داربستها برای یک غضروف کامل با شکل مورد نیاز هر بیمار ایجاد شود (42). در نهایت میتوان گفت استفاده از داربستهای الکتروریسی شده در مهندسی بافت غضروف با وجود پیشرفتهای قابلتوجهی که در طی سالهای اخیر داشته است ولی هنوز با چالشهای جدی در حیطههای خواص بایومکانیکی و زیستی روبهرو است. زیستپلیمرهای جدیدتری نیاز است تا با درنظر گرفتن استحکام مکانیکی، زیستسازگاری و زیست تخریبپذیری مطالعه شوند و مورد ارزیابی قرار بگیرند. لازم است روشهای ساخت از نظر تجهیزات، تکرارپذیری و شرایط فرایندی با هدف زیست تقلیدپذیری بهتر و صرفه اقتصادی اصلاح شوند و بهبود پیدا کنند تا امکان کاربرد بالینی این محصولات مهیا شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Eltom A, Zhong G, Muhammad A. Scaffold Techniques and Designs in Tissue Ngineering Functions and Purposes: A Review. Adv Mater Sci Eng 2019; 2019: 3429527.
2- Ratner BD, Hoffman AS, Schoen FJ, Lemons JE. Biomaterials Science: An Introduction to Materials in Medicine. 2nd ed. San Diego: Elsevier Academic Press; 2004.
3- Rodríguez GB, Patrício TMF, Delgado López JM. Natural Polymers for Bone Repair in Bone Repair Biomaterials. 2nd edition. Regeneration and Clinical Applications: Woodhead Publishing; 2019: 199-232.
4- Meghdadi M, Mohammad S, Mohamad A, Modaress P, Irani S. Cold Atmospheric Plasma as A Promising Approach for Gelatin Immobilization on Poly (Ε-Caprolactone) Electrospun Scaffolds. Prog Biomater 2019; 8: 65-75.
5- Ito R, Morimoto N, Liem P, Nakamura Y, Kawai K, Taira T, et al. Adipogenesis Using Human Adipose Tissue-Derived Stromal Cells Combined with a Collagen/Gelatin Sponge Sustaining Release of Basic Fibroblast Growth Factor. Tissue Engineering and Regenerative Medicine 2012; 8(12): 1000-8.
6- Irani S, Tavakkoli S. Electrospun Nanofibrous Alginate Sulfate Scaffolds Promote Mesenchymal Stem Cells Differentiation to Chondrocytes. J Appl Polym Sci 2021; 138(8): 49868.
7- Liao J, Shi K, Ding Q, Qu Y, Luo F, Qian Z. Recent Developments in Scaffold-Guided Cartilage Tissue Regeneration. Journal of Biomedical Nanotechnology 2014; 10(10): 3085-104.
8- O’Brien FJ. Biomaterials & Scaffolds for Tissue Engineering. Mater Today 2011; 14(3): 88-95.
9- Dhandayuthapani B, Yoshida Y, Maekawa T, Kumar DS. Polymeric Scaffolds in Tissue Engineering Application: A Review. Int J Polym Sci 2011; 2011: 290602.
10- Cheung HY, Lau KT, Lu TP, Hui D. A Critical Review on Polymer-Based Bio-Engineered Materials for Scaffold Development. Compos Part B Eng 2007; 38(3): 291-300.
11- Velasco MA, Narváez-Tovar CA, Garzón-Alvarado DA. Design, Materials, and Mechanobiology of Biodegradable Scaffolds for Bone Tissue Engineering. Biomed Res Int 2015; 2015: 729076.
12- Ghasemi-Mobarakeh L, Prabhakaran MP, Balasubramanian P, Jin G, Valipouri A, Ramakrishna S. Advances in Electrospun Nanofibers for Bone and Cartilage Regeneration. J Nanosci Nanotechnol 2013; 13(7): 4656-71.
13- Rana D, Ratheesh G, Ramakrishna S, Ramalingam M. Nanofiber Composites in Cartilage Tissue Engineering. Elsevier Ltd; 2025; 325-44.
14- Karuppal R. Current Concepts in the Articular Cartilage Repair and Regeneration. J Orthop 2017; 14(2): A1-A3.
15- Kazemnejad S, Khanmohammadi M, Baheiraei N, Arasteh S. Current State of Cartilage Tissue Engineering Using Nanofibrous Scaffolds and Stem Cells. Avicenna J Med Biotechnol 2017; 9(2): 50-65.
16- Vinatier C, Guicheux J. Cartilage Tissue Engineering: From Biomaterials and Stem Cells to Osteoarthritis Treatments. Ann Phys Rehabil Med 2016; 59(3): 139-44.
17- Kazemnejad S, Khanmohammadi M, Baheiraei N, Arasteh S. Current State of Cartilage Tissue Engineering Using Nanofibrous Scaffolds and Stem Cells. Avicenna J Med Biotechnol 2017; 9(2): 50-65.
18- Sill TJ, von Recum HA. Electrospinning: Applications in Drug Delivery and Tissue Engineering. Biomaterials 2008; 29(13): 1989-2006.
19- Haider A, Haider S, Kang IK. A Comprehensive Review Summarizing the Effect of Electrospinning Parameters and Potential Applications of Nanofibers in Biomedical and Biotechnology. Arab J Chem 2018; 11(8): 1165-88.
20- Zamanlui S, Mahmoudifard M, Soleimani M, Bakhshandeh B, Vasei M, Faghihi S. Enhanced Chondrogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells on PCL/PLGA Electrospun with Different Alignment and Composition. Int J Polym Mater Polym Biomater 2018; 67(1): 50-60.
21- Shi X, Zhou W, Ma D, Ma Q, Bridges D. Electrospinning of Nanofibers and their Applications for Drug Delivery and Tissue Engineering. J Nanomater 2015; 2015: 140716.
22- Pham QP, Sharma U, Mikos AG. Electrospinning of Polymeric Nanofibers for Tissue Engineering Applications: A Review. Tissue Engineering 2006; 12(5): 1197-211.
23- Khorshidi S, Solouk A, Mirzadeh H, Mazinani S, Lagaron J, Sharifi S, et al. A Review of Key Challenges of Electrospun Scaffolds for Tissue-Engineering Applications. J Tissue Engineering and Regenerative Medicine 2015; 10: 715-38. [Persian]
24- Zhang Z, Hu J, Ma PX. Nanofiber-Based Delivery of Bioactive Agents and Stem Cells to Bone Sites. Adv Drug Deliv Rev 2012; 64(12): 1129-41.
25- Rnjak-Kovacina J, Weiss AS. Increasing the Pore Size of Electrospun Scaffolds. Tissue Eng Part B Rev 2011; 17(5): 365-72.
26- Murugan R, Ramakrishna S. Design Strategies of Tissue Engineering Scaffolds with Controlled Fiber Orientation. Tissue Eng 2007; 13(8): 1845-66.
27- Mahmoudifard M, Soleimani M, Hatamie S, Zamanlui S, Ranjbarvan P, Vossoughi M, et al. The Different Fate of Satellite Cells on Conductive Composite Electrospun Nanofibers with Graphene and Graphene Oxide Nanosheets. Biomed Mater 2016; 11(2): 025006. [Persian]
28- Hosseinzadeh S, Soleimani M, Vossoughi M, Ranjbarvan P, Hamedi S, Zamanlui S, et al. Study of Epithelial Differentiation and Protein Expression of Keratinocyte-Mesenchyme Stem Cell Co-Cultivation on Electrospun Nylon/B. Vulgaris Extract Composite Scaffold. Mater Sci Eng C. 2017; 75: 653-62.
29- Behtouei E, Zandi M, Askari F, Daemi H, Zamanlui S, Arabsorkhi Mishabi A, et al. Bead-Free and Tough Electrospun PCL/Gelatin/PGS Ternary Nanofibrous Scaffolds for Tissue Engineering Application. J Appl Polym Sci 2021; 139(2): 51471. [Persian]
30- Jiang T, Carbone EJ, Lo KWH, Laurencin CT. Electrospinning of Polymer Nanofibers for Tissue Regeneration. In: Elsevier Ltd; 2015; 46: 1-24.
31- Zhong S, Zhang Y, Lim CT. Fabrication of large pores in electrospun nanofibrous scaffolds for cellular infiltration: A review. Tissue Eng Part B Rev 2012; 18(2): 77-87.
32- Nisbet DR, Forsythe JS, Shen W, Finkelstein DI, Horne MK. Review Paper: A Review of the Cellular Response on Electrospun Nanofibers for Tissue Engineering. J Biomater Appl 2008; 24(1): 7-29.
33- Nemati S, Kim SJ, Shin YM, Shin H. Current Progress in Application of Polymeric Nanofibers to Tissue Engineering. Nano Converg 2019; 6(1): 1-17.
34- Jin GZ. Comparison of Chondrocyte Behaviors between Silk Microfibers and Polycaprolactone Microfibers in Tissue Engineering and Regenerative Medicine Applications. Bioengineering 2024; 11(12): 1209.
35- Hardingham T. Cartilage Tissue Regeneration. Electrospinning Tissue Regen 2011; 1: 111-26.
36- Zhao Z, Fan C, Chen F, Sun Y, Xia Y, Ji A, et al. Progress in Articular Cartilage Tissue Engineering: A Review on Therapeutic Cells and Macromolecular Scaffolds. Macromol Biosci 2020; 20(2): e1900278.
37- Rasheed T, Bilal M, Zhao Y, Raza A, Shah SZH, Iqbal HMN. Physiochemical Characteristics and Bone/Cartilage Tissue Engineering Potentialities of Protein-Based Macromolecules—A Review. Int J Biol Macromol 2019; 121: 13-22.
38- Zha F, Chen W, Zhang L, Yu D. Electrospun Natural Polymer and Its Composite Nanofibrous Scaffolds for Nerve Tissue Engineering. J Biomater Sci Polym Ed 2020; 31(4): 519-48.
39- Hanumantharao SN, Rao S. Multi-Functional Electrospun Nanofibers. Fibers 2019; 7(7): 66.
40- Yilmaz EN, Zeugolis DI. Electrospun Polymers in Cartilage Engineering—State of Play. Front Bioeng Biotechnol 2020; 8: 1-17.
41- Ding J, Zhang J, Li J, Li D, Xiao C, Xiao H, et al. Electrospun Polymer Biomaterials. Progress in Polymer science 2019; 90: 1-34.
42- Zamanlui S, Amirabad LM, Soleimani M, Faghihi S. Influence of Hydrodynamic Pressure on Chondrogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells Cultured in Perfusion System. Biologicals 2018; 56: 1-8.
43- Sharifi F, Irani S, Azadegan G, Pezeshki-Modaress M, Zandi M, Saeed M. Co-Electrospun Gelatin-Chondroitin Sulfate/Polycaprolactone Nanofibrous Scaffolds for Cartilage Tissue Engineering. Bioact Carbohydrates Diet Fibre 2020; 22: 100215.
44- Meghdadi M, Pezeshki-Modaress M, Irani S, Atyabi SM, Zandi M. Chondroitin Sulfate Immobilized PCL Nanofibers Enhance Chondrogenic Differentiation of Mesenchymal Stem Cells. Int J Biol Macromol 2019; 136: 616-24.
45- Honarpardaz A, Irani S, Pezeshki-Modaress M, Zandi M, Sadeghi A. Enhanced Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells on Gelatin/Glycosaminoglycan Electrospun Nanofibers with Different Amounts of Glycosaminoglycan. J Biomed Mater Res A 2019; 107(1): 38-48.
46- Ashraf R, Sofi HS, Malik A, Beigh MA, Hamid R, Sheikh FA. Recent Trends in the Fabrication of Starch Nanofibers: Electrospinning and Non-electrospinning Routes and Their Applications in Biotechnology. Appl Biochem Biotechnol 2019; 187(1): 47-74.
47- Matthews JA, Boland ED, Wnek GE, Simpson DG, Bowlin GL. Compatible Polymers Electrospinning of Collagen. J Bioact Compat Polym 2003; 18(2): 125-34.
48- Yao R, He J, Meng G, Jiang B, Wu F. Electrospun PCL/Gelatin Composite Fibrous Scaffolds: Mechanical Properties and Cellular Responses. J Biomater Sci Polym Ed 2016; 5063: 824-38.
49- Ho STB, Cool SM, Hui JH, Hutmacher DW. The Influence of Fibrin-Based Hydrogels on The Chondrogenic Differentiation of Human Bone Marrow Stromal Cells. Biomaterials. 2010; 31(1): 38-47.
50- Li Z, Liu P, Yang T, Qi You, Jiale Li, Zilin Wang, et al. Composite Poly(L-Lactic-Acid)/Silk Fibroin Scaffold Prepared by Electrospinning Promotes Chondrogenesis for Cartilage Tissue Engineering. J Biomater Appl 2015; 30(10): 1552-65.
51- Surucu S, Turkoglu Sasmazel H. Development of Core-Shell Coaxially Electrospun Composite PCL/Chitosan Scaffolds. Int J Biol Macromol 2016; 92: 321-28.
52- Rapa M, Darie-Nita RN, Preda P, Coroiu V, Tatia R, Vasile C, et al. PLA/Collagen Hydrolysate/Silver Nanoparticles Bionanocomposites for Potential Antimicrobial Urinary Drains. Polym Technol Mater 2019; 58(18): 2041-55.
53- Thorvaldsson A, Stenhamre H, Gatenholm P, Walkenström P. Electrospinning of Highly Porous Scaffolds for Cartilage Regeneration. Biomacromolecules 2008; 9(3): 1044-49.
54- Shields KJ, Beckman MJ, Bowlin GL, Wayne JS. Mechanical Properties and Cellular Proliferation of Electrospun Collagen Type II. Tissue Eng 2004; 10(9-10): 1510-17.
55- In KS, et al. Chitosan Nano-/Microfibrous Double-Layered Membrane with Rolled-Up Three-Dimensional Structures for Chondrocyte Cultivation. J Biomed Mater Res A 2009; 90A (2): 595-602.
56- Subramanian A, Vu D, Larsen GF, Lin HY. Preparation and Evaluation of the Electrospun Chitosan/PEO Fibers for Potential Applications in Cartilage Tissue Engineering. J Biomater Sci Polym Ed 2005; 16(7): 861-73.
57- Skotak M, Noriega S, Larsen G, Subramanian A. Electrospun Cross-Linked Gelatin Fibers with Controlled Diameter: The Effect of Matrix Stiffness on Proliferative and Biosynthetic Activity of Chondrocytes Cultured in Vitro. J Biomed Mater Res A 2010; 95(3): 828-36.
58- Ponticiello MS, Schinagl RM, Kadiyala S, Barry FP. Gelatin-Based Resorbable Sponge as A Carrier Matrix for Human Mesenchymal Stem Cells in Cartilage Regeneration Therapy. J Biomed Mater Res 2000; 52(2): 246-55.
59- Xu H, Cai S, Xu L, Yang Y. Water-Stable Three-Dimensional Ultrafine Fibrous Scaffolds from Keratin for Cartilage Tissue Engineering. Langmuir 2014; 30(28): 8461-70.
60- Rebelo R, Fernandes M, Fangueiro R. Biopolymers in Medical Implants: A Brief Review. Procedia Eng 2017; 200: 236-43.
61- Tuan RS, Chen AF, Klatt BA. Cartilage regeneration. J Am Acad Orthop Surg 2013; 21(5): 303-11.
62- Kulkarni AA, Rao PS. Synthesis of Polymeric Nanomaterials for Biomedical Applications. Woodhead Publishing Limited; 2013: 27-63.
63- Baek J, Chen X, Sovani S, Jin S, Grogan SP, Lima DDD. Meniscus Tissue Engineering Using a Novel Combination of Electrospun Scaffolds and Human Meniscus Cells Embedded Within an Extracellular Matrix Hydrogel. J Orthop Res 2015; 33(4): 572-83.
64- Zhou H, Green TB, Joo YL. The Thermal Effects on Electrospinning of Polylactic Acid Melts. Polymer (Guildf) 2006; 47(21): 7497-505.
65- Silva MLA, Martins A, Pinto A, Costa P, Fario S, Gomes M, et al. Cartilage Tissue Engineering Using Electrospun PCL Nanofiber Meshes and MSCs. Biomacromolecules 2010; 11(12): 3228-36.
66- Guimaires A, Martins A, Pinho ED, Faria S, Reis RL, Neves NM. Solving cell infiltration limitations of electrospun nanofiber meshes for tissue engineering applications. Nanomedicine 2010; 5(4): 539-54.
67- Kuo Y, Hung S, Hsu S. The Effect of Elastic Biodegradable Polyurethane Electrospun Nanofibers on the Differentiation of Mesenchymal Stem Cells. Colloids Surfaces B Biointerfaces 2014; 122: 414-22.
68- Shin HJ, Lee CH, Cho IH, Kim YJ, Lee YJ, Kim IA. Electrospun PLGA Nanofiber Scaffolds for Articular Cartilage Reconstruction: Mechanical Stability, Degradation and Cellular Responses Under Mechanical Stimulation in Vitro. J Biomater Sci Polym Ed 2006; 17(1-2): 103-19
69- Zhang Y, Yang F, Liu K, Shen H, Zhu Y, Zhang W, et al. The Impact of PLGA Scaffold Orientation on in Vitro Cartilage Regeneration. Biomaterials 2012; 33(10): 2926-35.
70- Lee JB, Yang DH, Ph D. Highly Porous Electrospun Nanofibers Enhanced by Ultrasonication for Improved Cellular Infiltration. Tissue Eng Part A 2011; 17: 21-22.
71- Janjanin S, Li W, Morgan M, Shanti R, Tuan R. Mold-Shaped, Nanofiber Scaffold-Based Cartilage Engineering Using. J Surg Sci 2008; 149: 1; 47-56.
72- Toyokawa N, Fujioka H, Kokubu T, Nagura I, Inui A, Sakata R, et al. Electrospun Synthetic Polymer Scaffold for Cartilage Repair without Cultured Cells in an Animal Model. Arthroscopy 2010; 26(3): 375-83.
73- Garrigues NW, Little D, Sanchez-Adams J, Ruch DS, Guilak F. Electrospun Cartilage-Derived Matrix Scaffolds for Cartilage Tissue Engineering. J Biomed Mater Res A 2014; 59784: 28-30.
74- Daemi H, Mashayekhi M, Pezeshki-Modaress M. Facile Fabrication of Sulfated Alginate Electrospun Nanofibers. Carbohydr Polym 2018; 198: 481-5.
75- Yang W, Fu J, Wang D, Wang T, Wang H, Jin S, He N. Study on Chitosan/Polycaprolactone Blending Vascular Scaffolds by Electrospinning. J Biomed Nanotechnol 2010; 6(3): 254-9.
76- Zahedi P, Rezaeian I, Jafari SH. In Vitro and in Vivo Evaluations of Phenytoin Sodium-Loaded Electrospun PVA, PCL, and their Hybrid Nanofibrous Mats for Use as Active Wound Dressings. J Mater Sci 2013; 48(8): 3147-59.
77- Irani S, Honarpardaz A, Choubini N, Pezeshki-Modaress M, Zandi M. Chondro-Inductive Nanofibrous Scaffold-Based Gelatin/Polyvinyl Alcohol/Chondroitin Sulfate for Cartilage Tissue Engineering. Polym Adv Technol 2020; 31(6): 1395-402.
78- Holland TA, Mikos AG. Advances in Drug Delivery for Articular Cartilage. J Control Release 2003; 86(1): 1-14.
79- Sharma C, Gautam S, Dinda AK, Mishra NC. Cartilage Tissue Engineering: Current Scenario and Challenges. Adv Mater Lett 2011; 2(2): 90-99.
80- Guntur AR, Rosen CJ. IGF-1 Regulation of Key Signaling Pathways in Bone. Bonekey Rep 2013; 2: 437.
81- Boushell MK, Mosher C, Suri G, Doty S, Strauss E, Hunziker E, Lu H. Polymeric Mesh and Insulin-Like Growth Factor 1 Delivery Enhance Cell Homing and Graft-Cartilage Integration. Ann N Y Acad Sci 2019; 1442(1): 138-52.
82- Mariani E, Pulsatelli L, Facchini A. Signaling pathways in cartilage repair. Int J Mol Sci. 2014;15(5):8667-8698. doi: 10.3390/ijms15058667.
83- Vayas R, Reyes R, Rodriguez-Evora M, Del Rosario C, Delgado A, Evora C. Evaluation of the effectiveness of a bMSC and BMP-2 polymeric trilayer system in cartilage repair. Biomed Mater. 2017;12(4). doi: 10.1088/1748-605X/aa6f1c.
84- Cai G, Liu W, He Y, Huang J, Duan L, Xiong J, et al. Recent advances in kartogenin for cartilage regeneration. J Drug Target 2018; 27(1): 28-32.
85- Huang X, Zhong L, Hendriks J, Post JN, Karperien M. The Effects of the WNT-Signaling Modulators BIO and PKF118-310 on the Chondrogenic Differentiation of Human Mesenchymal Stem Cells. Int J Mol Sci 2018; 19(2): 561.
86- Ham O, Youn Lee CH, Kim R, Lee J, Oh S, Young Lee M, et al. Therapeutic Potential of Differentiated Mesenchymal Stem Cells for Treatment of Osteoarthritis. Int J Mol Sci 2015; 16(7): 14961-78.
87- Zhou Y, Tao H, Li Y, Deng M, He B, Xia S, et al. Berberine Promotes Proliferation of Sodium Nitroprusside-Stimulated Rat Chondrocytes and Osteoarthritic Rat Cartilage Via Wnt/Β-Catenin Pathway. Eur J Pharmacol 2016; 789: 109-18.
88- Lima AC, Ferreira H, Reis RL, Neves NM. Biodegradable Polymers: An Update on Drug Delivery in Bone and Cartilage Diseases. Expert Opin Drug Deliv 2019; 16(8): 795-813.
89- Huebner KD, Shrive NG, Frank CB. Dexamethasone Inhibits Inflammation and Cartilage Damage in a New Model of Post-Traumatic Osteoarthritis. J Orthop Res 2014; 32(4): 566-72.
90- Huang K, Bao J peng, Jennings GJ, Wu L doing. The Disease-Modifying Effect of Dehydroepiandrosterone in Different Stages of Experimentally Induced Osteoarthritis: A Histomorphometric Study. BMC Musculoskelet Disord 2015; 16(1): 178.
91- Gao H, Peng L, Li C, Ji Q, Li P. Salidroside Alleviates Cartilage Degeneration through NF-Κb Pathway in Osteoarthritis Rats. Drug Des Devel Ther 2020; 14: 1445-54.
92- Cheleschi S, Calamia V, Fernandez-Moreno M, Biava M, Giordani A, Fioravanti A, et al. In Vitro Comprehensive Analysis of VA692 a New Chemical Entity for the Treatment of Osteoarthritis. Int Immunopharmacol 2018; 64: 86-100.
93- Ham O, Song B, Lee S, Choi E, Cha M, Lee C, et al. The role of microRNA-23b in the differentiation of MSC into chondrocyte by targeting protein kinase A signaling. Biomaterials 2012; 33(18): 4500-07.
94- Park K, Park JS, Woo DG, Yang HN, Chung HM, Park KH. The Use of Chondrogenic Differentiation Drugs to Induce Stem Cell Differentiation Using Double Bead Microsphere Structure. Biomaterials 2008; 29(16): 2490-500.
95- Sohier J, Moroni L, van Blitterswijk C, de Groot K, Bezemer JM. Critical Factors in the Design of Growth Factor Releasing Scaffolds for Cartilage Tissue Engineering. Expert Opin Drug Deliv 2008; 5(5): 543-66.
96- Augustyniak E, Trzeciak T, Richter M, Kaczmarczyk J, Suchorska W. The Role of Growth Factors in Stem Cell-Directed Chondrogenesis: A Real Hope for Damaged Cartilage Regeneration. Int Orthop 2015; 39(5): 995-1003.
97- Goonoo N, Bhaw-Luximon A. Mimicking Growth Factors: Role of Small Molecule Scaffold Additives in Promoting Tissue Regeneration and Repair. RSC Adv 2019; 9(32): 18124-46.
98- Merceron C, Portron S, Vignes-Colombeix C, Rederstorff E, Masson M, Lesoeur J, et.al. Pharmacological Modulation of Human Mesenchymal Stem Cell Chondrogenesis by A Chemically Oversulfated Polysaccharide of Marine Origin: Potential Application to Cartilage Repair. Stem Cells 2012; 30(3): 471-80.
99- Li T, Liu B, Chen K, Lou Y, Jiang Y, Zhang D. Small Molecule Compounds Promote the Proliferation of Chondrocytes and Chondrogenic Differentiation of Stem Cells in Cartilage Tissue Engineering. Biomed Pharmacother 2020; 131: 110652.
100- Publication A. The Journal of Veterinary Medical Science. Cell; 2011.Wu J, Sun J, Liu J. Evaluation of PHBV/Calcium Silicate Composite Scaffolds for Cartilage Tissue Engineering. Appl Surf Sci 2014; 317: 278-83.
101- Sadeghi A, Pezeshki-Modaress M, Zandi M. Electrospun Polyvinyl Alcohol/Gelatin/Chondroitin Sulfate Nanofibrous Scaffold: Fabrication and in Vitro Evaluation. Int J Biol Macromol 2018; 114: 1248-56.
102- Akbarzadeh M, Pezeshki-Modaress M, Zandi M. Biphasic, Tough Composite Core/Shell PCL/PVA-GEL Nanofibers for Biomedical Application. J Appl Polym Sci 2019; 137: 21; 48713. [Persian]
103- Kai D, Prabhakaran MP, Stahl B, Eblenkamp M, Wintermantel E, Ramakrishna S. Mechanical Properties and in Vitro Behavior of Nanofiber-Hydrogel Composites for Tissue Engineering Applications. Nanotechnology 2012; 23(9).
104- Nava MM, Draghi L, Giordano C, Pietrabissa R. The Effect of Scaffold Pore Size in Cartilage Tissue Engineering. J Appl Biomater Funct Mater 2016;14(3): e223-9.
105- Zhou Y, Chyu J, Zumwalt M. Recent Progress of Fabrication of Cell Scaffold by Electrospinning Technique for Articular Cartilage Tissue Engineering. Int J Biomater 2018; 2018: 1953636.
106- Levorson EJ, Raman Sreerekha P, Chennazhi KP, Kasper FK, Nair SV, Mikos AG. Fabrication and Characterization of Multiscale Electrospun Scaffolds for Cartilage Regeneration. Biomed Mater 2013; 8(1): 014103.
107- Beigi-Boroujeni S, Rajabi S, Rafati Ashteiani G, Dolatfarahi M, Özcan M. A Simple, Green Chemistry Technology for Fabrication of Tissue-Engineered Scaffolds Based on Mussel-Inspired 3D Centrifugal Spun. Mater Sci Eng C Mater Biol Appl 2021; 121: 111849.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




