دوره 32، شماره 11 - ( بهمن 1403 )
جلد 32 شماره 11 صفحات 8413-8404 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nasirzadeh M, Khayatnouri M H, Taginasab S, Navidi far P, Bakhshi M, Tayefesattari H. Renal Protective Effect of Resveratrol against Vincristine-Induced Oxidative Stress in Female Mice. JSSU 2025; 32 (11) :8404-8413
URL: http://jssu.ssu.ac.ir/article-1-6241-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6241-fa.html
نصیرزاده محمدرضا، خیاط نوری میرهادی، تقینسب سعید، نویدیفر پویا، بخشی محمد، طایفه ستاری حیدر. اثر محافظت کلیوی رزوراترول در برابر استرس اکسیداتیو القا شده با وینکریستین در موش سوری ماده. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (11) :8404-8413
متن کامل [PDF 490 kb]
(330 دریافت)
| چکیده (HTML) (1009 مشاهده)
متن کامل: (387 مشاهده)
مقدمه
سرطان به عنوان یکی از علل اصلی مرگ و میر در جهان بهشمار میرود که حتی در کشورهای توسعه یافته هم بهطور گستردهای مشاهده میشود (1). شیمیدرمانی شیوه عمومی درمان سرطان است که وجود بعضی محدودیتها در تاثیر شیمیدرمانی باعث میشود نتیجه ناموفقی از شیمیدرمانی بهدست آید (2). وینکریستین یک ترکیب قلیایی طبیعی است که از برگهای گیاه Catharanthus roseus قابل استخراج است (3). شواهد نشان داده است که وینکریستین یک ترکیب بهشدت فعال وابسته به سیکل سلول است که توبولین را هدف قرار داده و موجب دپلیمریزاسیون میکروتوبول و آپوپتوز در سلولهای میتوزی میشود. تداخل بین وینکریستین ومیکروتوبولها باعث تغییر در ساختار وعملکرد دوک بهصورت وابسته به دوز میشود (4). مواجهه با غلظت کم و بهصورت کوتاهمدت موجب توقف میتوز برگشتپذیر، جلوگیری از جور شدن کروموزومها و باعث برخی ناهنجاریها در شکل و پلیمریزاسیون میکروتوبولهای دوک میشود (5). در مواجهه طولانیمدت با غلظت بالای وینکریستین تخریب و دپلیمریزاسیون طولانیمدت میکروتوبولها ودر نتیجه سمیت سلولی کشنده رخ میدهد (4). به همین دلیل وینکریستین بهعنوان یک ماده ضدسرطان مطرح است که بهطور گستردهای در اهداف درمانی بهویژه در بدخیمیهای کودکان و هماتولوژی بالغین مصرف میشود. وینکریستین سولفات شکل رایج بهکار رفته در مدیریت شیمیدرمانی انواع بدخیمی ها در بیماران است (6). علیرغم فعالیت قوی ضدتوموری، وینکریستین دارای اثرات سمیت سلولی بر سلولهای طبیعی نیز است. مطالعات بسیاری اثرات سمیت سلولی وینکریستین بر سلولهای مختلف از جمله سلولهای کبدی، پانکراس و لنفاوی را گزارش کردهاند (7). جهت افزایش اثرات درمانی وینکریستین ضروری است که دوز آن افزایش یابد، اما بهدلیل سمیت سلولی آن محدودیت وجود دارد. در واقع وینکریستین در مقادیر بالا در اغلب اندامها و بافتها به استثنای مغز، چشم و چربی تجمع مییابد. بدین ترتیب نکروز و زخم بافت نرم، سختی تنفسی، آسیب عصبی، آسیب کلیوی و کبدی در بیمارانی که در کوتاهمدت وینکریستین دریافت کردهاند، گزارش شده است (9،8). شاطی علی در سال 2019 طی مطالعهای نشان داده است که تجویز طولانیمدت وینکریستین سولفات در موش صحرایی موجب آسیب کلیوی از طریق القای استرس اکسیداتیو میشود. بخوبی ثابت شده است که تولید بیش از حد گونههای واکنشی اکسیژن مالوندیآلدئید را افزایش و آنزیمهای سیستم آنتیاکسیدان از جمله سوپراکسید دسموتاز، گلوتاتیون پراکسیداز و ظرفیت تام آنتیاکسیدانی را کاهش میدهد (9). وضعیت آنتیاکسیدانی سلول تعیین کننده حساسیت سلول به آسیب اکسیداتیو است که معمولاً در پاسخ به استرس اکسیداتیو تغییر میکند (10). بنابراین به مادهای نیاز است که بتواند نفروتوکسیسیتی ناشی از وینکریستین را کاهش دهد تا قدرت اثر شیمیدرمانی وینکریستن بهبود یابد. در سالهای اخیر تحقیقات نشان داده که بعضی مواد غذایی با منشا گیاهی میتوانند به عنوان داروی موثر علیه سرطان مورد استفاده قرار بگیرند. رزوراترول (3،5،´4- تری هیدروکسی _ ترانس _استیلبن) یک پلیفنول طبیعی است که در منابع گیاهی بسیاری از جمله انگور، تمشک، توت، آجیل و دیگر غذاهای مصرفی انسان وجود دارد. پلیفنولهای غذا با استفاده از مکانیسمهای مولکولی متعدد وبا اثر در مسیرهای سیگنالینگ آپوپتوز در سلولهای سرطانی، اثر شیمیایی پیشگیری کننده خود را اعمال میکنند (12،11). مطالعات بسیاری روی اثرات رزوراترول نشاندهنده اثرات ضد التهابی، آنتیاکسیدانی، ضد پیری، حمایت کننده عروق، ضد ویروس، ضد قارچ و ضد میکروبی آن میباشد (14-12). مشخص شده است که وینکریستسن سولفات موجب افزایش پراکسیداسیون لیپیدی در موش صحرایی میشود (9). مطالعه انجام شده توسط دوبرک و همکاران در سال 2017 نشان داد که تجویز تک دز داروی سیکلوسفامید و ایفوسفامید موجب تغییرات ساختاری در بافت کلیه نمیشود هرچند پرخونی خفیف تا متوسط و ضایعات التهابی ایجاد میکند (15). همچنین مشخص شده است که سوماتریپتان (آگونیست گیرنده سروتونینی که در مدیریت دردهای میگرنی کاربرد دارد) در برابر سمیت کلیوی ناشی از سیس پلاتین اثرات محافظت کلیوی دارد. سیس پلاتین ترکیب ضد سرطانی است که در اکثر سرطانها مورد استفاده قرار میگیرد (16). بیشتر داروهای شیمیدرمانی نفروتوکسیسیتی ایجاد میکنند از اینرو امروزه، تحقیقات در زمینه پیشگیری از سمیت کلیوی ناشی از شیمیدرمانی متمرکز شدهاند (17). با توجه به اینکه از یک سو هزاران زن جوان مبتلا به سرطان سالیانه تشخیص داده میشوند وتحت سمیت شیمیدرمانی و یا پرتو درمانی قرار میگیرند، و از سویی دیگر، حفظ تعادل بین تولید و حذف رادیکالهای آزاد در پستانداران یک فاکتور کلیدی ضروری برای هر گونه فعالیت متابولیکی است (19،18). لذا هدف این مطالعه بررسی اثرات محافظتی رزوراترول برفعالیت آنزیمهای آنتیاکسیدان بافت کلیه متعاقب استرس اکسیداتیو ایجاد شده توسط وینکریستین در موش سوری ماده است.
روش بررسی
این مطالعه تجربی - مداخله ای در سال 1401 در دانشکده دامپزشکی دانشگاه آزاد اسلامی واحد تبریز انجام گرفت. در این مطالعه تعداد 36 سر موش ماده کوچک سفید آزمایشگاهی بالغ با وزن 20 تا 25 گرم بهطور تصادفی به 4 گروه 9 تایی تقسیم شد. موشهای هر 4 گروه از مرکز پرورش حیوانات آزمایشگاهی دانشگاه علوم پزشکی تبریز تهیه و در مرکز پرورش حیوانات آزمایشگاهی دانشکده دامپزشکی دانشگاه آزاد تبریز بهصورت 5 حیوان در هر قفس و در شرایط یکسان با دسترسی آزاد به آب و غذا و در سطحی با دمای2±22 درجه سانتیگراد و چرخه نوری 12/12 روشنایی – تاریکی نگهداری شدند. حیوانات قبل از شروع آزمایش به مدت 2 هفته به محل عادت داده شدند.
گروههای آزمایش
1. گروه کنترل: گروه دریافت کننده سرم فیزیولوژی با مقدار ml0/5 به صورت گاواژ
2. گروه وینکریستین: دریافت کننده داروی وینکریستین به میزان mg/kg 3 یک بار درهفته به مدت 4هفته (20).
3. گروه رزوراترول: دریافت کننده رزوراترول به میزان 30 mg/kg (21).
4. گروه وینکریستین - رزواترول: دریافت کننده داروی وینکریستین به میزان mg/kg 3 هفته ای یک بار به مدت 4هفته و رزوراترول به میزان mg/kg30 به مدت 4 هفته (21،20) .
داروی وینکریستین سولفات (شرکت Sigma) در محلول BPS استریل (mg/kg0/5) حل و بهصورت داخل صفاقی به موشها تزریق گردید. رزوراترول تهیه شده (شرکت Nutrabio) بهصورت محلول آبی و با استفاده از گاواژ روزانه ساعت 10 صبح به موشها خورانده شد.
نمونهبرداری: در پایان دوره مطالعه حیوانات با استفاده از داروی کتامین mg/kg 40 و زایلازینmg/kg 10 بصورت داخل صفاقی تحت بیهوشی جراحی قرار گرفته و پس از قطع سر نمونه خون جمعآوری شد. برای جداسازی سرم نمونهها با سرعت 3000 دور در دقیقه بهمدت 10 دقیقه سانتریفوژ شده و تا اندازهگیری اوره وکراتینین در فریزر 80- نگهداری شد. پس از اخذ نمونه خون محوطه شکمی باز و کلیه راست حیوان برداشته و بلافصله با سرم نرمال سالین شسته شد. کلیه راست در نیتروژن مایع منجمد و تا زمان اندازهگیری آنزیمهای آنتیاکسیدان در 80- نگهداری شد.
آماده کردن نمونه بافتی: پس از شستشوی نمونه بافتی با استفاده از بافر فسفات (PBS,PH=7.4) 1گرم از بافت کلیه راست در 5 میلیلیتر بافر سرد (Tris-Hcl 50 mM ,PH=7.5, EDTA 5mM, DTT 1mM) هموژنیزه شد. سپس محلول حاصل با سرعت 10،000 دور بمدت 15 دقیقه سانتریفوژ گشته و مایع رویی حاصل برای ارزیابی فعالیت آنزیمهای آنتیاکسیدان و شاخص پراکسیداسیون چربی بافت کلیه مورد استفاده قرار گرفت (22). مقادیر سرمی کراتینین (پارس آزمون، ایران) به روش ژافه (دستگاه آلفا کلاسیک) و اوره سرم (زیست شیمی، ایران) به روش آنزیماتیک (دستگاه آلفا کلاسیک) اندازهگیری گردید. آنزیمهای آنتیاکسیدان SOD,GPX,TAC و شاخص پراکسیداسیون چربی MDA بافت کلیه با استفاده از کیتهای اختصاصی ساخت شرکتRandox انگلستان و مطابق دستور بروشور در مرکز تحقیقات کاربردی دارویی اندازهگیری شد.
تجزیه و تحلیل آماری
برای تحلیل دادههای حاصله از نرمافزارversion 16 SPSS استفاده شد. دادههای بهدستآمده کمی، بهصورت انحراف معیار± میانگین Mean±SD ارائه و اختلاف معنیدار بین گروهها توسط آزمون آماری تحلیل واریانس یکطرفه (ANOVA) و آزمون تعقیبی Tukey مورد بررسی قرار گرفت. سطح معنیدار در این مطالعه P<0/05 در در نظر گرفته شد.
نتایج
نتایج فاکتورهای سرمی: مقایسه میانگین غلظت سرمی اوره در گروه های مختلف مورد مطالعه مشخص نمود که بین گروه کنترل با گروه وینکریستین تفاوت معنیداری وجود دارد(0/001=P). در حالیکه بین گروه وینکریستین-رزوراترول و گروه رزوراترول اختلاف معنیداری وجود ندارد (0/745=P). همچنین مشخص شد تجویز 4 هفته رزوراترول موجب کاهش معنیدار غلظت سرمی اوره درگروه وینکریستین-رزوراترول نسبت به گروه وینکریستین شده است (0/001=P). مقایسه میانگین غلظت سرمی کراتینین در گروههای مختلف نشان داد که تجویز وینکریستین باعث افزایش معنیدار کراتینین در گروه وینکریستین نسبت به سایر گروههای مورد مطالعه شده است (0/002=P). در حالیکه بین گروه کنترل با گروههای وینکریستین-رزوراترول و رزوراترول اختلاف معنیداری وجود ندارد (0/101=P) (جدول1).
نتایج آنزیمهای آنتی اکسیدان بافت کلیه: بررسی میانگین داده های مربوط به شاخص پراکسیداسیون چربی (0/001=P) و فعالیت آنزیم آنتیاکسیدان سوپراکسید دسموتاز نشان داد که بین گروه وینکریستین با سایرگروهها تفاوت معنیداری وجود دارد (0/001=P). همچنین مشخص شد بین گروه کنترل با گروههای وینکریستین-رزوراترول و رزوراترول تفاوت معنیداری دیده نمیشود (1/00=P). بررسی دادههای مربوط به فعالیت آنزیم گلوتاتیون پراکسیدازو ظرفیت تام آنتیاکسیدانی مشخص نمود که بین گروه کنترل با گروه وینکریستین تفاوت معنی داری وجود دارد (0/001=P). همچنین مشخص شد بین گروه کنترل با گروه رزوراترول تفاوت معنیداری دیده نمیشود (1/00=P). در حالیکه تیمارگروه وینکریستین-رزوراترول با رزوراترول به مدت 4 هفته موجب افزایش معنیداری در فعالیت آنزیم گلوتاتیون پراکسیداز شده است (0/001=P).
جدول1: میانگین غلظت سرمی اوره و کراتینین موشهای صحرایی در گروه های مختلف موردمطالعه (Mean±SD).
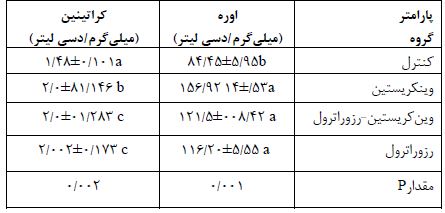
حروف نامشابه در هر ردیف نشانگر اختلاف معنیدار بین گروه ها هست. سطح معنیدارp< 0/05در نظر گرفتهشده است.
جدول2: میانگین میزان فعالیت آنزیمهای آنتیاکسیدان بافت کلیه موشهای صحرایی در گروه های مختلف موردمطالعه (Mean±SD).
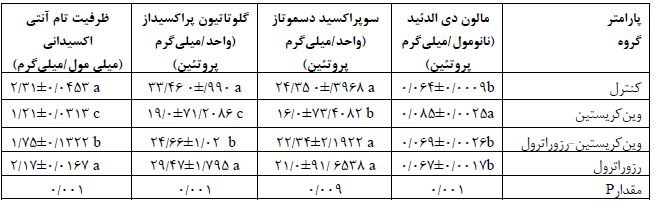
حروف نامشابه در هر ردیف نشانگر اختلاف معنیدار بین گروهها هست. سطح معنیدارp< 0/05در نظر گرفتهشده است.
بحث
در این مطالعه اثر محافظتی رزوراترول بر نفروتوکسیسیتی القا شده با وینکریستین در موش سوری بررسی گردید. نتایج نشان داد که تزریق داخل صفاقی وینکریستین موجب آسیب شدید کلیوی میشود، چنانچه موجب افزایش اوره وکراتینین سرم گردید. شاخصهای عملکرد کلیه شامل آنالیزسطوح سرمی اوره و کراتینین است.کراتینین فرآورده متابولیسمی کراتین عضلات است که آزادانه در کلیهها تصفیه می گردد. لذا افزایش سطوح سرمی کراتینین با سوء فعالیت کلیهها ارتباط دارد (9). افزایش سطوح سرمی اوره وکراتینین با افزایش تشکیل رادیکالهای آزاد اکسیژن در بافت کلیه همراه است. بهعبارتی دیگر، وینکریستین با ایجاد استرس اکسیداتیو ظرفیت آنتیاکسیدانی بافت کلیه و در نتیجه عملکرد آن را کاهش می دهد. نتایج حاصل از ارزیابی وضعیت استرس اکسیداتیو بافت کلیه نیز مشخص نمود که میزان فعالیت آنزیمهای آنتیاکسیدان پراکسید دسموتاز و گلوتاتیون پراکسیداز و نیز میزان ظرفیت تام آنتیاکسیدانی بافت کلیه در موشهای گروه وینکریستین بهطور معنیداری نسبت به گروه کنترل کاهش یافته است. در حالیکه وینکریستین باعث افزایش معنیدار سطح مالوندیآلدئید نسبت به گروه کنترل شده است. همچنین، پژوهش حاضر نشان داد که تیمار موشها با رزوراترول موجب بهبودی عملکرد کلیوی میشود. چنانچه همراه با افزایش فعالیت سیستم آنتیاکسیدانی بافت کلیه و ظرفیت تام آنتیاکسیدانی، سطح مالوندیآلدئید آن کاهش یافته است، این نتایج با دیگر مطالعات همخوانی دارد.این مطالعات نشان دادهاند که رزوراترول قادر است سطح سرمی کراتینین را تا حد کنترل کاهش و آسیب کلیوی ناشی از سیس پلاتین را تخفیف دهد (23،16). گونههای واکنشی اکسیژن نقش کلیدی در نفروتوکسیسیتی ناشی از دارو ایفا می کنند (9). چندین مطالعه نشان داده است که رزوراترول دارای اثرات آنتیاکسیدانی، ضد التهابی و تنظیم کننده سیستم ایمنی است (24،14،13،12). در مطالعه انجام شده توسط بازماندگان و همکاران در سال 2019 تجویز سیسپلاتین بهصورت داخل صفاقی باعث افزایش سطح مالوندیآلدئید در بافت کلیه موشها گردید (16). نتایج مطالعه حاضر با این پژوهش همخوانی دارد. چنانچه تزریق داخل صفاقی وینکریستین سطح سطح مالوندیآلدئید بافت کلیه را بهطور معنیداری نسبت به گروه کنترل افزایش داد. در حالیکه در موشهای دریافتکننده وینکریستین، تیمار رزوراترول سطح سطح مالوندیآلدئید بافت کلیه را بهطور معنیداری پائین آورد. مالوندیآلدئید یک شاخص معتبر برای آسیب سلولی است (10). پراکسیداسیون لیپیدی غشاهای بیولوژیکی منجر به ازبین رفتن سیالیت غشا، تغییر در پتانسیل غشاء، افزایش نفوذپذیری و تغییر در اعمال گیرنده میشود (25). پراکسید دسموتاز، گلوتاتیون پراکسیداز و کاتالاز، هم در سیستم دفاع آنتیاکسیدانی آنزیمی و هم غیرآنزیمی به منظور غیر سمی کردن رادیکالهای آزاد و ترمیم سلولی ضروری هستند. پراکسید دسموتاز تبدیل رادیکالهای سوپر اکسید به آب اکسیژنه را کاتالیز مینماید و سپس در داخل سلول گلوتاتیون پراکسیداز آن را غیر سمی مینماید (26). همچنین، در مطالعه حاضر نشان داده شد که تیمار موشها با رزوراترول باعث افزایش فعالیت پراکسید دسموتاز و گلوتاتیون پراکسیداز می گردد. اثر ضدسرطانی وینکریستین به اتصال آن به پروتئین بتا توبولین اسکلت سلولی و اختلال در پلیمریزاسیون میکروتوبولها مربوط است. همچنین شناخته شده است که وینکریستین موجب تولید رادیکالهای آزاد وآزادسازی فاکتورهای التهابی و تعدیل سطح کلسیم سلولی میشود (27). اگرچه رزوراترول میتواند از بافت کلیه در برابر آسیب ناشی از وینکریستین محافظت نماید. اما مکانیسمی که رزوراترول موجب بهبودی این اختلالات میگردد، بخوبی مشخص نشده است. شواهد اخیر نشانگر آن است که وینکریستین سولفات با تولید بیش از حد رادیکالهای آزاد واسترساکسیداتیو موجب کاهش ظرفیت آنتی اکسیدانی کلیه و آسیب بافتی میشود (28). مطالعاتی نشان داده اند که اثر سمیت کلیوی باعث تخلیه آنتی اکسیدان های آندوژن در کلیه میشود (29،21). بهنظر میرسد مهار استرس اکسیداتیو و گونههای واکنشی اکسیژن ایجاد شده توسط وینکریستین یکی از مکانیسمهایی باشد که رزوراترول موجب بهبودی آسیب کلیوی میگردد. امروزه، وقوع نفروتوکسیسیتی ناشی از دارو رو به افزایش است و بخوبی ثابت شده است که از عوارض جانبی بسیاری از داروهای ضد سرطان، نفروتوکسیسیتی است. مکانیسمهای سلولی نشان میدهند که وینکریستین با افزایش استرس اکسیداتیو والتهاب، مرگ سلولی ایجاد می کند که احتمالاً با فعال نمودن مسیر Raf-1/MEK1/2 ERK1/2 و القای آپوپتوز میباشد (30). لکوسیتها از طریق چندین مکانیسم باعث تشدید آسیب کلیوی میشوند، آنها بوسیله مدیاتورهای التهاب از جمله سیتوکینها، آیکوزانوئیدها وگونه های اکسیژن واکنشی فعال میشوند (23). علاوه بر این، در رت های درمان شده با دوکسوروبیسین، تیمار میوسیتهای بطن رت نوزاد با تک دز رزوراترول قابلیت آنها را افزایش میدهد و برادی کاردی القا شده با دوکسوروبیسین را کم میکند (31). این اثر محافظتی رزوراترول موافق با یافتههای پژوهش حاضر است که نشانگر اثر محافظتی رزوراترول در برابر نفروتوکسیستی ناشی از وینکرستین میباشد. مطالعه صورت گرفته توسط دوبرک و همکاران در سال 2017 نشان داده است که تزریق تک دز سیکلوسفامید و ایفوسفامید پس از 24 ساعت موجب افزایش معنی داری در سطح سرمی اوره وکراتینین گردید اما تغییرات ساختاری در بافت کلیه ایجاد نکرد (15). مطالعه دیگری نشان داده است که رزوراترول بهخوبی پارامترهای بیوشیمیایی وهیستوپاتولوژیکی مرتبط با عملکرد و ساختارکلیوی را در موشهای صحرایی مبتلا به نفروتوکسیسیتی بهبود داده است. دادههای مطالعه مذکور نشان میدهد که رزوراترول با بهبود سطح آنتی اکسیدانهای درون زاد و کاهش مارکرهای التهاب، نفروتوکسیسیتی ناشی ازآلومینیوم کلراید را در موش صحرایی تخفیف میدهد (26). ارزیابی تغییرات هیستو پاتولوژی و بررسی بیان ژنها در بروز آنزیمهای آنتی اکسیدان در بافت کلیه از محدودیتهای این مطالعه محسوب میشوند. لذا مطالعات بیشتری مورد نیاز است تا مکانیسمهای مولکولی دخیل در اثرات محافظت کلیوی رزوراترول را مشخص سازد.
نتیجه گیری
مطالعه ما نشان داد که رزوراترول در برابر نفروتوکسیسیتی القا شده با وینکریستین اثر محافظت کلیوی دارد. نتایج این تحقیق مشخص نمود که رزوراترول در برابر استرس اکسیداتیو ناشی از وینکریستین با کاهش شاخص پراکسیداسیون لیپیدی در بافت کلیه جلوگیری می نماید. مطابق با نتایج این مطالعه میتوان پیشنهاد داد که رزوراترول احتمالاً بدلیل داشتن ویژگیهای آنتی اکسیدانی می تواند از آسیب کلیوی ناشی از شیمی درمانی در بیماران سرطانی محافظت نماید.
سپاسگزاری
بدین وسیله نویسندگان مقاله از کلیه عزیزانی که در اجرای این پژوهش همکاری داشتند، تشکر و قدردانی می نمایند. هزینه این مقاله که مستخرج از طرح پژوهشی مصوب دانشگاه آزاد اسلامی واحد تبریز است توسط نویسندگان تامین ودر دانشکده دامپزشکی واحد تبریز اجرا شده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
در مطالعه حاضرکلیه موازین اخلاقی نحوه کار با حیوانات آزمایشگاهی طبق پروتکل رعایت شده و با کد IR.IAU.TABRIZ.REC.1398018 به تایید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد تبریز رسیده است.
مشارکت نویسندگان
آقای دکتر خیاط نوری در ارائه ایده، آقای دکتر محمدرضا نصیرزاده در طراحی مطالعه، آقایان سعید تقینسب، پویا نویدیفر، محمد بخشی در جمعآوری دادهها و آقای حیدر طایفه ستاری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
سرطان به عنوان یکی از علل اصلی مرگ و میر در جهان بهشمار میرود که حتی در کشورهای توسعه یافته هم بهطور گستردهای مشاهده میشود (1). شیمیدرمانی شیوه عمومی درمان سرطان است که وجود بعضی محدودیتها در تاثیر شیمیدرمانی باعث میشود نتیجه ناموفقی از شیمیدرمانی بهدست آید (2). وینکریستین یک ترکیب قلیایی طبیعی است که از برگهای گیاه Catharanthus roseus قابل استخراج است (3). شواهد نشان داده است که وینکریستین یک ترکیب بهشدت فعال وابسته به سیکل سلول است که توبولین را هدف قرار داده و موجب دپلیمریزاسیون میکروتوبول و آپوپتوز در سلولهای میتوزی میشود. تداخل بین وینکریستین ومیکروتوبولها باعث تغییر در ساختار وعملکرد دوک بهصورت وابسته به دوز میشود (4). مواجهه با غلظت کم و بهصورت کوتاهمدت موجب توقف میتوز برگشتپذیر، جلوگیری از جور شدن کروموزومها و باعث برخی ناهنجاریها در شکل و پلیمریزاسیون میکروتوبولهای دوک میشود (5). در مواجهه طولانیمدت با غلظت بالای وینکریستین تخریب و دپلیمریزاسیون طولانیمدت میکروتوبولها ودر نتیجه سمیت سلولی کشنده رخ میدهد (4). به همین دلیل وینکریستین بهعنوان یک ماده ضدسرطان مطرح است که بهطور گستردهای در اهداف درمانی بهویژه در بدخیمیهای کودکان و هماتولوژی بالغین مصرف میشود. وینکریستین سولفات شکل رایج بهکار رفته در مدیریت شیمیدرمانی انواع بدخیمی ها در بیماران است (6). علیرغم فعالیت قوی ضدتوموری، وینکریستین دارای اثرات سمیت سلولی بر سلولهای طبیعی نیز است. مطالعات بسیاری اثرات سمیت سلولی وینکریستین بر سلولهای مختلف از جمله سلولهای کبدی، پانکراس و لنفاوی را گزارش کردهاند (7). جهت افزایش اثرات درمانی وینکریستین ضروری است که دوز آن افزایش یابد، اما بهدلیل سمیت سلولی آن محدودیت وجود دارد. در واقع وینکریستین در مقادیر بالا در اغلب اندامها و بافتها به استثنای مغز، چشم و چربی تجمع مییابد. بدین ترتیب نکروز و زخم بافت نرم، سختی تنفسی، آسیب عصبی، آسیب کلیوی و کبدی در بیمارانی که در کوتاهمدت وینکریستین دریافت کردهاند، گزارش شده است (9،8). شاطی علی در سال 2019 طی مطالعهای نشان داده است که تجویز طولانیمدت وینکریستین سولفات در موش صحرایی موجب آسیب کلیوی از طریق القای استرس اکسیداتیو میشود. بخوبی ثابت شده است که تولید بیش از حد گونههای واکنشی اکسیژن مالوندیآلدئید را افزایش و آنزیمهای سیستم آنتیاکسیدان از جمله سوپراکسید دسموتاز، گلوتاتیون پراکسیداز و ظرفیت تام آنتیاکسیدانی را کاهش میدهد (9). وضعیت آنتیاکسیدانی سلول تعیین کننده حساسیت سلول به آسیب اکسیداتیو است که معمولاً در پاسخ به استرس اکسیداتیو تغییر میکند (10). بنابراین به مادهای نیاز است که بتواند نفروتوکسیسیتی ناشی از وینکریستین را کاهش دهد تا قدرت اثر شیمیدرمانی وینکریستن بهبود یابد. در سالهای اخیر تحقیقات نشان داده که بعضی مواد غذایی با منشا گیاهی میتوانند به عنوان داروی موثر علیه سرطان مورد استفاده قرار بگیرند. رزوراترول (3،5،´4- تری هیدروکسی _ ترانس _استیلبن) یک پلیفنول طبیعی است که در منابع گیاهی بسیاری از جمله انگور، تمشک، توت، آجیل و دیگر غذاهای مصرفی انسان وجود دارد. پلیفنولهای غذا با استفاده از مکانیسمهای مولکولی متعدد وبا اثر در مسیرهای سیگنالینگ آپوپتوز در سلولهای سرطانی، اثر شیمیایی پیشگیری کننده خود را اعمال میکنند (12،11). مطالعات بسیاری روی اثرات رزوراترول نشاندهنده اثرات ضد التهابی، آنتیاکسیدانی، ضد پیری، حمایت کننده عروق، ضد ویروس، ضد قارچ و ضد میکروبی آن میباشد (14-12). مشخص شده است که وینکریستسن سولفات موجب افزایش پراکسیداسیون لیپیدی در موش صحرایی میشود (9). مطالعه انجام شده توسط دوبرک و همکاران در سال 2017 نشان داد که تجویز تک دز داروی سیکلوسفامید و ایفوسفامید موجب تغییرات ساختاری در بافت کلیه نمیشود هرچند پرخونی خفیف تا متوسط و ضایعات التهابی ایجاد میکند (15). همچنین مشخص شده است که سوماتریپتان (آگونیست گیرنده سروتونینی که در مدیریت دردهای میگرنی کاربرد دارد) در برابر سمیت کلیوی ناشی از سیس پلاتین اثرات محافظت کلیوی دارد. سیس پلاتین ترکیب ضد سرطانی است که در اکثر سرطانها مورد استفاده قرار میگیرد (16). بیشتر داروهای شیمیدرمانی نفروتوکسیسیتی ایجاد میکنند از اینرو امروزه، تحقیقات در زمینه پیشگیری از سمیت کلیوی ناشی از شیمیدرمانی متمرکز شدهاند (17). با توجه به اینکه از یک سو هزاران زن جوان مبتلا به سرطان سالیانه تشخیص داده میشوند وتحت سمیت شیمیدرمانی و یا پرتو درمانی قرار میگیرند، و از سویی دیگر، حفظ تعادل بین تولید و حذف رادیکالهای آزاد در پستانداران یک فاکتور کلیدی ضروری برای هر گونه فعالیت متابولیکی است (19،18). لذا هدف این مطالعه بررسی اثرات محافظتی رزوراترول برفعالیت آنزیمهای آنتیاکسیدان بافت کلیه متعاقب استرس اکسیداتیو ایجاد شده توسط وینکریستین در موش سوری ماده است.
روش بررسی
این مطالعه تجربی - مداخله ای در سال 1401 در دانشکده دامپزشکی دانشگاه آزاد اسلامی واحد تبریز انجام گرفت. در این مطالعه تعداد 36 سر موش ماده کوچک سفید آزمایشگاهی بالغ با وزن 20 تا 25 گرم بهطور تصادفی به 4 گروه 9 تایی تقسیم شد. موشهای هر 4 گروه از مرکز پرورش حیوانات آزمایشگاهی دانشگاه علوم پزشکی تبریز تهیه و در مرکز پرورش حیوانات آزمایشگاهی دانشکده دامپزشکی دانشگاه آزاد تبریز بهصورت 5 حیوان در هر قفس و در شرایط یکسان با دسترسی آزاد به آب و غذا و در سطحی با دمای2±22 درجه سانتیگراد و چرخه نوری 12/12 روشنایی – تاریکی نگهداری شدند. حیوانات قبل از شروع آزمایش به مدت 2 هفته به محل عادت داده شدند.
گروههای آزمایش
1. گروه کنترل: گروه دریافت کننده سرم فیزیولوژی با مقدار ml0/5 به صورت گاواژ
2. گروه وینکریستین: دریافت کننده داروی وینکریستین به میزان mg/kg 3 یک بار درهفته به مدت 4هفته (20).
3. گروه رزوراترول: دریافت کننده رزوراترول به میزان 30 mg/kg (21).
4. گروه وینکریستین - رزواترول: دریافت کننده داروی وینکریستین به میزان mg/kg 3 هفته ای یک بار به مدت 4هفته و رزوراترول به میزان mg/kg30 به مدت 4 هفته (21،20) .
داروی وینکریستین سولفات (شرکت Sigma) در محلول BPS استریل (mg/kg0/5) حل و بهصورت داخل صفاقی به موشها تزریق گردید. رزوراترول تهیه شده (شرکت Nutrabio) بهصورت محلول آبی و با استفاده از گاواژ روزانه ساعت 10 صبح به موشها خورانده شد.
نمونهبرداری: در پایان دوره مطالعه حیوانات با استفاده از داروی کتامین mg/kg 40 و زایلازینmg/kg 10 بصورت داخل صفاقی تحت بیهوشی جراحی قرار گرفته و پس از قطع سر نمونه خون جمعآوری شد. برای جداسازی سرم نمونهها با سرعت 3000 دور در دقیقه بهمدت 10 دقیقه سانتریفوژ شده و تا اندازهگیری اوره وکراتینین در فریزر 80- نگهداری شد. پس از اخذ نمونه خون محوطه شکمی باز و کلیه راست حیوان برداشته و بلافصله با سرم نرمال سالین شسته شد. کلیه راست در نیتروژن مایع منجمد و تا زمان اندازهگیری آنزیمهای آنتیاکسیدان در 80- نگهداری شد.
آماده کردن نمونه بافتی: پس از شستشوی نمونه بافتی با استفاده از بافر فسفات (PBS,PH=7.4) 1گرم از بافت کلیه راست در 5 میلیلیتر بافر سرد (Tris-Hcl 50 mM ,PH=7.5, EDTA 5mM, DTT 1mM) هموژنیزه شد. سپس محلول حاصل با سرعت 10،000 دور بمدت 15 دقیقه سانتریفوژ گشته و مایع رویی حاصل برای ارزیابی فعالیت آنزیمهای آنتیاکسیدان و شاخص پراکسیداسیون چربی بافت کلیه مورد استفاده قرار گرفت (22). مقادیر سرمی کراتینین (پارس آزمون، ایران) به روش ژافه (دستگاه آلفا کلاسیک) و اوره سرم (زیست شیمی، ایران) به روش آنزیماتیک (دستگاه آلفا کلاسیک) اندازهگیری گردید. آنزیمهای آنتیاکسیدان SOD,GPX,TAC و شاخص پراکسیداسیون چربی MDA بافت کلیه با استفاده از کیتهای اختصاصی ساخت شرکتRandox انگلستان و مطابق دستور بروشور در مرکز تحقیقات کاربردی دارویی اندازهگیری شد.
تجزیه و تحلیل آماری
برای تحلیل دادههای حاصله از نرمافزارversion 16 SPSS استفاده شد. دادههای بهدستآمده کمی، بهصورت انحراف معیار± میانگین Mean±SD ارائه و اختلاف معنیدار بین گروهها توسط آزمون آماری تحلیل واریانس یکطرفه (ANOVA) و آزمون تعقیبی Tukey مورد بررسی قرار گرفت. سطح معنیدار در این مطالعه P<0/05 در در نظر گرفته شد.
نتایج
نتایج فاکتورهای سرمی: مقایسه میانگین غلظت سرمی اوره در گروه های مختلف مورد مطالعه مشخص نمود که بین گروه کنترل با گروه وینکریستین تفاوت معنیداری وجود دارد(0/001=P). در حالیکه بین گروه وینکریستین-رزوراترول و گروه رزوراترول اختلاف معنیداری وجود ندارد (0/745=P). همچنین مشخص شد تجویز 4 هفته رزوراترول موجب کاهش معنیدار غلظت سرمی اوره درگروه وینکریستین-رزوراترول نسبت به گروه وینکریستین شده است (0/001=P). مقایسه میانگین غلظت سرمی کراتینین در گروههای مختلف نشان داد که تجویز وینکریستین باعث افزایش معنیدار کراتینین در گروه وینکریستین نسبت به سایر گروههای مورد مطالعه شده است (0/002=P). در حالیکه بین گروه کنترل با گروههای وینکریستین-رزوراترول و رزوراترول اختلاف معنیداری وجود ندارد (0/101=P) (جدول1).
نتایج آنزیمهای آنتی اکسیدان بافت کلیه: بررسی میانگین داده های مربوط به شاخص پراکسیداسیون چربی (0/001=P) و فعالیت آنزیم آنتیاکسیدان سوپراکسید دسموتاز نشان داد که بین گروه وینکریستین با سایرگروهها تفاوت معنیداری وجود دارد (0/001=P). همچنین مشخص شد بین گروه کنترل با گروههای وینکریستین-رزوراترول و رزوراترول تفاوت معنیداری دیده نمیشود (1/00=P). بررسی دادههای مربوط به فعالیت آنزیم گلوتاتیون پراکسیدازو ظرفیت تام آنتیاکسیدانی مشخص نمود که بین گروه کنترل با گروه وینکریستین تفاوت معنی داری وجود دارد (0/001=P). همچنین مشخص شد بین گروه کنترل با گروه رزوراترول تفاوت معنیداری دیده نمیشود (1/00=P). در حالیکه تیمارگروه وینکریستین-رزوراترول با رزوراترول به مدت 4 هفته موجب افزایش معنیداری در فعالیت آنزیم گلوتاتیون پراکسیداز شده است (0/001=P).
جدول1: میانگین غلظت سرمی اوره و کراتینین موشهای صحرایی در گروه های مختلف موردمطالعه (Mean±SD).

حروف نامشابه در هر ردیف نشانگر اختلاف معنیدار بین گروه ها هست. سطح معنیدارp< 0/05در نظر گرفتهشده است.
جدول2: میانگین میزان فعالیت آنزیمهای آنتیاکسیدان بافت کلیه موشهای صحرایی در گروه های مختلف موردمطالعه (Mean±SD).

حروف نامشابه در هر ردیف نشانگر اختلاف معنیدار بین گروهها هست. سطح معنیدارp< 0/05در نظر گرفتهشده است.
بحث
در این مطالعه اثر محافظتی رزوراترول بر نفروتوکسیسیتی القا شده با وینکریستین در موش سوری بررسی گردید. نتایج نشان داد که تزریق داخل صفاقی وینکریستین موجب آسیب شدید کلیوی میشود، چنانچه موجب افزایش اوره وکراتینین سرم گردید. شاخصهای عملکرد کلیه شامل آنالیزسطوح سرمی اوره و کراتینین است.کراتینین فرآورده متابولیسمی کراتین عضلات است که آزادانه در کلیهها تصفیه می گردد. لذا افزایش سطوح سرمی کراتینین با سوء فعالیت کلیهها ارتباط دارد (9). افزایش سطوح سرمی اوره وکراتینین با افزایش تشکیل رادیکالهای آزاد اکسیژن در بافت کلیه همراه است. بهعبارتی دیگر، وینکریستین با ایجاد استرس اکسیداتیو ظرفیت آنتیاکسیدانی بافت کلیه و در نتیجه عملکرد آن را کاهش می دهد. نتایج حاصل از ارزیابی وضعیت استرس اکسیداتیو بافت کلیه نیز مشخص نمود که میزان فعالیت آنزیمهای آنتیاکسیدان پراکسید دسموتاز و گلوتاتیون پراکسیداز و نیز میزان ظرفیت تام آنتیاکسیدانی بافت کلیه در موشهای گروه وینکریستین بهطور معنیداری نسبت به گروه کنترل کاهش یافته است. در حالیکه وینکریستین باعث افزایش معنیدار سطح مالوندیآلدئید نسبت به گروه کنترل شده است. همچنین، پژوهش حاضر نشان داد که تیمار موشها با رزوراترول موجب بهبودی عملکرد کلیوی میشود. چنانچه همراه با افزایش فعالیت سیستم آنتیاکسیدانی بافت کلیه و ظرفیت تام آنتیاکسیدانی، سطح مالوندیآلدئید آن کاهش یافته است، این نتایج با دیگر مطالعات همخوانی دارد.این مطالعات نشان دادهاند که رزوراترول قادر است سطح سرمی کراتینین را تا حد کنترل کاهش و آسیب کلیوی ناشی از سیس پلاتین را تخفیف دهد (23،16). گونههای واکنشی اکسیژن نقش کلیدی در نفروتوکسیسیتی ناشی از دارو ایفا می کنند (9). چندین مطالعه نشان داده است که رزوراترول دارای اثرات آنتیاکسیدانی، ضد التهابی و تنظیم کننده سیستم ایمنی است (24،14،13،12). در مطالعه انجام شده توسط بازماندگان و همکاران در سال 2019 تجویز سیسپلاتین بهصورت داخل صفاقی باعث افزایش سطح مالوندیآلدئید در بافت کلیه موشها گردید (16). نتایج مطالعه حاضر با این پژوهش همخوانی دارد. چنانچه تزریق داخل صفاقی وینکریستین سطح سطح مالوندیآلدئید بافت کلیه را بهطور معنیداری نسبت به گروه کنترل افزایش داد. در حالیکه در موشهای دریافتکننده وینکریستین، تیمار رزوراترول سطح سطح مالوندیآلدئید بافت کلیه را بهطور معنیداری پائین آورد. مالوندیآلدئید یک شاخص معتبر برای آسیب سلولی است (10). پراکسیداسیون لیپیدی غشاهای بیولوژیکی منجر به ازبین رفتن سیالیت غشا، تغییر در پتانسیل غشاء، افزایش نفوذپذیری و تغییر در اعمال گیرنده میشود (25). پراکسید دسموتاز، گلوتاتیون پراکسیداز و کاتالاز، هم در سیستم دفاع آنتیاکسیدانی آنزیمی و هم غیرآنزیمی به منظور غیر سمی کردن رادیکالهای آزاد و ترمیم سلولی ضروری هستند. پراکسید دسموتاز تبدیل رادیکالهای سوپر اکسید به آب اکسیژنه را کاتالیز مینماید و سپس در داخل سلول گلوتاتیون پراکسیداز آن را غیر سمی مینماید (26). همچنین، در مطالعه حاضر نشان داده شد که تیمار موشها با رزوراترول باعث افزایش فعالیت پراکسید دسموتاز و گلوتاتیون پراکسیداز می گردد. اثر ضدسرطانی وینکریستین به اتصال آن به پروتئین بتا توبولین اسکلت سلولی و اختلال در پلیمریزاسیون میکروتوبولها مربوط است. همچنین شناخته شده است که وینکریستین موجب تولید رادیکالهای آزاد وآزادسازی فاکتورهای التهابی و تعدیل سطح کلسیم سلولی میشود (27). اگرچه رزوراترول میتواند از بافت کلیه در برابر آسیب ناشی از وینکریستین محافظت نماید. اما مکانیسمی که رزوراترول موجب بهبودی این اختلالات میگردد، بخوبی مشخص نشده است. شواهد اخیر نشانگر آن است که وینکریستین سولفات با تولید بیش از حد رادیکالهای آزاد واسترساکسیداتیو موجب کاهش ظرفیت آنتی اکسیدانی کلیه و آسیب بافتی میشود (28). مطالعاتی نشان داده اند که اثر سمیت کلیوی باعث تخلیه آنتی اکسیدان های آندوژن در کلیه میشود (29،21). بهنظر میرسد مهار استرس اکسیداتیو و گونههای واکنشی اکسیژن ایجاد شده توسط وینکریستین یکی از مکانیسمهایی باشد که رزوراترول موجب بهبودی آسیب کلیوی میگردد. امروزه، وقوع نفروتوکسیسیتی ناشی از دارو رو به افزایش است و بخوبی ثابت شده است که از عوارض جانبی بسیاری از داروهای ضد سرطان، نفروتوکسیسیتی است. مکانیسمهای سلولی نشان میدهند که وینکریستین با افزایش استرس اکسیداتیو والتهاب، مرگ سلولی ایجاد می کند که احتمالاً با فعال نمودن مسیر Raf-1/MEK1/2 ERK1/2 و القای آپوپتوز میباشد (30). لکوسیتها از طریق چندین مکانیسم باعث تشدید آسیب کلیوی میشوند، آنها بوسیله مدیاتورهای التهاب از جمله سیتوکینها، آیکوزانوئیدها وگونه های اکسیژن واکنشی فعال میشوند (23). علاوه بر این، در رت های درمان شده با دوکسوروبیسین، تیمار میوسیتهای بطن رت نوزاد با تک دز رزوراترول قابلیت آنها را افزایش میدهد و برادی کاردی القا شده با دوکسوروبیسین را کم میکند (31). این اثر محافظتی رزوراترول موافق با یافتههای پژوهش حاضر است که نشانگر اثر محافظتی رزوراترول در برابر نفروتوکسیستی ناشی از وینکرستین میباشد. مطالعه صورت گرفته توسط دوبرک و همکاران در سال 2017 نشان داده است که تزریق تک دز سیکلوسفامید و ایفوسفامید پس از 24 ساعت موجب افزایش معنی داری در سطح سرمی اوره وکراتینین گردید اما تغییرات ساختاری در بافت کلیه ایجاد نکرد (15). مطالعه دیگری نشان داده است که رزوراترول بهخوبی پارامترهای بیوشیمیایی وهیستوپاتولوژیکی مرتبط با عملکرد و ساختارکلیوی را در موشهای صحرایی مبتلا به نفروتوکسیسیتی بهبود داده است. دادههای مطالعه مذکور نشان میدهد که رزوراترول با بهبود سطح آنتی اکسیدانهای درون زاد و کاهش مارکرهای التهاب، نفروتوکسیسیتی ناشی ازآلومینیوم کلراید را در موش صحرایی تخفیف میدهد (26). ارزیابی تغییرات هیستو پاتولوژی و بررسی بیان ژنها در بروز آنزیمهای آنتی اکسیدان در بافت کلیه از محدودیتهای این مطالعه محسوب میشوند. لذا مطالعات بیشتری مورد نیاز است تا مکانیسمهای مولکولی دخیل در اثرات محافظت کلیوی رزوراترول را مشخص سازد.
نتیجه گیری
مطالعه ما نشان داد که رزوراترول در برابر نفروتوکسیسیتی القا شده با وینکریستین اثر محافظت کلیوی دارد. نتایج این تحقیق مشخص نمود که رزوراترول در برابر استرس اکسیداتیو ناشی از وینکریستین با کاهش شاخص پراکسیداسیون لیپیدی در بافت کلیه جلوگیری می نماید. مطابق با نتایج این مطالعه میتوان پیشنهاد داد که رزوراترول احتمالاً بدلیل داشتن ویژگیهای آنتی اکسیدانی می تواند از آسیب کلیوی ناشی از شیمی درمانی در بیماران سرطانی محافظت نماید.
سپاسگزاری
بدین وسیله نویسندگان مقاله از کلیه عزیزانی که در اجرای این پژوهش همکاری داشتند، تشکر و قدردانی می نمایند. هزینه این مقاله که مستخرج از طرح پژوهشی مصوب دانشگاه آزاد اسلامی واحد تبریز است توسط نویسندگان تامین ودر دانشکده دامپزشکی واحد تبریز اجرا شده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
در مطالعه حاضرکلیه موازین اخلاقی نحوه کار با حیوانات آزمایشگاهی طبق پروتکل رعایت شده و با کد IR.IAU.TABRIZ.REC.1398018 به تایید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد تبریز رسیده است.
مشارکت نویسندگان
آقای دکتر خیاط نوری در ارائه ایده، آقای دکتر محمدرضا نصیرزاده در طراحی مطالعه، آقایان سعید تقینسب، پویا نویدیفر، محمد بخشی در جمعآوری دادهها و آقای حیدر طایفه ستاری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, et al. Annual Report to the Nation on the Status of Cancer, 1975-2000, Featuring the Uses of Surveillance Data for Cancer Prevention and Control. J Natl Cancer Inst 2003; 95(17): 1276-99.
2- Smith RA, Manassaram-Baptiste D, Brooks D, Doroshenk M, Fedewa S, Saslow D, et al. Cancer Screening in the United States, 2015: A Review of Current American Cancer Society Guidelines and Current Issues in Cancer Screening. CA Cancer J Clin 2015; 65(1): 30-54.
3- Kumar A, Patil D, Rajamohanan PR, Ahmad A. Isolation, Purification and Characterization of Vinblastine and Vincristine from Endophytic Fungus Fusarium Oxysporum Isolated from Catharanthus Roseus. PLos One 2013; 8(9): e71805.
4- Beigi harchegani A, Khor A, Mirnamniha, M, Bakhtiari kaboutaraki H, Shirvani H and Shahriyari A. The Hepatoprotective and Antioxidative Effect of Saffron Stigma Alcoholic Extract Against Vincristine Sulfate Induced Toxicity in Rats. Interdiscip Toxicol 2019; 12(4): 186-91.
5- Silverman JA, Deitcher SR. Marqibo (R) (Vincristine Sulfate Liposome Injection) Improves the Pharmacokinetics and Pharmacodynamics of Vincristine. Cancer Chemother Pharmacol 2013; 71(3): 555-64.
6- Thakur V, Kush P, Pandey RS, Jain UK, Chandra R, Madan J. Vincristine Sulfate Loaded Dextran Microspheres Amalgamated with Thermo Sensitive Gel Offered Sustained Release and Enhanced Cytotoxicity in THP-1, Human Leukemia Cells: In Vitro and in Vivo Study. Mater Sci Eng C Mater Biol 2016; 61: 113-22.
7- Ogunc Y, Demirel M, Yakar A, Incesu Z. Vincristine and Varepsilon-Viniferine-Loaded PLGA-B-PEG Nanoparticles: Pharmaceutical Characteristics, Cellular Uptake and Cytotoxicity. J Microencapsul 2017; 34: 38-46.
8- Carter LG, D'Orazio JA, Pearson KJ. Resveratrol and Cancer: Focus on in Vivo Evidence. Endocr Relat Cancer 2014; 21(3): R209-25.
9- Shati AA. Sub-Chronic Administration of Vincristine Sulfate Induces Renal Damage and Apoptosis in Rats via Induction of Oxidative Stress and Activation of Raf1-MEK1/2-Erk1/2 Signal Transduction. Int J Morphol 2019; 37: 273-83.
10- Kashefimehr SH, Nasirzadeh MR. Oleuropein Cardioprotection Effect Against Oxidative Stress in Streptozotocin-Induced Diabetic Male Rats. JSSU Med Sci 2019; 27(3): 1372-80. [Persian]
11- Karabag-Coban F, Hazman O, Bozkurt MF, Ince S. Antioxidant Status and Anti-inflammatory Effects of Oleuropein in Streptozotocin-induced Diabetic Nephropathy in Rats. European J Med Plants 2017; 18(2): 1-10.
12- Vestergaard M, Ingmer H. Antibacterial and Antifungal Properties of Resveratrol. Int J Antimicrob Agents 2019; 53(6): 716-23.
13- Xiao Q, Zhu W, Feng W, Lee SS, Leung AW, Shen J, et al. A Review of Resveratrol as a Potent Chemoprotective and Synergistic Agent in Cancer Chemotherapy. Front Pharmacol 2018; 9: 1534.
14- Zhu W, Qin W, Zhang K, Rottinghaus GE, Chen YC, Kliethermes B, et al. Trans-Resveratrol Alters Mammary Promoter Hypermethylation in Women at Increased Risk for Breast Cancer. Nutr Cancer 2012; 64(3): 393-400.
15- Dobrek L, Baranowska A, Skowron B, Thor P. Biochemical and Histological Evaluation of Kidney Function in Rats after a Single Administration of Cyclophosphamide and Ifosfamide. J Nephrol Kidney Dis 2017; 1(1): 1002.
16- Bazmandegan G, Amirteimoury M, Kaeidi A, Shamsizadeh A, Khademalhosseini M, Nematollahi MH, et al. Sumatriptan Ameliorates Renal Injury Induced by Cisplatin in Mice. Iran J Basic Med Sci 2019; 22(5): 563-7.
17- Chiruvella V, Annamaraju P, Guddati AK. Management of Nephrotoxicity of Chemotherapy and Targeted Agents: 2020. Am J Cancer Res 2020; 10(12): 4151-64.
18- Meng W, Lingwei M, Liru X, Wenlei Y, Zhiyong L, Xiang L, et al. Resveratrol Alleviates Chemotherapy-Induced Oogonial Stem Cell Apoptosis and Ovarian Aging in Mice. Aging 2019; 11(3): 1030-44.
19- Shan W, Guolin H, Meng C, Tao Z, Wenming X, Xinghui L. The Role of Antioxidant Enzymes in the Ovaries. Oxid Med Cell Longev 2017; 1-14.
20- Geisler S, Doan RA, Strickland A, Huang X, Milbrandt J, DiAntonio A. Prevention of Vincristine-Induced Peripheral Neuropathy by Genetic Deletion of SARM1 in Mice. Brain 2016; 139(Pt 12): 3092-108.
21- Fan G, Tang JJ, Bhadauria M, Nirala SK, Dai F, Zhou B, et al. Resveratrol Ameliorates Carbon Tetrachloride-Induced Acute Liver Injury in Mice. Environ Toxicol Pharmacol 2009; 28(3):350-6.
22- Naderi R, Mohaddes G, Mohammadi M,Ghazn aviR, Ghyasi R, Vatankhah AM. Voluntary Exercise Protects Heart from Oxidative Stress in Diabetic Rats. Adv Pharm Bull 2015; 5(2): 231-6.
23- Valentovic MA, Ball JG, Brown MJ, Terneus MV, McQuade E, Van Meter E. Resveratrol Attenuates Cisplatin Renal Cortical Cytotoxicity by Modifying Oxidative Stress. Toxicol Vitro 2014; 28(2): 2014; 248-57.
24- Sugan Xia, Chaoyue Yan, Jianhong Gu, Yan Yuan, Hui Zou, Zongping Liu et al. Resveratrol Alleviates Zearalenone-Induced Intestinal Dysfunction in Mice Through the NF-Κb/Nrf2/HO-1 Signalling Pathway. Foods 2024; 13(8): 1217.
25- Al Dera HS. Protective Effect of Resveratrol Against Aluminum Chloride Induced Nephrotoxicity in Rats. Saudi Med J 2016; 37(4): 369-78.
26- Tábara LC, Poveda J, Martin-Cleary C, Selgas R, Ortiz A, Sanchez-Niño MD. Mitochondria-Targeted Therapies for Acute Kidney Injury. Expert Rev Mol Med 2014; 16: e13.
27- Anand Babu, KG. Prasanth, Bhaskar Balaji. Effect of Curcumin in Mice Model of Vincristine-Induced Neuropathy. Pharm Biol 2015; 53(6): 838-48.
28- Martins DB, Lopes STA, Mazzanti CM, Spanevello R, Schmatz R, Corrêa M, et al. Lipid Peroxidation in Rats Treated with Vincristine Sulphate and Nandrolone Decanoate. Arq Bras Med Vet Zootec 2011; 63: 107-13.
29- Alshammari GM , Al-Ayed MS , Abdelhalim MA, Al-Harbi LN , Yahya MA. Effects of Antioxidant Combinations on the Renal Toxicity Induced Rats by Gold Nanoparticles. Molecules 2023; 28(4): 1879.
30- Arafa MH, Mohammad NS, Atteia HH, Abd-Elaziz HR. Protective Effect of Resveratrol Against Doxorubicin-Induced Cardiac Toxicity and Fibrosis in Male Experimental Rats. J Physiol Biochem 2014; 70(3): 701-11.
31- Wencong T, Lei Y, Yuansheng L, Jianxiang H, Liang Y, Qiong Zh, etal. Resveratrol Attenuates Doxorubicin-Induced Cardiotoxicity in Rats by Up-Regulation of Vascular Endothelial Growth Factor B. J Nutr Biochem 2020; 79: 108132.
1- Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, et al. Annual Report to the Nation on the Status of Cancer, 1975-2000, Featuring the Uses of Surveillance Data for Cancer Prevention and Control. J Natl Cancer Inst 2003; 95(17): 1276-99.
2- Smith RA, Manassaram-Baptiste D, Brooks D, Doroshenk M, Fedewa S, Saslow D, et al. Cancer Screening in the United States, 2015: A Review of Current American Cancer Society Guidelines and Current Issues in Cancer Screening. CA Cancer J Clin 2015; 65(1): 30-54.
3- Kumar A, Patil D, Rajamohanan PR, Ahmad A. Isolation, Purification and Characterization of Vinblastine and Vincristine from Endophytic Fungus Fusarium Oxysporum Isolated from Catharanthus Roseus. PLos One 2013; 8(9): e71805.
4- Beigi harchegani A, Khor A, Mirnamniha, M, Bakhtiari kaboutaraki H, Shirvani H and Shahriyari A. The Hepatoprotective and Antioxidative Effect of Saffron Stigma Alcoholic Extract Against Vincristine Sulfate Induced Toxicity in Rats. Interdiscip Toxicol 2019; 12(4): 186-91.
5- Silverman JA, Deitcher SR. Marqibo (R) (Vincristine Sulfate Liposome Injection) Improves the Pharmacokinetics and Pharmacodynamics of Vincristine. Cancer Chemother Pharmacol 2013; 71(3): 555-64.
6- Thakur V, Kush P, Pandey RS, Jain UK, Chandra R, Madan J. Vincristine Sulfate Loaded Dextran Microspheres Amalgamated with Thermo Sensitive Gel Offered Sustained Release and Enhanced Cytotoxicity in THP-1, Human Leukemia Cells: In Vitro and in Vivo Study. Mater Sci Eng C Mater Biol 2016; 61: 113-22.
7- Ogunc Y, Demirel M, Yakar A, Incesu Z. Vincristine and Varepsilon-Viniferine-Loaded PLGA-B-PEG Nanoparticles: Pharmaceutical Characteristics, Cellular Uptake and Cytotoxicity. J Microencapsul 2017; 34: 38-46.
8- Carter LG, D'Orazio JA, Pearson KJ. Resveratrol and Cancer: Focus on in Vivo Evidence. Endocr Relat Cancer 2014; 21(3): R209-25.
9- Shati AA. Sub-Chronic Administration of Vincristine Sulfate Induces Renal Damage and Apoptosis in Rats via Induction of Oxidative Stress and Activation of Raf1-MEK1/2-Erk1/2 Signal Transduction. Int J Morphol 2019; 37: 273-83.
10- Kashefimehr SH, Nasirzadeh MR. Oleuropein Cardioprotection Effect Against Oxidative Stress in Streptozotocin-Induced Diabetic Male Rats. JSSU Med Sci 2019; 27(3): 1372-80. [Persian]
11- Karabag-Coban F, Hazman O, Bozkurt MF, Ince S. Antioxidant Status and Anti-inflammatory Effects of Oleuropein in Streptozotocin-induced Diabetic Nephropathy in Rats. European J Med Plants 2017; 18(2): 1-10.
12- Vestergaard M, Ingmer H. Antibacterial and Antifungal Properties of Resveratrol. Int J Antimicrob Agents 2019; 53(6): 716-23.
13- Xiao Q, Zhu W, Feng W, Lee SS, Leung AW, Shen J, et al. A Review of Resveratrol as a Potent Chemoprotective and Synergistic Agent in Cancer Chemotherapy. Front Pharmacol 2018; 9: 1534.
14- Zhu W, Qin W, Zhang K, Rottinghaus GE, Chen YC, Kliethermes B, et al. Trans-Resveratrol Alters Mammary Promoter Hypermethylation in Women at Increased Risk for Breast Cancer. Nutr Cancer 2012; 64(3): 393-400.
15- Dobrek L, Baranowska A, Skowron B, Thor P. Biochemical and Histological Evaluation of Kidney Function in Rats after a Single Administration of Cyclophosphamide and Ifosfamide. J Nephrol Kidney Dis 2017; 1(1): 1002.
16- Bazmandegan G, Amirteimoury M, Kaeidi A, Shamsizadeh A, Khademalhosseini M, Nematollahi MH, et al. Sumatriptan Ameliorates Renal Injury Induced by Cisplatin in Mice. Iran J Basic Med Sci 2019; 22(5): 563-7.
17- Chiruvella V, Annamaraju P, Guddati AK. Management of Nephrotoxicity of Chemotherapy and Targeted Agents: 2020. Am J Cancer Res 2020; 10(12): 4151-64.
18- Meng W, Lingwei M, Liru X, Wenlei Y, Zhiyong L, Xiang L, et al. Resveratrol Alleviates Chemotherapy-Induced Oogonial Stem Cell Apoptosis and Ovarian Aging in Mice. Aging 2019; 11(3): 1030-44.
19- Shan W, Guolin H, Meng C, Tao Z, Wenming X, Xinghui L. The Role of Antioxidant Enzymes in the Ovaries. Oxid Med Cell Longev 2017; 1-14.
20- Geisler S, Doan RA, Strickland A, Huang X, Milbrandt J, DiAntonio A. Prevention of Vincristine-Induced Peripheral Neuropathy by Genetic Deletion of SARM1 in Mice. Brain 2016; 139(Pt 12): 3092-108.
21- Fan G, Tang JJ, Bhadauria M, Nirala SK, Dai F, Zhou B, et al. Resveratrol Ameliorates Carbon Tetrachloride-Induced Acute Liver Injury in Mice. Environ Toxicol Pharmacol 2009; 28(3):350-6.
22- Naderi R, Mohaddes G, Mohammadi M,Ghazn aviR, Ghyasi R, Vatankhah AM. Voluntary Exercise Protects Heart from Oxidative Stress in Diabetic Rats. Adv Pharm Bull 2015; 5(2): 231-6.
23- Valentovic MA, Ball JG, Brown MJ, Terneus MV, McQuade E, Van Meter E. Resveratrol Attenuates Cisplatin Renal Cortical Cytotoxicity by Modifying Oxidative Stress. Toxicol Vitro 2014; 28(2): 2014; 248-57.
24- Sugan Xia, Chaoyue Yan, Jianhong Gu, Yan Yuan, Hui Zou, Zongping Liu et al. Resveratrol Alleviates Zearalenone-Induced Intestinal Dysfunction in Mice Through the NF-Κb/Nrf2/HO-1 Signalling Pathway. Foods 2024; 13(8): 1217.
25- Al Dera HS. Protective Effect of Resveratrol Against Aluminum Chloride Induced Nephrotoxicity in Rats. Saudi Med J 2016; 37(4): 369-78.
26- Tábara LC, Poveda J, Martin-Cleary C, Selgas R, Ortiz A, Sanchez-Niño MD. Mitochondria-Targeted Therapies for Acute Kidney Injury. Expert Rev Mol Med 2014; 16: e13.
27- Anand Babu, KG. Prasanth, Bhaskar Balaji. Effect of Curcumin in Mice Model of Vincristine-Induced Neuropathy. Pharm Biol 2015; 53(6): 838-48.
28- Martins DB, Lopes STA, Mazzanti CM, Spanevello R, Schmatz R, Corrêa M, et al. Lipid Peroxidation in Rats Treated with Vincristine Sulphate and Nandrolone Decanoate. Arq Bras Med Vet Zootec 2011; 63: 107-13.
29- Alshammari GM , Al-Ayed MS , Abdelhalim MA, Al-Harbi LN , Yahya MA. Effects of Antioxidant Combinations on the Renal Toxicity Induced Rats by Gold Nanoparticles. Molecules 2023; 28(4): 1879.
30- Arafa MH, Mohammad NS, Atteia HH, Abd-Elaziz HR. Protective Effect of Resveratrol Against Doxorubicin-Induced Cardiac Toxicity and Fibrosis in Male Experimental Rats. J Physiol Biochem 2014; 70(3): 701-11.
31- Wencong T, Lei Y, Yuansheng L, Jianxiang H, Liang Y, Qiong Zh, etal. Resveratrol Attenuates Doxorubicin-Induced Cardiotoxicity in Rats by Up-Regulation of Vascular Endothelial Growth Factor B. J Nutr Biochem 2020; 79: 108132.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1403/4/17 | پذیرش: 1403/7/29 | انتشار: 1403/11/15
دریافت: 1403/4/17 | پذیرش: 1403/7/29 | انتشار: 1403/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







