دوره 32، شماره 7 - ( مهر 1403 )
جلد 32 شماره 7 صفحات 8007-7991 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mirzapoor A, Meghdari Z, Ranjbar H, Moradifar F. A Review of Advanced and Smart Nano Wound Dressings Based on Investigating the Function of Hybrid Nanosystems in Wound Monitoring and Antimicrobial Activity. JSSU 2024; 32 (7) :7991-8007
URL: http://jssu.ssu.ac.ir/article-1-6186-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6186-fa.html
میرزاپور ارمکی ابوالفضل، مقداری زهرا، رنجبر هانیه، مرادی فر فاطمه. مروری بر نانو زخمپوشهای پیشرفته و هوشمند با تاکید بر بررسی کارکرد نانوسامانههای ترکیبی در نظارت زخم و فعالیت ضد میکروبی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (7) :7991-8007
متن کامل [PDF 1170 kb]
(756 دریافت)
| چکیده (HTML) (1494 مشاهده)
متن کامل: (3868 مشاهده)
مقدمه
زخمپوشهای پیشرفته و هوشمند، سامانههای پیشرفته مدیریت زخم بوده و به عنوان نسل جدید زخمپوش شناخته میشوند. بهطور کلی میتوان زخمپوشهای پیشرفته و هوشمند را در دو دسته کلی تشخیصی و تشخیصی پاسخگو دستهبندی کرد. دسته اول، هدف نظارت بر وضعیت زخم است و دسته دوم علاوه بر نظارت و تشخیص وضعیت زخم در هر لحظه، ارائه پاسخ مناسب به منظور بهبود وضعیت زخم، حائز اهمیت است. عوامل فتوترمال، نانوالیاف پاسخگو به pH، هیدروژلهای مبتنی بر DNA، هیدروژل با قابلیت تشخیص آنزیم و تغییر رنگ در اثر تغییر pH از مهمترین الگوهای تشخیصی مورد استفاده در این زخمپوشها هستند. این زخمپوشها مجهز به حسگرهایی هستند که میتوانند دادهها را جمعآوری کرده و برای تجزیه و تحلیل به گوشیهای هوشمند، و یا سیستمهای پیشرفته ذخیره اطلاعات ارسال نمایند. که امکان نظارت در لحظه متغیرهای زخم مانند عفونت، تورم، گلوکز خون، pH و دما از طریق این زخمپوشها فراهم میشود) همچنین میتوانند در صورت نیاز به درمان رهایش کنترل شده دارو کمک کنند. زخمپوشهای هوشمند فناوریهایی امیدوارکننده به منظور بهبود درمان زخمهای مزمن هستند که قابلیت شخصیسازی برای هر بیمار را داشته و اطلاعات قابل اعتماد و کمخطا را در اختیار اپراتورهای بالینی قرار میدهند (5-1). قابلیت ضد میکروبی زخمپوشها به پارامترهای مختلفی از جمله هزینه، نوع زخم، میزان میکروب در محل زخم و محل و وضعیت زخم بستگی دارد. ترکیبات طبیعی مشتق شده از گیاهان، نانوذرات، پلیمرهای طبیعی مانند کیتوزان و پپتیدهای ضد میکروبی از مهمترین عوامل ضد میکروبی مورد استفاده در زخمپوشها هستند (6). هیدروژلهای اصلاح شده با نانوذرات، نانوالیاف حاوی نانوذرات ضد میکروبی و نانو سلولز باکتریایی از دیگر جایگزینهای آنتیبیوتیکها برای استفاده در زخمپوش هستند (10-7). نانوسامانههای ترکیبی در زخمپوشهای پیشرفته و هوشمند دو ماموریت اصلی را دنیال میکنند؛ عملکرد ضد میکروبی و حمل و رهایش کنترل شده دارو. نانوذرات ویژگیهای ضد باکتریایی ذاتی دارند و در مبارزه با باکتریها، به ویژه گونههای مقاوم به چند دارو و بیوفیلمها موثر هستند. اخیرا نانوذرات در زخمپوشهای مبتنی بر هیدروژل ادغام شدهاند که این موضوع با بهبود فعالیت ضد باکتریایی آنها همراه بوده است. در این فناوری از نانوذرات فلزی و اکسید فلزی در ترمیم زخم و از پلیمرهای آبدوست زیستسازگار و غیرسمی به عنوان ماتریکس استفاده شده است و نشان داده شده است که زخمپوشهای اصلاح شده با نانوذرات اثرات ضد میکروبی و التیام بخشی داشتهاند (13-11). از سوی دیگر نانوسامانههای ترکیبی با قابلیت نظارت بر فرآیند بهبود زخم در مطالعات متعدد ساخت زخم پوش ها مورد استفاده قرار گرفتند (14،15). در مطالعه پیشرو ضمن برسی مروری نسل جدید از زخم پوش¬های پیشرفته و هوشمند، کارکرد انواع نانوسامانههای ترکیبی را در آنها مورد بررسی و ارزیابی قرار خواهیم داد.
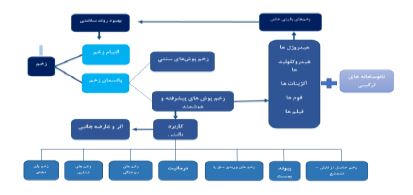
شماتیک 1- الگوی مفهومی نقش و کارکرد زخم پوش های هوشمند و ترکیبی
روش بررسی
در این پژوهش از روش مطالعه کتابخانهای و مرور اسناد، استفاده شده است و به منظور جمعآوری و بررسی زخمپوشهای هوشمند و کاربرد فناوریهای نانو در زمینه زخمپوشها، در سه بخش به جستجوی فناورهای جایگزین آنتیبیوتیکها برای استفاده در زخمپوش، زخمپوشهای با قابلیت نظارت بر ترمیم زخم، بازار زخمپوشها و فناوریهای حال حاضر در جهان پرداخته شده است. به این منظور از عبارتهای «electrochemical sensors and wound dressing» در بازه زمانی 2023-2020، « nanotechnology applications in wound dress» بدون محدودیت در بازه زمانی، «A variety of antimicrobial compounds »، «Smart wound dressings» در بازه زمانی 2023-2018 و «محصولات نانویی در حوزه زخمپوش»، «شرکتهای معتبر تولیدکننده زخمپوش بر پایه نانو »، «مارکتینگ نانوزخمپوشها » در بازه زمانی 2000 تا 2023 ، برای جستجو در داده پایگاههای بینالمللیGoogle Scholar، ScienceDirect، pubmed و پایگاه اینترنتی سیلویکا استفاده شده است. در این گزارش بهطور ویژه به زخمپوشهای هوشمند با قابلیت نظارت بر زخم، فناوریهای جایگزین آنتی بیوتیکها برای استفاده در درمان و ترمیم زخم و بازار زخمپوشها در جهان پرداخته شده است و به مقالات مرتبط با زخمپوشهای چندمنظوره اشاره نشده است. )همچنین برای استخراج پارامترهای مورد نظر برای نگارش مقاله، نیاز به دسترسی به کل محتوای مقالات بود. پس از جمعآوری مقالات مورد نظر و حذف مقالات غیر قابل دسترس، در مجموع 30 مقاله مروری و یا پژوهشی کامل برای تحریر این مقاله استفاده شده است.
3- روند ترمیم زخم
به منظور طراحی روشهای درمانی و تشخیصی مناسب هر زخم، درک چگونگی عملکرد این روشها و بررسی دقیق و شناخت وضعیت زخم در مراحل مختلف، روند بهبود زخم بهطور کلی در مراحل مختلفی بررسی میشود. این مراحل بسته به نوع مطالعه، طبق دستهبندیهای مختلفی طبقهبندی میشوند. در روند بهبود زخم، بافت پس از آسیب، خود را ترمیم میکند. در این مقاله، بهمنظور بررسی مراحل بهبود زخم، از دستهبندیای شامل چهار مرحله هموستاز، التهاب، تکثیر و بازسازی استفاده شده است.
3.1- مرحله هموستاز
این مرحله شامل مسیرهایی است که طی توالیهایی از واکنشهای پیچیده، منجر به تشکیل لخته میشوند. ابتدا یک آبشار انعقادی درونی و بیرونی با رویدادها و ویژگیهای جداگانه ایجاد میشود. هر دو مسیر انعقادی در نهایت منجر به تشکیل لخته میشوند.
3.2- مرحلهی التهابی
در این مرحله، طی واکنشهای ضدالتهابی با انقباض رگهای خونی آسیبدیده، خون نشتشده منعقد میگردد. بهطور کلی پاسخ سلولی در این مرحله در بیست و چهار ساعت اول ایجاد میشود و ممکن است تا دو روز ادامه یابد. سلولهای التهابی در بهبود زخم نقش حیاتی دارند و به آزادسازی آنزیمهای لیزوزومی و گونههای فعال اکسیژن کمک میکنند. نوتروفیلها با بیان بسیاری از سیتوکینهای ضدالتهابی و مقدار زیادی از مواد ضدمیکروبی فعال، پپتیدهای کاتیونی و پروتئازها در محل زخم، در این مرحله نقش مهمی دارند.
3.3-مرحله تکثیر
این مرحله شامل زیرمراحل دیگری میشود که از هم مجزا نیستند بلکه یک روند مداوم و یکپارچه را شکل میدهند. این زیرمراحل عبارت اند از: فیبروپلازی، رسوب ماتریکس، رگزایی و اپیتلیال شدن مجدد. در روزهای پنج تا هفت فیبروبلاستها به داخل زخم مهاجرت میکنند. پروتئوگلیکانها، گلیکوزآمینوگلیکآنهایی هستند که با پیوند کووالانسی به یک هسته پروتئینی پیوند میخورند و در رسوب ماتریکس نقش دارند. فاکتور اولیه رشد فیبروبلاست و اجزای رشد اندوتلیال عروقی، رگزایی را تعدیل میکنند. اپیتلیزه شدن مجدد با مهاجرت سلولها از محیط زخم و تشکیل ساختارهای متصلکننده انجام میشود. این زیر مرحله با ایجاد یک لایه سلولی اپیتلیال همراه است که پل زخم را ایجاد میکند. مراحل فرعی گفته شده میتوانند حداکثر تا چهار هفته در داخل زخم ساده و بدون آلودگی انجام شوند.
3.4- بازسازی
این مرحله دو تا سه هفته پس از ایجاد زخم شروع میشود. در این مرحله، هدف بهبود ساختار بافت است. بافت گرانوله به تدریج بازسازی میشود و بافت اسکار تشکیل میدهد که سلول و عروق کمتری دارد) همچنین تنوع رگهای خونی در ناحیه زخم، کاهش مییابد. پس از هفته سوم، زخم تحت تاثیر تغییرات ثابتی قرار میگیرد که میتوانند سالها پس از از بین رفتن آسیب اولیه، باقی بمانند (شکل1) (3،16).
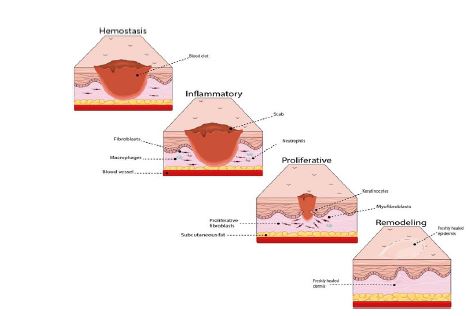
شکل 1: مراحل مختلف بهبود زخم؛ به ترتیب: هموستاز، التهاب، تکثیر و بازسازی (17)
4- نانوسامانه ترکیبی نظارت زخم
حسگرهای زیستی تعبیه شده در زخمپوشها، حسگرهای پوشیدنی یا زخمپوشهای هوشمند نامیده میشوند، این حسگرهای پوشیدنی هوشمند، مراقبتهای بهداشتی را از مدل سنتی "بیمارستان محور" به مدل متمرکز "دستگاه قابل حمل شخصی" ارتقا دادهاند و به دلیل توانایی آنها در بررسی مستقیم شرایط زخم و شناسایی باکتریها بدون نیاز به نمونه برداری سواب/بیوپسی مورد استفاده قرار گرفتهاند (20-18). محیط مرطوب زخم به روند بهبود زخم کمک میکند و حفظ این محیط و نظارت بر هرگونه تغییر در مسیر بهبود زخم از جمله چالشهای اولیهای است که در طی مراقبت از زخم با آن مواجه میشویم (22،21). بنابراین ادغام ابزارهای تشخیصی در زخمپوش برای نظارت و تشخیص بلادرنگ وضعیت زخم و در پی آن تحویل هوشمند عوامل بیولوژیکی و داروها میتواند حمایت بزرگی برای مراقبت از زخمهای مزمن باشد و نتایج درمان زخم را بهطور قابلتوجهی بهبود بخشد (25-23). ویژگی های محیط زخم و وضعیت بهبود زخم به هم مرتبط هستند و نظارت بر دما، رطوبت، pH، محتوای اکسیژن، رشد باکتریها و سایر شرایط زخم میتواند به درک سریع و در لحظه تغییرات، در ریزمحیط زخم کمک کند. با انتقال وایرلس و بلوتوث اطلاعات مربوط به زخم، خدمات پزشکی از راه دور ارتقا یافته و این امر مدیریت زخم را تا حد زیادی تسهیل میکند (27،26). در این بخش به برخی از حسگرهای پوشیدنی هوشمند که برای ارزیابی این پارامترها طراحی و ساخته شدهاند، پرداخته شده است.
4.1 – نانوسامانههای ترکیبی مبتنی بر گرافن و ارزیابی اسید اوریک در محل زخم
به همین منظور محققان کرهای از نانوصفحات دو بعدی ترکیبی برای کاربردی کردن ورقههای سه بعدی گرافن استفاده کردهاند و به دلیل اثر همافزایی بین گرافن و نانوصفحات دو بعدی، رسانایی الکترود قرار داده شده بر روی بستر الاستومری پلی دی متیل سیلوکسان (PDMS) بهبود یافت تا زخمپوش یکپارچهای با حسگرهای چند منظوره، انعطافپذیر و قابل کشش که قادر به ارزیابی اسید اوریک، pH و دما در محل زخم باشد، مهندسی شود. حسگرهای تعبیه شده در زخمپوش میتوانند پاسخ سریعی به اسید اوریک در محدوده 1200-50 میکرومولار با حساسیت بالا و حد تشخیص بسیار کم (50 میکرومولار) نشان دهند. )همچنین حسگرهای pH و دما نیز به ترتیب پاسخهای با حساسیت زیاد در محدوده pH مربوط به زخم (9-4) و پاسخ مقاومتی خطی سریع و پایدار به تغییرات دما در محدوده فیزیولوژیکی (25-50 درجه سانتیگراد) نشان دادند (28).
4.2- نانوسامانههای ترکیبی ارگانوسیلیکونی با قابلیت ارزیابی التهاب زخم
حسگر دیگر با ساختار ساندویچی توسط الاستومر دی الکتریک بین دو لایه هیدروژل برای نظارت مستمر و همزمان تورم، التهاب و چرک به ترتیب از طریق شاخصهای فشار، دما و ترشحات زخم طراحی شده است. این زخمپوش، مقاوم در برابر فشار بوده و برای بهبود آسیبهای فشاری سبب از بین رفتن یکپارچگی پوست در اثر فشار و له شدگی پوست کاربرد دارد. حسگر ساخته شده به دلیل پیوندهای عرضی نانوذرات ارگانوسیلیکون و مونومرهای زویتریونیک، دارای مقاومت عالی در برابر فشار (81/99٪ فشرده سازی تا بازیابی کامل) است و به طور مداوم و متمایز به سه شاخص التهاب، تورم و چروک را نظارت میکند. آزمایشهای درونتنی، قابلیت این حسگر را در پیشگیری از آسیبهای فشاری را تأیید میکند (29).
4.3- نانوسامانههای ترکیبی مبتنی بر DNA و ارزیابی فعالیت باکتریایی در محل زخم
اخیرا پژوهشی بر روی حسگر زیستی مبتنی بر هیدروژل DNA بدون باتری و بیسیم انجام گرفته است که به طور انتخابی به دئوکسی ریبونوکلئازهای مرتبط با باکتریهای بیماریزا پاسخ میدهد. تلاقی حسگرهای زیستی و فناوری بیسیم، تشخیص عفونت در زخمهای حاد را از طریق تغییرات دیالکتریک هیدروژل و انتقال اطلاعات آن به گوشیهای هوشمند را ممکن کرده است و نظارت بر بهبود زخمهای مزمن را در آینده نزدیک تسهیل میکند.
آنزیم (Deoxyribonucleas:DNase) ترشح شده توسط استافیلوکوکوس اورئوس میتواند با بریدن رشتههای DNA، که مکانیسم اساسی پاسخ انتخابی هیدروژل DNA به عفونت زخم است، باعث تخریب هیدروژل شود. این هیدروژل با اتصال شیمیایی رشتههای DNA با پلیاتیلنگلیکول (Polyethylene glycol :PEG) و دیگلیسیدیل اتر (Diglycidyl ether :PEGDE) تهیه شده است. در نهایت، حسگر هیدروژل DNA و مدار جلویی، با یک بخش ارتباط میدانی نزدیک (Near-field communication :NFC) ادغام شدند تا انتقال اطلاعات، بهطور بیسیم و با قابلیت تکرارپذیری بالا را، امکانپذیر کنند (30).
4.4- نانوسامانه های ترکیبی زئولیتی با قابلیت تعیین کمیت استافیلوکوکوس اورئوس
مطالعه مورد بررسی بر روی زخمپوش منعطف چاپ شده، مبتنی بر کامپوزیت چارچوب زئولیت ایمیدازولات (ZIF 67) و نیترید کربن (C3N4) همراه با پروب DNA استافیلوکوکوس اورئوس، برای تشخیص DNA استافیلوکوکوس اورئوس انجام گرفته است. این نانوزخمپوش با استفاده از طیفسنجی امپدانس الکتروشیمیایی (Electrochemical Impedance Spectroscopy :EIS) برای تعیین کمیت DNA استافیلوکوکوس اورئوس در 1 فمتومولار تا 10 میکرومولار ارزیابی شد. نتایج نشان داده، حد تشخیص (LoD)، حساسیت و زمان پاسخ حسگر به ترتیب 0/46 فمتومولار، 0/25 kΩ/fM/mm2 و تقریبا 10 ثانیه در فرکانس 21/04 کیلوهرتز است، و فقط برای DNA هدف (استافیلوکوکوس اورئوس) انتخابی عمل میکند. علاوه بر آن عملکرد حسگر، در نمونههای سرم انسانی تأیید شده و نشان داده شده است که 35 روز ماندگاری دارد و در نتیجه میتواند به عنوان پلتفرمی مقرون به صرفه، یکبار مصرف و قابلحمل در کاربردهای مراقبتهای بهداشتی و به عنوان زخمپوش هوشمند مورد استفاده قرار گیرد (31).
4.4- نانوسامانههای ترکیبی انعطاف پذیر با قابلیت ارزیابی عفونت زخم
محققان چینی یک حسگر زیستی انعطافپذیر و چندگانه برای ارزیابی ریز محیط زخم، التهاب و وضعیت عفونت با اندازهگیری واسطههای التهابی (فاکتور نکروز تومور-آلفا، اینترلوکین 6-8، فاکتور رشد بتا 1) بار میکروبی (استافیلوکوکوس اورئوس) و پارامترهای فیزیکوشیمیایی (دما و pH) طراحی کردهاند که با جمعآوری ترشحات زخم و به کارگیری لوازم الکترونیکی انعطافپذیر برای بازخوانی بیسیم دادهها مبتنی بر گوشیهای هوشمند عمل میکند. این ارزیابیها در مدل موش زخمی و ترشحات زخم بیماران مبتلا به زخمهای وریدی پا انجام گرفت. این فناوری میتواند مدیریت به موقع زخم مزمن را تسهیل کند (32).
4.5- نانوسامانههای ترکیبی مبتنی بر آئروژل نانوالیاف کربن با قابلیت ارزیابی ترمیم زخم
حسگر مورد بررسی برای پایش pH زخمهای مزمن طراحی شده است و مبتنی بر آئروژل نانوالیاف کربن رسانای سهبعدی است که از سلولز باکتریایی پیرولیز شده بهعنوان بستر رسانا استفاده شده است و با کامپوزیت پلیدیمتیلسیلوکسان/ پلیآنیلین منعطف ترکیب شده است. این نانوکامپوزیت در محلول بافر pH و در مایع زخم شبیهسازی شده در شرایط آزمایشگاهی به ترتیب حساسیت نزدیک به mV/pH50 و mV/pH 29- به pH نشان دهد. (33).
جدول 1: مقایسه الگوهای تشخیصی مورد استفاده در زخمپوشهای پیشرفته و هوشمند

5- نانوسامانههای ترکیبی ضدمیکروبی جایگزین آنتیبیوتیک در زخم پوش
بیش از 20 کلاس از آنتی بیوتیکها بین سالهای 1930 تا 1962 تولید شده است، اما به دلیل تکامل باکتریهای مقاوم جدید، کشف مولکولهای جدید با فعالیت ضد باکتریایی برای صنعت داروسازی چالش برانگیزتر شده است (34،35). بنابراین نیاز فوری به مواد جدید با خواص ضد باکتریایی مورد توجه قرار گرفته است. در ساخت زخمپوشهایی که شامل رویکرد درمانی هستند، عوامل درمانی بهکار گرفته شده در زخمپوش، حائز اهمیت هستند. به منظور انتخاب مناسبترین عوامل درمانی باید فعالیت ضدمیکروبی، میزان اثربخشی، سمیت و نحوهی عملکرد این عوامل، به دقت مورد بررسی قرار گیرند. عفونت باکتریایی یکی از مشکلات جدی حین روند بهبود زخم است. استفاده از آنتیبیوتیکهای معمول چالش مقاومت آنتیبیوتیکی را ایجاد کرده است. به همین دلیل دانشمندان و محققان بهدنبال توسعهی روشهای درمانی بدون استفاده از آنتیبیوتیکها و یا مقادیر کمتر آنها به منظور به حداقل رساندن مصرف این ترکیبات هستند. از اینرو انتخاب موادی با فعالیت ضدمیکروبی به منظور جایگزینی مناسب برای آنتیبیوتیکها مورد توجه قرار گرفتهاست با توجه به اینکه امروزه جایگزین کردن آنتیبیوتیکها با مواد کمخطرتر و دارای خاصیت ضدمیکروبی موردتوجه جامعه علمی است، در این مطالعه نانوسامانههای ترکیی ضدمیکروبی که میتوانند جایگزینهای مناسبی برای آنتیبیوتیکها باشند، معرفی شدهاند.
5.1- نانوسامانههای حاوی ترکیبات طبیعی و مشتقات گیاهی
گیاهان و سایر ترکیبات طبیعی میتوانند منابع محصولات مختل کننده بیوفیلمها باشند. بهعنوان مثال عسل حاوی طیف وسیعی از ترکیبات فعال از جمله فلاونوئیدها، اسیدهای آلی، اسید فنولیک، ویتامینها و آنزیمهایی است که میتوانند بهبود زخم را تسهیل کنند) همچنین مقدار زیاد اسیدهای آمینه موجود در عسل موجب رسوب فیبروبلاستها و تشکیل کلاژن در ناحیه زخم میشوند. پلیمرهای طبیعی مانند برخی از پلیساکاریدهای طبیعی نیز خاصیت ضدمیکروبی دارند. از دیگر پلیمرهای طبیعی دارای خاصیت ضدمیکروبی میتوان به پلیهگزامتیلنبیگوانیدین(polyhexamethyle biguanidine :PHMB) اشاره کرد. از دیگر ترکیبات طبیعی با خاصیت ضدمیکروبی میتوان به کیتوزان، ویتامین E، آبسیزیک اسید، عصارههای آبی و اتانولی رامنوس پرینویدس (Rhamnus prinoides)، مانوز(Mannose)، متیل آلفا دی مانوپیرانوزید (methyl α-D-mannopyranoside) دو د اکسی دی گلوکز (2-deoxy-D-glucose) و متیل آلفا دیگلوکوپیرانوزید (methyl α-D-glucopyranosid) اشاره کرد. تعدادی از مشتقات گیاهی شامل عصارهها، اسانسها و سایر ترکیبات با منشاء گیاهی، دارای خواص ضدمیکروبی هستند. به عنوان نمونهای از عصارهها با خاصیت ضد میکروبی میتوان به عصاره Aaronsohnia factorovskyi اشاره کرد. ترکیباتی مبتنی بر عصاره این گیاه، میتوانند به تنهایی و یا در ترکیب با سایر عصارههای گیاهی، به منظور بهبود فعالیت ضدمیکروبی بهکار روند. اسانسها به دلیل فعالیت بازدارنده در برابر میکروبها بهطور گسترده مورد مطالعه قرار گرفتهاند. به عنوان مثال، روغنهای گیاهانی مانند آویشن، علف لیمو، درخت چای، پونه کوهی، چوب سدر، بادرنجبویه، سوزن کاج، لیمو و صنوبر نقرهای به منظور از بین بردن هلیکوباکتر پیلوری بهکار گرفته شدهاند (36،37).
5.2- انواع نانوذرات و نانوساختارهای فلزی و غیر فلزی
نانوذرات در برابر سویههای باکتریایی بیماریزا، اغلب فعالیتهای ضدباکتریایی را در هر دو سویه گرممثبت و گرممنفی نشان میدهند. نانوذرات آهن (FeO) استرس اکسیداتیو را از طریق ایجاد رادیکالهای آزاد اکسیژن ایجاد میکند و به پروتئینهای باکتریایی و DNA برخی از سویههای گرممثبت و گرممنفی آزمایششده آسیب میرساند. بهنظر میرسد نانوذرات مس به گروههای کربوکسیل موجود در سطح سلول میل دارند و ممکن است پس از ورود به سلول، ساختار مارپیچ را در رشتههای اسید نوکلئیک به هم بزنند. به عنوان تعدادی از نانوذرات دارای خاصیت ضدمیکروبی میتوان به نانوذرات نقره، طلا، مس، دی اکسید تیتانیوم، اکسید روی و یا نانوذرات لیپیدی حاوی کورکومین اشاره کرد. نانوذرات پتانسیل زیادی به عنوان اجزای زخمپوش دارند که جایگزین آنتیبیوتیکها هستند، زیرا به دلیل ابعاد و شکلشان، فعالیت ضد میکروبی قوی و گستردهای را در دوزهای کمتر در برابر طیف وسیعی از میکروارگانیسمها ارائه میکنند و برخلاف آنتیبیوتیکها، عوارض جانبی کمتری ایجاد میکنند و و مستعد ایجاد مقاومت میکروبی نیستند و این امکان استفاده از آنها را برای مهار رشد باکتریهای مقاوم به دارو فراهم میکند (12) و (38،39). مطالعات انجام یافته نشان دادند نانوذرات فلزی نقره، اکسید مس، طلا، آهن اکسید، اکسید روی، اکسید آلومینیوم، تیتانیوم دی اکسید و گالیم، از طریق ایجاد تغییر در ساختار پروتئین، غیرفعال شدن آنزیم، آسیب DNA و جداسازی ریبوزومها) و همچنین تولید گونههای فعال اکسیژن فعالیت ضد باکتریایی نشان میدهند (شکل 2) (40).
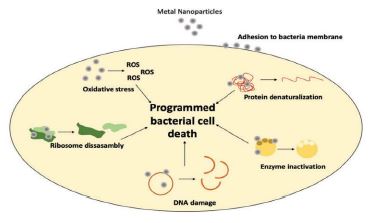
شکل 2 : مکانیسم اثر ضد باکتریایی نانوذرات فلزی.
*نانوذرات نقره (AgNPs): خواص ضد میکروبی
در طول تاریخ، نقره در تمامی اشکال، به تنهایی یا در ترکیب با سایر فناوریها به عنوان یک عامل ضد میکروبی استفاده شده است. با ظهور نانوفناوری، نانوذرات نقره (AgNPs) به عنوان عاملی ضد میکروبی که قادر به مبارزه با باکتریهایی که در شرایط درونتنی و آزمایشگاهی باعث عفونت میشوند، شناخته شده است. لازم به ذکر است، ظرفیت ضد باکتریایی نانوذرات نقره، باکتریهای گرم منفی، گرم مثبت و سویههای مقاوم به چند دارو را پوشش میدهد. مطالعات نشان دادهاند استفاده از نانوذرات نقره در زخمپوش، حتی در طولانیمدت مشکلی ایجاد نمیکنند. )همچنین ترکیب آن با کلاژن، فعالیت ضد باکتریایی قوی ایجاد کرده و آن را به یک جزء مناسب برای زخمپوش تبدیل میکند (41،42). خواص ضد باکتریایی نانوذرات نقره، به اندازه و سطح آنها بستگی دارد. در این رابطه محققان نشان دادند که نانوذرات نقره کوچکتر، سطح در دسترس بیشتری داشته و یونهای نقره بیشتری را آزاد میکنند و گونههای اکسیژن فعالتری را القا کرده و در نتیجه در برابر باکتری اشرشیاکلی مؤثرتراند. علاوه بر آن شکل و بار نانوذرات در میزان خواص ضد باکتریایی آنها موثر است. به این صورت که نانوذرات نقره با بار مثبت و شکل کروی فعالیت ضد باکتریایی بیشتری دارند (45-43).
*نانوذرات طلا (AuNPs): خواص ضد میکروبی
برخلاف نقره، نانومواد طلا به تنهایی هیچگونه فعالیت ضد میکروبی ارائه نمیکنند. با این وجود به دلیل امکان اصلاح سطح آنها و راندمان تبدیل فتوترمال زیادشان، پتانسیل زیادی در درمان ضد باکتری نشان دادهاند) همچنین ترکیب طلا با داروهای ضد میکروبی موجود یا با سایر نانوذرات، قدرت آنها را برای کشتن میکروبها افزایش میدهد. به عنوان مثال، نانوذرات طلای کونژوگه با ونکومایسین فعالیت ونکومایسین را در برابر انتروکوکهای مقاوم به ونکومایسین تا 50 برابر افزایش داده و فعالیت قابلتوجهی در برابر اشرشیاکلی، که معمولاً تحت تأثیر ونکومایسین قرار نمیگیرد، نشان داده است (49-46).
*نانوذرات مس (CuNPs): خواص ضد میکروبی
بیش از یک قرن از زمانی که مصریان باستان از مس به عنوان ماده ضدعفونی کننده آب و همچنین ضدعفونی کننده زخم استفاده میکردند، مس به عنوان عامل ضد باکتری در نظر گرفته میشود و با وجود مزایای متعدد نانوذرات مس، سمیت این نانوذرات موضوعی بحث برانگیز است که نیاز به توجه و تحقیقات بیشتری است (50). مطالعات قبلی، نشان داده است، بر خلاف باکتری اشرشیاکلی که به مس بیشتر از نقره حساس بود، تمام سویههای استافیلوکوکوس اورئوس حساسیت یکسانی به نانوذرات نقره و مس داشتند. در همین راستا میتوان از الیاف سلولزی مملو از نانوذرات مس به عنوان زخمپوش، استفاده کرد (51،52).
*نانوذرات اکسید آهن: خواص ضد میکروبی
نانوذرات اکسید آهن (Fe2O3-NPs)، میتوانند فعالیت ضد باکتریایی و ضد سرطانی نشان دهند (53)، با این وجود درمقایسه با نانوذرات اکسید روی و اکسید مس، زیست سازگاری کمتری برای سلولهای یوکاریوتی داشتند و عملکرد ضد میکروبی نسبتاً ضعیفی در مقابل سویههای اشریشیاکلی، استافیلوکوکوس اورئوس، سودوموناس آئروژینوزا و باسیلوس سوبتیلیس نشان دادند (54). مطالعات نشان دادهاند، برای افزایش تعامل نانوذرات اکسید آهن با سلولهای باکتریایی و بهبود عملکرد ضدمیکروبی، میتوان سطح آنها را با گروههای شیمیایی اصلاح کرد (55). علاوه بر این، استفاده از پایدار کنندهها، اثرات ضد میکروبی نانوذرات را بهبود میبخشد. نانوذرات Fe3O4 پوشش داده شده با اسید سیتریک، فعالیت ضد باکتریایی قابلتوجهی در برابر هر دو سویه اشرشیاکلی و اشرشیاکلی مقاوم به کانامایسین(E. coli pARG-25) از خود نشان دادند و سویه مقاوم به کانامایسین نسبت به سویه وحشی حساسیت بیشتری داشته است. لازم به ذکر است که اثرات ضد میکروبی نانوذرات اکسید آهن به نوع تثبیت کننده نیز بستگی دارد. نانوذرات اکسید آهن پوشش داده شده با اسید سیتریک، نسبت به نانوذرات تثبیت شده با اسید اولئیک، در برابر باکتریهای مقاوم به دارو عملکرد قابلتوجهتری نشان دادهاند (56). همچنین نانوذرات اکسید آهن اثر ضد باکتریایی بهتری روی باکتریهای گرم منفی نسبت به باکتریهای گرم مثبت نشان میدهند (57). مطالعه خواص ضد باکتری و ضد التهابی نانوذرات اکسید آهن سنتز شده به روش سبز بر روی موشها، گواهی بر کارآمدی عصاره میوه انجیر و نانوذرات اکسید آهن در برابر مقاومت باکتریایی بود، زیرا پس از 5 روز، موشهای تحت درمان با عصاره انجیر یا نانوذرات اکسید آهن در مقایسه با شاهد بهبود آشکاری نشان دادند و در روز چهاردهم، بهبودی تقریباً کامل مشاهده شد (58). با استفاده از مطالعات آزمایشگاهی بر روی ماکروفاژها و مطالعات درونتنی بر روی موش زخمی با عفونت پوستی ناشی از استافیلوکوکوس اورئوس، مکانیسم عملکرد ضد باکتریایی نانوذرات اکسید آهن ارائه شد. توانایی نانوذرات اکسید آهن در باکتریکشی و پاسخهای پیش التهابی در ماکروفاژها با تولید گونههای فعال اکسیژن مرتبط است. زیرا جذب نانوذرات اکسید آهن توسط ماکروفاژها ممکن است منجر به آزاد شدن آهن فریک (Fe3+) در سیتوپلاسم شود که در نتیجه افزایش تشکیل گونههای فعال اکسیژن از طریق واکنش فنتون(Fenton reaction ) را به دنبال دارد (61-59).
*نانوذرات اکسید روی (ZnO NPs): خواص ضد میکروبی
نانوذرات اکسید روی به دلیل زیستسازگاری و مقاومت در برابر باکتریها بهویژه باکتریهای شایع در زخمهای دیابتی، به خوبی مورد مطالعه قرار گرفتهاند. زیرا روند بهبود زخم را تسریع میکنند و به عنوان عوامل درمانی در عفونت زخم دیابتی و ترمیم زخم دیابتی استفاده میشوند. مکانیسم اساسی باکتریکشی نانوذرات اکسید روی، شامل تماس فیزیکی بین نانوذرات و دیواره سلولی باکتری، تولید گونههای فعال اکسیژن و همچنین رادیکالهای آزاد و آزادسازی یونهای روی میباشد. مطالعات متعدد نشان داده است که نانوذره اکسید روی در برابر طیفی از باکتریها و سایر عوامل بیماریزا موثر است (66-62).
*نانوذرات تیتانیوم دی اکسید (TiO2-NPs): خواص ضد میکروبی
در میان نانوذرات اکسید فلزی مختلف که به عنوان عوامل ضدمیکروبی عمل میکنند، نانوذرات تیتانیوم دی اکسید سابقه چندان طولانی برای بهکارگیری خواص ضد میکروبیشان ندارند (67). با اینحال مشخص شده است که نانوذرات تیتانیوم دی اکسید از طریق تعامل با پروتئینهای سرم خون، ترمیم زخم سوختگی و بازسازی بافت را بهبود میبخشند و از عفونت زخم جلوگیری میکنند (68). دی اکسید تیتانیوم به دلیل ماهیت فوتوکاتالیستی، پایداری شیمیایی و ارزان بودن، به عنوان ترکیب ضد میکروبی در نظر گرفته شده است. مطالعات نشان داده است که این اکسید فلزی دارای خواص ضد قارچی و ضد باکتریایی عالی در برابر طیف وسیعی از باکتریهای گرم مثبت و گرم منفی است. فعالیت ضد میکروبی نانوذرات تیتانیوم دی اکسید تا حد زیادی به عملکرد فوتوکاتالیستی آنها بستگی دارد که به شدت به خواص مورفولوژیکی، ساختاری آن وابسته است (69). دی اکسید تیتانیوم در سه اشکال کریستالی (آناتاز(Anatase) روتیل (Rutile) و بروکیت (Brookite) و آمورف تولید میشود که آناتاز بالاترین فعالیت فوتوکاتالیستی و ضد میکروبی را نشان میدهد و نانولولههای توخالی دی اکسید تیتانیوم به لطف افزایش سطح ویژه، خواص ضد میکروبی جالبی ارائه میکنند (70). علاوه بر این، مطالعات نشان داده است خواص ضد باکتریایی دی اکسید تیتانیوم با قرار گرفتن در معرض نور UV افزایش مییابد و ترکیب ساب فتالوسیانینها (جذب کننده نور) با نانوذرات تیتانیوم باعث افزایش فعالیت آنها در برابر استافیلوکوکوس اورئوس و اشرشیاکلی میشود (71).
*نانوذرات اکسید آلومینیوم: خواص ضد میکروبی
نانوذرات اکسید آلومینیوم برای استفاده در زخمپوش مورد مطالعه قرار گرفتهاند و استفاده از غشاهای اکسید آلومینیوم آندی نانومتخلخل به عنوان پانسمان پس از سوختگی، اثر مضری بر ترمیم زخم نشان ندادند و چسبندگی و انطباق مناسبی با سطح پوست نشان دادند (72). ترکیب نانوذرات آلومینا و دی اکسید تیتانیوم نیز در زخمپوشهای مبتنی بر کیتوزان با خواص ضدباکتریایی، باعث تسریع بهبود زخمهای عفونی میشوند (73).
6- بررسی و ارزیابی بازار زخم پوش های پیشرفته
در سال 2019 آمریکای شمالی بیشترین سهم از بازار زخمپوشها را بهخود اختصاص داده است و انتظار میرود ایــن روند تا ســال 2025 ادامه یابد. افزایش جمعیت ســالمندان، افزایش شــیوع زخمهای مزمــن، افزایش هزینههای مراقبت هــای بهداشــتی و حضــور بازیگــران اصلــی بــازار زخمپوش در این ناحیه، باعث شــده اســت ســهم عمده آمریکای شمالی را در بازار جهانی زخم¬پوش ها شاهد باشیم. باز اصلیترین تولیدکنندگان برجســته بــازار زخمپوشهــا، M3 ( ایالت متحــده)، plc Nephew & Smith (انگلســتان)، Integra Corporation Holdings LifeSciences (ایالت متحده)،AB Care Health Mölnlycke (سوئد)، ConvaTec plc Group ( انگلستان)، S/A Coloplast (دانمارک)، Incorporated Hollister (ایالت متحده) هستند. ( M3ایالت متحده) پیشــرو در بازار جهانی پانســمان زخم اســت. این شــرکت برای افزایش بیشــتر ســهم خود در بازار کاربردفناورینانودر تولیدصنعتی پانسمآنها و زخمپوشها صنعتی فنـاوری نـانـــــو 229 مجموعه گزارشهای 5 پانســمان زخم رو ی راه انداز ی خط تولید و خرید محصول تمرکز دارد. M3 در مراقبت از زخم های پیشــرفته پیشــگام اســت و بیش از 15 ســال اســت که در بازار حضور دارد؛ این امر مزیت رقابتی آن را در بازار فراهم میکند. این شــرکت روی افزایــش مشــتری و گســترش توانایــی خــود در بازارهــای نوظهور و دســت نخورده (ماننــد به کارگیــری فناوری نانو) تمرکز کرده است.
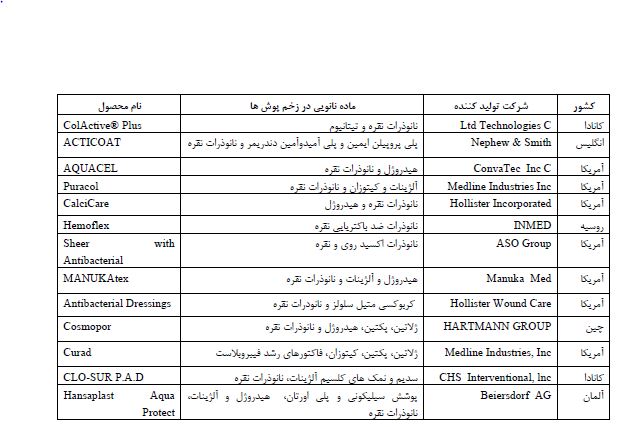
جدول2: شرکتهای تولیدکننده زخم پوشهای نانویی صادراتی.
نتیجهگیری
زخم پوشهای نانویی، که از فناوری نانو در طراحی و فرمولبندی خود بهره میبرند، در سالهای اخیر به دلیل ظرفیتی که برای بهبود زخم دارند، توجه زیادی را به خود جلب کردهاند. این پانسمانها در مقیاس نانو مهندسی شدهاند و خواص و عملکردهای منحصربهفردی را ارائه میکنند که میتواند نتایج درمانی را برای انواع مختلف زخمها بهبود بخشد. یکی از مزایای کلیدی پانسمانهای زخم نانو، توانایی آنها در ایجاد یک محیط مطلوب برای تسریع بهبودی است. مواد نانومقیاس استفاده شده در این پانسمانها می توانند ماتریکس خارج سلولی را تقلید کنند و داربستی را برای اتصال و تکثیر سلولی فراهم کنند. آنها نسبت سطح به حجم بالایی را ارائه می دهند، که دارورسانی کارآمد و برهمکنشهای افزایش یافته با سلول های زخم را ممکن می سازد. علاوه بر این، پانسمانهای نانو میتوانند سطوح رطوبت، اکسیژنرسانی و تعادل pH را در زخم تنظیم کنند و شرایط بهبودی بهینه را بهبود بخشند. پانسمانهای زخم نانو نیز دارای خواص ضد میکروبی هستند که می تواند به پیشگیری و درمان عفونت زخم کمک کند. در این بررسی انواع نانوموادی که در پانسمانها گنجانده شدهاند تا فعالیت ضد میکروبی وسیعطیفی را ارائه دهند گزارش و مورد بحث قرار گرفت. این نانوذرات میتوانند بهطور موثر باکتری ها را از بین ببرند و تشکیل بیوفیلم را کاهش دهند، که اغلب یک چالش بزرگ در مدیریت زخم است. از طریق مکانیسمهای آزادسازی کنترلشده، این پانسمانها میتوانند عوامل درمانی را مستقیماً به محل زخم برسانند و تکثیر سلولی، رگزایی و رسوب ماتریکس خارج سلولی را تحریک کنند. پانسمانهای زخم نانو دارای خواص و عملکردهای استثنایی هستند که میتوانند مراقبت از زخم را متحول کنند. این پانسمانها از طریق توانایی خود در ایجاد یک محیط بهینه، ارائه عوامل درمانی و جلوگیری از عفونت، مزایای قابلتوجهی نسبت به پانسمانهای سنتی دارند. آنها پتانسیل بهبود نتایج درمانی، کاهش عوارض و افزایش روند ترمیم زخم را دارند. علاوه بر این، مقرون به صرفه بودن پانسمان های زخم مبتنی بر فناوری نانو باید مورد توجه قرار گیرد. در حالیکه نانومواد پتانسیل بالایی از خود نشان داده اند، فرآیندهای تولید و ساخت آنها ممکن است در مقایسه با پانسمانهای زخم معمولی پیچیده و گران باشد. یافتن راههایی برای افزایش تولید و در دسترستر و مقرون به صرفهتر کردن پانسمآنهای نانو برای استفاده گسترده ضروری است. با اینحال، تحقیقات و توسعه بیشتر برای رفع نگرانیهای ایمنی، بهینه سازی فرآیندهای تولید و ارزیابی اثربخشی بلندمدت آنها مورد نیاز است. با پیشرفتهای مداوم در فناوری نانو و افزایش درک مکانیسمهای ترمیم زخم، پانسمانهای نانو نویدبخش آینده مراقبت از زخم هستند و گام مهمی در ارائه درمانهای موثرتر و منحصربهفرد برای بیماران مبتلا به انواع مختلف زخم فراهم می¬کنند.
حامی مالی: معاونت آموزش، پژوهش و فناوری جمعیت هلال احمر و معاونت پژوهشی دانشگاه تربیت مدرس
تعارض در منافع: ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند
زخمپوشهای پیشرفته و هوشمند، سامانههای پیشرفته مدیریت زخم بوده و به عنوان نسل جدید زخمپوش شناخته میشوند. بهطور کلی میتوان زخمپوشهای پیشرفته و هوشمند را در دو دسته کلی تشخیصی و تشخیصی پاسخگو دستهبندی کرد. دسته اول، هدف نظارت بر وضعیت زخم است و دسته دوم علاوه بر نظارت و تشخیص وضعیت زخم در هر لحظه، ارائه پاسخ مناسب به منظور بهبود وضعیت زخم، حائز اهمیت است. عوامل فتوترمال، نانوالیاف پاسخگو به pH، هیدروژلهای مبتنی بر DNA، هیدروژل با قابلیت تشخیص آنزیم و تغییر رنگ در اثر تغییر pH از مهمترین الگوهای تشخیصی مورد استفاده در این زخمپوشها هستند. این زخمپوشها مجهز به حسگرهایی هستند که میتوانند دادهها را جمعآوری کرده و برای تجزیه و تحلیل به گوشیهای هوشمند، و یا سیستمهای پیشرفته ذخیره اطلاعات ارسال نمایند. که امکان نظارت در لحظه متغیرهای زخم مانند عفونت، تورم، گلوکز خون، pH و دما از طریق این زخمپوشها فراهم میشود) همچنین میتوانند در صورت نیاز به درمان رهایش کنترل شده دارو کمک کنند. زخمپوشهای هوشمند فناوریهایی امیدوارکننده به منظور بهبود درمان زخمهای مزمن هستند که قابلیت شخصیسازی برای هر بیمار را داشته و اطلاعات قابل اعتماد و کمخطا را در اختیار اپراتورهای بالینی قرار میدهند (5-1). قابلیت ضد میکروبی زخمپوشها به پارامترهای مختلفی از جمله هزینه، نوع زخم، میزان میکروب در محل زخم و محل و وضعیت زخم بستگی دارد. ترکیبات طبیعی مشتق شده از گیاهان، نانوذرات، پلیمرهای طبیعی مانند کیتوزان و پپتیدهای ضد میکروبی از مهمترین عوامل ضد میکروبی مورد استفاده در زخمپوشها هستند (6). هیدروژلهای اصلاح شده با نانوذرات، نانوالیاف حاوی نانوذرات ضد میکروبی و نانو سلولز باکتریایی از دیگر جایگزینهای آنتیبیوتیکها برای استفاده در زخمپوش هستند (10-7). نانوسامانههای ترکیبی در زخمپوشهای پیشرفته و هوشمند دو ماموریت اصلی را دنیال میکنند؛ عملکرد ضد میکروبی و حمل و رهایش کنترل شده دارو. نانوذرات ویژگیهای ضد باکتریایی ذاتی دارند و در مبارزه با باکتریها، به ویژه گونههای مقاوم به چند دارو و بیوفیلمها موثر هستند. اخیرا نانوذرات در زخمپوشهای مبتنی بر هیدروژل ادغام شدهاند که این موضوع با بهبود فعالیت ضد باکتریایی آنها همراه بوده است. در این فناوری از نانوذرات فلزی و اکسید فلزی در ترمیم زخم و از پلیمرهای آبدوست زیستسازگار و غیرسمی به عنوان ماتریکس استفاده شده است و نشان داده شده است که زخمپوشهای اصلاح شده با نانوذرات اثرات ضد میکروبی و التیام بخشی داشتهاند (13-11). از سوی دیگر نانوسامانههای ترکیبی با قابلیت نظارت بر فرآیند بهبود زخم در مطالعات متعدد ساخت زخم پوش ها مورد استفاده قرار گرفتند (14،15). در مطالعه پیشرو ضمن برسی مروری نسل جدید از زخم پوش¬های پیشرفته و هوشمند، کارکرد انواع نانوسامانههای ترکیبی را در آنها مورد بررسی و ارزیابی قرار خواهیم داد.

شماتیک 1- الگوی مفهومی نقش و کارکرد زخم پوش های هوشمند و ترکیبی
روش بررسی
در این پژوهش از روش مطالعه کتابخانهای و مرور اسناد، استفاده شده است و به منظور جمعآوری و بررسی زخمپوشهای هوشمند و کاربرد فناوریهای نانو در زمینه زخمپوشها، در سه بخش به جستجوی فناورهای جایگزین آنتیبیوتیکها برای استفاده در زخمپوش، زخمپوشهای با قابلیت نظارت بر ترمیم زخم، بازار زخمپوشها و فناوریهای حال حاضر در جهان پرداخته شده است. به این منظور از عبارتهای «electrochemical sensors and wound dressing» در بازه زمانی 2023-2020، « nanotechnology applications in wound dress» بدون محدودیت در بازه زمانی، «A variety of antimicrobial compounds »، «Smart wound dressings» در بازه زمانی 2023-2018 و «محصولات نانویی در حوزه زخمپوش»، «شرکتهای معتبر تولیدکننده زخمپوش بر پایه نانو »، «مارکتینگ نانوزخمپوشها » در بازه زمانی 2000 تا 2023 ، برای جستجو در داده پایگاههای بینالمللیGoogle Scholar، ScienceDirect، pubmed و پایگاه اینترنتی سیلویکا استفاده شده است. در این گزارش بهطور ویژه به زخمپوشهای هوشمند با قابلیت نظارت بر زخم، فناوریهای جایگزین آنتی بیوتیکها برای استفاده در درمان و ترمیم زخم و بازار زخمپوشها در جهان پرداخته شده است و به مقالات مرتبط با زخمپوشهای چندمنظوره اشاره نشده است. )همچنین برای استخراج پارامترهای مورد نظر برای نگارش مقاله، نیاز به دسترسی به کل محتوای مقالات بود. پس از جمعآوری مقالات مورد نظر و حذف مقالات غیر قابل دسترس، در مجموع 30 مقاله مروری و یا پژوهشی کامل برای تحریر این مقاله استفاده شده است.
3- روند ترمیم زخم
به منظور طراحی روشهای درمانی و تشخیصی مناسب هر زخم، درک چگونگی عملکرد این روشها و بررسی دقیق و شناخت وضعیت زخم در مراحل مختلف، روند بهبود زخم بهطور کلی در مراحل مختلفی بررسی میشود. این مراحل بسته به نوع مطالعه، طبق دستهبندیهای مختلفی طبقهبندی میشوند. در روند بهبود زخم، بافت پس از آسیب، خود را ترمیم میکند. در این مقاله، بهمنظور بررسی مراحل بهبود زخم، از دستهبندیای شامل چهار مرحله هموستاز، التهاب، تکثیر و بازسازی استفاده شده است.
3.1- مرحله هموستاز
این مرحله شامل مسیرهایی است که طی توالیهایی از واکنشهای پیچیده، منجر به تشکیل لخته میشوند. ابتدا یک آبشار انعقادی درونی و بیرونی با رویدادها و ویژگیهای جداگانه ایجاد میشود. هر دو مسیر انعقادی در نهایت منجر به تشکیل لخته میشوند.
3.2- مرحلهی التهابی
در این مرحله، طی واکنشهای ضدالتهابی با انقباض رگهای خونی آسیبدیده، خون نشتشده منعقد میگردد. بهطور کلی پاسخ سلولی در این مرحله در بیست و چهار ساعت اول ایجاد میشود و ممکن است تا دو روز ادامه یابد. سلولهای التهابی در بهبود زخم نقش حیاتی دارند و به آزادسازی آنزیمهای لیزوزومی و گونههای فعال اکسیژن کمک میکنند. نوتروفیلها با بیان بسیاری از سیتوکینهای ضدالتهابی و مقدار زیادی از مواد ضدمیکروبی فعال، پپتیدهای کاتیونی و پروتئازها در محل زخم، در این مرحله نقش مهمی دارند.
3.3-مرحله تکثیر
این مرحله شامل زیرمراحل دیگری میشود که از هم مجزا نیستند بلکه یک روند مداوم و یکپارچه را شکل میدهند. این زیرمراحل عبارت اند از: فیبروپلازی، رسوب ماتریکس، رگزایی و اپیتلیال شدن مجدد. در روزهای پنج تا هفت فیبروبلاستها به داخل زخم مهاجرت میکنند. پروتئوگلیکانها، گلیکوزآمینوگلیکآنهایی هستند که با پیوند کووالانسی به یک هسته پروتئینی پیوند میخورند و در رسوب ماتریکس نقش دارند. فاکتور اولیه رشد فیبروبلاست و اجزای رشد اندوتلیال عروقی، رگزایی را تعدیل میکنند. اپیتلیزه شدن مجدد با مهاجرت سلولها از محیط زخم و تشکیل ساختارهای متصلکننده انجام میشود. این زیر مرحله با ایجاد یک لایه سلولی اپیتلیال همراه است که پل زخم را ایجاد میکند. مراحل فرعی گفته شده میتوانند حداکثر تا چهار هفته در داخل زخم ساده و بدون آلودگی انجام شوند.
3.4- بازسازی
این مرحله دو تا سه هفته پس از ایجاد زخم شروع میشود. در این مرحله، هدف بهبود ساختار بافت است. بافت گرانوله به تدریج بازسازی میشود و بافت اسکار تشکیل میدهد که سلول و عروق کمتری دارد) همچنین تنوع رگهای خونی در ناحیه زخم، کاهش مییابد. پس از هفته سوم، زخم تحت تاثیر تغییرات ثابتی قرار میگیرد که میتوانند سالها پس از از بین رفتن آسیب اولیه، باقی بمانند (شکل1) (3،16).

شکل 1: مراحل مختلف بهبود زخم؛ به ترتیب: هموستاز، التهاب، تکثیر و بازسازی (17)
4- نانوسامانه ترکیبی نظارت زخم
حسگرهای زیستی تعبیه شده در زخمپوشها، حسگرهای پوشیدنی یا زخمپوشهای هوشمند نامیده میشوند، این حسگرهای پوشیدنی هوشمند، مراقبتهای بهداشتی را از مدل سنتی "بیمارستان محور" به مدل متمرکز "دستگاه قابل حمل شخصی" ارتقا دادهاند و به دلیل توانایی آنها در بررسی مستقیم شرایط زخم و شناسایی باکتریها بدون نیاز به نمونه برداری سواب/بیوپسی مورد استفاده قرار گرفتهاند (20-18). محیط مرطوب زخم به روند بهبود زخم کمک میکند و حفظ این محیط و نظارت بر هرگونه تغییر در مسیر بهبود زخم از جمله چالشهای اولیهای است که در طی مراقبت از زخم با آن مواجه میشویم (22،21). بنابراین ادغام ابزارهای تشخیصی در زخمپوش برای نظارت و تشخیص بلادرنگ وضعیت زخم و در پی آن تحویل هوشمند عوامل بیولوژیکی و داروها میتواند حمایت بزرگی برای مراقبت از زخمهای مزمن باشد و نتایج درمان زخم را بهطور قابلتوجهی بهبود بخشد (25-23). ویژگی های محیط زخم و وضعیت بهبود زخم به هم مرتبط هستند و نظارت بر دما، رطوبت، pH، محتوای اکسیژن، رشد باکتریها و سایر شرایط زخم میتواند به درک سریع و در لحظه تغییرات، در ریزمحیط زخم کمک کند. با انتقال وایرلس و بلوتوث اطلاعات مربوط به زخم، خدمات پزشکی از راه دور ارتقا یافته و این امر مدیریت زخم را تا حد زیادی تسهیل میکند (27،26). در این بخش به برخی از حسگرهای پوشیدنی هوشمند که برای ارزیابی این پارامترها طراحی و ساخته شدهاند، پرداخته شده است.
4.1 – نانوسامانههای ترکیبی مبتنی بر گرافن و ارزیابی اسید اوریک در محل زخم
به همین منظور محققان کرهای از نانوصفحات دو بعدی ترکیبی برای کاربردی کردن ورقههای سه بعدی گرافن استفاده کردهاند و به دلیل اثر همافزایی بین گرافن و نانوصفحات دو بعدی، رسانایی الکترود قرار داده شده بر روی بستر الاستومری پلی دی متیل سیلوکسان (PDMS) بهبود یافت تا زخمپوش یکپارچهای با حسگرهای چند منظوره، انعطافپذیر و قابل کشش که قادر به ارزیابی اسید اوریک، pH و دما در محل زخم باشد، مهندسی شود. حسگرهای تعبیه شده در زخمپوش میتوانند پاسخ سریعی به اسید اوریک در محدوده 1200-50 میکرومولار با حساسیت بالا و حد تشخیص بسیار کم (50 میکرومولار) نشان دهند. )همچنین حسگرهای pH و دما نیز به ترتیب پاسخهای با حساسیت زیاد در محدوده pH مربوط به زخم (9-4) و پاسخ مقاومتی خطی سریع و پایدار به تغییرات دما در محدوده فیزیولوژیکی (25-50 درجه سانتیگراد) نشان دادند (28).
4.2- نانوسامانههای ترکیبی ارگانوسیلیکونی با قابلیت ارزیابی التهاب زخم
حسگر دیگر با ساختار ساندویچی توسط الاستومر دی الکتریک بین دو لایه هیدروژل برای نظارت مستمر و همزمان تورم، التهاب و چرک به ترتیب از طریق شاخصهای فشار، دما و ترشحات زخم طراحی شده است. این زخمپوش، مقاوم در برابر فشار بوده و برای بهبود آسیبهای فشاری سبب از بین رفتن یکپارچگی پوست در اثر فشار و له شدگی پوست کاربرد دارد. حسگر ساخته شده به دلیل پیوندهای عرضی نانوذرات ارگانوسیلیکون و مونومرهای زویتریونیک، دارای مقاومت عالی در برابر فشار (81/99٪ فشرده سازی تا بازیابی کامل) است و به طور مداوم و متمایز به سه شاخص التهاب، تورم و چروک را نظارت میکند. آزمایشهای درونتنی، قابلیت این حسگر را در پیشگیری از آسیبهای فشاری را تأیید میکند (29).
4.3- نانوسامانههای ترکیبی مبتنی بر DNA و ارزیابی فعالیت باکتریایی در محل زخم
اخیرا پژوهشی بر روی حسگر زیستی مبتنی بر هیدروژل DNA بدون باتری و بیسیم انجام گرفته است که به طور انتخابی به دئوکسی ریبونوکلئازهای مرتبط با باکتریهای بیماریزا پاسخ میدهد. تلاقی حسگرهای زیستی و فناوری بیسیم، تشخیص عفونت در زخمهای حاد را از طریق تغییرات دیالکتریک هیدروژل و انتقال اطلاعات آن به گوشیهای هوشمند را ممکن کرده است و نظارت بر بهبود زخمهای مزمن را در آینده نزدیک تسهیل میکند.
آنزیم (Deoxyribonucleas:DNase) ترشح شده توسط استافیلوکوکوس اورئوس میتواند با بریدن رشتههای DNA، که مکانیسم اساسی پاسخ انتخابی هیدروژل DNA به عفونت زخم است، باعث تخریب هیدروژل شود. این هیدروژل با اتصال شیمیایی رشتههای DNA با پلیاتیلنگلیکول (Polyethylene glycol :PEG) و دیگلیسیدیل اتر (Diglycidyl ether :PEGDE) تهیه شده است. در نهایت، حسگر هیدروژل DNA و مدار جلویی، با یک بخش ارتباط میدانی نزدیک (Near-field communication :NFC) ادغام شدند تا انتقال اطلاعات، بهطور بیسیم و با قابلیت تکرارپذیری بالا را، امکانپذیر کنند (30).
4.4- نانوسامانه های ترکیبی زئولیتی با قابلیت تعیین کمیت استافیلوکوکوس اورئوس
مطالعه مورد بررسی بر روی زخمپوش منعطف چاپ شده، مبتنی بر کامپوزیت چارچوب زئولیت ایمیدازولات (ZIF 67) و نیترید کربن (C3N4) همراه با پروب DNA استافیلوکوکوس اورئوس، برای تشخیص DNA استافیلوکوکوس اورئوس انجام گرفته است. این نانوزخمپوش با استفاده از طیفسنجی امپدانس الکتروشیمیایی (Electrochemical Impedance Spectroscopy :EIS) برای تعیین کمیت DNA استافیلوکوکوس اورئوس در 1 فمتومولار تا 10 میکرومولار ارزیابی شد. نتایج نشان داده، حد تشخیص (LoD)، حساسیت و زمان پاسخ حسگر به ترتیب 0/46 فمتومولار، 0/25 kΩ/fM/mm2 و تقریبا 10 ثانیه در فرکانس 21/04 کیلوهرتز است، و فقط برای DNA هدف (استافیلوکوکوس اورئوس) انتخابی عمل میکند. علاوه بر آن عملکرد حسگر، در نمونههای سرم انسانی تأیید شده و نشان داده شده است که 35 روز ماندگاری دارد و در نتیجه میتواند به عنوان پلتفرمی مقرون به صرفه، یکبار مصرف و قابلحمل در کاربردهای مراقبتهای بهداشتی و به عنوان زخمپوش هوشمند مورد استفاده قرار گیرد (31).
4.4- نانوسامانههای ترکیبی انعطاف پذیر با قابلیت ارزیابی عفونت زخم
محققان چینی یک حسگر زیستی انعطافپذیر و چندگانه برای ارزیابی ریز محیط زخم، التهاب و وضعیت عفونت با اندازهگیری واسطههای التهابی (فاکتور نکروز تومور-آلفا، اینترلوکین 6-8، فاکتور رشد بتا 1) بار میکروبی (استافیلوکوکوس اورئوس) و پارامترهای فیزیکوشیمیایی (دما و pH) طراحی کردهاند که با جمعآوری ترشحات زخم و به کارگیری لوازم الکترونیکی انعطافپذیر برای بازخوانی بیسیم دادهها مبتنی بر گوشیهای هوشمند عمل میکند. این ارزیابیها در مدل موش زخمی و ترشحات زخم بیماران مبتلا به زخمهای وریدی پا انجام گرفت. این فناوری میتواند مدیریت به موقع زخم مزمن را تسهیل کند (32).
4.5- نانوسامانههای ترکیبی مبتنی بر آئروژل نانوالیاف کربن با قابلیت ارزیابی ترمیم زخم
حسگر مورد بررسی برای پایش pH زخمهای مزمن طراحی شده است و مبتنی بر آئروژل نانوالیاف کربن رسانای سهبعدی است که از سلولز باکتریایی پیرولیز شده بهعنوان بستر رسانا استفاده شده است و با کامپوزیت پلیدیمتیلسیلوکسان/ پلیآنیلین منعطف ترکیب شده است. این نانوکامپوزیت در محلول بافر pH و در مایع زخم شبیهسازی شده در شرایط آزمایشگاهی به ترتیب حساسیت نزدیک به mV/pH50 و mV/pH 29- به pH نشان دهد. (33).
جدول 1: مقایسه الگوهای تشخیصی مورد استفاده در زخمپوشهای پیشرفته و هوشمند

5- نانوسامانههای ترکیبی ضدمیکروبی جایگزین آنتیبیوتیک در زخم پوش
بیش از 20 کلاس از آنتی بیوتیکها بین سالهای 1930 تا 1962 تولید شده است، اما به دلیل تکامل باکتریهای مقاوم جدید، کشف مولکولهای جدید با فعالیت ضد باکتریایی برای صنعت داروسازی چالش برانگیزتر شده است (34،35). بنابراین نیاز فوری به مواد جدید با خواص ضد باکتریایی مورد توجه قرار گرفته است. در ساخت زخمپوشهایی که شامل رویکرد درمانی هستند، عوامل درمانی بهکار گرفته شده در زخمپوش، حائز اهمیت هستند. به منظور انتخاب مناسبترین عوامل درمانی باید فعالیت ضدمیکروبی، میزان اثربخشی، سمیت و نحوهی عملکرد این عوامل، به دقت مورد بررسی قرار گیرند. عفونت باکتریایی یکی از مشکلات جدی حین روند بهبود زخم است. استفاده از آنتیبیوتیکهای معمول چالش مقاومت آنتیبیوتیکی را ایجاد کرده است. به همین دلیل دانشمندان و محققان بهدنبال توسعهی روشهای درمانی بدون استفاده از آنتیبیوتیکها و یا مقادیر کمتر آنها به منظور به حداقل رساندن مصرف این ترکیبات هستند. از اینرو انتخاب موادی با فعالیت ضدمیکروبی به منظور جایگزینی مناسب برای آنتیبیوتیکها مورد توجه قرار گرفتهاست با توجه به اینکه امروزه جایگزین کردن آنتیبیوتیکها با مواد کمخطرتر و دارای خاصیت ضدمیکروبی موردتوجه جامعه علمی است، در این مطالعه نانوسامانههای ترکیی ضدمیکروبی که میتوانند جایگزینهای مناسبی برای آنتیبیوتیکها باشند، معرفی شدهاند.
5.1- نانوسامانههای حاوی ترکیبات طبیعی و مشتقات گیاهی
گیاهان و سایر ترکیبات طبیعی میتوانند منابع محصولات مختل کننده بیوفیلمها باشند. بهعنوان مثال عسل حاوی طیف وسیعی از ترکیبات فعال از جمله فلاونوئیدها، اسیدهای آلی، اسید فنولیک، ویتامینها و آنزیمهایی است که میتوانند بهبود زخم را تسهیل کنند) همچنین مقدار زیاد اسیدهای آمینه موجود در عسل موجب رسوب فیبروبلاستها و تشکیل کلاژن در ناحیه زخم میشوند. پلیمرهای طبیعی مانند برخی از پلیساکاریدهای طبیعی نیز خاصیت ضدمیکروبی دارند. از دیگر پلیمرهای طبیعی دارای خاصیت ضدمیکروبی میتوان به پلیهگزامتیلنبیگوانیدین(polyhexamethyle biguanidine :PHMB) اشاره کرد. از دیگر ترکیبات طبیعی با خاصیت ضدمیکروبی میتوان به کیتوزان، ویتامین E، آبسیزیک اسید، عصارههای آبی و اتانولی رامنوس پرینویدس (Rhamnus prinoides)، مانوز(Mannose)، متیل آلفا دی مانوپیرانوزید (methyl α-D-mannopyranoside) دو د اکسی دی گلوکز (2-deoxy-D-glucose) و متیل آلفا دیگلوکوپیرانوزید (methyl α-D-glucopyranosid) اشاره کرد. تعدادی از مشتقات گیاهی شامل عصارهها، اسانسها و سایر ترکیبات با منشاء گیاهی، دارای خواص ضدمیکروبی هستند. به عنوان نمونهای از عصارهها با خاصیت ضد میکروبی میتوان به عصاره Aaronsohnia factorovskyi اشاره کرد. ترکیباتی مبتنی بر عصاره این گیاه، میتوانند به تنهایی و یا در ترکیب با سایر عصارههای گیاهی، به منظور بهبود فعالیت ضدمیکروبی بهکار روند. اسانسها به دلیل فعالیت بازدارنده در برابر میکروبها بهطور گسترده مورد مطالعه قرار گرفتهاند. به عنوان مثال، روغنهای گیاهانی مانند آویشن، علف لیمو، درخت چای، پونه کوهی، چوب سدر، بادرنجبویه، سوزن کاج، لیمو و صنوبر نقرهای به منظور از بین بردن هلیکوباکتر پیلوری بهکار گرفته شدهاند (36،37).
5.2- انواع نانوذرات و نانوساختارهای فلزی و غیر فلزی
نانوذرات در برابر سویههای باکتریایی بیماریزا، اغلب فعالیتهای ضدباکتریایی را در هر دو سویه گرممثبت و گرممنفی نشان میدهند. نانوذرات آهن (FeO) استرس اکسیداتیو را از طریق ایجاد رادیکالهای آزاد اکسیژن ایجاد میکند و به پروتئینهای باکتریایی و DNA برخی از سویههای گرممثبت و گرممنفی آزمایششده آسیب میرساند. بهنظر میرسد نانوذرات مس به گروههای کربوکسیل موجود در سطح سلول میل دارند و ممکن است پس از ورود به سلول، ساختار مارپیچ را در رشتههای اسید نوکلئیک به هم بزنند. به عنوان تعدادی از نانوذرات دارای خاصیت ضدمیکروبی میتوان به نانوذرات نقره، طلا، مس، دی اکسید تیتانیوم، اکسید روی و یا نانوذرات لیپیدی حاوی کورکومین اشاره کرد. نانوذرات پتانسیل زیادی به عنوان اجزای زخمپوش دارند که جایگزین آنتیبیوتیکها هستند، زیرا به دلیل ابعاد و شکلشان، فعالیت ضد میکروبی قوی و گستردهای را در دوزهای کمتر در برابر طیف وسیعی از میکروارگانیسمها ارائه میکنند و برخلاف آنتیبیوتیکها، عوارض جانبی کمتری ایجاد میکنند و و مستعد ایجاد مقاومت میکروبی نیستند و این امکان استفاده از آنها را برای مهار رشد باکتریهای مقاوم به دارو فراهم میکند (12) و (38،39). مطالعات انجام یافته نشان دادند نانوذرات فلزی نقره، اکسید مس، طلا، آهن اکسید، اکسید روی، اکسید آلومینیوم، تیتانیوم دی اکسید و گالیم، از طریق ایجاد تغییر در ساختار پروتئین، غیرفعال شدن آنزیم، آسیب DNA و جداسازی ریبوزومها) و همچنین تولید گونههای فعال اکسیژن فعالیت ضد باکتریایی نشان میدهند (شکل 2) (40).

شکل 2 : مکانیسم اثر ضد باکتریایی نانوذرات فلزی.
*نانوذرات نقره (AgNPs): خواص ضد میکروبی
در طول تاریخ، نقره در تمامی اشکال، به تنهایی یا در ترکیب با سایر فناوریها به عنوان یک عامل ضد میکروبی استفاده شده است. با ظهور نانوفناوری، نانوذرات نقره (AgNPs) به عنوان عاملی ضد میکروبی که قادر به مبارزه با باکتریهایی که در شرایط درونتنی و آزمایشگاهی باعث عفونت میشوند، شناخته شده است. لازم به ذکر است، ظرفیت ضد باکتریایی نانوذرات نقره، باکتریهای گرم منفی، گرم مثبت و سویههای مقاوم به چند دارو را پوشش میدهد. مطالعات نشان دادهاند استفاده از نانوذرات نقره در زخمپوش، حتی در طولانیمدت مشکلی ایجاد نمیکنند. )همچنین ترکیب آن با کلاژن، فعالیت ضد باکتریایی قوی ایجاد کرده و آن را به یک جزء مناسب برای زخمپوش تبدیل میکند (41،42). خواص ضد باکتریایی نانوذرات نقره، به اندازه و سطح آنها بستگی دارد. در این رابطه محققان نشان دادند که نانوذرات نقره کوچکتر، سطح در دسترس بیشتری داشته و یونهای نقره بیشتری را آزاد میکنند و گونههای اکسیژن فعالتری را القا کرده و در نتیجه در برابر باکتری اشرشیاکلی مؤثرتراند. علاوه بر آن شکل و بار نانوذرات در میزان خواص ضد باکتریایی آنها موثر است. به این صورت که نانوذرات نقره با بار مثبت و شکل کروی فعالیت ضد باکتریایی بیشتری دارند (45-43).
*نانوذرات طلا (AuNPs): خواص ضد میکروبی
برخلاف نقره، نانومواد طلا به تنهایی هیچگونه فعالیت ضد میکروبی ارائه نمیکنند. با این وجود به دلیل امکان اصلاح سطح آنها و راندمان تبدیل فتوترمال زیادشان، پتانسیل زیادی در درمان ضد باکتری نشان دادهاند) همچنین ترکیب طلا با داروهای ضد میکروبی موجود یا با سایر نانوذرات، قدرت آنها را برای کشتن میکروبها افزایش میدهد. به عنوان مثال، نانوذرات طلای کونژوگه با ونکومایسین فعالیت ونکومایسین را در برابر انتروکوکهای مقاوم به ونکومایسین تا 50 برابر افزایش داده و فعالیت قابلتوجهی در برابر اشرشیاکلی، که معمولاً تحت تأثیر ونکومایسین قرار نمیگیرد، نشان داده است (49-46).
*نانوذرات مس (CuNPs): خواص ضد میکروبی
بیش از یک قرن از زمانی که مصریان باستان از مس به عنوان ماده ضدعفونی کننده آب و همچنین ضدعفونی کننده زخم استفاده میکردند، مس به عنوان عامل ضد باکتری در نظر گرفته میشود و با وجود مزایای متعدد نانوذرات مس، سمیت این نانوذرات موضوعی بحث برانگیز است که نیاز به توجه و تحقیقات بیشتری است (50). مطالعات قبلی، نشان داده است، بر خلاف باکتری اشرشیاکلی که به مس بیشتر از نقره حساس بود، تمام سویههای استافیلوکوکوس اورئوس حساسیت یکسانی به نانوذرات نقره و مس داشتند. در همین راستا میتوان از الیاف سلولزی مملو از نانوذرات مس به عنوان زخمپوش، استفاده کرد (51،52).
*نانوذرات اکسید آهن: خواص ضد میکروبی
نانوذرات اکسید آهن (Fe2O3-NPs)، میتوانند فعالیت ضد باکتریایی و ضد سرطانی نشان دهند (53)، با این وجود درمقایسه با نانوذرات اکسید روی و اکسید مس، زیست سازگاری کمتری برای سلولهای یوکاریوتی داشتند و عملکرد ضد میکروبی نسبتاً ضعیفی در مقابل سویههای اشریشیاکلی، استافیلوکوکوس اورئوس، سودوموناس آئروژینوزا و باسیلوس سوبتیلیس نشان دادند (54). مطالعات نشان دادهاند، برای افزایش تعامل نانوذرات اکسید آهن با سلولهای باکتریایی و بهبود عملکرد ضدمیکروبی، میتوان سطح آنها را با گروههای شیمیایی اصلاح کرد (55). علاوه بر این، استفاده از پایدار کنندهها، اثرات ضد میکروبی نانوذرات را بهبود میبخشد. نانوذرات Fe3O4 پوشش داده شده با اسید سیتریک، فعالیت ضد باکتریایی قابلتوجهی در برابر هر دو سویه اشرشیاکلی و اشرشیاکلی مقاوم به کانامایسین(E. coli pARG-25) از خود نشان دادند و سویه مقاوم به کانامایسین نسبت به سویه وحشی حساسیت بیشتری داشته است. لازم به ذکر است که اثرات ضد میکروبی نانوذرات اکسید آهن به نوع تثبیت کننده نیز بستگی دارد. نانوذرات اکسید آهن پوشش داده شده با اسید سیتریک، نسبت به نانوذرات تثبیت شده با اسید اولئیک، در برابر باکتریهای مقاوم به دارو عملکرد قابلتوجهتری نشان دادهاند (56). همچنین نانوذرات اکسید آهن اثر ضد باکتریایی بهتری روی باکتریهای گرم منفی نسبت به باکتریهای گرم مثبت نشان میدهند (57). مطالعه خواص ضد باکتری و ضد التهابی نانوذرات اکسید آهن سنتز شده به روش سبز بر روی موشها، گواهی بر کارآمدی عصاره میوه انجیر و نانوذرات اکسید آهن در برابر مقاومت باکتریایی بود، زیرا پس از 5 روز، موشهای تحت درمان با عصاره انجیر یا نانوذرات اکسید آهن در مقایسه با شاهد بهبود آشکاری نشان دادند و در روز چهاردهم، بهبودی تقریباً کامل مشاهده شد (58). با استفاده از مطالعات آزمایشگاهی بر روی ماکروفاژها و مطالعات درونتنی بر روی موش زخمی با عفونت پوستی ناشی از استافیلوکوکوس اورئوس، مکانیسم عملکرد ضد باکتریایی نانوذرات اکسید آهن ارائه شد. توانایی نانوذرات اکسید آهن در باکتریکشی و پاسخهای پیش التهابی در ماکروفاژها با تولید گونههای فعال اکسیژن مرتبط است. زیرا جذب نانوذرات اکسید آهن توسط ماکروفاژها ممکن است منجر به آزاد شدن آهن فریک (Fe3+) در سیتوپلاسم شود که در نتیجه افزایش تشکیل گونههای فعال اکسیژن از طریق واکنش فنتون(Fenton reaction ) را به دنبال دارد (61-59).
*نانوذرات اکسید روی (ZnO NPs): خواص ضد میکروبی
نانوذرات اکسید روی به دلیل زیستسازگاری و مقاومت در برابر باکتریها بهویژه باکتریهای شایع در زخمهای دیابتی، به خوبی مورد مطالعه قرار گرفتهاند. زیرا روند بهبود زخم را تسریع میکنند و به عنوان عوامل درمانی در عفونت زخم دیابتی و ترمیم زخم دیابتی استفاده میشوند. مکانیسم اساسی باکتریکشی نانوذرات اکسید روی، شامل تماس فیزیکی بین نانوذرات و دیواره سلولی باکتری، تولید گونههای فعال اکسیژن و همچنین رادیکالهای آزاد و آزادسازی یونهای روی میباشد. مطالعات متعدد نشان داده است که نانوذره اکسید روی در برابر طیفی از باکتریها و سایر عوامل بیماریزا موثر است (66-62).
*نانوذرات تیتانیوم دی اکسید (TiO2-NPs): خواص ضد میکروبی
در میان نانوذرات اکسید فلزی مختلف که به عنوان عوامل ضدمیکروبی عمل میکنند، نانوذرات تیتانیوم دی اکسید سابقه چندان طولانی برای بهکارگیری خواص ضد میکروبیشان ندارند (67). با اینحال مشخص شده است که نانوذرات تیتانیوم دی اکسید از طریق تعامل با پروتئینهای سرم خون، ترمیم زخم سوختگی و بازسازی بافت را بهبود میبخشند و از عفونت زخم جلوگیری میکنند (68). دی اکسید تیتانیوم به دلیل ماهیت فوتوکاتالیستی، پایداری شیمیایی و ارزان بودن، به عنوان ترکیب ضد میکروبی در نظر گرفته شده است. مطالعات نشان داده است که این اکسید فلزی دارای خواص ضد قارچی و ضد باکتریایی عالی در برابر طیف وسیعی از باکتریهای گرم مثبت و گرم منفی است. فعالیت ضد میکروبی نانوذرات تیتانیوم دی اکسید تا حد زیادی به عملکرد فوتوکاتالیستی آنها بستگی دارد که به شدت به خواص مورفولوژیکی، ساختاری آن وابسته است (69). دی اکسید تیتانیوم در سه اشکال کریستالی (آناتاز(Anatase) روتیل (Rutile) و بروکیت (Brookite) و آمورف تولید میشود که آناتاز بالاترین فعالیت فوتوکاتالیستی و ضد میکروبی را نشان میدهد و نانولولههای توخالی دی اکسید تیتانیوم به لطف افزایش سطح ویژه، خواص ضد میکروبی جالبی ارائه میکنند (70). علاوه بر این، مطالعات نشان داده است خواص ضد باکتریایی دی اکسید تیتانیوم با قرار گرفتن در معرض نور UV افزایش مییابد و ترکیب ساب فتالوسیانینها (جذب کننده نور) با نانوذرات تیتانیوم باعث افزایش فعالیت آنها در برابر استافیلوکوکوس اورئوس و اشرشیاکلی میشود (71).
*نانوذرات اکسید آلومینیوم: خواص ضد میکروبی
نانوذرات اکسید آلومینیوم برای استفاده در زخمپوش مورد مطالعه قرار گرفتهاند و استفاده از غشاهای اکسید آلومینیوم آندی نانومتخلخل به عنوان پانسمان پس از سوختگی، اثر مضری بر ترمیم زخم نشان ندادند و چسبندگی و انطباق مناسبی با سطح پوست نشان دادند (72). ترکیب نانوذرات آلومینا و دی اکسید تیتانیوم نیز در زخمپوشهای مبتنی بر کیتوزان با خواص ضدباکتریایی، باعث تسریع بهبود زخمهای عفونی میشوند (73).
6- بررسی و ارزیابی بازار زخم پوش های پیشرفته
در سال 2019 آمریکای شمالی بیشترین سهم از بازار زخمپوشها را بهخود اختصاص داده است و انتظار میرود ایــن روند تا ســال 2025 ادامه یابد. افزایش جمعیت ســالمندان، افزایش شــیوع زخمهای مزمــن، افزایش هزینههای مراقبت هــای بهداشــتی و حضــور بازیگــران اصلــی بــازار زخمپوش در این ناحیه، باعث شــده اســت ســهم عمده آمریکای شمالی را در بازار جهانی زخم¬پوش ها شاهد باشیم. باز اصلیترین تولیدکنندگان برجســته بــازار زخمپوشهــا، M3 ( ایالت متحــده)، plc Nephew & Smith (انگلســتان)، Integra Corporation Holdings LifeSciences (ایالت متحده)،AB Care Health Mölnlycke (سوئد)، ConvaTec plc Group ( انگلستان)، S/A Coloplast (دانمارک)، Incorporated Hollister (ایالت متحده) هستند. ( M3ایالت متحده) پیشــرو در بازار جهانی پانســمان زخم اســت. این شــرکت برای افزایش بیشــتر ســهم خود در بازار کاربردفناورینانودر تولیدصنعتی پانسمآنها و زخمپوشها صنعتی فنـاوری نـانـــــو 229 مجموعه گزارشهای 5 پانســمان زخم رو ی راه انداز ی خط تولید و خرید محصول تمرکز دارد. M3 در مراقبت از زخم های پیشــرفته پیشــگام اســت و بیش از 15 ســال اســت که در بازار حضور دارد؛ این امر مزیت رقابتی آن را در بازار فراهم میکند. این شــرکت روی افزایــش مشــتری و گســترش توانایــی خــود در بازارهــای نوظهور و دســت نخورده (ماننــد به کارگیــری فناوری نانو) تمرکز کرده است.
جدول2: شرکتهای تولیدکننده زخم پوشهای نانویی صادراتی.

نتیجهگیری
زخم پوشهای نانویی، که از فناوری نانو در طراحی و فرمولبندی خود بهره میبرند، در سالهای اخیر به دلیل ظرفیتی که برای بهبود زخم دارند، توجه زیادی را به خود جلب کردهاند. این پانسمانها در مقیاس نانو مهندسی شدهاند و خواص و عملکردهای منحصربهفردی را ارائه میکنند که میتواند نتایج درمانی را برای انواع مختلف زخمها بهبود بخشد. یکی از مزایای کلیدی پانسمانهای زخم نانو، توانایی آنها در ایجاد یک محیط مطلوب برای تسریع بهبودی است. مواد نانومقیاس استفاده شده در این پانسمانها می توانند ماتریکس خارج سلولی را تقلید کنند و داربستی را برای اتصال و تکثیر سلولی فراهم کنند. آنها نسبت سطح به حجم بالایی را ارائه می دهند، که دارورسانی کارآمد و برهمکنشهای افزایش یافته با سلول های زخم را ممکن می سازد. علاوه بر این، پانسمانهای نانو میتوانند سطوح رطوبت، اکسیژنرسانی و تعادل pH را در زخم تنظیم کنند و شرایط بهبودی بهینه را بهبود بخشند. پانسمانهای زخم نانو نیز دارای خواص ضد میکروبی هستند که می تواند به پیشگیری و درمان عفونت زخم کمک کند. در این بررسی انواع نانوموادی که در پانسمانها گنجانده شدهاند تا فعالیت ضد میکروبی وسیعطیفی را ارائه دهند گزارش و مورد بحث قرار گرفت. این نانوذرات میتوانند بهطور موثر باکتری ها را از بین ببرند و تشکیل بیوفیلم را کاهش دهند، که اغلب یک چالش بزرگ در مدیریت زخم است. از طریق مکانیسمهای آزادسازی کنترلشده، این پانسمانها میتوانند عوامل درمانی را مستقیماً به محل زخم برسانند و تکثیر سلولی، رگزایی و رسوب ماتریکس خارج سلولی را تحریک کنند. پانسمانهای زخم نانو دارای خواص و عملکردهای استثنایی هستند که میتوانند مراقبت از زخم را متحول کنند. این پانسمانها از طریق توانایی خود در ایجاد یک محیط بهینه، ارائه عوامل درمانی و جلوگیری از عفونت، مزایای قابلتوجهی نسبت به پانسمانهای سنتی دارند. آنها پتانسیل بهبود نتایج درمانی، کاهش عوارض و افزایش روند ترمیم زخم را دارند. علاوه بر این، مقرون به صرفه بودن پانسمان های زخم مبتنی بر فناوری نانو باید مورد توجه قرار گیرد. در حالیکه نانومواد پتانسیل بالایی از خود نشان داده اند، فرآیندهای تولید و ساخت آنها ممکن است در مقایسه با پانسمانهای زخم معمولی پیچیده و گران باشد. یافتن راههایی برای افزایش تولید و در دسترستر و مقرون به صرفهتر کردن پانسمآنهای نانو برای استفاده گسترده ضروری است. با اینحال، تحقیقات و توسعه بیشتر برای رفع نگرانیهای ایمنی، بهینه سازی فرآیندهای تولید و ارزیابی اثربخشی بلندمدت آنها مورد نیاز است. با پیشرفتهای مداوم در فناوری نانو و افزایش درک مکانیسمهای ترمیم زخم، پانسمانهای نانو نویدبخش آینده مراقبت از زخم هستند و گام مهمی در ارائه درمانهای موثرتر و منحصربهفرد برای بیماران مبتلا به انواع مختلف زخم فراهم می¬کنند.
حامی مالی: معاونت آموزش، پژوهش و فناوری جمعیت هلال احمر و معاونت پژوهشی دانشگاه تربیت مدرس
تعارض در منافع: ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند
References:
1- Pang Q, Yang F, Jiang Z, Wu K, Hou R, Zhu Y. Smart Wound Dressing for Advanced Wound Management: Real-Time Monitoring and On-Demand Treatment. Materials & Design 2023: 111917.
2- Ehtesabi H, Kalji SO, Movsesian L. Smartphone-Based Wound Dressings: A Mini-Review. Heliyon 2022; 8(7): e09876.
3- Rani Raju N, Silina E, Stupin V, Manturova N, Chidambaram SB, Achar RR. Multifunctional and Smart Wound Dressings—A Review on Recent Research Advancements in Skin Regenerative Medicine. Pharmaceutics 2022; 14(8): 1574.
4- Mirani B, Hadisi Z, Pagan E, Dabiri SM, van Rijt A, Almutairi L, et al. Smart Dual‐Sensor Wound Dressing for Monitoring Cutaneous Wounds. Adv Healthc Mater 2023; 12(18): 2203233.
5- Leal-Junior A, Guo J, Min R, Fernandes AJ, Frizera A, Marques C. Photonic Smart Bandage for Wound Healing Assessment. Photonics Research 2021; 9(3): 272-80.
6- Yousefian F, Hesari R, Jensen T, Obagi S, Rgeai A, Damiani G, Bunick CG, Grada A. Antimicrobial Wound Dressings: A Concise Review for Clinicians. Antibiotics 2023; 12(9): 1434.
7- Liang Y, Liang Y, Zhang H, Guo B. Antibacterial Biomaterials for Skin Wound Dressing. Asian Journal of Pharmaceutical Sciences 2022; 17(3): 353-84.
8- Preem L, Kogermann K. Electrospun antimicrobial wound dressings: Novel strategies to fight against wound infections. Chronic Wounds, Wound Dressings and Wound Healing. 2021:213-53.
9- Zhang Y, Yu J, Zhang H, Li Y, Wang L. Nanofibrous Dressing: Potential Alternative for Fighting Against Antibiotic‐Resistance Wound Infections. Journal of Applied Polymer Science 2022; 139(20): 52178.
10- Zheng L, Li S, Luo J, Wang X. Latest Advances on Bacterial Cellulose-Based Antibacterial Materials as Wound Dressings. Front Bioen Biotech 2020; 8: 593768.
11- Pang Q, Jiang Z, Wu K, Hou R, Zhu Y. Nanomaterials-Based Wound Dressing for Advanced Management of Infected Wound. Antibiotics 2023; 12(2): 351.
12- Yudaev P, Mezhuev Y, Chistyakov E. Nanoparticle-Containing Wound Dressing: Antimicrobial And Healing Effects. Gels 2022; 8(6): 329.
13- Xu C, Akakuru OU, Ma X, Zheng J, Zheng J, Wu A. Nanoparticle-Based Wound Dressing: Recent Progress in The Detection and Therapy of Bacterial Infections. Bioconjugate Chemistry 2020; 31(7): 1708-23.
14- Jiang L, Loo SC. Intelligent nanoparticle-based dressings for bacterial wound infections. ACS Applied Bio Materials 2021; 4(5): 3849-62.
15- Pormohammad A, Monych NK, Ghosh S, Turner DL, Turner RJ. Nanomaterials in wound healing and infection control. Antibiotics 2021; 10(5): 473.
16- Visha MG, Karunagaran M. A Review on Wound Healing. International Journal of Clinicopathological Correlation 2019; 3(2): 50.
17- Canchy L, Kerob D, Demessant AL, Amici JM. Wound Healing and Microbiome, An Unexpected Relationship. J Eur Acad Dermatol Venereol 2023; 37: 7-15.
18- Cheng S, Gu Z, Zhou L, Hao M, An H, Song K, et al. Recent Progress in Intelligent Wearable Sensors for Health Monitoring and Wound Healing Based on Biofluids. Front Bioeng Biotechnol 2021; 9: 765987.
19- Mohamed Salleh NAB, Tanaka Y, Sutarlie L, Su X. Detecting Bacterial Infections in Wounds: A Review of Biosensors and Wearable Sensors in Comparison with Conventional Laboratory Methods. Analyst 2022; 147(9): 1756-76.
20- Farahani M, Shafiee A. Wound Healing: From Passive to Smart Dressings. Adv Healthc Mater 2021; 10(16): 2100477.
21- Chamanga ET. Clinical Management of Non-Healing Wounds. Nurs Stand 2018; 32(29): 48-62.
22- O'Callaghan S, Galvin P, O'Mahony C, Moore Z, Derwin R. ‘Smart’wound Dressings for Advanced Wound Care: A Review. J Wound Care 2020; 29(7): 394-406.
23- Rawal V, Dhamija A, Gupta S. Recent advancements in wearable bio-sensor applications. Int. J. Sci. Res. Eng. Technol. 2012 Aug;1(5):154-9.
24- Dargaville TR, Farrugia BL, Broadbent JA, Pace S, Upton Z, Voelcker NH. Sensors and Imaging for Wound Healing: A Review. Biosens Bioelectron 2013; 41: 30-42.
25- Derakhshandeh H, Kashaf SS, Aghabaglou F, Ghanavati IO, Tamayol A. Smart Bandages: The Future of Wound Care. Trends biotechnol 2018; 36(12): 1259-74.
26- Li H, Li B, Lv D, Li W, Lu Y, Luo G. Biomaterials Releasing Drug Responsively to Promote Wound Healing Via Regulation of Pathological Microenvironment. Adv Drug Deliv Rev 2023: 114778.
27- Su L, Jia Y, Fu L, Guo K, Xie S. The Emerging Progress on Wound Dressings and their Application in Clinic Wound Management. Heliyon 2023; 9(12): e22520.
28- Sharifuzzaman M, Chhetry A, Zahed MA, Yoon SH, Park CI, Zhang S, et al. Smart Bandage with Integrated Multifunctional Sensors Based on Mxene-Functionalized Porous Graphene Scaffold for Chronic Wound Care Management. Biosens Bioelectron 2020; 169: 112637.
29- Liu X, Tian S, Xu S, Lu W, Zhong C, Long Y, Ma Y, Yang K, Zhang L, Yang J. A Pressure-Resistant Zwitterionic Skin Sensor for Domestic Real-Time Monitoring and Pro-Healing of Pressure Injury. Biosens Bioelectron 2022; 214: 114528.
30- Li X, Lu Y, Hu Y. A wireless and battery-free DNA hydrogel biosensor for wound infection monitoring. Matter 2022; 5(8): 2473-5.
31- Roy S, Bisaria K, Nagabooshanam S, Selvam A, Chakrabarti S, Wadhwa S, et al. An Electroanalytical Paper-Based Wound Dressing Using ZIF-67/C 3 N 4 Nanocomposite Towards the Monitoring of Staphylococcus Aureus in Diabetic Foot Ulcer. IEEE Sensors Journal 2020; 21(2): 1215-21.
32- Gao Y, Nguyen DT, Yeo T, Lim SB, Tan WX, Madden LE, et al. A Flexible Multiplexed Immunosensor for Point-Of-Care in Situ Wound Monitoring. Science Advances 2021; 7(21): eabg9614.
33- Yang M, Choy KL. A Nature-Derived, Flexible and Three-Dimensional (3D) Nano-Composite for Chronic Wounds Ph Monitoring. Materials Letters 2021; 288: 129335.
34- World Health Organization. 2019 antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline. World Health Organization; 2020 Feb 20.
35- Coates AR, Halls G, Hu Y. Novel Classes of Antibiotics or More of the Same? Br J Pharmacol 2011; 163(1): 184-94.
36- Zhong Y, Xiao H, Seidi F, Jin Y. Natural Polymer-Based Antimicrobial Hydrogels Without Synthetic Antibiotics as Wound Dressings. Biomacromol 2020; 21(8): 2983-3006.
37- Guglielmi P, Pontecorvi V, Rotondi G. Natural Compounds and Extracts as Novel Antimicrobial Agents. Expert Opin Ther Pat 2020; 30(12): 949-62.
38- Sharifiaghdam M, Shaabani E, Asghari F, Faridi‐Majidi R. Chitosan Coated Metallic Nanoparticles with Stability, Antioxidant, And Antibacterial Properties: Potential for Wound Healing Application. Journal of Applied Polymer Science 2022; 139(10): 51766.
39- Amini SM. Preparation of Antimicrobial Metallic Nanoparticles with Bioactive Compounds. Materials Science and Engineering: C 2019; 103: 109809.
40- Blanco-Fernandez B, Castano O, Mateos-Timoneda MÁ, Engel E, Pérez-Amodio S. Nanotechnology Approaches in Chronic Wound Healing. Adv wound Care 2021; 10(5): 234-56.
41- Yildirimer L, Thanh NT, Loizidou M, Seifalian AM. Toxicology and Clinical Potential of Nanoparticles. Nano today 2011; 6(6): 585-607.
42- Sarhan WA, Azzazy HM, El-Sherbiny IM. Honey/Chitosan Nanofiber Wound Dressing Enriched With Allium Sativum And Cleome Droserifolia: Enhanced Antimicrobial And Wound Healing Activity. ACS Appl Mater Interfaces 2016; 8(10): 6379-90.
43- Wang L, Hu C, Shao L. The Antimicrobial Activity of Nanoparticles: Present Situation and Prospects for the Future. Int J Nanomedicine 2017; 12: 1227-49.
44- Jo DH, Kim JH, Lee TG, Kim JH. Size, Surface Charge, And Shape Determine Therapeutic Effects of Nanoparticles on Brain and Retinal Diseases. Nanomedicine 2015; 11(7): 1603-11.
45- Bruna T, Maldonado-Bravo F, Jara P, Caro N. Silver Nanoparticles and their Antibacterial Applications. Int J Mol Sci 2021; 22(13): 7202.
46- Gu H, Ho PL, Tong E, Wang L, Xu B. Presenting Vancomycin on Nanoparticles to Enhance Antimicrobial Activities. Nano letters 2003; 3(9): 1261-3.
47- Rajendran NK, Kumar SS, Houreld NN, Abrahamse H. A Review on Nanoparticle Based Treatment for Wound Healing. Journal of Drug Delivery Science and Technology 2018; 44: 421-30.
48- Tian EK, Wang Y, Ren R, Zheng W, Liao W. Gold Nanoparticle: Recent Progress on Its Antibacterial Applications and Mechanisms. Journal of Nanomaterials 2021; 2021: 1-8.
49- Gu X, Xu Z, Gu L, Xu H, Han F, Chen B, Pan X. Preparation and Antibacterial Properties of Gold Nanoparticles: A Review. Environmental Chemistry Letters 2021; 19: 167-87.
50- Zamindar N, Anari ES, Bathaei SS, Shirani N, Tabatabaei L, Mahdavi-Asl N, et al. Application of Copper Nano Particles in Antimicrobial Packaging: A Mini Review. Acta Sci Nutr Health 2020; 4(5): 14-8.
51- Mary G, Bajpai SK, Chand N. Copper (II) Ions and Copper Nanoparticles‐Loaded Chemically Modified Cotton Cellulose Fibers with Fair Antibacterial Properties. Journal of Applied Polymer Science 2009; 113(2): 757-66.
52- Crisan MC, Teodora M, Lucian M. Copper Nanoparticles: Synthesis and Characterization, Physiology, Toxicity and Antimicrobial Applications. Appl Sci 2021; 12(1): 141.
53- Alangari A, Alqahtani MS, Mateen A, Kalam MA, Alshememry A, Ali R, et al. Iron Oxide Nanoparticles: Preparation, Characterization, and Assessment of Antimicrobial and Anticancer Activity. Adsorption Science & Technology 2022; 2022: 1562051.
54- Gudkov SV, Burmistrov DE, Serov DA, Rebezov MB, Semenova AA, Lisitsyn AB. Do Iron Oxide Nanoparticles Have Significant Antibacterial Properties? Antibiotics 2021; 10(7): 884.
55- Correa MG, Martínez FB, Vidal CP, Streitt C, Escrig J, de Dicastillo CL. Antimicrobial Metal-Based Nanoparticles: A Review on their Synthesis, Types and Antimicrobial Action. Beilstein J Nanotechnol 2020; 11(1): 1450-69.
56- Gabrielyan L, Hakobyan L, Hovhannisyan A, Trchounian A. Effects of Iron Oxide (Fe3O4) Nanoparticles on Escherichia Coli Antibiotic‐Resistant Strains. J Appl Microbiol 2019; 126(4): 1108-16.
57- Gabrielyan L, Badalyan H, Gevorgyan V, Trchounian A. Comparable Antibacterial Effects and Action Mechanisms of Silver and Iron Oxide Nanoparticles on Escherichia Coli and Salmonella Typhimurium. Sci Rep 2020; 10(1): 13145.
58- Almaamuri AM, Ahmed GS, Shari FH, Al-Dhalimy AM, Almashhadani HA, Kadhim MM. The Wound Healing Effect of the Green Synthesized Iron Oxide Nanoparticles: A Study on Mice. Research Journal of Pharmacy and Technology 2023; 16(4): 1569-73.
59- Egan TJ, Barthakur SR, Aisen P. Catalysis of the Haber-Weiss Reaction by Iron-Diethylenetriamine Pentaacetate. J Inorg Biochem 1992; 48(4): 241-9.
60- Wu H, Yin JJ, Wamer WG, Zeng M, Lo YM. Reactive Oxygen Species-Related Activities of Nano-Iron Metal and Nano-Iron Oxides. J J Food Drug Anal 2014; 22(1): 86-94.
61- Yu B, Wang Z, Almutairi L, Huang S, Kim MH. Harnessing Iron-Oxide Nanoparticles Towards the Improved Bactericidal Activity of Macrophage Against Staphylococcus Aureus. Nanomedicine: Nanotechnology, Biology and Medicine 2020; 24: 102158.
62- Balalakshitha M, Kolanjinathan K, Aishwarya T, Vinothini B. A Review on Diabetic Wound Infection and Its Treatment Using Zinc Oxide Nanoparticle Synthesized by Green Chemistry Techniques. Bulletin of Environment, Pharmacology and Life Sciences. 2021; 10: 1-22.
63- Gharpure S, Ankamwar B. Synthesis and Antimicrobial Properties of Zinc Oxide Nanoparticles. J Nanosci Nanotechnol 2020; 20(10): 5977-96.
64- Ifijen IH, Maliki M, Anegbe B. Synthesis, Photocatalytic Degradation and Antibacterial Properties of Selenium or Silver Doped Zinc Oxide Nanoparticles: A Detailed Review. OpenNano 2022; 8: 100082.
65- Siddiqi KS, ur Rahman A, Tajuddin N, Husen A. Properties of Zinc Oxide Nanoparticles and their Activity Against Microbes. Nanoscale Research Letters 2018; 13: 141.
66- Tamimi N, Mohammadi Nafchi A, Hashemi‐Moghaddam H, Baghaie H. The Effects of Nano‐Zinc Oxide Morphology on Functional and Antibacterial Properties of Tapioca Starch Bionanocomposite. Food Sci Nutr 2021; 9(8): 4497-508.
67- Ahmad W, Jaiswal KK, Soni S. Green Synthesis of Titanium Dioxide (Tio2) Nanoparticles by Using Mentha Arvensis Leaves Extract and Its Antimicrobial Properties. Inorganic and Nano-Metal Chemistry 2020; 50(10): 1032-8.
68- Seisenbaeva GA, Fromell K, Vinogradov VV, Terekhov AN, Pakhomov AV, Nilsson B, et al. Dispersion of Tio2 Nanoparticles Improves Burn Wound Healing and Tissue Regeneration Through Specific Interaction with Blood Serum Proteins. Sci Rep 2017; 7(1): 15448.
69- Ziental D, Czarczynska-Goslinska B, Mlynarczyk DT, Glowacka-Sobotta A, Stanisz B, Goslinski T, et al. Titanium Dioxide Nanoparticles: Prospects and Applications in Medicine. Nanomaterials 2020; 10(2): 387.
70- Younis AB, Haddad Y, Kosaristanova L, Smerkova K. Titanium dioxide nanoparticles: Recent progress in antimicrobial applications. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 2023; 15(3): e1860.
71- Pavlović VP, Vujančević JD, Mašković P, Ćirković J, Papan JM, Kosanović D, et al. Structure and Enhanced Antimicrobial Activity of Mechanically Activated Nano Tio2. Journal of the American Ceramic Society 2019; 102(12): 7735-45.
72- Parkinson LG, Giles NL, Adcroft KF, Fear MW, Wood FM, Poinern GE. The Potential of Nanoporous Anodic Aluminium Oxide Membranes to Influence Skin Wound Repair. Tissue Engineering Part A 2009; 15(12): 3753-63.
73- Rahmanpour A, Farahpour MR, Shapouri R, Jafarirad S, Rahimi P. Synthesis and Characterization of Alumina-Based Nanocomposites of Tio2/Al2O3/Chitosan with Antibacterial Properties Accelarate Healing of Infected Excision Wounds. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2022; 644: 128839.
2- Ehtesabi H, Kalji SO, Movsesian L. Smartphone-Based Wound Dressings: A Mini-Review. Heliyon 2022; 8(7): e09876.
3- Rani Raju N, Silina E, Stupin V, Manturova N, Chidambaram SB, Achar RR. Multifunctional and Smart Wound Dressings—A Review on Recent Research Advancements in Skin Regenerative Medicine. Pharmaceutics 2022; 14(8): 1574.
4- Mirani B, Hadisi Z, Pagan E, Dabiri SM, van Rijt A, Almutairi L, et al. Smart Dual‐Sensor Wound Dressing for Monitoring Cutaneous Wounds. Adv Healthc Mater 2023; 12(18): 2203233.
5- Leal-Junior A, Guo J, Min R, Fernandes AJ, Frizera A, Marques C. Photonic Smart Bandage for Wound Healing Assessment. Photonics Research 2021; 9(3): 272-80.
6- Yousefian F, Hesari R, Jensen T, Obagi S, Rgeai A, Damiani G, Bunick CG, Grada A. Antimicrobial Wound Dressings: A Concise Review for Clinicians. Antibiotics 2023; 12(9): 1434.
7- Liang Y, Liang Y, Zhang H, Guo B. Antibacterial Biomaterials for Skin Wound Dressing. Asian Journal of Pharmaceutical Sciences 2022; 17(3): 353-84.
8- Preem L, Kogermann K. Electrospun antimicrobial wound dressings: Novel strategies to fight against wound infections. Chronic Wounds, Wound Dressings and Wound Healing. 2021:213-53.
9- Zhang Y, Yu J, Zhang H, Li Y, Wang L. Nanofibrous Dressing: Potential Alternative for Fighting Against Antibiotic‐Resistance Wound Infections. Journal of Applied Polymer Science 2022; 139(20): 52178.
10- Zheng L, Li S, Luo J, Wang X. Latest Advances on Bacterial Cellulose-Based Antibacterial Materials as Wound Dressings. Front Bioen Biotech 2020; 8: 593768.
11- Pang Q, Jiang Z, Wu K, Hou R, Zhu Y. Nanomaterials-Based Wound Dressing for Advanced Management of Infected Wound. Antibiotics 2023; 12(2): 351.
12- Yudaev P, Mezhuev Y, Chistyakov E. Nanoparticle-Containing Wound Dressing: Antimicrobial And Healing Effects. Gels 2022; 8(6): 329.
13- Xu C, Akakuru OU, Ma X, Zheng J, Zheng J, Wu A. Nanoparticle-Based Wound Dressing: Recent Progress in The Detection and Therapy of Bacterial Infections. Bioconjugate Chemistry 2020; 31(7): 1708-23.
14- Jiang L, Loo SC. Intelligent nanoparticle-based dressings for bacterial wound infections. ACS Applied Bio Materials 2021; 4(5): 3849-62.
15- Pormohammad A, Monych NK, Ghosh S, Turner DL, Turner RJ. Nanomaterials in wound healing and infection control. Antibiotics 2021; 10(5): 473.
16- Visha MG, Karunagaran M. A Review on Wound Healing. International Journal of Clinicopathological Correlation 2019; 3(2): 50.
17- Canchy L, Kerob D, Demessant AL, Amici JM. Wound Healing and Microbiome, An Unexpected Relationship. J Eur Acad Dermatol Venereol 2023; 37: 7-15.
18- Cheng S, Gu Z, Zhou L, Hao M, An H, Song K, et al. Recent Progress in Intelligent Wearable Sensors for Health Monitoring and Wound Healing Based on Biofluids. Front Bioeng Biotechnol 2021; 9: 765987.
19- Mohamed Salleh NAB, Tanaka Y, Sutarlie L, Su X. Detecting Bacterial Infections in Wounds: A Review of Biosensors and Wearable Sensors in Comparison with Conventional Laboratory Methods. Analyst 2022; 147(9): 1756-76.
20- Farahani M, Shafiee A. Wound Healing: From Passive to Smart Dressings. Adv Healthc Mater 2021; 10(16): 2100477.
21- Chamanga ET. Clinical Management of Non-Healing Wounds. Nurs Stand 2018; 32(29): 48-62.
22- O'Callaghan S, Galvin P, O'Mahony C, Moore Z, Derwin R. ‘Smart’wound Dressings for Advanced Wound Care: A Review. J Wound Care 2020; 29(7): 394-406.
23- Rawal V, Dhamija A, Gupta S. Recent advancements in wearable bio-sensor applications. Int. J. Sci. Res. Eng. Technol. 2012 Aug;1(5):154-9.
24- Dargaville TR, Farrugia BL, Broadbent JA, Pace S, Upton Z, Voelcker NH. Sensors and Imaging for Wound Healing: A Review. Biosens Bioelectron 2013; 41: 30-42.
25- Derakhshandeh H, Kashaf SS, Aghabaglou F, Ghanavati IO, Tamayol A. Smart Bandages: The Future of Wound Care. Trends biotechnol 2018; 36(12): 1259-74.
26- Li H, Li B, Lv D, Li W, Lu Y, Luo G. Biomaterials Releasing Drug Responsively to Promote Wound Healing Via Regulation of Pathological Microenvironment. Adv Drug Deliv Rev 2023: 114778.
27- Su L, Jia Y, Fu L, Guo K, Xie S. The Emerging Progress on Wound Dressings and their Application in Clinic Wound Management. Heliyon 2023; 9(12): e22520.
28- Sharifuzzaman M, Chhetry A, Zahed MA, Yoon SH, Park CI, Zhang S, et al. Smart Bandage with Integrated Multifunctional Sensors Based on Mxene-Functionalized Porous Graphene Scaffold for Chronic Wound Care Management. Biosens Bioelectron 2020; 169: 112637.
29- Liu X, Tian S, Xu S, Lu W, Zhong C, Long Y, Ma Y, Yang K, Zhang L, Yang J. A Pressure-Resistant Zwitterionic Skin Sensor for Domestic Real-Time Monitoring and Pro-Healing of Pressure Injury. Biosens Bioelectron 2022; 214: 114528.
30- Li X, Lu Y, Hu Y. A wireless and battery-free DNA hydrogel biosensor for wound infection monitoring. Matter 2022; 5(8): 2473-5.
31- Roy S, Bisaria K, Nagabooshanam S, Selvam A, Chakrabarti S, Wadhwa S, et al. An Electroanalytical Paper-Based Wound Dressing Using ZIF-67/C 3 N 4 Nanocomposite Towards the Monitoring of Staphylococcus Aureus in Diabetic Foot Ulcer. IEEE Sensors Journal 2020; 21(2): 1215-21.
32- Gao Y, Nguyen DT, Yeo T, Lim SB, Tan WX, Madden LE, et al. A Flexible Multiplexed Immunosensor for Point-Of-Care in Situ Wound Monitoring. Science Advances 2021; 7(21): eabg9614.
33- Yang M, Choy KL. A Nature-Derived, Flexible and Three-Dimensional (3D) Nano-Composite for Chronic Wounds Ph Monitoring. Materials Letters 2021; 288: 129335.
34- World Health Organization. 2019 antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline. World Health Organization; 2020 Feb 20.
35- Coates AR, Halls G, Hu Y. Novel Classes of Antibiotics or More of the Same? Br J Pharmacol 2011; 163(1): 184-94.
36- Zhong Y, Xiao H, Seidi F, Jin Y. Natural Polymer-Based Antimicrobial Hydrogels Without Synthetic Antibiotics as Wound Dressings. Biomacromol 2020; 21(8): 2983-3006.
37- Guglielmi P, Pontecorvi V, Rotondi G. Natural Compounds and Extracts as Novel Antimicrobial Agents. Expert Opin Ther Pat 2020; 30(12): 949-62.
38- Sharifiaghdam M, Shaabani E, Asghari F, Faridi‐Majidi R. Chitosan Coated Metallic Nanoparticles with Stability, Antioxidant, And Antibacterial Properties: Potential for Wound Healing Application. Journal of Applied Polymer Science 2022; 139(10): 51766.
39- Amini SM. Preparation of Antimicrobial Metallic Nanoparticles with Bioactive Compounds. Materials Science and Engineering: C 2019; 103: 109809.
40- Blanco-Fernandez B, Castano O, Mateos-Timoneda MÁ, Engel E, Pérez-Amodio S. Nanotechnology Approaches in Chronic Wound Healing. Adv wound Care 2021; 10(5): 234-56.
41- Yildirimer L, Thanh NT, Loizidou M, Seifalian AM. Toxicology and Clinical Potential of Nanoparticles. Nano today 2011; 6(6): 585-607.
42- Sarhan WA, Azzazy HM, El-Sherbiny IM. Honey/Chitosan Nanofiber Wound Dressing Enriched With Allium Sativum And Cleome Droserifolia: Enhanced Antimicrobial And Wound Healing Activity. ACS Appl Mater Interfaces 2016; 8(10): 6379-90.
43- Wang L, Hu C, Shao L. The Antimicrobial Activity of Nanoparticles: Present Situation and Prospects for the Future. Int J Nanomedicine 2017; 12: 1227-49.
44- Jo DH, Kim JH, Lee TG, Kim JH. Size, Surface Charge, And Shape Determine Therapeutic Effects of Nanoparticles on Brain and Retinal Diseases. Nanomedicine 2015; 11(7): 1603-11.
45- Bruna T, Maldonado-Bravo F, Jara P, Caro N. Silver Nanoparticles and their Antibacterial Applications. Int J Mol Sci 2021; 22(13): 7202.
46- Gu H, Ho PL, Tong E, Wang L, Xu B. Presenting Vancomycin on Nanoparticles to Enhance Antimicrobial Activities. Nano letters 2003; 3(9): 1261-3.
47- Rajendran NK, Kumar SS, Houreld NN, Abrahamse H. A Review on Nanoparticle Based Treatment for Wound Healing. Journal of Drug Delivery Science and Technology 2018; 44: 421-30.
48- Tian EK, Wang Y, Ren R, Zheng W, Liao W. Gold Nanoparticle: Recent Progress on Its Antibacterial Applications and Mechanisms. Journal of Nanomaterials 2021; 2021: 1-8.
49- Gu X, Xu Z, Gu L, Xu H, Han F, Chen B, Pan X. Preparation and Antibacterial Properties of Gold Nanoparticles: A Review. Environmental Chemistry Letters 2021; 19: 167-87.
50- Zamindar N, Anari ES, Bathaei SS, Shirani N, Tabatabaei L, Mahdavi-Asl N, et al. Application of Copper Nano Particles in Antimicrobial Packaging: A Mini Review. Acta Sci Nutr Health 2020; 4(5): 14-8.
51- Mary G, Bajpai SK, Chand N. Copper (II) Ions and Copper Nanoparticles‐Loaded Chemically Modified Cotton Cellulose Fibers with Fair Antibacterial Properties. Journal of Applied Polymer Science 2009; 113(2): 757-66.
52- Crisan MC, Teodora M, Lucian M. Copper Nanoparticles: Synthesis and Characterization, Physiology, Toxicity and Antimicrobial Applications. Appl Sci 2021; 12(1): 141.
53- Alangari A, Alqahtani MS, Mateen A, Kalam MA, Alshememry A, Ali R, et al. Iron Oxide Nanoparticles: Preparation, Characterization, and Assessment of Antimicrobial and Anticancer Activity. Adsorption Science & Technology 2022; 2022: 1562051.
54- Gudkov SV, Burmistrov DE, Serov DA, Rebezov MB, Semenova AA, Lisitsyn AB. Do Iron Oxide Nanoparticles Have Significant Antibacterial Properties? Antibiotics 2021; 10(7): 884.
55- Correa MG, Martínez FB, Vidal CP, Streitt C, Escrig J, de Dicastillo CL. Antimicrobial Metal-Based Nanoparticles: A Review on their Synthesis, Types and Antimicrobial Action. Beilstein J Nanotechnol 2020; 11(1): 1450-69.
56- Gabrielyan L, Hakobyan L, Hovhannisyan A, Trchounian A. Effects of Iron Oxide (Fe3O4) Nanoparticles on Escherichia Coli Antibiotic‐Resistant Strains. J Appl Microbiol 2019; 126(4): 1108-16.
57- Gabrielyan L, Badalyan H, Gevorgyan V, Trchounian A. Comparable Antibacterial Effects and Action Mechanisms of Silver and Iron Oxide Nanoparticles on Escherichia Coli and Salmonella Typhimurium. Sci Rep 2020; 10(1): 13145.
58- Almaamuri AM, Ahmed GS, Shari FH, Al-Dhalimy AM, Almashhadani HA, Kadhim MM. The Wound Healing Effect of the Green Synthesized Iron Oxide Nanoparticles: A Study on Mice. Research Journal of Pharmacy and Technology 2023; 16(4): 1569-73.
59- Egan TJ, Barthakur SR, Aisen P. Catalysis of the Haber-Weiss Reaction by Iron-Diethylenetriamine Pentaacetate. J Inorg Biochem 1992; 48(4): 241-9.
60- Wu H, Yin JJ, Wamer WG, Zeng M, Lo YM. Reactive Oxygen Species-Related Activities of Nano-Iron Metal and Nano-Iron Oxides. J J Food Drug Anal 2014; 22(1): 86-94.
61- Yu B, Wang Z, Almutairi L, Huang S, Kim MH. Harnessing Iron-Oxide Nanoparticles Towards the Improved Bactericidal Activity of Macrophage Against Staphylococcus Aureus. Nanomedicine: Nanotechnology, Biology and Medicine 2020; 24: 102158.
62- Balalakshitha M, Kolanjinathan K, Aishwarya T, Vinothini B. A Review on Diabetic Wound Infection and Its Treatment Using Zinc Oxide Nanoparticle Synthesized by Green Chemistry Techniques. Bulletin of Environment, Pharmacology and Life Sciences. 2021; 10: 1-22.
63- Gharpure S, Ankamwar B. Synthesis and Antimicrobial Properties of Zinc Oxide Nanoparticles. J Nanosci Nanotechnol 2020; 20(10): 5977-96.
64- Ifijen IH, Maliki M, Anegbe B. Synthesis, Photocatalytic Degradation and Antibacterial Properties of Selenium or Silver Doped Zinc Oxide Nanoparticles: A Detailed Review. OpenNano 2022; 8: 100082.
65- Siddiqi KS, ur Rahman A, Tajuddin N, Husen A. Properties of Zinc Oxide Nanoparticles and their Activity Against Microbes. Nanoscale Research Letters 2018; 13: 141.
66- Tamimi N, Mohammadi Nafchi A, Hashemi‐Moghaddam H, Baghaie H. The Effects of Nano‐Zinc Oxide Morphology on Functional and Antibacterial Properties of Tapioca Starch Bionanocomposite. Food Sci Nutr 2021; 9(8): 4497-508.
67- Ahmad W, Jaiswal KK, Soni S. Green Synthesis of Titanium Dioxide (Tio2) Nanoparticles by Using Mentha Arvensis Leaves Extract and Its Antimicrobial Properties. Inorganic and Nano-Metal Chemistry 2020; 50(10): 1032-8.
68- Seisenbaeva GA, Fromell K, Vinogradov VV, Terekhov AN, Pakhomov AV, Nilsson B, et al. Dispersion of Tio2 Nanoparticles Improves Burn Wound Healing and Tissue Regeneration Through Specific Interaction with Blood Serum Proteins. Sci Rep 2017; 7(1): 15448.
69- Ziental D, Czarczynska-Goslinska B, Mlynarczyk DT, Glowacka-Sobotta A, Stanisz B, Goslinski T, et al. Titanium Dioxide Nanoparticles: Prospects and Applications in Medicine. Nanomaterials 2020; 10(2): 387.
70- Younis AB, Haddad Y, Kosaristanova L, Smerkova K. Titanium dioxide nanoparticles: Recent progress in antimicrobial applications. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 2023; 15(3): e1860.
71- Pavlović VP, Vujančević JD, Mašković P, Ćirković J, Papan JM, Kosanović D, et al. Structure and Enhanced Antimicrobial Activity of Mechanically Activated Nano Tio2. Journal of the American Ceramic Society 2019; 102(12): 7735-45.
72- Parkinson LG, Giles NL, Adcroft KF, Fear MW, Wood FM, Poinern GE. The Potential of Nanoporous Anodic Aluminium Oxide Membranes to Influence Skin Wound Repair. Tissue Engineering Part A 2009; 15(12): 3753-63.
73- Rahmanpour A, Farahpour MR, Shapouri R, Jafarirad S, Rahimi P. Synthesis and Characterization of Alumina-Based Nanocomposites of Tio2/Al2O3/Chitosan with Antibacterial Properties Accelarate Healing of Infected Excision Wounds. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2022; 644: 128839.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







