دوره 32، شماره 8 - ( آبان 1403 )
جلد 32 شماره 8 صفحات 8140-8118 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nowruzi B, Beyranvand H. Studying the Antimicrobial Effects of Silver Nanoparticles Coated with Alginate Biosynthesized by Dulcicalothrix alborzica. JSSU 2024; 32 (8) :8118-8140
URL: http://jssu.ssu.ac.ir/article-1-6182-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6182-fa.html
نوروزی بهاره، بیرانوند حسن. مطالعه اثرات ضد میکروبی نانوذرات نقره پوشش دار شده با آلجینات بیوسنتز شده توسط Dulcicalothrix alborzica. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (8) :8118-8140
واژههای کلیدی: اثرات ضد میکروبی، نانوذرات نقره پوشش دار شده، آلجینات، Dulcicalothrix alborzica، پاتوژن های ماهی
متن کامل [PDF 2218 kb]
(410 دریافت)
| چکیده (HTML) (1274 مشاهده)
متن کامل: (967 مشاهده)
مقدمه
رشد، تکامل و سلامت بدن انسان تحت تأثیر غذایی است که میخورد در حقیقت رژیم غذایی به عنوان عامل محیطی موثر برای رشد بدن انسان در نظر گرفته میشود. صید و پرورش ماهی یکی از مهمترین منابع غذایی در سراسر جهان است و از نظر اقتصادی نیز اهمیت زیادی دارد. با اینحال، صنعت آبزیپروری با چالشهای متعددی از جمله بیماریهای عفونی ماهی مواجه است که میتواند منجر به مرگ و میر گسترده ماهیها و خسارات اقتصادی قابلتوجهی شود. بیماریهای عفونی ماهی را میتوان به سه دسته کلی باکتریایی (استرپتوکوکوس، آئروموناس هیدروفیلا، سودوموناس و ویبریو که شایعترین آنها هستند)، قارچی و انگلی تقسیمبندی کرد (1). کنترل سنتی بیماریهای ماهی عمدتاً به استفاده از آنتیبیوتیکها متکی است. با اینحال، نگرانیهای فزایندهای در مورد مقاومت ضد میکروبی در برابر آنتیبیوتیکها و اثرات مخرب زیستمحیطی آنها وجود دارد. در مقابل، نانوذرات نقره سنتز شده با سیانوباکتریها جایگزینی امیدوارکننده و سازگار با محیط زیست برای آنتیبیوتیکها ارائه میدهند. مطالعات متعددی نشان دادهاند که نانوذرات نقره سنتز شده با سیانوباکتریها فعالیت ضد باکتریایی قوی در برابر طیف گستردهای از پاتوژنهای ماهی، از جمله باکتریهای گرم مثبت و گرم منفی دارند. به عنوان مثال، Ameen و همکاران گزارش دادند که نانوذرات نقره سنتز شده با Spirulina platensis فعالیت ضد باکتریایی قوی در برابر Aeromonas hydrophila، Vibrio parahaemolyticus و Streptococcus iniae نشان دادند (2) علاوه بر این،Younis و همکاران نشان دادند که نانوذرات نقره سنتز شده با Phormidium cyanobacterium علاوه بر فعالیت ضد میکروبی، خواص ضد التهابی و آنتیاکسیدانی نیز نشان دادند که میتواند بهطور بالقوه به بهبود سلامت ماهیان آسیبدیده از بیماریهای عفونی کمک کند (3). حفظ ماهی یک جنبه فرآوری بسیار مهم در شیلات است. بهطور معمول، مزارع پرورش ماهی یا سایر سایتهای صید ماهی در فواصل زیادی از نقاط خردهفروشی قرار دارند و فراوانی تجزیه ماهی و عدم قطعیت فروش آنها در بازار وجود دارد. هنگامیکه ماهی به مقدار زیاد، بیشتر از نیاز بازار برداشت میشود، نگهداری و فرآوری آنها برای کاربردهای آینده آنها ضروری میشود. بنابراین نگهداری و فرآوری اجزای آبزیان ضروری هستند. این روشها با این هدف انجام میشوند که ماهیها برای مدت طولانیتر، با حداقل از دست دادن ویژگیهای کیفی ضروری، ارزش غذایی و قابلیت هضم گوشت آنها تازه و ایمن باقیبمانند. برای جلوگیری از فاسد شدن ماهی و افزایش ماندگاری غذاهای دریایی، تکنیکهای نگهداری زیادی مورد نیاز است. این تکنیکها برای مهار رشد، تکثیر باکتریهای فاسد و تغییرات متابولیکی که منجر به از دست دادن کیفیت ماهی میشود، طراحی شدهاند (4). در صنایع آبزیپروری و غذاهای دریایی، فناوری نانو پتانسیل گستردهای برای کاربرد دارد. از جمله، فناوری میتواند بهطور موثر از بیماریها و عوامل بیماریزا پیشگیری کند و مزایای آبزیپروری را چند برابر کند. برخی از کاربردهای نانوتکنولوژی برای سلامت ماهی، سطوح ضد باکتری یا ضد قارچی هستند که با استفاده از نانوساختارهای متخلخل و نانوحسگرها در سیستمهای آبزیپروری برای تشخیص عوامل بیماریزا در آب و تأمین محصولات نانو دامپزشکی و داروهای ماهی از طریق غذاهای ماهی توسعه یافتهاند (5). کنترل ویروس، باکتری و قارچ مستلزم تشخیص زودهنگام است و از بین بردن پاتوژنها میتواند از طریق نانومواد امکانپذیر باشد، زیرا آنها در مقیاسی مشابه ویروس یا بیماری آلوده کننده ذرات عمل میکنند (6). با اینحال، نگرانیهای مرتبط با ایمنی نانو هنوز وجود دارد و باید قبل از اجرای کامل آنها برطرف شود. اثرات سمی نانوذرات به عوامل مختلفی از جمله تعامل پیچیده بین ویژگیهای ذرات مانند قطر، فرم، بار سطحی، غلظت، زمان قرار گرفتن در معرض، ماهیت نانوذرات، ترکیب محیط، مسیر تزریق ذرات و سیستم ایمنی گونههای هدف بستگی دارد. بنابراین، جالب است که بررسی کنیم که چگونه با کمک تکنولوژی نانو میتواند بر مشکلات فساد آبزیان غلبه کرد (7). بیوسنتز نانو ذرات از روشهای شیمیایی، فیزیکی و بیولوژیکی و همچنین از طریق مسیرهای درون سلولی و خارج سلولی توسط انواعی از میکروارگانیسمها انجام میشود. در حال حاضر، بیشتر روشهای سنتز شیمیایی نانو ذرات به استفاده از مواد احیا کننده سمی مثل بوروهیدرید سدیم و حلالهای آلی مضر متکی هستند. این مواد شیمیایی خطرات بالقوه بیولوژیکی و محیطی را نشان میدهند. بنابراین، امروزه دانشمندان را بر آن داشت تا از رویکردهای شیمیایی سبز، روشهای زیست سازگار، تمیز، دوستدار محیط زیست و ایمن برای سنتز نانو مواد استفاده کنند (8). بیوسنتز نانوذرات با استفاده از گیاهان به مساحت وسیع و دورههای رشد نسبتاً طولانی نیاز دارد که در نهایت امکانسنجی فرآیند سنتز را محدود میکند. در حال حاضر، در میان رویکردهای شیمی سبز، سیانوباکترها، یکی از بزرگترین، متنوعترین و مهمترین گروههای باکتریهای فوتواتوتروف روی زمین به دلیل سرعت رشد بالا و بهرهوری زیست توده، توجه ویژهای را برای سنتز نانومواد به خود جلب کردهاند (9). در سالهای اخیر، نانو ذرات نقره با افزایش تقاضا به دلیل طیف وسیعی از کاربردهای آن در الکترونیک، نانوپزشکی، انرژی، حسگرهای زیستی، کاتالیزور و فعالیتهای ضد باکتریایی و ضد قارچی در کانون توجه قرار گرفتهاند (10). همچنین، در مقایسه با روشهای سنتی، روشهای سبز امکان ساخت اشکال مختلف نانوذرات را فراهم میکنند که با ویژگیهای منحصربهفرد در شرایط فشار و دمای ملایم متمایز میشوند. در بین روشهای بیولوژیکی، سنتز نانوذرات نقره توسط باکتریها به دلیل پایداری، زیست سازگاری، مقرونبهصرفه بودن، غیرسمی بودن آن در حال افزایش است و به راحتی میتوان از آن برای تولید انبوه استفاده کرد. تعدادی از گونههای سیانوباکتری متعلق به راسته Nostocales، Oscillatoriales و Synchococcales در مطالعات مختلف برای سنتز نانو ذرات نقره استفاده شدهاند (9). توسعه سریع نانوتکنولوژی و نانومواد منجر به نیاز به اصلاح سطح نانوذرات برای کاربردهای مختلف شده است. نانو ذرات به دلیل تمایلشان به متراکم شدن بر اساس نیروی واندروالس، نیازمند پایدار شدن در مایع حامل میباشند. برای این منظور، نانو ذرات توسط یک سورفیکانت یا پلیمر پوشش داده میشوند. پوشش دار کردن نانو ذرات با گروههای آمینه، سیلیس، سورفکتانتهای پلیمری یا ترکیبات آلی دیگر معمولاً به منظور دسیتیابی به خواص فیزیکی و شیمیایی بهتر ارائه شده است. علاوه براین بسیاری از گروههای عاملی پلیمرهای سطحی میتوانند برای افزایش کاربرد به منظور دستیابی به ویژگیهای مختلف مورد استفاده قرار بگیرند (11).
نانو ذرات نقره به دلیل ویژگیهای منحصربهفرد خود، از جمله سطح ویژه بالا و پایداری، و فعالیت ضد میکروبی قوی، به عنوان مواد ضد میکروبی در حوزههای مختلف، از جمله صنایع آبزیپروری، مورد توجه قرار گرفتهاند. پوششدارسازی نانوذرات نقره مزایای متعددی از جمله بهبود پایداری، کاهش سمیت و افزایش زیست سازگاری نانوذرات را به همراه دارد. نانو ذرات نقره در مقابل بسیاری از پاتوژنها فعالیت ضد میکروبی قابلتوجهی نشان دادهاند و راهی کنترل کننده در درمان بسیاری از بیماریها هستند (12). برای پوششدار سازی نانوذرات، از طیف وسیعی از نانوکامپوزیتها و پلیساکاریدها استفاده میشود. انتخاب ماده پوششدهی به عوامل مختلفی از جمله خواص مورد نظر نانوذره، کاربرد نهایی و روشهای تولید بستگی دارد. علاوه بر کاربرد در بسیاری از روشهای زیستی، آلجینات و نانوکامپوزیتهای حاصل از آن به دلیل اثرات ضدمیکروبی، دارای کاربردهای پزشکی قابلتوجهی در مقابل بسیاری از میکروارگانیسمها هستند. پوششدار سازی نانوذرات با آلجینات، مسمومیت بسیار کمتری در مقایسه با سایر پلی ساکاریدهای طبیعی دیگر دارد و کاربردهای بسیار وسیعی در زیست پزشکی دارد (13). عصاره سیانوباکتری ها حاوی ترکیبات فعال زیستی مانند پروتئینها، لیپیدها، پلیساکاریدها، روغنها، ویتامینها، ترپنها، استرها، پلیفنلها، کاروتنوئیدها دارای خواص ضد باکتریایی، ضد قارچی، آنتیاکسیدانی، ضد سرطانی هستند که در توسعه داروهای جدید ضروری هستند. در این مطالعه، اثرات ضد میکروبی نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط سویه Dulcicalothrix alborzica که به عنوان گونه جدید اولین بار توسط نوروزی و شالگین در سال 2021 از آبهای روان از کوههای البرز جمعآوری و خالصسازی شده است، در مقابل پاتوژنهای ماهی مورد بررسی قرار گرفت (14).
روش بررسی
کشت سیانوباکتری Dulcicalothrix alborzica: سیانوباکتری Dulcicalothrix alborzica از مجموعه کشت سیانوباکتری¬های دانشگاه آزاد واحد علوم و تحقیقات Cyanobacteria culture collection (Ccc) جمع آوری، در محیط کشت BG-11 کشت داده شد. پس از اطمینان از خلوص و عاری بودن کشت از هرگونه آلودگی، آنها به ارلنهای کشت در اتاقک رشد منتقل شدند. شرایط کشت شامل شدت نور 40 تا 60 میکروموول فوتون/مترمربع/ثانیه و دمای 28 تا 30 درجه سانتیگراد بود (15).
.JPG)
شکل1: کشت سیانوباکتری Dulcicalothrix alborzica
بیوسنتز نانوذرات نقره
1: روش استفاده از بیومس تر
کشتهای فاز لگاریتمی سیانوباکتری Dulcicalothrix alborzica با سانتریفیوژ با دور 5000 به مدت 10 دقیقه در دمای C° 20 جدا شدند و 3 بار با آب مقطر استریل شسته شدند. سپس یک گرم از بیومس وزن مرطوب درون فلاکسهای 500 و 100 میلیلیتر از محلول آبی 1، 2 و 3 میلیمولار نیترات نقره، با 7= pH تلقیح شد. در نهایت مخلوط در دمای C¬° 25 به مدت 24 ساعت گرمخانهگذاری شدند. به عنوان شاهد از محیط کشت تازه BG11 با افزودن نیترات نقره استفاده شد. شرایط تاریکی با بستهبندی فلاسکها به کمک فویل آلومینیومی فراهم شد (16).
طیفسنجی نانو ذرات نقره سنتز شده به روش بیومس تَر: نمونهبرداری از هر محلول در دورههای زمانی مختلف (0، 12، 24، 48 و 72 ساعت) انجام گرفت. نمونه¬های 1 میلیلیتری هر 12 ساعت، به مدت 5 دقیقه سانتیفیوژ شدند و جذب طیف UV-vis با وضوح 1 نانومتر بین 300 تا 800 نانومتر با استفاده از اسپکتروفتومتر گرفته شد. سویههایی که پیک بین 400 تا 450 نانومتر به عنوان سویههای تولیدکننده نانو ذرات شناسایی شدند (16).
2: روش جوشاندن
کشتهای سیانوباکتر به مدت 10 دقیقه با سرعت rpm 2500، تا تشکیل بیومس سانتریفیوژ شدند. سپس باقیمانده سیانوباکتریها در آون با دمای C° 60 خشک شدند. 1 گرم از زیست توده خشک در 10 میلیلیتر آب دوبار تقطیر به مدت 15 دقیقه در دمای C¬° 100 جوشانده شدند. پس از سرد شدن مخلوط، مجدداً به مدت 15 دقیقه با سرعت rpm 10000 سانتریفیوژ شدند. سوپرناتانت جمعآوری و در دمای C° 4 نگهداری شدند. عصارههای فاقد سلول سویههای سیانوباکتری برای سنتز نانوذرات نقره استفاده شدند. برای این منظور، 2 میلیلیتر از عصاره مذکور، درون 10 میلیلیتر محلول نقره 1 میلیمولار ریخته و بهطور مداوم در دمای C° 100 همزده شدند. محلول بیرنگ به تدریج به قهوهای مایل به زرد تبدیل و سپس به آرامی به قهوهای تبدیل شد (بعد از 45 دقیقه). نانوذرات نقره سنتز شده، به کمک سانتریفیوژ با سرعت rpm 15000، 20 دقیقه در دمای C° 4 جمعآوری شدند. پلت به دست آمده با آب مقطر چندین بار شسته شد و از اتانول 90 % برای حذف ناخالصیها و تهیه نانو ذره نقره خالص استفاده شد (17).
طیفسنجی نانوذرات نقره سنتز شده: برای طیفسنجی، 1 میلیگرم نانوذره در 4 میلیلیتر آب مقطر حل شد. طیفسنجی در طول موج 200 تا 700 نانومتر با استفاده از طیفسنجی UV-vis تعیین شد. از آب مقطر به عنوان نمونه شاهد استفاده گردید (16).
3: سنتز نانوذرات نقره با استفاده از پلیساکاریدهای خارج سلولی
زیست توده در فاز لگاریتمی، به کمک سانتریفیوژ با سرعت rpm 3000 جداسازی شد و از سوپرناتانت برای جداسازی پلیساکاریدهای خارج سلولی استفاده شد. مساوی با حجم سوپرناتانت، اتانول 95 % به آن اضافه گردید و یکشبانه روز درون فریزر (C° 20-) قرار داده شد. پس از سپری شدن 24 ساعت، پلیساکاریدها رسوب کرده و به کمک سانتریفیوژ با سرعت rpm 10000 جداسازی شدند. رسوب بهدست آمده به کمک خشک انجمادی، خشک و وزن کل آن محاسبه شد. در نهایت، 1/3 میلیگرم/ میلیلیتر پلیساکارید خشک شده، در 1 میلیلیتر محلول نیترات نقره 1 میلیمولار با 7= PH تلقیح شد و در دو لوله آزمایش تقسیم شدند. محلول بهدست آمده در دمای C° 25 و نور فلورسنت قرار گرفت. سپس طیفسنجی در هر 12 ساعت انجام شد.
.JPG)
شکل 2 سنتز نانوذرات نقره با استفاده از روش جوشاندن (a) وزن کردن عصاره سیانوباکتری. (b)محلول بی رنگ نقره 1 میلیمولار قبل از اضافه کردن عصاره. (c)تغییر رنگ محلول از بی رنگ به قهوهای مایل به زرد و سپس قهوهای، نشان دهنده تولید نانوذرات نقره.
.JPG)
شکل 3 سنتز نانوذرات نقره با استفاده از پلیساکاریدهای خارج سلولی (a) محلول پلیساکارید شفاف (b) محلول پلیساکارید بعد از اضافه کردن محلول نیترات نقره (قهوهای رنگ به دلیل تشکیل نانوذرات نقره) (c) محلول حاوی نانوذرات نقره سنتز شده (قهوهای رنگ)
پایدارسازی و پوششدار کردن نانوذره تولید شده: نانوذرات نقره با استفاده از روش احیای شیمیایی نیترات نقره با سدیم بوراید هیدرید در ماتریکس سدیم آلجینات 4% وزنی/ حجمی پایدار شدند. 100 میلیلیتر محلول آبی سدیم آلجینات با 1 میلیلیتر نانوذرات نقره سنتز شده به مدت 60 دقیقه با سرعت 200 دور در دقیقه با استفاده از همزن مغناطیسی مخلوط شد. سپس، 1 میلیلیتر محلول آبی 60 میلیمول بر لیتر سدیم بوراید هیدرید بهصورت قطره قطره در عرض 10 دقیقه به مخلوط اضافه شد و به مدت 2 ساعت هم زدن ادامه یافت. دمای واکنش در طول فرآیند در 25 درجه سانتیگراد حفظ شد. تغییر رنگ محلول از قهوهای کمرنگ به قهوهای پررنگ با طیفهای مایل به سبز نشاندهنده پوششدهی نانوذرات نقره با آلژینات بود. در نهایت، محلول کلوئیدی حاصل در دمای 4 درجه سانتیگراد برای جلوگیری از تخریب زیستی نگهداری شد (18).
مشخصه یابی نانوذرات سنتز شده
1: آنالیز میکروسکوپ الکترونی عبوری (TEM)
تجزیه و تحلیل TEM با استفاده از 3 میکرولیتر از محلول نمونه قرار داده شده بر روی شبکههای مسی با پوشش کربن انجام شد. یک لایه نازک از نمونه روی شبکه ساخته شد و نمونه های اضافی با استفاده از یک مخروط کاغذ لکهبرداری برداشته شد و بهطور متوالی در یک جعبه توری نگهداری شد و تصاویر TEM تهیه شد. ولتاژ Kv 200 بود. اندازه میانگین نانوذرات نقره با اندازهگیری حداقل 100 ذره تعیین شد (19).
2: آنالیز تبدیل فوریه مادون قرمز (FTIR)
شیمی و تغییرات گروههای عاملی متصل به سطح نانوذرات نقره با یک طیف¬سنج FTIR شناسایی شدند. نانوذرات خشک شده با برومید پتاسیم به نسبت 100/1 مخلوط شدند. نمونه 100 میکرولیتری در آنالایزر بازتاب کلی ضعیف قرار داده شد. محلول نانو ذرات نقره توسط ATR-FTIR آنالیز شد. طیف پرتوهای IR در طول 4000-400 سانتیمتر، با حالت بازتاب منتشر در وضوح cm-1 4 اسکن شد (20).
3: آزمون پتانسیل زتا
پتانسیل زتا سوسپانسیونهای آبی نانوذرات نقره بیوسنتز شده با قرار دادن 2 میلیلیتر از نمونهها در یک کووت پلاستیکی شفاف چهار وجهی در دستگاه زتا سایزر در دمای C¬° 25 تعیین شد. اندازه گیری مستقیماً در سلول زتا یکبار مصرف شفاف انجام شد (21).
بررسی فعالیت آنتیباکتریال نانوذرات نقره پوششدار و فاقد پوشش
1: معرفی و کشت پاتوژن های مورد بررسی
ایزولههای باکتریایی پاتوژنی ماهی مرتبط با Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli هستند که حساسیت این باکتریها در برابر نانوذرات تهیه شده سنجیده شد. تمامی سویه های مورد بررسی روی محیط کشت آگار مولر هیلتون کشت شدند و به مدت 5 روز در دمای °C 22.گرمخانه گذاری شدند (18).
2: آزمون حداقل غلظت مهارکنندگی (MIC)
از روش کدورت سنجی با غلظتهای مختلف نانوذره پوششدار شده برای ارزیابی میزان حداقل غلظت مهارکنندگی برای هر سویه باکتری استفاده گردید. در ابتدا یک لوله آزمایش شامل 10 میلیلیتر سوسپانسیون (1 میلیگرم بر میلیلیتر) در محیط کشت مایع MH آماده گردید، سپس جهت رقتسازی در هر لوله آزمایش 6 میلیلیتر محیط MH آماده و سوسپانسیون باکتریها در غلظت نهایی CFU/ml 105 × 1 به هر لوله اضافه شد. غلظتهای مشابه از نانوذرات پوششدار شده به عنوان کنترل استفاده شد. کمترین غلظتی که از رشد هر سویه باکتری جلوگیری کرد به عنوان MIC در نظر گرفته و گزارش شد (22).
3: آزمون حداقل غلظت کشندگی (MBC)
ابتدا 100 میکرولیتر از هر مخلوط نانوذره پوششدار شده به همراه باکتری های پاتوژن که رشد قابل مشاهدهای را در طول تست MIC نشان ندادند، انتخاب و روی پلیتهای آگار بصورت خطی کشت داده شدند و درون انکوباتور گرمخانه گذاری شدند. عدم وجود کلنی در صفحات نشان دهنده فقدان باکتریهای زنده و اثر باکتری کشی نانوذرات در آن غلظت بود. از سوی دیگر، رشد کلنی بر روی صفحات نشان دهنده وجود باکتریهای زنده و اثر باکتریو استاتیک نانوذره در آن غلظت بود (22).
4: ارزیابی حساسیت پاتوژنهای منتخب به نانوذرات نقره: مقایسه نانوذرات پوششدار و بدون پوشش با روش انتشار دیسک
ارزیابی ویژگیهای ضدمیکروبی با روش انتشار دیسک بر طبق روش نوروزی و همکاران انجام گرفت (23). این روش بر دیدن هاله بدون رشد در پیرامون دیسکهای دارای خاصیت ضد میکروبی استوار است. در این پژوهش سویههای باکتریایی Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli سنجش شدند. سویههای خالص میکروبی به گونه لیوفیلیز شده، بسترهای کشت آماده مولر هینتون آگار، TSB و همچنین محلول استاندارد نیم مک فارلند از شرکت زیست رویش خریداری شدند. دیسکهای آنتیبیوتیک و دیسکهای خام نیز از شرکت پادتن طب فراهم شدند. سویههای لیوفیلیزه بر پایه آییننامه شرکت زیست رویش برای بازیابی شدن در بسترهای کشت مایع TSB نهاده شده و برای 24 ساعت در انکوباتور oC 35 جای گرفتند. پس از گذشت 24 ساعت با استفاده لوپ از TSB دارای سویههای بازیابی شده بر روی بسترهای کشتهای بلاد آگار کشت شده و برای 24 ساعت در انکوباتور oC 35 جای گرفتند. تعداد اندکی از کلنیهای ناب از پلیتهای آگار خوندار برداشت شده و در لولههای تمیز و سترون سرم فیزیولوژیک پراکنده شدند. تیرگی این محلولهای دارای باکتریهای ناب با استاندارد نیم مک فارلند سنجش و با آن برابر شدند. پس از آماده شدن محلولهای باکتریایی با غلظت نیم مک فارلند با سوآپهای استریل از محلول نیم مک فارلند برداشت شده و به گونهی کشت چمنی بر روی بسترهای مولر هینتون آگار کشت داده شدند. بر روی هر پلیت مورد آزمون در کنار شعله با استفاده از پنس استریل، 3 دیسک جایگذاری شد. یک دیسک آنتیبیوتیک به عنوان شاهد مثبت، یک دیسک آغشته شده به نانوذره و یک دیسک برای کنترل منفی و بدون نانوذره بود. برای ارزیابی نانوذرات سنتز شده از دیسک دارای عصاره بدون نانوذرات نقره برای کنترل منفی بهرهگیری شد. دیسکهای سیپروفلوکساسین 5 میکروگرم برای آزمون با سویههای E.coli،Pseudomonas و دیسک آمپیسیلین 10 میکروگرم برای آزمون با سویههای Yersinia و Edwardsiella بهکار رفتند.
5: جذب UV-vis
برای تایید ممانعت رشد باکتریها، تراکم نوری (OD) در محیط مایع لولههای MIC با استفاده از اسپکتروفتومتری UV-visدر 600 نانومتر (در غلظت 0 تا 200 ppm) سنجیده شد. جذب کمتر، رشد کمتر باکتری ها را نشان داد. نمونه شاهد در این آزمایش همان نمونه شاهد آزمایش MIC بود. اثرات آنتیباکتریال هر دز از نانوذرات سنتز شده بهصورت درصد ممانعت کنندگی (%) رشد باکتری بر طبق معادله زیر تعیین گزارش شد (24).
رشد، تکامل و سلامت بدن انسان تحت تأثیر غذایی است که میخورد در حقیقت رژیم غذایی به عنوان عامل محیطی موثر برای رشد بدن انسان در نظر گرفته میشود. صید و پرورش ماهی یکی از مهمترین منابع غذایی در سراسر جهان است و از نظر اقتصادی نیز اهمیت زیادی دارد. با اینحال، صنعت آبزیپروری با چالشهای متعددی از جمله بیماریهای عفونی ماهی مواجه است که میتواند منجر به مرگ و میر گسترده ماهیها و خسارات اقتصادی قابلتوجهی شود. بیماریهای عفونی ماهی را میتوان به سه دسته کلی باکتریایی (استرپتوکوکوس، آئروموناس هیدروفیلا، سودوموناس و ویبریو که شایعترین آنها هستند)، قارچی و انگلی تقسیمبندی کرد (1). کنترل سنتی بیماریهای ماهی عمدتاً به استفاده از آنتیبیوتیکها متکی است. با اینحال، نگرانیهای فزایندهای در مورد مقاومت ضد میکروبی در برابر آنتیبیوتیکها و اثرات مخرب زیستمحیطی آنها وجود دارد. در مقابل، نانوذرات نقره سنتز شده با سیانوباکتریها جایگزینی امیدوارکننده و سازگار با محیط زیست برای آنتیبیوتیکها ارائه میدهند. مطالعات متعددی نشان دادهاند که نانوذرات نقره سنتز شده با سیانوباکتریها فعالیت ضد باکتریایی قوی در برابر طیف گستردهای از پاتوژنهای ماهی، از جمله باکتریهای گرم مثبت و گرم منفی دارند. به عنوان مثال، Ameen و همکاران گزارش دادند که نانوذرات نقره سنتز شده با Spirulina platensis فعالیت ضد باکتریایی قوی در برابر Aeromonas hydrophila، Vibrio parahaemolyticus و Streptococcus iniae نشان دادند (2) علاوه بر این،Younis و همکاران نشان دادند که نانوذرات نقره سنتز شده با Phormidium cyanobacterium علاوه بر فعالیت ضد میکروبی، خواص ضد التهابی و آنتیاکسیدانی نیز نشان دادند که میتواند بهطور بالقوه به بهبود سلامت ماهیان آسیبدیده از بیماریهای عفونی کمک کند (3). حفظ ماهی یک جنبه فرآوری بسیار مهم در شیلات است. بهطور معمول، مزارع پرورش ماهی یا سایر سایتهای صید ماهی در فواصل زیادی از نقاط خردهفروشی قرار دارند و فراوانی تجزیه ماهی و عدم قطعیت فروش آنها در بازار وجود دارد. هنگامیکه ماهی به مقدار زیاد، بیشتر از نیاز بازار برداشت میشود، نگهداری و فرآوری آنها برای کاربردهای آینده آنها ضروری میشود. بنابراین نگهداری و فرآوری اجزای آبزیان ضروری هستند. این روشها با این هدف انجام میشوند که ماهیها برای مدت طولانیتر، با حداقل از دست دادن ویژگیهای کیفی ضروری، ارزش غذایی و قابلیت هضم گوشت آنها تازه و ایمن باقیبمانند. برای جلوگیری از فاسد شدن ماهی و افزایش ماندگاری غذاهای دریایی، تکنیکهای نگهداری زیادی مورد نیاز است. این تکنیکها برای مهار رشد، تکثیر باکتریهای فاسد و تغییرات متابولیکی که منجر به از دست دادن کیفیت ماهی میشود، طراحی شدهاند (4). در صنایع آبزیپروری و غذاهای دریایی، فناوری نانو پتانسیل گستردهای برای کاربرد دارد. از جمله، فناوری میتواند بهطور موثر از بیماریها و عوامل بیماریزا پیشگیری کند و مزایای آبزیپروری را چند برابر کند. برخی از کاربردهای نانوتکنولوژی برای سلامت ماهی، سطوح ضد باکتری یا ضد قارچی هستند که با استفاده از نانوساختارهای متخلخل و نانوحسگرها در سیستمهای آبزیپروری برای تشخیص عوامل بیماریزا در آب و تأمین محصولات نانو دامپزشکی و داروهای ماهی از طریق غذاهای ماهی توسعه یافتهاند (5). کنترل ویروس، باکتری و قارچ مستلزم تشخیص زودهنگام است و از بین بردن پاتوژنها میتواند از طریق نانومواد امکانپذیر باشد، زیرا آنها در مقیاسی مشابه ویروس یا بیماری آلوده کننده ذرات عمل میکنند (6). با اینحال، نگرانیهای مرتبط با ایمنی نانو هنوز وجود دارد و باید قبل از اجرای کامل آنها برطرف شود. اثرات سمی نانوذرات به عوامل مختلفی از جمله تعامل پیچیده بین ویژگیهای ذرات مانند قطر، فرم، بار سطحی، غلظت، زمان قرار گرفتن در معرض، ماهیت نانوذرات، ترکیب محیط، مسیر تزریق ذرات و سیستم ایمنی گونههای هدف بستگی دارد. بنابراین، جالب است که بررسی کنیم که چگونه با کمک تکنولوژی نانو میتواند بر مشکلات فساد آبزیان غلبه کرد (7). بیوسنتز نانو ذرات از روشهای شیمیایی، فیزیکی و بیولوژیکی و همچنین از طریق مسیرهای درون سلولی و خارج سلولی توسط انواعی از میکروارگانیسمها انجام میشود. در حال حاضر، بیشتر روشهای سنتز شیمیایی نانو ذرات به استفاده از مواد احیا کننده سمی مثل بوروهیدرید سدیم و حلالهای آلی مضر متکی هستند. این مواد شیمیایی خطرات بالقوه بیولوژیکی و محیطی را نشان میدهند. بنابراین، امروزه دانشمندان را بر آن داشت تا از رویکردهای شیمیایی سبز، روشهای زیست سازگار، تمیز، دوستدار محیط زیست و ایمن برای سنتز نانو مواد استفاده کنند (8). بیوسنتز نانوذرات با استفاده از گیاهان به مساحت وسیع و دورههای رشد نسبتاً طولانی نیاز دارد که در نهایت امکانسنجی فرآیند سنتز را محدود میکند. در حال حاضر، در میان رویکردهای شیمی سبز، سیانوباکترها، یکی از بزرگترین، متنوعترین و مهمترین گروههای باکتریهای فوتواتوتروف روی زمین به دلیل سرعت رشد بالا و بهرهوری زیست توده، توجه ویژهای را برای سنتز نانومواد به خود جلب کردهاند (9). در سالهای اخیر، نانو ذرات نقره با افزایش تقاضا به دلیل طیف وسیعی از کاربردهای آن در الکترونیک، نانوپزشکی، انرژی، حسگرهای زیستی، کاتالیزور و فعالیتهای ضد باکتریایی و ضد قارچی در کانون توجه قرار گرفتهاند (10). همچنین، در مقایسه با روشهای سنتی، روشهای سبز امکان ساخت اشکال مختلف نانوذرات را فراهم میکنند که با ویژگیهای منحصربهفرد در شرایط فشار و دمای ملایم متمایز میشوند. در بین روشهای بیولوژیکی، سنتز نانوذرات نقره توسط باکتریها به دلیل پایداری، زیست سازگاری، مقرونبهصرفه بودن، غیرسمی بودن آن در حال افزایش است و به راحتی میتوان از آن برای تولید انبوه استفاده کرد. تعدادی از گونههای سیانوباکتری متعلق به راسته Nostocales، Oscillatoriales و Synchococcales در مطالعات مختلف برای سنتز نانو ذرات نقره استفاده شدهاند (9). توسعه سریع نانوتکنولوژی و نانومواد منجر به نیاز به اصلاح سطح نانوذرات برای کاربردهای مختلف شده است. نانو ذرات به دلیل تمایلشان به متراکم شدن بر اساس نیروی واندروالس، نیازمند پایدار شدن در مایع حامل میباشند. برای این منظور، نانو ذرات توسط یک سورفیکانت یا پلیمر پوشش داده میشوند. پوشش دار کردن نانو ذرات با گروههای آمینه، سیلیس، سورفکتانتهای پلیمری یا ترکیبات آلی دیگر معمولاً به منظور دسیتیابی به خواص فیزیکی و شیمیایی بهتر ارائه شده است. علاوه براین بسیاری از گروههای عاملی پلیمرهای سطحی میتوانند برای افزایش کاربرد به منظور دستیابی به ویژگیهای مختلف مورد استفاده قرار بگیرند (11).
نانو ذرات نقره به دلیل ویژگیهای منحصربهفرد خود، از جمله سطح ویژه بالا و پایداری، و فعالیت ضد میکروبی قوی، به عنوان مواد ضد میکروبی در حوزههای مختلف، از جمله صنایع آبزیپروری، مورد توجه قرار گرفتهاند. پوششدارسازی نانوذرات نقره مزایای متعددی از جمله بهبود پایداری، کاهش سمیت و افزایش زیست سازگاری نانوذرات را به همراه دارد. نانو ذرات نقره در مقابل بسیاری از پاتوژنها فعالیت ضد میکروبی قابلتوجهی نشان دادهاند و راهی کنترل کننده در درمان بسیاری از بیماریها هستند (12). برای پوششدار سازی نانوذرات، از طیف وسیعی از نانوکامپوزیتها و پلیساکاریدها استفاده میشود. انتخاب ماده پوششدهی به عوامل مختلفی از جمله خواص مورد نظر نانوذره، کاربرد نهایی و روشهای تولید بستگی دارد. علاوه بر کاربرد در بسیاری از روشهای زیستی، آلجینات و نانوکامپوزیتهای حاصل از آن به دلیل اثرات ضدمیکروبی، دارای کاربردهای پزشکی قابلتوجهی در مقابل بسیاری از میکروارگانیسمها هستند. پوششدار سازی نانوذرات با آلجینات، مسمومیت بسیار کمتری در مقایسه با سایر پلی ساکاریدهای طبیعی دیگر دارد و کاربردهای بسیار وسیعی در زیست پزشکی دارد (13). عصاره سیانوباکتری ها حاوی ترکیبات فعال زیستی مانند پروتئینها، لیپیدها، پلیساکاریدها، روغنها، ویتامینها، ترپنها، استرها، پلیفنلها، کاروتنوئیدها دارای خواص ضد باکتریایی، ضد قارچی، آنتیاکسیدانی، ضد سرطانی هستند که در توسعه داروهای جدید ضروری هستند. در این مطالعه، اثرات ضد میکروبی نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط سویه Dulcicalothrix alborzica که به عنوان گونه جدید اولین بار توسط نوروزی و شالگین در سال 2021 از آبهای روان از کوههای البرز جمعآوری و خالصسازی شده است، در مقابل پاتوژنهای ماهی مورد بررسی قرار گرفت (14).
روش بررسی
کشت سیانوباکتری Dulcicalothrix alborzica: سیانوباکتری Dulcicalothrix alborzica از مجموعه کشت سیانوباکتری¬های دانشگاه آزاد واحد علوم و تحقیقات Cyanobacteria culture collection (Ccc) جمع آوری، در محیط کشت BG-11 کشت داده شد. پس از اطمینان از خلوص و عاری بودن کشت از هرگونه آلودگی، آنها به ارلنهای کشت در اتاقک رشد منتقل شدند. شرایط کشت شامل شدت نور 40 تا 60 میکروموول فوتون/مترمربع/ثانیه و دمای 28 تا 30 درجه سانتیگراد بود (15).
.JPG)
شکل1: کشت سیانوباکتری Dulcicalothrix alborzica
بیوسنتز نانوذرات نقره
1: روش استفاده از بیومس تر
کشتهای فاز لگاریتمی سیانوباکتری Dulcicalothrix alborzica با سانتریفیوژ با دور 5000 به مدت 10 دقیقه در دمای C° 20 جدا شدند و 3 بار با آب مقطر استریل شسته شدند. سپس یک گرم از بیومس وزن مرطوب درون فلاکسهای 500 و 100 میلیلیتر از محلول آبی 1، 2 و 3 میلیمولار نیترات نقره، با 7= pH تلقیح شد. در نهایت مخلوط در دمای C¬° 25 به مدت 24 ساعت گرمخانهگذاری شدند. به عنوان شاهد از محیط کشت تازه BG11 با افزودن نیترات نقره استفاده شد. شرایط تاریکی با بستهبندی فلاسکها به کمک فویل آلومینیومی فراهم شد (16).
طیفسنجی نانو ذرات نقره سنتز شده به روش بیومس تَر: نمونهبرداری از هر محلول در دورههای زمانی مختلف (0، 12، 24، 48 و 72 ساعت) انجام گرفت. نمونه¬های 1 میلیلیتری هر 12 ساعت، به مدت 5 دقیقه سانتیفیوژ شدند و جذب طیف UV-vis با وضوح 1 نانومتر بین 300 تا 800 نانومتر با استفاده از اسپکتروفتومتر گرفته شد. سویههایی که پیک بین 400 تا 450 نانومتر به عنوان سویههای تولیدکننده نانو ذرات شناسایی شدند (16).
2: روش جوشاندن
کشتهای سیانوباکتر به مدت 10 دقیقه با سرعت rpm 2500، تا تشکیل بیومس سانتریفیوژ شدند. سپس باقیمانده سیانوباکتریها در آون با دمای C° 60 خشک شدند. 1 گرم از زیست توده خشک در 10 میلیلیتر آب دوبار تقطیر به مدت 15 دقیقه در دمای C¬° 100 جوشانده شدند. پس از سرد شدن مخلوط، مجدداً به مدت 15 دقیقه با سرعت rpm 10000 سانتریفیوژ شدند. سوپرناتانت جمعآوری و در دمای C° 4 نگهداری شدند. عصارههای فاقد سلول سویههای سیانوباکتری برای سنتز نانوذرات نقره استفاده شدند. برای این منظور، 2 میلیلیتر از عصاره مذکور، درون 10 میلیلیتر محلول نقره 1 میلیمولار ریخته و بهطور مداوم در دمای C° 100 همزده شدند. محلول بیرنگ به تدریج به قهوهای مایل به زرد تبدیل و سپس به آرامی به قهوهای تبدیل شد (بعد از 45 دقیقه). نانوذرات نقره سنتز شده، به کمک سانتریفیوژ با سرعت rpm 15000، 20 دقیقه در دمای C° 4 جمعآوری شدند. پلت به دست آمده با آب مقطر چندین بار شسته شد و از اتانول 90 % برای حذف ناخالصیها و تهیه نانو ذره نقره خالص استفاده شد (17).
طیفسنجی نانوذرات نقره سنتز شده: برای طیفسنجی، 1 میلیگرم نانوذره در 4 میلیلیتر آب مقطر حل شد. طیفسنجی در طول موج 200 تا 700 نانومتر با استفاده از طیفسنجی UV-vis تعیین شد. از آب مقطر به عنوان نمونه شاهد استفاده گردید (16).
3: سنتز نانوذرات نقره با استفاده از پلیساکاریدهای خارج سلولی
زیست توده در فاز لگاریتمی، به کمک سانتریفیوژ با سرعت rpm 3000 جداسازی شد و از سوپرناتانت برای جداسازی پلیساکاریدهای خارج سلولی استفاده شد. مساوی با حجم سوپرناتانت، اتانول 95 % به آن اضافه گردید و یکشبانه روز درون فریزر (C° 20-) قرار داده شد. پس از سپری شدن 24 ساعت، پلیساکاریدها رسوب کرده و به کمک سانتریفیوژ با سرعت rpm 10000 جداسازی شدند. رسوب بهدست آمده به کمک خشک انجمادی، خشک و وزن کل آن محاسبه شد. در نهایت، 1/3 میلیگرم/ میلیلیتر پلیساکارید خشک شده، در 1 میلیلیتر محلول نیترات نقره 1 میلیمولار با 7= PH تلقیح شد و در دو لوله آزمایش تقسیم شدند. محلول بهدست آمده در دمای C° 25 و نور فلورسنت قرار گرفت. سپس طیفسنجی در هر 12 ساعت انجام شد.
.JPG)
شکل 2 سنتز نانوذرات نقره با استفاده از روش جوشاندن (a) وزن کردن عصاره سیانوباکتری. (b)محلول بی رنگ نقره 1 میلیمولار قبل از اضافه کردن عصاره. (c)تغییر رنگ محلول از بی رنگ به قهوهای مایل به زرد و سپس قهوهای، نشان دهنده تولید نانوذرات نقره.
.JPG)
شکل 3 سنتز نانوذرات نقره با استفاده از پلیساکاریدهای خارج سلولی (a) محلول پلیساکارید شفاف (b) محلول پلیساکارید بعد از اضافه کردن محلول نیترات نقره (قهوهای رنگ به دلیل تشکیل نانوذرات نقره) (c) محلول حاوی نانوذرات نقره سنتز شده (قهوهای رنگ)
پایدارسازی و پوششدار کردن نانوذره تولید شده: نانوذرات نقره با استفاده از روش احیای شیمیایی نیترات نقره با سدیم بوراید هیدرید در ماتریکس سدیم آلجینات 4% وزنی/ حجمی پایدار شدند. 100 میلیلیتر محلول آبی سدیم آلجینات با 1 میلیلیتر نانوذرات نقره سنتز شده به مدت 60 دقیقه با سرعت 200 دور در دقیقه با استفاده از همزن مغناطیسی مخلوط شد. سپس، 1 میلیلیتر محلول آبی 60 میلیمول بر لیتر سدیم بوراید هیدرید بهصورت قطره قطره در عرض 10 دقیقه به مخلوط اضافه شد و به مدت 2 ساعت هم زدن ادامه یافت. دمای واکنش در طول فرآیند در 25 درجه سانتیگراد حفظ شد. تغییر رنگ محلول از قهوهای کمرنگ به قهوهای پررنگ با طیفهای مایل به سبز نشاندهنده پوششدهی نانوذرات نقره با آلژینات بود. در نهایت، محلول کلوئیدی حاصل در دمای 4 درجه سانتیگراد برای جلوگیری از تخریب زیستی نگهداری شد (18).
مشخصه یابی نانوذرات سنتز شده
1: آنالیز میکروسکوپ الکترونی عبوری (TEM)
تجزیه و تحلیل TEM با استفاده از 3 میکرولیتر از محلول نمونه قرار داده شده بر روی شبکههای مسی با پوشش کربن انجام شد. یک لایه نازک از نمونه روی شبکه ساخته شد و نمونه های اضافی با استفاده از یک مخروط کاغذ لکهبرداری برداشته شد و بهطور متوالی در یک جعبه توری نگهداری شد و تصاویر TEM تهیه شد. ولتاژ Kv 200 بود. اندازه میانگین نانوذرات نقره با اندازهگیری حداقل 100 ذره تعیین شد (19).
2: آنالیز تبدیل فوریه مادون قرمز (FTIR)
شیمی و تغییرات گروههای عاملی متصل به سطح نانوذرات نقره با یک طیف¬سنج FTIR شناسایی شدند. نانوذرات خشک شده با برومید پتاسیم به نسبت 100/1 مخلوط شدند. نمونه 100 میکرولیتری در آنالایزر بازتاب کلی ضعیف قرار داده شد. محلول نانو ذرات نقره توسط ATR-FTIR آنالیز شد. طیف پرتوهای IR در طول 4000-400 سانتیمتر، با حالت بازتاب منتشر در وضوح cm-1 4 اسکن شد (20).
3: آزمون پتانسیل زتا
پتانسیل زتا سوسپانسیونهای آبی نانوذرات نقره بیوسنتز شده با قرار دادن 2 میلیلیتر از نمونهها در یک کووت پلاستیکی شفاف چهار وجهی در دستگاه زتا سایزر در دمای C¬° 25 تعیین شد. اندازه گیری مستقیماً در سلول زتا یکبار مصرف شفاف انجام شد (21).
بررسی فعالیت آنتیباکتریال نانوذرات نقره پوششدار و فاقد پوشش
1: معرفی و کشت پاتوژن های مورد بررسی
ایزولههای باکتریایی پاتوژنی ماهی مرتبط با Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli هستند که حساسیت این باکتریها در برابر نانوذرات تهیه شده سنجیده شد. تمامی سویه های مورد بررسی روی محیط کشت آگار مولر هیلتون کشت شدند و به مدت 5 روز در دمای °C 22.گرمخانه گذاری شدند (18).
2: آزمون حداقل غلظت مهارکنندگی (MIC)
از روش کدورت سنجی با غلظتهای مختلف نانوذره پوششدار شده برای ارزیابی میزان حداقل غلظت مهارکنندگی برای هر سویه باکتری استفاده گردید. در ابتدا یک لوله آزمایش شامل 10 میلیلیتر سوسپانسیون (1 میلیگرم بر میلیلیتر) در محیط کشت مایع MH آماده گردید، سپس جهت رقتسازی در هر لوله آزمایش 6 میلیلیتر محیط MH آماده و سوسپانسیون باکتریها در غلظت نهایی CFU/ml 105 × 1 به هر لوله اضافه شد. غلظتهای مشابه از نانوذرات پوششدار شده به عنوان کنترل استفاده شد. کمترین غلظتی که از رشد هر سویه باکتری جلوگیری کرد به عنوان MIC در نظر گرفته و گزارش شد (22).
3: آزمون حداقل غلظت کشندگی (MBC)
ابتدا 100 میکرولیتر از هر مخلوط نانوذره پوششدار شده به همراه باکتری های پاتوژن که رشد قابل مشاهدهای را در طول تست MIC نشان ندادند، انتخاب و روی پلیتهای آگار بصورت خطی کشت داده شدند و درون انکوباتور گرمخانه گذاری شدند. عدم وجود کلنی در صفحات نشان دهنده فقدان باکتریهای زنده و اثر باکتری کشی نانوذرات در آن غلظت بود. از سوی دیگر، رشد کلنی بر روی صفحات نشان دهنده وجود باکتریهای زنده و اثر باکتریو استاتیک نانوذره در آن غلظت بود (22).
4: ارزیابی حساسیت پاتوژنهای منتخب به نانوذرات نقره: مقایسه نانوذرات پوششدار و بدون پوشش با روش انتشار دیسک
ارزیابی ویژگیهای ضدمیکروبی با روش انتشار دیسک بر طبق روش نوروزی و همکاران انجام گرفت (23). این روش بر دیدن هاله بدون رشد در پیرامون دیسکهای دارای خاصیت ضد میکروبی استوار است. در این پژوهش سویههای باکتریایی Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli سنجش شدند. سویههای خالص میکروبی به گونه لیوفیلیز شده، بسترهای کشت آماده مولر هینتون آگار، TSB و همچنین محلول استاندارد نیم مک فارلند از شرکت زیست رویش خریداری شدند. دیسکهای آنتیبیوتیک و دیسکهای خام نیز از شرکت پادتن طب فراهم شدند. سویههای لیوفیلیزه بر پایه آییننامه شرکت زیست رویش برای بازیابی شدن در بسترهای کشت مایع TSB نهاده شده و برای 24 ساعت در انکوباتور oC 35 جای گرفتند. پس از گذشت 24 ساعت با استفاده لوپ از TSB دارای سویههای بازیابی شده بر روی بسترهای کشتهای بلاد آگار کشت شده و برای 24 ساعت در انکوباتور oC 35 جای گرفتند. تعداد اندکی از کلنیهای ناب از پلیتهای آگار خوندار برداشت شده و در لولههای تمیز و سترون سرم فیزیولوژیک پراکنده شدند. تیرگی این محلولهای دارای باکتریهای ناب با استاندارد نیم مک فارلند سنجش و با آن برابر شدند. پس از آماده شدن محلولهای باکتریایی با غلظت نیم مک فارلند با سوآپهای استریل از محلول نیم مک فارلند برداشت شده و به گونهی کشت چمنی بر روی بسترهای مولر هینتون آگار کشت داده شدند. بر روی هر پلیت مورد آزمون در کنار شعله با استفاده از پنس استریل، 3 دیسک جایگذاری شد. یک دیسک آنتیبیوتیک به عنوان شاهد مثبت، یک دیسک آغشته شده به نانوذره و یک دیسک برای کنترل منفی و بدون نانوذره بود. برای ارزیابی نانوذرات سنتز شده از دیسک دارای عصاره بدون نانوذرات نقره برای کنترل منفی بهرهگیری شد. دیسکهای سیپروفلوکساسین 5 میکروگرم برای آزمون با سویههای E.coli،Pseudomonas و دیسک آمپیسیلین 10 میکروگرم برای آزمون با سویههای Yersinia و Edwardsiella بهکار رفتند.
5: جذب UV-vis
برای تایید ممانعت رشد باکتریها، تراکم نوری (OD) در محیط مایع لولههای MIC با استفاده از اسپکتروفتومتری UV-visدر 600 نانومتر (در غلظت 0 تا 200 ppm) سنجیده شد. جذب کمتر، رشد کمتر باکتری ها را نشان داد. نمونه شاهد در این آزمایش همان نمونه شاهد آزمایش MIC بود. اثرات آنتیباکتریال هر دز از نانوذرات سنتز شده بهصورت درصد ممانعت کنندگی (%) رشد باکتری بر طبق معادله زیر تعیین گزارش شد (24).
P(GI%) =1-OD sample/OD control×100
Growth Inhibit Percentage (GI%) = 1- .JPG)
.JPG)
6: بررسی فعالیت ضد قارچی نانوذرات نقره پوششدار
توانایی فعالیت ضد قارچی نانو ذرات پوششدار شده در ممانعت از رشد دو سویه قارچ از خانواده اوومیستها (Aphanomyces invadans) و (Saprolegnia parasitica) بررسی شد. برای این منظور، ابتدا Aphanomyces invadans روی محیط کشت پپتون گلوکز حاوی آگار برای در دمای °C 26 به مدت 5 روز و Saprolegnia parasitica روی محیط کشت مخمر گلوکز در دمای °C 21 به مدت 2 گرمخانه گذاری شدند. اثرات ممانعت کنندگی از رشد غلظت های 1 تا 10 میلیگرم/ میلیلیتر نانوذره پوششدار شده و فاقد سنجیده شدند. برای این منظور، از پلیتهای 24 چاهکی استفاده گردید. 1 میلیلیتر از محیط کشتها درون هر چاهک ریخته شد سپس یک تکه کوچک 1 میلیمتری از میسلیومهای در حال رشد از هر قارچ درون هر چاهک قرار داده شد. سپس همه پلیتها گرمخانه گذاری شدند. کمترین غلظت که سبب مهار 90% رشد میسلیومها شد، برای هر سویه قارچی به عنوان MIC در نظر گرفته و گزارش شد (25).
تجزیه و تحلیل آماری
آنالیزهای آماری دادههای حاصل از هر آزمایش با نرمافزار SPSS version 16 انجام شد. تمام دادهها حاصل از نتایج سه تکرار بود. تفاوت معنیدار بین عوامل اندازهگیری شده با آنالیز واریانس یک طرفه با حدود اطمینان 95% و مقایسه میانگینها با آزمون توکی انجام گردید و نتایج مربوط به مقایسهها بهصورت نمودار با نرمافزار Excel رسم شد.
نتایج
نتایج طیفسنجی نانو ذرات تولید شده به سه روش مختلف: بررسی طیفسنجی نانو ذرات تهیه شده به روش بیومس در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM) در (شکل 4(a نشان داده شده است. به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 425 و nm 420 مشاهده شد. طی بررسی طیف¬سنجی (ƛmax) نانو ذرات تهیه شده به روش جوشاندن (شکل 4 b) در طول موج nm 428 مشاهده شد. بررسی طیف سنجی (ƛmax) نانوذرات تهیه شده به کمک پلیساکارید عصاره (شکل 4 c) در زمان¬های 0، 12، 24، 48 و 72 ساعت به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 433، nm 433 مشاهده شد در 0 و 12 ساعت پیک نمودار ƛmax مشاهده نشد.
نتایج آزمون FTIR: نتایج طیفسنجی FTIR نانو ذرات نقره سنتز شده به سه روش مختلف در شکل 5 (به ترتیب (a) طیفسنجی نانو ذرات تولید شده به روش بیومس تَر، (b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی) نشان داده شده است. با بررسی طیفها مشخص شد، هر سه طیف بریکدیگر منطبق هستند که نشان دهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروه های عاملی و اتم های تشکیل دهنده هر طیف است.
نتایج آزمون پتانسیل زتا: نتایج دیاگرام پتانسیل زتا نانو ذرات تولید شده (شکل 6) نشان داد پتانسیل زتا نانوذرات تولید شده به روش بیومس تر (شکل 6 a) برابر mV 7/24 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000192 داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6 b )، میانگین اندازه ذرات نانو نقره nm 0/75 ± 115/4 بهدست آمد. پتانسیل زتا نانو ذرات تولید شده به روش جوشاندن (شکل 6 c) برابر mV 27/5 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000199 داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6d¬)، میانگین اندازه ذرات نانو نقره nm 0/687 ± 160/0 بهدست آمد. پتانسیل زتا نانو ذرات تولید شده با کمک پلیساکاریدهای خارج سلولی (شکل 6 e ) برابر mV 22/5 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000175. داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6 f ) ، میانگین اندازه ذرات نانو نقره nm 0/612 ± 238/9
جدول 1: پیک های متناظر با گروه های عاملی تغییر در گروههای عاملی نانوذرات تولید شده به روش های مختلف


شکل 4: نتایج طیفسنجی UV.Vis نانوذرات نقره سنتز شده به سه روش مختلف ( (a) طیف سنجی نانوذرات تولید شده به روش بیومس تَر، (b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی)

شکل5 : نتایج طیفسنجی FTIR نانوذرات نقره سنتز شده به سه روش مختلف ( (a) طیفسنجی نانوذرات تولید شده به روش بیومس تَر،
(b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی
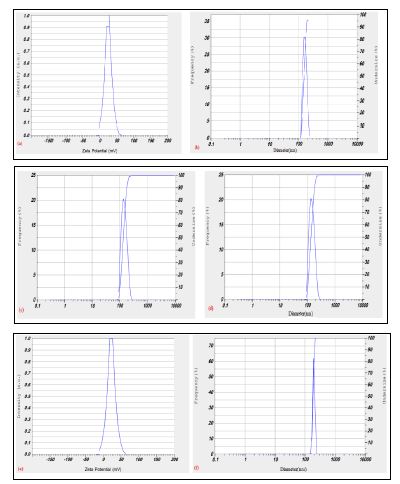
شکل 6: نتایج دیاگرام پتانسیل زتا نانوذرات نقره سنتز شده به سه روش مختلف ( (a-b) طیف سنجی نانوذرات تولید شده به روش بیومس تَر، (c-d) به روش جوشاندن، (e-f) با استفاده از پلیساکاریدهای خارج سلولی)
نتایج آزمون SEM: نتایج عکس SEM نانوذرات بدون پوشش و پوششدهی شده با آلجینات بیوسنتز شده به روش جوشاندن در شکل 7 نشان داده شده است. در (شکل 7 a ) مورفولوژی نانوذرات سنتز شده بدون پوشش نشان داده شده است. نتایج نشان داد نانوذرات سنتز شده بهصورت کروی بوده و اندازه ذراتی nm 33/57 تا 80/67 داشتند. بررسی مورفولوژی نانوذرات پوشش داده شده با آلجینات (شکل 7 b) نیز نشان داد نانوذرات نقره -آلژینات عمدتاً یک شکل نامنظم کروی و با تغییرات اندازه بین 74/43 تا 277/9 داشتند.
نتایج آزمون TEM: میکروگراف نانوذرات نقره سنتز شده به روش جوشاندن در شکل 8 نشان داده شده است. استفاده از این تکنیک کروی بودن نانوذرات سنتز شده را تأیید کرد. نتایج نشاندهنده این بود که نانوذرات حالت آگلومره داشتند.
نتایج آزمون میکروبی
بررسی قطر عدم هاله رشد نانوذرات تهیه شده بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان قطر عدم هاله رشد نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 2 بر روی باکتریهای Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات مورد بررسی بر قطر عدم هاله رشد تأثیر معنی¬داری داشت (P<0.05). بیشترین میزان مهار بازدارنگی توسط نانو ذرات تهیه شده به روش جوشاندن برای باکتریهای Yersinia enterocolitica و Escherichia coli بود سپس بیشترین مهارکنندگی در نانوذرات تهیه شده به روش بیومس تر در غلظت mM 3 و به دنبال آن در غلظت mM 2 و 1 مشاهده شد .(P<0.05). برای باکتری Edwardsiella بیشترین میزان مهار بازدارنگی توسط نانوذرات تهیه شده به روش بیومس تر در غلظت mM 3 و به دنبال آن در غلظت mM 2 مشاهده شد (P<0.05). در سایر روش¬های سنتز نانو ذرات تأثیر معناداری گزارش نشد (P>0.05). بر روی باکتری Pseudomonas aeruginosa مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر قطر عدم هاله رشد نداشت (P>0.05). تمامی نانوذرات به یک میزان حساسیت رشد نشان دادند.

شکل 7 : عکس¬های SEM نانوذرات (a) بدون پوشش (b) پوششدار شده با آلجینات
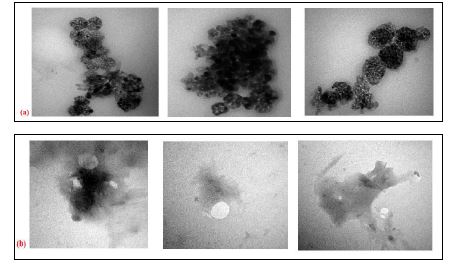
شکل 8 : میکروگراف الکترون عبوری (TEM) نانوذرات (a) بدون پوشش (b) پوششدار شده با آلجینات
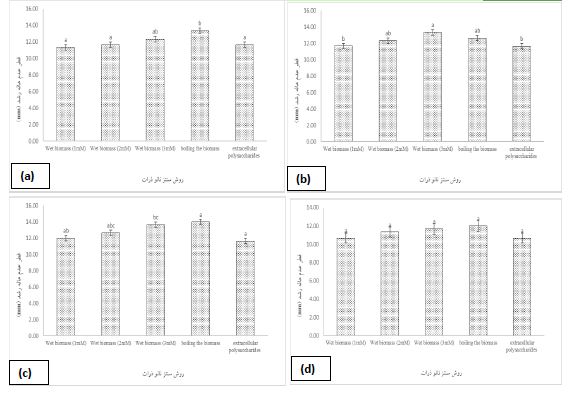
شکل 9 : نمودار میانگین نتایج قطر عدم هاله رشد نانو ذرات تهیه شده برحسب (mm) بر روی باکتری های (a) Escherichia coli (b) Edwardsiella (c) Yersinia enterocolitica (d) Pseudomonas aeruginosa
جدول 2 : میانگین نتایج قطر عدم هاله رشد نانو ذرات تهیه شده (برحسب mm) بر روی پاتوژن های ماهی
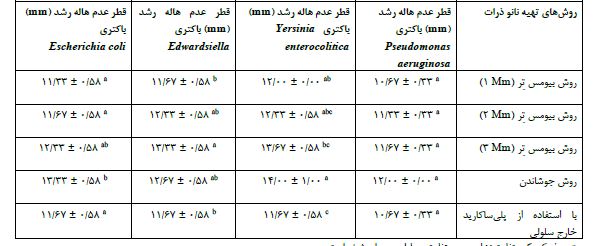
*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.

شکل:10 هاله عدم رشد باکتری در برابر نانوذرات نقره سنتز شده به سه روش مختلف a بیومس ترb جوشاندنc پلی ساکارید های خارج سلولی، (1) باکتری Edwardsiella ، (2) باکتری Yersinia enterocolitica ، (3) باکتری Pseudomonas aeruginosa ، (4) باکتری Escherichia coli ..
بررسی میزان MIC نانوذرات نقره
بررسی میزان MIC بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان MIC نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 3 بر روی باکتری های Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MIC تأثیر معنیداری باکتری Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نداشتند (P>0.05).
بررسی میزان MBC نانوذرات نقره
بررسی میزان MBC بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان MBC نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 4 بر روی باکتری های Pseudomonas aeruginos،Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MBC تأثیر معنیداری باکتریهای Pseudomonas aeruginos،Yersinia و Escherichia coli نداشتند (P>0.05). مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MBC تأثیر معنی¬داری باکتری Edwardsiella داشت (P<0.05). بیشترین مهارکشندگی توسط نانوذرات سنتز شده با استفاده از پلیساکاریدهای خارج سلولی و به دنبال آن نانوذرات سنتز شده به روش بیومس تَر با غلظت Mm 1 و 3 گزارش شد (P<0.05). کمترین میزان کشندگی توسط نانوذرات سنتز شده به روش جوشاندن و بیومس تَر با غلظت Mm 3 گزارش شد (P<0.05).
نتایج تأیید ممانعت از رشد باکتریها (OD) Optical density: جدول 5 نتایج تأیید ممانعت از رشد میکروارگانیسمهای مورد مطالعه اندازهگیری شده با UV را نشان میدهد. در طول اندازهگیریهای OD، مشخص شد که مرگ باکتریها ارتباط مستقیمی با غلظت نیترات نقره، پوششدهی نانوذرات دارد (P<0.05). مطابق با نتایج افزایش غلظت نیترات نقره در سنتز نانوذرات سبب افزایش درصد مهارکنندگی رشد باکتریهای مورد بررسی شد (P<0.05).
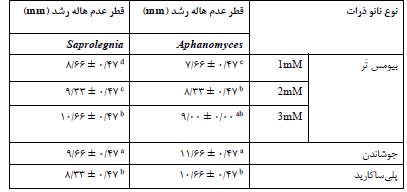
نتایج خاصیت ضد قارچی نانوذرات سنتز شده (قطر عدم هاله رشد)
نتایج خاصیت ضد قارچی بر روی قارچهای Aphanomyces و Saprolegnia: جدول 6 بررسی نتایج خاصیت ضد قارچی نانوذرات سنتز شده به روشهای مختلف را روی قارچ های Aphanomyces و Saprolegnia را نشان میدهد. مطابق نتایج روشهای مختلف سنتز تأثیر معنادار بر خاصیت ضد قارچی داشت (P<0.05). نانو ذرات سنتز شده در غلظت بالاتر نیترات نقره خاصیت ضد قارچی بالاتری داشتند (P<0.05). پوشش دار کردن نانوذرات با آلجینات نیز بهطور قابلتوجهای خاصیت ضد قارچی را افزایش داد (P<0.05). در مقایسه روشهای مختلف تهیه نانوذرات، نانوذرات نقره سنتز شده به روش جوشاندن و به دنبال آن نانوذرات سنتز شده با روش بیومس تَر در غلظت mM 3 بالاترین خاصیت ضد قارچی را نشان دادند (P<0.05). کمترین میزان فعالیت ضد قارچی در نانو ذرات سنتز شده به روش بیومس تَر در غلظت mM 1 گزارش شد (P<0.05).
جدول 3 میانگین نتایج MIC نانو ذرات تهیه شده (برحسب mg/ml) بر روی پاتوژن های ماهی

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است
جدول 4 میانگین نتایج MBC نانو ذرات تهیه شده (برحسب mg/ml) بر روی پاتوژن های ماهی
.JPG)
*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.
جدول 5 نتایج درصد زندهمانی میکروارگانیسمها در غلظتهای مختلف نانو ذرات سنتز شده به روش جوشاندن

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است
جدول 6 میانگین نتایج فعالیت ضد قارچی نانو ذرات سنتز شده (بر حسب mm) بر وری قارچ ها
*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.
بحث
نتایج مشخصهیابی نانو ذرات تهیه شده به روش بیومس تَر (شکل 4 a) در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM) ƛmax نانو ذرات نقره در طول موج nm 420 تا 434 مشاهده شد. که مربوط به جذب پلاسمون نانو ذرات نقره است که نشان میدهد که عصاره سیانوباکتریایی مسئول سنتز نانوذرات نقره است (26). در سنتز نانوذرات نقره به روش جوشاندن نیز یک پیک در طول موج nm 428 مشاهده شد که تأیید تشکیل نانوذرات نقره است. طی بررسی مشخصهیابی نانوذرات با کمک پلیساکاریدهای خارج سلولی مشاهده شد شدت پیک تابعی از زمان آزمایش افزایش یافت. در زمانهای 0 و 12 ساعت پیکی گزارش نشد. درحالیکه در در زمانهای 24، 48 و 72 ساعت به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 433، nm 433 مشاهده شد. گزارش شده است که طیف جذب نانو ذرات حداکثر ارتفاع پیک بین nm 420 تا 450 را همراه با جابجایی آبی یا قرمز با افزایش اندازه ذرات دارد (27). پیشنهاد میشود که اگزوپلیساکاریدها نقش کاهشدهنده و تثبیتکننده را ایفا کنند، زیرا این پلیمرهای پیچیده همچنین میتوانند حاوی بخشهای آمینو قند استیله شده و همچنین ترکیبات غیر کربوهیدراتی مانند فسفات، لاکتات، استات و گلیسرول باشند (28). تفاوت در پتانسیل سنتز نانوذرات سیانوباکتری ها ممکن است به دلیل تفاوتهای کمی و کیفی در مواد پروتئینی در عصارههای سلولی باشد. از نتایج بهدست آمده در این تحقیق می توان گفت نانوذارت بهدست آمده کروی بودند و با افزایش زمان و غلظت عصاره اندازه بزرگتری داشتند که مطابق با نتایج بدست آمده از مرفولوژی نانو ذارت (SEM) بود. همراستا با نتایج، Tomer و همکاران طی بررسی سنتز سبز نانوذرات با عصاره سیانوباکتر Haloleptolyngbya alcalis نشان دادند پیک SPR نانو ذرات در محدوده 400-450 مشاهده شد و گزارش کردند تشخیص تک پیک در 440 نانومتر با نانوذرات کروی شکل مطابقت دارد و ترکیبات زیست فعال موجود در عصاره را مسئول سنتز نانو ذرات گزارش کردند (10). همچنین، Sahoo و همکاران طی مشخصه یابی نانوذرات نقره از عصاره سیانوباکتر پیک تیز در محدوده nm 420 را گزارش کردند.و اظهار نمودند کاهش یونهای Ag و تبدیل به Ag (0) به دلیل ترکیبات زیست فعال در سیانوباکتر طی 48 تا 56 ساعت عمل کرد (29). Weiو همکاران نشان دادند افزایش نیترات نقره تا 52 mM سبب افزایش باند SPR شد که نشان دهنده تشکیل بیشتر نانوذرات نقره بود (29). دادههای FTIR بر اساس مطالعات Supengو همکاران، Mallikarjuna و همکاران (2011) همچنین Kanipandian و همکاران (2014) آنالیز شدند. مطابق با نتایج، هر سه طیف بریکدیگر منطبق هستند که نشان دهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروههای عاملی و اتمهای تشکیل دهنده هر طیف است (30) (31) (32). نتایج پتانسل زتا نانو ذرات نقره تولید شده به روشهای مختلف، تحرک و اندزاه آنها در شکل 6 گزارش شده است. نتایج پتانسیل زتا در هر سه روش مثبت بود که نشان دهنده بار مثبت ذرات پراکنده در سوسپانسیون میباشد. طی مقایسه سه روش تولید نانو ذرات مشخص شد تولید نانو ذرات با کمک جوشاندن پایداری بالاتری (mV 27/5) نسبت به سایر روشها داشتند. کاهش پتانسیل زتا در سایر روشها به دلیل گروه عاملی اکترونگاتیو آلجینات مورد استفاده در پایداری نانوذرات نقره است (33). بررسی اندازه ذرات بهدست آمده نشان داد کمترین به بیشتری اندازه در نانوذرات سنتز شده به روش بیومس تَر> جوشاندن > با کمک پلیساکارید خارج سلولی بود که به ترتیب اندازهای برابر با nm 115/4، 160 و 238/9 داشتند. Casals و همکاران (2010) طی بررسی پوششدهی نانو ذرات طلا با پروتئین نتایج مطابق با این مطالعه را نشان دادند. همچنین Faried و همکاران (2017)، طی بررسی تولید نانوذرات نقره و بررسی افزایش پایداری آن با آلجینات نشان دادند نانوذرات تولید شده پایداری بالایی داشتند (34). در مقایسه بین نتایج SEM نانو ذرات بدون پوشش و پوششدار تجمع کمترنانو ذرات نقره پوشش داده شده با آلجینات مشاهده شد. با این تفاوت که شکل نانوذرات اندکی خشنتر بود که میتواند تأیید کننده برهمکنش نانوذرات با ماتریس آلجینات باشد. Yalçın و همکاران (2022) نیز نشان دادند نانوذرات سنتز شده به روش سبز با استفاده از عصاره سیانوباکتر Oscillatoria princeps اندازه ذرات برابر با 38 nm و تقریباً کروی و بصورت آگلومره گزارش کردند. Kuraganti و همکاران نیز طی سنتز نانوذرات نقره از عصاره Characium typicum نشان دادند و اندازه نانوذرات سنتز شده را بین 22 تا 34 nm و به شکل بیضی گزارش کردند (35،36). TEM روش ارجح برای اندازهگیری مستقیم اندازه نانوذرات، اندازه دانه، توزیع اندازه و مورفولوژی است. میکروگرافهای بدست آمده از TEM کروی بودن نانوذرات سنتز شده و تجمع آنها را تأیید کرد. این تجمع نانوذرات سنتز شده از عصاره سیانوباکتری¬ها توسط مطالعات مختلف گزارش شده است (37). Hanna و همکاران نیز شکل کروی نانوذرات نقره سنتز شده از عصاره سیانوباکتر Phormidium ambiguum و Desertifilum tharense را با TEM نشان دادند (38).
در این مطالعه، فعالیت ضد باکتری نانوذرات نقره بر روی میکروارگانیسم پاتوژنزای ماهی شامل (Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli) مورد ارزیابی قرار گرفت. مطابق با نتایج افزایش غلظت نیترات نقره برای سنتز نانوذرات سبب افزایش حسایت باکتریها شد. مطابق با نتایج بالاترین حساسیت در باکتری Yersinia enterocolitica گزارش شد. در روشهای مورد بررسی بالاترین عدم هاله رشد در نانو ذرات سنتز شده به روش جوشاندن و پوشش داده شده با آلجینات مشاهده شد (39). نتایج مشابه در بررسی میزان MIC و MBC نانوذرات گزارش شد. در تمامی آزمایشات مورد بررسی تأثیر مثبت پوششدهی و روش جوشاندن برای سنتز نانوذرات در خاصیت ضد میکروبی نانوذرات را نشان داد (34). در رابطه با استفاده از پوشش برای پایداری نانوذرات، اینگونه میتوان گفت، عوامل پوشاننده به عنوان تثبیت کننده مانع از رشد بیش از حد نانوذرات میشوند و از تجمع/انعقاد آن¬ها در سنتز کلوئیدی جلوگیری میکنند که بسیار مهم است. همچنین، لیگاندهای پوشاننده سطح مشترک را که در آن نانوذرات با محیط آمادهسازی خود برهمکنش میکنند، را تثبیت می¬کنند (40). El-Naggar و همکاران، در رابطه با فعالیت ضد میکروبی نانوذرات نقره تهیه شده از عصاره فیکوبیلی پروتئینی سیانوباکتر اعلام کردند وجود مولکولهای زیستی فیکوبیلیپروتئین ممکن است توانایی لنگر انداختن نانوذرات پوشش داده شده بر روی غشای سلولی باکتریها را ارائه دهد و آنها را قادر میسازد تا به فعالیت ضدباکتریایی دست یابند (26). Seku و همکاران، طی بررسی سنتز سبز نانوذرات نقره با پوشش صمغ کندر گوگو کربوکسی متیله نشان دادند اثر ضد باکتریایی راروی باکتری Escherichia coli ، Bacillus subtilis و Bacillus cereus نشان دادند (41). Hamida و همکاران طی بررسی خاصیت ضد باکتری نانوذرات نقره سنتز شده از عصاره سیانوباکتری Desertifilum sp در برابر 5 باکتری (Bacillus cereus ، Pseudomonas aeruginosa ،Shigella flexneri ، Salmonella enterica و Bacillus subtilis) نشان دادند (42). Aletayeb و همکاران طی بررسی خواص ضد میکروبی نانوذرات نقره AgCl/AgPO4 از دو سویه متفاوت سیانوباکتر Nostoc نشان دادند نانوذرات ساخته شده توسط سویه Nostoc pruniforme در مهار رشد باکتری موثرتر از نانوذرات سنتز شده توسط سویه Nostoc M5094-IBRC بودند (43). محققان اینگونه نتیجهگیری کردند که که نانو ذرات Ag3¬PO4 در خواص ضد باکتریایی بسیار مهم هستند. همچنین فعالیت باکتریکشی این دو نوع نانوذره را نشان داند و اظهار کردند غلظت MBC با غلظت MIC یکسان بود. Karageorgou و همکاران نیز نشان دادند نانوذرات نقره سنتز شده از عصاره سیانوباکتر Pseudanabaena/Limnothrix sp اثر آنتیباکتریایی در غلظتهای پایین و در مدت زمان کوتاهی را علیه سلولهای باکتریایی گرم مثبت و گرم منفی داشتند (44). در تأیید خاصیت ضد میکروبی نانوذرات تهیه شده میزان تراکم نوری با استفاده از اسپکتوفتومتر اندازهگیری شد (42). مطابق با نتایج ارائه شده در (جدول 5) مرگ باکتریها ارتباط مستقیمی با غلظت نیترات نقره، پوششدهی نانو ذرات و روش سنتز نانو ذرات دارد. فعالیت ضد قارچی نانوذرات نقره ناشی از تشکیل ترکیبات نامحلول با گروه¬های سولفیدریل در دیواره سلولی قارچها و اختلال در آنزیمها و لیپیدهای متصل به غشاء است که باعث لیز سلولی میشود. آسیب به دیواره سلولی و غشاء منجر به افزایش نفوذپذیری غشا و آزاد شدن یونهای پتاسیم (K+) میشود .علاوه بر این، نانوذرات نقره فرآیندهای سلولی را که در جوانه زدن مخمر نقش دارند، احتمالاً از طریق اختلال در یکپارچگی غشاء مهار میکنند. میکروسکوپ الکترونی عبوری برهمکنش بین نانوذرات نقره و ساختار غشا را تایید میکند (45). Hamidaو همکاران طی بررسی خاصیت ضد قارچی نانوذرات نقره از دو عصاره سیانو باکتری Nostoc Bahar_M و Desertifilum sp نشان دادند نانوذرات تهیه شده از سویه Desertifilu sp خاصیت ضد قارچی بالاتری را نشان دادند و علت آن ¬را به الگوهای متفاوت رابط نانو/سلول ناشی از تفاوت در گروههای عاملی احاطه کننده نانوذرات نقره، که از سویههای سیانوباکتری مختلف مشتق شده¬اند، نسبت دادند (46). Elkomy و همکاران طی بررسی خاصیت آنتیباکتریال نانو ذرا تهیه شده از عصاره سیانوباکتری Phormidium formosum نشان دادند نانوذرات سنتز شده فعالیت ضد باکتریایی و ضد قارچی در برابر طیف وسیعی از باکتریهای بیماریزا داشتند (47). در این مطالعه، فقط از یک نوع سیانوباکتری (Dulcicalothrix alborzica) برای سنتز نانوذرات نقره استفاده شد. بررسی سنتز نانوذرات نقره با استفاده از سایر گونههای سیانوباکتری میتواند اطلاعات مفیدی در مورد تاثیر تنوع زیستی سیانوباکتریها بر خواص نانو ذرات نقره بهدست دهد. همچنین اثر ضد میکروبی نانو ذرات نقره بر روی چهار نوع باکتری گرم منفی مورد بررسی قرار گرفت .بررسی اثر ضد میکروبی نانوذرات نقره بر روی سایر میکروارگانیسمها مانند قارچها، ویروسها و باکتریهای گرم مثبت میتواند کاربردهای بالقوه این نانوذرات را گسترش دهد.
نتیجهگیری
نتایج، نشان ویژه سازی نانوذرات نقره سنتز شده را در هر سه روش تأیید کرد. حضور تنها یک باند SPR در طیف جذب نشاندهنده سنتز نانو ذرات کروی بود. نتایج طیف¬سنجی FTIR بهدست آمده نشان داد هر سه طیف بریکدیگر منطبق بودند که نشاندهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروه¬های عاملی و اتم¬های تشکیل دهنده هر طیف است. پتانسیل زتا نانوذرات سنتز شده در هر سه روش مثبت بود که نشاندهنده بار مثبت ذرات پراکنده در سوسپانسیون می¬باشد. طی مقایسه سه روش تولید نانوذرات مشخص شد تولید نانوذرات با کمک جوشاندن پایداری بالاتری (mV 5/27) نسبت به سایر روش¬ها داشتند. همچنین نانو ذرات تهیه شده به روش بیومس تحرک بالاتری داشتند. بررسی مورفولوژی نانو ذرات SEM و TEM کروی بودن نانوذرات سنتز شده را تأیید کرد. همچنین تجمع کمتر نانوذرات نقره پوشش داده شده با آلژینات در بررسی SEM مشاهده شد. بررسی خاصیت آنتیباکتریال و آنتیفانگال نانوذرات بر روی پاتوژنهای ماهی نشان دهنده فعالیت خوب ضد میکروبی نانوذرات سنتز شده به روش جوشاندن و پوشش¬دار شده با آلژینات نسبت به سایر روشها بود. این مطالعه نشان میدهد که نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط Dulcicalothrix alborzica میتوانند به عنوان یک جایگزین بالقوه برای آنتیبیوتیکهای سنتی در درمان عفونتهای باکتریایی در ماهیان استفاده شوند. این نانوذرات دارای مزایایی مانند طیف وسیع فعالیت ضد میکروبی، بیسمیت بودن برای سلولهای ماهی و قابلیت تولید به روش ساده و کمهزینه هستند. پیشنهاد میشود در تحقیقات آینده، سایر عوامل پوشش دهنده جهت تکمیل بانک اطلاعاتی و بررسی خواص آنتیباکتریال و آنتیفانگال نانوذرات نقره سنتز شده در این مقاله بر روی عوامل پاتوژنزای انسانی بررسی شوند. همچنین سنتز نانوذرات نقره از دیگر سویه های سیانوباکتر در مقایسه با عملکرد این مطالعه بررسی شود. در مجموع، نتایج این مطالعه نشان میدهد که نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط Dulcicalothrix alborzica دارای پتانسیل قوی برای استفاده به عنوان یک عامل ضد میکروبی در صنعت آبزیپروری هستند.
سپاسگزاری
نتایج موجود در این مقاله مستخرج از پایان نامه می باشد، به این وسیله از کلیه افراد تشکر و قدردانی می شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد علوم و تحقیقات تایید شده است (کد اخلاق :IR.IAU.B.REC.1401.030).
مشارکت نویسندگان
دکتر بهاره نوروزی در ارائه ایده و در طراحی مطالعه، حسن بیرانوند در جمعآوری دادهها و دکتر بهاره نوروزی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
توانایی فعالیت ضد قارچی نانو ذرات پوششدار شده در ممانعت از رشد دو سویه قارچ از خانواده اوومیستها (Aphanomyces invadans) و (Saprolegnia parasitica) بررسی شد. برای این منظور، ابتدا Aphanomyces invadans روی محیط کشت پپتون گلوکز حاوی آگار برای در دمای °C 26 به مدت 5 روز و Saprolegnia parasitica روی محیط کشت مخمر گلوکز در دمای °C 21 به مدت 2 گرمخانه گذاری شدند. اثرات ممانعت کنندگی از رشد غلظت های 1 تا 10 میلیگرم/ میلیلیتر نانوذره پوششدار شده و فاقد سنجیده شدند. برای این منظور، از پلیتهای 24 چاهکی استفاده گردید. 1 میلیلیتر از محیط کشتها درون هر چاهک ریخته شد سپس یک تکه کوچک 1 میلیمتری از میسلیومهای در حال رشد از هر قارچ درون هر چاهک قرار داده شد. سپس همه پلیتها گرمخانه گذاری شدند. کمترین غلظت که سبب مهار 90% رشد میسلیومها شد، برای هر سویه قارچی به عنوان MIC در نظر گرفته و گزارش شد (25).
تجزیه و تحلیل آماری
آنالیزهای آماری دادههای حاصل از هر آزمایش با نرمافزار SPSS version 16 انجام شد. تمام دادهها حاصل از نتایج سه تکرار بود. تفاوت معنیدار بین عوامل اندازهگیری شده با آنالیز واریانس یک طرفه با حدود اطمینان 95% و مقایسه میانگینها با آزمون توکی انجام گردید و نتایج مربوط به مقایسهها بهصورت نمودار با نرمافزار Excel رسم شد.
نتایج
نتایج طیفسنجی نانو ذرات تولید شده به سه روش مختلف: بررسی طیفسنجی نانو ذرات تهیه شده به روش بیومس در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM) در (شکل 4(a نشان داده شده است. به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 425 و nm 420 مشاهده شد. طی بررسی طیف¬سنجی (ƛmax) نانو ذرات تهیه شده به روش جوشاندن (شکل 4 b) در طول موج nm 428 مشاهده شد. بررسی طیف سنجی (ƛmax) نانوذرات تهیه شده به کمک پلیساکارید عصاره (شکل 4 c) در زمان¬های 0، 12، 24، 48 و 72 ساعت به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 433، nm 433 مشاهده شد در 0 و 12 ساعت پیک نمودار ƛmax مشاهده نشد.
نتایج آزمون FTIR: نتایج طیفسنجی FTIR نانو ذرات نقره سنتز شده به سه روش مختلف در شکل 5 (به ترتیب (a) طیفسنجی نانو ذرات تولید شده به روش بیومس تَر، (b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی) نشان داده شده است. با بررسی طیفها مشخص شد، هر سه طیف بریکدیگر منطبق هستند که نشان دهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروه های عاملی و اتم های تشکیل دهنده هر طیف است.
نتایج آزمون پتانسیل زتا: نتایج دیاگرام پتانسیل زتا نانو ذرات تولید شده (شکل 6) نشان داد پتانسیل زتا نانوذرات تولید شده به روش بیومس تر (شکل 6 a) برابر mV 7/24 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000192 داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6 b )، میانگین اندازه ذرات نانو نقره nm 0/75 ± 115/4 بهدست آمد. پتانسیل زتا نانو ذرات تولید شده به روش جوشاندن (شکل 6 c) برابر mV 27/5 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000199 داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6d¬)، میانگین اندازه ذرات نانو نقره nm 0/687 ± 160/0 بهدست آمد. پتانسیل زتا نانو ذرات تولید شده با کمک پلیساکاریدهای خارج سلولی (شکل 6 e ) برابر mV 22/5 بود و ذرات تحرک الکتروفورتیک برابر با cm2/Vs 0/000175. داشتند. بررسی اندازه ذرات بهدست آمده (شکل 6 f ) ، میانگین اندازه ذرات نانو نقره nm 0/612 ± 238/9
جدول 1: پیک های متناظر با گروه های عاملی تغییر در گروههای عاملی نانوذرات تولید شده به روش های مختلف


شکل 4: نتایج طیفسنجی UV.Vis نانوذرات نقره سنتز شده به سه روش مختلف ( (a) طیف سنجی نانوذرات تولید شده به روش بیومس تَر، (b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی)

شکل5 : نتایج طیفسنجی FTIR نانوذرات نقره سنتز شده به سه روش مختلف ( (a) طیفسنجی نانوذرات تولید شده به روش بیومس تَر،
(b) به روش جوشاندن، (c) با استفاده از پلیساکاریدهای خارج سلولی

شکل 6: نتایج دیاگرام پتانسیل زتا نانوذرات نقره سنتز شده به سه روش مختلف ( (a-b) طیف سنجی نانوذرات تولید شده به روش بیومس تَر، (c-d) به روش جوشاندن، (e-f) با استفاده از پلیساکاریدهای خارج سلولی)
نتایج آزمون SEM: نتایج عکس SEM نانوذرات بدون پوشش و پوششدهی شده با آلجینات بیوسنتز شده به روش جوشاندن در شکل 7 نشان داده شده است. در (شکل 7 a ) مورفولوژی نانوذرات سنتز شده بدون پوشش نشان داده شده است. نتایج نشان داد نانوذرات سنتز شده بهصورت کروی بوده و اندازه ذراتی nm 33/57 تا 80/67 داشتند. بررسی مورفولوژی نانوذرات پوشش داده شده با آلجینات (شکل 7 b) نیز نشان داد نانوذرات نقره -آلژینات عمدتاً یک شکل نامنظم کروی و با تغییرات اندازه بین 74/43 تا 277/9 داشتند.
نتایج آزمون TEM: میکروگراف نانوذرات نقره سنتز شده به روش جوشاندن در شکل 8 نشان داده شده است. استفاده از این تکنیک کروی بودن نانوذرات سنتز شده را تأیید کرد. نتایج نشاندهنده این بود که نانوذرات حالت آگلومره داشتند.
نتایج آزمون میکروبی
بررسی قطر عدم هاله رشد نانوذرات تهیه شده بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان قطر عدم هاله رشد نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 2 بر روی باکتریهای Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات مورد بررسی بر قطر عدم هاله رشد تأثیر معنی¬داری داشت (P<0.05). بیشترین میزان مهار بازدارنگی توسط نانو ذرات تهیه شده به روش جوشاندن برای باکتریهای Yersinia enterocolitica و Escherichia coli بود سپس بیشترین مهارکنندگی در نانوذرات تهیه شده به روش بیومس تر در غلظت mM 3 و به دنبال آن در غلظت mM 2 و 1 مشاهده شد .(P<0.05). برای باکتری Edwardsiella بیشترین میزان مهار بازدارنگی توسط نانوذرات تهیه شده به روش بیومس تر در غلظت mM 3 و به دنبال آن در غلظت mM 2 مشاهده شد (P<0.05). در سایر روش¬های سنتز نانو ذرات تأثیر معناداری گزارش نشد (P>0.05). بر روی باکتری Pseudomonas aeruginosa مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر قطر عدم هاله رشد نداشت (P>0.05). تمامی نانوذرات به یک میزان حساسیت رشد نشان دادند.

شکل 7 : عکس¬های SEM نانوذرات (a) بدون پوشش (b) پوششدار شده با آلجینات

شکل 8 : میکروگراف الکترون عبوری (TEM) نانوذرات (a) بدون پوشش (b) پوششدار شده با آلجینات

شکل 9 : نمودار میانگین نتایج قطر عدم هاله رشد نانو ذرات تهیه شده برحسب (mm) بر روی باکتری های (a) Escherichia coli (b) Edwardsiella (c) Yersinia enterocolitica (d) Pseudomonas aeruginosa
جدول 2 : میانگین نتایج قطر عدم هاله رشد نانو ذرات تهیه شده (برحسب mm) بر روی پاتوژن های ماهی

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.

شکل:10 هاله عدم رشد باکتری در برابر نانوذرات نقره سنتز شده به سه روش مختلف a بیومس ترb جوشاندنc پلی ساکارید های خارج سلولی، (1) باکتری Edwardsiella ، (2) باکتری Yersinia enterocolitica ، (3) باکتری Pseudomonas aeruginosa ، (4) باکتری Escherichia coli ..
بررسی میزان MIC نانوذرات نقره
بررسی میزان MIC بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان MIC نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 3 بر روی باکتری های Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MIC تأثیر معنیداری باکتری Pseudomonas aeruginos، Yersinia enterocolitica، Edwardsiella و Escherichia coli نداشتند (P>0.05).
بررسی میزان MBC نانوذرات نقره
بررسی میزان MBC بر روی باکتریهای پاتوژن ماهی مورد بررسی: بررسی میزان MBC نانوذرات تهیه شده با روش بیومس تِر در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM)، جوشاندن و با استفاده از پلیساکاریدهای خارج سلولی در جدول 4 بر روی باکتری های Pseudomonas aeruginos،Yersinia enterocolitica، Edwardsiella و Escherichia coli نشان داده شده است. مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MBC تأثیر معنیداری باکتریهای Pseudomonas aeruginos،Yersinia و Escherichia coli نداشتند (P>0.05). مطابق با نتایج روشهای مختلف سنتز نانو ذرات تأثیر معناداری بر MBC تأثیر معنی¬داری باکتری Edwardsiella داشت (P<0.05). بیشترین مهارکشندگی توسط نانوذرات سنتز شده با استفاده از پلیساکاریدهای خارج سلولی و به دنبال آن نانوذرات سنتز شده به روش بیومس تَر با غلظت Mm 1 و 3 گزارش شد (P<0.05). کمترین میزان کشندگی توسط نانوذرات سنتز شده به روش جوشاندن و بیومس تَر با غلظت Mm 3 گزارش شد (P<0.05).
نتایج تأیید ممانعت از رشد باکتریها (OD) Optical density: جدول 5 نتایج تأیید ممانعت از رشد میکروارگانیسمهای مورد مطالعه اندازهگیری شده با UV را نشان میدهد. در طول اندازهگیریهای OD، مشخص شد که مرگ باکتریها ارتباط مستقیمی با غلظت نیترات نقره، پوششدهی نانوذرات دارد (P<0.05). مطابق با نتایج افزایش غلظت نیترات نقره در سنتز نانوذرات سبب افزایش درصد مهارکنندگی رشد باکتریهای مورد بررسی شد (P<0.05).
نتایج خاصیت ضد قارچی نانوذرات سنتز شده (قطر عدم هاله رشد)
نتایج خاصیت ضد قارچی بر روی قارچهای Aphanomyces و Saprolegnia: جدول 6 بررسی نتایج خاصیت ضد قارچی نانوذرات سنتز شده به روشهای مختلف را روی قارچ های Aphanomyces و Saprolegnia را نشان میدهد. مطابق نتایج روشهای مختلف سنتز تأثیر معنادار بر خاصیت ضد قارچی داشت (P<0.05). نانو ذرات سنتز شده در غلظت بالاتر نیترات نقره خاصیت ضد قارچی بالاتری داشتند (P<0.05). پوشش دار کردن نانوذرات با آلجینات نیز بهطور قابلتوجهای خاصیت ضد قارچی را افزایش داد (P<0.05). در مقایسه روشهای مختلف تهیه نانوذرات، نانوذرات نقره سنتز شده به روش جوشاندن و به دنبال آن نانوذرات سنتز شده با روش بیومس تَر در غلظت mM 3 بالاترین خاصیت ضد قارچی را نشان دادند (P<0.05). کمترین میزان فعالیت ضد قارچی در نانو ذرات سنتز شده به روش بیومس تَر در غلظت mM 1 گزارش شد (P<0.05).
جدول 3 میانگین نتایج MIC نانو ذرات تهیه شده (برحسب mg/ml) بر روی پاتوژن های ماهی

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است
جدول 4 میانگین نتایج MBC نانو ذرات تهیه شده (برحسب mg/ml) بر روی پاتوژن های ماهی
.JPG)
*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.
جدول 5 نتایج درصد زندهمانی میکروارگانیسمها در غلظتهای مختلف نانو ذرات سنتز شده به روش جوشاندن

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است
جدول 6 میانگین نتایج فعالیت ضد قارچی نانو ذرات سنتز شده (بر حسب mm) بر وری قارچ ها

*حروف کوچک متفاوت نشان دهنده تفاوت معنادار در سطح 0/05 است.
بحث
نتایج مشخصهیابی نانو ذرات تهیه شده به روش بیومس تَر (شکل 4 a) در سه غلظت مختلف نیترات نقره (1، 2 و 3 mM) ƛmax نانو ذرات نقره در طول موج nm 420 تا 434 مشاهده شد. که مربوط به جذب پلاسمون نانو ذرات نقره است که نشان میدهد که عصاره سیانوباکتریایی مسئول سنتز نانوذرات نقره است (26). در سنتز نانوذرات نقره به روش جوشاندن نیز یک پیک در طول موج nm 428 مشاهده شد که تأیید تشکیل نانوذرات نقره است. طی بررسی مشخصهیابی نانوذرات با کمک پلیساکاریدهای خارج سلولی مشاهده شد شدت پیک تابعی از زمان آزمایش افزایش یافت. در زمانهای 0 و 12 ساعت پیکی گزارش نشد. درحالیکه در در زمانهای 24، 48 و 72 ساعت به ترتیب ƛmax نانو ذرات نقره در طول موج nm 434، nm 433، nm 433 مشاهده شد. گزارش شده است که طیف جذب نانو ذرات حداکثر ارتفاع پیک بین nm 420 تا 450 را همراه با جابجایی آبی یا قرمز با افزایش اندازه ذرات دارد (27). پیشنهاد میشود که اگزوپلیساکاریدها نقش کاهشدهنده و تثبیتکننده را ایفا کنند، زیرا این پلیمرهای پیچیده همچنین میتوانند حاوی بخشهای آمینو قند استیله شده و همچنین ترکیبات غیر کربوهیدراتی مانند فسفات، لاکتات، استات و گلیسرول باشند (28). تفاوت در پتانسیل سنتز نانوذرات سیانوباکتری ها ممکن است به دلیل تفاوتهای کمی و کیفی در مواد پروتئینی در عصارههای سلولی باشد. از نتایج بهدست آمده در این تحقیق می توان گفت نانوذارت بهدست آمده کروی بودند و با افزایش زمان و غلظت عصاره اندازه بزرگتری داشتند که مطابق با نتایج بدست آمده از مرفولوژی نانو ذارت (SEM) بود. همراستا با نتایج، Tomer و همکاران طی بررسی سنتز سبز نانوذرات با عصاره سیانوباکتر Haloleptolyngbya alcalis نشان دادند پیک SPR نانو ذرات در محدوده 400-450 مشاهده شد و گزارش کردند تشخیص تک پیک در 440 نانومتر با نانوذرات کروی شکل مطابقت دارد و ترکیبات زیست فعال موجود در عصاره را مسئول سنتز نانو ذرات گزارش کردند (10). همچنین، Sahoo و همکاران طی مشخصه یابی نانوذرات نقره از عصاره سیانوباکتر پیک تیز در محدوده nm 420 را گزارش کردند.و اظهار نمودند کاهش یونهای Ag و تبدیل به Ag (0) به دلیل ترکیبات زیست فعال در سیانوباکتر طی 48 تا 56 ساعت عمل کرد (29). Weiو همکاران نشان دادند افزایش نیترات نقره تا 52 mM سبب افزایش باند SPR شد که نشان دهنده تشکیل بیشتر نانوذرات نقره بود (29). دادههای FTIR بر اساس مطالعات Supengو همکاران، Mallikarjuna و همکاران (2011) همچنین Kanipandian و همکاران (2014) آنالیز شدند. مطابق با نتایج، هر سه طیف بریکدیگر منطبق هستند که نشان دهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروههای عاملی و اتمهای تشکیل دهنده هر طیف است (30) (31) (32). نتایج پتانسل زتا نانو ذرات نقره تولید شده به روشهای مختلف، تحرک و اندزاه آنها در شکل 6 گزارش شده است. نتایج پتانسیل زتا در هر سه روش مثبت بود که نشان دهنده بار مثبت ذرات پراکنده در سوسپانسیون میباشد. طی مقایسه سه روش تولید نانو ذرات مشخص شد تولید نانو ذرات با کمک جوشاندن پایداری بالاتری (mV 27/5) نسبت به سایر روشها داشتند. کاهش پتانسیل زتا در سایر روشها به دلیل گروه عاملی اکترونگاتیو آلجینات مورد استفاده در پایداری نانوذرات نقره است (33). بررسی اندازه ذرات بهدست آمده نشان داد کمترین به بیشتری اندازه در نانوذرات سنتز شده به روش بیومس تَر> جوشاندن > با کمک پلیساکارید خارج سلولی بود که به ترتیب اندازهای برابر با nm 115/4، 160 و 238/9 داشتند. Casals و همکاران (2010) طی بررسی پوششدهی نانو ذرات طلا با پروتئین نتایج مطابق با این مطالعه را نشان دادند. همچنین Faried و همکاران (2017)، طی بررسی تولید نانوذرات نقره و بررسی افزایش پایداری آن با آلجینات نشان دادند نانوذرات تولید شده پایداری بالایی داشتند (34). در مقایسه بین نتایج SEM نانو ذرات بدون پوشش و پوششدار تجمع کمترنانو ذرات نقره پوشش داده شده با آلجینات مشاهده شد. با این تفاوت که شکل نانوذرات اندکی خشنتر بود که میتواند تأیید کننده برهمکنش نانوذرات با ماتریس آلجینات باشد. Yalçın و همکاران (2022) نیز نشان دادند نانوذرات سنتز شده به روش سبز با استفاده از عصاره سیانوباکتر Oscillatoria princeps اندازه ذرات برابر با 38 nm و تقریباً کروی و بصورت آگلومره گزارش کردند. Kuraganti و همکاران نیز طی سنتز نانوذرات نقره از عصاره Characium typicum نشان دادند و اندازه نانوذرات سنتز شده را بین 22 تا 34 nm و به شکل بیضی گزارش کردند (35،36). TEM روش ارجح برای اندازهگیری مستقیم اندازه نانوذرات، اندازه دانه، توزیع اندازه و مورفولوژی است. میکروگرافهای بدست آمده از TEM کروی بودن نانوذرات سنتز شده و تجمع آنها را تأیید کرد. این تجمع نانوذرات سنتز شده از عصاره سیانوباکتری¬ها توسط مطالعات مختلف گزارش شده است (37). Hanna و همکاران نیز شکل کروی نانوذرات نقره سنتز شده از عصاره سیانوباکتر Phormidium ambiguum و Desertifilum tharense را با TEM نشان دادند (38).
در این مطالعه، فعالیت ضد باکتری نانوذرات نقره بر روی میکروارگانیسم پاتوژنزای ماهی شامل (Pseudomonas ، Yersinia، Edwardsiella و Escherichia coli) مورد ارزیابی قرار گرفت. مطابق با نتایج افزایش غلظت نیترات نقره برای سنتز نانوذرات سبب افزایش حسایت باکتریها شد. مطابق با نتایج بالاترین حساسیت در باکتری Yersinia enterocolitica گزارش شد. در روشهای مورد بررسی بالاترین عدم هاله رشد در نانو ذرات سنتز شده به روش جوشاندن و پوشش داده شده با آلجینات مشاهده شد (39). نتایج مشابه در بررسی میزان MIC و MBC نانوذرات گزارش شد. در تمامی آزمایشات مورد بررسی تأثیر مثبت پوششدهی و روش جوشاندن برای سنتز نانوذرات در خاصیت ضد میکروبی نانوذرات را نشان داد (34). در رابطه با استفاده از پوشش برای پایداری نانوذرات، اینگونه میتوان گفت، عوامل پوشاننده به عنوان تثبیت کننده مانع از رشد بیش از حد نانوذرات میشوند و از تجمع/انعقاد آن¬ها در سنتز کلوئیدی جلوگیری میکنند که بسیار مهم است. همچنین، لیگاندهای پوشاننده سطح مشترک را که در آن نانوذرات با محیط آمادهسازی خود برهمکنش میکنند، را تثبیت می¬کنند (40). El-Naggar و همکاران، در رابطه با فعالیت ضد میکروبی نانوذرات نقره تهیه شده از عصاره فیکوبیلی پروتئینی سیانوباکتر اعلام کردند وجود مولکولهای زیستی فیکوبیلیپروتئین ممکن است توانایی لنگر انداختن نانوذرات پوشش داده شده بر روی غشای سلولی باکتریها را ارائه دهد و آنها را قادر میسازد تا به فعالیت ضدباکتریایی دست یابند (26). Seku و همکاران، طی بررسی سنتز سبز نانوذرات نقره با پوشش صمغ کندر گوگو کربوکسی متیله نشان دادند اثر ضد باکتریایی راروی باکتری Escherichia coli ، Bacillus subtilis و Bacillus cereus نشان دادند (41). Hamida و همکاران طی بررسی خاصیت ضد باکتری نانوذرات نقره سنتز شده از عصاره سیانوباکتری Desertifilum sp در برابر 5 باکتری (Bacillus cereus ، Pseudomonas aeruginosa ،Shigella flexneri ، Salmonella enterica و Bacillus subtilis) نشان دادند (42). Aletayeb و همکاران طی بررسی خواص ضد میکروبی نانوذرات نقره AgCl/AgPO4 از دو سویه متفاوت سیانوباکتر Nostoc نشان دادند نانوذرات ساخته شده توسط سویه Nostoc pruniforme در مهار رشد باکتری موثرتر از نانوذرات سنتز شده توسط سویه Nostoc M5094-IBRC بودند (43). محققان اینگونه نتیجهگیری کردند که که نانو ذرات Ag3¬PO4 در خواص ضد باکتریایی بسیار مهم هستند. همچنین فعالیت باکتریکشی این دو نوع نانوذره را نشان داند و اظهار کردند غلظت MBC با غلظت MIC یکسان بود. Karageorgou و همکاران نیز نشان دادند نانوذرات نقره سنتز شده از عصاره سیانوباکتر Pseudanabaena/Limnothrix sp اثر آنتیباکتریایی در غلظتهای پایین و در مدت زمان کوتاهی را علیه سلولهای باکتریایی گرم مثبت و گرم منفی داشتند (44). در تأیید خاصیت ضد میکروبی نانوذرات تهیه شده میزان تراکم نوری با استفاده از اسپکتوفتومتر اندازهگیری شد (42). مطابق با نتایج ارائه شده در (جدول 5) مرگ باکتریها ارتباط مستقیمی با غلظت نیترات نقره، پوششدهی نانو ذرات و روش سنتز نانو ذرات دارد. فعالیت ضد قارچی نانوذرات نقره ناشی از تشکیل ترکیبات نامحلول با گروه¬های سولفیدریل در دیواره سلولی قارچها و اختلال در آنزیمها و لیپیدهای متصل به غشاء است که باعث لیز سلولی میشود. آسیب به دیواره سلولی و غشاء منجر به افزایش نفوذپذیری غشا و آزاد شدن یونهای پتاسیم (K+) میشود .علاوه بر این، نانوذرات نقره فرآیندهای سلولی را که در جوانه زدن مخمر نقش دارند، احتمالاً از طریق اختلال در یکپارچگی غشاء مهار میکنند. میکروسکوپ الکترونی عبوری برهمکنش بین نانوذرات نقره و ساختار غشا را تایید میکند (45). Hamidaو همکاران طی بررسی خاصیت ضد قارچی نانوذرات نقره از دو عصاره سیانو باکتری Nostoc Bahar_M و Desertifilum sp نشان دادند نانوذرات تهیه شده از سویه Desertifilu sp خاصیت ضد قارچی بالاتری را نشان دادند و علت آن ¬را به الگوهای متفاوت رابط نانو/سلول ناشی از تفاوت در گروههای عاملی احاطه کننده نانوذرات نقره، که از سویههای سیانوباکتری مختلف مشتق شده¬اند، نسبت دادند (46). Elkomy و همکاران طی بررسی خاصیت آنتیباکتریال نانو ذرا تهیه شده از عصاره سیانوباکتری Phormidium formosum نشان دادند نانوذرات سنتز شده فعالیت ضد باکتریایی و ضد قارچی در برابر طیف وسیعی از باکتریهای بیماریزا داشتند (47). در این مطالعه، فقط از یک نوع سیانوباکتری (Dulcicalothrix alborzica) برای سنتز نانوذرات نقره استفاده شد. بررسی سنتز نانوذرات نقره با استفاده از سایر گونههای سیانوباکتری میتواند اطلاعات مفیدی در مورد تاثیر تنوع زیستی سیانوباکتریها بر خواص نانو ذرات نقره بهدست دهد. همچنین اثر ضد میکروبی نانو ذرات نقره بر روی چهار نوع باکتری گرم منفی مورد بررسی قرار گرفت .بررسی اثر ضد میکروبی نانوذرات نقره بر روی سایر میکروارگانیسمها مانند قارچها، ویروسها و باکتریهای گرم مثبت میتواند کاربردهای بالقوه این نانوذرات را گسترش دهد.
نتیجهگیری
نتایج، نشان ویژه سازی نانوذرات نقره سنتز شده را در هر سه روش تأیید کرد. حضور تنها یک باند SPR در طیف جذب نشاندهنده سنتز نانو ذرات کروی بود. نتایج طیف¬سنجی FTIR بهدست آمده نشان داد هر سه طیف بریکدیگر منطبق بودند که نشاندهنده تساوی در میزان تخلیص آنها و تولید ترکیبات مشابه است. تفاوت اندکی در شدت پیک وجود دارد که به دلیل تفاوت در تعداد گروه¬های عاملی و اتم¬های تشکیل دهنده هر طیف است. پتانسیل زتا نانوذرات سنتز شده در هر سه روش مثبت بود که نشاندهنده بار مثبت ذرات پراکنده در سوسپانسیون می¬باشد. طی مقایسه سه روش تولید نانوذرات مشخص شد تولید نانوذرات با کمک جوشاندن پایداری بالاتری (mV 5/27) نسبت به سایر روش¬ها داشتند. همچنین نانو ذرات تهیه شده به روش بیومس تحرک بالاتری داشتند. بررسی مورفولوژی نانو ذرات SEM و TEM کروی بودن نانوذرات سنتز شده را تأیید کرد. همچنین تجمع کمتر نانوذرات نقره پوشش داده شده با آلژینات در بررسی SEM مشاهده شد. بررسی خاصیت آنتیباکتریال و آنتیفانگال نانوذرات بر روی پاتوژنهای ماهی نشان دهنده فعالیت خوب ضد میکروبی نانوذرات سنتز شده به روش جوشاندن و پوشش¬دار شده با آلژینات نسبت به سایر روشها بود. این مطالعه نشان میدهد که نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط Dulcicalothrix alborzica میتوانند به عنوان یک جایگزین بالقوه برای آنتیبیوتیکهای سنتی در درمان عفونتهای باکتریایی در ماهیان استفاده شوند. این نانوذرات دارای مزایایی مانند طیف وسیع فعالیت ضد میکروبی، بیسمیت بودن برای سلولهای ماهی و قابلیت تولید به روش ساده و کمهزینه هستند. پیشنهاد میشود در تحقیقات آینده، سایر عوامل پوشش دهنده جهت تکمیل بانک اطلاعاتی و بررسی خواص آنتیباکتریال و آنتیفانگال نانوذرات نقره سنتز شده در این مقاله بر روی عوامل پاتوژنزای انسانی بررسی شوند. همچنین سنتز نانوذرات نقره از دیگر سویه های سیانوباکتر در مقایسه با عملکرد این مطالعه بررسی شود. در مجموع، نتایج این مطالعه نشان میدهد که نانوذرات نقره پوششدار شده با آلجینات بیوسنتز شده توسط Dulcicalothrix alborzica دارای پتانسیل قوی برای استفاده به عنوان یک عامل ضد میکروبی در صنعت آبزیپروری هستند.
سپاسگزاری
نتایج موجود در این مقاله مستخرج از پایان نامه می باشد، به این وسیله از کلیه افراد تشکر و قدردانی می شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد علوم و تحقیقات تایید شده است (کد اخلاق :IR.IAU.B.REC.1401.030).
مشارکت نویسندگان
دکتر بهاره نوروزی در ارائه ایده و در طراحی مطالعه، حسن بیرانوند در جمعآوری دادهها و دکتر بهاره نوروزی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Nasr-Eldahan S, Nabil-Adam A, Shreadah MA, Maher AM, El-Sayed Ali T. A Review Article on Nanotechnology in Aquaculture Sustainability as a Novel Tool in Fish Disease Control. Aquaculture International 2021; 29: 1459-80.
2- Ameen F, Abdullah MM, Al-Homaidan AA, Al-Lohedan HA, Al-Ghanayem AA, Almansob A. Fabrication of Silver Nanoparticles Employing the Cyanobacterium Spirulina Platensis and Its Bactericidal Effect Against Opportunistic Nosocomial Pathogens of The Respiratory Tract. Journal of Molecular Structure 2020; 1217: 128392.
3- Younis NS, El Semary NA, Mohamed ME. Silver Nanoparticles Green Synthesis Via Cyanobacterium Phormidium Sp.: Characterization, Wound Healing, Antioxidant, Antibacterial, and Anti-Inflammatory Activities. Eur Rev Med Pharmacol Sci 2021: 25(7); 3083-96.
4- Qiu L, Zhang M, Bhandari B, Yang C. Shelf-life extension of aquatic products by applying nanotechnology: A review. Crit Rev Food Sci Nutr 2022; 62(6): 1521-35.
5- Muruganandam M, Chipps SR, Ojasvi PR. On The Advanced Technologies to Enhance Fisheries Production and Management. ASAG 2019; 3(8): 216-22.
6- Shah BR, Mraz J. Advances in Nanotechnology for Sustainable Aquaculture and Fisheries. Reviews in Aquaculture 2020; 12(2): 925-42.
7- Sarkar B, Mahanty A, Gupta SK, Choudhury AR, Daware A, Bhattacharjee S. Nanotechnology: A Next-Generation Tool for Sustainable Aquaculture. Aquaculture 2022; 546: 737330.
8- Nowruzi B, Hashemi N. A Review on the Antimicrobial Effects of Nanoparticles and Atmospheric Cold Plasma Technology. Journal of Isfahan Medical School 2023; 41(729): 631-42.
9- Tomer AK, Rahi T, Neelam DK, Dadheech PK. Cyanobacterial Extract-Mediated Synthesis of Silver Nanoparticles and their Application in Ammonia Sensing. International Microbiology 2019; 22: 49-58.
10- Javaid A, Oloketuyi SF, Khan MM, Khan F. Diversity of Bacterial Synthesis of Silver Nanoparticles. BioNanoScience 2018; 8: 43-59.
11- Aslam H, Shukrullah S, Naz MY, Fatima H, Hussain H, Ullah S, Assiri MA. Current and Future Perspectives of Multifunctional Magnetic Nanoparticles Based Controlled Drug Delivery Systems. Journal of Drug Delivery Science and Technology 2022; 67: 102946.
12- Nowruzi B, Beiranvand H. A Review of Medical Applications of Cyanobacteria. Journal of Isfahan Medical School 2024: 42(755); 69-83. [Persian]
13- Anvar SA, Nowruzi B, Afshari G. A Review of The Application of Nanoparticles Biosynthesized by Microalgae and Cyanobacteria in Medical and Veterinary Sciences. Iranian Journal of Veterinary Medicine 2023; 17(1): 1-18. [Persian]
14- Nowruzi B, Shalygin S. Multiple Phylogenies Reveal a True Taxonomic Position of Dulcicalothrix Alborzica Sp. Nov. (Nostocales, Cyanobacteria). Fottea 2021; 21(2): 235-46.
15- Raj R, Kumari M. Blue Green Algae (BGA) and Its Application. Journal of Pharmacognosy and Phytochemistry 2020; 9(2): 287-96.
16- Garg D, Sarkar A, Chand P, Bansal P, Gola D, Sharma S, et al. Synthesis of Silver Nanoparticles Utilizing Various Biological Systems: Mechanisms and Applications—A Review. Prog Biomater 2020; 9(3): 81-95.
17- Geetha S, Vijayakumar K, Aranganayagam KR, Thiruneelakandan G. Biosynthesis, Characterization of Silver Nanoparticles and Antimicrobial Screening by Oscillatoria Annae. AIP Conf Proc 2020: 2270(1); 110026.
18- Ahmed F, Soliman FM, Adly MA, Soliman HA, El‐Matbouli M, Saleh M. In Vitro Assessment of the Antimicrobial Efficacy of Chitosan Nanoparticles Against Major Fish Pathogens and their Cytotoxicity to Fish Cell Lines. J Fish Dis 2020; 43(9): 1049-63.
19- Al-Dhafri K, Ching CL. Phyto-Synthesis of Silver Nanoparticles and Its Bioactivity Response Towards Nosocomial Bacterial Pathogens. Biocatalysis and Agricultural Biotechnology 2019; 18: 101075.
20- Kashyap M, Samadhiya K, Ghosh A, Anand V, Shirage PM, Bala K. Screening of Microalgae for Biosynthesis and Optimization of Ag/Agcl Nano Hybrids Having Antibacterial Effect. RSC Advances 2019; 9(44): 25583-91.
21- Ismail GA, El-Sheekh MM, Samy RM, Gheda SF. Antimicrobial, Antioxidant, and Antiviral Activities of Biosynthesized Silver Nanoparticles by Phycobiliprotein Crude Extract of the Cyanobacteria Spirulina Platensis and Nostoc Linckia. Bionanoscience 2021; 11: 355-70.
22- Little RF, Hertweck C. Chain Release Mechanisms in Polyketide and Non-Ribosomal Peptide Biosynthesis. Nat Prod Rep 2022; 39(1): 163-205.
23- Nowruzi B, Blanco S, Nejadsattari T. Chemical and Molecular Evidences for the Poisoning of a Duck by Anatoxin-A, Nodularin and Cryptophycin at the Coast of Lake Shoormast (Mazandaran Province, Iran). International Journal on Algae 2018; 20(4): 359-76.
24- Divya M, Vaseeharan B, Abinaya M, Vijayakumar S, Govindarajan M, Alharbi NS, et al. Biopolymer Gelatin-Coated Zinc Oxide Nanoparticles Showed High Antibacterial, Antibiofilm and Anti-Angiogenic Activity. Journal of Photochemistry and Photobiology B: Biology 2018; 178: 211-8.
25- Gulick AM, Aldrich CC. Trapping Interactions between Catalytic Domains and Carrier Proteins of Modular Biosynthetic Enzymes with Chemical Probes. Nat prod Rep 2018; 35(11): 1156-84.
26- El-Naggar NE, Hussein MH, El-Sawah AA. Phycobiliprotein-Mediated Synthesis of Biogenic Silver Nanoparticles, Characterization, In Vitro and in Vivo Assessment of Anticancer Activities. Sci Rep 2018; 8(1): 8925.
27- Husain S, Afreen S, Yasin D, Afzal B, Fatma T. Cyanobacteria as A Bioreactor for Synthesis of Silver Nanoparticles-An Effect of Different Reaction Conditions on the Size of Nanoparticles and their Dye Decolorization Ability. J Microbiol Methods 2019; 162: 77-82.
28- Yadav S, Chandra S, Amardeep, Kumar A, Awasthi M. Green Synthesis of Silver Nano-Particle from Cyanobacteria and Effect on Microalgal Growth and Production of Exopolysaccharide (EPS). Cyanobacteria - Recent Advances and New Perspectives [Working Title]. IntechOpen; 2022. Available from: http://dx.doi.org/10.5772/intechopen.106039
29- Sahoo CR, Maharana S, Mandhata CP, Bishoyi AK, Paidesetty SK, Padhy RN. Biogenic Silver Nanoparticle Synthesis with Cyanobacterium Chroococcus Minutus Isolated from Baliharachandi Sea-Mouth, Odisha, and in Vitro Antibacterial Activity. Saudi J Biol Sci 2020; 27(6): 1580-6.
30- Supeng L, Guirong B, Hua W, Fashe L, Yizhe L. TG-DSC-FTIR Analysis of Cyanobacteria Pyrolysis. Physics Procedia 2012; 33: 657-62.
31- Mallikarjuna K, Narasimha G, Dillip GR, Praveen B, Shreedhar B, Lakshmi CS, et al. Green Synthesis of Silver Nanoparticles Using Ocimum Leaf Extract and their Characterization. Digest Journal of Nanomaterials and Biostructures 2011; 6(1): 181-6.
32- Kanipandian N, Kannan S, Ramesh R, Subramanian P, Thirumurugan R. Characterization, Antioxidant and Cytotoxicity Evaluation of Green Synthesized Silver Nanoparticles Using Cleistanthus Collinus Extract as Surface Modifier. Materials Research Bulletin 2014; 49: 494-502.
33- Shao Y, Wu C, Wu T, Yuan C, Chen S, Ding T, Ye X, Hu Y. Green Synthesis of Sodium Alginate-Silver Nanoparticles and their Antibacterial Activity. International Journal of Biological Macromolecules 2018; 111: 1281-92.
34- Manosalva N, Tortella G, Cristina Diez M, Schalchli H, Seabra AB, Durán N, et al. Green Synthesis of Silver Nanoparticles: Effect of Synthesis Reaction Parameters on Antimicrobial Activity. World J Microbiol Biotechnol 2019; 35(6): 1-9.
35- Yalçın D, Erkaya İA, Erdem B. Antimicrobial, Antibiofilm Potential, and Anti-Quorum Sensing Activity of Silver Nanoparticles Synthesized from Cyanobacteria Oscillatoria Princeps. Environ Sci Pollut Res Int 2022; 29(59): 89738-52.
36- Kuraganti GS, Edla S, Dasari T, Reddy M. Characterization, In Vitro Cytotoxic and Antibacterial Exploitation of Green Synthesized Freshwater Cyanobacterial Silver Nanoparticles. Journal of Applied Pharmaceutical Science 2020; 10(9): 088-98.
37- Vanlalveni C, Rajkumari K, Biswas A, Adhikari PP, Lalfakzuala R, Rokhum L. Green Synthesis of Silver Nanoparticles Using Nostoc Linckia and Its Antimicrobial Activity: A Novel Biological Approach. Bionanosci 2018; 8: 624-31.
38- Hanna AL, Hamouda HM, Goda HA, Sadik MW, Moghanm FS, Ghoneim AM, et al. Biosynthesis and Characterization of Silver Nanoparticles Produced by Phormidium Ambiguum and Desertifilum Tharense Cyanobacteria. Bioinorg Chem Appl 2022; 2022: 9072508.
39- Wu Y, Yang Y, Zhang Z, Wang Z, Zhao Y, Sun L. A Facile Method to Prepare Size-Tunable Silver Nanoparticles and Its Antibacterial Mechanism. Advanced Powder Technology 2018; 29(2): 407-15.
40- Javed R, Zia M, Naz S, Aisida SO, Ain NU, Ao Q. Role of Capping Agents in the Application of Nanoparticles in Biomedicine and Environmental Remediation: Recent Trends and Future Prospects. Nanobiotechnol 2020; 18: 1-5.
41- Seku K, Gangapuram BR, Pejjai B, Kadimpati KK, Golla N. Microwave-Assisted Synthesis of Silver Nanoparticles and their Application in Catalytic, Antibacterial and Antioxidant Activities. Journal of Nanostructure in Chemistry 2018; 8: 179-88.
42- Hamida RS, Abdelmeguid NE, Ali MA, Bin-Meferij MM, Khalil MI. Synthesis of Silver Nanoparticles Using a Novel Cyanobacteria Desertifilum Sp. Extract: Their Antibacterial and Cytotoxicity Effects. International Journal of Nanomedicine 2020: 49-63.
43- Aletayeb P, Ghadam P, Mohammadi P. Green Synthesis of Agcl/Ag3 PO4 Nanoparticle Using Cyanobacteria and Assessment of Its Antibacterial, Colorimetric Detection of Heavy Metals and Antioxidant Properties. IET Nanobiotechnology 2020; 14(8): 707-13.
44- Karageorgou D, Zygouri P, Tsakiridis T, Hammami MA, Chalmpes N, Subrati M, et al. Green Synthesis and Characterization of Silver Nanoparticles with High Antibacterial Activity Using Cell Extracts of Cyanobacterium Pseudanabaena/Limnothrix Sp. Nanomaterials 2022; 12(13): 2296.
45- Rozhin A, Batasheva S, Kruychkova M, Cherednichenko Y, Rozhina E, Fakhrullin R. Biogenic Silver Nanoparticles: Synthesis and Application as Antibacterial and Antifungal Agents. Micromachines 2021; 12(12): 1480.
46- Hamida RS, Ali MA, Goda DA, Redhwan A. Anticandidal Potential of Two Cyanobacteria-Synthesized Silver Nanoparticles: Effects on Growth, Cell Morphology, and Key Virulence Attributes of Candida Albicans. Pharmaceutics 2021; 13(10): 1688.
47- Elkomy RG. Antimicrobial Screening of Silver Nanoparticles Synthesized by Marine Cyanobacterium Phormidium Formosum. Iran J Microbiol 2020; 12(3): 242-8.
1- Nasr-Eldahan S, Nabil-Adam A, Shreadah MA, Maher AM, El-Sayed Ali T. A Review Article on Nanotechnology in Aquaculture Sustainability as a Novel Tool in Fish Disease Control. Aquaculture International 2021; 29: 1459-80.
2- Ameen F, Abdullah MM, Al-Homaidan AA, Al-Lohedan HA, Al-Ghanayem AA, Almansob A. Fabrication of Silver Nanoparticles Employing the Cyanobacterium Spirulina Platensis and Its Bactericidal Effect Against Opportunistic Nosocomial Pathogens of The Respiratory Tract. Journal of Molecular Structure 2020; 1217: 128392.
3- Younis NS, El Semary NA, Mohamed ME. Silver Nanoparticles Green Synthesis Via Cyanobacterium Phormidium Sp.: Characterization, Wound Healing, Antioxidant, Antibacterial, and Anti-Inflammatory Activities. Eur Rev Med Pharmacol Sci 2021: 25(7); 3083-96.
4- Qiu L, Zhang M, Bhandari B, Yang C. Shelf-life extension of aquatic products by applying nanotechnology: A review. Crit Rev Food Sci Nutr 2022; 62(6): 1521-35.
5- Muruganandam M, Chipps SR, Ojasvi PR. On The Advanced Technologies to Enhance Fisheries Production and Management. ASAG 2019; 3(8): 216-22.
6- Shah BR, Mraz J. Advances in Nanotechnology for Sustainable Aquaculture and Fisheries. Reviews in Aquaculture 2020; 12(2): 925-42.
7- Sarkar B, Mahanty A, Gupta SK, Choudhury AR, Daware A, Bhattacharjee S. Nanotechnology: A Next-Generation Tool for Sustainable Aquaculture. Aquaculture 2022; 546: 737330.
8- Nowruzi B, Hashemi N. A Review on the Antimicrobial Effects of Nanoparticles and Atmospheric Cold Plasma Technology. Journal of Isfahan Medical School 2023; 41(729): 631-42.
9- Tomer AK, Rahi T, Neelam DK, Dadheech PK. Cyanobacterial Extract-Mediated Synthesis of Silver Nanoparticles and their Application in Ammonia Sensing. International Microbiology 2019; 22: 49-58.
10- Javaid A, Oloketuyi SF, Khan MM, Khan F. Diversity of Bacterial Synthesis of Silver Nanoparticles. BioNanoScience 2018; 8: 43-59.
11- Aslam H, Shukrullah S, Naz MY, Fatima H, Hussain H, Ullah S, Assiri MA. Current and Future Perspectives of Multifunctional Magnetic Nanoparticles Based Controlled Drug Delivery Systems. Journal of Drug Delivery Science and Technology 2022; 67: 102946.
12- Nowruzi B, Beiranvand H. A Review of Medical Applications of Cyanobacteria. Journal of Isfahan Medical School 2024: 42(755); 69-83. [Persian]
13- Anvar SA, Nowruzi B, Afshari G. A Review of The Application of Nanoparticles Biosynthesized by Microalgae and Cyanobacteria in Medical and Veterinary Sciences. Iranian Journal of Veterinary Medicine 2023; 17(1): 1-18. [Persian]
14- Nowruzi B, Shalygin S. Multiple Phylogenies Reveal a True Taxonomic Position of Dulcicalothrix Alborzica Sp. Nov. (Nostocales, Cyanobacteria). Fottea 2021; 21(2): 235-46.
15- Raj R, Kumari M. Blue Green Algae (BGA) and Its Application. Journal of Pharmacognosy and Phytochemistry 2020; 9(2): 287-96.
16- Garg D, Sarkar A, Chand P, Bansal P, Gola D, Sharma S, et al. Synthesis of Silver Nanoparticles Utilizing Various Biological Systems: Mechanisms and Applications—A Review. Prog Biomater 2020; 9(3): 81-95.
17- Geetha S, Vijayakumar K, Aranganayagam KR, Thiruneelakandan G. Biosynthesis, Characterization of Silver Nanoparticles and Antimicrobial Screening by Oscillatoria Annae. AIP Conf Proc 2020: 2270(1); 110026.
18- Ahmed F, Soliman FM, Adly MA, Soliman HA, El‐Matbouli M, Saleh M. In Vitro Assessment of the Antimicrobial Efficacy of Chitosan Nanoparticles Against Major Fish Pathogens and their Cytotoxicity to Fish Cell Lines. J Fish Dis 2020; 43(9): 1049-63.
19- Al-Dhafri K, Ching CL. Phyto-Synthesis of Silver Nanoparticles and Its Bioactivity Response Towards Nosocomial Bacterial Pathogens. Biocatalysis and Agricultural Biotechnology 2019; 18: 101075.
20- Kashyap M, Samadhiya K, Ghosh A, Anand V, Shirage PM, Bala K. Screening of Microalgae for Biosynthesis and Optimization of Ag/Agcl Nano Hybrids Having Antibacterial Effect. RSC Advances 2019; 9(44): 25583-91.
21- Ismail GA, El-Sheekh MM, Samy RM, Gheda SF. Antimicrobial, Antioxidant, and Antiviral Activities of Biosynthesized Silver Nanoparticles by Phycobiliprotein Crude Extract of the Cyanobacteria Spirulina Platensis and Nostoc Linckia. Bionanoscience 2021; 11: 355-70.
22- Little RF, Hertweck C. Chain Release Mechanisms in Polyketide and Non-Ribosomal Peptide Biosynthesis. Nat Prod Rep 2022; 39(1): 163-205.
23- Nowruzi B, Blanco S, Nejadsattari T. Chemical and Molecular Evidences for the Poisoning of a Duck by Anatoxin-A, Nodularin and Cryptophycin at the Coast of Lake Shoormast (Mazandaran Province, Iran). International Journal on Algae 2018; 20(4): 359-76.
24- Divya M, Vaseeharan B, Abinaya M, Vijayakumar S, Govindarajan M, Alharbi NS, et al. Biopolymer Gelatin-Coated Zinc Oxide Nanoparticles Showed High Antibacterial, Antibiofilm and Anti-Angiogenic Activity. Journal of Photochemistry and Photobiology B: Biology 2018; 178: 211-8.
25- Gulick AM, Aldrich CC. Trapping Interactions between Catalytic Domains and Carrier Proteins of Modular Biosynthetic Enzymes with Chemical Probes. Nat prod Rep 2018; 35(11): 1156-84.
26- El-Naggar NE, Hussein MH, El-Sawah AA. Phycobiliprotein-Mediated Synthesis of Biogenic Silver Nanoparticles, Characterization, In Vitro and in Vivo Assessment of Anticancer Activities. Sci Rep 2018; 8(1): 8925.
27- Husain S, Afreen S, Yasin D, Afzal B, Fatma T. Cyanobacteria as A Bioreactor for Synthesis of Silver Nanoparticles-An Effect of Different Reaction Conditions on the Size of Nanoparticles and their Dye Decolorization Ability. J Microbiol Methods 2019; 162: 77-82.
28- Yadav S, Chandra S, Amardeep, Kumar A, Awasthi M. Green Synthesis of Silver Nano-Particle from Cyanobacteria and Effect on Microalgal Growth and Production of Exopolysaccharide (EPS). Cyanobacteria - Recent Advances and New Perspectives [Working Title]. IntechOpen; 2022. Available from: http://dx.doi.org/10.5772/intechopen.106039
29- Sahoo CR, Maharana S, Mandhata CP, Bishoyi AK, Paidesetty SK, Padhy RN. Biogenic Silver Nanoparticle Synthesis with Cyanobacterium Chroococcus Minutus Isolated from Baliharachandi Sea-Mouth, Odisha, and in Vitro Antibacterial Activity. Saudi J Biol Sci 2020; 27(6): 1580-6.
30- Supeng L, Guirong B, Hua W, Fashe L, Yizhe L. TG-DSC-FTIR Analysis of Cyanobacteria Pyrolysis. Physics Procedia 2012; 33: 657-62.
31- Mallikarjuna K, Narasimha G, Dillip GR, Praveen B, Shreedhar B, Lakshmi CS, et al. Green Synthesis of Silver Nanoparticles Using Ocimum Leaf Extract and their Characterization. Digest Journal of Nanomaterials and Biostructures 2011; 6(1): 181-6.
32- Kanipandian N, Kannan S, Ramesh R, Subramanian P, Thirumurugan R. Characterization, Antioxidant and Cytotoxicity Evaluation of Green Synthesized Silver Nanoparticles Using Cleistanthus Collinus Extract as Surface Modifier. Materials Research Bulletin 2014; 49: 494-502.
33- Shao Y, Wu C, Wu T, Yuan C, Chen S, Ding T, Ye X, Hu Y. Green Synthesis of Sodium Alginate-Silver Nanoparticles and their Antibacterial Activity. International Journal of Biological Macromolecules 2018; 111: 1281-92.
34- Manosalva N, Tortella G, Cristina Diez M, Schalchli H, Seabra AB, Durán N, et al. Green Synthesis of Silver Nanoparticles: Effect of Synthesis Reaction Parameters on Antimicrobial Activity. World J Microbiol Biotechnol 2019; 35(6): 1-9.
35- Yalçın D, Erkaya İA, Erdem B. Antimicrobial, Antibiofilm Potential, and Anti-Quorum Sensing Activity of Silver Nanoparticles Synthesized from Cyanobacteria Oscillatoria Princeps. Environ Sci Pollut Res Int 2022; 29(59): 89738-52.
36- Kuraganti GS, Edla S, Dasari T, Reddy M. Characterization, In Vitro Cytotoxic and Antibacterial Exploitation of Green Synthesized Freshwater Cyanobacterial Silver Nanoparticles. Journal of Applied Pharmaceutical Science 2020; 10(9): 088-98.
37- Vanlalveni C, Rajkumari K, Biswas A, Adhikari PP, Lalfakzuala R, Rokhum L. Green Synthesis of Silver Nanoparticles Using Nostoc Linckia and Its Antimicrobial Activity: A Novel Biological Approach. Bionanosci 2018; 8: 624-31.
38- Hanna AL, Hamouda HM, Goda HA, Sadik MW, Moghanm FS, Ghoneim AM, et al. Biosynthesis and Characterization of Silver Nanoparticles Produced by Phormidium Ambiguum and Desertifilum Tharense Cyanobacteria. Bioinorg Chem Appl 2022; 2022: 9072508.
39- Wu Y, Yang Y, Zhang Z, Wang Z, Zhao Y, Sun L. A Facile Method to Prepare Size-Tunable Silver Nanoparticles and Its Antibacterial Mechanism. Advanced Powder Technology 2018; 29(2): 407-15.
40- Javed R, Zia M, Naz S, Aisida SO, Ain NU, Ao Q. Role of Capping Agents in the Application of Nanoparticles in Biomedicine and Environmental Remediation: Recent Trends and Future Prospects. Nanobiotechnol 2020; 18: 1-5.
41- Seku K, Gangapuram BR, Pejjai B, Kadimpati KK, Golla N. Microwave-Assisted Synthesis of Silver Nanoparticles and their Application in Catalytic, Antibacterial and Antioxidant Activities. Journal of Nanostructure in Chemistry 2018; 8: 179-88.
42- Hamida RS, Abdelmeguid NE, Ali MA, Bin-Meferij MM, Khalil MI. Synthesis of Silver Nanoparticles Using a Novel Cyanobacteria Desertifilum Sp. Extract: Their Antibacterial and Cytotoxicity Effects. International Journal of Nanomedicine 2020: 49-63.
43- Aletayeb P, Ghadam P, Mohammadi P. Green Synthesis of Agcl/Ag3 PO4 Nanoparticle Using Cyanobacteria and Assessment of Its Antibacterial, Colorimetric Detection of Heavy Metals and Antioxidant Properties. IET Nanobiotechnology 2020; 14(8): 707-13.
44- Karageorgou D, Zygouri P, Tsakiridis T, Hammami MA, Chalmpes N, Subrati M, et al. Green Synthesis and Characterization of Silver Nanoparticles with High Antibacterial Activity Using Cell Extracts of Cyanobacterium Pseudanabaena/Limnothrix Sp. Nanomaterials 2022; 12(13): 2296.
45- Rozhin A, Batasheva S, Kruychkova M, Cherednichenko Y, Rozhina E, Fakhrullin R. Biogenic Silver Nanoparticles: Synthesis and Application as Antibacterial and Antifungal Agents. Micromachines 2021; 12(12): 1480.
46- Hamida RS, Ali MA, Goda DA, Redhwan A. Anticandidal Potential of Two Cyanobacteria-Synthesized Silver Nanoparticles: Effects on Growth, Cell Morphology, and Key Virulence Attributes of Candida Albicans. Pharmaceutics 2021; 13(10): 1688.
47- Elkomy RG. Antimicrobial Screening of Silver Nanoparticles Synthesized by Marine Cyanobacterium Phormidium Formosum. Iran J Microbiol 2020; 12(3): 242-8.
نوع مطالعه: پژوهشي |
موضوع مقاله:
میکروبیولوژی
دریافت: 1402/12/12 | پذیرش: 1403/5/1 | انتشار: 1403/8/15
دریافت: 1402/12/12 | پذیرش: 1403/5/1 | انتشار: 1403/8/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







