دوره 32، شماره 6 - ( شهریور 1403 )
جلد 32 شماره 6 صفحات 7932-7922 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nasratipour R, Mirzaei M, Mehrabi M R. Examining the Frequency of Selected Genes Involved in Biofilm Formation in Clinical Isolates of Acinetobacter Baumannii. JSSU 2024; 32 (6) :7922-7932
URL: http://jssu.ssu.ac.ir/article-1-6178-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6178-fa.html
نصرتیپور رضا، میرزایی محسن، مهرابی محمدرضا. بررسی فراوانی ژنهای منتخب دخیل در تشکیل بیوفیلم در جدایه های بالینی اسینتوباکتر بومانی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (6) :7922-7932
متن کامل [PDF 861 kb]
(488 دریافت)
| چکیده (HTML) (1258 مشاهده)
References:
1- Gedefie A, Demsis W, Ashagrie M, Kassa Y, Tesfaye M, Tilahun M, Bisetegn H, Sahle Z. Acinetobacter Baumannii Biofilm Formation and Its Role in Disease Pathogenesis: A Review. Infect Drug Resist 2021; 14: 3711-19.
2- Longo F, Vuotto C, Donelli G. Biofilm Formation in Acinetobacter Baumannii. New Microbiol 2014; 37(2): 119-27.
3- Zhu L, Yan Z, Zhang Z, Zhou Q, Zhou J, Wakeland EK, et al. Complete Genome Analysis of Three Acinetobacter Baumannii Clinical Isolates in China for Insight Into the Diversification of Drug Resistance Elements. PLoS One 2013; 8(6): e66584.
4- Alamri AM, Alsultan AA, Ansari MA, Alnimr AM. Biofilm-Formation in Clonally Unrelated Multidrug-Resistant Acinetobacter Baumannii Isolates. Pathogens 2020; 9(8): 630.
5- Gurung J, Khyriem AB, Banik A, Lyngdoh WV, Choudhury B, Bhattacharyya P. Association of Biofilm Production with Multidrug Resistance among Clinical Isolates of Acinetobacter Baumannii and Pseudomonas Aeruginosa from Intensive Care Unit. Indian J Crit Care Med 2013; 17(4): 214-8.
6- Lear G, Lewis GD. Microbial Biofilms: Current Research and Applications. Horizon Sci Press; 2012.
7- Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial Biofilms: From the Natural Environment to Infectious Diseases. Nat Rev Microbiol 2004; 2(2): 95-108.
8- Stewart PS, Costerton JW. Antibiotic Resistance of Bacteria in Biofilms. Lancet 2001; 358(9276): 135-8.
9- Brossard KA, Campagnari AA. The Acinetobacter Baumannii Biofilm Associated Protein Plays a Role in Adherence to Human Epithelial Cells. Infect Immun 2012; 80: 228-33.
10- Jalali M, Rasooli I, Ahmadi Zanoos K, Jahangiri A, Jalali Nadooshan M, Darvish Alipour Astaneh S. Immunogenicity of Amino Acid Region 7601-8140 in Biofilm Associated Protein of Acinetobacter Baumannii. MJMS 2014; 16(4): 15-26. [Persian]
11- McConnell MJ, Pachón J. Expression, Purification, and Refolding of Biologically Active Acinetobacter Baumannii Ompa from Escherichia Coli Inclusion Bodies. Protein Expr Purif 2011; 77(1): 98-103.
12- Choi CH, Lee EY, Lee YC, Park TI, Kim HJ, Hyun SH, et al. Outer Membrane Protein 38 of Acinetobacter Baumannii Localizes to the Mitochondria and Induces Apoptosis of Epithelial Cells. Cell Microbiol 2005; 7(8): 1127-38.
13- Smani Y, Fàbrega A, Roca I, Sánchez-Encinales V, Vila J, Pachón J. Role of Ompa in the Multidrug Resistance Phenotype of Acinetobacter Baumannii. Antimicrob Agents Chemother 2014; 58(3): 1806-8.
14- Tomaras AP, Dorsey CW, Edelmann RE, Actis LA. Attachment to and Biofilm Formation on Abiotic Surfaces by Acinetobacter Baumannii: Involvement of a Novel Chaperone-Usher Pili Assembly System. Microbiology 2003; 149(pt12): 3473-84.
15- Wang X, Preston JF 3rd, Romeo T. The Pgaabcd Locus of Escherichia Coli Promotes the Synthesis of a Polysaccharide Adhesin Required for Biofilm Formation. J Bacteriol 2004; 186(9): 2724-34.
16- Itoh Y, Rice JD, Goller C, Pannuri A, Taylor J, Meisner J, et al. Roles of Pgaabcd Genes in Synthesis, Modification, and Export of the Escherichia Coli Biofilm Adhesin Poly-Β-1, 6-N-Acetyl-D-Glucosamine. J Bacteriol 2008; 190(10): 3670-80.
17- Zeighami H, Valadkhani F, Shapouri R, Samadi E, Haghi F. Virulence Characteristics of Multidrug Resistant Biofilm Forming Acinetobacter Baumannii Isolated from Intensive Care Unit Patients. BMC Infect Dis 2019; 19(1): 629. [Persian]
18- Mozafari H, Mirkalantari SH, Sadeghi Kalani B, Amirmozafari N. Prevalence Determination of Virulence Related and Biofilm Formation Genes in Acinetobacter Baumannii Isolates From Clinical Respiratory Samples in Imam Khomeini Hospital, Tehran, Iran in 2018. Iran J Med Microbiol 2021; 15(3): 266-80. [Persian]
19- Tseng CC, Tsai YH, Hu A, Liou JW, Chang KC. Altered Susceptibility to the Bactericidal Effect of Photocatalytic Oxidation. Appl Microbiol Biotechnol 2016; 100(19): 8549-61.
20- Morris FC, Dexter C, Kostoulias X, Uddin MI, Peleg A. The Mechanisms of Disease Caused By Acinetobacter Baumannii. Front Microbiol 2019; 10: 1601.
21- Sechi LA, Karadenizli A, Deriu A, Zanetti S, Kolayli F, Balikci E, et al. PER-1 Type Beta-Lactamase Production In Acinetobacter Baumannii Is Related To Cell Adhesion. Med Sci Monit Basic Res 2004; 10(6): BR180-BR4.
22- Nirwati H, Hakim MS, Darma S, Mustafa M, Nuryastuti T. Detection of Blaoxa Genes and Identification of Biofilm-Producing Capacity of Acinetobacter Baumannii in a Tertiary Teaching Hospital, Klaten, Indonesia. Med J Malaysia 2018; 73(5): 291-6.
23- Ranjbar R, Farahani A. Study of Genetic Diversity, Biofilm Formation, and Detection of Carbapenemase, MBL, ESBL, and Tetracycline Resistance Genes in Multidrug-Resistant Acinetobacter Baumannii Isolated from Burn Wound Infections in Iran. Antimicrob Resist Infect Control 2019; 8(1): 172. [Persian]
24- Yang CH, Su PW, Moi SH, Chuang LY. Biofilm Formation in Acinetobacter Baumannii: Genotype-Phenotype Correlation. Molecules 2019; 24(10): 1849.
25- Liu C, Chang Y, Xu Y, Luo Y, Wu L, Mei Z, et al. Distribution of Virulence-Associated Genes and Antimicrobial Susceptibility in Clinical Acinetobacter Baumannii Isolates. Oncotarget 2018; 9(31): 21663-21673.
26- Fallah A, Rezaee MA, Hasani A, Barhaghi MHS, Kafil HS, et al. Frequency of Bap and Cpaa Virulence Genes in Drug Resistant Clinical Isolates of Acinetobacter Baumannii and their Role in Biofilm Formation. Iran J Basic Med Sci 2017; 20(8): 849-55. [Persian]
27- Thummeepak R, Kongthai P, Leungtongkam U, Sitthisak S. Distribution of Virulence Genes Involved in Biofilm Formation in Multidrug Resistant Acinetobacter Baumannii Clinical Isolates. Int Microbiol 2016; 19(2): 121-9.
28- Bardbari AM, Arabestani MR, Karami M, Keramat F, Alikhani MY, Bagheri KP. Correlation between Ability of Biofilm Formation with their Responsible Genes and MDR Patterns in Clinical and Environmental Acinetobacter Baumannii Isolates. Microb Pathog 2017; 108: 122-8.
29- Lib SS, Abdulrahman TR, Ali SH. Detection of Some Biofilm Genes Related with Multidrug-Resistant in Acinetobacter Baumannii Isolated from Clinical Isolates. Iraqi J Med Sci 2018; 16(4): 430-8.
30- McConnell MJ, Actis L, Pachón J. Acinetobacter Baumannii: Human Infections, Factors Contributing to Pathogenesis and Animal Models. FEMS Microbiol Rev 2013; 37(2): 130-55.
متن کامل: (979 مشاهده)
مقدمه
اسینتوباکتر بومانی به دلیل پراکندگی آن در بیمارستان و انتقال به بیماران بستری، بهطور عمده از نمونههای انسانی و محیط بیمارستان جدا میشود. این باکتری میتواند در بیماران بستری در بخش مراقبت ویژه (ICU) باعث عفونتهایی مانند پنومونی مرتبط با ونتیلاتور، باکتریمی، عفونتهای ادراری و برخی دیگر از عفونتهای بیمارستانی گردد (2 ، 1) و عامل بیش از 10% عفونتهای بیمارستانی و 70% مرگ و میرهای ناشی از عفونت است (3). پنومونیهای ایجاد شده توسط اسینتوباکتر بومانی میتواند بهصورت اکتسابی از جامعه بوده و یا در بیمارستان به دلیل ارتباط بیمار با دستگاههای تهویه یا اشیاء خارجی مانند لولهگذاری در تراشه، تراکئوستومی و یا سابقه جراحی و بیماریهای ریوی قبلی بهوجود می آید. طول مدت بستری بیماران مستعد در ICU و سهلانگاری در بهداشت احتمال کلونیزاسیون و عفونت ناشی از اسینتوباکتر بومانی را افزایش میدهد (5،4). به اجتماع سلولهای میکروبی که محکم به سطحی اتصال پیدا میکنند با یک ماتریکس پلیساکاریدی که دارای منشأ میکروبی است بیوفیلم میگویند. اصولاً باکتریها با تشکیل بیوفیلم سبب مقاومت در برابر عوامل ضد میکروبی، مقاومت در برابر سیستم ایمنی میزبان و سبب حفظ شرایط فیزیکی و شیمیایی مناسب برای رشد میشوند و این امر سبب مقاومت بیوفیلمها در شرایط نامساعد میشود. در ضمن روابط سینرژیسم و همیاری بین باکتریهای بیوفیلم در مقاومت آنها در مقابل شرایط نامساعد مؤثراست (7،6). یکی از ویژگیهای بارز بیوفیلمها، تفاوت در الگوی رشد آنها است که منجر به مقاومت دارویی و نیاز به روشهای درمانی و شناسایی متفاوت میشود. بیوفیلمها، مشابه اسپورهای باکتریایی، در برابر آنتیبیوتیکها مقاومت نشان میدهند، به گونهای که برخی محققان بر این باورند که مقاومت بیوفیلمها در مقابل آنتیبیوتیکها تا هزار برابر بیشتر از سلولهای پلانکتونیک است. بیوفیلمها در برابر عوامل ضدباکتریایی نظیر مواد ضدعفونیکننده، حرارت و خشکسازی مقاوم هستند و بر روی سطوح باقی میمانند، که این امر بهویژه در بیمارستانها موجب آلودگی و انتقال بیماریهای عفونی میشود و بهصورت فیزیکی از باکتریها در برابر سیستم ایمنی میزبان و آنتیبیوتیکها محافظت میکند. این پدیده به عنوان یکی از دلایل عود بیماریهای عفونی شناخته میشود (8). پروتئین-های مختلفی در ایجاد این مقاومت تأثیرگذارند که از این بین میتوان به پروتئینهای ایجادکننده و تقویتکننده ساختار بیوفیلم اشاره کرد. اولین عضو این گروه از پروتئینها با عنوان BAP در باکتری اسینتوباکتربومانی شناسایی شده است. این پروتئین در سطح خارجی باکتریها قرار دارند. شامل هسته مرکزی متشکل از تکرارهای متوالی از توالیهای مشابه هستند. به باکتری قابلیت تشکیل بیوفیلم میدهند به این ترتیب نقش مهمی در عفونتزایی پاتوژنها دارند (9). اسینتوباکتر بومانی با بیان ژن Bap سبب کاهش نفوذپذیری و در نتیجه ایجاد مقاومت به کارباپنمها میشود و علاوه بر آن با چسبندگی بالایی که با سطح زنده و غیرزنده ایجاد مینماید موجب پایداری بالای عامل بیماریزا میگردد (10). غشای خارجی در باکتریهای گرم منفی دارای ساختار دو لایهای است که به نظر میرسد شبیه به غشای پلاسمایی باشد. در غشای خارجی، پروتئینها در آن قرار میگیرند و سطح داخلی آن از فسفولیپیدها تشکیل شده است، که به شکلی مشابه با غشای سیتوپلاسمی ساخته شدهاند. پروتئینهای غشای خارجی، مانند OmpA، در باکتریهای گرم منفی نقشهای مهمی دارند. این پروتئینها به نفوذپذیری سلولی، مقاومت آنتیبیوتیکی، تطابق با محیط و بیماریزایی در سلول میزبان کمک میکنند. در اسینتوباکتر بومانی نیز انواعی از پروتئینهای غشاء خارجی از خانواده OmpA شناسایی شدهاند (11). این پروتئین فراوانترین پروتئین سطحی باکتری است که در اتصال و تهاجم به سلول¬های اپیتلیال و القاء آپوپتوزیس در مراحل اولیه عفونت اسینتوباکتر بومانی نقش دارد (12). علاوه بر این OmpA با مقاومت آنتیبیوتیکی در ارتباط است. گرچه مطالعاتی دخالت OmpA را به عنوان عامل مقاومت در برابر آنتیبیوتیکهای بتالاکتام نشان دادهاند، اما هنوز نقش این پروتئین در مقاومت ضدمیکروبی به روشنی مشخص نشده است، از طرفی مقاومت این باکتری نسبت به آنتیبیوتیکها در استفاده از داروها جهت درمان بیماران تأثیر نامطلوبی خواهد گذاشت (13). توماراس نشان داد که شکلگیری بیوفیلم در اسینتوباکتر بومانی بهطور فنوتیپی همراه با شکلگیری پیلوس و تولید اگزوپلیساکارید بود. آنالیز بیشتر توالیها مشخص کرد، اپرون پلیسیسترونیک Csu شامل 5 ژن است که شبیه ژنهایی میباشد که پروتئین های مربوط به چاپرون و هم-چنین پروتئینهایی را که در تجمع پیلوس در دیگر باکتریهای گرم منفی نقش دارد را کد می کند. چسبندگی اسینتوباکتر بومانی به سلولهای اپیتلیال برونش انسان و گلبولهای قرمز به علت وجود ساختاری شبه پیلوس ایجاد میشود (14). هموپلیمر خطی پلی- بتا-6،1-N- استیل-D- گلوکز آمین (PGA:beta-1,6-GlcNAc) به عنوان ادهسین برای حفظ ساختار بیوفیلم در یوباکتری¬ها عمل می¬کند که عملکرد آن به محصولات ژنی اپرون pgaABCD نیاز دارد که همه آنها برای تشکیل بیوفیلم ضروری هستند (16، 15). پژوهش در زمینه توانایی تشکیل بیوفیلم و ژنهای مؤثر در این فرآیند در سویههای متفاوت اسینتوباکتر بومانی، میتواند دادههای امیدبخشی را برای فهم بهتر فرایند پیچیده تشکیل بیوفیلم و عفونتهای ناشی از این میکروارگانیسمها ارائه دهد. بنابراین، مطالعه مورد نظر با هدف بررسی شیوع ژنهای منتخب مرتبط با تشکیل بیوفیلم در نمونههای بالینی اسینتوباکتر بومانی صورت گرفته است.
روش بررسی
از 49 نمونه (13 قطره خون،20 قطره خلط، 12 قطره ادرار، 4 نمونه زخم) اسینتوباکتر که از مراکز بهداشتی درمانی شهرستان بروجرد در پلیت جمعآوری شده بودند به آزمایشگاه تحقیقاتی دانشگاه آزاد واحد بروجرد انتقال داده شد و مورد استفاده قرار گرفتند و شناسایی تأییدی باکتری با روشهای استاندارد افتراقی میکروبیولوژی شد. به این ترتیب وجود کوکوباسیلهای گرم منفی اسینتو باکتر به روش میکروسکوپی تأیید شد. سپس تستهای افتراقی Methyl Red/ Voges-Proskaure(MRVP) و Sulfide Indol Motility (SIM) و Oxidative-Fermentative test(OF) و همچنین تستهای کاتالاز و اکسیداز و سیمون سیترات نیز انجام شد. رشد در 37 و 42 درجه سلسیوس، نیز از جمله تستهایی بود که جهت تشخیص گونههای مختلف اسینتوباکتر انجام شد (13) (شکل 1).
تولید بیوفیلم
تولید بیوفیلم با استفاده از روش میکروپلیت: جدایههای اسینتوباکتر بومانی را در محیط TSB که با 0/5 درصد گلوکز غنی شده باشد کشت میدهیم و در انکوباتور 37 درجه به مدت 24 ساعت میگذاریم. محیط کشت حاوی سوسپانسیون میکروبی را به نسبت 1 به 5 رقیق شده سپس 20 میکرولیتر از سوسپانسیون برای اضافه شدن به چاهکهای میکروپلیت انتخاب شد، در آن چاهکها ریخته شده به مدت 48 ساعت در 37 درجه انکوبه شد. کنترل منفی شامل 200 میکرولیتر از محیط TSB بود (15).
سنجش تولید بیوفیلم: بعد از انکوبه کردن به منظور سنجش مقدار تولید بیوفیلم در هر چاهک؛ 1) در ابتدا میکروپلیتها با استفاده از بافر PBS شستشو داده شدند، 2) چاهکها با استفاده از 150 میکرولیتر متانول به مدت 20 دقیقه ثابت میشوند سپس باقی مانده متانول خارج و پلیت در دمای اتاق در شرایط معکوس کاملاً خشک شده و 3) به مدت 15 دقیقه با رنگ سافرانین 0/01% رنگآمیزی شد و سپس پلیتها با آب مقطر شستشو داده شد و در مجاورت هوا خشک گردید و با اضافه کردن 150 میکرولیتر اتانول 95 درصد به مدت 15 دقیقه رنگ متصل شده به باکتری در بیوفیلم تشکیل شده جدا میشود و جذب نوری را در طول موج nm 490 با دستگاه الایزا ریدر اندازهگیری شد. مقادیر جذب نوری به عنوان شاخص اتصال باکتریها به سطح و تشکیل بیوفیلم در نظر گرفته شد. برای تجزیه و تحلیل کمی تولید بیوفیلم، میانگین جذب نوری سه چاهک (A) محاسبه و با چاهک کنترل (AC) مقایسه و بهصورت زیر محاسبه گردید:
1- عدم تشکیل بیوفیلم: A≤Ac
2- تشکیل بیوفیلم به صورت ضعیف: Ac×≤A˂(2×Ac)
3- تشکیل بیوفیلم به صورت متوسط: (2×Ac)×˂A≤ (4×Ac)
4- تشکیل بیوفیلم به صورت قوی: ˂A (4×Ac)
استخراج و تعیین کیفیت و کمیت DNA استخراجی: استخراج ژنوم به روش جوشاندن طبق دستورالعمل انجام شد. کیفیت و کمیت DNAاستخراج شده به ترتیب با کمک ژل الکتروفورز و نیز طیف سنجی (OD 260/280) بررسی شد (شکل2).
روش PCR: واکنش PCR در حجم 25 ماکرولیتر با استفاده از پرایمرهای اختصاصی جدول یک انجام شد. تکثیر ژنهای منتخب با شرایط دمای واسرشت اولیه در °C94 به مدت 5 دقیقه، 30 سیکل حرارتی شامل واسرشت در °C94 به مدت 1 دقیقه، اتصال پرایمر مطابق جدول 1 و تکثیر در °C72 به مدت 1 دقیقه و در پایان تکثیر در °C72 به مدت 10 دقیقه انجام شد. الکتروفورز محصولات PCR توسط ژل آگارز 1% انجام و سپس باندها توسط دستگاه ژل داک ( UVI-DOC) عکسبرداری شد.

شکل 1: اسینتوباکتر بومانی در Methyl Red/ Voges

شکل 2: چاهک های بیوفیلم
جدول 1: پرایمر¬های استفاده شده در این مطالعه (18 و 17).

تجزیه و تحلیل آماری
دادههای جمع آوری شده با استفاده از نرمافزارversion 16 SPSS بهطور توصیفی و تحلیلی بررسی شدند؛ تحلیل دادهها با آزمون مربع کای، آزمون دقیق فیشر انجام شد و P<0/05 به عنوان مبنای معنی دار بودن Significant در نظر گرفته شد.
نتایج
همه جدایههای مورد بررسی تمایل به تشکیل بیوفیلم داشتند. در میان انواع بیوفیلم تشکیل شده اکثر جدایههای مورد بررسی بیوفیلم ضعیف تشکیل دادند. فراوانی توانایی تشکیل بیوفیلم در میان جدایههای اسینتوباکتر بومانی در نمودار 4-1 گزارش شده است. تشکیل بیوفیلم در 3 جدایه (6 درصد) قوی، در 17 جدایه (35 درصد) متوسط و در 29 جدایه (59 درصد) ضعیف گزارش گردید. در این مطالعه مشخص شد، از میان 49 جدایه اسینتوباکتر بومانی، 43 جدایه (87%)، 45 جدایه (92%)، 48 جدایه (98%) و تمامی جدایه-ها (100%) به ترتیب واجد ژن ompA، csuA، bap و pgaB بودند (اشکال 3 تا 6).
لازم به ذکر است کنترل مثبت با روش تعیین توالییابی از حضور ژن مورد نظر تایید شد.
میزان تشکیل بیوفیلم در سویههای واجد ژنهای ompA، csuA، bap و pgaB مورد بررسی قرار گرفت. بر اساس آنالیز آماری بین میزان شدت تشکیل بیوفیلم به روش میکروتیترپلیت و حضور ژنهای مورد مطالعه ارتباط معناداری مشاهده نشد (P≥0.05). ژنهای ompA، csuA، bap و pgaB در جدایههای با توانایی تشکیل بیوفیلم (قوی، متوسط و ضعیف) مشاهده شدند.

شکل 3: محصولات PCR برای شناسایی ژن ompA: ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 6 نمونههای مثبت مورد آزمایش 531 جفت بازی.
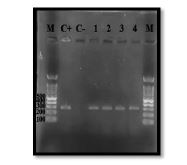
شکل 4: محصولات PCR برای شناسایی ژن csuA: ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 4 نمونههای مثبت مورد آزمایش 322 جفت بازی.

شکل 5: محصولات PCR برای شناسایی ژن bap:
ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 3 نمونههای مثبت مورد آزمایش 223 جفت بازی.
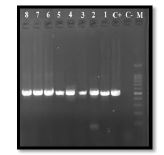
شکل 6: محصولات PCR برای شناسایی ژن pgaB:
ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 8 نمونههای مثبت مورد آزمایش 490 جفت بازی.
بحث
در طی دهه گذشته، اسینتوباکتر بومانی به عنوان یکی از مهمترین عوامل بیماریزای بیمارستانی در سراسر جهان شناخته شده است. بخشی از این مسئله به توانایی بقای این میکروارگانیسم در محیطهای بیمارستانی و اکتساب مکانیسمهای مقاومتی و ایجاد عفونتهای حاد، بهویژه در بیماران بدحال، مربوط میشود. با وجود اطلاعات فراوان در مورد مکانیسمهای مسئول مقاومت آنتیبیوتیکی در این میکروارگانیسم، هنوز راهی برای متوقف کردن آن معرفی نشده است (19). شدت عفونتزایی اسینتوباکتر بومانی بهطور مستقیم با فاکتورهای بیماریزایی آن مرتبط است. با این وجود، گزارشهای مربوط به فراوانی فاکتورهای بیماریزایی در نمونههای کلینیکی اسینتوباکتر بومانی نسبتاً کم است (20). در نتیجه چگونگی عفونتزایی و نیز پاسخ سیستم ایمنی میزبان نسبت به این عفونتها، همچنان در هالهای از ابهام باقی مانده است. در این مطالعه، فراوانی چهار ژن مرتبط با فاکتورهای بیماریزایی در نمونههای بالینی Acinetobacter baumannii جدا شده از بیماران را بررسی کردیم. بیوفیلم به-عنوان یک فاکتور بیماریزایی مهم در نمونههای بالینی اسینتوباکتر بومانی مطرح است. تشکیل بیوفیلم یکی از خصوصیتهای مهم در پاتوژنزایی اسینتوباکتر به خصوص در عفونتهای ایجاد شده به واسطه ونتیلاتور میباشد و این واضح است که افزایش تولید پلیساکارید موجب افزایش بیوفیلم و متعاقب آن افزایش مقاومت میباشد. در مطالعه حاضر که به بررسی این موضوع پرداختیم و مشاهده شد تمامی جدایهها توانایی تشکیل بیوفیلم را داشتند که با مطالعه Sechi و همکاران همپوشانی نسبی دارد بهطوری که 80% سویهها توانایی تشکیل بیوفیلم را داشتند (21). در مطالعه حاضر تشکیل بیوفیلم در 3 جدایه (6 درصد) قوی، در 17 جدایه (35درصد) متوسط و در 29 جدایه (59 درصد) ضعیف گزارش گردید، در میان انواع بیوفیلم تشکیل شده اکثر جدایههای مورد بررسی بیوفیلم ضعیف تشکیل دادند که با مطالعه اکبری و همکاران همخوانی دارد، همچنین در مطالعه Nirwati و همکاران در سال 2018 (22) که با هدف بررسی توانایی تشکیل بیوفیلم در جدایههای اسینتوباکتر بومانی انجام شد نتایج نشان داد که 52/2% جدایهها بیوفیلم ضعیف، 20% جدایهها بیوفیلم متوسط و 2/5% جدایهها بیوفیلم قوی تشکیل دادند که با مطالعه حاضر همخوانی دارد. این در حالی است که در مطالعه مشابه رنجبر و همکاران تشکیل بیوفیلم در 70/6% قوی، در 12/2% متوسط و 17/2% ضعیف گزارش گردید اکثر جدایههای مورد بررسی بیوفیلم قوی تشکیل دادند (23). گسترش و ضخامت ساختارهای بیوفیلم و اتصالات داخل سلولی ارتباط تنگاتنگ با پروتئینهای خانواده bap دارد که توسط ژن bap کد میشوند (24، 2). نتایج حاصل از درصد فراوانی ژنهای مطالعه حاضر با مطالعه Liu و همکاران که در چین انجام شد، شباهت زیادی دارد. در مطالعه مذکور بین 88 نمونه بالینی اسینتوباکتر بومانی فراوانی ژن bap 87/5% گزارش گردید (25). همچنین در مطالعه Fallah و همکاران در سال 2017، روی 100 ایزوله بالینی در ایران فراوانی این ژن 92% گزارش شد (26). ompA یک پروتئین غشای خارجی است که القاکننده بیوفیلم روی سلولهای اپیتلیال انسانی است. این پروتئین توسط ژن ompA کد میشود (27). در دو مطالعه جداگانه در ایران که توسط Bardbari و همکاران در سال 2017 و Zeighami و همکاران در سال 2019 انجام گردید، درصد فراوانی این ژن به ترتیب، 100% در جدایههای بالینی اسینتوباکتر بومانی جدا شده از نمونههای تنفسی در مطالعه Bardbari و 81% در جدایههای مربوط به سایر نمونه-های بالینی در مطالعه و Zeighami و همکاران، گزارش شده است که شباهت بالایی با مطالعه حاضر داشتند (28 ، 17). اگرچه ژن ompA فراوانی بالایی دارد، ولی بر اساس مطالعات پیشین ایجاد ساختارهای بیوفیلم با ژن bap در مقایسه با ژن ompA ارتباط موثرتری دارد (29). ژن csuA متعلق به اپرون ژنی csu است که شامل 6 ژن (BABCDE/csuA) بوده و سیستم ترشحی چاپرون آشر را کد و در ایجاد پیلی و تشکیل ساختارهای بیوفیلم روی سطوح غیر جاندار بسیار مهم است (30). در مطالعه حاضر ژن csuA فراوانی 92% داشت. در مطالعه مظفری و همکاران که در سال 2018 بر روی نمونه-های بالینی اسینتوباکتر بومانی انجام شد فراوانی این ژن 98% گزارش شده است (18). این یافتهها نشان دهنده این مهم هستند که بیشتر سویههای بالینی اسینتوباکتر بومانی جداشده، توانایی تشکیل بیوفیلم را دارند.در برخی مطالعات، شباهت دادهها با نتایج این تحقیق بسیار پایین بوده است، که این موضوع میتواند ناشی از تفاوتهایی در نوع نمونههای مورد بررسی و زمان انجام مطالعه باشد. به عنوان مثال، تغییرات جغرافیایی و تفاوتهای فرهنگی در روشهای نمونهبرداری و تشخیص میتواند بر روی دادههای به دست آمده تأثیر بگذارد. همچنین، تغییرات در شیوع بیماریها و مقاومت دارویی در طول زمان میتواند بر نتایج تأثیر بگذارد .از سوی دیگر، باکتریهای اسینتوباکتر بومانی از مکانیزمهای متنوعی برای حفظ پاتوژنیسیته، فرار از سیستم ایمنی میزبان، و همچنین مقاومت در برابر آنتیبیوتیکها استفاده میکنند. این مکانیزمها میتوانند شامل تولید آنزیمهایی که آنتیبیوتیکها را تجزیه میکنند، تغییر در ساختار گیرندههای دارویی، و استفاده از سیستمهای افزار دفاعی مانند پمپهای افزار برای دفع دارو باشند .با وجود اینکه در کشور ما مطالعات فراوانی در رابطه با ویژگیهای اپیدمیولوژیک و الگوی مقاومت دارویی جدایههای اسینتوباکتر بومانی انجام شده است، همچنان توجه به نقش این باکتری به عنوان یک عامل بالقوه خطرناک در عفونتهای بیمارستانی ضروری بهنظر میرسد. این امر بهویژه در محیطهای بیمارستانی که با چالشهای مقاومت دارویی مواجه هستند، اهمیت دارد. توسعه استراتژیهای جدید برای مقابله با این باکتریها و جلوگیری از شیوع بیماریهای بیمارستانی ناشی از آنها، یک اولویت بهداشتی مهم است. افزایش آگاهی در میان کادر پزشکی و بیماران، بهبود روشهای کنترل عفونت، و تحقیقات بیشتر در زمینه مکانیزمهای مقاومت دارویی این باکتریها میتواند به کاهش خطرات ناشی از آنها کمک کند.
نتیجهگیری
عفونت اسینتوباکتر بومانی، یک چالش پزشکی جهانی است. پاتوژنهای فرصتطلب و بهخصوص در تجمع و تداوم در محیط بیمارستان موفق هستند. قادر به مقاومت در برابر خشکی میباشند و در سطوح بیجان برای سالها زنده می-مانند. در میان شایعترین علل عفونت بیمارستانی قرار دارد؛ به علت مقاومت در برابر عوامل فیزیکی و شیمیایی که با تشکیل بیوفیلم ایجاد میشود. کسب توانایی تشکیل بیوفیلم میتواند یک استراتژی خوب به منظور افزایش بقا تحت شرایط استرس، به عنوان مثال در طول حمله میزبان یا پس از درمان آنتیبیوتیک میباشد. درک بیشتری از ماهیت بیوفیلم و ارتباط بین سلولی در بیوفیلم و همچنین نقش آنها در ارتباط با مقاومت آنتی بیوتیکی و عفونت جدایههای اسینتوباکتر بومانی در توسعه درمانهای جدید و موثر برای عفونتهای اسینتوباکتر کمک خواهد کرد. با توجه به میزان فراوانی بالای ژنهای دخیل در پاتوژنسیته، افزایش میزان شیوع بیمارستانی اسینتوباکتر بومانی، لزوم طراحی مطالعه در سطح وسیع و هم-چنین برنامههای حفاظتی نظیر کنترل عفونتهای ایجادشده در بخش مراقبتهای ویژه را خاطرنشان میکند. همچنین با استفاده از روشهای مولکولی میتوان این باکتریهای پاتوژن را شناسایی و ویژگی مقاومت آنتیبیوتیکی آنها را تعیین کرد و متناسب با آن آنتیبیوتیکها تجویز نمود. محدود کردن استفاده از آنتیبیوتیکها، گسترش و تغییر طرحهای نظافت برای تجهیزات آلوده و دستهبندی بیمارانی که این باکتری در آنها مستقر شده است، راهکار مفیدی برای کنترل انتشار این باکتری است.
سپاسگزاری
اﻳﻦ ﻣﻘﺎﻟﻪ ﺑﺮﮔﺮﻓﺘﻪ ﺍﺯ رساله کارشناسی ارشد در رشته میکروبیولوژی در ﺩﺍﻧﺸﮕﺎﻩ آزاد اسلامی واحد بروجرد ﻣﻲﺑﺎﺷﺪ. هزینه اجرای آن توسط پژوهشگر تامین شد. ﺍﺯ ﺗﻤﺎﻣﻲ ﺁﺯﻣﻮﺩﻧﻲﻫﺎ ﻭ ﺍﻓﺮﺍﺩﻱ ﻛﻪ ﺩﺭ ﺍﻧﺠﺎﻡ ﺍﻳﻦ ﻣﻄﺎﻟﻌﻪ ﺷﺮﻛﺖ ﻭ ﻫﻤﻜﺎﺭﻱ ﺩﺍﺷﺘﻪﺍﻧﺪ ﺗﺸﻜﺮ ﻭ ﻗﺪﺭﺩﺍﻧﻲ ﻣﻲﮔﺮﺩﺩ.
حامی مالی: ندارد
تعارض در منافع : وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد بروجرد تایید شده است (کد اخلاق IR.IAU.B.REC.100.028)
مشارکت نویسندگان
محسن میرزایی در ارائه ایده، رضا نصرتیپور و محسن میرزایی در طراحی مطالعه، رضا نصرتیپور در جمعآوری دادهها، محمدرضا مهرابی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
اسینتوباکتر بومانی به دلیل پراکندگی آن در بیمارستان و انتقال به بیماران بستری، بهطور عمده از نمونههای انسانی و محیط بیمارستان جدا میشود. این باکتری میتواند در بیماران بستری در بخش مراقبت ویژه (ICU) باعث عفونتهایی مانند پنومونی مرتبط با ونتیلاتور، باکتریمی، عفونتهای ادراری و برخی دیگر از عفونتهای بیمارستانی گردد (2 ، 1) و عامل بیش از 10% عفونتهای بیمارستانی و 70% مرگ و میرهای ناشی از عفونت است (3). پنومونیهای ایجاد شده توسط اسینتوباکتر بومانی میتواند بهصورت اکتسابی از جامعه بوده و یا در بیمارستان به دلیل ارتباط بیمار با دستگاههای تهویه یا اشیاء خارجی مانند لولهگذاری در تراشه، تراکئوستومی و یا سابقه جراحی و بیماریهای ریوی قبلی بهوجود می آید. طول مدت بستری بیماران مستعد در ICU و سهلانگاری در بهداشت احتمال کلونیزاسیون و عفونت ناشی از اسینتوباکتر بومانی را افزایش میدهد (5،4). به اجتماع سلولهای میکروبی که محکم به سطحی اتصال پیدا میکنند با یک ماتریکس پلیساکاریدی که دارای منشأ میکروبی است بیوفیلم میگویند. اصولاً باکتریها با تشکیل بیوفیلم سبب مقاومت در برابر عوامل ضد میکروبی، مقاومت در برابر سیستم ایمنی میزبان و سبب حفظ شرایط فیزیکی و شیمیایی مناسب برای رشد میشوند و این امر سبب مقاومت بیوفیلمها در شرایط نامساعد میشود. در ضمن روابط سینرژیسم و همیاری بین باکتریهای بیوفیلم در مقاومت آنها در مقابل شرایط نامساعد مؤثراست (7،6). یکی از ویژگیهای بارز بیوفیلمها، تفاوت در الگوی رشد آنها است که منجر به مقاومت دارویی و نیاز به روشهای درمانی و شناسایی متفاوت میشود. بیوفیلمها، مشابه اسپورهای باکتریایی، در برابر آنتیبیوتیکها مقاومت نشان میدهند، به گونهای که برخی محققان بر این باورند که مقاومت بیوفیلمها در مقابل آنتیبیوتیکها تا هزار برابر بیشتر از سلولهای پلانکتونیک است. بیوفیلمها در برابر عوامل ضدباکتریایی نظیر مواد ضدعفونیکننده، حرارت و خشکسازی مقاوم هستند و بر روی سطوح باقی میمانند، که این امر بهویژه در بیمارستانها موجب آلودگی و انتقال بیماریهای عفونی میشود و بهصورت فیزیکی از باکتریها در برابر سیستم ایمنی میزبان و آنتیبیوتیکها محافظت میکند. این پدیده به عنوان یکی از دلایل عود بیماریهای عفونی شناخته میشود (8). پروتئین-های مختلفی در ایجاد این مقاومت تأثیرگذارند که از این بین میتوان به پروتئینهای ایجادکننده و تقویتکننده ساختار بیوفیلم اشاره کرد. اولین عضو این گروه از پروتئینها با عنوان BAP در باکتری اسینتوباکتربومانی شناسایی شده است. این پروتئین در سطح خارجی باکتریها قرار دارند. شامل هسته مرکزی متشکل از تکرارهای متوالی از توالیهای مشابه هستند. به باکتری قابلیت تشکیل بیوفیلم میدهند به این ترتیب نقش مهمی در عفونتزایی پاتوژنها دارند (9). اسینتوباکتر بومانی با بیان ژن Bap سبب کاهش نفوذپذیری و در نتیجه ایجاد مقاومت به کارباپنمها میشود و علاوه بر آن با چسبندگی بالایی که با سطح زنده و غیرزنده ایجاد مینماید موجب پایداری بالای عامل بیماریزا میگردد (10). غشای خارجی در باکتریهای گرم منفی دارای ساختار دو لایهای است که به نظر میرسد شبیه به غشای پلاسمایی باشد. در غشای خارجی، پروتئینها در آن قرار میگیرند و سطح داخلی آن از فسفولیپیدها تشکیل شده است، که به شکلی مشابه با غشای سیتوپلاسمی ساخته شدهاند. پروتئینهای غشای خارجی، مانند OmpA، در باکتریهای گرم منفی نقشهای مهمی دارند. این پروتئینها به نفوذپذیری سلولی، مقاومت آنتیبیوتیکی، تطابق با محیط و بیماریزایی در سلول میزبان کمک میکنند. در اسینتوباکتر بومانی نیز انواعی از پروتئینهای غشاء خارجی از خانواده OmpA شناسایی شدهاند (11). این پروتئین فراوانترین پروتئین سطحی باکتری است که در اتصال و تهاجم به سلول¬های اپیتلیال و القاء آپوپتوزیس در مراحل اولیه عفونت اسینتوباکتر بومانی نقش دارد (12). علاوه بر این OmpA با مقاومت آنتیبیوتیکی در ارتباط است. گرچه مطالعاتی دخالت OmpA را به عنوان عامل مقاومت در برابر آنتیبیوتیکهای بتالاکتام نشان دادهاند، اما هنوز نقش این پروتئین در مقاومت ضدمیکروبی به روشنی مشخص نشده است، از طرفی مقاومت این باکتری نسبت به آنتیبیوتیکها در استفاده از داروها جهت درمان بیماران تأثیر نامطلوبی خواهد گذاشت (13). توماراس نشان داد که شکلگیری بیوفیلم در اسینتوباکتر بومانی بهطور فنوتیپی همراه با شکلگیری پیلوس و تولید اگزوپلیساکارید بود. آنالیز بیشتر توالیها مشخص کرد، اپرون پلیسیسترونیک Csu شامل 5 ژن است که شبیه ژنهایی میباشد که پروتئین های مربوط به چاپرون و هم-چنین پروتئینهایی را که در تجمع پیلوس در دیگر باکتریهای گرم منفی نقش دارد را کد می کند. چسبندگی اسینتوباکتر بومانی به سلولهای اپیتلیال برونش انسان و گلبولهای قرمز به علت وجود ساختاری شبه پیلوس ایجاد میشود (14). هموپلیمر خطی پلی- بتا-6،1-N- استیل-D- گلوکز آمین (PGA:beta-1,6-GlcNAc) به عنوان ادهسین برای حفظ ساختار بیوفیلم در یوباکتری¬ها عمل می¬کند که عملکرد آن به محصولات ژنی اپرون pgaABCD نیاز دارد که همه آنها برای تشکیل بیوفیلم ضروری هستند (16، 15). پژوهش در زمینه توانایی تشکیل بیوفیلم و ژنهای مؤثر در این فرآیند در سویههای متفاوت اسینتوباکتر بومانی، میتواند دادههای امیدبخشی را برای فهم بهتر فرایند پیچیده تشکیل بیوفیلم و عفونتهای ناشی از این میکروارگانیسمها ارائه دهد. بنابراین، مطالعه مورد نظر با هدف بررسی شیوع ژنهای منتخب مرتبط با تشکیل بیوفیلم در نمونههای بالینی اسینتوباکتر بومانی صورت گرفته است.
روش بررسی
از 49 نمونه (13 قطره خون،20 قطره خلط، 12 قطره ادرار، 4 نمونه زخم) اسینتوباکتر که از مراکز بهداشتی درمانی شهرستان بروجرد در پلیت جمعآوری شده بودند به آزمایشگاه تحقیقاتی دانشگاه آزاد واحد بروجرد انتقال داده شد و مورد استفاده قرار گرفتند و شناسایی تأییدی باکتری با روشهای استاندارد افتراقی میکروبیولوژی شد. به این ترتیب وجود کوکوباسیلهای گرم منفی اسینتو باکتر به روش میکروسکوپی تأیید شد. سپس تستهای افتراقی Methyl Red/ Voges-Proskaure(MRVP) و Sulfide Indol Motility (SIM) و Oxidative-Fermentative test(OF) و همچنین تستهای کاتالاز و اکسیداز و سیمون سیترات نیز انجام شد. رشد در 37 و 42 درجه سلسیوس، نیز از جمله تستهایی بود که جهت تشخیص گونههای مختلف اسینتوباکتر انجام شد (13) (شکل 1).
تولید بیوفیلم
تولید بیوفیلم با استفاده از روش میکروپلیت: جدایههای اسینتوباکتر بومانی را در محیط TSB که با 0/5 درصد گلوکز غنی شده باشد کشت میدهیم و در انکوباتور 37 درجه به مدت 24 ساعت میگذاریم. محیط کشت حاوی سوسپانسیون میکروبی را به نسبت 1 به 5 رقیق شده سپس 20 میکرولیتر از سوسپانسیون برای اضافه شدن به چاهکهای میکروپلیت انتخاب شد، در آن چاهکها ریخته شده به مدت 48 ساعت در 37 درجه انکوبه شد. کنترل منفی شامل 200 میکرولیتر از محیط TSB بود (15).
سنجش تولید بیوفیلم: بعد از انکوبه کردن به منظور سنجش مقدار تولید بیوفیلم در هر چاهک؛ 1) در ابتدا میکروپلیتها با استفاده از بافر PBS شستشو داده شدند، 2) چاهکها با استفاده از 150 میکرولیتر متانول به مدت 20 دقیقه ثابت میشوند سپس باقی مانده متانول خارج و پلیت در دمای اتاق در شرایط معکوس کاملاً خشک شده و 3) به مدت 15 دقیقه با رنگ سافرانین 0/01% رنگآمیزی شد و سپس پلیتها با آب مقطر شستشو داده شد و در مجاورت هوا خشک گردید و با اضافه کردن 150 میکرولیتر اتانول 95 درصد به مدت 15 دقیقه رنگ متصل شده به باکتری در بیوفیلم تشکیل شده جدا میشود و جذب نوری را در طول موج nm 490 با دستگاه الایزا ریدر اندازهگیری شد. مقادیر جذب نوری به عنوان شاخص اتصال باکتریها به سطح و تشکیل بیوفیلم در نظر گرفته شد. برای تجزیه و تحلیل کمی تولید بیوفیلم، میانگین جذب نوری سه چاهک (A) محاسبه و با چاهک کنترل (AC) مقایسه و بهصورت زیر محاسبه گردید:
1- عدم تشکیل بیوفیلم: A≤Ac
2- تشکیل بیوفیلم به صورت ضعیف: Ac×≤A˂(2×Ac)
3- تشکیل بیوفیلم به صورت متوسط: (2×Ac)×˂A≤ (4×Ac)
4- تشکیل بیوفیلم به صورت قوی: ˂A (4×Ac)
استخراج و تعیین کیفیت و کمیت DNA استخراجی: استخراج ژنوم به روش جوشاندن طبق دستورالعمل انجام شد. کیفیت و کمیت DNAاستخراج شده به ترتیب با کمک ژل الکتروفورز و نیز طیف سنجی (OD 260/280) بررسی شد (شکل2).
روش PCR: واکنش PCR در حجم 25 ماکرولیتر با استفاده از پرایمرهای اختصاصی جدول یک انجام شد. تکثیر ژنهای منتخب با شرایط دمای واسرشت اولیه در °C94 به مدت 5 دقیقه، 30 سیکل حرارتی شامل واسرشت در °C94 به مدت 1 دقیقه، اتصال پرایمر مطابق جدول 1 و تکثیر در °C72 به مدت 1 دقیقه و در پایان تکثیر در °C72 به مدت 10 دقیقه انجام شد. الکتروفورز محصولات PCR توسط ژل آگارز 1% انجام و سپس باندها توسط دستگاه ژل داک ( UVI-DOC) عکسبرداری شد.

شکل 1: اسینتوباکتر بومانی در Methyl Red/ Voges

شکل 2: چاهک های بیوفیلم
جدول 1: پرایمر¬های استفاده شده در این مطالعه (18 و 17).

تجزیه و تحلیل آماری
دادههای جمع آوری شده با استفاده از نرمافزارversion 16 SPSS بهطور توصیفی و تحلیلی بررسی شدند؛ تحلیل دادهها با آزمون مربع کای، آزمون دقیق فیشر انجام شد و P<0/05 به عنوان مبنای معنی دار بودن Significant در نظر گرفته شد.
نتایج
همه جدایههای مورد بررسی تمایل به تشکیل بیوفیلم داشتند. در میان انواع بیوفیلم تشکیل شده اکثر جدایههای مورد بررسی بیوفیلم ضعیف تشکیل دادند. فراوانی توانایی تشکیل بیوفیلم در میان جدایههای اسینتوباکتر بومانی در نمودار 4-1 گزارش شده است. تشکیل بیوفیلم در 3 جدایه (6 درصد) قوی، در 17 جدایه (35 درصد) متوسط و در 29 جدایه (59 درصد) ضعیف گزارش گردید. در این مطالعه مشخص شد، از میان 49 جدایه اسینتوباکتر بومانی، 43 جدایه (87%)، 45 جدایه (92%)، 48 جدایه (98%) و تمامی جدایه-ها (100%) به ترتیب واجد ژن ompA، csuA، bap و pgaB بودند (اشکال 3 تا 6).
لازم به ذکر است کنترل مثبت با روش تعیین توالییابی از حضور ژن مورد نظر تایید شد.
میزان تشکیل بیوفیلم در سویههای واجد ژنهای ompA، csuA، bap و pgaB مورد بررسی قرار گرفت. بر اساس آنالیز آماری بین میزان شدت تشکیل بیوفیلم به روش میکروتیترپلیت و حضور ژنهای مورد مطالعه ارتباط معناداری مشاهده نشد (P≥0.05). ژنهای ompA، csuA، bap و pgaB در جدایههای با توانایی تشکیل بیوفیلم (قوی، متوسط و ضعیف) مشاهده شدند.

شکل 3: محصولات PCR برای شناسایی ژن ompA: ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 6 نمونههای مثبت مورد آزمایش 531 جفت بازی.

شکل 4: محصولات PCR برای شناسایی ژن csuA: ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 4 نمونههای مثبت مورد آزمایش 322 جفت بازی.

شکل 5: محصولات PCR برای شناسایی ژن bap:
ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 3 نمونههای مثبت مورد آزمایش 223 جفت بازی.

شکل 6: محصولات PCR برای شناسایی ژن pgaB:
ستون M لدر 100 جفت بازی، C- کنترل منفی، C+کنترل مثبت و ستونهای 1 تا 8 نمونههای مثبت مورد آزمایش 490 جفت بازی.
بحث
در طی دهه گذشته، اسینتوباکتر بومانی به عنوان یکی از مهمترین عوامل بیماریزای بیمارستانی در سراسر جهان شناخته شده است. بخشی از این مسئله به توانایی بقای این میکروارگانیسم در محیطهای بیمارستانی و اکتساب مکانیسمهای مقاومتی و ایجاد عفونتهای حاد، بهویژه در بیماران بدحال، مربوط میشود. با وجود اطلاعات فراوان در مورد مکانیسمهای مسئول مقاومت آنتیبیوتیکی در این میکروارگانیسم، هنوز راهی برای متوقف کردن آن معرفی نشده است (19). شدت عفونتزایی اسینتوباکتر بومانی بهطور مستقیم با فاکتورهای بیماریزایی آن مرتبط است. با این وجود، گزارشهای مربوط به فراوانی فاکتورهای بیماریزایی در نمونههای کلینیکی اسینتوباکتر بومانی نسبتاً کم است (20). در نتیجه چگونگی عفونتزایی و نیز پاسخ سیستم ایمنی میزبان نسبت به این عفونتها، همچنان در هالهای از ابهام باقی مانده است. در این مطالعه، فراوانی چهار ژن مرتبط با فاکتورهای بیماریزایی در نمونههای بالینی Acinetobacter baumannii جدا شده از بیماران را بررسی کردیم. بیوفیلم به-عنوان یک فاکتور بیماریزایی مهم در نمونههای بالینی اسینتوباکتر بومانی مطرح است. تشکیل بیوفیلم یکی از خصوصیتهای مهم در پاتوژنزایی اسینتوباکتر به خصوص در عفونتهای ایجاد شده به واسطه ونتیلاتور میباشد و این واضح است که افزایش تولید پلیساکارید موجب افزایش بیوفیلم و متعاقب آن افزایش مقاومت میباشد. در مطالعه حاضر که به بررسی این موضوع پرداختیم و مشاهده شد تمامی جدایهها توانایی تشکیل بیوفیلم را داشتند که با مطالعه Sechi و همکاران همپوشانی نسبی دارد بهطوری که 80% سویهها توانایی تشکیل بیوفیلم را داشتند (21). در مطالعه حاضر تشکیل بیوفیلم در 3 جدایه (6 درصد) قوی، در 17 جدایه (35درصد) متوسط و در 29 جدایه (59 درصد) ضعیف گزارش گردید، در میان انواع بیوفیلم تشکیل شده اکثر جدایههای مورد بررسی بیوفیلم ضعیف تشکیل دادند که با مطالعه اکبری و همکاران همخوانی دارد، همچنین در مطالعه Nirwati و همکاران در سال 2018 (22) که با هدف بررسی توانایی تشکیل بیوفیلم در جدایههای اسینتوباکتر بومانی انجام شد نتایج نشان داد که 52/2% جدایهها بیوفیلم ضعیف، 20% جدایهها بیوفیلم متوسط و 2/5% جدایهها بیوفیلم قوی تشکیل دادند که با مطالعه حاضر همخوانی دارد. این در حالی است که در مطالعه مشابه رنجبر و همکاران تشکیل بیوفیلم در 70/6% قوی، در 12/2% متوسط و 17/2% ضعیف گزارش گردید اکثر جدایههای مورد بررسی بیوفیلم قوی تشکیل دادند (23). گسترش و ضخامت ساختارهای بیوفیلم و اتصالات داخل سلولی ارتباط تنگاتنگ با پروتئینهای خانواده bap دارد که توسط ژن bap کد میشوند (24، 2). نتایج حاصل از درصد فراوانی ژنهای مطالعه حاضر با مطالعه Liu و همکاران که در چین انجام شد، شباهت زیادی دارد. در مطالعه مذکور بین 88 نمونه بالینی اسینتوباکتر بومانی فراوانی ژن bap 87/5% گزارش گردید (25). همچنین در مطالعه Fallah و همکاران در سال 2017، روی 100 ایزوله بالینی در ایران فراوانی این ژن 92% گزارش شد (26). ompA یک پروتئین غشای خارجی است که القاکننده بیوفیلم روی سلولهای اپیتلیال انسانی است. این پروتئین توسط ژن ompA کد میشود (27). در دو مطالعه جداگانه در ایران که توسط Bardbari و همکاران در سال 2017 و Zeighami و همکاران در سال 2019 انجام گردید، درصد فراوانی این ژن به ترتیب، 100% در جدایههای بالینی اسینتوباکتر بومانی جدا شده از نمونههای تنفسی در مطالعه Bardbari و 81% در جدایههای مربوط به سایر نمونه-های بالینی در مطالعه و Zeighami و همکاران، گزارش شده است که شباهت بالایی با مطالعه حاضر داشتند (28 ، 17). اگرچه ژن ompA فراوانی بالایی دارد، ولی بر اساس مطالعات پیشین ایجاد ساختارهای بیوفیلم با ژن bap در مقایسه با ژن ompA ارتباط موثرتری دارد (29). ژن csuA متعلق به اپرون ژنی csu است که شامل 6 ژن (BABCDE/csuA) بوده و سیستم ترشحی چاپرون آشر را کد و در ایجاد پیلی و تشکیل ساختارهای بیوفیلم روی سطوح غیر جاندار بسیار مهم است (30). در مطالعه حاضر ژن csuA فراوانی 92% داشت. در مطالعه مظفری و همکاران که در سال 2018 بر روی نمونه-های بالینی اسینتوباکتر بومانی انجام شد فراوانی این ژن 98% گزارش شده است (18). این یافتهها نشان دهنده این مهم هستند که بیشتر سویههای بالینی اسینتوباکتر بومانی جداشده، توانایی تشکیل بیوفیلم را دارند.در برخی مطالعات، شباهت دادهها با نتایج این تحقیق بسیار پایین بوده است، که این موضوع میتواند ناشی از تفاوتهایی در نوع نمونههای مورد بررسی و زمان انجام مطالعه باشد. به عنوان مثال، تغییرات جغرافیایی و تفاوتهای فرهنگی در روشهای نمونهبرداری و تشخیص میتواند بر روی دادههای به دست آمده تأثیر بگذارد. همچنین، تغییرات در شیوع بیماریها و مقاومت دارویی در طول زمان میتواند بر نتایج تأثیر بگذارد .از سوی دیگر، باکتریهای اسینتوباکتر بومانی از مکانیزمهای متنوعی برای حفظ پاتوژنیسیته، فرار از سیستم ایمنی میزبان، و همچنین مقاومت در برابر آنتیبیوتیکها استفاده میکنند. این مکانیزمها میتوانند شامل تولید آنزیمهایی که آنتیبیوتیکها را تجزیه میکنند، تغییر در ساختار گیرندههای دارویی، و استفاده از سیستمهای افزار دفاعی مانند پمپهای افزار برای دفع دارو باشند .با وجود اینکه در کشور ما مطالعات فراوانی در رابطه با ویژگیهای اپیدمیولوژیک و الگوی مقاومت دارویی جدایههای اسینتوباکتر بومانی انجام شده است، همچنان توجه به نقش این باکتری به عنوان یک عامل بالقوه خطرناک در عفونتهای بیمارستانی ضروری بهنظر میرسد. این امر بهویژه در محیطهای بیمارستانی که با چالشهای مقاومت دارویی مواجه هستند، اهمیت دارد. توسعه استراتژیهای جدید برای مقابله با این باکتریها و جلوگیری از شیوع بیماریهای بیمارستانی ناشی از آنها، یک اولویت بهداشتی مهم است. افزایش آگاهی در میان کادر پزشکی و بیماران، بهبود روشهای کنترل عفونت، و تحقیقات بیشتر در زمینه مکانیزمهای مقاومت دارویی این باکتریها میتواند به کاهش خطرات ناشی از آنها کمک کند.
نتیجهگیری
عفونت اسینتوباکتر بومانی، یک چالش پزشکی جهانی است. پاتوژنهای فرصتطلب و بهخصوص در تجمع و تداوم در محیط بیمارستان موفق هستند. قادر به مقاومت در برابر خشکی میباشند و در سطوح بیجان برای سالها زنده می-مانند. در میان شایعترین علل عفونت بیمارستانی قرار دارد؛ به علت مقاومت در برابر عوامل فیزیکی و شیمیایی که با تشکیل بیوفیلم ایجاد میشود. کسب توانایی تشکیل بیوفیلم میتواند یک استراتژی خوب به منظور افزایش بقا تحت شرایط استرس، به عنوان مثال در طول حمله میزبان یا پس از درمان آنتیبیوتیک میباشد. درک بیشتری از ماهیت بیوفیلم و ارتباط بین سلولی در بیوفیلم و همچنین نقش آنها در ارتباط با مقاومت آنتی بیوتیکی و عفونت جدایههای اسینتوباکتر بومانی در توسعه درمانهای جدید و موثر برای عفونتهای اسینتوباکتر کمک خواهد کرد. با توجه به میزان فراوانی بالای ژنهای دخیل در پاتوژنسیته، افزایش میزان شیوع بیمارستانی اسینتوباکتر بومانی، لزوم طراحی مطالعه در سطح وسیع و هم-چنین برنامههای حفاظتی نظیر کنترل عفونتهای ایجادشده در بخش مراقبتهای ویژه را خاطرنشان میکند. همچنین با استفاده از روشهای مولکولی میتوان این باکتریهای پاتوژن را شناسایی و ویژگی مقاومت آنتیبیوتیکی آنها را تعیین کرد و متناسب با آن آنتیبیوتیکها تجویز نمود. محدود کردن استفاده از آنتیبیوتیکها، گسترش و تغییر طرحهای نظافت برای تجهیزات آلوده و دستهبندی بیمارانی که این باکتری در آنها مستقر شده است، راهکار مفیدی برای کنترل انتشار این باکتری است.
سپاسگزاری
اﻳﻦ ﻣﻘﺎﻟﻪ ﺑﺮﮔﺮﻓﺘﻪ ﺍﺯ رساله کارشناسی ارشد در رشته میکروبیولوژی در ﺩﺍﻧﺸﮕﺎﻩ آزاد اسلامی واحد بروجرد ﻣﻲﺑﺎﺷﺪ. هزینه اجرای آن توسط پژوهشگر تامین شد. ﺍﺯ ﺗﻤﺎﻣﻲ ﺁﺯﻣﻮﺩﻧﻲﻫﺎ ﻭ ﺍﻓﺮﺍﺩﻱ ﻛﻪ ﺩﺭ ﺍﻧﺠﺎﻡ ﺍﻳﻦ ﻣﻄﺎﻟﻌﻪ ﺷﺮﻛﺖ ﻭ ﻫﻤﻜﺎﺭﻱ ﺩﺍﺷﺘﻪﺍﻧﺪ ﺗﺸﻜﺮ ﻭ ﻗﺪﺭﺩﺍﻧﻲ ﻣﻲﮔﺮﺩﺩ.
حامی مالی: ندارد
تعارض در منافع : وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد بروجرد تایید شده است (کد اخلاق IR.IAU.B.REC.100.028)
مشارکت نویسندگان
محسن میرزایی در ارائه ایده، رضا نصرتیپور و محسن میرزایی در طراحی مطالعه، رضا نصرتیپور در جمعآوری دادهها، محمدرضا مهرابی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Gedefie A, Demsis W, Ashagrie M, Kassa Y, Tesfaye M, Tilahun M, Bisetegn H, Sahle Z. Acinetobacter Baumannii Biofilm Formation and Its Role in Disease Pathogenesis: A Review. Infect Drug Resist 2021; 14: 3711-19.
2- Longo F, Vuotto C, Donelli G. Biofilm Formation in Acinetobacter Baumannii. New Microbiol 2014; 37(2): 119-27.
3- Zhu L, Yan Z, Zhang Z, Zhou Q, Zhou J, Wakeland EK, et al. Complete Genome Analysis of Three Acinetobacter Baumannii Clinical Isolates in China for Insight Into the Diversification of Drug Resistance Elements. PLoS One 2013; 8(6): e66584.
4- Alamri AM, Alsultan AA, Ansari MA, Alnimr AM. Biofilm-Formation in Clonally Unrelated Multidrug-Resistant Acinetobacter Baumannii Isolates. Pathogens 2020; 9(8): 630.
5- Gurung J, Khyriem AB, Banik A, Lyngdoh WV, Choudhury B, Bhattacharyya P. Association of Biofilm Production with Multidrug Resistance among Clinical Isolates of Acinetobacter Baumannii and Pseudomonas Aeruginosa from Intensive Care Unit. Indian J Crit Care Med 2013; 17(4): 214-8.
6- Lear G, Lewis GD. Microbial Biofilms: Current Research and Applications. Horizon Sci Press; 2012.
7- Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial Biofilms: From the Natural Environment to Infectious Diseases. Nat Rev Microbiol 2004; 2(2): 95-108.
8- Stewart PS, Costerton JW. Antibiotic Resistance of Bacteria in Biofilms. Lancet 2001; 358(9276): 135-8.
9- Brossard KA, Campagnari AA. The Acinetobacter Baumannii Biofilm Associated Protein Plays a Role in Adherence to Human Epithelial Cells. Infect Immun 2012; 80: 228-33.
10- Jalali M, Rasooli I, Ahmadi Zanoos K, Jahangiri A, Jalali Nadooshan M, Darvish Alipour Astaneh S. Immunogenicity of Amino Acid Region 7601-8140 in Biofilm Associated Protein of Acinetobacter Baumannii. MJMS 2014; 16(4): 15-26. [Persian]
11- McConnell MJ, Pachón J. Expression, Purification, and Refolding of Biologically Active Acinetobacter Baumannii Ompa from Escherichia Coli Inclusion Bodies. Protein Expr Purif 2011; 77(1): 98-103.
12- Choi CH, Lee EY, Lee YC, Park TI, Kim HJ, Hyun SH, et al. Outer Membrane Protein 38 of Acinetobacter Baumannii Localizes to the Mitochondria and Induces Apoptosis of Epithelial Cells. Cell Microbiol 2005; 7(8): 1127-38.
13- Smani Y, Fàbrega A, Roca I, Sánchez-Encinales V, Vila J, Pachón J. Role of Ompa in the Multidrug Resistance Phenotype of Acinetobacter Baumannii. Antimicrob Agents Chemother 2014; 58(3): 1806-8.
14- Tomaras AP, Dorsey CW, Edelmann RE, Actis LA. Attachment to and Biofilm Formation on Abiotic Surfaces by Acinetobacter Baumannii: Involvement of a Novel Chaperone-Usher Pili Assembly System. Microbiology 2003; 149(pt12): 3473-84.
15- Wang X, Preston JF 3rd, Romeo T. The Pgaabcd Locus of Escherichia Coli Promotes the Synthesis of a Polysaccharide Adhesin Required for Biofilm Formation. J Bacteriol 2004; 186(9): 2724-34.
16- Itoh Y, Rice JD, Goller C, Pannuri A, Taylor J, Meisner J, et al. Roles of Pgaabcd Genes in Synthesis, Modification, and Export of the Escherichia Coli Biofilm Adhesin Poly-Β-1, 6-N-Acetyl-D-Glucosamine. J Bacteriol 2008; 190(10): 3670-80.
17- Zeighami H, Valadkhani F, Shapouri R, Samadi E, Haghi F. Virulence Characteristics of Multidrug Resistant Biofilm Forming Acinetobacter Baumannii Isolated from Intensive Care Unit Patients. BMC Infect Dis 2019; 19(1): 629. [Persian]
18- Mozafari H, Mirkalantari SH, Sadeghi Kalani B, Amirmozafari N. Prevalence Determination of Virulence Related and Biofilm Formation Genes in Acinetobacter Baumannii Isolates From Clinical Respiratory Samples in Imam Khomeini Hospital, Tehran, Iran in 2018. Iran J Med Microbiol 2021; 15(3): 266-80. [Persian]
19- Tseng CC, Tsai YH, Hu A, Liou JW, Chang KC. Altered Susceptibility to the Bactericidal Effect of Photocatalytic Oxidation. Appl Microbiol Biotechnol 2016; 100(19): 8549-61.
20- Morris FC, Dexter C, Kostoulias X, Uddin MI, Peleg A. The Mechanisms of Disease Caused By Acinetobacter Baumannii. Front Microbiol 2019; 10: 1601.
21- Sechi LA, Karadenizli A, Deriu A, Zanetti S, Kolayli F, Balikci E, et al. PER-1 Type Beta-Lactamase Production In Acinetobacter Baumannii Is Related To Cell Adhesion. Med Sci Monit Basic Res 2004; 10(6): BR180-BR4.
22- Nirwati H, Hakim MS, Darma S, Mustafa M, Nuryastuti T. Detection of Blaoxa Genes and Identification of Biofilm-Producing Capacity of Acinetobacter Baumannii in a Tertiary Teaching Hospital, Klaten, Indonesia. Med J Malaysia 2018; 73(5): 291-6.
23- Ranjbar R, Farahani A. Study of Genetic Diversity, Biofilm Formation, and Detection of Carbapenemase, MBL, ESBL, and Tetracycline Resistance Genes in Multidrug-Resistant Acinetobacter Baumannii Isolated from Burn Wound Infections in Iran. Antimicrob Resist Infect Control 2019; 8(1): 172. [Persian]
24- Yang CH, Su PW, Moi SH, Chuang LY. Biofilm Formation in Acinetobacter Baumannii: Genotype-Phenotype Correlation. Molecules 2019; 24(10): 1849.
25- Liu C, Chang Y, Xu Y, Luo Y, Wu L, Mei Z, et al. Distribution of Virulence-Associated Genes and Antimicrobial Susceptibility in Clinical Acinetobacter Baumannii Isolates. Oncotarget 2018; 9(31): 21663-21673.
26- Fallah A, Rezaee MA, Hasani A, Barhaghi MHS, Kafil HS, et al. Frequency of Bap and Cpaa Virulence Genes in Drug Resistant Clinical Isolates of Acinetobacter Baumannii and their Role in Biofilm Formation. Iran J Basic Med Sci 2017; 20(8): 849-55. [Persian]
27- Thummeepak R, Kongthai P, Leungtongkam U, Sitthisak S. Distribution of Virulence Genes Involved in Biofilm Formation in Multidrug Resistant Acinetobacter Baumannii Clinical Isolates. Int Microbiol 2016; 19(2): 121-9.
28- Bardbari AM, Arabestani MR, Karami M, Keramat F, Alikhani MY, Bagheri KP. Correlation between Ability of Biofilm Formation with their Responsible Genes and MDR Patterns in Clinical and Environmental Acinetobacter Baumannii Isolates. Microb Pathog 2017; 108: 122-8.
29- Lib SS, Abdulrahman TR, Ali SH. Detection of Some Biofilm Genes Related with Multidrug-Resistant in Acinetobacter Baumannii Isolated from Clinical Isolates. Iraqi J Med Sci 2018; 16(4): 430-8.
30- McConnell MJ, Actis L, Pachón J. Acinetobacter Baumannii: Human Infections, Factors Contributing to Pathogenesis and Animal Models. FEMS Microbiol Rev 2013; 37(2): 130-55.
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1402/12/2 | پذیرش: 1403/3/9 | انتشار: 1403/6/15
دریافت: 1402/12/2 | پذیرش: 1403/3/9 | انتشار: 1403/6/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







