دوره 32، شماره 6 - ( شهریور 1403 )
جلد 32 شماره 6 صفحات 7911-7894 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Pouladvand N, Azarnia M, Zeinali H, Fathi R, Tavana S. A Review of the Types of Chemotherapy Drugs Used to Induce Premature Ovarian Failure in Mice. JSSU 2024; 32 (6) :7894-7911
URL: http://jssu.ssu.ac.ir/article-1-6165-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6165-fa.html
پولادوند نگار، آذرنیا مهناز، زینلی حدیث، فتحی روحالله، توانا سمیه. مروری بر انواع داروهای شیمیدرمانی دخیل در ایجاد مدل نارسایی زودرس تخمدان در موش. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (6) :7894-7911
متن کامل [PDF 925 kb]
(459 دریافت)
| چکیده (HTML) (1417 مشاهده)
متن کامل: (1133 مشاهده)
مقدمه
سرطان یکی از مهمترین مشکلات سلامت عمومی جوامع در سراسر جهان است .هر ساله هزاران زن جوان به سرطان مبتلا شده و در معرض رژیمهای شیمیدرمانی و پرتوهای سایتوتوکسیک یا سمیت سلولی، قرار میگیرند که تأثیر منفی قابلتوجهی بر تولیدمثل دارند (1). مهمترین و شایعترین عوارض شیمیدرمانی، نارسایی زودرس تخمدان Premature ovarian failure (POF) یا نارسایی اولیه تخمدان Primary Ovarian Insufficiency (POI) و به دنبال آن ناباروری میباشد (3, 2). POF یک بیماری غدد درونریز شایع است، که با افزایش سطح گنادوتروپینها هورمون لوتئین کننده Luteinizing hormone (LH) و هورمون محرک فولیکول Follicle-stimulating hormone (FSH)] (آمنوره هیپرگنادوتروپیک)، سطوح پایین هورمونهای جنسی (استرادیول (E2) و اینهیبینها) و عدم قاعدگی به مدت حداقل 4 ماه در زنان کمتر از 40 سال مشخص میشود (5, 4). علاوه بر این، بیماران از پیامدهای طولانیمدت کمبود استروژن، از جمله پوکی استخوان، بیماریهای قلبی عروقی و اختلالات روانی مانند افسردگی رنج میبرند (7, 6). علل POF ناشناخته است و به عوامل پیچیده بسیاری مانند نقایص ژنتیکی، اختلالات خودایمنی، عفونت، عوامل ایاتروژنیک (جراحی تخمدان، آسیب شیمیدرمانی یا رادیوتراپی) و غیره مربوط می شود (9, 8). از داروهای شیمیدرمانی به عنوان یکی از عوامل مهم نارسایی زودرس تخمدان در بیمارانی که عملکرد تخمدان آنها متوقف شده است، یاد میشود (10). داروهای شیمیدرمانی به 5 گروه تقسیم میشوند: 1- عوامل آلکیله کننده مثل سیکلوفسفامید، مکلورتامین، کلورامبوسیل، پروکاربازین، بوسولفان و ملفان 2- ترکیبات با پایه پلاتینیوم مثل سیسپلاتین و کربوپلاتین 3- آنتیمتابولیتها مثل متوتروکسات، 5- فلوئوراسیل و سیتارابین 4- آلکالوئیدهای وینکا مثل وینکریستین و وینبلاستین 5- آنتیبیوتیکهای آنتراسایکلین مثل دانوروبیسین، بیلومایسین و دوکسوروبیسین (12, 11). قرار گرفتن در معرض داروهای شیمیدرمانی منجر به تشکیل شکستگیهای دو رشتهای DNA Double-stranded breaks (DSBs) (شدیدترین نوع آسیب به DNA)، در فولیکولهای بدوی میشوند. پروتئین جهش یافته آتاکسی تلانژکتازی Ataxia-telangiectasia mutated (ATM)، پروتئین دخیل در تشخیص آسیب DNA، DSBs را از طریق فعالسازی نقاط بازرسی چرخه سلولی و پروتئینهای ترمیم DNA شناسایی و ترمیم میکند. با اینحال، اگر در تخمدان مسیرهای ترمیم DSBs فعال نشوند، آسیب DNA میتواند منجر به مهار تقسیم سلولی، فعال شدن مسیر آپوپتوز سلولهای گرانولوزای سوماتیک و تخمکها و در نهایت منجر به کاهش ذخیره تخمدان شود (15-13). همچنین داروهای شیمیدرمانی در درمان طیف وسیعی از بیماریهای غیربدخیم از جمله بیماریهای خودایمنی با شرایط شیمیدرمانی قبل از پیوند با سلولهای بنیادی که بهطور فزایندهای برای شرایط هماتولوژیک مانند کمخونی سلول داسی شکل، مورد استفاده قرار میگیرند. علیرغم تاثیر عظیم POF بر سلامت عمومی و کیفیت زندگی زنان مبتلا، پاتوفیزیولوژی آن نامشخص است. به همین منظور مدلهای حیوانی این فرصت را به ما میدهند که بهطور فرضی پاتوژنز را بهطور جامع بررسی کنیم. توضیح مکانیسم توسعه POF برای درمان بالینی این بیماری، حیاتی است و با توجه محدودیتهایی که در انجام مطالعات کامل در انسان وجود دارد، مدلهای حیوانی مثل موش و رت ابزار قدرتمندی برای یافتن پاتوژنز این بیماری می باشند. در این مقاله به بررسی مطالعاتی که از موش به عنوان مدل POF استفاده کردند، پرداختیم. همچنین از آنجاییکه رایجترین مدل ایجاد POF با استفاده از داروهای شیمیدرمانی ایجاد میشود و شایعترین علل POF، قرارگرفتن در معرض شیمیدرمانی و پرتودرمانی در درمان است (17, 16)، لذا در این مقاله مروری مدلهای نارسایی زودرس تخمدان ناشی از داروهای شیمیدرمانی و مکانیسم های مربوطه را بررسی خواهیم کرد.
1- انواع داروهای شیمیدرمانی به منظور ایجاد مدل POF
سیکلوفسفامید Cychlophosphamide (CTX): سیکلوفسفامید با فرمول شیمیایی C7H15Cl2N2O2P.H2O یک عامل ضد سرطان آلکیله کننده (19, 18) موثر است که از سال 1950 بهطور گسترده در بیماران مبتلا به سرطان استفاده میشود. CTX خود یک داروی جانبی است که توسط سایتوکرومP450 Cytochorome در کبد به شکل 4- هیدروکسی سیکلوفسفامید سپس به آلدوفسفامید متابولیزه میشود که به نوبه خود به خردل فسفورامید و آکرولئین تبدیل میشود. اثرات درمانی و سمی CTX مربوط به متابولیتهای فعال آن به عنوان آکرولئین و خردل فسفورامید میباشد. این متابولیتها با وارد کردن رادیکالهای آلکیل به DNA عمل میکنند که با ایجاد پیوند های عرضی درون رشتهای یا بین رشتهای منجر به اختلال سنتز DNA و مرگ سلولی میشوند (23-20)، که پیامدهای سمی مضر برای سلول های موجود در اندامهایی مانند قلب، کبد و کلیه داشته و اثرات سمی شدیدی نیز بر روی تخمدان دارد (24, 19). علاوه بر این خردل فسفورامید بر میتوکندری هم اثر گذاشته و منجر به کاهش پتانسیل دو طرف غشاء و تجمع سایتوکرومC سیتوزولی میشود که در نهایت باعث القا آپوپتوز سلولی میشود (25). CTX اولین داروی شیمیدرمانی مرتبط با آمنوره/POI، اختلال عملکرد تخمدان (موش و انسان) (26, 18) و همچنین به عنوان یکی از مهمترین عوامل گنادوتوکسیک (27) که با تسریع روند بلوغ فولیکولهای تخمدان به فولیکولهای بالغ، ذخایر تخمدان را کاهش داده و در نهایت منجر به نارسایی زودرس تخمدان میشود (28). در مطالعات قبلی نشان داده شده است، CTX باعث کاهش تعداد فولیکولهای بدوی، اولیه، ثانویه، آنترال و همچنین افزایش فولیکولهای مرده در تخمدانهای موش و رت میشود (34-29). کاهش ذخیره فولیکولی ناشی از سیکلوفسفامید مربوط به تحریک بیش از حد و کاهش ذخیره فولیکولهای بدوی Primordial follicles (PMFs) از طریق فعال سازی مسیر سیگنالینگ PTEN/Akt/FOXO3 میباشد (36, 35, 31). با اینحال در یک مطالعه نشان داده شده است که سیکلوفسفامید هیچ اثری در فعال سازی مسیر PTEN/Akt/FOXO3 ندارد که ممکن است به دلیل استفاده از دوز متفاوت CTX نسبت به مطالعات قبلی باشد (37). افزایش فسفوریلاسیون S473 AKT، S65 4E-BP1 به P-AKT و P-4E-BP1 در اثر قرار گرفتن در معرض سیکلوفسفامید توسط گلدمن و همکاران در سال 2017 نشان داده شده است (38). در مقابل مطالعات قبلی در یک مدل جوندگان نشان داد که مهار راپامایسین (mTOR) از فعال شدن فولیکولهای اولیه ناشی از سیکلوفسفامید از طریق مسیر PTEN/Akt/mTOR جلوگیری میکند (39, 38). اختلال در تنظیم محور سیگنالینگ Rictor/mTORC2/Akt/ Foxo3a می تواند منجر به آپوپتوز سلولی شود (40). همچنین شواهد روشنی وجود دارد که نشان میدهد CTX منجربه افزایش آپوپتوز سلولهای گرانولوزا در فولیکولهای در حال رشد از طریق فعالسازی مسیر میتوکندریایی و افزایش بیان پروتئین آپوپتوز Bax، Caspase3، Caspase1،NOD‐like receptor protein3 (NLPR3)، سیتوکرومc و کاهش بیان پروتئین ضدآپوپتوز Bcl-2 و Bclx-l می شود (45-40, 34, 28). همچنین پروتئین پروآپوپتوز PUMA ناشی از آسیب DNA نقش کلیدی در القا آپوپتوز تخمک در جوندگان به دنبال درمان با سیکلوفسفامید، دارد (30).
در مطالعات اخیر نشان داده شده است که سیکلوفسفامید باعث کاهش هورمونهای ضد مولرین Anti-Müllerian hormone (AMH)، E2، استروژن، پروژسترون و افزایش هورمون های FSH و LH میشود (47, 46, 32, 31, 29, 6). قرار گرفتن در معرض سیکلوفسفامید باعث آسیب فولیکولی و ایجاد POF ناشی از استرس اکسیداتیو (OS) می شود (48, 37). سیکلوفسفامید باعث افزایش تولید گونههای فعال اکسیژن (ROS) و کاهش آنتیاکسیدانهای آنزیمی و غیر آنزیمی در بافت تخمدان موش و رت میشود که باعث اختلال در عملکرد میتوکندری، التهاب، پراکسیداسیون لیپدی و آپوپتوز می شود (49-51, 31, 10). کاهش سطح آنزیم های آنتی اکسیدانی مثل سوپراکسید دیسموتاز (SOD)، گلوتاتیون پراکسیداز (GPx) و افزایش مالوندیآلدهید (MDA) در نارسایی زودرس تخمدان ناشی سیکلوفسفامید نشان داده شده است (شکل 1) (54-52, 49, 46, 44). از طرف دیگر یک حسگر مهم برای استرس اکسیداتیو، SIRT Silent information regulator1 (SIRT1) است، که مکانیسمهای دفاعی و ترمیم سلولی را هماهنگ و سرنوشت سلولی را کنترل میکند و از بقای سلولهای آسیب دیده جلوگیری می کند (55). در واقع SIRT1 هم در التهاب هم در استرس اکسیداتیو با مهار سیگنالینگ NF-kB Nuclear factor kappa B و تحریک پاسخ آنتی اکسیدانی از طریق بیان فاکتور رونویسی FOXO عمل میکند. سیکلوفسفامید در تخمک موش باعث افزایش SIRT1 به عنوان یه پاسخ تطبیقی به استرس اکسیداتیو میشود. (58-56, 44). بنابراین استفاده از سیکلوفسفامید میتواند همراه با اثرات مضر بر اندامهای مختلف از جمله تخمدان باشد. در حال حاضر قرارگیری منظم در معرض سیکلوفسفامید به عنوان یک پیش درمان برای القای از دست دادن گستره فولیکولی در آزمایشاتی که در آنها تحقیقات فیزیولوژیک تخمدان فاقد فولیکول بررسی میشود، استفاده می شود (26).
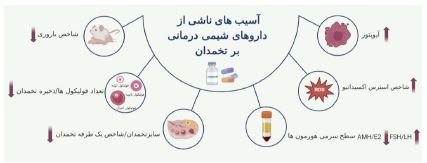
شکل 1: انواع آسیبهای ناشی از داروهای شیمیدرمانی بر تخمدان
بوسولفان Busulfan (BU): بوسولفان دارویی است که همراه با سیکلوفسفامید برای مدیریت و درمان پیوند سلولهای پیشساز خونساز آلوژنیک، بهویژه برای بیماران مبتلا به لوسمی میلوژن مزمن استفاده میشود. این دارو در گروه داروهای ضد سرطان قرار دارد و به عنوان یک عامل آلکیله کننده تعریف میشود که از دهه 1950 مورد استفاده قرار گرفته است. بوسولفان با اتصال به مولکولهای سیستئین پروتئینهای هیستون، منجر به اتصال DNA به پروتئین میشود. بوسولفان همچنین با برهمکنش با گروههای سولفیدریل گلوتاتیون، تعادل ردوکس سلولی را مختل میکند و در نتیجه باعث افزایش استرس اکسیداتیو در سلولهای سرطانی میشود (59). داروهای شیمیدرمانی کلاسیک سیکلوفسفامید و بوسولفان (CTX/BU)، که اغلب برای درمان سرطان در بالینی استفاده میشود، سمیت تولیدمثلی جدی دارند و برای القای POF در مدل حیوانی استفاده میشوند (60). ترکیب بوسولفان و سیکلوفسفامید باعث کاهش سایز تخمدان، کاهش تعداد فولیکولها (61) و افزایش تعداد فولیکولهای مرده در موش میشود. از سوی دیگر بوسولفان با کاهش عوامل آنتیاکسیدانی سوپراکسید دیسموتاز و Nrf2 و نیز کاهش پروتئین ضدآپتوزی Bcl-2 و افزایش پروتئین آپتوزی Bax در نهایت باعث آپوپتوز میشود (62, 60). مطالعات نشان دادهاند که وزن تخمدانها، وزن رحم و همچنین وزن بدن تحت درمان با سیکلوفسفامید و بوسولفان بهطور قابلتوجهی کاهش یافته است (شکل 1) (64, 63). لیو و همکاران در سال 2020 نشان دادند که در موشهای تحت درمان با CTX و BU افزایش بیان فسفوریلاسیون AKT و PI3K اتفاق میافتد (62).
سیسپلاتین Cisplatin (CIS): عوامل شیمیدرمانی مبتنی بر پلاتین، از جمله کربوپلاتین، سیسپلاتین، لوباپلاتین، نداپلاتین و اگزالیپلاتین، تقریباً 50 درصد از داروهای ضد سرطان مورد استفاده در محیط بالینی را تشکیل میدهند (65). متداولترین داروی مبتنی بر پلاتین، سیسپلاتین با فرمول شیمیایی Cl2H6N2Pt است (66). توانایی CIS برای مهار تقسیم سلولی برای اولین بار در دهه 1960 شناسایی شد (67) و اولین ترکیب پلاتین مورد تایید FDA برای درمان سرطان در سال 1987 معرفی شد که منجر به استفاده آن و سایر ترکیبات حاوی فلز به عنوان داروهای ضد سرطان بالقوه گردید. سیسپلاتین از ترکیبات فلزات سنگین است و به عنوان یک عامل پیوند متقابل DNA که با مکانیسمهای ترمیم DNA تداخل دارد، تقسیم سلولی را مسدود کرده، باعث آسیب DNA و ایجاد مرگ سلولی یا آپوپتوز میشود. CIS با چندین جزء سلولی مختلف تعامل دارد، اما هدف بیولوژیکی اولیه آن DNA است (18). به دنبال قرارگرفتن تخمدانهای موش و رت در معرض CIS، با از دست دادن ذخیره تخمدانی و افزایش فولیکولهای مرده همراه است (شکل 1) (70-68). سیسپلاتین با آسیب به DNA، نقاط بازرسی Checkpoint چرخه سلولی را فعال میکند و منجر به توقف چرخه سلولی و فعال شدن مسیر آپوپتوز از طریق افزایش بیان ژنهای Bax، Caspase3 و P53 میشود (72, 71). ژن سرکوبگر تومور p53، یکی از فاکتورهای رونویسی است که در تنظیم چرخه سلولی با جلوگیری از رشد و تقسیم آنها نقش دارد و در سرطانهای انسانی جهش یافته و غیر فعال میشود (73). (ATR) ATM-Rad3 Related، یک کیناز درگیر در فعالسازی نقطه بازرسی میباشد که توسط CIS فعال می شود و به نوبه خود میتواند پروتئین p53 و همچنین مسیر سیگنالینگ Mitogen-activated protein kinase (MAPK) را فعال کند (74). تخمک اولیه موش و انسان هر دو حاوی غلظت بالایی از Tap63(یک ایزوفرم خاص از P53، اعضای خانواده P63) هستند. سیسپلاتین Tap63α را از طریق مسیر ATR/CHEK1/CK1 فعال میکند و Tap63α به نوبه خود باعث افزایش بیان پروتئینهای پروآپوپتوز BH3-only، PUMA و NOXA میشود که در نهایت منجر به آپوپتوز تخمکها میشود (75). مطالعات نشان میدهند که قرارگرفتن فولیکولهای بدوی در معرض CIS، باعث فعالسازی بیش از حد PMFs و کاهش ذخیره تخمدان میشود و در نهایت با فعال کردن مسیر PTEN/Akt/FOXO3 باعث POF میشود (79-76). سیسپلاتین باعث افزایش قابلتوجه استرس اکسیداتیو و کاهش سطح آنتیاکسیدانهای SOD، GSH و GPx در بافت تخمدان رت میشود (80, 41).
دوکسوروبیسین Doxorubicin (DOX): دوکسوروبیسین با فرمول شیمیایی C27H29NO11، یک آنتیبیوتیک آنتراسایکلین (14-hydroxydaunomicyn) است که اغلب با نامهای تجاری آدریامایسین Adriamycin یا روبکس Rubex شناخته میشود. DOX با DNA تداخل دارد و از تکثیر و رونویسی آن جلوگیری میکند. همچنین برای درمان طیف وسیعی از سرطانها از جمله سرطان سینه، ریه، لنفوم، معده، تخمدان و سرطان خون استفاده میشود. شواهد اخیر نشان میدهند که گنادوتوکسیک بودن این دارو، در حد متوسط است. اصلیترین و شناختهشدهترین مکانیسم DOX مهار آنزیم هستهای توپوایزومراز II است (81, 18). در طول همانندسازی و رونویسی DNA، توپوایزومرازها نقش مهمی در حفظ ساختار صحیح DNA دارند. توپوایزومرازII از پیچش یا باز شدن بیش از حد رشتههای DNA، با ایجاد برش های موقت در دو رشته DNA در طول همانند سازی، جلوگیری میکند، بنابراین در انتقال فاز G2 به M چرخه سلولی فراوان هستند. DOX با وارد شدن به هسته سلول، توپوایزومراز II را مهار و همانندسازی DNA و RNA و سنتز پروتئین را نیز مختل میکند و باعث مرگ سلولی میشود. مکانیسم دیگر DOX تولید رادیکال های آزاد و دیگر گونههای فعال اکسیژن است (شکل 1). گونههای فعال اکسیژن میتوانند منجر به پراکسیداسیون لیپیدی و آسیب غشاء، آسیب به DNA، استرس اکسیداتیو و راهاندازی مسیرهای آپوپتوز و مرگ سلولی شوند (83, 82, 18). آپوپتوز اصلی ترین فرآیند مرگ سلولی ناشی از DOX در تخمدان است (18). سلولهای گرانولوزا و سلولهای استرومایی/تکا جدا شده از فولیکولهای در حال رشد و همچنین تخمکها در موش، پس از تزریق DOX دچار شکستگی DNA دو رشتهای و فعالسازی آپوپتوز میتوکندریایی از طریق ژنهای تنظیم کننده مرگ (BAX، Bcl-2، Caspase12 و p53) میشوند (87-84). همچنین مطالعات قبلی نشان داده شده است که 12 ساعت پس از تزریق DOX در موش، کاهش قابلتوجهی در جمعیت فولیکولهای بدوی و ثانویه و همچنین کاهش در اندازه و وزن تخمدان تا یک ماه بعد از آن مشاهده شد (89, 88).
بحث
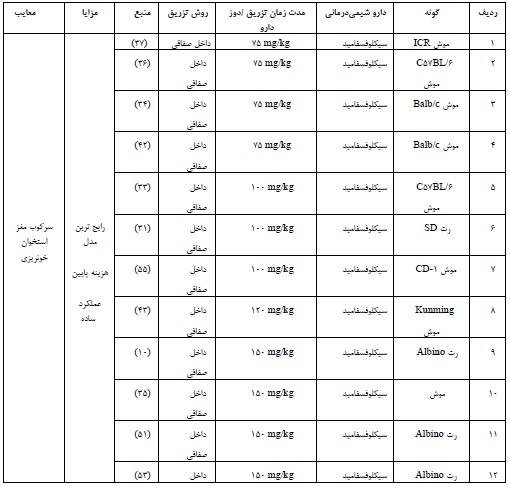
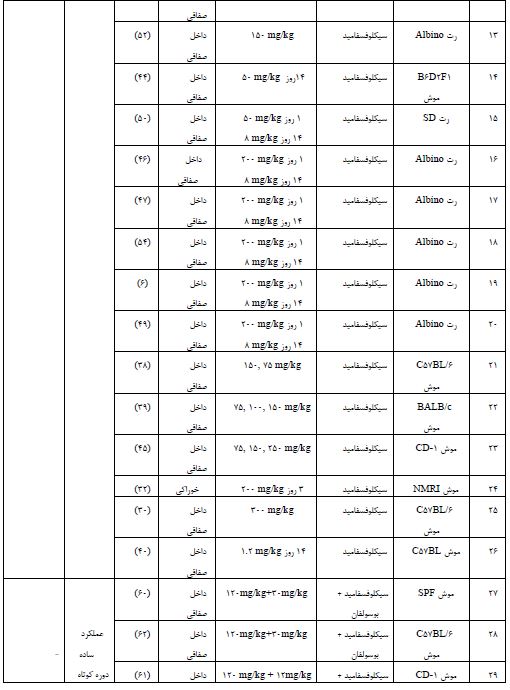
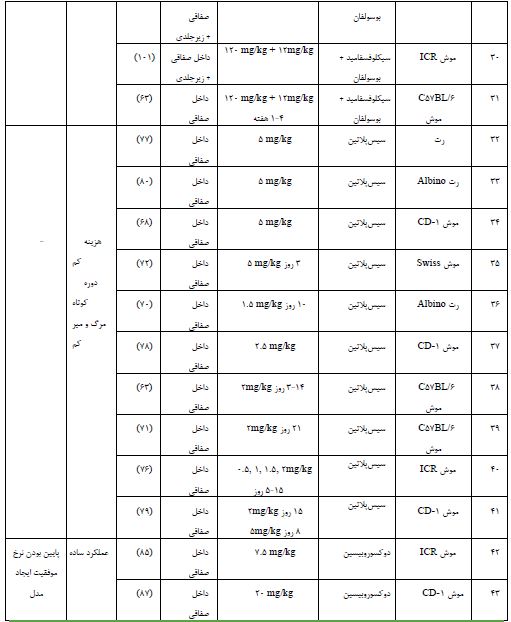
برای ابداع گزینههای درمانی موثر برای POF، درک بیشتر مکانیسمهای پاتوفیزیولوژیک این بیماری از اهمیت بالایی برخوردار است. درک ناقص از پاتوژنز POF یک مانع بزرگ برای توسعه گزینههای درمانی موثر برای این بیماری است (90). بسیاری از مطالعات از مدلهای حیوانی POF برای بررسی و شناسایی مکانیسم های POF و توسعه عوامل درمانی استفاده کردهاند. القای مدل حیوانی نارسایی زودرس تخمدان با استفاده از یک عامل گنادوتوکسیک بدون آسیب جدی به سایر اندامها کاری چالشبرانگیز است. بنابراین، توضیح مکانیسم توسعه POF برای درمان بالینی این بیماری، حیاتی است و با توجه محدودیت هایی که در انجام مطالعات کامل در انسان وجود دارد، مدل های حیوانی مثل موش و رت ابزار قدرتمندی برای یافتن پاتوژنز این بیماری می باشند. در این مقاله به بررسی مطالعاتی که از موش به عنوان مدل POF استفاده کردند، پرداختیم. از آنجاییکه سیکل جنسی موش ماده شبیه انسان است، غالبا از موش و رت برای القا مدل نارسایی زودرس تخمدان استفاده می شود. اگرچه سیکل جنسی موش کوتاهتر از انسان است. همچنین موش و رت، درجه بالایی از شباهت فرآیندها و عملکردهای رشد تخمدان با انسان دارند و تنظیم مسیر ژنتیکی مسئول POI در آن ها مشابه انسان است (91). همچنین از نظر آناتومی شباهت زیادی به انسان دارند و 95% ژنها بین سه گونه یکسان است. از طرفی هزینه نگهداری کم و آسان، زادآوری زیاد و دوره بارداری کوتاهی (21-19 روز) دارند و تعداد نسبتاً زیادی فرزند تولید میکنند که آن ها را مدلهای حیوانی ایدهآلی برای تحقیقات زیستپزشکی کرده است (92). برای اطمینان از ایجاد یک مدل حیوانی POF، شاخصهای ارزیابی عمدتاً شامل بافتشناسی تخمدان، باروری و هورمون است. بافتشناسی تخمدان یک شاخص ارزیابی ضروری مدل حیوانی POF است. ذخیره تخمدان به فولیکولهای بدوی در قشر تخمدان اشاره دارد. آزمایشهای ذخیره تخمدان با ارزیابی مستقیم یا غیرمستقیم کاهش تعداد فولیکول ها انجام می شود (93). ارزیابی بافتشناسی شامل حجم و وزن تخمدان، تعداد جسم زرد، طول سیکل جنسی، تعداد فولیکولها، تعداد تخمک گذاری طبیعی است (94). در بافتهای تخمدانی مدل حیوانی POF، حجم و وزن تخمدان کاهش یافته، جسم زرد، تعداد تخمکگذاری طبیعی کمتر است و سیکل جنسی طولانی میشود. علاوه بر این، فولیکولهای بدوی، فولیکولهای ثانویه و فولیکولهای آنترال کاهش یافته اما فولیکولهای مرده و آپوپتوز افزایش مییابد (95). ناباروری در POF به دلیل کاهش عملکرد ذخیره تخمدان ایجاد میشود. از اینرو باروری یک شاخص ارزیابی حیاتی مدل حیوانی POF است. مدلهای حیوانی POF اغلب برای توانایی آنها در باردار شدن و تولید فرزندان ارزیابی میشوند. باروری حیوانات POF را می توان با جفتگیری آنها با نرهای بارور و نظارت بر نتایج بارداری آنها ارزیابی کرد (96). ارزیابی باروری، یک شاخص ارزیابی ضروری مدل حیوانی POF است، زیرا اطلاعاتی در مورد عملکرد تولیدمثل حیوانات ارائه میدهد. اندازهگیری سطوح هورمونی، مانند FSH، AMH و استرادیول، یکی دیگر از شاخصهای ارزیابی مهم مدل حیوانی POF است. در بیماری POF، سطح FSH بهطور معمول افزایش مییابد، در حالیکه سطوح استرادیول و AMH کاهش مییابد. پایین بودن AMH نشان دهنده کاهش عملکرد ذخیره تخمدان است. این تغییرات هورمونی را می توان در سرم یا پلاسمای حیوانات اندازهگیری کرد و میتواند بینش مهمی در مورد پاتوژنز POF ارائه دهد (98, 97). در یک مقاله مروری مطالعهای مبنی بر مقایسه مدلهای مختلف ایجاد POF انجام شده است (16)، در حالیکه ما در این مطالعه مروری به بررسی کاملتر و جامعتر مدلهای POF ناشی از داروهای مختلف شیمیدرمانی پرداختهایم، به دلیل اینکه رایجترین مدل ایجاد POF با استفاده از داروهای شیمیدرمانی ایجاد میشود و همچنین شایعترین علل POF، قرارگرفتن در معرض شیمیدرمانی و پرتودرمانی در درمان است (16،17). نارسایی تخمدان مرتبط با شیمیدرمانی Chemotherapy associated ovarian failure (COF) به اختلال در عملکرد غدد درونریز و باروری تخمدان، پس از قرار گرفتن در معرض داروهای شیمیدرمانی اشاره دارد. شیمیدرمانی جدا از تأثیر مستقیم بر فولیکولها و تخمکها، از طریق تأثیر بر کل تخمدان و با افزایش مداوم هورمونهای گنادوتروپین، منجر به بلوغ زودرس فولیکولهای تخمدانی میشود. همچنین عوامل آلکیله کننده، سمیترین داروهای شیمیدرمانی وابسته به دوز، باعث تخریب مستقیم تخمکها و تخلیه فولیکولی میشوند و ممکن است باعث فیبروز و آسیب عروق خونی تخمدان شوند (99). داروهای شیمیدرمانی گنادوتوکسیک میتواند باعث آسیب به سیستم تولیدمثل و اختلال در باروری شود. این داروها را میتوان بر اساس تأثیر بالقوه آنها بر باروری به سه دسته طبقهبندی کرد: 1- داروهای پرخطر: این داروها به شدت گنادوتوکسیک هستند و خطر بالایی برای ایجاد ناباروری دائمی دارند. برخی از نمونههای داروهای پرخطر عبارتند از سیکلوفسفامید، ایزوفسفامید، بوسولفان، ملفان، نیتروژن موستارد، پروکاربازین و کرامبوسیل 2-داروهای با خطر متوسط: این داروها خطر متوسطی در ایجاد ناباروری دارند و احتمال بازگشت برخی از باروریها پس از درمان وجود دارد. دوکسوروبیسین، سیسپلاتین و آدرامایسین، چند نمونه از داروهای با خطر متوسط بهشمار میروند. 3- داروهای کم خطر: این داروها خطر ناباروری پایینی دارند و معمولاً باروری پس از درمان برمیگردد. برخی از نمونههای داروهای کمخطر عبارتند از وینکریستین، متوترکسات، و بیلومایسین و 5-فلوروراسین (100). از بین داروهای شیمیدرمانی مذکور، سیکلوفسفامید به عنوان گنادوتوکسیک ترین دارو، که در بالین هم به عنوان خط اول داروهای شیمیدرمانی استفاده میشود به طور گسترده تری در ایجاد مدلهای حیوانی بهکار رفته است. مدل حیوانی کلاسیک برای مطالعه POF، ایجاد مدل با استفاده از داروهای شیمیدرمانی است. از طرفی رایجترین مدل حیوانی POF توسط سیکلوفسفامید القا میشود و اثر سمی تخمدان آن تایید شده است (101). مطالعات قبلی نشان دادهاند که برای ایجاد موثرترین مدل POF استفاده از سیکلوفسفامید (mg/kg120) حداقل به مدت 2 هفته و استفاده از سیسپلاتین (mg/kg2) برای حداقل بیش از 10 روز توصیه میشود. (63). در مطالعه بهرهبر و همکاران غلظتهای مختلف دو داروی شیمیدرمانی سیکلوفسفامید و بوسولفان به منظور ایجاد یک مدل POF بررسی کردند، که استفاده از mg/kg100 CTX به تنهایی برای 10 روز متوالی به عنوان موثرترین مدل القا POF انتخاب کردند (64). در یک مقاله متاآنالیز نشان داده شده است که دوز mg/kg200 با mg/kg8 دوز نگهدارنده از CTX برای 14 روز متوالی بهترین اثربخشی را در ایجاد مدل POF ناشی از CTX دارد (102). در جدول1 انواع داروهای شیمیدرمانی دخیل در ایجاد مدل نارسایی زودرس تخمدان در موش نشان داده شده است. با توجه به اینکه در مطالعات زیادی از سیکلوفسفامید به عنوان یک داروی شیمیدرمانی گنادوتوکسیک برای القا مدل POF در گونههای موش و رت استفاده کردهاند، از اینرو پیشنهاد ما هم استفاده از سیکوفسفامید برای ایجاد یک مدل POF موثر در گونه موش و رت میباشد. با اینحال، توجه به این نکته مهم است که انتخاب داروها ممکن است به اهداف تحقیقاتی خاص بستگی داشته باشد، از طرفی میزان گزارش شده از مدلهای نارسایی زودرس تخمدان با استفاده از داروهای شیمیدرمانی بسیار متفاوت میباشد و عمدتاً به پروتکلهای شیمیدرمانی، تعداد تزریق، محدوده سنی و نژاد حیوان بستگی دارد.
نتیجهگیری
با توجه به مطالعات، رایجترین روش ایجاد مدل حیوانی نارسایی زودرس تخمدان استفاده از داروهای شیمیدرمانی، بهویژه داروی سیکلوفسفامید می باشد؛ زیرا کمترین آسیب را به حیوان می زند و میزان مرگ پایینتر است. هرچند مدلهای حیوانی POF با استفاده از داروهای شیمیدرمانی، تصویر کاملی از این بیماری ارائه نمی دهند اما هنوز هم روشی موثر برای مطالعه و پیشگیری از آسیب عملکرد تخمدان مرتبط با شیمیدرمانی است. این مطالعه ممکن است در آینده به انتخاب موثرترین داروی شیمیدرمانی برای ایجاد مدل POF در موش به منظور توسعه داروهای درمانی، مطالعه عملکرد و مکانیسم POF کمک کند. هر چند برای انتخاب بهترین داروی شیمیدرمانی ایجاد کننده مدل POF در گونههای مختلف، یافتن موثرترین دوز دارو، و نیز دفعات تزریق، نیاز به مطالعات بیشتری دارد.
تعارض در منافع: وجود ندارد.
حامی مالی: ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
جدول 1: انواع داروهای شیمیدرمانی دخیل در ایجاد مدل نارسایی زودرس تخمدان در موش
سرطان یکی از مهمترین مشکلات سلامت عمومی جوامع در سراسر جهان است .هر ساله هزاران زن جوان به سرطان مبتلا شده و در معرض رژیمهای شیمیدرمانی و پرتوهای سایتوتوکسیک یا سمیت سلولی، قرار میگیرند که تأثیر منفی قابلتوجهی بر تولیدمثل دارند (1). مهمترین و شایعترین عوارض شیمیدرمانی، نارسایی زودرس تخمدان Premature ovarian failure (POF) یا نارسایی اولیه تخمدان Primary Ovarian Insufficiency (POI) و به دنبال آن ناباروری میباشد (3, 2). POF یک بیماری غدد درونریز شایع است، که با افزایش سطح گنادوتروپینها هورمون لوتئین کننده Luteinizing hormone (LH) و هورمون محرک فولیکول Follicle-stimulating hormone (FSH)] (آمنوره هیپرگنادوتروپیک)، سطوح پایین هورمونهای جنسی (استرادیول (E2) و اینهیبینها) و عدم قاعدگی به مدت حداقل 4 ماه در زنان کمتر از 40 سال مشخص میشود (5, 4). علاوه بر این، بیماران از پیامدهای طولانیمدت کمبود استروژن، از جمله پوکی استخوان، بیماریهای قلبی عروقی و اختلالات روانی مانند افسردگی رنج میبرند (7, 6). علل POF ناشناخته است و به عوامل پیچیده بسیاری مانند نقایص ژنتیکی، اختلالات خودایمنی، عفونت، عوامل ایاتروژنیک (جراحی تخمدان، آسیب شیمیدرمانی یا رادیوتراپی) و غیره مربوط می شود (9, 8). از داروهای شیمیدرمانی به عنوان یکی از عوامل مهم نارسایی زودرس تخمدان در بیمارانی که عملکرد تخمدان آنها متوقف شده است، یاد میشود (10). داروهای شیمیدرمانی به 5 گروه تقسیم میشوند: 1- عوامل آلکیله کننده مثل سیکلوفسفامید، مکلورتامین، کلورامبوسیل، پروکاربازین، بوسولفان و ملفان 2- ترکیبات با پایه پلاتینیوم مثل سیسپلاتین و کربوپلاتین 3- آنتیمتابولیتها مثل متوتروکسات، 5- فلوئوراسیل و سیتارابین 4- آلکالوئیدهای وینکا مثل وینکریستین و وینبلاستین 5- آنتیبیوتیکهای آنتراسایکلین مثل دانوروبیسین، بیلومایسین و دوکسوروبیسین (12, 11). قرار گرفتن در معرض داروهای شیمیدرمانی منجر به تشکیل شکستگیهای دو رشتهای DNA Double-stranded breaks (DSBs) (شدیدترین نوع آسیب به DNA)، در فولیکولهای بدوی میشوند. پروتئین جهش یافته آتاکسی تلانژکتازی Ataxia-telangiectasia mutated (ATM)، پروتئین دخیل در تشخیص آسیب DNA، DSBs را از طریق فعالسازی نقاط بازرسی چرخه سلولی و پروتئینهای ترمیم DNA شناسایی و ترمیم میکند. با اینحال، اگر در تخمدان مسیرهای ترمیم DSBs فعال نشوند، آسیب DNA میتواند منجر به مهار تقسیم سلولی، فعال شدن مسیر آپوپتوز سلولهای گرانولوزای سوماتیک و تخمکها و در نهایت منجر به کاهش ذخیره تخمدان شود (15-13). همچنین داروهای شیمیدرمانی در درمان طیف وسیعی از بیماریهای غیربدخیم از جمله بیماریهای خودایمنی با شرایط شیمیدرمانی قبل از پیوند با سلولهای بنیادی که بهطور فزایندهای برای شرایط هماتولوژیک مانند کمخونی سلول داسی شکل، مورد استفاده قرار میگیرند. علیرغم تاثیر عظیم POF بر سلامت عمومی و کیفیت زندگی زنان مبتلا، پاتوفیزیولوژی آن نامشخص است. به همین منظور مدلهای حیوانی این فرصت را به ما میدهند که بهطور فرضی پاتوژنز را بهطور جامع بررسی کنیم. توضیح مکانیسم توسعه POF برای درمان بالینی این بیماری، حیاتی است و با توجه محدودیتهایی که در انجام مطالعات کامل در انسان وجود دارد، مدلهای حیوانی مثل موش و رت ابزار قدرتمندی برای یافتن پاتوژنز این بیماری می باشند. در این مقاله به بررسی مطالعاتی که از موش به عنوان مدل POF استفاده کردند، پرداختیم. همچنین از آنجاییکه رایجترین مدل ایجاد POF با استفاده از داروهای شیمیدرمانی ایجاد میشود و شایعترین علل POF، قرارگرفتن در معرض شیمیدرمانی و پرتودرمانی در درمان است (17, 16)، لذا در این مقاله مروری مدلهای نارسایی زودرس تخمدان ناشی از داروهای شیمیدرمانی و مکانیسم های مربوطه را بررسی خواهیم کرد.
1- انواع داروهای شیمیدرمانی به منظور ایجاد مدل POF
سیکلوفسفامید Cychlophosphamide (CTX): سیکلوفسفامید با فرمول شیمیایی C7H15Cl2N2O2P.H2O یک عامل ضد سرطان آلکیله کننده (19, 18) موثر است که از سال 1950 بهطور گسترده در بیماران مبتلا به سرطان استفاده میشود. CTX خود یک داروی جانبی است که توسط سایتوکرومP450 Cytochorome در کبد به شکل 4- هیدروکسی سیکلوفسفامید سپس به آلدوفسفامید متابولیزه میشود که به نوبه خود به خردل فسفورامید و آکرولئین تبدیل میشود. اثرات درمانی و سمی CTX مربوط به متابولیتهای فعال آن به عنوان آکرولئین و خردل فسفورامید میباشد. این متابولیتها با وارد کردن رادیکالهای آلکیل به DNA عمل میکنند که با ایجاد پیوند های عرضی درون رشتهای یا بین رشتهای منجر به اختلال سنتز DNA و مرگ سلولی میشوند (23-20)، که پیامدهای سمی مضر برای سلول های موجود در اندامهایی مانند قلب، کبد و کلیه داشته و اثرات سمی شدیدی نیز بر روی تخمدان دارد (24, 19). علاوه بر این خردل فسفورامید بر میتوکندری هم اثر گذاشته و منجر به کاهش پتانسیل دو طرف غشاء و تجمع سایتوکرومC سیتوزولی میشود که در نهایت باعث القا آپوپتوز سلولی میشود (25). CTX اولین داروی شیمیدرمانی مرتبط با آمنوره/POI، اختلال عملکرد تخمدان (موش و انسان) (26, 18) و همچنین به عنوان یکی از مهمترین عوامل گنادوتوکسیک (27) که با تسریع روند بلوغ فولیکولهای تخمدان به فولیکولهای بالغ، ذخایر تخمدان را کاهش داده و در نهایت منجر به نارسایی زودرس تخمدان میشود (28). در مطالعات قبلی نشان داده شده است، CTX باعث کاهش تعداد فولیکولهای بدوی، اولیه، ثانویه، آنترال و همچنین افزایش فولیکولهای مرده در تخمدانهای موش و رت میشود (34-29). کاهش ذخیره فولیکولی ناشی از سیکلوفسفامید مربوط به تحریک بیش از حد و کاهش ذخیره فولیکولهای بدوی Primordial follicles (PMFs) از طریق فعال سازی مسیر سیگنالینگ PTEN/Akt/FOXO3 میباشد (36, 35, 31). با اینحال در یک مطالعه نشان داده شده است که سیکلوفسفامید هیچ اثری در فعال سازی مسیر PTEN/Akt/FOXO3 ندارد که ممکن است به دلیل استفاده از دوز متفاوت CTX نسبت به مطالعات قبلی باشد (37). افزایش فسفوریلاسیون S473 AKT، S65 4E-BP1 به P-AKT و P-4E-BP1 در اثر قرار گرفتن در معرض سیکلوفسفامید توسط گلدمن و همکاران در سال 2017 نشان داده شده است (38). در مقابل مطالعات قبلی در یک مدل جوندگان نشان داد که مهار راپامایسین (mTOR) از فعال شدن فولیکولهای اولیه ناشی از سیکلوفسفامید از طریق مسیر PTEN/Akt/mTOR جلوگیری میکند (39, 38). اختلال در تنظیم محور سیگنالینگ Rictor/mTORC2/Akt/ Foxo3a می تواند منجر به آپوپتوز سلولی شود (40). همچنین شواهد روشنی وجود دارد که نشان میدهد CTX منجربه افزایش آپوپتوز سلولهای گرانولوزا در فولیکولهای در حال رشد از طریق فعالسازی مسیر میتوکندریایی و افزایش بیان پروتئین آپوپتوز Bax، Caspase3، Caspase1،NOD‐like receptor protein3 (NLPR3)، سیتوکرومc و کاهش بیان پروتئین ضدآپوپتوز Bcl-2 و Bclx-l می شود (45-40, 34, 28). همچنین پروتئین پروآپوپتوز PUMA ناشی از آسیب DNA نقش کلیدی در القا آپوپتوز تخمک در جوندگان به دنبال درمان با سیکلوفسفامید، دارد (30).
در مطالعات اخیر نشان داده شده است که سیکلوفسفامید باعث کاهش هورمونهای ضد مولرین Anti-Müllerian hormone (AMH)، E2، استروژن، پروژسترون و افزایش هورمون های FSH و LH میشود (47, 46, 32, 31, 29, 6). قرار گرفتن در معرض سیکلوفسفامید باعث آسیب فولیکولی و ایجاد POF ناشی از استرس اکسیداتیو (OS) می شود (48, 37). سیکلوفسفامید باعث افزایش تولید گونههای فعال اکسیژن (ROS) و کاهش آنتیاکسیدانهای آنزیمی و غیر آنزیمی در بافت تخمدان موش و رت میشود که باعث اختلال در عملکرد میتوکندری، التهاب، پراکسیداسیون لیپدی و آپوپتوز می شود (49-51, 31, 10). کاهش سطح آنزیم های آنتی اکسیدانی مثل سوپراکسید دیسموتاز (SOD)، گلوتاتیون پراکسیداز (GPx) و افزایش مالوندیآلدهید (MDA) در نارسایی زودرس تخمدان ناشی سیکلوفسفامید نشان داده شده است (شکل 1) (54-52, 49, 46, 44). از طرف دیگر یک حسگر مهم برای استرس اکسیداتیو، SIRT Silent information regulator1 (SIRT1) است، که مکانیسمهای دفاعی و ترمیم سلولی را هماهنگ و سرنوشت سلولی را کنترل میکند و از بقای سلولهای آسیب دیده جلوگیری می کند (55). در واقع SIRT1 هم در التهاب هم در استرس اکسیداتیو با مهار سیگنالینگ NF-kB Nuclear factor kappa B و تحریک پاسخ آنتی اکسیدانی از طریق بیان فاکتور رونویسی FOXO عمل میکند. سیکلوفسفامید در تخمک موش باعث افزایش SIRT1 به عنوان یه پاسخ تطبیقی به استرس اکسیداتیو میشود. (58-56, 44). بنابراین استفاده از سیکلوفسفامید میتواند همراه با اثرات مضر بر اندامهای مختلف از جمله تخمدان باشد. در حال حاضر قرارگیری منظم در معرض سیکلوفسفامید به عنوان یک پیش درمان برای القای از دست دادن گستره فولیکولی در آزمایشاتی که در آنها تحقیقات فیزیولوژیک تخمدان فاقد فولیکول بررسی میشود، استفاده می شود (26).

شکل 1: انواع آسیبهای ناشی از داروهای شیمیدرمانی بر تخمدان
بوسولفان Busulfan (BU): بوسولفان دارویی است که همراه با سیکلوفسفامید برای مدیریت و درمان پیوند سلولهای پیشساز خونساز آلوژنیک، بهویژه برای بیماران مبتلا به لوسمی میلوژن مزمن استفاده میشود. این دارو در گروه داروهای ضد سرطان قرار دارد و به عنوان یک عامل آلکیله کننده تعریف میشود که از دهه 1950 مورد استفاده قرار گرفته است. بوسولفان با اتصال به مولکولهای سیستئین پروتئینهای هیستون، منجر به اتصال DNA به پروتئین میشود. بوسولفان همچنین با برهمکنش با گروههای سولفیدریل گلوتاتیون، تعادل ردوکس سلولی را مختل میکند و در نتیجه باعث افزایش استرس اکسیداتیو در سلولهای سرطانی میشود (59). داروهای شیمیدرمانی کلاسیک سیکلوفسفامید و بوسولفان (CTX/BU)، که اغلب برای درمان سرطان در بالینی استفاده میشود، سمیت تولیدمثلی جدی دارند و برای القای POF در مدل حیوانی استفاده میشوند (60). ترکیب بوسولفان و سیکلوفسفامید باعث کاهش سایز تخمدان، کاهش تعداد فولیکولها (61) و افزایش تعداد فولیکولهای مرده در موش میشود. از سوی دیگر بوسولفان با کاهش عوامل آنتیاکسیدانی سوپراکسید دیسموتاز و Nrf2 و نیز کاهش پروتئین ضدآپتوزی Bcl-2 و افزایش پروتئین آپتوزی Bax در نهایت باعث آپوپتوز میشود (62, 60). مطالعات نشان دادهاند که وزن تخمدانها، وزن رحم و همچنین وزن بدن تحت درمان با سیکلوفسفامید و بوسولفان بهطور قابلتوجهی کاهش یافته است (شکل 1) (64, 63). لیو و همکاران در سال 2020 نشان دادند که در موشهای تحت درمان با CTX و BU افزایش بیان فسفوریلاسیون AKT و PI3K اتفاق میافتد (62).
سیسپلاتین Cisplatin (CIS): عوامل شیمیدرمانی مبتنی بر پلاتین، از جمله کربوپلاتین، سیسپلاتین، لوباپلاتین، نداپلاتین و اگزالیپلاتین، تقریباً 50 درصد از داروهای ضد سرطان مورد استفاده در محیط بالینی را تشکیل میدهند (65). متداولترین داروی مبتنی بر پلاتین، سیسپلاتین با فرمول شیمیایی Cl2H6N2Pt است (66). توانایی CIS برای مهار تقسیم سلولی برای اولین بار در دهه 1960 شناسایی شد (67) و اولین ترکیب پلاتین مورد تایید FDA برای درمان سرطان در سال 1987 معرفی شد که منجر به استفاده آن و سایر ترکیبات حاوی فلز به عنوان داروهای ضد سرطان بالقوه گردید. سیسپلاتین از ترکیبات فلزات سنگین است و به عنوان یک عامل پیوند متقابل DNA که با مکانیسمهای ترمیم DNA تداخل دارد، تقسیم سلولی را مسدود کرده، باعث آسیب DNA و ایجاد مرگ سلولی یا آپوپتوز میشود. CIS با چندین جزء سلولی مختلف تعامل دارد، اما هدف بیولوژیکی اولیه آن DNA است (18). به دنبال قرارگرفتن تخمدانهای موش و رت در معرض CIS، با از دست دادن ذخیره تخمدانی و افزایش فولیکولهای مرده همراه است (شکل 1) (70-68). سیسپلاتین با آسیب به DNA، نقاط بازرسی Checkpoint چرخه سلولی را فعال میکند و منجر به توقف چرخه سلولی و فعال شدن مسیر آپوپتوز از طریق افزایش بیان ژنهای Bax، Caspase3 و P53 میشود (72, 71). ژن سرکوبگر تومور p53، یکی از فاکتورهای رونویسی است که در تنظیم چرخه سلولی با جلوگیری از رشد و تقسیم آنها نقش دارد و در سرطانهای انسانی جهش یافته و غیر فعال میشود (73). (ATR) ATM-Rad3 Related، یک کیناز درگیر در فعالسازی نقطه بازرسی میباشد که توسط CIS فعال می شود و به نوبه خود میتواند پروتئین p53 و همچنین مسیر سیگنالینگ Mitogen-activated protein kinase (MAPK) را فعال کند (74). تخمک اولیه موش و انسان هر دو حاوی غلظت بالایی از Tap63(یک ایزوفرم خاص از P53، اعضای خانواده P63) هستند. سیسپلاتین Tap63α را از طریق مسیر ATR/CHEK1/CK1 فعال میکند و Tap63α به نوبه خود باعث افزایش بیان پروتئینهای پروآپوپتوز BH3-only، PUMA و NOXA میشود که در نهایت منجر به آپوپتوز تخمکها میشود (75). مطالعات نشان میدهند که قرارگرفتن فولیکولهای بدوی در معرض CIS، باعث فعالسازی بیش از حد PMFs و کاهش ذخیره تخمدان میشود و در نهایت با فعال کردن مسیر PTEN/Akt/FOXO3 باعث POF میشود (79-76). سیسپلاتین باعث افزایش قابلتوجه استرس اکسیداتیو و کاهش سطح آنتیاکسیدانهای SOD، GSH و GPx در بافت تخمدان رت میشود (80, 41).
دوکسوروبیسین Doxorubicin (DOX): دوکسوروبیسین با فرمول شیمیایی C27H29NO11، یک آنتیبیوتیک آنتراسایکلین (14-hydroxydaunomicyn) است که اغلب با نامهای تجاری آدریامایسین Adriamycin یا روبکس Rubex شناخته میشود. DOX با DNA تداخل دارد و از تکثیر و رونویسی آن جلوگیری میکند. همچنین برای درمان طیف وسیعی از سرطانها از جمله سرطان سینه، ریه، لنفوم، معده، تخمدان و سرطان خون استفاده میشود. شواهد اخیر نشان میدهند که گنادوتوکسیک بودن این دارو، در حد متوسط است. اصلیترین و شناختهشدهترین مکانیسم DOX مهار آنزیم هستهای توپوایزومراز II است (81, 18). در طول همانندسازی و رونویسی DNA، توپوایزومرازها نقش مهمی در حفظ ساختار صحیح DNA دارند. توپوایزومرازII از پیچش یا باز شدن بیش از حد رشتههای DNA، با ایجاد برش های موقت در دو رشته DNA در طول همانند سازی، جلوگیری میکند، بنابراین در انتقال فاز G2 به M چرخه سلولی فراوان هستند. DOX با وارد شدن به هسته سلول، توپوایزومراز II را مهار و همانندسازی DNA و RNA و سنتز پروتئین را نیز مختل میکند و باعث مرگ سلولی میشود. مکانیسم دیگر DOX تولید رادیکال های آزاد و دیگر گونههای فعال اکسیژن است (شکل 1). گونههای فعال اکسیژن میتوانند منجر به پراکسیداسیون لیپیدی و آسیب غشاء، آسیب به DNA، استرس اکسیداتیو و راهاندازی مسیرهای آپوپتوز و مرگ سلولی شوند (83, 82, 18). آپوپتوز اصلی ترین فرآیند مرگ سلولی ناشی از DOX در تخمدان است (18). سلولهای گرانولوزا و سلولهای استرومایی/تکا جدا شده از فولیکولهای در حال رشد و همچنین تخمکها در موش، پس از تزریق DOX دچار شکستگی DNA دو رشتهای و فعالسازی آپوپتوز میتوکندریایی از طریق ژنهای تنظیم کننده مرگ (BAX، Bcl-2، Caspase12 و p53) میشوند (87-84). همچنین مطالعات قبلی نشان داده شده است که 12 ساعت پس از تزریق DOX در موش، کاهش قابلتوجهی در جمعیت فولیکولهای بدوی و ثانویه و همچنین کاهش در اندازه و وزن تخمدان تا یک ماه بعد از آن مشاهده شد (89, 88).
بحث
برای ابداع گزینههای درمانی موثر برای POF، درک بیشتر مکانیسمهای پاتوفیزیولوژیک این بیماری از اهمیت بالایی برخوردار است. درک ناقص از پاتوژنز POF یک مانع بزرگ برای توسعه گزینههای درمانی موثر برای این بیماری است (90). بسیاری از مطالعات از مدلهای حیوانی POF برای بررسی و شناسایی مکانیسم های POF و توسعه عوامل درمانی استفاده کردهاند. القای مدل حیوانی نارسایی زودرس تخمدان با استفاده از یک عامل گنادوتوکسیک بدون آسیب جدی به سایر اندامها کاری چالشبرانگیز است. بنابراین، توضیح مکانیسم توسعه POF برای درمان بالینی این بیماری، حیاتی است و با توجه محدودیت هایی که در انجام مطالعات کامل در انسان وجود دارد، مدل های حیوانی مثل موش و رت ابزار قدرتمندی برای یافتن پاتوژنز این بیماری می باشند. در این مقاله به بررسی مطالعاتی که از موش به عنوان مدل POF استفاده کردند، پرداختیم. از آنجاییکه سیکل جنسی موش ماده شبیه انسان است، غالبا از موش و رت برای القا مدل نارسایی زودرس تخمدان استفاده می شود. اگرچه سیکل جنسی موش کوتاهتر از انسان است. همچنین موش و رت، درجه بالایی از شباهت فرآیندها و عملکردهای رشد تخمدان با انسان دارند و تنظیم مسیر ژنتیکی مسئول POI در آن ها مشابه انسان است (91). همچنین از نظر آناتومی شباهت زیادی به انسان دارند و 95% ژنها بین سه گونه یکسان است. از طرفی هزینه نگهداری کم و آسان، زادآوری زیاد و دوره بارداری کوتاهی (21-19 روز) دارند و تعداد نسبتاً زیادی فرزند تولید میکنند که آن ها را مدلهای حیوانی ایدهآلی برای تحقیقات زیستپزشکی کرده است (92). برای اطمینان از ایجاد یک مدل حیوانی POF، شاخصهای ارزیابی عمدتاً شامل بافتشناسی تخمدان، باروری و هورمون است. بافتشناسی تخمدان یک شاخص ارزیابی ضروری مدل حیوانی POF است. ذخیره تخمدان به فولیکولهای بدوی در قشر تخمدان اشاره دارد. آزمایشهای ذخیره تخمدان با ارزیابی مستقیم یا غیرمستقیم کاهش تعداد فولیکول ها انجام می شود (93). ارزیابی بافتشناسی شامل حجم و وزن تخمدان، تعداد جسم زرد، طول سیکل جنسی، تعداد فولیکولها، تعداد تخمک گذاری طبیعی است (94). در بافتهای تخمدانی مدل حیوانی POF، حجم و وزن تخمدان کاهش یافته، جسم زرد، تعداد تخمکگذاری طبیعی کمتر است و سیکل جنسی طولانی میشود. علاوه بر این، فولیکولهای بدوی، فولیکولهای ثانویه و فولیکولهای آنترال کاهش یافته اما فولیکولهای مرده و آپوپتوز افزایش مییابد (95). ناباروری در POF به دلیل کاهش عملکرد ذخیره تخمدان ایجاد میشود. از اینرو باروری یک شاخص ارزیابی حیاتی مدل حیوانی POF است. مدلهای حیوانی POF اغلب برای توانایی آنها در باردار شدن و تولید فرزندان ارزیابی میشوند. باروری حیوانات POF را می توان با جفتگیری آنها با نرهای بارور و نظارت بر نتایج بارداری آنها ارزیابی کرد (96). ارزیابی باروری، یک شاخص ارزیابی ضروری مدل حیوانی POF است، زیرا اطلاعاتی در مورد عملکرد تولیدمثل حیوانات ارائه میدهد. اندازهگیری سطوح هورمونی، مانند FSH، AMH و استرادیول، یکی دیگر از شاخصهای ارزیابی مهم مدل حیوانی POF است. در بیماری POF، سطح FSH بهطور معمول افزایش مییابد، در حالیکه سطوح استرادیول و AMH کاهش مییابد. پایین بودن AMH نشان دهنده کاهش عملکرد ذخیره تخمدان است. این تغییرات هورمونی را می توان در سرم یا پلاسمای حیوانات اندازهگیری کرد و میتواند بینش مهمی در مورد پاتوژنز POF ارائه دهد (98, 97). در یک مقاله مروری مطالعهای مبنی بر مقایسه مدلهای مختلف ایجاد POF انجام شده است (16)، در حالیکه ما در این مطالعه مروری به بررسی کاملتر و جامعتر مدلهای POF ناشی از داروهای مختلف شیمیدرمانی پرداختهایم، به دلیل اینکه رایجترین مدل ایجاد POF با استفاده از داروهای شیمیدرمانی ایجاد میشود و همچنین شایعترین علل POF، قرارگرفتن در معرض شیمیدرمانی و پرتودرمانی در درمان است (16،17). نارسایی تخمدان مرتبط با شیمیدرمانی Chemotherapy associated ovarian failure (COF) به اختلال در عملکرد غدد درونریز و باروری تخمدان، پس از قرار گرفتن در معرض داروهای شیمیدرمانی اشاره دارد. شیمیدرمانی جدا از تأثیر مستقیم بر فولیکولها و تخمکها، از طریق تأثیر بر کل تخمدان و با افزایش مداوم هورمونهای گنادوتروپین، منجر به بلوغ زودرس فولیکولهای تخمدانی میشود. همچنین عوامل آلکیله کننده، سمیترین داروهای شیمیدرمانی وابسته به دوز، باعث تخریب مستقیم تخمکها و تخلیه فولیکولی میشوند و ممکن است باعث فیبروز و آسیب عروق خونی تخمدان شوند (99). داروهای شیمیدرمانی گنادوتوکسیک میتواند باعث آسیب به سیستم تولیدمثل و اختلال در باروری شود. این داروها را میتوان بر اساس تأثیر بالقوه آنها بر باروری به سه دسته طبقهبندی کرد: 1- داروهای پرخطر: این داروها به شدت گنادوتوکسیک هستند و خطر بالایی برای ایجاد ناباروری دائمی دارند. برخی از نمونههای داروهای پرخطر عبارتند از سیکلوفسفامید، ایزوفسفامید، بوسولفان، ملفان، نیتروژن موستارد، پروکاربازین و کرامبوسیل 2-داروهای با خطر متوسط: این داروها خطر متوسطی در ایجاد ناباروری دارند و احتمال بازگشت برخی از باروریها پس از درمان وجود دارد. دوکسوروبیسین، سیسپلاتین و آدرامایسین، چند نمونه از داروهای با خطر متوسط بهشمار میروند. 3- داروهای کم خطر: این داروها خطر ناباروری پایینی دارند و معمولاً باروری پس از درمان برمیگردد. برخی از نمونههای داروهای کمخطر عبارتند از وینکریستین، متوترکسات، و بیلومایسین و 5-فلوروراسین (100). از بین داروهای شیمیدرمانی مذکور، سیکلوفسفامید به عنوان گنادوتوکسیک ترین دارو، که در بالین هم به عنوان خط اول داروهای شیمیدرمانی استفاده میشود به طور گسترده تری در ایجاد مدلهای حیوانی بهکار رفته است. مدل حیوانی کلاسیک برای مطالعه POF، ایجاد مدل با استفاده از داروهای شیمیدرمانی است. از طرفی رایجترین مدل حیوانی POF توسط سیکلوفسفامید القا میشود و اثر سمی تخمدان آن تایید شده است (101). مطالعات قبلی نشان دادهاند که برای ایجاد موثرترین مدل POF استفاده از سیکلوفسفامید (mg/kg120) حداقل به مدت 2 هفته و استفاده از سیسپلاتین (mg/kg2) برای حداقل بیش از 10 روز توصیه میشود. (63). در مطالعه بهرهبر و همکاران غلظتهای مختلف دو داروی شیمیدرمانی سیکلوفسفامید و بوسولفان به منظور ایجاد یک مدل POF بررسی کردند، که استفاده از mg/kg100 CTX به تنهایی برای 10 روز متوالی به عنوان موثرترین مدل القا POF انتخاب کردند (64). در یک مقاله متاآنالیز نشان داده شده است که دوز mg/kg200 با mg/kg8 دوز نگهدارنده از CTX برای 14 روز متوالی بهترین اثربخشی را در ایجاد مدل POF ناشی از CTX دارد (102). در جدول1 انواع داروهای شیمیدرمانی دخیل در ایجاد مدل نارسایی زودرس تخمدان در موش نشان داده شده است. با توجه به اینکه در مطالعات زیادی از سیکلوفسفامید به عنوان یک داروی شیمیدرمانی گنادوتوکسیک برای القا مدل POF در گونههای موش و رت استفاده کردهاند، از اینرو پیشنهاد ما هم استفاده از سیکوفسفامید برای ایجاد یک مدل POF موثر در گونه موش و رت میباشد. با اینحال، توجه به این نکته مهم است که انتخاب داروها ممکن است به اهداف تحقیقاتی خاص بستگی داشته باشد، از طرفی میزان گزارش شده از مدلهای نارسایی زودرس تخمدان با استفاده از داروهای شیمیدرمانی بسیار متفاوت میباشد و عمدتاً به پروتکلهای شیمیدرمانی، تعداد تزریق، محدوده سنی و نژاد حیوان بستگی دارد.
نتیجهگیری
با توجه به مطالعات، رایجترین روش ایجاد مدل حیوانی نارسایی زودرس تخمدان استفاده از داروهای شیمیدرمانی، بهویژه داروی سیکلوفسفامید می باشد؛ زیرا کمترین آسیب را به حیوان می زند و میزان مرگ پایینتر است. هرچند مدلهای حیوانی POF با استفاده از داروهای شیمیدرمانی، تصویر کاملی از این بیماری ارائه نمی دهند اما هنوز هم روشی موثر برای مطالعه و پیشگیری از آسیب عملکرد تخمدان مرتبط با شیمیدرمانی است. این مطالعه ممکن است در آینده به انتخاب موثرترین داروی شیمیدرمانی برای ایجاد مدل POF در موش به منظور توسعه داروهای درمانی، مطالعه عملکرد و مکانیسم POF کمک کند. هر چند برای انتخاب بهترین داروی شیمیدرمانی ایجاد کننده مدل POF در گونههای مختلف، یافتن موثرترین دوز دارو، و نیز دفعات تزریق، نیاز به مطالعات بیشتری دارد.
تعارض در منافع: وجود ندارد.
حامی مالی: ندارد.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
جدول 1: انواع داروهای شیمیدرمانی دخیل در ایجاد مدل نارسایی زودرس تخمدان در موش



References:
1- Bildik G, Acılan C, Sahin GN, Karahuseyinoglu S, Oktem O. C-Abl is Not Actıvated in DNA Damage-Induced and Tap63-Mediated Oocyte Apoptosıs in Human Ovary. Cell Death Dis 2018; 9: 943.
2- Jang H, Hong K, Choi Y. Melatonin and Fertoprotective Adjuvants: Prevention against Premature Ovarian Failure during Chemotherapy. Int J Mol Sci 2017; 18(6): 1221.
3- Waxman J. Chemotherapy and the Adult Gonad: A Review. J R Soc Med 1983; 76(2): 144-8.
4- Coulam CB. Premature Gonadal Failure. Fertil Steril 1982; 38(6): 645-55.
5- Vujovic S, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, Moen MH, et al. EMAS Position Statement: Managing Women with Premature Ovarian Failure. Maturitas 2010; 67(1): 91-3
6- Abdelzaher WY, Abdel-Hafez SMN, Rofaeil RR, Ali A, Hegazy A, Bahaa HA. The Protective Effect of Fenofibrate, Triptorelin, and their Combination Against Premature Ovarian Failure in Rats. Naunyn Schmiedebergs Arch Pharmacol 2021; 394(1): 137-49.
7- Podfigurna-Stopa A, Czyzyk A, Grymowicz M, Smolarczyk R, Katulski K, Czajkowski K, et al. Premature Ovarian Insufficiency: The Context of Long-Term Effects. J Endocrinol Invest 2016; 39(9): 983-90.
8- Elkady MA, Shalaby S, Fathi F, El-Mandouh S. Effects of Quercetin and Rosuvastatin Each Alone or in Combination on Cyclophosphamide-Induced Premature Ovarian Failure in Female Albino Mice. Hum Exp Toxicol 2019; 38(11): 1283-95.
9- Wang XF, Zhang L, Wu QH, Min JX, Ma N, Luo LC. Biological Mechanisms of Premature Ovarian Failure Caused by Psychological Stress Based on Support Vector Regression. Int J Clin Exp Med 2015; 8(11): 21393-9.
10- Abdel-Aziz AM, Mohamed ASM, Abdelazem O, Okasha AMM, Kamel MY. Cilostazol Protects Against Cyclophosphamide-Induced Ovarian Toxicity in Female Rats: Role of Camp and HO-1. Toxicol Mech Methods 2020; 30(7): 526-35.
11- Okada K, Fujisawa M. Recovery of Spermatogenesis Following Cancer Treatment with Cytotoxic Chemotherapy and Radiotherapy. World J Mens Health 2019; 37(2): 166-74.
12- Bedoschi G, Navarro PA, Oktay K. Chemotherapy-Induced Damage to Ovary: Mechanisms and Clinical Impact. Future Oncol 2016; 12(20): 2333-44.
13- Kim S, Kim SW, Han SJ, Lee S, Park HT, Song JY, et al. Molecular Mechanism and Prevention Strategy of Chemotherapy- and Radiotherapy-Induced Ovarian Damage. Int J Mol Sci 2021; 22(14): 7484.
14- Di Giacomo M, Barchi M, Baudat F, Edelmann W, Keeney S, Jasin M. Distinct Dna-Damage-Dependent and -Independent Responses Drive the Loss of Oocytes in Recombination-Defective Mouse Mutants. Proc Natl Acad Sci USA 2005; 102(3): 737-42.
15- Perez GI, Acton BM, Jurisicova A, Perkins GA, White A, Brown J, et al. Genetic Variance Modifies Apoptosis Susceptibility in Mature Oocytes Via Alterations in DNA Repair Capacity and Mitochondrial Ultrastructure. Cell Death Differ 2007; 14(3): 524-33.
16- Dai F, Wang R, Deng Z, Yang D, Wang L, Wu M, et al. Comparison of the Different Animal Modeling and Therapy Methods of Premature Ovarian Failure in Animal Model. Stem Cell Res Ther 2023; 14(1): 135.
17- Sheikhansari G, Aghebati-Maleki L, Nouri M, Jadidi-Niaragh F, Yousefi M. Current Approaches for the Treatment of Premature Ovarian Failure with Stem Cell Therapy. Biomed Pharmacother 2018; 102: 254-62.
18- Spears N, Lopes F, Stefansdottir A, Rossi V, De Felici M, Anderson RA, et al. Ovarian Damage from Chemotherapy and Current Approaches to Its Protection. Hum Reprod Update 2019; 25(6): 673-93.
19- Akyol S, Gulec MA, Erdemli HK, Akyol O. Can Propolis and Caffeic Acid Phenethyl Ester Be Promising Agents Against Cyclophosphamide Toxicity? J Intercult Ethnopharmacol. 2016; 5(1): 105-7.
20- Fleer R, Brendel M. Toxicity, Interstrand Cross-Links and DNA Fragmentation Induced by 'Activated' Cyclophosphamide in Yeast: Comparative Studies on 4-Hydroperoxy-Cyclophosphamide, Its Monofunctional Analogon, Acrolein, Phosphoramide Mustard, and Nor-Nitrogen Mustard. Chem Biol Interact 1982; 39(1): 1-15.
21- Ogino MH, Tadi P. Cyclophosphamide. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.Available at: https://www.ncbi.nlm.nih.gov/books/NBK553087/. Accessed July 3, 2023.
22- Madden JA, Keating AF. Ovarian Xenobiotic Biotransformation Enzymes are Altered During Phosphoramide Mustard-Induced Ovotoxicity. Toxicol Sci 2014; 141(2): 441-52.
23- Ludeman SM. The Chemistry of the Metabolites of Cyclophosphamide. Curr Pharm Des 1999; 5: 627-43.
24- Jarrell JF, Bodo L, YoungLai EV, Barr RD, O'Connell GJ. The Short-Term Reproductive Toxicity of Cyclophosphamide in the Female Rat. Reprod Toxicol 1991; 5(6): 481-5.
25- Madden JA, Thomas PQ, Keating AF. Phosphoramide Mustard Induces Autophagy Markers and Mtor Inhibition Prevents Follicle Loss Due to Phosphoramide Mustard Exposure. Reprod Toxicol 2017; 67: 65-78.
26- Barberino RS, Silva RLS, Palheta Junior RC, Smitz JE, Matos MHT. Protective Effects of Antioxidants on Cyclophosphamide-Induced Ovarian Toxicity. Biopreserv Biobank 2023; 21(2): 121-41.
27- Overbeek A, van den Berg MH, van Leeuwen FE, Kaspers GJ, Lambalk CB, van Dulmen-den Broeder E. Chemotherapy-Related Late Adverse Effects on Ovarian Function in Female Survivors of Childhood and Young Adult Cancer: A Systematic Review. Cancer Treat Rev 2017; 53: 10-24
28- Piasecka-Srader J, Blanco FF, Delman DH, Dixon DA, Geiser JL, Ciereszko RE, et al. Tamoxifen Prevents Apoptosis and Follicle Loss from Cyclophosphamide in Cultured Rat Ovaries. Biol Reprod 2015; 92(5): 132.
29- Huang CC, Chou CH, Yang YS, Ho HN, Shun CT, Wen WF, et al. Metformin: A Novel Promising Option for Fertility Preservation during Cyclophosphamide-Based Chemotherapy. Biol Reprod 2015; 92(5): 132.
30- Nguyen Q-N, Zerafa N, Liew SH, Morgan FH, Strasser A, Scott CL, et al. Loss of PUMA Protects the Ovarian Reserve During DNA-Damaging Chemotherapy and Preserves Fertility. Cell Death Dis 2018; 9(6): 618.
31- Zheng S, Ma M, Chen Y, Li M. Effects of Quercetin on Ovarian Function and Regulation of the Ovarian PI3K/Akt/Foxo3A Signalling Pathway and Oxidative Stress in a Rat Model of Cyclophosphamide-Induced Premature Ovarian Failure. Basic Clin Pharmacol Toxicol 2022; 130(2): 240-53.
32- Hassanpour A, Yousefian S, Askaripour M, Sharififar F, Ezzatabadipour M. Ovarian Protection in Cyclophosphamide-Treated Mice by Fennel. Oxicol Rep 2017; 4: 160-64.
33- Liu X, Song Y, Zhou F, Zhang C, Li F, Hu R, et al. Network and Experimental Pharmacology on Mechanism of Si-Wu-Tang Improving Ovarian Function in a Mouse Model of Premature Ovarian Failure Induced By Cyclophosphamide. J Ethnopharmacol 2023; 301: 115842
34- Pascuali N, Scotti L, Di Pietro M, Oubiña G, Bas D, May M, et al. Ceramide-1-Phosphate Has Protective Properties Against Cyclophosphamide-Induced Ovarian Damage in a Mice Model of Premature Ovarian Failure. Hum Reprod 2018; 33(5): 844-59.
35- Kalich-Philosoph L, Roness H, Carmely A, Fishel-Bartal M, Ligumsky H, Paglin S, et al. Cyclophosphamide Triggers Follicle Activation and "Burnout"; AS101 Prevents Follicle Loss and Preserves Fertility. Sci Transl Med 2013; 5(185): 185ra62.
36- Li J, Long H, Cong Y, Gao H, Lyu Q, Yu S, et al. Quercetin Prevents Primordial Follicle Loss Via Suppression of PI3K/Akt/Foxo3a Pathway Activation in Cyclophosphamide-Treated Mice. Reprod Biol Endocrinol 2021; 19(1): 63.
37- Feng J, Ma WW, Li HX, Pei XY, Deng SL, Jia H, et al. Melatonin Prevents Cyclophosphamide-Induced Primordial Follicle Loss by Inhibiting Ovarian Granulosa Cell Apoptosis and Maintaining AMH Expression. Front Endocrinol (Lausanne) 2022; 13: 895095.
38- Goldman KN, Chenette D, Arju R, Duncan FE, Keefe DL, Grifo JA, et al. Mtorc1/2 Inhibition Preserves Ovarian Function and Fertility During Genotoxic Chemotherapy. Proc Natl Acad Sci USA 2017; 114(12): 3186-91.
39- Zhou L, Xie Y, Li S, Liang Y, Qiu Q, Lin H, et al. Rapamycin Prevents Cyclophosphamide-Induced Over-Activation of Primordial Follicle Pool through PI3K/Akt/Mtor Signaling Pathway in Vivo. J Ovarian Res 2017; 10(1): 56.
40- Zhang B-f, Hu Y, Liu X, Cheng Z, Lei Y, Liu Y, et al. The Role of AKT and FOXO3 in Preventing Ovarian Toxicity Induced by Cyclophosphamide. PloS one 2018; 13(8): e0201136.
41- Barberino RS, Silva RL, Palheta Junior RC, Smitz JE, Matos MH. Protective Effects of Antioxidants on Cyclophosphamide-Induced Ovarian Toxicity. Biopreservation and Biobanking 2023; 21(2): 121-41
42- Barekati Z, Golkar-Narenji A, Totonchi M, Radpour R, Gourabi H. Effects of Amifostine in Combination with Cyclophosphamide on Female Reproductive System. Reproductive Sciences 2012; 19(5): 539-46.
43- Yao Y, Xu Y, Wang Y. Protective Roles and Mechanisms of Rosmarinic Acid in Cyclophosphamide-Induced Premature Ovarian Failure. Journal of Biochemical and Molecular Toxicology 2020; 34(12): e22591.
44- Wang S, Sun M, Yu L, Wang Y, Yao Y, Wang D. Niacin Inhibits Apoptosis and Rescues Premature Ovarian Failure. Cell Physiol Biochem 2018; 50(6): 2060-70.
45- Petrillo SK, Desmeules P, Truong TQ, Devine PJ. Detection of DNA Damage in Oocytes of Small Ovarian Follicles Following Phosphoramide Mustard Exposures of Cultured Rodent Ovaries in Vitro. Toxicology and Applied Pharmacology 2011; 253(2): 94-102.
46- Mobasher MA, Hassen MT, Ebiya RA, Alturki NA, Alzamami A, Mohamed HK, et al. Ameliorative Effect of Citrus Lemon Peel Extract and Resveratrol on Premature Ovarian Failure Rat Model: Role of Inos/Caspase-3 Pathway. Molecules 2022; 28(1): 122.
47- Çağlı F, Baktır MA, Dolanbay M, Balcıoğlu E, Cumaoğlu A, Ermiş M, et al. An Evaluation of the Effects on the Ovaries of Hyperbaric Oxygen Therapy in a Rat Model of Premature Ovarian Failure Created With Cyclophosphamide. Turk J Obstet Gynecol 2023; 20(1): 46-52.
48- Jeelani R, Khan SN, Shaeib F, Kohan-Ghadr HR, Aldhaheri SR, Najafi T, et al. Cyclophosphamide and Acrolein Induced Oxidative Stress Leading to Deterioration of Metaphase II Mouse Oocyte Quality. Free Radic Biol Med 2017; 110: 11-8.
49- Melekoglu R, Ciftci O, Eraslan S, Cetin A, Basak N. Beneficial Effects of Curcumin and Capsaicin on Cyclophosphamide-Induced Premature Ovarian Failure in a Rat Model. J Ovarian Res 2018; 33: 11 .
50- Li S, Liu M, Ma H, Jin Q, Ma Y, Wang C, et al. Ameliorative Effect of Recombinant Human Lactoferrin on the Premature Ovarian Failure in Rats after Cyclophosphamide Treatments. Journal of Ovarian Research 2021; 14: 17.
51- Hamzeh M, Hosseinimehr SJ, Mohammadi HR, Yaghubi Beklar S, Dashti A, Talebpour Amiri F. Atorvastatin Attenuates the Ovarian Damage Induced by Cyclophosphamide in Rat: An Experimental Study. Int J Reprod Biomed Int J Reprod Biomed 2018; 16(5): 323-34.
52- Khedr NF. Protective Effect of Mirtazapine and Hesperidin on Cyclophosphamide-Induced Oxidative Damage and Infertility in Rat Ovaries. Exp Biol Med (Maywood) 2015; 240(12): 1682-9.
53- Yener NA, Sinanoglu O, Ilter E, Celik A, Sezgin G, Midi A, et al. Effects of Spirulina on Cyclophosphamide-Induced Ovarian Toxicity in Rats: Biochemical and Histomorphometric Evaluation of the Ovary. Biochem Res Int 2013; 2013: 764262.
54- Elsenosi Y, Aziza S, Hussein A, Mohsen, Aggag A, Elnahas K. Curcumin and/or Hesperidin Alleviates Oxidative Stress and Hormonal Alterations in a Rat Model of Cyclophosphamide-Induced Premature Ovarian Failure. Benha Veterinary Medical Journal 2020; 39: 95-100.
55- Di Emidio G, Rossi G, Bonomo I, Alonso GL, Sferra R, Vetuschi A, et al. The Natural Carotenoid Crocetin and the Synthetic Tellurium Compound AS101 Protect the Ovary against Cyclophosphamide by Modulating SIRT1 and Mitochondrial Markers. Oxid Med Cell Longev 2017; 2017: 8928604.
56- Salminen A, Kaarniranta K, Kauppinen A. Crosstalk between Oxidative Stress and SIRT: Impact on the Aging Process. Int J Mol Sci 2013; 14(2): 3834-59..
57- Zhang M, Yu X, Li D, Ma N, Wei Z, Ci X, et al. Nrf2 Signaling Pathway Mediates the Protective Effects of Daphnetin Against D-Galactose Induced-Premature Ovarian Failure. 2022; 13: 810524.
58- Ma M, Chen XY, Li B, Li XT. Melatonin Protects Premature Ovarian Insufficiency Induced by Tripterygium Glycosides: Role of SIRT1. Am J Transl Res 2017; 9(4): 1580-602.
59- Patel R, Tadi P. Busulfan. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.Available at: https://www.ncbi.nlm.nih.gov/books/NBK555986/. Aceessed March 10, 2024
60- Chen C, Li S, Hu C, Cao W, Fu Q, Li J, et al. Protective Effects of Puerarin on Premature Ovarian Failure Via Regulation of Wnt/Β-Catenin Signaling Pathway and Oxidative Stress. Reprod Sci 2021; 28(4): 982-90.
61- Jiang Y, Zhao J, Qi HJ, Li XL, Zhang SR, Song DW, et al. Accelerated Ovarian Aging in Mice by Treatment of Busulfan and Cyclophosphamide. J Zhejiang Univ Sci B 2013; 14(4): 318-24.
62- Liu M, Qiu Y, Xue Z, Wu R, Li J, Niu X, et al. Small Extracellular Vesicles Derived from Embryonic Stem Cells Restore Ovarian Function of Premature Ovarian Failure through PI3K/AKT Signaling Pathway. Stem Cell Res Ther 2020;11(1): 3.
63- Lee Eh, Han SE, Park MJ, Kim HJ, Kim HG, Kim CW, et al. Establishment of Effective Mouse Model of Premature Ovarian Failure Considering Treatment Duration of Anticancer Drugs and Natural Recovery Time. J Menopausal Med 2018; 24(3): 196-203.
64- Bahrehbar K, Rezazadeh Valojerdi M, Esfandiari F, Fathi R, Hassani SN, Baharvand H. Human Embryonic Stem Cell-Derived Mesenchymal Stem Cells Improved Premature Ovarian Failure. World J Stem Cells 2020; 12(8): 857-78.
65- Ma P, Xiao H, Yu C, Liu J, Cheng Z, Song H, et al. Enhanced Cisplatin Chemotherapy by Iron Oxide Nanocarrier-Mediated Generation of Highly Toxic Reactive Oxygen Species. Nano Lett 2017; 17(2): 928-37.
66- Wang Q, Hutt KJ. Evaluation of Mitochondria in Mouse Oocytes Following Cisplatin Exposure. J Ovarian Res 2021; 14(1): 65.
67- Kelland L. The Resurgence of Platinum-Based Cancer Chemotherapy. Nat Rev Cancer 2007; 7(8): 573-84.
68- Gonfloni S, Tella L, Caldarola S, Cannata S, Klinger F, Di Bartolomeo C, et al. Inhibition of the C-Abl-Tap63 Pathway Protects Mouse Oocytes from Chemotherapy-Induced Death. Nat Med 2009; 15(10): 1179-85.
69- Kim SY, Cordeiro MH, Serna VA, Ebbert K, Butler LM, Sinha S, et al. Rescue of Platinum-Damaged Oocytes from Programmed Cell Death through Inactivation of the P53 Family Signaling Network. Cell Death Differ 2013; 20(8): 987-97.
70- Gürsoy A, Sade AG. Effects of Diosmin Administration on Cisplatin-Induced Premature Ovarian Failure in a Rat Model. J Contemp Med 2022; 12(6): 912-6.
71- Xing F, Wang M, Ding Z, Zhang J, Ding S, Shi L, et al. Protective Effect and Mechanism of Melatonin on Cisplatin-Induced Ovarian Damage in Mice. J Clin Med. 2022; 11(24): 7383.
72- Barberino RS, Menezes VG, Ribeiro A, Palheta RC, Jr., Jiang X, Smitz JEJ, et al. Melatonin Protects Against Cisplatin-Induced Ovarian Damage in Mice Via the MT1 Receptor and Antioxidant Activity. Biol Reprod 2017; 96(6): 1244-55.
73- Patil MR, Bihari A. A Comprehensive Study Of P53 Protein. J Cell Biochem 2022; 123(12): 1891-937.
74- Damia G, Filiberti L, Vikhanskaya F, Carrassa L, Taya Y, D'Incalci M, et al. Cisplatinum and Taxol Induce Different Patterns of P53 Phosphorylation. Neoplasia 2001; 3(1): 10-6.
75- Tuppi M, Kehrloesser S, Coutandin DW, Rossi V, Luh LM, Strubel A, et al. Oocyte DNA Damage Quality Control Requires Consecutive Interplay of CHK2 and CK1 to Activate P63. Nat Struct Mol Biol 2018; 25(3): 261-9.
76- Chang EM, Lim E, Yoon S, Jeong K, Bae S, Lee DR, et al. Cisplatin Induces Overactivation of the Dormant Primordial Follicle through PTEN/AKT/FOXO3a Pathway which Leads to Loss of Ovarian Reserve in Mice. PLoS One 2015; 10(12): e0144245.
77- Yucebilgin MS, Terek MC, Ozsaran A, Akercan F, Zekioglu O, Isik E, et al. Effect of Chemotherapy on Primordial Follicular Reserve of Rat: An Animal Model of Premature Ovarian Failure and Infertility. Aust N Z J Obstet Gynaecol 2004; 44(1): 6-9.
78- Jang H, Na Y, Hong K, Lee S, Moon S, Cho M, et al. Synergistic Effect of Melatonin And Ghrelin in Preventing Cisplatin-Induced Ovarian Damage Via Regulation of FOXO3a Phosphorylation and Binding to the P27(Kip1) Promoter in Primordial Follicles. J Pineal Res 2017; 63(3).
79- Eldani M, Luan Y, Xu PC, Bargar T, Kim SY. Continuous Treatment with Cisplatin Induces the Oocyte Death of Primordial Follicles without Activation. FASEB J 2020; 34(10):13885-99.
80- Altuner D, Gulaboglu M, Yapca OE, Cetin N. The Effect of Mirtazapine on Cisplatin-Induced Oxidative Damage and Infertility in Rat Ovaries. ScientificWorld Journal 2013; 2013: 327240.
81- Morgan S, Lopes F, Gourley C, Anderson RA, Spears N. Cisplatin and Doxorubicin Induce Distinct Mechanisms of Ovarian Follicle Loss; Imatinib Provides Selective Protection Only Against Cisplatin. PLoS One 2013; 8(7): e70117.
82- Pommier Y, Leo E, Zhang H, Marchand C. DNA Topoisomerases and their Poisoning by Anticancer and Antibacterial Drugs. Chem Biol 2010; 17(5): 421-33.
83- Kciuk M, Gielecińska A, Mujwar S, Kołat D, Kałuzińska-Kołat Ż, Celik I, et al. Doxorubicin-An Agent with Multiple Mechanisms of Anticancer Activity. Cells 2023; 12(4): 659.
84- Zhang T, He WH, Feng LL, Huang HG. Effect of Doxorubicin-Induced Ovarian Toxicity on Mouse Ovarian Granulosa Cells. Regul Toxicol Pharmacol 2017; 86:1-10.
85- Ben-Aharon I, Bar-Yosef H, Rizel S, Sulkes A, Stemmer SM, Shalgi R. Doxorubicin Induced Apoptosis in Oocytes—Mechanism and Possible Executers. Journal of Clinical Oncology 2008; 26(15_suppl):9611.
86- Xiao S, Zhang J, Liu M, Iwahata H, Rogers HB, Woodruff TK. Doxorubicin Has Dose-Dependent Toxicity on Mouse Ovarian Follicle Development, Hormone Secretion, and Oocyte Maturation. Toxicological Sciences 2017;157(2): 320-9.
87- Roti Roti EC, Leisman SK, Abbott DH, Salih SM. Acute Doxorubicin Insult in the Mouse Ovary is Cell- and Follicle-Type Dependent. PLoS One 2012; 7(8): e42293.
88- Perez GI, Knudson CM, Leykin L, Korsmeyer SJ, Tilly JL. Apoptosis-Associated Signaling Pathways are Required for Chemotherapy-Mediated Female Germ Cell Destruction. Nature Medicine 1997; 3(11): 1228-32.
89- Ben-Aharon I, Bar-Joseph H, Tzarfaty G, Kuchinsky L, Rizel S, Stemmer SM, et al. Doxorubicin-Induced Ovarian Toxicity. Reprod Biol Endocrinol 2010; 8: 20.
90- Liu G, Hale GE, Hughes CL. Galactose Metabolism and Ovarian Toxicity. Reprod Toxicol 2000; 14(5): 377-84.
91- Chon SJ, Umair Z, Yoon M-S. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol 2021; 9: 672890.
92- Bryda EC. The Mighty Mouse: The Impact of Rodents on Advances in Biomedical Research. Mo Med 2013; 110(3): 207-11.
93- Cedars MI. Evaluation of Female Fertility-AMH and Ovarian Reserve Testing. J Clin Endocrinol Metab 2022; 107(6): 1510-9.
94- Qin X, Zhao Y, Zhang T, Yin C, Qiao J, Guo W, et al. Trkb Agonist Antibody Ameliorates Fertility Deficits in Aged and Cyclophosphamide-Induced Premature Ovarian Failure Model Mice. Nature Communications 2022; 13(1): 914.
95- Liu Z, Li F, Xue J, Wang M, Lai S, Bao H, et al. Esculentoside a Rescues Granulosa Cell Apoptosis and Folliculogenesis in Mice with Premature Ovarian Failure. Aging (Albany NY) 2020; 12(17):16951-62.
96- Cao LB, Leung CK, Law PW, Lv Y, Ng CH, Liu HB, et al. Systemic Changes in a Mouse Model of VCD-Induced Premature Ovarian Failure. Life Sci 2020; 262: 118543.
97- Moolhuijsen LME, Visser JA. Anti-Müllerian Hormone and Ovarian Reserve: Update on Assessing Ovarian Function. J Clin Endocrinol Metab 2020; 105(11): 3361-73.
98- Zhang H, Luo Q, Lu X, Yin N, Zhou D, Zhang L, et al. RETRACTED ARTICLE: Effects of Hpmscs on Granulosa Cell Apoptosis and AMH Expression and their Role in the Restoration of Ovary Function in Premature Ovarian Failure Mice. Stem Cell Res Ther 2018; 9(1): 20.
99- Mauri D, Gazouli I, Zarkavelis G, Papadaki A, Mavroeidis L, Gkoura S, et al. Chemotherapy Associated Ovarian Failure. Front Endocrinol (Lausanne) 2020; 11: 572388.
100- Rodriguez-Wallberg K, Anastácio A, Vonheim E, Deen S, Malmros J, Borgström B. Fertility Preservation for Young Adults, Adolescents, and Children with Cancer. Ups J Med Sci 2020; 125(2): 112-20.
101- Zhang T, Yan D, Yang Y, Ma A, Li L, Wang Z, et al. The Comparison of Animal Models for Premature Ovarian Failure Established by Several Different Source of Inducers. Regul Toxicol Pharmacol 2016; 81: 223-32.
102- Qi Y, Zhu Y-m, Li B. Comparison of Animal Models for Premature Ovarian Insufficiency Induced by Different Doses of Cyclophosphamide: a Network Meta‑analysis. Front Endocrinol (Lausanne) 2022; 11: 572388.
1- Bildik G, Acılan C, Sahin GN, Karahuseyinoglu S, Oktem O. C-Abl is Not Actıvated in DNA Damage-Induced and Tap63-Mediated Oocyte Apoptosıs in Human Ovary. Cell Death Dis 2018; 9: 943.
2- Jang H, Hong K, Choi Y. Melatonin and Fertoprotective Adjuvants: Prevention against Premature Ovarian Failure during Chemotherapy. Int J Mol Sci 2017; 18(6): 1221.
3- Waxman J. Chemotherapy and the Adult Gonad: A Review. J R Soc Med 1983; 76(2): 144-8.
4- Coulam CB. Premature Gonadal Failure. Fertil Steril 1982; 38(6): 645-55.
5- Vujovic S, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, Moen MH, et al. EMAS Position Statement: Managing Women with Premature Ovarian Failure. Maturitas 2010; 67(1): 91-3
6- Abdelzaher WY, Abdel-Hafez SMN, Rofaeil RR, Ali A, Hegazy A, Bahaa HA. The Protective Effect of Fenofibrate, Triptorelin, and their Combination Against Premature Ovarian Failure in Rats. Naunyn Schmiedebergs Arch Pharmacol 2021; 394(1): 137-49.
7- Podfigurna-Stopa A, Czyzyk A, Grymowicz M, Smolarczyk R, Katulski K, Czajkowski K, et al. Premature Ovarian Insufficiency: The Context of Long-Term Effects. J Endocrinol Invest 2016; 39(9): 983-90.
8- Elkady MA, Shalaby S, Fathi F, El-Mandouh S. Effects of Quercetin and Rosuvastatin Each Alone or in Combination on Cyclophosphamide-Induced Premature Ovarian Failure in Female Albino Mice. Hum Exp Toxicol 2019; 38(11): 1283-95.
9- Wang XF, Zhang L, Wu QH, Min JX, Ma N, Luo LC. Biological Mechanisms of Premature Ovarian Failure Caused by Psychological Stress Based on Support Vector Regression. Int J Clin Exp Med 2015; 8(11): 21393-9.
10- Abdel-Aziz AM, Mohamed ASM, Abdelazem O, Okasha AMM, Kamel MY. Cilostazol Protects Against Cyclophosphamide-Induced Ovarian Toxicity in Female Rats: Role of Camp and HO-1. Toxicol Mech Methods 2020; 30(7): 526-35.
11- Okada K, Fujisawa M. Recovery of Spermatogenesis Following Cancer Treatment with Cytotoxic Chemotherapy and Radiotherapy. World J Mens Health 2019; 37(2): 166-74.
12- Bedoschi G, Navarro PA, Oktay K. Chemotherapy-Induced Damage to Ovary: Mechanisms and Clinical Impact. Future Oncol 2016; 12(20): 2333-44.
13- Kim S, Kim SW, Han SJ, Lee S, Park HT, Song JY, et al. Molecular Mechanism and Prevention Strategy of Chemotherapy- and Radiotherapy-Induced Ovarian Damage. Int J Mol Sci 2021; 22(14): 7484.
14- Di Giacomo M, Barchi M, Baudat F, Edelmann W, Keeney S, Jasin M. Distinct Dna-Damage-Dependent and -Independent Responses Drive the Loss of Oocytes in Recombination-Defective Mouse Mutants. Proc Natl Acad Sci USA 2005; 102(3): 737-42.
15- Perez GI, Acton BM, Jurisicova A, Perkins GA, White A, Brown J, et al. Genetic Variance Modifies Apoptosis Susceptibility in Mature Oocytes Via Alterations in DNA Repair Capacity and Mitochondrial Ultrastructure. Cell Death Differ 2007; 14(3): 524-33.
16- Dai F, Wang R, Deng Z, Yang D, Wang L, Wu M, et al. Comparison of the Different Animal Modeling and Therapy Methods of Premature Ovarian Failure in Animal Model. Stem Cell Res Ther 2023; 14(1): 135.
17- Sheikhansari G, Aghebati-Maleki L, Nouri M, Jadidi-Niaragh F, Yousefi M. Current Approaches for the Treatment of Premature Ovarian Failure with Stem Cell Therapy. Biomed Pharmacother 2018; 102: 254-62.
18- Spears N, Lopes F, Stefansdottir A, Rossi V, De Felici M, Anderson RA, et al. Ovarian Damage from Chemotherapy and Current Approaches to Its Protection. Hum Reprod Update 2019; 25(6): 673-93.
19- Akyol S, Gulec MA, Erdemli HK, Akyol O. Can Propolis and Caffeic Acid Phenethyl Ester Be Promising Agents Against Cyclophosphamide Toxicity? J Intercult Ethnopharmacol. 2016; 5(1): 105-7.
20- Fleer R, Brendel M. Toxicity, Interstrand Cross-Links and DNA Fragmentation Induced by 'Activated' Cyclophosphamide in Yeast: Comparative Studies on 4-Hydroperoxy-Cyclophosphamide, Its Monofunctional Analogon, Acrolein, Phosphoramide Mustard, and Nor-Nitrogen Mustard. Chem Biol Interact 1982; 39(1): 1-15.
21- Ogino MH, Tadi P. Cyclophosphamide. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.Available at: https://www.ncbi.nlm.nih.gov/books/NBK553087/. Accessed July 3, 2023.
22- Madden JA, Keating AF. Ovarian Xenobiotic Biotransformation Enzymes are Altered During Phosphoramide Mustard-Induced Ovotoxicity. Toxicol Sci 2014; 141(2): 441-52.
23- Ludeman SM. The Chemistry of the Metabolites of Cyclophosphamide. Curr Pharm Des 1999; 5: 627-43.
24- Jarrell JF, Bodo L, YoungLai EV, Barr RD, O'Connell GJ. The Short-Term Reproductive Toxicity of Cyclophosphamide in the Female Rat. Reprod Toxicol 1991; 5(6): 481-5.
25- Madden JA, Thomas PQ, Keating AF. Phosphoramide Mustard Induces Autophagy Markers and Mtor Inhibition Prevents Follicle Loss Due to Phosphoramide Mustard Exposure. Reprod Toxicol 2017; 67: 65-78.
26- Barberino RS, Silva RLS, Palheta Junior RC, Smitz JE, Matos MHT. Protective Effects of Antioxidants on Cyclophosphamide-Induced Ovarian Toxicity. Biopreserv Biobank 2023; 21(2): 121-41.
27- Overbeek A, van den Berg MH, van Leeuwen FE, Kaspers GJ, Lambalk CB, van Dulmen-den Broeder E. Chemotherapy-Related Late Adverse Effects on Ovarian Function in Female Survivors of Childhood and Young Adult Cancer: A Systematic Review. Cancer Treat Rev 2017; 53: 10-24
28- Piasecka-Srader J, Blanco FF, Delman DH, Dixon DA, Geiser JL, Ciereszko RE, et al. Tamoxifen Prevents Apoptosis and Follicle Loss from Cyclophosphamide in Cultured Rat Ovaries. Biol Reprod 2015; 92(5): 132.
29- Huang CC, Chou CH, Yang YS, Ho HN, Shun CT, Wen WF, et al. Metformin: A Novel Promising Option for Fertility Preservation during Cyclophosphamide-Based Chemotherapy. Biol Reprod 2015; 92(5): 132.
30- Nguyen Q-N, Zerafa N, Liew SH, Morgan FH, Strasser A, Scott CL, et al. Loss of PUMA Protects the Ovarian Reserve During DNA-Damaging Chemotherapy and Preserves Fertility. Cell Death Dis 2018; 9(6): 618.
31- Zheng S, Ma M, Chen Y, Li M. Effects of Quercetin on Ovarian Function and Regulation of the Ovarian PI3K/Akt/Foxo3A Signalling Pathway and Oxidative Stress in a Rat Model of Cyclophosphamide-Induced Premature Ovarian Failure. Basic Clin Pharmacol Toxicol 2022; 130(2): 240-53.
32- Hassanpour A, Yousefian S, Askaripour M, Sharififar F, Ezzatabadipour M. Ovarian Protection in Cyclophosphamide-Treated Mice by Fennel. Oxicol Rep 2017; 4: 160-64.
33- Liu X, Song Y, Zhou F, Zhang C, Li F, Hu R, et al. Network and Experimental Pharmacology on Mechanism of Si-Wu-Tang Improving Ovarian Function in a Mouse Model of Premature Ovarian Failure Induced By Cyclophosphamide. J Ethnopharmacol 2023; 301: 115842
34- Pascuali N, Scotti L, Di Pietro M, Oubiña G, Bas D, May M, et al. Ceramide-1-Phosphate Has Protective Properties Against Cyclophosphamide-Induced Ovarian Damage in a Mice Model of Premature Ovarian Failure. Hum Reprod 2018; 33(5): 844-59.
35- Kalich-Philosoph L, Roness H, Carmely A, Fishel-Bartal M, Ligumsky H, Paglin S, et al. Cyclophosphamide Triggers Follicle Activation and "Burnout"; AS101 Prevents Follicle Loss and Preserves Fertility. Sci Transl Med 2013; 5(185): 185ra62.
36- Li J, Long H, Cong Y, Gao H, Lyu Q, Yu S, et al. Quercetin Prevents Primordial Follicle Loss Via Suppression of PI3K/Akt/Foxo3a Pathway Activation in Cyclophosphamide-Treated Mice. Reprod Biol Endocrinol 2021; 19(1): 63.
37- Feng J, Ma WW, Li HX, Pei XY, Deng SL, Jia H, et al. Melatonin Prevents Cyclophosphamide-Induced Primordial Follicle Loss by Inhibiting Ovarian Granulosa Cell Apoptosis and Maintaining AMH Expression. Front Endocrinol (Lausanne) 2022; 13: 895095.
38- Goldman KN, Chenette D, Arju R, Duncan FE, Keefe DL, Grifo JA, et al. Mtorc1/2 Inhibition Preserves Ovarian Function and Fertility During Genotoxic Chemotherapy. Proc Natl Acad Sci USA 2017; 114(12): 3186-91.
39- Zhou L, Xie Y, Li S, Liang Y, Qiu Q, Lin H, et al. Rapamycin Prevents Cyclophosphamide-Induced Over-Activation of Primordial Follicle Pool through PI3K/Akt/Mtor Signaling Pathway in Vivo. J Ovarian Res 2017; 10(1): 56.
40- Zhang B-f, Hu Y, Liu X, Cheng Z, Lei Y, Liu Y, et al. The Role of AKT and FOXO3 in Preventing Ovarian Toxicity Induced by Cyclophosphamide. PloS one 2018; 13(8): e0201136.
41- Barberino RS, Silva RL, Palheta Junior RC, Smitz JE, Matos MH. Protective Effects of Antioxidants on Cyclophosphamide-Induced Ovarian Toxicity. Biopreservation and Biobanking 2023; 21(2): 121-41
42- Barekati Z, Golkar-Narenji A, Totonchi M, Radpour R, Gourabi H. Effects of Amifostine in Combination with Cyclophosphamide on Female Reproductive System. Reproductive Sciences 2012; 19(5): 539-46.
43- Yao Y, Xu Y, Wang Y. Protective Roles and Mechanisms of Rosmarinic Acid in Cyclophosphamide-Induced Premature Ovarian Failure. Journal of Biochemical and Molecular Toxicology 2020; 34(12): e22591.
44- Wang S, Sun M, Yu L, Wang Y, Yao Y, Wang D. Niacin Inhibits Apoptosis and Rescues Premature Ovarian Failure. Cell Physiol Biochem 2018; 50(6): 2060-70.
45- Petrillo SK, Desmeules P, Truong TQ, Devine PJ. Detection of DNA Damage in Oocytes of Small Ovarian Follicles Following Phosphoramide Mustard Exposures of Cultured Rodent Ovaries in Vitro. Toxicology and Applied Pharmacology 2011; 253(2): 94-102.
46- Mobasher MA, Hassen MT, Ebiya RA, Alturki NA, Alzamami A, Mohamed HK, et al. Ameliorative Effect of Citrus Lemon Peel Extract and Resveratrol on Premature Ovarian Failure Rat Model: Role of Inos/Caspase-3 Pathway. Molecules 2022; 28(1): 122.
47- Çağlı F, Baktır MA, Dolanbay M, Balcıoğlu E, Cumaoğlu A, Ermiş M, et al. An Evaluation of the Effects on the Ovaries of Hyperbaric Oxygen Therapy in a Rat Model of Premature Ovarian Failure Created With Cyclophosphamide. Turk J Obstet Gynecol 2023; 20(1): 46-52.
48- Jeelani R, Khan SN, Shaeib F, Kohan-Ghadr HR, Aldhaheri SR, Najafi T, et al. Cyclophosphamide and Acrolein Induced Oxidative Stress Leading to Deterioration of Metaphase II Mouse Oocyte Quality. Free Radic Biol Med 2017; 110: 11-8.
49- Melekoglu R, Ciftci O, Eraslan S, Cetin A, Basak N. Beneficial Effects of Curcumin and Capsaicin on Cyclophosphamide-Induced Premature Ovarian Failure in a Rat Model. J Ovarian Res 2018; 33: 11 .
50- Li S, Liu M, Ma H, Jin Q, Ma Y, Wang C, et al. Ameliorative Effect of Recombinant Human Lactoferrin on the Premature Ovarian Failure in Rats after Cyclophosphamide Treatments. Journal of Ovarian Research 2021; 14: 17.
51- Hamzeh M, Hosseinimehr SJ, Mohammadi HR, Yaghubi Beklar S, Dashti A, Talebpour Amiri F. Atorvastatin Attenuates the Ovarian Damage Induced by Cyclophosphamide in Rat: An Experimental Study. Int J Reprod Biomed Int J Reprod Biomed 2018; 16(5): 323-34.
52- Khedr NF. Protective Effect of Mirtazapine and Hesperidin on Cyclophosphamide-Induced Oxidative Damage and Infertility in Rat Ovaries. Exp Biol Med (Maywood) 2015; 240(12): 1682-9.
53- Yener NA, Sinanoglu O, Ilter E, Celik A, Sezgin G, Midi A, et al. Effects of Spirulina on Cyclophosphamide-Induced Ovarian Toxicity in Rats: Biochemical and Histomorphometric Evaluation of the Ovary. Biochem Res Int 2013; 2013: 764262.
54- Elsenosi Y, Aziza S, Hussein A, Mohsen, Aggag A, Elnahas K. Curcumin and/or Hesperidin Alleviates Oxidative Stress and Hormonal Alterations in a Rat Model of Cyclophosphamide-Induced Premature Ovarian Failure. Benha Veterinary Medical Journal 2020; 39: 95-100.
55- Di Emidio G, Rossi G, Bonomo I, Alonso GL, Sferra R, Vetuschi A, et al. The Natural Carotenoid Crocetin and the Synthetic Tellurium Compound AS101 Protect the Ovary against Cyclophosphamide by Modulating SIRT1 and Mitochondrial Markers. Oxid Med Cell Longev 2017; 2017: 8928604.
56- Salminen A, Kaarniranta K, Kauppinen A. Crosstalk between Oxidative Stress and SIRT: Impact on the Aging Process. Int J Mol Sci 2013; 14(2): 3834-59..
57- Zhang M, Yu X, Li D, Ma N, Wei Z, Ci X, et al. Nrf2 Signaling Pathway Mediates the Protective Effects of Daphnetin Against D-Galactose Induced-Premature Ovarian Failure. 2022; 13: 810524.
58- Ma M, Chen XY, Li B, Li XT. Melatonin Protects Premature Ovarian Insufficiency Induced by Tripterygium Glycosides: Role of SIRT1. Am J Transl Res 2017; 9(4): 1580-602.
59- Patel R, Tadi P. Busulfan. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.Available at: https://www.ncbi.nlm.nih.gov/books/NBK555986/. Aceessed March 10, 2024
60- Chen C, Li S, Hu C, Cao W, Fu Q, Li J, et al. Protective Effects of Puerarin on Premature Ovarian Failure Via Regulation of Wnt/Β-Catenin Signaling Pathway and Oxidative Stress. Reprod Sci 2021; 28(4): 982-90.
61- Jiang Y, Zhao J, Qi HJ, Li XL, Zhang SR, Song DW, et al. Accelerated Ovarian Aging in Mice by Treatment of Busulfan and Cyclophosphamide. J Zhejiang Univ Sci B 2013; 14(4): 318-24.
62- Liu M, Qiu Y, Xue Z, Wu R, Li J, Niu X, et al. Small Extracellular Vesicles Derived from Embryonic Stem Cells Restore Ovarian Function of Premature Ovarian Failure through PI3K/AKT Signaling Pathway. Stem Cell Res Ther 2020;11(1): 3.
63- Lee Eh, Han SE, Park MJ, Kim HJ, Kim HG, Kim CW, et al. Establishment of Effective Mouse Model of Premature Ovarian Failure Considering Treatment Duration of Anticancer Drugs and Natural Recovery Time. J Menopausal Med 2018; 24(3): 196-203.
64- Bahrehbar K, Rezazadeh Valojerdi M, Esfandiari F, Fathi R, Hassani SN, Baharvand H. Human Embryonic Stem Cell-Derived Mesenchymal Stem Cells Improved Premature Ovarian Failure. World J Stem Cells 2020; 12(8): 857-78.
65- Ma P, Xiao H, Yu C, Liu J, Cheng Z, Song H, et al. Enhanced Cisplatin Chemotherapy by Iron Oxide Nanocarrier-Mediated Generation of Highly Toxic Reactive Oxygen Species. Nano Lett 2017; 17(2): 928-37.
66- Wang Q, Hutt KJ. Evaluation of Mitochondria in Mouse Oocytes Following Cisplatin Exposure. J Ovarian Res 2021; 14(1): 65.
67- Kelland L. The Resurgence of Platinum-Based Cancer Chemotherapy. Nat Rev Cancer 2007; 7(8): 573-84.
68- Gonfloni S, Tella L, Caldarola S, Cannata S, Klinger F, Di Bartolomeo C, et al. Inhibition of the C-Abl-Tap63 Pathway Protects Mouse Oocytes from Chemotherapy-Induced Death. Nat Med 2009; 15(10): 1179-85.
69- Kim SY, Cordeiro MH, Serna VA, Ebbert K, Butler LM, Sinha S, et al. Rescue of Platinum-Damaged Oocytes from Programmed Cell Death through Inactivation of the P53 Family Signaling Network. Cell Death Differ 2013; 20(8): 987-97.
70- Gürsoy A, Sade AG. Effects of Diosmin Administration on Cisplatin-Induced Premature Ovarian Failure in a Rat Model. J Contemp Med 2022; 12(6): 912-6.
71- Xing F, Wang M, Ding Z, Zhang J, Ding S, Shi L, et al. Protective Effect and Mechanism of Melatonin on Cisplatin-Induced Ovarian Damage in Mice. J Clin Med. 2022; 11(24): 7383.
72- Barberino RS, Menezes VG, Ribeiro A, Palheta RC, Jr., Jiang X, Smitz JEJ, et al. Melatonin Protects Against Cisplatin-Induced Ovarian Damage in Mice Via the MT1 Receptor and Antioxidant Activity. Biol Reprod 2017; 96(6): 1244-55.
73- Patil MR, Bihari A. A Comprehensive Study Of P53 Protein. J Cell Biochem 2022; 123(12): 1891-937.
74- Damia G, Filiberti L, Vikhanskaya F, Carrassa L, Taya Y, D'Incalci M, et al. Cisplatinum and Taxol Induce Different Patterns of P53 Phosphorylation. Neoplasia 2001; 3(1): 10-6.
75- Tuppi M, Kehrloesser S, Coutandin DW, Rossi V, Luh LM, Strubel A, et al. Oocyte DNA Damage Quality Control Requires Consecutive Interplay of CHK2 and CK1 to Activate P63. Nat Struct Mol Biol 2018; 25(3): 261-9.
76- Chang EM, Lim E, Yoon S, Jeong K, Bae S, Lee DR, et al. Cisplatin Induces Overactivation of the Dormant Primordial Follicle through PTEN/AKT/FOXO3a Pathway which Leads to Loss of Ovarian Reserve in Mice. PLoS One 2015; 10(12): e0144245.
77- Yucebilgin MS, Terek MC, Ozsaran A, Akercan F, Zekioglu O, Isik E, et al. Effect of Chemotherapy on Primordial Follicular Reserve of Rat: An Animal Model of Premature Ovarian Failure and Infertility. Aust N Z J Obstet Gynaecol 2004; 44(1): 6-9.
78- Jang H, Na Y, Hong K, Lee S, Moon S, Cho M, et al. Synergistic Effect of Melatonin And Ghrelin in Preventing Cisplatin-Induced Ovarian Damage Via Regulation of FOXO3a Phosphorylation and Binding to the P27(Kip1) Promoter in Primordial Follicles. J Pineal Res 2017; 63(3).
79- Eldani M, Luan Y, Xu PC, Bargar T, Kim SY. Continuous Treatment with Cisplatin Induces the Oocyte Death of Primordial Follicles without Activation. FASEB J 2020; 34(10):13885-99.
80- Altuner D, Gulaboglu M, Yapca OE, Cetin N. The Effect of Mirtazapine on Cisplatin-Induced Oxidative Damage and Infertility in Rat Ovaries. ScientificWorld Journal 2013; 2013: 327240.
81- Morgan S, Lopes F, Gourley C, Anderson RA, Spears N. Cisplatin and Doxorubicin Induce Distinct Mechanisms of Ovarian Follicle Loss; Imatinib Provides Selective Protection Only Against Cisplatin. PLoS One 2013; 8(7): e70117.
82- Pommier Y, Leo E, Zhang H, Marchand C. DNA Topoisomerases and their Poisoning by Anticancer and Antibacterial Drugs. Chem Biol 2010; 17(5): 421-33.
83- Kciuk M, Gielecińska A, Mujwar S, Kołat D, Kałuzińska-Kołat Ż, Celik I, et al. Doxorubicin-An Agent with Multiple Mechanisms of Anticancer Activity. Cells 2023; 12(4): 659.
84- Zhang T, He WH, Feng LL, Huang HG. Effect of Doxorubicin-Induced Ovarian Toxicity on Mouse Ovarian Granulosa Cells. Regul Toxicol Pharmacol 2017; 86:1-10.
85- Ben-Aharon I, Bar-Yosef H, Rizel S, Sulkes A, Stemmer SM, Shalgi R. Doxorubicin Induced Apoptosis in Oocytes—Mechanism and Possible Executers. Journal of Clinical Oncology 2008; 26(15_suppl):9611.
86- Xiao S, Zhang J, Liu M, Iwahata H, Rogers HB, Woodruff TK. Doxorubicin Has Dose-Dependent Toxicity on Mouse Ovarian Follicle Development, Hormone Secretion, and Oocyte Maturation. Toxicological Sciences 2017;157(2): 320-9.
87- Roti Roti EC, Leisman SK, Abbott DH, Salih SM. Acute Doxorubicin Insult in the Mouse Ovary is Cell- and Follicle-Type Dependent. PLoS One 2012; 7(8): e42293.
88- Perez GI, Knudson CM, Leykin L, Korsmeyer SJ, Tilly JL. Apoptosis-Associated Signaling Pathways are Required for Chemotherapy-Mediated Female Germ Cell Destruction. Nature Medicine 1997; 3(11): 1228-32.
89- Ben-Aharon I, Bar-Joseph H, Tzarfaty G, Kuchinsky L, Rizel S, Stemmer SM, et al. Doxorubicin-Induced Ovarian Toxicity. Reprod Biol Endocrinol 2010; 8: 20.
90- Liu G, Hale GE, Hughes CL. Galactose Metabolism and Ovarian Toxicity. Reprod Toxicol 2000; 14(5): 377-84.
91- Chon SJ, Umair Z, Yoon M-S. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol 2021; 9: 672890.
92- Bryda EC. The Mighty Mouse: The Impact of Rodents on Advances in Biomedical Research. Mo Med 2013; 110(3): 207-11.
93- Cedars MI. Evaluation of Female Fertility-AMH and Ovarian Reserve Testing. J Clin Endocrinol Metab 2022; 107(6): 1510-9.
94- Qin X, Zhao Y, Zhang T, Yin C, Qiao J, Guo W, et al. Trkb Agonist Antibody Ameliorates Fertility Deficits in Aged and Cyclophosphamide-Induced Premature Ovarian Failure Model Mice. Nature Communications 2022; 13(1): 914.
95- Liu Z, Li F, Xue J, Wang M, Lai S, Bao H, et al. Esculentoside a Rescues Granulosa Cell Apoptosis and Folliculogenesis in Mice with Premature Ovarian Failure. Aging (Albany NY) 2020; 12(17):16951-62.
96- Cao LB, Leung CK, Law PW, Lv Y, Ng CH, Liu HB, et al. Systemic Changes in a Mouse Model of VCD-Induced Premature Ovarian Failure. Life Sci 2020; 262: 118543.
97- Moolhuijsen LME, Visser JA. Anti-Müllerian Hormone and Ovarian Reserve: Update on Assessing Ovarian Function. J Clin Endocrinol Metab 2020; 105(11): 3361-73.
98- Zhang H, Luo Q, Lu X, Yin N, Zhou D, Zhang L, et al. RETRACTED ARTICLE: Effects of Hpmscs on Granulosa Cell Apoptosis and AMH Expression and their Role in the Restoration of Ovary Function in Premature Ovarian Failure Mice. Stem Cell Res Ther 2018; 9(1): 20.
99- Mauri D, Gazouli I, Zarkavelis G, Papadaki A, Mavroeidis L, Gkoura S, et al. Chemotherapy Associated Ovarian Failure. Front Endocrinol (Lausanne) 2020; 11: 572388.
100- Rodriguez-Wallberg K, Anastácio A, Vonheim E, Deen S, Malmros J, Borgström B. Fertility Preservation for Young Adults, Adolescents, and Children with Cancer. Ups J Med Sci 2020; 125(2): 112-20.
101- Zhang T, Yan D, Yang Y, Ma A, Li L, Wang Z, et al. The Comparison of Animal Models for Premature Ovarian Failure Established by Several Different Source of Inducers. Regul Toxicol Pharmacol 2016; 81: 223-32.
102- Qi Y, Zhu Y-m, Li B. Comparison of Animal Models for Premature Ovarian Insufficiency Induced by Different Doses of Cyclophosphamide: a Network Meta‑analysis. Front Endocrinol (Lausanne) 2022; 11: 572388.
نوع مطالعه: مروری |
موضوع مقاله:
زیست شناسی
دریافت: 1402/10/28 | پذیرش: 1402/12/27 | انتشار: 1403/6/15
دریافت: 1402/10/28 | پذیرش: 1402/12/27 | انتشار: 1403/6/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







