دوره 32، شماره 2 - ( اردیبهشت 1403 )
جلد 32 شماره 2 صفحات 7491-7480 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mozaffari Khosravi S, Seyedabadi S, Shahcheraghi S H, Lotfi M. Potential Ability of Umbilical Cord-Derived Mesenchymal Stem Cells in The Treatment of Premature Ovarian Failure. JSSU 2024; 32 (2) :7480-7491
URL: http://jssu.ssu.ac.ir/article-1-6147-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6147-fa.html
مظفری خسروی سمیرا، سیدآبادی سامان، شاهچراغی سید حسین، لطفی مرضیه. توانایی بالقوه سلولهای بنیادی مزانشیمی مشتق از بند ناف در درمان نارسایی زودرس تخمدان. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (2) :7480-7491
متن کامل [PDF 830 kb]
(612 دریافت)
| چکیده (HTML) (1513 مشاهده)
متن کامل: (1419 مشاهده)
مقدمه
ناباروری در زنان میتواند ناشی از علل مختلفی باشد که بر عملکرد تخمدان تأثیر میگذارد. فولیکولها ساختارهای مجزایی هستند که در لایه بیرونی تخمدان ها یافت میشوند (1). فرآیندی که به عنوان فولیکولوژنز شناخته میشود به این فولیکولها اجازه میدهد تا یک تخمک یا تخمک نابالغ تولید کنند که به یک تخمک بارور بالغ می شود (2). سه نوع سلولی که فولیکولهای تخمدان را تشکیل میدهند عبارتند از گرانولوزا، تکا و اووسیت. سلولهای گرانولوزا و تکا حاوی گیرندههای هورمون محرک فولیکول (FSH) و هورمون لوتئینکننده (LH) هستند که برای رشد و نمو فولیکولها ضروری هستند (3). فولیکولوژنز فرآیندی است که با دقت هماهنگ و کنترل شده است. فولیکولهای اولیه در این مرحله به پرهآنترال و در نهایت آنترال تبدیل میشوند. این مرحله با تخمک گذاری دنبال می شود. تعداد فولیکول های اولیه در زنان در طول سالهای باروری محدود است. وقتی ذخایر زن تمام میشود، گفته میشود که فرد وارد یائسگی یا پیری باروری شده است. جنین دختر بین 6 تا 7 میلیون سلول زاینده دارد. هنگامی که یک دختر به بلوغ میرسد، بین 400000 تا 500000 فولیکول اولیه هنوز وجود دارد. پس از قاعدگی، حدود 1000 فولیکول در ماه از بین میرود. تعداد فولیکولها پس از 37 سالگی به 25000 کاهش مییابد و سرعت از دست دادن فولیکولها تا حدود 50 سالگی که تنها حدود 1000 فولیکول باقی میماند تسریع مییابد. بنابراین، تنها حدود 400 فولیکول در طول زندگی باروری یک زن بالغ تخمکگذاری میکنند (5, 4). توقف عملکرد تخمدان می تواند در نتیجه ناهنجاریهای مختلف تولید مثلی رخ دهد که بر تخمدانها تأثیر می گذارد و منجر به احساس ناراحتی، بی نظمی در چرخههای قاعدگی، عوارض ادراری، ناتوانی در باردار شدن و بارداری ناموفق میشود. در میان این اختلالات، نارسایی زودرس تخمدان (POF)، نارسایی اولیه تخمدان (POI)، سندرم تخمدان پلیکیستیک (PCOS)، سندرم آشرمن، آندومتریوز و پرهاکلامپسی شایعترین اختلالات باروری زنان هستند (6،7). POF یکی از شایعترین علل ناباروری زنان است. در سطح جهانی، 3/5 درصد از زنان را تحت تاثیر قرار میدهد که 11/2 درصد آنها بدون علت مشخص هستند (8). از ویژگیهای اصلی آن کاهش سطح استروژن، آمنوره، افزایش سطح گنادوتروپین و عدم وجود فولیکولهای بالغ میباشد (9). برخی از علل نارسایی زودرس تخمدان شامل اختلالات خودایمنی، بیماری های ژنتیکی و عوامل محیطی است. در اکثر موارد، علت POF منشأ ناشناختهای دارد (10). کاهش عملکرد تخمدان که در سنین جوانی اتفاق میافتد، میتواند منجر به بسیاری از پیامدهای عمیق برای سلامت زنان و همچنین پیامدهای روانی شود. POF طیف گستردهای از تظاهرات بالینی را نشان می دهد و میتواند منجر به پیامدهای سلامتی قابلتوجهی شود که شامل ناباروری، پوکی استخوان، گرفتگی، آمنوره، دیابت نوع دوم و اختلالات قلبی عروقی می-شود (11). با توجه به پیچیدگیهای POF چندین درمان وجود دارد اما هیچیک از آنها به اندازه کافی دلگرم کننده نبوده اند. درمانهای POF شامل درمان جایگزینی هورمونی، آندروژن، مشاوره، دهیدرواپیآندروسترون، ورزش، رژیم غذایی میباشد این درمانها تا حدودی از عوارض کاهش استروژن در بدن میکاهند ولی درمان قطعی این بیماری محسوب نمیشوند (12). در حال حاضر، سلولهای بنیادی مزانشیمی (MSCs) به منظور مدیریت بیماریهای مختلف یک روش امیدوارکننده میباشند (7). این روش یک درمان مبتنی بر سلول و منحصربهفرد میباشد زیرا این سلولها توانایی بالقوه ایی را در نوسازی و تمایز نشان میدهند. اخیرأ مطالعات گزارش کردهاند که استفاده از MSCs از منابع مختلف (مغز استخوان، بافت چربی و خون قاعدگی) عملکرد تخمدان را بهبود بخشیده است و منجر به تقویت باروری در مدل POF شده است (13). منابع ذکر شده شامل روشهای تهاجمی یا دارای مقدار کمی سلول بنیادی اصلی میباشند از آنجاییکه خون بندناف جزء ضایعات پزشکی بافت پری ناتال می¬باشد. روش بهدست آوردن HUC-MSCs غیر تهاجمی است لذا مشکل اخلاقی ندارد. مطالعات نشان داده است که هنگامیکه HUC-MSCs در کنار سلولهای استرومایی اندومتر آسیب دیده انسان کشت میشود، بهطور قابلتوجهی میزان آپوپتوز را کاهش میدهد و تکثیر ESC را افزایش میدهد (14). در یکی از مطالعات انجام شده بر روی یک مدل موش، مشخص شد که پیوند HUC-MSC رشد فولیکولی را افزایش میدهد و همچنین سطح پروژسترون و استرادیول به میزان زیادی افزایش مییابد. همچنین مشاهده شده است که سلولهای بنیادی مزانشیمی به بافتهای آسیبدیده مهاجرت کرده و با اصلاح سیستم ایمنی و ترشح فاکتورهای رشد، آنها را بازسازی میکنند. از سوی دیگر، سایتوکاینهای تولید شده توسط سلولهای بنیادی مزانشیمی از طریق مسیر پاراکرین بهطور قابلتوجهی مسئول بهبود عملکرد تخمدان در مدل موشPOF هستند (15،16).
روش بررسی
در این مطالعه با استفاده از کلیدواژههای تخمدان نارسا، ناباروری، سلول های بنیادی مزانشیمی مشتق از بند ناف در پایگاههای الکترونیکی Scopus، PubMed، Google scholar و Web of Science به جستجوی مطالعاتی در این زمینه پرداخته شد، همچنین با استفاده از کلیدواژه¬های مطالعه مورد نظر ۹۹ مقاله به دست آمد و با توجه به هدف مورد نظر و حذف مقالات تکراری ۴۸ مقاله مورد مطالعه بهدست آمد.
پاتوفیزیولوژی POF: از نظر بافتشناسی نارسایی اولیه تخمدان به دو دسته تقسیم میشود. در نوع اول، فولیکولهای تخمدان بهطور کامل تخلیه میشوند، اما در نوع دوم، ویژگیهای فولیکولی تخمدان حفظ میشود. بر اساس نظریه نلسون و همکاران، عوامل اصلی نارسایی تخمدان اولیه شامل تخلیه فولیکول و اختلال در عملکرد فولیکولی هستند. کیفیت تخمکها و ذخیره فولیکولی تحت تأثیر ژنتیک، پاراکرین، اختلالات عملکرد غدد درونریز، میتوکندری، و عوامل متابولیک قرار دارند، اما منشأ نارسایی تخمدان اولیه هنوز معلوم نیست (17). در این زمینه، اندازهگیری سطوح FSH (هورمون محرک فولیکول) در فاز اولیه فولیکولی، همچنین سطوح استرادیول، اینهیبین B (Inhibin B) ، FSH و هورمون لوتئینیزه (LH) برای تشخیص استفاده میشود. افزایش محسوس در سطح FSH نشاندهنده نارسایی تخمدان است. علاوه بر این، اندازهگیری هورمونهای دیگری نظیر هورمون تحریککننده تیروئید (TSH)، پرولاکتین (PRL) و هورمون ضد مولر (AMH) نیز انجام میشود(20-18).
دلایل ایجاد نارسایی زودرس تخمدان:
اختلالات کروموزومی: در مطالعات گزارش شده است که حدود 20 تا 30 درصد زنان مبتلا به POF هستند که نشان دهنده حساسیت ارثی POF می¬باشد و تنها چند مورد POF با هر جهش رخ می دهد از جمله سندرم ترنر، اختلال در کروموزوم X، سندرم X شکننده (ژن FMR1) و جهش ژن اتوزومال. حدود 13-26% موارد POFبا جهش ژن FMR1 حادث شده است، در نتیجه کاهش باروری یا حتی ناباروری را ممکن میسازد (20,21). نتیجه آزمایش برای زنانی که تصمیمگیری در مورد بچهدار شدن را به تعویق می¬اندازند اهمیت زیادی دارد. مردانیکه نقص FMR1 را به ارث برده اند از سندرم X شکننده رنج میبرند که دومین علت شایع ناتوانی ذهنی (عقبماندگی ذهنی) بعد از سندرم داون است. در حال حاضر، حتی گاهی اوقات توصیه میشود که آزمایش ژن برای POF قبل از شروع پیشگیری از بارداری هورمونی در نظر گرفته شود. مدافعان ادعا میکنند که اگر یک زن از خطر بالای ابتلا به POF به دلیل جهش آگاه باشد، ممکن است تصمیم بگیرد که از روشهای پیشگیری از بارداری استفاده نکند و زودتر بچهدار شود. در واقع، گاهی اوقات پیش میآید که وقتی زنی مصرف طولانیمدت داروهای ضد بارداری را قطع میکند، مشخص میشود که عملکرد تخمدان او دیگر برای باردار شدن کافی نیست (24, 23).
بیماریهای خودایمنی: ناهنجاری در تشخیص توسط سیستم ایمنی، که به عنوان خودایمنی شناخته میشود، همچنین میتواند منجر به POF شود، شواهد نشان می¬دهد که نزدیک به 30 تا 50 درصد موارد POF با اختلالات خودایمنی مرتبط بودند(25). شایعترین اختلال، اختلالات مرتبط با تیروئید مانند تیروئیدیت هاشیموتو، کمکاری تیروئید و پرکاری تیروئید می¬باشد. دومین وضعیت شایع مربوط به موارد POF، اختلالات خودایمنی آدرنال است. درصد کمتر آن نیز با سایر اختلالات مانند لوپوس اریتماتوز سیستمیک، میاستنی گراویس، ویتیلیگو، بیماری سلیاک، آرتریت روماتوئید و سندرم چند غدهای خودایمنی مرتبط است (26). شواهدی برای علت خودایمنی وجود دارند که عبارتند از وجود اوفوریت لنفوسیتی، نشان دادن اتوآنتیبادیهای تخمدانی، اختلالات خودایمنی مرتبط. اوفوریت در درجه اول با نفوذ سلولی ماکروفاژها، سلولهای کشنده طبیعی، لنفوسیتهای T، سلول-های پلاسما و لنفوسیتهای B. هدف آلودگی لنفوسیتی ممکن است MHC کلاس II روی سلولهای گرانولوزا باشد (27). آنتیبادیهای ضد تخمدان در POF نیز گزارش شده است. چندین بیماری خودایمنی میتوانند باعث POF شوند و همچنین نشان داده شده است که 20 درصد از بیماران POF از بیماریهای خودایمنی همزمان رنج میبرند، از جمله بیماریهای آدرنال، عوارض تیروئید و دیابت (28).
واکسیناسیون: مطالعاتی نشان میدهد POF به دنبال واکسیناسیون HPV نیز میتواند ایجاد شود (29،30). بیماران به دنبال واکسیناسیون HPV دچار آمنوره ثانویه شدند که با درمان با درمانهای جایگزین هورمونی برطرف نشد (29). ارزیابیهای سرولوژیکی، سطوح پایین استرادیول ((E2 و افزایش FSH و LH و آنتیبادیهای اختصاصی (ضد تخمدان و ضد تیروئید) نشان داد که واکسن HPV باعث ایجاد پاسخ خودایمنی میشود. علت در 90 درصد موارد ناشناخته است، بسیاری از مطالعات نارسایی زودرس تخمدان را به عنوان یک عارضه جانبی احتمالی واکسیناسیون گزارش کردهاند (31).
شیمیدرمانی و رادیوتراپی: اگرچه شیمیدرمانی و پرتودرمانی در جمعیت جوان منجر به افزایش بقا و ماندگاری می شود اما با افزایش سن پس از بلوغ، شیمیدرمانی و پرتودرمانی منجر به POF میشوند (32). با توجه به اینکه سلولهای فولیکولی اولیه تخمدان توانایی بازسازی ندارند تخریب این سلول ها منجر به اختلال در عملکرد تخمدان شده است که در نهایت بهصورت نارسایی زودرس تخمدان بروز میکند. از سوی دیگر، عوامل آلکیله کننده و پرتودرمانی لگن بیشترین خطر را برای عملکرد تخمدان دارند و می توانند عوارضی مانند کاهش تخمک با آسیب به DNA و اختلال در ویژگی های عملکردی و ساختاری تخمک را بهدنبال داشته باشند (33). در برخی مطالعات گزارش شده است که به منظور حل این مشکل از سرکوب موقت تخمدان با آگونیستهای هورمون آزاد کننده هورمون لوتئینیزه کننده (LHRHa) استفاده شده است (34،35).
عفونت: در مطالعاتی گزارش شده است که عفونت هایی مانند آبلهمرغان، سل، مالاریا، شیگلا و هرپس سیمپلکس در سابقه پزشکی بیماران POF مشاهده شده است و همچنین گزارش شده است که اگرچه POF با عفونت های شیگلا، وارسیلا، مالاریا و سل مرتبط است اما رابطه علت و معلولی ثابت نشده است (36،37).
آنزیمی: کمبود آنزیمهای مادرزادی مانند گالاکتوزمی میتواند دلیل POF باشد. از سوی دیگر، هر گونه نقص در آنزیمهایی مانند α -17هیدروکسیلاز، کلسترول دسمولاز و آروماتاز میتواند باعث بینظمیهای بافتشناسی و بالینی مانند اختلال در سنتز استروژن، تاخیر در شروع بلوغ، آمنوره اولیه و افزایش سطح گنادوتروپین شود. کمبود α-17 هیدروکسیلاز در بیماران میتواند باعث افزایش فشارخون و نارسایی در تشکیل استروئیدهای آدرنال و تخمدان شود و منجر به نارسایی تخمدان شود (38،39).
درمانهای رایج: استراتژیهای درمانی مختلفی به دلیل پیچیدگی بیماری POF انجام شده است. با اینحال، هیچ یک از درمانها کاملاً موفقیتآمیز نبوده است. با این وجود، پیوند سلولهای بنیادی موثرترین روش در این زمینه است (جدول 1). استفاده از روش درمان جایگزین هورمونی به دلیل افزایش خطر ابتلا به سرطان، دانشمندان را به استفاده از درمانهای دیگر مانند سلولهای بنیادی هدایت میکند. با توجه به اینکه سلولهای بنیادی ظرفیت تقسیم و تبدیل به هر بافت سلولی را دارند و همچنین دارای خاصیت خود نوسازی و خود ترمیم هستند این سلولها نقش کلیدی در درمان POF دارند (40). مطالعات اخیر بر روی مدل های حیوانی ثابت کردهاند که درمان با سلولهای بنیادی یک درمان کارآمد به منظور درمان POF میباشد زیرا میتواند ساختار و عملکرد تخمدان را بازیابی کند. سلولهای بنیادی مزانشیمی مشتق از بند ناف میتوانند به مناطقی از بافت آسیب دیده یا التهاب مهاجرت کرده و به سه لایه جدا از هم تبدیل شوند و به بهبود بافت کمک کنند (41). این سلول ها سه اثر قابلتوجه نشان میدهند که شامل ترمیم بافت، تعدیل پاسخ ایمنی و اثرات ضد سرطان می باشد. تخمدانهای آسیب دیده در شیمیدرمانی توسط پیوند HUCMSC بازیابی میشوند. بهبود عملکرد تخمدان در مدل موش POF عمدتاً به دلیل سایتوکاینهای تولید شده توسط HUCMSCs از طریق مکانیسم پاراکرین به جای تمایز مستقیم به سلولهای زایا است (42). سلولهای کشنده رحم طبیعی (uNK) نقش مهمی در حفظ تعادل سایتوکاین Th1/Th2 در پاسخ ایمنی موضعی آندومتر دارند. سلولهای uNK گروهی از سلولهای خاص در استرومای اندومتر هستند که در آن بیشتر فنوتیپهای سلولی uNK بهصورت CD56 + CD16- رنگآمیزی میشوند. سلولهای uNK در مرحله ترشحی و اوایل بارداری به سرعت تکثیر می-شوند (43،44). اگر سلولهای uNK توسط عوامل پاتولوژیک خاصی فعال شوند، سلولها عوامل سیتوتوکسیک ترشح میکنند تا منجر به عدم تعادل سایتوکاینهای Th1/Th2 شود. در نتیجه، این امر باعث کاهش اثر سایتوکاینای Th1 بر پذیرش آندومتر و نارسایی لانهگزینی جنین میشود. مطالعات نشان دادهاند که تنظیم ایمنی در تعادل سایتوکاین Th1/Th2 و بیان سلولهای uNK در بهبود عملکرد تخمدان و بهبود پذیرش آندومتر پس از پیوند HUCMSC در موشهای POF نقش دارد (45). در شکل (1)، توضیح پیشنهادی از مکانیسم سلولهای بنیادی گزارش شده است.
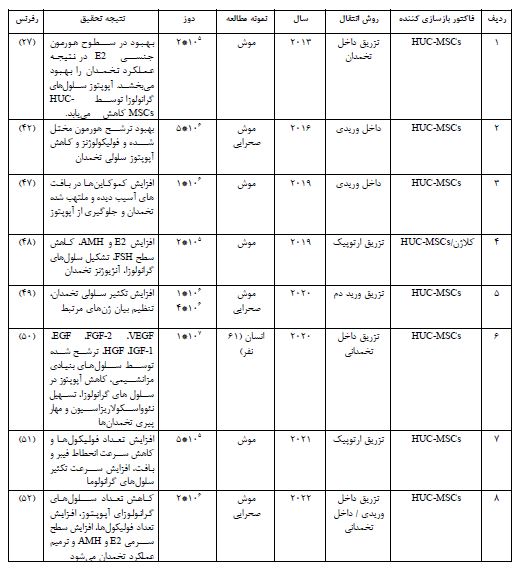
جدول 1: استراتژیهای درمان (14)

جدول 2: دادههای حاصل از اثربخشی استفاده از HUC-MSCs به منظور درمان POF
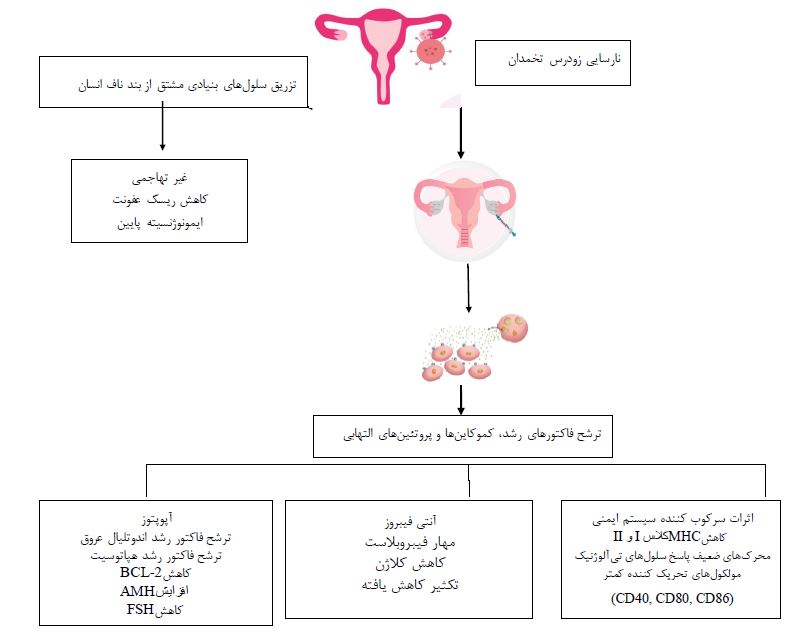
شکل 1: مکانیسمهای پیشنهادی درمان آسیب تخمدان با استفاده از سلولهای بنیادی (46)
نتیجهگیری
در افراد مواجه با چالشهای ناشی از نارسایی زودرس تخمدان اثرات قابلتوجهی بر سلامت روحی و جسمی وجود دارد. استفاده از درمانهای هورمونی، معمولاً برای کاهش علائم کمبود استروژن در زنان مبتلا به POF انجام میشود، اما موفقیت چشمگیری ندارد. بنابراین، نیاز به گزینههای درمانی بهتر برای حل این مشکل وجود دارد و تحقیقات زیادی انجام شده است تا راهحلهای موثرتری برای درمان POF پیدا شود. در نتیجه تحقیقات متعدد در زمینه استفاده از سلولهای بنیادی مزانشیمی مشتق از بند ناف در درمان نارسایی زودرس تخمک، به نظر میرسد که این سلولها میتوانند نقش مهمی در بهبود و بازسازی عملکرد تخمدان ایفا کنند. از جمله نتایج مهم این تحقیقات میتوان به افزایش تعداد و عملکرد فولیکولها، بهبود فرآیند تکثیر، و تنظیم منظم هورمونها اشاره کرد. این سلولها بهنظر میآید قادر به بازگرداندن عملکرد تخمدان پس از آسیبهای ناشی از موارد مختلف، از جمله شیمیدرمانی، هستند. در کل، به نظر میرسد که سلولهای بنیادی مزانشیمی مشتق از بند ناف توانایی بالقوهای برای بهبود و ترمیم تخمدانها در مواجهه با نارسایی زودرس تخمک دارند. این نتایج نشان میدهند که استفاده از این سلولها ممکن است یک رویکرد موثر و نوین در درمان این نقصان تولید تخمک باشد و موجب بهبود عملکرد تخمدان و افزایش فرصتهای باروری در افراد مبتلا به نارسایی زودرس تخمک گردد.
سپاسگزاری
در پایان، از حوزه معاونت محترم پژوهشی و فناوری دانشگاه علوم پزشکی شهید صدوقی یزد نهایت تشکر را داریم. امیدواریم که نتایج این تحقیق نه تنها به توسعه دانش در زمینه درمان نارسایی زودرس تخمدان کمک کنند بلکه در طیف وسیعی از حوزههای پزشکی اثرگذار باشند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق دانشکده پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد با کد IR.SSU.MEDICINE.REC.1402.346 به تصویب رسیده است.
مشارکت نویسندگان
مرضیه لطفی در ارائه ایده، سید حسین شاهچراغی در طراحی مطالعه، سمیرا مظفری خسروی در جمعآوری دادهها، سامان سیدآبادی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
ناباروری در زنان میتواند ناشی از علل مختلفی باشد که بر عملکرد تخمدان تأثیر میگذارد. فولیکولها ساختارهای مجزایی هستند که در لایه بیرونی تخمدان ها یافت میشوند (1). فرآیندی که به عنوان فولیکولوژنز شناخته میشود به این فولیکولها اجازه میدهد تا یک تخمک یا تخمک نابالغ تولید کنند که به یک تخمک بارور بالغ می شود (2). سه نوع سلولی که فولیکولهای تخمدان را تشکیل میدهند عبارتند از گرانولوزا، تکا و اووسیت. سلولهای گرانولوزا و تکا حاوی گیرندههای هورمون محرک فولیکول (FSH) و هورمون لوتئینکننده (LH) هستند که برای رشد و نمو فولیکولها ضروری هستند (3). فولیکولوژنز فرآیندی است که با دقت هماهنگ و کنترل شده است. فولیکولهای اولیه در این مرحله به پرهآنترال و در نهایت آنترال تبدیل میشوند. این مرحله با تخمک گذاری دنبال می شود. تعداد فولیکول های اولیه در زنان در طول سالهای باروری محدود است. وقتی ذخایر زن تمام میشود، گفته میشود که فرد وارد یائسگی یا پیری باروری شده است. جنین دختر بین 6 تا 7 میلیون سلول زاینده دارد. هنگامی که یک دختر به بلوغ میرسد، بین 400000 تا 500000 فولیکول اولیه هنوز وجود دارد. پس از قاعدگی، حدود 1000 فولیکول در ماه از بین میرود. تعداد فولیکولها پس از 37 سالگی به 25000 کاهش مییابد و سرعت از دست دادن فولیکولها تا حدود 50 سالگی که تنها حدود 1000 فولیکول باقی میماند تسریع مییابد. بنابراین، تنها حدود 400 فولیکول در طول زندگی باروری یک زن بالغ تخمکگذاری میکنند (5, 4). توقف عملکرد تخمدان می تواند در نتیجه ناهنجاریهای مختلف تولید مثلی رخ دهد که بر تخمدانها تأثیر می گذارد و منجر به احساس ناراحتی، بی نظمی در چرخههای قاعدگی، عوارض ادراری، ناتوانی در باردار شدن و بارداری ناموفق میشود. در میان این اختلالات، نارسایی زودرس تخمدان (POF)، نارسایی اولیه تخمدان (POI)، سندرم تخمدان پلیکیستیک (PCOS)، سندرم آشرمن، آندومتریوز و پرهاکلامپسی شایعترین اختلالات باروری زنان هستند (6،7). POF یکی از شایعترین علل ناباروری زنان است. در سطح جهانی، 3/5 درصد از زنان را تحت تاثیر قرار میدهد که 11/2 درصد آنها بدون علت مشخص هستند (8). از ویژگیهای اصلی آن کاهش سطح استروژن، آمنوره، افزایش سطح گنادوتروپین و عدم وجود فولیکولهای بالغ میباشد (9). برخی از علل نارسایی زودرس تخمدان شامل اختلالات خودایمنی، بیماری های ژنتیکی و عوامل محیطی است. در اکثر موارد، علت POF منشأ ناشناختهای دارد (10). کاهش عملکرد تخمدان که در سنین جوانی اتفاق میافتد، میتواند منجر به بسیاری از پیامدهای عمیق برای سلامت زنان و همچنین پیامدهای روانی شود. POF طیف گستردهای از تظاهرات بالینی را نشان می دهد و میتواند منجر به پیامدهای سلامتی قابلتوجهی شود که شامل ناباروری، پوکی استخوان، گرفتگی، آمنوره، دیابت نوع دوم و اختلالات قلبی عروقی می-شود (11). با توجه به پیچیدگیهای POF چندین درمان وجود دارد اما هیچیک از آنها به اندازه کافی دلگرم کننده نبوده اند. درمانهای POF شامل درمان جایگزینی هورمونی، آندروژن، مشاوره، دهیدرواپیآندروسترون، ورزش، رژیم غذایی میباشد این درمانها تا حدودی از عوارض کاهش استروژن در بدن میکاهند ولی درمان قطعی این بیماری محسوب نمیشوند (12). در حال حاضر، سلولهای بنیادی مزانشیمی (MSCs) به منظور مدیریت بیماریهای مختلف یک روش امیدوارکننده میباشند (7). این روش یک درمان مبتنی بر سلول و منحصربهفرد میباشد زیرا این سلولها توانایی بالقوه ایی را در نوسازی و تمایز نشان میدهند. اخیرأ مطالعات گزارش کردهاند که استفاده از MSCs از منابع مختلف (مغز استخوان، بافت چربی و خون قاعدگی) عملکرد تخمدان را بهبود بخشیده است و منجر به تقویت باروری در مدل POF شده است (13). منابع ذکر شده شامل روشهای تهاجمی یا دارای مقدار کمی سلول بنیادی اصلی میباشند از آنجاییکه خون بندناف جزء ضایعات پزشکی بافت پری ناتال می¬باشد. روش بهدست آوردن HUC-MSCs غیر تهاجمی است لذا مشکل اخلاقی ندارد. مطالعات نشان داده است که هنگامیکه HUC-MSCs در کنار سلولهای استرومایی اندومتر آسیب دیده انسان کشت میشود، بهطور قابلتوجهی میزان آپوپتوز را کاهش میدهد و تکثیر ESC را افزایش میدهد (14). در یکی از مطالعات انجام شده بر روی یک مدل موش، مشخص شد که پیوند HUC-MSC رشد فولیکولی را افزایش میدهد و همچنین سطح پروژسترون و استرادیول به میزان زیادی افزایش مییابد. همچنین مشاهده شده است که سلولهای بنیادی مزانشیمی به بافتهای آسیبدیده مهاجرت کرده و با اصلاح سیستم ایمنی و ترشح فاکتورهای رشد، آنها را بازسازی میکنند. از سوی دیگر، سایتوکاینهای تولید شده توسط سلولهای بنیادی مزانشیمی از طریق مسیر پاراکرین بهطور قابلتوجهی مسئول بهبود عملکرد تخمدان در مدل موشPOF هستند (15،16).
روش بررسی
در این مطالعه با استفاده از کلیدواژههای تخمدان نارسا، ناباروری، سلول های بنیادی مزانشیمی مشتق از بند ناف در پایگاههای الکترونیکی Scopus، PubMed، Google scholar و Web of Science به جستجوی مطالعاتی در این زمینه پرداخته شد، همچنین با استفاده از کلیدواژه¬های مطالعه مورد نظر ۹۹ مقاله به دست آمد و با توجه به هدف مورد نظر و حذف مقالات تکراری ۴۸ مقاله مورد مطالعه بهدست آمد.
پاتوفیزیولوژی POF: از نظر بافتشناسی نارسایی اولیه تخمدان به دو دسته تقسیم میشود. در نوع اول، فولیکولهای تخمدان بهطور کامل تخلیه میشوند، اما در نوع دوم، ویژگیهای فولیکولی تخمدان حفظ میشود. بر اساس نظریه نلسون و همکاران، عوامل اصلی نارسایی تخمدان اولیه شامل تخلیه فولیکول و اختلال در عملکرد فولیکولی هستند. کیفیت تخمکها و ذخیره فولیکولی تحت تأثیر ژنتیک، پاراکرین، اختلالات عملکرد غدد درونریز، میتوکندری، و عوامل متابولیک قرار دارند، اما منشأ نارسایی تخمدان اولیه هنوز معلوم نیست (17). در این زمینه، اندازهگیری سطوح FSH (هورمون محرک فولیکول) در فاز اولیه فولیکولی، همچنین سطوح استرادیول، اینهیبین B (Inhibin B) ، FSH و هورمون لوتئینیزه (LH) برای تشخیص استفاده میشود. افزایش محسوس در سطح FSH نشاندهنده نارسایی تخمدان است. علاوه بر این، اندازهگیری هورمونهای دیگری نظیر هورمون تحریککننده تیروئید (TSH)، پرولاکتین (PRL) و هورمون ضد مولر (AMH) نیز انجام میشود(20-18).
دلایل ایجاد نارسایی زودرس تخمدان:
اختلالات کروموزومی: در مطالعات گزارش شده است که حدود 20 تا 30 درصد زنان مبتلا به POF هستند که نشان دهنده حساسیت ارثی POF می¬باشد و تنها چند مورد POF با هر جهش رخ می دهد از جمله سندرم ترنر، اختلال در کروموزوم X، سندرم X شکننده (ژن FMR1) و جهش ژن اتوزومال. حدود 13-26% موارد POFبا جهش ژن FMR1 حادث شده است، در نتیجه کاهش باروری یا حتی ناباروری را ممکن میسازد (20,21). نتیجه آزمایش برای زنانی که تصمیمگیری در مورد بچهدار شدن را به تعویق می¬اندازند اهمیت زیادی دارد. مردانیکه نقص FMR1 را به ارث برده اند از سندرم X شکننده رنج میبرند که دومین علت شایع ناتوانی ذهنی (عقبماندگی ذهنی) بعد از سندرم داون است. در حال حاضر، حتی گاهی اوقات توصیه میشود که آزمایش ژن برای POF قبل از شروع پیشگیری از بارداری هورمونی در نظر گرفته شود. مدافعان ادعا میکنند که اگر یک زن از خطر بالای ابتلا به POF به دلیل جهش آگاه باشد، ممکن است تصمیم بگیرد که از روشهای پیشگیری از بارداری استفاده نکند و زودتر بچهدار شود. در واقع، گاهی اوقات پیش میآید که وقتی زنی مصرف طولانیمدت داروهای ضد بارداری را قطع میکند، مشخص میشود که عملکرد تخمدان او دیگر برای باردار شدن کافی نیست (24, 23).
بیماریهای خودایمنی: ناهنجاری در تشخیص توسط سیستم ایمنی، که به عنوان خودایمنی شناخته میشود، همچنین میتواند منجر به POF شود، شواهد نشان می¬دهد که نزدیک به 30 تا 50 درصد موارد POF با اختلالات خودایمنی مرتبط بودند(25). شایعترین اختلال، اختلالات مرتبط با تیروئید مانند تیروئیدیت هاشیموتو، کمکاری تیروئید و پرکاری تیروئید می¬باشد. دومین وضعیت شایع مربوط به موارد POF، اختلالات خودایمنی آدرنال است. درصد کمتر آن نیز با سایر اختلالات مانند لوپوس اریتماتوز سیستمیک، میاستنی گراویس، ویتیلیگو، بیماری سلیاک، آرتریت روماتوئید و سندرم چند غدهای خودایمنی مرتبط است (26). شواهدی برای علت خودایمنی وجود دارند که عبارتند از وجود اوفوریت لنفوسیتی، نشان دادن اتوآنتیبادیهای تخمدانی، اختلالات خودایمنی مرتبط. اوفوریت در درجه اول با نفوذ سلولی ماکروفاژها، سلولهای کشنده طبیعی، لنفوسیتهای T، سلول-های پلاسما و لنفوسیتهای B. هدف آلودگی لنفوسیتی ممکن است MHC کلاس II روی سلولهای گرانولوزا باشد (27). آنتیبادیهای ضد تخمدان در POF نیز گزارش شده است. چندین بیماری خودایمنی میتوانند باعث POF شوند و همچنین نشان داده شده است که 20 درصد از بیماران POF از بیماریهای خودایمنی همزمان رنج میبرند، از جمله بیماریهای آدرنال، عوارض تیروئید و دیابت (28).
واکسیناسیون: مطالعاتی نشان میدهد POF به دنبال واکسیناسیون HPV نیز میتواند ایجاد شود (29،30). بیماران به دنبال واکسیناسیون HPV دچار آمنوره ثانویه شدند که با درمان با درمانهای جایگزین هورمونی برطرف نشد (29). ارزیابیهای سرولوژیکی، سطوح پایین استرادیول ((E2 و افزایش FSH و LH و آنتیبادیهای اختصاصی (ضد تخمدان و ضد تیروئید) نشان داد که واکسن HPV باعث ایجاد پاسخ خودایمنی میشود. علت در 90 درصد موارد ناشناخته است، بسیاری از مطالعات نارسایی زودرس تخمدان را به عنوان یک عارضه جانبی احتمالی واکسیناسیون گزارش کردهاند (31).
شیمیدرمانی و رادیوتراپی: اگرچه شیمیدرمانی و پرتودرمانی در جمعیت جوان منجر به افزایش بقا و ماندگاری می شود اما با افزایش سن پس از بلوغ، شیمیدرمانی و پرتودرمانی منجر به POF میشوند (32). با توجه به اینکه سلولهای فولیکولی اولیه تخمدان توانایی بازسازی ندارند تخریب این سلول ها منجر به اختلال در عملکرد تخمدان شده است که در نهایت بهصورت نارسایی زودرس تخمدان بروز میکند. از سوی دیگر، عوامل آلکیله کننده و پرتودرمانی لگن بیشترین خطر را برای عملکرد تخمدان دارند و می توانند عوارضی مانند کاهش تخمک با آسیب به DNA و اختلال در ویژگی های عملکردی و ساختاری تخمک را بهدنبال داشته باشند (33). در برخی مطالعات گزارش شده است که به منظور حل این مشکل از سرکوب موقت تخمدان با آگونیستهای هورمون آزاد کننده هورمون لوتئینیزه کننده (LHRHa) استفاده شده است (34،35).
عفونت: در مطالعاتی گزارش شده است که عفونت هایی مانند آبلهمرغان، سل، مالاریا، شیگلا و هرپس سیمپلکس در سابقه پزشکی بیماران POF مشاهده شده است و همچنین گزارش شده است که اگرچه POF با عفونت های شیگلا، وارسیلا، مالاریا و سل مرتبط است اما رابطه علت و معلولی ثابت نشده است (36،37).
آنزیمی: کمبود آنزیمهای مادرزادی مانند گالاکتوزمی میتواند دلیل POF باشد. از سوی دیگر، هر گونه نقص در آنزیمهایی مانند α -17هیدروکسیلاز، کلسترول دسمولاز و آروماتاز میتواند باعث بینظمیهای بافتشناسی و بالینی مانند اختلال در سنتز استروژن، تاخیر در شروع بلوغ، آمنوره اولیه و افزایش سطح گنادوتروپین شود. کمبود α-17 هیدروکسیلاز در بیماران میتواند باعث افزایش فشارخون و نارسایی در تشکیل استروئیدهای آدرنال و تخمدان شود و منجر به نارسایی تخمدان شود (38،39).
درمانهای رایج: استراتژیهای درمانی مختلفی به دلیل پیچیدگی بیماری POF انجام شده است. با اینحال، هیچ یک از درمانها کاملاً موفقیتآمیز نبوده است. با این وجود، پیوند سلولهای بنیادی موثرترین روش در این زمینه است (جدول 1). استفاده از روش درمان جایگزین هورمونی به دلیل افزایش خطر ابتلا به سرطان، دانشمندان را به استفاده از درمانهای دیگر مانند سلولهای بنیادی هدایت میکند. با توجه به اینکه سلولهای بنیادی ظرفیت تقسیم و تبدیل به هر بافت سلولی را دارند و همچنین دارای خاصیت خود نوسازی و خود ترمیم هستند این سلولها نقش کلیدی در درمان POF دارند (40). مطالعات اخیر بر روی مدل های حیوانی ثابت کردهاند که درمان با سلولهای بنیادی یک درمان کارآمد به منظور درمان POF میباشد زیرا میتواند ساختار و عملکرد تخمدان را بازیابی کند. سلولهای بنیادی مزانشیمی مشتق از بند ناف میتوانند به مناطقی از بافت آسیب دیده یا التهاب مهاجرت کرده و به سه لایه جدا از هم تبدیل شوند و به بهبود بافت کمک کنند (41). این سلول ها سه اثر قابلتوجه نشان میدهند که شامل ترمیم بافت، تعدیل پاسخ ایمنی و اثرات ضد سرطان می باشد. تخمدانهای آسیب دیده در شیمیدرمانی توسط پیوند HUCMSC بازیابی میشوند. بهبود عملکرد تخمدان در مدل موش POF عمدتاً به دلیل سایتوکاینهای تولید شده توسط HUCMSCs از طریق مکانیسم پاراکرین به جای تمایز مستقیم به سلولهای زایا است (42). سلولهای کشنده رحم طبیعی (uNK) نقش مهمی در حفظ تعادل سایتوکاین Th1/Th2 در پاسخ ایمنی موضعی آندومتر دارند. سلولهای uNK گروهی از سلولهای خاص در استرومای اندومتر هستند که در آن بیشتر فنوتیپهای سلولی uNK بهصورت CD56 + CD16- رنگآمیزی میشوند. سلولهای uNK در مرحله ترشحی و اوایل بارداری به سرعت تکثیر می-شوند (43،44). اگر سلولهای uNK توسط عوامل پاتولوژیک خاصی فعال شوند، سلولها عوامل سیتوتوکسیک ترشح میکنند تا منجر به عدم تعادل سایتوکاینهای Th1/Th2 شود. در نتیجه، این امر باعث کاهش اثر سایتوکاینای Th1 بر پذیرش آندومتر و نارسایی لانهگزینی جنین میشود. مطالعات نشان دادهاند که تنظیم ایمنی در تعادل سایتوکاین Th1/Th2 و بیان سلولهای uNK در بهبود عملکرد تخمدان و بهبود پذیرش آندومتر پس از پیوند HUCMSC در موشهای POF نقش دارد (45). در شکل (1)، توضیح پیشنهادی از مکانیسم سلولهای بنیادی گزارش شده است.
جدول 1: استراتژیهای درمان (14)

جدول 2: دادههای حاصل از اثربخشی استفاده از HUC-MSCs به منظور درمان POF


شکل 1: مکانیسمهای پیشنهادی درمان آسیب تخمدان با استفاده از سلولهای بنیادی (46)
نتیجهگیری
در افراد مواجه با چالشهای ناشی از نارسایی زودرس تخمدان اثرات قابلتوجهی بر سلامت روحی و جسمی وجود دارد. استفاده از درمانهای هورمونی، معمولاً برای کاهش علائم کمبود استروژن در زنان مبتلا به POF انجام میشود، اما موفقیت چشمگیری ندارد. بنابراین، نیاز به گزینههای درمانی بهتر برای حل این مشکل وجود دارد و تحقیقات زیادی انجام شده است تا راهحلهای موثرتری برای درمان POF پیدا شود. در نتیجه تحقیقات متعدد در زمینه استفاده از سلولهای بنیادی مزانشیمی مشتق از بند ناف در درمان نارسایی زودرس تخمک، به نظر میرسد که این سلولها میتوانند نقش مهمی در بهبود و بازسازی عملکرد تخمدان ایفا کنند. از جمله نتایج مهم این تحقیقات میتوان به افزایش تعداد و عملکرد فولیکولها، بهبود فرآیند تکثیر، و تنظیم منظم هورمونها اشاره کرد. این سلولها بهنظر میآید قادر به بازگرداندن عملکرد تخمدان پس از آسیبهای ناشی از موارد مختلف، از جمله شیمیدرمانی، هستند. در کل، به نظر میرسد که سلولهای بنیادی مزانشیمی مشتق از بند ناف توانایی بالقوهای برای بهبود و ترمیم تخمدانها در مواجهه با نارسایی زودرس تخمک دارند. این نتایج نشان میدهند که استفاده از این سلولها ممکن است یک رویکرد موثر و نوین در درمان این نقصان تولید تخمک باشد و موجب بهبود عملکرد تخمدان و افزایش فرصتهای باروری در افراد مبتلا به نارسایی زودرس تخمک گردد.
سپاسگزاری
در پایان، از حوزه معاونت محترم پژوهشی و فناوری دانشگاه علوم پزشکی شهید صدوقی یزد نهایت تشکر را داریم. امیدواریم که نتایج این تحقیق نه تنها به توسعه دانش در زمینه درمان نارسایی زودرس تخمدان کمک کنند بلکه در طیف وسیعی از حوزههای پزشکی اثرگذار باشند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق دانشکده پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد با کد IR.SSU.MEDICINE.REC.1402.346 به تصویب رسیده است.
مشارکت نویسندگان
مرضیه لطفی در ارائه ایده، سید حسین شاهچراغی در طراحی مطالعه، سمیرا مظفری خسروی در جمعآوری دادهها، سامان سیدآبادی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Okonofua FE, Ntoimo LFC, Omonkhua A, Ayodeji O, Olafusi C, Unuabonah E, et al. Causes and Risk Factors for Male Infertility: A Scoping Review of Published Studies. Int J Gen Med 2022;15: 5985-97.
2- Seneda MM, Zangirolamo AF, González SM, Morotti F. Oogenesis and Folliculogenesis.In Yata, V.K., Mohanty, A.K., Lichtfouse, E. (eds) Sustainable Agriculture Reviews 59. Sustainable Agriculture Reviews: , vol 59. Springer, Cham; 2023: 59-88.
3- Li L, Shi X, Shi Y, Wang Z. The Signaling Pathways Involved in Ovarian Follicle Development. Front Physiol 2021; 12: 730196.
4- Drummond AE. The Role of Steroids in Follicular Growth. Reprod biol endocrinol 2006; 4: 16.
5- Sun YC, Sun XF, Dyce PW, Shen W, Chen H. The Role of Germ Cell Loss during Primordial Follicle Assembly: A Review of Current Advances. Int J Biol Sci 2017; 13(4): 449-57.
6- Zhao YX, Chen SR, Su PP, Huang FH, Shi YC, Shi QY, et al. Using Mesenchymal Stem Cells to Treat Female Infertility: An Update on Female Reproductive Diseases. Stem cells int 2019; 2019: 9071720.
7- Sheikhansari G, Aghebati-Maleki L, Nouri M, Jadidi-Niaragh F, Yousefi M. Current Approaches for the Treatment of Premature Ovarian Failure with Stem Cell Therapy. Biomedicine & pharmacotherapy 2018; 102: 254-62.
8- Li M, Zhu Y, Wei J, Chen L, Chen S, Lai D. The Global Prevalence of Premature Ovarian Insufficiency: A Systematic Review and Meta-Analysis. Climacteric 2023; 26(2): 95-102.
9- Jankowska K. Premature Ovarian Failure. Prz Menopauzalny 2017; 16(2): 51-6.
10- Ebrahimi M, Akbari Asbagh F. The Role of Autoimmunity in Premature Ovarian Failure. Iran J Reprod Med 2015; 13(8): 461-72.
11- Akbaba E, Akbaba G. Primary Ovarian Failure. Medical Bulletin of Haseki/Haseki Tip Bulteni. 2015; 53(1).
12- Shelling AN. Premature Ovarian Failure. Reproduction 2010; 140(5): 633-41.
13- Wang MY, Wang YX, Li-Ling J, Xie HQ. Adult Stem Cell Therapy for Premature Ovarian Failure: from Bench to Bedside. Tissue Eng Part B Rev 2022; 28(1): 63-78.
14- Shareghi-Oskoue O, Aghebati-Maleki L, Yousefi M. Transplantation of Human Umbilical Cord Mesenchymal Stem Cells to Treat Premature Ovarian Failure. Stem Cell Res Ther 2021; 12(1): 454.
15- Li J, Mao Q, He J, She H, Zhang Z, Yin C. Human Umbilical Cord Mesenchymal Stem Cells Improve the Reserve Function of Perimenopausal Ovary via a Paracrine Mechanism. Stem Cell Res Ther 2017; 8(1): 55.
16- Liu R, Zhang X, Fan Z, Wang Y, Yao G, Wan X, et al. Human Amniotic Mesenchymal Stem Cells Improve the Follicular Microenvironment to Recover Ovarian Function in Premature Ovarian Failure Mice. Stem Cell Res Ther 2019; 10(1): 299.
17- Kawamura K, Kawamura N, Hsueh AJ. Activation of Dormant Follicles: A New Treatment for Premature Ovarian Failure? Curr opin obstet gynecol 2016; 28(3): 217-22.
18- Nelson LM. Primary ovarian insufficiency. New Engl J Med 2009; 360(6): 606-14.
19- Şükür YE, Kıvançlı İB, Özmen B. Ovarian Aging and Premature Ovarian Failure. J Turk Ger Gynecol Assoc 2014; 15(3): 190-6.
20- Goswami D, Conway GS. Premature Ovarian Failure. Human reproduction update 2005; 11(4): 391-410.
21- Vijayalakshmi S, Aggarwal S. Genetics of premature ovarian failure. Genetic Clinics. 2018;11(2):10-17
22- Qin, Y., Simpson, J. L., Chen, Z.-J. Genetics of premature ovarian failure: new developments in etiology In: Genetics of human infertility. 2017, Karger Publishers, pp. 17–39.
23- Nippita TA, Baber RJ. Premature Ovarian Failure: A Review. Climacteric 2007;10(1):11-22.
24- Halder A. New Insights into the Mechanism of Pathogenesis of Fragile X-Associated Premature Ovarian Failure. EC Gynaecology 2022; 11: 38-43.
25- Verma P, K Sharma A, Shankar H, Sharma A, Rao D. Role of Trace Elements, Oxidative Stress and Immune System: A Triad in Premature Ovarian Failure. Biol Trace Elem Res 2018; 184(2): 325-33.
26- Novosad JA, Kalantaridou SN, Tong ZB, Nelson LM. Ovarian Antibodies as Detected by Indirect Immunofluorescence are Unreliable in The Diagnosis of Autoimmune Premature Ovarian Failure: A Controlled Evaluation. BMC Women's Health 2003; 3(1): 2.
27- Yan M, Sun M, Zhou Y, Wang W, He Z, Tang D, et al. Conversion of Human Umbilical Cord Mesenchymal Stem Cells in Wharton’s Jelly to Dopamine Neurons Mediated by the Lmx1a and Neurturin in Vitro: Potential Therapeutic Application for Parkinson’s Disease in a Rhesus Monkey Model. PloS One 2013; 8(5): e64000.
28- Grossmann B, Saur S, Rall K, Pecher AC, Hübner S, Henes J, et al. Prevalence of Autoimmune Disease in Women with Premature Ovarian Failure. Eur J Contracept Reprod Health Care 2020;25(1):72-5.
29- Colafrancesco S, Perricone C, Tomljenovic L, Shoenfeld Y. Human Papilloma Virus Vaccine and Primary Ovarian Failure: Another Facet of the Autoimmune/Inflammatory Syndrome Induced by Adjuvants. Am J Reprod Immunol 2013; 70(4): 309-16.
30- Tatang C, Arredondo Bisonó T, Bergamasco A, Salvo F, Costa Clemens SA, Moride Y. Human Papillomavirus Vaccination and Premature Ovarian Failure: A Disproportionality Analysis Using the Vaccine Adverse Event Reporting System. Drugs Real World Outcomes 2022: 9(1): 79-90.
31- Yan Y, Xu W, Qian H, Si Y, Zhu W, Cao H, et al. Mesenchymal Stem Cells from Human Umbilical Cords Ameliorate Mouse Hepatic Injury in Vivo. Liver Int 2009; 29(3): 356-65.
32- Lie Fong S, P J Lugtenburg, Schipper I, A P N Themmen, F H de Jong, Sonneveld P, et al. Anti-Müllerian Hormone as a Marker of Ovarian Function in Women after Chemotherapy and Radiotherapy for Haematological Malignancies. Human Reproduction. 2008;23(3):674-8.
33- Chemaitilly W, Mertens AC, Mitby P, Whitton J, Stovall M, Yasui Y, et al. Acute Ovarian Failure in the Childhood Cancer Survivor Study. J Cli Endocrinol Metab 2006; 91(5): 1723-8.
34- Wallace WH, Thomson AB, Saran F, Kelsey TW. Predicting Age of Ovarian Failure after Radiation to a Field That Includes the Ovaries. Int J Radiat Oncol Biol Phys 2005; 62(3): 738-44.
35- Yuan Y, Zhang C, Lei X, Ren T, Chen H, Zhao Q. Gonadotropin-Releasing Hormone Agonists during Gonadal Chemotherapy for the Effect on Pregnancy Outcome and Ovarian Function in Premenopausal Patients with Breast Cancer: A Systematic Review and Meta-Analysis. Breast Care. 2023; 18(4): 270-7.
36- Rebar RW, Connolly HV. Clinical Features of Young Women with Hypergonadotropic Amenorrhea. Fertil steril 1990; 53(5): 804-10.
37- Anasti JN. Premature Ovarian Failure: An Update. Fertil steril 1998; 70(1): 1-15.
38- Słopien RS, Warenik-Szymankiewicz A. Premature Ovarian Failure: Diagnosis and Treatment. Clin Exp Obstet Gynecol 2014; 41(6): 659-61.
39- Beştaş A, Bolu S, Unal E, Aktar Karakaya A, Eröz R, Tekin M, et al. A Rare Cause of Delayed Puberty and Primary Amenorrhea: 17α-Hydroxylase Enzyme Deficiency. Endocrine 2022; 75(3):927-933
40- Hu L, Tan R, He Y, Wang H, Pu D, Wu J. Stem Cell Therapy for Premature Ovarian Insufficiency: A Systematic Review and Meta-Analysis of Animal and Clinical Studies. Arch Gynecol Obstet 2024; 309(2):457-467.
41- Gao M, Yu Z, Yao D, Qian Y, Wang Q, Jia R. Mesenchymal Stem Cells Therapy: A Promising Method for the Treatment of Uterine Scars and Premature Ovarian Failure. Tissue and Cell 2022;74:101676.
42- Song D, Zhong Y, Qian C, Zou Q, Ou J, Shi Y, et al. Human Umbilical Cord Mesenchymal Stem Cells Therapy in Cyclophosphamide-Induced Premature Ovarian Failure Rat Model. BioMed Res Int 2016; 2016: 2517514.
43- Tuckerman E, Mariee N, Prakash A, Li TC, Laird S. Uterine Natural Killer Cells in Peri-Implantation Endometrium From Women with Repeated Implantation Failure after IVF. J Reprod Immunol 2010; 87(1-2):60-6.
44- Faas MM, De Vos P. Uterine NK Cells and Macrophages in Pregnancy. Placenta 2017; 56: 44-52.
45- Lu X, Cui J, Cui L, Luo Q, Cao Q, Yuan W, et al. The Effects of Human Umbilical Cord-Derived Mesenchymal Stem Cell Transplantation on Endometrial Receptivity are Associated With Th1/Th2 Balance Change and Unk Cell Expression of Uterine in Autoimmune Premature Ovarian Failure Mice. Stem Cell Res Ther 2019; 10(1): 214.
46- Umer A, Khan N, Greene DL, Habiba UE, Shamim S, Khayam AU. The Therapeutic Potential of Human Umbilical Cord Derived Mesenchymal Stem Cells for the Treatment of Premature Ovarian Failure. Stem Cell Rev Rep 2023; 19(3): 651-66
47- Jalalie L, Rezaie MJ, Jalili A, Rezaee MA, Vahabzadeh Z, Rahmani MR, et al. Distribution of the CM-Dil-Labeled Human Umbilical Cord Vein Mesenchymal Stem Cells Migrated to the Cyclophosphamide-Injured Ovaries in C57BL/6 Mice. Iran Biomed J 2019; 23(3): 200-8.
48- Yang Y, Lei L, Wang S, Sheng X, Yan G, Xu L, et al. Transplantation of Umbilical Cord–Derived Mesenchymal Stem Cells on a Collagen Scaffold Improves Ovarian Function in a Premature Ovarian Failure Model of Mice. In Vitro Cell Dev Biol Anim 2019; 55(4):302-11.
49- Wang Z, Wei Q, Wang H, Han L, Dai H, Qian X, et al. Mesenchymal Stem Cell Therapy Using Human Umbilical Cord in a Rat Model of Autoimmune-Induced Premature Ovarian Failure. Stem Cells Int 2020; 2020: 3249495.
50- Yan L, Wu Y, Li L, Wu J, Zhao F, Gao Z, et al. Clinical Analysis of Human Umbilical Cord Mesenchymal Stem Cell Allotransplantation in Patients with Premature Ovarian Insufficiency. Cell Prolif 2020; 53(12): e12938.
51- Zhou Y, Zhou J, Xu X, Du F, Nie M, Hu L, et al. Matrigel/Umbilical Cord-Derived Mesenchymal Stem Cells Promote Granulosa Cell Proliferation And Ovarian Vascularization in a Mouse Model of Premature Ovarian Failure. Stem Cells Dev 2021; 30(15): 782-96.
52- Zhang M, Xie T, Dai W, Zhao B, Zheng Y, Hu J, et al. Umbilical Cord Mesenchymal Stem Cells Ameliorate Premature Ovarian Insufficiency in Rats. Evid Based Complement Alternat Med 2022; 2022: 9228456.
1- Okonofua FE, Ntoimo LFC, Omonkhua A, Ayodeji O, Olafusi C, Unuabonah E, et al. Causes and Risk Factors for Male Infertility: A Scoping Review of Published Studies. Int J Gen Med 2022;15: 5985-97.
2- Seneda MM, Zangirolamo AF, González SM, Morotti F. Oogenesis and Folliculogenesis.In Yata, V.K., Mohanty, A.K., Lichtfouse, E. (eds) Sustainable Agriculture Reviews 59. Sustainable Agriculture Reviews: , vol 59. Springer, Cham; 2023: 59-88.
3- Li L, Shi X, Shi Y, Wang Z. The Signaling Pathways Involved in Ovarian Follicle Development. Front Physiol 2021; 12: 730196.
4- Drummond AE. The Role of Steroids in Follicular Growth. Reprod biol endocrinol 2006; 4: 16.
5- Sun YC, Sun XF, Dyce PW, Shen W, Chen H. The Role of Germ Cell Loss during Primordial Follicle Assembly: A Review of Current Advances. Int J Biol Sci 2017; 13(4): 449-57.
6- Zhao YX, Chen SR, Su PP, Huang FH, Shi YC, Shi QY, et al. Using Mesenchymal Stem Cells to Treat Female Infertility: An Update on Female Reproductive Diseases. Stem cells int 2019; 2019: 9071720.
7- Sheikhansari G, Aghebati-Maleki L, Nouri M, Jadidi-Niaragh F, Yousefi M. Current Approaches for the Treatment of Premature Ovarian Failure with Stem Cell Therapy. Biomedicine & pharmacotherapy 2018; 102: 254-62.
8- Li M, Zhu Y, Wei J, Chen L, Chen S, Lai D. The Global Prevalence of Premature Ovarian Insufficiency: A Systematic Review and Meta-Analysis. Climacteric 2023; 26(2): 95-102.
9- Jankowska K. Premature Ovarian Failure. Prz Menopauzalny 2017; 16(2): 51-6.
10- Ebrahimi M, Akbari Asbagh F. The Role of Autoimmunity in Premature Ovarian Failure. Iran J Reprod Med 2015; 13(8): 461-72.
11- Akbaba E, Akbaba G. Primary Ovarian Failure. Medical Bulletin of Haseki/Haseki Tip Bulteni. 2015; 53(1).
12- Shelling AN. Premature Ovarian Failure. Reproduction 2010; 140(5): 633-41.
13- Wang MY, Wang YX, Li-Ling J, Xie HQ. Adult Stem Cell Therapy for Premature Ovarian Failure: from Bench to Bedside. Tissue Eng Part B Rev 2022; 28(1): 63-78.
14- Shareghi-Oskoue O, Aghebati-Maleki L, Yousefi M. Transplantation of Human Umbilical Cord Mesenchymal Stem Cells to Treat Premature Ovarian Failure. Stem Cell Res Ther 2021; 12(1): 454.
15- Li J, Mao Q, He J, She H, Zhang Z, Yin C. Human Umbilical Cord Mesenchymal Stem Cells Improve the Reserve Function of Perimenopausal Ovary via a Paracrine Mechanism. Stem Cell Res Ther 2017; 8(1): 55.
16- Liu R, Zhang X, Fan Z, Wang Y, Yao G, Wan X, et al. Human Amniotic Mesenchymal Stem Cells Improve the Follicular Microenvironment to Recover Ovarian Function in Premature Ovarian Failure Mice. Stem Cell Res Ther 2019; 10(1): 299.
17- Kawamura K, Kawamura N, Hsueh AJ. Activation of Dormant Follicles: A New Treatment for Premature Ovarian Failure? Curr opin obstet gynecol 2016; 28(3): 217-22.
18- Nelson LM. Primary ovarian insufficiency. New Engl J Med 2009; 360(6): 606-14.
19- Şükür YE, Kıvançlı İB, Özmen B. Ovarian Aging and Premature Ovarian Failure. J Turk Ger Gynecol Assoc 2014; 15(3): 190-6.
20- Goswami D, Conway GS. Premature Ovarian Failure. Human reproduction update 2005; 11(4): 391-410.
21- Vijayalakshmi S, Aggarwal S. Genetics of premature ovarian failure. Genetic Clinics. 2018;11(2):10-17
22- Qin, Y., Simpson, J. L., Chen, Z.-J. Genetics of premature ovarian failure: new developments in etiology In: Genetics of human infertility. 2017, Karger Publishers, pp. 17–39.
23- Nippita TA, Baber RJ. Premature Ovarian Failure: A Review. Climacteric 2007;10(1):11-22.
24- Halder A. New Insights into the Mechanism of Pathogenesis of Fragile X-Associated Premature Ovarian Failure. EC Gynaecology 2022; 11: 38-43.
25- Verma P, K Sharma A, Shankar H, Sharma A, Rao D. Role of Trace Elements, Oxidative Stress and Immune System: A Triad in Premature Ovarian Failure. Biol Trace Elem Res 2018; 184(2): 325-33.
26- Novosad JA, Kalantaridou SN, Tong ZB, Nelson LM. Ovarian Antibodies as Detected by Indirect Immunofluorescence are Unreliable in The Diagnosis of Autoimmune Premature Ovarian Failure: A Controlled Evaluation. BMC Women's Health 2003; 3(1): 2.
27- Yan M, Sun M, Zhou Y, Wang W, He Z, Tang D, et al. Conversion of Human Umbilical Cord Mesenchymal Stem Cells in Wharton’s Jelly to Dopamine Neurons Mediated by the Lmx1a and Neurturin in Vitro: Potential Therapeutic Application for Parkinson’s Disease in a Rhesus Monkey Model. PloS One 2013; 8(5): e64000.
28- Grossmann B, Saur S, Rall K, Pecher AC, Hübner S, Henes J, et al. Prevalence of Autoimmune Disease in Women with Premature Ovarian Failure. Eur J Contracept Reprod Health Care 2020;25(1):72-5.
29- Colafrancesco S, Perricone C, Tomljenovic L, Shoenfeld Y. Human Papilloma Virus Vaccine and Primary Ovarian Failure: Another Facet of the Autoimmune/Inflammatory Syndrome Induced by Adjuvants. Am J Reprod Immunol 2013; 70(4): 309-16.
30- Tatang C, Arredondo Bisonó T, Bergamasco A, Salvo F, Costa Clemens SA, Moride Y. Human Papillomavirus Vaccination and Premature Ovarian Failure: A Disproportionality Analysis Using the Vaccine Adverse Event Reporting System. Drugs Real World Outcomes 2022: 9(1): 79-90.
31- Yan Y, Xu W, Qian H, Si Y, Zhu W, Cao H, et al. Mesenchymal Stem Cells from Human Umbilical Cords Ameliorate Mouse Hepatic Injury in Vivo. Liver Int 2009; 29(3): 356-65.
32- Lie Fong S, P J Lugtenburg, Schipper I, A P N Themmen, F H de Jong, Sonneveld P, et al. Anti-Müllerian Hormone as a Marker of Ovarian Function in Women after Chemotherapy and Radiotherapy for Haematological Malignancies. Human Reproduction. 2008;23(3):674-8.
33- Chemaitilly W, Mertens AC, Mitby P, Whitton J, Stovall M, Yasui Y, et al. Acute Ovarian Failure in the Childhood Cancer Survivor Study. J Cli Endocrinol Metab 2006; 91(5): 1723-8.
34- Wallace WH, Thomson AB, Saran F, Kelsey TW. Predicting Age of Ovarian Failure after Radiation to a Field That Includes the Ovaries. Int J Radiat Oncol Biol Phys 2005; 62(3): 738-44.
35- Yuan Y, Zhang C, Lei X, Ren T, Chen H, Zhao Q. Gonadotropin-Releasing Hormone Agonists during Gonadal Chemotherapy for the Effect on Pregnancy Outcome and Ovarian Function in Premenopausal Patients with Breast Cancer: A Systematic Review and Meta-Analysis. Breast Care. 2023; 18(4): 270-7.
36- Rebar RW, Connolly HV. Clinical Features of Young Women with Hypergonadotropic Amenorrhea. Fertil steril 1990; 53(5): 804-10.
37- Anasti JN. Premature Ovarian Failure: An Update. Fertil steril 1998; 70(1): 1-15.
38- Słopien RS, Warenik-Szymankiewicz A. Premature Ovarian Failure: Diagnosis and Treatment. Clin Exp Obstet Gynecol 2014; 41(6): 659-61.
39- Beştaş A, Bolu S, Unal E, Aktar Karakaya A, Eröz R, Tekin M, et al. A Rare Cause of Delayed Puberty and Primary Amenorrhea: 17α-Hydroxylase Enzyme Deficiency. Endocrine 2022; 75(3):927-933
40- Hu L, Tan R, He Y, Wang H, Pu D, Wu J. Stem Cell Therapy for Premature Ovarian Insufficiency: A Systematic Review and Meta-Analysis of Animal and Clinical Studies. Arch Gynecol Obstet 2024; 309(2):457-467.
41- Gao M, Yu Z, Yao D, Qian Y, Wang Q, Jia R. Mesenchymal Stem Cells Therapy: A Promising Method for the Treatment of Uterine Scars and Premature Ovarian Failure. Tissue and Cell 2022;74:101676.
42- Song D, Zhong Y, Qian C, Zou Q, Ou J, Shi Y, et al. Human Umbilical Cord Mesenchymal Stem Cells Therapy in Cyclophosphamide-Induced Premature Ovarian Failure Rat Model. BioMed Res Int 2016; 2016: 2517514.
43- Tuckerman E, Mariee N, Prakash A, Li TC, Laird S. Uterine Natural Killer Cells in Peri-Implantation Endometrium From Women with Repeated Implantation Failure after IVF. J Reprod Immunol 2010; 87(1-2):60-6.
44- Faas MM, De Vos P. Uterine NK Cells and Macrophages in Pregnancy. Placenta 2017; 56: 44-52.
45- Lu X, Cui J, Cui L, Luo Q, Cao Q, Yuan W, et al. The Effects of Human Umbilical Cord-Derived Mesenchymal Stem Cell Transplantation on Endometrial Receptivity are Associated With Th1/Th2 Balance Change and Unk Cell Expression of Uterine in Autoimmune Premature Ovarian Failure Mice. Stem Cell Res Ther 2019; 10(1): 214.
46- Umer A, Khan N, Greene DL, Habiba UE, Shamim S, Khayam AU. The Therapeutic Potential of Human Umbilical Cord Derived Mesenchymal Stem Cells for the Treatment of Premature Ovarian Failure. Stem Cell Rev Rep 2023; 19(3): 651-66
47- Jalalie L, Rezaie MJ, Jalili A, Rezaee MA, Vahabzadeh Z, Rahmani MR, et al. Distribution of the CM-Dil-Labeled Human Umbilical Cord Vein Mesenchymal Stem Cells Migrated to the Cyclophosphamide-Injured Ovaries in C57BL/6 Mice. Iran Biomed J 2019; 23(3): 200-8.
48- Yang Y, Lei L, Wang S, Sheng X, Yan G, Xu L, et al. Transplantation of Umbilical Cord–Derived Mesenchymal Stem Cells on a Collagen Scaffold Improves Ovarian Function in a Premature Ovarian Failure Model of Mice. In Vitro Cell Dev Biol Anim 2019; 55(4):302-11.
49- Wang Z, Wei Q, Wang H, Han L, Dai H, Qian X, et al. Mesenchymal Stem Cell Therapy Using Human Umbilical Cord in a Rat Model of Autoimmune-Induced Premature Ovarian Failure. Stem Cells Int 2020; 2020: 3249495.
50- Yan L, Wu Y, Li L, Wu J, Zhao F, Gao Z, et al. Clinical Analysis of Human Umbilical Cord Mesenchymal Stem Cell Allotransplantation in Patients with Premature Ovarian Insufficiency. Cell Prolif 2020; 53(12): e12938.
51- Zhou Y, Zhou J, Xu X, Du F, Nie M, Hu L, et al. Matrigel/Umbilical Cord-Derived Mesenchymal Stem Cells Promote Granulosa Cell Proliferation And Ovarian Vascularization in a Mouse Model of Premature Ovarian Failure. Stem Cells Dev 2021; 30(15): 782-96.
52- Zhang M, Xie T, Dai W, Zhao B, Zheng Y, Hu J, et al. Umbilical Cord Mesenchymal Stem Cells Ameliorate Premature Ovarian Insufficiency in Rats. Evid Based Complement Alternat Med 2022; 2022: 9228456.
نوع مطالعه: مروری |
موضوع مقاله:
زیست شناسی
دریافت: 1402/10/1 | پذیرش: 1402/10/27 | انتشار: 1403/2/15
دریافت: 1402/10/1 | پذیرش: 1402/10/27 | انتشار: 1403/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







