دوره 32، شماره 11 - ( بهمن 1403 )
جلد 32 شماره 11 صفحات 8462-8451 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ranaei M, Yaghoubi A. The Effect of Aerobic Training along with Resveratrol Supplementation on Some Inflammatory Index Levels in the Spinal Cord Tissue of Rats after Spinal Cord Injury. JSSU 2025; 32 (11) :8451-8462
URL: http://jssu.ssu.ac.ir/article-1-6135-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6135-fa.html
رعنایی محمد، یعقوبی علی. تأثیر تمرین هوازی همراه با مکملیاری رزوراترول بر سطح IL-1β و IL-10 نخاعی بافت نخاعی موشها پس از آسیب طناب نخاعی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (11) :8451-8462
متن کامل [PDF 788 kb]
(289 دریافت)
| چکیده (HTML) (958 مشاهده)
References:
1- Myatich A, Haque A, Sole C, Banik NL. Clemastine in Remyelination and Protection of Neurons and Skeletal Muscle after Spinal Cord Injury. Neural Regen Res 2023; 18(5): 940-6.
2- Michel-Flutot P, Lane MA, Lepore AC, Vinit S. Therapeutic Strategies Targeting Respiratory Recovery after Spinal Cord Injury: from Preclinical Development to Clinical Translation. Cells 2023; 12(11): 1519.
3- Sweis R, Biller J. Systemic Complications of Spinal Cord Injury. Curr Neurol Neurosci Rep 2017; 17(2): 1-8.
4- Anjum A, Yazid MDi, Fauzi Daud M, Idris J, Ng AMH, Selvi Naicker A, et al. Spinal Cord Injury: Pathophysiology, Multimolecular Interactions, and Underlying Recovery Mechanisms. Int J Mol Sci 2020; 21(20): 7533.
5- Alizadeh A, Dyck SM, Karimi-Abdolrezaee S. Traumatic Spinal Cord Injury: An Overview of Pathophysiology, Models and Acute Injury Mechanisms. Front Neurol 2019; 10: 282.
6- Zhang H, Jiang S, Deng B, Liu G, Bai H, Tao J, et al. Mechanism by Which Tetramethylpyrazine Improves Inflammatory Microenvironment after Spinal Cord Injury in Rats. Chinese J Tiss Eng Res 2023; 27(11): 1701-7.
7- Takami T, Oudega M, Bethea JR, Wood PM, Kleitman N, Bunge MB. Methylprednisolone and Interleukin-10 Reduce Gray Matter Damage in the Contused Fischer Rat Thoracic Spinal Cord but Do Not Improve Functional Outcome. J Neurotraum 2002; 19(5): 653-66.
8- Genovese T, Esposito E, Mazzon E, Di Paola R, Caminiti R, Bramanti P, et al. Absence of Endogenous Interleukin‐10 Enhances Secondary Inflammatory Process after Spinal Cord Compression Injury in Mice. J Neurochem 2009; 108(6): 1360-72.
9- Thompson CD, Zurko JC, Hanna BF, Hellenbrand DJ, Hanna A. The Therapeutic Role of Interleukin-10 after Spinal Cord Injury. J Neurotraum 2013; 30(15): 1311-24.
10- Chen X, Lu D, Liu W, Xie J, Lu Z, Yang H, et al. Therapeutic Effect of Atractylenolide I on Aspergillus Fumigatus Keratitis by Affecting Myd88/NF-Κb Pathway and IL-1β, IL-10 Expression. Cytokine 2023; 162: 156112.
11- Nesic O, Xu G-Y, McAdoo D, Westlund High K, Hulsebosch C, Perez-Polo R. IL-1 Receptor Antagonist Prevents Apoptosis and Caspase-3 Activation after Spinal Cord Injury. J Neurotraum 2001; 18(9): 947-56.
12- Abraham K, McMillen D, Brewer K. The Effects of Endogenous Interleukin-10 on Gray Matter Damage and the Development of Pain Behaviors Following Excitotoxic Spinal Cord Injury in the Mouse. Neurosci 2004; 124(4): 945-52.
13- Coyoy-Salgado A, Segura-Uribe JJ, Guerra-Araiza C, Orozco-Suárez S, Salgado-Ceballos H, Feria-Romero IA, et al. The Importance of Natural Antioxidants in the Treatment of Spinal Cord Injury in Animal Models: An Overview. Oxid Med Cell Long 2019; 2019: 3642491.
14- Kaki A, Nikbakht M, Fathimoghadam H, Habibi A. The Effect Aerobic Exercise on the Level of Expression of Toll-Like Receptor 4 and Inflammatory Mediators in the Sensory Spinal Cord of Male Rats with Diabetic Neuropathic Pain. Jundishapur Sci Med J 2019; 17(5): 503-17.
15- Wu Z, Zhang Z, Zhou Z, Rao S, Li S. Effect of Aerobic Exercise on Lung Regeneration and Inflammation in Mice. Immunobiolgy 2022; 227(6): 152296.
16- Gharib M, Samani K, ZarrinÅbadi Z, Mokhtari M, Heydarian E. Effect of Resveratrol Supplementation on Antioxidant Parameters, Lipids Profile and Several Biochemical Indices in Type 2 Diabetic Patients: A Double-Blind Randomized-Controlled Clinical Trial. Iranian J Nut Sci Food Tech 2018; 12(4): 33-42.
17- Naeini FB, Hassanpour S, Asghari A. Resveratrol Exerts Anxiolytic-Like Effects through Anti-Inflammatory and Antioxidant Activities in Rats Exposed to Chronic Social Isolation. Behav Brain Res 2023; 438: 114201.
18- Santana TM, Ogawa LY, Rogero MM, Barroso LP, de Castro IA. Effect of Resveratrol Supplementation on Biomarkers Associated with Atherosclerosis in Humans. Complemen Ther Clin Pract 2022; 46: 101491.
19- Freyermuth-Trujillo X, Segura-Uribe JJ, Salgado-Ceballos H, Orozco-Barrios CE, Coyoy-Salgado A. Inflammation: A Target for Treatment in Spinal Cord Injury. Cells 2022; 11(17): 2692.
20- Byrnes KR, Fricke ST, Faden AI. Neuropathological Differences Between Rats and Mice after Spinal Cord Injury. J Mag Res Imag 2010; 32(4): 836-46.
21- Basso D, Beattie M, Bresnahan J, Anderson D, Faden A, Gruner J, et al. MASCIS Evaluation of Open Field Locomotor Scores: Effects of Experience and Teamwork on Reliability. J Neurotraum 1996; 13(7): 343-59.
22- Girbovan C, Kent P, Merali Z, Plamondon H. Dose-Related Effects of Chronic Resveratrol Administration on Neurogenesis, Angiogenesis, and Corticosterone Secretion are Associated with Improved Spatial Memory Retention Following Global Cerebral Ischemia. Nut Neurosci 2016; 19(8): 352-68.
23- Alvarez-Mejia L, Morales J, Cruz GJ, Olayo M-G, Olayo R, Díaz-Ruíz A, et al. Functional Recovery in Spinal Cord Injured Rats Using Polypyrrole/Iodine Implants and Treadmill Training. J Mat Sci Mat Med 2015; 26(7): 209.
24- Bolton AE. Biologic Effects and Basic Science of a Novel Immune-Modulation Therapy. Am J Cardiol 2005; 95(11A): 24C-9C.
25- Jin Y, Song Y, Lin J, Liu T, Li G, Lai B, et al. Role of Inflammation in Neurological Damage and Regeneration Following Spinal Cord Injury and Its Therapeutic Implications. Burns Trauma 2023; 11: tkac054.
26- Gashmardi N, Edalatmanesh MA. Cellular and Molecular Mechanisms Involved in Neuroinflammation after Acute Traumatic Spinal Cord Injury. Neurosci J Shefaye Khatam 2019; 7(4): 89-105.
27- Kouda K, Furusawa K, Sugiyama H, Sumiya T, Ito T, Tajima F, et al. Does 20-Min Arm Crank Ergometer Exercise Increase Plasma Interleukin-6 in Individuals with Cervical Spinal Cord Injury? Eur J Appl Physiol 2012; 112(2): 597-604.
28- Kotas ME, Medzhitov R. Homeostasis, Inflammation, and Disease Susceptibility. Cell 2015; 160(5): 816-27.
29- Black LM, Lever JM, Agarwal A. Renal Inflammation and Fibrosis: A Double-Edged Sword. J Histochem Cytochem 2019; 67(9): 663-81.
30- Orr MB, Gensel JC. Spinal Cord Injury Scarring and Inflammation: Therapies Targeting Glial and Inflammatory Responses. Neurotherap 2018; 15(3): 541-53.
31- Gensel JC, Zhang B. Macrophage Activation and Its Role in Repair and Pathology after Spinal Cord Injury. Brain Res 2015; 1619: 1-11.
32- Harvey L, Lin C-W, Glinsky J, De Wolf A. The Effectiveness of Physical Interventions for People with Spinal Cord Injuries: A Systematic Review. Spin Cord 2009; 47(3): 184-95.
33- Rosety-Rodriguez M, Camacho A, Rosety I, Fornieles G, Rosety MA, Diaz AJ, et al. Low-Grade Systemic Inflammation and Leptin Levels Were Improved by Arm Cranking Exercise in Adults with Chronic Spinal Cord Injury. Arch Phys Med Rehab 2014; 95(2): 297-302.
34- Neefkes-Zonneveld CR, Bakkum AJ, Bishop NC, van Tulder MW, Janssen TW. Effect of Long-Term Physical Activity and Acute Exercise on Markers of Systemic Inflammation in Persons with Chronic Spinal Cord Injury: A Systematic Review. Archiv Phys Med Rehab 2015; 96(1): 30-42.
35- Gleeson M, Bishop NC, Stensel DJ, Lindley MR, Mastana SS, Nimmo MA. The Anti-Inflammatory Effects of Exercise: Mechanisms and Implications for the Prevention and Treatment of Disease. Nature Rev Immunol 2011; 11(9): 607-15.
36- Reihmane D, Jurka A, Tretjakovs P. The relationship between maximal exercise‐induced increases in serum IL‐6, MPO and MMP‐9 concentrations. Scand J Immunol 2012; 76(2): 188-92.
37- Umemoto Y, Furusawa K, Kouda K, Sasaki Y, Kanno N, Kojima D, et al. Plasma IL-6 Levels During Arm Exercise in Persons with Spinal Cord Injury. Spinal Cord 2011; 49(12): 1182-7.
38- Zhao H, Mei X, Yang D, Tu G. Resveratrol Inhibits Inflammation after Spinal Cord Injury Via SIRT-1/NF-Κb Signaling Pathway. Neurosci Let 2021; 762: 136151.
39- Salla M, Pandya V, Bhullar KS, Kerek E, Wong YF, Losch R, et al. Resveratrol and Resveratrol-Aspirin Hybrid Compounds as Potent Intestinal Anti-Inflammatory and Anti-Tumor Drugs. Molecules 2020; 25(17): 3849.
40- Lu KT, Wang YW, Yang JT, Yang YL, Chen HI. Effect of Interleukin-1 on Traumatic Brain Injury–Induced Damage to Hippocampal Neurons. J Neurotraum 2005; 22(8): 885-95.
41- Matute C, Domercq M, Sánchez‐Gómez MV. Glutamate‐Mediated Glial Injury: Mechanisms And Clinical Importance. Glia 2006; 53(2): 212-24.
42- Li S, Stys PK. Mechanisms of Ionotropic Glutamate Receptor-Mediated Excitotoxicity in Isolated Spinal Cord White Matter. J Neurosci 2000; 20(3): 1190-8.
43- Takahashi JL, Giuliani F, Power C, Imai Y, Yong VW. Interleukin‐1β Promotes Oligodendrocyte Death Through Glutamate Excitotoxicity. Ann Neurol 2003; 53(5): 588-95.
متن کامل: (351 مشاهده)
مقدمه
آسیب طناب نخاعی (SCI spinal cord injury) یک آسیب تروماتیک به نخاع است که باعث آسیب به اعصاب، عضلات و بافت اطراف نخاع میشود. ای عارضه بر اثر حوادث جادهای و یا حوادث قهری بهوجود میآید و میزان ابتلا به آن هر ساله در حال افزایش است (1). بلافاصله پس از SCI، بیماران شرایط تهدید کننده زندگی را تجربه میکنند. صدمات نخاعی باعث ایجاد نقص دائمی عصبی حرکتی و خودکار میشوند. این آسیبها بر عملکردهای تنفسی مرکزی، قلبی عروقی، کلیوی و ادراری از طریق تعدیل سیستم عصبی سمپاتیک تأثیر میگذارند (3, 2). آسیب اولیه به طناب نخاعی، آسیب ثانویه را در پی دارد که باعث آسیب شیمیایی و مکانیکی بیشتر به بافت¬های ستون فقرات میشود (4). آسیب ثانویه در عرض چند دقیقه پس از آسیب اولیه شروع میشود و برای هفتهها یا ماهها ادامه مییابد و باعث آسیب تدریجی بافت نخاع اطراف محل ضایعه میشود. مفهوم آسیب ثانویه برای اولین بار توسط آلن Allen در سال 1911 معرفی شد. او در حین مطالعه SCI در سگها، مشاهده کرد که حذف هماتومیلیا پس از سانحه، باعث بهبود نتیجه عصبی در سگ میشود. او فرض کرد که وجود برخی عوامل بیوشیمیایی در ضایعه هموراژیک باعث آسیب بیشتر به نخاع میشود (5). نشان داده شده است که این آسیب شیمیایی و مکانیکی بیشتر به بافتهای ستون فقرات به دلیل تجمع بالای کلسیم در سلولها و افزایش غلظت اکسیژن فعال و سطح گلوتامات، منجر به تجمع انتقال دهندههای عصبی خواهد شد. این موارد به اسید نوکلئیک، پروتئینها و فسفولیپیدهای زیرین آسیب میرساند و منجر به اختلال عملکرد عصبی میشود. این پدیده همچنین با انتشار سایتوکاینهای التهابی پس از 6 تا 12 ساعت پس از آسیب همراه است. این نفوذ سلولهای ایمنی و سایتوکاینهای التهابی باعث التهاب نورونها میشود (4).
در این ارتباط نشان داده شده است که پس از آسیب نخاعی، بیان عوامل پیش التهابی بهطور قابلتوجهی افزایش یافته و شرایط بافتی به سمت التهابی نامتعادل میشود. عدم تعادل ریزمحیط التهابی پس از آسیب نخاعی میتواند آسیب نخاعی ثانویه را تشدید کند و ترمیم آن را مختل کند (6). بیان شده است که پس از SCI، آسیب فوری و به دنبال آن مجموعهای از پاسخهای سلولی و مولکولی وجود دارد که منجر به یک بافت زخم متراکم در بافت گلیال میشود (7). این فرآیند التهابی منجر به آپوپتوز عصبی، افزایش حجم ضایعه و کاهش بهبود عملکرد میشود (8). در طی چند ساعت تا روزهای بعد از SCI، آسیب بافتی میتواند بسیار متنوع است و کنترل التهاب نقش مهمی در کنترل این آسیب¬های بافتی بر عهده دارد (9). التهاب پاتوفیزیولوژیک با افزایش تولید سایتوکاین های التهابی و سایر واسطههای التهابی کلیدی، از جمله اینترلوکین -1 بتا (IL-1β Interleukin-1 beta)، که یک سایتوکاین پیش التهابی قوی است، رخ میدهد. غلظتهای بالاتر IL-1β در مایع مغزی نخاعی در اثر SCI گزارش شده است (10). بیان شده است که میکروگلیاهای فعال شده در نخاع آسیب دیده، سایتوکاینهای پیش التهابی مختلفی از جمله IL-1β، عامل نکروز تومور آلفا (TNF-α Tumor necrosis factor α)، پروتئازها و سایر عوامل سیتوتوکسیک تولید میکنند. تزریق آنتاگونیستهای IL-1β 72 ساعت پس از SCI در موشها بهطور قابلتوجهی آپوپتوز ناشی از آسیب را کاهش داد، که نشان میدهد بیان اولیه IL-1β مضر است (11). اینترلوکین 10 (IL-10 Interluekine-10) یک سایتوکاین ضد التهابی میباشد و عنوان شده است که درمان SCI با این سایتوکاین ضد التهابی، نقش محافظت کننده عصبی ایفا میکند (12)، حمایت تغذیهای از نورونها را فراهم میکند، از التهاب ثانویه مضر، محافظت میکند (8) و در درمانهای ترکیبی مفید است (7). علاوه بر این بهطور تجربی نشان داده شده است که IL-10 حجم ضایعه را کاهش میدهد (12, 7)، تاخیر و کاهش درد نوروپاتیک (12) و بهبود عملکرد در موشهای مدل SCI ایجاد میکند (8). تمرین ورزشی و استفاده از آنتی اکسیدانهای طبیعی بهعنوان روش درمانی جایگزین برای برخی آسیبهای عصبی از جمله SCI استفاده میشود (13). در این ارتباط تمرینات ورزشی، به عنوان یک استراتژی غیردارویی جهت کاهش عوارض ناشی از آسیب نخاعی مورد توجه پژوهشگران قرار گرفته است. برخی مطالعات نشان دادهاند که فعالیتهای هوازی باعث کاهش درد نوروپاتیک و کاهش شاخصهای پیش التهابی از جمله IL-1β بعد از آسیب نخاعی میشود (14). تمرین هوازی بهعنوان یکی از درمانهای حمایتی نیز در این بیماران در نظر گرفته میشود. ارتباط بین تمرین هوازی و پاسخ ایمنی همیشه موضوع داغ جامعه ورزش و پزشکی بوده است. ورزش متوسط می تواند سیستم ایمنی بدن را فعال کند. بر اساس برخی از مطالعات، تمرین هوازی میتواند با تنظیم بیان سایتوکاینهایی از جمله IL-10 و آنتیاکسیدانها اثرات ضد التهابی داشته باشد (15). از طرف دیگر رزوراترول (۳، ۴،۵ -تری هیدروکسی ترانس- استیلبن) یک پلی فنل قوی و ماده بیولوژیک فعال در برخی دانهها سبزیجات و میوهها به خصوص توت و انگور قرمز است که سبب افزایش طول عمر سلولها میگردد. محققین تأثیر این پلی فنول را به اثر آنتیاکسیدانی آن مرتبط میدانند. رزوراترول نوعی فیتوآلکسین است که توسط برخی اسپرماتوفیت ها در پاسخ به آسیب تولید میشود و در کاهش استرس اکسایشی و تجمع پلاکت نقش دارد (16). مصرف مکمل رزوراترول با توجه به نقش آنتیاکسیدانی و ضد التهابی در این بیماران مورد تأکید قرار گرفته است. رزوراترول طیف گستردهای از فعالیتهای زیستی، از جمله آنتیاکسیدان، ضد التهاب، ضد سرطان، ضد پیری و خواص محافظتی عصبی را نشان میدهد. رزوراترول یک جزء بالقوه در تعدیل التهاب عصبی است که در برخی اختلالات عصبی تأثیرگذار است (17). برخی مطالعات نیز، نقش مکمل رزوراترول در تنظیم هموستاز گلوکز، التهاب و استرس اکسایشی را در مقایسه با دارونما نشان داده اند. مداخلات با رزوراترول میتواند با توجه به شرایط بیمار، از نظر "دوز / زمان" سفارشی شود (18). به دلیل آسیبشناسی فیزیکی پیچیده SCI یعنی آسیب اولیه و به دنبال آن گسترش آسیب ثانویه بافتی، در حال حاضر درمانی قطعی برای ترمیم آسیب نخاعی شناسایی نشده است. ارزیابی تحقیقات عملکردی در مراحل حاد SCI در انسان غیرممکن است. بنابراین، مدلهای پیش بالینی برای درک فیزیولوژی سلامت بعد از آسیب نخاعی ضروری هستند. ازآنجاکه یکی از اهداف در درمان SCI، مهار آسیب ثانویه در ناحیه آسیب و ارتقاء بهبود عملکرد اندام پایینتر از آن میباشد؛ و با توجه به نقش التهاب و فشار اکسایشی در پاتوژنز SCI، مهار فشار اکسایشی و التهاب میتواند یک استراتژی مناسب برای کاهش عوارض ناشی از SCI باشد (19). بنابراین، هدف از تحقیق حاضر بررسی تأثیر تمرین هوازی همراه با مکمل یاری رزوراترول بر سطح IL-1β و IL-10 نخاعی در موشهای مبتلا به SCI بود.
روش بررسی
تحقیق حاضر از نوع تجربی میباشد که با طرح پیش آزمون و پس آزمون با یک گروه کنترل و چهار گروه تجربی انجام شد. در این تحقیق اطلاعات مورد نظر بر اساس اندازهگیری متغیرهای وابسته تحقیق، از طریق پس آزمون جمعآوری شد. بر این اساس تعداد 45 سر رت نر بالغ نژاد ویستار با سن هشت هفته و با دامنه وزنی 185 تا 200 گرم استفاده شد که از آزمایشگاه حیوانات دانشگاه علوم پزشکی خراسان شمالی خریداری شده بوند. حیوانات پس از انتقال به محیط تحقیق و آشنایی یک هفته¬ای با محیط جدید و آشنایی با فعالیت روی نوارگردان، ابتدا بر اساس وزن و به صورت تصادفی گروه بندی شده و قفسهها به صورت تصادفی نامگذاری گردیدند. 9 سر موش به عنوان گروه کنترل جدا شدند. سایر موشها، پس از ایجاد جراحی و ایجاد آسیب نخاعی در 4 گروه شامل ۱- کنترل، ۲- رزوراترول، ۳- تمرین و ۴- رزوراترول+تمرین. قرار داده شدند. پس از رسیدن وزن موشها به 225 گرم، حیوانات با استفاده از مخلوط کتامین/ زایلازین بیش هوش شدند، سپس موهای پشت آن به آرامی تراشیده شد و محل مورد نظر ضدعفونی گردید. یک برش در خط وسط و روی برجستگیهای مهرهای ایجاد شد، سپس عضلات و لامینای مهره T9 بدون آسیب رساندن به سخت شامه برداشته شد، در ادامه SCI با انداختن وزنه ده گرمی از ارتفاع ۲۵ میلیمتری بر روی نخاع در قطعه T10 ایجاد گردید (20). مقیاس باسو بتی برسنان (BBB Basso-Beattie-Bresnahan) برای ارزیابی عملکرد عصبی مورد استفاده قرار گرفت. مقیاس BBB یک مقیاس 21 امتیازی است که در آن امتیاز 1 نشان دهنده عدم حرکت اندام عقبی تا امتیاز 21 که نشان دهنده عملکرد طبیعی اندام عقبی است، امتیاز بندی میشود. امتیاز دهی این مقیاس بر جنبههای عملکردی اندام عقبی مانند حمایت از وزن، توانایی قدم زدن، هماهنگی و فاصله انگشتان پا نظارت دارد (21, 20). امتیازدهی به موشهای SCI توسط متخصص بیطرف انجام شد. مکمل رزوراترول (تهیه شده از شرکت سیگما) در اتانول 50 درصد حل شد. سپس بهصورت روزانه در محلولی متشکل از 0/9 درصد نمک حاوی 20 درصد هیدروکسی پروپیل h-cyclodextrin (شرکت سیگما) حل شد. این محلول با دوز 10 میلیگرم به ازای هر کیلوگرم بهصورت درون صفاقی، به صورت درون صفاقی و روزانه تزریق شد. به موشهای سایر گروهها به مقدار مشابه سالین تزریق شد (22). گروههای تمرینی پروتکل تمرینی را از طریق تردمیل به کمک سیستم حمایت وزن بدن دنبال کردند. قبل از SCI، همه موشها دو جلسه نیم ساعته در معرض محیط تردمیل قرار گرفتند. برای پیشگیری از آبشارهای آسیب ثانویه، برنامه تمرینی در ۱۴ روز پس از آسیب و انجام آزمون BBB، آغاز شد. گروههای تمرینی ابتدا با سرعت 10 متر در دقیقه و به مدت ۲۰ دقیقه روی تردمیل با جلیقه حمایتی تحت تمرین قرار گرفتند. در طول ۷ روز تمرینی که قبلاً در مطالعات توضیح داده شده است، زمان جلسه به تدریج از ۲۰ دقیقه به هدف ۵۸ دقیقه و شدت تمرین به 20 متر در دقیقه افزایش یافت (23). کل دوره تمرین 4 هفته بود. موشها 48 ساعت پس از آخرین جلسه تمرین بیهوش شدند. بیهوشی با استفاده از تزریق درون صفاقی ترکیبی از داروی کتامین (60 تا 80 میلیگرم بهازای هر کیلوگرم وزن بدن) و زایلازین (هشت میلیگرم بهازای هر کیلوگرم وزن بدن) انجام شد. نمونه نخاعی آزمودنیها پس از پاکسازی پوست و جدا کردن مهرهها در قسمت آسیب دیده به دقت جدا شده و پس از برداشتن و پاکسازی از خون به درون کرایوتیوبهای کدگذاری شده منتقل و سپس با استفاده از ازت مایع منجمد شده و در ادامه در یخچال 70- درجه سانتیگراد نگهداری شدند. سطح IL-1β و IL-10 نخاعی با استفاده از کیت های آزمایشگاهی، به روش الایزا و طبق دستورالعمل شرکت سازنده اندازهگیری شد. پس از جمعآوری دادههای خام، به منظور بررسی نرمال بودن دادهها از آزمون شاپیرو-ویلک و برای بررسی فرض برابری واریانسها، از آزمون لون استفاده شد. پس از مشخص شدن طبیعی بودن توزیع دادهها و برقراری فرض برابری واریانسها، به منظور تجزیه و تحلیل آماری دادهها و مقایسه بین گروهها از آزمون آنالیز واریانس یک طرفه One-way ANOVAو آزمون تعقیبی LSD استفاده شد. تمام محاسبات آماری با استفاده از نرمافزار آماری version 16 SPSS در سطح معناداری P˂ 0/05 صورت گرفت. جهت رسم نمودارها از نرمافزار اکسل نسخه 2013 استفاده گردید.
نتایج
در این بخش اطلاعات توصیفی مربوط به مقیاس BBB موشها در ابتدا و پس از 4 هفته تمرین هوازی و مصرف رزوراترول ارائه شده است. در جدول 1 نتایج مربوط به آزمون BBB موشهای مبتلا به آسیب نخاعی قبل و بعد از تمرین هوازی و مصرف مکمل رزوراترول را نشان میدهد. نتایج حاصل از آنالیز واریانس یکطرفه نشان داد که بین مقیاس BBB قبل از شروع پروتکل تمرین هوازی و مصرف رزوراترول تفاوت معناداری وجود ندارد (0/819=P). اما بین نتایج حاصل از آزمون BBB بعد از پروتکل تمرین هوازی و مصرف رزوراترول بین گروه ها تفاوت معناداری مشاهده شد (0/001=P). سطح این شاخص در پس آزمون، در گروه تمرین هوازی و تمرین+رزوراترول نسبت به پیش آزمون و گروههای کنترل و رزوراترول به طور معناداری بالاتر بود (0/05>P). به منظور مقایسه سطوح IL-1β و IL-10 نخاع موش های مبتلا به SCI در گروههای تحقیق از آزمون آنالیز واریانس یک طرفه و آزمون تعقیبی توکی استفاده شد. در جدول 2 یافتههای آزمون آنالیز واریانس یک طرفه در خصوص مقایسه اثر تمرین هوازی و مصرف رزوراترول بر سطوح IL-1β و IL-10 نخاع موشهای مبتلا به SCI در گروه های تحقیق ارائه شده است. یافتههای حاصل از آزمون آنالیز واریانس یک طرفه حاکی از آن بود که بین سطح IL-1β نخاعی در موش های مبتلا به آسیب نخاعی پس از 4 هفته تمرین هوازی و مصرف مکمل رزوراترول، تفاوت معناداری وجود دارد (6/426=F و 0/003=p). نتایج حاصل از آزمون تعقیبی LSD نشان داده که سطح IL-1β نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری بالاتر تر بود (0/005=p). سطح این شاخص در گروه های مکمل رزوراترول (0/011=p)، تمرین هوازی (0/002=p) و تمرین+رزوراترول (0/016=p) به طور معناداری نسبت به گروه کنترل پایین تر بود؛ اما سطح آن در گروه رزوراترول، تمرین و تمرین+رزوراترول نسبت به گروه سالم کنترل تفاوت معناداری را نشان نداد (0/05<p). بین سطح IL-1β در مکمل رزوراترول گروه تمرین و تمرین+مکمل رزوراترول نسبت به گروه کنترل تفاوت معناداری مشاهده نشد (0/05<p). یافتههای حاصل از آزمون آنالیز واریانس یک طرفه حاکی از آن بود که بین سطح IL-10 نخاعی در موشهای مبتلا به آسیب نخاعی پس از 4 هفته تمرین هوازی و مصرف مکمل رزوراترول، تفاوت معناداری وجود دارد (326/4=F و 016/0=p). نتایج حاصل از آزمون تعقیبی LSD نشان داده که سطح IL-10 نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری پایین تر بود (0/011=p). سطح این شاخص در گروههای تمرین و تمرین +رزوراترول نسبت به گروه کنترل افزایش را نشان داد ولی از نظر آماری معنادار نبود (0/05<p). همچنین سطح IL-10 نخاعی در گروه مکمل رزوراترول نسبت به گروه کنترل تفاوت معناداری نشان ندارد (0/05<p). بین سطح IL-10 در گروه تمرین و تمرین+مکمل رزوراترول نسبت به گروه سالم تفاوت معناداری مشاهده نشد (0/05<p).
جدول1: نتایج آزمون *BBB در پیش آزمون و پس آزمون گروههای تحقیق
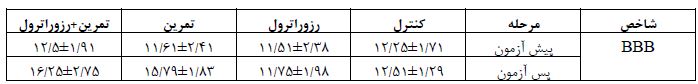
BBB: Basso-Beattie-Bresnahan*
جدول 2: مقایسه سطوح IL-1β و IL-10 نخاع در گروههای تحقیق و یافتههای آزمون آنالیز واریانس یک طرفه
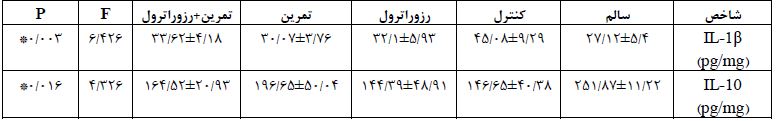
* نشانه تفاوت معنیدار بین گروههای تحقیق
بحث
هدف از تحقیق حاضر بررسی اثر تمرین هوازی همراه با مصرف مکمل رزوراترول بر سطح IL-1β و IL-10 نخاعی موش های مبتلا به SCI بود. نتایج تحقیق حاضر نشان داد که سطح IL-1β نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری بالاتر بود همچنین سطح IL-10 نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری پایین تر بود. همانطور که عنوان شد SCI شامل آسیب اولیه و آسیب ثانویه است. آسیب اولیه مربوط به آسیب تروماتیک اولیه است و در اثر ضربه مخرب ایجاد میشود که منجر به آسیب مکانیکی فوری و غیرقابل برگشت میشود. آسیب اولیه باعث ایجاد یک آبشار پاتوفیزیولوژیکی، از جمله مرحله آسیب ثانویه میشود. آسیب ثانویه چند دقیقه پس از ترومای اولیه شروع میشود و به سه مرحله حاد، تحت حاد و مزمن تقسیم میشود (5, 4). مرحله آسیب ثانویه حاد با آسیب عروقی، سمیت تحریکی، عدم تعادل یونی، آسیب اکسایشی، پاسخ التهابی و فعال شدن سلول های ایمنی مشخص می شود. آسیب ثانویه حاد منجر به مرحله آسیب ثانویه تحت حاد می شود که با آپوپتوز عصبی، دژنراسیون والرین، فعال شدن واکنشی آستروسیت، بازسازی آکسون و تشکیل اسکار گلیال مشخص می شود. آسیب ثانویه تحت حاد منجر به آسیب ثانویه مزمن می شود که با ایجاد کیست ها، ضعف آکسون و بلوغ اسکار گلیال مشخص می شود (5). سیستم ایمنی در تعادل پویا بین عوامل التهابی (از جمله IL-1β) که با عوامل ضد التهابی (از جمله IL-10) متعادل میشوند، قرار دارد (24). سیستم ایمنی برای مقابله با التهاب افزایش یافته در اثر SCI (IL-1β)، شروع به ترشح سایتوکاین های ضد التهابی از جمله IL-10 میکند. تعادل پویای سیستم ایمنی و پاسخ التهابی عصبی برای آسیب ثانویه مهم است که منجر به مرگ سلولی و تخریب بافت در مراحل تحت حاد و مزمن می شود و افزایش شدت آسیب را در پی دارند (25). در این ارتباط عنوان شده است که حوادث متعاقب SCI به وسیله حضور سلول های التهابی و سایتوکاینهای پیش التهابی تشدید میشود. پاسخهای التهابی منجر به آپوپتوز نورونها و الیگودندروسیتها و نیز تشکیل بافت جوشگاه و در نهایت کاهش عملکرد عصبی میشوند (26). عنوان شده است که بلافاصله پس از SCI، نوتروفیل ها و میکروگلیاها فعال میشوند و تعدادی سایتوکاین IL-1β ترشح می کنند. در این راستا کودا kouda و همکاران در سال 2012 نشان دادند که سطح پایه عوامل التهابی در افراد مبتلا به SCI بالاتر از افراد سالم است (27). از طرف دیگر عنوان شده است که هدف اصلی التهاب، که پاسخ بدن به محرکهای خارجی است، حفظ هموستاز بدن و محافظت از بدن در برابر آسیب محرکهای نامطلوب خارجی است (28). با این حال، مطالعات نشان داده اند که پاسخ التهابی یک "شمشیر دولبه" پس از SCI است. تا حدودی، پاسخ التهابی پس از SCI میتواند به حفظ ثبات محیط داخلی کمک کند. از سوی دیگر، پاسخ التهابی بیش از حد میتواند آسیب بیشتر را تشدید کند (29, 26). پس از SCI، با از بین رفتن نفوذپذیری سد خونی نخاعی، کموکاینهایی که توسط بافت نکروزه و آپوپتوز آزاد میشوند، میتوانند به تجمع کموتاکتیک سلولهای ایمنی کمک کنند و سپس باعث شروع پاسخ التهابی شوند (30). سلولهای ایمنی میتوانند سلولها و بافتهای نکروزه را ببلعند. با این حال، تجمع سلولهای ایمنی و آزاد شدن عوامل التهابی پس از SCI منجر به ایجاد یک پاسخ التهابی بارزتر میشود (31). این افزایش IL-1β نخاعی که در تحقیق حاضر مشاهده شد نیز میتواند در راستای جلوگیری از آسیب بیشتر در سیستم عصبی باشد. یکی از مهمترین یافتههای تحقیق حاضر حاکی از کاهش سطح IL-1β نخاعی در موشهای مبتلا به SCI در اثر تمرین هوازی و عدم تأثیر آن بر سطح IL-10 نخاعی بود. تمرینات ورزشی در موارد مختلف از جمله قدرت عضلانی، آمادگی قلبی عروقی، تحرک مفاصل، انبساط عضلانی، تحلیل استخوان، درد و اسپاستیسیته در گیر میباشد و ممکن است توانایی انجام فعالیتها را بدون کمک مراقب یا انجام وظایف با استفاده از روشهای جبرانی با یا بدون تجهیزات بهبود بخشد (32)؛ اما تأثیر آن بر عوامل التهابی و ضد التهابی طناب نخاعی در آزمودنیهای مبتلا به SCI کمتر مورد بررسی قرار گرفته است. روزتی-رودریگوئز Rosety-Rodriguezو همکاران در سال 2014 نشان دادند که التهاب سیستمیک متعاقب 12 هفته تمرین هوازی بالاتنه با شدت 50 تا 65 درصد ضربان قلب ذخیره، در افراد مبتلا به SCI، بهطور معناداری کاهش یافت (33). در تحقیق دیگری نیفکز-زونولد Neefkes-Zonneveld و همکاران در سال 2015 در مقالهای مروری تأثیر فعالیت بدنی طولانیمدت و فعالیت ورزشی حاد را بر عوامل التهابی در افراد مبتلا به SCI مورد بررسی قرار دادند. آنها عنوان داشتند که التهاب سیستمیک منشا بسیاری از بیماریهای ناشی از SCI، همچون بیماریهای قلبی و عروقی، دیابت نوع 2 و سایر بیماریهای التهابی میباشد. فعالیت بدنی طولانیمدت کاهش سایتوکاینهای التهابی و همچنین بهبود عوامل ضد التهابی را در پی دارد (34). از جمله دلایل تفاوت نتایج تحقیق فوق با مطالعه حاضر نوع بافت مورد بررسی میباشد. چرا که در تحقیق نیفکز-زونولد و همکاران، عوامل ضد التهابی در جریان خون مورد بررسی قرار گرفت ولی در تحقیق حاضر سطح آن در بافت نخاعی بررسی شد. در این راستا عنوان شده است که فعالیت بدنی منظم با تعداد بیشتری از سلولهای T تنظیمی در گردش خون همراه است که سایتوکاینهای ضد التهابی از جمله IL-10 را آزاد میکند (35). همچنین پیشنهاد شده است که شدت ورزش در تنظیم افزایش مولکولهای التهابی مهم است. در واقع، تمرین ورزشی در دامنه حداکثر (تست افزایشی دوچرخه تا زمان خستگی) باعث ایجاد یک پاسخ التهابی با لکوسیتوز و افزایش سطح سایتوکاینهای التهابی (IL-6، ماتریکس متالوپروتئاز-9 Matrix metalloproteinase-9، میلوپراکسیداز Myeloperoxidase) میشود (36). همچنین اوماموتو و همکاران در سال 2011 عنوان داشتند که سطح پلاسمایی IL-6 به عنوان یک عامل پیش التهابی در اثر فعالیت ورزشی شدید یک جلسه ای افزایش داشت (37). نتایج تحقیق حاضر نشان داد که مصرف مکمل رزوراترول به مدت 4 هفته تأثیری بر سطح IL-1β و IL-10 نخاعی موش های مبتلا به SCI نداشت. یکی از مهمترین نقش های دارویی رزوراترول از طریق اثرات ضد التهابی آن اعمال میشود (38). رزوراترول به دلیل اثرات ضد التهابی، ضد اکسیداسیون، ضد تومور و سایر اثرات دارویی در سال های اخیر به طور گسترده مورد مطالعه قرار گرفته است (39). همراستا با نتایج تحقیق حاضر ژائو zhao و همکاران در سال 2021 نشان دادند که مصرف مکمل رزوراترول به مدت 28 روز کاهش التهاب را در موشهای مبتلا به SCI را نشان داد. درمان با رزوراترول هم عملکرد حرکتی و هم بقای نورونهای حرکتی را بهبود میبخشد، علاوه بر آن نشان داده شده است که اندازه ضایعه را در موشها پس از SCI کاهش میدهد. این بیشتر اثرات محافظتکننده عصبی رزوراترول را بعد از SCI تایید میکند. علاوه بر این، درمان رزوراترول بهطور قابلتوجهی بیان پروتئینهای مرتبط با التهاب مانند TNF-α، IL-1β و IL-6 را در مقایسه با گروه حامل کاهش داد. از سوی دیگر، درمان با رزوراترول نیز بیان BDNF را بهطور قابلتوجهی افزایش داد. همانطور که قبلا ذکر شد، رزوراترول میتواند با مهار پاسخ التهابی پس از SCI به اثرات محافظت کننده عصبی دست یابد (38). یک محیط پیش التهابی که با سایتوکاین های التهابی نظیر IL-1β مشخص میشود، یکی از ویژگیهای متمایز پاسخ التهابی SCI است. IL-1β در سطوح پایه پایین توسط نورونهای سیستم عصبی مرکزی (CNS) و گلیا آزاد می شوند تا ارتباط سلولی طبیعی را ایجاد کنند (9). سطوح افزایش یافته IL-1β که پس از SCI رخ میدهد باعث افزایش نفوذپذیری عروقی، التهاب و افزایش انتشار سایتوکاین می شود و نشان داده شده است که این تلاقی رویدادها باعث القای آپوپتوز الیگودندروسیت و نورون می شود (40, 26). IL-1β ماکروفاژها را از طریق فعالسازی سلولهای اندوتلیال به محل التهاب جذب میکنند. از طرف دیگر IL-1β بیش از حد به دنبال SCI آسیب بیشتری به دلیل اثرات آن بر کلیرانس گلوتامات ایجاد می کند. گلوتامات یک انتقال دهنده عصبی تحریکی در CNS است و عمدتاً توسط آستروسیتها از غشای خارج سلولی پاک میشود (41). گلوتامات اضافی باعث سمیت عصبی می شود (42). پاکسازی گلوتامات توسط آستروسیت به وسیله IL-1β اضافی و ROS مسدود میشود (43). علاوه بر این، نشان داده شده است که درمان IL-10 در یک مدل SCI باعث کاهش سطوح اثرات مضر مرتبط با TNF و IL-1β اضافی میشود (8). بنابراین با وجود اینکه تغییری در سطح IL-10 نخاعی مشاهده نشد ولی با کاهش سطح IL-1β نخاعی در موش¬های مبتلا به SCI می تواند باعث کاهش شدت آسیبهای ثانویه در بافت نخاعی شود.
نتیجهگیری
نتایج تحقیق حاضر نشان دهنده کاهش سطح IL-1β نخاعی در اثر تمرین ورزشی هوازی همراه با مصرف مکمل رزوراترول در موش¬های مبتلا به SCI بود. بنابراین بهنظر میرسد تمرین هوازی در کنار مصرف رزوراترول می¬تواند تأثیرات مثبتی بر التهاب ناحیه آسیب دیده داشته باشد و از عوارض جانبی و آسیب¬های ثانویه SCI در نخاع این آزمودنی-ها جلوگیری نماید.
سپاسگزاری
این مقاله مستخرج از پایاننامه کارشناسی ارشد دانشگاه آزاد اسلامی واحد بجنورد میباشد، بر این اساس، از تمامی کسانی که ما را در انجام این پژوهش یاری کردند، کمال تشکر و قدردانی را داریم
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
لازم به توضیح است تمام مراحل تحقیق در کار گروه اخلاق در پژوهش پژوهشگاه تربیت بدنی مورد پذیرش قرار گرفت (کد اخلاق SSRI.REC-2308-2383).
مشارکت نویسندگان
دکتر علی یعقوبی در ارائه ایده، طراحی مطالعه و تجزیه و تحلیل دادهها و آقای محمد رعنایی در اجرای پروتکل تحقیق و جمعآوری دادهها مشارکت داشتهاند و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
آسیب طناب نخاعی (SCI spinal cord injury) یک آسیب تروماتیک به نخاع است که باعث آسیب به اعصاب، عضلات و بافت اطراف نخاع میشود. ای عارضه بر اثر حوادث جادهای و یا حوادث قهری بهوجود میآید و میزان ابتلا به آن هر ساله در حال افزایش است (1). بلافاصله پس از SCI، بیماران شرایط تهدید کننده زندگی را تجربه میکنند. صدمات نخاعی باعث ایجاد نقص دائمی عصبی حرکتی و خودکار میشوند. این آسیبها بر عملکردهای تنفسی مرکزی، قلبی عروقی، کلیوی و ادراری از طریق تعدیل سیستم عصبی سمپاتیک تأثیر میگذارند (3, 2). آسیب اولیه به طناب نخاعی، آسیب ثانویه را در پی دارد که باعث آسیب شیمیایی و مکانیکی بیشتر به بافت¬های ستون فقرات میشود (4). آسیب ثانویه در عرض چند دقیقه پس از آسیب اولیه شروع میشود و برای هفتهها یا ماهها ادامه مییابد و باعث آسیب تدریجی بافت نخاع اطراف محل ضایعه میشود. مفهوم آسیب ثانویه برای اولین بار توسط آلن Allen در سال 1911 معرفی شد. او در حین مطالعه SCI در سگها، مشاهده کرد که حذف هماتومیلیا پس از سانحه، باعث بهبود نتیجه عصبی در سگ میشود. او فرض کرد که وجود برخی عوامل بیوشیمیایی در ضایعه هموراژیک باعث آسیب بیشتر به نخاع میشود (5). نشان داده شده است که این آسیب شیمیایی و مکانیکی بیشتر به بافتهای ستون فقرات به دلیل تجمع بالای کلسیم در سلولها و افزایش غلظت اکسیژن فعال و سطح گلوتامات، منجر به تجمع انتقال دهندههای عصبی خواهد شد. این موارد به اسید نوکلئیک، پروتئینها و فسفولیپیدهای زیرین آسیب میرساند و منجر به اختلال عملکرد عصبی میشود. این پدیده همچنین با انتشار سایتوکاینهای التهابی پس از 6 تا 12 ساعت پس از آسیب همراه است. این نفوذ سلولهای ایمنی و سایتوکاینهای التهابی باعث التهاب نورونها میشود (4).
در این ارتباط نشان داده شده است که پس از آسیب نخاعی، بیان عوامل پیش التهابی بهطور قابلتوجهی افزایش یافته و شرایط بافتی به سمت التهابی نامتعادل میشود. عدم تعادل ریزمحیط التهابی پس از آسیب نخاعی میتواند آسیب نخاعی ثانویه را تشدید کند و ترمیم آن را مختل کند (6). بیان شده است که پس از SCI، آسیب فوری و به دنبال آن مجموعهای از پاسخهای سلولی و مولکولی وجود دارد که منجر به یک بافت زخم متراکم در بافت گلیال میشود (7). این فرآیند التهابی منجر به آپوپتوز عصبی، افزایش حجم ضایعه و کاهش بهبود عملکرد میشود (8). در طی چند ساعت تا روزهای بعد از SCI، آسیب بافتی میتواند بسیار متنوع است و کنترل التهاب نقش مهمی در کنترل این آسیب¬های بافتی بر عهده دارد (9). التهاب پاتوفیزیولوژیک با افزایش تولید سایتوکاین های التهابی و سایر واسطههای التهابی کلیدی، از جمله اینترلوکین -1 بتا (IL-1β Interleukin-1 beta)، که یک سایتوکاین پیش التهابی قوی است، رخ میدهد. غلظتهای بالاتر IL-1β در مایع مغزی نخاعی در اثر SCI گزارش شده است (10). بیان شده است که میکروگلیاهای فعال شده در نخاع آسیب دیده، سایتوکاینهای پیش التهابی مختلفی از جمله IL-1β، عامل نکروز تومور آلفا (TNF-α Tumor necrosis factor α)، پروتئازها و سایر عوامل سیتوتوکسیک تولید میکنند. تزریق آنتاگونیستهای IL-1β 72 ساعت پس از SCI در موشها بهطور قابلتوجهی آپوپتوز ناشی از آسیب را کاهش داد، که نشان میدهد بیان اولیه IL-1β مضر است (11). اینترلوکین 10 (IL-10 Interluekine-10) یک سایتوکاین ضد التهابی میباشد و عنوان شده است که درمان SCI با این سایتوکاین ضد التهابی، نقش محافظت کننده عصبی ایفا میکند (12)، حمایت تغذیهای از نورونها را فراهم میکند، از التهاب ثانویه مضر، محافظت میکند (8) و در درمانهای ترکیبی مفید است (7). علاوه بر این بهطور تجربی نشان داده شده است که IL-10 حجم ضایعه را کاهش میدهد (12, 7)، تاخیر و کاهش درد نوروپاتیک (12) و بهبود عملکرد در موشهای مدل SCI ایجاد میکند (8). تمرین ورزشی و استفاده از آنتی اکسیدانهای طبیعی بهعنوان روش درمانی جایگزین برای برخی آسیبهای عصبی از جمله SCI استفاده میشود (13). در این ارتباط تمرینات ورزشی، به عنوان یک استراتژی غیردارویی جهت کاهش عوارض ناشی از آسیب نخاعی مورد توجه پژوهشگران قرار گرفته است. برخی مطالعات نشان دادهاند که فعالیتهای هوازی باعث کاهش درد نوروپاتیک و کاهش شاخصهای پیش التهابی از جمله IL-1β بعد از آسیب نخاعی میشود (14). تمرین هوازی بهعنوان یکی از درمانهای حمایتی نیز در این بیماران در نظر گرفته میشود. ارتباط بین تمرین هوازی و پاسخ ایمنی همیشه موضوع داغ جامعه ورزش و پزشکی بوده است. ورزش متوسط می تواند سیستم ایمنی بدن را فعال کند. بر اساس برخی از مطالعات، تمرین هوازی میتواند با تنظیم بیان سایتوکاینهایی از جمله IL-10 و آنتیاکسیدانها اثرات ضد التهابی داشته باشد (15). از طرف دیگر رزوراترول (۳، ۴،۵ -تری هیدروکسی ترانس- استیلبن) یک پلی فنل قوی و ماده بیولوژیک فعال در برخی دانهها سبزیجات و میوهها به خصوص توت و انگور قرمز است که سبب افزایش طول عمر سلولها میگردد. محققین تأثیر این پلی فنول را به اثر آنتیاکسیدانی آن مرتبط میدانند. رزوراترول نوعی فیتوآلکسین است که توسط برخی اسپرماتوفیت ها در پاسخ به آسیب تولید میشود و در کاهش استرس اکسایشی و تجمع پلاکت نقش دارد (16). مصرف مکمل رزوراترول با توجه به نقش آنتیاکسیدانی و ضد التهابی در این بیماران مورد تأکید قرار گرفته است. رزوراترول طیف گستردهای از فعالیتهای زیستی، از جمله آنتیاکسیدان، ضد التهاب، ضد سرطان، ضد پیری و خواص محافظتی عصبی را نشان میدهد. رزوراترول یک جزء بالقوه در تعدیل التهاب عصبی است که در برخی اختلالات عصبی تأثیرگذار است (17). برخی مطالعات نیز، نقش مکمل رزوراترول در تنظیم هموستاز گلوکز، التهاب و استرس اکسایشی را در مقایسه با دارونما نشان داده اند. مداخلات با رزوراترول میتواند با توجه به شرایط بیمار، از نظر "دوز / زمان" سفارشی شود (18). به دلیل آسیبشناسی فیزیکی پیچیده SCI یعنی آسیب اولیه و به دنبال آن گسترش آسیب ثانویه بافتی، در حال حاضر درمانی قطعی برای ترمیم آسیب نخاعی شناسایی نشده است. ارزیابی تحقیقات عملکردی در مراحل حاد SCI در انسان غیرممکن است. بنابراین، مدلهای پیش بالینی برای درک فیزیولوژی سلامت بعد از آسیب نخاعی ضروری هستند. ازآنجاکه یکی از اهداف در درمان SCI، مهار آسیب ثانویه در ناحیه آسیب و ارتقاء بهبود عملکرد اندام پایینتر از آن میباشد؛ و با توجه به نقش التهاب و فشار اکسایشی در پاتوژنز SCI، مهار فشار اکسایشی و التهاب میتواند یک استراتژی مناسب برای کاهش عوارض ناشی از SCI باشد (19). بنابراین، هدف از تحقیق حاضر بررسی تأثیر تمرین هوازی همراه با مکمل یاری رزوراترول بر سطح IL-1β و IL-10 نخاعی در موشهای مبتلا به SCI بود.
روش بررسی
تحقیق حاضر از نوع تجربی میباشد که با طرح پیش آزمون و پس آزمون با یک گروه کنترل و چهار گروه تجربی انجام شد. در این تحقیق اطلاعات مورد نظر بر اساس اندازهگیری متغیرهای وابسته تحقیق، از طریق پس آزمون جمعآوری شد. بر این اساس تعداد 45 سر رت نر بالغ نژاد ویستار با سن هشت هفته و با دامنه وزنی 185 تا 200 گرم استفاده شد که از آزمایشگاه حیوانات دانشگاه علوم پزشکی خراسان شمالی خریداری شده بوند. حیوانات پس از انتقال به محیط تحقیق و آشنایی یک هفته¬ای با محیط جدید و آشنایی با فعالیت روی نوارگردان، ابتدا بر اساس وزن و به صورت تصادفی گروه بندی شده و قفسهها به صورت تصادفی نامگذاری گردیدند. 9 سر موش به عنوان گروه کنترل جدا شدند. سایر موشها، پس از ایجاد جراحی و ایجاد آسیب نخاعی در 4 گروه شامل ۱- کنترل، ۲- رزوراترول، ۳- تمرین و ۴- رزوراترول+تمرین. قرار داده شدند. پس از رسیدن وزن موشها به 225 گرم، حیوانات با استفاده از مخلوط کتامین/ زایلازین بیش هوش شدند، سپس موهای پشت آن به آرامی تراشیده شد و محل مورد نظر ضدعفونی گردید. یک برش در خط وسط و روی برجستگیهای مهرهای ایجاد شد، سپس عضلات و لامینای مهره T9 بدون آسیب رساندن به سخت شامه برداشته شد، در ادامه SCI با انداختن وزنه ده گرمی از ارتفاع ۲۵ میلیمتری بر روی نخاع در قطعه T10 ایجاد گردید (20). مقیاس باسو بتی برسنان (BBB Basso-Beattie-Bresnahan) برای ارزیابی عملکرد عصبی مورد استفاده قرار گرفت. مقیاس BBB یک مقیاس 21 امتیازی است که در آن امتیاز 1 نشان دهنده عدم حرکت اندام عقبی تا امتیاز 21 که نشان دهنده عملکرد طبیعی اندام عقبی است، امتیاز بندی میشود. امتیاز دهی این مقیاس بر جنبههای عملکردی اندام عقبی مانند حمایت از وزن، توانایی قدم زدن، هماهنگی و فاصله انگشتان پا نظارت دارد (21, 20). امتیازدهی به موشهای SCI توسط متخصص بیطرف انجام شد. مکمل رزوراترول (تهیه شده از شرکت سیگما) در اتانول 50 درصد حل شد. سپس بهصورت روزانه در محلولی متشکل از 0/9 درصد نمک حاوی 20 درصد هیدروکسی پروپیل h-cyclodextrin (شرکت سیگما) حل شد. این محلول با دوز 10 میلیگرم به ازای هر کیلوگرم بهصورت درون صفاقی، به صورت درون صفاقی و روزانه تزریق شد. به موشهای سایر گروهها به مقدار مشابه سالین تزریق شد (22). گروههای تمرینی پروتکل تمرینی را از طریق تردمیل به کمک سیستم حمایت وزن بدن دنبال کردند. قبل از SCI، همه موشها دو جلسه نیم ساعته در معرض محیط تردمیل قرار گرفتند. برای پیشگیری از آبشارهای آسیب ثانویه، برنامه تمرینی در ۱۴ روز پس از آسیب و انجام آزمون BBB، آغاز شد. گروههای تمرینی ابتدا با سرعت 10 متر در دقیقه و به مدت ۲۰ دقیقه روی تردمیل با جلیقه حمایتی تحت تمرین قرار گرفتند. در طول ۷ روز تمرینی که قبلاً در مطالعات توضیح داده شده است، زمان جلسه به تدریج از ۲۰ دقیقه به هدف ۵۸ دقیقه و شدت تمرین به 20 متر در دقیقه افزایش یافت (23). کل دوره تمرین 4 هفته بود. موشها 48 ساعت پس از آخرین جلسه تمرین بیهوش شدند. بیهوشی با استفاده از تزریق درون صفاقی ترکیبی از داروی کتامین (60 تا 80 میلیگرم بهازای هر کیلوگرم وزن بدن) و زایلازین (هشت میلیگرم بهازای هر کیلوگرم وزن بدن) انجام شد. نمونه نخاعی آزمودنیها پس از پاکسازی پوست و جدا کردن مهرهها در قسمت آسیب دیده به دقت جدا شده و پس از برداشتن و پاکسازی از خون به درون کرایوتیوبهای کدگذاری شده منتقل و سپس با استفاده از ازت مایع منجمد شده و در ادامه در یخچال 70- درجه سانتیگراد نگهداری شدند. سطح IL-1β و IL-10 نخاعی با استفاده از کیت های آزمایشگاهی، به روش الایزا و طبق دستورالعمل شرکت سازنده اندازهگیری شد. پس از جمعآوری دادههای خام، به منظور بررسی نرمال بودن دادهها از آزمون شاپیرو-ویلک و برای بررسی فرض برابری واریانسها، از آزمون لون استفاده شد. پس از مشخص شدن طبیعی بودن توزیع دادهها و برقراری فرض برابری واریانسها، به منظور تجزیه و تحلیل آماری دادهها و مقایسه بین گروهها از آزمون آنالیز واریانس یک طرفه One-way ANOVAو آزمون تعقیبی LSD استفاده شد. تمام محاسبات آماری با استفاده از نرمافزار آماری version 16 SPSS در سطح معناداری P˂ 0/05 صورت گرفت. جهت رسم نمودارها از نرمافزار اکسل نسخه 2013 استفاده گردید.
نتایج
جدول1: نتایج آزمون *BBB در پیش آزمون و پس آزمون گروههای تحقیق

BBB: Basso-Beattie-Bresnahan*
جدول 2: مقایسه سطوح IL-1β و IL-10 نخاع در گروههای تحقیق و یافتههای آزمون آنالیز واریانس یک طرفه

* نشانه تفاوت معنیدار بین گروههای تحقیق
بحث
هدف از تحقیق حاضر بررسی اثر تمرین هوازی همراه با مصرف مکمل رزوراترول بر سطح IL-1β و IL-10 نخاعی موش های مبتلا به SCI بود. نتایج تحقیق حاضر نشان داد که سطح IL-1β نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری بالاتر بود همچنین سطح IL-10 نخاعی در گروه کنترل نسبت به گروه سالم به طور معناداری پایین تر بود. همانطور که عنوان شد SCI شامل آسیب اولیه و آسیب ثانویه است. آسیب اولیه مربوط به آسیب تروماتیک اولیه است و در اثر ضربه مخرب ایجاد میشود که منجر به آسیب مکانیکی فوری و غیرقابل برگشت میشود. آسیب اولیه باعث ایجاد یک آبشار پاتوفیزیولوژیکی، از جمله مرحله آسیب ثانویه میشود. آسیب ثانویه چند دقیقه پس از ترومای اولیه شروع میشود و به سه مرحله حاد، تحت حاد و مزمن تقسیم میشود (5, 4). مرحله آسیب ثانویه حاد با آسیب عروقی، سمیت تحریکی، عدم تعادل یونی، آسیب اکسایشی، پاسخ التهابی و فعال شدن سلول های ایمنی مشخص می شود. آسیب ثانویه حاد منجر به مرحله آسیب ثانویه تحت حاد می شود که با آپوپتوز عصبی، دژنراسیون والرین، فعال شدن واکنشی آستروسیت، بازسازی آکسون و تشکیل اسکار گلیال مشخص می شود. آسیب ثانویه تحت حاد منجر به آسیب ثانویه مزمن می شود که با ایجاد کیست ها، ضعف آکسون و بلوغ اسکار گلیال مشخص می شود (5). سیستم ایمنی در تعادل پویا بین عوامل التهابی (از جمله IL-1β) که با عوامل ضد التهابی (از جمله IL-10) متعادل میشوند، قرار دارد (24). سیستم ایمنی برای مقابله با التهاب افزایش یافته در اثر SCI (IL-1β)، شروع به ترشح سایتوکاین های ضد التهابی از جمله IL-10 میکند. تعادل پویای سیستم ایمنی و پاسخ التهابی عصبی برای آسیب ثانویه مهم است که منجر به مرگ سلولی و تخریب بافت در مراحل تحت حاد و مزمن می شود و افزایش شدت آسیب را در پی دارند (25). در این ارتباط عنوان شده است که حوادث متعاقب SCI به وسیله حضور سلول های التهابی و سایتوکاینهای پیش التهابی تشدید میشود. پاسخهای التهابی منجر به آپوپتوز نورونها و الیگودندروسیتها و نیز تشکیل بافت جوشگاه و در نهایت کاهش عملکرد عصبی میشوند (26). عنوان شده است که بلافاصله پس از SCI، نوتروفیل ها و میکروگلیاها فعال میشوند و تعدادی سایتوکاین IL-1β ترشح می کنند. در این راستا کودا kouda و همکاران در سال 2012 نشان دادند که سطح پایه عوامل التهابی در افراد مبتلا به SCI بالاتر از افراد سالم است (27). از طرف دیگر عنوان شده است که هدف اصلی التهاب، که پاسخ بدن به محرکهای خارجی است، حفظ هموستاز بدن و محافظت از بدن در برابر آسیب محرکهای نامطلوب خارجی است (28). با این حال، مطالعات نشان داده اند که پاسخ التهابی یک "شمشیر دولبه" پس از SCI است. تا حدودی، پاسخ التهابی پس از SCI میتواند به حفظ ثبات محیط داخلی کمک کند. از سوی دیگر، پاسخ التهابی بیش از حد میتواند آسیب بیشتر را تشدید کند (29, 26). پس از SCI، با از بین رفتن نفوذپذیری سد خونی نخاعی، کموکاینهایی که توسط بافت نکروزه و آپوپتوز آزاد میشوند، میتوانند به تجمع کموتاکتیک سلولهای ایمنی کمک کنند و سپس باعث شروع پاسخ التهابی شوند (30). سلولهای ایمنی میتوانند سلولها و بافتهای نکروزه را ببلعند. با این حال، تجمع سلولهای ایمنی و آزاد شدن عوامل التهابی پس از SCI منجر به ایجاد یک پاسخ التهابی بارزتر میشود (31). این افزایش IL-1β نخاعی که در تحقیق حاضر مشاهده شد نیز میتواند در راستای جلوگیری از آسیب بیشتر در سیستم عصبی باشد. یکی از مهمترین یافتههای تحقیق حاضر حاکی از کاهش سطح IL-1β نخاعی در موشهای مبتلا به SCI در اثر تمرین هوازی و عدم تأثیر آن بر سطح IL-10 نخاعی بود. تمرینات ورزشی در موارد مختلف از جمله قدرت عضلانی، آمادگی قلبی عروقی، تحرک مفاصل، انبساط عضلانی، تحلیل استخوان، درد و اسپاستیسیته در گیر میباشد و ممکن است توانایی انجام فعالیتها را بدون کمک مراقب یا انجام وظایف با استفاده از روشهای جبرانی با یا بدون تجهیزات بهبود بخشد (32)؛ اما تأثیر آن بر عوامل التهابی و ضد التهابی طناب نخاعی در آزمودنیهای مبتلا به SCI کمتر مورد بررسی قرار گرفته است. روزتی-رودریگوئز Rosety-Rodriguezو همکاران در سال 2014 نشان دادند که التهاب سیستمیک متعاقب 12 هفته تمرین هوازی بالاتنه با شدت 50 تا 65 درصد ضربان قلب ذخیره، در افراد مبتلا به SCI، بهطور معناداری کاهش یافت (33). در تحقیق دیگری نیفکز-زونولد Neefkes-Zonneveld و همکاران در سال 2015 در مقالهای مروری تأثیر فعالیت بدنی طولانیمدت و فعالیت ورزشی حاد را بر عوامل التهابی در افراد مبتلا به SCI مورد بررسی قرار دادند. آنها عنوان داشتند که التهاب سیستمیک منشا بسیاری از بیماریهای ناشی از SCI، همچون بیماریهای قلبی و عروقی، دیابت نوع 2 و سایر بیماریهای التهابی میباشد. فعالیت بدنی طولانیمدت کاهش سایتوکاینهای التهابی و همچنین بهبود عوامل ضد التهابی را در پی دارد (34). از جمله دلایل تفاوت نتایج تحقیق فوق با مطالعه حاضر نوع بافت مورد بررسی میباشد. چرا که در تحقیق نیفکز-زونولد و همکاران، عوامل ضد التهابی در جریان خون مورد بررسی قرار گرفت ولی در تحقیق حاضر سطح آن در بافت نخاعی بررسی شد. در این راستا عنوان شده است که فعالیت بدنی منظم با تعداد بیشتری از سلولهای T تنظیمی در گردش خون همراه است که سایتوکاینهای ضد التهابی از جمله IL-10 را آزاد میکند (35). همچنین پیشنهاد شده است که شدت ورزش در تنظیم افزایش مولکولهای التهابی مهم است. در واقع، تمرین ورزشی در دامنه حداکثر (تست افزایشی دوچرخه تا زمان خستگی) باعث ایجاد یک پاسخ التهابی با لکوسیتوز و افزایش سطح سایتوکاینهای التهابی (IL-6، ماتریکس متالوپروتئاز-9 Matrix metalloproteinase-9، میلوپراکسیداز Myeloperoxidase) میشود (36). همچنین اوماموتو و همکاران در سال 2011 عنوان داشتند که سطح پلاسمایی IL-6 به عنوان یک عامل پیش التهابی در اثر فعالیت ورزشی شدید یک جلسه ای افزایش داشت (37). نتایج تحقیق حاضر نشان داد که مصرف مکمل رزوراترول به مدت 4 هفته تأثیری بر سطح IL-1β و IL-10 نخاعی موش های مبتلا به SCI نداشت. یکی از مهمترین نقش های دارویی رزوراترول از طریق اثرات ضد التهابی آن اعمال میشود (38). رزوراترول به دلیل اثرات ضد التهابی، ضد اکسیداسیون، ضد تومور و سایر اثرات دارویی در سال های اخیر به طور گسترده مورد مطالعه قرار گرفته است (39). همراستا با نتایج تحقیق حاضر ژائو zhao و همکاران در سال 2021 نشان دادند که مصرف مکمل رزوراترول به مدت 28 روز کاهش التهاب را در موشهای مبتلا به SCI را نشان داد. درمان با رزوراترول هم عملکرد حرکتی و هم بقای نورونهای حرکتی را بهبود میبخشد، علاوه بر آن نشان داده شده است که اندازه ضایعه را در موشها پس از SCI کاهش میدهد. این بیشتر اثرات محافظتکننده عصبی رزوراترول را بعد از SCI تایید میکند. علاوه بر این، درمان رزوراترول بهطور قابلتوجهی بیان پروتئینهای مرتبط با التهاب مانند TNF-α، IL-1β و IL-6 را در مقایسه با گروه حامل کاهش داد. از سوی دیگر، درمان با رزوراترول نیز بیان BDNF را بهطور قابلتوجهی افزایش داد. همانطور که قبلا ذکر شد، رزوراترول میتواند با مهار پاسخ التهابی پس از SCI به اثرات محافظت کننده عصبی دست یابد (38). یک محیط پیش التهابی که با سایتوکاین های التهابی نظیر IL-1β مشخص میشود، یکی از ویژگیهای متمایز پاسخ التهابی SCI است. IL-1β در سطوح پایه پایین توسط نورونهای سیستم عصبی مرکزی (CNS) و گلیا آزاد می شوند تا ارتباط سلولی طبیعی را ایجاد کنند (9). سطوح افزایش یافته IL-1β که پس از SCI رخ میدهد باعث افزایش نفوذپذیری عروقی، التهاب و افزایش انتشار سایتوکاین می شود و نشان داده شده است که این تلاقی رویدادها باعث القای آپوپتوز الیگودندروسیت و نورون می شود (40, 26). IL-1β ماکروفاژها را از طریق فعالسازی سلولهای اندوتلیال به محل التهاب جذب میکنند. از طرف دیگر IL-1β بیش از حد به دنبال SCI آسیب بیشتری به دلیل اثرات آن بر کلیرانس گلوتامات ایجاد می کند. گلوتامات یک انتقال دهنده عصبی تحریکی در CNS است و عمدتاً توسط آستروسیتها از غشای خارج سلولی پاک میشود (41). گلوتامات اضافی باعث سمیت عصبی می شود (42). پاکسازی گلوتامات توسط آستروسیت به وسیله IL-1β اضافی و ROS مسدود میشود (43). علاوه بر این، نشان داده شده است که درمان IL-10 در یک مدل SCI باعث کاهش سطوح اثرات مضر مرتبط با TNF و IL-1β اضافی میشود (8). بنابراین با وجود اینکه تغییری در سطح IL-10 نخاعی مشاهده نشد ولی با کاهش سطح IL-1β نخاعی در موش¬های مبتلا به SCI می تواند باعث کاهش شدت آسیبهای ثانویه در بافت نخاعی شود.
نتیجهگیری
نتایج تحقیق حاضر نشان دهنده کاهش سطح IL-1β نخاعی در اثر تمرین ورزشی هوازی همراه با مصرف مکمل رزوراترول در موش¬های مبتلا به SCI بود. بنابراین بهنظر میرسد تمرین هوازی در کنار مصرف رزوراترول می¬تواند تأثیرات مثبتی بر التهاب ناحیه آسیب دیده داشته باشد و از عوارض جانبی و آسیب¬های ثانویه SCI در نخاع این آزمودنی-ها جلوگیری نماید.
سپاسگزاری
این مقاله مستخرج از پایاننامه کارشناسی ارشد دانشگاه آزاد اسلامی واحد بجنورد میباشد، بر این اساس، از تمامی کسانی که ما را در انجام این پژوهش یاری کردند، کمال تشکر و قدردانی را داریم
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
لازم به توضیح است تمام مراحل تحقیق در کار گروه اخلاق در پژوهش پژوهشگاه تربیت بدنی مورد پذیرش قرار گرفت (کد اخلاق SSRI.REC-2308-2383).
مشارکت نویسندگان
دکتر علی یعقوبی در ارائه ایده، طراحی مطالعه و تجزیه و تحلیل دادهها و آقای محمد رعنایی در اجرای پروتکل تحقیق و جمعآوری دادهها مشارکت داشتهاند و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Myatich A, Haque A, Sole C, Banik NL. Clemastine in Remyelination and Protection of Neurons and Skeletal Muscle after Spinal Cord Injury. Neural Regen Res 2023; 18(5): 940-6.
2- Michel-Flutot P, Lane MA, Lepore AC, Vinit S. Therapeutic Strategies Targeting Respiratory Recovery after Spinal Cord Injury: from Preclinical Development to Clinical Translation. Cells 2023; 12(11): 1519.
3- Sweis R, Biller J. Systemic Complications of Spinal Cord Injury. Curr Neurol Neurosci Rep 2017; 17(2): 1-8.
4- Anjum A, Yazid MDi, Fauzi Daud M, Idris J, Ng AMH, Selvi Naicker A, et al. Spinal Cord Injury: Pathophysiology, Multimolecular Interactions, and Underlying Recovery Mechanisms. Int J Mol Sci 2020; 21(20): 7533.
5- Alizadeh A, Dyck SM, Karimi-Abdolrezaee S. Traumatic Spinal Cord Injury: An Overview of Pathophysiology, Models and Acute Injury Mechanisms. Front Neurol 2019; 10: 282.
6- Zhang H, Jiang S, Deng B, Liu G, Bai H, Tao J, et al. Mechanism by Which Tetramethylpyrazine Improves Inflammatory Microenvironment after Spinal Cord Injury in Rats. Chinese J Tiss Eng Res 2023; 27(11): 1701-7.
7- Takami T, Oudega M, Bethea JR, Wood PM, Kleitman N, Bunge MB. Methylprednisolone and Interleukin-10 Reduce Gray Matter Damage in the Contused Fischer Rat Thoracic Spinal Cord but Do Not Improve Functional Outcome. J Neurotraum 2002; 19(5): 653-66.
8- Genovese T, Esposito E, Mazzon E, Di Paola R, Caminiti R, Bramanti P, et al. Absence of Endogenous Interleukin‐10 Enhances Secondary Inflammatory Process after Spinal Cord Compression Injury in Mice. J Neurochem 2009; 108(6): 1360-72.
9- Thompson CD, Zurko JC, Hanna BF, Hellenbrand DJ, Hanna A. The Therapeutic Role of Interleukin-10 after Spinal Cord Injury. J Neurotraum 2013; 30(15): 1311-24.
10- Chen X, Lu D, Liu W, Xie J, Lu Z, Yang H, et al. Therapeutic Effect of Atractylenolide I on Aspergillus Fumigatus Keratitis by Affecting Myd88/NF-Κb Pathway and IL-1β, IL-10 Expression. Cytokine 2023; 162: 156112.
11- Nesic O, Xu G-Y, McAdoo D, Westlund High K, Hulsebosch C, Perez-Polo R. IL-1 Receptor Antagonist Prevents Apoptosis and Caspase-3 Activation after Spinal Cord Injury. J Neurotraum 2001; 18(9): 947-56.
12- Abraham K, McMillen D, Brewer K. The Effects of Endogenous Interleukin-10 on Gray Matter Damage and the Development of Pain Behaviors Following Excitotoxic Spinal Cord Injury in the Mouse. Neurosci 2004; 124(4): 945-52.
13- Coyoy-Salgado A, Segura-Uribe JJ, Guerra-Araiza C, Orozco-Suárez S, Salgado-Ceballos H, Feria-Romero IA, et al. The Importance of Natural Antioxidants in the Treatment of Spinal Cord Injury in Animal Models: An Overview. Oxid Med Cell Long 2019; 2019: 3642491.
14- Kaki A, Nikbakht M, Fathimoghadam H, Habibi A. The Effect Aerobic Exercise on the Level of Expression of Toll-Like Receptor 4 and Inflammatory Mediators in the Sensory Spinal Cord of Male Rats with Diabetic Neuropathic Pain. Jundishapur Sci Med J 2019; 17(5): 503-17.
15- Wu Z, Zhang Z, Zhou Z, Rao S, Li S. Effect of Aerobic Exercise on Lung Regeneration and Inflammation in Mice. Immunobiolgy 2022; 227(6): 152296.
16- Gharib M, Samani K, ZarrinÅbadi Z, Mokhtari M, Heydarian E. Effect of Resveratrol Supplementation on Antioxidant Parameters, Lipids Profile and Several Biochemical Indices in Type 2 Diabetic Patients: A Double-Blind Randomized-Controlled Clinical Trial. Iranian J Nut Sci Food Tech 2018; 12(4): 33-42.
17- Naeini FB, Hassanpour S, Asghari A. Resveratrol Exerts Anxiolytic-Like Effects through Anti-Inflammatory and Antioxidant Activities in Rats Exposed to Chronic Social Isolation. Behav Brain Res 2023; 438: 114201.
18- Santana TM, Ogawa LY, Rogero MM, Barroso LP, de Castro IA. Effect of Resveratrol Supplementation on Biomarkers Associated with Atherosclerosis in Humans. Complemen Ther Clin Pract 2022; 46: 101491.
19- Freyermuth-Trujillo X, Segura-Uribe JJ, Salgado-Ceballos H, Orozco-Barrios CE, Coyoy-Salgado A. Inflammation: A Target for Treatment in Spinal Cord Injury. Cells 2022; 11(17): 2692.
20- Byrnes KR, Fricke ST, Faden AI. Neuropathological Differences Between Rats and Mice after Spinal Cord Injury. J Mag Res Imag 2010; 32(4): 836-46.
21- Basso D, Beattie M, Bresnahan J, Anderson D, Faden A, Gruner J, et al. MASCIS Evaluation of Open Field Locomotor Scores: Effects of Experience and Teamwork on Reliability. J Neurotraum 1996; 13(7): 343-59.
22- Girbovan C, Kent P, Merali Z, Plamondon H. Dose-Related Effects of Chronic Resveratrol Administration on Neurogenesis, Angiogenesis, and Corticosterone Secretion are Associated with Improved Spatial Memory Retention Following Global Cerebral Ischemia. Nut Neurosci 2016; 19(8): 352-68.
23- Alvarez-Mejia L, Morales J, Cruz GJ, Olayo M-G, Olayo R, Díaz-Ruíz A, et al. Functional Recovery in Spinal Cord Injured Rats Using Polypyrrole/Iodine Implants and Treadmill Training. J Mat Sci Mat Med 2015; 26(7): 209.
24- Bolton AE. Biologic Effects and Basic Science of a Novel Immune-Modulation Therapy. Am J Cardiol 2005; 95(11A): 24C-9C.
25- Jin Y, Song Y, Lin J, Liu T, Li G, Lai B, et al. Role of Inflammation in Neurological Damage and Regeneration Following Spinal Cord Injury and Its Therapeutic Implications. Burns Trauma 2023; 11: tkac054.
26- Gashmardi N, Edalatmanesh MA. Cellular and Molecular Mechanisms Involved in Neuroinflammation after Acute Traumatic Spinal Cord Injury. Neurosci J Shefaye Khatam 2019; 7(4): 89-105.
27- Kouda K, Furusawa K, Sugiyama H, Sumiya T, Ito T, Tajima F, et al. Does 20-Min Arm Crank Ergometer Exercise Increase Plasma Interleukin-6 in Individuals with Cervical Spinal Cord Injury? Eur J Appl Physiol 2012; 112(2): 597-604.
28- Kotas ME, Medzhitov R. Homeostasis, Inflammation, and Disease Susceptibility. Cell 2015; 160(5): 816-27.
29- Black LM, Lever JM, Agarwal A. Renal Inflammation and Fibrosis: A Double-Edged Sword. J Histochem Cytochem 2019; 67(9): 663-81.
30- Orr MB, Gensel JC. Spinal Cord Injury Scarring and Inflammation: Therapies Targeting Glial and Inflammatory Responses. Neurotherap 2018; 15(3): 541-53.
31- Gensel JC, Zhang B. Macrophage Activation and Its Role in Repair and Pathology after Spinal Cord Injury. Brain Res 2015; 1619: 1-11.
32- Harvey L, Lin C-W, Glinsky J, De Wolf A. The Effectiveness of Physical Interventions for People with Spinal Cord Injuries: A Systematic Review. Spin Cord 2009; 47(3): 184-95.
33- Rosety-Rodriguez M, Camacho A, Rosety I, Fornieles G, Rosety MA, Diaz AJ, et al. Low-Grade Systemic Inflammation and Leptin Levels Were Improved by Arm Cranking Exercise in Adults with Chronic Spinal Cord Injury. Arch Phys Med Rehab 2014; 95(2): 297-302.
34- Neefkes-Zonneveld CR, Bakkum AJ, Bishop NC, van Tulder MW, Janssen TW. Effect of Long-Term Physical Activity and Acute Exercise on Markers of Systemic Inflammation in Persons with Chronic Spinal Cord Injury: A Systematic Review. Archiv Phys Med Rehab 2015; 96(1): 30-42.
35- Gleeson M, Bishop NC, Stensel DJ, Lindley MR, Mastana SS, Nimmo MA. The Anti-Inflammatory Effects of Exercise: Mechanisms and Implications for the Prevention and Treatment of Disease. Nature Rev Immunol 2011; 11(9): 607-15.
36- Reihmane D, Jurka A, Tretjakovs P. The relationship between maximal exercise‐induced increases in serum IL‐6, MPO and MMP‐9 concentrations. Scand J Immunol 2012; 76(2): 188-92.
37- Umemoto Y, Furusawa K, Kouda K, Sasaki Y, Kanno N, Kojima D, et al. Plasma IL-6 Levels During Arm Exercise in Persons with Spinal Cord Injury. Spinal Cord 2011; 49(12): 1182-7.
38- Zhao H, Mei X, Yang D, Tu G. Resveratrol Inhibits Inflammation after Spinal Cord Injury Via SIRT-1/NF-Κb Signaling Pathway. Neurosci Let 2021; 762: 136151.
39- Salla M, Pandya V, Bhullar KS, Kerek E, Wong YF, Losch R, et al. Resveratrol and Resveratrol-Aspirin Hybrid Compounds as Potent Intestinal Anti-Inflammatory and Anti-Tumor Drugs. Molecules 2020; 25(17): 3849.
40- Lu KT, Wang YW, Yang JT, Yang YL, Chen HI. Effect of Interleukin-1 on Traumatic Brain Injury–Induced Damage to Hippocampal Neurons. J Neurotraum 2005; 22(8): 885-95.
41- Matute C, Domercq M, Sánchez‐Gómez MV. Glutamate‐Mediated Glial Injury: Mechanisms And Clinical Importance. Glia 2006; 53(2): 212-24.
42- Li S, Stys PK. Mechanisms of Ionotropic Glutamate Receptor-Mediated Excitotoxicity in Isolated Spinal Cord White Matter. J Neurosci 2000; 20(3): 1190-8.
43- Takahashi JL, Giuliani F, Power C, Imai Y, Yong VW. Interleukin‐1β Promotes Oligodendrocyte Death Through Glutamate Excitotoxicity. Ann Neurol 2003; 53(5): 588-95.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/9/18 | پذیرش: 1403/3/9 | انتشار: 1403/11/15
دریافت: 1402/9/18 | پذیرش: 1403/3/9 | انتشار: 1403/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







