دوره 32، شماره 2 - ( اردیبهشت 1403 )
جلد 32 شماره 2 صفحات 7540-7525 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Falahnezhad Mojarad A, Amini N, SeyyedAshour S. Effect of Eight Weeks of Intense Interval Training and Self-Obesity on Serum Lipid Peroxidation Status and Adiponectin Gene Expression in Obese Male Wistar Rats. JSSU 2024; 32 (2) :7525-7540
URL: http://jssu.ssu.ac.ir/article-1-6122-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6122-fa.html
فلاحنژاد مجرد امیر، امینی نسترن، سیدعاشور سید مصطفی. اثر هشت هفته تمرین تناوبی شدید و خودچاقی بر وضعیت پراکسیداسیون لیپیدی سرم و بیان ژن آدیپونکتین در رت نر ویستار چاق. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (2) :7525-7540
متن کامل [PDF 1056 kb]
(502 دریافت)
| چکیده (HTML) (1547 مشاهده)
متن کامل: (737 مشاهده)
مقدمه
چاقی Obesity یک مشکل عمده سلامتی و از مهمترین عوامل تاثیرگذار بر کیفیت زندگی و همچنین از مهمترین عوامل ایجاد کننده بیماریهای غیرواگیر (NCDs Non-Communicable Diseases) در سراسر جهان است که بر اساس شواهد تحقیقاتی موجود، به دلیل ارتباط آن با اختلالات متابولیکی و هورمونی مانند اختلال متابولیسم چربی، دیابت نوع دو، بیماریهای قلبی عروقی (CVD Cardiovascular Diseases) و فشارخون بالا، بیماریهای تنفسی، بیماریهای مزمن کلیوی، برخی از انواع سرطانها و همچنین اختلالات عضلانی اسکلتی یکی از مهمترین علل مرگ و میر در جهان میباشد (1-4). مطالعات انجام گرفته در زمینه بررسی سازوکارهای مرتبط با چاقی و بیماریهای مرتبط با آن، افزایش توده چربی را از مهمترین عوامل اثرگذار معرفی کردهاند (5). چاقی از طریق تکثیر آدیپوسیت ها باعث اختلال عملکرد بافت چربی به عنوان یک منبع التهاب میگردد (6،7). بافت چربی انسان به عنوان بزرگترین اندام بدن با عملکرد اندوکرین میباشد (8) که قادر به تولید پروتئینهای فعال بیولوژیکی است که آدیپوسایتوکین یا آدیپوکاین نام دارد (9). آدیپوکایــنهــا شــامل تعــداد زیــادی واســطههــای پیــشالتهابــی از جملــه عامــل نکــروز دهنــده تومــور آلفــا Tumor necrosis factor alpha (TNF-α)، اینترلوکیــن-6 Interleukin 6 (IL-6) رزیســتین Resistin و کمریــن Chemerin مــیباشــند کــه ســبب گســترش بیماریهــای متابولیکــی میگردنــد و از طرف دیگر تعـدادی از ادیپوکاینهایی که از بافت چربی ترشح میشوند به عنوان واسـطههـای ضـد التهابـی شناخته می شوند از جملـه آپلیـن Apelin و آدیپونکتین Adiponectinکــه میتوانــد در برابــر بیمــاری التهابــی، عملکــرد محافظتــی داشــته باشــند (10) و همچنین از دیگر ادیپوکاینها میتوان به پروتئین 4 متصل شونده به رتینول (RBP4 Retinol binding protein-4)، ویسفاتین Visfatinو امنتین Omentin نیز اشاره کرد. در افراد چاق، افزایش میزان چربی احشایی بدن از طریق عدم تعادل و تولید غیرطبیعی آدیپوکاینها بر بافت چربی همچنین بر سایر بافتها همچون کبد و در نهایت روی سلامتی اثر میگذارد (10،11). آدیپونکتین (که همچنینAcrp30 ، AdipoQ ، GBP-28، APM1، نامیده میشود (12) هورمون پپتیدی با 244 اسید آمینه (13) و وزن 30 کیلودالتون است (14) که در سال 1990 کشف شد (15). در انسان توسط ژن AdipoQ که روی بازوی 3q27 کروموزوم 17 قرار دارد کدگذاری میشود (16،17) و از بافت چربی ترشح می شود. این سایتوکاین به سه شکل آدیپونکتین با وزن مولکولی بالا، متوسط و پایین در خون وجود دارد (18) و 0/01 کل پروتئینهای پلاسما را شامل میشود و غلظت پلاسمایی آن بین 2 تا 20 میکروگرم بر میلیلیتر میباشد (15،19). آدیپونکتین در پلاسما به سه فرم پلیمر، هگزامر و مولتیمر گردش میکند که به نظر میرسد مولتیمر فرم فعالتر آن است (20). سطوح سرمی آدیپونکتین و میزان بیان ژن این هورمون نه تنها در افراد با رژیم غذایی پر چرب کاهش مییابد بلکه در بیماری قلب و عروق و چندین اختلال متابولیکی شامل چاقی، افزایش نمایه توده بدنی، اختلال در نیمرخ لپیدی، وضعیت التهابی، مقاومت به انسولین (IR Insulin resistance) و دیابــت نوع 2 کاهــــش مییابد (24-21، 10). به نظر میرسد کاهش سطوح سرمی آدیپونکتین در افراد چاق ناشی از کاهش سنتز آدیپونکتین توسط آدیپوسیتها به دلیل وجود التهاب در آنها میباشد (25). هنگامی که قدرت این هورمون همراه با چاقی کاهش مییابد شرایطیکه به عنوان هیپو آدیپونکتینما شناخته میشود، پیش می آید (26). نتایج مطالعهای بر روی 661 مرد نشان داد که غلظت پلاسمایی پایین آدیپونکتین با چاقی شکمی، غلظت پایین لیپوپروتئین پرچگال (HDL)، هیپرتریگلیسریدمی، غلظت بالای گلوکز ناشتا، پرفشاری خون و سندروم متابولیک مرتبط است و همچنین سطوح بالای آدیپونکتین در افراد سالم با اثرات ضد التهابی، آنتی آتروژنیک و آنتی دیابتیک همراه است (27). همچنین در مطالعه مروری دیگر بر روی بیش از هزار نفر آزمودنی لاغر و چاق به این نتیجه رسیدند که سطوح آدیپونکتین در افراد چاق پایینتر است (28). آدیپونکتین از طریق گیرندههای خود به نام Adipo R1 و Adipo R2 عمل میکند (27). Adipo R1 بهطور عمده در عضله اسکلتی یافت میشود اما در هیپوتالاموس، کبد و دیگر بافتها نیز ظاهر میشود. Adipo R2 معمولاً در بافت کبد یافت میشود اما در دیگر بافتها مانند چربی سفید و عروق نیز دیده میشود (29). نتایج مطالعات پیشین نشان میدهد که چاقی با کاهش بیان گیرندههای Adipo R1وAdipo R2 مرتبط است (30). نتایج یک پژوهش بر روی بیان ژن گیرنده آدیپونکتین نشان داد که بیان ژن گیرنده نوع دو آدیپونکتین بین موشهای چاق و لاغر مشابه بوده، در حالیکه بیان ژن گیرنده نوع یک آدیپونکتین بهطور معنیداری در بافت پانکراس موشهای چاق کاهش یافته بود (31). آدیپونکتین عاملی مؤثر در اکسیداسیون چربی و جذب گلوکز در عضلات اسکلتی و کاهش گلوکز خروجی از کبد است (32). آدیپونکتین، متابولیسم گلوکز را از طریق فعالسازی AMP کیناز تنظیم میکند (33). آدیپونکتین آدیپوکاینی است که نقش محافظتی در بیماریهای کبدی دارد و با ممانعت از ورود اسیدهای چرب به داخل سلولهای کبدی و همچنین با افزایش سوخت و ساز چربی از طریق فرایند اکسیداسیون در سلولهای کبدی از افزایش چربی در سلولهای کبدی جلوگیری میکند (32). نتایج مطالعات پیشین حاکی از آن است که تجویز آدیپونکتین نوترکیب به موشها منجر به افزایش جذب گلوکز، افزایش اسیدهای چرب آزاد پلاسما و اکسیداسیون اسیدهای چرب در عضلات شده و تولید گلوکز کبدی را کاهش میدهد (34). از طرف دیگر مشخص شده است چاقی و تجمع چربی در بدن با التهاب مزمن، تولید گونههای فعال اکسیژن (ROS)، کم اکسیژنی سلولی، افزایش پراکسیداسیون لپیدی و در نتیجه با استرس اکسایشی همراه است (35،36). سوپر اکسید دیسموتاز (SOD) یکی از ارکان مهم سیستم دفاعی آنتیاکسیدان است که تقریباً در تمامی سلولهایی که در معـرض اکسـیژن قـرار دارنـد، وجـود دارد. همچنین مالوندیآلدهید (MDA) یکی از محصولات نهــایی پراکسیداســیون لیپیــدی اســت. گونههای فعال اکسیژن، چربـی را تخریـب میکننـد و باعـث تشـکیل مــالوندیآلدهیــد میشــوند (37،38). ارتبــاط بــین ســطوح آدیپونکتین در گردش خون با شاخصهای استرس اکسیداتیو از جمله MDAو SOD در مطالعات پیشـین نشـان داده شده است (39،40). مطالعات گذشته نشان دادهاند که فعالیت ورزشی منظم را میتوان یک روش درمانی مهم برای التهاب مزمن و بیماریهای مرتبط با چاقی به واسطه نقش آن در تغییر هورمونهای متابولیکی در نظر گرفت (41،42). در سالهای اخیر تمرینات تناوبی شدید (HIIT High-intensity interval training) که با دورههای کوتاه و متناوب فعالیتهای شدید و فواصل استراحت بین آنها شناخته میشوند؛ به علت زمان مورد نیاز اندک تمرین و اثرات مثبتی که دارد توجه محققین را به خود جلب کرده است (43،44). شینگ Shing و همکــارانش در مطالعــه خود افــزایش میــزان آدیپونکتین و کاهش درصد چربی بدن را پـس از چهار هفته تمرین تناوبی با شدت بالا در قایقرانـان ورزشـکار مشاهده کردنـد (45). همچنین لی Lee و همکـارانش افزایش گیرندههای آدیپونکتین، و کاهش درصد چربی بدن را پس از دوازده هفته فعالیـت با 60 تـا 75 درصـد حـداکثر ضـربان قلـب در مردان جوان مشاهده کردنـد (46). در حـالیکـه لگاته Leggate و همکارانش در مطالعهای کاهش میـزان آدیپونکتین را با دو هفته تمرینات تنـاوبی خیلـی شـدید در افـراد دارای اضافه وزن و چاق مشاهده کردنـد (47). تحقیقات نشان دادهاند که سطوح آدیپونکتین تحت تاثیر شدت تمرین بیشتر قرار میگیرد تا حجم تمرین (48). نقیزاده و همکاران در مطالعه خود به این نتیجه رسیدند که 12 هفته تمرین تناوبی شدید موجب تغییر معنادار در پروفایل لپیدی و سطوح آدیپونکتین در مردان چاق مبتلا به دیابت نوع دو با چربی خون بالا شد (49). در ایــن راســتا، برخــی مطالعــات گــزارش کــرده انــد کــه تمرینــات ورزشــی از جمله هــوازی (50) و تناوبــی بــا شــدتهــای مختلــف (51)، میتوانــد ســبب افزایــش آدیپونکتین گــردد. از طـرف دیگــر، عــدم تغییــر معنــیدار آدیپونکتین به دنبال تمریــن هــوازی نیــز گــزارش شــده اســت (52). امروزه تمرین تناوبی با شدت بالا در حال گسترش روزافزون بین افراد ورزشکار و غیر ورزشکار است تا از سلامت جسمی بیشتری بهرهمند شوند و زندگی مطلوبتری را تجربه کنند. بهدست آوردن اطلاعات کافی درباره پاسخهای فیزیولوژیک و اکسیدانی باعث میشود دریچه نوینی به سوی برنامهنویسی تمرین برای این افراد گشوده شود. علیرغم اثرات مثبت گزارش شده برای تمرین ورزشی بر روی میزان آدیپونکتین، نتایج متناقضی در زمینه تاثیر تمرین تناوبی شدید بر روی میزان آدیپونکتین و همچنین فاکتورهای اکسایشی وجود دارد. بنابراین مطالعه حاضر با هدف بررسی تاثیر تمرین تناوبی شدید بر میزان بیان آدیپونکتین و میزان سطوح مالوندیآلدهید و سوپر اکسید دیسموتاز در موشهای چاق به اجرا در آمد.
روش بررسی
پژوهش حاضر از نوع تجربی - بنیادی میباشد. جامعه آماری پژوهش حاضر را موش رت نر نژاد ویستار تشکیل میدهند. با میانگین وزنی 20±220گرم و سن 22 روز که از مرکز حیوانات موسسه پاستور تهیه شد. تعداد نمونهها این مطالعه 24 سر موش می باشد که به صورت تصادفی به 3 گروه کنترل سالم (8 سر)، گروه تمرین تناوبی شدید (8 سر)، گروه مدل (8 سر)تقسیم شدند. همه حیوانات در مدت پژوهش با دسترسی آزاد به آب و بسته های غذایی و طبق چرخه 12ساعت روشنایی/خاموشی و دمای محیطی در محدوده 3 ± 23 درجه سانتیگراد و رطوبت 50 ± 10 نگهداری شدند. شرایط نگهداری و کار با حیوانات براساس توصیههای قوانین حمایت از حیوانات آزمایشگاهی NIH در مرکز تحقیقاتی پاسارگاد (هیستوژن) انجام گرفت. برای القای چاقی گروه کنترل با غذای استاندارد جوندگان تغذیه شد و گروه مدل خودچاقی و گروه خودچاقی به همراه تمرین با رژیم غذای پرچرب تغذیه شدند. غذای پرچرب استفاده شده شامل غذای پایه جوندگان به اضافه 15% چربی حیوانی و 4% کلسترول می باشد که بهصورت نامحدود در اختیار گروهها قرار داده شد. به منظور القاء چاقی، ابتدا حیوانات به مدت 45روز با این ترکیب غذائی به چاقی مبتلا شدند. وزن موشها پس از چاق شدن حدود 380±50 گرم میباشد. سپس در گروههای مطالعاتی طبقهبندی شدند و به مدت 8 هفته تحت درمان در گروههای مختلف آزمایشی قرار گرفتند. به منظور اجرای پروتکل تمرینی که بر گرفته از مطالعات پیشین بود (53) قبل از شروع تمرینات ورزشی، همه موشها تحت یک دوره سازگاری قرار گرفتند تا استرس احتمالی ناشی از تجهیزات را به حداقل برسانند. به این منظور آنها روی تردمیل خاموش قرار گرفتند. سپس تمرینات ورزشی 3 روز در هفته به مدت 8 هفته انجام شد، در حالی که تغذیه رژیمی همچنان به طور همزمان ارائه می شد. پروتکل HIIT از جمالی و همکاران، 2016 اتخاذ شد که شامل فعالیت دویدن روی تردمیل حیوانات بود. این پروتکل شامل 5 دقیقه گرم کردن و 5 دقیقه خنک کردن با سرعت 10 متر در دقیقه بود. پس از گرم کردن بدن، جلسه تمرین با 5 تکرار 30 ثانیهای با سرعت 29 متر در دقیقه به همراه یک دقیقه استراحت فعال آغاز شد. شدت از جمله تکرار و سرعت در هفته افزایش می یابد. استراحت فعال ادامه دویدن روی تردمیل اما با سرعت 13 متر در دقیقه بود. شیب تردمیل صفر بود و در 8 هفته تغییری نداشت. در این مدت گروه کنترل هیچ برنامه تمرینی نداشت. جراحی و بافتبرداری کبد در پایان هفته هشتم 24 ساعت پس از آخرین تمرین صورت گرفت. لازم به ذکر است در این ازمایش تلفات نداشتیم. رتها توسطCO2 آسانکشی شدند سپس خونگیری از قلب رتها انجام شد و با سانتریفیوژ دور 3500دور بر دقیقه بهمدت 15 دقیقه جداسازی شد و سرم خون برای بررسی مارکرهای بیوشیمیایی تهیه گردید. سپس موشها تشریح و بافت کبد جداسازی شد و درون فرمالین 10 % فیکس شد. برای اندازهگیری MDA و SOD از کیت مخصوص اندازهگیری شرکت زلبیو آلمان استفاده شد و آماده سازی سازی محلول ها توسط دستورالعمل شرکت مطابق زیر انجام گرفت.
روش کار تستMDA: ابتدا نمونههای خون در دمای اتاق به مدت 5 تا10دقیقه لخته شد. نمونهها در دور3000- 2000 سانترفیوژ شدند، سوپرناتانت جدا گردید. نمونههای لازم برای تست MDA تا زمان انجام کار در دمای انجماد20-ذخیره شد.
آماده سازی واکنشگرها: پس از آمادهسازی محلولهای مورد نیاز و رسیدن به دمای محیط 50 میکرولیتر از نمونه به هر میکروتیوب اضافه گردید. 50 میکرولیتر از محلول شماره4 به هرمیکروتیوب اضافه گردید. سپس1میلیلیتر از محلول کروموژنیک به هر میکروتیوب اضافه شده و میکروتیوبها به مدت یک ساعت درون آب در حال جوش قرار داده شد .میکروتیوبها درون ظرف یخ خنک گردید و به مدت 10دقیقه با دور 4000 RPM سانتریفیوژ شد. 200 میکرولیتر از محلول رویی صورتی رنگ را به درون چاهک میکروپلیت شده وجذب آن در طول موج 535 نانومتر با دستگاه خوانش الایزا اندازهگیری شد. آنالیز نتایج، براساس منحنی استاندارد بهدست آمده، محاسبه شد.
روش کار SOD: نمونههای لازم برای تست SOD تا زمان انجام کار در دمای انجماد20- ذخیره شد. برای تهیه سرم نمونههای خون در دمای اتاق به مدت 5 تا 10دقیقه لخته شدند. نمونهها در دور3000-2000 سانترفیوژ گردید، سوپرناتانت را جدا شد.
آنالیز نتایج طبق فرمول زیر محاسبه خواهد گردید.
SOD activity(u/Ml)=(Vp-Vc)/(Vp)*60
Vp=ODsample 2min -ODblank 2min
به منظور استخراج RNA بافت کبد قبل از استفاده با استفاده از دستگاه هموژنایزر به طور کامل هموژن شد و سپس مقدار 1 میلی ترایزول به ازای 50الی 100 میلیگرم از بافت اضافه گردید تا لیزات سلولی بهدست آید. به ازای 1 میلیلیتر ترایزول ا ضافه شده در مرحله اول، مقدار 200 میکرولیتر کلروفرم به نمونهها اضافه گردید و 15 ثانیه تکان داده شد تا مخلوط شوند. میکروتیوبها به مدت 15دقیقه در دمای محیط انکوبه شدند و سپس به مدت 15 دقیقه در 12000 RPM و دمای 4درجه سانتیگراد سانتریفیوژ شدند. فاز شفاف رویی حاوی RNA جدا شده و به میکروتیوب دیگری منتقل گردید. به میکروتیوبهای حاوی فاز شفاف رویی ایزوپروپانول اضافه شد ( 500 میکرولیتر به ازای 1 میلیلیتر ترایزول اضافه شده) و دو مرتبه میکروتیوبها سروته شوند invertingتا محتویات میکروتیوبها مخلوط شوند. سپس به مدت 10دقیقه در دمای فریزر -20 انکوبه شدند. به منظور رسوب RNA، نمونهها به مدت 10 دقیقه در 12000 RPM و دمای 4 درجه سانتریفیوژ شدند. محلول رویی تخلیه شده و رسوبها با اتانول 75% شستشو داده شدند به این صورت که مقدار 200 میکرولیتر اتانول 75% به هر میکروتیوب اضافه شده و چند ثانیه ورتکس انجام شد سانتریفیوژ در 7500 RPM به مدت 5 دقیقه در دمای 4 درجه انجام شد. محیط رویی تخلیه و میکروتیوبها به مدت 15 دقیقه بر روی دستمال کاغذی استریل وارونه قرار داده شدند تا رسوب نیمه خشک شده و الکل تبخیر شود. پس از نیمه خشک شدن رسوب، مقدار 20 الی 30میکرولیتر آب DEPCیا عاری از RNase به هر میکروتیوب اضافه شده تا رسوب RNA در آن حل شود. سنتز cDNA با استفاده از کیت Easy cDNA Synthesis Kit شرکت پارس طوس ایران و طبق پروتکل شرکت سازنده انجام شد. نمونههای استخراج شده در دمای-80 درجه برای نگهداری بلند مدت قرار داده شدند. برای کمیسازی مقادیر بیان ژن مورد نظر از فرمول ∆∆ct به توان منفی2- استفاده شد.
پرایمرها
جدول 1: پروتکل تمرینی

جدول 2: آمادهسازی واکنشگرها

جدول 3: روش کار SOD

1.محلولR1 : 13میلی لیتر از ترکیبR1 را با 13میلیلیتر از آب دوبار تقطیر مخلوط گردید.2.آمادهسازی کروموژن: R3 باR4ترکیب گردید.
جدول 4: محتویات نمونه در SOD

جدول 5: پرایمرهای مورد استفاده

توزیع طبیعی دادهها به کمک آزمون شاپیرو-ویلک ارزیابی شد. سپس در ادامه برای مقایسه بین گروهی دادهها پس از پایان مداخله، از تحلیل واریانس یکراهه استفاده شد که در صورت معنادارشدن آن، در ادامه دادهها با استفاده از آزمون تعقیبی توکی در سطح معناداری P < 0.05 مقایسه شدند.
نتایج
به منظور بررسی اثرتمرین تناوبی شدید بر روی فاکتورهای پراکسیداسیون لیپیدی و میزان بیان ژن آدیپونکتین در کبد موشهای چاق ابتدا توزیع طبیعی دادهها به کمک آزمون شاپیرو - ویلک ارزیابی شد. پس از مشخص شدن طبیعی بودن دادهها ( p>0.05) از آزمونANOVA یک طرفه برای بررسی استفاده شد. نتایج آزمونANOVA یک طرفه نشان داد اثر تمرین معنیدار است (P < 0.05). سپس از آزمون تعقیقبی توکی به منظور بر سی بین گروه ها انجام شد. در پایان پژوهش نتایج نشان داد هشت هفته تمرین HIIT میزان سطح SOD سرم را به طور معنا داری افزایش میدهد. اما هشت هفته تمرین HIIT با اینکه موجب کاهش سطح MDA سرم و افزایش میزان پروتئین آدیپونکتین بافت کبد شد اما این تغییرات بین گروه تمرین چاق و کنترل چاق معنادار نبود به ترتیب P=0.4198 و P=0.3209. پس از 8 هفته نتایج نشان داد میزان سطح SOD سرم درموشهای گروه HIIT و موشهای گروه مدل نسبت به گروه کنترل، کاهش معنادار مشاهده شد )به ترتیب P=0.0044 و P<0.0001 (. همچنین این سطح در موش های گروه HIIT نسبت به گروه مدل به طور معنا داری افزایش داشته است (P=0.0007) (جدول 7). سطح MDA سرم درموش های گروه HIIT و موشهای گروه مدل نسبت به گروه کنترل، افزایش معنادار مشاهده شد )به ترتیب P=0.0003 و (P<0.0001 سطح MDA سرم درموش های گروه HIIT نسبت به گروه مدل کاهش معنا دار نداشته است (p=4198) (جدول 6). میزان پروتئین آدیپونکتین بافت کبد درموش های گروه HIIT و موش های گروه مدل نسبت به گروه کنترل، کاهش معنادار مشاهده شد ( هر دو P<0.0001). میزان این پروتئین در بافت کبد موش های گروه HIIT نسبت به گروه مدل افزایش معنا دار نداشته است.(p=0.3209) (جدول 8).
جدول 6: نتایج آزمون انوا یک طرفه برای متغیر MDA
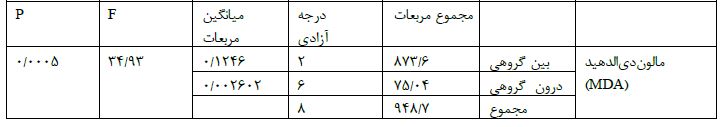
جدول 7: نتایج آزمون انوا یک طرفه برای متغیر SOD

جدول 8: نتایج آزمون انوا یک طرفه برای متغیر آدیپونکتین


شکل1: نمودار تغییرات غلظت متغیرهای پژوهش control: گروه کنترل، model: گروه مدل خودچاقی، Exe: گروه خودچاقی به همراه تمرین ns: عدم معنیداری تغییرات
بحث
یافتههای این تحقیق نشان داد در گروه تمرین افزایش معنادار میزان وضعیت سوپر اکسید دیسموتاز SOD نسبت به گروه خودچاقی مشاهده شد. اما تغییر معناداری در میزان مالوندیآلدهید MDA و میزان بیان ژن آدیپونکتین بافت کبد گروه خودچاقی و گروه تمرین تناوبی مشاهده مشاهده نشد. بر اساس نتایج حاصل از تحقیق حاضر 45 روز استفاده از رژیم غذایی پر چرب باعث تغییر در وضعیت اکسیدانی موش شد بهطوری که میزان SOD کاهش و میزان MDA افزایش معناداری پیدا کردند. همچنین میزان بیان آدیپونکتین بافت کبد بهطور معناداری کاهش پیدا کرد. در مطالعهای همسو دهواری و همکاران نتایج نشان داد رژیم غذایی پر چرب باعث باعث کاهش بیان ژن آدیپونکتین در بافتهای چربی و کبد میشود (54). از طرف دیگر نتایج این پژوهش نشان داد هشت هفته تمرین تناوبی شدید با اینکه باعث افزایش میزان بیان آدیپونکتین بافت کبد میشود اما تاثیر آن بر میزان بیان ژن آیپونکتین بافت کبد موشهای چاق معنیدار نیست. در مطالعهای همسو هوانگ Huang همکارانش با بررسی اثر هشت هفته تمرین هوازی بر آدیپونکتین سرم موشهای دیابتی به این نتیجه رسیدند که تمرین هوازی تاثیر معنیداری بر آدیپونکتین سرم موشهای دیابتی ندارد (55). خدری و همکاران نیز تغییرات معناداری را در میزان آدیپونکتین پلاسما پس از 8 هفته تمرین هوازی با شدت بالا مشاهده نکردند (56). همچنین شینگ Shing و همکاران افزایش میزان آدیپونکتین پس از چهار هفته تمرین تناوبی شدید در قایقرانان را مشاهده کرند (45). اما در مطالعهای ناهمسو با مطالعه حاضر لگاته همکارانش کاهش میـزان آدیپونکتین را با دو هفته تمرینات تنـاوبی خیلـی شـدید در افـراد دارای اضافه وزن و چاق مشاهده کردنـد (47). نتایج مطالعه سبزهپرور و همکاران آلوئهورا منجر به افزایش معنیدار آدیپونکتین و انسولین در موشهای نر دیابتی میشود (57). همچنین نتایج عزیزی و همکاران ورزش تناوبی با شدت بالا (HIIT) بر روی بیان ژن آدیپونکتین تاثیر معناداری دارد و باعث افزایش بیان این ژن میشود (58). علی دلپیشه و همکاران اثر HIIT بر سطوح آدیپونکتین و TNF-α سرم و بافت چربی در موشهای تغذیه شده با رژیم غذایی پرچرب به همراه محلول ساکارز مورد بررسی قرار دادند آنها دریافتند برنامه HIIT میتواند اثرات کاهنده قابلتوجهی بر افزایش وزن و وزن چربی داشته باشد، اما بر سطوح آدیپونکتین و TNF-α در گردش و ذخیره چربی در موشهای تغذیه شده با با رژیم غذایی پرچرب به همراه محلول ساکارز تأثیری ندارد. که با نتایج مطالعه حاضر همسو است (59). آدیپونکتین عملکرد متابولیک روی بافتهای متفاوت از جمله کبد دارد. آدیپونکتین در کبد، انتقال گلوکز را فعال و گلوکونئوژنز را از طریق آدنوزین مونوفسفات کیناز (AMPK) مهار میکند؛ در حالیکه اکسیداسیون اسیدهای چرب را فعال کرده و از طریق گیرنده آلفای پروکسیزوم فعال شده، التهاب را کاهش می دهد. به نظر می رسد که فعالشدن آدنوزین مونوفسفات کیناز بهطور عمده توسط گیرنده نوع Iو فعال شدن گیرنده آلفای پروکسیزوم فعال شده توسط گیرنده نوع IIانجام شود. همچنین آدیپونکتین در کبد، حساسیت به انسولین را با فسفوریلاسیون گیرندههای انسولین افزایش می دهد. یکی دیگر از دلایل تغییر در میزان آدیپونکتین پس از مداخله تمرینی میتواند ناشی از اثر تمرین در مقدار توده چربی باشد. بافت چربی میتواند تعادل انرژی و محتوای لیپیدی را به عنوان ذخیره انرژی کشف کرده و بر اساس آن بیان ژنی آدیپونکتین را اصلاح کند (60). فعالیت بدنی و تمرین ورزشی؛ میزان وزن بدن و توده چربی را کاهش میدهد و نقش تعیین کنندهای در مصرف انرژی دارد (61). همچنین بر غلظت هورمون های مختلف موثر بر تنظیم متابولیسم و اشتها نظیر گرلین، رزیستین، آدیپونکتین و متابولیتهایی مثل اسیدهای چرب آزاد، اسید لاکتیک و تریگلیسرید اثرگذار است (62،63). کاهش وزن از طریق ورزش عامل کلـــیدی در بیان آدیپونکتین میباشد. برخی مطالعات بر این باورند که افزایش آدیپونکتین تنها در شرایط کاهش وزن اتفاق میافتد (64). از طرفی مطالعات دیگر به خصوص مطالعات خیر بر این باورند که حجم و شدت ورزش نسبت به کـــاهش وزن در افزایــش بیان آدیپونکتین مهمتر میباشنـــد (65). شدت تمرین عامل بسیار موثری در آزادسازی آدیپونکتین از بافت چربی به جریان خون است. کرامر و همکارانش به حجم تمرین ورزشی به عنوان یک عامل موثر در مقادیر آدیپونکتین اشاره کردهاند (28). بهطور کلی به نظر میرسد میزان تغییرات آدیپونکتین در پاسخ به تمرین ورزشی به چند فاکتور وابسته است. این فاکتورها شامل شدت و مدت تمرین ورزشی، وضعیت تغذیه آزمودنی ها، ریتم شبانه روزی، آدیپونکتین، ساعت خونگیری و میزان عدم تعادل کالری ناشی از تمرین میباشند. تیروپاتی Thirupathiو همکاران در یک مطالعه مروری بـه بررسـی نقـش انـواع فعالیـت بدنی بر عوامل استرس اکسیداتیو پرداختند. بر اساس نتایج آنها فعالیت بدنی شدید منجر به افـزایش اسـترس اکسیداتیو میشود امـا فعالیـت مـنظم بـا شـدت متوسـط استرس اکسیداتیو را کـاهش مـیدهـد (66). نتایج مطالعات پیشین حاکی از آن است که پاسخهای آنتیاکسیدانی به عوامل التهابی و رادیکالهای آزاد در افراد دارای فعالیت ورزشی و افراد کم تحرک متفاوتاند به گونهای که سطوح آنتیاکسیدانی در افراد ورزشکار بالاتر از افراد کمتحرک است (67،68). مالوندیآلدئید (MDA)، پروپانال، هگزانال و 4-هیدروکسینوننال (4-HNE) بهطور گسترده توسط استرباور Esterbauer و همکارانش در دهه 80 مورد مطالعه قرار گرفته است. به نظر میرسد MDA بیشترین محصول جهشزا پراکسیداسیون لیپید است، در حالیکه 4-HNE سمیترین است (69). نتایج این پژوهش نشان داد هشت هفته تمرین تناوبی شدید باعث افزایش معنادار میزان SOD سرم موشهای چاق میشود ولی تاثیر معنیداری بر میزان مالوندیآلدهید سرم ندارد. پیوی هو و همکاران در سال 2020 تحقیقی انجام دادند که متوجه شدند پس از 8 هفته تمرین، HIIT هیچ تغییر آماری در سطح مالوندیآلدئید (MDA) یا سوپراکسید دیسموتاز (SOD) پیدا نکردند که نتایج MDA با این پژوهش همسو است اما نتایج SOD با پژوهش حاضر همسو نیست. تمرینات ورزشی مستمر و منظم با افزایش دفاع ضد اکسایشی موجب کاهش پراکسیداسیون لپیدی و پروتئینی میشود (70). بنابراین یکی از علل عدم تغییر میزان مالوندیآلدهید را می توان به زمان تمرین نسبت داد. میتوان از محدودیتهای این تحقیق از جمله عدم دسترسی به نمونههای انسانی و عدم استفاده از روش وسترن بلات برای اندازهگیری پروتئین ژن آدیپونکتین به دلیل کبود بودجه پژوهش اشاره کرد. همچنین از دیگر محدودیتهای این مطالعه عدم کنترل میزان فعالیت بدنی خارج از برنامه به دلیل نگهداری موش ها در قفس میباشد. در آخر توصیه می شود مدل مذکور با تمرین تناوبی با شدتهای متفاوتی، به دلیل دقیق نبودن تعریف تناوبی شدید، بهطور گسترده بررسی شود.
نتیجه گیری
بهطور خلاصه، هشت هفته تمرینی تناوبی شدید (HIIT) میتواند سطوح سوپراکسید دیسموتاز سرم (SOD) را بهطور معنیداری افزایش بدهد. با توجه به تاثیر اندک تمرینی تناوبی شدید بر میزان بیان آدیپونکتین و همچنین غلظت مالوندیآلدهید سرم (MDA)، بنابراین تجویز تمرینات تناوبی شدید برای کنترل اضافه وزن و چاقی با احتیاط باید انجام پذیرد.
سپاسگزاری
از اساتید محترم و کلیه عزیزانی که ما را در اجرای این تحقیق یاری نمودند کمال سپاسگزاری را داریم.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد علوم و تحقیقات تایید شده است (کد اخلاق IR.IAU.SRB.REC.1402.026)
مشارکت نویسندگان
تمامی نویسندگان در تمامی مراحل در ارائه ایده، در طراحی مطالعه، در جمعآوری دادهها، در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
چاقی Obesity یک مشکل عمده سلامتی و از مهمترین عوامل تاثیرگذار بر کیفیت زندگی و همچنین از مهمترین عوامل ایجاد کننده بیماریهای غیرواگیر (NCDs Non-Communicable Diseases) در سراسر جهان است که بر اساس شواهد تحقیقاتی موجود، به دلیل ارتباط آن با اختلالات متابولیکی و هورمونی مانند اختلال متابولیسم چربی، دیابت نوع دو، بیماریهای قلبی عروقی (CVD Cardiovascular Diseases) و فشارخون بالا، بیماریهای تنفسی، بیماریهای مزمن کلیوی، برخی از انواع سرطانها و همچنین اختلالات عضلانی اسکلتی یکی از مهمترین علل مرگ و میر در جهان میباشد (1-4). مطالعات انجام گرفته در زمینه بررسی سازوکارهای مرتبط با چاقی و بیماریهای مرتبط با آن، افزایش توده چربی را از مهمترین عوامل اثرگذار معرفی کردهاند (5). چاقی از طریق تکثیر آدیپوسیت ها باعث اختلال عملکرد بافت چربی به عنوان یک منبع التهاب میگردد (6،7). بافت چربی انسان به عنوان بزرگترین اندام بدن با عملکرد اندوکرین میباشد (8) که قادر به تولید پروتئینهای فعال بیولوژیکی است که آدیپوسایتوکین یا آدیپوکاین نام دارد (9). آدیپوکایــنهــا شــامل تعــداد زیــادی واســطههــای پیــشالتهابــی از جملــه عامــل نکــروز دهنــده تومــور آلفــا Tumor necrosis factor alpha (TNF-α)، اینترلوکیــن-6 Interleukin 6 (IL-6) رزیســتین Resistin و کمریــن Chemerin مــیباشــند کــه ســبب گســترش بیماریهــای متابولیکــی میگردنــد و از طرف دیگر تعـدادی از ادیپوکاینهایی که از بافت چربی ترشح میشوند به عنوان واسـطههـای ضـد التهابـی شناخته می شوند از جملـه آپلیـن Apelin و آدیپونکتین Adiponectinکــه میتوانــد در برابــر بیمــاری التهابــی، عملکــرد محافظتــی داشــته باشــند (10) و همچنین از دیگر ادیپوکاینها میتوان به پروتئین 4 متصل شونده به رتینول (RBP4 Retinol binding protein-4)، ویسفاتین Visfatinو امنتین Omentin نیز اشاره کرد. در افراد چاق، افزایش میزان چربی احشایی بدن از طریق عدم تعادل و تولید غیرطبیعی آدیپوکاینها بر بافت چربی همچنین بر سایر بافتها همچون کبد و در نهایت روی سلامتی اثر میگذارد (10،11). آدیپونکتین (که همچنینAcrp30 ، AdipoQ ، GBP-28، APM1، نامیده میشود (12) هورمون پپتیدی با 244 اسید آمینه (13) و وزن 30 کیلودالتون است (14) که در سال 1990 کشف شد (15). در انسان توسط ژن AdipoQ که روی بازوی 3q27 کروموزوم 17 قرار دارد کدگذاری میشود (16،17) و از بافت چربی ترشح می شود. این سایتوکاین به سه شکل آدیپونکتین با وزن مولکولی بالا، متوسط و پایین در خون وجود دارد (18) و 0/01 کل پروتئینهای پلاسما را شامل میشود و غلظت پلاسمایی آن بین 2 تا 20 میکروگرم بر میلیلیتر میباشد (15،19). آدیپونکتین در پلاسما به سه فرم پلیمر، هگزامر و مولتیمر گردش میکند که به نظر میرسد مولتیمر فرم فعالتر آن است (20). سطوح سرمی آدیپونکتین و میزان بیان ژن این هورمون نه تنها در افراد با رژیم غذایی پر چرب کاهش مییابد بلکه در بیماری قلب و عروق و چندین اختلال متابولیکی شامل چاقی، افزایش نمایه توده بدنی، اختلال در نیمرخ لپیدی، وضعیت التهابی، مقاومت به انسولین (IR Insulin resistance) و دیابــت نوع 2 کاهــــش مییابد (24-21، 10). به نظر میرسد کاهش سطوح سرمی آدیپونکتین در افراد چاق ناشی از کاهش سنتز آدیپونکتین توسط آدیپوسیتها به دلیل وجود التهاب در آنها میباشد (25). هنگامی که قدرت این هورمون همراه با چاقی کاهش مییابد شرایطیکه به عنوان هیپو آدیپونکتینما شناخته میشود، پیش می آید (26). نتایج مطالعهای بر روی 661 مرد نشان داد که غلظت پلاسمایی پایین آدیپونکتین با چاقی شکمی، غلظت پایین لیپوپروتئین پرچگال (HDL)، هیپرتریگلیسریدمی، غلظت بالای گلوکز ناشتا، پرفشاری خون و سندروم متابولیک مرتبط است و همچنین سطوح بالای آدیپونکتین در افراد سالم با اثرات ضد التهابی، آنتی آتروژنیک و آنتی دیابتیک همراه است (27). همچنین در مطالعه مروری دیگر بر روی بیش از هزار نفر آزمودنی لاغر و چاق به این نتیجه رسیدند که سطوح آدیپونکتین در افراد چاق پایینتر است (28). آدیپونکتین از طریق گیرندههای خود به نام Adipo R1 و Adipo R2 عمل میکند (27). Adipo R1 بهطور عمده در عضله اسکلتی یافت میشود اما در هیپوتالاموس، کبد و دیگر بافتها نیز ظاهر میشود. Adipo R2 معمولاً در بافت کبد یافت میشود اما در دیگر بافتها مانند چربی سفید و عروق نیز دیده میشود (29). نتایج مطالعات پیشین نشان میدهد که چاقی با کاهش بیان گیرندههای Adipo R1وAdipo R2 مرتبط است (30). نتایج یک پژوهش بر روی بیان ژن گیرنده آدیپونکتین نشان داد که بیان ژن گیرنده نوع دو آدیپونکتین بین موشهای چاق و لاغر مشابه بوده، در حالیکه بیان ژن گیرنده نوع یک آدیپونکتین بهطور معنیداری در بافت پانکراس موشهای چاق کاهش یافته بود (31). آدیپونکتین عاملی مؤثر در اکسیداسیون چربی و جذب گلوکز در عضلات اسکلتی و کاهش گلوکز خروجی از کبد است (32). آدیپونکتین، متابولیسم گلوکز را از طریق فعالسازی AMP کیناز تنظیم میکند (33). آدیپونکتین آدیپوکاینی است که نقش محافظتی در بیماریهای کبدی دارد و با ممانعت از ورود اسیدهای چرب به داخل سلولهای کبدی و همچنین با افزایش سوخت و ساز چربی از طریق فرایند اکسیداسیون در سلولهای کبدی از افزایش چربی در سلولهای کبدی جلوگیری میکند (32). نتایج مطالعات پیشین حاکی از آن است که تجویز آدیپونکتین نوترکیب به موشها منجر به افزایش جذب گلوکز، افزایش اسیدهای چرب آزاد پلاسما و اکسیداسیون اسیدهای چرب در عضلات شده و تولید گلوکز کبدی را کاهش میدهد (34). از طرف دیگر مشخص شده است چاقی و تجمع چربی در بدن با التهاب مزمن، تولید گونههای فعال اکسیژن (ROS)، کم اکسیژنی سلولی، افزایش پراکسیداسیون لپیدی و در نتیجه با استرس اکسایشی همراه است (35،36). سوپر اکسید دیسموتاز (SOD) یکی از ارکان مهم سیستم دفاعی آنتیاکسیدان است که تقریباً در تمامی سلولهایی که در معـرض اکسـیژن قـرار دارنـد، وجـود دارد. همچنین مالوندیآلدهید (MDA) یکی از محصولات نهــایی پراکسیداســیون لیپیــدی اســت. گونههای فعال اکسیژن، چربـی را تخریـب میکننـد و باعـث تشـکیل مــالوندیآلدهیــد میشــوند (37،38). ارتبــاط بــین ســطوح آدیپونکتین در گردش خون با شاخصهای استرس اکسیداتیو از جمله MDAو SOD در مطالعات پیشـین نشـان داده شده است (39،40). مطالعات گذشته نشان دادهاند که فعالیت ورزشی منظم را میتوان یک روش درمانی مهم برای التهاب مزمن و بیماریهای مرتبط با چاقی به واسطه نقش آن در تغییر هورمونهای متابولیکی در نظر گرفت (41،42). در سالهای اخیر تمرینات تناوبی شدید (HIIT High-intensity interval training) که با دورههای کوتاه و متناوب فعالیتهای شدید و فواصل استراحت بین آنها شناخته میشوند؛ به علت زمان مورد نیاز اندک تمرین و اثرات مثبتی که دارد توجه محققین را به خود جلب کرده است (43،44). شینگ Shing و همکــارانش در مطالعــه خود افــزایش میــزان آدیپونکتین و کاهش درصد چربی بدن را پـس از چهار هفته تمرین تناوبی با شدت بالا در قایقرانـان ورزشـکار مشاهده کردنـد (45). همچنین لی Lee و همکـارانش افزایش گیرندههای آدیپونکتین، و کاهش درصد چربی بدن را پس از دوازده هفته فعالیـت با 60 تـا 75 درصـد حـداکثر ضـربان قلـب در مردان جوان مشاهده کردنـد (46). در حـالیکـه لگاته Leggate و همکارانش در مطالعهای کاهش میـزان آدیپونکتین را با دو هفته تمرینات تنـاوبی خیلـی شـدید در افـراد دارای اضافه وزن و چاق مشاهده کردنـد (47). تحقیقات نشان دادهاند که سطوح آدیپونکتین تحت تاثیر شدت تمرین بیشتر قرار میگیرد تا حجم تمرین (48). نقیزاده و همکاران در مطالعه خود به این نتیجه رسیدند که 12 هفته تمرین تناوبی شدید موجب تغییر معنادار در پروفایل لپیدی و سطوح آدیپونکتین در مردان چاق مبتلا به دیابت نوع دو با چربی خون بالا شد (49). در ایــن راســتا، برخــی مطالعــات گــزارش کــرده انــد کــه تمرینــات ورزشــی از جمله هــوازی (50) و تناوبــی بــا شــدتهــای مختلــف (51)، میتوانــد ســبب افزایــش آدیپونکتین گــردد. از طـرف دیگــر، عــدم تغییــر معنــیدار آدیپونکتین به دنبال تمریــن هــوازی نیــز گــزارش شــده اســت (52). امروزه تمرین تناوبی با شدت بالا در حال گسترش روزافزون بین افراد ورزشکار و غیر ورزشکار است تا از سلامت جسمی بیشتری بهرهمند شوند و زندگی مطلوبتری را تجربه کنند. بهدست آوردن اطلاعات کافی درباره پاسخهای فیزیولوژیک و اکسیدانی باعث میشود دریچه نوینی به سوی برنامهنویسی تمرین برای این افراد گشوده شود. علیرغم اثرات مثبت گزارش شده برای تمرین ورزشی بر روی میزان آدیپونکتین، نتایج متناقضی در زمینه تاثیر تمرین تناوبی شدید بر روی میزان آدیپونکتین و همچنین فاکتورهای اکسایشی وجود دارد. بنابراین مطالعه حاضر با هدف بررسی تاثیر تمرین تناوبی شدید بر میزان بیان آدیپونکتین و میزان سطوح مالوندیآلدهید و سوپر اکسید دیسموتاز در موشهای چاق به اجرا در آمد.
روش بررسی
پژوهش حاضر از نوع تجربی - بنیادی میباشد. جامعه آماری پژوهش حاضر را موش رت نر نژاد ویستار تشکیل میدهند. با میانگین وزنی 20±220گرم و سن 22 روز که از مرکز حیوانات موسسه پاستور تهیه شد. تعداد نمونهها این مطالعه 24 سر موش می باشد که به صورت تصادفی به 3 گروه کنترل سالم (8 سر)، گروه تمرین تناوبی شدید (8 سر)، گروه مدل (8 سر)تقسیم شدند. همه حیوانات در مدت پژوهش با دسترسی آزاد به آب و بسته های غذایی و طبق چرخه 12ساعت روشنایی/خاموشی و دمای محیطی در محدوده 3 ± 23 درجه سانتیگراد و رطوبت 50 ± 10 نگهداری شدند. شرایط نگهداری و کار با حیوانات براساس توصیههای قوانین حمایت از حیوانات آزمایشگاهی NIH در مرکز تحقیقاتی پاسارگاد (هیستوژن) انجام گرفت. برای القای چاقی گروه کنترل با غذای استاندارد جوندگان تغذیه شد و گروه مدل خودچاقی و گروه خودچاقی به همراه تمرین با رژیم غذای پرچرب تغذیه شدند. غذای پرچرب استفاده شده شامل غذای پایه جوندگان به اضافه 15% چربی حیوانی و 4% کلسترول می باشد که بهصورت نامحدود در اختیار گروهها قرار داده شد. به منظور القاء چاقی، ابتدا حیوانات به مدت 45روز با این ترکیب غذائی به چاقی مبتلا شدند. وزن موشها پس از چاق شدن حدود 380±50 گرم میباشد. سپس در گروههای مطالعاتی طبقهبندی شدند و به مدت 8 هفته تحت درمان در گروههای مختلف آزمایشی قرار گرفتند. به منظور اجرای پروتکل تمرینی که بر گرفته از مطالعات پیشین بود (53) قبل از شروع تمرینات ورزشی، همه موشها تحت یک دوره سازگاری قرار گرفتند تا استرس احتمالی ناشی از تجهیزات را به حداقل برسانند. به این منظور آنها روی تردمیل خاموش قرار گرفتند. سپس تمرینات ورزشی 3 روز در هفته به مدت 8 هفته انجام شد، در حالی که تغذیه رژیمی همچنان به طور همزمان ارائه می شد. پروتکل HIIT از جمالی و همکاران، 2016 اتخاذ شد که شامل فعالیت دویدن روی تردمیل حیوانات بود. این پروتکل شامل 5 دقیقه گرم کردن و 5 دقیقه خنک کردن با سرعت 10 متر در دقیقه بود. پس از گرم کردن بدن، جلسه تمرین با 5 تکرار 30 ثانیهای با سرعت 29 متر در دقیقه به همراه یک دقیقه استراحت فعال آغاز شد. شدت از جمله تکرار و سرعت در هفته افزایش می یابد. استراحت فعال ادامه دویدن روی تردمیل اما با سرعت 13 متر در دقیقه بود. شیب تردمیل صفر بود و در 8 هفته تغییری نداشت. در این مدت گروه کنترل هیچ برنامه تمرینی نداشت. جراحی و بافتبرداری کبد در پایان هفته هشتم 24 ساعت پس از آخرین تمرین صورت گرفت. لازم به ذکر است در این ازمایش تلفات نداشتیم. رتها توسطCO2 آسانکشی شدند سپس خونگیری از قلب رتها انجام شد و با سانتریفیوژ دور 3500دور بر دقیقه بهمدت 15 دقیقه جداسازی شد و سرم خون برای بررسی مارکرهای بیوشیمیایی تهیه گردید. سپس موشها تشریح و بافت کبد جداسازی شد و درون فرمالین 10 % فیکس شد. برای اندازهگیری MDA و SOD از کیت مخصوص اندازهگیری شرکت زلبیو آلمان استفاده شد و آماده سازی سازی محلول ها توسط دستورالعمل شرکت مطابق زیر انجام گرفت.
روش کار تستMDA: ابتدا نمونههای خون در دمای اتاق به مدت 5 تا10دقیقه لخته شد. نمونهها در دور3000- 2000 سانترفیوژ شدند، سوپرناتانت جدا گردید. نمونههای لازم برای تست MDA تا زمان انجام کار در دمای انجماد20-ذخیره شد.
آماده سازی واکنشگرها: پس از آمادهسازی محلولهای مورد نیاز و رسیدن به دمای محیط 50 میکرولیتر از نمونه به هر میکروتیوب اضافه گردید. 50 میکرولیتر از محلول شماره4 به هرمیکروتیوب اضافه گردید. سپس1میلیلیتر از محلول کروموژنیک به هر میکروتیوب اضافه شده و میکروتیوبها به مدت یک ساعت درون آب در حال جوش قرار داده شد .میکروتیوبها درون ظرف یخ خنک گردید و به مدت 10دقیقه با دور 4000 RPM سانتریفیوژ شد. 200 میکرولیتر از محلول رویی صورتی رنگ را به درون چاهک میکروپلیت شده وجذب آن در طول موج 535 نانومتر با دستگاه خوانش الایزا اندازهگیری شد. آنالیز نتایج، براساس منحنی استاندارد بهدست آمده، محاسبه شد.
روش کار SOD: نمونههای لازم برای تست SOD تا زمان انجام کار در دمای انجماد20- ذخیره شد. برای تهیه سرم نمونههای خون در دمای اتاق به مدت 5 تا 10دقیقه لخته شدند. نمونهها در دور3000-2000 سانترفیوژ گردید، سوپرناتانت را جدا شد.
آنالیز نتایج طبق فرمول زیر محاسبه خواهد گردید.
SOD activity(u/Ml)=(Vp-Vc)/(Vp)*60
Vp=ODsample 2min -ODblank 2min
به منظور استخراج RNA بافت کبد قبل از استفاده با استفاده از دستگاه هموژنایزر به طور کامل هموژن شد و سپس مقدار 1 میلی ترایزول به ازای 50الی 100 میلیگرم از بافت اضافه گردید تا لیزات سلولی بهدست آید. به ازای 1 میلیلیتر ترایزول ا ضافه شده در مرحله اول، مقدار 200 میکرولیتر کلروفرم به نمونهها اضافه گردید و 15 ثانیه تکان داده شد تا مخلوط شوند. میکروتیوبها به مدت 15دقیقه در دمای محیط انکوبه شدند و سپس به مدت 15 دقیقه در 12000 RPM و دمای 4درجه سانتیگراد سانتریفیوژ شدند. فاز شفاف رویی حاوی RNA جدا شده و به میکروتیوب دیگری منتقل گردید. به میکروتیوبهای حاوی فاز شفاف رویی ایزوپروپانول اضافه شد ( 500 میکرولیتر به ازای 1 میلیلیتر ترایزول اضافه شده) و دو مرتبه میکروتیوبها سروته شوند invertingتا محتویات میکروتیوبها مخلوط شوند. سپس به مدت 10دقیقه در دمای فریزر -20 انکوبه شدند. به منظور رسوب RNA، نمونهها به مدت 10 دقیقه در 12000 RPM و دمای 4 درجه سانتریفیوژ شدند. محلول رویی تخلیه شده و رسوبها با اتانول 75% شستشو داده شدند به این صورت که مقدار 200 میکرولیتر اتانول 75% به هر میکروتیوب اضافه شده و چند ثانیه ورتکس انجام شد سانتریفیوژ در 7500 RPM به مدت 5 دقیقه در دمای 4 درجه انجام شد. محیط رویی تخلیه و میکروتیوبها به مدت 15 دقیقه بر روی دستمال کاغذی استریل وارونه قرار داده شدند تا رسوب نیمه خشک شده و الکل تبخیر شود. پس از نیمه خشک شدن رسوب، مقدار 20 الی 30میکرولیتر آب DEPCیا عاری از RNase به هر میکروتیوب اضافه شده تا رسوب RNA در آن حل شود. سنتز cDNA با استفاده از کیت Easy cDNA Synthesis Kit شرکت پارس طوس ایران و طبق پروتکل شرکت سازنده انجام شد. نمونههای استخراج شده در دمای-80 درجه برای نگهداری بلند مدت قرار داده شدند. برای کمیسازی مقادیر بیان ژن مورد نظر از فرمول ∆∆ct به توان منفی2- استفاده شد.
پرایمرها
جدول 1: پروتکل تمرینی

جدول 2: آمادهسازی واکنشگرها

جدول 3: روش کار SOD

1.محلولR1 : 13میلی لیتر از ترکیبR1 را با 13میلیلیتر از آب دوبار تقطیر مخلوط گردید.2.آمادهسازی کروموژن: R3 باR4ترکیب گردید.
جدول 4: محتویات نمونه در SOD

جدول 5: پرایمرهای مورد استفاده

توزیع طبیعی دادهها به کمک آزمون شاپیرو-ویلک ارزیابی شد. سپس در ادامه برای مقایسه بین گروهی دادهها پس از پایان مداخله، از تحلیل واریانس یکراهه استفاده شد که در صورت معنادارشدن آن، در ادامه دادهها با استفاده از آزمون تعقیبی توکی در سطح معناداری P < 0.05 مقایسه شدند.
نتایج
به منظور بررسی اثرتمرین تناوبی شدید بر روی فاکتورهای پراکسیداسیون لیپیدی و میزان بیان ژن آدیپونکتین در کبد موشهای چاق ابتدا توزیع طبیعی دادهها به کمک آزمون شاپیرو - ویلک ارزیابی شد. پس از مشخص شدن طبیعی بودن دادهها ( p>0.05) از آزمونANOVA یک طرفه برای بررسی استفاده شد. نتایج آزمونANOVA یک طرفه نشان داد اثر تمرین معنیدار است (P < 0.05). سپس از آزمون تعقیقبی توکی به منظور بر سی بین گروه ها انجام شد. در پایان پژوهش نتایج نشان داد هشت هفته تمرین HIIT میزان سطح SOD سرم را به طور معنا داری افزایش میدهد. اما هشت هفته تمرین HIIT با اینکه موجب کاهش سطح MDA سرم و افزایش میزان پروتئین آدیپونکتین بافت کبد شد اما این تغییرات بین گروه تمرین چاق و کنترل چاق معنادار نبود به ترتیب P=0.4198 و P=0.3209. پس از 8 هفته نتایج نشان داد میزان سطح SOD سرم درموشهای گروه HIIT و موشهای گروه مدل نسبت به گروه کنترل، کاهش معنادار مشاهده شد )به ترتیب P=0.0044 و P<0.0001 (. همچنین این سطح در موش های گروه HIIT نسبت به گروه مدل به طور معنا داری افزایش داشته است (P=0.0007) (جدول 7). سطح MDA سرم درموش های گروه HIIT و موشهای گروه مدل نسبت به گروه کنترل، افزایش معنادار مشاهده شد )به ترتیب P=0.0003 و (P<0.0001 سطح MDA سرم درموش های گروه HIIT نسبت به گروه مدل کاهش معنا دار نداشته است (p=4198) (جدول 6). میزان پروتئین آدیپونکتین بافت کبد درموش های گروه HIIT و موش های گروه مدل نسبت به گروه کنترل، کاهش معنادار مشاهده شد ( هر دو P<0.0001). میزان این پروتئین در بافت کبد موش های گروه HIIT نسبت به گروه مدل افزایش معنا دار نداشته است.(p=0.3209) (جدول 8).
جدول 6: نتایج آزمون انوا یک طرفه برای متغیر MDA

جدول 7: نتایج آزمون انوا یک طرفه برای متغیر SOD

جدول 8: نتایج آزمون انوا یک طرفه برای متغیر آدیپونکتین


شکل1: نمودار تغییرات غلظت متغیرهای پژوهش control: گروه کنترل، model: گروه مدل خودچاقی، Exe: گروه خودچاقی به همراه تمرین ns: عدم معنیداری تغییرات
بحث
یافتههای این تحقیق نشان داد در گروه تمرین افزایش معنادار میزان وضعیت سوپر اکسید دیسموتاز SOD نسبت به گروه خودچاقی مشاهده شد. اما تغییر معناداری در میزان مالوندیآلدهید MDA و میزان بیان ژن آدیپونکتین بافت کبد گروه خودچاقی و گروه تمرین تناوبی مشاهده مشاهده نشد. بر اساس نتایج حاصل از تحقیق حاضر 45 روز استفاده از رژیم غذایی پر چرب باعث تغییر در وضعیت اکسیدانی موش شد بهطوری که میزان SOD کاهش و میزان MDA افزایش معناداری پیدا کردند. همچنین میزان بیان آدیپونکتین بافت کبد بهطور معناداری کاهش پیدا کرد. در مطالعهای همسو دهواری و همکاران نتایج نشان داد رژیم غذایی پر چرب باعث باعث کاهش بیان ژن آدیپونکتین در بافتهای چربی و کبد میشود (54). از طرف دیگر نتایج این پژوهش نشان داد هشت هفته تمرین تناوبی شدید با اینکه باعث افزایش میزان بیان آدیپونکتین بافت کبد میشود اما تاثیر آن بر میزان بیان ژن آیپونکتین بافت کبد موشهای چاق معنیدار نیست. در مطالعهای همسو هوانگ Huang همکارانش با بررسی اثر هشت هفته تمرین هوازی بر آدیپونکتین سرم موشهای دیابتی به این نتیجه رسیدند که تمرین هوازی تاثیر معنیداری بر آدیپونکتین سرم موشهای دیابتی ندارد (55). خدری و همکاران نیز تغییرات معناداری را در میزان آدیپونکتین پلاسما پس از 8 هفته تمرین هوازی با شدت بالا مشاهده نکردند (56). همچنین شینگ Shing و همکاران افزایش میزان آدیپونکتین پس از چهار هفته تمرین تناوبی شدید در قایقرانان را مشاهده کرند (45). اما در مطالعهای ناهمسو با مطالعه حاضر لگاته همکارانش کاهش میـزان آدیپونکتین را با دو هفته تمرینات تنـاوبی خیلـی شـدید در افـراد دارای اضافه وزن و چاق مشاهده کردنـد (47). نتایج مطالعه سبزهپرور و همکاران آلوئهورا منجر به افزایش معنیدار آدیپونکتین و انسولین در موشهای نر دیابتی میشود (57). همچنین نتایج عزیزی و همکاران ورزش تناوبی با شدت بالا (HIIT) بر روی بیان ژن آدیپونکتین تاثیر معناداری دارد و باعث افزایش بیان این ژن میشود (58). علی دلپیشه و همکاران اثر HIIT بر سطوح آدیپونکتین و TNF-α سرم و بافت چربی در موشهای تغذیه شده با رژیم غذایی پرچرب به همراه محلول ساکارز مورد بررسی قرار دادند آنها دریافتند برنامه HIIT میتواند اثرات کاهنده قابلتوجهی بر افزایش وزن و وزن چربی داشته باشد، اما بر سطوح آدیپونکتین و TNF-α در گردش و ذخیره چربی در موشهای تغذیه شده با با رژیم غذایی پرچرب به همراه محلول ساکارز تأثیری ندارد. که با نتایج مطالعه حاضر همسو است (59). آدیپونکتین عملکرد متابولیک روی بافتهای متفاوت از جمله کبد دارد. آدیپونکتین در کبد، انتقال گلوکز را فعال و گلوکونئوژنز را از طریق آدنوزین مونوفسفات کیناز (AMPK) مهار میکند؛ در حالیکه اکسیداسیون اسیدهای چرب را فعال کرده و از طریق گیرنده آلفای پروکسیزوم فعال شده، التهاب را کاهش می دهد. به نظر می رسد که فعالشدن آدنوزین مونوفسفات کیناز بهطور عمده توسط گیرنده نوع Iو فعال شدن گیرنده آلفای پروکسیزوم فعال شده توسط گیرنده نوع IIانجام شود. همچنین آدیپونکتین در کبد، حساسیت به انسولین را با فسفوریلاسیون گیرندههای انسولین افزایش می دهد. یکی دیگر از دلایل تغییر در میزان آدیپونکتین پس از مداخله تمرینی میتواند ناشی از اثر تمرین در مقدار توده چربی باشد. بافت چربی میتواند تعادل انرژی و محتوای لیپیدی را به عنوان ذخیره انرژی کشف کرده و بر اساس آن بیان ژنی آدیپونکتین را اصلاح کند (60). فعالیت بدنی و تمرین ورزشی؛ میزان وزن بدن و توده چربی را کاهش میدهد و نقش تعیین کنندهای در مصرف انرژی دارد (61). همچنین بر غلظت هورمون های مختلف موثر بر تنظیم متابولیسم و اشتها نظیر گرلین، رزیستین، آدیپونکتین و متابولیتهایی مثل اسیدهای چرب آزاد، اسید لاکتیک و تریگلیسرید اثرگذار است (62،63). کاهش وزن از طریق ورزش عامل کلـــیدی در بیان آدیپونکتین میباشد. برخی مطالعات بر این باورند که افزایش آدیپونکتین تنها در شرایط کاهش وزن اتفاق میافتد (64). از طرفی مطالعات دیگر به خصوص مطالعات خیر بر این باورند که حجم و شدت ورزش نسبت به کـــاهش وزن در افزایــش بیان آدیپونکتین مهمتر میباشنـــد (65). شدت تمرین عامل بسیار موثری در آزادسازی آدیپونکتین از بافت چربی به جریان خون است. کرامر و همکارانش به حجم تمرین ورزشی به عنوان یک عامل موثر در مقادیر آدیپونکتین اشاره کردهاند (28). بهطور کلی به نظر میرسد میزان تغییرات آدیپونکتین در پاسخ به تمرین ورزشی به چند فاکتور وابسته است. این فاکتورها شامل شدت و مدت تمرین ورزشی، وضعیت تغذیه آزمودنی ها، ریتم شبانه روزی، آدیپونکتین، ساعت خونگیری و میزان عدم تعادل کالری ناشی از تمرین میباشند. تیروپاتی Thirupathiو همکاران در یک مطالعه مروری بـه بررسـی نقـش انـواع فعالیـت بدنی بر عوامل استرس اکسیداتیو پرداختند. بر اساس نتایج آنها فعالیت بدنی شدید منجر به افـزایش اسـترس اکسیداتیو میشود امـا فعالیـت مـنظم بـا شـدت متوسـط استرس اکسیداتیو را کـاهش مـیدهـد (66). نتایج مطالعات پیشین حاکی از آن است که پاسخهای آنتیاکسیدانی به عوامل التهابی و رادیکالهای آزاد در افراد دارای فعالیت ورزشی و افراد کم تحرک متفاوتاند به گونهای که سطوح آنتیاکسیدانی در افراد ورزشکار بالاتر از افراد کمتحرک است (67،68). مالوندیآلدئید (MDA)، پروپانال، هگزانال و 4-هیدروکسینوننال (4-HNE) بهطور گسترده توسط استرباور Esterbauer و همکارانش در دهه 80 مورد مطالعه قرار گرفته است. به نظر میرسد MDA بیشترین محصول جهشزا پراکسیداسیون لیپید است، در حالیکه 4-HNE سمیترین است (69). نتایج این پژوهش نشان داد هشت هفته تمرین تناوبی شدید باعث افزایش معنادار میزان SOD سرم موشهای چاق میشود ولی تاثیر معنیداری بر میزان مالوندیآلدهید سرم ندارد. پیوی هو و همکاران در سال 2020 تحقیقی انجام دادند که متوجه شدند پس از 8 هفته تمرین، HIIT هیچ تغییر آماری در سطح مالوندیآلدئید (MDA) یا سوپراکسید دیسموتاز (SOD) پیدا نکردند که نتایج MDA با این پژوهش همسو است اما نتایج SOD با پژوهش حاضر همسو نیست. تمرینات ورزشی مستمر و منظم با افزایش دفاع ضد اکسایشی موجب کاهش پراکسیداسیون لپیدی و پروتئینی میشود (70). بنابراین یکی از علل عدم تغییر میزان مالوندیآلدهید را می توان به زمان تمرین نسبت داد. میتوان از محدودیتهای این تحقیق از جمله عدم دسترسی به نمونههای انسانی و عدم استفاده از روش وسترن بلات برای اندازهگیری پروتئین ژن آدیپونکتین به دلیل کبود بودجه پژوهش اشاره کرد. همچنین از دیگر محدودیتهای این مطالعه عدم کنترل میزان فعالیت بدنی خارج از برنامه به دلیل نگهداری موش ها در قفس میباشد. در آخر توصیه می شود مدل مذکور با تمرین تناوبی با شدتهای متفاوتی، به دلیل دقیق نبودن تعریف تناوبی شدید، بهطور گسترده بررسی شود.
نتیجه گیری
بهطور خلاصه، هشت هفته تمرینی تناوبی شدید (HIIT) میتواند سطوح سوپراکسید دیسموتاز سرم (SOD) را بهطور معنیداری افزایش بدهد. با توجه به تاثیر اندک تمرینی تناوبی شدید بر میزان بیان آدیپونکتین و همچنین غلظت مالوندیآلدهید سرم (MDA)، بنابراین تجویز تمرینات تناوبی شدید برای کنترل اضافه وزن و چاقی با احتیاط باید انجام پذیرد.
سپاسگزاری
از اساتید محترم و کلیه عزیزانی که ما را در اجرای این تحقیق یاری نمودند کمال سپاسگزاری را داریم.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد علوم و تحقیقات تایید شده است (کد اخلاق IR.IAU.SRB.REC.1402.026)
مشارکت نویسندگان
تمامی نویسندگان در تمامی مراحل در ارائه ایده، در طراحی مطالعه، در جمعآوری دادهها، در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Davis JN, Tung A, Chak SS, Ventura EE, Byrd-Williams CE, Alexander KE, et al. Aerobic and Strength Training Reduces Adiposity in Overweight Latina Adolescents. Med Sci Sports Exerc 2009; 41(7): 1494-1503.
2- Rashti B، Mehrabani J، Damirchi A، Babaei P. The Influence of Concurrent Training Intensity on Serum Irisin and Abdominal Fat in Postmenopausal Women. Prz Menopauzalny 2019; 18(3): 166-73.
3- Gholaman M, Gholami M, Azarbayjani MA, Abed Natanzi H. High and Moderate Intensity Aerobic Training Effects on Galectin-3، Pentraxin-3، and Several Inflammatory Mediators Levels in Type 2 Diabetic Women، a Randomized Clinical Trial. Womens Health Bull 2021; 8(4): 238-46.
4- Roque FR, Hernanz R, Salaices M, Briones AM. Exercise Training and Cardiometabolic Diseases: Focus on the Vascular System. Curr Hypertens Rep 2013; 15(3): 204-14.
5- Stout MB، Justice JN، Nicklas BJ، Kirkland JL. Physiological Aging: Links among Adipose Tissue Dysfunction, Diabetes, And Frailty. Physiology (Bethesda) 2017; 32(1): 9-19.
6- García-Hermoso A, Ceballos-Ceballos RJ, Poblete-Aro CE, Hackney AC, Mota J, Ramírez-Vélez R. Exercise، Adipokines and Pediatric Obesity: A Meta-Analysis of Randomized Controlled Trials. Int J Obes. 2017;41(4):475-82.
7- Jahandideh AA, Rohani H, Rajabi H, Shariatzade Joneidi M. Effect of 8-weeks of Combined Exercise Training on Plasma Leptin and Adiponectin levels in Obese Boys. J Applied Health Studies in Sport Physiology 2021; 8(2): 25-33.
8- Guardiola M, Ribalta J, Gómez-Coronado D, Lasunción MA, de Oya M, Garcés C. The Apolipoprotein A5 (APOA5) Gene Predisposes Caucasian Children to Elevated Triglycerides and Vitamin E (Four Provinces Study). Atherosclerosis 2010; 212(2): 543-7.
9- Nakamura K, Fuster JJ, Walsh K. Adipokines: A Link Between Obesity and Cardiovascular Disease. J cardiol 2014; 63(4): 250-9.
10- Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in Inflammation and Metabolic Disease. Nat rev immunol 2011; 11(2): 85-97.
11- Gregor MF, Hotamisligil GS. Thematic Review Series: Adipocyte Biology. Adipocyte Stress: The Endoplasmic Reticulum and Metabolic Disease. J Lipid Res 2007; 48(9): 1905-14.
12- Ahmadi M, Kazemzadeh Y, Mirzayan S, Shahedi V, Eizadi M. Improvement Of Glucose Levels and Insulin Resistance in the Absence of Change in Adiponectin Expression in Subcutaneous Adipose Tissue in Response to Intence Interval Training in Obese Diabetic Rats. Razi Journal of Medical Sciences 2021; 28(8): 33-43. [Persian]
13- Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A Novel Serum Protein Similar To C1q، Produced Exclusively in Adipocytes. J Biol Chem 1995; 270(45): 26746-9.
14- Awad AB, Bradford PG. Adipose Tissue and Inflammation. 1st ed. CRC Press; 2009: 256-300.
15- Baek K, Kang J, Lee J, Kim M, Baek JH. The Time Point-Specific Effect of Beta-Adrenergic Blockade in Attenuating High Fat Diet-Induced Obesity and Bone Loss. Calcif Tissue Int 2018; 103(2): 217-26.
16- Saito K, Tobe T, Minoshima S, Asakawa S, Sumiya J,Yoda M, et al. Organization of the Gene For Gelatin-Binding Protein (GBP28). Gene 1999; 229(1-2): 67-73.
17- Takahashi M, Arita Y, Yamagata K, Matsukawa Y, Okutomi K, Horie M, et al. Genomic Structure and Mutations in Adipose-Specific Gene, Adiponectin. Int J Obes Relat Metab Disord 2000; 24(7): 861-8.
18- Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance، diabetes، and the metabolic syndrome. J Clin Invest 2006; 116(7): 1784-92.
19- Basati G, Pourfarzam M, Movahedian A, Samsamshariat SZ, Sarrafzadegan N. Reduced Plasma Adiponectin Levels Relative to Oxidized Low Density Lipoprotein and Nitric Oxide in Coronary Artery Disease Patients. Clinics (Sao Paulo) 2011; 66(7): 1129-35.
20- Kandula V, Kosuru R, Li H, Yan D, Zhu Q, Lian Q, et al. Forkhead Box Transcription Factor 1: Role in the Pathogenesis of Diabetic Cardiomyopathy. Cardiovasc Diabetol 2016; 15(1):44-56.
21- Saltevo J, Laakso M, Jokelainen J, Keinänen‐Kiukaanniemi S, Kumpusalo E, Vanhala M. Levels of Adiponectin، C‐Reactive Protein and Interleukin‐1 Receptor Antagonist are Associated with Insulin Sensitivity: A Population‐Based Study. Diabetes Metab Res Rev 2008; 24(5): 378-83.
22- Maleki S, Behpoor N, Tadibi V. Effect of 8 Weeks of Resistance Training and Supplementation of Cinnamon on Plasma Levels of Leptin and Adiponectin in Overweight Women. J Practical Studies of Biosciences in Sport 2020; 8(16): 132-42.
23- Martins R, Lithgow GJ, Link W. Long Live FOXO: Unraveling the Role of FOXO Proteins in Aging and Longevity. Aging cell 2016; 15(2): 196-207.
24- Nigro E, Scudiero O, Monaco ML, Palmieri A, Mazzarella G, Costagliola C, et al. New Insight into Adiponectin Role in Obesity and Obesity-Related Diseases. Biomed Res Int 2014; 2014.
25- Degawa‐Yamauchi M, Moss KA, Bovenkerk JE, Shankar SS, Morrison CL, Lelliott CJ, et al. Regulation of Adiponectin Expression in Human Adipocytes: Effects of Adiposity، Glucocorticoids، and Tumor Necrosis Factor Α. Obes Res 2005;13(4): 662-9.
26- Relling DP, Esberg LB, Fang CX, Johnson WT, Murphy EJ, Carlson EC, et al. High-Fat Diet-Induced Juvenile Obesity Leads to Cardiomyocyte Dysfunction and Upregulation of Foxo3a Transcription Factor Independent of Lipotoxicity and Apoptosis. J hypertens 2006; 24(3): 549-61.
27- Sokolovska J, Ostrovska K, Pahirko L, Varblane G, Krilatiha K, Cirulnieks A, et al. Impact of Interval Walking Training Managed Through Smart Mobile Devices on Albuminuria and Leptin/Adiponectin Ratio in Patients with Type 2 Diabetes. Physiol Rep 2020; 8(13): e14506.
28- Kraemer RR, Castracane VD. Exercise and Humoral Mediators of Peripheral Energy Balance: Ghrelin and Adiponectin. Exp Biol Med (Maywood) 2007; 232(2):184-94.
29- Perl A. mTOR Activation is a Biomarker and a Central Pathway to Autoimmune Disorders، Cancer، Obesity، and Aging. Ann N Y Acad Sci 2015; 1346(1): 33-44.
30- Jiménez-Maldonado A، Virgen-Ortiz A، Lemus M، Castro-Rodríguez E، Cerna-Cortés J، Muñiz J، et al. Effects of Moderate-and High-Intensity Chronic Exercise on the Adiponectin Levels in Slow-Twitch and Fast-Twitch Muscles in Rats. Medicina (Kaunas) 2019; 55(6): 291.
31- Wade TE,Mathur A, Lu D, Swartz-Basile DA, Pitt HA, Zyromski NJ. Adiponectin Receptor-1 Expression is Decreased in the Pancreas of Obese Mice. J Surg Res 2009; 154(1): 78-84.
32- Yanai H، Yoshida H. Beneficial Effects of Adiponectin on Glucose and Lipid Metabolism and Atherosclerotic Progression: Mechanisms and Perspectives. Int J Mol Sci 2019; 20(5): 1190.
33- Park CE، Kim M-J، Lee JH، Min B-I، Bae H، Choe W، et al. Resveratrol Stimulates Glucose Transport In C2C12 Myotubes by Activating AMP-Activated Protein Kinase. Exp Mol Med 2007; 39(2): 222-9.
34- Pedersen BK, Febbraio MA. Muscles, Exercise and Obesity: Skeletal Muscle as a Secretory Organ. Nat Rev Endocrinol 2012; 8(8): 457-65.
35- Badid N, Baba Ahmed FZ, Merzouk H, Belbraouet S, Mokhtari N, Merzouk SA, et al. Oxidant/Antioxidant Status، Lipids and Hormonal Profile in Overweight Women with Breast Cancer. Pathol Oncol Res 2010; 16(2): 159-67.
36- Saito I, Yonemasu K, Inami F. Association of Body Mass Index، Body Fat، and Weight Gain with Inflammation Markers among Rural Residents in Japan. Circ J 2003; 67(4): 323-9.
37- Kurutas EB. The Importance of Antioxidants which Play the Role in Cellular Response against Oxidative/Nitrosative Stress: Current State. Nutr J 2015; 15(1): 71-93.
38- Birben E، Sahiner UM، Sackesen C، Erzurum S، Kalayci O. Oxidative Stress and Antioxidant Defense. World Allergy Organ J 2012; 5(1): 9-19.
39- Bondor CI، Potra AR، Moldovan D، Rusu CC، Ciorba Pop M، Muresan A، et al. Relationship of Adiponectin to Markers of Oxidative Stress in Type 2 Diabetic Patients: Influence of Incipient Diabetes-Associated Kidney Disease. Int Urol Nephrol 2015; 47(7): 1173-80.
40- Sharma R, Satyanarayana P, Anand P, Kumari GA. Adiponectin Level Association with MDA in the Patients With Type 2 Diabetes Mellitus. Biomed Pharmacol J 2020; 13(2): 943-55.
41- Balagopal P, George D, Yarandi H, Funanage V, Bayne E. Reversal of Obesity-Related Hypoadiponectinemia by Lifestyle Intervention: A Controlled، Randomized Study in Obese Adolescents. J Clin Endocrinol Metab 2005; 90(11): 6192-7.
42- Bouassida A, Chamari K, Zaouali M, Feki Y, Zbidi A, Tabka Z. Review on Leptin and Adiponectin Responses and Adaptations to Acute and Chronic Exercise. Br J Sports Med 2010; 44(9): 620-30.
43- Gibala MJ, Little JP, MacDonald MJ, Hawley JA. Physiological Adaptations to Low‐Volume، High‐Intensity Interval Training in Health and Disease. J physiol 2012; 590(5): 1077-84.
44- Farzaneh hesari A, Mhdavi ortakand S, Samadi B. Neuromuscular Indices Adaptation of Sarcopenic Elderly Men to High-Intensity Interval Training and L-Citrulline Supplementation. Journal of Sports and Biomotor Sciences 2023; 14(2): 66-76.
45- Shing CM, Webb JJ, Driller MW, Williams AD, Fell JW. Circulating Adiponectin Concentration and Body Composition are Altered in Response to High-Intensity Interval Training. J Strength Cond Res 2013; 27(8): 2213-8.
46- Lee SH, Hong HR, Han TK, Kang HS. Aerobic Training Increases the Expression of Adiponectin Receptor Genes in the Peripheral Blood Mononuclear Cells of Young Men. Biol Sport 2015; 32(3):181-6.
47- Leggate M، Carter WG، Evans MJ، Vennard RA، Sribala-Sundaram S، Nimmo MA. Determination of Inflammatory and Prominent Proteomic Changes in Plasma and Adipose Tissue after High-Intensity Intermittent Training in Overweight and Obese Males. J Appl Physiol 2012; 112(8): 1353-60.
48- Kao HH, Hsu HS, Wu TH, Chiang HF, Huang HY, Wang HJ, et al. Effects of a Single Bout of Short-Duration High-Intensity and Long-Duration Low-Intensity Exercise on Insulin Resistance and Adiponectin/Leptin Ratio. Obes Res Clin Pract 2021; 15(1): 58-63.
49- Naghizadeh H, Heydari F, Pouzesh Jadidi G. The Effect of 12 Weeks of High-Intensity Interval Training and Curcumin Consumption on Glycemic Index، Adiponectin and Lipid Profile in Obese Men with Type2 Diabetes Hyperlipidemia. Journal of Applied Health Studies in Sport Physiology 2023; 10(1): 50-66.
50- Wang X, You T, Murphy K, Lyles MF, Nicklas BJ. Addition of Exercise Increases Plasma Adiponectin and Release from Adipose Tissue. Med Sci Sports Exerc 2015; 47(11): 2450-5.
51- Racil G، Ben Ounis O، Hammouda O، Kallel A، Zouhal H، Chamari K، et al. Effects of High vs. Moderate Exercise Intensity During Interval Training on Lipids and Adiponectin Levels in Obese Young Females. Eur J Appl Physiol 2013; 113(10): 2531-40.
52- Yokoyama H, Emoto M, Araki T, Fujiwara S, Motoyama K, Morioka T, et al. Effect of Aerobic Exercise on Plasma Adiponectin Levels and Insulin Resistance in Type 2 Diabetes. Diabetes Care 2004; 27(7): 1756-8.
53- Tine Kartinah N, Rosalyn Sianipar I, Nafi'ah، Rabia. The Effects of Exercise Regimens on Irisin Levels in Obese Rats Model: Comparing High-Intensity Intermittent with Continuous Moderate-Intensity Training. Biomed Res Int 2018; 2018: 4708287.
54- Dehvari M, Banaeifar A, Arshadi S, Zafar, A. The Effect of Aerobic Training and Cinnamon Extract Gavage on Adiponectin Gene Expression in Liver and Fat Tissues of Male Rats Fed by High Fat Diet. Journal of Animal Physiology and Development (Quarterly Journal of Biological Sciences) 2022; 15(4 (60) ): 97-117. [Persian]
55- Huang H, Iida KT, Sone H, Yokoo T, Yamada N, Ajisaka R. The Effect of Exercise Training on Adiponectin Receptor Expression in Kkay Obese/Diabetic Mice. J endocrinol 2006; 189(3): 643-53.
56- Khedri G، Mogharnasi M. Interaction Effect of 8-Week Aerobic Exercise and Omega-3 Fatty Acid Supplementation on Plasma Adiponectin Concentration. Zahedan J Res Med Sci 2013; 15(3): 36-41.
57- Sabzparvar M, Riyahi Malayeri S, Divkan B. Effect of High-Intensity Interval Training and Aloe Vera Consumption on Serum Adiponectin and Beta Cells Function in Diabetic Male Rats. MEDICAL SCIENCES 2021; 31(3): 299-306. [Persian]
58- Azizi Ghouchan Z, Ravasi AA, Delfan M. The Effect of High Intensity Interval Training on the Gene Expression of Adiponectin and Resistin in Adipose Tissue of Diabetic Rats. J Jiroft Univ Med Sci 2022; 9(1): 915-23. [Persian]
59- Delpisheh A, Safarzade A. The Effect of High-Intensity Interval Training on the Adiponectin and TNF-α Levels of Serum and Adipose Tissues in Rats Fed with a High-Fat Diet Plus Sucrose Solution. Shiraz E-Med J 2022; 23(9): ell9373.
60- Fatouros I, Tournis S, Leontsini D, Jamurtas A, Sxina M, Thomakos P, et al. Leptin and Adiponectin Responses in Overweight Inactive Elderly Following Resistance Training and Detraining are Intensity Related. J Clin Endocrinol Metab 2005; 90(11): 5970-7.
61- Anderson RA، Qin B، Canini F، Poulet L، Roussel AM. Cinnamon Counteracts the Negative Effects of a High Fat/High Fructose Diet on Behavior, Brain Insulin Signaling and Alzheimer-Associated Changes. PloS One 2013; 8(12): e83243.
62- Dyck DJ. Leptin Sensitivity in Skeletal Muscle is Modulated by Diet and Exercise. Exerc Sport Sci Rev 2005; 33(4): 189-94.
63- Rohner-Jeanrenaud F. Aspects of the Neuroendocrine Regulation of Body Weight Homeostasis. Ann Endocrinol (Paris) 2002;63(2 Pt 1):125-128
64- Jonas MI, Kurylowicz A, Bartoszewicz Z, Lisik W, Jonas M, Domienik-Karlowicz J, et al. Adiponectin/Resistin Interplay in Serum and in Adipose Tissue of Obese and Normal-Weight Individuals. Diabetol Metab Syndr 2017; 9: 95-104.
65- Parastesh M, Saremi A. Effect of high Intensity Interval Training on Adiponectin Leptin Ratio and C-Reactive Protein in Streptozotocin Nicotinamide Induced Diabetic Rats. J Ilam Uni Med Sci 2019; 27(1): 192-202. [Persian]
66- Thirupathi A, Wang M, Lin JK, Fekete G, István B, Baker JS, et al. Effect of Different Exercise Modalities on Oxidative Stress: A Systematic Review. BioMed Res Int 2021; 2021: 1-10.
67- Valado A, Pereira L, Paula C. Effect of the Intense Anaerobic Exercise on Nitric Oxide and Malondialdehyde in Studies of Oxidative Stress. International Journal of Biology and Biomedical Engineering 2007; 1(1): 26-32.
68- Leelarungrayub N, Sutabhaha T, Pothongsunun P, Chanarat N. Exhaustive Exercise Test and Oxidative Stress Response in Athletic and Sedentary Subjects. CMU J 2005; 4: 183-90.
69- Ayala A, Muñoz MF, Argüelles S. Lipid Peroxidation: Production، Metabolism، and Signaling Mechanisms of Malondialdehyde and 4-Hydroxy-2-Nonenal. Oxid Med Cell Longev 2014; 2014: 360438.
70- Robertson J, Maughan R, Duthie G, Morrice P. Increased Blood Antioxidant Systems of Runners in Response to Training Load. Clin Sci (Lond);80(6):611-8.
1- Davis JN, Tung A, Chak SS, Ventura EE, Byrd-Williams CE, Alexander KE, et al. Aerobic and Strength Training Reduces Adiposity in Overweight Latina Adolescents. Med Sci Sports Exerc 2009; 41(7): 1494-1503.
2- Rashti B، Mehrabani J، Damirchi A، Babaei P. The Influence of Concurrent Training Intensity on Serum Irisin and Abdominal Fat in Postmenopausal Women. Prz Menopauzalny 2019; 18(3): 166-73.
3- Gholaman M, Gholami M, Azarbayjani MA, Abed Natanzi H. High and Moderate Intensity Aerobic Training Effects on Galectin-3، Pentraxin-3، and Several Inflammatory Mediators Levels in Type 2 Diabetic Women، a Randomized Clinical Trial. Womens Health Bull 2021; 8(4): 238-46.
4- Roque FR, Hernanz R, Salaices M, Briones AM. Exercise Training and Cardiometabolic Diseases: Focus on the Vascular System. Curr Hypertens Rep 2013; 15(3): 204-14.
5- Stout MB، Justice JN، Nicklas BJ، Kirkland JL. Physiological Aging: Links among Adipose Tissue Dysfunction, Diabetes, And Frailty. Physiology (Bethesda) 2017; 32(1): 9-19.
6- García-Hermoso A, Ceballos-Ceballos RJ, Poblete-Aro CE, Hackney AC, Mota J, Ramírez-Vélez R. Exercise، Adipokines and Pediatric Obesity: A Meta-Analysis of Randomized Controlled Trials. Int J Obes. 2017;41(4):475-82.
7- Jahandideh AA, Rohani H, Rajabi H, Shariatzade Joneidi M. Effect of 8-weeks of Combined Exercise Training on Plasma Leptin and Adiponectin levels in Obese Boys. J Applied Health Studies in Sport Physiology 2021; 8(2): 25-33.
8- Guardiola M, Ribalta J, Gómez-Coronado D, Lasunción MA, de Oya M, Garcés C. The Apolipoprotein A5 (APOA5) Gene Predisposes Caucasian Children to Elevated Triglycerides and Vitamin E (Four Provinces Study). Atherosclerosis 2010; 212(2): 543-7.
9- Nakamura K, Fuster JJ, Walsh K. Adipokines: A Link Between Obesity and Cardiovascular Disease. J cardiol 2014; 63(4): 250-9.
10- Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in Inflammation and Metabolic Disease. Nat rev immunol 2011; 11(2): 85-97.
11- Gregor MF, Hotamisligil GS. Thematic Review Series: Adipocyte Biology. Adipocyte Stress: The Endoplasmic Reticulum and Metabolic Disease. J Lipid Res 2007; 48(9): 1905-14.
12- Ahmadi M, Kazemzadeh Y, Mirzayan S, Shahedi V, Eizadi M. Improvement Of Glucose Levels and Insulin Resistance in the Absence of Change in Adiponectin Expression in Subcutaneous Adipose Tissue in Response to Intence Interval Training in Obese Diabetic Rats. Razi Journal of Medical Sciences 2021; 28(8): 33-43. [Persian]
13- Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A Novel Serum Protein Similar To C1q، Produced Exclusively in Adipocytes. J Biol Chem 1995; 270(45): 26746-9.
14- Awad AB, Bradford PG. Adipose Tissue and Inflammation. 1st ed. CRC Press; 2009: 256-300.
15- Baek K, Kang J, Lee J, Kim M, Baek JH. The Time Point-Specific Effect of Beta-Adrenergic Blockade in Attenuating High Fat Diet-Induced Obesity and Bone Loss. Calcif Tissue Int 2018; 103(2): 217-26.
16- Saito K, Tobe T, Minoshima S, Asakawa S, Sumiya J,Yoda M, et al. Organization of the Gene For Gelatin-Binding Protein (GBP28). Gene 1999; 229(1-2): 67-73.
17- Takahashi M, Arita Y, Yamagata K, Matsukawa Y, Okutomi K, Horie M, et al. Genomic Structure and Mutations in Adipose-Specific Gene, Adiponectin. Int J Obes Relat Metab Disord 2000; 24(7): 861-8.
18- Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance، diabetes، and the metabolic syndrome. J Clin Invest 2006; 116(7): 1784-92.
19- Basati G, Pourfarzam M, Movahedian A, Samsamshariat SZ, Sarrafzadegan N. Reduced Plasma Adiponectin Levels Relative to Oxidized Low Density Lipoprotein and Nitric Oxide in Coronary Artery Disease Patients. Clinics (Sao Paulo) 2011; 66(7): 1129-35.
20- Kandula V, Kosuru R, Li H, Yan D, Zhu Q, Lian Q, et al. Forkhead Box Transcription Factor 1: Role in the Pathogenesis of Diabetic Cardiomyopathy. Cardiovasc Diabetol 2016; 15(1):44-56.
21- Saltevo J, Laakso M, Jokelainen J, Keinänen‐Kiukaanniemi S, Kumpusalo E, Vanhala M. Levels of Adiponectin، C‐Reactive Protein and Interleukin‐1 Receptor Antagonist are Associated with Insulin Sensitivity: A Population‐Based Study. Diabetes Metab Res Rev 2008; 24(5): 378-83.
22- Maleki S, Behpoor N, Tadibi V. Effect of 8 Weeks of Resistance Training and Supplementation of Cinnamon on Plasma Levels of Leptin and Adiponectin in Overweight Women. J Practical Studies of Biosciences in Sport 2020; 8(16): 132-42.
23- Martins R, Lithgow GJ, Link W. Long Live FOXO: Unraveling the Role of FOXO Proteins in Aging and Longevity. Aging cell 2016; 15(2): 196-207.
24- Nigro E, Scudiero O, Monaco ML, Palmieri A, Mazzarella G, Costagliola C, et al. New Insight into Adiponectin Role in Obesity and Obesity-Related Diseases. Biomed Res Int 2014; 2014.
25- Degawa‐Yamauchi M, Moss KA, Bovenkerk JE, Shankar SS, Morrison CL, Lelliott CJ, et al. Regulation of Adiponectin Expression in Human Adipocytes: Effects of Adiposity، Glucocorticoids، and Tumor Necrosis Factor Α. Obes Res 2005;13(4): 662-9.
26- Relling DP, Esberg LB, Fang CX, Johnson WT, Murphy EJ, Carlson EC, et al. High-Fat Diet-Induced Juvenile Obesity Leads to Cardiomyocyte Dysfunction and Upregulation of Foxo3a Transcription Factor Independent of Lipotoxicity and Apoptosis. J hypertens 2006; 24(3): 549-61.
27- Sokolovska J, Ostrovska K, Pahirko L, Varblane G, Krilatiha K, Cirulnieks A, et al. Impact of Interval Walking Training Managed Through Smart Mobile Devices on Albuminuria and Leptin/Adiponectin Ratio in Patients with Type 2 Diabetes. Physiol Rep 2020; 8(13): e14506.
28- Kraemer RR, Castracane VD. Exercise and Humoral Mediators of Peripheral Energy Balance: Ghrelin and Adiponectin. Exp Biol Med (Maywood) 2007; 232(2):184-94.
29- Perl A. mTOR Activation is a Biomarker and a Central Pathway to Autoimmune Disorders، Cancer، Obesity، and Aging. Ann N Y Acad Sci 2015; 1346(1): 33-44.
30- Jiménez-Maldonado A، Virgen-Ortiz A، Lemus M، Castro-Rodríguez E، Cerna-Cortés J، Muñiz J، et al. Effects of Moderate-and High-Intensity Chronic Exercise on the Adiponectin Levels in Slow-Twitch and Fast-Twitch Muscles in Rats. Medicina (Kaunas) 2019; 55(6): 291.
31- Wade TE,Mathur A, Lu D, Swartz-Basile DA, Pitt HA, Zyromski NJ. Adiponectin Receptor-1 Expression is Decreased in the Pancreas of Obese Mice. J Surg Res 2009; 154(1): 78-84.
32- Yanai H، Yoshida H. Beneficial Effects of Adiponectin on Glucose and Lipid Metabolism and Atherosclerotic Progression: Mechanisms and Perspectives. Int J Mol Sci 2019; 20(5): 1190.
33- Park CE، Kim M-J، Lee JH، Min B-I، Bae H، Choe W، et al. Resveratrol Stimulates Glucose Transport In C2C12 Myotubes by Activating AMP-Activated Protein Kinase. Exp Mol Med 2007; 39(2): 222-9.
34- Pedersen BK, Febbraio MA. Muscles, Exercise and Obesity: Skeletal Muscle as a Secretory Organ. Nat Rev Endocrinol 2012; 8(8): 457-65.
35- Badid N, Baba Ahmed FZ, Merzouk H, Belbraouet S, Mokhtari N, Merzouk SA, et al. Oxidant/Antioxidant Status، Lipids and Hormonal Profile in Overweight Women with Breast Cancer. Pathol Oncol Res 2010; 16(2): 159-67.
36- Saito I, Yonemasu K, Inami F. Association of Body Mass Index، Body Fat، and Weight Gain with Inflammation Markers among Rural Residents in Japan. Circ J 2003; 67(4): 323-9.
37- Kurutas EB. The Importance of Antioxidants which Play the Role in Cellular Response against Oxidative/Nitrosative Stress: Current State. Nutr J 2015; 15(1): 71-93.
38- Birben E، Sahiner UM، Sackesen C، Erzurum S، Kalayci O. Oxidative Stress and Antioxidant Defense. World Allergy Organ J 2012; 5(1): 9-19.
39- Bondor CI، Potra AR، Moldovan D، Rusu CC، Ciorba Pop M، Muresan A، et al. Relationship of Adiponectin to Markers of Oxidative Stress in Type 2 Diabetic Patients: Influence of Incipient Diabetes-Associated Kidney Disease. Int Urol Nephrol 2015; 47(7): 1173-80.
40- Sharma R, Satyanarayana P, Anand P, Kumari GA. Adiponectin Level Association with MDA in the Patients With Type 2 Diabetes Mellitus. Biomed Pharmacol J 2020; 13(2): 943-55.
41- Balagopal P, George D, Yarandi H, Funanage V, Bayne E. Reversal of Obesity-Related Hypoadiponectinemia by Lifestyle Intervention: A Controlled، Randomized Study in Obese Adolescents. J Clin Endocrinol Metab 2005; 90(11): 6192-7.
42- Bouassida A, Chamari K, Zaouali M, Feki Y, Zbidi A, Tabka Z. Review on Leptin and Adiponectin Responses and Adaptations to Acute and Chronic Exercise. Br J Sports Med 2010; 44(9): 620-30.
43- Gibala MJ, Little JP, MacDonald MJ, Hawley JA. Physiological Adaptations to Low‐Volume، High‐Intensity Interval Training in Health and Disease. J physiol 2012; 590(5): 1077-84.
44- Farzaneh hesari A, Mhdavi ortakand S, Samadi B. Neuromuscular Indices Adaptation of Sarcopenic Elderly Men to High-Intensity Interval Training and L-Citrulline Supplementation. Journal of Sports and Biomotor Sciences 2023; 14(2): 66-76.
45- Shing CM, Webb JJ, Driller MW, Williams AD, Fell JW. Circulating Adiponectin Concentration and Body Composition are Altered in Response to High-Intensity Interval Training. J Strength Cond Res 2013; 27(8): 2213-8.
46- Lee SH, Hong HR, Han TK, Kang HS. Aerobic Training Increases the Expression of Adiponectin Receptor Genes in the Peripheral Blood Mononuclear Cells of Young Men. Biol Sport 2015; 32(3):181-6.
47- Leggate M، Carter WG، Evans MJ، Vennard RA، Sribala-Sundaram S، Nimmo MA. Determination of Inflammatory and Prominent Proteomic Changes in Plasma and Adipose Tissue after High-Intensity Intermittent Training in Overweight and Obese Males. J Appl Physiol 2012; 112(8): 1353-60.
48- Kao HH, Hsu HS, Wu TH, Chiang HF, Huang HY, Wang HJ, et al. Effects of a Single Bout of Short-Duration High-Intensity and Long-Duration Low-Intensity Exercise on Insulin Resistance and Adiponectin/Leptin Ratio. Obes Res Clin Pract 2021; 15(1): 58-63.
49- Naghizadeh H, Heydari F, Pouzesh Jadidi G. The Effect of 12 Weeks of High-Intensity Interval Training and Curcumin Consumption on Glycemic Index، Adiponectin and Lipid Profile in Obese Men with Type2 Diabetes Hyperlipidemia. Journal of Applied Health Studies in Sport Physiology 2023; 10(1): 50-66.
50- Wang X, You T, Murphy K, Lyles MF, Nicklas BJ. Addition of Exercise Increases Plasma Adiponectin and Release from Adipose Tissue. Med Sci Sports Exerc 2015; 47(11): 2450-5.
51- Racil G، Ben Ounis O، Hammouda O، Kallel A، Zouhal H، Chamari K، et al. Effects of High vs. Moderate Exercise Intensity During Interval Training on Lipids and Adiponectin Levels in Obese Young Females. Eur J Appl Physiol 2013; 113(10): 2531-40.
52- Yokoyama H, Emoto M, Araki T, Fujiwara S, Motoyama K, Morioka T, et al. Effect of Aerobic Exercise on Plasma Adiponectin Levels and Insulin Resistance in Type 2 Diabetes. Diabetes Care 2004; 27(7): 1756-8.
53- Tine Kartinah N, Rosalyn Sianipar I, Nafi'ah، Rabia. The Effects of Exercise Regimens on Irisin Levels in Obese Rats Model: Comparing High-Intensity Intermittent with Continuous Moderate-Intensity Training. Biomed Res Int 2018; 2018: 4708287.
54- Dehvari M, Banaeifar A, Arshadi S, Zafar, A. The Effect of Aerobic Training and Cinnamon Extract Gavage on Adiponectin Gene Expression in Liver and Fat Tissues of Male Rats Fed by High Fat Diet. Journal of Animal Physiology and Development (Quarterly Journal of Biological Sciences) 2022; 15(4 (60) ): 97-117. [Persian]
55- Huang H, Iida KT, Sone H, Yokoo T, Yamada N, Ajisaka R. The Effect of Exercise Training on Adiponectin Receptor Expression in Kkay Obese/Diabetic Mice. J endocrinol 2006; 189(3): 643-53.
56- Khedri G، Mogharnasi M. Interaction Effect of 8-Week Aerobic Exercise and Omega-3 Fatty Acid Supplementation on Plasma Adiponectin Concentration. Zahedan J Res Med Sci 2013; 15(3): 36-41.
57- Sabzparvar M, Riyahi Malayeri S, Divkan B. Effect of High-Intensity Interval Training and Aloe Vera Consumption on Serum Adiponectin and Beta Cells Function in Diabetic Male Rats. MEDICAL SCIENCES 2021; 31(3): 299-306. [Persian]
58- Azizi Ghouchan Z, Ravasi AA, Delfan M. The Effect of High Intensity Interval Training on the Gene Expression of Adiponectin and Resistin in Adipose Tissue of Diabetic Rats. J Jiroft Univ Med Sci 2022; 9(1): 915-23. [Persian]
59- Delpisheh A, Safarzade A. The Effect of High-Intensity Interval Training on the Adiponectin and TNF-α Levels of Serum and Adipose Tissues in Rats Fed with a High-Fat Diet Plus Sucrose Solution. Shiraz E-Med J 2022; 23(9): ell9373.
60- Fatouros I, Tournis S, Leontsini D, Jamurtas A, Sxina M, Thomakos P, et al. Leptin and Adiponectin Responses in Overweight Inactive Elderly Following Resistance Training and Detraining are Intensity Related. J Clin Endocrinol Metab 2005; 90(11): 5970-7.
61- Anderson RA، Qin B، Canini F، Poulet L، Roussel AM. Cinnamon Counteracts the Negative Effects of a High Fat/High Fructose Diet on Behavior, Brain Insulin Signaling and Alzheimer-Associated Changes. PloS One 2013; 8(12): e83243.
62- Dyck DJ. Leptin Sensitivity in Skeletal Muscle is Modulated by Diet and Exercise. Exerc Sport Sci Rev 2005; 33(4): 189-94.
63- Rohner-Jeanrenaud F. Aspects of the Neuroendocrine Regulation of Body Weight Homeostasis. Ann Endocrinol (Paris) 2002;63(2 Pt 1):125-128
64- Jonas MI, Kurylowicz A, Bartoszewicz Z, Lisik W, Jonas M, Domienik-Karlowicz J, et al. Adiponectin/Resistin Interplay in Serum and in Adipose Tissue of Obese and Normal-Weight Individuals. Diabetol Metab Syndr 2017; 9: 95-104.
65- Parastesh M, Saremi A. Effect of high Intensity Interval Training on Adiponectin Leptin Ratio and C-Reactive Protein in Streptozotocin Nicotinamide Induced Diabetic Rats. J Ilam Uni Med Sci 2019; 27(1): 192-202. [Persian]
66- Thirupathi A, Wang M, Lin JK, Fekete G, István B, Baker JS, et al. Effect of Different Exercise Modalities on Oxidative Stress: A Systematic Review. BioMed Res Int 2021; 2021: 1-10.
67- Valado A, Pereira L, Paula C. Effect of the Intense Anaerobic Exercise on Nitric Oxide and Malondialdehyde in Studies of Oxidative Stress. International Journal of Biology and Biomedical Engineering 2007; 1(1): 26-32.
68- Leelarungrayub N, Sutabhaha T, Pothongsunun P, Chanarat N. Exhaustive Exercise Test and Oxidative Stress Response in Athletic and Sedentary Subjects. CMU J 2005; 4: 183-90.
69- Ayala A, Muñoz MF, Argüelles S. Lipid Peroxidation: Production، Metabolism، and Signaling Mechanisms of Malondialdehyde and 4-Hydroxy-2-Nonenal. Oxid Med Cell Longev 2014; 2014: 360438.
70- Robertson J, Maughan R, Duthie G, Morrice P. Increased Blood Antioxidant Systems of Runners in Response to Training Load. Clin Sci (Lond);80(6):611-8.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/8/25 | پذیرش: 1402/10/24 | انتشار: 1403/2/15
دریافت: 1402/8/25 | پذیرش: 1402/10/24 | انتشار: 1403/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







