دوره 32، شماره 1 - ( فروردین 1403 )
جلد 32 شماره 1 صفحات 7427-7416 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Lotfi Dashbelagh F, Ghaffarian S. Study the Association between TP53 (rs12602273C>G) Gene Polymorphism with Susceptibility to the Breast Cancer in North West of Iran. JSSU 2024; 32 (1) :7416-7427
URL: http://jssu.ssu.ac.ir/article-1-6046-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6046-fa.html
لطفی داشبلاغ فاطمه، غفاریان سارا. بررسی همراهی چندشکلی ژن TP53 (rs12602273C>G)با استعداد ابتلا به سرطان پستان در شمال غرب ایران. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (1) :7416-7427
متن کامل [PDF 885 kb]
(69 دریافت)
| چکیده (HTML) (81 مشاهده)
متن کامل: (55 مشاهده)
مقدمه
سرطان پستان ناشی از تکثیر غیرطبیعی سلولها در بافت پستان، شایع¬ترین بدخیمی در زنان و عامل اصلی مرگ و میر ناشی از سرطان در زنان سراسر جهان میباشد (1). طبق آمار ارائه شده توسط GLOBOCAN، از مجموع موارد ابتلای زنان به سرطان در سطح جهان در سال۲۰۲۰، میزان بروز سرطان پستان 39/4 درصد، میزان شیوع آن 47/2 درصد و میزان مرگ و میر ناشی از آن 24/5 درصد از جمعیت بوده است، این موارد در ایران به ترتیب 38 درصد، 51 درصد و 20 درصد از جمعیت گزارش شده است. بر اساس آمارها بروز سالانه این سرطان در کشورهایی که دارای میزان پایینی از بروز سرطان پستان بودهاند از جمله ایران در حال افزایش است (2). فاکتور p53 پیشرفت چرخه سلولی را کنترل میکند. جهشهای TP53 در سرطانها رایج هستند (3). این جهشها تقریباً در نیمی از تومورهای انسانی یافت میشوند و به نظر میرسد که بقیه تومورها نیز به علت نقص در مسیرهای مرتبط با P53 ایجاد میشود (4). طبق تحقیقات جدید مبتنی بر توالی یابی نسل جدید، جهشهای TP53 شایعترین تغییرات ژنتیکی در سرطان پستان بوده و بهطور متوسط 30 درصد از آنها را تشکیل میدهند. از سوی دیگر، توزیع این جهشها به شدت با زیرگروههای تومور مرتبط است (5). ژن TP53 مستقر بر روی بازوی کوتاه کروموزوم شماره 17 به طول 20 کیلو باز و با 11 اگزون عملکردی (6)، به عنوان مهـمتـرین ژن مهارکننـده تومـور، پروتئین P53 را کد میکند که یک فسفوپروتئین هستهای متشکل از 939 اسید آمینــه و چندین دومین عملکردی است و بیان بیش از 2500 ژن هدف را تنظیم میکند (7). عملکردهای قابل توجه p53 شامل برهمکنش با پروتئینهای اتصال یابنده به TATA و مهار رونویسی، کنترل چرخه سلولی، پاسخ به آسیب DNA و ترمیم DNA آسیب دیده یا القای آپوپتوز، و ویژگیهای بازدارندگی توموری و آنکوژنی هستند (8). پروتئین تومور p53 چرخه سلولی را از طریق اتصال مستقیم DNA کنترل میکند (9). فرآورده ژن p53 چرخه سلولی را در G1 و با ممانعت از فعالیت کمپلکسهای –cdk2 سایکلین D و –cdk2 سایکلین E متوقف میکند و بدین ترتیب موجب مهار آنزیمهای کینازی وابسته به گروهی از پروتئینها به نام سایکلینها میشود (10). یکی از عملکردهای عمدهی ژن TP53 در ارتباط با تومورها، سرکوب تومور از طریق تنظیم سوخت و ساز است. مطالعات نشان دادهاند P53 نقش مهمی در تنظیم سوخت و ساز سلولی به ویژه گلیکولیز و فسفوریلاسیون اکسیداتیو سلولهای سرطانی دارد (11). سلولهای سرطانی برای تامین انرژی نیاز به مصرف گلوکز بالاتر و گلیکولیز هوازی بیشتری دارند (12). در این سلولها القای بیان ژن TIGAR با کاهش گلیکولیز سبب ممانعت از توسعه فرمهای تهاجمی سرطان و با کاهش ROS از آپوپتوز القا شونده از طریق P53 جلوگیری میکند و افزایش بیان SCO2 با افزایش فسفوریلاسیون اکسیداتیو منجر به افزایش ROSها (Reactive oxygen species) و آپوپتوز وابسته به P53 میشود. ژن P53 با القای بیان ژنهای TIGARو SCO علاوه بر تنظیم سوخت و ساز سلول های سرطانی، سرنوشت این سلولها را نیز کنترل میکند. ژن P53 با بیان TIGAR در آسیبهای با دوز پایین و قابل ترمیم، سبب توقف چرخهی سلولی میشود، اما همین ژن در آسیبهای شدید و غیر قابل ترمیم، ژن SCO را فعال و سلول را وادار به آپوپتوز میکند (11).
مشــخص شــده که در اغلب ســرطانهای انســانی P53 غیر فعــال و یــا عملکرد آن مختل میشــود. همچنین نشان داده شده است که این پروتئین نقــش حیاتــی در جلوگیــری از گسترش تومور دارد (13). شایعترین اختلال در سرطانهای انسانی جهش در ژن P53 است. درصد بالایی (87٪) از جهشهای ژن TP53 شــامل جایگزینــی یــک باز میشــود .(14) بهعلاوه، WRAP53 یک نسخه آنتیسنس طبیعی از P53 است که رونویسی TP53 را تنظیم و به عنوان یک پروتئین، چرخه سلولی طبیعی را تعدیل و میتواند منجر به حساسیت به سرطان پستان شود (15).
چندشکلیهای تکنوکلئوتیدی(SNPs) زمانی اتفاق میافتند که یک نوکلئوتید منفرد با نوکلئوتید دیگری جایگزین میشود و این رایجترین نوع تغییر در DNA است. SNPها فراوانترین و پایدارترین تنوع ژنتیکی در ژنومها هستند (16). بیش از ۲00 چندشکلی تک نوکلئوتیدی (SNP) در ژن p53 شناسایی شدهاند که بالای 90 درصد آنها در نواحی غیر کدکننده قرار گرفتهاند. این تغییرات ممکن است بر عملکرد پروتئین p53 تأثیر و در نتیجه بر خطر سرطان، پیشرفت یا پاسخ به درمان تأثیر بگذارد (17). پولادی و همکاران در مطالعهای روی زنان آذری ایرانی، ژن TP53 را به عنوان یک ژن مهم در تنظیم چرخه سلولی دانسته و هاپلوتایپ CAGC را به عنوان یک عامل خطر و هاپلوتایپ GACC را به عنوان یک عامل محافظتی در برابر سرطان پستان معرفی کردند (15). سامانی و همکاران در مطالعهای SNP شماره rs1625895 ژن p53 با بروز سرطان پستان در زنان ژنوتیپ هموزیگوت GG متداولترین ژنوتیپ در ارتباط با افزایش خطر ابتلا به سرطان پستان زنان ایرانی است (18). بر اساس مطالعه رو و همکاران هیچکدام از 5 SNP ,-rs12951053، rs1042522، rs8064946، rs9895829 و rs12602273 ژن TP53 ارتباط معنیداری با بیماری استئوسارکوما در جمعیت چینی نداشتند (0/05>P) (19). لین و همکاران همراهی دو آللrs9895829G وrs1788227C از ژن p53 را با سرطان مثانه بر روی جمعیت کائوسینگ تایوان با استفاده از روش Tetra ARMS-PCR نشان دادند (20). با توجه به اهمیت ژن TP53 و شناسایی جهشهای آن در اغلب موارد ابتلا به سرطان، بررسی منابع انجام شده و عدم وجود گزارش قبلی از چند شکلی SNPی rs12602273C>G ژن TP53 در جمعیت شمال غرب ایران، در این مطالعه همراهی چندشکلی rs1972820G>A واقع در موقعیت 17:7679695 (GRCh38) در ناحیه 3′UTR این ژن و دارای دو آلل C و G (21) با استعداد ابتلا به سرطان پستان در شمال غرب ایران مورد بررسی قرار گرفت.
روش بررسی
نمونهگیری: این مطالعه یک بررسی موردی-شاهدی بوده و انتخاب بیماران بهصورت تصادفی انجام شد. جمعیت مورد مطالعه شامل 100 زن مبتلا به سرطان پستان و 100 زن سالم بدون سابقه فامیلی سرطان در اقوام درجه یک و دو آنها بود. برای محاسبه تعداد نمونه از رابطه کوکران استفاده شد و تعداد افراد نمونه کنترل نیز مطابق با نمونه بیمار تعیین شد. نمونهگیری و ثبت مشخصات افراد با کسب اجازه از آنها انجام شد و از هر فرد 4 سی¬سی خون وریدی گرفته شد. استخراج DNA از خون به روش نمک اشباع(out Salting) انجام شد. سپس بررسی کیفیت و کمیت DNA استخراجی با استفاده از الکتروفورز ژل آگاروز یک درصد و اسپکتروفتومترانجام شد.
تکنیک Tetra ARMS-PCR: بررسی چندشکلی rs12602273C>G ژن TP53 با استفاده از تکنیک Tetra-primer Amplification Refractory Mutation System Polymerase Chain Reaction (Tetra ARMS-PCR) انجام شد. توالی آغازگرها بر مبنای مطالعه Lin و همکاران طراحی (20) و سنتز آنها توسط شرکت Metabion (Gernany) انجام شد (جدول 1). مشخصات و توالی آغازگرهای مورد استفاده برای تکثیر توالی چندشکلی rs12602273 در جدول 1 و محل اتصال آغازگرها در شکل 1 نشان داده شده است. چرخه¬های حرارتی واکنش زنجیره پلیمراز شامل واسرشتهسازی (Denaturing) اولیه در دمای 94 درجه سانتیگراد به مدت 5 دقیقه، 35 چرخه تکثیر در چرخه حرارتی شامل واسرشتهسازی به مدت30 ثانیه در 94 درجه سانتیگراد، اتصال پرایمرها به مدت 40 ثانیه در دمای 40 درجه سانتیگراد و گسترش در دمای 72 درجه سانتیگراد به مدت 40 ثانیه و یک چرخه گسترش نهایی در دمای 72 درجه سانتیگراد به مدت 5 دقیقه بود. بعد از بهینهسازی چرخهها و ترکیبات واکنش PCR، واکنش زنجیرهای پلیمراز در حجم نهایی 10/75 میکرولیتر با اجزای 3/5 میکرولیتر MasterMix (AMPLIQON, Denmark)، 1/25 میکرولیتر از هر کدام از آغازگرهای خارجی و 2 میکرولیتر از هر کدام از آغازگرهای داخلی در میکروتیوب 0/5 با یکدیگر مخلوط شدند تمام مراحل روی یخ انجام شد. نمونهها جهت انجام واکنش در دستگاه Thermal Cycler (ABI, Thermo Fisher Scientific, USA ) قرار گرفت. چرخههای حرارتی واکنش زنجیره¬ای پلیمراز شامل یک چرخه در دمای °C 94 به مدت 300 ثانیه جهت واسرشتهسازی اولیه، سپس واسرشتهسازی در °C 94 به مدت 30 ثانیه، اتصال آغازگرها در دمای °C 40 به مدت 40 ثانیه و بسط در دمای °C 72 به مدت 40 ثانیه برای 35 چرخه و یک چرخه بسط نهایی در °C 72 به مدت 10 دقیقه بود. محصولات حاصل از واکنش زنجیرهای پلیمراز بر روی ژل آگارز 2 درصد الکتروفورز شدند. اندازه قطعات تکثیر شده بر روی ژل آگارز با استفاده از نشانگر اندازه DNA، bp1000 (SinaClon, Iran) تعیین شد. رنگآمیزی محصولات واکنش زنجیرهای پلیمراز با استفاده از Safe Stain (SinaClon, Iran) انجام شد.
تجزیه و تحلیل آماری
با توجه به ماهیت مورد - شاهدی مطالعه، تجزیه و تحلیل آماری نتایج بین افراد بیمار و سالم و زیرگروه¬های بیمار بهصورت مقایسهای انجام شد. ارتباط بین ژنوتیپها و آللها بین گروه شاهد و بیمار با استفاده از آزمون مربع کای پیرسون بررسی شد. شدت ارتباط بین چند شکلیها و ریسک ابتلا به سرطان با استفاده از نسبت شانس با فاصله اطمینان ۹۵% محاسبهگردید. کاوشهای آماری ذکر شده با استفاده از برنامه javastat online statistics package به آدرس http://statpages.org/ctab2x2.html)) انجام شد. برای بررسی ارتباط بین مشخصات بالینی بیماران شامل سن بیماران، درجه تومور، درگیری لنف، سمت درگیر، اندازه تومور، مرحله تومور و نوع بیماری با توزیع ژنوتیپی و شاخص میانگین از نرمافزارversion 16 SPSS استفاده شد. در تمامی آزمونها، p<0.05 بهعنوان سطح معنیداری درنظرگرفته شد. همچنین آنالیزهای In silico برای این چندشکلی با استفاده از نرمافزارهای SplicAid2، Alibaba و RNAsnp انجام گرفت.
جدول 1: توالی آغازگرهای مورداستفاده و اندازه قطعات تکثیری طی واکنش زنجیره¬ای پلیمراز


شکل 1: محل اتصال پرایمرها بر روی توالی ژن TP53
نتایج
از بین 100 بیمار بررسی شده، تکثیر DNA به روشTetra ARMS-PCR در 92 بیمار با موفقیت انجام شد. از بین 92 بیمار دارای تکثیر موفق، ویژگیهای بالینی شامل سمت درگیر برای 11 بیمار، سن برای 10 بیمار، نوع تومور برای 19 بیمار، مرحله تومور برای 35 بیمار، سایز تومور برای 19 بیمار و درگیری لنفی برای 25 بیمار در دسترس نبود. اطلاعات بالینی بیماران در جدول 3 ذکر شده است. طول قطعات حاصل از واکنش PCR برای نوار کنترل حاصل تکثیر توسط پرایمرهای Outer Forward و outer Reverse، 203 جفت باز، برای نوار C مربوط به الل وحشی حاصل تکثیر توسط پرایمرهای Outer Forward و Inner Reverse، 143 جفت باز و برای نوار G مربوط به الل جهش یافته حاصل تکثیر توسط پرایمرهای outer Reverse و Inner forward، 102 جفت باز بود (شکل 2).
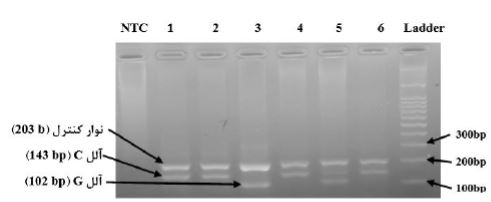
شکل 2: الکتروفورز محصوالت PCR مربوط به ژنوتیپ های CC، CG و GG افراد بیمار بر روی ژل آگارز 2 درصد
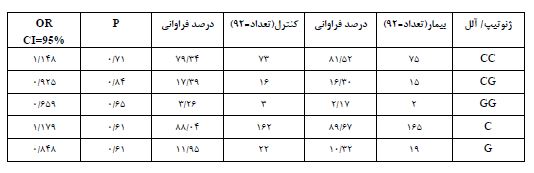
توزیع فراوانی ژنوتیپی بین دو گروه بیمار و کنترل: بر اساس نتایج حاصل از این پژوهش در جمعیت کنترل بیشترین فراوانی متعلق به ژنوتیپ CC با فراوانی 79/34 درصد (73 نفر) و کمترین فراوانی متعلق به ژنوتیپ GG با فراوانی 3/26 درصد (3 نفر) بود. فراوانی هتروزیگوتهای CG برابر با 17/39 درصد (16 نفر) بود. در جمعیت بیماران مورد مطالعه بیشترین فراوانی و کمترین فراوانی به ترتیب متعلق به ژنوتیپهای CC و GG با فراوانی 81/52 (75 نفر) و 2/17 (2 نفر) درصد بود. فراوانی ژنوتیپ CG، 16/3 درصد (15 نفر) بود. برای ژنوتیپهای CC، CG و GG مقادیر P به ترتیب 0/71، 0/84 و 0/65 بود. ارتباط معنیداری بین فراوانی هیچکدام از ژنوتیپهای جایگاه چندشکل rs12602273C>G ژن TP53 با احتمال ابتلا به سرطان پستان مشاهده نشد (جدول 2).
توزیع فراوانی آللی بین دو گروه بیمار و کنترل: در جمعیت کنترل فراوانی آلل C، 89/67 درصد (با تعداد 162) و فراوانی آلل G، 11/95 درصد (با تعداد 22) بود. در جمعیت بیمار فراوانی آللG ، 88/04 درصد (با تعداد 165) و فراوانی آلل G، 10/32 درصد (با تعداد 19) بود. در هر دو گروه بیمار و کنترل آلل C بیشترین فراوانی را داشت. مقدار P برای هر دو آلل¬ C و G برابر با 0/61 بود. نتایج نشان دهنده عدم همراهی فراوانی آللی چندشکلی جایگاه rs12602273C>G ژن TP53 با سرطان پستان بود (جدول 2). همراهی فراوانی آللی
چندشکلی جایگاه rs12602273C>G ژن TP53 با سرطان پستان در بیماران دارای تومورهای IDC نیز غیرمعنیدار بود (0.186=P).
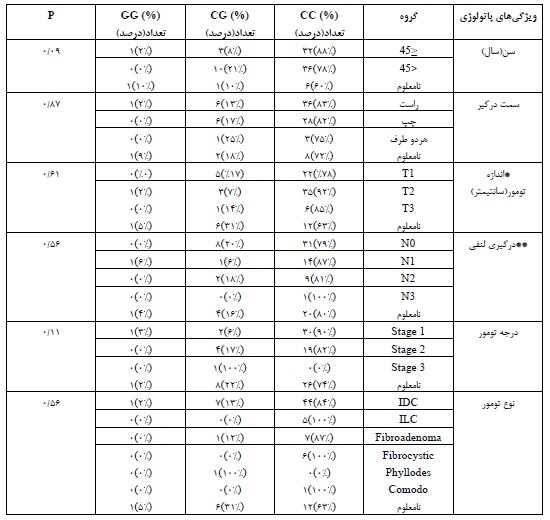
همراهی چندشکلی rs1260073 ژن TP53 با علائم بالینی بیماران: با بررسی ارتباط چندشکلی rs12602273 ژن TP53 با علائم بالینی بر اساس تجزیههای انجام شده ارتباط معنی¬داری بین توزیع فراوانیهای ژنوتیپی چندشکلی rs12602273 ژن TP53 با علائم بالینی شامل نوع تومور (0.56=P)، درجه تومور (0.11=P)، سن (0.09=P) ، سمت درگیر (0.87=P)، اندازه تومور (0.61=P) و درگیری غدد لنفی (0.56=P) مشاهده نشد (جدول 3). با توجه به تعداد زیاد افرادی با تومورهای IDC، تجزیه همراهی این چندشکلی با سن این دسته از بیماران نیز انجام شد که نشان دهنده عدم همراهی سن با تومورهای IDC بود (0.20=P).
آنالیز In silico جایگاه چندشکل rs1260073 ژن TP53: تغییرات ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 توسط نرمافزار آنالین RNAsnp در شکل شماره 3 نشان داده شده است. بر این اساس تغییر ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 منجر به کاهش ∆G آلل جهش یافته (∆G=-47.80 kcal/mol) در مقایسه با آلل طبیعی (∆G= -51.60 kcal/mol) با 68/0 P= شد که غیرمعنیدار بود (P>0/2). نتایج حاصل از آنالیز چندشکلیهای مورد نظر بر روی ژن TP53 توسط نرمافزار Splice Aid2 نشان داد که در حالت جهشیافته دو پروتئین SC35 و ETR-3 با امتیاز 5+ به RNA متصل میشوند. اتصال با امتیاز مثبت منجر به تسهیل پیرایش اگزون، و با امتیاز منفی باعث تسهیل پیرایش اینترون میشود. اطلاعات حاصل از این آنالیز در شکل 4 قابل مشاهده است. نتایج حاصل از آنالیز چندشکلی مورد نظر بر روی ژن TP53 توسط نرمافزار ALIbaba2.1، نشاندهنده تمایل فاکتورهای رونویسی متفاوت به ناحیه موردنظر در حالت وحشی و جهشیافته است. نتایج حاصل از این آنالیز در جدول 3 قابل مشاهده است.
جدول 2: توزیع فراوانی ژنوتیپی و آللی در افراد کنترل و بیمار
جدول 3: ویژگیهای بالینی بیماران و توزیع چندشکلی تک نوکلئوتیدی rs12602273 آلل C در ارتباط با مشخصات بالینی بیماران (n=92)
* T1≤ 2cm, T2: 2-5cm, T3> 5cm, ** N0: 0, N1: 1-3cm, N2: 4-9cm, N3≥ 10cm

شکل 3: تغییرات ساختار فضایی ناشی از چندشکلی rs12602273 ژن) TP53 A: آلل حالت جهشیافته ∆G = -47.80 kcal/mol و B: آلل طبیعی(∆G = -51.60 kcal/mol) .

شکل4: آنالیز چندشکلی ژن TP53 توسط نرمافزار آنلاین Splice Aid2
(A: عدم اتصال دو پروتیین SC35 وETR-3 ، B: اتصال دو پروتئین SC35 و ETR-3 ).
جدول 3: آنالیز چندشکلی ژن TP53 توسط نرمافزار آنلاین ALIbaba2.1

بحث
فراوانی ژنوتیپهای CC، CG و GG در بیماران به ترتیب 81/52، 16/30 و 2/17 درصد و فراوانی آللهای C و G در افراد بیمار به ترتیب 89/67 و 10/32 درصد بود. در جمعیت کنترل فراوانی آللهای C و G در افراد بیمار به ترتیب 88/04 و 11/95 درصد بود. تجزیههای آماری نشان دهنده عدم همراهی فراوانی ژنوتیپی و آللی چندشکلی(rs12602273C>G) ژن TP53 با سرطان پستان بود. همچنین بر اساس نتایج حاصل از این مطالعه، همراهی معناداری بین چندشکلی مورد مطالعه با ویژگیهای بالینی بیماران مبتلا به سرطان پستان در زنان شمالغرب ایران مشاهده نشد. ژن TP53 یک ژن سرکوب کننده تومور است که نقش کلیدی در بسیاری از مسیرهای سلولی دارد. از مهمترین عملکردهای P53 میتوان به نقش آن در فعالیتهای ضروری سلول مانند تکثیر، تمایز، مرگ سلولی، ترمیم DNA و تشکیل عروق خونی اشاره کرد. جهشهای TP53 در سرطانها رایج هستند بطوریکه جهشهای ژن p53 بیشترین فراوانی را در سرطانهای انسان دارد. جهشهای این ژن تقریبا در ۲۵ تا ۳۰ درصد موارد سرطان پستان شناسایی شده است (22). ارزیابی دقیق جهش¬های این ژن در مبتلایان به سرطان پستان میتواند درتشخیص، پیش آگهی یا درمان آن اهمیت داشته باشد. نجفی درچه و همکاران در مطالعهای روی جمعیت زنان اصفهان ارتباط معنیداری بین پلیمورفیسم تکرار TAAAA در ژن p53 و خطر ابتلا به سرطان پستان گزارش کردند. در این مطالعه ارتباط معنیداری بین این ژنوتیپها با درجهی پیشرفت بیماری، وضعیت بیان گیرندههای استروژن، پروژسترون و Her2 و سن مشاهده نشد (23). همچنین شیخپور و تقیپور ظهیر در مطالعهای بر روی زنان مبتلا به سرطان پستان یزد، توزیع پلیمورفیسم کدون 72 برای ژنوتیپهای آرژنین/آرژنین، پرولین/پرولین و آرژنین/ پرولین را در بیماران به ترتیب 49/04، 5 21/1، 1 29/8 درصد و در گروه کنترل به ترتیب 21/15، 26/92، 51/39 درصد گزارش کردند. بر این اساس تفاوت آماری معنیداری بین توزیع ژنوتیپ آرژنین/ آرژنین و آرژنین/ پرولین ژن p53در افراد سرطانی و کنترل دیده شد .(p˂0.05) بر اساس این مطالعه ژنوتیپ Arg/Arg یک عامل ژنتیکی مستعدکننده برای ابتلا به سرطان پستان و ژنوتیپ Arg/Pro دارای نقش حفاظتی در برابر سرطان پستان شناخته شد (24). در مطالعهای توسط Pouladi و همکاران اثرات ترکیبی ژنوتیپ چندشکلیهای TP53 و PAI-1 در حساسیت به سرطان پستان بررسی شد. در این مطالعه مورد-شاهدی 200 فرد مبتلا به سرطان پستان و 179 فرد سالم مورد مطالعه قرار گرفتند. یافتهها نشان داد که چندشکلی کدون 72 ژن TP53 به طور معنیداری با مرحله تومور مرتبط است (P=0/023) ((25). در مطالعهای که توسط Lin و همکاران بر روی همراهی چندشکلی 5 SNPی ژن TP53 از جمله rs12602273 با سرطان مثانه، در جمعیت کائوسینگ تایوان متشکل از 201 بیمار و 311 کنترل بدون سرطان انجام گرفت، نشان داده شد در این جمعیت آللهای (P=0.003) rs9895829G و آلل rs1788227C (P=0.027) هر دو با بروز سرطان مثانه مرتبط هستند. همچنین هاپلوتیپهای GTT (P=0.001) و GGTC (P=0.001) با بروز کم سرطان مثانه در ارتباط بودند. در مقابل، هیچیک از هاپلوتیپهای SNPهای rs9895829، rs12602273، rs17882227 و rs2287497 ارتباط معنیداری با درجه بالای تومور یا تهاجم عضلانی نداشتند (20). در مطالعه حاضرکه اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در شمالغرب ایران است، همانند مطالعهLin و همکاران، که همراهی چندشکلی rs12602273را بر روی سرطان مثانه مورد بررسی قرار دادند (20)، هیچکدام از ژنوتیپهای CC ، CG و GG چند-شکلی rs12602273C>G ژن TP53در جمعیتهای مورد بررسی بهترتیب با سرطان پستان (P=0.7) و سرطان مثانه (P=0.054)همراهی معناداری نشان ندادند. اما فراوانی آللی همراهی معناداری با سرطان مثانه (P=0.041) نشان داد. همچنین براساس نتایج مطالعه حاضر هیچیک از ژنوتیپهای چندشکل با علائم بالینی افراد بیمار از قبیل سن، اندازه تومور، درجه تومور، درگیری غدد لنفاوی، سمت درگیری و نوع تومور همراهی معناداری نداشتند. با توجه به اینکه این اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در شمالغرب ایران است میتواند نشاندهنده عدم همراهی چندشکلی مورد مطالعه با سرطان پستان در زنان این منطقه باشد. عدم تغییر در ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 با وجود تغییر در ∆G، و اتصال فاکتور رونویسی مشابه به اینجا برای دو الل وحشی و جهش یافته نشان دهنده مطابقت نتایج حاصل از پژوهش در جهت عدم همراهی این چندشکلی با ریسک ابتلا به سرطان در جمعیت مورد مطالعه بود. توصیه میشود در مطالعات مشابه یک نمونه از هر ژنوتیپ توالییابی و از صحت نوارهای تکثیر شده اطمینان حاصل شود. همچنین جهت اطمینان بررسی ارتباط چندشکلی rs12602273 با احتمال ابتلا به سرطان پستان در جامعه آماری بزرگتری از افراد بیمار و سالم، مطالعه بیان افتراقی این ژن در افراد بیمار و سالم، آنالیزهای in silico بیشتر با استفاده از داده پایگاههای متعدد توصیه میشود.
نتیجهگیری
در مطالعه حاضر هیچکدام از ژنوتیپ های CC ، CG و GG چندشکلی rs12602273 ژن TP53 در جمعیت مورد بررسی همراهی معناداری با سرطان پستان نداشتند. همچنین هیچیک از ژنوتیپ های مورد نظر با علائم بالینی افراد بیمار از قبیل سن، اندازه تومور، درجه تومور، درگیری غدد لنفاوی، سمت درگیری و نوع تومور همراهی موثری نداشتند. با توجه به اینکه این اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در زنان شمالغرب ایران است می¬تواند نشان دهنده عدم همراهی چندشکلی مورد مطالعه با سرطان پستان در زنان این منطقه باشد.
سپاسگزاری
پژوهش فوق حاصل پایاننامه کارشناسی ارشد رشته زیستشناسی با گرایش سلولی - مولکولی مصوب شورای تحصیلات تکمیلی دانشگاه شهید مدنی آذربایجان در تاریخ 06/06/1401 است. این مطالعه در آزمایشگاه زیستشناسی سلولی - مولکولی گروه زیست دانشگاه شهید مدنی آذربایجان و با بودجه اختصاص یافته معاونت پژوهش به پایاننامه دانشجو انجام یافته است.
حامی مالی: این پژوهش با بودجه اختصاص یافته معاونت پژوهش دانشگاه شهید مدنی آذربایجان به پایاننامه دانشجو انجام یافته است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
تمامی اطلاعات مربوط به بیماران پروندههای آنها بیماران استخراج، فرم رضایت انجام طرح تحقیقاتی توسط بیماران تکمیل، و هیچ نوع مداخله اضافی از طرف محققین بر روی بیماران صورت نگرفت. نام و نشانی بیماران کاملأ محرمانه خواهد بود. این پژوهش با کد اخلاق به شماره IR.AZARUNIV.REC.1401.018 در کمیته اخلاق دانشگاه شهید مدنی آذربایجان تصویب شد.
مشارکت نویسندگان
سارا غفاریان در ارائه ایده و طراحی مطالعه، فاطمه لطفی در جمعآوری دادهها، سارا غفاریان و فاطمه لطفی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
سرطان پستان ناشی از تکثیر غیرطبیعی سلولها در بافت پستان، شایع¬ترین بدخیمی در زنان و عامل اصلی مرگ و میر ناشی از سرطان در زنان سراسر جهان میباشد (1). طبق آمار ارائه شده توسط GLOBOCAN، از مجموع موارد ابتلای زنان به سرطان در سطح جهان در سال۲۰۲۰، میزان بروز سرطان پستان 39/4 درصد، میزان شیوع آن 47/2 درصد و میزان مرگ و میر ناشی از آن 24/5 درصد از جمعیت بوده است، این موارد در ایران به ترتیب 38 درصد، 51 درصد و 20 درصد از جمعیت گزارش شده است. بر اساس آمارها بروز سالانه این سرطان در کشورهایی که دارای میزان پایینی از بروز سرطان پستان بودهاند از جمله ایران در حال افزایش است (2). فاکتور p53 پیشرفت چرخه سلولی را کنترل میکند. جهشهای TP53 در سرطانها رایج هستند (3). این جهشها تقریباً در نیمی از تومورهای انسانی یافت میشوند و به نظر میرسد که بقیه تومورها نیز به علت نقص در مسیرهای مرتبط با P53 ایجاد میشود (4). طبق تحقیقات جدید مبتنی بر توالی یابی نسل جدید، جهشهای TP53 شایعترین تغییرات ژنتیکی در سرطان پستان بوده و بهطور متوسط 30 درصد از آنها را تشکیل میدهند. از سوی دیگر، توزیع این جهشها به شدت با زیرگروههای تومور مرتبط است (5). ژن TP53 مستقر بر روی بازوی کوتاه کروموزوم شماره 17 به طول 20 کیلو باز و با 11 اگزون عملکردی (6)، به عنوان مهـمتـرین ژن مهارکننـده تومـور، پروتئین P53 را کد میکند که یک فسفوپروتئین هستهای متشکل از 939 اسید آمینــه و چندین دومین عملکردی است و بیان بیش از 2500 ژن هدف را تنظیم میکند (7). عملکردهای قابل توجه p53 شامل برهمکنش با پروتئینهای اتصال یابنده به TATA و مهار رونویسی، کنترل چرخه سلولی، پاسخ به آسیب DNA و ترمیم DNA آسیب دیده یا القای آپوپتوز، و ویژگیهای بازدارندگی توموری و آنکوژنی هستند (8). پروتئین تومور p53 چرخه سلولی را از طریق اتصال مستقیم DNA کنترل میکند (9). فرآورده ژن p53 چرخه سلولی را در G1 و با ممانعت از فعالیت کمپلکسهای –cdk2 سایکلین D و –cdk2 سایکلین E متوقف میکند و بدین ترتیب موجب مهار آنزیمهای کینازی وابسته به گروهی از پروتئینها به نام سایکلینها میشود (10). یکی از عملکردهای عمدهی ژن TP53 در ارتباط با تومورها، سرکوب تومور از طریق تنظیم سوخت و ساز است. مطالعات نشان دادهاند P53 نقش مهمی در تنظیم سوخت و ساز سلولی به ویژه گلیکولیز و فسفوریلاسیون اکسیداتیو سلولهای سرطانی دارد (11). سلولهای سرطانی برای تامین انرژی نیاز به مصرف گلوکز بالاتر و گلیکولیز هوازی بیشتری دارند (12). در این سلولها القای بیان ژن TIGAR با کاهش گلیکولیز سبب ممانعت از توسعه فرمهای تهاجمی سرطان و با کاهش ROS از آپوپتوز القا شونده از طریق P53 جلوگیری میکند و افزایش بیان SCO2 با افزایش فسفوریلاسیون اکسیداتیو منجر به افزایش ROSها (Reactive oxygen species) و آپوپتوز وابسته به P53 میشود. ژن P53 با القای بیان ژنهای TIGARو SCO علاوه بر تنظیم سوخت و ساز سلول های سرطانی، سرنوشت این سلولها را نیز کنترل میکند. ژن P53 با بیان TIGAR در آسیبهای با دوز پایین و قابل ترمیم، سبب توقف چرخهی سلولی میشود، اما همین ژن در آسیبهای شدید و غیر قابل ترمیم، ژن SCO را فعال و سلول را وادار به آپوپتوز میکند (11).
مشــخص شــده که در اغلب ســرطانهای انســانی P53 غیر فعــال و یــا عملکرد آن مختل میشــود. همچنین نشان داده شده است که این پروتئین نقــش حیاتــی در جلوگیــری از گسترش تومور دارد (13). شایعترین اختلال در سرطانهای انسانی جهش در ژن P53 است. درصد بالایی (87٪) از جهشهای ژن TP53 شــامل جایگزینــی یــک باز میشــود .(14) بهعلاوه، WRAP53 یک نسخه آنتیسنس طبیعی از P53 است که رونویسی TP53 را تنظیم و به عنوان یک پروتئین، چرخه سلولی طبیعی را تعدیل و میتواند منجر به حساسیت به سرطان پستان شود (15).
چندشکلیهای تکنوکلئوتیدی(SNPs) زمانی اتفاق میافتند که یک نوکلئوتید منفرد با نوکلئوتید دیگری جایگزین میشود و این رایجترین نوع تغییر در DNA است. SNPها فراوانترین و پایدارترین تنوع ژنتیکی در ژنومها هستند (16). بیش از ۲00 چندشکلی تک نوکلئوتیدی (SNP) در ژن p53 شناسایی شدهاند که بالای 90 درصد آنها در نواحی غیر کدکننده قرار گرفتهاند. این تغییرات ممکن است بر عملکرد پروتئین p53 تأثیر و در نتیجه بر خطر سرطان، پیشرفت یا پاسخ به درمان تأثیر بگذارد (17). پولادی و همکاران در مطالعهای روی زنان آذری ایرانی، ژن TP53 را به عنوان یک ژن مهم در تنظیم چرخه سلولی دانسته و هاپلوتایپ CAGC را به عنوان یک عامل خطر و هاپلوتایپ GACC را به عنوان یک عامل محافظتی در برابر سرطان پستان معرفی کردند (15). سامانی و همکاران در مطالعهای SNP شماره rs1625895 ژن p53 با بروز سرطان پستان در زنان ژنوتیپ هموزیگوت GG متداولترین ژنوتیپ در ارتباط با افزایش خطر ابتلا به سرطان پستان زنان ایرانی است (18). بر اساس مطالعه رو و همکاران هیچکدام از 5 SNP ,-rs12951053، rs1042522، rs8064946، rs9895829 و rs12602273 ژن TP53 ارتباط معنیداری با بیماری استئوسارکوما در جمعیت چینی نداشتند (0/05>P) (19). لین و همکاران همراهی دو آللrs9895829G وrs1788227C از ژن p53 را با سرطان مثانه بر روی جمعیت کائوسینگ تایوان با استفاده از روش Tetra ARMS-PCR نشان دادند (20). با توجه به اهمیت ژن TP53 و شناسایی جهشهای آن در اغلب موارد ابتلا به سرطان، بررسی منابع انجام شده و عدم وجود گزارش قبلی از چند شکلی SNPی rs12602273C>G ژن TP53 در جمعیت شمال غرب ایران، در این مطالعه همراهی چندشکلی rs1972820G>A واقع در موقعیت 17:7679695 (GRCh38) در ناحیه 3′UTR این ژن و دارای دو آلل C و G (21) با استعداد ابتلا به سرطان پستان در شمال غرب ایران مورد بررسی قرار گرفت.
روش بررسی
نمونهگیری: این مطالعه یک بررسی موردی-شاهدی بوده و انتخاب بیماران بهصورت تصادفی انجام شد. جمعیت مورد مطالعه شامل 100 زن مبتلا به سرطان پستان و 100 زن سالم بدون سابقه فامیلی سرطان در اقوام درجه یک و دو آنها بود. برای محاسبه تعداد نمونه از رابطه کوکران استفاده شد و تعداد افراد نمونه کنترل نیز مطابق با نمونه بیمار تعیین شد. نمونهگیری و ثبت مشخصات افراد با کسب اجازه از آنها انجام شد و از هر فرد 4 سی¬سی خون وریدی گرفته شد. استخراج DNA از خون به روش نمک اشباع(out Salting) انجام شد. سپس بررسی کیفیت و کمیت DNA استخراجی با استفاده از الکتروفورز ژل آگاروز یک درصد و اسپکتروفتومترانجام شد.
تکنیک Tetra ARMS-PCR: بررسی چندشکلی rs12602273C>G ژن TP53 با استفاده از تکنیک Tetra-primer Amplification Refractory Mutation System Polymerase Chain Reaction (Tetra ARMS-PCR) انجام شد. توالی آغازگرها بر مبنای مطالعه Lin و همکاران طراحی (20) و سنتز آنها توسط شرکت Metabion (Gernany) انجام شد (جدول 1). مشخصات و توالی آغازگرهای مورد استفاده برای تکثیر توالی چندشکلی rs12602273 در جدول 1 و محل اتصال آغازگرها در شکل 1 نشان داده شده است. چرخه¬های حرارتی واکنش زنجیره پلیمراز شامل واسرشتهسازی (Denaturing) اولیه در دمای 94 درجه سانتیگراد به مدت 5 دقیقه، 35 چرخه تکثیر در چرخه حرارتی شامل واسرشتهسازی به مدت30 ثانیه در 94 درجه سانتیگراد، اتصال پرایمرها به مدت 40 ثانیه در دمای 40 درجه سانتیگراد و گسترش در دمای 72 درجه سانتیگراد به مدت 40 ثانیه و یک چرخه گسترش نهایی در دمای 72 درجه سانتیگراد به مدت 5 دقیقه بود. بعد از بهینهسازی چرخهها و ترکیبات واکنش PCR، واکنش زنجیرهای پلیمراز در حجم نهایی 10/75 میکرولیتر با اجزای 3/5 میکرولیتر MasterMix (AMPLIQON, Denmark)، 1/25 میکرولیتر از هر کدام از آغازگرهای خارجی و 2 میکرولیتر از هر کدام از آغازگرهای داخلی در میکروتیوب 0/5 با یکدیگر مخلوط شدند تمام مراحل روی یخ انجام شد. نمونهها جهت انجام واکنش در دستگاه Thermal Cycler (ABI, Thermo Fisher Scientific, USA ) قرار گرفت. چرخههای حرارتی واکنش زنجیره¬ای پلیمراز شامل یک چرخه در دمای °C 94 به مدت 300 ثانیه جهت واسرشتهسازی اولیه، سپس واسرشتهسازی در °C 94 به مدت 30 ثانیه، اتصال آغازگرها در دمای °C 40 به مدت 40 ثانیه و بسط در دمای °C 72 به مدت 40 ثانیه برای 35 چرخه و یک چرخه بسط نهایی در °C 72 به مدت 10 دقیقه بود. محصولات حاصل از واکنش زنجیرهای پلیمراز بر روی ژل آگارز 2 درصد الکتروفورز شدند. اندازه قطعات تکثیر شده بر روی ژل آگارز با استفاده از نشانگر اندازه DNA، bp1000 (SinaClon, Iran) تعیین شد. رنگآمیزی محصولات واکنش زنجیرهای پلیمراز با استفاده از Safe Stain (SinaClon, Iran) انجام شد.
تجزیه و تحلیل آماری
با توجه به ماهیت مورد - شاهدی مطالعه، تجزیه و تحلیل آماری نتایج بین افراد بیمار و سالم و زیرگروه¬های بیمار بهصورت مقایسهای انجام شد. ارتباط بین ژنوتیپها و آللها بین گروه شاهد و بیمار با استفاده از آزمون مربع کای پیرسون بررسی شد. شدت ارتباط بین چند شکلیها و ریسک ابتلا به سرطان با استفاده از نسبت شانس با فاصله اطمینان ۹۵% محاسبهگردید. کاوشهای آماری ذکر شده با استفاده از برنامه javastat online statistics package به آدرس http://statpages.org/ctab2x2.html)) انجام شد. برای بررسی ارتباط بین مشخصات بالینی بیماران شامل سن بیماران، درجه تومور، درگیری لنف، سمت درگیر، اندازه تومور، مرحله تومور و نوع بیماری با توزیع ژنوتیپی و شاخص میانگین از نرمافزارversion 16 SPSS استفاده شد. در تمامی آزمونها، p<0.05 بهعنوان سطح معنیداری درنظرگرفته شد. همچنین آنالیزهای In silico برای این چندشکلی با استفاده از نرمافزارهای SplicAid2، Alibaba و RNAsnp انجام گرفت.
جدول 1: توالی آغازگرهای مورداستفاده و اندازه قطعات تکثیری طی واکنش زنجیره¬ای پلیمراز


شکل 1: محل اتصال پرایمرها بر روی توالی ژن TP53
نتایج
از بین 100 بیمار بررسی شده، تکثیر DNA به روشTetra ARMS-PCR در 92 بیمار با موفقیت انجام شد. از بین 92 بیمار دارای تکثیر موفق، ویژگیهای بالینی شامل سمت درگیر برای 11 بیمار، سن برای 10 بیمار، نوع تومور برای 19 بیمار، مرحله تومور برای 35 بیمار، سایز تومور برای 19 بیمار و درگیری لنفی برای 25 بیمار در دسترس نبود. اطلاعات بالینی بیماران در جدول 3 ذکر شده است. طول قطعات حاصل از واکنش PCR برای نوار کنترل حاصل تکثیر توسط پرایمرهای Outer Forward و outer Reverse، 203 جفت باز، برای نوار C مربوط به الل وحشی حاصل تکثیر توسط پرایمرهای Outer Forward و Inner Reverse، 143 جفت باز و برای نوار G مربوط به الل جهش یافته حاصل تکثیر توسط پرایمرهای outer Reverse و Inner forward، 102 جفت باز بود (شکل 2).

شکل 2: الکتروفورز محصوالت PCR مربوط به ژنوتیپ های CC، CG و GG افراد بیمار بر روی ژل آگارز 2 درصد
توزیع فراوانی ژنوتیپی بین دو گروه بیمار و کنترل: بر اساس نتایج حاصل از این پژوهش در جمعیت کنترل بیشترین فراوانی متعلق به ژنوتیپ CC با فراوانی 79/34 درصد (73 نفر) و کمترین فراوانی متعلق به ژنوتیپ GG با فراوانی 3/26 درصد (3 نفر) بود. فراوانی هتروزیگوتهای CG برابر با 17/39 درصد (16 نفر) بود. در جمعیت بیماران مورد مطالعه بیشترین فراوانی و کمترین فراوانی به ترتیب متعلق به ژنوتیپهای CC و GG با فراوانی 81/52 (75 نفر) و 2/17 (2 نفر) درصد بود. فراوانی ژنوتیپ CG، 16/3 درصد (15 نفر) بود. برای ژنوتیپهای CC، CG و GG مقادیر P به ترتیب 0/71، 0/84 و 0/65 بود. ارتباط معنیداری بین فراوانی هیچکدام از ژنوتیپهای جایگاه چندشکل rs12602273C>G ژن TP53 با احتمال ابتلا به سرطان پستان مشاهده نشد (جدول 2).
توزیع فراوانی آللی بین دو گروه بیمار و کنترل: در جمعیت کنترل فراوانی آلل C، 89/67 درصد (با تعداد 162) و فراوانی آلل G، 11/95 درصد (با تعداد 22) بود. در جمعیت بیمار فراوانی آللG ، 88/04 درصد (با تعداد 165) و فراوانی آلل G، 10/32 درصد (با تعداد 19) بود. در هر دو گروه بیمار و کنترل آلل C بیشترین فراوانی را داشت. مقدار P برای هر دو آلل¬ C و G برابر با 0/61 بود. نتایج نشان دهنده عدم همراهی فراوانی آللی چندشکلی جایگاه rs12602273C>G ژن TP53 با سرطان پستان بود (جدول 2). همراهی فراوانی آللی
چندشکلی جایگاه rs12602273C>G ژن TP53 با سرطان پستان در بیماران دارای تومورهای IDC نیز غیرمعنیدار بود (0.186=P).
همراهی چندشکلی rs1260073 ژن TP53 با علائم بالینی بیماران: با بررسی ارتباط چندشکلی rs12602273 ژن TP53 با علائم بالینی بر اساس تجزیههای انجام شده ارتباط معنی¬داری بین توزیع فراوانیهای ژنوتیپی چندشکلی rs12602273 ژن TP53 با علائم بالینی شامل نوع تومور (0.56=P)، درجه تومور (0.11=P)، سن (0.09=P) ، سمت درگیر (0.87=P)، اندازه تومور (0.61=P) و درگیری غدد لنفی (0.56=P) مشاهده نشد (جدول 3). با توجه به تعداد زیاد افرادی با تومورهای IDC، تجزیه همراهی این چندشکلی با سن این دسته از بیماران نیز انجام شد که نشان دهنده عدم همراهی سن با تومورهای IDC بود (0.20=P).
آنالیز In silico جایگاه چندشکل rs1260073 ژن TP53: تغییرات ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 توسط نرمافزار آنالین RNAsnp در شکل شماره 3 نشان داده شده است. بر این اساس تغییر ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 منجر به کاهش ∆G آلل جهش یافته (∆G=-47.80 kcal/mol) در مقایسه با آلل طبیعی (∆G= -51.60 kcal/mol) با 68/0 P= شد که غیرمعنیدار بود (P>0/2). نتایج حاصل از آنالیز چندشکلیهای مورد نظر بر روی ژن TP53 توسط نرمافزار Splice Aid2 نشان داد که در حالت جهشیافته دو پروتئین SC35 و ETR-3 با امتیاز 5+ به RNA متصل میشوند. اتصال با امتیاز مثبت منجر به تسهیل پیرایش اگزون، و با امتیاز منفی باعث تسهیل پیرایش اینترون میشود. اطلاعات حاصل از این آنالیز در شکل 4 قابل مشاهده است. نتایج حاصل از آنالیز چندشکلی مورد نظر بر روی ژن TP53 توسط نرمافزار ALIbaba2.1، نشاندهنده تمایل فاکتورهای رونویسی متفاوت به ناحیه موردنظر در حالت وحشی و جهشیافته است. نتایج حاصل از این آنالیز در جدول 3 قابل مشاهده است.
جدول 2: توزیع فراوانی ژنوتیپی و آللی در افراد کنترل و بیمار

جدول 3: ویژگیهای بالینی بیماران و توزیع چندشکلی تک نوکلئوتیدی rs12602273 آلل C در ارتباط با مشخصات بالینی بیماران (n=92)

* T1≤ 2cm, T2: 2-5cm, T3> 5cm, ** N0: 0, N1: 1-3cm, N2: 4-9cm, N3≥ 10cm

شکل 3: تغییرات ساختار فضایی ناشی از چندشکلی rs12602273 ژن) TP53 A: آلل حالت جهشیافته ∆G = -47.80 kcal/mol و B: آلل طبیعی(∆G = -51.60 kcal/mol) .

شکل4: آنالیز چندشکلی ژن TP53 توسط نرمافزار آنلاین Splice Aid2
(A: عدم اتصال دو پروتیین SC35 وETR-3 ، B: اتصال دو پروتئین SC35 و ETR-3 ).
جدول 3: آنالیز چندشکلی ژن TP53 توسط نرمافزار آنلاین ALIbaba2.1

بحث
فراوانی ژنوتیپهای CC، CG و GG در بیماران به ترتیب 81/52، 16/30 و 2/17 درصد و فراوانی آللهای C و G در افراد بیمار به ترتیب 89/67 و 10/32 درصد بود. در جمعیت کنترل فراوانی آللهای C و G در افراد بیمار به ترتیب 88/04 و 11/95 درصد بود. تجزیههای آماری نشان دهنده عدم همراهی فراوانی ژنوتیپی و آللی چندشکلی(rs12602273C>G) ژن TP53 با سرطان پستان بود. همچنین بر اساس نتایج حاصل از این مطالعه، همراهی معناداری بین چندشکلی مورد مطالعه با ویژگیهای بالینی بیماران مبتلا به سرطان پستان در زنان شمالغرب ایران مشاهده نشد. ژن TP53 یک ژن سرکوب کننده تومور است که نقش کلیدی در بسیاری از مسیرهای سلولی دارد. از مهمترین عملکردهای P53 میتوان به نقش آن در فعالیتهای ضروری سلول مانند تکثیر، تمایز، مرگ سلولی، ترمیم DNA و تشکیل عروق خونی اشاره کرد. جهشهای TP53 در سرطانها رایج هستند بطوریکه جهشهای ژن p53 بیشترین فراوانی را در سرطانهای انسان دارد. جهشهای این ژن تقریبا در ۲۵ تا ۳۰ درصد موارد سرطان پستان شناسایی شده است (22). ارزیابی دقیق جهش¬های این ژن در مبتلایان به سرطان پستان میتواند درتشخیص، پیش آگهی یا درمان آن اهمیت داشته باشد. نجفی درچه و همکاران در مطالعهای روی جمعیت زنان اصفهان ارتباط معنیداری بین پلیمورفیسم تکرار TAAAA در ژن p53 و خطر ابتلا به سرطان پستان گزارش کردند. در این مطالعه ارتباط معنیداری بین این ژنوتیپها با درجهی پیشرفت بیماری، وضعیت بیان گیرندههای استروژن، پروژسترون و Her2 و سن مشاهده نشد (23). همچنین شیخپور و تقیپور ظهیر در مطالعهای بر روی زنان مبتلا به سرطان پستان یزد، توزیع پلیمورفیسم کدون 72 برای ژنوتیپهای آرژنین/آرژنین، پرولین/پرولین و آرژنین/ پرولین را در بیماران به ترتیب 49/04، 5 21/1، 1 29/8 درصد و در گروه کنترل به ترتیب 21/15، 26/92، 51/39 درصد گزارش کردند. بر این اساس تفاوت آماری معنیداری بین توزیع ژنوتیپ آرژنین/ آرژنین و آرژنین/ پرولین ژن p53در افراد سرطانی و کنترل دیده شد .(p˂0.05) بر اساس این مطالعه ژنوتیپ Arg/Arg یک عامل ژنتیکی مستعدکننده برای ابتلا به سرطان پستان و ژنوتیپ Arg/Pro دارای نقش حفاظتی در برابر سرطان پستان شناخته شد (24). در مطالعهای توسط Pouladi و همکاران اثرات ترکیبی ژنوتیپ چندشکلیهای TP53 و PAI-1 در حساسیت به سرطان پستان بررسی شد. در این مطالعه مورد-شاهدی 200 فرد مبتلا به سرطان پستان و 179 فرد سالم مورد مطالعه قرار گرفتند. یافتهها نشان داد که چندشکلی کدون 72 ژن TP53 به طور معنیداری با مرحله تومور مرتبط است (P=0/023) ((25). در مطالعهای که توسط Lin و همکاران بر روی همراهی چندشکلی 5 SNPی ژن TP53 از جمله rs12602273 با سرطان مثانه، در جمعیت کائوسینگ تایوان متشکل از 201 بیمار و 311 کنترل بدون سرطان انجام گرفت، نشان داده شد در این جمعیت آللهای (P=0.003) rs9895829G و آلل rs1788227C (P=0.027) هر دو با بروز سرطان مثانه مرتبط هستند. همچنین هاپلوتیپهای GTT (P=0.001) و GGTC (P=0.001) با بروز کم سرطان مثانه در ارتباط بودند. در مقابل، هیچیک از هاپلوتیپهای SNPهای rs9895829، rs12602273، rs17882227 و rs2287497 ارتباط معنیداری با درجه بالای تومور یا تهاجم عضلانی نداشتند (20). در مطالعه حاضرکه اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در شمالغرب ایران است، همانند مطالعهLin و همکاران، که همراهی چندشکلی rs12602273را بر روی سرطان مثانه مورد بررسی قرار دادند (20)، هیچکدام از ژنوتیپهای CC ، CG و GG چند-شکلی rs12602273C>G ژن TP53در جمعیتهای مورد بررسی بهترتیب با سرطان پستان (P=0.7) و سرطان مثانه (P=0.054)همراهی معناداری نشان ندادند. اما فراوانی آللی همراهی معناداری با سرطان مثانه (P=0.041) نشان داد. همچنین براساس نتایج مطالعه حاضر هیچیک از ژنوتیپهای چندشکل با علائم بالینی افراد بیمار از قبیل سن، اندازه تومور، درجه تومور، درگیری غدد لنفاوی، سمت درگیری و نوع تومور همراهی معناداری نداشتند. با توجه به اینکه این اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در شمالغرب ایران است میتواند نشاندهنده عدم همراهی چندشکلی مورد مطالعه با سرطان پستان در زنان این منطقه باشد. عدم تغییر در ساختار فضایی ناشی از چندشکلی rs12602273 ژن TP53 با وجود تغییر در ∆G، و اتصال فاکتور رونویسی مشابه به اینجا برای دو الل وحشی و جهش یافته نشان دهنده مطابقت نتایج حاصل از پژوهش در جهت عدم همراهی این چندشکلی با ریسک ابتلا به سرطان در جمعیت مورد مطالعه بود. توصیه میشود در مطالعات مشابه یک نمونه از هر ژنوتیپ توالییابی و از صحت نوارهای تکثیر شده اطمینان حاصل شود. همچنین جهت اطمینان بررسی ارتباط چندشکلی rs12602273 با احتمال ابتلا به سرطان پستان در جامعه آماری بزرگتری از افراد بیمار و سالم، مطالعه بیان افتراقی این ژن در افراد بیمار و سالم، آنالیزهای in silico بیشتر با استفاده از داده پایگاههای متعدد توصیه میشود.
نتیجهگیری
در مطالعه حاضر هیچکدام از ژنوتیپ های CC ، CG و GG چندشکلی rs12602273 ژن TP53 در جمعیت مورد بررسی همراهی معناداری با سرطان پستان نداشتند. همچنین هیچیک از ژنوتیپ های مورد نظر با علائم بالینی افراد بیمار از قبیل سن، اندازه تومور، درجه تومور، درگیری غدد لنفاوی، سمت درگیری و نوع تومور همراهی موثری نداشتند. با توجه به اینکه این اولین گزارش از ارتباط چندشکلی rs12602273 ژن TP53با احتمال ابتلا به سرطان پستان در زنان شمالغرب ایران است می¬تواند نشان دهنده عدم همراهی چندشکلی مورد مطالعه با سرطان پستان در زنان این منطقه باشد.
سپاسگزاری
پژوهش فوق حاصل پایاننامه کارشناسی ارشد رشته زیستشناسی با گرایش سلولی - مولکولی مصوب شورای تحصیلات تکمیلی دانشگاه شهید مدنی آذربایجان در تاریخ 06/06/1401 است. این مطالعه در آزمایشگاه زیستشناسی سلولی - مولکولی گروه زیست دانشگاه شهید مدنی آذربایجان و با بودجه اختصاص یافته معاونت پژوهش به پایاننامه دانشجو انجام یافته است.
حامی مالی: این پژوهش با بودجه اختصاص یافته معاونت پژوهش دانشگاه شهید مدنی آذربایجان به پایاننامه دانشجو انجام یافته است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
تمامی اطلاعات مربوط به بیماران پروندههای آنها بیماران استخراج، فرم رضایت انجام طرح تحقیقاتی توسط بیماران تکمیل، و هیچ نوع مداخله اضافی از طرف محققین بر روی بیماران صورت نگرفت. نام و نشانی بیماران کاملأ محرمانه خواهد بود. این پژوهش با کد اخلاق به شماره IR.AZARUNIV.REC.1401.018 در کمیته اخلاق دانشگاه شهید مدنی آذربایجان تصویب شد.
مشارکت نویسندگان
سارا غفاریان در ارائه ایده و طراحی مطالعه، فاطمه لطفی در جمعآوری دادهها، سارا غفاریان و فاطمه لطفی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Afrasiabifar A, Hamzhiekia SH, Hosseini NA. The Effect of Self-Care Program Using Orem’s Self-Care Model on the Life Quality of Women with Breast Cancer Undergoing Chemotherapy: A Randomized Controlled Trial. Armaghane Danesh 2018; 23(1): 1-13.
2- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021; 71(3): 209-49.
3- Zhao P, Chen H, Wen D, Mou S, Zhang F, Zheng S. Personalized Treatment Based on Mini Patient-Derived Xenografts and WES/RNA Sequencing in a Patient with Metastatic Duodenal Adenocarcinoma. Cancer Commun (Lond) 2018; 38(1): 54.
4- Leroy B, Ballinger ML, Baran-Marszak F, Bond GL, Braithwaite A, Concin N, et al. Recommended Guidelines for Validation, Quality Control, and Reporting of TP53 Variants in Clinical Practice. Cancer Res 2017: 77(6): 1250-60.
5- Prabhu KS, Raza A, Karedath T, Raza SS, Fathima H, Ahmed EI, et al. Non-Coding Rnas as Regulators and Markers for Targeting of Breast Cancer and Cancer Stem Cells. Cancers(Basel) 2020; 12(2): 351.
6- Kamada R, Toguchi Y, Nomura T, Imagawa T, Sakaguchi K. Tetramer Formation of Tumor Suppressor Protein P53: Structure, Function, and Applications. Biopolymers 2016; 106(4): 598-612.
7- Wang SP, Wang WL, Chang YL, Wu CT, Chao YC, Kao SH, et al. P53 Controls Cancer Cell Invasion by Inducing the MDM2-Mediated Degradation of Slug. Nat Cell Biol 2009; 11(6): 694-704.
8- Nooridaloii MR, Abdollah Zade R. Role of P53 in Apoptosis and Cancer Therapy. Quarterly Horiz Med Sci2014; 20(3): 191-201.
9- Coskun KA, Tutar M, Al M, Yurttas AG, Abay EC, Yurekli N, et al. Role of P53 in Human Cancers. 1st ed. Budapest: IntechOpen; 2022: 1-19.
10- Noori-Daloii MR. Medical Molecular Genetics in the Third Millennium. 4 ed. Tehran: Jame-e-Negar; 2009. [Persian]
11- Kim SH, Choi SI, Won KY, Lim SJ. Distinctive Interrelation of P53 with SCO2, COX, and TIGAR in Human Gastric Cancer. Pathol Res Pract 2016; 212(10): 904 -10.
12- Humpton TJ, Vousden KH. Regulation of Cellular Metabolism and Hypoxia by P53. Cold Spring Harb Perspect Med 2016; 6(7): a026146.
13- Vogelstein B, Lane D, Levine AJ. Surfing the P53 Network. Nature 2000; 408(6810): 307-10.
14- Hainaut P, Hollstein M. P53 and Human Cancer: The First Ten Thousand Mutations. Adv Cancer Res 2000; 77: 81-137.
15- Pouladi N, Abdolahi S, Farajzadeh D, Hosseinpour-Feizi MA. Haplotype and Linkage Disequilibrium of TP53-WRAP53 Locus in Iranian-Azeri Women with Breast Cancer. Plus One 2019; 14 (8): e0220727.
16- Zhang J, Yang J, Zhang L, Luo J, Zhao H, Zhang J, et al. A New SNP Genotyping Technology Target SNP-Seq and its Application in Genetic Analysis of Cucumber Varieties. Sci Rep 2020; 10(1): 5623.
17- Cohen HJ, Rao AV. Geriatric Oncology, an Issue of Clinics in Geriatric Medicine. 1st ed. Elsevier; 2015: 690-749.
18- Samani LA, Javadirad SM, Parsafar S, Tabatabaeian H, Ghaedi K, Azadeh M. TP53 Rs1625895 is Related to Breast Cancer Incidence and Early Death in Iranian Population. Indian J Clin Biochem 2019 34(4): 485-9.
19- Ru JY, Cong Y, Kang WB, Yu L, Guo T, Zhao JN. Polymorphisms in TP53 are Associated with Risk and Survival of Osteosarcoma in a Chinese Population. Int J Clin Exp Pathol 2015; 8(3): 3198-203.
20- Lin HY, Yang MC, Huang CH, Wu WJ, Yu TJ, Lung FW. Polymorphisms of TP53 are Markers of Bladder Cancer Vulnerability and Prognosis. Urol Oncol 2013; 31(7): 1231-41.
21- Lane D, Levine A. P53 Research: The Past Thirty Years and the Next Thirty Years. Cold Spring Harb Perspect Biol 2010; 2(12): a000893.
22- Silwal-Pandit L, Langerød A, Børresen-Dale AL. TP53 Mutations in Breast and Ovarian Cancer. Cold Spring Harb Perspect Med 2017; 7(1): a026252.
23- Najafi-Dorche S, Tavassoli M, Hemati S, Safari F. The Study of TAAAA Polymorphism in P53 Gene and its Association with Breast Cancer. J Isfahan Med Sch 2015; 33: 134-43. [Persian]
24- Sheikhpour R, Taghipour Zahir S. Evaluation of TP53 Codon 72 Polymorphism and Resulted Protein in Breast Cancer Patients in Yazd City. ijbd 2014; 7(3): 20-9. [Persian]
25- Pouladi N, Shavali M, Abdolahi S. Combined Genotype Effects of TP53 and PAI-1 Polymorphisms in Breast Cancer Susceptibility: Multifactor Dimensionality Reduction and in Silico Analysis. Hum Hered 2020; 85(2): 51-60.
1- Afrasiabifar A, Hamzhiekia SH, Hosseini NA. The Effect of Self-Care Program Using Orem’s Self-Care Model on the Life Quality of Women with Breast Cancer Undergoing Chemotherapy: A Randomized Controlled Trial. Armaghane Danesh 2018; 23(1): 1-13.
2- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021; 71(3): 209-49.
3- Zhao P, Chen H, Wen D, Mou S, Zhang F, Zheng S. Personalized Treatment Based on Mini Patient-Derived Xenografts and WES/RNA Sequencing in a Patient with Metastatic Duodenal Adenocarcinoma. Cancer Commun (Lond) 2018; 38(1): 54.
4- Leroy B, Ballinger ML, Baran-Marszak F, Bond GL, Braithwaite A, Concin N, et al. Recommended Guidelines for Validation, Quality Control, and Reporting of TP53 Variants in Clinical Practice. Cancer Res 2017: 77(6): 1250-60.
5- Prabhu KS, Raza A, Karedath T, Raza SS, Fathima H, Ahmed EI, et al. Non-Coding Rnas as Regulators and Markers for Targeting of Breast Cancer and Cancer Stem Cells. Cancers(Basel) 2020; 12(2): 351.
6- Kamada R, Toguchi Y, Nomura T, Imagawa T, Sakaguchi K. Tetramer Formation of Tumor Suppressor Protein P53: Structure, Function, and Applications. Biopolymers 2016; 106(4): 598-612.
7- Wang SP, Wang WL, Chang YL, Wu CT, Chao YC, Kao SH, et al. P53 Controls Cancer Cell Invasion by Inducing the MDM2-Mediated Degradation of Slug. Nat Cell Biol 2009; 11(6): 694-704.
8- Nooridaloii MR, Abdollah Zade R. Role of P53 in Apoptosis and Cancer Therapy. Quarterly Horiz Med Sci2014; 20(3): 191-201.
9- Coskun KA, Tutar M, Al M, Yurttas AG, Abay EC, Yurekli N, et al. Role of P53 in Human Cancers. 1st ed. Budapest: IntechOpen; 2022: 1-19.
10- Noori-Daloii MR. Medical Molecular Genetics in the Third Millennium. 4 ed. Tehran: Jame-e-Negar; 2009. [Persian]
11- Kim SH, Choi SI, Won KY, Lim SJ. Distinctive Interrelation of P53 with SCO2, COX, and TIGAR in Human Gastric Cancer. Pathol Res Pract 2016; 212(10): 904 -10.
12- Humpton TJ, Vousden KH. Regulation of Cellular Metabolism and Hypoxia by P53. Cold Spring Harb Perspect Med 2016; 6(7): a026146.
13- Vogelstein B, Lane D, Levine AJ. Surfing the P53 Network. Nature 2000; 408(6810): 307-10.
14- Hainaut P, Hollstein M. P53 and Human Cancer: The First Ten Thousand Mutations. Adv Cancer Res 2000; 77: 81-137.
15- Pouladi N, Abdolahi S, Farajzadeh D, Hosseinpour-Feizi MA. Haplotype and Linkage Disequilibrium of TP53-WRAP53 Locus in Iranian-Azeri Women with Breast Cancer. Plus One 2019; 14 (8): e0220727.
16- Zhang J, Yang J, Zhang L, Luo J, Zhao H, Zhang J, et al. A New SNP Genotyping Technology Target SNP-Seq and its Application in Genetic Analysis of Cucumber Varieties. Sci Rep 2020; 10(1): 5623.
17- Cohen HJ, Rao AV. Geriatric Oncology, an Issue of Clinics in Geriatric Medicine. 1st ed. Elsevier; 2015: 690-749.
18- Samani LA, Javadirad SM, Parsafar S, Tabatabaeian H, Ghaedi K, Azadeh M. TP53 Rs1625895 is Related to Breast Cancer Incidence and Early Death in Iranian Population. Indian J Clin Biochem 2019 34(4): 485-9.
19- Ru JY, Cong Y, Kang WB, Yu L, Guo T, Zhao JN. Polymorphisms in TP53 are Associated with Risk and Survival of Osteosarcoma in a Chinese Population. Int J Clin Exp Pathol 2015; 8(3): 3198-203.
20- Lin HY, Yang MC, Huang CH, Wu WJ, Yu TJ, Lung FW. Polymorphisms of TP53 are Markers of Bladder Cancer Vulnerability and Prognosis. Urol Oncol 2013; 31(7): 1231-41.
21- Lane D, Levine A. P53 Research: The Past Thirty Years and the Next Thirty Years. Cold Spring Harb Perspect Biol 2010; 2(12): a000893.
22- Silwal-Pandit L, Langerød A, Børresen-Dale AL. TP53 Mutations in Breast and Ovarian Cancer. Cold Spring Harb Perspect Med 2017; 7(1): a026252.
23- Najafi-Dorche S, Tavassoli M, Hemati S, Safari F. The Study of TAAAA Polymorphism in P53 Gene and its Association with Breast Cancer. J Isfahan Med Sch 2015; 33: 134-43. [Persian]
24- Sheikhpour R, Taghipour Zahir S. Evaluation of TP53 Codon 72 Polymorphism and Resulted Protein in Breast Cancer Patients in Yazd City. ijbd 2014; 7(3): 20-9. [Persian]
25- Pouladi N, Shavali M, Abdolahi S. Combined Genotype Effects of TP53 and PAI-1 Polymorphisms in Breast Cancer Susceptibility: Multifactor Dimensionality Reduction and in Silico Analysis. Hum Hered 2020; 85(2): 51-60.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







