دوره 31، شماره 7 - ( مهر 1402 )
جلد 31 شماره 7 صفحات 6884-6873 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mehrabi M, Kazemzadeh Y, Gorzi A, Hosseini S A, Sedaghati S. Effect of Eight Weeks of Resistance Training on Inflammatory Markers and Antioxidant Indices of Kidney Tissue Following Testosterone Enanthate Abuse in Male Rats. JSSU 2023; 31 (7) :6873-6884
URL: http://jssu.ssu.ac.ir/article-1-6032-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6032-fa.html
مهرابی معصومه، کاظمزاده یاسر، گرزی علی، حسینی سیدعلی، صداقتی سعید. تاثیر هشت هفته تمرین مقاومتی بر نشانگرهای التهابی و شاخصهای آنتیاکسیدانی بافت کلیه متعاقب سوءمصرف تستوسترون انانتات در موشهای صحرایینر. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (7) :6873-6884
متن کامل [PDF 919 kb]
(615 دریافت)
| چکیده (HTML) (1730 مشاهده)
متن کامل: (701 مشاهده)
مقدمه
استروئیدهای آنابولیک آندروژنیک (Anabolic androgenic steroids ; AAS) ترکیبات مشتق شده از تستوسترون هستند که در دوزهای متعارف توسط پزشکان برای هیپوگنادیسم استفاده میشوند (1). از بین انواع مشتقات AASها، تستوسترون انانتات یک AAS طولانیاثر است که به دلیل ارزان و در دسترس بودن آن بهطور گسترده توسط ورزشکاران رشتههای قدرتی با اهداف افزایش توده عضلانی، افزایش قدرت و افزایش عملکرد مورد استفاده قرار میگیرد (2). این نکته قابل ذکر است که محققین نشان دادهاند که دوز مصرفی AASها توسط ورزشکاران حتی به 100 برابر بیشتر از دوزهای درمانی رسیده است (3). اطلاعات نشان میدهد که استفاده از AASها در دوزهای فوق فیزیولوژیک با عوارض جبرانناپذیر همراه است. بهطوری که منجر به افزایش فشار خون، سکته قلبی، ترومبوز، نارسایی قلبی، اختلالات رفتاری و اختلال در عملکرد کبد و کلیه میشود (5-4). محققین بر این باورند که تستوسترون انانتات در وحله اول با اتصال به گیرندههای اندروژنی در توبولهای کلیوی در موشهای صحرایینر با افزایش استرس اکسیداتیو همراه است (2) و منجر به افزایش کراتینین سرم، نارسایی حاد کلیه به دنبال عارضه رابدومیولیز (rhabdomyolysis)، تغییرات بافتی کلیه مانند فیبروز، آتروفی توبولی و اختلالات نفرونی و افزایش التهابی در بافت کلیه میشود (7-6). با توجه به ماهیت عملکرد کلیه در دفع مواد سمی بدن، این بافت بهطور مداوم در معرض سطوح بالایی از اکسیدانهای درونزا و برونزا قرار میگیرد (8). گونههای فعال اکسیژن (Reactive Oxygen Species; ROS) که در اثر فعالیت میتوکندریها، NADPH اکسیدازها (NOX) و منابع دیگر تولید میشوند، زمانی که سیستمهای آنتیاکسیدانی نتوانند بهطور متناسب این مولکولها را خنثی کنند، میتوانند باعث استرس اکسیداتیو شوند (9،4). این اتفاق منجر به پراکسیداسیون لیپیدی، اکسایش DNA و پروتئینها میشود و در نهایت همه این موارد با بروز التهاب و آپوپتوز به اختلال در اعمال حیاتی سلول همراه است (8). مطالعات قبلی نشان دادند که مصرف دوزهای بالای AASها با اختلال در ردوکس سلولی منجر به فعالسازی سلولهای ایمنی شده و در نتیجه با افزایش ترشح سایتوکینهای التهابی همراه است (1). علاوه بر این بهنظر میرسد دوزهای فرافیزیولوژیک تستوسترون مستقیما در تولید فاکتور نکروزدهنده تومور -آلفا (Tumor necrosis factor alpha: TNF-α)، اینترلوکین-1 بتا (Interleukin-1 beta: IL-1 β) و اینترلوکین-6 (Interleukin-6: IL-6) در بافت کلیه نقش داشته باشد (6). علاوه بر این اطلاعات موجود نشان می-دهند که، افزایش TNF-α و IL-6 با افزایش فعالیت گیرنده-های آندروژن، سمیت گلومرولها، کاهش آنزیمهای آنتی اکسیدانی در بافت کلیه میشود همراه است (10،11-6). بررسی مطالعات نشان داده است که مصرف AASها بیشتر با تمرینات شدت بالا همراه است. در حالیکه اثربخشی این تمرینات بسته به نوع تمرین، شدت تمرین، حجم تمرین، تعداد تکرار متفاوت است (12). بهطوری که تمرینات مقاومتی با شدت کم تا متوسط، فشار اکسایشی، عوامل التهابی و آسیب سلولی را در افراد جوان تمرین کرده کاهش میدهد (13)؛ اما، تمرینات مقاومتی طولانیمدت شدید عوامل التهابی مانند β1IL-، TNF-α و 6 IL را در طول و به دنبال ورزش افزایش میدهد. و بهطور خاص، با ایجاد اختلال در تعادل اکسیدان/ آنتیاکسیدان، منجر به فشار اکسایشی میشود و در نتیجه وضعیتی به نام اختلال عملکرد ایمنی ناشی از ورزش را ایجاد میکند (14). شواهد تجربی نشان میدهد که هم تجویز AAS و هم فعالیت ورزشی شدید، میزان آسیب کلیوی را در پاسخ به آسیب سمیت کلیوی افزایش میدهد (11). با توجه به شیوع روزافزاون استفاده بیرویه از AASها توسط ورزشکاران منجر به آسیبهای جبرانناپذیر در عملکرد فیزیولوژیک بسیاری از اندامها به ویژه کلیه میگردد. بنابراین کسب اطلاعات بیشتر در زمینه اثر تمرین مقاومتی شدید و سوءمصرف تستوسترون انانتات میتواند به پیشگیری از آسیبهای کلیوی در این قشر جامعه منجر شود. با توجه به محدودیت اطلاعات در رابطه با اثرات مخرب کلیوی ناشی از سوءمصرفAAS بهویژه در ورزشکاران قدرتی، مطالعه حاضر با هدف بررسی تأثیرات یک دوره تمرین مقاومتی همراه با تجویز تستوسترون بر برخی نشانگرهای سیستم آنتی-اکسیدانی،TNF-α و IL-6 در بافت کلیه موشهای صحرایی در معرض تستوسترون انانتات بود.
روش بررسی
در این پژوهش تجربی 24 سر موش صحرایینر نژاد ویستار با سن 8 هفته و میانگین وزنی 13 ±220 گرم از انستیتو پاستور ایران خریداری شدند. از بین این موشهای صحرایی آنهایی که کاملاً سالم بودند و توان انجام فعالیت بدنی را داشتند به عنوان نمونه آماری انتخاب شدند. همچنین مشاهده مشکلات ظاهری مانند اختلال در حفظ تعادل، بیشتر بودن سن موشهای صحرایی از 10 هفته و عدم توان انجام تمرین از ملاکهای خروج نمونهها در این تحقیق بود. در ابتدا حیوانات به مدت یک هفته با شرایط آزمایشگاه سازگار شدند. در تمام دوره پژوهش، حیوانات در قفسه های پلی کربنات با قابلیت شستشو و در شرایط استاندارد (رطوبت 45 تا 55 درصد، چرخه نور تاریکی 12:12 ساعت و دمای 2±23 درجه سانتیگراد) نگهداری شدند. گفتنی است که در این پژوهش آب و غذا به وفور در اختیار حیوانات گذاشته شد و آنها به طور آزادانه به آن دسترسی داشتند. برای اطمینان از شرایط محیطی مناسب و حفظ رطوبت، دما و تهویه مناسب از دستگاه تهویه هوا و از دماسنج و رطوبت سنج برای پایش تغییرات شبانه روزی دما و رطوبت استفاده شد. پس از یک هفته آشناسازی با محیط آزمایشگاه، تمرینات آشناسازی نیز به مدت یک هفته برای آشناسازی موشهای صحرایی با بالا رفتن از نردبان مخصوص تمرینات مقاومتی جوندگان انجام شد. سپس موشهای صحرایی بهصورت تصادفی به سه گروه 8 تایی شامل (1) گروه کنترل، (2) گروه تمرین و (3) تمرین + تستوسترون تقسیم شدند. موشهای صحرایی گروه¬های تمرین و تمرین + تستوسترون به مدت هشت هفته و پنج جلسه در هفته تمرینات مقاومتی را انجام میدادند. این نکته قابل ذکر است که این پروتکل تمرینی بر اساس راهنمای عملی و علمی از مطالعه گرزی و همکاران انجام شد (15). همچنین موشهای صحرایی گروه تمرین + تستوسترون سه روز در هفته به میزان mg/kg 20 تستوسترون انانتات (ساخت شرکت ایران هورمون، کشور ایران با شماره سریال ساخت 0069) را بهصورت تزریق عضلانی دریافت نمودند (16). در پژوهش حاضر پروتکل تمرین مقاومتی شامل پنج روز تمرین در هفته (چهار نوبت ششتایی با استراحت 60 الی ۹۰ ثانیه) بهصورت صعود از نردبان ۱متری با ۲۶ پله و بستن وزنه به دم موشها که در آن وزنهها، هفته اول ۶۰ درصد وزن بدن موشهای صحرایی بود و هر هفته 20 درصد وزن بدن، به وزنهها اضافه میشد و دو جلسه در هفته وزنکشی انجام میشد و در هفته پنجم شدت تمرین به منظور جلوگیری از بیش تمرینی و فرصت بازیافت مناسب به حیوانات جهت اجرای تمرینات سنگین در سه هفته پایانی با شدت هفته چهارم انجام شد. شیوۀ تمرینی با اندکی تغییر از منابع معتبر اخذ شده است (15). 48 ساعت بعد از آخرین جلسه تمرینی و مصرف تستوسترون، موشها پس از 12 ساعت ناشتایی با ترکیب زایلازین (سه تا پنج میلی گرم به ازای هر کیلوگرم از وزن بدن) و کتامین (30 تا 50 میلیگرم به ازای هر کیلوگرم از وزن بدن) بیهوش شدند. سپس بافت کلیه حیوانات به سرعت برداشته شده و در سرم فیزیولوژیک شستوشو داده شدند، سپس بلافاصله با استفاده از ازت مایع منجمد شده و برای سنجش متغیرهای پژوهش به فریزر با دمای 70- منتقل شدند.
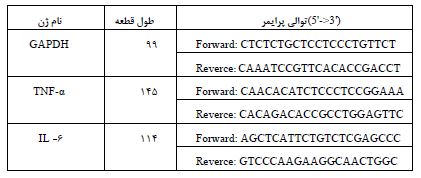
اندازه گیری متغیرهای وابسته: اندازهگیری فعالیت آنزیمهای آنتیاکسیدانی GPX و SOD به روش اسپکتروفتومتری با استفاده از کیت (Randox Laboratories Ltd, UK)، ساخت کشور انگلستان و مقیاس U/mg protein ارزیابی شد. اندازهگیری فعالیت سوپراکسید دیسموتاز (SOD: Superoxide dismutase) مطابق با روش ولیامز و همکاران (17) و اندازه¬گیری فعالیت گلوتاتیون پراکسیداز (Glutathione peroxidase :GPX) بر اساس روش ناکامورا و هوسادا (18) تعیین گردید. برای اندازهگیری بیان ژنهای 6- ILو TNF-α از کیت تجاری تری پیور (Roche, Cat No.11667165001)، به منظور جداسازی RNA کل از نمونههای بافتی، مطابق با راهنمای شرکت سازنده استفاده شد. برای تعیین کیفیت و کمیتRNA های استخراج شده، چگالی نوری (OD) همه نمونه ها با دستگاه نانودراپ اندازهگیری شد. پس از آن، سنتزDNA مکمل (cDNA) توسط کیت سنتز cDNA تاکارا (TAKARA Cat No. 6130) و مطابق با دستورالعمل شرکت سازنده انجام شد. تجزیه و تحلیل کمی توسط دستگاه real time PCR مدل استپ وان پلاس ((Applied Biosystems, Foster City, CA, USA انجام شد. کمیت نسبی سطح بیان mRNA ، 6- IL و TNF-α از نمونههای بافت کلیه سنجش شد که برای این کار از پرایمرهای اختصاصی ژن (6- IL و TNF-α) و مسترمیکس سایبرگرین (TAKARA Cat No. RR820W) استفاده شد. از سطح بیان ژن GAPDH(ژن خانه داری) جهت نرمالکردن سطح بیان ژن-های هدف استفاده شد. پرایمرها (جدول 1) با استفاده از نرمافزار الیگو 7 طراحی شدند و برای اختصاصیت و دقت همه پرایمرها در وب سایت NCBI بلاست می شوند. میانگین نمرات مقادیر تکراری Ct برای هر نمونه اندازهگیری شد و از روش Ct مقایسهای برای تعیین سطح بیان نسبی ژنهای هدف استفاده شد (19).
تجزیه و تحلیل آماری
برای بررسی نرمال بودن توزیع دادهها از آزمون شاپیرو-ویلک استفاده شد. در ادامه برای بررسی تفاوت بین گروهی از آزمون آنالیز واریانس یکراهه استفاده شد. سپس برای تعیین محل تفاوت بین گروهی از آزمون تعقیبی بونفرونی استفاده شد. دادههای تحقیق حاضر با استفاده از نرمافزارversion 16 SPSS تجزیه و تحلیل شدند. برای ترسیم نمودارها از نرمافزار اکسل 2019 استفاده شد. همچنین سطح معنیداری برای تمام دادهها 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
این پژوهش تجربی در کمیته اخلاق در پژوهش دانشکده پزشکی- دانشگاه علوم پزشکی آزاد اسلامی تهران تصویب شد و با توجه به راهنمای مراقبت و استفاده از حیوانات آزمایشگاهی انجام شد (IR.IAU.TMU.REC.1400.133).
جدول 1: پرایمرهای مورد استفاده در پژوهش حاضر
نتایج
نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر IL-6 (P=0/001 F= 12/77) در گروههای تحقیق وجود دارد. نتایج آزمون تعقیبی توکی نشان داد مقادیر IL-6 در گروه تمرین + تستوسترون بهطور معنیداری بیشتر از گروه کنترل بود (0/001=P)؛ اما تفاوت معنیداری در گروههای تمرین و کنترل مشاهده نشد (0/08=P). علاوه بر این مقادیر IL-6 در گروه تمرین + تستوسترون بهطور معنیداری بیشتر از گروه تمرین بود (0/04=P) (شکل 1). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر TNF-α (P=0/009 F= 7/87) در گروههای تحقیق وجود دارد. نتایج نشان داد مقادیر TNF-α در گروه تمرین + تستوسترون به طور معنیداری بیشتر از گروه کنترل بود (0/008=P)؛ اما تفاوت معنیداری در گروه تمرین و کنترل مشاهده نشد (0/68=P). اما گروههای تمرین + تستوسترون به طور معنیداری بیشتر از گروه تمرین بود (0/02=P) (شکل 2). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر GPx (P=0/001 F= 19/56) در گروههای تحقیق وجود دارد. مقادیر GPx در گروه تمرین + تستوسترون (0/001=P) و تمرین (0/001=P) بهطور معنیداری کمتر از گروه کنترل بود. اما تفاوت معنیداری در گروههای تمرین + تستوسترون و گروه تمرین مشاهده نشد (0/93=P) (شکل 3). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر SOD (P=0/62 F= 10/97)در گروههای تحقیق مشاهده نشد (شکل 4).
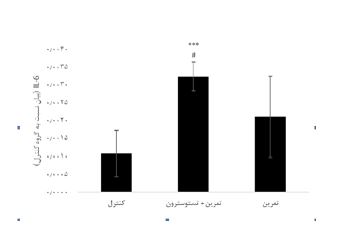
نمودار 1: مقایسه تغییرات سطوح بیان ژنی IL-6 در بافت کلیه موشهای صحرایی در گروههای تحقیق.
*** (0/001=P) افزایش معنیدار نسبت به گروه کنترل # (0/05=P) افزایش معنیدار نسبت به گروه تمرین
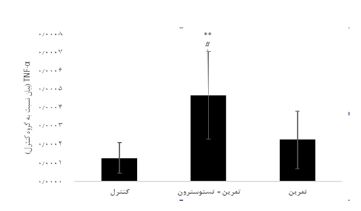
نمودار 2: مقایسه تغییرات سطوح بیان ژنی TNF-α در بافت کلیه موشهای صحرایی در گروههای تحقیق.
** (0/01=P) افزایش معنیدار نسبت به گروه کنترل # (0/05=P) افزایش معنیدار نسبت به گروه تمرین
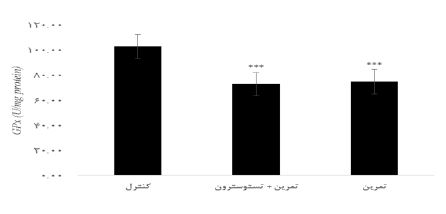
نمودار 3: مقایسه تغییرات مقادیر GPx در بافت کلیه موشهای صحرایی در گروههای تحقیق.
*** (0/001=P) کاهش معنیدار نسبت به گروه کنترل
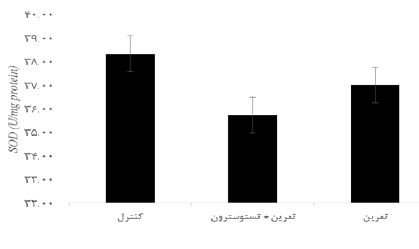
نمودار 4: مقایسه تغییرات مقادیر SOD در بافت کلیه موشهای صحرایی در گروههای تحقیق
بحث
هدف پژوهش حاضر، بررسی اثر یک دوره تمرین مقاومتی همراه با تجویز تستوسترون بر شاخصهای دفاع آنتیاکسیدانی و سایتوکینهای التهابی (6- IL و TNF-α) بافت کلیه در موشهای صحرایی نر بود. نتایج پژوهش حاضر نشان داد که هشت هفته تمرین مقاومتی موجب کاهش معنادار سطوح GPx نسبت به گروه کنترل شده است. اما تاثیر معناداری بر بیان ژن IL-6، TNF-α و میزان فعالیت SOD نسبت به گروه کنترل نداشت. هر چند که هشت هفته تمرین مقاومتی موجب افزایش غیرمعنادار در بیان ژنهای IL-6 و TNF-α شد. در این زمینه مطالعاتی انجام شده است. به عنوان مثال غیاثی و همکاران (2015) گزارش کردند اجرای تمرینات مقاومتی به مدت 4 ماه تاثیر معناداری بر روی آنزیم آنتیاکسیدانی SOD بافت قلب موشهای صحرایی نداشت (20). همچنین پژوهشی نشان داد که انجام یک دوره تمرینات مقاومتی فشرده منجر به کاهش سطوح GPx در زنان وزنه بردار میشود (21). چیما و همکاران (2011) نشان دادند که تمرین مقاومتی منجر به افزایش معنی دار TNF-α در بیماران کلیوی میگردد (22). همچنین واتسون و همکاران (2017) گزارش دادند که انجام تمرینات مقاومتی منجر به افزایش قابلتوجهی در TNF-α در بیماران کلیوی میگردد (23). از طرفی عزآبادی و همکاران (2019) نشان دادند که چهار هفته تمرین مقاومتی منجر به افزایش معنیدار سطوح SOD، CAT و کاهش MDA بافت مخچه موشهای صحرایی مسموم شده با دیازینون میگردد (24). در مقابل، گادلها و همکاران (2021) نشان دادند که 24 هفته تمرین مقاومتی باعث کاهش در TNFα و IL-6 در بیماران مزمن کلیوی شد (25). در پژوهشی دیگر یزدخواستی و همکاران (1401) نیز گزارش کردند که 12 هفته تمرین مقاومتی تناوبی باعث کاهش سطح سرمی IL-6 در مردان چاق شد، اما بر سطوح TNF-α تأثیر معنیداری نداشت (26). مطالعات نشان میدهند که مدت و شدت فعالیت ورزشی، متغیرهای مهمی در پاسخ دستگاه دفاع آنتیاکسیدانی بدن به فعالیت ورزشی هستند (28-27). لذا به نظر می¬رسد تمرین و فعالیت ورزشی، همانگونه که قادر به تقویت دستگاه دفاع آنتیاکسیدانی هستند، به همان نحو نیز میتواند منجر به افزایش تولید ROS از منابع مختلف و در نتیجه تضعیف سیستم آنتیاکسیدانی شوند (29،27). به طوری که در هنگام فعالیتهای ورزشی کلیهها به علت توزیع بیشتر خون به عضلات فعال، محیطی هایپوکسی را تجربه می-کنند، که میتواند از علل افزایش فشار اکسایشی باشند؛ زیرا، در اثر کم خونی ناشی از ورزش در بافتها، تولید رادیکالهای آزاد افزایش مییابد (27). بر اساس برخی از یافتهای پژوهشها علت کاهش فعالیت آنزیم¬های آنتیاکسیدانی بر هم خوردن هموستاز ردوکس (اکسیدان-آنت اکسیدان) می باشد، زیرا فعالیتهای مقاومتی میتواند از طریق سازوکارهایی مانند تغییر هموستاز کلسیم، مسیر گزانتین اکسیداز، افزایش اکسیداسیون کاتکول آمین موجب افزایش تولید رادیکالهای آزاد شود (30). از دلایل اختلاف نتایج پژوهش حاضر با پژوهشهای ذکر شده می¬توان به تفاوت بین بازههای زمانی برای نمونه¬گیری اشاره کرد زیرا بدیهی است که زمان نمونهگیری در رابطه با آخرین جلسه تمرینی مهم است. نزدیک بودن به آخرین جلسه تمرینی ممکن است نشان دهنده تأثیرات حاد ورزش بر التهاب باشد تا اثرات ناشی از سازگاری با فعالیت ورزشی باشد و همچنین میتوان به روش مورد استفاده برای اندازه¬گیری سایتوکاینها (الایزا در مقابل فلوسیتومتری)، نمونههای متفاوت و پروتکلهای تمرین و فعالیت ورزشی (به ویژه شدت) اشاره کرد (28). احتمالاً در مطالعه حاضر شدت فعالیت ورزشی به اندازهای بوده است که منجر به افزایش سایتوکینهای التهابی و راه اندازی مسیرهای سیگنالینگ التهابی (31) پس از فعالیت ورزشی شده باشد. یافته مهم پژوهش حاضر این است که مصرف هشت هفته تستوسترون به همراه تمرین مقاومتی موجب افزایش معنادار بیان ژن IL-6 و TNF-α نسبت به گروه تمرین و کنترل شد. همچنین مقادیر GPx در گروه تمرین+تستوسترون نسبت به گروه کنترل کاهش معنیداری داشت. با این حال تفاوت معناداری در مقادیر SOD در بین گروههای تحقیق مشاهده نشد. همسو با مطالعه حاضر ریزو و همکاران (2014) نشان دادند که مصرف استروئیدهای آنابولیک به همراه تمرینات ورزشی شدید موجب کاهش فعالیت آنزیمهای آنتیاکسیدان گلوتاتیون ردوکتاز و گلوتاتیون پراکسیداز میشود که منجر به کاهش توانایی حذف رادیکالها در کلیه میشود (11). همچنین کارا و همکاران (2018)، گزارش کردند که مصرف استروئیدهای آنابولیک موجب افزایش سطح پروتئین کربونیل (Protein carbonyl: PC) و کاتالاز (Catalase: CAT) در بافت قلب میشود (32). مایادا و همکاران (2015) نشان دادند که تزریق AAS باعث ایجاد تغییرات ساختاری و عملکردی، افزایش استرس اکسیداتیو و واسطههای آپوپتوز مانند ROS، p53 و TNF-α در کبد شد (33). همچنین گومز و همکاران (2016) نیزگزارش کردند که هشت هفته مصرف ناندرلون دکانوات به همراه تمرین مقاومتی منجر به افزایش سطوحNF-KB ، IRF، IL-6، TNF-a و نیتریک اکساید (Nitric oxide: NOX) در بافت پروستات موشهای صحرایی میشود (12). این در حالی است که در پژوهشی دیگر نشان داده شد که مصرف دوزهای بالای تستوسترون انانتات در موشهای صحرایینر که تحت تمرین استقامتی قرار دارند با کاهش فعالیت SOD و CAT به سیستمهای دفاعی و آنتیاکسیدانی آسیب میرساند (34). لیما و همکاران (2020) نیز گزارش کردند که مصرف ناندرلون موجب افزایش استرس اکسیداتیو هم در پروتئینها و هم در لیپیدها و به دنبال آن کاهش فعالیت SOD میشود (35). در ارتباط با سازوکارهای احتمالی گزارش شده است که مصرف طولانیمدت دوزهای بالای AAS منجر به افزایش متابولیسم سیتوکروم مونواکسیژناز و اختلال در زنجیره انتقال الکترونی میشود که این به نوبه خود موجب افزایش تولید ROS و استرس اکسیداتیو میشود (4،36). همچنین تستوسترون میتواند مستقیماً و به طور غیر مستقیم از طریق فعال سازی سیستم رنین- آنژیوتانسین- آلدوسترون و اندوتلین (از طریق افزایش NADPH اکسیداز) باعث ایجاد استرس اکسیداتیو شود (6). استرس اکسیداتیو پارامتر مهمی است که آسیب اندام را افزایش میدهد، و این اختلال متابولیک یا با افزایش گونههای اکسیژن واکنش پذیر یا کاهش در سیستم آنزیمی آنتیاکسیدان مشخص میشود (37). در پژوهش حاضر، کاهش فعالیت آنتیاکسیدانی گلوتاتیون پراکسیداز احتمال دارد ناشی از استفاده زیاد آنها برای کاهش ROS باشد و از طرف دیگر به علت محدود شدن آنزیمهای آنتیاکسیدانی توسط گونههای فعال اکسیژن باشد و ممکن است وضعیت اکسایشی- کاهشی را به سمت استرس اکسیداتیو تغییر دهد (38،39). در توجیه کاهش فعالیت GPX در موشهای مصرف کننده تستوسترون بهنظر میرسد افزایش ROS از دلایل کاهش فعالیت آنتیاکسیدانها باشد. شواهد نشان میدهد بیشتر ROSها و مشتقات فعال (Redox به عنوان مولکو های آسیبرسان شناخته میشوند که میتوانند مسیرهای پیام رسانی التهابی مانند عامل رونویسی هستهای کاپا بتا (nuclear factor Kappa B: NF-kB) را میانجیگری کنند (40) در ادامه NF-kB پس از فعال شدن، از سیتوپلاسم به هسته منتقل میشود، جایی که NF-kB روی پروموتور ژنهای IL-6و TNF-α می نشیند و با القا بیان آن ها موجب افزایش التهاب می شود (13). از سویی دیگر، واسطههای پیشالتهابی مانندTNF-𝛼 ، IL-1 و IL-6 نیز میتوانند منجر به تولیدROS شوند و سپس NF-kB و عامل القایی آپوپتوزی – 1 (Apoptosis induced factor-1: AP-1) را فعال میکنند (41).
نتیجهگیری
به نظر میرسد برای تایید یافتههای پژوهش حاضر بررسی تغییرات هیستوپاتولوژیکی بافت نیز مورد نیاز باشد که از محدودیتهای این پژوهش به شمار میرود. بنابراین پیشنهاد میشود. در پژوهشهای آتی برای اطمینان بیشتر از نتایج، تغییرات هیستوپاتولوژیکی بافت نیز ارزیابی شود. همچنین با توجه به نقش محوری NF-kB در افزایش سایتوکاینها و اهمیت ROSها در ارزیابی توان آنتیاکسیدانی، عدم ارزیابی این دو مسیر نیز از دیگر محدودیتهای مطالعه حاضر است. بنابراین پیشنهاد میگردد در مطالعات آتی این دو متغیر برای اطمینان بیشتر از نتایج ارزیابی شود. بهطور کلی باتوجه به یافته¬های پژوهش حاضر، به نظر میرسد سوءمصرف تستوسترون همراه با تمرین مقاومتی شدید احتمالا با افزایش رادیکالهای آزاد منجر به فعالسازی مسیر بیان سایتوکاین-های التهابی همراه است و در انتها تمرین مقاومتی با شدتهای بالا هم به تنهایی و هم همراه با مصرف دوز فوق فیزیولوژیک تستوسترون منجر به کاهش عملکرد سیستم آنتی¬اکسیدانی و افزایش نشانگرهای التهابی در بافت کلیه همراه است.
سپاسگزاری
این پژوهش برگرفته از رساله دکتری فیزیولوژی ورزش دانشگاه آزاد اسلامی واحد اسلامشهر است. از تمامی کسانی که ما را در انجام این پژوهش یاری نمودند سپاسگزاری میشود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
استروئیدهای آنابولیک آندروژنیک (Anabolic androgenic steroids ; AAS) ترکیبات مشتق شده از تستوسترون هستند که در دوزهای متعارف توسط پزشکان برای هیپوگنادیسم استفاده میشوند (1). از بین انواع مشتقات AASها، تستوسترون انانتات یک AAS طولانیاثر است که به دلیل ارزان و در دسترس بودن آن بهطور گسترده توسط ورزشکاران رشتههای قدرتی با اهداف افزایش توده عضلانی، افزایش قدرت و افزایش عملکرد مورد استفاده قرار میگیرد (2). این نکته قابل ذکر است که محققین نشان دادهاند که دوز مصرفی AASها توسط ورزشکاران حتی به 100 برابر بیشتر از دوزهای درمانی رسیده است (3). اطلاعات نشان میدهد که استفاده از AASها در دوزهای فوق فیزیولوژیک با عوارض جبرانناپذیر همراه است. بهطوری که منجر به افزایش فشار خون، سکته قلبی، ترومبوز، نارسایی قلبی، اختلالات رفتاری و اختلال در عملکرد کبد و کلیه میشود (5-4). محققین بر این باورند که تستوسترون انانتات در وحله اول با اتصال به گیرندههای اندروژنی در توبولهای کلیوی در موشهای صحرایینر با افزایش استرس اکسیداتیو همراه است (2) و منجر به افزایش کراتینین سرم، نارسایی حاد کلیه به دنبال عارضه رابدومیولیز (rhabdomyolysis)، تغییرات بافتی کلیه مانند فیبروز، آتروفی توبولی و اختلالات نفرونی و افزایش التهابی در بافت کلیه میشود (7-6). با توجه به ماهیت عملکرد کلیه در دفع مواد سمی بدن، این بافت بهطور مداوم در معرض سطوح بالایی از اکسیدانهای درونزا و برونزا قرار میگیرد (8). گونههای فعال اکسیژن (Reactive Oxygen Species; ROS) که در اثر فعالیت میتوکندریها، NADPH اکسیدازها (NOX) و منابع دیگر تولید میشوند، زمانی که سیستمهای آنتیاکسیدانی نتوانند بهطور متناسب این مولکولها را خنثی کنند، میتوانند باعث استرس اکسیداتیو شوند (9،4). این اتفاق منجر به پراکسیداسیون لیپیدی، اکسایش DNA و پروتئینها میشود و در نهایت همه این موارد با بروز التهاب و آپوپتوز به اختلال در اعمال حیاتی سلول همراه است (8). مطالعات قبلی نشان دادند که مصرف دوزهای بالای AASها با اختلال در ردوکس سلولی منجر به فعالسازی سلولهای ایمنی شده و در نتیجه با افزایش ترشح سایتوکینهای التهابی همراه است (1). علاوه بر این بهنظر میرسد دوزهای فرافیزیولوژیک تستوسترون مستقیما در تولید فاکتور نکروزدهنده تومور -آلفا (Tumor necrosis factor alpha: TNF-α)، اینترلوکین-1 بتا (Interleukin-1 beta: IL-1 β) و اینترلوکین-6 (Interleukin-6: IL-6) در بافت کلیه نقش داشته باشد (6). علاوه بر این اطلاعات موجود نشان می-دهند که، افزایش TNF-α و IL-6 با افزایش فعالیت گیرنده-های آندروژن، سمیت گلومرولها، کاهش آنزیمهای آنتی اکسیدانی در بافت کلیه میشود همراه است (10،11-6). بررسی مطالعات نشان داده است که مصرف AASها بیشتر با تمرینات شدت بالا همراه است. در حالیکه اثربخشی این تمرینات بسته به نوع تمرین، شدت تمرین، حجم تمرین، تعداد تکرار متفاوت است (12). بهطوری که تمرینات مقاومتی با شدت کم تا متوسط، فشار اکسایشی، عوامل التهابی و آسیب سلولی را در افراد جوان تمرین کرده کاهش میدهد (13)؛ اما، تمرینات مقاومتی طولانیمدت شدید عوامل التهابی مانند β1IL-، TNF-α و 6 IL را در طول و به دنبال ورزش افزایش میدهد. و بهطور خاص، با ایجاد اختلال در تعادل اکسیدان/ آنتیاکسیدان، منجر به فشار اکسایشی میشود و در نتیجه وضعیتی به نام اختلال عملکرد ایمنی ناشی از ورزش را ایجاد میکند (14). شواهد تجربی نشان میدهد که هم تجویز AAS و هم فعالیت ورزشی شدید، میزان آسیب کلیوی را در پاسخ به آسیب سمیت کلیوی افزایش میدهد (11). با توجه به شیوع روزافزاون استفاده بیرویه از AASها توسط ورزشکاران منجر به آسیبهای جبرانناپذیر در عملکرد فیزیولوژیک بسیاری از اندامها به ویژه کلیه میگردد. بنابراین کسب اطلاعات بیشتر در زمینه اثر تمرین مقاومتی شدید و سوءمصرف تستوسترون انانتات میتواند به پیشگیری از آسیبهای کلیوی در این قشر جامعه منجر شود. با توجه به محدودیت اطلاعات در رابطه با اثرات مخرب کلیوی ناشی از سوءمصرفAAS بهویژه در ورزشکاران قدرتی، مطالعه حاضر با هدف بررسی تأثیرات یک دوره تمرین مقاومتی همراه با تجویز تستوسترون بر برخی نشانگرهای سیستم آنتی-اکسیدانی،TNF-α و IL-6 در بافت کلیه موشهای صحرایی در معرض تستوسترون انانتات بود.
روش بررسی
در این پژوهش تجربی 24 سر موش صحرایینر نژاد ویستار با سن 8 هفته و میانگین وزنی 13 ±220 گرم از انستیتو پاستور ایران خریداری شدند. از بین این موشهای صحرایی آنهایی که کاملاً سالم بودند و توان انجام فعالیت بدنی را داشتند به عنوان نمونه آماری انتخاب شدند. همچنین مشاهده مشکلات ظاهری مانند اختلال در حفظ تعادل، بیشتر بودن سن موشهای صحرایی از 10 هفته و عدم توان انجام تمرین از ملاکهای خروج نمونهها در این تحقیق بود. در ابتدا حیوانات به مدت یک هفته با شرایط آزمایشگاه سازگار شدند. در تمام دوره پژوهش، حیوانات در قفسه های پلی کربنات با قابلیت شستشو و در شرایط استاندارد (رطوبت 45 تا 55 درصد، چرخه نور تاریکی 12:12 ساعت و دمای 2±23 درجه سانتیگراد) نگهداری شدند. گفتنی است که در این پژوهش آب و غذا به وفور در اختیار حیوانات گذاشته شد و آنها به طور آزادانه به آن دسترسی داشتند. برای اطمینان از شرایط محیطی مناسب و حفظ رطوبت، دما و تهویه مناسب از دستگاه تهویه هوا و از دماسنج و رطوبت سنج برای پایش تغییرات شبانه روزی دما و رطوبت استفاده شد. پس از یک هفته آشناسازی با محیط آزمایشگاه، تمرینات آشناسازی نیز به مدت یک هفته برای آشناسازی موشهای صحرایی با بالا رفتن از نردبان مخصوص تمرینات مقاومتی جوندگان انجام شد. سپس موشهای صحرایی بهصورت تصادفی به سه گروه 8 تایی شامل (1) گروه کنترل، (2) گروه تمرین و (3) تمرین + تستوسترون تقسیم شدند. موشهای صحرایی گروه¬های تمرین و تمرین + تستوسترون به مدت هشت هفته و پنج جلسه در هفته تمرینات مقاومتی را انجام میدادند. این نکته قابل ذکر است که این پروتکل تمرینی بر اساس راهنمای عملی و علمی از مطالعه گرزی و همکاران انجام شد (15). همچنین موشهای صحرایی گروه تمرین + تستوسترون سه روز در هفته به میزان mg/kg 20 تستوسترون انانتات (ساخت شرکت ایران هورمون، کشور ایران با شماره سریال ساخت 0069) را بهصورت تزریق عضلانی دریافت نمودند (16). در پژوهش حاضر پروتکل تمرین مقاومتی شامل پنج روز تمرین در هفته (چهار نوبت ششتایی با استراحت 60 الی ۹۰ ثانیه) بهصورت صعود از نردبان ۱متری با ۲۶ پله و بستن وزنه به دم موشها که در آن وزنهها، هفته اول ۶۰ درصد وزن بدن موشهای صحرایی بود و هر هفته 20 درصد وزن بدن، به وزنهها اضافه میشد و دو جلسه در هفته وزنکشی انجام میشد و در هفته پنجم شدت تمرین به منظور جلوگیری از بیش تمرینی و فرصت بازیافت مناسب به حیوانات جهت اجرای تمرینات سنگین در سه هفته پایانی با شدت هفته چهارم انجام شد. شیوۀ تمرینی با اندکی تغییر از منابع معتبر اخذ شده است (15). 48 ساعت بعد از آخرین جلسه تمرینی و مصرف تستوسترون، موشها پس از 12 ساعت ناشتایی با ترکیب زایلازین (سه تا پنج میلی گرم به ازای هر کیلوگرم از وزن بدن) و کتامین (30 تا 50 میلیگرم به ازای هر کیلوگرم از وزن بدن) بیهوش شدند. سپس بافت کلیه حیوانات به سرعت برداشته شده و در سرم فیزیولوژیک شستوشو داده شدند، سپس بلافاصله با استفاده از ازت مایع منجمد شده و برای سنجش متغیرهای پژوهش به فریزر با دمای 70- منتقل شدند.
اندازه گیری متغیرهای وابسته: اندازهگیری فعالیت آنزیمهای آنتیاکسیدانی GPX و SOD به روش اسپکتروفتومتری با استفاده از کیت (Randox Laboratories Ltd, UK)، ساخت کشور انگلستان و مقیاس U/mg protein ارزیابی شد. اندازهگیری فعالیت سوپراکسید دیسموتاز (SOD: Superoxide dismutase) مطابق با روش ولیامز و همکاران (17) و اندازه¬گیری فعالیت گلوتاتیون پراکسیداز (Glutathione peroxidase :GPX) بر اساس روش ناکامورا و هوسادا (18) تعیین گردید. برای اندازهگیری بیان ژنهای 6- ILو TNF-α از کیت تجاری تری پیور (Roche, Cat No.11667165001)، به منظور جداسازی RNA کل از نمونههای بافتی، مطابق با راهنمای شرکت سازنده استفاده شد. برای تعیین کیفیت و کمیتRNA های استخراج شده، چگالی نوری (OD) همه نمونه ها با دستگاه نانودراپ اندازهگیری شد. پس از آن، سنتزDNA مکمل (cDNA) توسط کیت سنتز cDNA تاکارا (TAKARA Cat No. 6130) و مطابق با دستورالعمل شرکت سازنده انجام شد. تجزیه و تحلیل کمی توسط دستگاه real time PCR مدل استپ وان پلاس ((Applied Biosystems, Foster City, CA, USA انجام شد. کمیت نسبی سطح بیان mRNA ، 6- IL و TNF-α از نمونههای بافت کلیه سنجش شد که برای این کار از پرایمرهای اختصاصی ژن (6- IL و TNF-α) و مسترمیکس سایبرگرین (TAKARA Cat No. RR820W) استفاده شد. از سطح بیان ژن GAPDH(ژن خانه داری) جهت نرمالکردن سطح بیان ژن-های هدف استفاده شد. پرایمرها (جدول 1) با استفاده از نرمافزار الیگو 7 طراحی شدند و برای اختصاصیت و دقت همه پرایمرها در وب سایت NCBI بلاست می شوند. میانگین نمرات مقادیر تکراری Ct برای هر نمونه اندازهگیری شد و از روش Ct مقایسهای برای تعیین سطح بیان نسبی ژنهای هدف استفاده شد (19).
تجزیه و تحلیل آماری
برای بررسی نرمال بودن توزیع دادهها از آزمون شاپیرو-ویلک استفاده شد. در ادامه برای بررسی تفاوت بین گروهی از آزمون آنالیز واریانس یکراهه استفاده شد. سپس برای تعیین محل تفاوت بین گروهی از آزمون تعقیبی بونفرونی استفاده شد. دادههای تحقیق حاضر با استفاده از نرمافزارversion 16 SPSS تجزیه و تحلیل شدند. برای ترسیم نمودارها از نرمافزار اکسل 2019 استفاده شد. همچنین سطح معنیداری برای تمام دادهها 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
این پژوهش تجربی در کمیته اخلاق در پژوهش دانشکده پزشکی- دانشگاه علوم پزشکی آزاد اسلامی تهران تصویب شد و با توجه به راهنمای مراقبت و استفاده از حیوانات آزمایشگاهی انجام شد (IR.IAU.TMU.REC.1400.133).
جدول 1: پرایمرهای مورد استفاده در پژوهش حاضر

نتایج
نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر IL-6 (P=0/001 F= 12/77) در گروههای تحقیق وجود دارد. نتایج آزمون تعقیبی توکی نشان داد مقادیر IL-6 در گروه تمرین + تستوسترون بهطور معنیداری بیشتر از گروه کنترل بود (0/001=P)؛ اما تفاوت معنیداری در گروههای تمرین و کنترل مشاهده نشد (0/08=P). علاوه بر این مقادیر IL-6 در گروه تمرین + تستوسترون بهطور معنیداری بیشتر از گروه تمرین بود (0/04=P) (شکل 1). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر TNF-α (P=0/009 F= 7/87) در گروههای تحقیق وجود دارد. نتایج نشان داد مقادیر TNF-α در گروه تمرین + تستوسترون به طور معنیداری بیشتر از گروه کنترل بود (0/008=P)؛ اما تفاوت معنیداری در گروه تمرین و کنترل مشاهده نشد (0/68=P). اما گروههای تمرین + تستوسترون به طور معنیداری بیشتر از گروه تمرین بود (0/02=P) (شکل 2). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر GPx (P=0/001 F= 19/56) در گروههای تحقیق وجود دارد. مقادیر GPx در گروه تمرین + تستوسترون (0/001=P) و تمرین (0/001=P) بهطور معنیداری کمتر از گروه کنترل بود. اما تفاوت معنیداری در گروههای تمرین + تستوسترون و گروه تمرین مشاهده نشد (0/93=P) (شکل 3). نتایج آزمون آنالیز واریانس یکراهه نشان داد تفاوت معنیداری در مقادیر SOD (P=0/62 F= 10/97)در گروههای تحقیق مشاهده نشد (شکل 4).

نمودار 1: مقایسه تغییرات سطوح بیان ژنی IL-6 در بافت کلیه موشهای صحرایی در گروههای تحقیق.
*** (0/001=P) افزایش معنیدار نسبت به گروه کنترل # (0/05=P) افزایش معنیدار نسبت به گروه تمرین

نمودار 2: مقایسه تغییرات سطوح بیان ژنی TNF-α در بافت کلیه موشهای صحرایی در گروههای تحقیق.
** (0/01=P) افزایش معنیدار نسبت به گروه کنترل # (0/05=P) افزایش معنیدار نسبت به گروه تمرین

نمودار 3: مقایسه تغییرات مقادیر GPx در بافت کلیه موشهای صحرایی در گروههای تحقیق.
*** (0/001=P) کاهش معنیدار نسبت به گروه کنترل

نمودار 4: مقایسه تغییرات مقادیر SOD در بافت کلیه موشهای صحرایی در گروههای تحقیق
بحث
هدف پژوهش حاضر، بررسی اثر یک دوره تمرین مقاومتی همراه با تجویز تستوسترون بر شاخصهای دفاع آنتیاکسیدانی و سایتوکینهای التهابی (6- IL و TNF-α) بافت کلیه در موشهای صحرایی نر بود. نتایج پژوهش حاضر نشان داد که هشت هفته تمرین مقاومتی موجب کاهش معنادار سطوح GPx نسبت به گروه کنترل شده است. اما تاثیر معناداری بر بیان ژن IL-6، TNF-α و میزان فعالیت SOD نسبت به گروه کنترل نداشت. هر چند که هشت هفته تمرین مقاومتی موجب افزایش غیرمعنادار در بیان ژنهای IL-6 و TNF-α شد. در این زمینه مطالعاتی انجام شده است. به عنوان مثال غیاثی و همکاران (2015) گزارش کردند اجرای تمرینات مقاومتی به مدت 4 ماه تاثیر معناداری بر روی آنزیم آنتیاکسیدانی SOD بافت قلب موشهای صحرایی نداشت (20). همچنین پژوهشی نشان داد که انجام یک دوره تمرینات مقاومتی فشرده منجر به کاهش سطوح GPx در زنان وزنه بردار میشود (21). چیما و همکاران (2011) نشان دادند که تمرین مقاومتی منجر به افزایش معنی دار TNF-α در بیماران کلیوی میگردد (22). همچنین واتسون و همکاران (2017) گزارش دادند که انجام تمرینات مقاومتی منجر به افزایش قابلتوجهی در TNF-α در بیماران کلیوی میگردد (23). از طرفی عزآبادی و همکاران (2019) نشان دادند که چهار هفته تمرین مقاومتی منجر به افزایش معنیدار سطوح SOD، CAT و کاهش MDA بافت مخچه موشهای صحرایی مسموم شده با دیازینون میگردد (24). در مقابل، گادلها و همکاران (2021) نشان دادند که 24 هفته تمرین مقاومتی باعث کاهش در TNFα و IL-6 در بیماران مزمن کلیوی شد (25). در پژوهشی دیگر یزدخواستی و همکاران (1401) نیز گزارش کردند که 12 هفته تمرین مقاومتی تناوبی باعث کاهش سطح سرمی IL-6 در مردان چاق شد، اما بر سطوح TNF-α تأثیر معنیداری نداشت (26). مطالعات نشان میدهند که مدت و شدت فعالیت ورزشی، متغیرهای مهمی در پاسخ دستگاه دفاع آنتیاکسیدانی بدن به فعالیت ورزشی هستند (28-27). لذا به نظر می¬رسد تمرین و فعالیت ورزشی، همانگونه که قادر به تقویت دستگاه دفاع آنتیاکسیدانی هستند، به همان نحو نیز میتواند منجر به افزایش تولید ROS از منابع مختلف و در نتیجه تضعیف سیستم آنتیاکسیدانی شوند (29،27). به طوری که در هنگام فعالیتهای ورزشی کلیهها به علت توزیع بیشتر خون به عضلات فعال، محیطی هایپوکسی را تجربه می-کنند، که میتواند از علل افزایش فشار اکسایشی باشند؛ زیرا، در اثر کم خونی ناشی از ورزش در بافتها، تولید رادیکالهای آزاد افزایش مییابد (27). بر اساس برخی از یافتهای پژوهشها علت کاهش فعالیت آنزیم¬های آنتیاکسیدانی بر هم خوردن هموستاز ردوکس (اکسیدان-آنت اکسیدان) می باشد، زیرا فعالیتهای مقاومتی میتواند از طریق سازوکارهایی مانند تغییر هموستاز کلسیم، مسیر گزانتین اکسیداز، افزایش اکسیداسیون کاتکول آمین موجب افزایش تولید رادیکالهای آزاد شود (30). از دلایل اختلاف نتایج پژوهش حاضر با پژوهشهای ذکر شده می¬توان به تفاوت بین بازههای زمانی برای نمونه¬گیری اشاره کرد زیرا بدیهی است که زمان نمونهگیری در رابطه با آخرین جلسه تمرینی مهم است. نزدیک بودن به آخرین جلسه تمرینی ممکن است نشان دهنده تأثیرات حاد ورزش بر التهاب باشد تا اثرات ناشی از سازگاری با فعالیت ورزشی باشد و همچنین میتوان به روش مورد استفاده برای اندازه¬گیری سایتوکاینها (الایزا در مقابل فلوسیتومتری)، نمونههای متفاوت و پروتکلهای تمرین و فعالیت ورزشی (به ویژه شدت) اشاره کرد (28). احتمالاً در مطالعه حاضر شدت فعالیت ورزشی به اندازهای بوده است که منجر به افزایش سایتوکینهای التهابی و راه اندازی مسیرهای سیگنالینگ التهابی (31) پس از فعالیت ورزشی شده باشد. یافته مهم پژوهش حاضر این است که مصرف هشت هفته تستوسترون به همراه تمرین مقاومتی موجب افزایش معنادار بیان ژن IL-6 و TNF-α نسبت به گروه تمرین و کنترل شد. همچنین مقادیر GPx در گروه تمرین+تستوسترون نسبت به گروه کنترل کاهش معنیداری داشت. با این حال تفاوت معناداری در مقادیر SOD در بین گروههای تحقیق مشاهده نشد. همسو با مطالعه حاضر ریزو و همکاران (2014) نشان دادند که مصرف استروئیدهای آنابولیک به همراه تمرینات ورزشی شدید موجب کاهش فعالیت آنزیمهای آنتیاکسیدان گلوتاتیون ردوکتاز و گلوتاتیون پراکسیداز میشود که منجر به کاهش توانایی حذف رادیکالها در کلیه میشود (11). همچنین کارا و همکاران (2018)، گزارش کردند که مصرف استروئیدهای آنابولیک موجب افزایش سطح پروتئین کربونیل (Protein carbonyl: PC) و کاتالاز (Catalase: CAT) در بافت قلب میشود (32). مایادا و همکاران (2015) نشان دادند که تزریق AAS باعث ایجاد تغییرات ساختاری و عملکردی، افزایش استرس اکسیداتیو و واسطههای آپوپتوز مانند ROS، p53 و TNF-α در کبد شد (33). همچنین گومز و همکاران (2016) نیزگزارش کردند که هشت هفته مصرف ناندرلون دکانوات به همراه تمرین مقاومتی منجر به افزایش سطوحNF-KB ، IRF، IL-6، TNF-a و نیتریک اکساید (Nitric oxide: NOX) در بافت پروستات موشهای صحرایی میشود (12). این در حالی است که در پژوهشی دیگر نشان داده شد که مصرف دوزهای بالای تستوسترون انانتات در موشهای صحرایینر که تحت تمرین استقامتی قرار دارند با کاهش فعالیت SOD و CAT به سیستمهای دفاعی و آنتیاکسیدانی آسیب میرساند (34). لیما و همکاران (2020) نیز گزارش کردند که مصرف ناندرلون موجب افزایش استرس اکسیداتیو هم در پروتئینها و هم در لیپیدها و به دنبال آن کاهش فعالیت SOD میشود (35). در ارتباط با سازوکارهای احتمالی گزارش شده است که مصرف طولانیمدت دوزهای بالای AAS منجر به افزایش متابولیسم سیتوکروم مونواکسیژناز و اختلال در زنجیره انتقال الکترونی میشود که این به نوبه خود موجب افزایش تولید ROS و استرس اکسیداتیو میشود (4،36). همچنین تستوسترون میتواند مستقیماً و به طور غیر مستقیم از طریق فعال سازی سیستم رنین- آنژیوتانسین- آلدوسترون و اندوتلین (از طریق افزایش NADPH اکسیداز) باعث ایجاد استرس اکسیداتیو شود (6). استرس اکسیداتیو پارامتر مهمی است که آسیب اندام را افزایش میدهد، و این اختلال متابولیک یا با افزایش گونههای اکسیژن واکنش پذیر یا کاهش در سیستم آنزیمی آنتیاکسیدان مشخص میشود (37). در پژوهش حاضر، کاهش فعالیت آنتیاکسیدانی گلوتاتیون پراکسیداز احتمال دارد ناشی از استفاده زیاد آنها برای کاهش ROS باشد و از طرف دیگر به علت محدود شدن آنزیمهای آنتیاکسیدانی توسط گونههای فعال اکسیژن باشد و ممکن است وضعیت اکسایشی- کاهشی را به سمت استرس اکسیداتیو تغییر دهد (38،39). در توجیه کاهش فعالیت GPX در موشهای مصرف کننده تستوسترون بهنظر میرسد افزایش ROS از دلایل کاهش فعالیت آنتیاکسیدانها باشد. شواهد نشان میدهد بیشتر ROSها و مشتقات فعال (Redox به عنوان مولکو های آسیبرسان شناخته میشوند که میتوانند مسیرهای پیام رسانی التهابی مانند عامل رونویسی هستهای کاپا بتا (nuclear factor Kappa B: NF-kB) را میانجیگری کنند (40) در ادامه NF-kB پس از فعال شدن، از سیتوپلاسم به هسته منتقل میشود، جایی که NF-kB روی پروموتور ژنهای IL-6و TNF-α می نشیند و با القا بیان آن ها موجب افزایش التهاب می شود (13). از سویی دیگر، واسطههای پیشالتهابی مانندTNF-𝛼 ، IL-1 و IL-6 نیز میتوانند منجر به تولیدROS شوند و سپس NF-kB و عامل القایی آپوپتوزی – 1 (Apoptosis induced factor-1: AP-1) را فعال میکنند (41).
نتیجهگیری
به نظر میرسد برای تایید یافتههای پژوهش حاضر بررسی تغییرات هیستوپاتولوژیکی بافت نیز مورد نیاز باشد که از محدودیتهای این پژوهش به شمار میرود. بنابراین پیشنهاد میشود. در پژوهشهای آتی برای اطمینان بیشتر از نتایج، تغییرات هیستوپاتولوژیکی بافت نیز ارزیابی شود. همچنین با توجه به نقش محوری NF-kB در افزایش سایتوکاینها و اهمیت ROSها در ارزیابی توان آنتیاکسیدانی، عدم ارزیابی این دو مسیر نیز از دیگر محدودیتهای مطالعه حاضر است. بنابراین پیشنهاد میگردد در مطالعات آتی این دو متغیر برای اطمینان بیشتر از نتایج ارزیابی شود. بهطور کلی باتوجه به یافته¬های پژوهش حاضر، به نظر میرسد سوءمصرف تستوسترون همراه با تمرین مقاومتی شدید احتمالا با افزایش رادیکالهای آزاد منجر به فعالسازی مسیر بیان سایتوکاین-های التهابی همراه است و در انتها تمرین مقاومتی با شدتهای بالا هم به تنهایی و هم همراه با مصرف دوز فوق فیزیولوژیک تستوسترون منجر به کاهش عملکرد سیستم آنتی¬اکسیدانی و افزایش نشانگرهای التهابی در بافت کلیه همراه است.
سپاسگزاری
این پژوهش برگرفته از رساله دکتری فیزیولوژی ورزش دانشگاه آزاد اسلامی واحد اسلامشهر است. از تمامی کسانی که ما را در انجام این پژوهش یاری نمودند سپاسگزاری میشود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Magalhães SC, de Oliveira KA, Freiras PA, Moreira Gomes MD, Pereira LM, Boa LF, et al. High-dose Nandrolone Decanoate Induces Oxidative Stress and Inflammation in Retroperitoneal Adipose Tissue Of Male Rats. J Steroid Biochem Mol Biol 2020; 203: 105728.
2- Karbasi S, Zaeemi M, Mohri M, Rashidlamir A, Moosavi Z. Outcomes of Testosterone Enanthate on Kidney of Male Wistar Rats Subjected to Resistance Training. Science & Sports 2017; 32(3): e107-e110.
3- Arazi H, Rahmati S, Ghafoori H. The Interaction Effects of Resistance Training and Sustanon Abuse on Liver Antioxidant Activities and Serum Enzymes in Male Rats. Interv Med Appl Sci 2017; 9(3): 178-83.
4- Frankenfeld SP, Oliveira LP, Ortenzi VH, Rego-Monteiro IC, Chaves EA, Ferreira AC, et al. The Anabolic Androgenic Steroid Nandrolone Decanoate Disrupts Redox Homeostasis in Liver, Heart and Kidney of Male Wistar Rats. PloS One 2014; 9(9): e102699.
5- Agahi MR, Mosallanejad Z, Salehi OR. The Effects of Resistance Training and Spirulina on the Performance of the Antioxidant System with Emphasis on Mir125b, Mir146a and Cognitive Function in Stanazolol-Induced Neurotoxicity in Rats. Chem Biol Interact 2022; 366: 110112.
6- Davani-Davari D, Karimzadeh I, Khalili H. The Potential Effects of Anabolic-Androgenic Steroids and Growth Hormone as Commonly Used Sport Supplements on The Kidney: A Systematic Review. BMC Nephrol 2019; 20(1): 198.
7- Albano GD, Amico F, Cocimano G, Liberto A, Maglietta F, Esposito M, et al. Adverse Effects of Anabolic-Androgenic Steroids: A Literature Review. Healthcare (Basel) 2021; 9(1): 97.
8- Dornelles GL, Bueno A, de Oliveira JS, da Silva AS, França RT, da Silva CB, et al. Biochemical and Oxidative Stress Markers in the Liver and Kidneys of Rats Submitted to Different Protocols of Anabolic Steroids. Mol Cell Biochem 2017; 425(1-2): 181-9.
9- Sottero B, Rossin D, Poli G, Biasi F. Lipid Oxidation Products in The Pathogenesis of Inflammation-Related Gut Diseases. Curr Med Chem 2018; 25(11): 1311-26.
10- Culig Z. Androgen Receptor Cross-Talk with Cell Signalling Pathways. Growth factors 2004; 22(3): 179-84.
11- Riezzo I, Turillazzi E, Bello S, Cantatore S, Cerretani D, Di Paolo M, et al. Chronic Nandrolone Administration Promotes Oxidative Stress, Induction of Pro-Inflammatory Cytokine and TNF-Α Mediated Apoptosis in Tthe Kidneys of CD1 Treated Mice. Toxicol Appl Pharmacol 2014; 280(1): 97-106.
12- Gomes FC, Chuffa LG, Scarano WR, Pinheiro PF, Fávaro WJ, Domeniconi RF. Nandrolone Decanoate and Resistance Exercise Training Favor the Occurrence of Lesions and Activate the Inflammatory Response in the Ventral Prostate. Andrology 2016; 4(3): 473-80.
13- Tofas T, Draganidis D, Deli CK, Georgakouli K, Fatouros IG, Jamurtas AZ. Exercise-Induced Regulation of Redox Status in Cardiovascular Diseases: The Role of Exercise Training and Detraining. Antioxidants (Basel) 2019; 9(1): 13.
14- Koozehchian MS, Daneshfar A, Fallah E, Agha-Alinejad H, Samadi M, Kaviani M, et al. Effects of Nine Weeks L-Carnitine Supplementation on Exercise Performance, Anaerobic Power, And Exercise-Induced Oxidative Stress in Resistance-Trained Males. J Exerc Nutrition Biochem 2018; 22(4):7-19.
15- Gorzi A, Rajabi H, Gharakhanlou R, Dehkhoda MR, Hedayati M. The Effects of 8 Weeks of Resistance Training on Total and A12 Acetyl Cholinesterase Activity in Slow Twitch Muscles of Rats. RSMT 2017; 15(13):9-16. [Persian]
16- Joksimović J, Selaković D, Jakovljević V, Mihailović V, Katanić J, Boroja T, et al. Alterations of the Oxidative Status in Rat Hippocampus and Prodepressant Effect of Chronic Testosterone Enanthate Administration. Mol Cell Biochem 2017; 433(1-2): 41-50.
17- Woolliams JA, Wiener G, Anderson PH, McMurray CH. Variation in the Activities of Glutathione Peroxidase and Superoxide Dismutase and in the Concentration of Copper in the Blood in Various Breed Crosses of Sheep. Res Vet Sci 1983; 34(3): 253–6.
18- Nakamura W, Hosada S, Hayashi K. Purification and Properties of Rat Liver Glutathione Peroxidase. Biochim Biophys Acta 1974: 358(2): 251-61.
19- Pfaffl MW. A New Mathematical Model for Relative Quantification in Real-Time RT–PCR. Nucleic Acids Res 2001; 29(9): e45.
20- Ghiasi R, Mohammadi M, Ashrafi Helan J, Jafari Jozani SR, Mohammadi S, Ghiasi A, et al. Influence of Two Various Durations of Resistance Exercise on Oxidative Stress in the Male Rat’s Hearts. J Cardiovasc Thorac Res 2015; 7(4): 149-53.
21- Liu JF, Chang WY, Chan KH, Tsai WY, Lin CL, Hsu MC. Blood Lipid Peroxides and Muscle Damage Increased Following Intensive Resistance Training of Female Weightlifters. Ann N Y Acad Sci 2005; 1042(1): 255-61.
22- Cheema BS, Abas H, Smith BC, O'Sullivan AJ, Chan M, Patwardhan A, et al. Effect of Resistance Training during Hemodialysis on Circulating Cytokines: A Randomized Controlled Trial. Eur J Appl Physiol 2011; 111: 1437-45.
23- Watson EL, Viana JL, Wimbury D, Martin N, Greening NJ, Barratt J, et al. The Effect of Resistance Exercise on Inflammatory and Myogenic Markers in Patients with Chronic Kidney Disease. Front Physiol 2017; 8: 541.
24- Ezabadi A, Peeri M, Azarbayjani MA, Hosseini SA. The Effects of Resistance Training and Berberine Chloride Supplementation on Oxidative Stress Markers in the Cerebellum Tissue of Diazinon-Poisoned Rats. MEJRHS 2019; 6(3): e92870.
25- Gadelha AB, Cesari M, Corrêa HL, Neves RVP, Sousa CV, Deus LA, et al. Effects of Pre-Dialysis Resistance Training on Sarcopenia, Inflammatory Profile, and Anemia Biomarkers in Older Community-Dwelling Patients with Chronic Kidney Disease: A Randomized Controlled Trial. Int Urol Nephrol 2021: 53(10): 2137-47.
26- Yazdkhasti E, Seifi-Skishahr F, Farzizadeh R. The Effect of Interval Resistance Training with Different Intensity on Interleukin-6, Tumor Necrosis Factor–Α and NRG-4 in Obese Men. JME 2022; 12(2): 1-20. [Persian]
27- Gorzi A, Ekradi S. The Effect of Intake Duration of Curcumin Supplementation during Strenuous Endurance Training on GPX Activity and MDA Levels of Liver, Heart and Skeletal Muscle in Male Wistar Rats. Sport Physiology 2020; 12(46): 139-56. [Persian]
28- Azizbeigi K, Azarbayjani MA, Atashak S, Stannard SR. Effect of Moderate and High Resistance Training Intensity on Indices of Inflammatory and Oxidative Stress. Res Sports Med 2015; 23(1): 73-87.
29- Delavar R, Mogharnasi M, Khoobkhahi N. The Effects of Combined Training on Oxidativestress and Antioxidant Defense Indicators. IJBSM 2017; 2(1): 29-32.
30- Mohammadjafari H, Arazi H, Nemati N, Bagherpoor T, Suzuki K. Acute Effects of Resistance Exercise and the Use of GH or IGF-1 Hormones on Oxidative Stress and Antioxidant Markers in Bodybuilders. Antioxidants (Basel) 2019; 8(12): 587.
31- Mehrabi M, Kazemzadeh Y, Gorzi A, Hosseini SA, Sedaghati S. The Effect of Eight Weeks of Testosterone Enanthate Consumption on Antioxidant Activity and NF-KB and Cyclooxygenase-2 Genes Expression of Kidney Tissue in Resistance Trained Male Rats. KAUMS Journal (FEYZ) 2022; 26(6): 666-75.
32- Kara M, Ozcagli E, Kotil T, Alpertunga B. Effects of Stanozolol on Apoptosis Mechanisms and Oxidative Stress in Rat Cardiac Tissue. Steroids 2018; 134: 96-100.
33- Mayada RF, Taghred MS, Haytham AA. Boldenone-Induced Apoptotic, Structural, and Functional Alterations in the Liver of Rabbits. World Rabbit Sci 2015; 23(1): 39-46.
34- Sadowska-Krępa E, Kłapcińska B, Nowara A, Jagsz S, Szołtysek-Bołdys I, Chalimoniuk M, et al. High-Dose Testosterone Supplementation Disturbs Liver Pro-Oxidant/Antioxidant Balance and Function in Adolescent Male Wistar Rats Undergoing Moderate-Intensity Endurance Training. PeerJ 2020; 8: e10228.
35- Lima EM, Cassaro KODS, Silva CLD, Silva MA, Poltronieri MP, Nascimento AMD, et al. Eight Weeks of Treatment with Nandrolone Decanoate in Female Rats Promotes Disruption in the Redox Homeostasis and Impaired Renal Function. Life Sci 2020; 242: 117227.
36- Arazi H, Mohammadjafari H, Asadi A. Use of Anabolic Androgenic Steroids Produces Greater Oxidative Stress Responses to Resistance Exercise in Strength-Trained Men. Toxicol Rep 2017; 4: 282-6.
37- Ara N, Nakkanong K, Lv W, Yang J, Hu Z, Zhang M. Antioxidant Enzymatic Activities and Gene Expression Associated with Heat Tolerance in the Stems and Roots of Two Cucurbit Species (“Cucurbita Maxima” and “Cucurbita Moschata”) and Their Interspecific Inbred Line “Maxchata”. Int J Mol Sci 2013; 14(12): 24008-28.
38- Dousdampanis P, Trigka K, Fourtounas C, Bargman JM. Role of Testosterone in the Pathogenesis, Progression, Prognosis and Comorbidity of Men with Chronic Kidney Disease. Ther Apher Dial 2014; 18(3): 220-30.
39- Gorzi A, Ekradi S, Rahmani A. The Effect of High Intensity Endurance Training on Antioxidant Defense and Lipid Peroxidation of Male Wistar Rats. Journal of Sport Biosciences 2018; 10(3): 333-45. [Persian]
40- Kabe Y, Ando K, Hirao S, Yoshida M, Handa H. Redox Regulation of NF-Κb Activation: Distinct Redox Regulation Between the Cytoplasm and the Nucleus. Antioxid Redox Signal 2005; 7(3-4): 395-403.
41- Sallam N, Laher I. Exercise Modulates Oxidative Stress and Inflammation in Aging and Cardiovascular Diseases. Oxid Med Cell Longev 2016; 2016: 7239639.
1- Magalhães SC, de Oliveira KA, Freiras PA, Moreira Gomes MD, Pereira LM, Boa LF, et al. High-dose Nandrolone Decanoate Induces Oxidative Stress and Inflammation in Retroperitoneal Adipose Tissue Of Male Rats. J Steroid Biochem Mol Biol 2020; 203: 105728.
2- Karbasi S, Zaeemi M, Mohri M, Rashidlamir A, Moosavi Z. Outcomes of Testosterone Enanthate on Kidney of Male Wistar Rats Subjected to Resistance Training. Science & Sports 2017; 32(3): e107-e110.
3- Arazi H, Rahmati S, Ghafoori H. The Interaction Effects of Resistance Training and Sustanon Abuse on Liver Antioxidant Activities and Serum Enzymes in Male Rats. Interv Med Appl Sci 2017; 9(3): 178-83.
4- Frankenfeld SP, Oliveira LP, Ortenzi VH, Rego-Monteiro IC, Chaves EA, Ferreira AC, et al. The Anabolic Androgenic Steroid Nandrolone Decanoate Disrupts Redox Homeostasis in Liver, Heart and Kidney of Male Wistar Rats. PloS One 2014; 9(9): e102699.
5- Agahi MR, Mosallanejad Z, Salehi OR. The Effects of Resistance Training and Spirulina on the Performance of the Antioxidant System with Emphasis on Mir125b, Mir146a and Cognitive Function in Stanazolol-Induced Neurotoxicity in Rats. Chem Biol Interact 2022; 366: 110112.
6- Davani-Davari D, Karimzadeh I, Khalili H. The Potential Effects of Anabolic-Androgenic Steroids and Growth Hormone as Commonly Used Sport Supplements on The Kidney: A Systematic Review. BMC Nephrol 2019; 20(1): 198.
7- Albano GD, Amico F, Cocimano G, Liberto A, Maglietta F, Esposito M, et al. Adverse Effects of Anabolic-Androgenic Steroids: A Literature Review. Healthcare (Basel) 2021; 9(1): 97.
8- Dornelles GL, Bueno A, de Oliveira JS, da Silva AS, França RT, da Silva CB, et al. Biochemical and Oxidative Stress Markers in the Liver and Kidneys of Rats Submitted to Different Protocols of Anabolic Steroids. Mol Cell Biochem 2017; 425(1-2): 181-9.
9- Sottero B, Rossin D, Poli G, Biasi F. Lipid Oxidation Products in The Pathogenesis of Inflammation-Related Gut Diseases. Curr Med Chem 2018; 25(11): 1311-26.
10- Culig Z. Androgen Receptor Cross-Talk with Cell Signalling Pathways. Growth factors 2004; 22(3): 179-84.
11- Riezzo I, Turillazzi E, Bello S, Cantatore S, Cerretani D, Di Paolo M, et al. Chronic Nandrolone Administration Promotes Oxidative Stress, Induction of Pro-Inflammatory Cytokine and TNF-Α Mediated Apoptosis in Tthe Kidneys of CD1 Treated Mice. Toxicol Appl Pharmacol 2014; 280(1): 97-106.
12- Gomes FC, Chuffa LG, Scarano WR, Pinheiro PF, Fávaro WJ, Domeniconi RF. Nandrolone Decanoate and Resistance Exercise Training Favor the Occurrence of Lesions and Activate the Inflammatory Response in the Ventral Prostate. Andrology 2016; 4(3): 473-80.
13- Tofas T, Draganidis D, Deli CK, Georgakouli K, Fatouros IG, Jamurtas AZ. Exercise-Induced Regulation of Redox Status in Cardiovascular Diseases: The Role of Exercise Training and Detraining. Antioxidants (Basel) 2019; 9(1): 13.
14- Koozehchian MS, Daneshfar A, Fallah E, Agha-Alinejad H, Samadi M, Kaviani M, et al. Effects of Nine Weeks L-Carnitine Supplementation on Exercise Performance, Anaerobic Power, And Exercise-Induced Oxidative Stress in Resistance-Trained Males. J Exerc Nutrition Biochem 2018; 22(4):7-19.
15- Gorzi A, Rajabi H, Gharakhanlou R, Dehkhoda MR, Hedayati M. The Effects of 8 Weeks of Resistance Training on Total and A12 Acetyl Cholinesterase Activity in Slow Twitch Muscles of Rats. RSMT 2017; 15(13):9-16. [Persian]
16- Joksimović J, Selaković D, Jakovljević V, Mihailović V, Katanić J, Boroja T, et al. Alterations of the Oxidative Status in Rat Hippocampus and Prodepressant Effect of Chronic Testosterone Enanthate Administration. Mol Cell Biochem 2017; 433(1-2): 41-50.
17- Woolliams JA, Wiener G, Anderson PH, McMurray CH. Variation in the Activities of Glutathione Peroxidase and Superoxide Dismutase and in the Concentration of Copper in the Blood in Various Breed Crosses of Sheep. Res Vet Sci 1983; 34(3): 253–6.
18- Nakamura W, Hosada S, Hayashi K. Purification and Properties of Rat Liver Glutathione Peroxidase. Biochim Biophys Acta 1974: 358(2): 251-61.
19- Pfaffl MW. A New Mathematical Model for Relative Quantification in Real-Time RT–PCR. Nucleic Acids Res 2001; 29(9): e45.
20- Ghiasi R, Mohammadi M, Ashrafi Helan J, Jafari Jozani SR, Mohammadi S, Ghiasi A, et al. Influence of Two Various Durations of Resistance Exercise on Oxidative Stress in the Male Rat’s Hearts. J Cardiovasc Thorac Res 2015; 7(4): 149-53.
21- Liu JF, Chang WY, Chan KH, Tsai WY, Lin CL, Hsu MC. Blood Lipid Peroxides and Muscle Damage Increased Following Intensive Resistance Training of Female Weightlifters. Ann N Y Acad Sci 2005; 1042(1): 255-61.
22- Cheema BS, Abas H, Smith BC, O'Sullivan AJ, Chan M, Patwardhan A, et al. Effect of Resistance Training during Hemodialysis on Circulating Cytokines: A Randomized Controlled Trial. Eur J Appl Physiol 2011; 111: 1437-45.
23- Watson EL, Viana JL, Wimbury D, Martin N, Greening NJ, Barratt J, et al. The Effect of Resistance Exercise on Inflammatory and Myogenic Markers in Patients with Chronic Kidney Disease. Front Physiol 2017; 8: 541.
24- Ezabadi A, Peeri M, Azarbayjani MA, Hosseini SA. The Effects of Resistance Training and Berberine Chloride Supplementation on Oxidative Stress Markers in the Cerebellum Tissue of Diazinon-Poisoned Rats. MEJRHS 2019; 6(3): e92870.
25- Gadelha AB, Cesari M, Corrêa HL, Neves RVP, Sousa CV, Deus LA, et al. Effects of Pre-Dialysis Resistance Training on Sarcopenia, Inflammatory Profile, and Anemia Biomarkers in Older Community-Dwelling Patients with Chronic Kidney Disease: A Randomized Controlled Trial. Int Urol Nephrol 2021: 53(10): 2137-47.
26- Yazdkhasti E, Seifi-Skishahr F, Farzizadeh R. The Effect of Interval Resistance Training with Different Intensity on Interleukin-6, Tumor Necrosis Factor–Α and NRG-4 in Obese Men. JME 2022; 12(2): 1-20. [Persian]
27- Gorzi A, Ekradi S. The Effect of Intake Duration of Curcumin Supplementation during Strenuous Endurance Training on GPX Activity and MDA Levels of Liver, Heart and Skeletal Muscle in Male Wistar Rats. Sport Physiology 2020; 12(46): 139-56. [Persian]
28- Azizbeigi K, Azarbayjani MA, Atashak S, Stannard SR. Effect of Moderate and High Resistance Training Intensity on Indices of Inflammatory and Oxidative Stress. Res Sports Med 2015; 23(1): 73-87.
29- Delavar R, Mogharnasi M, Khoobkhahi N. The Effects of Combined Training on Oxidativestress and Antioxidant Defense Indicators. IJBSM 2017; 2(1): 29-32.
30- Mohammadjafari H, Arazi H, Nemati N, Bagherpoor T, Suzuki K. Acute Effects of Resistance Exercise and the Use of GH or IGF-1 Hormones on Oxidative Stress and Antioxidant Markers in Bodybuilders. Antioxidants (Basel) 2019; 8(12): 587.
31- Mehrabi M, Kazemzadeh Y, Gorzi A, Hosseini SA, Sedaghati S. The Effect of Eight Weeks of Testosterone Enanthate Consumption on Antioxidant Activity and NF-KB and Cyclooxygenase-2 Genes Expression of Kidney Tissue in Resistance Trained Male Rats. KAUMS Journal (FEYZ) 2022; 26(6): 666-75.
32- Kara M, Ozcagli E, Kotil T, Alpertunga B. Effects of Stanozolol on Apoptosis Mechanisms and Oxidative Stress in Rat Cardiac Tissue. Steroids 2018; 134: 96-100.
33- Mayada RF, Taghred MS, Haytham AA. Boldenone-Induced Apoptotic, Structural, and Functional Alterations in the Liver of Rabbits. World Rabbit Sci 2015; 23(1): 39-46.
34- Sadowska-Krępa E, Kłapcińska B, Nowara A, Jagsz S, Szołtysek-Bołdys I, Chalimoniuk M, et al. High-Dose Testosterone Supplementation Disturbs Liver Pro-Oxidant/Antioxidant Balance and Function in Adolescent Male Wistar Rats Undergoing Moderate-Intensity Endurance Training. PeerJ 2020; 8: e10228.
35- Lima EM, Cassaro KODS, Silva CLD, Silva MA, Poltronieri MP, Nascimento AMD, et al. Eight Weeks of Treatment with Nandrolone Decanoate in Female Rats Promotes Disruption in the Redox Homeostasis and Impaired Renal Function. Life Sci 2020; 242: 117227.
36- Arazi H, Mohammadjafari H, Asadi A. Use of Anabolic Androgenic Steroids Produces Greater Oxidative Stress Responses to Resistance Exercise in Strength-Trained Men. Toxicol Rep 2017; 4: 282-6.
37- Ara N, Nakkanong K, Lv W, Yang J, Hu Z, Zhang M. Antioxidant Enzymatic Activities and Gene Expression Associated with Heat Tolerance in the Stems and Roots of Two Cucurbit Species (“Cucurbita Maxima” and “Cucurbita Moschata”) and Their Interspecific Inbred Line “Maxchata”. Int J Mol Sci 2013; 14(12): 24008-28.
38- Dousdampanis P, Trigka K, Fourtounas C, Bargman JM. Role of Testosterone in the Pathogenesis, Progression, Prognosis and Comorbidity of Men with Chronic Kidney Disease. Ther Apher Dial 2014; 18(3): 220-30.
39- Gorzi A, Ekradi S, Rahmani A. The Effect of High Intensity Endurance Training on Antioxidant Defense and Lipid Peroxidation of Male Wistar Rats. Journal of Sport Biosciences 2018; 10(3): 333-45. [Persian]
40- Kabe Y, Ando K, Hirao S, Yoshida M, Handa H. Redox Regulation of NF-Κb Activation: Distinct Redox Regulation Between the Cytoplasm and the Nucleus. Antioxid Redox Signal 2005; 7(3-4): 395-403.
41- Sallam N, Laher I. Exercise Modulates Oxidative Stress and Inflammation in Aging and Cardiovascular Diseases. Oxid Med Cell Longev 2016; 2016: 7239639.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/3/26 | پذیرش: 1402/5/15 | انتشار: 1402/7/15
دریافت: 1402/3/26 | پذیرش: 1402/5/15 | انتشار: 1402/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







