دوره 31، شماره 5 - ( مرداد 1402 )
جلد 31 شماره 5 صفحات 6645-6632 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Heidari M M, Ebrahimi F, Shaker Ardakani Z, Mirzaei M, Mirhosseini S, Khatami M. Molecular Study of Nucleotide Changes of ATPase6 and MT-CYB Genes in the Mitochondrial Genome of Patients with Familial Adenomatous Polyposis (FAP). JSSU 2023; 31 (5) :6632-6645
URL: http://jssu.ssu.ac.ir/article-1-5909-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5909-fa.html
حیدری محمد مهدی، ابراهیمی فاطمه، شاکر اردکانی زهرا، میرزایی مهسا، میرحسینی شیما، خاتمی مهری. بررسی مولکولی تغییرات نوکلئوتیدی ژنهای ATPase6 و MT-CYB در ژنوم میتوکندری بیماران مبتلا به پولیپوز آدنوماتوز خانوادگی (FAP). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (5) :6632-6645
متن کامل [PDF 1396 kb]
(576 دریافت)
| چکیده (HTML) (1551 مشاهده)
متن کامل: (892 مشاهده)
مقدمه
پولیپوز آدنوماتوز خانوادگی (FAP) یک بیماری ژنتیکی است که با الگوی اتوزومال غالب به ارث میرسد. ظهور صدها یا هزاران پولیپ در رکتوم، کولون، دوازدهه و یا مخاط معده از نشانههای اولیه این بیماری است. FAP در اثر جهش در ژن سرکوبگر توموری APC واقع در بازوی بلند کروموزوم 5 (5q21) ایجاد میشود (1,2). اکثر جهشها در این ژن از نوع جهش بیمعنی هستند، اما ژنوتیپ و فنوتیپها با توجه به بزرگی ژن APC بسیار متفاوت است. (3). اکثر افراد مبتلا به FAP سابقه خانوادگی دارند. با این وجود، تقریباً 20 تا30 درصد از افراد مبتلا به FAP هیچ سابقه خانوادگی شناختهشدهای ندارند که این موضوع نشاندهنده بروز جهشهای جدید است (6-4). میزان بروز FAP 1 در 7000 تا 1 در 16000 مورد در متولدین زنده است و تقریباً 0/5 درصد از تمام سرطانهای روده بزرگ را شامل میشود (7). افراد مبتلا به FAP یا کسانی که سابقه خانوادگی دارند باید از حدود 10 سالگی تحت آندوسکوپی سالیانه و سیگموئیدوسکوپی انعطافپذیر یا کولونوسکوپی قرار گیرند. پس از تایید تشخیص FAP از نظر بالینی، باید آزمایش ژنتیکی انجام شود (8). چندین نوع بالینی از فنوتیپ FAP بر اساس تعداد پولیپها و سن شروع بیماری توصیف شده است، FAP تهاجمی، FAP متوسط و FAP ضعیف. از ویژگیهای FAP تهاجمی وجود صدها تا هزاران پولیپ آدنوماتوز در سراسر کولون و رکتوم است. همچنین، سرطان کولورکتالCRC) ) در این بیماران در سنین پایینتری رخ میدهد. در FAP متوسط صدها پولیپ در دهه دوم و سوم زندگی ایجاد میشود و این بیماران تقریباً در 40 سالگی مبتلا به CRC میشوند. در FAP خفیف تعداد پولیپها به ده تا صد پولیپ کاهش مییابد و برخلاف دو نوع قبل، خطر سرطان در این بیماران بسیار کم است (9,10). مطالعات اخیر نشان میدهد که علاوه بر ناهنجاریهای ژنوم هستهای، اختلالات عملکردی میتوکندری نیز از عوامل مهم سرطانزا هستند (5,11). میتوکندری در چندین فعالیت سلول از جمله تولید ATP، تولید گونههای فعال اکسیژن، تنظیم پیامرسانی سلولی، مرگ سلولی و کنترل متابولیسمهای بیوسنتزی نقش دارد. بنابراین جهشهای DNA میتوکندری و نقص در عملکرد بیولوژیک آنها در ایجاد مسیرهای تومورزایی نقش مهمی دارند. (12). بنابراین میتوان از این اندامک به عنوان یک نشانگر مولکولی قدرتمند برای تشخیص سرطان استفاده کرد. زنجیره تنفسی میتوکندری در غشاء داخلی آن قرار دارد و از چهار کمپلکس برای انتقال الکترون (کمپلکسIV–I) و کمپلکس V یا ATP سنتاز تشکیل شده است (13). ژنهای ATPase6 و MT-CYB میتوکندری پروتئینهایی را کد میکنند که به ترتیب جزء کمپلکس ATP سنتاز و کمپلکس III زنجیره تنفسی میتوکندری هستند و مطالعات متعددی بر اهمیت این ژنها در بیماری های ژنتیکی متعدد تاکید کرده اند (15,14). در این مطالعه، ما نیز به بررسی تغییرات نوکلئوتیدی احتمالی در ژنهای میتوکندریایی ATPase6 و MT-CYB در افراد مبتلا به FAP و احتمال بیماریزایی آن ها با استفاده از نرمافزارهای بیوانفورماتیکی میپردازیم.
روش بررسی
در این مطالعه برای جمعآوری نمونهها، پروندههای مراکز تخصصی مختلف از جمله بیمارستان خاتمالانبیاء تهران، بیمارستان شریعتی تهران، بیمارستان پارسیان تهران، انستیتو کنسر تهران و بیمارستان امام خمینی تهران مورد بررسی قرار گرفت و خانوادههای مبتلا به FAP انتخاب شدند. بر اساس تشخیص پزشکان متخصص و مشاوران ژنتیک، از میان این خانوادهها، 9 خانواده ایرانی دارای FAP پس از جراحی برای درمان سرطان کولورکتال (26 نفر) شامل 17 زن (با میانگین سنی 25 سال، میانگین سن در زمان تشخیص 11/6) و 9 مرد (با میانگین سنی 31 سال، میانگین سن در زمان تشخیص 15/8) جهت مطالعه جهش در ژنهای میتوکندری ATPase6 و MT-CYB انتخاب شدند و مورد بررسی قرار گرفتند. معیارهای انتخاب این خانوادهها بر اساس تشخیص بالینی استاندارد FAP معمولی/کلاسیک، وجود حداقل دو فرد خویشاوند دارای سندرم FAP در خانواده، حالت وراثت غالب آدنوما کلورکتال و وجود بیش از صد پولیپ در کولون و رکتوم بود. با این حال، بیمارانی با کمتر از صد پولیپ، اما با سابقه خانوادگی مثبت برای FAP، از نظر بالینی جزو بیماران با FAP تشخیص داده شدند. همچنین، یک گروه 30 نفره به عنوان نمونههای کنترل سالم انتخاب شدند که سابقه خانوادگی شناخته شدهای از هیچ نوع سرطان نداشتند و از همان منطقه جغرافیایی بیماران انتخاب شدند. افراد کنترل از نظر سن و جنسیت با گروه بیماران، اختلاف آماری مهم و معناداری نداشتند (5 تا 25 سال: 0/15=P و 10 مرد و 20 زن: 0/004=P). چون در مطالعه حاضر، تمام متغیرهای انتخاب گروههای بیمار و کنترل، به خوبی توزیع شده بودند، بنابراین برای یک تحلیل آماری معتبر و قابل قبول در نظر گرفته شدند. تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد. پس از تکمیل پرسشنامه و اخذ رضایتنامه از همه شرکتکنندگان در تحقیق، خونگیری (5 میلیلیتر نمونه خون محیطی) از اعضای خانوادههای مذکور انجام گرفت. برای ادامه مراحل تحقیق، ابتدا با استفاده از کیت استخراج DNA pure، طی روش استاندارد، استخراج DNA از خون بیماران انجام شد. برای بررسی جهشهای ژنوم میتوکندری، قطعهای به طول bp558 که حاوی ژن ATPase6 بود و همچنین قطعهای حاوی ژن MT-CYB به طول bp853 برای روش Touchdown PCR انتخاب شدند. با استفاده از نرم افزارهای GenRunner و Primer1 دو جفت پرایمر برای تکثیر این ژنها طراحی شد و توسط شرکت پیشگام ساخته شد. با استفاده از برنامه BLAST در سایت http://www.ncbi.nlm.nih.gov/blast توالی پرایمرها از نظر همولوژی با کل ژنوم انسان همردیف شدند. توالی جفت پرایمرها و موقعیتهای آنها بر روی ژنوم میتوکندری در جدول 1 آمده است.
جدول 1: توالی و موقعیت پرایمرها
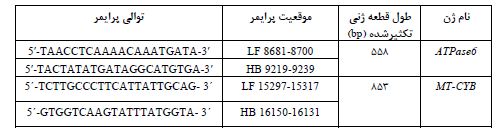
برای انجام روش Touchdown PCR واکنشهای PCR در حجمهای نهایی 25 میکرولیتری شامل 10 میکرولیتر مخلوط بهینه PCR (Master Mix-Amplicon-Pishgam که شامل Buffer 1X، 200 میکرولیتر از هر یک از dNTP ها، 1/5-1 واحد آنزیم Taq DNA polymerase، 4-1 میلیمولار MgCl2)، 2 میکرولیتر از هر پرایمر (Forward و Reverse)، 5 میکرولیتر DNA الگو و 6 میکرولیتر آب دیونیزه استریل آماده شد و با کمک دستگاه PCR (شرکت یکتا تجهیز آزما) واکنش تکثیر قطعات DNA میتوکندری انجام گرفت. برنامه زمانی و دمایی واکنش Touchdown PCR به این صورت انجام گرفت: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد به مدت 3 دقیقه و بهدنبال آن 35 سیکل دمایی متشکل از دمای دناتوراسیون 95 درجه سانتیگراد به مدت 30 ثانیه، دمای اتصال از درجه حرارت 53 تا 62 درجه سانتیگراد (به صورت کاهشی 0/5 درجه سانتیگراد به ازای هر سیکل) و مرحله گسترش به مدت یک دقیقه در درجه حرارت 72 درجه سانتیگراد و مرحله گسترش نهایی به مدت پنج دقیقه در درجه حرارت 72 درجه سانتیگراد صورت گرفت. در نهایت برای اطمینان از تکثیر قطعات مورد نظر، 5 میکرولیتر از محصولات PCR روی ژل آگاروز 1/5 درصد حاوی اتیدیوم بروماید، بارگذاری و الکتروفورز شد. ژل آگارز به مدت 30 دقیقه و با ولتاژ 100 ولت الکتروفورز گردید و پس از آن با استفاده از دستگاه Gel Doc نمونهها مشاهده شد و تصویربرداری از آنها صورت گرفت. برای شناسایی تغییرات نوکلئوتیدی در ژنهای میتوکندری، نمونههای بیماران و اعضای خانواده آنها، جهت تعیین توالی مستقیم به شرکتهای پیشگام و نورژن (تهران) ارسال گردید. نتایج تعیین توالیها با نرمافزار MEGA5 و برنامه کروماس (chromas) بررسی شدند و با توالی مرجع کمبریج (CRS)، MITOMAP و توالی ثبت شده در سایت NCBI همتراز شدند. همردیفی با ژنوم میتوکندری سایر گونهها نیز از طریق پایگاه BLAST انجام شد. برای شناسایی جهشهای یافت شده در این تحقیق و تعیین پاتوژن بودن و یا جدید بودن آنها از نرم افزارها و پایگاههای بیوانفورماتیکی متعددی شامل SIFT، I-Mutant، PSIPRED، ExPASy، PolyPhen-2، PROVEAN، PredictSNP و PyMol استفاده گردید. پایگاه اینترنتی SIFT (http://sift.jcvi.org) تاثیر احتمالی جهش بر ساختار و عملکرد پروتئین را پیشبینی میکند. این پایگاه نتیجه را بهصورت عددی نمایش میدهد که تفسیر آن بدین شرح است: امتیاز کمتر از 0/05 بدین معنی است که جهش تاثیر چشمگیری بر ساختار و عملکرد پروتئین داشته و احتمال پاتوژن بودن آن زیاد است و در مقابل امتیاز بیشتر از 0/05 به معنی این است که جهش تاثیر قابل توجهی نداشته و احتمالاً پاتوژن نیست. پایگاه اینترنتی I-Mutant (http:// gpcr2.biocomp.unibo.it/cgi/predictors/I-Mutant3.0) به بررسی و پیشبینی تغییرات پایداری پروتئین و تاثیر جهش تک نوکلئوتیدی بر ساختار پروتئین میپردازد. امتیاز خروجی I-Mutant مقدار تغییر انرژی آزاد یا DDG است. امتیاز کمتر از صفر کاهش پایداری و امتیاز بیشتر از صفر افزایش پایداری را نشان میدهد. همچنین از پایگاه اینترنتی PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred) برای بررسی ساختار پروتئینها استفاده میشود که بر اساس ساختار اولیه پروتئین، ساختار ثانویه آن پیشبینی میگردد. پایگاه اینترنتی ExPASy (http://web.expasy.org/protocol) طیف گستردهای از منابع اطلاعاتی در زمینههای پروتئومیکس، ژنومیکس، فیلوژنتیک/ تکامل، ژنتیک جمعیت و ترانسکریپتومیکس را در اختیار میگذارد. برای بررسی تغییرات هیدروفوبیسیته پروتئینهای جهشیافته از این پایگاه استفاده شد. پایگاه اینترنتی PolyPhen-2 (http://genetics.bwh.harvard.edu/pph2) نیز ابزاری است که تاثیر احتمالی جایگزینی اسیدهای آمینه بر ساختار و عملکرد پروتئین را پیشبینی میکند. پایگاه اینترنتی PROVEAN (http://provean.jcvi.org) تاثیر جابهجایی اسیدآمینه یا جایگزینی اسیدآمینه بر روی فعالیت بیولوژیکی پروتئین را پیشبینی میکند که برای شناسایی تأثیرات احتمالی جهشهای غیر هممعنی و اهمیت آنها بر فعالیت پروتئینی بسیار پرکاربرد میباشد. جهشها با امتیازکمتر از 2/5- زیانآور و امتیاز بیشتر از 2/5- خنثی هستند. پایگاه اینترنتی PredictSNP (https:// loschmidt.chemi.muni.cz/ predictsnp) نیز به بررسی تاثیر جهشها بر ساختار پروتئین میپردازد. نتایج حاصل از این سایت شامل بررسیهای چندین پایگاه مختلف (PredictSNP،MAPP ،PhD-SNP ،polyphen-1 ،polyphen-2 ،SIFT ، SNAP) است که بر اساس درصد و رنگ مشخص میشود که رنگ سبز به معنی جهش خنثی و رنگ قرمز به معنی جهش زیانآور میباشد. نرمافزار PyMol نیز برای نمایش ساختار فضایی ماکرومولکولهایی مانند پروتئینها به کار میرود. از کاربردهای این نرمافزار، تعیین تعداد و طول پیوندهای هیدروژنی بین اسید آمینههای پروتئین و مشاهده تغییرات ساختار پروتئین میباشد.
تجزیه و تحلیل آماری
در این مطالعه برای بررسیهای آماری و تعیین ارتباط یا تفاوت معنادار تغییرات نوکلئوتیدی با بیماری FAP در دو گروه کنترل و بیمار، از آزمون آماری فیشر (Fisher’s exact) و نرمافزار آماری SPSS version 16 استفاده شد. محاسبات با استفاده از نرمافزار GraphPad انجام شد و سطح معنیداری کمتر از 0/05 (P<0.05) از نظر آماری مهم در نظر گرفته شد. ملاحظات اخلاقی
پروپوزال این مطالعه توسط کمیته اخلاق دانشگاه یزد مورد تایید قرار گرفت (IR.YAZD.REC.1401.053) و تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد.
نتایج
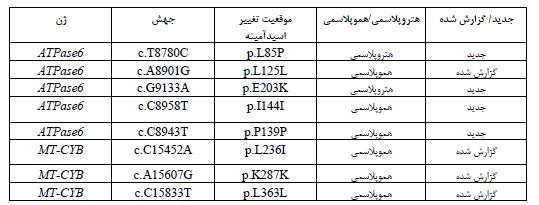
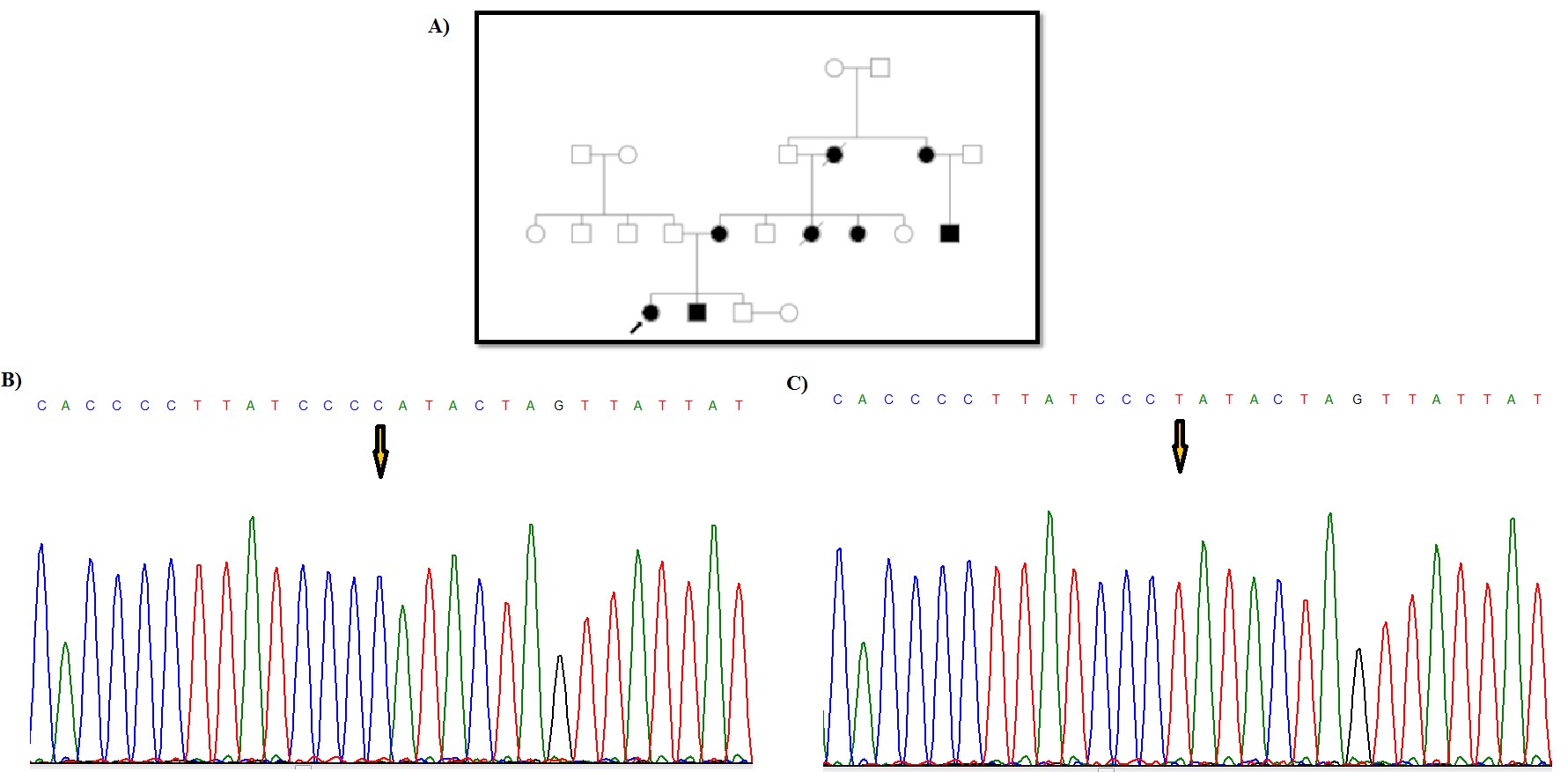
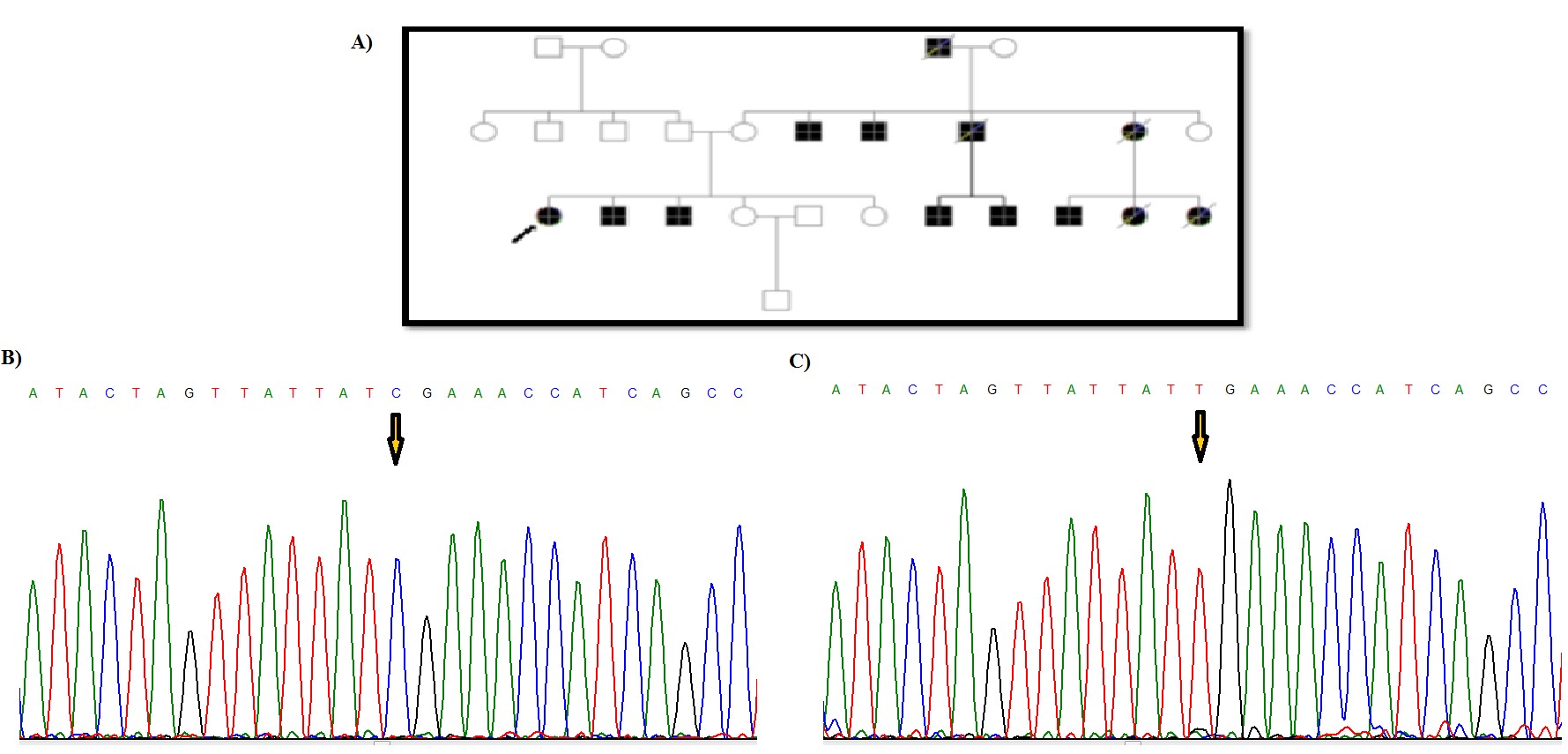
مطالعه بر روی 26 فرد مبتلا به FAP انجام شد و نتایج بررسی های مولکولی با استفاده از روشهایTouchdown PCR و تعیین توالی ژنومی، مشخص کننده 5 جهش و تغییر نوکلئوتیدی در ژن میتوکندریایی ATPase6 و 3 جهش و تغییر ژنی در MT-CYB بود (جدول 2). جهش هتروپلاسمی و تغییر اسید آمینهc.T8780C; p.L85P در ژن ATPase6 در یک بیمار زن 21 ساله مشاهده شد. فرد مبتلا در زمان مراجعه به پزشک، علائمی از بیماری نداشت و پس از تشخیص بیماری برادرش، با صلاحدید پزشک تحت کولونوسکوپی قرارگرفت که بیماری FAP برای این فرد نیز تشخیص داده شد (شکل 1). خواهر بیمار مشکلاتی از قبیل اسهال خونی و دردهای شکمی داشته که پزشک پس از معاینه تشخیص FAP داده و تحت عمل جراحی قرار گرفته بود. سپس او در اثر سرطان کولون فوت کرد. قابل ذکر است که دختر خاله فرد پروباند بر اثر سرطان روده فوت کرده و مادر بیمار نیز بر اثر سرطان کبد فوت کرده است. شجره این خانواده در شکل 1 نشان داده شده است. دو جهش هموپلاسمی در ژن MT-CYB در یک دختر بیمار 18 ساله مشاهده شد، یک تغییر نوکلئوتیدی هم معنی (p.K287K) c.A15607Gو یک جهش تغییر اسید آمینه (p.Leu236Ile) c.C15452A که در شکل 2 نشان داده شده است. فرد مبتلا به دلیل مشکل خونریزی رکتوم حدود 10 سال پیش به پزشک مراجعه کرده و پس از انجام کولونوسکوپی تشخیص FAP داده شد. طی دو جراحی روده بزرگ بطور کامل و قسمتی از روده کوچک بیمار برداشته شد. دو خواهر و برادر بیمار نیز درای FAP بوده و تحت عمل جراحی قرار گرفتند. شجره این خانواده در شکل2 نشان داده شده است. در خانواده بعدی، پروباند خانمی 31 ساله بود که با علائمی مثل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده و پس از کولونوسکوپی تشخیص FAP داده شد. بیمار تا کنون دو بار عمل جراحی شده و در نهایت کولکتومی شده بود. پدربزرگ مادری، علائمی از FAP نداشته و کولونوسکوپی نیز نشده بود. در نسل های قبل نیز موردی از FAP گزارش نشده بود. جهش هموپلاسمی p.L125L در ژن ATPase6 و جهش هموپلاسمی p.L363L در ژن MT-CYB در یک بیمار 14 ساله مشاهده شد. این فرد با علائمی مثل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده بود که پس از کولونوسکوپی FAP برای وی تشخیص داده شد (شکل 3). در خانواده دیگر، فرد مبتلا مردی بود 19 ساله که با علائمی نظیر دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرد. پس از انجام کولونوسکوپی برای وی تشخیص FAP داده شده و دو بار تحت عمل جراحی قرارگرفته و سپس کولکتومی شده بود. خواهر او در سن 18 سالگی بهدلیل مدفوع خونی به پزشک مراجعه کرده بود که تشخیص FAP دادهشده بود و دو سوم روده وی به علت بیماری برداشتهشده بود. مادر پروباند نیز در اثر بیماری FAP و در نهایت سرطان کولون، فوت کرده بود. جهش هتروپلاسمی و منجر به تغییر اسید آمینه (p.E203K) در ژن ATPase6 در این بیمار مشاهده شد (شکل 4). پروباند بعدی، دختری 20 ساله بود که پس از تشخیص بیماری FAP تحت عمل جراحی رزوکتومی قرارگرفت. مادر وی به دلیل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده بود که پس از کولونوسکوپی تشخیص FAP دادهشد و تحت عمل جراحی قرارگرفت. جهش هموپلاسمی (p.P139P) c.C8943Tدر ژن ATPase6 در این دختر بیمار مشاهده شد. این جهش از نوع هممعنی است (شکل 5). جهش هموپلاسمی (p.I144I) c.C8958T در ژن ATPase6 در پروباند دختری حدوداً 11 ساله مشاهده شد که با علائم خونریزی از رکتوم به پزشک مراجعه کرده و کولونوسکوپی از وی انجامشد و پولیپ خوشخیم مشاهده گردید. سپس با انجام کولونوسکوپی مجدد تودهای در رکتوم مشاهده شد که پس از بیوپسی آن را بدخیم تشخیص دادند و بیمار تحت عمل جراحی قرار گرفت. دو برادر بیمار نیز علائمی مشابه با خواهرشان داشتند که قسمتی از روده بزرگ آنها برداشته شد. قابل توجه است که مادر 58 ساله این خانواده با وجود داشتن فرزندانی با علائم FAP، هیچگونه علائمی از این بیماری نداشته و تا آن زمان کولونوسکوپی هم نشده بود (شکل 6).
جدول 2: نتایج تغییرات نوکلئوتیدی و جهشهای مشاهده شده ژنوم میتوکندری در بیماران مبتلا به FAP
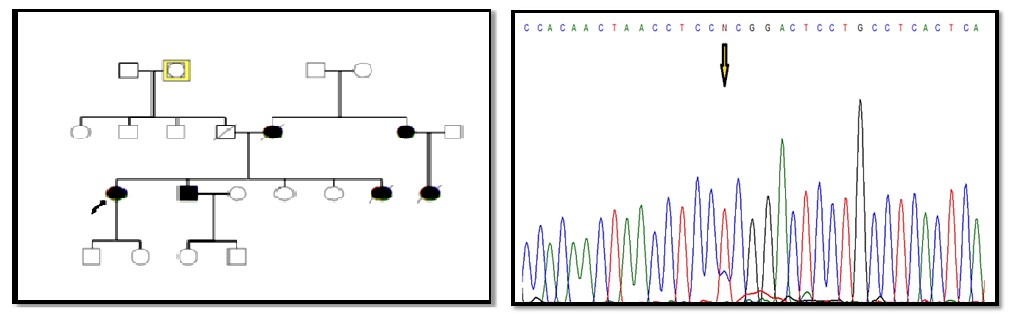
شکل 1: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هتروپلاسمی با تغییر اسید آمینه p.L85P
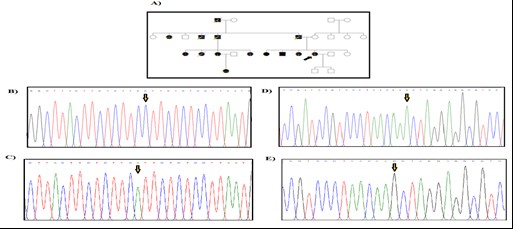
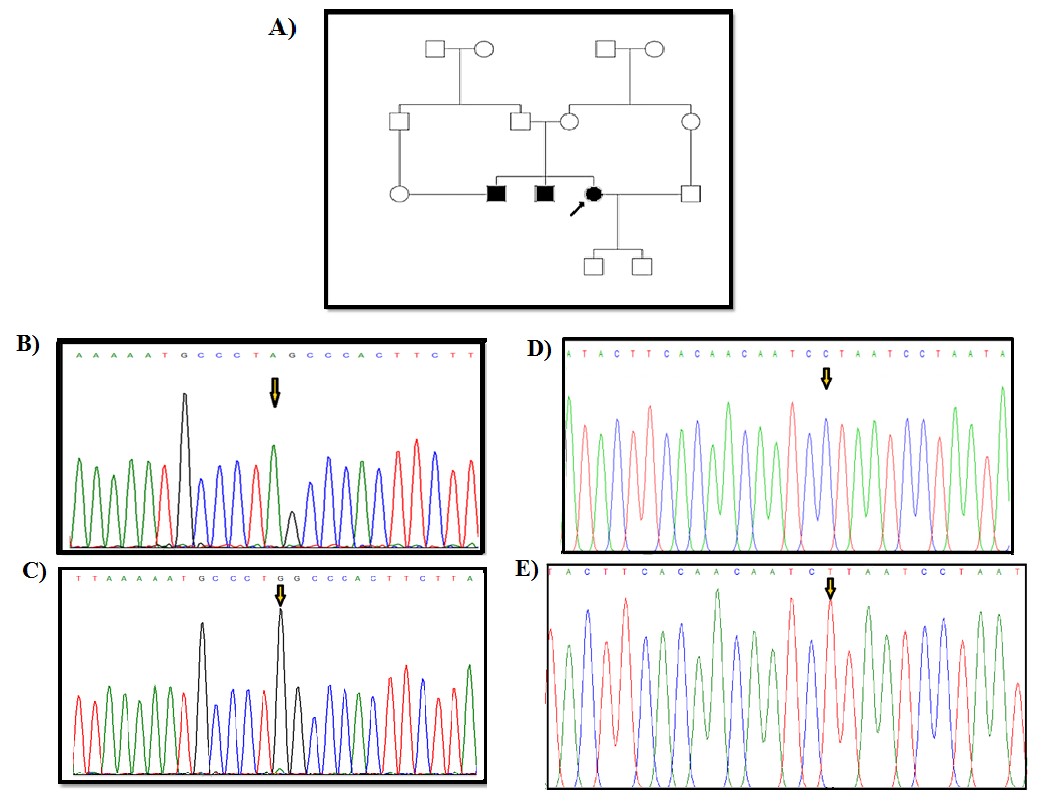
شکل 2: A) شجره خانوادگی پروباند بیمار، B) تعیین توالی ژن MT-CYB در فرد کنترل، C) جهش هموپلاسمی c.C15452A که منجر به تغییر اسید آمینه Leu236Ile در بیمار می شود، D) تعیین توالی ژن MT-CYB در فرد کنترل، E) جهش هموپلاسمی c.A15607G که یک جهش هممعنی است و منجر به تغییر اسید آمینه در بیمار نمیشود K287K.
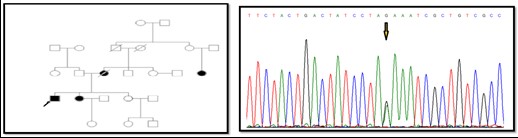
شکل 3: A) شجره خانوادگی پروباند بیمار، B) تعیین توالی ژن ATPase6 در فرد کنترل، C) جهش هموپلاسمی c.A8901G که منجر به تغییر اسید آمینه در بیمار نمی شود L125L، D) تعیین توالی ژن MT-CYB در فرد کنترل، E) جهش هموپلاسمی c.C15833T که یک جهش هممعنی است و منجر به تغییر اسید آمینه در بیمار نمی شود p.L363L.
شکل 4: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هتروپلاسمی با تغییر اسید آمینه p.E203K
شکل 5: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هموپلاسمی c.C8943T بدون تغییر اسید آمینه p.P139P
شکل 6: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هموپلاسمی c.C8958T بدون تغییر اسید آمینه p.I144I
از میان جهشهای مشاهده شده در این مطالعه، سه جهش p.L85P، p.E203K و p.L236I غیر هممعنی هستند که منجر به تغییر اسید آمینه در پروتئین های ATPase6 و MT-CYB میشوند و احتمالاً میتوانند در ساختار پروتئین تغییر ایجاد کنند. از این رو، جهشهای غیر هممعنی با استفاده از پایگاهها و نرم افزارهای بیوانفورماتیکی مورد تجزیه و تحلیل قرار گرفتند که نتایج آن به شرح زیر است:
طبق پیشبینی پایگاه اینترنتی PSIPRED هر سه جهش در ناحیه آلفا هلیکس پروتئین های ATPase6 و MT-CYB رخ دادهاند. پایگاه اینترنتی SIFT با امتیاز صفر برای دو جهش p.L85P و p.E203K در پروتئین ATPase6، پیشبینی میکند که این دو جهش تاثیر چشمگیری بر ساختار پروتئین داشته و احتمالاً پاتوژن هستند. این پایگاه با محاسبه امتیاز 1 برای جهش p.L236I در پروتئین MT-CYB نشان میدهد احتمالاً این جهش پاتوژن نیست. پایگاه اینترنتی PolyPhen-2 با امتیاز 0/999 برای جهش p.L85P و امتیاز 0/9994برای جهش p.E203K در پروتئین ATPase6 پیشبینی میکند که هر دو جهش با احتمال بالا بدخیم هستند؛ اما امتیاز 0/029 برای جهش p.L236I در پروتئین MT-CYB، خوشخیم بودن این جهش را پیشبینی میکند. پایگاه اینترنتی ExPASy برای هر دو جهش p.L85P و p.E203K کاهش هیدروفوبیسیته را در حالت موتانت نسبت به پروتئین نرمال پیشبینی میکند. در جهش p.L85P، درجه هیدروفوبیسیتی طبق امتیاز کیت/دولیتل (Kyte/Doolittle) از 3/800 برای اسید آمینه شدیداً هیدروفوب لوسین به 1/600- برای اسید آمینه هیدروفیل پرولین تغییر کرده است. در جهش p.E203K، درجه هیدروفوبیسیتی از 3/500- برای اسید آمینه هیدروفیل اسیدگلوتامیک به 3/900- برای اسید آمینه هیدروفیل لیزین تغییر کرده است. با این حال، این پایگاه برای جهش p.L236I در پروتئین MT-CYB، افزایش هیدروفوبیسیته را پیشبینی میکند، بگونهای که این جهش، درجه هیدروفوبیسیتی را از 3/800 برای اسید آمینه شدیداً هیدروفوب لوسین به 4/500 برای اسید آمینه هیدروفوب ایزولوسین تغییر داده است.بر اساس پایگاه اینترنتی I-Mutant در دمای 25 درجه سانتیگراد و 7 = pH جهش p.L85P با ایندکس 1/83-DDG= کاهش قابل توجه پایداری و جهشهای p.E203K و p.L236I به ترتیب با 0/71 DDG= و 0/58 DDG= افزایش پایداری پروتئین را به دنبال دارند. پایگاه اینترنتی PredictSNP نیز پیشبینی میکند که جهش p.L85P، به احتمال 76 درصد و جهش p.E203K، به احتمال 87 درصد، بر ساختار پروتئین اثر گذاشته و بنابراین جهشهایی زیانآوری هستند. همچنین این پایگاه جهش p.L236I را با احتمال 83 درصد به عنوان جهش خنثی پیشبینی کرد. پایگاه اینترنتی PROVEAN نیز با امتیاز 6/467- برای جهش p.L85P و امتیاز 3/548- برای جهش p.E203K، پیش بینی کرد که این دو جهش بر فعالیت پروتئین اثر گذاشته و بنابراین، آنها را به عنوان جهشهای زیانآور معرفی میکند. همچنین در این مطالعه با استفاده از نرمافزار PyMol، ساختار سه بعدی هر دو پروتئین ATPase6 و Cytb بررسی شد و تعداد و طول پیوندهای هیدروژنی مربوط به اسید آمینهها، قبل و بعد از جهش ارزیابی شد. ابتدا از سرور SWISS-MODEL برای مدلسازی ساختار سهبعدی پروتئینهای ATPase6 و سیتوکروم b استفاده شد. در جهش جدید و هتروپلاسمی p.L85P که مربوط به پروتئین ATPase6 است، اسیدآمینه پرولین در موقعیت 85، در حالت موتانت، با اسیدآمینههای لوسین در موقعیت 88 و سرین در موقعیت 91 تشکیل پیوندهای هیدوژنی میدهد که طول این پیوندها به ترتیب 3 و 2/6 آنگستروم است. در پروتئین نرمال ATPase6 در موقعیت 85 اسیدآمینه لوسین قرار دارد که با اسیدآمینههای ترئونین در موقعیت 81، لوسین در موقعیت 88 و سرین در موقعیت 91 پیوند هیدروژنی تشکیل میدهد که طول این پیوندها بهترتیب 3، 3/2 و 2/7 آنگستروم است (شکل7). در جهش p.E203K که مربوط به پروتئین ATPase6 میباشد، در فرم جهشیافته، اسیدآمینه لیزین در موقعیت 203 با اسیدآمینههای گلایسین در موقعیت 167، لوسین در موقعیت 199 و آلانین در موقعیت 207 تشکیل پیوند هیدوژنی میدهد که طول این پیوندها به ترتیب 3/3، 2/7 و 3/1 آنگستروم است. در پروتئین نرمال ATPase6 ، در موقعیت 203 اسیدگلوتامیک قرار دارد که با اسیدآمینههای لوسین در موقعیت 199و آلانین در موقعیت 207 پیوند هیدروژنی تشکیل میدهد. طول این پیوندها به ترتیب 3/1 و 2/7 آنگستروم است (شکل 8).
جهش p.L236I مربوط به پروتئین سیتوکروم b است. این جهش باعث تغییر در تعداد و طول پیوند هیدروژنی نشده است. در موقعیت 236 هر دو اسیدآمینه نرمال و جهشیافته با اسیدآمینههای لوسین در موقعیت 232 و متیونین در موقعیت 240 با پیوند هیدروژنی اتصال برقرار میکنند که طول این پیوندها به ترتیب 2/9 و 2/8 آنگستروم است (شکل 9).
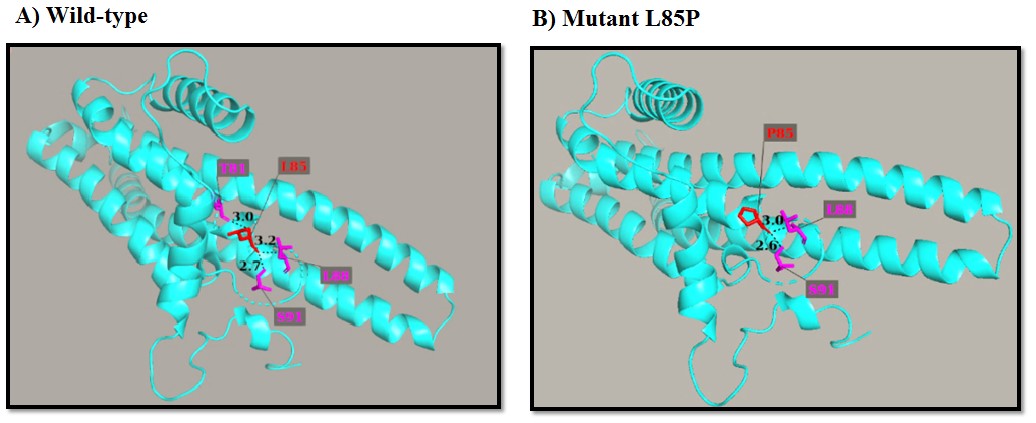
شکل 7: نتایج حاصل از نرمافزار PyMol برای جهش L85P در پروتئین ATPase6 و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها
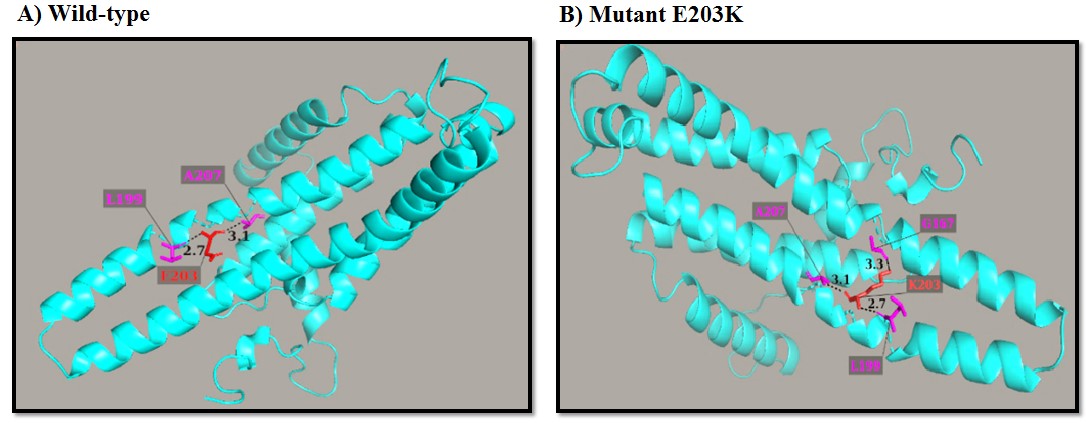
شکل 8: نتایج حاصل از نرمافزار PyMol برای جهش E203K در پروتئین ATPase6 و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها
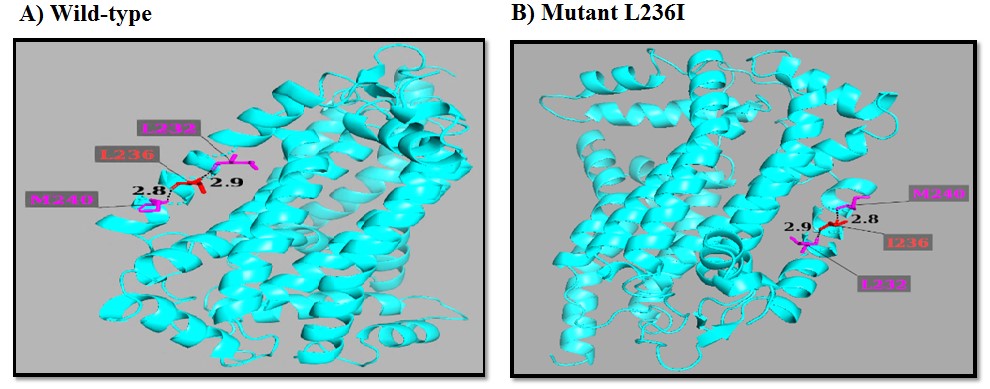
شکل 9: نتایج حاصل از نرمافزار PyMol برای جهش L236I در پروتئین سیتوکروم b و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها
بحث
پولیپوز آدنوماتوز خانوادگی یک بیماری اتوزومال غالب است که در 70 تا 90 درصد از موارد، جهش در ژن APC مسبب آن است (7). این بیماری یک اختلال نادر است که با وجود صدها و یا گاهی هزاران پولیپ در روده بزرگ شناخته میشود و تقریباً 5/0 درصد از تمام سرطانهای روده بزرگ را شامل میشود (16). مطالعات اخیر نشان داده است که علاوه بر ناهنجاریهای ژنوم هستهای، اختلالات عملکردی ژنوم میتوکندری نیز از عوامل مهم ابتلا به سرطان هستند. تغییرات ژنوم میتوکندری میتواند منجر به اختلالاتی از قبیل استرس اکسیداتیو، افزایش تجمع کلسیم سیتوزولی و گونههای فعال اکسیژن، کاهش سطح ATPو نیز عدم تعادل نسبت NADH/NAD+ گردد. تغییر در هریک از این عوامل میتواند بر مسیرهای پیامرسانی سلولی، عوامل رونویسی و ساختار کروماتین تاثیر بگذارد. همچنین استرس اکسیداتیو ناشی از گونههای فعال اکسیژن ممکن است بیان ژنهای هستهای درگیر در تومورزایی را تحت تاثیر قرار داده و در ایجاد و یا گسترش انواع سرطان نقش داشته باشد (11). در مطالعه حاضر، غربالگری دو ژن میتوکندریایی ATPase6 و MT-CYB در 26 بیمار خانوادگی مبتلا به FAP انجام شد. نتایج تحقیق ما، حضور هشت تغییر نوکلئوتیدی را در این دو ژن نشان داد، پنج جهش در ژن ATPase6 (3 واریانت هموپلاسمی هممعنی و بدون تغییر اسید آمینه و 2 جهش هتروپلاسمی بدمعنی و جدید: L85P و E203K) و سه جهش هموپلاسمی در ژن MT-CYB میتوکندری، شامل دو واریانت هممعنی و بدون تغییر اسید آمینه و 1 جهش بدمعنی: L236I، که در بیماران متعلق به 9 خانواده مبتلا به FAP یافت شد. کمپلکس III زنجیره تنفسی که به آن یوبی کوئینول سیتوکروم C ردوکتاز نیز گفته میشود، در غشای داخلی میتوکندری قرار گرفته است و دارای زیرواحدهای سیتوکروم b، سیتوکروم c1 و پروتئین واجد آهن و گوگرد است. این کمپلکس باعث اکسیداسیون یوبی کوئین احیاشده و انتقال الکترون به سیتوکروم c1 میشود. به ازای هر دو الکترون چهار پروتون توسط این کمپلکس به فضای بین غشاء میتوکندری پمپ میشود. سیتوکروم c مسئول انتقال الکترون بین کمپلکس سوم و چهارم است (17). تنها زیر واحد کمپلکس III که توسط ژنوم میتوکندری رمزگذاری میشود، سیتوکروم b است. در ژن سیتوکروم b، که مطالعه ما بر روی آن صورت گرفته است، دو نفر دارای جهش هم معنی p.K287K و یک نفر دارای جهش هم معنی p.L363L میباشند که تغییری در ساختار پروتئین نیز ایجاد نمیکنند. تنها جهش missense مشاهده شده در این ژنp.Leu236Ile میباشد که در دو نفر بیمار مشاهده شد. این تغییر اسیدآمینه در ناحیه عرض غشایی پروتئین میباشد که قبلاً در بیماریهایی نظیر نوروپاتی اپتیکی ارثی و پارکینسون نیز گزارش شده است (18). البته بر اساس سایت NCBI این جهش تغییر اسید آمینه پاتوژن نمیباشد و نتایج آنالیزهای بیوانفورماتیکی انجام شده در مطالعه حاضر نیز (SIFT و PolyPhen-2 ، PredictSNP، PROVEAN) نیز همین موضوع را ثابت میکند و تغییر اسیدآمینه مزبور به عنوان تغییری خنثی پیش بینی میشود. ژنهای مربوط به کمپلکس V میتوکندریایی (کمپلکس ATP سنتتاز) نیز نقش مهمی در تولید ATP دارند.کمپلکس ATP سنتتاز دارای دو دومین عملکردی است. بخش F0 که درون غشا داخلی قرار دارد و کانال انتقال پروتون است و بخش دیگر به نام F1 که از غشاء داخلی بهطرف ماتریکس کشیده شده است. این کمپلکس از انرژی تولیدشده توسط شیب الکتروشیمیایی پروتون، ADP را فسفریله کرده و ATP تولید می کند. ژن مورد تحقیق ما، ATPase6 از جمله ژنهایی است که پروتئین آن در کمپلکس V وجود دارد (19). برخی از شواهد نشان-دهنده جهش¬های متنوع کمپلکس V ژنوم میتوکندری در سرطانهای گوناگون از جمله سرطان کولون و پروستات است (20,21). در یک تحقیق نیز نشان داده شده است که جهشهای ژنهای ATPase باعث افزایش تولید گونههای فعال اکسیژن و افزایش اندازه تومور شده است (22). همانطور که در گفته شد، ما در ژن Mt-ATPase6 پنج جهش مشاهده کردیم که سه تغییر به صورت هممعنی (L125L، I144I وP139P) بودند که هیچ تغییری در ساختار و عملکرد پروتئین ایجاد نمیکردند. دو جهش غیر هممعنی بهصورت هتروپلاسمی، با تغییر اسید آمینه شامل L85P وE203K نیز مشاهده گردید که نتایج حاصل از آنالیزهای متعدد بیوانفورماتیکی ما نشان داد که هر دو جهش بر عملکرد و ساختار پروتئین تأثیرگذار هستند و به عنوان جهشهایی بدخیم و بیماریزا معرفی شدند بهصورتی که هر دو با درصد بالایی به عنوان جهشهایی زیانآور پیش بینی شدند. هر دوی این جهشها در ناحیه آلفا هلیکس پروتئین اتفاق افتادهاند. همچنین، تجزیه و تحلیل ساختار سه بعدی پروتئین نیز نشان داد که جهشهای بدمعنی L85P وE203K که در اینجا معرفی شدهاند، میتوانند بر ساختار سه بعدی پروتئین تأثیر بگذارند. مدلسازی ساختاری این دو جهش جدید میتواند تأیید کند که جهشها در ناحیه گذرنده و C ترمینال پروتئین، روی ترکیب فضایی و شکل مناطق مهم مربوط به انتقال الکترون تأثیر میگذارند و احتمالاً به ساختار پروتئین آسیب میرسانند و احتمالاً میتوانند فعالیت کمپلکس فسفوریلاسیون اکسیداتیو V را کاهش دهند و بدین ترتیب باعث اختلال عملکرد میتوکندری میشوند. از جهشهای مشاهده شده در ژن ATPase6، فقط جهش L125L قبلاً در بیماری کلیوی توبولینوسیتی نیز گزارششده بود (23)، ولی بقیه جهشهای یافت شده در این ژن جدید هستند و تاکنون در هیچ بیماری یا سرطانی گزارش نشدهاند. بر اساس نقش حیاتی ذکر شده برای هر یک از کمپلکسهای زنجیره تنفسی و زیرواحدهای آن واضح است که نقص در ساختار آنها میتواند بر عملکرد زنجیره انتقال الکترون و افزایش تولید گونه¬های فعال اکسیژن اثر گذاشته که به نوبه خود میتواند موجب افزایش جهش¬های انکوژنیک یا افزایش تکثیر سلولی شود. تاکنون مطالعات ژنتیکی زیادی در ایران بر روی بیماری FAP صورت نگرفته است. موارد اندکی از تحقیقات انجام شده نیز اکثرا بر روی ژنوم هسته¬ای متمرکز شده است. بنابراین تحقیق صورت گرفته می-تواند به شناخت بیشتر بیماری و بررسی تاثیر تغییرات ژنوم میتوکندری بر روی گسترش سرطان کمک کند.
نتیجهگیری
ارتباط بین جهشهای میتوکندری و بیماری FAP میتواند در تشخیص زود هنگام و درمان این بیماری مؤثر باشد. در این مطالعه ژنهای ATPase6 و MT-CYB در 26 فرد مبتلا به FAP بررسی شدند که بهترتیب 5 و 3 جهش و تغییر نوکلئوتیدی در بیماران مبتلا مشاهده گردید. با توجه به اینکه جهش و یا نقص در عملکرد میتوکندی در مسیر تومورزایی نقش دارد، کشف جهشهای جدید میتواند در تشخیص زودهنگام سرطان مؤثر باشد.
سپاسگزاری
نویسندگان مقاله از حمایتهای دانشگاه یزد در انجام این پژوهش تشکر و قدرانی میکنند. از بیمارستان خاتمالانبیا تهران، بیمارستان شریعتی تهران، بیمارستان پارسیان تهران، انستیتو کنسر تهران و بیمارستان امامخمینی تهران که بیمـاران را جهـت ایـن مطالعـه ارجـاع دادهانـد تـشکر و قـدردانی مـیشـود. همچنین از همکاری ارزشمند تمام بیماران سپاسگزاریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
پولیپوز آدنوماتوز خانوادگی (FAP) یک بیماری ژنتیکی است که با الگوی اتوزومال غالب به ارث میرسد. ظهور صدها یا هزاران پولیپ در رکتوم، کولون، دوازدهه و یا مخاط معده از نشانههای اولیه این بیماری است. FAP در اثر جهش در ژن سرکوبگر توموری APC واقع در بازوی بلند کروموزوم 5 (5q21) ایجاد میشود (1,2). اکثر جهشها در این ژن از نوع جهش بیمعنی هستند، اما ژنوتیپ و فنوتیپها با توجه به بزرگی ژن APC بسیار متفاوت است. (3). اکثر افراد مبتلا به FAP سابقه خانوادگی دارند. با این وجود، تقریباً 20 تا30 درصد از افراد مبتلا به FAP هیچ سابقه خانوادگی شناختهشدهای ندارند که این موضوع نشاندهنده بروز جهشهای جدید است (6-4). میزان بروز FAP 1 در 7000 تا 1 در 16000 مورد در متولدین زنده است و تقریباً 0/5 درصد از تمام سرطانهای روده بزرگ را شامل میشود (7). افراد مبتلا به FAP یا کسانی که سابقه خانوادگی دارند باید از حدود 10 سالگی تحت آندوسکوپی سالیانه و سیگموئیدوسکوپی انعطافپذیر یا کولونوسکوپی قرار گیرند. پس از تایید تشخیص FAP از نظر بالینی، باید آزمایش ژنتیکی انجام شود (8). چندین نوع بالینی از فنوتیپ FAP بر اساس تعداد پولیپها و سن شروع بیماری توصیف شده است، FAP تهاجمی، FAP متوسط و FAP ضعیف. از ویژگیهای FAP تهاجمی وجود صدها تا هزاران پولیپ آدنوماتوز در سراسر کولون و رکتوم است. همچنین، سرطان کولورکتالCRC) ) در این بیماران در سنین پایینتری رخ میدهد. در FAP متوسط صدها پولیپ در دهه دوم و سوم زندگی ایجاد میشود و این بیماران تقریباً در 40 سالگی مبتلا به CRC میشوند. در FAP خفیف تعداد پولیپها به ده تا صد پولیپ کاهش مییابد و برخلاف دو نوع قبل، خطر سرطان در این بیماران بسیار کم است (9,10). مطالعات اخیر نشان میدهد که علاوه بر ناهنجاریهای ژنوم هستهای، اختلالات عملکردی میتوکندری نیز از عوامل مهم سرطانزا هستند (5,11). میتوکندری در چندین فعالیت سلول از جمله تولید ATP، تولید گونههای فعال اکسیژن، تنظیم پیامرسانی سلولی، مرگ سلولی و کنترل متابولیسمهای بیوسنتزی نقش دارد. بنابراین جهشهای DNA میتوکندری و نقص در عملکرد بیولوژیک آنها در ایجاد مسیرهای تومورزایی نقش مهمی دارند. (12). بنابراین میتوان از این اندامک به عنوان یک نشانگر مولکولی قدرتمند برای تشخیص سرطان استفاده کرد. زنجیره تنفسی میتوکندری در غشاء داخلی آن قرار دارد و از چهار کمپلکس برای انتقال الکترون (کمپلکسIV–I) و کمپلکس V یا ATP سنتاز تشکیل شده است (13). ژنهای ATPase6 و MT-CYB میتوکندری پروتئینهایی را کد میکنند که به ترتیب جزء کمپلکس ATP سنتاز و کمپلکس III زنجیره تنفسی میتوکندری هستند و مطالعات متعددی بر اهمیت این ژنها در بیماری های ژنتیکی متعدد تاکید کرده اند (15,14). در این مطالعه، ما نیز به بررسی تغییرات نوکلئوتیدی احتمالی در ژنهای میتوکندریایی ATPase6 و MT-CYB در افراد مبتلا به FAP و احتمال بیماریزایی آن ها با استفاده از نرمافزارهای بیوانفورماتیکی میپردازیم.
روش بررسی
در این مطالعه برای جمعآوری نمونهها، پروندههای مراکز تخصصی مختلف از جمله بیمارستان خاتمالانبیاء تهران، بیمارستان شریعتی تهران، بیمارستان پارسیان تهران، انستیتو کنسر تهران و بیمارستان امام خمینی تهران مورد بررسی قرار گرفت و خانوادههای مبتلا به FAP انتخاب شدند. بر اساس تشخیص پزشکان متخصص و مشاوران ژنتیک، از میان این خانوادهها، 9 خانواده ایرانی دارای FAP پس از جراحی برای درمان سرطان کولورکتال (26 نفر) شامل 17 زن (با میانگین سنی 25 سال، میانگین سن در زمان تشخیص 11/6) و 9 مرد (با میانگین سنی 31 سال، میانگین سن در زمان تشخیص 15/8) جهت مطالعه جهش در ژنهای میتوکندری ATPase6 و MT-CYB انتخاب شدند و مورد بررسی قرار گرفتند. معیارهای انتخاب این خانوادهها بر اساس تشخیص بالینی استاندارد FAP معمولی/کلاسیک، وجود حداقل دو فرد خویشاوند دارای سندرم FAP در خانواده، حالت وراثت غالب آدنوما کلورکتال و وجود بیش از صد پولیپ در کولون و رکتوم بود. با این حال، بیمارانی با کمتر از صد پولیپ، اما با سابقه خانوادگی مثبت برای FAP، از نظر بالینی جزو بیماران با FAP تشخیص داده شدند. همچنین، یک گروه 30 نفره به عنوان نمونههای کنترل سالم انتخاب شدند که سابقه خانوادگی شناخته شدهای از هیچ نوع سرطان نداشتند و از همان منطقه جغرافیایی بیماران انتخاب شدند. افراد کنترل از نظر سن و جنسیت با گروه بیماران، اختلاف آماری مهم و معناداری نداشتند (5 تا 25 سال: 0/15=P و 10 مرد و 20 زن: 0/004=P). چون در مطالعه حاضر، تمام متغیرهای انتخاب گروههای بیمار و کنترل، به خوبی توزیع شده بودند، بنابراین برای یک تحلیل آماری معتبر و قابل قبول در نظر گرفته شدند. تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد. پس از تکمیل پرسشنامه و اخذ رضایتنامه از همه شرکتکنندگان در تحقیق، خونگیری (5 میلیلیتر نمونه خون محیطی) از اعضای خانوادههای مذکور انجام گرفت. برای ادامه مراحل تحقیق، ابتدا با استفاده از کیت استخراج DNA pure، طی روش استاندارد، استخراج DNA از خون بیماران انجام شد. برای بررسی جهشهای ژنوم میتوکندری، قطعهای به طول bp558 که حاوی ژن ATPase6 بود و همچنین قطعهای حاوی ژن MT-CYB به طول bp853 برای روش Touchdown PCR انتخاب شدند. با استفاده از نرم افزارهای GenRunner و Primer1 دو جفت پرایمر برای تکثیر این ژنها طراحی شد و توسط شرکت پیشگام ساخته شد. با استفاده از برنامه BLAST در سایت http://www.ncbi.nlm.nih.gov/blast توالی پرایمرها از نظر همولوژی با کل ژنوم انسان همردیف شدند. توالی جفت پرایمرها و موقعیتهای آنها بر روی ژنوم میتوکندری در جدول 1 آمده است.
جدول 1: توالی و موقعیت پرایمرها

برای انجام روش Touchdown PCR واکنشهای PCR در حجمهای نهایی 25 میکرولیتری شامل 10 میکرولیتر مخلوط بهینه PCR (Master Mix-Amplicon-Pishgam که شامل Buffer 1X، 200 میکرولیتر از هر یک از dNTP ها، 1/5-1 واحد آنزیم Taq DNA polymerase، 4-1 میلیمولار MgCl2)، 2 میکرولیتر از هر پرایمر (Forward و Reverse)، 5 میکرولیتر DNA الگو و 6 میکرولیتر آب دیونیزه استریل آماده شد و با کمک دستگاه PCR (شرکت یکتا تجهیز آزما) واکنش تکثیر قطعات DNA میتوکندری انجام گرفت. برنامه زمانی و دمایی واکنش Touchdown PCR به این صورت انجام گرفت: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد به مدت 3 دقیقه و بهدنبال آن 35 سیکل دمایی متشکل از دمای دناتوراسیون 95 درجه سانتیگراد به مدت 30 ثانیه، دمای اتصال از درجه حرارت 53 تا 62 درجه سانتیگراد (به صورت کاهشی 0/5 درجه سانتیگراد به ازای هر سیکل) و مرحله گسترش به مدت یک دقیقه در درجه حرارت 72 درجه سانتیگراد و مرحله گسترش نهایی به مدت پنج دقیقه در درجه حرارت 72 درجه سانتیگراد صورت گرفت. در نهایت برای اطمینان از تکثیر قطعات مورد نظر، 5 میکرولیتر از محصولات PCR روی ژل آگاروز 1/5 درصد حاوی اتیدیوم بروماید، بارگذاری و الکتروفورز شد. ژل آگارز به مدت 30 دقیقه و با ولتاژ 100 ولت الکتروفورز گردید و پس از آن با استفاده از دستگاه Gel Doc نمونهها مشاهده شد و تصویربرداری از آنها صورت گرفت. برای شناسایی تغییرات نوکلئوتیدی در ژنهای میتوکندری، نمونههای بیماران و اعضای خانواده آنها، جهت تعیین توالی مستقیم به شرکتهای پیشگام و نورژن (تهران) ارسال گردید. نتایج تعیین توالیها با نرمافزار MEGA5 و برنامه کروماس (chromas) بررسی شدند و با توالی مرجع کمبریج (CRS)، MITOMAP و توالی ثبت شده در سایت NCBI همتراز شدند. همردیفی با ژنوم میتوکندری سایر گونهها نیز از طریق پایگاه BLAST انجام شد. برای شناسایی جهشهای یافت شده در این تحقیق و تعیین پاتوژن بودن و یا جدید بودن آنها از نرم افزارها و پایگاههای بیوانفورماتیکی متعددی شامل SIFT، I-Mutant، PSIPRED، ExPASy، PolyPhen-2، PROVEAN، PredictSNP و PyMol استفاده گردید. پایگاه اینترنتی SIFT (http://sift.jcvi.org) تاثیر احتمالی جهش بر ساختار و عملکرد پروتئین را پیشبینی میکند. این پایگاه نتیجه را بهصورت عددی نمایش میدهد که تفسیر آن بدین شرح است: امتیاز کمتر از 0/05 بدین معنی است که جهش تاثیر چشمگیری بر ساختار و عملکرد پروتئین داشته و احتمال پاتوژن بودن آن زیاد است و در مقابل امتیاز بیشتر از 0/05 به معنی این است که جهش تاثیر قابل توجهی نداشته و احتمالاً پاتوژن نیست. پایگاه اینترنتی I-Mutant (http:// gpcr2.biocomp.unibo.it/cgi/predictors/I-Mutant3.0) به بررسی و پیشبینی تغییرات پایداری پروتئین و تاثیر جهش تک نوکلئوتیدی بر ساختار پروتئین میپردازد. امتیاز خروجی I-Mutant مقدار تغییر انرژی آزاد یا DDG است. امتیاز کمتر از صفر کاهش پایداری و امتیاز بیشتر از صفر افزایش پایداری را نشان میدهد. همچنین از پایگاه اینترنتی PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred) برای بررسی ساختار پروتئینها استفاده میشود که بر اساس ساختار اولیه پروتئین، ساختار ثانویه آن پیشبینی میگردد. پایگاه اینترنتی ExPASy (http://web.expasy.org/protocol) طیف گستردهای از منابع اطلاعاتی در زمینههای پروتئومیکس، ژنومیکس، فیلوژنتیک/ تکامل، ژنتیک جمعیت و ترانسکریپتومیکس را در اختیار میگذارد. برای بررسی تغییرات هیدروفوبیسیته پروتئینهای جهشیافته از این پایگاه استفاده شد. پایگاه اینترنتی PolyPhen-2 (http://genetics.bwh.harvard.edu/pph2) نیز ابزاری است که تاثیر احتمالی جایگزینی اسیدهای آمینه بر ساختار و عملکرد پروتئین را پیشبینی میکند. پایگاه اینترنتی PROVEAN (http://provean.jcvi.org) تاثیر جابهجایی اسیدآمینه یا جایگزینی اسیدآمینه بر روی فعالیت بیولوژیکی پروتئین را پیشبینی میکند که برای شناسایی تأثیرات احتمالی جهشهای غیر هممعنی و اهمیت آنها بر فعالیت پروتئینی بسیار پرکاربرد میباشد. جهشها با امتیازکمتر از 2/5- زیانآور و امتیاز بیشتر از 2/5- خنثی هستند. پایگاه اینترنتی PredictSNP (https:// loschmidt.chemi.muni.cz/ predictsnp) نیز به بررسی تاثیر جهشها بر ساختار پروتئین میپردازد. نتایج حاصل از این سایت شامل بررسیهای چندین پایگاه مختلف (PredictSNP،MAPP ،PhD-SNP ،polyphen-1 ،polyphen-2 ،SIFT ، SNAP) است که بر اساس درصد و رنگ مشخص میشود که رنگ سبز به معنی جهش خنثی و رنگ قرمز به معنی جهش زیانآور میباشد. نرمافزار PyMol نیز برای نمایش ساختار فضایی ماکرومولکولهایی مانند پروتئینها به کار میرود. از کاربردهای این نرمافزار، تعیین تعداد و طول پیوندهای هیدروژنی بین اسید آمینههای پروتئین و مشاهده تغییرات ساختار پروتئین میباشد.
تجزیه و تحلیل آماری
در این مطالعه برای بررسیهای آماری و تعیین ارتباط یا تفاوت معنادار تغییرات نوکلئوتیدی با بیماری FAP در دو گروه کنترل و بیمار، از آزمون آماری فیشر (Fisher’s exact) و نرمافزار آماری SPSS version 16 استفاده شد. محاسبات با استفاده از نرمافزار GraphPad انجام شد و سطح معنیداری کمتر از 0/05 (P<0.05) از نظر آماری مهم در نظر گرفته شد. ملاحظات اخلاقی
پروپوزال این مطالعه توسط کمیته اخلاق دانشگاه یزد مورد تایید قرار گرفت (IR.YAZD.REC.1401.053) و تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد.
نتایج
مطالعه بر روی 26 فرد مبتلا به FAP انجام شد و نتایج بررسی های مولکولی با استفاده از روشهایTouchdown PCR و تعیین توالی ژنومی، مشخص کننده 5 جهش و تغییر نوکلئوتیدی در ژن میتوکندریایی ATPase6 و 3 جهش و تغییر ژنی در MT-CYB بود (جدول 2). جهش هتروپلاسمی و تغییر اسید آمینهc.T8780C; p.L85P در ژن ATPase6 در یک بیمار زن 21 ساله مشاهده شد. فرد مبتلا در زمان مراجعه به پزشک، علائمی از بیماری نداشت و پس از تشخیص بیماری برادرش، با صلاحدید پزشک تحت کولونوسکوپی قرارگرفت که بیماری FAP برای این فرد نیز تشخیص داده شد (شکل 1). خواهر بیمار مشکلاتی از قبیل اسهال خونی و دردهای شکمی داشته که پزشک پس از معاینه تشخیص FAP داده و تحت عمل جراحی قرار گرفته بود. سپس او در اثر سرطان کولون فوت کرد. قابل ذکر است که دختر خاله فرد پروباند بر اثر سرطان روده فوت کرده و مادر بیمار نیز بر اثر سرطان کبد فوت کرده است. شجره این خانواده در شکل 1 نشان داده شده است. دو جهش هموپلاسمی در ژن MT-CYB در یک دختر بیمار 18 ساله مشاهده شد، یک تغییر نوکلئوتیدی هم معنی (p.K287K) c.A15607Gو یک جهش تغییر اسید آمینه (p.Leu236Ile) c.C15452A که در شکل 2 نشان داده شده است. فرد مبتلا به دلیل مشکل خونریزی رکتوم حدود 10 سال پیش به پزشک مراجعه کرده و پس از انجام کولونوسکوپی تشخیص FAP داده شد. طی دو جراحی روده بزرگ بطور کامل و قسمتی از روده کوچک بیمار برداشته شد. دو خواهر و برادر بیمار نیز درای FAP بوده و تحت عمل جراحی قرار گرفتند. شجره این خانواده در شکل2 نشان داده شده است. در خانواده بعدی، پروباند خانمی 31 ساله بود که با علائمی مثل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده و پس از کولونوسکوپی تشخیص FAP داده شد. بیمار تا کنون دو بار عمل جراحی شده و در نهایت کولکتومی شده بود. پدربزرگ مادری، علائمی از FAP نداشته و کولونوسکوپی نیز نشده بود. در نسل های قبل نیز موردی از FAP گزارش نشده بود. جهش هموپلاسمی p.L125L در ژن ATPase6 و جهش هموپلاسمی p.L363L در ژن MT-CYB در یک بیمار 14 ساله مشاهده شد. این فرد با علائمی مثل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده بود که پس از کولونوسکوپی FAP برای وی تشخیص داده شد (شکل 3). در خانواده دیگر، فرد مبتلا مردی بود 19 ساله که با علائمی نظیر دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرد. پس از انجام کولونوسکوپی برای وی تشخیص FAP داده شده و دو بار تحت عمل جراحی قرارگرفته و سپس کولکتومی شده بود. خواهر او در سن 18 سالگی بهدلیل مدفوع خونی به پزشک مراجعه کرده بود که تشخیص FAP دادهشده بود و دو سوم روده وی به علت بیماری برداشتهشده بود. مادر پروباند نیز در اثر بیماری FAP و در نهایت سرطان کولون، فوت کرده بود. جهش هتروپلاسمی و منجر به تغییر اسید آمینه (p.E203K) در ژن ATPase6 در این بیمار مشاهده شد (شکل 4). پروباند بعدی، دختری 20 ساله بود که پس از تشخیص بیماری FAP تحت عمل جراحی رزوکتومی قرارگرفت. مادر وی به دلیل دردهای شکمی و وجود خون در مدفوع به پزشک مراجعه کرده بود که پس از کولونوسکوپی تشخیص FAP دادهشد و تحت عمل جراحی قرارگرفت. جهش هموپلاسمی (p.P139P) c.C8943Tدر ژن ATPase6 در این دختر بیمار مشاهده شد. این جهش از نوع هممعنی است (شکل 5). جهش هموپلاسمی (p.I144I) c.C8958T در ژن ATPase6 در پروباند دختری حدوداً 11 ساله مشاهده شد که با علائم خونریزی از رکتوم به پزشک مراجعه کرده و کولونوسکوپی از وی انجامشد و پولیپ خوشخیم مشاهده گردید. سپس با انجام کولونوسکوپی مجدد تودهای در رکتوم مشاهده شد که پس از بیوپسی آن را بدخیم تشخیص دادند و بیمار تحت عمل جراحی قرار گرفت. دو برادر بیمار نیز علائمی مشابه با خواهرشان داشتند که قسمتی از روده بزرگ آنها برداشته شد. قابل توجه است که مادر 58 ساله این خانواده با وجود داشتن فرزندانی با علائم FAP، هیچگونه علائمی از این بیماری نداشته و تا آن زمان کولونوسکوپی هم نشده بود (شکل 6).
جدول 2: نتایج تغییرات نوکلئوتیدی و جهشهای مشاهده شده ژنوم میتوکندری در بیماران مبتلا به FAP


شکل 1: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هتروپلاسمی با تغییر اسید آمینه p.L85P

شکل 2: A) شجره خانوادگی پروباند بیمار، B) تعیین توالی ژن MT-CYB در فرد کنترل، C) جهش هموپلاسمی c.C15452A که منجر به تغییر اسید آمینه Leu236Ile در بیمار می شود، D) تعیین توالی ژن MT-CYB در فرد کنترل، E) جهش هموپلاسمی c.A15607G که یک جهش هممعنی است و منجر به تغییر اسید آمینه در بیمار نمیشود K287K.

شکل 3: A) شجره خانوادگی پروباند بیمار، B) تعیین توالی ژن ATPase6 در فرد کنترل، C) جهش هموپلاسمی c.A8901G که منجر به تغییر اسید آمینه در بیمار نمی شود L125L، D) تعیین توالی ژن MT-CYB در فرد کنترل، E) جهش هموپلاسمی c.C15833T که یک جهش هممعنی است و منجر به تغییر اسید آمینه در بیمار نمی شود p.L363L.

شکل 4: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هتروپلاسمی با تغییر اسید آمینه p.E203K

شکل 5: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هموپلاسمی c.C8943T بدون تغییر اسید آمینه p.P139P

شکل 6: شجره خانوادگی پروباند بیمار و نتیجه تعیین توالی ژن ATPase6 و مشخص شدن جهش هموپلاسمی c.C8958T بدون تغییر اسید آمینه p.I144I
از میان جهشهای مشاهده شده در این مطالعه، سه جهش p.L85P، p.E203K و p.L236I غیر هممعنی هستند که منجر به تغییر اسید آمینه در پروتئین های ATPase6 و MT-CYB میشوند و احتمالاً میتوانند در ساختار پروتئین تغییر ایجاد کنند. از این رو، جهشهای غیر هممعنی با استفاده از پایگاهها و نرم افزارهای بیوانفورماتیکی مورد تجزیه و تحلیل قرار گرفتند که نتایج آن به شرح زیر است:
طبق پیشبینی پایگاه اینترنتی PSIPRED هر سه جهش در ناحیه آلفا هلیکس پروتئین های ATPase6 و MT-CYB رخ دادهاند. پایگاه اینترنتی SIFT با امتیاز صفر برای دو جهش p.L85P و p.E203K در پروتئین ATPase6، پیشبینی میکند که این دو جهش تاثیر چشمگیری بر ساختار پروتئین داشته و احتمالاً پاتوژن هستند. این پایگاه با محاسبه امتیاز 1 برای جهش p.L236I در پروتئین MT-CYB نشان میدهد احتمالاً این جهش پاتوژن نیست. پایگاه اینترنتی PolyPhen-2 با امتیاز 0/999 برای جهش p.L85P و امتیاز 0/9994برای جهش p.E203K در پروتئین ATPase6 پیشبینی میکند که هر دو جهش با احتمال بالا بدخیم هستند؛ اما امتیاز 0/029 برای جهش p.L236I در پروتئین MT-CYB، خوشخیم بودن این جهش را پیشبینی میکند. پایگاه اینترنتی ExPASy برای هر دو جهش p.L85P و p.E203K کاهش هیدروفوبیسیته را در حالت موتانت نسبت به پروتئین نرمال پیشبینی میکند. در جهش p.L85P، درجه هیدروفوبیسیتی طبق امتیاز کیت/دولیتل (Kyte/Doolittle) از 3/800 برای اسید آمینه شدیداً هیدروفوب لوسین به 1/600- برای اسید آمینه هیدروفیل پرولین تغییر کرده است. در جهش p.E203K، درجه هیدروفوبیسیتی از 3/500- برای اسید آمینه هیدروفیل اسیدگلوتامیک به 3/900- برای اسید آمینه هیدروفیل لیزین تغییر کرده است. با این حال، این پایگاه برای جهش p.L236I در پروتئین MT-CYB، افزایش هیدروفوبیسیته را پیشبینی میکند، بگونهای که این جهش، درجه هیدروفوبیسیتی را از 3/800 برای اسید آمینه شدیداً هیدروفوب لوسین به 4/500 برای اسید آمینه هیدروفوب ایزولوسین تغییر داده است.بر اساس پایگاه اینترنتی I-Mutant در دمای 25 درجه سانتیگراد و 7 = pH جهش p.L85P با ایندکس 1/83-DDG= کاهش قابل توجه پایداری و جهشهای p.E203K و p.L236I به ترتیب با 0/71 DDG= و 0/58 DDG= افزایش پایداری پروتئین را به دنبال دارند. پایگاه اینترنتی PredictSNP نیز پیشبینی میکند که جهش p.L85P، به احتمال 76 درصد و جهش p.E203K، به احتمال 87 درصد، بر ساختار پروتئین اثر گذاشته و بنابراین جهشهایی زیانآوری هستند. همچنین این پایگاه جهش p.L236I را با احتمال 83 درصد به عنوان جهش خنثی پیشبینی کرد. پایگاه اینترنتی PROVEAN نیز با امتیاز 6/467- برای جهش p.L85P و امتیاز 3/548- برای جهش p.E203K، پیش بینی کرد که این دو جهش بر فعالیت پروتئین اثر گذاشته و بنابراین، آنها را به عنوان جهشهای زیانآور معرفی میکند. همچنین در این مطالعه با استفاده از نرمافزار PyMol، ساختار سه بعدی هر دو پروتئین ATPase6 و Cytb بررسی شد و تعداد و طول پیوندهای هیدروژنی مربوط به اسید آمینهها، قبل و بعد از جهش ارزیابی شد. ابتدا از سرور SWISS-MODEL برای مدلسازی ساختار سهبعدی پروتئینهای ATPase6 و سیتوکروم b استفاده شد. در جهش جدید و هتروپلاسمی p.L85P که مربوط به پروتئین ATPase6 است، اسیدآمینه پرولین در موقعیت 85، در حالت موتانت، با اسیدآمینههای لوسین در موقعیت 88 و سرین در موقعیت 91 تشکیل پیوندهای هیدوژنی میدهد که طول این پیوندها به ترتیب 3 و 2/6 آنگستروم است. در پروتئین نرمال ATPase6 در موقعیت 85 اسیدآمینه لوسین قرار دارد که با اسیدآمینههای ترئونین در موقعیت 81، لوسین در موقعیت 88 و سرین در موقعیت 91 پیوند هیدروژنی تشکیل میدهد که طول این پیوندها بهترتیب 3، 3/2 و 2/7 آنگستروم است (شکل7). در جهش p.E203K که مربوط به پروتئین ATPase6 میباشد، در فرم جهشیافته، اسیدآمینه لیزین در موقعیت 203 با اسیدآمینههای گلایسین در موقعیت 167، لوسین در موقعیت 199 و آلانین در موقعیت 207 تشکیل پیوند هیدوژنی میدهد که طول این پیوندها به ترتیب 3/3، 2/7 و 3/1 آنگستروم است. در پروتئین نرمال ATPase6 ، در موقعیت 203 اسیدگلوتامیک قرار دارد که با اسیدآمینههای لوسین در موقعیت 199و آلانین در موقعیت 207 پیوند هیدروژنی تشکیل میدهد. طول این پیوندها به ترتیب 3/1 و 2/7 آنگستروم است (شکل 8).
جهش p.L236I مربوط به پروتئین سیتوکروم b است. این جهش باعث تغییر در تعداد و طول پیوند هیدروژنی نشده است. در موقعیت 236 هر دو اسیدآمینه نرمال و جهشیافته با اسیدآمینههای لوسین در موقعیت 232 و متیونین در موقعیت 240 با پیوند هیدروژنی اتصال برقرار میکنند که طول این پیوندها به ترتیب 2/9 و 2/8 آنگستروم است (شکل 9).

شکل 7: نتایج حاصل از نرمافزار PyMol برای جهش L85P در پروتئین ATPase6 و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها

شکل 8: نتایج حاصل از نرمافزار PyMol برای جهش E203K در پروتئین ATPase6 و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها

شکل 9: نتایج حاصل از نرمافزار PyMol برای جهش L236I در پروتئین سیتوکروم b و تعیین تعداد و طول پیوندهای هیدروژنی بین اسیدآمینهها
بحث
پولیپوز آدنوماتوز خانوادگی یک بیماری اتوزومال غالب است که در 70 تا 90 درصد از موارد، جهش در ژن APC مسبب آن است (7). این بیماری یک اختلال نادر است که با وجود صدها و یا گاهی هزاران پولیپ در روده بزرگ شناخته میشود و تقریباً 5/0 درصد از تمام سرطانهای روده بزرگ را شامل میشود (16). مطالعات اخیر نشان داده است که علاوه بر ناهنجاریهای ژنوم هستهای، اختلالات عملکردی ژنوم میتوکندری نیز از عوامل مهم ابتلا به سرطان هستند. تغییرات ژنوم میتوکندری میتواند منجر به اختلالاتی از قبیل استرس اکسیداتیو، افزایش تجمع کلسیم سیتوزولی و گونههای فعال اکسیژن، کاهش سطح ATPو نیز عدم تعادل نسبت NADH/NAD+ گردد. تغییر در هریک از این عوامل میتواند بر مسیرهای پیامرسانی سلولی، عوامل رونویسی و ساختار کروماتین تاثیر بگذارد. همچنین استرس اکسیداتیو ناشی از گونههای فعال اکسیژن ممکن است بیان ژنهای هستهای درگیر در تومورزایی را تحت تاثیر قرار داده و در ایجاد و یا گسترش انواع سرطان نقش داشته باشد (11). در مطالعه حاضر، غربالگری دو ژن میتوکندریایی ATPase6 و MT-CYB در 26 بیمار خانوادگی مبتلا به FAP انجام شد. نتایج تحقیق ما، حضور هشت تغییر نوکلئوتیدی را در این دو ژن نشان داد، پنج جهش در ژن ATPase6 (3 واریانت هموپلاسمی هممعنی و بدون تغییر اسید آمینه و 2 جهش هتروپلاسمی بدمعنی و جدید: L85P و E203K) و سه جهش هموپلاسمی در ژن MT-CYB میتوکندری، شامل دو واریانت هممعنی و بدون تغییر اسید آمینه و 1 جهش بدمعنی: L236I، که در بیماران متعلق به 9 خانواده مبتلا به FAP یافت شد. کمپلکس III زنجیره تنفسی که به آن یوبی کوئینول سیتوکروم C ردوکتاز نیز گفته میشود، در غشای داخلی میتوکندری قرار گرفته است و دارای زیرواحدهای سیتوکروم b، سیتوکروم c1 و پروتئین واجد آهن و گوگرد است. این کمپلکس باعث اکسیداسیون یوبی کوئین احیاشده و انتقال الکترون به سیتوکروم c1 میشود. به ازای هر دو الکترون چهار پروتون توسط این کمپلکس به فضای بین غشاء میتوکندری پمپ میشود. سیتوکروم c مسئول انتقال الکترون بین کمپلکس سوم و چهارم است (17). تنها زیر واحد کمپلکس III که توسط ژنوم میتوکندری رمزگذاری میشود، سیتوکروم b است. در ژن سیتوکروم b، که مطالعه ما بر روی آن صورت گرفته است، دو نفر دارای جهش هم معنی p.K287K و یک نفر دارای جهش هم معنی p.L363L میباشند که تغییری در ساختار پروتئین نیز ایجاد نمیکنند. تنها جهش missense مشاهده شده در این ژنp.Leu236Ile میباشد که در دو نفر بیمار مشاهده شد. این تغییر اسیدآمینه در ناحیه عرض غشایی پروتئین میباشد که قبلاً در بیماریهایی نظیر نوروپاتی اپتیکی ارثی و پارکینسون نیز گزارش شده است (18). البته بر اساس سایت NCBI این جهش تغییر اسید آمینه پاتوژن نمیباشد و نتایج آنالیزهای بیوانفورماتیکی انجام شده در مطالعه حاضر نیز (SIFT و PolyPhen-2 ، PredictSNP، PROVEAN) نیز همین موضوع را ثابت میکند و تغییر اسیدآمینه مزبور به عنوان تغییری خنثی پیش بینی میشود. ژنهای مربوط به کمپلکس V میتوکندریایی (کمپلکس ATP سنتتاز) نیز نقش مهمی در تولید ATP دارند.کمپلکس ATP سنتتاز دارای دو دومین عملکردی است. بخش F0 که درون غشا داخلی قرار دارد و کانال انتقال پروتون است و بخش دیگر به نام F1 که از غشاء داخلی بهطرف ماتریکس کشیده شده است. این کمپلکس از انرژی تولیدشده توسط شیب الکتروشیمیایی پروتون، ADP را فسفریله کرده و ATP تولید می کند. ژن مورد تحقیق ما، ATPase6 از جمله ژنهایی است که پروتئین آن در کمپلکس V وجود دارد (19). برخی از شواهد نشان-دهنده جهش¬های متنوع کمپلکس V ژنوم میتوکندری در سرطانهای گوناگون از جمله سرطان کولون و پروستات است (20,21). در یک تحقیق نیز نشان داده شده است که جهشهای ژنهای ATPase باعث افزایش تولید گونههای فعال اکسیژن و افزایش اندازه تومور شده است (22). همانطور که در گفته شد، ما در ژن Mt-ATPase6 پنج جهش مشاهده کردیم که سه تغییر به صورت هممعنی (L125L، I144I وP139P) بودند که هیچ تغییری در ساختار و عملکرد پروتئین ایجاد نمیکردند. دو جهش غیر هممعنی بهصورت هتروپلاسمی، با تغییر اسید آمینه شامل L85P وE203K نیز مشاهده گردید که نتایج حاصل از آنالیزهای متعدد بیوانفورماتیکی ما نشان داد که هر دو جهش بر عملکرد و ساختار پروتئین تأثیرگذار هستند و به عنوان جهشهایی بدخیم و بیماریزا معرفی شدند بهصورتی که هر دو با درصد بالایی به عنوان جهشهایی زیانآور پیش بینی شدند. هر دوی این جهشها در ناحیه آلفا هلیکس پروتئین اتفاق افتادهاند. همچنین، تجزیه و تحلیل ساختار سه بعدی پروتئین نیز نشان داد که جهشهای بدمعنی L85P وE203K که در اینجا معرفی شدهاند، میتوانند بر ساختار سه بعدی پروتئین تأثیر بگذارند. مدلسازی ساختاری این دو جهش جدید میتواند تأیید کند که جهشها در ناحیه گذرنده و C ترمینال پروتئین، روی ترکیب فضایی و شکل مناطق مهم مربوط به انتقال الکترون تأثیر میگذارند و احتمالاً به ساختار پروتئین آسیب میرسانند و احتمالاً میتوانند فعالیت کمپلکس فسفوریلاسیون اکسیداتیو V را کاهش دهند و بدین ترتیب باعث اختلال عملکرد میتوکندری میشوند. از جهشهای مشاهده شده در ژن ATPase6، فقط جهش L125L قبلاً در بیماری کلیوی توبولینوسیتی نیز گزارششده بود (23)، ولی بقیه جهشهای یافت شده در این ژن جدید هستند و تاکنون در هیچ بیماری یا سرطانی گزارش نشدهاند. بر اساس نقش حیاتی ذکر شده برای هر یک از کمپلکسهای زنجیره تنفسی و زیرواحدهای آن واضح است که نقص در ساختار آنها میتواند بر عملکرد زنجیره انتقال الکترون و افزایش تولید گونه¬های فعال اکسیژن اثر گذاشته که به نوبه خود میتواند موجب افزایش جهش¬های انکوژنیک یا افزایش تکثیر سلولی شود. تاکنون مطالعات ژنتیکی زیادی در ایران بر روی بیماری FAP صورت نگرفته است. موارد اندکی از تحقیقات انجام شده نیز اکثرا بر روی ژنوم هسته¬ای متمرکز شده است. بنابراین تحقیق صورت گرفته می-تواند به شناخت بیشتر بیماری و بررسی تاثیر تغییرات ژنوم میتوکندری بر روی گسترش سرطان کمک کند.
نتیجهگیری
ارتباط بین جهشهای میتوکندری و بیماری FAP میتواند در تشخیص زود هنگام و درمان این بیماری مؤثر باشد. در این مطالعه ژنهای ATPase6 و MT-CYB در 26 فرد مبتلا به FAP بررسی شدند که بهترتیب 5 و 3 جهش و تغییر نوکلئوتیدی در بیماران مبتلا مشاهده گردید. با توجه به اینکه جهش و یا نقص در عملکرد میتوکندی در مسیر تومورزایی نقش دارد، کشف جهشهای جدید میتواند در تشخیص زودهنگام سرطان مؤثر باشد.
سپاسگزاری
نویسندگان مقاله از حمایتهای دانشگاه یزد در انجام این پژوهش تشکر و قدرانی میکنند. از بیمارستان خاتمالانبیا تهران، بیمارستان شریعتی تهران، بیمارستان پارسیان تهران، انستیتو کنسر تهران و بیمارستان امامخمینی تهران که بیمـاران را جهـت ایـن مطالعـه ارجـاع دادهانـد تـشکر و قـدردانی مـیشـود. همچنین از همکاری ارزشمند تمام بیماران سپاسگزاریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Half E, Bercovich D, Rozen P. Familial Adenomatous Polyposis. Orphanet Journal Of Rare Diseases 2009; 4(1): 1-23.
2- Galiatsatos P, Foulkes WD. Familial Adenomatous Polyposis. Am J Gastroenterol 2006; 101(2): 385-98.
3- Nieuwenhuis M, Vasen H. Correlations between Mutation Site in APC and Phenotype of Familial Adenomatous Polyposis (FAP): A Review of the Literature. Crit Rev Oncol Hematol 2007; 61(2): 153-61
4- Ghadamyari F, Heidari MM, Zeinali S, Khatami M, Merat S, Bagherian H, et al. Mutational Screening through Comprehensive Bioinformatics Analysis To Detect Novel Germline Mutations in the APC Gene in Patients with Familial Adenomatous Polyposis (FAP). J Clin Lab Anal 2021; 35(5): E23768
5- Afkhami E, Heidari MM, Khatami M, Ghadamyari F, Dianatpour S. Detection of Novel Mitochondrial Mutations in Cytochrome C Oxidase Subunit 1 (COX1) in Patients with Familial Adenomatous Polyposis (FAP). Clin Transl Oncol 2019; 22(6): 908-18.
6- Ardakani ZS, Heidari MM, Khatami M, Sani MB. Association of Pathogenic Missense and Nonsense Mutations in Mitochondrial COII Gene with Familial Adenomatous Polyposis (FAP). Int J Mol Cell Med 2020; 9(4): 255-65.
7- Friedl W, Aretz S. Familial Adenomatous Polyposis: Experience from a Study of 1164 Unrelated German Polyposis Patients. Hered Cancer Clin Pract 2005; 3(3): 95-114.
8- Tudyka VN, Clark SK. Surgical Treatment in Familial Adenomatous Polyposis. Annals of Gastroenterology 2012; 25(3): 201-6.
9- Kennedy RD, Potter DD, Moir CR, El-Youssef M. The Natural History of Familial Adenomatous Polyposis Syndrome: A 24 Year Review of a Single Center Experience in Screening, Diagnosis, and Outcomes. J Pediatric Surg 2014; 49(1): 82-6
10- Dejea CM, Fathi P, Craig JM, Boleij A, Taddese R, Geis AL, et al. Patients with Familial Adenomatous Polyposis Harbor Colonic Biofilms Containing Tumorigenic Bacteria. Science 2018; 359(6375): 592-7
11- Cristofaro M, Contursi A, D'Amore S, Martelli N, Spaziante AF, Moschetta A, Villani G. Adenomatous Polyposis Coli (APC)-Induced Apoptosis of HT29 Colorectal Cancer Cells Depends on Mitochondrial Oxidative Metabolism. Biochim Biophys Acta 2015; 1852(9): 1719-28
12- Venesio T, Balsamo A, Errichiello E, Ranzani GN, Risio M. Oxidative DNA Damage Drives Carcinogenesis in MUTYH-Associated-Polyposis by Specific Mutations of Mitochondrial and MAPK Genes. Mod Pathol 2013; 26(10): 1371-81.
13- Wallace DC. Mitochondria and Cancer. Nat Rev Cancer 2012; 12(10): 685-98
14- Dirican E, Savrun ŞT, Aydın İE, Gülbay G, Karaman Ü. Analysis of Mitochondrial DNA Cytochrome‐B (CYB) and Atpase‐6 Gene Mutations in COVID‐19 Patients. J Med Virol 2022; 94(7): 3138-46.
15- Kozakiewicz P, Grzybowska-Szatkowska L, Ciesielka M, Całka P, Osuchowski J, Szmygin P, et al. Mitochondrial DNA Changes in Genes of Respiratory Complexes III, IV and V Could Be Related to Brain Tumours in Humans. Int J Mol Sci 2022; 23(20): 12131.
16- Desurmont T, Lefèvre JH, Shields C, Colas C, Tiret E, Parc Y. Desmoid Tumour in Familial Adenomatous Polyposis Patients: Responses to Treatments. Fam Cancer 2015; 14(1): 31-9.
17- Guzy RD, Schumacker PT. Oxygen Sensing by Mitochondria at Complex III: The Paradox of Increased Reactive Oxygen Species during Hypoxia. Exp Physiol 2006; 91(5): 807-19.
18- Vives-Bauza C, Andreu AL, Manfredi G, Beal MF, Janetzky B, Gruenewald TH, Lin MT. Sequence Analysis of the Entire Mitochondrial Genome in Parkinson's Disease. Biochem Biophy Res Commun 2002; 290(5): 1593-601.
19- Jonckheere AI, Smeitink JA, Rodenburg RJ. Mitochondrial ATP Synthase: Architecture, Function and Pathology. J Inherit Metab Dis 2012; 35(2): 211-25.
20- Shin Y-K, Yoo BC, Chang HJ, Jeon E, Hong S-H, Jung M-S, et al. Down-Regulation of Mitochondrial F1F0-ATP Synthase in Human Colon Cancer Cells with Induced 5-Fluorouracil Resistance. Cancer Res 2005; 65(8): 3162-70.
21- Feichtinger RG, Schäfer G, Seifarth C, Mayr JA, Kofler B, Klocker H. Reduced Levels of ATP Synthase Subunit ATP5F1A Correlate with Earlier-Onset Prostate Cancer. Oxid Med Cell Longev 2018; 2018: 1347174.
22- Penta JS, Johnson F, Wachsman JT, Copeland WC. Mitochondrial DNA in Human Malignancy. Mutat Res 2001; 488(2): 119-33
23- Connor TM, Hoer S, Mallett A, Gale DP, Gomez-Duran A, Posse V, et al. Mutations in Mitochondrial DNA Causing Tubulointerstitial Kidney Disease. Plos Genetics 2017; 13(3): E1006620.
1- Half E, Bercovich D, Rozen P. Familial Adenomatous Polyposis. Orphanet Journal Of Rare Diseases 2009; 4(1): 1-23.
2- Galiatsatos P, Foulkes WD. Familial Adenomatous Polyposis. Am J Gastroenterol 2006; 101(2): 385-98.
3- Nieuwenhuis M, Vasen H. Correlations between Mutation Site in APC and Phenotype of Familial Adenomatous Polyposis (FAP): A Review of the Literature. Crit Rev Oncol Hematol 2007; 61(2): 153-61
4- Ghadamyari F, Heidari MM, Zeinali S, Khatami M, Merat S, Bagherian H, et al. Mutational Screening through Comprehensive Bioinformatics Analysis To Detect Novel Germline Mutations in the APC Gene in Patients with Familial Adenomatous Polyposis (FAP). J Clin Lab Anal 2021; 35(5): E23768
5- Afkhami E, Heidari MM, Khatami M, Ghadamyari F, Dianatpour S. Detection of Novel Mitochondrial Mutations in Cytochrome C Oxidase Subunit 1 (COX1) in Patients with Familial Adenomatous Polyposis (FAP). Clin Transl Oncol 2019; 22(6): 908-18.
6- Ardakani ZS, Heidari MM, Khatami M, Sani MB. Association of Pathogenic Missense and Nonsense Mutations in Mitochondrial COII Gene with Familial Adenomatous Polyposis (FAP). Int J Mol Cell Med 2020; 9(4): 255-65.
7- Friedl W, Aretz S. Familial Adenomatous Polyposis: Experience from a Study of 1164 Unrelated German Polyposis Patients. Hered Cancer Clin Pract 2005; 3(3): 95-114.
8- Tudyka VN, Clark SK. Surgical Treatment in Familial Adenomatous Polyposis. Annals of Gastroenterology 2012; 25(3): 201-6.
9- Kennedy RD, Potter DD, Moir CR, El-Youssef M. The Natural History of Familial Adenomatous Polyposis Syndrome: A 24 Year Review of a Single Center Experience in Screening, Diagnosis, and Outcomes. J Pediatric Surg 2014; 49(1): 82-6
10- Dejea CM, Fathi P, Craig JM, Boleij A, Taddese R, Geis AL, et al. Patients with Familial Adenomatous Polyposis Harbor Colonic Biofilms Containing Tumorigenic Bacteria. Science 2018; 359(6375): 592-7
11- Cristofaro M, Contursi A, D'Amore S, Martelli N, Spaziante AF, Moschetta A, Villani G. Adenomatous Polyposis Coli (APC)-Induced Apoptosis of HT29 Colorectal Cancer Cells Depends on Mitochondrial Oxidative Metabolism. Biochim Biophys Acta 2015; 1852(9): 1719-28
12- Venesio T, Balsamo A, Errichiello E, Ranzani GN, Risio M. Oxidative DNA Damage Drives Carcinogenesis in MUTYH-Associated-Polyposis by Specific Mutations of Mitochondrial and MAPK Genes. Mod Pathol 2013; 26(10): 1371-81.
13- Wallace DC. Mitochondria and Cancer. Nat Rev Cancer 2012; 12(10): 685-98
14- Dirican E, Savrun ŞT, Aydın İE, Gülbay G, Karaman Ü. Analysis of Mitochondrial DNA Cytochrome‐B (CYB) and Atpase‐6 Gene Mutations in COVID‐19 Patients. J Med Virol 2022; 94(7): 3138-46.
15- Kozakiewicz P, Grzybowska-Szatkowska L, Ciesielka M, Całka P, Osuchowski J, Szmygin P, et al. Mitochondrial DNA Changes in Genes of Respiratory Complexes III, IV and V Could Be Related to Brain Tumours in Humans. Int J Mol Sci 2022; 23(20): 12131.
16- Desurmont T, Lefèvre JH, Shields C, Colas C, Tiret E, Parc Y. Desmoid Tumour in Familial Adenomatous Polyposis Patients: Responses to Treatments. Fam Cancer 2015; 14(1): 31-9.
17- Guzy RD, Schumacker PT. Oxygen Sensing by Mitochondria at Complex III: The Paradox of Increased Reactive Oxygen Species during Hypoxia. Exp Physiol 2006; 91(5): 807-19.
18- Vives-Bauza C, Andreu AL, Manfredi G, Beal MF, Janetzky B, Gruenewald TH, Lin MT. Sequence Analysis of the Entire Mitochondrial Genome in Parkinson's Disease. Biochem Biophy Res Commun 2002; 290(5): 1593-601.
19- Jonckheere AI, Smeitink JA, Rodenburg RJ. Mitochondrial ATP Synthase: Architecture, Function and Pathology. J Inherit Metab Dis 2012; 35(2): 211-25.
20- Shin Y-K, Yoo BC, Chang HJ, Jeon E, Hong S-H, Jung M-S, et al. Down-Regulation of Mitochondrial F1F0-ATP Synthase in Human Colon Cancer Cells with Induced 5-Fluorouracil Resistance. Cancer Res 2005; 65(8): 3162-70.
21- Feichtinger RG, Schäfer G, Seifarth C, Mayr JA, Kofler B, Klocker H. Reduced Levels of ATP Synthase Subunit ATP5F1A Correlate with Earlier-Onset Prostate Cancer. Oxid Med Cell Longev 2018; 2018: 1347174.
22- Penta JS, Johnson F, Wachsman JT, Copeland WC. Mitochondrial DNA in Human Malignancy. Mutat Res 2001; 488(2): 119-33
23- Connor TM, Hoer S, Mallett A, Gale DP, Gomez-Duran A, Posse V, et al. Mutations in Mitochondrial DNA Causing Tubulointerstitial Kidney Disease. Plos Genetics 2017; 13(3): E1006620.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







