دوره 31، شماره 2 - ( اردیبهشت 1402 )
جلد 31 شماره 2 صفحات 6395-6378 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zare B, Daryanoosh F, Rezaei R, Nemati J, Hemmatinafar M. Effect of Eight Weeks of High-Intensity Intermittent Swimming Training on the Biochemical Factors of Lipid Metabolism and Hippocampal Memory Function of Male Rats with Non-Alcoholic Steatohepatitis (NASH). JSSU 2023; 31 (2) :6378-6395
URL: http://jssu.ssu.ac.ir/article-1-5869-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5869-fa.html
زارع بهاره، دریانوش فرهاد، رضایی رسول، نعمتی جواد، همتی نفر محمد. تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر عوامل بیوشیمیایی متابولیسم لیپید و عملکرد حافظه هیپوکمپ موش های صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NASH). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (2) :6378-6395
واژههای کلیدی: استئاتوهپاتیت غیرالکلی، شنای تناوبی با شدت بالا، FNDC5، هیپوکمپ، آیریزین، متابولیسم لیپید، عملکرد حافظه
متن کامل [PDF 1019 kb]
(668 دریافت)
| چکیده (HTML) (1936 مشاهده)
متن کامل: (1582 مشاهده)
مقدمه
Non-alcoholic fatty liver disease (NAFLD) از استئاتوز ساده (تجمع چربی در کبد، عمدتاً تریگلیسیرید) تا Nonalcoholic steatohepatitis (NASH) و با تحریک مسیر استرس لیپوپراکسیداتیو همراه با سندرمهای متابولیک مختلف است که میتوان به مقاومت به انسولین، افزایش خطر دیابت نوع دو و بیماریهای قلبی- عروقی اشاره کرد (1). مقاومت به انسولین و هیپرانسولینمی مزمن ناشی از بیماری استئاتوهپاتیت غیرالکلی، انتقال انسولین به مغز را با وضعیت کمبود انسولین مغز تنظیم میکند که با اختلالات حافظه مرتبط با سن و بیماری آلزایمر مرتبط است (2). مقاومت به انسولین و متعاقب آن هیپرانسولینمی ممکن است منجر به تغییر در مسیرهای کبدی جذب، سنتز، تجزیه و ترشح اسیدهای چرب آزاد شود و سپس منجر به آسیب کبدی و پیشرفت بیماری میشود (3). انجام فعالیت ورزشی منظم اثرات مفیدی بر سـلامـت مـغـز داشته و اثرات مخرب بیماریهای عصبی مانـنـد آلـزایـمـر، پارکینسون و افسردگی و بیماریهای متابولیکی مانند دیابت نوع دو را کاهش میدهد. یکی از مولکولهای مهمی که اثرات مفید فعالیت ورزشی را بر هیپوکمپ القاء میکند، (FNDC5) Fibronectin type III domain-containing protein 5 است. این پروتئین علاوه بر عضله اسکلتی در مغز نیز بیان میشود و نشان داده شـده جـدا کردن ژن FNDC5 در نورونهای نابالغ، سبب توقف رشـدی نورونها و عدم تبدیل آنها به نورونهـای بـالـغ میشود (4). به تازگی Wrann و همکاران، نشان دادهاند کـه 32 روز فعالیت ورزشی اختیاری بر روی چرخ گردان در موشهای نـر شش هفتهای، منجر به افزایش بیان ژنهای Peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1α)، FNDC5 و (BDNF) Brain-Derived Neurotrophic Factor در هیپوکمپ میشود (5). با این وجود، نتایج در ایـن زمینه ضد و نقیض است (6). در تحقیقی پیشنهاد شده است که مسیر Irisin/PGC1α/ FNDC5/ BDNF ناشی از فعالیت ورزشی وجود دارد که باعث تأثیر ورزش از طریق عضله اسکلتی بر مغز میشود. همه این دادهها نشان میدهد که FNDC5 ممکن است تمایز عصبی را تسهیل کند و باعث افزایش عملکرد حافظه شود (7). بر خلاف پیشساز FNDC5 برای آیریزین، این هورمون کمتر نشان داده شده است که به طور مستقیم نوروژنز و عملکرد حافظه را تنظیم کند (8). در مقابل، مطالعه اخیر توسط Tu و همکاران، نشان میدهد که بیان بیش از حد FNDC5 کبدی باعث بیان BNDF و سایر ژنهای محافظت کننده عصبی در هیپوکمپ میشود. این اثر احتمالاً با واسطه آیریزین انجام میشود، زیرا سطح گردش آن بهطور قابل توجهی افزایش یافته بود. بیان بیش از حد محیطی FNDC5 باعث افزایش بیانBDNF در هیپوکمپ میشود و این مطلب را بیان میکند که آیریزین ممکن است برای بهبود یادگیری و حافظه توسط مسیر BDNF عمل کند (9). این نتایج همراه با یافتهها مبنی بر اینکه ورزش استقامتی سطوح آیریزین در گردش را افزایش میدهد، عملکرد نوروتروفیک بالقوه آیریزین را نشان میدهد. بنابراین آیریزین ممکن است یک مولکول حیاتی باشد که اثرات مفید فعالیت بدنی منظم را با بهبود عصبی رفتاری مرتبط میکند. این مفهوم بیشتر توسط مطالعات اخیر پشتیبانی میشود (10). با اینحال این مطلب که آیا آیریزین عملکرد هیپوکامپ را از طریق یک مکانیسم مستقیم یا غیرمستقیم تنظیم میکند یا نه، باید بیشتر بررسی شود (11). افزایش مزمن گلوکز خون و فشار خون در بیماران مبتلا به سندروم متابولیک خود مانع نروژنز خواهد گردید که در نتیجه این احتمال وجود دارد که با کاهش فعالیت مسیر Irisin/ FNDC5/ BDNF حجم مغز نیز کاهش یافته و در پی آن، کاهش عملکرد شناختی اتفاق بیفتد (12). از اینرو استراتژیهای درمانی برای این بیماری و عوارض آن بسیار حائز اهمیت است. از جمله استراتژیهای درمانی موثر و کم هزینه، فعالیت ورزشی منظم میباشد. فعالیت بدنی منظم با بهبود عملکرد شناختی، یادگیری و حافظه در موشها در ارتباط است (13). یک رژیم با چربی تام بالا، سطح عملکرد حافظه در حیوانات را کاهش میدهد اما ورزش میتواند این کاهش را معکوس کند (14). بهدنبال تمرین با شدت متوسط، عملکرد مربوط به حافظه فضایی در موش¬ها را بهبود میبخشد (15). از سوی دیگر در تحقیقات متعددی ارتباط معکوس بین عملکرد حافظه و فعالیت ورزشی نشان داده شده است (18-16). با توجه به نتایج متناقض تحقیقات گذشته درباره فعالیت بدنی و دلایل مسیرهای بیوشیمیایی تغییرات آن از جمله مسیر بیوشیمیایی Irisin/FNDC5 هم چنان بر سر تاثیرات فعالیت ورزشی بر عملکرد حافظه و مسیرهای ذکر شده مورد بحث است. اکثر پژوهش ها بر تمرینات ورزشی در خشکی متمرکز شده اند و و نتایج ضدو نقیضی از تاثیر این نوع تمرینات بر بهبود عملکرد حافظه در بیماران NASH گزارش کردهاند. از طرف دیگر پژوهش های بسیار اندکی درباره تاثیر محیط آبی و شنا بر میزان بهبود عملکرد حافظه در بیماران NASH وجود دارند (15). بهطوری¬که Alomari و همکاران، تمرین شنای اجباری و دویدن اختیاری بر عملکرد حافظه در موشهای صحرایی سالم را مورد مقایسه قرار دادند و به این نتیجه رسیدند که عملکرد حافظه در هر دو گروه نسبت به گروه کنترل افزایش یافته است (6). در تحقیقی دیگر که توسط Khabour و همکاران انجام شد پس از شش هفته تمرین شنای تداومی؛ افزایش معنادار عملکرد حافظه در موشهای صحرایی سالم نسبت به کنترل مشاهده شد (19). از طرف دیگر مسیرهای بیوشیمیایی این افزایش یا کاهش عملکرد حافظه در هیپوکمپ مغز ناشی از فعالیت ورزشی شنای تناوبی با شدت بالا از جمله مسیر Irisin/ FNDC5/ BDNF در جامعه آماری بیماران مبتلا به استئاتوهپاتیت غیرالکلی بسیار کم مطالعه شده است و هم-چنان بر سر آن اختلاف نظر وجود دارد. در نتیجه تحقیق حاضر با هدف تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر عوامل بیوشیمیایی متابولیسم لیپید و عملکرد حافظه هیپوکمپ موشهای صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NASH) خواهد بود.
روش بررسی
پژوهش حاضر با توجه به هدف از نوع توسعهای- بنیادی و با در نظر گرفتن روش از نوع تجربی بود. در این پژوهش، 40 سر موش صحرایی نر (سن: 6 تا 8 هفته) از نژاد Sprague –Dawley با میانگین وزن 20 ± 230 گرم انتخاب شدند. موشهای صحرایی در حیوان¬خانه دانشگاه شیراز با دمای 22 تا 24 درجه سانتیگراد، رطوبت 45 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به¬صورت آزادانه در ظرف 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه شیراز مورد توجه قرار گرفت. موشهای صحرایی انتخاب شده در دو گروه سالم با دریافت غذای استاندارد (20= n) و گروه غذای پرچرب (20= n) که با دریافت غذای پرچرب منجر به بیماری استئاتوهپاتیت غیرالکلی گردید، قرار گرفتند.
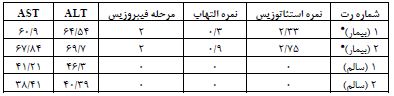
رژیم امولسیون پرچرب، از 77 درصد از چربی، 14 درصد پروتئین و 9 درصد کربوهیدراتها تشکیل شد. محتوای این امولسیون شامل روغن ذرت، ساکارز، پودر شیر خشک، کلسترول، سدیم دزوکسیکولات، توئین80، پروپیلین گلایکول، مخلوط ویتامین و مواد معدنی و آب مقطر بود. در این امولسیون، پروتئینها توسط پودر شیر خشک، کربوهیدراتها توسط ساکاروز و چربی توسط روغن ذرت و کلسترول تأمین شدند. هر وعده با مخلوطی از ویتامین و مواد معدنی تکمیل شد. این امولسیون در دمای 4 درجه سانتیگراد ذخیره، در حمام آب با دمای 42 درجه سانتیگراد گرم و قبل از استفاده کاملاً میکس و مخلوط شد (20). در گروه رژیم پرچرب علاوه بر غذای روزانه استاندارد جوندگان، بهصورت خوراکی و توسط تکنیک گاواژ، موش¬های صحرایی با امولسیون پرچرب (10 میلیلیتر در کیلوگرم) یک بار در روز تحت گاواژ قرار گرفتند. به موشهای صحرایی گروه سالم نیز از طریق تکنیک گاواژ، روزانه مقدار مساوی محلول نمک (سالین) داده شد. این شیوه تغذیهای بهمدت هشت هفته ادامه داشت تا بر اساس مقالات پیشینه بیماری استئاتوهپاتیت غیرالکلی در موش¬های صحرایی القا شود. در پایان دوره القا بیماری استئاتوهپاتیت غیرالکلی، جهت اثبات ایجاد بیماری NASH، بهطور تصادفی از گروه بیمار و سالم، جداگانه، دو رت کشتار شدند و پس از این¬که آنالیزهای مربوطه توسط متخصص پاتولوژیست از بافت کبد آنها انجام شد، نتایج زیر بهدست آمد. رنگآمیزی Oil red O: ابتدا بافت کبد در ایزوپنتان (isopentane) غوطه¬ور و در دمای برش بهینه Tissue-Plus® (OCT) (Fisher HealthCareTM برش داده شد. نمونههای کبد بر روی یک کرایواستات (CM3050S،Leica Microsystems، Nussloch، ساخت کشور آلمان) به برش¬هایی به ضخامت پنج میکرومتر برش داده شدند. مقاطع کبد با Oil Red O (105230, Merck, Darmstadt, Germany) رنگ-آمیزی شدند. تصاویر زیر یک میکروسکوپ نوری (CX22، Olympus، توکیو، ژاپن) مشاهده شد و از یک میدان تصادفی 40X از کبد هر حیوان با استفاده از نرمافزار Toup View (ToupTekPhotonics، Zhejiang، چین) گرفته شد (21). یک میدان میکروسکوپی نوری در هر بخش مشاهده شد و برای شدت استئاتوز کبدی، التهاب و فیبروز بر اساس معیارهای زیر نمره گذاری شد: برای استئاتوز کبدی: درجه صفر، بدون چربی. درجه یک، استئاتوز کمتر از 33 درصد از پارانشیم کبدی را اشغال میکند. درجه دو، 34 تا 66 درصد از پارانشیم کبدی. درجه سه، بیش از 66 درصد از پارانشیم کبدی. برای انفیلتراسیون التهاب سلولی: درجه صفر: هیچ foci/field. درجه یک، 1-2 foci/field. درجه 2، 3-4 foci/field. درجه 3، بیش از 4 foci/field. مرحلهبندی فیبروز کبدی با رنگآمیزی Oil red O به شرح زیر بررسی شد: صفر، هیچ؛ یک، خفیف، منطقه (zone) 3، پریسینوزوئیدال (perisinusoidal)؛ دو، متوسط، منطقه 3، پریسینوزوئیدال؛ سه، پورتال/پریپورتال؛ چهار، فیبروزیس (bridging fibrosis) (22). همانگونه که در جدول 1 نشان داده شده است در نمونههای بیمار 1 و 2 پس از هشت هفته تغذیه با رژیم پرچرب نمره استئاتوزیس و التهاب، مقادیر سرمی آلانین آمینوترتسفراز (ALT) و آسپارتات-آمینوترنسفراز (AST) و همچنین آنالیز بافتی کبد نشان داد که کبد رتها در مرحله دوم فیبروزیس قرار دارد. همچنین در شکل 1، تصاویر کیفی از نمونههای کبد سالم و بیمار آورده شده است. در قسمت A از شکل 1 قطرات چربی به رنگ قرمز در آمدهاند و به عنوان نمونه با پیکان¬های مشکی نشان داده شدهاند و در قسمت B از شکل 1 نمونه کبد سالم در زیر میکروسکوپ نشان داده شده است و هیچ لکه قرمز در آن وجود ندارد و این بدین معنی است که تجمع چربی در آن رخ نداده است. پس از اثبات القا بیماری در موشهای صحرایی، گروه بیمار (رژیم پرچرب) بهطور تصادفی به دو گروه بیماربی-تحرک (9= n)، بیمار-شنا (9= n) و گروه سالم نیز به¬طور تصادفی به دو گروه سالم بیتحرک (9= n)، گروه سالم - شنا (9= n) تقسیم شدند. لازم به ذکر است رژیم غذایی پرچرب گروه¬های بیمار تا پایان دوره تمرینات ادامه داشت. پس از تقسیمبندی گروهها، همه موشهای صحرایی گروههای تمرین بهمدت دو هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتی و ارتفاع 80 سانتیمتر) را قبل از شروع تمرین اصلی گذراندند (23). در هفته اول موشهای صحرایی با نهایت دقت و آرامش در استخر حیوانات با عمق آب 50 سانتیمتر و میانگین دمای 0/5 ± 30 درجه سانتیگراد قرار گرفتند و با سرعت دلخواه به مدت 20 دقیقه به طور متناوب شنا کردند. در هفته دوم که موشهای صحرایی بهخوبی با استخر حیوانات آشنا شدند؛ برای آشنایی با نوع تمرین تناوبی، چندین مرتبه بعد از یک دقیقه شنا بهوسیله صفحه استراحت از آب بیرون آورده و دوباره در آب قرار داده شدند. بعد از گذشت 48 ساعت از زمان آخرین جلسه آشنایی، موشهای صحرایی گروه تمرین، ابتدا 5 دقیقه گرم کردن و سپس تمرین اصلی HIIT (تمرین تناوبی با شدت بالا) شنا، شامل 20 نوبت 30 ثانیهای شنا با 30 ثانیه استراحت بین هر نوبت را انجام دادند. در پایان هر برنامه تمرینی نیز 5 دقیقه عمل سرد کردن اعمال شد و سپس تمام موشهای صحرایی کاملاً خشک شده و به قفسهایشان منتقل شدند. این برنامه ورزشی بهمدت هشت هفته (سه روز در هفته، روزهای زوج) انجام شد. در تمرین تناوبی بار اعمال شده در هفته اول، وزنهای به میزان 7 درصد وزن بدن هر موش صحرایی بود و هر هفته یک درصد به آن اضافه شد؛ بهطوریکه در هفته آخر (هشتم) موشهای صحرایی با وزنهای به میزان 14 درصد وزن بدن خود که به ریشه دم آنها بسته شد، شنا کردند (جدول2) (24). تمرینات، عصرهنگام (بهترین زمان تمرین در ریتم فعالیتی طبیعی موشهای صحرایی) انجام شد (25). در مدت دوره تداخل، گروه کنترل هیچگونه برنامه تمرینی نداشتند. برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین، موشهای صحرایی با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (سه تا پنج میلیگرم بر کیلوگرم وزن بدن)، بی هوش شدند. ابتدا نمونه-های خونی از قلب رتها به میزان 5 سی سی گرفته شد؛ بلافاصله آن را در داخل لوله آزمایش ژل کلات اکتیویتر انتقال داده و سپس توسط سانترفیوژ با سرعت 3000 دور بر دقیقه و دمای 18 درجه سانتی گراد به مدت 20 دقیقه سانترفیوژ شدند. پس از آن توسط سمپلر به میکروتیوبهای 2 سی سی سرم خون منتقل شد و برای آنالیز نهایی در دمای منهای 20 درجه سانتی گراد نگهداری شدند. سپس بافت هیپوکمپ مغز از بدن حیوانات استخراج و در سرم فیزیولوژیک شستشو داده شد و سپس بلافاصله در دمای منهای 80 درجه سانتیگراد فریز شد. با استفاده از روش آزمایشگاهی الایزا، اسید چرب آزاد توسط کیتهای تشخیصی از شرکت سیگما آلدریچ (شماره کاتالوگ: 74385) از سرم خون اندازه¬گیری شد. همچنین جهت اندازهگیری پروتئین بافتی، بافت هیپوکمپ پس از جداسازی، بلافاصله در تانک ازت در دمای منهای 196 درجه سانتیگراد نگهداری شد. برای اندازه گیری آیریزین بافت هیپوکمپ مغز از کیت الایزای مخصوص رت به شماره کاتالوگ LS-F23902 از شرکت LifeSpan BioSciences, Inc. استفاده شد. سپس جهت انجام تکنیک وسترن بلات و آنالیزهای نهایی پروتئین FNDC5 به آزمایشگاه منتقل شد. بهطور خلاصه، برای لیز کردن بافت¬ها از Lysis buffer با ترکیب (Tris-HCL: 500µL, PH=8, EDTA: 0.003gr, NaCl: 0.08gr, Sodium Deoxycholate: 0.025gr, SDS: 0.01gr, Protease inhibitor cocktail: 1 tablet, NP40((1%))Triton: 10 μl) استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر منهای 20 درجه سانتیگراد نگهداری و سپس غلظت پروتئین به وسیله بردفورد تعیین گشت. نمونههای پروتئینی تهیه شده قبل از ریخته شدن در چاهک با بافر نمونه (Tris (*PH=6.8): 0.6ml, Glycerol: 2.5mgr, ᵦ-mercapto ethanol: 0.5mgr, Bromo phenol bule: 0.01gr, SDS:0.2gr ) هم غلظت و مخلوط شده و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شدند. سپس ساخت الکتروفوژ بر روی ژل SDS page انجام شد. پس از آن محلولهای استوک اکریل آمید 30/8 درصد (acrylamide: 15gr, Bais acrylamide: 0.4gr, water: 50ml)، بافر ژل پایین (Tris: 9.1gr, SDS:0.2gr, water:50 ml, PH=8.8)، بافر ژل بالا (Tris:3.5gr, SDS:0.2gr, water:50ml, PH=-6.8) و بافر ژل تانک الکتروفوز (Tris:1.5gr, SDS:1.5gr, Clycine: 7.2gr, water: 500ml) تهیه گردیدند. پس از آن ژل پایین (بافر ژل پایین: 2/5 میلیلیتر، استوک آکریل آمید:3/3 میلیلیتر، آب مقطر: 4/1 میلیلیتر، APS10%=0.1 ml، TEMED 10%= 0.06 ml)، ژل بالا (بافر ژل بالا: 1/25 میلیلیتر، استوک اکریل آمید: 0/81 میلیلیتر، آب مقطر: 2/9 میلیلیتر، APS10%= 0.5 ml، TEMED10%= 0.003ml) تهیه شدند. پس از این مرحله الکتروفورز بر ژل SDS page انجام شد. در مرحله وسترن بلات یا ایمنوبلاتینگ ابتدا مرحله انتقال از ژل به کاغذ PVDF انجام شد و سپس مرحله بلاکینگ صورت گرفت. پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه (β-Actin (C4): sc-47778, Anti-FNDC5 antibody ab131390) مخلوط و رقیق شده است، به مدت 16 تا 18 ساعت انکوبه گردید. سپس کاغذ سه بار و هر بار به مدت 15 دقیقه با بافر TBS-T (Tris-HCL: 20ml, Sudium chloride: 8gr, Tween20 0.1 v/v: 1ml, Distal water: 100 ml) شستوشو داده شد. سپس کاغذ با آنتیبادی ثانویه (m-IgGκ BP-HRP: sc-516102, mouse anti-rabbit IgG-HRP: sc-2357)، با غلظت (1:1000) برای تمام آنتیبادیهای اولیه به مدت یک ساعت و 15 دقیقه در دمای اتاق شیک گردید. در پایان این مرحله نیز کاغذ سه بار و هر بار به مدت 15 دقیقه با بافر TBS-T شستوشو داده شد. سپس مرحله آشکارسازی باند پروتئینی مورد نظر با استفاده از کیتهای Chemoluminescnce انجام شد. برای مشاهده باند پروتئینی مورد نظر مراحل ظهور فیلم در تاریکخانه و روش Striping (Mercaptanol: 208 μl, Tris,IM: 12.5 ml, SDS: 4gr,Water: 200ml) انجام گردید (26).
تجزیه و تحلیل آماری
در بخش آمار توصیفی از شاخصهای پراکندگی، میانگین، انحراف معیار و نمودار؛ و در بخش آمار استنباطی برای تعیین نحوه توزیع دادهها از آزمون شاپیرو ویلک استفاده شد. در صورت طبیعی بودن دادهها، از روش تجزیه و تحلیل واریانس یک طرفه استفاده گردید و در صورت معنادار بودن تفاوتها، آزمون از تعقیبی بونفرونی برای تعیین محل دقیق تفاوت ها به کار رفت. سطح معنیداری (0/05>P) بود. کلیه روش های آماری با استفاده از نرمافزارversion 16 SPSS صورت گرفت و نمودارها با نرمافزار Excel2019 ترسیم شدند.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شیراز مورد تایید قرار گرفته است (IR.SUMS.REHAB.REC.1400.008).
جدول 1: نتایج آزمایش بافتی و خونی جهت اثبات بیماری
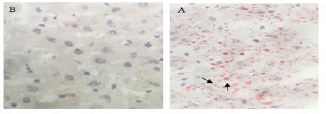
شکل1: رنگ آمیزی بافت کبد توسط Oil red O، A: کبد چرب، لیپیدها به رنگ قرمز درآمده¬اند.
B: کبد سالم- به دلیل عدم وجود چربی هیچ نوع رنگ قرمزی به خود نگرفته است.
جدول2: پروتکل تناوبی شنا با شدت بالا
.JPG)
نتایج
در نمودار 1 میانگین± انحراف معیار وزن گروههای سالم (20=n) و رژیم پرچرب (HFD) (20=n)، در مدت هشت هفته القا رژیم پرچرب نمایش داده شده است. اولین هفته به عنوان سازگاری رتها با محیط آزمایشگاه در نظر گرفته شد و پس از آن دوره هشت هفته ای القا رژیم پرچرب ادامه یافت.
نمودار 2، وزن گروه های تحقیق پس از اثبات بیماری استئاتوهپاتیت غیرالکلی و تقسیم بندی تصادفی آن ها به چهار گروه سالم بیتحرک (9= n)، سالم-شنا (9= n)، بیمار بی-تحرک (9= n) و بیمار-شنا (9= n)، نشان میدهد. در این نمودار هفتههای اول و دوم جهت آشنایی و سازگاری موشهای صحرایی با محیط استخر و نوع تمرین در نظر گرفته شد. هفته¬های یک تا هشت، بازه تمرین اصلی مطابق پروتکل ارائه شده بود و هفته نهم، هفته تشریح موشهای صحرایی گروههای آزمایش بود. بر اساس میانگین وزن هر گروه در کل دوره مداخله تمرینی مشخص شد بین گروههای کنترل-سالم و سالم- شنا (0/003=P) و میان گروههای کنترل-بیمار و سالم-شنا (0/002=P) تفاوت معنادار وجود دارد. در متغیر پروتئین FNDC5 هیپوکمپ مغز، افزایش معنادار در گروه سالم-شنا نسبت به بیمار بی¬تحرک (0/014=P) و بیمار-شنا (0/029=P) مشاهده شد. با این حال به میزان 35/16 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک مشاهده شد. شکل یک به مقایسه نتایج وسترن بلات بین گروهها پرداخته است. در سطر اول شکل 1 بتااکتین با وزن مولکولی 43 کیلودالتون و در سطر دوم میزان غلظت پروتئین FNDC5 هیپوکمپ مغز با وزن مولکولی 22 کیلودالتون میباشد. میزان پهنا و شدت رنگ هر باند پروتئین FNDC5 نسبت به بتااکیتن آن در هر گروه نشاندهنده غلظت این پروتئین است.
در نمودار 3 میزان پروتئین FNDC5 هیپوکمپ مغز به صورت کمی نشان داده شده است. گروه سالم بیتحرک به عنوان معیار، عدد یک درنظر گرفته شده است و مابقی گروهها نسبت به گروه سالم-بی¬تحرک میزان کمی پروتئین آنها سنجیده شده است.
نمودار4، متغیر پروتئین آیریزین هیپوکمپ مغز نشان میدهد. در این متغیر افزایش معنادار در گروه سالم-بیتحرک نسبت به سالم-شنا(0/004=P) ، بیمار بیتحرک (0/001=P) و بیمار-شنا (0/001=P) مشاهده شد. با این حال به میزان 16/34 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک (نمودار4) وجود داشت.
نمودار5، متغیر پروتئین اسید چرب آزاد (FFA) سرم خون را نشان میدهد. در این متغیر کاهش معنادار در گروه سالم-بیتحرک نسبت به سالم-شنا (0/001=P)، بیمار بیتحرک (0/001=P) و بیمار-شنا (0/001=P) مشاهده شد. با این حال به میزان 16/34 درصد کاهش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک وجود داشت (نمودار5).
در متغیر زمان رسیدن به سکو (T) در آزمون ماز آبی موریس، افزایش معنادار در گروه بیمار-بیتحرک نسبت به سالم-بیتحرک (0/025=P)، سالم- شنا (0/01=P) و بیمار-شنا (0/048=P) (شکل A) و در متغیر مسافت پیموده شده در منطقه سکو (Q2) در آزمون موریس میز، افزایش معنادار در گروه سالم-بیتحرک نسبت به بیمار-بیتحرک(0/002=P) و بیمار- شنا (0/02=P) مشاهده شد. با این حال به میزان 9/78 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک (شکل B) و در متغیر زمان سپری شده در منطقه سکو (TQ2) در آزمون موریس میز، در هیچ یک از گروه ها تفاوت معنادار مشاهده نشد. با اینحال به میزان 19/37 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک مشاهده شد (شکل C).

نمودار 1: میانگین± انحراف معیار تغییرات وزن گروههای سالم و رژیم پرچرب در هشت هفته اول القا کبد چرب، در ابتدا یک هفته به عنوان سازگاری رتها با محیط آزمایشگاه و رژیم غذایی در نظر گرفته شد.
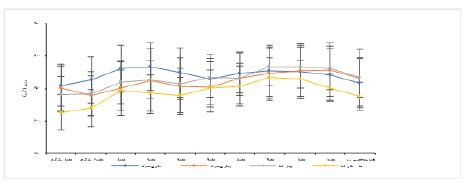
نمودار 2: میانگین± انحراف معیار تغییرات وزن چهار گروه آزمایش در هشت هفته دوم پس از اثبات بیماری استئاتوهپاتیت غیرالکلی، در ابتدا دو هفته به عنوان سازگاری رتها با محیط تمرین در نظر گرفته شد و سپس از هفتههای یک تا هشت تمرین اصلی مطابق پروتکل تمرینی انجام شد. هفته نهم، هفته تشریح رتها بود.
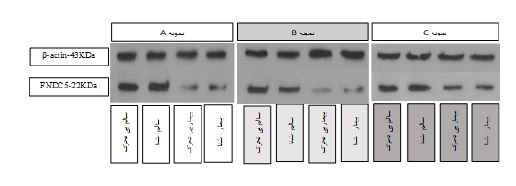
شکل2: مقایسه نتایج وسترن بلات در پروتئین FNDC5 هیپوکمپ مغز، باندهای سطر دوم نشاندهنده غلظت پروتئین هستند و نسبت به بتااکتین در سطر اول مقایسه میشوند.
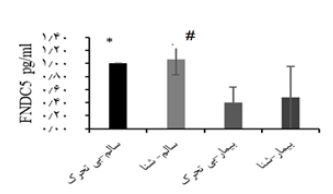
نمودار3: میزان پروتئین FNDC5 درون هیپوکمپ مغز در میان چهار گروه-
*: تفاوت معنادار بین گروه سالم بیتحرک با بیمار بیتحرک.
#: گروه سالم-شنا با بیمار-شنا و بیمار-بیتحرک- (0/05>p)

نمودار4: سطح پروتئین آیریزین هیپوکمپ مغز در میان چهار گروه-
*: تفاوت معنادار بین گروه سالم-بیتحرک با بیمار-بیتحرک، بیمار-شنا و سالم-شنا- (0/05>p)

نمودار 5: اسید چرب آزاد سرم خون در میان چهار گروه- *: تفاوت معنادار بین گروه سالم-بیتحرک با بیمار-بیتحرک، بیمار-شنا و سالم-شنا -(0/05>p).
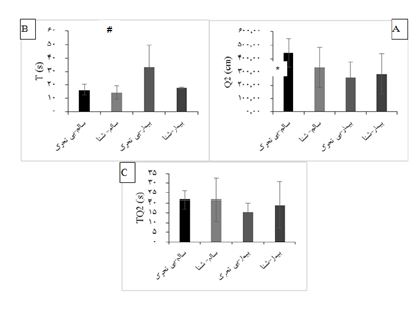
نمودار6: شکل A: زمان رسیدن به سکو (T) در میان چهار گروه-
*: تفاوت معنادار بین گروه بیمار بیتحرک با سالم-بیتحرک، بیمار-شنا، سالم-شنا- (0/05>p)- شکل B: مسافت پیموده شده در منطقه سکو (Q2) در میان چهار گروه- #: تفاوت معنادار بین گروه سالم بیتحرک با ، بیمار-شنا ، بیمار بیتحرک (0/05>p)- شکل C: زمان سپری شده در منطقه سکو (Q2) در میان چهار گروه- عدم معناداری میان چهار گروه (05/0>p)
بحث
نتایج پژوهش حاضر را میتوان با نتایج برخی پژوهشها از جمله پژوهش Azimi Dokht و همکاران مقایسه کرد. آنها در پژوهش خود تأثیر هشت هفته تمرین اجباری باشدت کم روی نوارگردان بر بیان ژن FNDC5، PGC-1α و BDNF در هیپوکمپ موشهای صحرایی نر نژاد ویستار را مورد سنجش قرار دادند. در هر سه متغیر مورد ارزیابی در تحقیق مذکور افزایش معنادار در گروه تمرین اجباری نسبت به کنترل مشاهده شد (27). در تحقیق حاضر نیز افزایش غیرمعنادار در گروه سالم-شنا نسبت به کنترل مشاهده شد که از جمله دلایل عدم معناداری نسبت به تحقیق Azimi Dokht میتوان به نوع و محیط پروتکل تمرین اشاره کرد؛ که در تحقیق حاضر تمرینات شنای تناوبی با شدت بالا در محیط آبی، سه روز در هفته به مدت هشت هفته و در تحقیق مذکور تمرینات تداومی اجباری روی نوار گردان، پنج روز در هفته به مدت هشت هفته بود. همچنین از جمله دلایل مغایرت نتایج تحقیقAzimi Dokht و همکاران با نتایج تحقیق حاضر در متغیر FNDC5 میتوان به نوع آزمودنیها اشاره کرد. آزمودنیهای تحقیق حاضر دائما رژیم پرچرب 77 درصد مصرف میکردند و مبتلا به بیماری استئاتوهپاتیت غیر الکلی بودند و همچنین نژاد رتها از نوع اسپراگوداولی بود اما در تحقیق عظیمی دخت و همکاران نژاد رتها از نوع ویستار و همه رتها سالم بودند و از رژیم استاندارد استفاده میکردند. همچنین نحوه سنجش ارزیابی FNDC5 نیز در معناداری این پروتئین موثر است بهطوری که در تحقیق حاضر از سنجش اندازه پروتئین FNDC5 از طریق تکنیک وسترن بلات که یکی از دقیقترین تکنیکهای آزمایشگاهی محسوب میشود استفاده شد اما در تحقیق Azimi Dokht و همکاران از تکنیک ریل تایم PCR و بیان ژن FNDC5 استفاده شد که به نسبت روش مورد استفاده در تحقیق حاضر از دقت پایینتری برخوردار است. با اینوجود در هر دو تحقیق عملکرد حافظه در گروه تمرین نسبت به بیتحرک بهبود معناداری داشت. این نشان میدهد که تغییرات بیوشیمیایی در بافت هیپوکمپ نسبت به سازگاریهای رفتاری و محیطی با تاخیر انجام می¬شود. Hegazy و همکاران تحقیقی را با هدف اثر ورزش شنا و مصرف مکمل ال-کارنوزین خوراکی بر میزان آیریزین هیپوکمپ مغز و عملکرد حافظه در رتهای مبتلا به آلزایمر مورد ارزیابی قرار دادند. در پایان آنها نتیجه گرفتند که ورزش شنا به تنهایی و ورزش شنا+مکمل الکارنوزین باعث افزایش معنادار آیریزین هیپوکمپ مغز و عملکرد حافظه میشود (28). در تحقیق حاضر نیز آیریزین هیپوکمپ مغز گروه بیمار-شنا نسبت به بیمار بی-تحرک افزایش داشت اما غیرمعنادار بود. از جمله دلایل تناقض در نتیجه تحقیق حاضر با تحقیق Hegazy و همکاران می¬توان به نوع آزمودنیها اشاره کرد؛ بهطوری که در تحقیق حاضر آزمودنیها دائما رژیم پرچرب 77درصد در اختیارشان بود و مصرف میکردند و به بیماری اختلال کبدی استئاتوهپاتیت غیرالکلی دچار بودند با اینحال در تحقیق Hegazy و همکاران آزمودنیها دارای بیماری آلزایمر و دارای وزن طبیعی بودند و همچنین غذای استاندارد مصرف میکردند. این نتایج خطرات زیانبار مصرف دائمی رژیم پرچرب و اختلال عملکرد کبد در بیماری استئاتوهپاتیت غیرالکلی را بر پروتئینهای آیریزین و FNDC5 و به تبع آن افزایش غلظت اسید چرب آزاد را در گروه بیمار بیتحرک نشان میدهد که با افت عملکرد حافظه همراه بود با اینحال در گروه بیمار-شنا، شنای تناوبی با شدت بالا توانست به مقدار زیادی افت آیریزین و FNDC5 و عملکرد حافظه را کاهش دهد؛ اما به اندازهای نبود که بتواند همانند تحقیق Hegazy و همکاران در بیماران آلزایمر موجب افزایش معنادار آن شود و این مطلب نشان دهنده خطر بالقوه مصرف دائمی رژیم پرچرب و اختلال عملکرد کبد است و میتواند به شدت بر هیپوکمپ مغز تاثیر منفی بگذارد. بسیاری از پروتکل-های ورزشی که افزایشی در FNDC5 مشاهده نکردند، افزایشی در PGC1α (تنظیمکننده رونویسی آن) و یا حتی تغییراتی در آن نیز مشاهده نکردند (29). عوامل دیگری که باعث تناقض در نتایج میشود را میتوان به پروتکل ورزشی مورد استفاده، نحوه ورزش، نقطه زمانی نمونهگیری و جمعیت مورد مطالعه اشاره کرد (29). Wrann و همکاران، پژوهشی را با هدف تاثیر سی روز فعالیت ورزشی اختیاری روی چرخگردان در موشهای C57/B16 بر روی میزان عوامل بیوشیمیایی موثر بر حافظه در بافت هیپوکمپ انجام دادند. PGC-1α، FNDC5 و BDNF پس از سی روز فعالیت در بافت هیپوکمپ افزایش معنادار یافت (11). از جمله دلایل مغایرت نتایج این تحقیق با تحقیق حاضر میتوان به نوع آزمودنی اشاره کرد؛ به طوری که در تحقیق Wrann و همکاران از مدل موشهای C57/B16 و سالم با وزن طبیعی استفاده شده بود و همچنین در تمام طول دوره تمرین غذای استاندارد مصرف میکردند، این در حالی است که علیرغم افزایش پروتئین FNDC5 و آیریزین در بافت هیپوکمپ مغز در گروه سالم نسبت به بیمار؛ با اینحال گروه بیمار-شنا نسبت به گروه بیمار بیتحرک افزایش غیرمعنادار در پروتئین FNDC5 از خود نشان داد که وقتی با تحقیق Wrann و همکاران مقایسه میشود، این مطلب دریافت می¬گردد که رژیم پرچرب دائم و متعاقب آن بیماری استئاتوهپاتیت غیرالکلی و اختلال عملکرد کبدی بر روند تولید و عملکرد پروتئین FNDC5 در بافت هیپوکمپ مغز بسیار اثر منفی دارد با این¬حال فعالیت ورزشی تناوبی با شدت بالا در آب توانست پیشرفت این اثر منفی را کاهش دهد. همچنین از جمله دلایل دیگر مغایرت در نتایج تحقیق ویران و همکاران با تحقیق حاضر نوع پروتکل تمرینی بود؛ این احتمال وجود دارد که عواملی هم چون شدت فعالیت، استرس ناشی از محیط فعالیت (محیط آب در برابر خشکی) و همچنین نوع فعالیت (فعالیت اختیاری در تحقیق ویران در برابر فعالیت اجباری به کار رفته در تحقیق حاضر) از جمله دلایل عدم معناداری پروتئین FNDC5 هیپوکمپ مغز در تحقیق حاضر نسبت به نتایج تحقیق ویران و همکاران باشد. Babaei و همکاران، پژوهشی را با هدف مقایسه فعالیتهای تناوبی و تداومی پیش آماده سازی بر متغیرهای FNDC5، BDNF و PGC-1α بافت هیپوکمپ در شرایط یک دوره استرس ناگهانی مزمن (ایجاد شرایط افسردگی) پس از دوره پیش آماده سازی انجام دادند. در پایان آنها نتیجه گرفتند که در هر دو نوع فعالیت میزان هر پروتئین افزایش معنادار یافت با اینحال نوع تناوبی نسبت به تداومی افزایش معنادار بیشتری داشت. همچنین در گروه فعالیت تناوبی، پروتئینهای مذکور در دوران افسردگی کاهش کمتری نسبت به تداومی تجربه کردند. از سوی دیگر آزمون عملکرد حافظه در گروه تناوبی نسبت تداومی از نتایج بهتری برخوردار بود (30). یافتههای این تحقیق نشان میدهد که فعالیت تناوبی با شذت بالا میتواند اثرات مثبت بیشتری در پروتئین FNDC5 نسبت به فعالیت با شدت متوسط بگذارد و این نتیجه در تحقیق حاضر نیز نشان داده شد بهطوری که فعالیت تناوبی با شدت بالا در گروه سالم و بیمار-شنا باعث افزایش در پروتئین FNDC5 هیپوکمپ مغز شد. با اینحال از جمله دلایل عدم معناداری این افزایش در گروه بیمار-شنا نسبت به بیمار بیتحرک در تحقیق حاضر و بروز افزایش معنادار در تحقیق Babaei و همکاران در پروتئین FNDC5 هیپوکمپ مغز به نوع آزمودنیها اشاره کرد. در تحقیق Babaei تمام آزمودنی¬ها موقع ورود به مرحله دوره تمرین سالم بودند و غذای استاندارد مصرف می¬کردند اما آزمودنیهای تحقیق حاضر در شروع دوره تمرین مبتلا به بیماری استئاتوهپاتیت غیرالکلی و دچار اختلال در عملکرد کبد بودند و دائما رژیم پرچرب 77 درصد مصرف میکردند. همچنین نوع پروتکل تمرینی و محیط تمرین نیز بسیار در نتایج موثر است که در این مورد نیز در دو تحقیق تفاوت وجود داشت. در تحقیق Babaei و همکاران پس از دوره تمرین و افزایش در پروتئین FNDC5 هیپوکمپ مغز، دوره استرس مزمن و افسردگی میزان این پروتئین را کاهش داد. حال آن که در تحقیق حاضر نیز به دلیل این¬که بهطور دائم رژیم پرچرب در اختیار رتها قرار داشت میتوان به عنوان یک بار متابولیکی بر کبد و به دنبال آن بر بافتهای دیگر بدن از جمله هیپوکمپ مغز آن را در نظر گرفت و از جمله دلایل عدم معناداری پروتئین FNDC5 هیپوکمپ مغز در گروه بیمار-شنا نسبت به بیمار بیتحرک میتوان به همین بار متابولیک (مصرف دائم رژیم پرچرب و اختلال متابولیسم در کبد) اشاره کرد. این احتمال وجود دارد که از جمله دلایل عدم معناداری افزایش FNDC5 در هیپوکمپ مغز میتوان به عدم تغییر احتمالی در PGC-1α اشاره کرد که در این تحقیق این پروتئین اندازه¬گیری نشد. PGC-1α موجب تحریک ترشح موادی از عضله اسکلتی میگردد که بر عملکرد سایر بافت ها از جمله مغز تأثیرگذار است. یکی از مهمترین این مواد، FNDC5 است. این پروتئین پس از شکستن، در خون ترشح میگردد که هورمون irisin نامگذاری شده است. آیریزین در بافت چربی قهوهای موجب بیان ژن پروتئین غیرجفت کننده 1 (UCP1) میشود. بافت چربی قهوهای به خاطر بیان پروتئین UCP1 و افزایش تراکم میتوکندریایی، نقش گرمازایی را ایفا میکند. به طور کلی در هنگام ورزش کردن در عضلات تولید PGC-1α افزایش مییابد که این مسئله سبب افزایش ساخت FNDC5 میشود؛ که این پروتئین در نهایت باعث تولید آیریزین میشود. آیریزین برخلاف اکثر موادی که در عضله تولید میشود وارد جریان خون میشود و خود را به سلولهای چربی و مغز میرساند و در داخل این سلولها با ایجاد پیامهای بیوشیمیایی خاصی چربی سفید را به چربی قهوهای تبدیل میکند (31). آیریزین هورمونی است که با ورزش تحریک می شود و در موشها و انسان ها توسط عضلات اسکلتی ترشح میشود. تبدیل بافت چربی سفید به بافت چربی قهوهای را تحریک میکند که میزان مصرف انرژی را بهبود میبخشد (32). در این تحقیق به نظر می رسد فعال شدن کیناز فعالشونده توسط آدنوزین مونوفسفات (AMPK) در حین تمرین HIIT یکی از عوامل افزایش آیریزین ناشی از فعال شدن PGC-1α باشد. فعال شدن AMPK منجر به فسفوریلاسیون PGC-1α به عنوان اصلاح کننده FNDC5 و ترشح آیریزین میشود (33). همچنین PGC-1α، گیرنده فعالکننده تکثیر پروکسی زوم گاما (PPARγ) را فعال می کند. PPARγ در متابولیسم انرژی نقش دارد وFNDC5 و افزایش آیریزین را تحریک میکند (34). نشان داده شده است که بین مقادیر آیریزین و پیشساز FNDC5 و PGC-1α رابطه وجود دارد (33). بیان ژن FNDC5 در عضله اسکلتی با چاقی در انسان مرتبط است. میزان بیان با چاقی افزایش مییابد. این رابطه می تواند یک مکانیسم جبرانی باشد (35). در راستای این نظریه، پژوهش دیگری نشان داد که بیان ژن FNDC5 در عضله اسکلتی با شاخص توده بدنی (BMI) رابطه مثبت دارد (35). برخی از مطالعات نشان میدهند که آیریزین با BMI، گلوکز و تریگلیسیرید رابطه معکوس دارد (36). همچنین برخی از مطالعات نشان میدهند که میزان آیریزین با توده عضلانی همبستگی مثبت و با توده چربی همبستگی منفی دارد (37). با این وجود به نظر می¬رسد تمرین شنای تناوبی با شدت بالا در این مطالعه با افزایش نسبت بافت عضلانی به بافت چربی، کاهش BMI، تغییر نوع چربی (تبدیل White adipose tissue (WAT) به (BAT) Brown adipose tissue) و افزایش UCP1 باعث مصرف انرژی و تولید گرما میشود. بنابراین، راه را برای افزایشPGC-1α ، FNDC5 و آیریزین هموار میکند. شدتی که اکسیداسیون چربی را به عنوان منبع اصلی انرژی در طول ورزش بهینه میکند، مهم است. تحقیقات نشان داده است که افراد چاق در استفاده از اسید چرب آزاد در عضلات اسکلتی اختلال دارند (38). تمرینات استقامتی یک استراتژی موثر برای پیشگیری از چاقی و کاهش وزن است زیرا لیپولیز و اکسیداسیون اسیدهای چرب را در عضلات اسکلتی افزایش می¬دهد. این افزایش به شدت ورزش وابسته است، زیرا میزان مطلق اکسیداسیون چربی (گرم در دقیقه) از شدت کم به متوسط افزایش مییابد و سپس با شدیدتر شدن ورزش کاهش مییابد (39). با این وجود، مطالعات نشان می دهد که شش هفته HIIT به مدت دو هفته می¬تواند ظرفیت اکسیداتیو عضلات اسکلتی، عملکرد استقامتی و تغییر مقدار متابولیک را افزایش دهد (40). اAstorino و همکاران، نشان داد که دو هفته HIIT (6 جلسه 4 تا 6 تکراری 30 ثانیه¬ای وینگیت با 5-4 دقیقه ریکاوری) اکسیداسیون چربی در حالت استراحت را در مردان کمتحرک دارای اضافه وزن/چاق افزایش داد (41). مکانیسم¬هایی که از طریق آن HIIT منجر به افزایش اکسیداسیون چربی و کاهش وزن میشود؛ ناشناخته است. با اینحال، به نظر میرسد تمرین HIIT در این تحقیق با مکانیسم¬هایی که در ادامه بیان میشود؛ منجر به افزایش لیپولیز و متعاقب آن افزایش اسیدهای چرب آزاد و کاهش وزن در گروه سالم-شنا و بیمار-شنا می¬شود. به نظر می¬رسد که پروتئین¬های انتقال اسیدهای چرب با افزایش اکسیداسیون چربی مرتبط هستند. افزایش اسید چرب ترانسلوکاز (FAT/CD36) و پروتئین اتصال دهنده به اسید چرب غشای پلاسما (FABPpm) که هر دو در سارکولما، غشای میتوکندری و در یک محیط سیتوپلاسمی در عضله اسکلتی یافت میشوند، میتوانند به سرعت انتقال اسیدهای چرب آزاد در عضله و غشای میتوکندری و افزایش اکسیداسیون چربی کمک کنند (40). نشان داده شده است که شش هفته HIIT (ده دوره چهار دقیقهای با 90 درصد حداکثر اکسیژن مصرفی (VO2max) با فواصل دو دقیقهای استراحت بر روی دوچرخه ارگومتر) باعث افزایش محتوای پروتئین انتقال اسید چرب در کل عضله (FAT/CD36 و FABPpm)، سارکولما (FABPpm) و غشاهای میتوکندری (FAT/CD36) در عضله اسکلتی 10 زن تمرین نکرده، نشان میدهد که افزایش اکسیداسیون اسید چرب عضلات اسکلتی به دنبال تمرین ورزشی با شدت بالا تا حدی با تغییرات در محتوای پروتئین انتقال اسید چرب مرتبط است (42). تمرینات ورزشی لیپوپروتئین نوع A و (LPL) Lipoprotein lipase که از آنزیم کلیدی در متابولیسم چربی است را افزایش می¬دهند. افزایش فعالیت LPL می¬تواند به دلیل افزایش کاتکولآمینها، تخلیه بارهای انرژی، افزایش رادیکالهای آزاد و کاهش PH سلولی باشد (43). اگرچه فعالیت LPL در این مطالعه اندازه¬گیری نشده است، اما احتمال دارد که افزایش آن با تریگلیسیرید رابطه معکوس داشته باشد که منجر به شکستن تری¬گلیسیرید و افزایش اسیدهای چرب آزاد شده باشد (43). همچنین LPL با لاکتات دهیدروژناز (HDL) رابطه مستقیم دارد و منجر به تکامل مولکولهای HDL میشود (44). علاوه بر این، افزایش HDL را می¬توان به عواملی مانند افزایش LCAT نسبت داد (45). به نظر میرسد که HIIT فعالیت آنزیم LPL،lecithin-cholesterol acyltransferase (LCAT) و HDL را افزایش می¬دهد اما LDL، TG و کلسترول را کاهش میدهد (45). تمرین ورزشی میتواند مداخله مهمی برای کاهش وزن باشد. ورزش یک مداخله مهم برای کاهش وزن است زیرا پتانسیل کاهش توده بدن، افزایش توده بدون چربی و حفظ یا افزایش سرعت متابولیسم در حالت استراحت را دارد (41). تعدادی از مطالعات نشان دادهاند که HIIT ممکن است باعث کاهش وزن در افراد دارای اضافه وزن/چاق کم تحرک شود. به عنوان مثال، کاهش قابلتوجهی در دور کمر و بافت چربی زیر جلدی پس از دو هفته HIIT در مردان کم تحرک دارای اضافه وزن/چاق مشاهده شد (41). اگرچه مکانیسم مسئول کاهش چربی و وزن پس از HIIT نامشخص است، یک دلیل احتمالی افزایش متابولیسم پس از ورزش است (46). پاسخ مصرفExcess Post-Exercise Oxygen Consumption (EPOC) به HIIT ممکن است در افزایش اکسیداسیون چربی پس از ورزش از طریق افزایش سطوح کاتکولآمین تولید شده در طول HIIT حاد نقش داشته باشد (46). افزایش اپی نفرین و نوراپینفرین پلاسما در پایان HIIT میتواند لیپولیز و در دسترس بودن اسیدهای چرب آزاد را افزایش دهد و در نتیجه اکسیداسیون چربی کلی در طول و بعد از HIIT افزایش یابد (47). علاوه بر این، HIIT به طور قابل توجهی بتا هیدروکسی آسیل- CoA دهیدروژناز میتوکندری عضلانی را افزایش می¬دهد، که ممکن است کاهش چربی را افزایش دهد (47). همچنین نیاز به حذف لاکتات و H+ و سنتز مجدد گلیکوژن در طول و بعد از HIIT نیز اکسیداسیون چربی را افزایش می¬دهد (39). کاهش اشتهای بعد از ورزش یکی دیگر از مکانیسمهای احتمالی زیربنایی کاهش چربی ناشی از HIIT است. اگرچه تأثیرHIIT بر سرکوب اشتها در افراد دارای اضافه وزن/چاق مورد بررسی قرار نگرفته است، اما مشخص شده است که یک دوره ورزش شدید بلافاصله پس از توقف ورزش، گرسنگی را سرکوب می¬کند (39). در بررسی اثرات HIIT (شش دوره 30 ثانیه¬ای آزمون وینگیت) و ورزش استقامتی (60 دقیقه ورزش با 1/68 درصد VO2max) بر اشتها نشان داده شد که آزمودنی¬های مذکر در یک ساعت پس از یک فعالیت حاد HIIT نسبت به تمرینات استقامتی اشتهای بالاتری را از خود نشان دادند (48). هیچ مکانیسم روشنی وجود ندارد که توضیح دهد چرا سطح گرسنگی پس از ورزش با شدت بالا سرکوب می شود. با این حال، شواهدی وجود دارد که بر اساس گزارشهای بیاشتهایی ناشی از ورزش، تأثیر مشخصی از ورزش شدید بر گرسنگی ذهنی را نشان میدهد (39) همچنین، کاهش اشتها پس از HIIT را می¬توان با توزیع مجدد قابل توجه جریان خون فارغ از گردش خون در عضلات فعال توضیح داد (39). در حالیکه ورزش حاد ذخایر گلیکوژن کبد و عضلات را کاهش میدهد، ممکن است منجر به افزایش فوری گرسنگی شود، تمرینات ورزشی مزمن ممکن است سازگاریهای بیشتری را ایجاد کند که ممکن است منجر به سطوح پایدارتر سوختهای متابولیک شود و در نتیجه باعث سرکوب گرسنگی شوند (48). به¬طور خلاصه، کاهش وزن و اکسیداسیون چربی ناشی از HIIT را میتوان با آنزیم های لیپولیتیک، پروتئین¬های انتقال اسید چرب (FAT/CD36، FABPpm)، کاهش اشتها و تعادل منفی انرژی از طریق EPOC توضیح داد. از جمله محدودیتهای پژوهش حاضر می¬توان به عدم امکان بررسی بسیاری از پروتئینها و بیان ژنها موثر در فرآیند لیپولیز و لیپوژنز در بافت هیپوکمپ مغز، عدم امکان بررسی وزن چربی درون بافت مغز و هیپوکمپ، عدم کنترل استرس رتها در حین تمرین شنا، عدم کنترل استرس رتها در حین گاواژ روزانه، عدم کنترل استرس رتها در حین بیهوشی، تفاوت پاسخهای سازگاری متفاوت موش¬های صحرایی به ورزش و رژیم غذایی پرچرب ناشی از تفاوتهای فردی هر نمونه موش صحرایی اشاره کرد.
نتیجهگیری
بر اساس یافتههای تحقیق حاضر و مقایسه این نتایج با یافتههای تحقیقات پیشین میتوان اینگونه نتیجه گرفت که فعالیت شنای تناوبی با شدت در بیماران مبتلا به استئاتوهپاتیت غیرالکلی که دچار اختلال عملکرد کبدی هستند میتواند عوامل موثر بر متابولیسم لیپید در هیپوکمپ مغز فعال کند و عملکرد حافظه را بهبود بخشد. از سوی دیگر می¬توان گفت که مصرف دائم رژیم غذایی با چربی بالا در افت عملکرد حافظه و افزایش اختلال متابولیسم لیپید بسیار تاثیرگذار است؛ از این رو میتوان آن را بهعنوان یک مداخله با پیامدهای خطرناک نظیر کاهش حافظه و بروز و پیشرفت بیماریهای متابولیکی در نظر گرفت و باید توجهی بر مصرف آن شود. در مقابل با توجه به یافتههای تحقیق حاضر می¬توان برای جلوگیری از بروز زیانهای ناشی از مصرف رژیم پرچرب و متعاقب آن عوارض بیماری استئاتوهپاتیت غیرالکلی، از فعالیتهای تناوبی شنا با شدت بالا استفاده کرد.
سپاسگزاری
از تمامی کسانی که ما را در اجرای این پایاننامه دکتری یاری رساندند، نهایت تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارند.
Non-alcoholic fatty liver disease (NAFLD) از استئاتوز ساده (تجمع چربی در کبد، عمدتاً تریگلیسیرید) تا Nonalcoholic steatohepatitis (NASH) و با تحریک مسیر استرس لیپوپراکسیداتیو همراه با سندرمهای متابولیک مختلف است که میتوان به مقاومت به انسولین، افزایش خطر دیابت نوع دو و بیماریهای قلبی- عروقی اشاره کرد (1). مقاومت به انسولین و هیپرانسولینمی مزمن ناشی از بیماری استئاتوهپاتیت غیرالکلی، انتقال انسولین به مغز را با وضعیت کمبود انسولین مغز تنظیم میکند که با اختلالات حافظه مرتبط با سن و بیماری آلزایمر مرتبط است (2). مقاومت به انسولین و متعاقب آن هیپرانسولینمی ممکن است منجر به تغییر در مسیرهای کبدی جذب، سنتز، تجزیه و ترشح اسیدهای چرب آزاد شود و سپس منجر به آسیب کبدی و پیشرفت بیماری میشود (3). انجام فعالیت ورزشی منظم اثرات مفیدی بر سـلامـت مـغـز داشته و اثرات مخرب بیماریهای عصبی مانـنـد آلـزایـمـر، پارکینسون و افسردگی و بیماریهای متابولیکی مانند دیابت نوع دو را کاهش میدهد. یکی از مولکولهای مهمی که اثرات مفید فعالیت ورزشی را بر هیپوکمپ القاء میکند، (FNDC5) Fibronectin type III domain-containing protein 5 است. این پروتئین علاوه بر عضله اسکلتی در مغز نیز بیان میشود و نشان داده شـده جـدا کردن ژن FNDC5 در نورونهای نابالغ، سبب توقف رشـدی نورونها و عدم تبدیل آنها به نورونهـای بـالـغ میشود (4). به تازگی Wrann و همکاران، نشان دادهاند کـه 32 روز فعالیت ورزشی اختیاری بر روی چرخ گردان در موشهای نـر شش هفتهای، منجر به افزایش بیان ژنهای Peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1α)، FNDC5 و (BDNF) Brain-Derived Neurotrophic Factor در هیپوکمپ میشود (5). با این وجود، نتایج در ایـن زمینه ضد و نقیض است (6). در تحقیقی پیشنهاد شده است که مسیر Irisin/PGC1α/ FNDC5/ BDNF ناشی از فعالیت ورزشی وجود دارد که باعث تأثیر ورزش از طریق عضله اسکلتی بر مغز میشود. همه این دادهها نشان میدهد که FNDC5 ممکن است تمایز عصبی را تسهیل کند و باعث افزایش عملکرد حافظه شود (7). بر خلاف پیشساز FNDC5 برای آیریزین، این هورمون کمتر نشان داده شده است که به طور مستقیم نوروژنز و عملکرد حافظه را تنظیم کند (8). در مقابل، مطالعه اخیر توسط Tu و همکاران، نشان میدهد که بیان بیش از حد FNDC5 کبدی باعث بیان BNDF و سایر ژنهای محافظت کننده عصبی در هیپوکمپ میشود. این اثر احتمالاً با واسطه آیریزین انجام میشود، زیرا سطح گردش آن بهطور قابل توجهی افزایش یافته بود. بیان بیش از حد محیطی FNDC5 باعث افزایش بیانBDNF در هیپوکمپ میشود و این مطلب را بیان میکند که آیریزین ممکن است برای بهبود یادگیری و حافظه توسط مسیر BDNF عمل کند (9). این نتایج همراه با یافتهها مبنی بر اینکه ورزش استقامتی سطوح آیریزین در گردش را افزایش میدهد، عملکرد نوروتروفیک بالقوه آیریزین را نشان میدهد. بنابراین آیریزین ممکن است یک مولکول حیاتی باشد که اثرات مفید فعالیت بدنی منظم را با بهبود عصبی رفتاری مرتبط میکند. این مفهوم بیشتر توسط مطالعات اخیر پشتیبانی میشود (10). با اینحال این مطلب که آیا آیریزین عملکرد هیپوکامپ را از طریق یک مکانیسم مستقیم یا غیرمستقیم تنظیم میکند یا نه، باید بیشتر بررسی شود (11). افزایش مزمن گلوکز خون و فشار خون در بیماران مبتلا به سندروم متابولیک خود مانع نروژنز خواهد گردید که در نتیجه این احتمال وجود دارد که با کاهش فعالیت مسیر Irisin/ FNDC5/ BDNF حجم مغز نیز کاهش یافته و در پی آن، کاهش عملکرد شناختی اتفاق بیفتد (12). از اینرو استراتژیهای درمانی برای این بیماری و عوارض آن بسیار حائز اهمیت است. از جمله استراتژیهای درمانی موثر و کم هزینه، فعالیت ورزشی منظم میباشد. فعالیت بدنی منظم با بهبود عملکرد شناختی، یادگیری و حافظه در موشها در ارتباط است (13). یک رژیم با چربی تام بالا، سطح عملکرد حافظه در حیوانات را کاهش میدهد اما ورزش میتواند این کاهش را معکوس کند (14). بهدنبال تمرین با شدت متوسط، عملکرد مربوط به حافظه فضایی در موش¬ها را بهبود میبخشد (15). از سوی دیگر در تحقیقات متعددی ارتباط معکوس بین عملکرد حافظه و فعالیت ورزشی نشان داده شده است (18-16). با توجه به نتایج متناقض تحقیقات گذشته درباره فعالیت بدنی و دلایل مسیرهای بیوشیمیایی تغییرات آن از جمله مسیر بیوشیمیایی Irisin/FNDC5 هم چنان بر سر تاثیرات فعالیت ورزشی بر عملکرد حافظه و مسیرهای ذکر شده مورد بحث است. اکثر پژوهش ها بر تمرینات ورزشی در خشکی متمرکز شده اند و و نتایج ضدو نقیضی از تاثیر این نوع تمرینات بر بهبود عملکرد حافظه در بیماران NASH گزارش کردهاند. از طرف دیگر پژوهش های بسیار اندکی درباره تاثیر محیط آبی و شنا بر میزان بهبود عملکرد حافظه در بیماران NASH وجود دارند (15). بهطوری¬که Alomari و همکاران، تمرین شنای اجباری و دویدن اختیاری بر عملکرد حافظه در موشهای صحرایی سالم را مورد مقایسه قرار دادند و به این نتیجه رسیدند که عملکرد حافظه در هر دو گروه نسبت به گروه کنترل افزایش یافته است (6). در تحقیقی دیگر که توسط Khabour و همکاران انجام شد پس از شش هفته تمرین شنای تداومی؛ افزایش معنادار عملکرد حافظه در موشهای صحرایی سالم نسبت به کنترل مشاهده شد (19). از طرف دیگر مسیرهای بیوشیمیایی این افزایش یا کاهش عملکرد حافظه در هیپوکمپ مغز ناشی از فعالیت ورزشی شنای تناوبی با شدت بالا از جمله مسیر Irisin/ FNDC5/ BDNF در جامعه آماری بیماران مبتلا به استئاتوهپاتیت غیرالکلی بسیار کم مطالعه شده است و هم-چنان بر سر آن اختلاف نظر وجود دارد. در نتیجه تحقیق حاضر با هدف تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر عوامل بیوشیمیایی متابولیسم لیپید و عملکرد حافظه هیپوکمپ موشهای صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NASH) خواهد بود.
روش بررسی
پژوهش حاضر با توجه به هدف از نوع توسعهای- بنیادی و با در نظر گرفتن روش از نوع تجربی بود. در این پژوهش، 40 سر موش صحرایی نر (سن: 6 تا 8 هفته) از نژاد Sprague –Dawley با میانگین وزن 20 ± 230 گرم انتخاب شدند. موشهای صحرایی در حیوان¬خانه دانشگاه شیراز با دمای 22 تا 24 درجه سانتیگراد، رطوبت 45 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به¬صورت آزادانه در ظرف 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه شیراز مورد توجه قرار گرفت. موشهای صحرایی انتخاب شده در دو گروه سالم با دریافت غذای استاندارد (20= n) و گروه غذای پرچرب (20= n) که با دریافت غذای پرچرب منجر به بیماری استئاتوهپاتیت غیرالکلی گردید، قرار گرفتند.
رژیم امولسیون پرچرب، از 77 درصد از چربی، 14 درصد پروتئین و 9 درصد کربوهیدراتها تشکیل شد. محتوای این امولسیون شامل روغن ذرت، ساکارز، پودر شیر خشک، کلسترول، سدیم دزوکسیکولات، توئین80، پروپیلین گلایکول، مخلوط ویتامین و مواد معدنی و آب مقطر بود. در این امولسیون، پروتئینها توسط پودر شیر خشک، کربوهیدراتها توسط ساکاروز و چربی توسط روغن ذرت و کلسترول تأمین شدند. هر وعده با مخلوطی از ویتامین و مواد معدنی تکمیل شد. این امولسیون در دمای 4 درجه سانتیگراد ذخیره، در حمام آب با دمای 42 درجه سانتیگراد گرم و قبل از استفاده کاملاً میکس و مخلوط شد (20). در گروه رژیم پرچرب علاوه بر غذای روزانه استاندارد جوندگان، بهصورت خوراکی و توسط تکنیک گاواژ، موش¬های صحرایی با امولسیون پرچرب (10 میلیلیتر در کیلوگرم) یک بار در روز تحت گاواژ قرار گرفتند. به موشهای صحرایی گروه سالم نیز از طریق تکنیک گاواژ، روزانه مقدار مساوی محلول نمک (سالین) داده شد. این شیوه تغذیهای بهمدت هشت هفته ادامه داشت تا بر اساس مقالات پیشینه بیماری استئاتوهپاتیت غیرالکلی در موش¬های صحرایی القا شود. در پایان دوره القا بیماری استئاتوهپاتیت غیرالکلی، جهت اثبات ایجاد بیماری NASH، بهطور تصادفی از گروه بیمار و سالم، جداگانه، دو رت کشتار شدند و پس از این¬که آنالیزهای مربوطه توسط متخصص پاتولوژیست از بافت کبد آنها انجام شد، نتایج زیر بهدست آمد. رنگآمیزی Oil red O: ابتدا بافت کبد در ایزوپنتان (isopentane) غوطه¬ور و در دمای برش بهینه Tissue-Plus® (OCT) (Fisher HealthCareTM برش داده شد. نمونههای کبد بر روی یک کرایواستات (CM3050S،Leica Microsystems، Nussloch، ساخت کشور آلمان) به برش¬هایی به ضخامت پنج میکرومتر برش داده شدند. مقاطع کبد با Oil Red O (105230, Merck, Darmstadt, Germany) رنگ-آمیزی شدند. تصاویر زیر یک میکروسکوپ نوری (CX22، Olympus، توکیو، ژاپن) مشاهده شد و از یک میدان تصادفی 40X از کبد هر حیوان با استفاده از نرمافزار Toup View (ToupTekPhotonics، Zhejiang، چین) گرفته شد (21). یک میدان میکروسکوپی نوری در هر بخش مشاهده شد و برای شدت استئاتوز کبدی، التهاب و فیبروز بر اساس معیارهای زیر نمره گذاری شد: برای استئاتوز کبدی: درجه صفر، بدون چربی. درجه یک، استئاتوز کمتر از 33 درصد از پارانشیم کبدی را اشغال میکند. درجه دو، 34 تا 66 درصد از پارانشیم کبدی. درجه سه، بیش از 66 درصد از پارانشیم کبدی. برای انفیلتراسیون التهاب سلولی: درجه صفر: هیچ foci/field. درجه یک، 1-2 foci/field. درجه 2، 3-4 foci/field. درجه 3، بیش از 4 foci/field. مرحلهبندی فیبروز کبدی با رنگآمیزی Oil red O به شرح زیر بررسی شد: صفر، هیچ؛ یک، خفیف، منطقه (zone) 3، پریسینوزوئیدال (perisinusoidal)؛ دو، متوسط، منطقه 3، پریسینوزوئیدال؛ سه، پورتال/پریپورتال؛ چهار، فیبروزیس (bridging fibrosis) (22). همانگونه که در جدول 1 نشان داده شده است در نمونههای بیمار 1 و 2 پس از هشت هفته تغذیه با رژیم پرچرب نمره استئاتوزیس و التهاب، مقادیر سرمی آلانین آمینوترتسفراز (ALT) و آسپارتات-آمینوترنسفراز (AST) و همچنین آنالیز بافتی کبد نشان داد که کبد رتها در مرحله دوم فیبروزیس قرار دارد. همچنین در شکل 1، تصاویر کیفی از نمونههای کبد سالم و بیمار آورده شده است. در قسمت A از شکل 1 قطرات چربی به رنگ قرمز در آمدهاند و به عنوان نمونه با پیکان¬های مشکی نشان داده شدهاند و در قسمت B از شکل 1 نمونه کبد سالم در زیر میکروسکوپ نشان داده شده است و هیچ لکه قرمز در آن وجود ندارد و این بدین معنی است که تجمع چربی در آن رخ نداده است. پس از اثبات القا بیماری در موشهای صحرایی، گروه بیمار (رژیم پرچرب) بهطور تصادفی به دو گروه بیماربی-تحرک (9= n)، بیمار-شنا (9= n) و گروه سالم نیز به¬طور تصادفی به دو گروه سالم بیتحرک (9= n)، گروه سالم - شنا (9= n) تقسیم شدند. لازم به ذکر است رژیم غذایی پرچرب گروه¬های بیمار تا پایان دوره تمرینات ادامه داشت. پس از تقسیمبندی گروهها، همه موشهای صحرایی گروههای تمرین بهمدت دو هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتی و ارتفاع 80 سانتیمتر) را قبل از شروع تمرین اصلی گذراندند (23). در هفته اول موشهای صحرایی با نهایت دقت و آرامش در استخر حیوانات با عمق آب 50 سانتیمتر و میانگین دمای 0/5 ± 30 درجه سانتیگراد قرار گرفتند و با سرعت دلخواه به مدت 20 دقیقه به طور متناوب شنا کردند. در هفته دوم که موشهای صحرایی بهخوبی با استخر حیوانات آشنا شدند؛ برای آشنایی با نوع تمرین تناوبی، چندین مرتبه بعد از یک دقیقه شنا بهوسیله صفحه استراحت از آب بیرون آورده و دوباره در آب قرار داده شدند. بعد از گذشت 48 ساعت از زمان آخرین جلسه آشنایی، موشهای صحرایی گروه تمرین، ابتدا 5 دقیقه گرم کردن و سپس تمرین اصلی HIIT (تمرین تناوبی با شدت بالا) شنا، شامل 20 نوبت 30 ثانیهای شنا با 30 ثانیه استراحت بین هر نوبت را انجام دادند. در پایان هر برنامه تمرینی نیز 5 دقیقه عمل سرد کردن اعمال شد و سپس تمام موشهای صحرایی کاملاً خشک شده و به قفسهایشان منتقل شدند. این برنامه ورزشی بهمدت هشت هفته (سه روز در هفته، روزهای زوج) انجام شد. در تمرین تناوبی بار اعمال شده در هفته اول، وزنهای به میزان 7 درصد وزن بدن هر موش صحرایی بود و هر هفته یک درصد به آن اضافه شد؛ بهطوریکه در هفته آخر (هشتم) موشهای صحرایی با وزنهای به میزان 14 درصد وزن بدن خود که به ریشه دم آنها بسته شد، شنا کردند (جدول2) (24). تمرینات، عصرهنگام (بهترین زمان تمرین در ریتم فعالیتی طبیعی موشهای صحرایی) انجام شد (25). در مدت دوره تداخل، گروه کنترل هیچگونه برنامه تمرینی نداشتند. برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین، موشهای صحرایی با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (سه تا پنج میلیگرم بر کیلوگرم وزن بدن)، بی هوش شدند. ابتدا نمونه-های خونی از قلب رتها به میزان 5 سی سی گرفته شد؛ بلافاصله آن را در داخل لوله آزمایش ژل کلات اکتیویتر انتقال داده و سپس توسط سانترفیوژ با سرعت 3000 دور بر دقیقه و دمای 18 درجه سانتی گراد به مدت 20 دقیقه سانترفیوژ شدند. پس از آن توسط سمپلر به میکروتیوبهای 2 سی سی سرم خون منتقل شد و برای آنالیز نهایی در دمای منهای 20 درجه سانتی گراد نگهداری شدند. سپس بافت هیپوکمپ مغز از بدن حیوانات استخراج و در سرم فیزیولوژیک شستشو داده شد و سپس بلافاصله در دمای منهای 80 درجه سانتیگراد فریز شد. با استفاده از روش آزمایشگاهی الایزا، اسید چرب آزاد توسط کیتهای تشخیصی از شرکت سیگما آلدریچ (شماره کاتالوگ: 74385) از سرم خون اندازه¬گیری شد. همچنین جهت اندازهگیری پروتئین بافتی، بافت هیپوکمپ پس از جداسازی، بلافاصله در تانک ازت در دمای منهای 196 درجه سانتیگراد نگهداری شد. برای اندازه گیری آیریزین بافت هیپوکمپ مغز از کیت الایزای مخصوص رت به شماره کاتالوگ LS-F23902 از شرکت LifeSpan BioSciences, Inc. استفاده شد. سپس جهت انجام تکنیک وسترن بلات و آنالیزهای نهایی پروتئین FNDC5 به آزمایشگاه منتقل شد. بهطور خلاصه، برای لیز کردن بافت¬ها از Lysis buffer با ترکیب (Tris-HCL: 500µL, PH=8, EDTA: 0.003gr, NaCl: 0.08gr, Sodium Deoxycholate: 0.025gr, SDS: 0.01gr, Protease inhibitor cocktail: 1 tablet, NP40((1%))Triton: 10 μl) استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر منهای 20 درجه سانتیگراد نگهداری و سپس غلظت پروتئین به وسیله بردفورد تعیین گشت. نمونههای پروتئینی تهیه شده قبل از ریخته شدن در چاهک با بافر نمونه (Tris (*PH=6.8): 0.6ml, Glycerol: 2.5mgr, ᵦ-mercapto ethanol: 0.5mgr, Bromo phenol bule: 0.01gr, SDS:0.2gr ) هم غلظت و مخلوط شده و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شدند. سپس ساخت الکتروفوژ بر روی ژل SDS page انجام شد. پس از آن محلولهای استوک اکریل آمید 30/8 درصد (acrylamide: 15gr, Bais acrylamide: 0.4gr, water: 50ml)، بافر ژل پایین (Tris: 9.1gr, SDS:0.2gr, water:50 ml, PH=8.8)، بافر ژل بالا (Tris:3.5gr, SDS:0.2gr, water:50ml, PH=-6.8) و بافر ژل تانک الکتروفوز (Tris:1.5gr, SDS:1.5gr, Clycine: 7.2gr, water: 500ml) تهیه گردیدند. پس از آن ژل پایین (بافر ژل پایین: 2/5 میلیلیتر، استوک آکریل آمید:3/3 میلیلیتر، آب مقطر: 4/1 میلیلیتر، APS10%=0.1 ml، TEMED 10%= 0.06 ml)، ژل بالا (بافر ژل بالا: 1/25 میلیلیتر، استوک اکریل آمید: 0/81 میلیلیتر، آب مقطر: 2/9 میلیلیتر، APS10%= 0.5 ml، TEMED10%= 0.003ml) تهیه شدند. پس از این مرحله الکتروفورز بر ژل SDS page انجام شد. در مرحله وسترن بلات یا ایمنوبلاتینگ ابتدا مرحله انتقال از ژل به کاغذ PVDF انجام شد و سپس مرحله بلاکینگ صورت گرفت. پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه (β-Actin (C4): sc-47778, Anti-FNDC5 antibody ab131390) مخلوط و رقیق شده است، به مدت 16 تا 18 ساعت انکوبه گردید. سپس کاغذ سه بار و هر بار به مدت 15 دقیقه با بافر TBS-T (Tris-HCL: 20ml, Sudium chloride: 8gr, Tween20 0.1 v/v: 1ml, Distal water: 100 ml) شستوشو داده شد. سپس کاغذ با آنتیبادی ثانویه (m-IgGκ BP-HRP: sc-516102, mouse anti-rabbit IgG-HRP: sc-2357)، با غلظت (1:1000) برای تمام آنتیبادیهای اولیه به مدت یک ساعت و 15 دقیقه در دمای اتاق شیک گردید. در پایان این مرحله نیز کاغذ سه بار و هر بار به مدت 15 دقیقه با بافر TBS-T شستوشو داده شد. سپس مرحله آشکارسازی باند پروتئینی مورد نظر با استفاده از کیتهای Chemoluminescnce انجام شد. برای مشاهده باند پروتئینی مورد نظر مراحل ظهور فیلم در تاریکخانه و روش Striping (Mercaptanol: 208 μl, Tris,IM: 12.5 ml, SDS: 4gr,Water: 200ml) انجام گردید (26).
تجزیه و تحلیل آماری
در بخش آمار توصیفی از شاخصهای پراکندگی، میانگین، انحراف معیار و نمودار؛ و در بخش آمار استنباطی برای تعیین نحوه توزیع دادهها از آزمون شاپیرو ویلک استفاده شد. در صورت طبیعی بودن دادهها، از روش تجزیه و تحلیل واریانس یک طرفه استفاده گردید و در صورت معنادار بودن تفاوتها، آزمون از تعقیبی بونفرونی برای تعیین محل دقیق تفاوت ها به کار رفت. سطح معنیداری (0/05>P) بود. کلیه روش های آماری با استفاده از نرمافزارversion 16 SPSS صورت گرفت و نمودارها با نرمافزار Excel2019 ترسیم شدند.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شیراز مورد تایید قرار گرفته است (IR.SUMS.REHAB.REC.1400.008).
جدول 1: نتایج آزمایش بافتی و خونی جهت اثبات بیماری


شکل1: رنگ آمیزی بافت کبد توسط Oil red O، A: کبد چرب، لیپیدها به رنگ قرمز درآمده¬اند.
B: کبد سالم- به دلیل عدم وجود چربی هیچ نوع رنگ قرمزی به خود نگرفته است.
جدول2: پروتکل تناوبی شنا با شدت بالا
.JPG)
نتایج
در نمودار 1 میانگین± انحراف معیار وزن گروههای سالم (20=n) و رژیم پرچرب (HFD) (20=n)، در مدت هشت هفته القا رژیم پرچرب نمایش داده شده است. اولین هفته به عنوان سازگاری رتها با محیط آزمایشگاه در نظر گرفته شد و پس از آن دوره هشت هفته ای القا رژیم پرچرب ادامه یافت.
نمودار 2، وزن گروه های تحقیق پس از اثبات بیماری استئاتوهپاتیت غیرالکلی و تقسیم بندی تصادفی آن ها به چهار گروه سالم بیتحرک (9= n)، سالم-شنا (9= n)، بیمار بی-تحرک (9= n) و بیمار-شنا (9= n)، نشان میدهد. در این نمودار هفتههای اول و دوم جهت آشنایی و سازگاری موشهای صحرایی با محیط استخر و نوع تمرین در نظر گرفته شد. هفته¬های یک تا هشت، بازه تمرین اصلی مطابق پروتکل ارائه شده بود و هفته نهم، هفته تشریح موشهای صحرایی گروههای آزمایش بود. بر اساس میانگین وزن هر گروه در کل دوره مداخله تمرینی مشخص شد بین گروههای کنترل-سالم و سالم- شنا (0/003=P) و میان گروههای کنترل-بیمار و سالم-شنا (0/002=P) تفاوت معنادار وجود دارد. در متغیر پروتئین FNDC5 هیپوکمپ مغز، افزایش معنادار در گروه سالم-شنا نسبت به بیمار بی¬تحرک (0/014=P) و بیمار-شنا (0/029=P) مشاهده شد. با این حال به میزان 35/16 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک مشاهده شد. شکل یک به مقایسه نتایج وسترن بلات بین گروهها پرداخته است. در سطر اول شکل 1 بتااکتین با وزن مولکولی 43 کیلودالتون و در سطر دوم میزان غلظت پروتئین FNDC5 هیپوکمپ مغز با وزن مولکولی 22 کیلودالتون میباشد. میزان پهنا و شدت رنگ هر باند پروتئین FNDC5 نسبت به بتااکیتن آن در هر گروه نشاندهنده غلظت این پروتئین است.
در نمودار 3 میزان پروتئین FNDC5 هیپوکمپ مغز به صورت کمی نشان داده شده است. گروه سالم بیتحرک به عنوان معیار، عدد یک درنظر گرفته شده است و مابقی گروهها نسبت به گروه سالم-بی¬تحرک میزان کمی پروتئین آنها سنجیده شده است.
نمودار4، متغیر پروتئین آیریزین هیپوکمپ مغز نشان میدهد. در این متغیر افزایش معنادار در گروه سالم-بیتحرک نسبت به سالم-شنا(0/004=P) ، بیمار بیتحرک (0/001=P) و بیمار-شنا (0/001=P) مشاهده شد. با این حال به میزان 16/34 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک (نمودار4) وجود داشت.
نمودار5، متغیر پروتئین اسید چرب آزاد (FFA) سرم خون را نشان میدهد. در این متغیر کاهش معنادار در گروه سالم-بیتحرک نسبت به سالم-شنا (0/001=P)، بیمار بیتحرک (0/001=P) و بیمار-شنا (0/001=P) مشاهده شد. با این حال به میزان 16/34 درصد کاهش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک وجود داشت (نمودار5).
در متغیر زمان رسیدن به سکو (T) در آزمون ماز آبی موریس، افزایش معنادار در گروه بیمار-بیتحرک نسبت به سالم-بیتحرک (0/025=P)، سالم- شنا (0/01=P) و بیمار-شنا (0/048=P) (شکل A) و در متغیر مسافت پیموده شده در منطقه سکو (Q2) در آزمون موریس میز، افزایش معنادار در گروه سالم-بیتحرک نسبت به بیمار-بیتحرک(0/002=P) و بیمار- شنا (0/02=P) مشاهده شد. با این حال به میزان 9/78 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک (شکل B) و در متغیر زمان سپری شده در منطقه سکو (TQ2) در آزمون موریس میز، در هیچ یک از گروه ها تفاوت معنادار مشاهده نشد. با اینحال به میزان 19/37 درصد افزایش غیرمعنادار در گروه بیمار-شنا نسبت به بیمار بیتحرک مشاهده شد (شکل C).

نمودار 1: میانگین± انحراف معیار تغییرات وزن گروههای سالم و رژیم پرچرب در هشت هفته اول القا کبد چرب، در ابتدا یک هفته به عنوان سازگاری رتها با محیط آزمایشگاه و رژیم غذایی در نظر گرفته شد.

نمودار 2: میانگین± انحراف معیار تغییرات وزن چهار گروه آزمایش در هشت هفته دوم پس از اثبات بیماری استئاتوهپاتیت غیرالکلی، در ابتدا دو هفته به عنوان سازگاری رتها با محیط تمرین در نظر گرفته شد و سپس از هفتههای یک تا هشت تمرین اصلی مطابق پروتکل تمرینی انجام شد. هفته نهم، هفته تشریح رتها بود.

شکل2: مقایسه نتایج وسترن بلات در پروتئین FNDC5 هیپوکمپ مغز، باندهای سطر دوم نشاندهنده غلظت پروتئین هستند و نسبت به بتااکتین در سطر اول مقایسه میشوند.

نمودار3: میزان پروتئین FNDC5 درون هیپوکمپ مغز در میان چهار گروه-
*: تفاوت معنادار بین گروه سالم بیتحرک با بیمار بیتحرک.
#: گروه سالم-شنا با بیمار-شنا و بیمار-بیتحرک- (0/05>p)

نمودار4: سطح پروتئین آیریزین هیپوکمپ مغز در میان چهار گروه-
*: تفاوت معنادار بین گروه سالم-بیتحرک با بیمار-بیتحرک، بیمار-شنا و سالم-شنا- (0/05>p)

نمودار 5: اسید چرب آزاد سرم خون در میان چهار گروه- *: تفاوت معنادار بین گروه سالم-بیتحرک با بیمار-بیتحرک، بیمار-شنا و سالم-شنا -(0/05>p).

نمودار6: شکل A: زمان رسیدن به سکو (T) در میان چهار گروه-
*: تفاوت معنادار بین گروه بیمار بیتحرک با سالم-بیتحرک، بیمار-شنا، سالم-شنا- (0/05>p)- شکل B: مسافت پیموده شده در منطقه سکو (Q2) در میان چهار گروه- #: تفاوت معنادار بین گروه سالم بیتحرک با ، بیمار-شنا ، بیمار بیتحرک (0/05>p)- شکل C: زمان سپری شده در منطقه سکو (Q2) در میان چهار گروه- عدم معناداری میان چهار گروه (05/0>p)
بحث
نتایج پژوهش حاضر را میتوان با نتایج برخی پژوهشها از جمله پژوهش Azimi Dokht و همکاران مقایسه کرد. آنها در پژوهش خود تأثیر هشت هفته تمرین اجباری باشدت کم روی نوارگردان بر بیان ژن FNDC5، PGC-1α و BDNF در هیپوکمپ موشهای صحرایی نر نژاد ویستار را مورد سنجش قرار دادند. در هر سه متغیر مورد ارزیابی در تحقیق مذکور افزایش معنادار در گروه تمرین اجباری نسبت به کنترل مشاهده شد (27). در تحقیق حاضر نیز افزایش غیرمعنادار در گروه سالم-شنا نسبت به کنترل مشاهده شد که از جمله دلایل عدم معناداری نسبت به تحقیق Azimi Dokht میتوان به نوع و محیط پروتکل تمرین اشاره کرد؛ که در تحقیق حاضر تمرینات شنای تناوبی با شدت بالا در محیط آبی، سه روز در هفته به مدت هشت هفته و در تحقیق مذکور تمرینات تداومی اجباری روی نوار گردان، پنج روز در هفته به مدت هشت هفته بود. همچنین از جمله دلایل مغایرت نتایج تحقیقAzimi Dokht و همکاران با نتایج تحقیق حاضر در متغیر FNDC5 میتوان به نوع آزمودنیها اشاره کرد. آزمودنیهای تحقیق حاضر دائما رژیم پرچرب 77 درصد مصرف میکردند و مبتلا به بیماری استئاتوهپاتیت غیر الکلی بودند و همچنین نژاد رتها از نوع اسپراگوداولی بود اما در تحقیق عظیمی دخت و همکاران نژاد رتها از نوع ویستار و همه رتها سالم بودند و از رژیم استاندارد استفاده میکردند. همچنین نحوه سنجش ارزیابی FNDC5 نیز در معناداری این پروتئین موثر است بهطوری که در تحقیق حاضر از سنجش اندازه پروتئین FNDC5 از طریق تکنیک وسترن بلات که یکی از دقیقترین تکنیکهای آزمایشگاهی محسوب میشود استفاده شد اما در تحقیق Azimi Dokht و همکاران از تکنیک ریل تایم PCR و بیان ژن FNDC5 استفاده شد که به نسبت روش مورد استفاده در تحقیق حاضر از دقت پایینتری برخوردار است. با اینوجود در هر دو تحقیق عملکرد حافظه در گروه تمرین نسبت به بیتحرک بهبود معناداری داشت. این نشان میدهد که تغییرات بیوشیمیایی در بافت هیپوکمپ نسبت به سازگاریهای رفتاری و محیطی با تاخیر انجام می¬شود. Hegazy و همکاران تحقیقی را با هدف اثر ورزش شنا و مصرف مکمل ال-کارنوزین خوراکی بر میزان آیریزین هیپوکمپ مغز و عملکرد حافظه در رتهای مبتلا به آلزایمر مورد ارزیابی قرار دادند. در پایان آنها نتیجه گرفتند که ورزش شنا به تنهایی و ورزش شنا+مکمل الکارنوزین باعث افزایش معنادار آیریزین هیپوکمپ مغز و عملکرد حافظه میشود (28). در تحقیق حاضر نیز آیریزین هیپوکمپ مغز گروه بیمار-شنا نسبت به بیمار بی-تحرک افزایش داشت اما غیرمعنادار بود. از جمله دلایل تناقض در نتیجه تحقیق حاضر با تحقیق Hegazy و همکاران می¬توان به نوع آزمودنیها اشاره کرد؛ بهطوری که در تحقیق حاضر آزمودنیها دائما رژیم پرچرب 77درصد در اختیارشان بود و مصرف میکردند و به بیماری اختلال کبدی استئاتوهپاتیت غیرالکلی دچار بودند با اینحال در تحقیق Hegazy و همکاران آزمودنیها دارای بیماری آلزایمر و دارای وزن طبیعی بودند و همچنین غذای استاندارد مصرف میکردند. این نتایج خطرات زیانبار مصرف دائمی رژیم پرچرب و اختلال عملکرد کبد در بیماری استئاتوهپاتیت غیرالکلی را بر پروتئینهای آیریزین و FNDC5 و به تبع آن افزایش غلظت اسید چرب آزاد را در گروه بیمار بیتحرک نشان میدهد که با افت عملکرد حافظه همراه بود با اینحال در گروه بیمار-شنا، شنای تناوبی با شدت بالا توانست به مقدار زیادی افت آیریزین و FNDC5 و عملکرد حافظه را کاهش دهد؛ اما به اندازهای نبود که بتواند همانند تحقیق Hegazy و همکاران در بیماران آلزایمر موجب افزایش معنادار آن شود و این مطلب نشان دهنده خطر بالقوه مصرف دائمی رژیم پرچرب و اختلال عملکرد کبد است و میتواند به شدت بر هیپوکمپ مغز تاثیر منفی بگذارد. بسیاری از پروتکل-های ورزشی که افزایشی در FNDC5 مشاهده نکردند، افزایشی در PGC1α (تنظیمکننده رونویسی آن) و یا حتی تغییراتی در آن نیز مشاهده نکردند (29). عوامل دیگری که باعث تناقض در نتایج میشود را میتوان به پروتکل ورزشی مورد استفاده، نحوه ورزش، نقطه زمانی نمونهگیری و جمعیت مورد مطالعه اشاره کرد (29). Wrann و همکاران، پژوهشی را با هدف تاثیر سی روز فعالیت ورزشی اختیاری روی چرخگردان در موشهای C57/B16 بر روی میزان عوامل بیوشیمیایی موثر بر حافظه در بافت هیپوکمپ انجام دادند. PGC-1α، FNDC5 و BDNF پس از سی روز فعالیت در بافت هیپوکمپ افزایش معنادار یافت (11). از جمله دلایل مغایرت نتایج این تحقیق با تحقیق حاضر میتوان به نوع آزمودنی اشاره کرد؛ به طوری که در تحقیق Wrann و همکاران از مدل موشهای C57/B16 و سالم با وزن طبیعی استفاده شده بود و همچنین در تمام طول دوره تمرین غذای استاندارد مصرف میکردند، این در حالی است که علیرغم افزایش پروتئین FNDC5 و آیریزین در بافت هیپوکمپ مغز در گروه سالم نسبت به بیمار؛ با اینحال گروه بیمار-شنا نسبت به گروه بیمار بیتحرک افزایش غیرمعنادار در پروتئین FNDC5 از خود نشان داد که وقتی با تحقیق Wrann و همکاران مقایسه میشود، این مطلب دریافت می¬گردد که رژیم پرچرب دائم و متعاقب آن بیماری استئاتوهپاتیت غیرالکلی و اختلال عملکرد کبدی بر روند تولید و عملکرد پروتئین FNDC5 در بافت هیپوکمپ مغز بسیار اثر منفی دارد با این¬حال فعالیت ورزشی تناوبی با شدت بالا در آب توانست پیشرفت این اثر منفی را کاهش دهد. همچنین از جمله دلایل دیگر مغایرت در نتایج تحقیق ویران و همکاران با تحقیق حاضر نوع پروتکل تمرینی بود؛ این احتمال وجود دارد که عواملی هم چون شدت فعالیت، استرس ناشی از محیط فعالیت (محیط آب در برابر خشکی) و همچنین نوع فعالیت (فعالیت اختیاری در تحقیق ویران در برابر فعالیت اجباری به کار رفته در تحقیق حاضر) از جمله دلایل عدم معناداری پروتئین FNDC5 هیپوکمپ مغز در تحقیق حاضر نسبت به نتایج تحقیق ویران و همکاران باشد. Babaei و همکاران، پژوهشی را با هدف مقایسه فعالیتهای تناوبی و تداومی پیش آماده سازی بر متغیرهای FNDC5، BDNF و PGC-1α بافت هیپوکمپ در شرایط یک دوره استرس ناگهانی مزمن (ایجاد شرایط افسردگی) پس از دوره پیش آماده سازی انجام دادند. در پایان آنها نتیجه گرفتند که در هر دو نوع فعالیت میزان هر پروتئین افزایش معنادار یافت با اینحال نوع تناوبی نسبت به تداومی افزایش معنادار بیشتری داشت. همچنین در گروه فعالیت تناوبی، پروتئینهای مذکور در دوران افسردگی کاهش کمتری نسبت به تداومی تجربه کردند. از سوی دیگر آزمون عملکرد حافظه در گروه تناوبی نسبت تداومی از نتایج بهتری برخوردار بود (30). یافتههای این تحقیق نشان میدهد که فعالیت تناوبی با شذت بالا میتواند اثرات مثبت بیشتری در پروتئین FNDC5 نسبت به فعالیت با شدت متوسط بگذارد و این نتیجه در تحقیق حاضر نیز نشان داده شد بهطوری که فعالیت تناوبی با شدت بالا در گروه سالم و بیمار-شنا باعث افزایش در پروتئین FNDC5 هیپوکمپ مغز شد. با اینحال از جمله دلایل عدم معناداری این افزایش در گروه بیمار-شنا نسبت به بیمار بیتحرک در تحقیق حاضر و بروز افزایش معنادار در تحقیق Babaei و همکاران در پروتئین FNDC5 هیپوکمپ مغز به نوع آزمودنیها اشاره کرد. در تحقیق Babaei تمام آزمودنی¬ها موقع ورود به مرحله دوره تمرین سالم بودند و غذای استاندارد مصرف می¬کردند اما آزمودنیهای تحقیق حاضر در شروع دوره تمرین مبتلا به بیماری استئاتوهپاتیت غیرالکلی و دچار اختلال در عملکرد کبد بودند و دائما رژیم پرچرب 77 درصد مصرف میکردند. همچنین نوع پروتکل تمرینی و محیط تمرین نیز بسیار در نتایج موثر است که در این مورد نیز در دو تحقیق تفاوت وجود داشت. در تحقیق Babaei و همکاران پس از دوره تمرین و افزایش در پروتئین FNDC5 هیپوکمپ مغز، دوره استرس مزمن و افسردگی میزان این پروتئین را کاهش داد. حال آن که در تحقیق حاضر نیز به دلیل این¬که بهطور دائم رژیم پرچرب در اختیار رتها قرار داشت میتوان به عنوان یک بار متابولیکی بر کبد و به دنبال آن بر بافتهای دیگر بدن از جمله هیپوکمپ مغز آن را در نظر گرفت و از جمله دلایل عدم معناداری پروتئین FNDC5 هیپوکمپ مغز در گروه بیمار-شنا نسبت به بیمار بیتحرک میتوان به همین بار متابولیک (مصرف دائم رژیم پرچرب و اختلال متابولیسم در کبد) اشاره کرد. این احتمال وجود دارد که از جمله دلایل عدم معناداری افزایش FNDC5 در هیپوکمپ مغز میتوان به عدم تغییر احتمالی در PGC-1α اشاره کرد که در این تحقیق این پروتئین اندازه¬گیری نشد. PGC-1α موجب تحریک ترشح موادی از عضله اسکلتی میگردد که بر عملکرد سایر بافت ها از جمله مغز تأثیرگذار است. یکی از مهمترین این مواد، FNDC5 است. این پروتئین پس از شکستن، در خون ترشح میگردد که هورمون irisin نامگذاری شده است. آیریزین در بافت چربی قهوهای موجب بیان ژن پروتئین غیرجفت کننده 1 (UCP1) میشود. بافت چربی قهوهای به خاطر بیان پروتئین UCP1 و افزایش تراکم میتوکندریایی، نقش گرمازایی را ایفا میکند. به طور کلی در هنگام ورزش کردن در عضلات تولید PGC-1α افزایش مییابد که این مسئله سبب افزایش ساخت FNDC5 میشود؛ که این پروتئین در نهایت باعث تولید آیریزین میشود. آیریزین برخلاف اکثر موادی که در عضله تولید میشود وارد جریان خون میشود و خود را به سلولهای چربی و مغز میرساند و در داخل این سلولها با ایجاد پیامهای بیوشیمیایی خاصی چربی سفید را به چربی قهوهای تبدیل میکند (31). آیریزین هورمونی است که با ورزش تحریک می شود و در موشها و انسان ها توسط عضلات اسکلتی ترشح میشود. تبدیل بافت چربی سفید به بافت چربی قهوهای را تحریک میکند که میزان مصرف انرژی را بهبود میبخشد (32). در این تحقیق به نظر می رسد فعال شدن کیناز فعالشونده توسط آدنوزین مونوفسفات (AMPK) در حین تمرین HIIT یکی از عوامل افزایش آیریزین ناشی از فعال شدن PGC-1α باشد. فعال شدن AMPK منجر به فسفوریلاسیون PGC-1α به عنوان اصلاح کننده FNDC5 و ترشح آیریزین میشود (33). همچنین PGC-1α، گیرنده فعالکننده تکثیر پروکسی زوم گاما (PPARγ) را فعال می کند. PPARγ در متابولیسم انرژی نقش دارد وFNDC5 و افزایش آیریزین را تحریک میکند (34). نشان داده شده است که بین مقادیر آیریزین و پیشساز FNDC5 و PGC-1α رابطه وجود دارد (33). بیان ژن FNDC5 در عضله اسکلتی با چاقی در انسان مرتبط است. میزان بیان با چاقی افزایش مییابد. این رابطه می تواند یک مکانیسم جبرانی باشد (35). در راستای این نظریه، پژوهش دیگری نشان داد که بیان ژن FNDC5 در عضله اسکلتی با شاخص توده بدنی (BMI) رابطه مثبت دارد (35). برخی از مطالعات نشان میدهند که آیریزین با BMI، گلوکز و تریگلیسیرید رابطه معکوس دارد (36). همچنین برخی از مطالعات نشان میدهند که میزان آیریزین با توده عضلانی همبستگی مثبت و با توده چربی همبستگی منفی دارد (37). با این وجود به نظر می¬رسد تمرین شنای تناوبی با شدت بالا در این مطالعه با افزایش نسبت بافت عضلانی به بافت چربی، کاهش BMI، تغییر نوع چربی (تبدیل White adipose tissue (WAT) به (BAT) Brown adipose tissue) و افزایش UCP1 باعث مصرف انرژی و تولید گرما میشود. بنابراین، راه را برای افزایشPGC-1α ، FNDC5 و آیریزین هموار میکند. شدتی که اکسیداسیون چربی را به عنوان منبع اصلی انرژی در طول ورزش بهینه میکند، مهم است. تحقیقات نشان داده است که افراد چاق در استفاده از اسید چرب آزاد در عضلات اسکلتی اختلال دارند (38). تمرینات استقامتی یک استراتژی موثر برای پیشگیری از چاقی و کاهش وزن است زیرا لیپولیز و اکسیداسیون اسیدهای چرب را در عضلات اسکلتی افزایش می¬دهد. این افزایش به شدت ورزش وابسته است، زیرا میزان مطلق اکسیداسیون چربی (گرم در دقیقه) از شدت کم به متوسط افزایش مییابد و سپس با شدیدتر شدن ورزش کاهش مییابد (39). با این وجود، مطالعات نشان می دهد که شش هفته HIIT به مدت دو هفته می¬تواند ظرفیت اکسیداتیو عضلات اسکلتی، عملکرد استقامتی و تغییر مقدار متابولیک را افزایش دهد (40). اAstorino و همکاران، نشان داد که دو هفته HIIT (6 جلسه 4 تا 6 تکراری 30 ثانیه¬ای وینگیت با 5-4 دقیقه ریکاوری) اکسیداسیون چربی در حالت استراحت را در مردان کمتحرک دارای اضافه وزن/چاق افزایش داد (41). مکانیسم¬هایی که از طریق آن HIIT منجر به افزایش اکسیداسیون چربی و کاهش وزن میشود؛ ناشناخته است. با اینحال، به نظر میرسد تمرین HIIT در این تحقیق با مکانیسم¬هایی که در ادامه بیان میشود؛ منجر به افزایش لیپولیز و متعاقب آن افزایش اسیدهای چرب آزاد و کاهش وزن در گروه سالم-شنا و بیمار-شنا می¬شود. به نظر می¬رسد که پروتئین¬های انتقال اسیدهای چرب با افزایش اکسیداسیون چربی مرتبط هستند. افزایش اسید چرب ترانسلوکاز (FAT/CD36) و پروتئین اتصال دهنده به اسید چرب غشای پلاسما (FABPpm) که هر دو در سارکولما، غشای میتوکندری و در یک محیط سیتوپلاسمی در عضله اسکلتی یافت میشوند، میتوانند به سرعت انتقال اسیدهای چرب آزاد در عضله و غشای میتوکندری و افزایش اکسیداسیون چربی کمک کنند (40). نشان داده شده است که شش هفته HIIT (ده دوره چهار دقیقهای با 90 درصد حداکثر اکسیژن مصرفی (VO2max) با فواصل دو دقیقهای استراحت بر روی دوچرخه ارگومتر) باعث افزایش محتوای پروتئین انتقال اسید چرب در کل عضله (FAT/CD36 و FABPpm)، سارکولما (FABPpm) و غشاهای میتوکندری (FAT/CD36) در عضله اسکلتی 10 زن تمرین نکرده، نشان میدهد که افزایش اکسیداسیون اسید چرب عضلات اسکلتی به دنبال تمرین ورزشی با شدت بالا تا حدی با تغییرات در محتوای پروتئین انتقال اسید چرب مرتبط است (42). تمرینات ورزشی لیپوپروتئین نوع A و (LPL) Lipoprotein lipase که از آنزیم کلیدی در متابولیسم چربی است را افزایش می¬دهند. افزایش فعالیت LPL می¬تواند به دلیل افزایش کاتکولآمینها، تخلیه بارهای انرژی، افزایش رادیکالهای آزاد و کاهش PH سلولی باشد (43). اگرچه فعالیت LPL در این مطالعه اندازه¬گیری نشده است، اما احتمال دارد که افزایش آن با تریگلیسیرید رابطه معکوس داشته باشد که منجر به شکستن تری¬گلیسیرید و افزایش اسیدهای چرب آزاد شده باشد (43). همچنین LPL با لاکتات دهیدروژناز (HDL) رابطه مستقیم دارد و منجر به تکامل مولکولهای HDL میشود (44). علاوه بر این، افزایش HDL را می¬توان به عواملی مانند افزایش LCAT نسبت داد (45). به نظر میرسد که HIIT فعالیت آنزیم LPL،lecithin-cholesterol acyltransferase (LCAT) و HDL را افزایش می¬دهد اما LDL، TG و کلسترول را کاهش میدهد (45). تمرین ورزشی میتواند مداخله مهمی برای کاهش وزن باشد. ورزش یک مداخله مهم برای کاهش وزن است زیرا پتانسیل کاهش توده بدن، افزایش توده بدون چربی و حفظ یا افزایش سرعت متابولیسم در حالت استراحت را دارد (41). تعدادی از مطالعات نشان دادهاند که HIIT ممکن است باعث کاهش وزن در افراد دارای اضافه وزن/چاق کم تحرک شود. به عنوان مثال، کاهش قابلتوجهی در دور کمر و بافت چربی زیر جلدی پس از دو هفته HIIT در مردان کم تحرک دارای اضافه وزن/چاق مشاهده شد (41). اگرچه مکانیسم مسئول کاهش چربی و وزن پس از HIIT نامشخص است، یک دلیل احتمالی افزایش متابولیسم پس از ورزش است (46). پاسخ مصرفExcess Post-Exercise Oxygen Consumption (EPOC) به HIIT ممکن است در افزایش اکسیداسیون چربی پس از ورزش از طریق افزایش سطوح کاتکولآمین تولید شده در طول HIIT حاد نقش داشته باشد (46). افزایش اپی نفرین و نوراپینفرین پلاسما در پایان HIIT میتواند لیپولیز و در دسترس بودن اسیدهای چرب آزاد را افزایش دهد و در نتیجه اکسیداسیون چربی کلی در طول و بعد از HIIT افزایش یابد (47). علاوه بر این، HIIT به طور قابل توجهی بتا هیدروکسی آسیل- CoA دهیدروژناز میتوکندری عضلانی را افزایش می¬دهد، که ممکن است کاهش چربی را افزایش دهد (47). همچنین نیاز به حذف لاکتات و H+ و سنتز مجدد گلیکوژن در طول و بعد از HIIT نیز اکسیداسیون چربی را افزایش می¬دهد (39). کاهش اشتهای بعد از ورزش یکی دیگر از مکانیسمهای احتمالی زیربنایی کاهش چربی ناشی از HIIT است. اگرچه تأثیرHIIT بر سرکوب اشتها در افراد دارای اضافه وزن/چاق مورد بررسی قرار نگرفته است، اما مشخص شده است که یک دوره ورزش شدید بلافاصله پس از توقف ورزش، گرسنگی را سرکوب می¬کند (39). در بررسی اثرات HIIT (شش دوره 30 ثانیه¬ای آزمون وینگیت) و ورزش استقامتی (60 دقیقه ورزش با 1/68 درصد VO2max) بر اشتها نشان داده شد که آزمودنی¬های مذکر در یک ساعت پس از یک فعالیت حاد HIIT نسبت به تمرینات استقامتی اشتهای بالاتری را از خود نشان دادند (48). هیچ مکانیسم روشنی وجود ندارد که توضیح دهد چرا سطح گرسنگی پس از ورزش با شدت بالا سرکوب می شود. با این حال، شواهدی وجود دارد که بر اساس گزارشهای بیاشتهایی ناشی از ورزش، تأثیر مشخصی از ورزش شدید بر گرسنگی ذهنی را نشان میدهد (39) همچنین، کاهش اشتها پس از HIIT را می¬توان با توزیع مجدد قابل توجه جریان خون فارغ از گردش خون در عضلات فعال توضیح داد (39). در حالیکه ورزش حاد ذخایر گلیکوژن کبد و عضلات را کاهش میدهد، ممکن است منجر به افزایش فوری گرسنگی شود، تمرینات ورزشی مزمن ممکن است سازگاریهای بیشتری را ایجاد کند که ممکن است منجر به سطوح پایدارتر سوختهای متابولیک شود و در نتیجه باعث سرکوب گرسنگی شوند (48). به¬طور خلاصه، کاهش وزن و اکسیداسیون چربی ناشی از HIIT را میتوان با آنزیم های لیپولیتیک، پروتئین¬های انتقال اسید چرب (FAT/CD36، FABPpm)، کاهش اشتها و تعادل منفی انرژی از طریق EPOC توضیح داد. از جمله محدودیتهای پژوهش حاضر می¬توان به عدم امکان بررسی بسیاری از پروتئینها و بیان ژنها موثر در فرآیند لیپولیز و لیپوژنز در بافت هیپوکمپ مغز، عدم امکان بررسی وزن چربی درون بافت مغز و هیپوکمپ، عدم کنترل استرس رتها در حین تمرین شنا، عدم کنترل استرس رتها در حین گاواژ روزانه، عدم کنترل استرس رتها در حین بیهوشی، تفاوت پاسخهای سازگاری متفاوت موش¬های صحرایی به ورزش و رژیم غذایی پرچرب ناشی از تفاوتهای فردی هر نمونه موش صحرایی اشاره کرد.
نتیجهگیری
بر اساس یافتههای تحقیق حاضر و مقایسه این نتایج با یافتههای تحقیقات پیشین میتوان اینگونه نتیجه گرفت که فعالیت شنای تناوبی با شدت در بیماران مبتلا به استئاتوهپاتیت غیرالکلی که دچار اختلال عملکرد کبدی هستند میتواند عوامل موثر بر متابولیسم لیپید در هیپوکمپ مغز فعال کند و عملکرد حافظه را بهبود بخشد. از سوی دیگر می¬توان گفت که مصرف دائم رژیم غذایی با چربی بالا در افت عملکرد حافظه و افزایش اختلال متابولیسم لیپید بسیار تاثیرگذار است؛ از این رو میتوان آن را بهعنوان یک مداخله با پیامدهای خطرناک نظیر کاهش حافظه و بروز و پیشرفت بیماریهای متابولیکی در نظر گرفت و باید توجهی بر مصرف آن شود. در مقابل با توجه به یافتههای تحقیق حاضر می¬توان برای جلوگیری از بروز زیانهای ناشی از مصرف رژیم پرچرب و متعاقب آن عوارض بیماری استئاتوهپاتیت غیرالکلی، از فعالیتهای تناوبی شنا با شدت بالا استفاده کرد.
سپاسگزاری
از تمامی کسانی که ما را در اجرای این پایاننامه دکتری یاری رساندند، نهایت تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارند.
References:
1- Vallet-Pichard A, Parlati L, Pol S. Epidemiology of Non-Alcoholic Steatohepatitis. Extent/Burden of the Problem and its Impact on Public Health. Presse Medicale 2019; 48(12): 1459-67.
2- Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of Nonalcoholic Hepatic Steatosis, Hepatic Insulin Resistance, and Hyperglycemia by Moderate Weight Reduction in Patients with Type 2 Diabetes. Diabetes 2005; 54(3): 603-8.
3- Das SK, Balakrishnan V. Role of Cytokines in the Pathogenesis of Non-Alcoholic Fatty Liver Disease. Indian J Clin Biochem 2011; 26(2): 202-9.
4- Hashemi M-S, Ghaedi K, Salamian A, Karbalaie K, Emadi-Baygi M, Tanhaei S, et al. Fndc5 Knockdown Significantly Decreased Neural Differentiation Rate of Mouse Embryonic Stem Cells. Neuroscience 2013; 231: 296-304.
5- Wrann CD. FNDC5/Irisin–Their Role in the Nervous System and as a Mediator for Beneficial Effects of Exercise on the Brain. Brain plast 2015; 1(1): 55-61.
6- Alomari MA, Khabour OF, Alzoubi KH, Alzubi MA. Forced and Voluntary Exercises Equally Improve Spatial Learning and Memory and Hippocampal BDNF Levels. Behav Brain Res 2013; 247: 34-9.
7- Forouzanfar M, Rabiee F, Ghaedi K, Beheshti S, Tanhaei S, Shoaraye Nejati A, et al. Fndc5 Overexpression Facilitated Neural Differentiation of Mouse Embryonic Stem Cells. Cell Biol Int 2015; 39(5): 629-37.
8- Moon H-S, Dincer F, Mantzoros CS. Pharmacological Concentrations of Irisin Increase Cell Proliferation Without Influencing Markers of Neurite Outgrowth And Synaptogenesis In Mouse H19-7 Hippocampal Cell Lines. Metabolism 2013; 62(8): 1131-6.
9- Tu T, Peng J, Jiang Y. FNDC5/Irisin: A New Protagonist in Acute Brain Injury. Stem cells Dev 2020; 29(9): 533-43.
10- Zhang J, Zhang W. Can Irisin be a Linker between Physical Activity and Brain Function? Biomol concepts 2016; 7(4): 253-8.
11- Wrann CD, White JP, Salogiannnis J, Laznik-Bogoslavski D, Wu J, Ma D, et al. Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway. Cell metab 2013; 18(5): 649-59.
12- Lee SS, Yoo JH, Kang S, Woo JH, Shin KO, Kim KB, et al. The Effects of 12 Weeks Regular Aerobic Exercise on Brain-Derived Neurotrophic Factor and Inflammatory Factors in Juvenile Obesity and Type 2 Diabetes Mellitus. J Phys Ther Sci 2014; 26(8): 1199-204.
13- Atashak S, Sharafi H, Azarbayjani MA, Stannard SR, Goli MA, Haghighi MM. Effect of Omega-3 Supplementation on the Blood Levels of Oxidative Stress, Muscle Damage and Inflammation Markers after Acute Resistance Exercise in Young Athletes. Kinesiology 2013; 45(1): 22-9.
14- Assis GGd, Gasanov EV, Sousa MBCd, Kozacz A, Murawska-Cialowicz E. Brain Derived Neutrophic Factor, a Link of Aerobic Metabolism to Neuroplasticity. J Physiol Pharmacol 2018; 69(3).
15- Loprinzi PD. Does Brain-Derived Neurotrophic Factor Mediate the Effects of Exercise on Memory? Phys Sportsmed 2019; 47(4): 395-405.
16- Elce V, Del Pizzo A, Nigro E, Frisso G, Martiniello L, Daniele A, et al. Impact of Physical Activity on Cognitive Functions: a New Field for Research and Management of Cystic Fibrosis. Diagnostics(Basel) 2020; 10(7): 489.
17- Anderson-Hanley C, Barcelos NM, Zimmerman EA, Gillen RW, Dunnam M, Cohen BD, et al. The Aerobic and Cognitive Exercise Study (ACES) for Community-Dwelling Older Adults with or At-Risk for Mild Cognitive Impairment (MCI): Neuropsychological, Neurobiological and Neuroimaging Outcomes of a Randomized Clinical Trial. Front Aging Neurosci 2018; 10: 76.
18- Damirchi A, Hosseini F, Babaei P. Mental Training Enhances Cognitive Function and BDNF More than Either Physical or Combined Training in Elderly Women with MCI: a Small-Scale Study. Am J Alzheimers Dis Other Demen 2018; 33(1): 20-9.
19- Khabour OF, Alzoubi KH, Alomari MA, Alzubi MA. Changes in Spatial Memory and BDNF Expression to Simultaneous Dietary Restriction and Forced Exercise. Brain Res Bull 2013; 90: 19-24.
20- Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, et al. High-Fat Emulsion-Induced Rat Model of Nonalcoholic Steatohepatitis. Life sci 2006; 79(11): 1100-7.
21- Chen B, Ma Y, Xue X, Wei J, Hu G, Lin Y. Tetramethylpyrazine Reduces Inflammation in the Livers of Mice Fed a High Fat Diet. Mol Med Rep 2019; 19(4): 2561-8.
22- Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Design and Validation of a Histological Scoring System for Nonalcoholic Fatty Liver Disease. Hepatology 2005; 41(6): 1313-21.
23- Farzanegi P, Habibian M, Alinejad H. The Combined Effect of Regular Aerobic Exercise with Garlic Extract on Renal Apoptosis Regulatory Factors in Aged Rats with Chronic Kidney Disease. J Arak Uni Med Sci 2016; 19(3): 62-70.
24- Ramos-Filho D, Chicaybam G, de-Souza-Ferreira E, Guerra Martinez C, Kurtenbach E, Casimiro-Lopes G, et al. High Intensity Interval Training (HIIT) Induces Specific Changes in Respiration and Electron Leakage in the Mitochondria of Different Rat Skeletal Muscles. PloS One 2015; 10(6): e0131766.
25- Shafiee A, Gaeini A, Soleimani M, Nekouei A, Hadidi V. The Effect of Eight Week of High Intensity Interval Training on Expression of Mir-210 and Ephrina3 Mrna in Soleus Muscle Healthy Male Rats. J Arak Uni Med Sci 2014; 17(3): 26-34. [Persian]
26- Tipoe GL, Ho CT, Liong EC, Leung TM, Lau TY, Fung ML, et al. Voluntary Oral Feeding of Rats Not Requiring a Very High Fat Diet is a Clinically Relevant Animal Model of Non-Alcoholic Fatty Liver Disease (NAFLD). Histol Histopathol 2009; 24(9): 1161-9.
27- Azimi Dokht SMA, Gharakhanlou R, Naghdi N, Khodadadi D, Zare Zade Mehrizi AA. The Effect of the Treadmill Running on Genes Expression Ofthepgc-1α, FNDC5 and BDNF in Hippocampus of Male Rats. Journal of Practical Studies of Biosciences in Sport 2019; 7(14): 91-101.[Persain]
28- Hegazy MA, Abdelmonsif DA, Zeitoun TM, El-Sayed NS, Samy DM. Swimming Exercise Versus L-Carnosine Supplementation for Alzheimer’s Dementia in Rats: Implication of Circulating and Hippocampal FNDC5/Irisin. J Physiol Biochem 2022; 78(1): 109-24.
29- Lourenco MV, Frozza RL, de Freitas GB, Zhang H, Kincheski GC, Ribeiro FC, et al. Exercise-Linked FNDC5/Irisin Rescues Synaptic Plasticity and Memory Defects in Alzheimer’s Models. Nat Med 2019; 25(1): 165-75.
30- Babaei A, Nourshahi M, Fani M, Entezari Z, Jameie SB, Haghparast A. The Effectiveness of Continuous and Interval Exercise Preconditioning Against Chronic Unpredictable Stress: Involvement of Hippocampal PGC-1α/FNDC5/BDNF Pathway. J Psychiatr Res 2021; 136: 173-83.
31- Martinez Munoz IY, Camarillo Romero EdS, Garduno Garcia JdJ. Irisin a Novel Metabolic Biomarker: Present Knowledge and Future Directions. Int J Endocrinol 2018; 2018: 7816806.
32- Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. A PGC1-Α-Dependent Myokine that Drives Brown-Fat-Like Development of White Fat and Thermogenesis. Nature 2012; 481(7382): 463-8.
33- Huh JY, Mougios V, Kabasakalis A, Fatouros I, Siopi A, Douroudos II, et al. Exercise-Induced Irisin Secretion is Independent of Age or Fitness Level and Increased Irisin May Directly Modulate Muscle Metabolism through AMPK Activation. J Clin Endocrinol Metab 2014; 99(11): E2154-E61.
34- Seale P, Conroe HM, Estall J, Kajimura S, Frontini A, Ishibashi J, et al. Prdm16 Determines the Thermogenic Program of Subcutaneous White Adipose Tissue in Mice. J Clinical Investigat 2011; 121(1): 96-105.
35- Hee Park K, Zaichenko L, Brinkoetter M, Thakkar B, Sahin-Efe A, Joung KE, et al. Circulating Irisin in Relation to Insulin Resistance and the Metabolic Syndrome. J Clin Endocrinol Metab 2013; 98(12): 4899-907.
36- Hecksteden A, Wegmann M, Steffen A, Kraushaar J, Morsch A, Ruppenthal S, et al. Irisin and Exercise Training in Humans–Results from a Randomized Controlled Training Trial. BMC Med 2013; 11(1): 235.
37- Kim HJ, Lee HJ, So B, Son JS, Yoon D, Song W. Effect of Aerobic Training and Resistance Training on Circulating Irisin Level and their Association with Change of Body Composition in Overweight/Obese Adults: a Pilot Study. Physioll Res 2016; 65(2): 271-9.
38- Colberg SR, Simoneau JA, Thaete FL, Kelley DE. Skeletal Muscle Utilization of Free Fatty Acids in Women with Visceral Obesity. J Clin Invest 1995; 95(4): 1846-53.
39- Alahmadi M. High-Intensity Interval Training and Obesity. J Nov Physiother 2014; 4(3): 1-6.
40- Gibala MJ, Little JP, Van Essen M, Wilkin GP, Burgomaster KA, Safdar A, et al. Short Term Sprint Interval Versus Traditional Endurance Training: Similar Initial Adaptations in Human Skeletal Muscle and Exercise Performance. J physiol 2006; 575(pt 3): 901-11.
41- Astorino TA, Schubert MM, Palumbo E, Stirling D, McMillan DW. Effect of Two Doses of Interval Training on Maximal Fat Oxidation in Sedentary Women. Med Sci Sports Exerc 2013; 45(10): 1878-86.
42- Talanian JL, Holloway GP, Snook LA, Heigenhauser GJ, Bonen A, Spriet LL. Exercise Training Increases Sarcolemmal and Mitochondrial Fatty Acid Transport Proteins in Human Skeletal Muscle. Am J Physiol Endocrinol Metab 2010; 299(2): E180-E8.
43- Taylor AJ, Watkins T, Bell D, Carrow J, Bindeman J, Scherr D, et al. Physical Activity and the Presence and Extent of Calcified Coronary Atherosclerosis. Med Sci Sports Exerc 2002; 34(2): 228-33.
44- Lewis GF, Rader DJ. New Insights Into the Regulation of HDL Metabolism and Reverse Cholesterol Transport. Circ Res 2005; 96(12): 1221-32.
45- Tofighi A, Alizadeh R, Tolouei Azar J. The Effect of Eight Weeks High Intensity Interval Training (HIIT) on Serum Amounts of FGF21 and Irisin in Sedentary Obese Women. Studies in Medical Sciences 2017; 28(7): 453-66.
46- Trapp EG, Chisholm DJ, Boutcher SH. Metabolic Response of Trained and Untrained Women During High-Intensity Intermittent Cycle Exercise. Am J Physiol Regul Integr Comp Physiol 2007; 293(6): R2370-5.
47- Talanian JL, Galloway SDR, Heigenhauser GJF, Bonen A, Spriet LL. Two Weeks of High-Intensity Aerobic Interval Training Increases the Capacity for Fat Oxidation during Exercise in Women. J Appl Physiol (1985) 2007; 102(4):1439-47.
48- Deighton K, Barry R, Connon CE, Stensel DJ. Appetite, Gut Hormone and Energy Intake Responses to Low Volume Sprint Interval and Traditional Endurance Exercise. Eur J Appl Physiol 2013; 113(5): 1147-56.
1- Vallet-Pichard A, Parlati L, Pol S. Epidemiology of Non-Alcoholic Steatohepatitis. Extent/Burden of the Problem and its Impact on Public Health. Presse Medicale 2019; 48(12): 1459-67.
2- Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of Nonalcoholic Hepatic Steatosis, Hepatic Insulin Resistance, and Hyperglycemia by Moderate Weight Reduction in Patients with Type 2 Diabetes. Diabetes 2005; 54(3): 603-8.
3- Das SK, Balakrishnan V. Role of Cytokines in the Pathogenesis of Non-Alcoholic Fatty Liver Disease. Indian J Clin Biochem 2011; 26(2): 202-9.
4- Hashemi M-S, Ghaedi K, Salamian A, Karbalaie K, Emadi-Baygi M, Tanhaei S, et al. Fndc5 Knockdown Significantly Decreased Neural Differentiation Rate of Mouse Embryonic Stem Cells. Neuroscience 2013; 231: 296-304.
5- Wrann CD. FNDC5/Irisin–Their Role in the Nervous System and as a Mediator for Beneficial Effects of Exercise on the Brain. Brain plast 2015; 1(1): 55-61.
6- Alomari MA, Khabour OF, Alzoubi KH, Alzubi MA. Forced and Voluntary Exercises Equally Improve Spatial Learning and Memory and Hippocampal BDNF Levels. Behav Brain Res 2013; 247: 34-9.
7- Forouzanfar M, Rabiee F, Ghaedi K, Beheshti S, Tanhaei S, Shoaraye Nejati A, et al. Fndc5 Overexpression Facilitated Neural Differentiation of Mouse Embryonic Stem Cells. Cell Biol Int 2015; 39(5): 629-37.
8- Moon H-S, Dincer F, Mantzoros CS. Pharmacological Concentrations of Irisin Increase Cell Proliferation Without Influencing Markers of Neurite Outgrowth And Synaptogenesis In Mouse H19-7 Hippocampal Cell Lines. Metabolism 2013; 62(8): 1131-6.
9- Tu T, Peng J, Jiang Y. FNDC5/Irisin: A New Protagonist in Acute Brain Injury. Stem cells Dev 2020; 29(9): 533-43.
10- Zhang J, Zhang W. Can Irisin be a Linker between Physical Activity and Brain Function? Biomol concepts 2016; 7(4): 253-8.
11- Wrann CD, White JP, Salogiannnis J, Laznik-Bogoslavski D, Wu J, Ma D, et al. Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway. Cell metab 2013; 18(5): 649-59.
12- Lee SS, Yoo JH, Kang S, Woo JH, Shin KO, Kim KB, et al. The Effects of 12 Weeks Regular Aerobic Exercise on Brain-Derived Neurotrophic Factor and Inflammatory Factors in Juvenile Obesity and Type 2 Diabetes Mellitus. J Phys Ther Sci 2014; 26(8): 1199-204.
13- Atashak S, Sharafi H, Azarbayjani MA, Stannard SR, Goli MA, Haghighi MM. Effect of Omega-3 Supplementation on the Blood Levels of Oxidative Stress, Muscle Damage and Inflammation Markers after Acute Resistance Exercise in Young Athletes. Kinesiology 2013; 45(1): 22-9.
14- Assis GGd, Gasanov EV, Sousa MBCd, Kozacz A, Murawska-Cialowicz E. Brain Derived Neutrophic Factor, a Link of Aerobic Metabolism to Neuroplasticity. J Physiol Pharmacol 2018; 69(3).
15- Loprinzi PD. Does Brain-Derived Neurotrophic Factor Mediate the Effects of Exercise on Memory? Phys Sportsmed 2019; 47(4): 395-405.
16- Elce V, Del Pizzo A, Nigro E, Frisso G, Martiniello L, Daniele A, et al. Impact of Physical Activity on Cognitive Functions: a New Field for Research and Management of Cystic Fibrosis. Diagnostics(Basel) 2020; 10(7): 489.
17- Anderson-Hanley C, Barcelos NM, Zimmerman EA, Gillen RW, Dunnam M, Cohen BD, et al. The Aerobic and Cognitive Exercise Study (ACES) for Community-Dwelling Older Adults with or At-Risk for Mild Cognitive Impairment (MCI): Neuropsychological, Neurobiological and Neuroimaging Outcomes of a Randomized Clinical Trial. Front Aging Neurosci 2018; 10: 76.
18- Damirchi A, Hosseini F, Babaei P. Mental Training Enhances Cognitive Function and BDNF More than Either Physical or Combined Training in Elderly Women with MCI: a Small-Scale Study. Am J Alzheimers Dis Other Demen 2018; 33(1): 20-9.
19- Khabour OF, Alzoubi KH, Alomari MA, Alzubi MA. Changes in Spatial Memory and BDNF Expression to Simultaneous Dietary Restriction and Forced Exercise. Brain Res Bull 2013; 90: 19-24.
20- Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, et al. High-Fat Emulsion-Induced Rat Model of Nonalcoholic Steatohepatitis. Life sci 2006; 79(11): 1100-7.
21- Chen B, Ma Y, Xue X, Wei J, Hu G, Lin Y. Tetramethylpyrazine Reduces Inflammation in the Livers of Mice Fed a High Fat Diet. Mol Med Rep 2019; 19(4): 2561-8.
22- Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Design and Validation of a Histological Scoring System for Nonalcoholic Fatty Liver Disease. Hepatology 2005; 41(6): 1313-21.
23- Farzanegi P, Habibian M, Alinejad H. The Combined Effect of Regular Aerobic Exercise with Garlic Extract on Renal Apoptosis Regulatory Factors in Aged Rats with Chronic Kidney Disease. J Arak Uni Med Sci 2016; 19(3): 62-70.
24- Ramos-Filho D, Chicaybam G, de-Souza-Ferreira E, Guerra Martinez C, Kurtenbach E, Casimiro-Lopes G, et al. High Intensity Interval Training (HIIT) Induces Specific Changes in Respiration and Electron Leakage in the Mitochondria of Different Rat Skeletal Muscles. PloS One 2015; 10(6): e0131766.
25- Shafiee A, Gaeini A, Soleimani M, Nekouei A, Hadidi V. The Effect of Eight Week of High Intensity Interval Training on Expression of Mir-210 and Ephrina3 Mrna in Soleus Muscle Healthy Male Rats. J Arak Uni Med Sci 2014; 17(3): 26-34. [Persian]
26- Tipoe GL, Ho CT, Liong EC, Leung TM, Lau TY, Fung ML, et al. Voluntary Oral Feeding of Rats Not Requiring a Very High Fat Diet is a Clinically Relevant Animal Model of Non-Alcoholic Fatty Liver Disease (NAFLD). Histol Histopathol 2009; 24(9): 1161-9.
27- Azimi Dokht SMA, Gharakhanlou R, Naghdi N, Khodadadi D, Zare Zade Mehrizi AA. The Effect of the Treadmill Running on Genes Expression Ofthepgc-1α, FNDC5 and BDNF in Hippocampus of Male Rats. Journal of Practical Studies of Biosciences in Sport 2019; 7(14): 91-101.[Persain]
28- Hegazy MA, Abdelmonsif DA, Zeitoun TM, El-Sayed NS, Samy DM. Swimming Exercise Versus L-Carnosine Supplementation for Alzheimer’s Dementia in Rats: Implication of Circulating and Hippocampal FNDC5/Irisin. J Physiol Biochem 2022; 78(1): 109-24.
29- Lourenco MV, Frozza RL, de Freitas GB, Zhang H, Kincheski GC, Ribeiro FC, et al. Exercise-Linked FNDC5/Irisin Rescues Synaptic Plasticity and Memory Defects in Alzheimer’s Models. Nat Med 2019; 25(1): 165-75.
30- Babaei A, Nourshahi M, Fani M, Entezari Z, Jameie SB, Haghparast A. The Effectiveness of Continuous and Interval Exercise Preconditioning Against Chronic Unpredictable Stress: Involvement of Hippocampal PGC-1α/FNDC5/BDNF Pathway. J Psychiatr Res 2021; 136: 173-83.
31- Martinez Munoz IY, Camarillo Romero EdS, Garduno Garcia JdJ. Irisin a Novel Metabolic Biomarker: Present Knowledge and Future Directions. Int J Endocrinol 2018; 2018: 7816806.
32- Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. A PGC1-Α-Dependent Myokine that Drives Brown-Fat-Like Development of White Fat and Thermogenesis. Nature 2012; 481(7382): 463-8.
33- Huh JY, Mougios V, Kabasakalis A, Fatouros I, Siopi A, Douroudos II, et al. Exercise-Induced Irisin Secretion is Independent of Age or Fitness Level and Increased Irisin May Directly Modulate Muscle Metabolism through AMPK Activation. J Clin Endocrinol Metab 2014; 99(11): E2154-E61.
34- Seale P, Conroe HM, Estall J, Kajimura S, Frontini A, Ishibashi J, et al. Prdm16 Determines the Thermogenic Program of Subcutaneous White Adipose Tissue in Mice. J Clinical Investigat 2011; 121(1): 96-105.
35- Hee Park K, Zaichenko L, Brinkoetter M, Thakkar B, Sahin-Efe A, Joung KE, et al. Circulating Irisin in Relation to Insulin Resistance and the Metabolic Syndrome. J Clin Endocrinol Metab 2013; 98(12): 4899-907.
36- Hecksteden A, Wegmann M, Steffen A, Kraushaar J, Morsch A, Ruppenthal S, et al. Irisin and Exercise Training in Humans–Results from a Randomized Controlled Training Trial. BMC Med 2013; 11(1): 235.
37- Kim HJ, Lee HJ, So B, Son JS, Yoon D, Song W. Effect of Aerobic Training and Resistance Training on Circulating Irisin Level and their Association with Change of Body Composition in Overweight/Obese Adults: a Pilot Study. Physioll Res 2016; 65(2): 271-9.
38- Colberg SR, Simoneau JA, Thaete FL, Kelley DE. Skeletal Muscle Utilization of Free Fatty Acids in Women with Visceral Obesity. J Clin Invest 1995; 95(4): 1846-53.
39- Alahmadi M. High-Intensity Interval Training and Obesity. J Nov Physiother 2014; 4(3): 1-6.
40- Gibala MJ, Little JP, Van Essen M, Wilkin GP, Burgomaster KA, Safdar A, et al. Short Term Sprint Interval Versus Traditional Endurance Training: Similar Initial Adaptations in Human Skeletal Muscle and Exercise Performance. J physiol 2006; 575(pt 3): 901-11.
41- Astorino TA, Schubert MM, Palumbo E, Stirling D, McMillan DW. Effect of Two Doses of Interval Training on Maximal Fat Oxidation in Sedentary Women. Med Sci Sports Exerc 2013; 45(10): 1878-86.
42- Talanian JL, Holloway GP, Snook LA, Heigenhauser GJ, Bonen A, Spriet LL. Exercise Training Increases Sarcolemmal and Mitochondrial Fatty Acid Transport Proteins in Human Skeletal Muscle. Am J Physiol Endocrinol Metab 2010; 299(2): E180-E8.
43- Taylor AJ, Watkins T, Bell D, Carrow J, Bindeman J, Scherr D, et al. Physical Activity and the Presence and Extent of Calcified Coronary Atherosclerosis. Med Sci Sports Exerc 2002; 34(2): 228-33.
44- Lewis GF, Rader DJ. New Insights Into the Regulation of HDL Metabolism and Reverse Cholesterol Transport. Circ Res 2005; 96(12): 1221-32.
45- Tofighi A, Alizadeh R, Tolouei Azar J. The Effect of Eight Weeks High Intensity Interval Training (HIIT) on Serum Amounts of FGF21 and Irisin in Sedentary Obese Women. Studies in Medical Sciences 2017; 28(7): 453-66.
46- Trapp EG, Chisholm DJ, Boutcher SH. Metabolic Response of Trained and Untrained Women During High-Intensity Intermittent Cycle Exercise. Am J Physiol Regul Integr Comp Physiol 2007; 293(6): R2370-5.
47- Talanian JL, Galloway SDR, Heigenhauser GJF, Bonen A, Spriet LL. Two Weeks of High-Intensity Aerobic Interval Training Increases the Capacity for Fat Oxidation during Exercise in Women. J Appl Physiol (1985) 2007; 102(4):1439-47.
48- Deighton K, Barry R, Connon CE, Stensel DJ. Appetite, Gut Hormone and Energy Intake Responses to Low Volume Sprint Interval and Traditional Endurance Exercise. Eur J Appl Physiol 2013; 113(5): 1147-56.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1401/8/18 | پذیرش: 1401/10/17 | انتشار: 1402/2/15
دریافت: 1401/8/18 | پذیرش: 1401/10/17 | انتشار: 1402/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







