دوره 31، شماره 2 - ( اردیبهشت 1402 )
جلد 31 شماره 2 صفحات 6406-6396 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghaffarian A, Ebrahimi Kalan A, Afshari F, Alipanah-Moghadam R. Effect of Vaccinium Arctostaphylus Plant Extract on the Histopathological Alterations of Cisplatin on Testicular Tissue. JSSU 2023; 31 (2) :6396-6406
URL: http://jssu.ssu.ac.ir/article-1-5835-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5835-fa.html
غفاریان علی، ابراهیمی کلان عباس، افشاری فاطمه، علیپناه مقدم رضا. تاثیر عصاره گیاه واکسینیوم آرکتوستافیلوس بر تغییرات هیستوپاتولوژیک ناشی از سیسپلاتین بر بافت بیضه. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (2) :6396-6406
متن کامل [PDF 1034 kb]
(548 دریافت)
| چکیده (HTML) (1605 مشاهده)
متن کامل: (662 مشاهده)
مقدمه
سیس پلاتین یکی از پرکاربردترین داروها برای درمان انواع سرطان های مانند سیستم عصبی، تناسلی، تنفسی و...میباشد. سیس پلاتین از طریق مکانیسم های متعدد فعالیت ضد سرطانی را انجام می دهد ، اما قابل قبول ترین مکانیسم آن ایجاد آسیب در ساختار DNA از طریق تاثیر بر روی بازهای پورین موجود بر روی DNA و فعال کردن چندین مسیر انتقال سیگنال است که در نهایت منجر به آپوپتوز و از بین رفتن سلول سرطانی می شود. اثرات سیتوتوکسیک ناشی از بازجذب سیسپلاتین به واسطه انتقال دهندههای کاتیونی و افزایش گونههای رادیکال اکسیژن صورت میگیرد که منجر به فعال شدن مسیرهای آپوپتوزی داخلی، خارجی، تخریب DNA و پراکسیده شدن لیپیدها میشود (2-1). اسپرم یکی از سلولهایی است که در اثر استفاده از سیسپلاتین دچار تغییر شکل شده و منجر به ایجاد شکلهای غیرطبیعی، القا مرگ سلولی و کاهش حرکت رو به جلو در اسپرم میشود (4-3). واکسینیوم آرکتوفیلوس (با نام مرسوم قرهقاط) از خانواده اریکاسه به صورت درختچههایی با برگهای ساده و معمولاً همیشه سبز میباشد. برگهای این گیاه مضرس میباشد. گلها نیز معمولاً محوری یا انتهایی هستند و ممکن است به صورت منفرد در پوششی به شکل خوشه یا سنبله قرار گیرند. میوه ممکن است به رنگهای قرمز، آبی، مشکی، ارغوانی و یا سبز متمایل به زرد دیده شود (5). از گیاهانیکه در جنس واکسینیوم قرار دارند اثرات ضدمیکروبی، ضدویروسی، ضدسرطان، ضددیابت و آنتیاکسیدانی گزارش شده است. ترکیبات موثر گیاه همانند مواد فنلی، آنتوسیانین، میریستین، کاروارکول و تیمول موجود در عصاره این گیاهان میتواند از رشد پاتوژنهای رودهای ممانعت کند. همچنین آنتوسیانینها به عنوان ترکیبات فنولیکی میتوانند عوارض جانبی ناشی از سیسپلاتین را تا حد زیادی کاهش دهند (10-6). از دیگر فعالیتهای ضدمیکروبی این گیاهان، جلوگیری از عفونت مجاری ادراری، درمان ناراحتیهای گوارشی و کاهش فشارخون است. همچنین ثابت شده است گیاهان جنس واکسینیوم از رشد و تکثیـر تومـورها ممانعـت بهعمل میآورد (6،7،10). در بین مواد موثر در این گیاه، فالونوئید یک آنتیاکسیدان قوی میباشد که میتواند بهطور نسبی نفروتوکسیسیتی که عارضه اصلی ناشی از سیسپلاتین است را کاهش دهد همچنین دارای اثرات ضدالتهابی، ضدآلرژی، ضدسرطانی میباشد (9). نتایج بررسیهای انجام شده بر روی ظرفیت آنتیاکسیدانی و مقدار ترکیبات فنولی در فصول مختلف در 13 نمونه اصلاح شده نشان داد که ترکیبات فنلی آنتوسیانین و هیدروکسیسینامیک اسید و کل فالونوئیدها در ژنوتیپهای مختلف متفاوت میباشد (13-11). در گزارشی دستهبندی و تعیین مقدار فنولیک اسید در میوههای گیاه واکسینیوم در کشور ترکیه مشخص نموده است که میتوان میوههای این گیاه را به عنوان منبع خوبی از فنولیک اسیدها معرفی نمود. اکثر گونههای موجود در جنس Vaccinium خاصیت دارویی دارند و گونه موجود در ایران نیز از این قاعده مستثنی نمیباشد (16-14). واکـسینیـوم آرکتوستافیلوس، تنها گونه از این جنس است که در ایران رشد میکند. این گیاه در شمال و شمال شرقی ایران، ارتفاعات استان گیلان، کالردشت، خانقاه اردبیل و آذربایجان غربی میروید (17). نظر به افزایش آمار سرطان و اهمیت حفظ باروری، هدف از این مطالعه بررسی اثرات سیسپلانین و اثرات درمانی گیاه واکـسینیـوم آرکتوستافیلوس با دوزهای مختلف بر پارامترهای هیستوپاتولوژیک بافت بیضه میباشد.
روش بررسی
حیوانات: در این مطالعه مورد- شاهدی از موشهای بزرگ آزمایشگاهی، نژاد ویستار استفاده شد که از حیوانخانه دانشگاه علوم پزشکی تبریز تهیه شدند. غذای روزانه این موشها ابه صورت فشرده بود. آب مورد نیاز توسط ظروف شیشهای در اختیار حیوانات قرار میگرفت و درجه حرارت حدود 22 درجه سانتیگراد و تحت شرایط یکسان سیکل نوری دوازده ساعت روشنایی و دوازده ساعت تاریکی نگهداری میشدند. پس از تهیه گیاه واکسینیوم آرکتوستافیلوس (ایران-آذربایجان) با کد 181، آن را خشککرده سپس پودر میکنیم و از پودر بهدست آمده برای تهیه عصاره خشک (با استفاده از اتانول 50 درصد) و سپس غلظتهای مورد نظر عصاره واکسینیوم آرکتوستافیلوس استفاده خواهیم کرد.
گروههای آزمایشی: تعداد 40 موش آزمایشگاهی نژاد ویستار با وزن تقریبی 200-250 گرم در 5 گروه 8تایی طبقهبندی شدند .1-گروه کنترل منفی: تزریق 1 سیسی سرم فیزیولوژیک بهصورت پریتونئال به مدت 2 هفته2- گروه کنترل مثبت: تزریق 1 سیسی سرم فیزیولوژیک بهصورت پریتونئال به مدت 2 هفته سپس دریافت تک دوز سیسپلاتین (mg/kg 5) 3- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین: در این گروه به حیوانات 1 سیسی عصاره با غلظت mg/kg 100 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد.
4- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین: در این گروه به موشها 1 سیسی عصاره با غلظت mg/kg 200 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد. 5- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 300 و سیسپلاتین: در این گروه به حیوانات 1 سیسی عصاره با غلظت mg/kg 300 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد. بعد از 24 ساعت حیوانات با روش جابجایی مهرههای گردنی کشته شدند و سپس بافت بیضه سمت راست حیوانات جدا شد و پس از رنگآمیزی H&E از نظر بافتشناسی و آسیب سلولی مورد ارزیابی کمی و کیفی قرار گرفت. برای اندازهگیری قطر لولههای سمینیفر از نرمافزار keview استفاده گردید. برای این منظور از مقاطع تهیه شده برای هر موش، در 20 میدان، با عدسی 10، قطرهای عمود برهم لولههای سمینیفر که بهصورت عرضی مقطع خورده بودند اندازهگیری شد. سپس میانگین اقطار محاسبه شده و دادههای بهدست آمده از محاسبه، بهوسیله روشهای آماری مورد بررسی و تجزیه قرار گرفت. همچنین، تعداد سلولهای اسپرماتوگونی در 20 میدان با عدسی 40 مورد شمارش قرار گرفت.
تجریه و تحلیل آماری
در این مطالعه از روش آماری تی تست و One way anova برای مقایسه بین گروهها در نرمافزار9 Prism - GraphPad استفاده شد. برای مطالعه هیستولوژیک، نمونهها توسط رنگ آمیزی H&E مورد بررسی قرار گرفتند. بهطوریکه بعد از فیکس کردن درفرمالین ده درصد و قالبگیری با پارافین، برشهای 5 میکرون بهصورت سریال سکشن تهیه و پس از رنگآمیزی با میکروسکوپ نوری مورد بررسی قرار گرفتند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی تبریز تایید شده است (کد اخلاق IR.IAU.TABRIZ.REC.1400.078)
نتایج
مطالعات هیستوپاتولوژیک: بررسی بافتهای بیضه در گروهها آزمایشی و مقایسه آن بهصورت زیر انجام گرفت. نتایج بهصورت زیر در گروههای آزمایشی قابل بررسی است.
در تصویرالف، G1 (گروه کنترل منفی) لولههای سمینیفر دارای اپی تلیوم ژرمینال ضخیمی بودند که سلولهای اسپرماتوژنیک در مراحل مختلف تکاملی در آنها دیده میشد. سلولهای اسپرماتوگونی روی غشای پایه قرار داشته و به سهولت قابل تشخیص و قابل شمارش بودند. سایر سلولهای اسپرماتوژنیک در مراحل مختلف تکامل و در چند ردیف دیده میشدند.
در بخش G2 تصویر الف (گروه کنترل مثبت) بررسی با میکروسکوپ نوری مشخص کرد که قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه کنترل کاهش یافته است. آسیب پارامترهای بافتی قابل مشاهده هست.
در بخش G3 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین) قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه G2 افزایش یافته بود اما همچنان نسبت به گروهG1 کمتر بود. بهبود آسیب پارامترهای بافتی قابل مشاهده هست.
در بخش G4 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین). قطر لولههای سمینیفر، و تعداد اسپرماتوگونیها نسبت به گروهG3 و کنترل کاهش یافته بود. اما ضخامت اپیتلیوم ژرمینال در گروه G4به نسب گروه G3 افزایش نسبی داشت. در بخش G5 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 300 و سیسپلاتین) بررسی بیضه نشان داد که قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه G4 و کنترل کاهش یافته بود. آسیب پارامترهای بافتی در گروه مذکور مشابه گروه دریافتکننده سیسپلاتین میباشد و بهبود معنیداری بهنظر نمیرسد.

تصویر الف) مقاطع بافتی بیضه در گروههای مختلف کنترل و آزمایشی، بزرگنمایی: 400X، برای مطالعه هیستولوژیک مقاطع 5 میکرونی رنگآمیزی H&E مورد استفاده قرار گرفتند.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.
(SP: Spermatogonia, PS: Primary Spermatocyte, S: Spermatis, SL: Seminiferous Lumen)
نتایج مطالعات هیستومورفومتریک
ارزیابی تعداد سلولهای اسپرماتوگونی: برای تعیین تعداد سلولهای اسپرماتوگونی، ابتدا بزرگنمایی میکروسکوپ یر روی 10 تنظیم شد. سپس به روش شمارش دستی تعداد این سلولها در مقطع عرضی 20 لوله سمینیفر برای هر نمونه مورد شمارش قرار گرفتند. میانگین تعداد این سلولها در گروه مختلف نسبت به هم تغییرات معنیداری را نشان میدهد. مقایسه آماری ارقام بهدست آمده نشان داد که تعداد سلولهای اسپرماتوگونی در گروه آزمایشی G2 نسبت به گروه G1 بهطور معنیداری کاهش یافته است ((P=0.01، ولی در گروه G3، تعداد سلولهای اسپرماتوگونیها نسبت به گروه G2افزایش یافته بود (P=0.02) اما همچنان نسبت به گروه G1کمتر بود (P=0.01). تعداد سلولهای اسپرماتوگونیها درگروههای G4و G5نسبت به گروه G3 کاهش معنیداری نشان میدهد. تعداد سلولهای اسپرماتوگونی در G5نسبت به G4کاهش قابل توجهی را نشان نمیدهد (نمودار 1).
ارزیابی قطر لولههای سمینیفر: برای محاسبه قطر لولههای سمینیفر، ابتدا اقطار کوچک و بزرگ لولههای سمینیفر در مقطع عرضی 20 لوله سمینیفر از هر نمونه اندازهگیری و سپس میانگین آنها تعیین شد و نتایج بدست آمده در هر گروه با گروههای دیگر از نظر آماری مورد بررسی و مقایسه قرار گرفت. بر این اساس، میانگین قطر لولههای سمینیفر در گروههای مختلف دچار تغییر شده بود. مقایسه آماری ارقام بهدست آمده نشان داد که قطر لولههای سمینیفر در گروه آزمایشی G2 نسبت به گروه کنترل G1 بهطور معنیداری کاهش یافته است (p<0.01) ولی در گروهه G3 و G4 قطر لولههای سمینیفر نسبت به گروهG2 افزایش یافته بود اما همچنان نسبت به گروه G1کمتر بود (P =0.01). قطر لولههای سمینیفر درگروه G5نسبت به گروههای دیگر تفاوت معنیداری را نشان نمیدهد (P =0.01) .
ارزیابی اپیتلیوم ژرمینال: بررسی نتایج نشان داد که در گروه دریافتکننده سیسپلاتین (G2) بهطور معنیداری اپیتلیوم ژرمینال کاهش یافته بود (P =0.002) اما نسبت به گروههای G3 (P =0.01) و G4 (P <0.0001) تغییر قابلملاحظهای مشاهده نشد. یهبود نسبی همراه با افزایش نسبی سلولها در گروههای G3 و G4 رویت میشود و گروه G5 تفاوت چندانی با گروه G2 شان نمیدهد (P =0.0002).
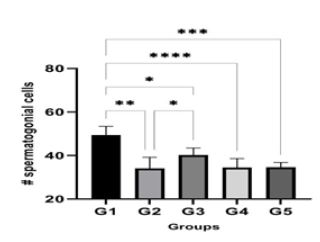
نمودار 1: مقایسه تعداد سلولهای اسپرماتوگونی در گروههای کنترل مثبت و منفی با گروههای آزمایشی.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.
(****: P <0.0001, ***: P =0.0002, **: P =0.002,*: P =0.01)
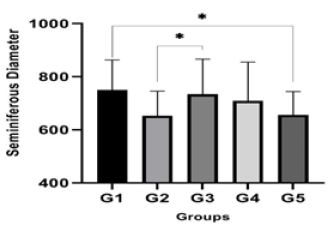
نمودار 2: مقایسه اندازه قطر لوله سمینیفر در گروههای مختلف.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.*: P =0.01
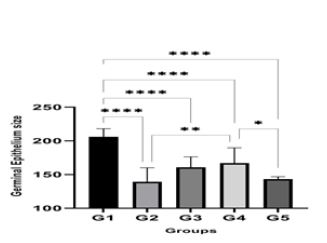
نمودار3: میانگین اندازه اپیتلیوم ژرمینال در گروههای مختلف.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین) ، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس. (****: P <0.0001, **: P =0.002,*: P =0.01
بحث
نتایج بهدست آمده از این مطالعه بیانگر آن است که واکسینیوم آرکتوستافیلوس در بهبود اختلالات ناشی از سیسپلاتین در اپیتلیوم ژرمینال و سایر خصوصیات بافتی تاثیر معنیداری دارد. سیسپلاتین یک عامل ضد نئوپلاستیک است که به طور گسترده برای درمان تومورهای مختلف دستگاه تناسلی استفاده میشود (18) علیرغم این واقعیت که سیسپلاتین یکی از موثرترین داروهای ضد نئوپلاستیک است که در درمان بسیاری از انواع سرطان در انکولوژی بالینی استفاده می شود، مهمترین عارضه جانبی محدودکننده استفاده از آن سمیت وابسته به دوز است. ناباروری متناسب با آسیب بیضه (تصویر الف G2) ناشی از سیسپلاتین است (22-19). بهطور کلی مشکلات ناباروری بعد از شیمی درمانی و رادیوتراپی ایجاد میشود. بنابراین، حفاظت از سلامت باروری موضوع مهمی است که باید در بیماران با نگرانیهای تولید مثل حل شود (24-22). مکانیسم اصلی آسیب بیضه ناشی از سیسپلاتین شامل اختلالات بیوشیمیایی و فیزیولوژیکی ناشی از استرس اکسیداتیو و تشکیل ROSاست (27-25). سایتوکاینهای التهابی، از جمله TNF-α وIL-6، نقش مهمی در اسپرمزایی و استروئیدزایی بیضه در شرایط عادی دارند (28). با اینحال، این سیتوکینها میتوانند در وضعیت التهابی در بیضه تاثیر منفی بر اسپرماتوژنز طبیعی داشته باشند (29). ارزیابی قطر لولههای سمینیفر در گروه دریافت کننده سیسپلاتین نشان داد که. قطر لوله سمینیفر گروه دریافتکننده سیسپلاتین بهطور معناداری کمتر از گروه کنترل بود. بررسیها نشان میدهد پس از استفاده از سیسپلاتین ضخامت اپیتلیوم ژرمینال کاهش مییابد یا بهطور کلی از بین میرود و فقط سلولهای سرتولی باقی میمانند. بنابراین، مراحل اسپرماتوژنز دیگر قابل تشخیص نبوده و تکثیر سلولی در لولههای سمینیفر کاهش یافته و هتروکروماتین هستهای افزایش میابد. ( تصویر الف G2)، (نمودار 2). ارزیابی اپیتلیوم ژرمینال در گروه دریافتکننده سیسپلاتین نشان داد که ضخامت اپیتلیوم ژرمینال در گروه دریافتکننده سیسپلاتین نسبت به گروه کنترل بهطور معناداری کاهش یافته بود. ارزیابی تعداد اسپرماتوگونیها در گروه دریافتکننده سیسپلاتین در این تحقیق نشان داد تعداد اسپرماتوگونیها در گروه دریافتکننده سیسپلاتین نسبت به گروه کنترل بهطور معناداری کمتر بود. (نمودار1 و2). در تایید یافتههای اسمارت و همکاران القای کاهش سریع و قابلتوجهی در جمعیت سلولهای زاینده از جمله سلولهای بنیادی در بیضه قبل از بلوغ و پس از درمان با سیسپلاتین را نشان دادهاند سیسپلاتین همچنین تعداد سلولهای زاینده را حتی زمانی که در غلظتهای پایینتر در سرم بیماران تجویز میشود، کاهش میدهد (30). همچنین یاداو و همکارانش تغییرات دژنراتیو در چندین لوله منیساز و کاهش سلولهای زاینده را پس از درمان با سیسپلاتین گزارش کردهاند که حاکی از تأثیر مضر این عامل بر سلولهای بیضه از طریق القای استرس اکسیداتیو مرتبط با رادیکالهای آزاد است (31). در تایید یافتههای ما، مطالعه همیدی و همکارانش دژنراسیون و از بین رفتن اسپرماتوژنز را در گروه تحت درمان با سیسپلاتین نشان داد. چنین تخریبی درساختار بیضه عمدتاً به آپوپتوز شدید و آسیب اکسیداتیو ناشی از سیسپلاتین اشاره دارد (32). همچنین نتایح به دست آمده از مطالعه تولگا و همکارانش بیاتگر این است که سیسپلاتین منجر به ادماتوز وسیع به دلیل از بین رفتن سلولهای اپیتلیال ژرمینال لولههای اسپرمساز، اسپرماتوسیتها و اسپرماتوگونی با کروماتین متراکم حاوی هستههای آتیپیک و نیز کاهش تعداد اسپرمها و اسپرماتیدها میشود (33). بررسیها نشان میدهد که سیسپلاتین از طریق القای آپوپتوز سلولی بر پتانسیل باروری مردانه تأثیر میگذارد. همچنین پارامترهای اسپرم را کاهش میدهد، تغییراتی در هورمونهاFSH ، LH، و تستوسترون ایجاد میکند (34) و قطر لولههای اسپرمساز را کاهش میدهد (35). همچنین سیسپلاتین تولید گونههای فعال اکسیژن (ROS) را افزایش میدهد که باعث مرگ سلولی میشوند که در راستای نتایج حاصل ار این تحقیق میباشد (36). ترکیبات آنتیاکسیدانی در گیاه واکسینیوم نقش مهمی را در حفاظت از عناصر بافتی همانند: لیپدها، پروتئینها و اسیدهای نوکلئیک در مقابل اثرات اکسیدکنندگی رادیکالهای آزاد اکسیژن و سایر گونههای فعال ایفا میکنند، به طوری که از بروز بیماریهای متعددی از جمله بیماریهای التهابی، سرطان، دیابت، سکته قلبی، آلزایمر و پارکینسون پیشگیری کرده و در درمان آنها موثر میباشد (39-37). ارزیابی قطر لولههای سمینی فردر گروههای دریافتکننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که که گیاه واکسینیوم آرکتوستافیلوس به عنوان یک عامل آنتیاکسیدانی توانسته بود تا حد قابل قبولی تاثیر سیسپلاتین را کاهش دهد. در این آزمایش قطر لولههای سمینیفر در گروه G3نسبت به گروه G2 (گروه دریافتکننده سیسپلاتین) افزایش یافت. اما نسبت به گروه G1که فقط نرمالسالین دریافت کرده بودند همچنان کمتر بود. قطر لولههای سمینیفر در گروهG4 نسبت به گروهG3 کمتر شده بود.همچنین قطر لوله های سمینیفر در گروهG5 نسبت به گروه G4 کاهش نشان میدهد. ( نمودار 2). بررسی ضخامت اپیتلیوم ژرمینال فردر گروههای دریافت کننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که ضخامت اپیتلیوم ژرمینال در گروه G3 نسبت به گروه G2 (گروه دریافتکننده سیسپلاتین) افزایش یافته بود. اما نسبت به گروهG1 که فقط نرمالسالین دریافت کرده بودند همچنان کمتر بود. ضخامت اپیتلیوم ژرمینال در در گروهG4 نسبت به گروه G3 کاهش یافته بود. همچنین ضخامت اپیتلیوم ژرمینال در گروهG5 نسبت به گروه G4کاهش نشان میداد. (تصویرالف)، (نمودار 3). ارزیابی اسپرماتوگونیها در گروههای دریافتکننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که دراولین گروه دریافتکننده گیاه واکسینیوم آرکتوستافیلوس (G3) تعداد اسپرماتوگونیها در گروه G3نسبت به گروه G2 کمتر بود. تعداد اسپرماتوگونیها در گروهG4 نسبت به گروهG3 کمتر بود. همچنین قطر اسپرماتوگونی در گروهG5 نسبت به گروه G4 کاهش نشان میداد (نمودار 1). با توجه به ارزیابی هیستولوژیک، ارزیابی روند آپوپتوز در گروههای مختلف و همچنین ارزیابی پارامترهای سیمن در مطالعات بعدی نیز میتواند نتایج مهمی را بعد از مصرف گیاه مذکور و نقش حفاظتی آن در مقابل مصرف داروی ضدسرطان بهوجود آورد.
نتیجهگیری
بر طبق نتایج بهدست آمده گیاه واکسینیوم آرکتوستافیلوس بهعنوان یک گیاه دارای خواص آنتیاکسیدانی در بهبود اختلالات ناشی از سیسپلاتین درضخامت اپیتلیوم ژرمینال و قطر لوله سمینیفر تاثیر معنیداری دارد و میتواند تعداد سلولهای اسپرماتوگونی که از طریق آپوپتوز از بین میروند را دراپیتلیوم اپیتلیوم ژرمینال کاهش میدهد. نتایج این تحقیق میتواند کمکی در جهت رفع عوارض به وجود آمده به دنبال درمان با سیسپلاتین در مردان مبتلا به سرطان تستیس بنماید.
سپاسگزاری
مطالعه حاضر مستخرج از پایاننامه دانشجویی هست و از زحمات سرکارخانم مهسا رضایی و ناصر خاطرهای که در مراحل مختلف کار صمیمانه همکاری داشتند تشکر و قدردانی میشود.
حامی مالی: این تحقیق با حمایت دانشگاه علوم پرشکی تبریز و دانشگاه علوم پزشکی اردبیل انجام شده است
تعارض در منافع: وجود ندارد.
سیس پلاتین یکی از پرکاربردترین داروها برای درمان انواع سرطان های مانند سیستم عصبی، تناسلی، تنفسی و...میباشد. سیس پلاتین از طریق مکانیسم های متعدد فعالیت ضد سرطانی را انجام می دهد ، اما قابل قبول ترین مکانیسم آن ایجاد آسیب در ساختار DNA از طریق تاثیر بر روی بازهای پورین موجود بر روی DNA و فعال کردن چندین مسیر انتقال سیگنال است که در نهایت منجر به آپوپتوز و از بین رفتن سلول سرطانی می شود. اثرات سیتوتوکسیک ناشی از بازجذب سیسپلاتین به واسطه انتقال دهندههای کاتیونی و افزایش گونههای رادیکال اکسیژن صورت میگیرد که منجر به فعال شدن مسیرهای آپوپتوزی داخلی، خارجی، تخریب DNA و پراکسیده شدن لیپیدها میشود (2-1). اسپرم یکی از سلولهایی است که در اثر استفاده از سیسپلاتین دچار تغییر شکل شده و منجر به ایجاد شکلهای غیرطبیعی، القا مرگ سلولی و کاهش حرکت رو به جلو در اسپرم میشود (4-3). واکسینیوم آرکتوفیلوس (با نام مرسوم قرهقاط) از خانواده اریکاسه به صورت درختچههایی با برگهای ساده و معمولاً همیشه سبز میباشد. برگهای این گیاه مضرس میباشد. گلها نیز معمولاً محوری یا انتهایی هستند و ممکن است به صورت منفرد در پوششی به شکل خوشه یا سنبله قرار گیرند. میوه ممکن است به رنگهای قرمز، آبی، مشکی، ارغوانی و یا سبز متمایل به زرد دیده شود (5). از گیاهانیکه در جنس واکسینیوم قرار دارند اثرات ضدمیکروبی، ضدویروسی، ضدسرطان، ضددیابت و آنتیاکسیدانی گزارش شده است. ترکیبات موثر گیاه همانند مواد فنلی، آنتوسیانین، میریستین، کاروارکول و تیمول موجود در عصاره این گیاهان میتواند از رشد پاتوژنهای رودهای ممانعت کند. همچنین آنتوسیانینها به عنوان ترکیبات فنولیکی میتوانند عوارض جانبی ناشی از سیسپلاتین را تا حد زیادی کاهش دهند (10-6). از دیگر فعالیتهای ضدمیکروبی این گیاهان، جلوگیری از عفونت مجاری ادراری، درمان ناراحتیهای گوارشی و کاهش فشارخون است. همچنین ثابت شده است گیاهان جنس واکسینیوم از رشد و تکثیـر تومـورها ممانعـت بهعمل میآورد (6،7،10). در بین مواد موثر در این گیاه، فالونوئید یک آنتیاکسیدان قوی میباشد که میتواند بهطور نسبی نفروتوکسیسیتی که عارضه اصلی ناشی از سیسپلاتین است را کاهش دهد همچنین دارای اثرات ضدالتهابی، ضدآلرژی، ضدسرطانی میباشد (9). نتایج بررسیهای انجام شده بر روی ظرفیت آنتیاکسیدانی و مقدار ترکیبات فنولی در فصول مختلف در 13 نمونه اصلاح شده نشان داد که ترکیبات فنلی آنتوسیانین و هیدروکسیسینامیک اسید و کل فالونوئیدها در ژنوتیپهای مختلف متفاوت میباشد (13-11). در گزارشی دستهبندی و تعیین مقدار فنولیک اسید در میوههای گیاه واکسینیوم در کشور ترکیه مشخص نموده است که میتوان میوههای این گیاه را به عنوان منبع خوبی از فنولیک اسیدها معرفی نمود. اکثر گونههای موجود در جنس Vaccinium خاصیت دارویی دارند و گونه موجود در ایران نیز از این قاعده مستثنی نمیباشد (16-14). واکـسینیـوم آرکتوستافیلوس، تنها گونه از این جنس است که در ایران رشد میکند. این گیاه در شمال و شمال شرقی ایران، ارتفاعات استان گیلان، کالردشت، خانقاه اردبیل و آذربایجان غربی میروید (17). نظر به افزایش آمار سرطان و اهمیت حفظ باروری، هدف از این مطالعه بررسی اثرات سیسپلانین و اثرات درمانی گیاه واکـسینیـوم آرکتوستافیلوس با دوزهای مختلف بر پارامترهای هیستوپاتولوژیک بافت بیضه میباشد.
روش بررسی
حیوانات: در این مطالعه مورد- شاهدی از موشهای بزرگ آزمایشگاهی، نژاد ویستار استفاده شد که از حیوانخانه دانشگاه علوم پزشکی تبریز تهیه شدند. غذای روزانه این موشها ابه صورت فشرده بود. آب مورد نیاز توسط ظروف شیشهای در اختیار حیوانات قرار میگرفت و درجه حرارت حدود 22 درجه سانتیگراد و تحت شرایط یکسان سیکل نوری دوازده ساعت روشنایی و دوازده ساعت تاریکی نگهداری میشدند. پس از تهیه گیاه واکسینیوم آرکتوستافیلوس (ایران-آذربایجان) با کد 181، آن را خشککرده سپس پودر میکنیم و از پودر بهدست آمده برای تهیه عصاره خشک (با استفاده از اتانول 50 درصد) و سپس غلظتهای مورد نظر عصاره واکسینیوم آرکتوستافیلوس استفاده خواهیم کرد.
گروههای آزمایشی: تعداد 40 موش آزمایشگاهی نژاد ویستار با وزن تقریبی 200-250 گرم در 5 گروه 8تایی طبقهبندی شدند .1-گروه کنترل منفی: تزریق 1 سیسی سرم فیزیولوژیک بهصورت پریتونئال به مدت 2 هفته2- گروه کنترل مثبت: تزریق 1 سیسی سرم فیزیولوژیک بهصورت پریتونئال به مدت 2 هفته سپس دریافت تک دوز سیسپلاتین (mg/kg 5) 3- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین: در این گروه به حیوانات 1 سیسی عصاره با غلظت mg/kg 100 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد.
4- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین: در این گروه به موشها 1 سیسی عصاره با غلظت mg/kg 200 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد. 5- گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 300 و سیسپلاتین: در این گروه به حیوانات 1 سیسی عصاره با غلظت mg/kg 300 بهصورت پریتونئال به مدت 2 هفته و سپس تک دوز سیسپلاتین (mg/kg 5) تزریق شد. بعد از 24 ساعت حیوانات با روش جابجایی مهرههای گردنی کشته شدند و سپس بافت بیضه سمت راست حیوانات جدا شد و پس از رنگآمیزی H&E از نظر بافتشناسی و آسیب سلولی مورد ارزیابی کمی و کیفی قرار گرفت. برای اندازهگیری قطر لولههای سمینیفر از نرمافزار keview استفاده گردید. برای این منظور از مقاطع تهیه شده برای هر موش، در 20 میدان، با عدسی 10، قطرهای عمود برهم لولههای سمینیفر که بهصورت عرضی مقطع خورده بودند اندازهگیری شد. سپس میانگین اقطار محاسبه شده و دادههای بهدست آمده از محاسبه، بهوسیله روشهای آماری مورد بررسی و تجزیه قرار گرفت. همچنین، تعداد سلولهای اسپرماتوگونی در 20 میدان با عدسی 40 مورد شمارش قرار گرفت.
تجریه و تحلیل آماری
در این مطالعه از روش آماری تی تست و One way anova برای مقایسه بین گروهها در نرمافزار9 Prism - GraphPad استفاده شد. برای مطالعه هیستولوژیک، نمونهها توسط رنگ آمیزی H&E مورد بررسی قرار گرفتند. بهطوریکه بعد از فیکس کردن درفرمالین ده درصد و قالبگیری با پارافین، برشهای 5 میکرون بهصورت سریال سکشن تهیه و پس از رنگآمیزی با میکروسکوپ نوری مورد بررسی قرار گرفتند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی تبریز تایید شده است (کد اخلاق IR.IAU.TABRIZ.REC.1400.078)
نتایج
مطالعات هیستوپاتولوژیک: بررسی بافتهای بیضه در گروهها آزمایشی و مقایسه آن بهصورت زیر انجام گرفت. نتایج بهصورت زیر در گروههای آزمایشی قابل بررسی است.
در تصویرالف، G1 (گروه کنترل منفی) لولههای سمینیفر دارای اپی تلیوم ژرمینال ضخیمی بودند که سلولهای اسپرماتوژنیک در مراحل مختلف تکاملی در آنها دیده میشد. سلولهای اسپرماتوگونی روی غشای پایه قرار داشته و به سهولت قابل تشخیص و قابل شمارش بودند. سایر سلولهای اسپرماتوژنیک در مراحل مختلف تکامل و در چند ردیف دیده میشدند.
در بخش G2 تصویر الف (گروه کنترل مثبت) بررسی با میکروسکوپ نوری مشخص کرد که قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه کنترل کاهش یافته است. آسیب پارامترهای بافتی قابل مشاهده هست.
در بخش G3 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین) قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه G2 افزایش یافته بود اما همچنان نسبت به گروهG1 کمتر بود. بهبود آسیب پارامترهای بافتی قابل مشاهده هست.
در بخش G4 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین). قطر لولههای سمینیفر، و تعداد اسپرماتوگونیها نسبت به گروهG3 و کنترل کاهش یافته بود. اما ضخامت اپیتلیوم ژرمینال در گروه G4به نسب گروه G3 افزایش نسبی داشت. در بخش G5 تصویر الف (گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 300 و سیسپلاتین) بررسی بیضه نشان داد که قطر لولههای سمینیفر، ضخامت اپیتلیوم ژرمینال لولههای سمینیفر و تعداد اسپرماتوگونیها نسبت به گروه G4 و کنترل کاهش یافته بود. آسیب پارامترهای بافتی در گروه مذکور مشابه گروه دریافتکننده سیسپلاتین میباشد و بهبود معنیداری بهنظر نمیرسد.

تصویر الف) مقاطع بافتی بیضه در گروههای مختلف کنترل و آزمایشی، بزرگنمایی: 400X، برای مطالعه هیستولوژیک مقاطع 5 میکرونی رنگآمیزی H&E مورد استفاده قرار گرفتند.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.
(SP: Spermatogonia, PS: Primary Spermatocyte, S: Spermatis, SL: Seminiferous Lumen)
نتایج مطالعات هیستومورفومتریک
ارزیابی تعداد سلولهای اسپرماتوگونی: برای تعیین تعداد سلولهای اسپرماتوگونی، ابتدا بزرگنمایی میکروسکوپ یر روی 10 تنظیم شد. سپس به روش شمارش دستی تعداد این سلولها در مقطع عرضی 20 لوله سمینیفر برای هر نمونه مورد شمارش قرار گرفتند. میانگین تعداد این سلولها در گروه مختلف نسبت به هم تغییرات معنیداری را نشان میدهد. مقایسه آماری ارقام بهدست آمده نشان داد که تعداد سلولهای اسپرماتوگونی در گروه آزمایشی G2 نسبت به گروه G1 بهطور معنیداری کاهش یافته است ((P=0.01، ولی در گروه G3، تعداد سلولهای اسپرماتوگونیها نسبت به گروه G2افزایش یافته بود (P=0.02) اما همچنان نسبت به گروه G1کمتر بود (P=0.01). تعداد سلولهای اسپرماتوگونیها درگروههای G4و G5نسبت به گروه G3 کاهش معنیداری نشان میدهد. تعداد سلولهای اسپرماتوگونی در G5نسبت به G4کاهش قابل توجهی را نشان نمیدهد (نمودار 1).
ارزیابی قطر لولههای سمینیفر: برای محاسبه قطر لولههای سمینیفر، ابتدا اقطار کوچک و بزرگ لولههای سمینیفر در مقطع عرضی 20 لوله سمینیفر از هر نمونه اندازهگیری و سپس میانگین آنها تعیین شد و نتایج بدست آمده در هر گروه با گروههای دیگر از نظر آماری مورد بررسی و مقایسه قرار گرفت. بر این اساس، میانگین قطر لولههای سمینیفر در گروههای مختلف دچار تغییر شده بود. مقایسه آماری ارقام بهدست آمده نشان داد که قطر لولههای سمینیفر در گروه آزمایشی G2 نسبت به گروه کنترل G1 بهطور معنیداری کاهش یافته است (p<0.01) ولی در گروهه G3 و G4 قطر لولههای سمینیفر نسبت به گروهG2 افزایش یافته بود اما همچنان نسبت به گروه G1کمتر بود (P =0.01). قطر لولههای سمینیفر درگروه G5نسبت به گروههای دیگر تفاوت معنیداری را نشان نمیدهد (P =0.01) .
ارزیابی اپیتلیوم ژرمینال: بررسی نتایج نشان داد که در گروه دریافتکننده سیسپلاتین (G2) بهطور معنیداری اپیتلیوم ژرمینال کاهش یافته بود (P =0.002) اما نسبت به گروههای G3 (P =0.01) و G4 (P <0.0001) تغییر قابلملاحظهای مشاهده نشد. یهبود نسبی همراه با افزایش نسبی سلولها در گروههای G3 و G4 رویت میشود و گروه G5 تفاوت چندانی با گروه G2 شان نمیدهد (P =0.0002).

نمودار 1: مقایسه تعداد سلولهای اسپرماتوگونی در گروههای کنترل مثبت و منفی با گروههای آزمایشی.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.
(****: P <0.0001, ***: P =0.0002, **: P =0.002,*: P =0.01)

نمودار 2: مقایسه اندازه قطر لوله سمینیفر در گروههای مختلف.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین)، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس.*: P =0.01

نمودار3: میانگین اندازه اپیتلیوم ژرمینال در گروههای مختلف.
G1: گروه کنترل منفی، G2: گروه کنترل مثبت (دریافتکننده فقط سیسپلاتین) ، G3: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 100 و سیسپلاتین، G4: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس با غلظت mg/kg 200 و سیسپلاتین، G5: گروه دریافتکننده عصاره واکسینیوم آرکتوستافیلوس. (****: P <0.0001, **: P =0.002,*: P =0.01
بحث
نتایج بهدست آمده از این مطالعه بیانگر آن است که واکسینیوم آرکتوستافیلوس در بهبود اختلالات ناشی از سیسپلاتین در اپیتلیوم ژرمینال و سایر خصوصیات بافتی تاثیر معنیداری دارد. سیسپلاتین یک عامل ضد نئوپلاستیک است که به طور گسترده برای درمان تومورهای مختلف دستگاه تناسلی استفاده میشود (18) علیرغم این واقعیت که سیسپلاتین یکی از موثرترین داروهای ضد نئوپلاستیک است که در درمان بسیاری از انواع سرطان در انکولوژی بالینی استفاده می شود، مهمترین عارضه جانبی محدودکننده استفاده از آن سمیت وابسته به دوز است. ناباروری متناسب با آسیب بیضه (تصویر الف G2) ناشی از سیسپلاتین است (22-19). بهطور کلی مشکلات ناباروری بعد از شیمی درمانی و رادیوتراپی ایجاد میشود. بنابراین، حفاظت از سلامت باروری موضوع مهمی است که باید در بیماران با نگرانیهای تولید مثل حل شود (24-22). مکانیسم اصلی آسیب بیضه ناشی از سیسپلاتین شامل اختلالات بیوشیمیایی و فیزیولوژیکی ناشی از استرس اکسیداتیو و تشکیل ROSاست (27-25). سایتوکاینهای التهابی، از جمله TNF-α وIL-6، نقش مهمی در اسپرمزایی و استروئیدزایی بیضه در شرایط عادی دارند (28). با اینحال، این سیتوکینها میتوانند در وضعیت التهابی در بیضه تاثیر منفی بر اسپرماتوژنز طبیعی داشته باشند (29). ارزیابی قطر لولههای سمینیفر در گروه دریافت کننده سیسپلاتین نشان داد که. قطر لوله سمینیفر گروه دریافتکننده سیسپلاتین بهطور معناداری کمتر از گروه کنترل بود. بررسیها نشان میدهد پس از استفاده از سیسپلاتین ضخامت اپیتلیوم ژرمینال کاهش مییابد یا بهطور کلی از بین میرود و فقط سلولهای سرتولی باقی میمانند. بنابراین، مراحل اسپرماتوژنز دیگر قابل تشخیص نبوده و تکثیر سلولی در لولههای سمینیفر کاهش یافته و هتروکروماتین هستهای افزایش میابد. ( تصویر الف G2)، (نمودار 2). ارزیابی اپیتلیوم ژرمینال در گروه دریافتکننده سیسپلاتین نشان داد که ضخامت اپیتلیوم ژرمینال در گروه دریافتکننده سیسپلاتین نسبت به گروه کنترل بهطور معناداری کاهش یافته بود. ارزیابی تعداد اسپرماتوگونیها در گروه دریافتکننده سیسپلاتین در این تحقیق نشان داد تعداد اسپرماتوگونیها در گروه دریافتکننده سیسپلاتین نسبت به گروه کنترل بهطور معناداری کمتر بود. (نمودار1 و2). در تایید یافتههای اسمارت و همکاران القای کاهش سریع و قابلتوجهی در جمعیت سلولهای زاینده از جمله سلولهای بنیادی در بیضه قبل از بلوغ و پس از درمان با سیسپلاتین را نشان دادهاند سیسپلاتین همچنین تعداد سلولهای زاینده را حتی زمانی که در غلظتهای پایینتر در سرم بیماران تجویز میشود، کاهش میدهد (30). همچنین یاداو و همکارانش تغییرات دژنراتیو در چندین لوله منیساز و کاهش سلولهای زاینده را پس از درمان با سیسپلاتین گزارش کردهاند که حاکی از تأثیر مضر این عامل بر سلولهای بیضه از طریق القای استرس اکسیداتیو مرتبط با رادیکالهای آزاد است (31). در تایید یافتههای ما، مطالعه همیدی و همکارانش دژنراسیون و از بین رفتن اسپرماتوژنز را در گروه تحت درمان با سیسپلاتین نشان داد. چنین تخریبی درساختار بیضه عمدتاً به آپوپتوز شدید و آسیب اکسیداتیو ناشی از سیسپلاتین اشاره دارد (32). همچنین نتایح به دست آمده از مطالعه تولگا و همکارانش بیاتگر این است که سیسپلاتین منجر به ادماتوز وسیع به دلیل از بین رفتن سلولهای اپیتلیال ژرمینال لولههای اسپرمساز، اسپرماتوسیتها و اسپرماتوگونی با کروماتین متراکم حاوی هستههای آتیپیک و نیز کاهش تعداد اسپرمها و اسپرماتیدها میشود (33). بررسیها نشان میدهد که سیسپلاتین از طریق القای آپوپتوز سلولی بر پتانسیل باروری مردانه تأثیر میگذارد. همچنین پارامترهای اسپرم را کاهش میدهد، تغییراتی در هورمونهاFSH ، LH، و تستوسترون ایجاد میکند (34) و قطر لولههای اسپرمساز را کاهش میدهد (35). همچنین سیسپلاتین تولید گونههای فعال اکسیژن (ROS) را افزایش میدهد که باعث مرگ سلولی میشوند که در راستای نتایج حاصل ار این تحقیق میباشد (36). ترکیبات آنتیاکسیدانی در گیاه واکسینیوم نقش مهمی را در حفاظت از عناصر بافتی همانند: لیپدها، پروتئینها و اسیدهای نوکلئیک در مقابل اثرات اکسیدکنندگی رادیکالهای آزاد اکسیژن و سایر گونههای فعال ایفا میکنند، به طوری که از بروز بیماریهای متعددی از جمله بیماریهای التهابی، سرطان، دیابت، سکته قلبی، آلزایمر و پارکینسون پیشگیری کرده و در درمان آنها موثر میباشد (39-37). ارزیابی قطر لولههای سمینی فردر گروههای دریافتکننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که که گیاه واکسینیوم آرکتوستافیلوس به عنوان یک عامل آنتیاکسیدانی توانسته بود تا حد قابل قبولی تاثیر سیسپلاتین را کاهش دهد. در این آزمایش قطر لولههای سمینیفر در گروه G3نسبت به گروه G2 (گروه دریافتکننده سیسپلاتین) افزایش یافت. اما نسبت به گروه G1که فقط نرمالسالین دریافت کرده بودند همچنان کمتر بود. قطر لولههای سمینیفر در گروهG4 نسبت به گروهG3 کمتر شده بود.همچنین قطر لوله های سمینیفر در گروهG5 نسبت به گروه G4 کاهش نشان میدهد. ( نمودار 2). بررسی ضخامت اپیتلیوم ژرمینال فردر گروههای دریافت کننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که ضخامت اپیتلیوم ژرمینال در گروه G3 نسبت به گروه G2 (گروه دریافتکننده سیسپلاتین) افزایش یافته بود. اما نسبت به گروهG1 که فقط نرمالسالین دریافت کرده بودند همچنان کمتر بود. ضخامت اپیتلیوم ژرمینال در در گروهG4 نسبت به گروه G3 کاهش یافته بود. همچنین ضخامت اپیتلیوم ژرمینال در گروهG5 نسبت به گروه G4کاهش نشان میداد. (تصویرالف)، (نمودار 3). ارزیابی اسپرماتوگونیها در گروههای دریافتکننده گیاه واکسینیوم آرکتوستافیلوس نشان داد که دراولین گروه دریافتکننده گیاه واکسینیوم آرکتوستافیلوس (G3) تعداد اسپرماتوگونیها در گروه G3نسبت به گروه G2 کمتر بود. تعداد اسپرماتوگونیها در گروهG4 نسبت به گروهG3 کمتر بود. همچنین قطر اسپرماتوگونی در گروهG5 نسبت به گروه G4 کاهش نشان میداد (نمودار 1). با توجه به ارزیابی هیستولوژیک، ارزیابی روند آپوپتوز در گروههای مختلف و همچنین ارزیابی پارامترهای سیمن در مطالعات بعدی نیز میتواند نتایج مهمی را بعد از مصرف گیاه مذکور و نقش حفاظتی آن در مقابل مصرف داروی ضدسرطان بهوجود آورد.
نتیجهگیری
بر طبق نتایج بهدست آمده گیاه واکسینیوم آرکتوستافیلوس بهعنوان یک گیاه دارای خواص آنتیاکسیدانی در بهبود اختلالات ناشی از سیسپلاتین درضخامت اپیتلیوم ژرمینال و قطر لوله سمینیفر تاثیر معنیداری دارد و میتواند تعداد سلولهای اسپرماتوگونی که از طریق آپوپتوز از بین میروند را دراپیتلیوم اپیتلیوم ژرمینال کاهش میدهد. نتایج این تحقیق میتواند کمکی در جهت رفع عوارض به وجود آمده به دنبال درمان با سیسپلاتین در مردان مبتلا به سرطان تستیس بنماید.
سپاسگزاری
مطالعه حاضر مستخرج از پایاننامه دانشجویی هست و از زحمات سرکارخانم مهسا رضایی و ناصر خاطرهای که در مراحل مختلف کار صمیمانه همکاری داشتند تشکر و قدردانی میشود.
حامی مالی: این تحقیق با حمایت دانشگاه علوم پرشکی تبریز و دانشگاه علوم پزشکی اردبیل انجام شده است
تعارض در منافع: وجود ندارد.
References:
1- Tsukamoto G, Ichikawa H, Kobashi M, Yamada Y, Kikuchi T, Mese H, et al. Cisplatin-Induced Long-Term Dynorphin A-Immunoreactivity in Cell Somata of Rat Area Postrema Neurons. Neuroscience Letters 2007; 424(2): 122-6.
2- Brozovic A, Ambriović-Ristov A, Osmak M. The Relationship between Cisplatin-Induced Reactive Oxygen Species, Glutathione, and BCL-2 and Resistance to Cisplatin. Crit Rev Toxicol 2010; 40(4): 347-59.
3- Gandini L, Sgrò P, Lombardo F, Paoli D, Culasso F, Toselli L, et al. Effect of Chemo-Or Radiotherapy on Sperm Parameters of Testicular Cancer Patients. Hum Reprod 2006; 21(11): 2882-9.
4- Sawhney P, Giammona CJ, Meistrich ML, Richburg JH. Cisplatin Induced Long Term Failure of Spermatogenesis in Adult C57/Bl/6j Mice. J Androl 2005; 26(1): 136-45.
5- Moini F, Mohammadi Sichani M, Shahanipoor K. Antibacterial Effect of Methanolic and Aqueous Extracts of Arcostaphyllus Fruit Fruit on Gastrointestinal Pathogen Escherichia Coli. Qom University of Medical Science Journal 2016; 9(12): 16-24.[Persian]
6- Guha S, Cao M, Kane RM, Savino AM, Zou S, Dong Y. The Longevity Effect of Cranberry Extract in Caenorhabditis Elegans is modulated by Daf-16 and Osr-1. Age (Dordr) 2013; 35(5): 1559-74.
7- Pervin M, Hasnat MA, Lim BO. Antibacterial and Antioxidant Activities of Vaccinium Corymbosum L. Leaf Extract. Asian Pac J Trop Dis 2013; 3(6): 444-53.
8- Puupponen‐Pimiä R, Nohynek L, Hartmann Schmidlin S, Kähkönen M, Heinonen M, Määttä Riihinen K, et al. Berry Phenolics Selectively Inhibit the Growth of Intestinal Pathogens. Journal of Applied Microbiology 2005; 98(4): 991-1000.
9- Puupponen‐Pimiä R, Nohynek L, Meier C, Kähkönen M, Heinonen M, Hopia A, et al. Antimicrobial Properties of Phenolic Compounds from Berries. Journal of Applied Microbiology 2001; 90(4): 494-507.
10- Wachtel-Galor S, Yuen J, Buswell JA, Benzie IF. Ganoderma lucidum (Lingzhi or Reishi). Herbal Medicine: Biomolecular and Clinical Aspects. 2011.
11- Akhondzadeh Sh. Encyclopedia of Iranian Medicinal Plants. Iranian Instituete of Medicinal Plants 2000; 144
12- Howard LR, Clark JR, Brownmiller C. Antioxidant Capacity and Phenolic Content in Blueberries as Affected by Genotype and Growing Season. Journal of the Science of Food and Agriculture 2003; 83(12): 1238-47.
13- Ayaz FA, Kadioglu A, Bertoft E, Acar C, Turna I. Effect of Fruit Maturation on Sugar and Organic Acid Composition in Two Blueberries (Vaccinium Arctostaphylos & V. Myrtillus) Native to Turkey. New Zealand J of Crop and Hort. Sci 2005; 29(2): 137-41.
14- Salgado Alejandra, Torres and Borbar Jessica. Strategies to Reduce Solar Radiation in Uv - Sun Light Effects in Blueberry in Chile. 10th International Vaccinium and other super fruits. USA 2012.
15- Hasanloo T, Sepehrifar R, Hajimehdipoor H. Levels of Phenolic Compounds and their Effects on Antioxidant Capacity of Wild Vaccinium Arctostaphylos L.(Qare-Qat) Collected from Different Regions of Iran. Turkish Journal of Biology 2011; 35(3): 371-7.
16- Nickavar B, Salehi-Sormagi MH, Amin G, Daneshtalab M. Steam Volatiles of Vaccinium Arctostaphylos. Pharmaceutical Biology 2002; 40(6): 448-9.
17- Khalili A, Khosravi MB, Nekooeian AA. The Effects of Aqueous Extract of Vaccinium Arctostaphylos Leaves on Blood Pressure in Renal Hypertensive Rats. Iran Red Crescent Med J 2011; 13(2): 123-7.
18- Awadalla EA. Ameliorative Effect of the Crude Oil of the Nigella Sativa on Oxidative Stress Induced in Rat Testes by Cisplatin Treatment. Biomedicine & Preventive Nutrition 2012; 2(4): 265-8.
19- Sabanegh Jr ES, Ragheb AM. Male Fertility after Cancer. Urology 2009; 73(2): 225-31.
20- Schrier RW, Wang W, Poole B, Mitra A. Acute Renal Failure: Definitions, Diagnosis, Pathogenesis, and Therapy. J Clin Invest 2004; 114(1): 5-14.
21- Amin A, Hamza AA. Effects of Roselle and Ginger on Cisplatin‐Induced Reproductive Toxicity in Rats. Asian J Androl 2006; 8(5): 607-12.
22- Colpi GM, Contalbi GF, Nerva F, Sagone P, Piediferro G. Testicular Function Following Chemo–Radiotherapy. Eur J Obstet Gynecol Reprod Biol 2004; 113: 2-6.
23- Cherry SM, Hunt PA, Hassold TJ. Cisplatin Disrupts Mammalian Spermatogenesis, but Does Not Affect Recombination or Chromosome Segregation. Mutat Res 2004; 564(2): 115-28.
24- Dohle GR. Male Infertility in Cancer Patients: Review of the Literature. Int J Urol 2010; 17(4): 327-31.
25- Azu OO, Duru FIO, Osinubi AA, Oremosu AA, Noronha CC, Elesha SO, et al. Histomorphometric Effects of Kigelia Africana (Bignoniaceae) Fruit Extract on the Testis Following Short-Term Treatment with Cisplatin in Male Spragu- Dawley Rats. Middle East Fertility Society Journal 2010; 15(3): 200-8.
26- Türk G, Ateşşahin A, Sönmez M, Ceribaşi AO, Yüce A. Improvement of Cisplatin-Induced Injuries to Sperm Quality, the Oxidant-Antioxidant System, and the Histologic Structure of the Rat Testis by Ellagic Acid. Fertil Steril 2008; 89(5 Suppl): 1474–81.
27- Ateşşahin A, Karahan I, Türk G, Gür S, Yilmaz S, Ceribaşi AO. Protective Role of Lycopene on Cisplatin-Induced Changes in Sperm Characteristics, Testicular Damage and Oxidative Stress in Rats. Reprod Toxicol 2006; 21(1): 42–7.
28- Hedger MP, Meinhardt A. Cytokines and the Immune-Testicular Axis. J Reprod Immunol 2003; 58(1): 1-26.
29- Theas MS, Rival C, Jarazo-Dietrich S, Jacobo P, Guazzone VA, Lustig L. Tumour Necrosis Factor-Α Released by Testicular Macrophages Induces Apoptosis of Germ Cells in Autoimmune Orchitis. Hum Reprod 2008; 23(8): 1865-72.
30- Smart E, Lopes F, Rice S, Nagy B, Anderson RA, Mitchell RT, Spears N. Chemotherapy Drugs Cyclophosphamide, Cisplatin and Doxorubicin Induce Germ Cell Loss in an in Vitro Model of the Prepubertal Testis. Sci Rep 2018; 8(1): 1773.
31- Yadav YC. Effect of Cisplatin on Pancreas and Testes in Wistar Rats: Biochemical Parameters and Histology. Heliyon 2019; 5(8): E02247.
32- Aly HA, Eid BG. Cisplatin Induced Testicular Damage through Mitochondria Mediated Apoptosis, Inflammation and Oxidative Stress in Rats: Impact of Resveratrol. Endocr 2020; 67(9): 969-80.
33- Mercantepe T, Unal D, Tümkaya L, Yazici ZA. Protective Effects of Amifostine, Curcumin and Caffeic Acid Phenethyl Ester against Cisplatin-Induced Testis Tissue Damage in Rats. Exp Ther Med 2018; 15(4): 3404-12.
34- Shokri V, Jalili C, Raissi F, Akhshi N, Ghanbari A. Evaluating the Effects of Acacetin Versus a Low Dose of Cisplatin Drug on Male Reproductive System and Kidney in Mice: with Emphasis on Inflammation Process. Andrologia 2020 ; 52(1): e13444.
35- Kata FS. Effect of Cisplatin Drug on Sperm Characterizes, Spermatogenesis and Sex Hormones Levels of Male Mice Mus Musculus L. J Basrah Res (Sciences) 2013; 39(2A): 112-24.
36- Brozovic A, Ambriović-Ristov A, Osmak M. The Relationship between Cisplatin-Induced Reactive Oxygen Species, Glutathione, and BCL-2 and Resistance to Cisplatin. Crit Rev Toxicol 2010; 40(4): 347-59.
37- Nickavar B, Salehi-Sormagi MH, Amin G, Daneshtalab M. Steam Volatiles of Vaccinium Arctostaphylos. Pharmaceutical Biology 2002; 40(6): 448-9.
38- Sedaghathoor Sh. Seed Dormancy and Germination of Vaccinium Arctostaphylos L. International Journal of Botany 2007; 3(3): 307-11.
39- Feshani AM, Kouhsari SM, Mohammadi S. Vaccinium Arctostaphylos, a Common Herbal Medicine in Iran: Molecular and Biochemical Study of Its Antidiabetic Effects on Alloxan-Diabetic Wistar Rats. Journal of Ethnopharmacology 2011; 133(1): 67-74.
1- Tsukamoto G, Ichikawa H, Kobashi M, Yamada Y, Kikuchi T, Mese H, et al. Cisplatin-Induced Long-Term Dynorphin A-Immunoreactivity in Cell Somata of Rat Area Postrema Neurons. Neuroscience Letters 2007; 424(2): 122-6.
2- Brozovic A, Ambriović-Ristov A, Osmak M. The Relationship between Cisplatin-Induced Reactive Oxygen Species, Glutathione, and BCL-2 and Resistance to Cisplatin. Crit Rev Toxicol 2010; 40(4): 347-59.
3- Gandini L, Sgrò P, Lombardo F, Paoli D, Culasso F, Toselli L, et al. Effect of Chemo-Or Radiotherapy on Sperm Parameters of Testicular Cancer Patients. Hum Reprod 2006; 21(11): 2882-9.
4- Sawhney P, Giammona CJ, Meistrich ML, Richburg JH. Cisplatin Induced Long Term Failure of Spermatogenesis in Adult C57/Bl/6j Mice. J Androl 2005; 26(1): 136-45.
5- Moini F, Mohammadi Sichani M, Shahanipoor K. Antibacterial Effect of Methanolic and Aqueous Extracts of Arcostaphyllus Fruit Fruit on Gastrointestinal Pathogen Escherichia Coli. Qom University of Medical Science Journal 2016; 9(12): 16-24.[Persian]
6- Guha S, Cao M, Kane RM, Savino AM, Zou S, Dong Y. The Longevity Effect of Cranberry Extract in Caenorhabditis Elegans is modulated by Daf-16 and Osr-1. Age (Dordr) 2013; 35(5): 1559-74.
7- Pervin M, Hasnat MA, Lim BO. Antibacterial and Antioxidant Activities of Vaccinium Corymbosum L. Leaf Extract. Asian Pac J Trop Dis 2013; 3(6): 444-53.
8- Puupponen‐Pimiä R, Nohynek L, Hartmann Schmidlin S, Kähkönen M, Heinonen M, Määttä Riihinen K, et al. Berry Phenolics Selectively Inhibit the Growth of Intestinal Pathogens. Journal of Applied Microbiology 2005; 98(4): 991-1000.
9- Puupponen‐Pimiä R, Nohynek L, Meier C, Kähkönen M, Heinonen M, Hopia A, et al. Antimicrobial Properties of Phenolic Compounds from Berries. Journal of Applied Microbiology 2001; 90(4): 494-507.
10- Wachtel-Galor S, Yuen J, Buswell JA, Benzie IF. Ganoderma lucidum (Lingzhi or Reishi). Herbal Medicine: Biomolecular and Clinical Aspects. 2011.
11- Akhondzadeh Sh. Encyclopedia of Iranian Medicinal Plants. Iranian Instituete of Medicinal Plants 2000; 144
12- Howard LR, Clark JR, Brownmiller C. Antioxidant Capacity and Phenolic Content in Blueberries as Affected by Genotype and Growing Season. Journal of the Science of Food and Agriculture 2003; 83(12): 1238-47.
13- Ayaz FA, Kadioglu A, Bertoft E, Acar C, Turna I. Effect of Fruit Maturation on Sugar and Organic Acid Composition in Two Blueberries (Vaccinium Arctostaphylos & V. Myrtillus) Native to Turkey. New Zealand J of Crop and Hort. Sci 2005; 29(2): 137-41.
14- Salgado Alejandra, Torres and Borbar Jessica. Strategies to Reduce Solar Radiation in Uv - Sun Light Effects in Blueberry in Chile. 10th International Vaccinium and other super fruits. USA 2012.
15- Hasanloo T, Sepehrifar R, Hajimehdipoor H. Levels of Phenolic Compounds and their Effects on Antioxidant Capacity of Wild Vaccinium Arctostaphylos L.(Qare-Qat) Collected from Different Regions of Iran. Turkish Journal of Biology 2011; 35(3): 371-7.
16- Nickavar B, Salehi-Sormagi MH, Amin G, Daneshtalab M. Steam Volatiles of Vaccinium Arctostaphylos. Pharmaceutical Biology 2002; 40(6): 448-9.
17- Khalili A, Khosravi MB, Nekooeian AA. The Effects of Aqueous Extract of Vaccinium Arctostaphylos Leaves on Blood Pressure in Renal Hypertensive Rats. Iran Red Crescent Med J 2011; 13(2): 123-7.
18- Awadalla EA. Ameliorative Effect of the Crude Oil of the Nigella Sativa on Oxidative Stress Induced in Rat Testes by Cisplatin Treatment. Biomedicine & Preventive Nutrition 2012; 2(4): 265-8.
19- Sabanegh Jr ES, Ragheb AM. Male Fertility after Cancer. Urology 2009; 73(2): 225-31.
20- Schrier RW, Wang W, Poole B, Mitra A. Acute Renal Failure: Definitions, Diagnosis, Pathogenesis, and Therapy. J Clin Invest 2004; 114(1): 5-14.
21- Amin A, Hamza AA. Effects of Roselle and Ginger on Cisplatin‐Induced Reproductive Toxicity in Rats. Asian J Androl 2006; 8(5): 607-12.
22- Colpi GM, Contalbi GF, Nerva F, Sagone P, Piediferro G. Testicular Function Following Chemo–Radiotherapy. Eur J Obstet Gynecol Reprod Biol 2004; 113: 2-6.
23- Cherry SM, Hunt PA, Hassold TJ. Cisplatin Disrupts Mammalian Spermatogenesis, but Does Not Affect Recombination or Chromosome Segregation. Mutat Res 2004; 564(2): 115-28.
24- Dohle GR. Male Infertility in Cancer Patients: Review of the Literature. Int J Urol 2010; 17(4): 327-31.
25- Azu OO, Duru FIO, Osinubi AA, Oremosu AA, Noronha CC, Elesha SO, et al. Histomorphometric Effects of Kigelia Africana (Bignoniaceae) Fruit Extract on the Testis Following Short-Term Treatment with Cisplatin in Male Spragu- Dawley Rats. Middle East Fertility Society Journal 2010; 15(3): 200-8.
26- Türk G, Ateşşahin A, Sönmez M, Ceribaşi AO, Yüce A. Improvement of Cisplatin-Induced Injuries to Sperm Quality, the Oxidant-Antioxidant System, and the Histologic Structure of the Rat Testis by Ellagic Acid. Fertil Steril 2008; 89(5 Suppl): 1474–81.
27- Ateşşahin A, Karahan I, Türk G, Gür S, Yilmaz S, Ceribaşi AO. Protective Role of Lycopene on Cisplatin-Induced Changes in Sperm Characteristics, Testicular Damage and Oxidative Stress in Rats. Reprod Toxicol 2006; 21(1): 42–7.
28- Hedger MP, Meinhardt A. Cytokines and the Immune-Testicular Axis. J Reprod Immunol 2003; 58(1): 1-26.
29- Theas MS, Rival C, Jarazo-Dietrich S, Jacobo P, Guazzone VA, Lustig L. Tumour Necrosis Factor-Α Released by Testicular Macrophages Induces Apoptosis of Germ Cells in Autoimmune Orchitis. Hum Reprod 2008; 23(8): 1865-72.
30- Smart E, Lopes F, Rice S, Nagy B, Anderson RA, Mitchell RT, Spears N. Chemotherapy Drugs Cyclophosphamide, Cisplatin and Doxorubicin Induce Germ Cell Loss in an in Vitro Model of the Prepubertal Testis. Sci Rep 2018; 8(1): 1773.
31- Yadav YC. Effect of Cisplatin on Pancreas and Testes in Wistar Rats: Biochemical Parameters and Histology. Heliyon 2019; 5(8): E02247.
32- Aly HA, Eid BG. Cisplatin Induced Testicular Damage through Mitochondria Mediated Apoptosis, Inflammation and Oxidative Stress in Rats: Impact of Resveratrol. Endocr 2020; 67(9): 969-80.
33- Mercantepe T, Unal D, Tümkaya L, Yazici ZA. Protective Effects of Amifostine, Curcumin and Caffeic Acid Phenethyl Ester against Cisplatin-Induced Testis Tissue Damage in Rats. Exp Ther Med 2018; 15(4): 3404-12.
34- Shokri V, Jalili C, Raissi F, Akhshi N, Ghanbari A. Evaluating the Effects of Acacetin Versus a Low Dose of Cisplatin Drug on Male Reproductive System and Kidney in Mice: with Emphasis on Inflammation Process. Andrologia 2020 ; 52(1): e13444.
35- Kata FS. Effect of Cisplatin Drug on Sperm Characterizes, Spermatogenesis and Sex Hormones Levels of Male Mice Mus Musculus L. J Basrah Res (Sciences) 2013; 39(2A): 112-24.
36- Brozovic A, Ambriović-Ristov A, Osmak M. The Relationship between Cisplatin-Induced Reactive Oxygen Species, Glutathione, and BCL-2 and Resistance to Cisplatin. Crit Rev Toxicol 2010; 40(4): 347-59.
37- Nickavar B, Salehi-Sormagi MH, Amin G, Daneshtalab M. Steam Volatiles of Vaccinium Arctostaphylos. Pharmaceutical Biology 2002; 40(6): 448-9.
38- Sedaghathoor Sh. Seed Dormancy and Germination of Vaccinium Arctostaphylos L. International Journal of Botany 2007; 3(3): 307-11.
39- Feshani AM, Kouhsari SM, Mohammadi S. Vaccinium Arctostaphylos, a Common Herbal Medicine in Iran: Molecular and Biochemical Study of Its Antidiabetic Effects on Alloxan-Diabetic Wistar Rats. Journal of Ethnopharmacology 2011; 133(1): 67-74.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







