دوره ۳۱، شماره ۳ - ( خرداد ۱۴۰۲ )
جلد ۳۱ شماره ۳ صفحات ۶۵۳۶-۶۵۲۶ |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.TNB.REC.1400.022
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Saghari Y, Movahedi M, Tebianian M, Entezari M. Investigating the Effect of Curcumin and Betanin Nanoparticles on Antioxidant and Inflammatory Response in Rats Suffering from Brain Ischemia/Reperfusion. JSSU 2023; 31 (3) :6526-6536
URL: http://jssu.ssu.ac.ir/article-1-5821-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5821-fa.html
ساغری یلدا، موحدی منیره، تبیانیان مجید، انتظاری ملیحه. بررسی تأثیر نانوذرات کورکومین و بتانین بر پاسخ آنتیاکسیدانتی و التهابی در رتهای مبتلا به ایسکمی/خونرسانی مجدد مغز. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. ۱۴۰۲; ۳۱ (۳) :۶۵۲۶-۶۵۳۶
متن کامل [PDF 994 kb]
(۳۵۸ دریافت)
| چکیده (HTML) (730 مشاهده)
References:
1- Pérez-Asensio FJ, Hurtado O, Burguete MC, Moro MA, Salom JB, Lizasoain I, et al. Inhibition of Inos Activity by 1400W Decreases Glutamate Release and Ameliorates Stroke outcome after Experimental Ischemia. Neurobiol Dis 2005; 18(2): 375-84.
2- Zhao G, Zhang W, Li L, Wu S, Du G. Pinocembrin Protects the Brain Against Ischemia-Reperfusion Injury and Reverses the Autophagy Dysfunction in the Penumbra Area. Molecules 2014; 19(10): 15786-98.
3- Li L, Xiao L, Hou Y, He Q, Zhu J, Li Y, et al. Sestrin2 Silencing Exacerbates Cerebral Ischemia/Reperfusion Injury By Decreasing Mitochondrial Biogenesis through the AMPK/PGC-1α Pathway in Rats. Sci Rep 2016; 6: 30272.
4- Radak D, Resanovic I, Isenovic ER. Link between Oxidative Stress and Acute Brain Ischemia. Angiology 2014; 65(8): 667-76.
5- Azeredo HMC. Betalains: Properties, Sources, Applications, and Stability – A Review. International Journal of Food Science & Technology 2009; 44(12): 2365-76.
6- Tural K, Ozden O, Bilgi Z, Kubat E, Ermutlu CS, Merhan O, et al. The Protective Effect of Betanin and Copper on Spinal Cord Ischemia–Reperfusion Injury. The Journal of Spinal Cord Medicine 2021; 44(5): 704-10.
7- Toth S, Jonecova Z, Maretta M, Curgali K, Kalpakidis T, Pribula M, et al. The Effect of Betanin Parenteral Pretreatment on Jejunal and Pulmonary Tissue Histological Architecture and Inflammatory Response after Jejunal Ischemia-Reperfusion Injury. Experimental and Molecular Pathology 2019; 110: 104292.
8- Thong-asa W, Prasartsri S, Klomkleaw N, Thongwan N. The Neuroprotective Effect of Betanin in Trimethyltin-Induced Neurodegeneration in Mice. Metabolic Brain Disease 2020; 35(8): 1395-405.
9- Abrahams S, Haylett WL, Johnson G, Carr JA, Bardien S. Antioxidant Effects of Curcumin in Models of Neurodegeneration, Aging, Oxidative and Nitrosative Stress: A Review. Neuroscience. 2019; 406: 1-21.
10- Malik P, Singh M. Study of Curcumin Antioxidant Activities in Robust Oil–Water Nanoemulsions. New Journal of Chemistry 2017; 41(21): 12506-19.
11- Farooqui T, Farooqui AA. Chapter 2 - Curcumin: Historical Background, Chemistry, Pharmacological Action, and Potential Therapeutic Value. In: Farooqui T, Farooqui AA, Editors. Curcumin for Neurological and Psychiatric Disorders: Academic Press; 2019; 23-44.
12- Forouzanfar F, Read MI, Barreto GE, Sahebkar A. Neuroprotective Effects of Curcumin through Autophagy Modulation. IUBMB Life 2020; 72(4): 652-64.
13- Prasad S, Tyagi AK, Aggarwal BB. Recent Developments in Delivery, Bioavailability, Absorption and Metabolism of Curcumin: the Golden Pigment from Golden Spice. Cancer Res Treat 2014; 46(1): 2-18.
14- Chen A, Xu Y, Yuan J. Ginkgolide B Ameliorates NLRP3 Inflammasome Activation after Hypoxic-Ischemic Brain Injury in the Neonatal Male Rat. Int J Dev Neurosci 2018; 69: 106-11.
15- Dhindsa RS, Plumb-Dhindsa P, Thorpe TA. Leaf Senescence: Correlated with Increased Levels of Membrane Permeability and Lipid Peroxidation, and Decreased Levels of Superoxide Dismutase and Catalase. Journal of Experimental botany 1981; 32(1): 93-101.
16- Batandier C, Fontaine E, Kériel C, Leverve X. Determination of Mitochondrial Reactive Oxygen Species: Methodological Aspects. J Cell Mol Med 2002; 6(2): 175-87.
17- Jollow D, Mitchell J, Zampaglione N, Gillette J. Bromobenzene-Induced Liver Necrosis. Protective Role of Glutathione and Evidence for 3, 4-Bromobenzene Oxide as the Hepatotoxic Metabolite. Pharmacology 1974; 11(3): 151-69.
18- Kono Y. Generation of Superoxide Radical during Autoxidation of Hydroxylamine and an Assay for Superoxide Dismutase. Arch Biochem Biophys 1978;186(1): 726: 109247.
19- Greenwald RA. Handbook Methods for Oxygen Radical Research: CRC Press; 2018.
20- Crack PJ, Wong CH. Modulation of Neuro-Inflammation and Vascular Response by Oxidative Stress Following Cerebral Ischemia-Reperfusion Injury. Current Medicinal Chemistry 2008; 15(1): 1-14.
21- Torki A, Khalaji-Pirbalouty V, Lorigooini Z, Rafieian-Kopaei M, Sadeghimanesh A, Rabiei Z. Anchusa Italica Extract: Phytochemical and Neuroprotective Evaluation on Global Cerebral Ischemia and Reperfusion. Braz J Pharm Sci 2018; 54(1).
22- Bodega G, Alique M, Puebla L, Carracedo J, Ramírez R. Microvesicles: ROS Scavengers and ROS Producers. Journal of Extracellular Vesicles 2019; 8(1): 1626654.
23- El-Demerdash FM. Lipid Peroxidation, Oxidative Stress and Acetylcholinesterase in Rat Brain Exposed to Organophosphate and Pyrethroid Insecticides. Food and Chemical Toxicology 2011; 49(6): 1346-52.
24- R Buettner G. Superoxide Dismutase in Redox Biology: The Roles of Superoxide and Hydrogen Peroxide. Anti-Cancer Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Anti-Cancer Agents) 2011; 11(4): 341-6.
25- Mitchell JP, Carmody RJ. NF-Κb and the Transcriptional Control of Inflammation. Int Rev Cell Mol Biol 2018; 335: 41-84.
26- Luo L-N, Xie DQ, Zhang XG, Jiang R. Osthole Decreases Renal Ischemia-Reperfusion Injury by Suppressing JAK2/STAT3 Signaling Activation. Exp Ther Med 2016; 12(4): 2009-14.
27- Mo Y, Yue E, Shi N, Liu K. The Protective Effects of Curcumin in Cerebral Ischemia and Reperfusion Injury through PKC-Θ Signaling. Cell Cycle 2021; 20(5-6): 550-60.
28- Huang L, Chen C, Zhang X, Li X, Chen Z, Yang C, et al. Neuroprotective Effect of Curcumin Against Cerebral Ischemia-Reperfusion Via Mediating Autophagy and Inflammation. J Mol Neuroscience 2018; 64(1): 129-39.
29- Li Q, Qu M, Wang N, Wang L, Fan G, Yang C. Betaine Protects Rats Against Ischemia/Reperfusion Injury-Induced Brain Damage. J Neurophysiol 2022; 127(2): 444-51.
متن کامل: (۳۸۱ مشاهده)
مقدمه
سکته مغزی یکی از علل اصلی مرگ و میر در جهان است و بسیاری از افراد ممکن است در مقطعی از زندگی خود آن را تجربه کنند (1). کاهش شدید یا قطع موقت جریان خون در ناحیهای از مغز باعث ایسکمی میشود و پس از مدت کوتاهی سلولهای ناحیه مرکزی از بین میروند، اما سلولهای اطراف، به دلیل دریافت خون از نواحی مجاور، بیشتر زنده میمانند (2). آسیب ایسکمی/خونرسانی مجدد (I/R) مغز باعث افزایش تولید گونههای فعال اکسیژن (ROS) میشود، عملکرد میتوکندری را مختل میکند و باعث تخریب عصبی میشود (3). در عین حال، ظرفیت آنتیاکسیدانی در غلظتهای بالای ROS به شدت کاهش مییابد و پراکسیداسیون لیپیدی و اکسیداسیون پروتئینها و DNA آغاز میشود. تحقیقات نشان داده است که اگر ترکیبات آنتیاکسیدانی همزمان با جریان خون کافی در ناحیه ایسکمیک استفاده شود، بیمار عوارض کمتری از آسیب (I/R) را تجربه خواهد کرد (4). بتانین، زیر مجموعهای از خانواده بتاسیانین، ترکیبی از گیاه Beta vulgaris var. rubra به دلیل داشتن گروههای آمین فنلی و حلقوی، خواص آنتیاکسیدانی و مهارکنندگی ROS خوبی دارد (5). اثرات محافظتی بتانین در آسیب ایسکمی-پرفیوژن مجدد طناب نخاعی (6) و آسیب ایسکمی-پرفیوژن مجدد ژژنوم (7) گزارش شده است. هیچ مطالعهای در مورد اثر بتانین بر آسیب مغزی I/R انجام نشده است. با اینحال، اثر محافظت عصبی بتانین در تخریب عصبی ناشی از تری متیلتین (trimethyltin) در موش نشان داده شده است (8). کورکومین (C21H20O6) ماده فعال ریزوم گیاه زردچوبه Curcuma longa است و گزارشهای زیادی در مورد نقش آنتیاکسیدانی آن وجود دارد (9). بیان شده است که این ترکیب با از بین بردن فعالیت گونههای اکسیژن فعال (ROS) نقش مهمی در محافظت در برابر آسیب اکسیداتیو ایفا میکند (10). اثر آنتیاکسیدانی این ترکیب به گروههای فنلی یا گروه CH2 از قسمت β-دیکتون نسبت داده شده است (11). مطالعات اثرات محافظت کننده عصبی کورکومین را در برابر آسیب مغزی ایسکمیک نشان دادهاند (12). با اینحال، بهنظر میرسد که سد خونی مغزی (BBB) از رسیدن کورکومین آزاد به مغز و اعمال اثرات آن جلوگیری میکند و فراهمی زیستی این ترکیب را در مغز کاهش میدهد (13). برای غلبه بر BBB، فرمولاسیون نانوذرات کورکومین میتواند راه حلی باشد و گفته شده است که نانوذرات کورکومین میتوانند بر این مانع غلبه کرده و غلظت کورکومین را در مغز افزایش دهند. بنابراین، هدف از مطالعه حاضر بررسی اثرات آنتیاکسیدانی و محافظت عصبی نانوذرات کورکومین و بتانین در در رتهای مبتلا به آسیب ایسکمی/خونرسانی مجدد مغز بود.
روش بررسی
تهیه حیوانات: موشهای صحرایی نر نژاد ویستار (250 تا 300 گرم) از انستیتو پاستور ایران خریداری شدند. شرایط محیطی 1.5±25 درجه سانتیگراد و رطوبت نسبی 65 درصد با چرخه 12 ساعته تاریکی/نور برای نگهداری حیوانات استفاده شد. سازگاری حیوانات با شرایط آزمایشگاهی قبل از شروع آزمایش به مدت یک هفته انجام شد.
مواد: نانوذرات بتانین و کورکومین از شرکت نانواکسیر سینا، ایران تهیه شد. دیگر مواد از درجه تحلیلی و از شرکت مرک، آلمان، تهیه شدند.
القاء آسیب ایسکمی خونرسانی مجدد مغز در رتها: القای سکته مغزی با روش انسداد دو طرفه شریان کاروتید مشترک (Bilateral Common Carotid Artery Occlusion) انجام شد. ابتدا موشها با کتامین (50 میلیگرم بر کیلوگرم) و زایلازین (8-2 میلیگرم بر کیلوگرم) بیهوش شدند و یک برش ساژیتال از خط وسط گردن (طول 1 سانتیمتر) ایجاد شد و سپس هر دو شریان کاروتید با دقت از شریان مربوطه جدا شدند. واگ عصبی یک حلقه بخیه ابریشم 5-0 در اطراف هر شریان کاروتید مشترک ایجاد شد و سپس CCA ها به مدت 30 دقیقه با سفت کردن نخهای ابریشمی مسدود شدند. پس از بازگشایی هر دو CCA، یک دوره خونرسانی مجدد پنج دقیقهای آغاز شد. پس از خونرسانی مجدد، زخمها بخیه شدند. در طی این دوره، حیوانات از نظر دمای رکتوم 37 درجه سانتیگراد، رفلکس قرنیه در مواجهه با نور و حفظ مردمکهای گشاد شده مورد بررسی قرار گرفتند. حیواناتی که این معیارها را نداشتند یا تشنج داشتند از مطالعه حذف شدند. سه روز پس از القای I/R مغزی، حیوانات برای جداسازی مغزشان در ابتدا بیهوش و سپس کشته شدند.
گروهبندی حیوانات: در مجموع از 80 موش صحرایی در مطالعه حاضر استفاده شد و به 8 گروه تقسیم شدند: I) رتهای کنترل سالم. II) رتهای سالم دریافتکننده بتانین، III) رتهای سالم دریافتکننده کورکومین، IV) رتهای I/R مغزی، V) رتهای I/R مغزی دریافت کننده نانوبتانین (25 میلی گرم/کیلوگرم)، VI) رتهای I/R مغزی دریافت کننده نانوکورکومین و نانوبتانین (25 میلیگرم بر کیلوگرم)، VII) رتهای سالم دریافت کننده نانوکورکومین و نانوبتانین (25 میلیگرم بر کیلوگرم)، VIII) رتهای I/R مغزی دریافت کننده 25 میلیگرم بر کیلوگرم نانو بتانین و کورکومین. تجویز بتانین و کورکومین آزاد و نانو کورکومین و بتانین 5 روز قبل از القای I/R مغزی شروع شد و تا سه روز پس از BCCAO ادامه یافت.
نمرات اختلالات نورلوژیکی: 24 ساعت پس از القای I/R مغزی، نمرات اختلالات عصبی (NDS) با استفاده از آزمون پنج نقطهای ارزیابی شد و به حیوانات امتیاز 1 تا 5 داده شد. به رتهایی که هیچ گونه اختلال در حرکت را نشان ندادند، نمره 1 داده شد. نمره 2 به حیواناتی داده شد که هنگام آویزان شدن از دم (flexion) به سمت مخالف نیمکره ایسکمیک خم شدند. نمره 3 به حیواناتی داده شد که در ابتدای حرکت روی یک سطح صاف به سمت نیمکره ایسکمیک چرخیدند و موشهایی که رفلکس ایستادن را از دست دادند نمره 4 گرفتند. به حیوانات بدون هیچ حرکتی نمره 5 داده شد (14).
اندازهگیری سطوح پراکسیداسیون لیپید و ROS: محتوای مالون دی آلدئید (MDA) به عنوان شاخص پراکسیداسیون لیپیدی بر اساس روش Dhindsa و همکاران (1981) تعیین شد (15). تبدیل H2DCFDA به DCFDA توسط طیفسنجهای 499 نانومتر و 520 نانومتر بهعنوان شاخصی برای اندازهگیری سطوح ROS در میتوکندریهای مغز پس از نرمالسازی و بیان آن بهعنوان درصد استفاده شد (16). اندازهگیری فعالیت کاتالاز، گلوتیاتیون احیاء و سوپراکسید دیسمیوتاز: اندازهگیری محتوای GSH بر اساس روش Jollow و همکاران انجام شد (17) فعالیت SOD با روش (18) و فعالیت CAT با روش Greenwald (19) برآورد شد.
اندازهگیری سطوح سیتوکاینهای التهابی: از تکنیک الایزا برای اندازهگیری سطوح سیتوکین های التهابی IL-1β، TNF-α و IL-6 طبق دستورالعمل سازنده استفاده شد. برای بررسی بیان این پروتئینها از کیتهای BioLegend، Mybiosource و Abcam استفاده شد.
تجزیه و تحلیل آماری
آنالیز دادهها با استفاده از نرمافزار GraphPad Prism V.8 انجام شد. از آنالیز واریانس یک راهه (ANOVA) برای آنالیز دادهها استفاده شد. دادهها بهصورت انحرافمعیار±میانگین بیان شدند.
ملاحظات اخلاقی
مطالعه حاضر، توسط کمیته اخلاق دانشگاه آزاد اسلامی واحد علوم پزشکی به شماره کد IR.IAU.TNB.REC.1400.022 مورد تأیید قرار گرفت.
نتایج
نمرات اختلالات نورولوژیکی: القاء آسیب ایسکمی خونرسانی مجدد مغز منجر افزایش نمرات اختلالات نورولوژیکی در مقایسه با کنترل سالم شد. با این وجود، تجویز نانوبتانین و ترکیب نانوبتانین+نانوکورکومین پنج روز قبل از القاء بیماری و سه روز پس از آن منجر به کاهش معنیدار در این شاخص در مقایسه با کنترل منفی (رتهای I/R) شد (نمودار۱). هیچ تفاوت معنیداری در نمرات اختلالات نورولوژیکی در رتهای سالم دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب آن دو در مقایسه با کنترل سالم مشاهده نشد. بنابراین، بهنظر میرسد که نانوبتانین و نانوکورکومین اثرات محافظت از نورونی در شرایط آسیب ایسکمی خونرسانی مجدد مغز دارند.
محتوی ROS: یافتههای مطالعه حاضر حاکی از این بود که آسیب ایسکمی خونرسانی مجدد مغز منجر به افزایش تنش اکسیداتیو در مغز میگردد، به طوریکه افزایش 5/2 برابری در محتوی گونههای فعال اکسیژن (ROS) در رتهای دچار آسیب I/R مغزی در مقایسه با رتهای گروه کنترل سالم مشاهده شد (P<0.0001). با این وجود، کاهش معنیدار محتوی ROS در رتهای دریافتکننده نانوکورکومین، نانوبتانین و یا ترکیب هر دوی آنها به مدت ۵ روز قبل از القاء بیماری و سه روز پس از آن در مقایسه با گروه کنترل منفی مشاهده شد. قویترین تأثیر کاهش محتوی ROS در تیمار ترکیبی نانوبتانین+نانوکورکومین در رتهای I/R مغزی دیده شد (نمودار۲). بنابراین، نانوکورکومین و نانوبتانین با اثرات آنتیاکسیدانتی قوی منجر به کاهش تنش اکسیداتیو در شرایط آسیب ایسکمی خونرسانی مجدد مغز میشوند.
فعالیت آنزیمهای آنتیاکسیدانتی: کاهش در فعالیت آنزیم آنتیاکسیدانتی سوپراکسید دیسمیوتاز در مغز رتها در شرایط آسیب ایسکمی خونرسانی مجدد در مقایسه با گروه کنترل سالم مشاهده شد (نمودار a۳). با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح فعالیت این آنزیم در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد. کاهش فعالیت در فعالیت آنزیم آنتیاکسیدانتی کاتالاز در مغز رتها در شرایط آسیب ایسکمی خونرسانی مجدد در مقایسه با گروه کنترل سالم مشاهده شد (نمودار ۳). با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح فعالیت این آنزیم در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد (نمودار b۳). کاهش شدید در محتوی گلوتاتیون احیاء در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل سالم مشاهده شد که نشان دهنده کاهش ظرفیت آنتیاکسیدانتی مغز است. با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح گلوتاتیون احیاء در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد (نمودار c۳) که نشان دهنده بهبود در ظرفیت آنتیاکسیدانتی مغز است.
سطوح سیتوکاینهای التهابی: IL-1β: القاء آسیب ایسکمی خونرسانی مجدد منجر به افزایش تقریبا سه برابری در سطوح بیان IL-1β در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشاندهنده اثرات ضدالتهابی این ترکیبات است. نتایج همچنین نشان داد که ترکیب نانوکورکومین+نانوبتانین در کاهش سطوح سیتوکاین IL-1β بیشترین اثر را دارد (نمودارa۴). القاء آسیب ایسکمی خونرسانی مجدد منجر به افزایش معنیدار در بیان سیتوکاین TNF-α در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافت کننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشان دهنده اثرات ضدالتهابی این ترکیبات است (نمودارb4). القاء آسیب I/R مغز منجر به افزایش معنیدار در بیان سیتوکاین IL-6 در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشاندهنده اثرات ضدالتهابی این ترکیبات است (نمودار c4).
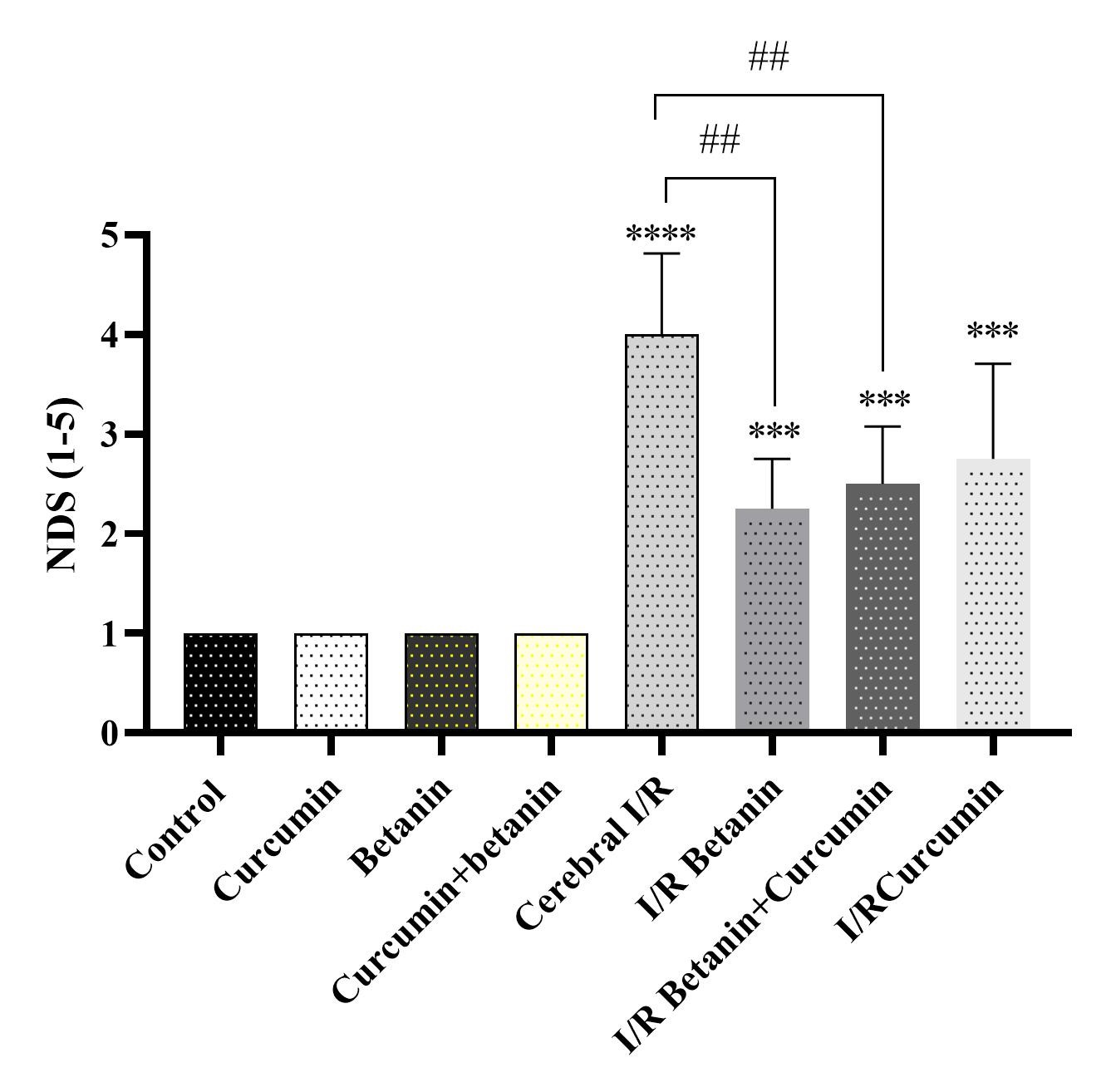
نمودار ۱: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی نمرات اختلالات نورولوژیکی در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و *** نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.001 میباشد. ## نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل منفی در سطح احتمال P<0.01 است.
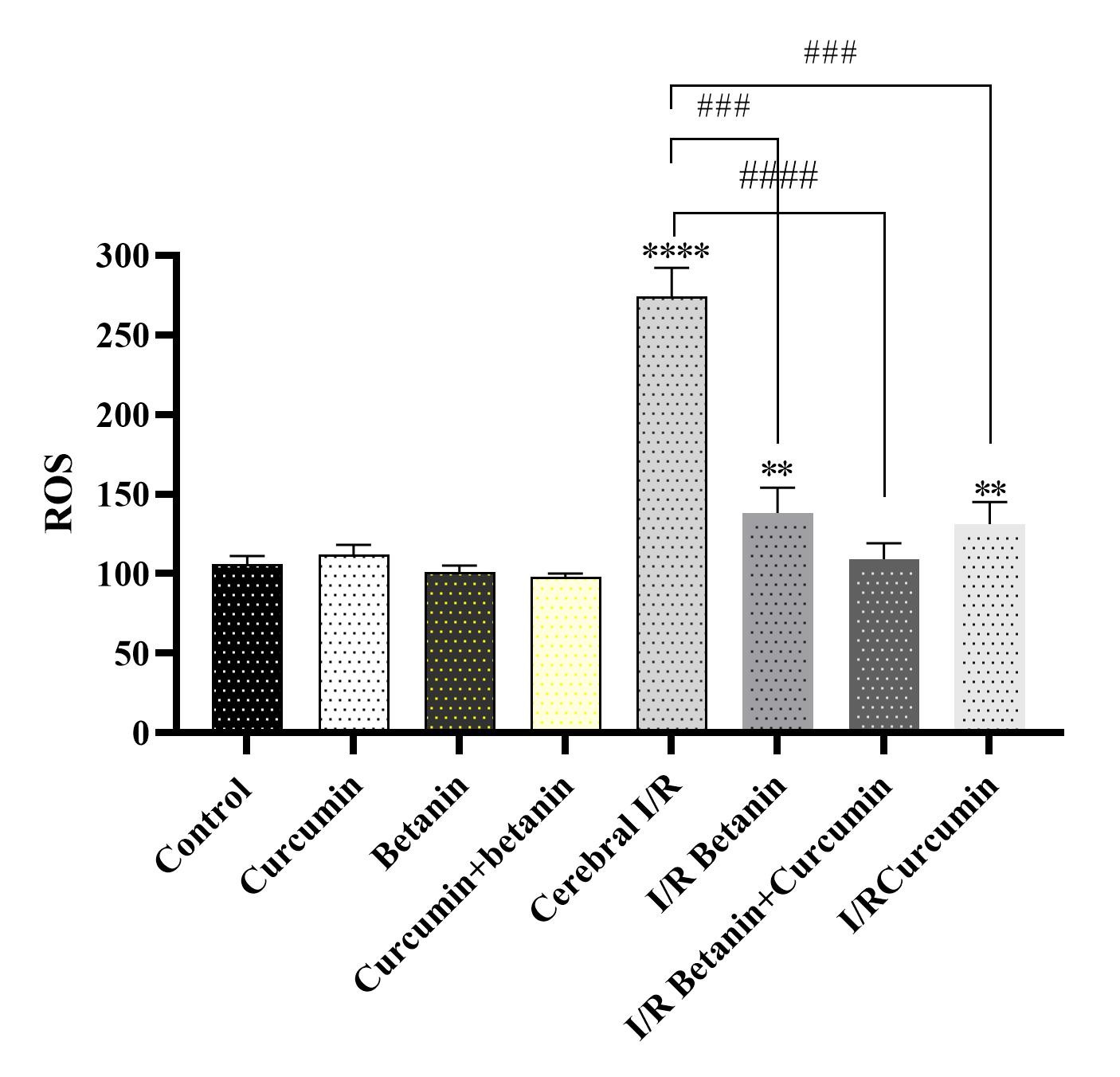
نمودار ۲: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی محتوی ROS مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و ** نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.01 میباشد. #### و ### نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل منفی در سطح احتمال P<0.0001 و P<0.001 است.
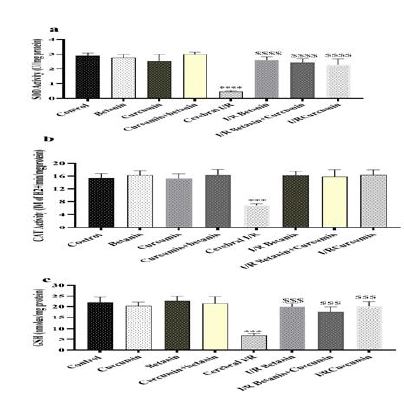
نمودار ۳: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی فعالیت آنزیم سوپراکسید دیسمیوتاز (a)، کاتالاز (b) و محتوی گلوتاتیون احیاء مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و *** به ترتیب نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.001 میباشد. #### و ### به ترتیب نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل مثبت در سطح احتمال P<0.0001 و P<0.001 میباشد.
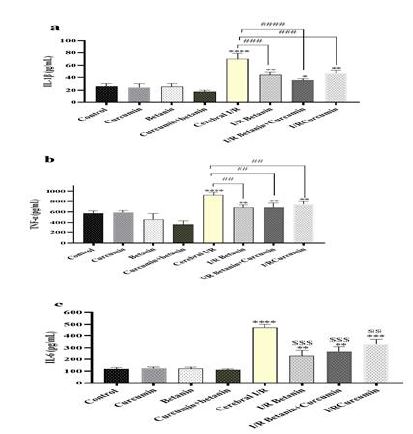
نمودار ۴: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی سطوح بیان سیتوکاینهای IL-1β (a)، TNF-α (b) و IL-6 (c) مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد. ****، ** و * نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001، P<0.01 و P<0.05 میباشد. ####، ### و ## نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل مثبت در سطح احتمال P<0.0001، P<0.001 و P<0.01 میباشد.
بحث
مطالعه حاضر نشان داد که نانوذرات بتانین و کورکومین دارای اثرات محافظت عصبی در آسیب I/R مغزی است. همچنین اثرات قوی در کاهش استرس اکسیداتیو ناشی از I/R مغزی در موشها نشان داد و فعالیت آنزیمهای آنتیاکسیدانی مانند SOD و CAT را بهبود بخشید و همچنین محتوای GSH را افزایش داد. القای استرس اکسیداتیو در آسیب I/R مغزی در بسیاری از مطالعات گزارش شده است (20) و بنابراین تجویز ترکیبات آنتیاکسیدانی برای کاهش اثرات کشنده آن در نظر گرفته شده است (21). در مطالعه حاضر نانوکورکومین و بتانین توانستند تا حد زیادی از تولید بیش از حد رادیکالهای آزاد جلوگیری کند و بهنظر میرسد این ترکیبات دارای اثر آنتیاکسیدانی قوی هستند. این را میتوان به اندازه کوچکتر و توانایی آنها در عبور از مانع خونیمغزی (BBB) نسبت داد (8). بنابراین، برای کاهش استرس اکسیداتیو ناشی از آسیب I/R مغزی، میتوان از نانوبتانین و کورکومین به عنوان یک گزینه درمانی مناسب استفاده کرد. محتوای ROS درون سلولی به شدت بر فعالیت آنزیمهای آنتیاکسیدانی تأثیر میگذارد و محتوای بالای آن میتواند منجر به غیرفعال شدن آنزیمهای آنتیاکسیدانی و مصرف سریع آنتیاکسیدآنهای داخلی شود (22). به دلیل سطوح بالای اسیدهای چرب اشباع نشده چندگانه (polyunsaturated fatty acids)، مغز به استرس اکسیداتیو بسیار حساس است و در نتیجه مقادیر زیادی پراکسیداسیون لیپیدی ایجاد میکند (23). در مطالعه حاضر مشاهده شد که آسیب I/R مغزی باعث افزایش تولید ROS و در نتیجه پراکسیداسیون لیپیدی به شدت افزایش یافت. با اینحال، هنگامی که نانوبتانین و کورکومین به موشها داده شد، محتوای ROS و پراکسیداسیون لیپیدی در مغز به شدت کاهش یافت، که نشان دهنده اثر آنتیاکسیدانی قوی آنها است. بهنظر میرسد که تولید بیش از حد ROS در آسیب I/R مغزی به دلیل کاهش فعالیت آنزیمهای CAT (پاک کننده رادیکالهای H2O2) و SOD (پاک کننده رادیکالهای سوپراکسید) و همچنین کاهش محتوای GSH باشد (24). نشان داده شده است که القای I/R مغزی باعث افزایش التهاب و تولید سیتوکینهای پیش التهابی در مغز میشود که با نتایج مطالعه حاضر مطابقت دارد. در این میان، NF-kB نقش مهمی در تنظیم بیان سایتوکینهای التهابی مانند IL-1، IL-6 و TNF-α ایفا میکند (25). تولید این سیتوکینها مسیر JAK2 / STAT3 را فعال میکند و در نتیجه پاسخهای التهابی را تشدید میکند (26). بنابراین، در مطالعه حاضر، بیان بیش از حد سیتوکینهای التهابی IL-1، IL-6 و TNF-α در شرایط آسیب ایسکمی خونرسانی مجدد مغز را میتوان به افزایش بیان NF-kB نسبت داد. با این حال، تجویز نانوکورکومین و نانوبتانین بیان تمام این سیتوکینهای التهابی را در شرایط I/R مغزی کاهش داد که نشاندهنده اثرات ضد التهابی قوی این ترکیب است. اثرات محافظت از نورون کورکومین و بتانین در شرایط I/R مغزی که در مطالعه حاضر مشاهده شد مطابق با یافتههای دیگر مطالعات در این زمینه است. به عنوان مثال، مو و همکاران (2021) نشان دادند که کورکومین اثرات محافظت از نورون در I/R مغزی داشته و این اثرات را با اثرگذاری بر سیگنالینگ پروتئین کیناز C تتا اعمال میکند (27). همچنین، هانگ و همکاران (2018) گزارش کردند که کورکومین اثرات محافظت از نورون در شرایط I/R مغزی را با اثرگذاری بر مسیر اتوفاژی و التهاب اعمال میکند (28). کاهش التهاب مغزی نیز در پژوهش حاضر دیده شد. اخیراً، لی و همکاران (2022) نشان دادند که بتانین از رتها در برابر آسیب ایسکمی خونرسانی مجدد محافظت میکند (29) که مطابق با یافتههای مطالعه حاضر است. در پژوهش حاضر نشان داده شد که ترکیب نانوکورمین و نانوبتانین در کاهش آسیب ناشی از آسیب I/R مغزی مؤثر است که از نوآوری تحقیق میباشد. از محدودیتهای تحقیق حاضر میتوان به استفاده از مدل حیوانی اشاره کرد که برای تأیید اثرات محافظتی ترکیبات مورد بررسی نیاز به مطالعات بالینی میباشد. همچنین، اندازه نمونه بزرگتر در مطالعات آینده توصیه میشود.
نتیجهگیری
در مطالعه حاضر اثر پیش تیمار با نانوبتانین و نانوکورکومین بر آسیب I/R مغزی در موشهای صحرایی مورد بررسی قرار گرفت و نتایج حاکی از اثرات مثبت آنها بر کاهش استرس اکسیداتیو، افزایش فعالیت آنزیمهای آنتی اکسیدانی و کاهش التهاب در مغز بود. همچنین، این ترکیبات منجر به کاهش نمره اختلالات نورولوژیکی در رتهای I/R شد که نشاندهنده اثرات محافظت از نورونی این ترکیبات میباشد. بهطور کلی، نتیجهگیری میشود که نانوبتانین و نانوکورکومین به دلیل خواص آنتی اکسیدانی و ضد التهابی، اثرات محافظت کننده عصبی قوی در شرایط I/R مغزی دارد و میتواند به عنوان یک گزینه کمکدرمانی مناسب در شرایط سکته مغزی در نظر گرفته شود.
سپاسگزاری
این مقاله حاصل از رساله دکتری یلدا ساغری به استاد راهنمایی اول دکتر ملیحه انتظاری در دانشگاه آزاد اسلامی-واحد تهران شمال است. از کلیه پرسنل انیستیتو پاستور که در انجام این پژوهش یاری رساندند، تشکر و قدردانی میگردد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
سکته مغزی یکی از علل اصلی مرگ و میر در جهان است و بسیاری از افراد ممکن است در مقطعی از زندگی خود آن را تجربه کنند (1). کاهش شدید یا قطع موقت جریان خون در ناحیهای از مغز باعث ایسکمی میشود و پس از مدت کوتاهی سلولهای ناحیه مرکزی از بین میروند، اما سلولهای اطراف، به دلیل دریافت خون از نواحی مجاور، بیشتر زنده میمانند (2). آسیب ایسکمی/خونرسانی مجدد (I/R) مغز باعث افزایش تولید گونههای فعال اکسیژن (ROS) میشود، عملکرد میتوکندری را مختل میکند و باعث تخریب عصبی میشود (3). در عین حال، ظرفیت آنتیاکسیدانی در غلظتهای بالای ROS به شدت کاهش مییابد و پراکسیداسیون لیپیدی و اکسیداسیون پروتئینها و DNA آغاز میشود. تحقیقات نشان داده است که اگر ترکیبات آنتیاکسیدانی همزمان با جریان خون کافی در ناحیه ایسکمیک استفاده شود، بیمار عوارض کمتری از آسیب (I/R) را تجربه خواهد کرد (4). بتانین، زیر مجموعهای از خانواده بتاسیانین، ترکیبی از گیاه Beta vulgaris var. rubra به دلیل داشتن گروههای آمین فنلی و حلقوی، خواص آنتیاکسیدانی و مهارکنندگی ROS خوبی دارد (5). اثرات محافظتی بتانین در آسیب ایسکمی-پرفیوژن مجدد طناب نخاعی (6) و آسیب ایسکمی-پرفیوژن مجدد ژژنوم (7) گزارش شده است. هیچ مطالعهای در مورد اثر بتانین بر آسیب مغزی I/R انجام نشده است. با اینحال، اثر محافظت عصبی بتانین در تخریب عصبی ناشی از تری متیلتین (trimethyltin) در موش نشان داده شده است (8). کورکومین (C21H20O6) ماده فعال ریزوم گیاه زردچوبه Curcuma longa است و گزارشهای زیادی در مورد نقش آنتیاکسیدانی آن وجود دارد (9). بیان شده است که این ترکیب با از بین بردن فعالیت گونههای اکسیژن فعال (ROS) نقش مهمی در محافظت در برابر آسیب اکسیداتیو ایفا میکند (10). اثر آنتیاکسیدانی این ترکیب به گروههای فنلی یا گروه CH2 از قسمت β-دیکتون نسبت داده شده است (11). مطالعات اثرات محافظت کننده عصبی کورکومین را در برابر آسیب مغزی ایسکمیک نشان دادهاند (12). با اینحال، بهنظر میرسد که سد خونی مغزی (BBB) از رسیدن کورکومین آزاد به مغز و اعمال اثرات آن جلوگیری میکند و فراهمی زیستی این ترکیب را در مغز کاهش میدهد (13). برای غلبه بر BBB، فرمولاسیون نانوذرات کورکومین میتواند راه حلی باشد و گفته شده است که نانوذرات کورکومین میتوانند بر این مانع غلبه کرده و غلظت کورکومین را در مغز افزایش دهند. بنابراین، هدف از مطالعه حاضر بررسی اثرات آنتیاکسیدانی و محافظت عصبی نانوذرات کورکومین و بتانین در در رتهای مبتلا به آسیب ایسکمی/خونرسانی مجدد مغز بود.
روش بررسی
تهیه حیوانات: موشهای صحرایی نر نژاد ویستار (250 تا 300 گرم) از انستیتو پاستور ایران خریداری شدند. شرایط محیطی 1.5±25 درجه سانتیگراد و رطوبت نسبی 65 درصد با چرخه 12 ساعته تاریکی/نور برای نگهداری حیوانات استفاده شد. سازگاری حیوانات با شرایط آزمایشگاهی قبل از شروع آزمایش به مدت یک هفته انجام شد.
مواد: نانوذرات بتانین و کورکومین از شرکت نانواکسیر سینا، ایران تهیه شد. دیگر مواد از درجه تحلیلی و از شرکت مرک، آلمان، تهیه شدند.
القاء آسیب ایسکمی خونرسانی مجدد مغز در رتها: القای سکته مغزی با روش انسداد دو طرفه شریان کاروتید مشترک (Bilateral Common Carotid Artery Occlusion) انجام شد. ابتدا موشها با کتامین (50 میلیگرم بر کیلوگرم) و زایلازین (8-2 میلیگرم بر کیلوگرم) بیهوش شدند و یک برش ساژیتال از خط وسط گردن (طول 1 سانتیمتر) ایجاد شد و سپس هر دو شریان کاروتید با دقت از شریان مربوطه جدا شدند. واگ عصبی یک حلقه بخیه ابریشم 5-0 در اطراف هر شریان کاروتید مشترک ایجاد شد و سپس CCA ها به مدت 30 دقیقه با سفت کردن نخهای ابریشمی مسدود شدند. پس از بازگشایی هر دو CCA، یک دوره خونرسانی مجدد پنج دقیقهای آغاز شد. پس از خونرسانی مجدد، زخمها بخیه شدند. در طی این دوره، حیوانات از نظر دمای رکتوم 37 درجه سانتیگراد، رفلکس قرنیه در مواجهه با نور و حفظ مردمکهای گشاد شده مورد بررسی قرار گرفتند. حیواناتی که این معیارها را نداشتند یا تشنج داشتند از مطالعه حذف شدند. سه روز پس از القای I/R مغزی، حیوانات برای جداسازی مغزشان در ابتدا بیهوش و سپس کشته شدند.
گروهبندی حیوانات: در مجموع از 80 موش صحرایی در مطالعه حاضر استفاده شد و به 8 گروه تقسیم شدند: I) رتهای کنترل سالم. II) رتهای سالم دریافتکننده بتانین، III) رتهای سالم دریافتکننده کورکومین، IV) رتهای I/R مغزی، V) رتهای I/R مغزی دریافت کننده نانوبتانین (25 میلی گرم/کیلوگرم)، VI) رتهای I/R مغزی دریافت کننده نانوکورکومین و نانوبتانین (25 میلیگرم بر کیلوگرم)، VII) رتهای سالم دریافت کننده نانوکورکومین و نانوبتانین (25 میلیگرم بر کیلوگرم)، VIII) رتهای I/R مغزی دریافت کننده 25 میلیگرم بر کیلوگرم نانو بتانین و کورکومین. تجویز بتانین و کورکومین آزاد و نانو کورکومین و بتانین 5 روز قبل از القای I/R مغزی شروع شد و تا سه روز پس از BCCAO ادامه یافت.
نمرات اختلالات نورلوژیکی: 24 ساعت پس از القای I/R مغزی، نمرات اختلالات عصبی (NDS) با استفاده از آزمون پنج نقطهای ارزیابی شد و به حیوانات امتیاز 1 تا 5 داده شد. به رتهایی که هیچ گونه اختلال در حرکت را نشان ندادند، نمره 1 داده شد. نمره 2 به حیواناتی داده شد که هنگام آویزان شدن از دم (flexion) به سمت مخالف نیمکره ایسکمیک خم شدند. نمره 3 به حیواناتی داده شد که در ابتدای حرکت روی یک سطح صاف به سمت نیمکره ایسکمیک چرخیدند و موشهایی که رفلکس ایستادن را از دست دادند نمره 4 گرفتند. به حیوانات بدون هیچ حرکتی نمره 5 داده شد (14).
اندازهگیری سطوح پراکسیداسیون لیپید و ROS: محتوای مالون دی آلدئید (MDA) به عنوان شاخص پراکسیداسیون لیپیدی بر اساس روش Dhindsa و همکاران (1981) تعیین شد (15). تبدیل H2DCFDA به DCFDA توسط طیفسنجهای 499 نانومتر و 520 نانومتر بهعنوان شاخصی برای اندازهگیری سطوح ROS در میتوکندریهای مغز پس از نرمالسازی و بیان آن بهعنوان درصد استفاده شد (16). اندازهگیری فعالیت کاتالاز، گلوتیاتیون احیاء و سوپراکسید دیسمیوتاز: اندازهگیری محتوای GSH بر اساس روش Jollow و همکاران انجام شد (17) فعالیت SOD با روش (18) و فعالیت CAT با روش Greenwald (19) برآورد شد.
اندازهگیری سطوح سیتوکاینهای التهابی: از تکنیک الایزا برای اندازهگیری سطوح سیتوکین های التهابی IL-1β، TNF-α و IL-6 طبق دستورالعمل سازنده استفاده شد. برای بررسی بیان این پروتئینها از کیتهای BioLegend، Mybiosource و Abcam استفاده شد.
تجزیه و تحلیل آماری
آنالیز دادهها با استفاده از نرمافزار GraphPad Prism V.8 انجام شد. از آنالیز واریانس یک راهه (ANOVA) برای آنالیز دادهها استفاده شد. دادهها بهصورت انحرافمعیار±میانگین بیان شدند.
ملاحظات اخلاقی
مطالعه حاضر، توسط کمیته اخلاق دانشگاه آزاد اسلامی واحد علوم پزشکی به شماره کد IR.IAU.TNB.REC.1400.022 مورد تأیید قرار گرفت.
نتایج
نمرات اختلالات نورولوژیکی: القاء آسیب ایسکمی خونرسانی مجدد مغز منجر افزایش نمرات اختلالات نورولوژیکی در مقایسه با کنترل سالم شد. با این وجود، تجویز نانوبتانین و ترکیب نانوبتانین+نانوکورکومین پنج روز قبل از القاء بیماری و سه روز پس از آن منجر به کاهش معنیدار در این شاخص در مقایسه با کنترل منفی (رتهای I/R) شد (نمودار۱). هیچ تفاوت معنیداری در نمرات اختلالات نورولوژیکی در رتهای سالم دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب آن دو در مقایسه با کنترل سالم مشاهده نشد. بنابراین، بهنظر میرسد که نانوبتانین و نانوکورکومین اثرات محافظت از نورونی در شرایط آسیب ایسکمی خونرسانی مجدد مغز دارند.
محتوی ROS: یافتههای مطالعه حاضر حاکی از این بود که آسیب ایسکمی خونرسانی مجدد مغز منجر به افزایش تنش اکسیداتیو در مغز میگردد، به طوریکه افزایش 5/2 برابری در محتوی گونههای فعال اکسیژن (ROS) در رتهای دچار آسیب I/R مغزی در مقایسه با رتهای گروه کنترل سالم مشاهده شد (P<0.0001). با این وجود، کاهش معنیدار محتوی ROS در رتهای دریافتکننده نانوکورکومین، نانوبتانین و یا ترکیب هر دوی آنها به مدت ۵ روز قبل از القاء بیماری و سه روز پس از آن در مقایسه با گروه کنترل منفی مشاهده شد. قویترین تأثیر کاهش محتوی ROS در تیمار ترکیبی نانوبتانین+نانوکورکومین در رتهای I/R مغزی دیده شد (نمودار۲). بنابراین، نانوکورکومین و نانوبتانین با اثرات آنتیاکسیدانتی قوی منجر به کاهش تنش اکسیداتیو در شرایط آسیب ایسکمی خونرسانی مجدد مغز میشوند.
فعالیت آنزیمهای آنتیاکسیدانتی: کاهش در فعالیت آنزیم آنتیاکسیدانتی سوپراکسید دیسمیوتاز در مغز رتها در شرایط آسیب ایسکمی خونرسانی مجدد در مقایسه با گروه کنترل سالم مشاهده شد (نمودار a۳). با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح فعالیت این آنزیم در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد. کاهش فعالیت در فعالیت آنزیم آنتیاکسیدانتی کاتالاز در مغز رتها در شرایط آسیب ایسکمی خونرسانی مجدد در مقایسه با گروه کنترل سالم مشاهده شد (نمودار ۳). با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح فعالیت این آنزیم در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد (نمودار b۳). کاهش شدید در محتوی گلوتاتیون احیاء در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل سالم مشاهده شد که نشان دهنده کاهش ظرفیت آنتیاکسیدانتی مغز است. با این وجود، نانوبتانین، نانوکورکومین و یا ترکیب آنها منجر به افزایش سطح گلوتاتیون احیاء در مغز رتهای دچار آسیب I/R مغزی در مقایسه با گروه کنترل منفی شد (نمودار c۳) که نشان دهنده بهبود در ظرفیت آنتیاکسیدانتی مغز است.
سطوح سیتوکاینهای التهابی: IL-1β: القاء آسیب ایسکمی خونرسانی مجدد منجر به افزایش تقریبا سه برابری در سطوح بیان IL-1β در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشاندهنده اثرات ضدالتهابی این ترکیبات است. نتایج همچنین نشان داد که ترکیب نانوکورکومین+نانوبتانین در کاهش سطوح سیتوکاین IL-1β بیشترین اثر را دارد (نمودارa۴). القاء آسیب ایسکمی خونرسانی مجدد منجر به افزایش معنیدار در بیان سیتوکاین TNF-α در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافت کننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشان دهنده اثرات ضدالتهابی این ترکیبات است (نمودارb4). القاء آسیب I/R مغز منجر به افزایش معنیدار در بیان سیتوکاین IL-6 در مغز رتها در مقایسه با گروه کنترل سالم شد که نشان دهنده افزایش التهاب میباشد. با این وجود، کاهش در سطوح بیان این سیتوکاین در رتهای دریافتکننده نانوبتانین، نانوکورکومین یا ترکیب هر دوی آنها در مقایسه با رتهای گروه کنترل منفی مشاهده شد که نشاندهنده اثرات ضدالتهابی این ترکیبات است (نمودار c4).

نمودار ۱: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی نمرات اختلالات نورولوژیکی در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و *** نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.001 میباشد. ## نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل منفی در سطح احتمال P<0.01 است.

نمودار ۲: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی محتوی ROS مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و ** نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.01 میباشد. #### و ### نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل منفی در سطح احتمال P<0.0001 و P<0.001 است.

نمودار ۳: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی فعالیت آنزیم سوپراکسید دیسمیوتاز (a)، کاتالاز (b) و محتوی گلوتاتیون احیاء مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد.
**** و *** به ترتیب نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001 و P<0.001 میباشد. #### و ### به ترتیب نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل مثبت در سطح احتمال P<0.0001 و P<0.001 میباشد.

نمودار ۴: تأثیر تجویز نانوکورکومین، نانوبتانین و ترکیب آنها روی سطوح بیان سیتوکاینهای IL-1β (a)، TNF-α (b) و IL-6 (c) مغز در شرایط آسیب ایسکمی خونرسانی مجدد مغز در مدل رت. نانوبتانین و نانوکورکومین ۵ روز قبل از القاء بیماری و سه روز پس از آن تجویز شد. ****، ** و * نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل سالم در سطح احتمال P<0.0001، P<0.01 و P<0.05 میباشد. ####، ### و ## نشان دهنده تفاوتهای معنیدار در مقایسه با گروه کنترل مثبت در سطح احتمال P<0.0001، P<0.001 و P<0.01 میباشد.
بحث
مطالعه حاضر نشان داد که نانوذرات بتانین و کورکومین دارای اثرات محافظت عصبی در آسیب I/R مغزی است. همچنین اثرات قوی در کاهش استرس اکسیداتیو ناشی از I/R مغزی در موشها نشان داد و فعالیت آنزیمهای آنتیاکسیدانی مانند SOD و CAT را بهبود بخشید و همچنین محتوای GSH را افزایش داد. القای استرس اکسیداتیو در آسیب I/R مغزی در بسیاری از مطالعات گزارش شده است (20) و بنابراین تجویز ترکیبات آنتیاکسیدانی برای کاهش اثرات کشنده آن در نظر گرفته شده است (21). در مطالعه حاضر نانوکورکومین و بتانین توانستند تا حد زیادی از تولید بیش از حد رادیکالهای آزاد جلوگیری کند و بهنظر میرسد این ترکیبات دارای اثر آنتیاکسیدانی قوی هستند. این را میتوان به اندازه کوچکتر و توانایی آنها در عبور از مانع خونیمغزی (BBB) نسبت داد (8). بنابراین، برای کاهش استرس اکسیداتیو ناشی از آسیب I/R مغزی، میتوان از نانوبتانین و کورکومین به عنوان یک گزینه درمانی مناسب استفاده کرد. محتوای ROS درون سلولی به شدت بر فعالیت آنزیمهای آنتیاکسیدانی تأثیر میگذارد و محتوای بالای آن میتواند منجر به غیرفعال شدن آنزیمهای آنتیاکسیدانی و مصرف سریع آنتیاکسیدآنهای داخلی شود (22). به دلیل سطوح بالای اسیدهای چرب اشباع نشده چندگانه (polyunsaturated fatty acids)، مغز به استرس اکسیداتیو بسیار حساس است و در نتیجه مقادیر زیادی پراکسیداسیون لیپیدی ایجاد میکند (23). در مطالعه حاضر مشاهده شد که آسیب I/R مغزی باعث افزایش تولید ROS و در نتیجه پراکسیداسیون لیپیدی به شدت افزایش یافت. با اینحال، هنگامی که نانوبتانین و کورکومین به موشها داده شد، محتوای ROS و پراکسیداسیون لیپیدی در مغز به شدت کاهش یافت، که نشان دهنده اثر آنتیاکسیدانی قوی آنها است. بهنظر میرسد که تولید بیش از حد ROS در آسیب I/R مغزی به دلیل کاهش فعالیت آنزیمهای CAT (پاک کننده رادیکالهای H2O2) و SOD (پاک کننده رادیکالهای سوپراکسید) و همچنین کاهش محتوای GSH باشد (24). نشان داده شده است که القای I/R مغزی باعث افزایش التهاب و تولید سیتوکینهای پیش التهابی در مغز میشود که با نتایج مطالعه حاضر مطابقت دارد. در این میان، NF-kB نقش مهمی در تنظیم بیان سایتوکینهای التهابی مانند IL-1، IL-6 و TNF-α ایفا میکند (25). تولید این سیتوکینها مسیر JAK2 / STAT3 را فعال میکند و در نتیجه پاسخهای التهابی را تشدید میکند (26). بنابراین، در مطالعه حاضر، بیان بیش از حد سیتوکینهای التهابی IL-1، IL-6 و TNF-α در شرایط آسیب ایسکمی خونرسانی مجدد مغز را میتوان به افزایش بیان NF-kB نسبت داد. با این حال، تجویز نانوکورکومین و نانوبتانین بیان تمام این سیتوکینهای التهابی را در شرایط I/R مغزی کاهش داد که نشاندهنده اثرات ضد التهابی قوی این ترکیب است. اثرات محافظت از نورون کورکومین و بتانین در شرایط I/R مغزی که در مطالعه حاضر مشاهده شد مطابق با یافتههای دیگر مطالعات در این زمینه است. به عنوان مثال، مو و همکاران (2021) نشان دادند که کورکومین اثرات محافظت از نورون در I/R مغزی داشته و این اثرات را با اثرگذاری بر سیگنالینگ پروتئین کیناز C تتا اعمال میکند (27). همچنین، هانگ و همکاران (2018) گزارش کردند که کورکومین اثرات محافظت از نورون در شرایط I/R مغزی را با اثرگذاری بر مسیر اتوفاژی و التهاب اعمال میکند (28). کاهش التهاب مغزی نیز در پژوهش حاضر دیده شد. اخیراً، لی و همکاران (2022) نشان دادند که بتانین از رتها در برابر آسیب ایسکمی خونرسانی مجدد محافظت میکند (29) که مطابق با یافتههای مطالعه حاضر است. در پژوهش حاضر نشان داده شد که ترکیب نانوکورمین و نانوبتانین در کاهش آسیب ناشی از آسیب I/R مغزی مؤثر است که از نوآوری تحقیق میباشد. از محدودیتهای تحقیق حاضر میتوان به استفاده از مدل حیوانی اشاره کرد که برای تأیید اثرات محافظتی ترکیبات مورد بررسی نیاز به مطالعات بالینی میباشد. همچنین، اندازه نمونه بزرگتر در مطالعات آینده توصیه میشود.
نتیجهگیری
در مطالعه حاضر اثر پیش تیمار با نانوبتانین و نانوکورکومین بر آسیب I/R مغزی در موشهای صحرایی مورد بررسی قرار گرفت و نتایج حاکی از اثرات مثبت آنها بر کاهش استرس اکسیداتیو، افزایش فعالیت آنزیمهای آنتی اکسیدانی و کاهش التهاب در مغز بود. همچنین، این ترکیبات منجر به کاهش نمره اختلالات نورولوژیکی در رتهای I/R شد که نشاندهنده اثرات محافظت از نورونی این ترکیبات میباشد. بهطور کلی، نتیجهگیری میشود که نانوبتانین و نانوکورکومین به دلیل خواص آنتی اکسیدانی و ضد التهابی، اثرات محافظت کننده عصبی قوی در شرایط I/R مغزی دارد و میتواند به عنوان یک گزینه کمکدرمانی مناسب در شرایط سکته مغزی در نظر گرفته شود.
سپاسگزاری
این مقاله حاصل از رساله دکتری یلدا ساغری به استاد راهنمایی اول دکتر ملیحه انتظاری در دانشگاه آزاد اسلامی-واحد تهران شمال است. از کلیه پرسنل انیستیتو پاستور که در انجام این پژوهش یاری رساندند، تشکر و قدردانی میگردد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
References:
1- Pérez-Asensio FJ, Hurtado O, Burguete MC, Moro MA, Salom JB, Lizasoain I, et al. Inhibition of Inos Activity by 1400W Decreases Glutamate Release and Ameliorates Stroke outcome after Experimental Ischemia. Neurobiol Dis 2005; 18(2): 375-84.
2- Zhao G, Zhang W, Li L, Wu S, Du G. Pinocembrin Protects the Brain Against Ischemia-Reperfusion Injury and Reverses the Autophagy Dysfunction in the Penumbra Area. Molecules 2014; 19(10): 15786-98.
3- Li L, Xiao L, Hou Y, He Q, Zhu J, Li Y, et al. Sestrin2 Silencing Exacerbates Cerebral Ischemia/Reperfusion Injury By Decreasing Mitochondrial Biogenesis through the AMPK/PGC-1α Pathway in Rats. Sci Rep 2016; 6: 30272.
4- Radak D, Resanovic I, Isenovic ER. Link between Oxidative Stress and Acute Brain Ischemia. Angiology 2014; 65(8): 667-76.
5- Azeredo HMC. Betalains: Properties, Sources, Applications, and Stability – A Review. International Journal of Food Science & Technology 2009; 44(12): 2365-76.
6- Tural K, Ozden O, Bilgi Z, Kubat E, Ermutlu CS, Merhan O, et al. The Protective Effect of Betanin and Copper on Spinal Cord Ischemia–Reperfusion Injury. The Journal of Spinal Cord Medicine 2021; 44(5): 704-10.
7- Toth S, Jonecova Z, Maretta M, Curgali K, Kalpakidis T, Pribula M, et al. The Effect of Betanin Parenteral Pretreatment on Jejunal and Pulmonary Tissue Histological Architecture and Inflammatory Response after Jejunal Ischemia-Reperfusion Injury. Experimental and Molecular Pathology 2019; 110: 104292.
8- Thong-asa W, Prasartsri S, Klomkleaw N, Thongwan N. The Neuroprotective Effect of Betanin in Trimethyltin-Induced Neurodegeneration in Mice. Metabolic Brain Disease 2020; 35(8): 1395-405.
9- Abrahams S, Haylett WL, Johnson G, Carr JA, Bardien S. Antioxidant Effects of Curcumin in Models of Neurodegeneration, Aging, Oxidative and Nitrosative Stress: A Review. Neuroscience. 2019; 406: 1-21.
10- Malik P, Singh M. Study of Curcumin Antioxidant Activities in Robust Oil–Water Nanoemulsions. New Journal of Chemistry 2017; 41(21): 12506-19.
11- Farooqui T, Farooqui AA. Chapter 2 - Curcumin: Historical Background, Chemistry, Pharmacological Action, and Potential Therapeutic Value. In: Farooqui T, Farooqui AA, Editors. Curcumin for Neurological and Psychiatric Disorders: Academic Press; 2019; 23-44.
12- Forouzanfar F, Read MI, Barreto GE, Sahebkar A. Neuroprotective Effects of Curcumin through Autophagy Modulation. IUBMB Life 2020; 72(4): 652-64.
13- Prasad S, Tyagi AK, Aggarwal BB. Recent Developments in Delivery, Bioavailability, Absorption and Metabolism of Curcumin: the Golden Pigment from Golden Spice. Cancer Res Treat 2014; 46(1): 2-18.
14- Chen A, Xu Y, Yuan J. Ginkgolide B Ameliorates NLRP3 Inflammasome Activation after Hypoxic-Ischemic Brain Injury in the Neonatal Male Rat. Int J Dev Neurosci 2018; 69: 106-11.
15- Dhindsa RS, Plumb-Dhindsa P, Thorpe TA. Leaf Senescence: Correlated with Increased Levels of Membrane Permeability and Lipid Peroxidation, and Decreased Levels of Superoxide Dismutase and Catalase. Journal of Experimental botany 1981; 32(1): 93-101.
16- Batandier C, Fontaine E, Kériel C, Leverve X. Determination of Mitochondrial Reactive Oxygen Species: Methodological Aspects. J Cell Mol Med 2002; 6(2): 175-87.
17- Jollow D, Mitchell J, Zampaglione N, Gillette J. Bromobenzene-Induced Liver Necrosis. Protective Role of Glutathione and Evidence for 3, 4-Bromobenzene Oxide as the Hepatotoxic Metabolite. Pharmacology 1974; 11(3): 151-69.
18- Kono Y. Generation of Superoxide Radical during Autoxidation of Hydroxylamine and an Assay for Superoxide Dismutase. Arch Biochem Biophys 1978;186(1): 726: 109247.
19- Greenwald RA. Handbook Methods for Oxygen Radical Research: CRC Press; 2018.
20- Crack PJ, Wong CH. Modulation of Neuro-Inflammation and Vascular Response by Oxidative Stress Following Cerebral Ischemia-Reperfusion Injury. Current Medicinal Chemistry 2008; 15(1): 1-14.
21- Torki A, Khalaji-Pirbalouty V, Lorigooini Z, Rafieian-Kopaei M, Sadeghimanesh A, Rabiei Z. Anchusa Italica Extract: Phytochemical and Neuroprotective Evaluation on Global Cerebral Ischemia and Reperfusion. Braz J Pharm Sci 2018; 54(1).
22- Bodega G, Alique M, Puebla L, Carracedo J, Ramírez R. Microvesicles: ROS Scavengers and ROS Producers. Journal of Extracellular Vesicles 2019; 8(1): 1626654.
23- El-Demerdash FM. Lipid Peroxidation, Oxidative Stress and Acetylcholinesterase in Rat Brain Exposed to Organophosphate and Pyrethroid Insecticides. Food and Chemical Toxicology 2011; 49(6): 1346-52.
24- R Buettner G. Superoxide Dismutase in Redox Biology: The Roles of Superoxide and Hydrogen Peroxide. Anti-Cancer Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Anti-Cancer Agents) 2011; 11(4): 341-6.
25- Mitchell JP, Carmody RJ. NF-Κb and the Transcriptional Control of Inflammation. Int Rev Cell Mol Biol 2018; 335: 41-84.
26- Luo L-N, Xie DQ, Zhang XG, Jiang R. Osthole Decreases Renal Ischemia-Reperfusion Injury by Suppressing JAK2/STAT3 Signaling Activation. Exp Ther Med 2016; 12(4): 2009-14.
27- Mo Y, Yue E, Shi N, Liu K. The Protective Effects of Curcumin in Cerebral Ischemia and Reperfusion Injury through PKC-Θ Signaling. Cell Cycle 2021; 20(5-6): 550-60.
28- Huang L, Chen C, Zhang X, Li X, Chen Z, Yang C, et al. Neuroprotective Effect of Curcumin Against Cerebral Ischemia-Reperfusion Via Mediating Autophagy and Inflammation. J Mol Neuroscience 2018; 64(1): 129-39.
29- Li Q, Qu M, Wang N, Wang L, Fan G, Yang C. Betaine Protects Rats Against Ischemia/Reperfusion Injury-Induced Brain Damage. J Neurophysiol 2022; 127(2): 444-51.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بیماریهای مغز و اعصاب
دریافت: 1401/5/31 | پذیرش: 1401/8/22 | انتشار: 1402/3/15
دریافت: 1401/5/31 | پذیرش: 1401/8/22 | انتشار: 1402/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







