دوره 31، شماره 6 - ( شهریور 1402 )
جلد 31 شماره 6 صفحات 6731-6718 |
برگشت به فهرست نسخه ها
Ethics code: IR.AJUMS.REC.1395.160
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mehrabi M, Alemohammad S, Dashtebozorgi R, Tahmasebi Birgani M, Hajjari M R, Mohammadi-Asl J. Evaluate the Effect of Dendrosomal Curcumin on Expression Level of HOTAIR Long Noncoding RNA in MCF-7 Breast Cancer Cell Line. JSSU 2023; 31 (6) :6718-6731
URL: http://jssu.ssu.ac.ir/article-1-5815-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5815-fa.html
مهرابی مریم، آلمحمد سارا، دشت بزرگ رضا، طهماسبی بیرگانی مریم، حجاری محمدرضا، محمدی اصل جواد. بررسی تاثیر نانوکورکومین دندروزومی بر بیان ترانسکریپت غیرکدکننده HOTAIR در رده سلولی توموری MCF-7 پستان. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (6) :6718-6731
متن کامل [PDF 1217 kb]
(552 دریافت)
| چکیده (HTML) (1517 مشاهده)
متن کامل: (1212 مشاهده)
مقدمه
سرطان پستان یکی از شایعترین انواع بدخیمی در زنان کل دنیاست و بیشترین نرخ مرگ و میر ناشی از سرطانها در زنان را به خود اختصاص میدهد. نوع درمان در بیماران مبتلا به سرطان پستان با توجه به شرایط پاتولوژیک بیماران متفاوت است اما تمامی روشها در داشتن عوارض جانبی ناخواسته برای بیمار مشابه هستند (1). در دهههای اخیر استفاده از ترکیبات داروئی با منشا گیاهی مورد توجه پزشکان قرار گرفته است که این توجه ویژه به دلیل اثرات جانبی کم و عدم سمیت که ناشی از سازگاری این ترکیبات با بدن انسان میباشد (2). یکی از نکات قابلتامل ترکیبات گیاهی توانائی چند هدفه بودن این ترکیبات است بدین معنی که قادرند چندین مسیر انتقال پیام سلولی را شناسائی کنند. از طرف دیگر میزان نفوذشان به سلولهای سرطانی در قیاس با سلولهای نرمال بیشتر است (3). کورکومین یک پلیفنل مستخرج از ریشه گیاه زردچوبه با ویژگیهای ضد توموری اثبات شده است. کورکومین در سیستمهای آبی نامحلول بوده، جذب و توزیع بافتی پائین و متابولیسم سریع دارد که مانع شده کورکومین به فاز داروئی وارد شود (4,5). طراحی مهارکنندههای متابولیسمی و سنتز ناقلین میسل- لیپوزوم راهکارهائی هستند که در جهت رفع مشکلات ترکیباتی نظیر کورکومین پیشنهاد شده است (6). در سال 2000 میلادی، دندروزومها به عنوان نسل جدیدی از نانوحاملهای زیست تخریبپذیر و کارآمد انتقال ژن معرفی شدند (7). مطالعات به چاپ رسیده گروه تحقیقاتی ما نشان میدهد که دندروزومها قادرند کورکومین را با بازدهی 80% در خود بارگیری و میسلهایی کروی با اندازه 147 نانومتر ایجاد کنند که بهطور قابلتوجهی از نظر شیمیائی و فیزیکی پایدارند (3) کورکومین با فورمولاسیون دندروزومی بهطور کارآمدی رشد سلولهای سرطانی پستان، مغز، کولون، فیبروسارکوما و کبد را مهار میکند (8,9). بخش عمدهای از توالیهای ژنوم انسانی غیرکد کننده هستند و لذا تولید پروتئین از این مناطق وجود ندارد. اگرچه این توالیها پیشتر به عنوان زبالههای ژنومی در نظر گرفته میشدند، بررسیها نشان میدهد این توالیها در تنظیم طیف وسیعی از عملکردهای حیاتی سلول نظیر پاسخ به استرسهای سلولی، رشد و نمو ،تنظیم بیان ژن، پردازش RNA، تنظیم چرخه سلولی، تنظیم ساختار کروماتین، جایابی درون سلولی و حافظه اپی ژنتیک دخالت دارند. توالیهای غیرکدکننده با طول بلند بیان اختصاصی در یک سلول یا بافت دارند. این ترانسکریپتها عمدتا توسط RNA Polymerase II نسخهبرداری میشوند بنابراین دم پلی A و کلاهک به ترتیب در انتهای '3 و '5 آنها مشاهده میشود (10). ترانسکریپت HOTAIR یکی از انواع ترانسکریپتهای طویل است که نقش انکوژنی آن در طیف وسیعی از سرطانهای انسانی نظیر معده، کولون و پستان به اثبات رسیده است (11) و به نظر میرسد مهار بیان این ژن با توقف رشد سلولهای سرطانی همراه است (12). افزایش بیان ترانسکریپت HOTAIR در سلولهای سرطانی پستان با گیرنده استروژن مشاهده شده است و قدرت متاستاز این سلولها را افزایش میدهد (13). مطالعه حاضر بر این هدف پایهگذاری شده است که تاثیر نانوفورمولاسیون دندروزومی کورکومین بر بیان ژن HOTAIR را در رده سلولی توموری پستان MCF-7 به عنوان رده سلولی توموری پستان دارای گیرنده استروژن مورد مطالعه قرار گیرد.
روش بررسی
آماده سازی کورکومین در فرمول دندروزومی OA400: دندروزومها میسلهای پلیاتیلگلایکول (Polyethylene glycol) دار شده مشتق از واحدهای اسید چرب اولیئک اسید از طرف گروه تحقیقاتی دکتر مجید صادقیزاده در دانشگاه تربیت مدرس اهدا و به عنوان نانوحاملهائی پلیمری جهت افزایش حلالیت کورکومین در این تحقیق مورد استفاده قرار گرفتند. نانوکورکومین دندروزومی OA400 مطابق دستورالعمل بهینه شده توسط طهماسبی بیرگانی و همکاران (3) تهیه گردید. اطلاعات مربوط به ساختار، میکروسکوپ الکترونی، بار سطحی، بازدهی انکپسولاسیون کورکومین در دندروزوم و پایداری فیزیکو- شیمیائی دارو در مطالعه پیشین نویسنده گزارش شده است. (3) نانوکورکومین دندروزومی OA400 با غلظت استوک 2700 میکرومولار تهیه و در شرایط دور از نور در 4 درجه سانتیگراد نگهداری شد. پیش از استفاده در هر تکنیک، رقیقسازی دارو با استفاده از محیط کشت کامل (حاوی 10% سرم جنین گاوی) انجام گرفت.
کشت رده سلولی توموری MCF-7: رده سلولی MCF-7 سرطان پستان از بانک سلولی انستیتو پاستور ایران خریداری شد سلولها در محیط کشت RPMI1640 حاوی 10% FBS و 1% آنتی بیوتیک پنیسیلین-استرپتومایسین رشد داده شدند. کشت سلول در انکوباتور 37 درجه سانتیگراد و25Co2% نگهداری شدند. سلولها پس از گذشت 3 روز با استفاده از تریپسین 0/25% - ای.دی.تی. آ 0/02% پاساژ داده شدند.
بررسی بقای سلولی با استفاده از تکنیک:MTT حساسیت سلولهای MCF-7 سرطان پستان به کورکومین دندرزومی و دوز موثر دارو بر آنها، توسط تکنیک MTT انجام شد. روش MTT، یکی از پرکاربردترین و مهمترین تکنیکهای بررسی و ارزیابی تکثیر و بقای سلولی در آزمایشگاههای سلولی محسوب میشود. تکنیک MTT از حساسیت و تکرارپذیری قابل قبولی برخوردار است. این روش اولین بار در سال 1983 توسط Mossman معرفی گردید و نیازمند کمّی سازی دقیق تعداد سلولهای زنده در محیط کشت سلولی است (14,15). سنجش به روش MTT بازدهی بالایی برای اندازهگیری تکثیر، بقاء و مرگ و میر سلولی دارد و روش اجرای آن نیازی به مراحل وقتگیر شستشو و انتقال از یک پلیت به پلیت دیگر را ندارد. نمونههای مورد بررسی در این روش عبارتند از سلولهای چسبنده یا معلق و سلولهای تکثیر شونده یا غیر تکثیر شونده. در این روش سوبسترای زردرنگ MTT به واسطه آنزیمهای اکسیدوردوکتاز میتوکندریایی وابسته به NAD(P)H در سلولهای زنده به رسوب بنفش رنگ فورمازان احیا میگردد. درواقع سلولهای زنده قادر به احیای رنگ تترازولیوم برماید به رسوب بنفش رنگ فورمازان هستند. رسوب فورمازان در حلال آلی دی متیل سولفوکسید (DMSO) حل و شدت رنگ تولید شده با استفاده از اسپکتروفوتومتری قابل سنجش است. شدت جذب رابطه مستقیمی با تعداد سلولهای زنده دارد. در این مطالعه، 20 هزار سلول در هر چاهک از پلیتهای 96 خانه کشت داده شدند و پس از اینکه سلولها به بستر چسبیدند و به مورفولوژی رسیدند، تحت تیمار با غلظتهای مختلف کورکومین دندروزومی در دو بازه زمانی 24 و 48 ساعت قرار گرفتند. سلولها با دندروزوم تنها نیز تیمار شدند و به عنوان گروه کنترل قرار گرفتند. پس از طی بازههای زمانی مورد نظر، محیط کشت حاوی دارو حذف و سلولها با بافر نمکی فسفات (PBS) شستشو داده شدند و پیش ماده MTT با غلظت mg/ml 5 در بافر نمکی فسفات تهیه، فیلتر و در حجم 20 میکرولیتر به هر چاهک اضافه شد و به پلیت مربوطه مدت 4 ساعت در انکوباتور C°37 نگهداری شد. دویست میکرولیتر دی.ام.اس.او جهت حل کردن رسوب فورمازان اضافه شد و شدت رنگ با استفاده از دستگاه الیزا در طول موج 570 نانومتر برآورد شد. نسبت جدب در سلولهای گروه تیمار به گروه کنترل (غلظت صفر از دارو) میزان بقاء سلول ها در هر غلظت را نشان خواهد داد. غلظتی که در آن 50% از سلول ها توسط دارو کشته شدند تحت عنوان غلظت کشنده (LD50) در نظر گرفته شد. دادههای حاصل از 3 آزمایش مجزا به صورت Mean ± SD ارائه شدند.
میکروسکوپی فلورسانت: ورود کورکومین به سلولهای MCF-7 سرطان پستان بر اساس خاصیت فلورسانت ذاتی این مولکول انجام گرفت. سلول ها به مدت 4 ساعت با غلظت 20 میکرومولار کورکومین تیمار شدند. سپس محیط کشت حاوی دارو خارج و بعد از شستشوی سلول ها با بافر نمکی فسفات، عکسبرداری با میکروسکوپ فلورسانت انجام گرفت.
سنجش مرگ آپوپتوزی: در سلولهای سالم، فسفاتیدیل سرین (PS) فقط در لایه داخلی غشای لیپیدی سلول عرضه میشود. در مرحله اولیه آپوپتوز، فسفاتیدیل سرین از داخل غشای لیپیدی به خارج غشای لیپیدی منتقل میشود. انکسینV، یک بایندینگ پروتئین وابسته به Ca2 با وزن مولکولی 35-36 کیلو دالتون است که میل بالایی به فسفاتیدیل سرین دارد و میتوان از آن برای تشخیص جهت شناسایی خارجی بودن فسفاتیدیل سرین استفاده کرد. انکسین V به عنوان یکی از شاخصهای حساس آپوپتوز زودرس شناخته میشود. آپوپتوز را میتوان با میکروسکوپ فلورسانس یا فلوسایتومتری با استفاده از پروب انکسین V کونژوگه شده با FITC) یک فلورسنت سبز) تشخیص داد (16). به منظور بررسی نوع مرگ القا شده در سلولهای توموری پستان (مرگ آپوپتوز یا نکروز)، تست انکسین- پروپیدیوم یدید و تیمار با نانوکورکومین دندروزومی و در غلظت 20 و 25 میکرومولار و در بازههای زمانی24 و 48 ساعت) توسط کیت Annexin-PI (Roche company) و با استفاده از پروتکل آن انجام گرفت. در این آزمایش قرارگیری سلولها به سمت راست نمودار بیانگر مرگ سلولی آپوپتوز می باشد. به طور کلی در سلولهای سالم، فسفاتیدیل سرین (PS) در لایه داخلی غشای پلاسمایی قرار گرفته است اما هنگامیکه آپوپتوز در سلولی القا میشود فسفاتیدیل سرین به غشاء خارجی سلول انتقال مییابد. این جابجائی در نهایت موجب میشود ماکروفاژها سلولهای آپوپتوتیک را شناسائی و فاگوسیتوز کنند. در کیت آپوپتوز مورد استفاده در این مطالعه، دو ترکیب انکسینV-ورنگ حیاتی پروپیدیوم یودید موجود میباشد. پروپیدیوم یودید تنها وارد سلولهایی میشود که ساختار غشاء پلاسمایی آنها از بین رفته باشد و بنابراین این امکان را فراهم میسازد که سلولهایی را که در مراحل اولیه آپوپتوز Annexin+ PI- هستند از سلولهایی که در مراحل نهایی آپوپتوز Annexin- PI+ هستند تمایز دهیم. سلولهای زنده و سالم Annexin- PI- هستند (3). استخراج RNA و واکنش نسخه برداری معکوس: RNAسلولی با استفاده ازمحلول RNX-Plus (سیناکلون، ایران) از سلولها استخراج گردید. بررسی کیفی RNA توسط الکتروفورز افقی روی ژل آگارز 1% انجام گرفت. حضور باندهای s18 و s28 مرتبط با RNA ریبوزومی به عنوان شاخص کیفیت RNA استخراج شده در نظر گرفته میشود. غلظت و خلوص نمونه RNA بااستفاده از دستگاه نانودراپ با اندازهگیری جذب نوری نمونهها در طول موجهای 260 و 280 نانومتر صورت گرفت. نمونههای حاوی RNA در فریزر80- درجه سانتیگراد نگهداری شدند. سنتز cDNA توسط کیتPrimScriptTM RT reagent kit (Takara, Japan) و بر اساس پروتکل کیت انجام گرفت.
بررسی بیان ژن HOTAIR با استفاده از تکنیک Real-time PCR: واکنش پلیمراز زنجیرهای کمی با استفاده از SYBR Premix Ex Taq TM II (TAKARA, Japan) و پرایمرهای اختصاصی ژنهای HOTAIR و GAPDH ( ژن کنترل داخلی) انجام گرفت. نام و توالی پرایمرهای مورد استفاده در جدول 1 خلاصه شده است. در این راستا، توالی ترانسکریپت ژن مربوطه از پایگاه اینترنتی NCBI با آدرس اینترنتی ذکر شده در منبع شماره (17) دریافت و آغازگرهای الیگونوکلئوتیدی مستقیم و معکوس توسط نرمافزار3 Primer express، طراحی گردید. مخلوط واکنشی Real-time PCR مطابق دستورالعمل کیت مذکور تهیه شد. کارائی تکثیر ژنهای مورد مطالعه پس از انجام هر واکنش توسط نرمافزارLinreg-PCR تعیین و تخمین تغییر بیان ژنها با استفاده روش –ΔΔCt2 انجام شد. میانگین کارائی عملکرد آغازگرهایHOTAIR وGAPDH به ترتیب برابر 88, 87% به دست آمد.
تجزیه و تحلیل آماری
برای هر آزمایش سه تکرار مستقل مدنظر قرار گرفت. نتایج حاصل با استفاده از از نرمافزار آماریGraphPad PrismV9.5 و با بکارگیری آنالیز آماریNOVA one- way و Student t-test انجام گردید. نتایج به صورت میانگین ± انحراف معیار (Mean±SD) گزارش شد. ارزش آماری کمتر از 0/05 به عنوان سطح معنیداری در نظر گرفته شد.
ملاحظات اخلاقی
تحقیق حاضر یک مطالعه بنیادی است که در کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندیشاپور اهواز و با کد اخلاق IR.AJUMS.REC.1395.160 تصویب کمیتههای پژوهشی و اخلاق دانشگاه رسیده است. مراحل اجرائی تحقیق حاصل در مرکز تحقیقات سلولی مولکولی دانشگاه علوم پزشکی جندی شاپور اهواز صورت گرفته است.
جدول 1: پرایمرهای مورد استفاده در واکنش Realtime PCR

نتایج
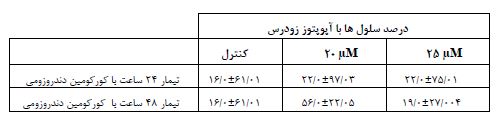
نانوکورکومین دندروزومی به شکل وابسته به غلظت و زمان رشد سلولهای توموری MCF-7 سرطان پستان را مهار میکند. همان طور که در شکل 1و جدول2 مشاهده میشود، پس 24 ساعت تیمار داروئی با نانوکورکومین دندروزومی با بازه غلظتی 0 تا 40 میکرومولار، در غلظت 25 میکرومولار دارو، بیش از نیمی از سلولها از بین رفتند که به عنوان دوز موثر دارو (LD50) در این بازه زمانی در نظر گرفته میشود (0001/>P). به طور مشابه پس از تیمار 48 ساعت با غلظتهای 0 تا 40 میکرومولار کورکومین دندروزومی، در غلظت 20 میکرومولار دارو، بیش از نیمی از سلولها از بین رفتند که بهعنوان دوز موثر دارو (LD50) در این بازه زمانی در نظر گرفته میشود (P =0/001 ). در هردو بازه زمانی 24 و 48 ساعت، کورکومین آزاد و دندروزوم به تنهائی و حتی تا غلظت 40 میکرومولار تاثیر کشندگی معنیداری بر سلولها نشان ندادند (شکل 1و جدول2). این یافتهها نشان میدهد که حاملین دندروزومی خاصیت سیتوتوکسیک ندارند و صرفاً تاثیر ضد سرطانی کورکومین را به واسطه افزایش قدرت انحلال آن افزایش میدهند. در شکل 2 قسمت A و B تصویر میکروسکوپ نوری سلولهای MCF-7 پس از تیمار24 ساعته سلولها با کورکومین دندروزومی را نشان میدهد که اثر مهاری دارو بر رشد این سلولها به وضوح قابل رویت است. همچنین در شکل 2، قسمت C، سلولهای دریافتکننده کورکومین به رنگ سبز قابل رویت هستند که نشان میدهد دندروزوم ورود کورکومین به سلول را تسهیل کرده است. شکل 3 و جدول 3 نشان میدهد، نانوکورکومین دندروزومی به صورت وابسته به غلظت و زمان مرگ آپوپتوز را در رده سلولی MCF-7 پستان القا میکند درصد سلولهایی که پس از 24 ساعت تیمار با نانوکورکومین دندروزومی با غلظت 20 و 25 میکرومولار، دچار مرگ سلولی آپوپتوز اولیه و زودرس شدهاند به ترتیب (97/03±22/0)، (75/01±22/0) از سلولهاست که در مقایسه با سلولهای تیمار نشده با دارو (کنترل) (0/01±16/61) معنیدار بود. همچنین تیمار با غلظت 20 میکرومولار کورکومین دندروزومی به مدت 48 ساعت موجب افزایش درصد سلولهای دچار شده با مرگ سلولی آپوپتوز اولیه و زودرس به میزان 0/05±56/22 شد (05/>P). در تیمار 48 ساعت با غلظت 25 میکرومولار کورکومین دندروزومی درصد سلولهائی دچار مرگ سلولی آپوپتوز اولیه و زودرس شدهاند، 27/004±19/0 بهدست آمد و درصد بیشتری از سلولها (04/03±33/0) دچار مرگ سلولی آپوپتوز دیررس شده بودند که در مقایسه با سلولهای تیمار نشده با دارو (کنترل) (61/01±16/0) معنیدار بودند (05/>P).
جدول 2: بررسی تاثیر کورکومین دندروزومی، کورکومین آزاد و دندروزوم بر تکثیر سلولهای توموری MCF-7 سرطان پستان بعد از 24 و 48 ساعت تیمار با غلظتهای مختلف برای هر ترکیب. دادهها به صورت انحرافمعیار ± میانگین بیان شدهاند.
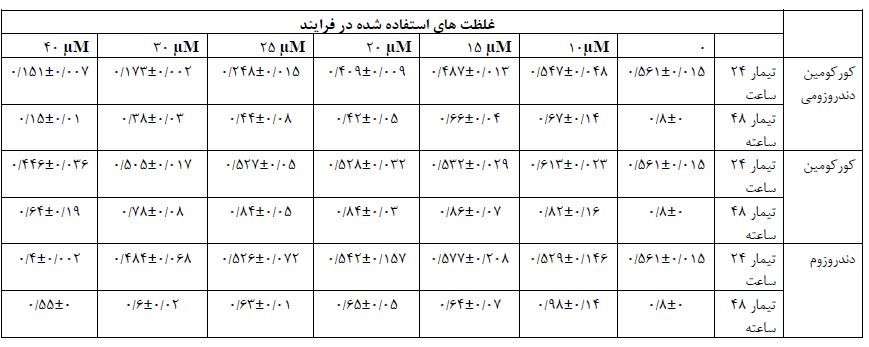
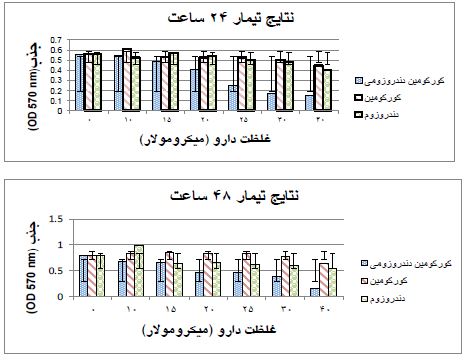
شکل 1: بررسی تاثیر کورکومین دندروزومی، کورکومین آزاد و دندروزوم بر سلولهای توموری MCF-7 سرطان پستان بعد از 24 و 48 ساعت تیمار با غلظتهای مختلف برای هر ترکیب. محور عمودی نمودار بیانگر میزان جذب نمونهها در طول موج 570nm و محور افقی نمودار بیانگر مقدار غلظت استفاده شده از دارو است. داده ها به صورت میانگین ± انحراف معیار بیان شدهاند. سطح معناداری بر اساس قیاس با دادههای بهدست آمده با سلولهای بدون تیمار داروئی محاسبه شده است.

شکل 2: تصویر میکروسکوپ نوری سلولهای MCF-7 قبل(A) و بعد(B) از 24 ساعت تیمار سلولی با غلظت 20 میکرومولار کورکومین دندروزومی. شکل C، عکسبرداری میکروسکوپ فلورسانت جهت بررسی ورود کورکومین دندروزومی به سلولهای توموری MCF-7 پس از 4 ساعت تیمار با دارو. عکسها با بزرگنمائی 400 گرفته شده است.
جدول3: نتایج حاصل از سنجش میزان آپوپتوز القا شده توسط نانوکورکومین دندروزومی پس از 24 و 48 ساعت تیمار با غلظت 20 میکرومولار از دارو. دادههای بهصورت انحرافمعیار± میانگین بیان شدهاند.
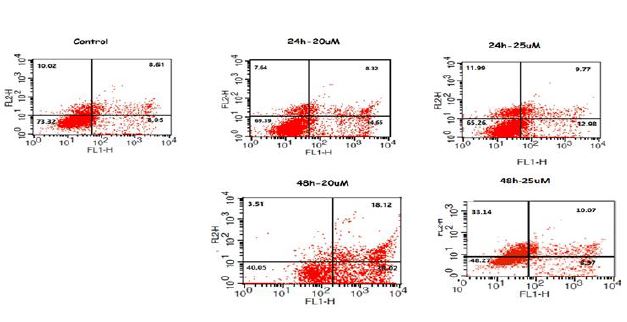
شکل3: بررسی مرگ سلولی آپوپتوز پس از تیمار 24 و 48 ساعت با غلظت های 20 و 25 میکرومولار از کورکومین دندروزومی.
نمودار افقی (FL1-H) آنالیز فلوسیتومتری بیانگر سلولهای رنگ آمیزی شده با انکسینV و نمودار عمودی (FL2-H) ) آنالیز فلوسیتومتری بیانگر سلولهای رنگ آمیزی شده با PI می باشد.
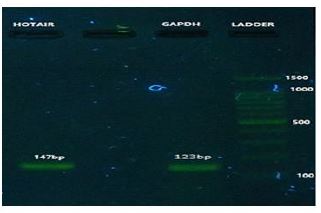
شکل 4: نتایج حاصل از الکتروفورز محصولات حاصل از Real time-PCR دو ژن HOTAIR با طول 147 باز و GAPDH با طول 123 باز
نانوکورکومین دندروزومی موجب کاهش معنیدار بیان ژن HOTAIR میشود. دادههای حاصل از Real-time نشان داد که ژن HOTAIR با اندازه 147 جفت باز و کنترل داخلی GAPDH با طول 123 جفت باز تکثیر شدهاند. شکل 4 نتایج حاصل از الکتروفورز محصولات حاصل از Real-time این دو ژن را نشان میدهد.
نتایج نشان داد که ژن HOTAIR در سلولهای سرطانی MCF-7 بیان نسبتا بالائی دارد. تیمار با دوز موثر مربوط به هر بازه زمانی( غلظت20 و 25 میکرومولار دارو) نانوکورکومین دندروزومی در دو بازه زمانی24 و 48 ساعت به ترتیب با مهار معنیدار این ترانسکریپت همراه بود. میزان تغییر بیان ژن محاسبه شده در بازه زمانی 24 ساعت 0/040±0/4 بهدست آمد (P=0/006). میزان تغییر بیان ژن محاسبه شده در بازه زمانی 48 ساعت 0/030 ±0/25 بهدست آمد (P=0/01). همچنین مشاهده شد کورکومین در حالت آزاد و بدون فورمولاسیون دندروزومی قادر به مهار این ژن نیست. پس از تیمار با کورکومین در حالت آزاد، میزان تغییر بیان ژن محاسبه شده در بازه زمانی 24 ساعت 0/010 ±1/1 بهدست آمد (P=0/05). میزان تغییر بیان ژن محاسبه شده در بازه زمانی 48 ساعت 0/070 ±1/28 بهدست آمد (P>0/05).(شکل5)
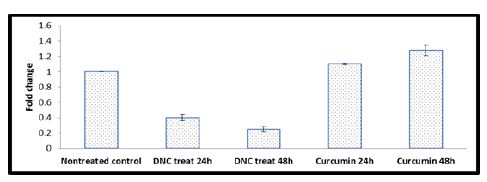
شکل 5: بررسی تاثیر کورکومین دندروزومی بر بیان ژن HOTAIR پس از 24 و 48 ساعت تیمار با غلظت 20 میکرومولار دارو. نمودار عمودی نسبت بیان ژن هدف به ژن مرجع میباشد. نتایج به صورت انحرافمعیار ± میانگین بیان شده اند.
بحث
مطالعه اخیر، ترکیب داروئی کورکومین که در سیستمهای آبی نامحلول است در ساختارهای میسلی با عنوان دندروزم فورموله و بارگیری شد و مشاهده شد که حلالیت این ترکیب افزایش یافت. بررسی میکروسکوپی فلورسانت نیز نشان داد که دندروزومها توانستهاند که کورکومین نامحلول را به درون سلولهای توموری MCF-7 پستان وارد کنند. نتایج این بررسی نشان داد که نانوکورکومین دندروزومی وابسته به زمان و غلظت اثر مهاری کورکومین بر سلولهای توموری پستان را افزایش میدهد و این درحالیست که دندروزوم ها هیچگونه تاثیر کشندگی بر سلولهای MCF-7 نشان ندادند و در غلظتهای بالا نظیر 40 میکرومولار و پس از تیماری 48 ساعته تنها درصد کمی از سلولها دچار مرگ شدند. اثر سمیت داروی نانوکوروکومین دندروزومی در مطالعات پیشین گروه تحقیقاتی نویسنده به انجام رسیده است. در سال 2014، طهماسبی و همکاران نشان دادند که اگرچه کورکومین دندروزومی موجب کاهش رشد سلولهای سرطانی بدخیم گلیوبلاستوما میشود، بر سلولهای نرمال بنیادی و تمایز یافته فیبروبلاست اثر مهاری ندارد. همچنین در غلظت موثر نانو دارو بر سلولهای سرطانی، هیچ سمیتی مرتبط با حامل دندروزومی بر سلولهای سرطانی، بنیادی نرمال و نرمال تمایزیافته مشاهده نشد (3). پیشتر نیز سربلوکی و همکاران، دندروزوم را ترکیبی امن و زیست تخریبپذیر معرفی کرده بودند (7). در سال 2015، فرهنگی و همکاران در گروه تحقیقاتی نویسنده، نشان دادند که نانوکورکومین دندروزومی موجب کاهش ابعاد توموری در مدلهای موشی متاستاتیک سرطان سینه شد و دندروزم به تنهائی فاقد اثر سمیت گزارش شد (18). همچنین علیزاده و همکاران در 2015 از گروه تحقیقاتی ما نشان دادند که نانوکورکومین دندروزومی تا غلظت mg/kg 25/31 ایمن میباشد و در غلظتهای بالاتر درجات خفیفی از سمیت کبدی در نتایج پاراکلینیکی و هیستوپاتولوژیکی مشاهده شد (19). همچنین مطالعات بر پایه میکروسکوپ فلورسانت نشان داده است که جذب سلولی کورکومین در سلولهای سرطانی بیشتر است و به عبارتی ورود ترجیحی به سلولهای توموری دارد. به نظر میرسد که این تمایل ترجیحی به تفاوت محتوای غشائی سلولهای نرمال و سرطانی مرتبط است (20). القای مرگ آپوپتوز یکی از روشهای پیشنهادی در درمان سرطانهای انسانی است زیرا درمان را محدود به توده سرطانی و از توزیع اثرات سمی دارو به بافتهای سالم مجاور جلوگیری میکند (21). یافتههای حاصل از این پژوهش نشان داد که مرگ سلولی القا شده در سلولهای توموری مورد مطالعه به فرم آپوپتوزیس (و نه نکروز) میباشد که برخلاف مرگهای نکروتیک محدود به سلولهایی میشود که دارو را دریافت کردهاند که میتواند این ترکیب را نسبت به داروهایی با پیامدهای نکروتیک ارجحیت بخشد. در مرگ، نکروز به علت تخریب کامل غشای سلول و آزاد شدن محتوای آنزیمی سلول، سلولهای مجاور نیز آسیب و التهاب و بافت مردگی ایجاد میشود (22). نقش کورکومین در القای مرگ آپوپتوزی به کرات در مطالعات پیشین تاثیر این ترکیب گیاهی بر سلولهای سرطانی تائید شده است (23,24). در مطالعه نور ایسنیدا و همکارانش نیز در سال 2019 نشان داده شده است که کورکومین توانایی القای آپوپتوز در سلولهای سرطان کولورکتال را دارد و شواهدی نشان میدهد آپوپتوز امکان دارد توسط مسیری مستقل از میتوکندری و ناشی از استرس شبکه آندوپلاسمی (ER) باشد القا شود (25). همچنین در مطالعه انتونی گیوردانو و همکارش که در سال 2019 منتشر شد بیان شد که در تکثیر سلولهای سرطان سینه، NF-kB فاکتور رونویسی پیش التهابی نقش کلیدی ایفا میکند. NF-kB بیش از 500 ژن مختلف را تنظیم می کند و بیان پروتئین های دخیل در مسیرهای پیام رسانی سلولی را کنترل میکند و در نتیجه باعث ایجاد سرطان و التهاب می شود. ترکیباتی که قادر به تعامل با NF-kB هستند، میتوانند مورد نظر محققان قرار گیرند و جهت مبارزه با سرطان استفاده شوند. کورکومین با کاهش ژنهای القاکننده NF-kB، توانایی کاهش و تأثیرگذاری بر تکثیر و تهاجم سلولهای سرطان سینه را نشان داد (28-26). در مطالعه اخیر ژن غیرکدکننده HOTAIR به عنوان هدف مولکولی کورکومین دندرووزمی در نظر گرفته شد. این ژن ترانسکریپتی طویل ایجاد میکند که در طیف وسیعی از فرآیندهای حیاتی سلول نظیر تنظیم تکثیر، رشد، مرگ سلولی و تمایز دخالت دارد (29). مطالعات پیشین نشان میدهد که بیان ژن مذکور در سلولهای توموری پستان افزایش یافته است و لذا آن را به عنوان یک هدف درمانی معرفی کردند (30). یافتههای بهدست آمده نشان داد که کورکومین دندروزومی موجب مهار ژن HOTAIR میشود و این درحالیست که کورکومین به تنهائی قادر به مهار این ژن نبود که با توجه به عدم حلالیت آن در سیستمهای آبی جهت ورود به سلول، دور از انتظار نبود. پیشتر نیز به نقش مهاری فورمولاسیون دندرووزمی کورکومین بر بیان RNAهای طویل غیرکدکننده نظیر GAS5 در سلولهای توموری سینه اشاره شده است (31). مطالعات پیشین نشان داده است که خاموش سازی ژن HOTAIR با القای مرگ آپوپتوز در سلولهای سرطانی پستان (32,33)، ریه (34)، استئوسارکوما (35) و خون (36) میشود. در سال 2021، دشت بزرگ و همکاران نشان دادند که خاموش سازی ژن HOTAIR، موجب کاهش بیان ژن Bcl2 و افزایش بیان ژن Bax در سلولهای سرطانی کولورکتال میگردد (37). در سال 2022، آل محمد و همکارن نیز نشان دادند که خاموش سازی ژن HOTAIT موجب مهار مسیر EMT بواسطه کاهش بیان دو ژن فیبرونکتین-1 و کودلین-4 در سلولهای سرطان معده میگردد (38). در سال 2021، باباپور و همکاران نیز نتایج مشابهی در زمینه نقش مهار HOTAIT در توقف مسیر EMT در سلولهای سرطانی معده بهدست آوردند لذا این احتمال وجود دارد که القای آپوپتوز در رده سلولی توموری مورد مطالعه نیز بهواسطه کاهش بیان ژن HOTAIR توسط کورکومین دندروزومی باشد (39). با اینحال این سوالی است که در مطالعات بعدی باید به آن پاسخ داده شود. در پایان اشاره به این نکته حائز اهمیت است که اگرچه نتایج بسیار ارزشمندی در ارتباط با داروی نانوکورکومین دندروزومی در این تحقیق بهدست آمده است با این حال تحقیق حاضر دارای محدودیتهایی نیز میباشد که مهمترین آنها انجام این مطالعه در سطح مدل سلولی توموری است و برای تعمیم نتایج استفاده از مدلهای موشی آزمایشگاهی بسیار سودمند است.
نتیجهگیری
در مجموع، مطالعه اخیر نشان میدهد که بارگیری کوروکومین در نانو حاملهای غیرسمی نظیر دندروزومها میتواند حلالیت، رسانش و توزیع بافتی چنین ترکیبات داروئی ارزشمندی را افزایش و در نهایت موجب شود که بتوانیم از قدرت درمانی این ترکیبات در حوزه داروسازی و پزشکی بهره جست.
سپاسگزاری
این مقاله برگرفته از نتایج یک طرح پژوهشی مصوب در کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندی شاپور اهواز است. نویسندگان این مقاله به طور ویژه از جناب آقای پروفسور مجید صادقیزاده، عضو هیئت علمی گروه ژنتیک دانشگاه تربیت مدرس تهران جهت اهداء سخاوتمندانه نانوحاملهای دندروزوم کمال تشکر و قدردانی را مینمایند. همچنین از زحمات تمامی همکاران در معاونت پژوهشی دانشگاه علوم پزشکی جندی شاپور، کمیته تحقیقات دانشجوئی و مرکز تحقیقات سلولی مولکولی که گروه تحقیقاتی ما را در به ثمر رساندن این تحقیق یاری رساندند تشکر و قدردانی می نمایند.
حامی مالی: کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندی شاپور اهواز
تعارض در منافع: وجود ندارد.
سرطان پستان یکی از شایعترین انواع بدخیمی در زنان کل دنیاست و بیشترین نرخ مرگ و میر ناشی از سرطانها در زنان را به خود اختصاص میدهد. نوع درمان در بیماران مبتلا به سرطان پستان با توجه به شرایط پاتولوژیک بیماران متفاوت است اما تمامی روشها در داشتن عوارض جانبی ناخواسته برای بیمار مشابه هستند (1). در دهههای اخیر استفاده از ترکیبات داروئی با منشا گیاهی مورد توجه پزشکان قرار گرفته است که این توجه ویژه به دلیل اثرات جانبی کم و عدم سمیت که ناشی از سازگاری این ترکیبات با بدن انسان میباشد (2). یکی از نکات قابلتامل ترکیبات گیاهی توانائی چند هدفه بودن این ترکیبات است بدین معنی که قادرند چندین مسیر انتقال پیام سلولی را شناسائی کنند. از طرف دیگر میزان نفوذشان به سلولهای سرطانی در قیاس با سلولهای نرمال بیشتر است (3). کورکومین یک پلیفنل مستخرج از ریشه گیاه زردچوبه با ویژگیهای ضد توموری اثبات شده است. کورکومین در سیستمهای آبی نامحلول بوده، جذب و توزیع بافتی پائین و متابولیسم سریع دارد که مانع شده کورکومین به فاز داروئی وارد شود (4,5). طراحی مهارکنندههای متابولیسمی و سنتز ناقلین میسل- لیپوزوم راهکارهائی هستند که در جهت رفع مشکلات ترکیباتی نظیر کورکومین پیشنهاد شده است (6). در سال 2000 میلادی، دندروزومها به عنوان نسل جدیدی از نانوحاملهای زیست تخریبپذیر و کارآمد انتقال ژن معرفی شدند (7). مطالعات به چاپ رسیده گروه تحقیقاتی ما نشان میدهد که دندروزومها قادرند کورکومین را با بازدهی 80% در خود بارگیری و میسلهایی کروی با اندازه 147 نانومتر ایجاد کنند که بهطور قابلتوجهی از نظر شیمیائی و فیزیکی پایدارند (3) کورکومین با فورمولاسیون دندروزومی بهطور کارآمدی رشد سلولهای سرطانی پستان، مغز، کولون، فیبروسارکوما و کبد را مهار میکند (8,9). بخش عمدهای از توالیهای ژنوم انسانی غیرکد کننده هستند و لذا تولید پروتئین از این مناطق وجود ندارد. اگرچه این توالیها پیشتر به عنوان زبالههای ژنومی در نظر گرفته میشدند، بررسیها نشان میدهد این توالیها در تنظیم طیف وسیعی از عملکردهای حیاتی سلول نظیر پاسخ به استرسهای سلولی، رشد و نمو ،تنظیم بیان ژن، پردازش RNA، تنظیم چرخه سلولی، تنظیم ساختار کروماتین، جایابی درون سلولی و حافظه اپی ژنتیک دخالت دارند. توالیهای غیرکدکننده با طول بلند بیان اختصاصی در یک سلول یا بافت دارند. این ترانسکریپتها عمدتا توسط RNA Polymerase II نسخهبرداری میشوند بنابراین دم پلی A و کلاهک به ترتیب در انتهای '3 و '5 آنها مشاهده میشود (10). ترانسکریپت HOTAIR یکی از انواع ترانسکریپتهای طویل است که نقش انکوژنی آن در طیف وسیعی از سرطانهای انسانی نظیر معده، کولون و پستان به اثبات رسیده است (11) و به نظر میرسد مهار بیان این ژن با توقف رشد سلولهای سرطانی همراه است (12). افزایش بیان ترانسکریپت HOTAIR در سلولهای سرطانی پستان با گیرنده استروژن مشاهده شده است و قدرت متاستاز این سلولها را افزایش میدهد (13). مطالعه حاضر بر این هدف پایهگذاری شده است که تاثیر نانوفورمولاسیون دندروزومی کورکومین بر بیان ژن HOTAIR را در رده سلولی توموری پستان MCF-7 به عنوان رده سلولی توموری پستان دارای گیرنده استروژن مورد مطالعه قرار گیرد.
روش بررسی
آماده سازی کورکومین در فرمول دندروزومی OA400: دندروزومها میسلهای پلیاتیلگلایکول (Polyethylene glycol) دار شده مشتق از واحدهای اسید چرب اولیئک اسید از طرف گروه تحقیقاتی دکتر مجید صادقیزاده در دانشگاه تربیت مدرس اهدا و به عنوان نانوحاملهائی پلیمری جهت افزایش حلالیت کورکومین در این تحقیق مورد استفاده قرار گرفتند. نانوکورکومین دندروزومی OA400 مطابق دستورالعمل بهینه شده توسط طهماسبی بیرگانی و همکاران (3) تهیه گردید. اطلاعات مربوط به ساختار، میکروسکوپ الکترونی، بار سطحی، بازدهی انکپسولاسیون کورکومین در دندروزوم و پایداری فیزیکو- شیمیائی دارو در مطالعه پیشین نویسنده گزارش شده است. (3) نانوکورکومین دندروزومی OA400 با غلظت استوک 2700 میکرومولار تهیه و در شرایط دور از نور در 4 درجه سانتیگراد نگهداری شد. پیش از استفاده در هر تکنیک، رقیقسازی دارو با استفاده از محیط کشت کامل (حاوی 10% سرم جنین گاوی) انجام گرفت.
کشت رده سلولی توموری MCF-7: رده سلولی MCF-7 سرطان پستان از بانک سلولی انستیتو پاستور ایران خریداری شد سلولها در محیط کشت RPMI1640 حاوی 10% FBS و 1% آنتی بیوتیک پنیسیلین-استرپتومایسین رشد داده شدند. کشت سلول در انکوباتور 37 درجه سانتیگراد و25Co2% نگهداری شدند. سلولها پس از گذشت 3 روز با استفاده از تریپسین 0/25% - ای.دی.تی. آ 0/02% پاساژ داده شدند.
بررسی بقای سلولی با استفاده از تکنیک:MTT حساسیت سلولهای MCF-7 سرطان پستان به کورکومین دندرزومی و دوز موثر دارو بر آنها، توسط تکنیک MTT انجام شد. روش MTT، یکی از پرکاربردترین و مهمترین تکنیکهای بررسی و ارزیابی تکثیر و بقای سلولی در آزمایشگاههای سلولی محسوب میشود. تکنیک MTT از حساسیت و تکرارپذیری قابل قبولی برخوردار است. این روش اولین بار در سال 1983 توسط Mossman معرفی گردید و نیازمند کمّی سازی دقیق تعداد سلولهای زنده در محیط کشت سلولی است (14,15). سنجش به روش MTT بازدهی بالایی برای اندازهگیری تکثیر، بقاء و مرگ و میر سلولی دارد و روش اجرای آن نیازی به مراحل وقتگیر شستشو و انتقال از یک پلیت به پلیت دیگر را ندارد. نمونههای مورد بررسی در این روش عبارتند از سلولهای چسبنده یا معلق و سلولهای تکثیر شونده یا غیر تکثیر شونده. در این روش سوبسترای زردرنگ MTT به واسطه آنزیمهای اکسیدوردوکتاز میتوکندریایی وابسته به NAD(P)H در سلولهای زنده به رسوب بنفش رنگ فورمازان احیا میگردد. درواقع سلولهای زنده قادر به احیای رنگ تترازولیوم برماید به رسوب بنفش رنگ فورمازان هستند. رسوب فورمازان در حلال آلی دی متیل سولفوکسید (DMSO) حل و شدت رنگ تولید شده با استفاده از اسپکتروفوتومتری قابل سنجش است. شدت جذب رابطه مستقیمی با تعداد سلولهای زنده دارد. در این مطالعه، 20 هزار سلول در هر چاهک از پلیتهای 96 خانه کشت داده شدند و پس از اینکه سلولها به بستر چسبیدند و به مورفولوژی رسیدند، تحت تیمار با غلظتهای مختلف کورکومین دندروزومی در دو بازه زمانی 24 و 48 ساعت قرار گرفتند. سلولها با دندروزوم تنها نیز تیمار شدند و به عنوان گروه کنترل قرار گرفتند. پس از طی بازههای زمانی مورد نظر، محیط کشت حاوی دارو حذف و سلولها با بافر نمکی فسفات (PBS) شستشو داده شدند و پیش ماده MTT با غلظت mg/ml 5 در بافر نمکی فسفات تهیه، فیلتر و در حجم 20 میکرولیتر به هر چاهک اضافه شد و به پلیت مربوطه مدت 4 ساعت در انکوباتور C°37 نگهداری شد. دویست میکرولیتر دی.ام.اس.او جهت حل کردن رسوب فورمازان اضافه شد و شدت رنگ با استفاده از دستگاه الیزا در طول موج 570 نانومتر برآورد شد. نسبت جدب در سلولهای گروه تیمار به گروه کنترل (غلظت صفر از دارو) میزان بقاء سلول ها در هر غلظت را نشان خواهد داد. غلظتی که در آن 50% از سلول ها توسط دارو کشته شدند تحت عنوان غلظت کشنده (LD50) در نظر گرفته شد. دادههای حاصل از 3 آزمایش مجزا به صورت Mean ± SD ارائه شدند.
میکروسکوپی فلورسانت: ورود کورکومین به سلولهای MCF-7 سرطان پستان بر اساس خاصیت فلورسانت ذاتی این مولکول انجام گرفت. سلول ها به مدت 4 ساعت با غلظت 20 میکرومولار کورکومین تیمار شدند. سپس محیط کشت حاوی دارو خارج و بعد از شستشوی سلول ها با بافر نمکی فسفات، عکسبرداری با میکروسکوپ فلورسانت انجام گرفت.
سنجش مرگ آپوپتوزی: در سلولهای سالم، فسفاتیدیل سرین (PS) فقط در لایه داخلی غشای لیپیدی سلول عرضه میشود. در مرحله اولیه آپوپتوز، فسفاتیدیل سرین از داخل غشای لیپیدی به خارج غشای لیپیدی منتقل میشود. انکسینV، یک بایندینگ پروتئین وابسته به Ca2 با وزن مولکولی 35-36 کیلو دالتون است که میل بالایی به فسفاتیدیل سرین دارد و میتوان از آن برای تشخیص جهت شناسایی خارجی بودن فسفاتیدیل سرین استفاده کرد. انکسین V به عنوان یکی از شاخصهای حساس آپوپتوز زودرس شناخته میشود. آپوپتوز را میتوان با میکروسکوپ فلورسانس یا فلوسایتومتری با استفاده از پروب انکسین V کونژوگه شده با FITC) یک فلورسنت سبز) تشخیص داد (16). به منظور بررسی نوع مرگ القا شده در سلولهای توموری پستان (مرگ آپوپتوز یا نکروز)، تست انکسین- پروپیدیوم یدید و تیمار با نانوکورکومین دندروزومی و در غلظت 20 و 25 میکرومولار و در بازههای زمانی24 و 48 ساعت) توسط کیت Annexin-PI (Roche company) و با استفاده از پروتکل آن انجام گرفت. در این آزمایش قرارگیری سلولها به سمت راست نمودار بیانگر مرگ سلولی آپوپتوز می باشد. به طور کلی در سلولهای سالم، فسفاتیدیل سرین (PS) در لایه داخلی غشای پلاسمایی قرار گرفته است اما هنگامیکه آپوپتوز در سلولی القا میشود فسفاتیدیل سرین به غشاء خارجی سلول انتقال مییابد. این جابجائی در نهایت موجب میشود ماکروفاژها سلولهای آپوپتوتیک را شناسائی و فاگوسیتوز کنند. در کیت آپوپتوز مورد استفاده در این مطالعه، دو ترکیب انکسینV-ورنگ حیاتی پروپیدیوم یودید موجود میباشد. پروپیدیوم یودید تنها وارد سلولهایی میشود که ساختار غشاء پلاسمایی آنها از بین رفته باشد و بنابراین این امکان را فراهم میسازد که سلولهایی را که در مراحل اولیه آپوپتوز Annexin+ PI- هستند از سلولهایی که در مراحل نهایی آپوپتوز Annexin- PI+ هستند تمایز دهیم. سلولهای زنده و سالم Annexin- PI- هستند (3). استخراج RNA و واکنش نسخه برداری معکوس: RNAسلولی با استفاده ازمحلول RNX-Plus (سیناکلون، ایران) از سلولها استخراج گردید. بررسی کیفی RNA توسط الکتروفورز افقی روی ژل آگارز 1% انجام گرفت. حضور باندهای s18 و s28 مرتبط با RNA ریبوزومی به عنوان شاخص کیفیت RNA استخراج شده در نظر گرفته میشود. غلظت و خلوص نمونه RNA بااستفاده از دستگاه نانودراپ با اندازهگیری جذب نوری نمونهها در طول موجهای 260 و 280 نانومتر صورت گرفت. نمونههای حاوی RNA در فریزر80- درجه سانتیگراد نگهداری شدند. سنتز cDNA توسط کیتPrimScriptTM RT reagent kit (Takara, Japan) و بر اساس پروتکل کیت انجام گرفت.
بررسی بیان ژن HOTAIR با استفاده از تکنیک Real-time PCR: واکنش پلیمراز زنجیرهای کمی با استفاده از SYBR Premix Ex Taq TM II (TAKARA, Japan) و پرایمرهای اختصاصی ژنهای HOTAIR و GAPDH ( ژن کنترل داخلی) انجام گرفت. نام و توالی پرایمرهای مورد استفاده در جدول 1 خلاصه شده است. در این راستا، توالی ترانسکریپت ژن مربوطه از پایگاه اینترنتی NCBI با آدرس اینترنتی ذکر شده در منبع شماره (17) دریافت و آغازگرهای الیگونوکلئوتیدی مستقیم و معکوس توسط نرمافزار3 Primer express، طراحی گردید. مخلوط واکنشی Real-time PCR مطابق دستورالعمل کیت مذکور تهیه شد. کارائی تکثیر ژنهای مورد مطالعه پس از انجام هر واکنش توسط نرمافزارLinreg-PCR تعیین و تخمین تغییر بیان ژنها با استفاده روش –ΔΔCt2 انجام شد. میانگین کارائی عملکرد آغازگرهایHOTAIR وGAPDH به ترتیب برابر 88, 87% به دست آمد.
تجزیه و تحلیل آماری
برای هر آزمایش سه تکرار مستقل مدنظر قرار گرفت. نتایج حاصل با استفاده از از نرمافزار آماریGraphPad PrismV9.5 و با بکارگیری آنالیز آماریNOVA one- way و Student t-test انجام گردید. نتایج به صورت میانگین ± انحراف معیار (Mean±SD) گزارش شد. ارزش آماری کمتر از 0/05 به عنوان سطح معنیداری در نظر گرفته شد.
ملاحظات اخلاقی
تحقیق حاضر یک مطالعه بنیادی است که در کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندیشاپور اهواز و با کد اخلاق IR.AJUMS.REC.1395.160 تصویب کمیتههای پژوهشی و اخلاق دانشگاه رسیده است. مراحل اجرائی تحقیق حاصل در مرکز تحقیقات سلولی مولکولی دانشگاه علوم پزشکی جندی شاپور اهواز صورت گرفته است.
جدول 1: پرایمرهای مورد استفاده در واکنش Realtime PCR

نتایج
نانوکورکومین دندروزومی به شکل وابسته به غلظت و زمان رشد سلولهای توموری MCF-7 سرطان پستان را مهار میکند. همان طور که در شکل 1و جدول2 مشاهده میشود، پس 24 ساعت تیمار داروئی با نانوکورکومین دندروزومی با بازه غلظتی 0 تا 40 میکرومولار، در غلظت 25 میکرومولار دارو، بیش از نیمی از سلولها از بین رفتند که به عنوان دوز موثر دارو (LD50) در این بازه زمانی در نظر گرفته میشود (0001/>P). به طور مشابه پس از تیمار 48 ساعت با غلظتهای 0 تا 40 میکرومولار کورکومین دندروزومی، در غلظت 20 میکرومولار دارو، بیش از نیمی از سلولها از بین رفتند که بهعنوان دوز موثر دارو (LD50) در این بازه زمانی در نظر گرفته میشود (P =0/001 ). در هردو بازه زمانی 24 و 48 ساعت، کورکومین آزاد و دندروزوم به تنهائی و حتی تا غلظت 40 میکرومولار تاثیر کشندگی معنیداری بر سلولها نشان ندادند (شکل 1و جدول2). این یافتهها نشان میدهد که حاملین دندروزومی خاصیت سیتوتوکسیک ندارند و صرفاً تاثیر ضد سرطانی کورکومین را به واسطه افزایش قدرت انحلال آن افزایش میدهند. در شکل 2 قسمت A و B تصویر میکروسکوپ نوری سلولهای MCF-7 پس از تیمار24 ساعته سلولها با کورکومین دندروزومی را نشان میدهد که اثر مهاری دارو بر رشد این سلولها به وضوح قابل رویت است. همچنین در شکل 2، قسمت C، سلولهای دریافتکننده کورکومین به رنگ سبز قابل رویت هستند که نشان میدهد دندروزوم ورود کورکومین به سلول را تسهیل کرده است. شکل 3 و جدول 3 نشان میدهد، نانوکورکومین دندروزومی به صورت وابسته به غلظت و زمان مرگ آپوپتوز را در رده سلولی MCF-7 پستان القا میکند درصد سلولهایی که پس از 24 ساعت تیمار با نانوکورکومین دندروزومی با غلظت 20 و 25 میکرومولار، دچار مرگ سلولی آپوپتوز اولیه و زودرس شدهاند به ترتیب (97/03±22/0)، (75/01±22/0) از سلولهاست که در مقایسه با سلولهای تیمار نشده با دارو (کنترل) (0/01±16/61) معنیدار بود. همچنین تیمار با غلظت 20 میکرومولار کورکومین دندروزومی به مدت 48 ساعت موجب افزایش درصد سلولهای دچار شده با مرگ سلولی آپوپتوز اولیه و زودرس به میزان 0/05±56/22 شد (05/>P). در تیمار 48 ساعت با غلظت 25 میکرومولار کورکومین دندروزومی درصد سلولهائی دچار مرگ سلولی آپوپتوز اولیه و زودرس شدهاند، 27/004±19/0 بهدست آمد و درصد بیشتری از سلولها (04/03±33/0) دچار مرگ سلولی آپوپتوز دیررس شده بودند که در مقایسه با سلولهای تیمار نشده با دارو (کنترل) (61/01±16/0) معنیدار بودند (05/>P).
جدول 2: بررسی تاثیر کورکومین دندروزومی، کورکومین آزاد و دندروزوم بر تکثیر سلولهای توموری MCF-7 سرطان پستان بعد از 24 و 48 ساعت تیمار با غلظتهای مختلف برای هر ترکیب. دادهها به صورت انحرافمعیار ± میانگین بیان شدهاند.


شکل 1: بررسی تاثیر کورکومین دندروزومی، کورکومین آزاد و دندروزوم بر سلولهای توموری MCF-7 سرطان پستان بعد از 24 و 48 ساعت تیمار با غلظتهای مختلف برای هر ترکیب. محور عمودی نمودار بیانگر میزان جذب نمونهها در طول موج 570nm و محور افقی نمودار بیانگر مقدار غلظت استفاده شده از دارو است. داده ها به صورت میانگین ± انحراف معیار بیان شدهاند. سطح معناداری بر اساس قیاس با دادههای بهدست آمده با سلولهای بدون تیمار داروئی محاسبه شده است.

شکل 2: تصویر میکروسکوپ نوری سلولهای MCF-7 قبل(A) و بعد(B) از 24 ساعت تیمار سلولی با غلظت 20 میکرومولار کورکومین دندروزومی. شکل C، عکسبرداری میکروسکوپ فلورسانت جهت بررسی ورود کورکومین دندروزومی به سلولهای توموری MCF-7 پس از 4 ساعت تیمار با دارو. عکسها با بزرگنمائی 400 گرفته شده است.
جدول3: نتایج حاصل از سنجش میزان آپوپتوز القا شده توسط نانوکورکومین دندروزومی پس از 24 و 48 ساعت تیمار با غلظت 20 میکرومولار از دارو. دادههای بهصورت انحرافمعیار± میانگین بیان شدهاند.


شکل3: بررسی مرگ سلولی آپوپتوز پس از تیمار 24 و 48 ساعت با غلظت های 20 و 25 میکرومولار از کورکومین دندروزومی.
نمودار افقی (FL1-H) آنالیز فلوسیتومتری بیانگر سلولهای رنگ آمیزی شده با انکسینV و نمودار عمودی (FL2-H) ) آنالیز فلوسیتومتری بیانگر سلولهای رنگ آمیزی شده با PI می باشد.

شکل 4: نتایج حاصل از الکتروفورز محصولات حاصل از Real time-PCR دو ژن HOTAIR با طول 147 باز و GAPDH با طول 123 باز
نانوکورکومین دندروزومی موجب کاهش معنیدار بیان ژن HOTAIR میشود. دادههای حاصل از Real-time نشان داد که ژن HOTAIR با اندازه 147 جفت باز و کنترل داخلی GAPDH با طول 123 جفت باز تکثیر شدهاند. شکل 4 نتایج حاصل از الکتروفورز محصولات حاصل از Real-time این دو ژن را نشان میدهد.
نتایج نشان داد که ژن HOTAIR در سلولهای سرطانی MCF-7 بیان نسبتا بالائی دارد. تیمار با دوز موثر مربوط به هر بازه زمانی( غلظت20 و 25 میکرومولار دارو) نانوکورکومین دندروزومی در دو بازه زمانی24 و 48 ساعت به ترتیب با مهار معنیدار این ترانسکریپت همراه بود. میزان تغییر بیان ژن محاسبه شده در بازه زمانی 24 ساعت 0/040±0/4 بهدست آمد (P=0/006). میزان تغییر بیان ژن محاسبه شده در بازه زمانی 48 ساعت 0/030 ±0/25 بهدست آمد (P=0/01). همچنین مشاهده شد کورکومین در حالت آزاد و بدون فورمولاسیون دندروزومی قادر به مهار این ژن نیست. پس از تیمار با کورکومین در حالت آزاد، میزان تغییر بیان ژن محاسبه شده در بازه زمانی 24 ساعت 0/010 ±1/1 بهدست آمد (P=0/05). میزان تغییر بیان ژن محاسبه شده در بازه زمانی 48 ساعت 0/070 ±1/28 بهدست آمد (P>0/05).

شکل 5: بررسی تاثیر کورکومین دندروزومی بر بیان ژن HOTAIR پس از 24 و 48 ساعت تیمار با غلظت 20 میکرومولار دارو. نمودار عمودی نسبت بیان ژن هدف به ژن مرجع میباشد. نتایج به صورت انحرافمعیار ± میانگین بیان شده اند.
بحث
مطالعه اخیر، ترکیب داروئی کورکومین که در سیستمهای آبی نامحلول است در ساختارهای میسلی با عنوان دندروزم فورموله و بارگیری شد و مشاهده شد که حلالیت این ترکیب افزایش یافت. بررسی میکروسکوپی فلورسانت نیز نشان داد که دندروزومها توانستهاند که کورکومین نامحلول را به درون سلولهای توموری MCF-7 پستان وارد کنند. نتایج این بررسی نشان داد که نانوکورکومین دندروزومی وابسته به زمان و غلظت اثر مهاری کورکومین بر سلولهای توموری پستان را افزایش میدهد و این درحالیست که دندروزوم ها هیچگونه تاثیر کشندگی بر سلولهای MCF-7 نشان ندادند و در غلظتهای بالا نظیر 40 میکرومولار و پس از تیماری 48 ساعته تنها درصد کمی از سلولها دچار مرگ شدند. اثر سمیت داروی نانوکوروکومین دندروزومی در مطالعات پیشین گروه تحقیقاتی نویسنده به انجام رسیده است. در سال 2014، طهماسبی و همکاران نشان دادند که اگرچه کورکومین دندروزومی موجب کاهش رشد سلولهای سرطانی بدخیم گلیوبلاستوما میشود، بر سلولهای نرمال بنیادی و تمایز یافته فیبروبلاست اثر مهاری ندارد. همچنین در غلظت موثر نانو دارو بر سلولهای سرطانی، هیچ سمیتی مرتبط با حامل دندروزومی بر سلولهای سرطانی، بنیادی نرمال و نرمال تمایزیافته مشاهده نشد (3). پیشتر نیز سربلوکی و همکاران، دندروزوم را ترکیبی امن و زیست تخریبپذیر معرفی کرده بودند (7). در سال 2015، فرهنگی و همکاران در گروه تحقیقاتی نویسنده، نشان دادند که نانوکورکومین دندروزومی موجب کاهش ابعاد توموری در مدلهای موشی متاستاتیک سرطان سینه شد و دندروزم به تنهائی فاقد اثر سمیت گزارش شد (18). همچنین علیزاده و همکاران در 2015 از گروه تحقیقاتی ما نشان دادند که نانوکورکومین دندروزومی تا غلظت mg/kg 25/31 ایمن میباشد و در غلظتهای بالاتر درجات خفیفی از سمیت کبدی در نتایج پاراکلینیکی و هیستوپاتولوژیکی مشاهده شد (19). همچنین مطالعات بر پایه میکروسکوپ فلورسانت نشان داده است که جذب سلولی کورکومین در سلولهای سرطانی بیشتر است و به عبارتی ورود ترجیحی به سلولهای توموری دارد. به نظر میرسد که این تمایل ترجیحی به تفاوت محتوای غشائی سلولهای نرمال و سرطانی مرتبط است (20). القای مرگ آپوپتوز یکی از روشهای پیشنهادی در درمان سرطانهای انسانی است زیرا درمان را محدود به توده سرطانی و از توزیع اثرات سمی دارو به بافتهای سالم مجاور جلوگیری میکند (21). یافتههای حاصل از این پژوهش نشان داد که مرگ سلولی القا شده در سلولهای توموری مورد مطالعه به فرم آپوپتوزیس (و نه نکروز) میباشد که برخلاف مرگهای نکروتیک محدود به سلولهایی میشود که دارو را دریافت کردهاند که میتواند این ترکیب را نسبت به داروهایی با پیامدهای نکروتیک ارجحیت بخشد. در مرگ، نکروز به علت تخریب کامل غشای سلول و آزاد شدن محتوای آنزیمی سلول، سلولهای مجاور نیز آسیب و التهاب و بافت مردگی ایجاد میشود (22). نقش کورکومین در القای مرگ آپوپتوزی به کرات در مطالعات پیشین تاثیر این ترکیب گیاهی بر سلولهای سرطانی تائید شده است (23,24). در مطالعه نور ایسنیدا و همکارانش نیز در سال 2019 نشان داده شده است که کورکومین توانایی القای آپوپتوز در سلولهای سرطان کولورکتال را دارد و شواهدی نشان میدهد آپوپتوز امکان دارد توسط مسیری مستقل از میتوکندری و ناشی از استرس شبکه آندوپلاسمی (ER) باشد القا شود (25). همچنین در مطالعه انتونی گیوردانو و همکارش که در سال 2019 منتشر شد بیان شد که در تکثیر سلولهای سرطان سینه، NF-kB فاکتور رونویسی پیش التهابی نقش کلیدی ایفا میکند. NF-kB بیش از 500 ژن مختلف را تنظیم می کند و بیان پروتئین های دخیل در مسیرهای پیام رسانی سلولی را کنترل میکند و در نتیجه باعث ایجاد سرطان و التهاب می شود. ترکیباتی که قادر به تعامل با NF-kB هستند، میتوانند مورد نظر محققان قرار گیرند و جهت مبارزه با سرطان استفاده شوند. کورکومین با کاهش ژنهای القاکننده NF-kB، توانایی کاهش و تأثیرگذاری بر تکثیر و تهاجم سلولهای سرطان سینه را نشان داد (28-26). در مطالعه اخیر ژن غیرکدکننده HOTAIR به عنوان هدف مولکولی کورکومین دندرووزمی در نظر گرفته شد. این ژن ترانسکریپتی طویل ایجاد میکند که در طیف وسیعی از فرآیندهای حیاتی سلول نظیر تنظیم تکثیر، رشد، مرگ سلولی و تمایز دخالت دارد (29). مطالعات پیشین نشان میدهد که بیان ژن مذکور در سلولهای توموری پستان افزایش یافته است و لذا آن را به عنوان یک هدف درمانی معرفی کردند (30). یافتههای بهدست آمده نشان داد که کورکومین دندروزومی موجب مهار ژن HOTAIR میشود و این درحالیست که کورکومین به تنهائی قادر به مهار این ژن نبود که با توجه به عدم حلالیت آن در سیستمهای آبی جهت ورود به سلول، دور از انتظار نبود. پیشتر نیز به نقش مهاری فورمولاسیون دندرووزمی کورکومین بر بیان RNAهای طویل غیرکدکننده نظیر GAS5 در سلولهای توموری سینه اشاره شده است (31). مطالعات پیشین نشان داده است که خاموش سازی ژن HOTAIR با القای مرگ آپوپتوز در سلولهای سرطانی پستان (32,33)، ریه (34)، استئوسارکوما (35) و خون (36) میشود. در سال 2021، دشت بزرگ و همکاران نشان دادند که خاموش سازی ژن HOTAIR، موجب کاهش بیان ژن Bcl2 و افزایش بیان ژن Bax در سلولهای سرطانی کولورکتال میگردد (37). در سال 2022، آل محمد و همکارن نیز نشان دادند که خاموش سازی ژن HOTAIT موجب مهار مسیر EMT بواسطه کاهش بیان دو ژن فیبرونکتین-1 و کودلین-4 در سلولهای سرطان معده میگردد (38). در سال 2021، باباپور و همکاران نیز نتایج مشابهی در زمینه نقش مهار HOTAIT در توقف مسیر EMT در سلولهای سرطانی معده بهدست آوردند لذا این احتمال وجود دارد که القای آپوپتوز در رده سلولی توموری مورد مطالعه نیز بهواسطه کاهش بیان ژن HOTAIR توسط کورکومین دندروزومی باشد (39). با اینحال این سوالی است که در مطالعات بعدی باید به آن پاسخ داده شود. در پایان اشاره به این نکته حائز اهمیت است که اگرچه نتایج بسیار ارزشمندی در ارتباط با داروی نانوکورکومین دندروزومی در این تحقیق بهدست آمده است با این حال تحقیق حاضر دارای محدودیتهایی نیز میباشد که مهمترین آنها انجام این مطالعه در سطح مدل سلولی توموری است و برای تعمیم نتایج استفاده از مدلهای موشی آزمایشگاهی بسیار سودمند است.
نتیجهگیری
در مجموع، مطالعه اخیر نشان میدهد که بارگیری کوروکومین در نانو حاملهای غیرسمی نظیر دندروزومها میتواند حلالیت، رسانش و توزیع بافتی چنین ترکیبات داروئی ارزشمندی را افزایش و در نهایت موجب شود که بتوانیم از قدرت درمانی این ترکیبات در حوزه داروسازی و پزشکی بهره جست.
سپاسگزاری
این مقاله برگرفته از نتایج یک طرح پژوهشی مصوب در کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندی شاپور اهواز است. نویسندگان این مقاله به طور ویژه از جناب آقای پروفسور مجید صادقیزاده، عضو هیئت علمی گروه ژنتیک دانشگاه تربیت مدرس تهران جهت اهداء سخاوتمندانه نانوحاملهای دندروزوم کمال تشکر و قدردانی را مینمایند. همچنین از زحمات تمامی همکاران در معاونت پژوهشی دانشگاه علوم پزشکی جندی شاپور، کمیته تحقیقات دانشجوئی و مرکز تحقیقات سلولی مولکولی که گروه تحقیقاتی ما را در به ثمر رساندن این تحقیق یاری رساندند تشکر و قدردانی می نمایند.
حامی مالی: کمیته تحقیقات دانشجوئی دانشگاه علوم پزشکی جندی شاپور اهواز
تعارض در منافع: وجود ندارد.
References:
1- Moo TA, Sanford R, Dang C, Morrow M. Overview of Breast Cancer Therapy. PET Clin 2018; 13(3): 339-54.
2- Parle M, Bansal N. Herbal Medicines: Are They Safe? Natural Product Radiance 2006; 5: 6-14.
3- Tahmasebi Mirgani M, Isacchi B, Sadeghizadeh M, Marra F, Bilia AR, Mowla SJ, et al. Dendrosomal Curcumin Nanoformulation Downregulates Pluripotency Genes via miR-145 Activation in U87MG Glioblastoma Cells. Int J Nanomedicine 2014; 9: 403-17.
4- Burgos‐Morón E, Calderón‐Montaño JM, Salvador J, Robles A, López‐Lázaro M. The Dark Side of Curcumin. Int J Cancer 2010;126(7): 1771-5.
5- Anand P, Kunnumakkara AB, Newman RA, Aggarwal BB. Bioavailability of Curcumin: Problems and Promises. Mol Pharm 2007; 4(6): 807-18.
6- Prasad S, Tyagi AK, Aggarwal BB. Recent Developments in Delivery, Bioavailability, Absorption and Metabolism of Curcumin: The Golden Pigment from Golden Spice. Cancer Res Treat 2014; 46(1): 2-18.
7- Sarbolouki MN, Sadeghizadeh M, Yaghoobi MM, Karami A, Lohrasbi T. Dendrosomes: A Novel Family of Vehicles for Transfection and Therapy. J Chem Technol Biotechnol 2000; 75: 919-22.
8- Tahmasebi Birgani M, Erfani-Moghadam V, Babaei E, Najafi F, Zamani M, Shariati M, et al. Dendrosomal Nano-Curcumin; The Novel Formulation to Improve the Anticancer Properties of Curcumin. Progress in Biological Sciences 2015; 5(2): 143-58.
9- Migliore C, Giordano S. Molecular Cancer Therapy: Can Our Expectation be MET?. Eur J Cancer 2008; 44(5): 641-51.
10- Moran VA, Perera RJ, Khalil AM. Emerging Functional and Mechanistic Paradigms of Mammalian Long Non-Coding Rnas. Nucleic Acids Res 2012; 40(14): 6391-400.
11- Hajjari M, Salavaty A. HOTAIR: An Oncogenic Long Non-Coding RNA in Different Cancers. Cancer Biol Med 2015; 12(1): 1-9.
12- Xu ZY, Yu QM, Du YA, Yang LT, Dong RZ, Huang L, et al. Knockdown of Long Non-Coding RNA HOTAIR Suppresses Tumor Invasion and Reverses Epithelial-Mesenchymal Transition in Gastric Cancer. Int J Biol Sci 2013; 9(6): 587-97.
13- Sørensen KP, Thomassen M, Tan Q, Bak M, Cold S, Burton M, et al. Long Non-Coding RNA HOTAIR is an Independent Prognostic Marker of Metastasis in Estrogen Receptor-Positive Primary Breast Cancer. Breast Cancer Res Treat 2013; 142(3): 529-36.
14- Kumar P, Nagarajan A, Uchil PD. Analysis of Cell Viability by the MTT Assay. Cold Spring Harb Protoc 2018; 2018(6).
15- Measuring Cell Proliferation and Survival by MTT Method. 2018. Available at: http://padginteb.com/maghaalaat/59/mtt%D8%B3%D9%86%D8%AC%D8%B4%D9%90-%D8%AA%DA%A9%D8%AB%DB%8C%D8%B1-%D9%88-%D8%A8%D9%82%D8%A7%DB%8C-%D8%B3%D9%84%D9%88%D9%84%DB%8C-%D8%A8%D9%87-%D8%B1%D9%88%D8%B4.html .Accessed December 10, 2022.
16- Annexin FITC-V Apoptosis Kit. 2020. Available at: https://atrmed.com/product/fitc-v-anoxin-apoptosis-kit/. Accessed December 10, 2022.
17- National Center for Biotechnology Information. 2020. Available at: https://www.ncbi.nlm.nih.gov/. Accessed December 10, 2022.
18- Farhangi B, Alizadeh AM, Khodayari H, Khodayari S, Dehghan MJ, Khori V, et al. Protective Effects of Dendrosomal Curcumin on an Animal Metastatic Breast Tumor. Eur j pharmacol 2015; 758: 188-96.
19- Alizadeh AM, Sadeghizadeh M, Najafi F, Ardestani SK, Erfani-Moghadam V, Khaniki M, et al. Encapsulation of Curcumin in Diblock Copolymer Micelles for Cancer Therapy. Biomed Res Int 2015; 2015: 824746.
20- Kunwar A, Barik A, Mishra B, Rathinasamy K, Pandey R, Priyadarsini Kl. Quantitative Cellular Uptake, Localization and Cytotoxicity of Curcumin in Normal and Tumor Cells. Biochim Biophys Acta 2008; 1780(4): 673-9.
21- Fisher DE. Apoptosis in Cancer Therapy: Crossing the Threshold. Cell 1994; 78(4): 539-42.
22- Zong WX, Thompson CB. Necrotic Death as a Cell Fate. Genes Dev 2006; 20(1):1-15.
23- Khan AQ, Ahmed EI, Elareer N, Fathima H, Prabhu KS, Siveen KS, et al. Curcumin-Mediated Apoptotic Cell Death in Papillary Thyroid Cancer and Cancer Stem-Like Cells through Targeting of The JAK/STAT3 Signaling Pathway. Int J Mol Sci 2020; 21(2): 438.
24- Endo H, Inoue I, Masunaka K, Tanaka M, Yano M. Curcumin Induces Apoptosis in Lung Cancer Cells by 14-3-3 Protein-Mediated Activation of Bad. Biosci Biotechnol Biochem 2020; 84(12): 2440-7.
25- Ismail NI, Othman I, Abas F, H Lajis N, Naidu R. Mechanism of Apoptosis Induced by Curcumin in Colorectal Cancer. Int J Mol Sci 2019; 20(10): 2454.
26- Giordano A, Tommonaro G. Curcumin and Cancer. Nutrients 2019; 11(10): 2376.
27- Liu Q, Loo WT, Sze S, Tong Y. Curcumin Inhibits Cell Proliferation of MDA-MB-231 and BT-483 Breast Cancer Cells Mediated by Down-Regulation of Nfκb, Cyclind and MMP-1 Transcription. Phytomedicine 2009; 16(10): 916-22.
28- Kim JM, Noh EM, Kwon KB, Kim JS, You YO, Hwang JK, et al. Curcumin Suppresses the TPA-Induced Invasion through Inhibition of Pkcα-Dependent MMP-Expression in MCF-7 Human Breast Cancer Cells. Phytomedicine 2012; 19(12): 1085-92.
29- Yuan C, Ning Y, Pan Y. Emerging Roles of HOTAIR in Human Cancer. J Cell Biochem 2020; 121(5-6): 3235-47.
30- Cantile M, Di Bonito M, Cerrone M, Collina F, De Laurentiis M, Botti G. Long Non-Coding RNA HOTAIR in Breast Cancer Therapy. Cancers (Basel) 2020; 12(5): 1197.
31- Esmatabadi MJD, Motamedrad M, Sadeghizadeh M. Down-Regulation of LncRNA, GAS5 Decreases Chemotherapeutic Effect of Dendrosomal Curcumin (DNC) in Breast Cancer Cells. Phytomedicine 2018; 42: 56-65.
32- Chen T, Liu Z, Zeng W, Huang T. Down-Regulation of Long Non-Coding RNA HOTAIR Sensitizes Breast Cancer to Trastuzumab. Sci Rep 2019;9:19881.
33- Li Z, Qian J, Li J, Zhu C. Knockdown of LncRNA‑HOTAIR Downregulates the Drug‑Resistance of Breast Cancer Cells to Doxorubicin via the PI3K/AKT/mTOR Signaling Pathway. Exp Ther Med 2019; 18(1): 435-42.
34- Yang Y, Jiang C, Yang Y, Guo L, Huang J, Liu X, et al. Silencing of LncRNA-HOTAIR Decreases Drug Resistance of Non-Small Cell Lung Cancer Cells by Inactivating Autophagy via Suppressing the Phosphorylation of ULK1. Biochem Biophys Res Commun 2018; 497(4): 1003-10.
35- Zheng H, Min J. Role of Long Noncoding RNA HOTAIR in the Growth and Apoptosis of Osteosarcoma Cell MG-63. Biomed Res Int 2016; 2016: 5757641.
36- Wang SL, Huang Y, Su R, Yu YY. Silencing Long Non-Coding RNA HOTAIR Exerts Anti-Oncogenic Effect on Human Acute Myeloid Leukemia via Demethylation of HOXA5 by Inhibiting Dnmt3b. Cancer Cell Int 2019; 19: 114.
37- Dashtbozorgi R, Tahmasebi-Birgani M, Hajjari MR, Emami Razavi A. Silencing of HOTAIR Induced Apoptosis in Human Colorectal Cancer Cells through Up-Regulation of Bax and Down-Regulation of Bcl2. Jentashapir J Cell Mol Biol 2021; 12(4): e116108.
38- Alemohammad S, Tahmasebi Birgani M, Fahimi H, Hajjari MR. Silencing the Long Non-Coding RNA HOTAIR Inhibits Epithelial-Mesenchymal Transition in MKN45 Gastric Cancer Cell Line by Downregulation of Fibronectin-1 and Claudin-4. Jentashapir J Cell Mole Biol 2022;13(4): e131286.
39- Babapour P, Tahmasebi-Birgani M, Hashemi M, Hajjari MR. Silencing of Long Non-Coding RNA HOTAIR Suppresses Reverses Epithelial-Mesenchymal Transition in AGS Gastric Cancer Cell Line by Downregulation of Fibronectin 1 And Claudin-4. Jentashapir J Cell Mol Biol 2021;12(3): e116396.
1- Moo TA, Sanford R, Dang C, Morrow M. Overview of Breast Cancer Therapy. PET Clin 2018; 13(3): 339-54.
2- Parle M, Bansal N. Herbal Medicines: Are They Safe? Natural Product Radiance 2006; 5: 6-14.
3- Tahmasebi Mirgani M, Isacchi B, Sadeghizadeh M, Marra F, Bilia AR, Mowla SJ, et al. Dendrosomal Curcumin Nanoformulation Downregulates Pluripotency Genes via miR-145 Activation in U87MG Glioblastoma Cells. Int J Nanomedicine 2014; 9: 403-17.
4- Burgos‐Morón E, Calderón‐Montaño JM, Salvador J, Robles A, López‐Lázaro M. The Dark Side of Curcumin. Int J Cancer 2010;126(7): 1771-5.
5- Anand P, Kunnumakkara AB, Newman RA, Aggarwal BB. Bioavailability of Curcumin: Problems and Promises. Mol Pharm 2007; 4(6): 807-18.
6- Prasad S, Tyagi AK, Aggarwal BB. Recent Developments in Delivery, Bioavailability, Absorption and Metabolism of Curcumin: The Golden Pigment from Golden Spice. Cancer Res Treat 2014; 46(1): 2-18.
7- Sarbolouki MN, Sadeghizadeh M, Yaghoobi MM, Karami A, Lohrasbi T. Dendrosomes: A Novel Family of Vehicles for Transfection and Therapy. J Chem Technol Biotechnol 2000; 75: 919-22.
8- Tahmasebi Birgani M, Erfani-Moghadam V, Babaei E, Najafi F, Zamani M, Shariati M, et al. Dendrosomal Nano-Curcumin; The Novel Formulation to Improve the Anticancer Properties of Curcumin. Progress in Biological Sciences 2015; 5(2): 143-58.
9- Migliore C, Giordano S. Molecular Cancer Therapy: Can Our Expectation be MET?. Eur J Cancer 2008; 44(5): 641-51.
10- Moran VA, Perera RJ, Khalil AM. Emerging Functional and Mechanistic Paradigms of Mammalian Long Non-Coding Rnas. Nucleic Acids Res 2012; 40(14): 6391-400.
11- Hajjari M, Salavaty A. HOTAIR: An Oncogenic Long Non-Coding RNA in Different Cancers. Cancer Biol Med 2015; 12(1): 1-9.
12- Xu ZY, Yu QM, Du YA, Yang LT, Dong RZ, Huang L, et al. Knockdown of Long Non-Coding RNA HOTAIR Suppresses Tumor Invasion and Reverses Epithelial-Mesenchymal Transition in Gastric Cancer. Int J Biol Sci 2013; 9(6): 587-97.
13- Sørensen KP, Thomassen M, Tan Q, Bak M, Cold S, Burton M, et al. Long Non-Coding RNA HOTAIR is an Independent Prognostic Marker of Metastasis in Estrogen Receptor-Positive Primary Breast Cancer. Breast Cancer Res Treat 2013; 142(3): 529-36.
14- Kumar P, Nagarajan A, Uchil PD. Analysis of Cell Viability by the MTT Assay. Cold Spring Harb Protoc 2018; 2018(6).
15- Measuring Cell Proliferation and Survival by MTT Method. 2018. Available at: http://padginteb.com/maghaalaat/59/mtt%D8%B3%D9%86%D8%AC%D8%B4%D9%90-%D8%AA%DA%A9%D8%AB%DB%8C%D8%B1-%D9%88-%D8%A8%D9%82%D8%A7%DB%8C-%D8%B3%D9%84%D9%88%D9%84%DB%8C-%D8%A8%D9%87-%D8%B1%D9%88%D8%B4.html .Accessed December 10, 2022.
16- Annexin FITC-V Apoptosis Kit. 2020. Available at: https://atrmed.com/product/fitc-v-anoxin-apoptosis-kit/. Accessed December 10, 2022.
17- National Center for Biotechnology Information. 2020. Available at: https://www.ncbi.nlm.nih.gov/. Accessed December 10, 2022.
18- Farhangi B, Alizadeh AM, Khodayari H, Khodayari S, Dehghan MJ, Khori V, et al. Protective Effects of Dendrosomal Curcumin on an Animal Metastatic Breast Tumor. Eur j pharmacol 2015; 758: 188-96.
19- Alizadeh AM, Sadeghizadeh M, Najafi F, Ardestani SK, Erfani-Moghadam V, Khaniki M, et al. Encapsulation of Curcumin in Diblock Copolymer Micelles for Cancer Therapy. Biomed Res Int 2015; 2015: 824746.
20- Kunwar A, Barik A, Mishra B, Rathinasamy K, Pandey R, Priyadarsini Kl. Quantitative Cellular Uptake, Localization and Cytotoxicity of Curcumin in Normal and Tumor Cells. Biochim Biophys Acta 2008; 1780(4): 673-9.
21- Fisher DE. Apoptosis in Cancer Therapy: Crossing the Threshold. Cell 1994; 78(4): 539-42.
22- Zong WX, Thompson CB. Necrotic Death as a Cell Fate. Genes Dev 2006; 20(1):1-15.
23- Khan AQ, Ahmed EI, Elareer N, Fathima H, Prabhu KS, Siveen KS, et al. Curcumin-Mediated Apoptotic Cell Death in Papillary Thyroid Cancer and Cancer Stem-Like Cells through Targeting of The JAK/STAT3 Signaling Pathway. Int J Mol Sci 2020; 21(2): 438.
24- Endo H, Inoue I, Masunaka K, Tanaka M, Yano M. Curcumin Induces Apoptosis in Lung Cancer Cells by 14-3-3 Protein-Mediated Activation of Bad. Biosci Biotechnol Biochem 2020; 84(12): 2440-7.
25- Ismail NI, Othman I, Abas F, H Lajis N, Naidu R. Mechanism of Apoptosis Induced by Curcumin in Colorectal Cancer. Int J Mol Sci 2019; 20(10): 2454.
26- Giordano A, Tommonaro G. Curcumin and Cancer. Nutrients 2019; 11(10): 2376.
27- Liu Q, Loo WT, Sze S, Tong Y. Curcumin Inhibits Cell Proliferation of MDA-MB-231 and BT-483 Breast Cancer Cells Mediated by Down-Regulation of Nfκb, Cyclind and MMP-1 Transcription. Phytomedicine 2009; 16(10): 916-22.
28- Kim JM, Noh EM, Kwon KB, Kim JS, You YO, Hwang JK, et al. Curcumin Suppresses the TPA-Induced Invasion through Inhibition of Pkcα-Dependent MMP-Expression in MCF-7 Human Breast Cancer Cells. Phytomedicine 2012; 19(12): 1085-92.
29- Yuan C, Ning Y, Pan Y. Emerging Roles of HOTAIR in Human Cancer. J Cell Biochem 2020; 121(5-6): 3235-47.
30- Cantile M, Di Bonito M, Cerrone M, Collina F, De Laurentiis M, Botti G. Long Non-Coding RNA HOTAIR in Breast Cancer Therapy. Cancers (Basel) 2020; 12(5): 1197.
31- Esmatabadi MJD, Motamedrad M, Sadeghizadeh M. Down-Regulation of LncRNA, GAS5 Decreases Chemotherapeutic Effect of Dendrosomal Curcumin (DNC) in Breast Cancer Cells. Phytomedicine 2018; 42: 56-65.
32- Chen T, Liu Z, Zeng W, Huang T. Down-Regulation of Long Non-Coding RNA HOTAIR Sensitizes Breast Cancer to Trastuzumab. Sci Rep 2019;9:19881.
33- Li Z, Qian J, Li J, Zhu C. Knockdown of LncRNA‑HOTAIR Downregulates the Drug‑Resistance of Breast Cancer Cells to Doxorubicin via the PI3K/AKT/mTOR Signaling Pathway. Exp Ther Med 2019; 18(1): 435-42.
34- Yang Y, Jiang C, Yang Y, Guo L, Huang J, Liu X, et al. Silencing of LncRNA-HOTAIR Decreases Drug Resistance of Non-Small Cell Lung Cancer Cells by Inactivating Autophagy via Suppressing the Phosphorylation of ULK1. Biochem Biophys Res Commun 2018; 497(4): 1003-10.
35- Zheng H, Min J. Role of Long Noncoding RNA HOTAIR in the Growth and Apoptosis of Osteosarcoma Cell MG-63. Biomed Res Int 2016; 2016: 5757641.
36- Wang SL, Huang Y, Su R, Yu YY. Silencing Long Non-Coding RNA HOTAIR Exerts Anti-Oncogenic Effect on Human Acute Myeloid Leukemia via Demethylation of HOXA5 by Inhibiting Dnmt3b. Cancer Cell Int 2019; 19: 114.
37- Dashtbozorgi R, Tahmasebi-Birgani M, Hajjari MR, Emami Razavi A. Silencing of HOTAIR Induced Apoptosis in Human Colorectal Cancer Cells through Up-Regulation of Bax and Down-Regulation of Bcl2. Jentashapir J Cell Mol Biol 2021; 12(4): e116108.
38- Alemohammad S, Tahmasebi Birgani M, Fahimi H, Hajjari MR. Silencing the Long Non-Coding RNA HOTAIR Inhibits Epithelial-Mesenchymal Transition in MKN45 Gastric Cancer Cell Line by Downregulation of Fibronectin-1 and Claudin-4. Jentashapir J Cell Mole Biol 2022;13(4): e131286.
39- Babapour P, Tahmasebi-Birgani M, Hashemi M, Hajjari MR. Silencing of Long Non-Coding RNA HOTAIR Suppresses Reverses Epithelial-Mesenchymal Transition in AGS Gastric Cancer Cell Line by Downregulation of Fibronectin 1 And Claudin-4. Jentashapir J Cell Mol Biol 2021;12(3): e116396.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







