دوره 30، شماره 10 - ( دی 1401 )
جلد 30 شماره 10 صفحات 6051-6034 |
برگشت به فهرست نسخه ها
Ethics code: IR.SUMS.REHAB.REC.1400.008
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jowhari A, Daryanoosh F, Koushkie Jahromi M, Nekooeian A A. Effect of High-intensity Intermittent Swimming Training on peroxisome proliferator-activated receptors-αand Liver Enzymes in Non-alcoholic Steatohepatitis Male Rats. JSSU 2023; 30 (10) :6034-6051
URL: http://jssu.ssu.ac.ir/article-1-5812-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5812-fa.html
جوهری علیرضا، دریانوش فرهاد، کوشکی جهرمی مریم، نکوئیان علی اکبر. تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر برخی از عوامل بیوشیمیایی و آنزیمهای کبدی در موشهای صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NΑSH). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (10) :6034-6051
واژههای کلیدی: استئاتوهپاتیت غیرالکلی، شنای تناوبی با شدت بالا، پروتئین گیرندههای فعال تکثیرکننده پراکسیزوم کبدی، آنزیم های کبدی
متن کامل [PDF 1340 kb]
(684 دریافت)
| چکیده (HTML) (1892 مشاهده)
متن کامل: (1224 مشاهده)
مقدمه
عدم تعادل در متابولیسم اسیدهای چرب در ارتباط با بافت چربی، بافت کبد و التهاب سیستمیک، عوامل کلیدی برای ایجاد مقاومت به انسولین، دیسلیپیدمی و سایر عوامل خطر قلبی-عروقی مرتبط با بیماری کبد چرب غیرالکلی nonalcoholic fatty liver disease (NAFLD) هستند (1). این بیماری یک وضعیت روبه افزایش است که با سبک زندگی کمتحرک و عادات غذایی اشتباه همراه است و شیوع بالایی در سراسر جهان دارد (2). NAFLD با تجمع تریگلیسیریدها در سلولهای کبدی به شکل لیپیدهای ماکرو و میکرو ویزیکول با علائم خوشخیم، همراه با التهاب متعاقب با استئاتوهپاتیت غیرالکلی (NASH) Non-alcoholic steatohepatitis مشخص میشود که میتواند منجر به فیبروز، سیروز و نارسایی کبدی شود (3). استئاتوهپاتیت غیرالکلی نتیجه افزایش جذب چربی کبدی، افزایش لیپوژنز و ذخیره چربی در کبد است. مصرف بیرویه موادغذایی پرچرب و کاهش فعالیت بدنی منجر به افزایش لیپوژنز در کبد میشود و در نتیجه بهمیزان قابلتوجهی تریگلیسرید و سایر گونههای چربی در سلولهای کبد تجمع پیدا میکنند (4). گیرنده فعال تکثیرکننده پراکسیزوم آلفا (PPΑRα) peroxisome proliferator-activated α receptor از خانواده گیرندههای هستهای PPΑR است و در سلولهای کبدی بیان میشود و در اثر اتصال توسط اسیدهای چرب فعال میشود و جذب و استفاده اسید چرب آزاد را از طریق چرخه اکسیداسیون بتا و کتوژنز افزایش میدهد در نتیجه هموستاز چربی کبد را بر عهده دارد (5). با افزایش NΑSH، PPΑRα کاهش مییابد و این موضوع باعث افزایش تجمع هر چه بیشتر چربی در سلولهای کبدی میشود (4). فعالسازی PPΑRα باعث رونویسی از طیف وسیعی از ژنهای مرتبط با اکسیداسیون اسیدهای چرب در میتوکندریها، پراکسیزومها و سیتوکرومها میشود، در نتیجه سطح چربیهای کبدی کاهش مییابد (6). در مطالعه¬ای که روی موشها انجام شد بهدنبال غیرفعالسازی PPΑRα، استئاتوز کبدی بهوجود آمد و دریافتند که PPΑRα در تنظیم متابولیسم لیپیدهای کبدی نقش اساسی دارد (7). در یک مطالعه طولی پس از یک سال پیگیری نشان داده شد که با افزایشPPΑRα ، بهبود در NΑSH افزایش مییابد (8). همچنین در پژوهشی هنگامی که حیوانات را در گروه رژیم غذایی با چربی بالا یا گروه رژیم غذایی استاندارد در معرض ورزش منظم شنا بهمدت 12 هفته قرار دادند، در هر دو گروه بیان ژنPPΑRα mRNΑ کبدی افزایش یافت (9). تغییر در شیوه زندگی با هدف افزایش فعالیت بدنی و کاهش کالری دریافتی با هدف تعادل انرژی منفی برای از دست دادن و یا حفظ توده بدون چربی بدن است. بنابراین، بهبود تمرینات بدنی منظم به یک استراتژی مهم برای درمان غیردارویی بیماری استئاتوهپاتیت غیرالکلی تبدیل شده است (4,3). فعالیتهای ورزشی باعث کاهش آنزیمهای کبدی از جمله آسپارتات آمینوترانسفراز (AST) Aspartateaminotransferase و آلانین آمینوترانسفراز (ALT)Alanine aminotransferase ، گاماگلوتامیل ترانسفراز (GGT) Gama-Glutamyl Transferase، کاهش میزان چربی و تریگلیسیرید کبد میشود (10). از سوی دیگر در مطالعهای که اثر فعالیت ورزشی بر حجم و چربی کبد در بیماران NΑSH بررسی کردند به این نتیجه رسیدند که چربی و حجم کبد و همچنین شاخص توده بدن افراد کاهش معنیدار یافته بود اما سطوح آنزیمهای ΑST و ΑLT و GGT تغییری نکرده بود (11). با وجود نتایج متناقض تحقیقات اخیر، محققان همواره بهدنبال بهترین پروتکل تمرینی از نظر نوع، شدت، حجم و مدت فعالیت بودهاند. تمرینات تناوبی با شدت بالا (HIIT) High-Intensity Interval Training بهعنوان یک روش تمرینی جدید هوازی شناخته شده است. این نوع تمرینات شامل دوره-های تلاش حداکثری با فواصل استراحت فعال یا غیرفعال میان این دورههاست (12). در برخی پژوهشها گزارش شده است که تمرینات تناوبی با شدت بالا موجب کاهش توده چربی احشایی و چربی کل بدن، کاهش چربی کبد و بهبود سفتی آن میگردد و بهعنوان یک شیوه درمان غیردارویی موثر در درمان استئاتوهپاتیت غیرالکلی در بیمارانی که برای انجام فعالیت ورزشی با کمبود وقت مواجه هستند، معرفی شد (13,14). اما در مقابل برخی پژوهشها پس از بررسی این نوع تمرینات، عدم تغییر در چربی احشایی، شاخص توده بدنی، آنزیمهای ΑLT و ΑST، GGT و همچنین نشانگرهای التهابی را گزارش کردند (17-15). از طرف دیگر انجام تمرینات HIIT در خشکی با مشکلات و موانعی همراه است. بهگونهای که افراد چاق مبتلا به NΑSH بهدلیل سنگینی وزن آنها و ماهیت پرشدت بودن این مدل فعالیت، خطر ایجاد صدمه برای آنها بهوجود میآید (18). از جهت افزایش ایمنی و کاهش صدمات ناشی از این نوع تمرینات برخی مطالعات به تحقیق درباره مقایسه فعالیتهای ورزشی هوازی در آب و خشکی و بررسی اثرات ورزش در آب بر برخی از بیماریهای متابولیکی از جمله دیابت، چاقی، سندروم متابولیک و فشارخون پرداختهاند. آب بهدلیل خواص بینظیر هیدرودینامیکی و ایجاد شرایط بیوزنی باعث کاهش صدمات ناشی از تمرینات HIIT در مقایسه با خشکی میشود (18). همچنین در محیط آبی همانند محیط خشکی میتوان انواع فعالیتهای ورزشی هوازی و بیهوازی با وزن بدن انجام داد (21-19) با این وجود تمام این تحقیقات اظهار داشتند که بهینهترین پروتکل تمرین از نظر نوع، شدت، حجم و مدت فعالیت همچنان ناشناخته است (13,18,19). با توجه به نتایج متناقض تحقیقات در زمینه تاثیرات شنا بر انواع بیماریها و اثرات مبهم آن در مقایسه با ورزش در محیط خشکی و همچنین نیافتن تحقیقی در زمینه تاثیر تمرینات شنای تناوبی با شدت بالا بر کبد چرب بیماران مبتلا به استئاتوهپاتیت غیرالکلی توسط محققین تحقیق حاضر، لذا این محققان برای مشخص کردن کارایی و اثربخشی این مدل تمرین بر بهبود NΑSH از جنبه سلولیمولکولی در بافت کبد، تاثیر شنای تناوبی با شدت بالا بر عامل پروتئینی PPARα و آنزیمهای کبدی در موشهای صحرایی مبتلا به بیماری استئاتوهپاتیت غیرالکلی القا شده با رژیم پرچرب را بررسی کردند.
روش بررسی
پژوهش حاضر با توجه به هدف از نوع توسعهای- بنیادی و با در نظر گرفتن روش از نوع نیمهتجربی بود. در این پژوهش، 40 سر موش صحرایی نر (سن: 6 تا 8 هفته) از نژاد Sprague – Dawley با میانگین وزن 20 ± 230 گرم انتخاب شدند. موشهای صحرایی در حیوانخانه دانشگاه شیراز با دمای 22 تا 24 درجه سانتیگراد، رطوبت 45 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به¬صورت آزادانه در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. موشهای صحرایی انتخابشده به دو گروه 20 تایی تقسیم شدند. گروه اول گروه سالم، ماندند (n=20 ) و غذای استاندارد دریافت کردند. گروه دوم طی مدت هشت هفته تحت رژیم غذایی پرچرب (High fat diet :HFD) قرار گرفتند تا بیماری استئاتوهپاتیت غیرالکلی در آنها القا شود (HFD: n=20 ). رژیم پرچرب به-کار رفته در تحقیق حاضر بهصورت امولسیون (به حالت مایع با ویسکوزیته بالا) استفاده شد و با استفاده از روش گاواژ روزانه (بهمیزان 10 میلیلیتر به ازای هر کیلوگرم وزن بدن) به موشهای صحرایی گروه رژیم غذایی پرچرب (n=20 ) خورانده میشد. محتوای امولسیون پرچرب از 77 درصد چربی، 14 درصد پروتئین و 9 درصد کربوهیدراتها تشکیل گردید. محتوای این امولسیون شامل روغن ذرت، ساکارز، پودر شیر خشک، کلسترول، سدیم دزوکسیکولات، توئین80، پروپیلین گلایکول، مخلوط ویتامین و مواد معدنی و آب مقطر بود. در این امولسیون، پروتئینها توسط پودر شیر خشک، کربوهیدراتها توسط ساکاروز و چربی توسط روغن ذرت و پودر کلسترول تأمین شدند. هر وعده با مخلوطی از ویتامین و مواد معدنی تکمیل شد. این امولسیون در دمای چهار درجه سانتیگراد ذخیره، در حمام آب با دمای 42 درجه سانتیگراد گرم و قبل از استفاده کاملاً میکس و مخلوط شد (22). در گروه رژیم پرچرب علاوه بر غذای روزانه استاندارد جوندگان، بهصورت خوراکی و توسط تکنیک گاواژ، موشهای صحرایی با امولسیون پرچرب (10 میلیلیتر به ازای هر کیلوگرم وزن بدن) یک بار در روز تحت گاواژ قرار گرفتند. این شیوه تغذیهای بهمدت هشت هفته ادامه داشت تا بر اساس پژوهش Zou و همکاران (2006)، در موشهای صحرایی که رژیم غذایی پرچرب مصرف میکردند (HFD:n=20 ) بیماری استئاتوهپاتیت غیرالکلی القا شود (22). به موشهای صحرایی گروه سالم (n=20 ) نیز از طریق تکنیک گاواژ، روزانه مقدار مساوی محلول نمک (سالین) داده شد. پس از اثبات القا بیماری در موشهای صحرایی (یافتههای مربوط به اثبات بیماری در قسمت نتایج آمده است.)، گروه بیمار (رژیم پرچرب) بهطور تصادفی به دو گروه کنترل- بیمار (9= n)، بیمار-شنا (9= n) و گروه سالم نیز بهطور تصادفی به دو گروه کنترل-سالم (9= n)، گروه سالم-شنا (9= n) تقسیم شدند. لازم به ذکر است رژیم غذایی پرچرب گروههای بیمار تا پایان دوره تمرینات ادامه داشت. پس از تقسیمبندی گروهها، همه موشهای صحرایی گروههای تمرین بهمدت دو هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتیمتر و ارتفاع 80 سانتیمتر) را قبل از شروع تمرین اصلی گذراندند (23). در هفته اول موشهای صحرایی با نهایت دقت و آرامش در استخر حیوانات با عمق آب 50 سانتیمتر و میانگین دمای 0/5 ± 30 درجه سانتیگراد قرار گرفتند و با سرعت دلخواه به مدت 20 دقیقه بهطور متناوب شنا کردند. در هفته دوم وقتی که موش¬های صحرایی بهخوبی با استخر حیوانات آشنا شدند؛ برای آشنایی با نوع تمرین تناوبی، چندین مرتبه بعد از یک دقیقه شنا بهوسیله صفحه استراحت از آب بیرون آورده و دوباره در آب قرار داده شدند. بعد از گذشت 48 ساعت از زمان آخرین جلسه آشنایی، موشهای صحرایی گروه تمرین، ابتدا پنج دقیقه گرم کردن و سپس تمرین اصلی HIIT شنا، شامل 20 نوبت 30 ثانیهای شنا با 30 ثانیه استراحت بین هر نوبت را انجام دادند. در پایان هر برنامه تمرینی نیز پنج دقیقه عمل سرد کردن اعمال شد و سپس تمام موشهای صحرایی کاملا خشک شده و به قفسهایشان منتقل شدند. این برنامه ورزشی بهمدت هشت هفته (سه روز در هفته، روزهای زوج) انجام شد. در تمرین تناوبی بار اعمال شده در هفته اول، وزنه بهمیزان هفت درصد وزن بدن هر موش صحرایی بود و هر هفته یک درصد به آن اضافه شد؛ بهطوریکه در هفته آخر (هشتم) موشهای صحرایی با وزنهای بهمیزان 14 درصد وزن بدن خود که به ریشه دم آنها بسته شد، شنا کردند (جدول1) (24). تمرینات، عصرهنگام (بهترین زمان تمرین در ریتم فعالیتی طبیعی موشهای صحرایی) انجام شد (25).
جدول1: پروتکل تناوبی شنا با شدت بالا
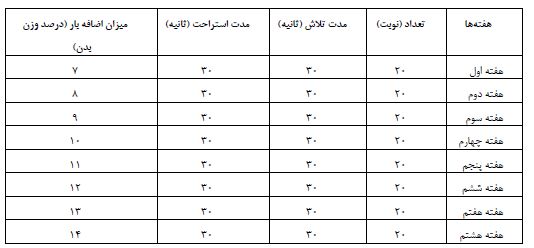
وزن موشهای صحرایی از روز اول شروع دوره تحقیق و سپس هر هفته در روزهای جمعه، عصر هنگام مورد سنجش قرار میگرفت و تا پایان دوره تحقیق و روز تشریح این روند ادامه داشت. پس از بدست آوردن وزن هر یک از موشهای صحرایی در هر گروه، میانگین وزنی هر گروه مشخص شده و ثبت میشد. یافتههای مریوط به میانگین وزن گروههای تحقیق در نمودار1 و 2، قسمت نتایج گزارش شده است. در مدت دوره تداخل، گروههای کنترل-سالم و کنترل-بیمار هیچ-گونه برنامه تمرینی نداشتند. برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین، موشهای صحرایی با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (سه تا پنج میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. ابتدا نمونههای خونی از قلب رتها بهمیزان 5 سیسی گرفته شد؛ بلافاصله آن را در داخل لوله آزمایش ژل کلات اکتیویتر انتقال داده و سپس توسط سانتریفیوژ با سرعت 3000 دور بر دقیقه و دمای 18 درجه سانتیگراد بهمدت 20 دقیقه سانترفیوژ شدند. پس از آن توسط سمپلر به میکروتیوبهای 2 سیسی سرم خون منتقل شد و برای آنالیز نهایی در دمای منهای 20 درجه سانتیگراد نگهداری شدند. سپس بافت کبد از بدن حیوانات استخراج و در سرم فیزیولوژیک شستشو داده شد و سپس بلافاصله در دمای منهای 80 درجه سانتی گراد فریز شد. با استفاده از روش آزمایشگاهی فتومتریک، آنزیمهای AST و ALT توسط کیتهای تشخیصی از شرکت پارسآزمون (شماره سفارش: 118400) و آنزیم GGT از شرکت بایرکس فارس (کد محصول: BXC0362) از سرم خون اندازهگیری شد. همچنین جهت اندازهگیری پروتئین بافتی، بافت کبد پس از جداسازی، در محلول نرمال سالین شستشو داده شد و بلافاصله در تانک ازت در دمای منهای 196 درجه سانتیگراد نگهداری شد. سپس جهت انجام تکنیک وسترن بلات و آنالیزهای نهایی پروتئین PPAR-α، به آزمایشگاه منتقل شد. بهطور کلی مراحل انجام تکنیک وسترن بلات بهترتیب شامل لیزکردن بافت، تعیین غلظت پروتئین بهوسیله بردفورد، تهیه غلظتهای مختلف BSAبرای کشیدن منحنی استاندارد، غلظتهای پروتئین، آب و سمپل بافر، آماده¬سازی نمونه، ساخت الکتروفوژ برروی ژل SDS page، تهیه محلولها، روش انجام آزمایش و ساختن ژل پایین و بالا، الکترو فوز بر ژل SDS page، وسترن بلات یا ایمنوبلاتینگ، مرحله انتقال از ژل به کاغذ، مرحله بلاکینگ، مرحله انکوبه کردن با آنتی بادی اولیه (β-Actin (C4): sc-47778, PPARα (H-2): sc-398394)، مرحله انکوبه کردن با آنتی بادی ثانویه (m-IgGκ BP-HRP: sc-516102, mouse anti-rabbit IgG-HRP: sc-2357)، مرحله آشکارسازی، مرحله ظهور فیلم در تاریکخانه، روش Striping بود.
تجزیه و تحلیل آماری
در بخش آمار توصیفی از شاخصهای پراکندگی، میانگین، انحرافاستاندارد و نمودار استفاده شد. در بخش آمار استنباطی اطلاعات جمعآوری شده برای تعیین نحوه توزیع دادهها از آزمون شپیرو-ویلک استفاده شد. در صورت طبیعی بودن یافتهها، از روش تجزیه و تحلیل واریانس یکطرفه استفاده شد. در صورت معنیدار بودن تفاوتها، از آزمون تعقیبی بونفرونی برای تعیین محل دقیق تفاوتها استفاده شد. سطح معنیداری (P≤ 0/05) در نظر گرفته شد. کلیه روشهای آماری با استفاده از نرمافزارversion 16 SPSS انجام شد و برای رسم نمودارها از نرمافزار Excel2019 کمک گرفته شد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شیراز مورد تایید قرار گرفته است (IR.SUMS.REHAB.REC.1400.008).
نتایج
در نمودار 1 انحراف معیار ± میانگین وزن گروههای سالم (20= n) و رژیم پرچرب (HFD) (20= n)، در مدت هشت هفته القا رژیم پرچرب نمایش داده شده است. اولین هفته به عنوان سازگاری رت¬ها با محیط آزمایشگاه در نظر گرفته شد و پس از آن دوره هشت هفتهای القا رژیم پرچرب ادامه یافت. در پایان دوره القا بیماری استئاتوهپاتیت غیرالکلی، جهت اثبات ایجاد بیماری NASH، به¬طور تصادفی از گروه بیمار (n=2 ) و سالم (n=2 )، جداگانه، دو رت قربانی شدند و بهعنوان نمونه، در شکل 1 کبد بیمار با کبد سالم از نظر ظاهری با هم مقایسه شده است و مشخص است که رنگ کبد بیمار بهدلیل تجمع بالای تریگلیسیرید در آن متمایل به سفید و رنگ کبد سالم بهدلیل عدم تجمع تریگلیسیرید به رنگ قرمز می¬باشد. پس از اثبات ظاهری کبد به اثبات پاتولوژی و بیوشیمیایی بافت کبد توسط متخصص پاتولوژیست پرداخته شد. در شکل 2 نتایج رنگآمیزی Oil red O بافت کبد بیمار و سالم با هم مقایسه و گزارش شده است. همان¬گونه که مشهود است تعداد نقطههای قرمز رنگ در نمونه کبد بیمار نشاندهنده میزان تجمعتریگلیسیرید در این بافت است با این¬حال در نمونه کبد سالم هیچ نوع نقطه قرمز رنگی مشاهده نمیشود و نشاندهنده عدم تجمع تریگلیسیرید در نمونه بافت کبد سالم است.
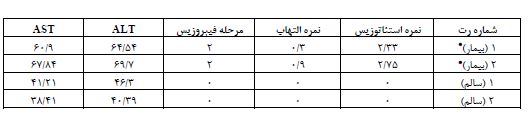
رنگ¬آمیزی Oil red O: بافت کبد که قبلاً در نیتروژن مایع خنک شده بود در ایزوپنتان (isopentane) غوطهور شد و در دمای برش بهینه Tissue-Plus® (OCT) (Fisher HealthCareTM) قرار داده شد و متعاقباً برای تجزیه و تحلیل بافتشناسی مورفولوژی کبد و محتوای چربی؛ ذخیره شد. نمونههای کبد بر روی یک کرایواستات (CM3050S، Leica Microsystems، Nussloch، ساخت کشور آلمان) به برشهایی به ضخامت پنج میکرومتر برش داده شدند. مقاطع کبد با Oil Red O (105230, Merck, Darmstadt, (Germany رنگ¬آمیزی شدند. تصاویر زیر یک میکروسکوپ نوری (CX22، Olympus، توکیو، ژاپن) مشاهده شد و از یک میدان تصادفی 40X از کبد هر حیوان با استفاده از نرم افزار Toup View (ToupTek Photonics، Zhejiang، چین) گرفته شد (26). یک میدان میکروسکوپی نوری در هر بخش مشاهده شد و برای شدت استئاتوز کبدی، التهاب و فیبروز بر اساس معیارهای زیر نمره-گذاری شد: برای استئاتوز کبدی: درجه صفر، بدون چربی. درجه یک، استئاتوز کمتر از 33 درصد از پارانشیم کبدی را اشغال میکند. درجه دو، 34 تا 66 درصد از پارانشیم کبدی. درجه سه، بیش از 66 درصد از پارانشیم کبدی. برای انفیلتراسیون التهاب سلولی: درجه صفر: هیچ foci/field. درجه یک، 1-2 foci/field. درجه 2، 3-4 foci/field. درجه 3، بیش از 4 foci/field. مرحله¬بندی فیبروز کبدی با رنگآمیزی Oil red O به شرح زیر بررسی شد: صفر، هیچ؛ یک، خفیف، منطقه (zone) 3، پریسینوزوئیدال (perisinusoidal)؛ دو، متوسط، منطقه 3، پریسینوزوئیدال؛ سه، پورتال/پریپورتال؛ چهار، فیبروزیس (bridging fibrosis) (27). همانگونه که در جدول 2 نشان داده شده است در نمونه¬های بیمار 1 و 2 پس از هشت هفته تغذیه با رژیم پرچرب نمره استئاتوزیس و التهاب، مقادیر سرمی ALT و AST و همچنین آنالیز بافتی کبد نشان داد که کبد رتها در مرحله دوم فیبروزیس قرار دارد. نمودار 2، وزن گروههای تحقیق پس از اثبات بیماری استئاتوهپاتیت غیرالکلی و تقسیم-بندی تصادفی آنها به چهار گروه کنترل-سالم (9=n)، سالم-شنا (9= n)، کنترل-بیمار (9= n) و بیمار-شنا (9= n)، نشان میدهد. در این نمودار هفته¬های اول و دوم جهت آشنایی و سازگاری موشهای صحرایی با محیط استخر و نوع تمرین در نظر گرفته شد. هفتههای یک تا هشت، بازه تمرین اصلی مطابق پروتکل ارائه شده بود و هفته نهم، هفته تشریح موش-های صحرایی گروههای آزمایش بود. بر اساس میانگین وزن هر گروه در کل دوره مداخله تمرینی، مشخص شد که بین گروه-های کنترل-سالم و سالم- شنا (0/003≥P) و بین گروههای کنترلبیمار و سالم-شنا (0/002≥P) تفاوت معنیدار وجود دارد. میان گروه¬ سالم-شنا با بیمار-شنا کاهش غیر معنیدار (P≥0/092) مشاهده شد. بر اساس نتایج آزمون تحلیل واریانس یکطرفه، میتوان گفت تفاوت معنیداری بین میانگین متغیر PPARα (P≤0/001، )3،8)F= 66/455) ، درگروههای تحقیق وجود داشت. با توجه به نتایج آزمون تعقیبی بونفرونی، نتایج شکل 3 و نمودار 3، در پروتئین PPAR-α بافت کبد، بین گروه کنترل-سالم با گروههای کنترل-بیمار (0/001≥P)، بیمار-شنا (0/001≥P) و همچنین در گروه سالم-شنا نسبت به گروههای کنترل-سالم (0/001≥P)، کنترل-بیمار (0/002≥P) و بیمار-شنا (0/004≥P) افزایش معنیدار وجود دارد. با این وجود در گروه بیمار-شنا نسبت به گروه کنترل-بیمار افزایش غیرمعنیداری (0/9≤P) در این پروتئین بافتی کبد مشاهده شد. در شکل 3، یافتههای مربوط به اندازهگیری پروتئین PPAR-α از روش تکنیک وسترن بلات بهصورت کیفی گزارش شده است. در این شکل از هر گروه آزمایش، سه نمونه بافت کبد انتخاب شد و اندازهگیری پروتئین PPAR-α نسبت به بتااکتین مورد سنجش و مقایسه قرار گرفت. بزرگی اندازه پهنا و تیرگی هر باند نسبت به بتااکتین نشاندهنده افزایش غلظت پروتئین یاد شده در نمونههای موردنظر است. بر اساس نتایج آزمون تحلیل واریانس یکطرفه، میتوان گفت تفاوت معنیداری بین میانگین متغیرهای AST (P≤0/001، )3،28)F= 87/509)، ALT (P≤0/001، )3،28)F=159/528)، GGT ( P≤0/001، )3،28)F=11/167(، ، درگروههای تحقیق وجود داشت. با توجه به نتایج آزمون تعقیبی بونفرونی و نمودار 4 و 5، در متغیرهای AST و ALT، در گروه کنترل-سالم نسبت به گروه¬های سالم-شنا (AST: P≤0/001)(ALT: P≤0/001) ، بیمار-شنا (AST: P≤0/001)(ALT: P≤0/001) و کنترل-بیمار (AST: P≤0/001)(ALT: P≤0/001)، کاهش معنی-دار و گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار (AST: P≤0/001)(ALT: P≤0/001)، و گروه سالم-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار (AST: P≤0/001)(ALT: P≤0/001(، وجود داشت (0/05≥P).
بر اساس نمودار 6، در متغیر GGT، افزایش معنیدار در گروه کنترل-بیمار نسبت به گروه کنترل-سالم (0/001≥P) و کاهش معنیدار در گروه سالم-شنا نسبت به گروه بیمار-کنترل (0/001≥P) و همچنین کاهش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا (0/044≥P) وجود داشت.

نمودار 1: انحراف معیار ± میانگین تغییرات وزن گروههای سالم و رژیم پرچرب در هشت هفته اول القا کبد چرب، در ابتدا یک هفته بهعنوان سازگاری رتها با محیط آزمایشگاه و رژیم غذایی در نظر گرفته شد.
جدول 2: نتایج آزمایش بافتی و خونی جهت اثبات بیماری استئاتوهپاتیت غیرالکلی

شکل1: مقایسه نمای ظاهری کبد چرب (سمت راست) و کبد سالم (سمت چپ)، بلافاصله پس از کشتار در گروه بیمار و سالم

شکل2: رنگ آمیزی بافت کبد توسط Oil red O، A: کبد چرب، لیپیدها به رنگ قرمز درآمده¬اند. B: کبد سالم- به دلیل عدم وجود چربی هیچ نوع رنگ قرمزی به خود نگرفته است.

نمودار 2: انحراف معیار ± میانگین تغییرات وزن چهار گروه آزمایش در هشت هفته دوم پس از اثبات بیماری استئاتوهپاتیت غیرالکلی، در ابتدا دو هفته بهعنوان سازگاری رتها با محیط تمرین در نظر گرفته شد و سپس از هفتههای یک تا هشت تمرین اصلی مطابق پروتکل تمرینی انجام شد. هفته نهم، هفته تشریح رتها بود.

شکل3: مقایسه باندهای شکل گرفته پروتئین PPAR-α نسبت به بتااکتین در 12 نمونه بافت کبد (از هر گروه آزمایش، سه نمونه انتخاب شدند) در روش وسترن بلات

نمودار3: غلظت پروتئین PPAR-α در گروههای آزمایش. *: افزایش معنیدار PPAR-α در گروه سالم-شنا نسبت به دو گروه بیمار-شنا و کنترل-بیمار (0/05≥P). گروه کنترل سالم بهعنوان گروه کنترل، عدد یک در نظر گرفته شده است.

نمودار 4: نتایج تحقیق در متغیر AST سرم، *: کاهش معنیدار در گروه کنترل-سالم نسبت به گروههای سالم-شنا، کنترل-بیمار و بیمار- شنا (0/001≥P)، #: کاهش معنیدار در گروه سالم-شنا نسبت به کنترل-بیمار، ##:کاهش معنیدار گروه بیمار-شنا نسبت به کنترل- بیمار (0/001≥P).
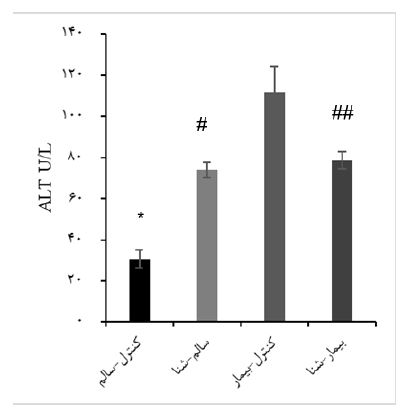
نمودار 5: نتایج تحقیق در متغیر ALT سرم، *: کاهش معنیدار در گروه کنترل-سالم نسبت به گروههای سالم-شنا، کنترل-بیمار و بیمار- شنا (01/001≥P)، #: کاهش معنی¬دار در گروه سالم-شنا نسبت به کنترل-بیمار، ##:کاهش معنیدار در گروه بیمار-شنا نسبت به کنترل- بیمار (0/001≥P).

نمودار6 : نتایج تحقیق در متغیر GGT: *:افزایش معنیدار گروه کنترل-بیمار نسبت به کنترل-سالم (001/0≥P)، #: کاهش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا (0/044≥P) و کنترل-بیمار (0/001≥P)
بحث
تحقیق حاضر با هدف بررسی تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر پروتئین PPAR-α بافت کبد و آنزیمهای کبدی در سرم خون موشهای صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NΑSH) انجام شد. یافتهها نشان دادند که میانگین وزن در گروه سالم-شنا کاهش معنیداری نسبت به گروههای کنترل-بیمار و سالم-شنا داشت. در پروتئین PPAR-α بافت کبد، افزایش معنیدار این پروتئین در گروه سالم-شنا نسبت به گروههای بیمار-شنا و کنترل-بیمار مشاهده شد. همچنین در گروه بیمار-شنا نسبت به گروه کنترل-بیمار در میزان این پروتئین افزایش غیرمعنیدار بود. همسو با نتایج پژوهش حاضر میتوان به Diniz و همکاران (2021) اشاره کرد. آنها به دنبال 12 هفته رژیم پرچرب در موش¬ها و هشت هفته فعالیت ورزشی هوازی روی تردمیل به این نتیجه رسیدند
که فعالیت ورزشی هوازی باعث افزایش در سطح پروتئین PPAR-α میشود. همچنین رژیم غذایی پرچرب و افزایش استئاتوزیس کبدی، باعث کاهش معنیدار این پروتئین در گروه بیمار بیتحرک شد. آنها این تغییرات را ناشی از افزایش مکانیسم سیگنالدهی AMPK-PPAR-α دانستند که بر اثر سازگاری با ورزش افزایش مییابد (28). با انجام فعالیت ورزشی، میزان فعالیت AMPK بالا میرود. AMPK یک حسگر حالت انرژی درون سلولی است که با نسبتهای بالای AMP بهATP (مثلاً در طول ناشتایی شبانه و یا در حالت فعالیت ورزشی) فعال میشود (29). این عامل فعال شده چندین اثر مهم در بهبود استئاتوهپاتیت غیرالکلی دارد. از جمله میتوان به فعالسازی پروتئین PPAR-α اشاره کرد و موجب افزایش غلظت آن پروتئین میشود. PPAR-α از راه افزایش بیان پروتئینهای ناقل و آنزیمهای تجزیهکننده اسیدهای چرب سبب افزایش و تنظیم متابولیسم میشود (30). از سوی دیگر ناهمسو با نتایج تحقیق حاضر؛ در تحقیق Nikroo و همکاران (2020)، پروتئینهای PPAR-α و SIRT1 افزایش غیرمعنیدار در گروه ورزش نسبت به گروه کنترل داشتند (31). این در حالی است که در تحقیق حاضر در گروه سالم-شنا پروتئین PPAR-α نسبت به سایر گروهها افزایش معنیدار داشت و از طرف دیگر در متغیر وزن، این گروه نسبت به سایر گروهها کاهش معنیدار دیده شد. بر اساس دیگر یافتههای پژوهش حاضر، پس از هشت هفته فعالیت تناوبی شنا با شدت بالا افزایش غیرمعنیدار در سطح پروتئین PPAR-α در گروه بیمار-شنا نسبت به گروه کنترل-بیمار مشاهده شد. نتایج مربوط به پروتئین PPAR-α در این مطالعه تقریباً با یافتههای ارائه شده در مطالعه Zhang و همکاران (2018)، Jinkyung Cho و همکاران (2014)، در تضاد بود (32,33). Zhang و همکاران (2018)، بیان کردند که بهدنبال شش هفته تمرین هوازی با رژیم کتوژنیک؛ ژنهای مصنوعی PPAR-γ و سطح لیپید کاهش مییابد و بیان ژن PPAR-α و بتااکسیداسیون لیپید افزایش مییابد. افزایش قابل توجه PPAR-α به این دلیل است که ورزش هوازی با رژیم کتوژنیک ترکیب شده بود. اما در این مطالعه تأثیر مستقل تمرینات ورزشی مورد بررسی قرار گرفت و موشها تا پایان مطالعه بدون پیروی از رژیمهای غذایی دیگر (مانند رژیمهای کتوژنیک و کم کالری) با رژیم غذایی پرچرب (HFD) تغذیه شدند (33). Jinkyung Cho و همکاران (2014)، پس از 15 هفته پیگیری HFD، اثرات هشت هفته تمرین ورزشی هوازی (دویدن روی تردمیل، پنج روز در هفته، هر جلسه 55 دقیقه با شیب پنج درجه) را بر روی موشهای C57BL/6 مبتلا به NAFLD مورد مطالعه قرار دادند. آنها به این نتیجه رسیدند که بیان PPARα کبدی بهطور قابلتوجهی در موشهای HFD و رژیم غذایی پرچرب+ورزش (HFD+EX) در مقایسه با موشهای معمولی کاهش یافت که از این نظر با نتایج مطالعه حاضر همسو است، با اینحال موشهای HFD + EX مقادیر قابل توجه بالاتری از بیان PPARα در مقایسه با موشهای HFD داشتند که با نتایج مطالعه حاضر در تناقض است. دلایل تفاوت بین یافتههای مطالعه آنها و یافتههای مطالعه حاضر ممکن است نوع تمرین (تمرینات تناوبی با شدت بالا در آب در برابر تمرینات هوازی تداومی بر روی تردمیل)، شدت تمرین (شدت بالا در برابر شدت متوسط)، حجم تمرین (سه روز در هفته و هر جلسه به مدت 30 دقیقه در برابر پنج روز در هفته و هر جلسه بهمدت 55 دقیقه) و طول دوره NAFLD ناشی از HFD (17 هفته در مقابل 15 هفته) باشند (32). فعال شدن PPAR-α در کبد منجر به افزایش اکسیداسیون اسیدهای چرب آزاد در فعالیتهای میتوکندری، پراکسیزومی و میکروزومی و هم-چنین کاهش تجمع چربی کبدی در طول پیشرفت NAFLD میشود و از استئاتوز جلوگیری میکند (34,35). در همین حال، آزاد شدن کلسیم بهدنبال انجام فعالیت ورزشی و انقباض عضلانی منجر به فعال شدن کالمودولین، کلسینورین و کالمودولین کیناز میشود و در عین حال بیان ژن SIRT1 و PGC-1α را افزایش میدهد. این پروتئینهای بالادست منجر به فعالسازی PPAR-α میشوند و باعث افزایش اکسیداسیون لیپید و اسیدهای چرب موجود در میتوکندری و کاهش ذخیره چربی در کبد میشوند (36،37). موشهایی که روزانه 40 دقیقه ورزش شنا کردند در مقایسه با موشهای غیرفعال، بیان SIRT1، PGC-1α و AMPK بالاتری در عضله گاستروکنمیوس داشتند. همچنین نشان داده شد که ورزش باعث افزایش محتوای SIRT1، PGC-1α، AMPK و پروتئین کیناز فعال شده با میتوژن (MAPK) میشود (37). همچنین نشان داده شده است که PPAR-α منجر به کاهش ApoC3میگردد و هیدرولیز LDL را مهار میکند و منجر به کاهش لیپیدها به واسطه فعالیت لیگاندهای PPAR-α می-گردد (38). علاوه بر این، PPAR-α از پیشرفت استئاتوز ساده به سمت NASH جلوگیری میکند. همچنین پروتئینهای التهابی را عمدتاً از طریق فعالیت ضدالتهابی قوی در کبد و مهار بیان ژن عوامل التهابی تنظیم میکند (39). در متغیرهای AST و ALT، بین گروه کنترل-سالم با گروههای کنترل-بیمار، بیمار-شنا و سالم-شنا کاهش معنیدار و همچنین بین گروههای بیمار-شنا و سالم-شنا با گروه کنترل-بیمار کاهش معنیدار مشاهده شد. در متغیر GGT، گروه کنترل-بیمار نسبت به گروه کنترل-سالم افزایش معنیدار و گروه سالم-شنا نسبت به کنترل-بیمار و هم¬چنین گروه سالم-شنا نسبت به بیمار-شنا کاهش معنی¬دار داشت. با اینحال در این متغیر گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش غیرمعنیدار مشاهده شد. همسو با نتایج تحقیق حاضر میتوان به پژوهش Batatinha و همکاران (2017) اشاره کرد. آنها بهدنبال هشت هفته فعالیت ورزشی هوازی بر موشهای C57BL6 القا شده به NAFLD توسط رژیم غذایی پرچرب، کاهش معنیدار آنزیم AST را در گروه بیمار-تمرین نسبت به گروه بیمار بیتحرک نتیجه گرفتند (40). Nikroo و همکاران (2020)، پس از 12 هفته القا بیماری استئاتوزیس از طریق رژیم غذایی پرچرب، به این نتیجه رسیدند که فعالیت ورزشی باعث کنترل وزن میشود. همچنین ورزش باعث کاهش معنیدار ALT و AST سرم نسبت به گروه کنترل در موشهای صحرایی تحقیق آنها شد (31). Liu و همکاران (2019)، مکانیسم اساسی تمرین هوازی با شدت متوسط (صفر درجه شیب، 5/2 متر در دقیقه، یک ساعت در روز و پنج روز در هفته برای مجموع هشت هفته) روی بافتهای کلیه و کبد در موشهای دیابتی db/db مورد بررسی قرار دادند. در پایان دوره تمرین به این نتیجه رسیدند که متغیرهای ALT و AST در گروه تمرین نسبت به بیمار بیتحرک کاهش معنی-دار یافتهاند. همچنین فعالیت ورزشی باعث کاهش وزن در گروه ورزش شده بود (41). Hajighasem و همکاران (2018)، بهطور تصادفی موشهای NAFLD ناشی از شش هفته HFD، به مدت هشت هفته تحت تمرینات تداومی و تناوبی قرار دادند. نتایج نشان داد که متغیرهای ALT و AST در گروههای تمرین+رزوراترول و تمرین ورزشی کاهش معنی-داری نسبت به گروه بیمار بیتحرک و سالم بیتحرک تجربه کردند. همچنین کاهش وزن در گروههای تمرین و تمرین+مکمل نسبت به بیمار بیتحرک و سالم بیتحرک به-طور معنیدار مشهود بود (42). آلانین آمینوترانسفراز (ALT) که عمدتاً در کبد یافت میشود بهعنوان شاخصی برای آسیب کبدی استفاده میگردد و در تحقیق حاضر در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش معنیدار داشت. این یافته نشان میدهد که علیرغم عدم محدودیت کالریک الگوی، شدت و مدت پروتکل ورزشی به کبد که منبع اصلی ALT است؛ نهتنها آسیبی وارد نکرده است بلکه در شرایط بیماری استئاتوهپاتیت غیرالکلی باعث بهبود آن شده است. در این راستا میتوان به نتایج تحقیقات Davries و همکاران (2008) و Sreenivasa و همکاران (2006) و Nuri و همکاران (2012) اشاره کرد (45-43). میکائیل و همکاران (2012)، تاثیر 12 هفته فعالیت ورزشی هوازی را بر شاخصهای بیوشیمیایی و آنزیمهای ALT و GGT کبد در زنان و مردان مبتلا به NAFLD بررسی کردند و به این -نتیجه رسیدند علیرغم کاهش معنیدار وزن آزمودنیها پس از دوره تمرین تفاوت معنیدار در آنزیم ALT مشاهده نشد؛ اما کاهش معنیدار در آنزیم GGT در گروه مردان یافت شد. این در حالی است که در تحقیق حاضر نیز گروه سالم-شنا نسبت به گروه کنترل-بیمار در متغیر GGT کاهش معنیداری تجربه کرد اما در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش غیرمعنیدار مشاهده شد. از جمله دلایل این عدم معنیداری را میتوان به تداوم رژیم پرچرب 77 درصد تا پایان دوره تحقیق برای گروه بیمار-شنا و کنترل-بیمار اشاره کرد. این نتیجه بیان میکند که با وجود عدم محدودیت کالریک؛ تمرینات تناوبی شنا با شدت بالا میتوانند بر کاهش آنزیم GGT به-عنوان یک نشانگر بیماری کبد چرب تاثیر داشته باشند. Uadia و همکاران (2016)، به بررسی تأثیر فعالیت بدنی و انعطافپذیری بر سطوح پلاسمایی برخی آنزیمهای کبدی در جوان نیجریهای پرداختند. یافتههای آنها نشان داد که نسبت به قبل از دوره تمرین متغیر AST افزایش معنیدار و متغیرهای ALT و GGT عدم معنیداری را از خود نشان دادند. از جمله دلایل تناقض یافتههای تحقیق آنها با یافتههای تحقیق حاضر میتوان به نوع آزمودنیها (موشهای صحرایی مبتلا به استئاتوهپاتیت غیرالکلی ناشی از رژیم پرچرب در برابر آزمودنی¬های سالم و جوان)، نوع پروتکل تمرینی (فعالیت تناوبی شنا با شدت بالا در برابر فعالیت بدنی با شدت کم) و مدت پروتکل تمرینی (هشت هفته در برابر شش هفته) اشاره کرد (17). این درحالی است که در تحقیق حاضر گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار در آنزیمهای GGT، ALT و AST داشت. این یافته نشان میدهد با وجود عدم محدودیت کالریک و مصرف دائم رژیم پرچرب، به واسطه انجام فعالیت ورزشی تناوبی شنا با شدت بالا از افزایش آنزیمهای کبد جلوگیری و حتی باعث کاهش آنها در بیماری استئاتوهپاتیت غیرالکلی شد. در مطالعه حاضر کاهش وزن، کاهش سطوح آمینوترانسفراز سرم و همچنین تغییرات افزایشی غلظت پروتئین PPAR-α در گروه سالم-شنا نسبت به سایر گروهها پس از هشت هفته شنای تناوبی با شدت بالا معنیدار بود؛ اما در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش آمینوترانسفراز سرم کاهش معنیدار و غلظت پروتئین PPAR-α افزایش غیرمعنیدار داشت. یکی از دلایل اصلی نتایج بدست آمده به این خاطر است که در تحقیق حاضر رژیم غذایی پرچرب تا پایان تمرینات بدون محدودیت کالریک برای گروههای بیمار-شنا و کنترل-بیمار ادامه داشت تا تنها تاثیر ورزش شنای تناوبی با شدت بالا بر سطح پروتئین PPAR-α کبدی در بیماری استئاتوهپاتیت غیرالکلی مورد سنجش قرار گیرد. با اینحال این مدل تمرین با وجود عدم محدودیت کالریک بر کاهش معنیدار آنزیمهای موثر کبدی (ALT،AST و GGT) در گروههای تمرین سالم-شنا نسبت به کنترل-بیمار و کنترل-سالم و بیمار-شنا نسبت به کنترل-بیمار موثر بوده است. به نظر میرسد با افزایش حجم نمونه و مدت زمان تمرین، تغییرات قابلتوجهی در پروتئین PPARα نیز رخ دهد و منجر به بهبود بیشتر بیماری استئاتوهپاتیت غیرالکلی ناشی از مصرف رژیم پرچرب شود. همچنین، مطالعات بیشتری نیز برای کشف مسیرهای مولکولی و مکانیسمهای درگیر مورد نیاز است.
نتیجهگیری
نتایج مطالعه حاضر بر روی موشهای صحرایی ناشی از بیماری استئاتوهپاتیت غیرالکلی ناشی از مصرف رژیم غذایی پرچرب نشان داد که هشت هفته تمرینات شنای تناوبی با شدت بالا در گروه بیمار-شنا نسبت به کنترل-بیمار علیرغم عدم تفاوت معنیدار در وزن این دو گروه باعث کاهش معنیدار در آنزیمهای کبدی (ALT، AST و GGT) که بهعنوان نشانگرهای عمومی بیماری استئاتوهپاتیت غیرالکلی میشوند، شد با این وجود منجر به کاهش غیرمعنیدار پروتئین PPARα گشت. این نتایج نشان میدهد علیرغم عدم محدودیت کالریک، این مدل تمرینات مستقل از کاهش وزن میتواند علائم عمومی بیماری استئاتوهپاتیت غیرالکلی از جمله آنزیمهای کبدی را کاهش دهد با اینحال تاثیر قابلتوجهی بر پروتئین PPARα نداشت و پیشنهاد میشود در مطالعات آتی مدت پروتکل تمرین و یا شدت آن و یا هر دو را افزایش داد. از طرف دیگر هشت هفته تمرینات تناوبی شنا با شدت بالا موجب کاهش معنیدار وزن آنزیمهای کبدی در گروه سالم-شنا نسبت به گروههای کنترلسالم و کنترل-بیمار شد. این یافتهها نشان میدهد که این مدل تمرین در آزمودنیهای سالم نیز بسیار اثرگذار است و میتواند باعث جلوگیری از ابتلا به بیماریهای متابولیکی از جمله کبد چرب نسبت به افراد بیتحرک شود. همچنین در پروتئین PPARα نیز افزایش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا و کنترل-بیمار نشان میدهد که این مدل تمرین میتواند پویایی و فعالیت متابولیسم لیپید را بسیار تحت تاثیر مثبت قرار دهد و موجب جلوگیری فرد از ابتلا به بیماری استئاتوهپاتیت غیرالکلی شود.
سپاسگزاری
از تمامی کسانی که ما را در اجرای این پایاننامه دکتری یاری رساندند، نهایت تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارد.
عدم تعادل در متابولیسم اسیدهای چرب در ارتباط با بافت چربی، بافت کبد و التهاب سیستمیک، عوامل کلیدی برای ایجاد مقاومت به انسولین، دیسلیپیدمی و سایر عوامل خطر قلبی-عروقی مرتبط با بیماری کبد چرب غیرالکلی nonalcoholic fatty liver disease (NAFLD) هستند (1). این بیماری یک وضعیت روبه افزایش است که با سبک زندگی کمتحرک و عادات غذایی اشتباه همراه است و شیوع بالایی در سراسر جهان دارد (2). NAFLD با تجمع تریگلیسیریدها در سلولهای کبدی به شکل لیپیدهای ماکرو و میکرو ویزیکول با علائم خوشخیم، همراه با التهاب متعاقب با استئاتوهپاتیت غیرالکلی (NASH) Non-alcoholic steatohepatitis مشخص میشود که میتواند منجر به فیبروز، سیروز و نارسایی کبدی شود (3). استئاتوهپاتیت غیرالکلی نتیجه افزایش جذب چربی کبدی، افزایش لیپوژنز و ذخیره چربی در کبد است. مصرف بیرویه موادغذایی پرچرب و کاهش فعالیت بدنی منجر به افزایش لیپوژنز در کبد میشود و در نتیجه بهمیزان قابلتوجهی تریگلیسرید و سایر گونههای چربی در سلولهای کبد تجمع پیدا میکنند (4). گیرنده فعال تکثیرکننده پراکسیزوم آلفا (PPΑRα) peroxisome proliferator-activated α receptor از خانواده گیرندههای هستهای PPΑR است و در سلولهای کبدی بیان میشود و در اثر اتصال توسط اسیدهای چرب فعال میشود و جذب و استفاده اسید چرب آزاد را از طریق چرخه اکسیداسیون بتا و کتوژنز افزایش میدهد در نتیجه هموستاز چربی کبد را بر عهده دارد (5). با افزایش NΑSH، PPΑRα کاهش مییابد و این موضوع باعث افزایش تجمع هر چه بیشتر چربی در سلولهای کبدی میشود (4). فعالسازی PPΑRα باعث رونویسی از طیف وسیعی از ژنهای مرتبط با اکسیداسیون اسیدهای چرب در میتوکندریها، پراکسیزومها و سیتوکرومها میشود، در نتیجه سطح چربیهای کبدی کاهش مییابد (6). در مطالعه¬ای که روی موشها انجام شد بهدنبال غیرفعالسازی PPΑRα، استئاتوز کبدی بهوجود آمد و دریافتند که PPΑRα در تنظیم متابولیسم لیپیدهای کبدی نقش اساسی دارد (7). در یک مطالعه طولی پس از یک سال پیگیری نشان داده شد که با افزایشPPΑRα ، بهبود در NΑSH افزایش مییابد (8). همچنین در پژوهشی هنگامی که حیوانات را در گروه رژیم غذایی با چربی بالا یا گروه رژیم غذایی استاندارد در معرض ورزش منظم شنا بهمدت 12 هفته قرار دادند، در هر دو گروه بیان ژنPPΑRα mRNΑ کبدی افزایش یافت (9). تغییر در شیوه زندگی با هدف افزایش فعالیت بدنی و کاهش کالری دریافتی با هدف تعادل انرژی منفی برای از دست دادن و یا حفظ توده بدون چربی بدن است. بنابراین، بهبود تمرینات بدنی منظم به یک استراتژی مهم برای درمان غیردارویی بیماری استئاتوهپاتیت غیرالکلی تبدیل شده است (4,3). فعالیتهای ورزشی باعث کاهش آنزیمهای کبدی از جمله آسپارتات آمینوترانسفراز (AST) Aspartateaminotransferase و آلانین آمینوترانسفراز (ALT)Alanine aminotransferase ، گاماگلوتامیل ترانسفراز (GGT) Gama-Glutamyl Transferase، کاهش میزان چربی و تریگلیسیرید کبد میشود (10). از سوی دیگر در مطالعهای که اثر فعالیت ورزشی بر حجم و چربی کبد در بیماران NΑSH بررسی کردند به این نتیجه رسیدند که چربی و حجم کبد و همچنین شاخص توده بدن افراد کاهش معنیدار یافته بود اما سطوح آنزیمهای ΑST و ΑLT و GGT تغییری نکرده بود (11). با وجود نتایج متناقض تحقیقات اخیر، محققان همواره بهدنبال بهترین پروتکل تمرینی از نظر نوع، شدت، حجم و مدت فعالیت بودهاند. تمرینات تناوبی با شدت بالا (HIIT) High-Intensity Interval Training بهعنوان یک روش تمرینی جدید هوازی شناخته شده است. این نوع تمرینات شامل دوره-های تلاش حداکثری با فواصل استراحت فعال یا غیرفعال میان این دورههاست (12). در برخی پژوهشها گزارش شده است که تمرینات تناوبی با شدت بالا موجب کاهش توده چربی احشایی و چربی کل بدن، کاهش چربی کبد و بهبود سفتی آن میگردد و بهعنوان یک شیوه درمان غیردارویی موثر در درمان استئاتوهپاتیت غیرالکلی در بیمارانی که برای انجام فعالیت ورزشی با کمبود وقت مواجه هستند، معرفی شد (13,14). اما در مقابل برخی پژوهشها پس از بررسی این نوع تمرینات، عدم تغییر در چربی احشایی، شاخص توده بدنی، آنزیمهای ΑLT و ΑST، GGT و همچنین نشانگرهای التهابی را گزارش کردند (17-15). از طرف دیگر انجام تمرینات HIIT در خشکی با مشکلات و موانعی همراه است. بهگونهای که افراد چاق مبتلا به NΑSH بهدلیل سنگینی وزن آنها و ماهیت پرشدت بودن این مدل فعالیت، خطر ایجاد صدمه برای آنها بهوجود میآید (18). از جهت افزایش ایمنی و کاهش صدمات ناشی از این نوع تمرینات برخی مطالعات به تحقیق درباره مقایسه فعالیتهای ورزشی هوازی در آب و خشکی و بررسی اثرات ورزش در آب بر برخی از بیماریهای متابولیکی از جمله دیابت، چاقی، سندروم متابولیک و فشارخون پرداختهاند. آب بهدلیل خواص بینظیر هیدرودینامیکی و ایجاد شرایط بیوزنی باعث کاهش صدمات ناشی از تمرینات HIIT در مقایسه با خشکی میشود (18). همچنین در محیط آبی همانند محیط خشکی میتوان انواع فعالیتهای ورزشی هوازی و بیهوازی با وزن بدن انجام داد (21-19) با این وجود تمام این تحقیقات اظهار داشتند که بهینهترین پروتکل تمرین از نظر نوع، شدت، حجم و مدت فعالیت همچنان ناشناخته است (13,18,19). با توجه به نتایج متناقض تحقیقات در زمینه تاثیرات شنا بر انواع بیماریها و اثرات مبهم آن در مقایسه با ورزش در محیط خشکی و همچنین نیافتن تحقیقی در زمینه تاثیر تمرینات شنای تناوبی با شدت بالا بر کبد چرب بیماران مبتلا به استئاتوهپاتیت غیرالکلی توسط محققین تحقیق حاضر، لذا این محققان برای مشخص کردن کارایی و اثربخشی این مدل تمرین بر بهبود NΑSH از جنبه سلولیمولکولی در بافت کبد، تاثیر شنای تناوبی با شدت بالا بر عامل پروتئینی PPARα و آنزیمهای کبدی در موشهای صحرایی مبتلا به بیماری استئاتوهپاتیت غیرالکلی القا شده با رژیم پرچرب را بررسی کردند.
روش بررسی
پژوهش حاضر با توجه به هدف از نوع توسعهای- بنیادی و با در نظر گرفتن روش از نوع نیمهتجربی بود. در این پژوهش، 40 سر موش صحرایی نر (سن: 6 تا 8 هفته) از نژاد Sprague – Dawley با میانگین وزن 20 ± 230 گرم انتخاب شدند. موشهای صحرایی در حیوانخانه دانشگاه شیراز با دمای 22 تا 24 درجه سانتیگراد، رطوبت 45 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به¬صورت آزادانه در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. موشهای صحرایی انتخابشده به دو گروه 20 تایی تقسیم شدند. گروه اول گروه سالم، ماندند (n=20 ) و غذای استاندارد دریافت کردند. گروه دوم طی مدت هشت هفته تحت رژیم غذایی پرچرب (High fat diet :HFD) قرار گرفتند تا بیماری استئاتوهپاتیت غیرالکلی در آنها القا شود (HFD: n=20 ). رژیم پرچرب به-کار رفته در تحقیق حاضر بهصورت امولسیون (به حالت مایع با ویسکوزیته بالا) استفاده شد و با استفاده از روش گاواژ روزانه (بهمیزان 10 میلیلیتر به ازای هر کیلوگرم وزن بدن) به موشهای صحرایی گروه رژیم غذایی پرچرب (n=20 ) خورانده میشد. محتوای امولسیون پرچرب از 77 درصد چربی، 14 درصد پروتئین و 9 درصد کربوهیدراتها تشکیل گردید. محتوای این امولسیون شامل روغن ذرت، ساکارز، پودر شیر خشک، کلسترول، سدیم دزوکسیکولات، توئین80، پروپیلین گلایکول، مخلوط ویتامین و مواد معدنی و آب مقطر بود. در این امولسیون، پروتئینها توسط پودر شیر خشک، کربوهیدراتها توسط ساکاروز و چربی توسط روغن ذرت و پودر کلسترول تأمین شدند. هر وعده با مخلوطی از ویتامین و مواد معدنی تکمیل شد. این امولسیون در دمای چهار درجه سانتیگراد ذخیره، در حمام آب با دمای 42 درجه سانتیگراد گرم و قبل از استفاده کاملاً میکس و مخلوط شد (22). در گروه رژیم پرچرب علاوه بر غذای روزانه استاندارد جوندگان، بهصورت خوراکی و توسط تکنیک گاواژ، موشهای صحرایی با امولسیون پرچرب (10 میلیلیتر به ازای هر کیلوگرم وزن بدن) یک بار در روز تحت گاواژ قرار گرفتند. این شیوه تغذیهای بهمدت هشت هفته ادامه داشت تا بر اساس پژوهش Zou و همکاران (2006)، در موشهای صحرایی که رژیم غذایی پرچرب مصرف میکردند (HFD:n=20 ) بیماری استئاتوهپاتیت غیرالکلی القا شود (22). به موشهای صحرایی گروه سالم (n=20 ) نیز از طریق تکنیک گاواژ، روزانه مقدار مساوی محلول نمک (سالین) داده شد. پس از اثبات القا بیماری در موشهای صحرایی (یافتههای مربوط به اثبات بیماری در قسمت نتایج آمده است.)، گروه بیمار (رژیم پرچرب) بهطور تصادفی به دو گروه کنترل- بیمار (9= n)، بیمار-شنا (9= n) و گروه سالم نیز بهطور تصادفی به دو گروه کنترل-سالم (9= n)، گروه سالم-شنا (9= n) تقسیم شدند. لازم به ذکر است رژیم غذایی پرچرب گروههای بیمار تا پایان دوره تمرینات ادامه داشت. پس از تقسیمبندی گروهها، همه موشهای صحرایی گروههای تمرین بهمدت دو هفته مرحله آشنایی با استخر حیوانات (قطر 160 سانتیمتر و ارتفاع 80 سانتیمتر) را قبل از شروع تمرین اصلی گذراندند (23). در هفته اول موشهای صحرایی با نهایت دقت و آرامش در استخر حیوانات با عمق آب 50 سانتیمتر و میانگین دمای 0/5 ± 30 درجه سانتیگراد قرار گرفتند و با سرعت دلخواه به مدت 20 دقیقه بهطور متناوب شنا کردند. در هفته دوم وقتی که موش¬های صحرایی بهخوبی با استخر حیوانات آشنا شدند؛ برای آشنایی با نوع تمرین تناوبی، چندین مرتبه بعد از یک دقیقه شنا بهوسیله صفحه استراحت از آب بیرون آورده و دوباره در آب قرار داده شدند. بعد از گذشت 48 ساعت از زمان آخرین جلسه آشنایی، موشهای صحرایی گروه تمرین، ابتدا پنج دقیقه گرم کردن و سپس تمرین اصلی HIIT شنا، شامل 20 نوبت 30 ثانیهای شنا با 30 ثانیه استراحت بین هر نوبت را انجام دادند. در پایان هر برنامه تمرینی نیز پنج دقیقه عمل سرد کردن اعمال شد و سپس تمام موشهای صحرایی کاملا خشک شده و به قفسهایشان منتقل شدند. این برنامه ورزشی بهمدت هشت هفته (سه روز در هفته، روزهای زوج) انجام شد. در تمرین تناوبی بار اعمال شده در هفته اول، وزنه بهمیزان هفت درصد وزن بدن هر موش صحرایی بود و هر هفته یک درصد به آن اضافه شد؛ بهطوریکه در هفته آخر (هشتم) موشهای صحرایی با وزنهای بهمیزان 14 درصد وزن بدن خود که به ریشه دم آنها بسته شد، شنا کردند (جدول1) (24). تمرینات، عصرهنگام (بهترین زمان تمرین در ریتم فعالیتی طبیعی موشهای صحرایی) انجام شد (25).
جدول1: پروتکل تناوبی شنا با شدت بالا

وزن موشهای صحرایی از روز اول شروع دوره تحقیق و سپس هر هفته در روزهای جمعه، عصر هنگام مورد سنجش قرار میگرفت و تا پایان دوره تحقیق و روز تشریح این روند ادامه داشت. پس از بدست آوردن وزن هر یک از موشهای صحرایی در هر گروه، میانگین وزنی هر گروه مشخص شده و ثبت میشد. یافتههای مریوط به میانگین وزن گروههای تحقیق در نمودار1 و 2، قسمت نتایج گزارش شده است. در مدت دوره تداخل، گروههای کنترل-سالم و کنترل-بیمار هیچ-گونه برنامه تمرینی نداشتند. برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین، موشهای صحرایی با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (سه تا پنج میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. ابتدا نمونههای خونی از قلب رتها بهمیزان 5 سیسی گرفته شد؛ بلافاصله آن را در داخل لوله آزمایش ژل کلات اکتیویتر انتقال داده و سپس توسط سانتریفیوژ با سرعت 3000 دور بر دقیقه و دمای 18 درجه سانتیگراد بهمدت 20 دقیقه سانترفیوژ شدند. پس از آن توسط سمپلر به میکروتیوبهای 2 سیسی سرم خون منتقل شد و برای آنالیز نهایی در دمای منهای 20 درجه سانتیگراد نگهداری شدند. سپس بافت کبد از بدن حیوانات استخراج و در سرم فیزیولوژیک شستشو داده شد و سپس بلافاصله در دمای منهای 80 درجه سانتی گراد فریز شد. با استفاده از روش آزمایشگاهی فتومتریک، آنزیمهای AST و ALT توسط کیتهای تشخیصی از شرکت پارسآزمون (شماره سفارش: 118400) و آنزیم GGT از شرکت بایرکس فارس (کد محصول: BXC0362) از سرم خون اندازهگیری شد. همچنین جهت اندازهگیری پروتئین بافتی، بافت کبد پس از جداسازی، در محلول نرمال سالین شستشو داده شد و بلافاصله در تانک ازت در دمای منهای 196 درجه سانتیگراد نگهداری شد. سپس جهت انجام تکنیک وسترن بلات و آنالیزهای نهایی پروتئین PPAR-α، به آزمایشگاه منتقل شد. بهطور کلی مراحل انجام تکنیک وسترن بلات بهترتیب شامل لیزکردن بافت، تعیین غلظت پروتئین بهوسیله بردفورد، تهیه غلظتهای مختلف BSAبرای کشیدن منحنی استاندارد، غلظتهای پروتئین، آب و سمپل بافر، آماده¬سازی نمونه، ساخت الکتروفوژ برروی ژل SDS page، تهیه محلولها، روش انجام آزمایش و ساختن ژل پایین و بالا، الکترو فوز بر ژل SDS page، وسترن بلات یا ایمنوبلاتینگ، مرحله انتقال از ژل به کاغذ، مرحله بلاکینگ، مرحله انکوبه کردن با آنتی بادی اولیه (β-Actin (C4): sc-47778, PPARα (H-2): sc-398394)، مرحله انکوبه کردن با آنتی بادی ثانویه (m-IgGκ BP-HRP: sc-516102, mouse anti-rabbit IgG-HRP: sc-2357)، مرحله آشکارسازی، مرحله ظهور فیلم در تاریکخانه، روش Striping بود.
تجزیه و تحلیل آماری
در بخش آمار توصیفی از شاخصهای پراکندگی، میانگین، انحرافاستاندارد و نمودار استفاده شد. در بخش آمار استنباطی اطلاعات جمعآوری شده برای تعیین نحوه توزیع دادهها از آزمون شپیرو-ویلک استفاده شد. در صورت طبیعی بودن یافتهها، از روش تجزیه و تحلیل واریانس یکطرفه استفاده شد. در صورت معنیدار بودن تفاوتها، از آزمون تعقیبی بونفرونی برای تعیین محل دقیق تفاوتها استفاده شد. سطح معنیداری (P≤ 0/05) در نظر گرفته شد. کلیه روشهای آماری با استفاده از نرمافزارversion 16 SPSS انجام شد و برای رسم نمودارها از نرمافزار Excel2019 کمک گرفته شد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شیراز مورد تایید قرار گرفته است (IR.SUMS.REHAB.REC.1400.008).
نتایج
در نمودار 1 انحراف معیار ± میانگین وزن گروههای سالم (20= n) و رژیم پرچرب (HFD) (20= n)، در مدت هشت هفته القا رژیم پرچرب نمایش داده شده است. اولین هفته به عنوان سازگاری رت¬ها با محیط آزمایشگاه در نظر گرفته شد و پس از آن دوره هشت هفتهای القا رژیم پرچرب ادامه یافت. در پایان دوره القا بیماری استئاتوهپاتیت غیرالکلی، جهت اثبات ایجاد بیماری NASH، به¬طور تصادفی از گروه بیمار (n=2 ) و سالم (n=2 )، جداگانه، دو رت قربانی شدند و بهعنوان نمونه، در شکل 1 کبد بیمار با کبد سالم از نظر ظاهری با هم مقایسه شده است و مشخص است که رنگ کبد بیمار بهدلیل تجمع بالای تریگلیسیرید در آن متمایل به سفید و رنگ کبد سالم بهدلیل عدم تجمع تریگلیسیرید به رنگ قرمز می¬باشد. پس از اثبات ظاهری کبد به اثبات پاتولوژی و بیوشیمیایی بافت کبد توسط متخصص پاتولوژیست پرداخته شد. در شکل 2 نتایج رنگآمیزی Oil red O بافت کبد بیمار و سالم با هم مقایسه و گزارش شده است. همان¬گونه که مشهود است تعداد نقطههای قرمز رنگ در نمونه کبد بیمار نشاندهنده میزان تجمعتریگلیسیرید در این بافت است با این¬حال در نمونه کبد سالم هیچ نوع نقطه قرمز رنگی مشاهده نمیشود و نشاندهنده عدم تجمع تریگلیسیرید در نمونه بافت کبد سالم است.
رنگ¬آمیزی Oil red O: بافت کبد که قبلاً در نیتروژن مایع خنک شده بود در ایزوپنتان (isopentane) غوطهور شد و در دمای برش بهینه Tissue-Plus® (OCT) (Fisher HealthCareTM) قرار داده شد و متعاقباً برای تجزیه و تحلیل بافتشناسی مورفولوژی کبد و محتوای چربی؛ ذخیره شد. نمونههای کبد بر روی یک کرایواستات (CM3050S، Leica Microsystems، Nussloch، ساخت کشور آلمان) به برشهایی به ضخامت پنج میکرومتر برش داده شدند. مقاطع کبد با Oil Red O (105230, Merck, Darmstadt, (Germany رنگ¬آمیزی شدند. تصاویر زیر یک میکروسکوپ نوری (CX22، Olympus، توکیو، ژاپن) مشاهده شد و از یک میدان تصادفی 40X از کبد هر حیوان با استفاده از نرم افزار Toup View (ToupTek Photonics، Zhejiang، چین) گرفته شد (26). یک میدان میکروسکوپی نوری در هر بخش مشاهده شد و برای شدت استئاتوز کبدی، التهاب و فیبروز بر اساس معیارهای زیر نمره-گذاری شد: برای استئاتوز کبدی: درجه صفر، بدون چربی. درجه یک، استئاتوز کمتر از 33 درصد از پارانشیم کبدی را اشغال میکند. درجه دو، 34 تا 66 درصد از پارانشیم کبدی. درجه سه، بیش از 66 درصد از پارانشیم کبدی. برای انفیلتراسیون التهاب سلولی: درجه صفر: هیچ foci/field. درجه یک، 1-2 foci/field. درجه 2، 3-4 foci/field. درجه 3، بیش از 4 foci/field. مرحله¬بندی فیبروز کبدی با رنگآمیزی Oil red O به شرح زیر بررسی شد: صفر، هیچ؛ یک، خفیف، منطقه (zone) 3، پریسینوزوئیدال (perisinusoidal)؛ دو، متوسط، منطقه 3، پریسینوزوئیدال؛ سه، پورتال/پریپورتال؛ چهار، فیبروزیس (bridging fibrosis) (27). همانگونه که در جدول 2 نشان داده شده است در نمونه¬های بیمار 1 و 2 پس از هشت هفته تغذیه با رژیم پرچرب نمره استئاتوزیس و التهاب، مقادیر سرمی ALT و AST و همچنین آنالیز بافتی کبد نشان داد که کبد رتها در مرحله دوم فیبروزیس قرار دارد. نمودار 2، وزن گروههای تحقیق پس از اثبات بیماری استئاتوهپاتیت غیرالکلی و تقسیم-بندی تصادفی آنها به چهار گروه کنترل-سالم (9=n)، سالم-شنا (9= n)، کنترل-بیمار (9= n) و بیمار-شنا (9= n)، نشان میدهد. در این نمودار هفته¬های اول و دوم جهت آشنایی و سازگاری موشهای صحرایی با محیط استخر و نوع تمرین در نظر گرفته شد. هفتههای یک تا هشت، بازه تمرین اصلی مطابق پروتکل ارائه شده بود و هفته نهم، هفته تشریح موش-های صحرایی گروههای آزمایش بود. بر اساس میانگین وزن هر گروه در کل دوره مداخله تمرینی، مشخص شد که بین گروه-های کنترل-سالم و سالم- شنا (0/003≥P) و بین گروههای کنترلبیمار و سالم-شنا (0/002≥P) تفاوت معنیدار وجود دارد. میان گروه¬ سالم-شنا با بیمار-شنا کاهش غیر معنیدار (P≥0/092) مشاهده شد. بر اساس نتایج آزمون تحلیل واریانس یکطرفه، میتوان گفت تفاوت معنیداری بین میانگین متغیر PPARα (P≤0/001، )3،8)F= 66/455) ، درگروههای تحقیق وجود داشت. با توجه به نتایج آزمون تعقیبی بونفرونی، نتایج شکل 3 و نمودار 3، در پروتئین PPAR-α بافت کبد، بین گروه کنترل-سالم با گروههای کنترل-بیمار (0/001≥P)، بیمار-شنا (0/001≥P) و همچنین در گروه سالم-شنا نسبت به گروههای کنترل-سالم (0/001≥P)، کنترل-بیمار (0/002≥P) و بیمار-شنا (0/004≥P) افزایش معنیدار وجود دارد. با این وجود در گروه بیمار-شنا نسبت به گروه کنترل-بیمار افزایش غیرمعنیداری (0/9≤P) در این پروتئین بافتی کبد مشاهده شد. در شکل 3، یافتههای مربوط به اندازهگیری پروتئین PPAR-α از روش تکنیک وسترن بلات بهصورت کیفی گزارش شده است. در این شکل از هر گروه آزمایش، سه نمونه بافت کبد انتخاب شد و اندازهگیری پروتئین PPAR-α نسبت به بتااکتین مورد سنجش و مقایسه قرار گرفت. بزرگی اندازه پهنا و تیرگی هر باند نسبت به بتااکتین نشاندهنده افزایش غلظت پروتئین یاد شده در نمونههای موردنظر است. بر اساس نتایج آزمون تحلیل واریانس یکطرفه، میتوان گفت تفاوت معنیداری بین میانگین متغیرهای AST (P≤0/001، )3،28)F= 87/509)، ALT (P≤0/001، )3،28)F=159/528)، GGT ( P≤0/001، )3،28)F=11/167(، ، درگروههای تحقیق وجود داشت. با توجه به نتایج آزمون تعقیبی بونفرونی و نمودار 4 و 5، در متغیرهای AST و ALT، در گروه کنترل-سالم نسبت به گروه¬های سالم-شنا (AST: P≤0/001)(ALT: P≤0/001) ، بیمار-شنا (AST: P≤0/001)(ALT: P≤0/001) و کنترل-بیمار (AST: P≤0/001)(ALT: P≤0/001)، کاهش معنی-دار و گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار (AST: P≤0/001)(ALT: P≤0/001)، و گروه سالم-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار (AST: P≤0/001)(ALT: P≤0/001(، وجود داشت (0/05≥P).
بر اساس نمودار 6، در متغیر GGT، افزایش معنیدار در گروه کنترل-بیمار نسبت به گروه کنترل-سالم (0/001≥P) و کاهش معنیدار در گروه سالم-شنا نسبت به گروه بیمار-کنترل (0/001≥P) و همچنین کاهش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا (0/044≥P) وجود داشت.

نمودار 1: انحراف معیار ± میانگین تغییرات وزن گروههای سالم و رژیم پرچرب در هشت هفته اول القا کبد چرب، در ابتدا یک هفته بهعنوان سازگاری رتها با محیط آزمایشگاه و رژیم غذایی در نظر گرفته شد.
جدول 2: نتایج آزمایش بافتی و خونی جهت اثبات بیماری استئاتوهپاتیت غیرالکلی


شکل1: مقایسه نمای ظاهری کبد چرب (سمت راست) و کبد سالم (سمت چپ)، بلافاصله پس از کشتار در گروه بیمار و سالم

شکل2: رنگ آمیزی بافت کبد توسط Oil red O، A: کبد چرب، لیپیدها به رنگ قرمز درآمده¬اند. B: کبد سالم- به دلیل عدم وجود چربی هیچ نوع رنگ قرمزی به خود نگرفته است.

نمودار 2: انحراف معیار ± میانگین تغییرات وزن چهار گروه آزمایش در هشت هفته دوم پس از اثبات بیماری استئاتوهپاتیت غیرالکلی، در ابتدا دو هفته بهعنوان سازگاری رتها با محیط تمرین در نظر گرفته شد و سپس از هفتههای یک تا هشت تمرین اصلی مطابق پروتکل تمرینی انجام شد. هفته نهم، هفته تشریح رتها بود.

شکل3: مقایسه باندهای شکل گرفته پروتئین PPAR-α نسبت به بتااکتین در 12 نمونه بافت کبد (از هر گروه آزمایش، سه نمونه انتخاب شدند) در روش وسترن بلات

نمودار3: غلظت پروتئین PPAR-α در گروههای آزمایش. *: افزایش معنیدار PPAR-α در گروه سالم-شنا نسبت به دو گروه بیمار-شنا و کنترل-بیمار (0/05≥P). گروه کنترل سالم بهعنوان گروه کنترل، عدد یک در نظر گرفته شده است.

نمودار 4: نتایج تحقیق در متغیر AST سرم، *: کاهش معنیدار در گروه کنترل-سالم نسبت به گروههای سالم-شنا، کنترل-بیمار و بیمار- شنا (0/001≥P)، #: کاهش معنیدار در گروه سالم-شنا نسبت به کنترل-بیمار، ##:کاهش معنیدار گروه بیمار-شنا نسبت به کنترل- بیمار (0/001≥P).

نمودار 5: نتایج تحقیق در متغیر ALT سرم، *: کاهش معنیدار در گروه کنترل-سالم نسبت به گروههای سالم-شنا، کنترل-بیمار و بیمار- شنا (01/001≥P)، #: کاهش معنی¬دار در گروه سالم-شنا نسبت به کنترل-بیمار، ##:کاهش معنیدار در گروه بیمار-شنا نسبت به کنترل- بیمار (0/001≥P).

نمودار6 : نتایج تحقیق در متغیر GGT: *:افزایش معنیدار گروه کنترل-بیمار نسبت به کنترل-سالم (001/0≥P)، #: کاهش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا (0/044≥P) و کنترل-بیمار (0/001≥P)
بحث
تحقیق حاضر با هدف بررسی تاثیر هشت هفته تمرینات تناوبی شنا با شدت بالا بر پروتئین PPAR-α بافت کبد و آنزیمهای کبدی در سرم خون موشهای صحرایی نر مبتلا به استئاتوهپاتیت غیرالکلی (NΑSH) انجام شد. یافتهها نشان دادند که میانگین وزن در گروه سالم-شنا کاهش معنیداری نسبت به گروههای کنترل-بیمار و سالم-شنا داشت. در پروتئین PPAR-α بافت کبد، افزایش معنیدار این پروتئین در گروه سالم-شنا نسبت به گروههای بیمار-شنا و کنترل-بیمار مشاهده شد. همچنین در گروه بیمار-شنا نسبت به گروه کنترل-بیمار در میزان این پروتئین افزایش غیرمعنیدار بود. همسو با نتایج پژوهش حاضر میتوان به Diniz و همکاران (2021) اشاره کرد. آنها به دنبال 12 هفته رژیم پرچرب در موش¬ها و هشت هفته فعالیت ورزشی هوازی روی تردمیل به این نتیجه رسیدند
که فعالیت ورزشی هوازی باعث افزایش در سطح پروتئین PPAR-α میشود. همچنین رژیم غذایی پرچرب و افزایش استئاتوزیس کبدی، باعث کاهش معنیدار این پروتئین در گروه بیمار بیتحرک شد. آنها این تغییرات را ناشی از افزایش مکانیسم سیگنالدهی AMPK-PPAR-α دانستند که بر اثر سازگاری با ورزش افزایش مییابد (28). با انجام فعالیت ورزشی، میزان فعالیت AMPK بالا میرود. AMPK یک حسگر حالت انرژی درون سلولی است که با نسبتهای بالای AMP بهATP (مثلاً در طول ناشتایی شبانه و یا در حالت فعالیت ورزشی) فعال میشود (29). این عامل فعال شده چندین اثر مهم در بهبود استئاتوهپاتیت غیرالکلی دارد. از جمله میتوان به فعالسازی پروتئین PPAR-α اشاره کرد و موجب افزایش غلظت آن پروتئین میشود. PPAR-α از راه افزایش بیان پروتئینهای ناقل و آنزیمهای تجزیهکننده اسیدهای چرب سبب افزایش و تنظیم متابولیسم میشود (30). از سوی دیگر ناهمسو با نتایج تحقیق حاضر؛ در تحقیق Nikroo و همکاران (2020)، پروتئینهای PPAR-α و SIRT1 افزایش غیرمعنیدار در گروه ورزش نسبت به گروه کنترل داشتند (31). این در حالی است که در تحقیق حاضر در گروه سالم-شنا پروتئین PPAR-α نسبت به سایر گروهها افزایش معنیدار داشت و از طرف دیگر در متغیر وزن، این گروه نسبت به سایر گروهها کاهش معنیدار دیده شد. بر اساس دیگر یافتههای پژوهش حاضر، پس از هشت هفته فعالیت تناوبی شنا با شدت بالا افزایش غیرمعنیدار در سطح پروتئین PPAR-α در گروه بیمار-شنا نسبت به گروه کنترل-بیمار مشاهده شد. نتایج مربوط به پروتئین PPAR-α در این مطالعه تقریباً با یافتههای ارائه شده در مطالعه Zhang و همکاران (2018)، Jinkyung Cho و همکاران (2014)، در تضاد بود (32,33). Zhang و همکاران (2018)، بیان کردند که بهدنبال شش هفته تمرین هوازی با رژیم کتوژنیک؛ ژنهای مصنوعی PPAR-γ و سطح لیپید کاهش مییابد و بیان ژن PPAR-α و بتااکسیداسیون لیپید افزایش مییابد. افزایش قابل توجه PPAR-α به این دلیل است که ورزش هوازی با رژیم کتوژنیک ترکیب شده بود. اما در این مطالعه تأثیر مستقل تمرینات ورزشی مورد بررسی قرار گرفت و موشها تا پایان مطالعه بدون پیروی از رژیمهای غذایی دیگر (مانند رژیمهای کتوژنیک و کم کالری) با رژیم غذایی پرچرب (HFD) تغذیه شدند (33). Jinkyung Cho و همکاران (2014)، پس از 15 هفته پیگیری HFD، اثرات هشت هفته تمرین ورزشی هوازی (دویدن روی تردمیل، پنج روز در هفته، هر جلسه 55 دقیقه با شیب پنج درجه) را بر روی موشهای C57BL/6 مبتلا به NAFLD مورد مطالعه قرار دادند. آنها به این نتیجه رسیدند که بیان PPARα کبدی بهطور قابلتوجهی در موشهای HFD و رژیم غذایی پرچرب+ورزش (HFD+EX) در مقایسه با موشهای معمولی کاهش یافت که از این نظر با نتایج مطالعه حاضر همسو است، با اینحال موشهای HFD + EX مقادیر قابل توجه بالاتری از بیان PPARα در مقایسه با موشهای HFD داشتند که با نتایج مطالعه حاضر در تناقض است. دلایل تفاوت بین یافتههای مطالعه آنها و یافتههای مطالعه حاضر ممکن است نوع تمرین (تمرینات تناوبی با شدت بالا در آب در برابر تمرینات هوازی تداومی بر روی تردمیل)، شدت تمرین (شدت بالا در برابر شدت متوسط)، حجم تمرین (سه روز در هفته و هر جلسه به مدت 30 دقیقه در برابر پنج روز در هفته و هر جلسه بهمدت 55 دقیقه) و طول دوره NAFLD ناشی از HFD (17 هفته در مقابل 15 هفته) باشند (32). فعال شدن PPAR-α در کبد منجر به افزایش اکسیداسیون اسیدهای چرب آزاد در فعالیتهای میتوکندری، پراکسیزومی و میکروزومی و هم-چنین کاهش تجمع چربی کبدی در طول پیشرفت NAFLD میشود و از استئاتوز جلوگیری میکند (34,35). در همین حال، آزاد شدن کلسیم بهدنبال انجام فعالیت ورزشی و انقباض عضلانی منجر به فعال شدن کالمودولین، کلسینورین و کالمودولین کیناز میشود و در عین حال بیان ژن SIRT1 و PGC-1α را افزایش میدهد. این پروتئینهای بالادست منجر به فعالسازی PPAR-α میشوند و باعث افزایش اکسیداسیون لیپید و اسیدهای چرب موجود در میتوکندری و کاهش ذخیره چربی در کبد میشوند (36،37). موشهایی که روزانه 40 دقیقه ورزش شنا کردند در مقایسه با موشهای غیرفعال، بیان SIRT1، PGC-1α و AMPK بالاتری در عضله گاستروکنمیوس داشتند. همچنین نشان داده شد که ورزش باعث افزایش محتوای SIRT1، PGC-1α، AMPK و پروتئین کیناز فعال شده با میتوژن (MAPK) میشود (37). همچنین نشان داده شده است که PPAR-α منجر به کاهش ApoC3میگردد و هیدرولیز LDL را مهار میکند و منجر به کاهش لیپیدها به واسطه فعالیت لیگاندهای PPAR-α می-گردد (38). علاوه بر این، PPAR-α از پیشرفت استئاتوز ساده به سمت NASH جلوگیری میکند. همچنین پروتئینهای التهابی را عمدتاً از طریق فعالیت ضدالتهابی قوی در کبد و مهار بیان ژن عوامل التهابی تنظیم میکند (39). در متغیرهای AST و ALT، بین گروه کنترل-سالم با گروههای کنترل-بیمار، بیمار-شنا و سالم-شنا کاهش معنیدار و همچنین بین گروههای بیمار-شنا و سالم-شنا با گروه کنترل-بیمار کاهش معنیدار مشاهده شد. در متغیر GGT، گروه کنترل-بیمار نسبت به گروه کنترل-سالم افزایش معنیدار و گروه سالم-شنا نسبت به کنترل-بیمار و هم¬چنین گروه سالم-شنا نسبت به بیمار-شنا کاهش معنی¬دار داشت. با اینحال در این متغیر گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش غیرمعنیدار مشاهده شد. همسو با نتایج تحقیق حاضر میتوان به پژوهش Batatinha و همکاران (2017) اشاره کرد. آنها بهدنبال هشت هفته فعالیت ورزشی هوازی بر موشهای C57BL6 القا شده به NAFLD توسط رژیم غذایی پرچرب، کاهش معنیدار آنزیم AST را در گروه بیمار-تمرین نسبت به گروه بیمار بیتحرک نتیجه گرفتند (40). Nikroo و همکاران (2020)، پس از 12 هفته القا بیماری استئاتوزیس از طریق رژیم غذایی پرچرب، به این نتیجه رسیدند که فعالیت ورزشی باعث کنترل وزن میشود. همچنین ورزش باعث کاهش معنیدار ALT و AST سرم نسبت به گروه کنترل در موشهای صحرایی تحقیق آنها شد (31). Liu و همکاران (2019)، مکانیسم اساسی تمرین هوازی با شدت متوسط (صفر درجه شیب، 5/2 متر در دقیقه، یک ساعت در روز و پنج روز در هفته برای مجموع هشت هفته) روی بافتهای کلیه و کبد در موشهای دیابتی db/db مورد بررسی قرار دادند. در پایان دوره تمرین به این نتیجه رسیدند که متغیرهای ALT و AST در گروه تمرین نسبت به بیمار بیتحرک کاهش معنی-دار یافتهاند. همچنین فعالیت ورزشی باعث کاهش وزن در گروه ورزش شده بود (41). Hajighasem و همکاران (2018)، بهطور تصادفی موشهای NAFLD ناشی از شش هفته HFD، به مدت هشت هفته تحت تمرینات تداومی و تناوبی قرار دادند. نتایج نشان داد که متغیرهای ALT و AST در گروههای تمرین+رزوراترول و تمرین ورزشی کاهش معنی-داری نسبت به گروه بیمار بیتحرک و سالم بیتحرک تجربه کردند. همچنین کاهش وزن در گروههای تمرین و تمرین+مکمل نسبت به بیمار بیتحرک و سالم بیتحرک به-طور معنیدار مشهود بود (42). آلانین آمینوترانسفراز (ALT) که عمدتاً در کبد یافت میشود بهعنوان شاخصی برای آسیب کبدی استفاده میگردد و در تحقیق حاضر در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش معنیدار داشت. این یافته نشان میدهد که علیرغم عدم محدودیت کالریک الگوی، شدت و مدت پروتکل ورزشی به کبد که منبع اصلی ALT است؛ نهتنها آسیبی وارد نکرده است بلکه در شرایط بیماری استئاتوهپاتیت غیرالکلی باعث بهبود آن شده است. در این راستا میتوان به نتایج تحقیقات Davries و همکاران (2008) و Sreenivasa و همکاران (2006) و Nuri و همکاران (2012) اشاره کرد (45-43). میکائیل و همکاران (2012)، تاثیر 12 هفته فعالیت ورزشی هوازی را بر شاخصهای بیوشیمیایی و آنزیمهای ALT و GGT کبد در زنان و مردان مبتلا به NAFLD بررسی کردند و به این -نتیجه رسیدند علیرغم کاهش معنیدار وزن آزمودنیها پس از دوره تمرین تفاوت معنیدار در آنزیم ALT مشاهده نشد؛ اما کاهش معنیدار در آنزیم GGT در گروه مردان یافت شد. این در حالی است که در تحقیق حاضر نیز گروه سالم-شنا نسبت به گروه کنترل-بیمار در متغیر GGT کاهش معنیداری تجربه کرد اما در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش غیرمعنیدار مشاهده شد. از جمله دلایل این عدم معنیداری را میتوان به تداوم رژیم پرچرب 77 درصد تا پایان دوره تحقیق برای گروه بیمار-شنا و کنترل-بیمار اشاره کرد. این نتیجه بیان میکند که با وجود عدم محدودیت کالریک؛ تمرینات تناوبی شنا با شدت بالا میتوانند بر کاهش آنزیم GGT به-عنوان یک نشانگر بیماری کبد چرب تاثیر داشته باشند. Uadia و همکاران (2016)، به بررسی تأثیر فعالیت بدنی و انعطافپذیری بر سطوح پلاسمایی برخی آنزیمهای کبدی در جوان نیجریهای پرداختند. یافتههای آنها نشان داد که نسبت به قبل از دوره تمرین متغیر AST افزایش معنیدار و متغیرهای ALT و GGT عدم معنیداری را از خود نشان دادند. از جمله دلایل تناقض یافتههای تحقیق آنها با یافتههای تحقیق حاضر میتوان به نوع آزمودنیها (موشهای صحرایی مبتلا به استئاتوهپاتیت غیرالکلی ناشی از رژیم پرچرب در برابر آزمودنی¬های سالم و جوان)، نوع پروتکل تمرینی (فعالیت تناوبی شنا با شدت بالا در برابر فعالیت بدنی با شدت کم) و مدت پروتکل تمرینی (هشت هفته در برابر شش هفته) اشاره کرد (17). این درحالی است که در تحقیق حاضر گروه بیمار-شنا نسبت به گروه کنترل-بیمار کاهش معنیدار در آنزیمهای GGT، ALT و AST داشت. این یافته نشان میدهد با وجود عدم محدودیت کالریک و مصرف دائم رژیم پرچرب، به واسطه انجام فعالیت ورزشی تناوبی شنا با شدت بالا از افزایش آنزیمهای کبد جلوگیری و حتی باعث کاهش آنها در بیماری استئاتوهپاتیت غیرالکلی شد. در مطالعه حاضر کاهش وزن، کاهش سطوح آمینوترانسفراز سرم و همچنین تغییرات افزایشی غلظت پروتئین PPAR-α در گروه سالم-شنا نسبت به سایر گروهها پس از هشت هفته شنای تناوبی با شدت بالا معنیدار بود؛ اما در گروه بیمار-شنا نسبت به کنترل-بیمار کاهش آمینوترانسفراز سرم کاهش معنیدار و غلظت پروتئین PPAR-α افزایش غیرمعنیدار داشت. یکی از دلایل اصلی نتایج بدست آمده به این خاطر است که در تحقیق حاضر رژیم غذایی پرچرب تا پایان تمرینات بدون محدودیت کالریک برای گروههای بیمار-شنا و کنترل-بیمار ادامه داشت تا تنها تاثیر ورزش شنای تناوبی با شدت بالا بر سطح پروتئین PPAR-α کبدی در بیماری استئاتوهپاتیت غیرالکلی مورد سنجش قرار گیرد. با اینحال این مدل تمرین با وجود عدم محدودیت کالریک بر کاهش معنیدار آنزیمهای موثر کبدی (ALT،AST و GGT) در گروههای تمرین سالم-شنا نسبت به کنترل-بیمار و کنترل-سالم و بیمار-شنا نسبت به کنترل-بیمار موثر بوده است. به نظر میرسد با افزایش حجم نمونه و مدت زمان تمرین، تغییرات قابلتوجهی در پروتئین PPARα نیز رخ دهد و منجر به بهبود بیشتر بیماری استئاتوهپاتیت غیرالکلی ناشی از مصرف رژیم پرچرب شود. همچنین، مطالعات بیشتری نیز برای کشف مسیرهای مولکولی و مکانیسمهای درگیر مورد نیاز است.
نتیجهگیری
نتایج مطالعه حاضر بر روی موشهای صحرایی ناشی از بیماری استئاتوهپاتیت غیرالکلی ناشی از مصرف رژیم غذایی پرچرب نشان داد که هشت هفته تمرینات شنای تناوبی با شدت بالا در گروه بیمار-شنا نسبت به کنترل-بیمار علیرغم عدم تفاوت معنیدار در وزن این دو گروه باعث کاهش معنیدار در آنزیمهای کبدی (ALT، AST و GGT) که بهعنوان نشانگرهای عمومی بیماری استئاتوهپاتیت غیرالکلی میشوند، شد با این وجود منجر به کاهش غیرمعنیدار پروتئین PPARα گشت. این نتایج نشان میدهد علیرغم عدم محدودیت کالریک، این مدل تمرینات مستقل از کاهش وزن میتواند علائم عمومی بیماری استئاتوهپاتیت غیرالکلی از جمله آنزیمهای کبدی را کاهش دهد با اینحال تاثیر قابلتوجهی بر پروتئین PPARα نداشت و پیشنهاد میشود در مطالعات آتی مدت پروتکل تمرین و یا شدت آن و یا هر دو را افزایش داد. از طرف دیگر هشت هفته تمرینات تناوبی شنا با شدت بالا موجب کاهش معنیدار وزن آنزیمهای کبدی در گروه سالم-شنا نسبت به گروههای کنترلسالم و کنترل-بیمار شد. این یافتهها نشان میدهد که این مدل تمرین در آزمودنیهای سالم نیز بسیار اثرگذار است و میتواند باعث جلوگیری از ابتلا به بیماریهای متابولیکی از جمله کبد چرب نسبت به افراد بیتحرک شود. همچنین در پروتئین PPARα نیز افزایش معنیدار در گروه سالم-شنا نسبت به بیمار-شنا و کنترل-بیمار نشان میدهد که این مدل تمرین میتواند پویایی و فعالیت متابولیسم لیپید را بسیار تحت تاثیر مثبت قرار دهد و موجب جلوگیری فرد از ابتلا به بیماری استئاتوهپاتیت غیرالکلی شود.
سپاسگزاری
از تمامی کسانی که ما را در اجرای این پایاننامه دکتری یاری رساندند، نهایت تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارد.
References:
1- Fabbrini E, Sullivan S, Klein S. Obesity and Nonalcoholic Fatty Liver Disease: Biochemical, Metabolic, and Clinical Implications. J Hepatol 2010; 51(2): 679-89.
2- Fan JG, Farrell GC. Epidemiology of Non-Alcoholic Fatty Liver Disease in China. J Hepatol 2009; 50(1): 204-10.
3- Schultz A, Mendonca LS, Aguila MB, Mandarim-de-Lacerda CA. Swimming Training Beneficial Effects in a Mice Model of Nonalcoholic Fatty Liver Disease. Exp Toxicol Pathol 2010; 64(4): 273-82.
4- Steensels S, Qiao J, Ersoy BA. Transcriptional Regulation in Non-Alcoholic Fatty Liver Disease. Metabolites 2020; 10(7): 283.
5- Souza-Mello V. Peroxisome Proliferator-Activated Receptors as Targets to Treat Non-Alcoholic Fatty Liver Disease. WJH 2015; 7(8): 1012.
6- Kersten S, Stienstra R. The Role and Regulation of the Peroxisome Proliferator Activated Receptor Alpha in Human Liver. J Biochem 2017; 136: 75-84.
7- Lee S, Pineau T, Drago J, Lee EJ, Owens JW, Kroetz DL, et al. Targeted Disruption of the Alpha Isoform of the Peroxisome Proliferator-Activated Receptor Gene in Mice Results in Abolishment of the Pleiotropic Effects of Peroxisome Proliferators. J Mol Cell Biol 1995; 15(6): 3012-22.
8- Francque S, Verrijken A, Caron S, Prawitt J, Paumelle R, Derudas B, et al. Pparα Gene Expression Correlates with Severity and Histological Treatment Response in Patients with Non-Alcoholic Steatohepatitis. J Hepatol 2015; 63(1): 164-73.
9- Zhang H, He Y, Chung PK, Tong TK, Fu FH, Chen Y, et al. Effects of 12 Weeks of Exercise on Hepatic TNF-Α and Pparα in an Animal Model of High-Fat Diet-Induced Nonalcoholic Steatohepatitis. JESF 2009; 7(1): 18-23.
10- Oh S, So R, Shida T, Matsuo T, Kim B, Akiyama K, et al. High-Intensity Aerobic Exercise Improves both Hepatic Fat Content and Stiffness in Sedentary Obese Men with Nonalcoholic Fatty Liver Disease. Sci Rep 2017; 7: 43029.
11- Patel NS, Doycheva I, Peterson MR, Hooker J, Kisselva T, Schnabl B, et al. Effect of Weight Loss on Magnetic Resonance Imaging Estimation of Liver Fat and Volume in Patients with Nonalcoholic Steatohepatitis. Clin Gastroenterol Hepatol 2015; 13(3): 561-8.
12- Hallsworth K, Adams LA. Lifestyle Modification in NAFLD/NASH: Facts and Figures. JHEP Rep 2019; 1(6): 468-79.
13- Hamasaki H. Perspectives on Interval Exercise Interventions for Non-Alcoholic Fatty Liver Disease. J Med 2019; 6(3): 83.
14- Abdelbasset WK, Tantawy SA, Kamel DM, Alqahtani BA, Soliman GS. A Randomized Controlled Trial on The Effectiveness of 8-Week High-Intensity Interval Exercise on Intrahepatic Triglycerides, Visceral Lipids, and Health-Related Quality of Life in Diabetic Obese Patients with Nonalcoholic Fatty Liver Disease. J Med 2019; 98(12): e14918.
15- Winn NC, Liu Y, Rector RS, Parks EJ, Ibdah JA, Kanaley JA. Energy-Matched Moderate and High Intensity Exercise Training Improves Nonalcoholic Fatty Liver Disease Risk Independent of Changes in Body Mass or Abdominal Adiposity—A Randomized Trial. Metabolism 2018; 78: 128-40.
16- Houghton D, Thoma C, Hallsworth K, Cassidy S, Hardy T, Burt AD, et al. Exercise Reduces Liver Lipids and Visceral Adiposity in Patients with Nonalcoholic Steatohepatitis in a Randomized Controlled Trial. Clin Gastroenterol Hepatol 2017; 15(1): 96-102.
17- Uadia P, Orumwensodia K, Arainru G, Agwubike E, Akpata C. Effect of Physical and Flexibility Exercise on Plasma Levels of Some Liver Enzymes and Biomolecules of Young Nigerian Adults. Trop J Pharm Res 2016; 15(2): 421-5.
18- Nagle EF, Sanders ME, Franklin BA. Aquatic High Intensity Interval Training for Cardiometabolic Health: Benefits and Training Design. Am J Lifestyle Med 2017; 11(1): 64-76.
19- Igarashi Y, Nogami Y. Response of Lipids and Lipoproteins to Regular Aquatic Endurance Exercise: A Meta-Analysis of Randomized Controlled Trials. JAT 2019; 26(1): 14-30.
20- Kasprzak Z, Pilaczyńska-Szcześniak Ł. Effects of Regular Physical Exercises in the Water on the Metabolic Profile of Women with Abdominal Obesity. J Hum Kinet 2014; 41(1): 71-9.
21- Kurobe K, Kousaka A, Ogita F, Matsumoto N. Metabolic Responses to Exercise on Land and in Water Following Glucose Ingestion. Clin Physiol Funct 2018; 38(2): 227-32.
22- Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, et al. High-Fat Emulsion-Induced Rat Model of Nonalcoholic Steatohepatitis. Life Sci 2006; 79(11): 1100-7.
23- Farzanegi P, Habibian M, Alinejad H. The Combined Effect of Regular Aerobic Exercise with Garlic Extract on Renal Apoptosis Regulatory Factors iin Aged Rats with Chronic Kidney Disease. AMUJ 2016; 19(3): 62-70. [Persian]
24- Ramos-Filho D, Chicaybam G, de-Souza-Ferreira E, Guerra Martinez C, Kurtenbach E, Casimiro-Lopes G, et al. High Intensity Interval Training (HIIT) Induces Specific Changes in Respiration and Electron Leakage in the Mitochondria of Different Rat Skeletal Muscles. PloS one 2015; 10(6): e0131766.
25- Shafiee A, Gaeini A, Soleimani M, Nekouei A, Hadidi V. The Effect of Eight Week of High Intensity Interval Training on Expression of Mir-210 and Ephrina3 Mrna in Soleus Muscle Healthy Male Rats. AMUJ 2014; 17(3): 26-34. [Persian]
26- Chen B, Ma Y, Xue X, Wei J, Hu G, Lin Y. Tetramethylpyrazine Reduces Inflammation in the Livers of Mice Fed a High Fat Diet. Mol Med Rep 2019; 19(4): 2561-8.
27- Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Design and Validation of a Histological Scoring System for Nonalcoholic Fatty Liver Disease. J Hepatol 2005; 41(6): 1313-21.
28- Diniz TA, de Lima Junior EA, Teixeira AA, Biondo LA, da Rocha LAF, Valadão IC, et al. Aerobic Training Improves NAFLD Markers And Insulin Resistance Through AMPK-PPAR-Α Signaling In Obese Mice. Life Sci 2021; 266: 118868.
29- Ren L, Sun D, Zhou X, Yang Y, Huang X, Li Y, et al. Chronic Treatment with the Modified Longdan Xiegan Tang Attenuates Olanzapine-Induced Fatty Liver in Rats by Regulating Hepatic De Novo Lipogenesis and Fatty Acid Beta-Oxidation-Associated Gene Expression Mediated by SREBP-1c, PPAR-Alpha and AMPK-Alpha. J Ethnopharmacol 2019; 232: 176-87.
30- Sozio MS, Liangpunsakul S, Crabb D, editors. The Role of Lipid Metabolism in the Pathogenesis of Alcoholic and Nonalcoholic Hepatic Steatosis. Semin Liver Dis 2010; 30(4): 378-90.
31- Nikroo H, Hosseini SRA, Fathi M, Sardar MA, Khazaei M. The Effect of Aerobic, Resistance, and Combined Training on PPAR-Α, SIRT1 Gene Expression, and Insulin Resistance in High-Fat Diet-Induced NAFLD Male Rats. Physiol Behav 2020; 227: 113149.
32- Cho J, Lee I, Kim D, Koh Y, Kong J, Lee S, et al. Effect of Aerobic Exercise Training on Non-Alcoholic Fatty Liver Disease Induced by a High Fat Diet in C57BL/6 Mice. J Nutr Biochem 2014; 18(4): 339-46.
33- Zhang Q, Xu L, Xia J, Wang D, Qian M, Ding S. Treatment of Diabetic Mice with a Combination of Ketogenic Diet and Aerobic Exercise Via Modulations of Ppars Gene Programs. PPAR Res 2018; 32(5): 245-56.
34- Mandard S, Müller M, Kersten S. Peroxisome Proliferator-Activated Receptor Α Target Genes. Cell Mol Life Sci 2004; 61(4): 393-416.
35- Ip E, Farrell G, Hall P, Robertson G, Leclercq I. Administration of the Potent Pparα Agonist, Wy‐14,643, Reverses Nutritional Fibrosis and Steatohepatitis in Mice. J Hepatol 2004; 39(5): 1286-96.
36- Radak Z, Koltai E, Taylor AW, Higuchi M, Kumagai S, Ohno H, et al. Redox-Regulating Sirtuins In Aging, Caloric Restriction, And Exercise. Free Radic Biol Med 2013; 58: 87-97.
37- Huang CC, Wang T, Tung YT, Lin WT. Effect of Exercise Training on Skeletal Muscle SIRT1 and PGC-1α Expression Levels in Rats of Different Age. Int J Med Sci 2016; 13(4): 260-70.
38- Contreras AV, Torres N, Tovar AR. PPAR-Α as a Key Nutritional and Environmental Sensor For Metabolic Adaptation. Adv Nutr 2013; 4(4): 439-52.
39- Gregoire F, Kersten S, Harrington W. PPARS and Obesity. PPAR Res 2007; 2007: 78475.
40- Batatinha HAP, Lima EA, Teixeira AAS, Souza CO, Biondo LA, Silveira LS, et al. Association between Aerobic Exercise and Rosiglitazone Avoided the NAFLD and Liver Inflammation Exacerbated in PPAR-α Knockout Mice. J Cell Physiol 2017; 232(5): 1008-19.
41- Liu HW, Kao HH, Wu CH. Exercise Training Upregulates SIRT1 to Attenuate Inflammation and Metabolic Dysfunction in Kidney and Liver of Diabetic Db/Db Mice. Nutr Metab 2019; 16(1):22.
42- Hajighasem A, Farzanegi P, Mazaheri Z, Naghizadeh M, Salehi G. Effects of Resveratrol, Exercises and their Combination on Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Gene Expression and Apoptosis in the Liver of Elderly Rats With Nonalcoholic Fatty Liver. Peer J 2018; 6: e5522.
43- Devries MC, Samjoo IA, Hamadeh MJ, Tarnopolsky MA. Effect of Endurance Exercise on Hepatic Lipid Content, Enzymes, and Adiposity in Men and Women. J Obes 2008; 16(10): 2281-8.
44- Baba CS, Alexander G, Kalyani B, Pandey R, Rastogi S, Pandey A, et al. Effect of Exercise and Dietary Modification on Serum Aminotransferase Levels in Patients with Nonalcoholic Steatohepatitis. JGH 2006; 21(1): 191-8.
45- Nuri R, Mahmudieh B, Akochakian M, Moghaddasi M. Effect of 15 Weeks Combination Exercise Training on Lipid Profile and Fatty Liver Indices in Postmenopausal Women with Breast Cancer. Braz J Biomotricity 2012; 6(4): 297-303.
1- Fabbrini E, Sullivan S, Klein S. Obesity and Nonalcoholic Fatty Liver Disease: Biochemical, Metabolic, and Clinical Implications. J Hepatol 2010; 51(2): 679-89.
2- Fan JG, Farrell GC. Epidemiology of Non-Alcoholic Fatty Liver Disease in China. J Hepatol 2009; 50(1): 204-10.
3- Schultz A, Mendonca LS, Aguila MB, Mandarim-de-Lacerda CA. Swimming Training Beneficial Effects in a Mice Model of Nonalcoholic Fatty Liver Disease. Exp Toxicol Pathol 2010; 64(4): 273-82.
4- Steensels S, Qiao J, Ersoy BA. Transcriptional Regulation in Non-Alcoholic Fatty Liver Disease. Metabolites 2020; 10(7): 283.
5- Souza-Mello V. Peroxisome Proliferator-Activated Receptors as Targets to Treat Non-Alcoholic Fatty Liver Disease. WJH 2015; 7(8): 1012.
6- Kersten S, Stienstra R. The Role and Regulation of the Peroxisome Proliferator Activated Receptor Alpha in Human Liver. J Biochem 2017; 136: 75-84.
7- Lee S, Pineau T, Drago J, Lee EJ, Owens JW, Kroetz DL, et al. Targeted Disruption of the Alpha Isoform of the Peroxisome Proliferator-Activated Receptor Gene in Mice Results in Abolishment of the Pleiotropic Effects of Peroxisome Proliferators. J Mol Cell Biol 1995; 15(6): 3012-22.
8- Francque S, Verrijken A, Caron S, Prawitt J, Paumelle R, Derudas B, et al. Pparα Gene Expression Correlates with Severity and Histological Treatment Response in Patients with Non-Alcoholic Steatohepatitis. J Hepatol 2015; 63(1): 164-73.
9- Zhang H, He Y, Chung PK, Tong TK, Fu FH, Chen Y, et al. Effects of 12 Weeks of Exercise on Hepatic TNF-Α and Pparα in an Animal Model of High-Fat Diet-Induced Nonalcoholic Steatohepatitis. JESF 2009; 7(1): 18-23.
10- Oh S, So R, Shida T, Matsuo T, Kim B, Akiyama K, et al. High-Intensity Aerobic Exercise Improves both Hepatic Fat Content and Stiffness in Sedentary Obese Men with Nonalcoholic Fatty Liver Disease. Sci Rep 2017; 7: 43029.
11- Patel NS, Doycheva I, Peterson MR, Hooker J, Kisselva T, Schnabl B, et al. Effect of Weight Loss on Magnetic Resonance Imaging Estimation of Liver Fat and Volume in Patients with Nonalcoholic Steatohepatitis. Clin Gastroenterol Hepatol 2015; 13(3): 561-8.
12- Hallsworth K, Adams LA. Lifestyle Modification in NAFLD/NASH: Facts and Figures. JHEP Rep 2019; 1(6): 468-79.
13- Hamasaki H. Perspectives on Interval Exercise Interventions for Non-Alcoholic Fatty Liver Disease. J Med 2019; 6(3): 83.
14- Abdelbasset WK, Tantawy SA, Kamel DM, Alqahtani BA, Soliman GS. A Randomized Controlled Trial on The Effectiveness of 8-Week High-Intensity Interval Exercise on Intrahepatic Triglycerides, Visceral Lipids, and Health-Related Quality of Life in Diabetic Obese Patients with Nonalcoholic Fatty Liver Disease. J Med 2019; 98(12): e14918.
15- Winn NC, Liu Y, Rector RS, Parks EJ, Ibdah JA, Kanaley JA. Energy-Matched Moderate and High Intensity Exercise Training Improves Nonalcoholic Fatty Liver Disease Risk Independent of Changes in Body Mass or Abdominal Adiposity—A Randomized Trial. Metabolism 2018; 78: 128-40.
16- Houghton D, Thoma C, Hallsworth K, Cassidy S, Hardy T, Burt AD, et al. Exercise Reduces Liver Lipids and Visceral Adiposity in Patients with Nonalcoholic Steatohepatitis in a Randomized Controlled Trial. Clin Gastroenterol Hepatol 2017; 15(1): 96-102.
17- Uadia P, Orumwensodia K, Arainru G, Agwubike E, Akpata C. Effect of Physical and Flexibility Exercise on Plasma Levels of Some Liver Enzymes and Biomolecules of Young Nigerian Adults. Trop J Pharm Res 2016; 15(2): 421-5.
18- Nagle EF, Sanders ME, Franklin BA. Aquatic High Intensity Interval Training for Cardiometabolic Health: Benefits and Training Design. Am J Lifestyle Med 2017; 11(1): 64-76.
19- Igarashi Y, Nogami Y. Response of Lipids and Lipoproteins to Regular Aquatic Endurance Exercise: A Meta-Analysis of Randomized Controlled Trials. JAT 2019; 26(1): 14-30.
20- Kasprzak Z, Pilaczyńska-Szcześniak Ł. Effects of Regular Physical Exercises in the Water on the Metabolic Profile of Women with Abdominal Obesity. J Hum Kinet 2014; 41(1): 71-9.
21- Kurobe K, Kousaka A, Ogita F, Matsumoto N. Metabolic Responses to Exercise on Land and in Water Following Glucose Ingestion. Clin Physiol Funct 2018; 38(2): 227-32.
22- Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, et al. High-Fat Emulsion-Induced Rat Model of Nonalcoholic Steatohepatitis. Life Sci 2006; 79(11): 1100-7.
23- Farzanegi P, Habibian M, Alinejad H. The Combined Effect of Regular Aerobic Exercise with Garlic Extract on Renal Apoptosis Regulatory Factors iin Aged Rats with Chronic Kidney Disease. AMUJ 2016; 19(3): 62-70. [Persian]
24- Ramos-Filho D, Chicaybam G, de-Souza-Ferreira E, Guerra Martinez C, Kurtenbach E, Casimiro-Lopes G, et al. High Intensity Interval Training (HIIT) Induces Specific Changes in Respiration and Electron Leakage in the Mitochondria of Different Rat Skeletal Muscles. PloS one 2015; 10(6): e0131766.
25- Shafiee A, Gaeini A, Soleimani M, Nekouei A, Hadidi V. The Effect of Eight Week of High Intensity Interval Training on Expression of Mir-210 and Ephrina3 Mrna in Soleus Muscle Healthy Male Rats. AMUJ 2014; 17(3): 26-34. [Persian]
26- Chen B, Ma Y, Xue X, Wei J, Hu G, Lin Y. Tetramethylpyrazine Reduces Inflammation in the Livers of Mice Fed a High Fat Diet. Mol Med Rep 2019; 19(4): 2561-8.
27- Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Design and Validation of a Histological Scoring System for Nonalcoholic Fatty Liver Disease. J Hepatol 2005; 41(6): 1313-21.
28- Diniz TA, de Lima Junior EA, Teixeira AA, Biondo LA, da Rocha LAF, Valadão IC, et al. Aerobic Training Improves NAFLD Markers And Insulin Resistance Through AMPK-PPAR-Α Signaling In Obese Mice. Life Sci 2021; 266: 118868.
29- Ren L, Sun D, Zhou X, Yang Y, Huang X, Li Y, et al. Chronic Treatment with the Modified Longdan Xiegan Tang Attenuates Olanzapine-Induced Fatty Liver in Rats by Regulating Hepatic De Novo Lipogenesis and Fatty Acid Beta-Oxidation-Associated Gene Expression Mediated by SREBP-1c, PPAR-Alpha and AMPK-Alpha. J Ethnopharmacol 2019; 232: 176-87.
30- Sozio MS, Liangpunsakul S, Crabb D, editors. The Role of Lipid Metabolism in the Pathogenesis of Alcoholic and Nonalcoholic Hepatic Steatosis. Semin Liver Dis 2010; 30(4): 378-90.
31- Nikroo H, Hosseini SRA, Fathi M, Sardar MA, Khazaei M. The Effect of Aerobic, Resistance, and Combined Training on PPAR-Α, SIRT1 Gene Expression, and Insulin Resistance in High-Fat Diet-Induced NAFLD Male Rats. Physiol Behav 2020; 227: 113149.
32- Cho J, Lee I, Kim D, Koh Y, Kong J, Lee S, et al. Effect of Aerobic Exercise Training on Non-Alcoholic Fatty Liver Disease Induced by a High Fat Diet in C57BL/6 Mice. J Nutr Biochem 2014; 18(4): 339-46.
33- Zhang Q, Xu L, Xia J, Wang D, Qian M, Ding S. Treatment of Diabetic Mice with a Combination of Ketogenic Diet and Aerobic Exercise Via Modulations of Ppars Gene Programs. PPAR Res 2018; 32(5): 245-56.
34- Mandard S, Müller M, Kersten S. Peroxisome Proliferator-Activated Receptor Α Target Genes. Cell Mol Life Sci 2004; 61(4): 393-416.
35- Ip E, Farrell G, Hall P, Robertson G, Leclercq I. Administration of the Potent Pparα Agonist, Wy‐14,643, Reverses Nutritional Fibrosis and Steatohepatitis in Mice. J Hepatol 2004; 39(5): 1286-96.
36- Radak Z, Koltai E, Taylor AW, Higuchi M, Kumagai S, Ohno H, et al. Redox-Regulating Sirtuins In Aging, Caloric Restriction, And Exercise. Free Radic Biol Med 2013; 58: 87-97.
37- Huang CC, Wang T, Tung YT, Lin WT. Effect of Exercise Training on Skeletal Muscle SIRT1 and PGC-1α Expression Levels in Rats of Different Age. Int J Med Sci 2016; 13(4): 260-70.
38- Contreras AV, Torres N, Tovar AR. PPAR-Α as a Key Nutritional and Environmental Sensor For Metabolic Adaptation. Adv Nutr 2013; 4(4): 439-52.
39- Gregoire F, Kersten S, Harrington W. PPARS and Obesity. PPAR Res 2007; 2007: 78475.
40- Batatinha HAP, Lima EA, Teixeira AAS, Souza CO, Biondo LA, Silveira LS, et al. Association between Aerobic Exercise and Rosiglitazone Avoided the NAFLD and Liver Inflammation Exacerbated in PPAR-α Knockout Mice. J Cell Physiol 2017; 232(5): 1008-19.
41- Liu HW, Kao HH, Wu CH. Exercise Training Upregulates SIRT1 to Attenuate Inflammation and Metabolic Dysfunction in Kidney and Liver of Diabetic Db/Db Mice. Nutr Metab 2019; 16(1):22.
42- Hajighasem A, Farzanegi P, Mazaheri Z, Naghizadeh M, Salehi G. Effects of Resveratrol, Exercises and their Combination on Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Gene Expression and Apoptosis in the Liver of Elderly Rats With Nonalcoholic Fatty Liver. Peer J 2018; 6: e5522.
43- Devries MC, Samjoo IA, Hamadeh MJ, Tarnopolsky MA. Effect of Endurance Exercise on Hepatic Lipid Content, Enzymes, and Adiposity in Men and Women. J Obes 2008; 16(10): 2281-8.
44- Baba CS, Alexander G, Kalyani B, Pandey R, Rastogi S, Pandey A, et al. Effect of Exercise and Dietary Modification on Serum Aminotransferase Levels in Patients with Nonalcoholic Steatohepatitis. JGH 2006; 21(1): 191-8.
45- Nuri R, Mahmudieh B, Akochakian M, Moghaddasi M. Effect of 15 Weeks Combination Exercise Training on Lipid Profile and Fatty Liver Indices in Postmenopausal Women with Breast Cancer. Braz J Biomotricity 2012; 6(4): 297-303.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1401/5/18 | پذیرش: 1401/7/17 | انتشار: 1401/10/15
دریافت: 1401/5/18 | پذیرش: 1401/7/17 | انتشار: 1401/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







