دوره 30، شماره 9 - ( آذر 1401 )
جلد 30 شماره 9 صفحات 5203-5183 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
somi M H, Tanhaei A, Abbasi A, Moaddab S Y, Ebrahimzadeh Leylabadlo H. Fecal Microbiota Transplantation in Liver Diseases and Recent Developments. JSSU 2022; 30 (9) :5183-5203
URL: http://jssu.ssu.ac.ir/article-1-5778-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5778-fa.html
صومی محمدحسین، تنهائی افسانه، عباسی امین، مودب سید یعقوب، ابراهیم زاده لیل آبادلو حامد. پیوند میکروبیوتای مدفوع در بیماریهای کبدی و پیشرفت های اخیر. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (9) :5183-5203
متن کامل [PDF 1105 kb]
(609 دریافت)
| چکیده (HTML) (2122 مشاهده)
متن کامل: (1640 مشاهده)
مقدمه
میکروبیوم انسان تحت عنوان اجتماعی از میکروبها از قبیل باکتریها، ویروسها، قارچها تعریف میشود که در بدن انسان مستقر هستند. روده بزرگترین اندام گوارشی و ایمنی بدن بوده و حاوی حدوداً 80 درصد از کل میکروبیوتای انسان است (1). بیش از 99 درصد میکروبهای موجود در روده انسان را باکتریها و سایر میکروبها از قبیل ویروسها و قارچها تشکیل میدهند (2). روده تقریباً دارای 1000 گونه باکتریایی است که هر گونه از 2000 ژن تشکیل میشود. بهطور میانگین 2 میلیون ژن در روده وجود دارد که 100 برابر بیشتر از از تعداد ژنی است که معمولاً برای انسان تخمین زده میشود (حدود 20 هزار). برخی از این باکتریها پروبیوتیک هستند اما برخی دیگر نیز پاتوژن یا بیماریزا میباشند. توازن دینامیک یا پویا (در حال تغییر) تعداد گونههای باکتریایی روده باعث حفظ توازن خود روده شده که نقشی مهم در اعمال گوارشی، متابولیک (سوخت و ساز) و ایمنی بدن انسان ایفا میکند. عواملی از قبیل رژیم غذایی، داروها، بیماری، اختلالات متابولیکی و بیماریهای خود ایمنی در برقراری توازن روده تاثیر به سزایی دارند. عدم توازن در فلور نرمال روده زمینهساز شیوع و ایجاد بسیاری از بیماری های رودهای و خارج رودهای از جمله بیماریهای کبدی، دیابت، لوسمی (سرطان خون) و سپسیس میباشد. بنابراین، تغییر و اصلاح میکروبیوتای رودهای میتواند سبب مبارزه با بیماریهایی شود که با دیس بیوزیس رودهای (عدم تعادل فلور روده) در ارتباط هستند. بسیاری از رویکردها به منظور تعدیل و تنظیم ساختار و متابولیسم میکروبیوتای روده مورد استفاده قرار گرفتهاند که از آنها میتوان به رژیم غذایی، پریبیوتیکها، پروبیوتیکها و آنتیبیوتیکها اشاره کرد (4،3). با این که روشهای فوقالذکر توانستند به یک سری از تاثیرات درمانی دست یابند، اما نتایج آن چنان که باید رضایتبخش نبود. انتقال یا پیوند میکروبیوتای مدفوعی (FMT) ممکن است به سالهای بسیار قبل و به سلسله Jin شرقی در کشور چین برگردد که حدود 1700 سال پیش از این بوده است. با اینحال این روش تنها در چندسال اخیر موفق به جلب توجه پزشکان و محققان شده است. FMT را میتوان بهعنوان یک روش یا رژیم درمانی مطمئن برای تنظیم مستقیم میکروبیوتای رودهای بر شمرد. در این روش مواد مدفوعی تغییر یافته و فرآوری شده از اهداکنندگان سالم به بیماران منتقل شده تا بدین طریق ترکیب و تنوع میکروبیوتای روده آنان اصلاح شود. اتفاقنظر گسترده و عمومی این است که FMT میتواند بهطور موفقیت آمیزی باعث درمان بیماری مقاوم و عودکننده ناشی از Clostridium difficile یا CDI شود. علاوه بر این افزایش تعداد دادهها و شواهد حاکی از آن است که FMT در بهبود و اصلاح یبوست عملی غیرقابل کنترل، بیماریهای التهاب روده (IBDs)، چاقی، دیابت نوع 2 و غیره موثر است (5). در ضمن دیس بیوزیس رودهای که در بسیاری از بیماری-های کبدی دیده میشود سبب جلب توجه به سمت پتانسیل و قدرت روش FMT در درمان بیماری¬های کبدی شده است. عدم توازن در میکروبیوتای روده ارتباط نزدیکی با شیوع، ایجاد، و پیشآگهی انواعی از بیماری-های کبدی از قبیل آسیب حاد کبدی، هپاتیت ویروسی، سیروز کبدی، بیماری خودایمنی کبد، بیماری کبد الکلی (ALD) و بیماری کبد چرب غیر الکلی (NAFLD) دارد (6،7). میزان بازده روش FMT در امر تسریع بهبودی بیماری بالاست که این را از راه بازیابی توازن عادی روده در بیماران مبتلا به اختلالات کبدی انجام میدهد (8،9). در این مقاله مروری، عمده توجه ما روی میکروبیوتای روده و ارتباط آن با انواعی از بیماریهای کبدی است. در قدم بعدی نیز در مورد مطالعات بالینی فعلی و آخرین پیشرفتهای حاصل شده در زمینه استفاده از روش FMT در بیماریهای حاد و مزمن کبدی طبق شکل 1، بحث خواهیم کرد.
روش بررسی
پژوهش مطالعه مروری حاضر با استفاده از پایگاههای علمی PubMed و Scopus انجام شد. در این پـایگـاههـا، از کلمات کلیدی همچون، gut microbiota،fecal microbiota transplantation، liver diseases، probiotic استفاده شد. براساس نتایج جستجو از سال ۲۰۱۸ تا ۲۰۲۲ میلادی مرتبط با هدف پژوهش مورد بررسی قرار گرفت.
ارتباط میکروبیوتای روده با بیماریهای کبدی
کبد بزرگترین غده هاضمه یا گوارشی محسوب شده و اندامی مهم در ایمنی بدن انسان به شمار میرود و همچنین ارتباط و تماسی نزدیک با روده دارد. مطالعات مشخص کردهاند که دیس بیوزیس روده در انواعی از بیماری های کبدی بروز میکند (7،6). در ضمن، این دیس بیوزیس روی درجه و شدت چربی کبد (استحاله چربی)، التهاب، فیبروز، و حتی ایجاد سرطان کبد نیز موثر است که این تاثیر را از راه چندین برهمکنش و ارتباط با سیستم ایمنی میزبان و سایر انواع سلولها اعمال میکند. رابطه میان بیماریهای کبدی و میکروبیوتای روده دارای مکانیسم پیچیدهای است که به خوبی مشخص و درک نشده است. بیماریهای کبدی ممکن است منجر به بههم خوردن توازن میکروبیوتای روده شوند و این عدم توازن ممکن است سبب تشدید پیشرفت بیماریهای کبدی گشته که تاثیر این بیماریها به دنبال تشدیدشان متقابلا افزایش خواهد یافت.
تغییر در میکروبیوتای روده و بیماریهای کبد
محور روده-کبد که اولین بار در سال 1987 توصیف شد، این موضوع را مطرح میکند که ارتباط بین روده و کبد یک رابطه دو طرفه و یک فرآیند چرخهای است. تحت شرایط فیزیولوژیک، کبد اسیدهای صفراوی (BAs) و سایر ترکیبات فعال زیستی را به درون روده ترشح کرده تا به جذب و متابولیسم روده کمک کند.
.jpg)
شکل1: استراتژیها و تدابیر اتخاذ شده به منظور بررسی میکروبیوم روده در بیماریهای کبدی. تعدیل و اصلاح میکروبیوتای روده و درمان آن ممکن است نتایج خوبی را در بیماران مبتلا به بیماریهای کبدی در بر داشته باشد. GLP1: آگونیست پپتید1 شبهگلوکان، FXR: گیرنده فارنزوئید X، TGR5: گیرنده شماره 5 ادغام شده با پروتئین Takeda G، FGF19: فاکتور 19 رشد فیبروبلاست، HSC: سلول ستارهای کبد LSEC: سلول اندوتلیال سینوسی کبد.
طی این فرآیند، علاوه بر کبد و متابولیتهای رودهای، اگزوتوکسینها نیز با خون از راه سیستم ورودی به کبد وارد میشوند که این عمل روی هومئوستاز (تعادل) سیستمیک بدن میزبان موثر است. در انسانهای سالم، روده عمدتاً از اپی تلیوم مخاطی رودهای، مخاط روده، و فلور طبیعی روده تشکیل شده و بعنوان یک سد مخاطی عمل میکند. این سد طبیعی روده میتواند بهطور موثر باعث محدودیت دسترسی ترکیبات باکتریایی شود. در مواقع بیماری، از قبیل بروز بیماریهای کبدی، این سد مخاطی روده میتواند صدمه ببیند. تغییرمکان باکتری از روده به سیستم گردش خون و یا از راه محور روده-کبد میتواند منجر به تشدید حالت بیماریزایی شود. بیماری NAFLD یک سندروم بالینی شایع است که توسط فاکتورها و عواملی غیر از مصرف الکل یا هر گونه از دیگر صدمات تایید شده کبدی ایجاد میشود. مطالعات حاکی از آن هستند که تغییر میکروبیوتای روده ممکن است کلید ایجاد و بروز NAFLD باشد. در سالهای نزدیک و حدود 20 سال قبل، گزارش شد که استفاده از پروبیوتیکها میتواند هم باعث جلوگیری از تشکیل توده چربی و هم استحاله چربی در اطراف کبد شود. Roy و همکارانش نشان دادند که میکروبیوتای روده در موشهای بدون میکروب در ایجاد NAFLD دخیل بوده (10) که این موضوع کاملا مستقل از چاق بودن یا نبودن است. علاوه بر این Gomez-Hurtado و همکارانش (11) نشان دادند که تغییرمکان آنتی ژن باکتریایی سبب ایجاد التهاب سیستمیک و سراسری در بیماران مبتلا به NAFLD میشود. سایر بیماریهای کبدی نیز با تغییر در ترکیب جوامع میکروبیوتای ساکن در روده مرتبط هستند (12). در مطالعات مختلف اشاره شده است که دیس بیوزیس میکروبیوتای روده در بیماران NAFLD وجود دارد که میانگین فراوانی Bacterioidetes وAkkermansia muciniphila در آنان کمتر بوده و فراوانی پروتئوباکترها در آنان بیشتر است (13،14). افراد مبتلا به کلانژیت صفراوی اولیه نیز دچار دیس بیوزیس میشوند که تنوع باکتریایی آن نسبت به افراد کنترل سالم کمتر است. بیماران دارای کلانژیت اسکلروزان اولیه (PSC) برخی از جنس¬های باکتریایی را بیشتر داشتند که از این جنسهای میتوان به Veillonella و Enterococcus اشاره نمود و نیز کلستریدیومهای کامنسال در آنان کمتر دیده میشود (15). بیماران مبتلا به آسیب حاد و مزمن کبدی مرتبط با هپاتیت B در مقایسه با افراد سالم میزان گردش DNA باکتریایی بیشتر و تنوع میکروبی کمتری در بدن خود دارند (20-16). علاوه بر این، مطالعهای که توسط Wang و همکارانش انجام شد نشان داد که بیماران دارای سیروز کبدی ترکیب میکروبیوتای رودهای خاص و منحصر بفردی دارند که میزان Prevotella، Streptococcus، Staphylococcus و nterococcus در آنان بیشتر بوده و مقدار Ruminococcus و Clostridium در آنها کمتر میباشد (17). بنابراین، عدم توازن در میکروبیوتای روده در طیف وسیعی از بیماریهای کبدی تشخیص داده شده و ممکن است نقشی حیاتی و محوری در بیماریزایی ایفا نماید.
نتیجه و تاثیر عدم توازن میکروبیوتا در بروز بیماری کبد
به هم خوردن توازن میکروبیوتای روده میتواند آسیب کبدی را تشدید کرده و احتمالاً با پیشرفت یک سری از بیماریهای کبدی مزمن از جمله، ALD، NAFLD (25-18)، سیروز صفراوی اولیه (30-26)، هپاتیت ویروسی (31)، سیروز (32) و خصوصا انسفالوپاتی کبدی (HE) (35-33) در ارتباط است. HE یکی از بیماریهای جدی دستگاه عصبی مرکزی بوده که از نارسایی کبد ناشی میگردد و انواعی از هپاتیتهای مزمن و حاد و یا سیروز جبران نشده میتوانند سبب ایجاد آن شوند، این بیماری مرگ و میر و نیز شیوع بسیار بالایی را از خود نشان میدهد. در حال حاضر مکانیسم دقیق HE نامشخص است. از میان چندین مدل فرضیه، تئوری یا نظریه سمیت آمونیاک شناخته شدهترین مکانیسم این بیماری میباشد. افزایش آمونیاک خون میتواند باعث افزایش شیوع HE و تشدید ادم مغزی شود. این فرآیند رابطه نزدیک و تنگاتنگی با عدم توازن میکروبیوتای روده و محورهای روده-مغزی متغیر دارد (36). میکروبیوتای روده در بیماران مبتلا به سیروز و HE بهطور قابل ملاحظه¬ای با چیزی که در افراد سالم دیده میشود فرق میکند، برای مثال می¬توان به افزایش Escherichia coli و Enterococcus اشاره کرد (37). رشد و ظهور باکتری میتواند منجر به افزایش تولید آمونیاک گردد. عدم توازن میکروبیوتای روده نیز بهطور همزمان منجر به آسیب به سد مخاطی شده که با بالا رفتن نفوذپذیری مخاط روده و تغییرمکان اندوتوکسین باکتریایی همراه خواهد بود. تمامی موارد فوق الذکر جزء فاکتورهای مهمی برای ایجاد HE محسوب میشوند. در طرف دیگر مسمومیت با اندوتوکسین (اندوتوکسمی) با ایجاد نارسایی کبدی ارتباط داشته و سبب ایجاد عوارضی از قبیل HE می¬شود. علاوه بر این اندوتوکسمی نقشی مهم و حیاتی در گردش هایپردینامیک (بسیار پویا) مشاهده شده در مبتلایان به سیروز ایفا می¬کند (38،39). مطالعات متعددی تاکید کردهاند که محور روده-کبد-مغز میتواند تاثیرات حیاتی و محوری روی HE از طریق میکروفلور روده (40،41) اعمال کنند و مکانیسم HE نیز با میکروفلور روده در ارتباط می¬باشد. به عبارت دیگر، کبد 75 تا 80 درصد حجم خون هپاتیک یا کبدی را از راه سیاهرگ یا ورید باب (پورتال) دریافت میکند و سپس این خون وارد سیستم گردش خون خواهد شد. به منظور ممانعت از ورود میکروبها به سیستم گردش خون، تمامیت سد روده¬ای میتواند محتوای لومینال (مواد درون روده) را از محیط داخلی جدا کند. مدارک و شواهد حاکی از آن هستند که آمونیاک و اندوتوکسین با ایجاد و بروز HE در صورت سوء عملکرد سد رودهای در ارتباط هستند (42،43). وقتی عملکرد روده از بین رفت، باکتری¬ها و محصولاتشان از دستگاه گوارش به کبد مهاجرت می-کنند. آمونیاک بهعنوان متابولیت اصلی و عمده حاصل از محصولات باکتریایی، میتواند سمیت زیادی برای کبد (هپاتوتوکسیسیته) ایجاد نماید. در ضمن، سلولهای نوروگلیا نیز توسط آمونیاک فعال میشوند و باعث تولید هرچه بیشتر فاکتورهای پیش التهابی خواهد شد. این فاکتورها باعث صدمه به بافت مغزی شده و به دنبال آن شاهد اختلال شناختی در مغز خواهیم بود. علاوه بر این یک سری از مطالعات بالینی و پیش بالینی حاکی از وجود یک ارتباط دو جهتی یا متقابل بین مغز و میکروبیوتای روده میباشند. مشخص شده است که میکروبهای روده میتوانند سیگنالهایی را از مسیرهای عصبی، درونریز، و مسیرهای با واسطه سیستم ایمنی، به مغز بفرستند. نوع و مقدار اطلاعات و سیگنالهای حاصل از میکروبهای روده که به مغز میروند بهطور عمده به میکروبهای مستقر در آن ناحیه از روده بستگی دارد. لذا تغییر در میکروبیوتای روده میتواند با مختل شدن عملکرد مغز از راه محور روده-مغز همراه باشد. Kang و همکارانش (44) دریافتند که وجود یک حالت دیس بیوزیس در میکروبیوتای روده ممکن است با ایجاد و بروز التهاب سیستمیک و التهاب عصبی در ارتباط باشد که بخاطر سیروز ایجاد شده است. اعمال تغییرات خاص و ویژه در میکروبیوتای روده روی ابعاد و جوانب مختلفی از عملکرد مغز تاثیر میگذارد. این موضوع ممکن است توضیح دهنده و تشریح کننده مکانیسمهای مربوطه HE از یک نقطه نظر و چشم انداز دیگر باشد. در مطالعهای (35) از توالی یابی 16S rRNA به منظور آنالیز میکروبیوتای مدفوعی/بزاقی در بیماران مبتلا به سیروز استفاده کرده و دریافتند که فراوانی نسبی Lactobacillaceae در بیماری انسفالوپاتی کبدی مینیمال یا خفیف (MHE) بالاتر بوده که میتواند در تشخیص بهتر MHE مورد استفاده قرار گیرد.
نقش میکروبیوتای روده در درمان بیماریهای کبدی
مدارک گستردهای وجود دارند که نقش حیاتی و مهم تغییر در جوامع روده، میکروبیوتای آن، و کبد را در ایجاد انواعی از بیماریهای حاد و مزمن کبدی و نیز عوارض جانبی ناشی از آنان تایید میکنند (47-45). عدم توازن میکروبیوتای روده یک نقش کلیدی و حیاتی در پاتوفیزیولوژی این فرآیند ایفاء میکند. در بیماران مبتلا به سیروز حاد کبدی، عدم توازن در میکروبیوتای روده میتواند منجر به التهاب سیستمیک، اندوتوکسمی، و عوارض جانبی مربوطه (التهاب خودبخودی صفاق، عفونت روده و غیره) (48) شود که این موضوع باعث کاهش میزان تاثیر روشهای درمانی شده و ممکن است سبب تشدید آن بیماری و حتی مرگ شود. یک مطالعه کارآزمایی بالینی نشان داد که بیماران مبتلا به سیروز در اغلب موارد با آنتیبیوتیکها درمان میشوند که این آنتیبیوتیکها سبب کاهش گونههای موجود در میکروبیوتای روده و فراوانی آنان میشود. اینکار سبب اختلال در ترکیب و تنوع میکروبیوتای روده و تاثیر روی نتایج درمان میشود (49). بنابراین فاکتورهای میکروبی در بسیاری از بیماریهای کبدی با هر مرحله و شدتی، جزو فاکتورهای مقدم و پیشرو محسوب میشوند. این یافتهها معانی و استدلالهای درمانی مهمی در بر دارند، ما بایستی توجه و ارزش بیشتری به میکروبیوتای روده در زمان درمان بیماریهای کبدی معطوف نماییم. دستکاری و تغییر میکروبیوتا با استفاده از استراتژیهای مختلف از قبیل پریبیوتیکها، پروبیوتیکهای جدید، آنتیبیوتیکها یا FMT بایستی به عنوان یک مقیاس درمانی مهم و قابل اهمیت قلمداد شوند. از لحاظ تاثیر قابلملاحظه FMT باید گفت که این تاثیر ممکن است به قدرتمندترین مقیاس و معیار برای اصلاح میکروبیوتای نامتوازن روده در آینده مبدل گردد.
پیوند میکروبیوتای مدفوعی
FMT یک روش درمانی مبتکرانه بالینی است که مدفوع فرآوری شده و غربالگری شده را از مسیر گوارشی فوقانی یا تحتانی از اهدا کننده یه یک گیرنده منتقل کرده تا به این طریق میکروبیوتای ناقص را بازیابی کرده و عدم توازن باکتریایی را نیز اصلاح نماید. تقریباً 1700 سال قبل در چین، Ge Hong توانست اسهال شدید را با استفاده از مواد مدفوعی (از راه دهان) درمان نماید (50). در سال 1958 بکارگیری و استفاده از مدفوع از راه تنقیه به منظور درمان بیماران مبتلا به انتروکولیت با غشاء کاذب نیز گزارش شد (51). در سال 1983 یک بیمار مبتلا به انتروکولیت مکرر Clostridium difficile پس از دریافت فلور رودهای از راه استفاده از مدفوع درمان شد که این اولین استفاده بالینی از روش FMT بود (52). بعدها FMT بهطور وسیعی در CDI و سایر بیماریهای رودهای و خارج رودهای استفاده شد. بنابراین توجه و تمرکز پژوهشهای اخیر بیشتر به سمت نقش درمانی بالقوه این روش در بیماری حاد و مزمن کبدی حرکت کرده است.
روشهای پیوند میکروبیوتای مدفوعی
پروتکلهای درمانی FMT ممکن است بسته به نوع بیماری بسیار متفاوت و متغیر باشند و چیزی که اهمیت دارد انتخاب و گزینش شخص اهدا کننده است. اهداکنندگان سالم ممکن است افراد غیر خویشاوند، خویشاوندان نزدیک، یا اعضای خانواده باشند. با اینحال دستورالعملها و خطی مشیهای فعلی پیشنهاد میکنند که بهترین منبع اهدا کننده یک شخص غیر خویشاوند است. این موضوع به این دلیل است که خویشاوندان و اعضای خانواده ممکن است محیط زندگی مشترک و نیز رژیم غذایی مشابهی را با فرد گیرنده داشته باشند. در عوض، افراد غیر خویشاوند جوامع بسیار متفاوتی را در میکروبیوتای روده خود دارند. به منظور تضمین موفقیتآمیز بودن عمل پیوند، نیاز است که اهدا کننده تست غربالگری داده و تحت یک سری از مقیاسهای سختگیرانه و دقیق بایدها و نبایدها طبق پروتکل تایید شده قرار گیرد (5). مواد مدفوعی تازه، رقیق و همگن میشوند تا به شکل قابل استفاده برسند (53). مواد مدفوعی منجمد نیز میتوانند در برخی موارد استفاده شوند (54). با اینحال تنوع باکتریایی موجود در محصولات منجمد ممکن است از مواد تازه کمتر باشد. در مطالعهای که اخیراً روی بیماران مبتلا به CDI انجام شد نشان داده شد که مواد مدفوعی منجمد در مقایسه با مواد تازه بازده و تاثیر درمانی کمتری دارند. روش و مسیرهای استفاده مواد نیز متفاوت است. میکروبیوتای مدفوعی را میتوان از راه آندوسکوپی، کپسول و کلونوسکوپی وارد مجرای روده نمود (58-54). با اینحال مسیر بهینه FMT هنوز کاملاً مشخص نشده است. تنقیه ابقایی متداول ترین روش در کشور چین است چرا که مطمئن و ارزان میباشد، اما توانایی کلونیزه شدن و مستقر شدن میکروبیوتا در آن محدود است. کپسول دهانی نیز یک روش غیر تهاجمی بوده و توسط بیماران ترجیح داده می شود ولی هزینه آن بقدری بالاست که معمولاً شخص از انجام آن منصرف می¬شود. علاوه بر این، شایان ذکر است که بدانیم دادههای مهم بایستی در زمان اجرای تست¬های FMT جمعآوری شوند که از این دادهها میتوانند به اطلاعات ریزمغذی و درشت مغذی¬ها اشاره کنند که عبارتند از استفاده از PPI، متفورمین، سابقه دیابت شخص، چاقی، مصرف آنتی بیوتیک، سابقه جراحی GI، IBD و سایر بیماریهای روده (64-59).
علائم متداول و میزان اثر بخشی
تعداد قابل توجهی از آزمایشات بالینی وجود دارند که هدف و تمرکزشان روی بررسی بیماریهایی است که در آنان میتوان از FMT برای افزایش بازده و تاثیرگذاری و نیز امنیت استفاده نمود. تا به امروز، FMT بهعنوان آخرین امید برای درمان CDI شدید شناخته میشود (65). بهعبارتی دیگر، مدارک نشان دادهاند که FMT یک روش درمانی امن و موثر علیه CDI میباشد (62،59). علاوه بر این، FMT برای درمان بسیاری از انواع بیماریها از قبیل بیماریهای رودهای، بیماریهای کبدی، و اختلالات عصبی میتواند موثر عمل کند (69-66). در بسیاری از موارد گزارش شده است که روش FMT کاملاً امن و مطمئن، تطبیق پذیر، و بسیار موثرتر از مقیاسها و روشهای قبلی تنظیم میکروبیوتای روده از جمله پریبیوتیکها، پروبیوتیکها و آنتیبیوتیکها میباشد (53). در مطالعهای گزارش شد که از بین 536 بیمار مبتلا به CDI که تحت درمان FMT قرار داشتند، میزان پاسخ بالینی حداکثر تا 87 درصد بوده است و هیچ اتفاق مشکلساز و غیر منتظرهای نیز مشاهده نشده است (70). یک مطالعه دیگر از کپسولهای مدفوع منجمد برای درمان 20 بیمار مبتلا به CDI استفاده کرد که میزان پاسخگویی و عملکرد آن پس از برگزاری یک یا دو دوره درمان برابر 90 درصد بوده و هیچ عارضه جانبی ناسازگار نیز بروز نکرد. مطالعاتی که در بالا گفته شد حاکی از آن هستند که استفاده و بهکارگیری روش FMT در بیماران CDI موثر و امن میباشد. با اینحال گزارش شده که در سال 2019 دو بیمار دارای CDI پس از درمان با FMT دچار باکتریمی شده و یکی از آنان را به کام مرگ کشاند. این دو بیمار هر دو کپسولهای مدفوعی را از یک اهداکننده مشترک دریافت کردند که نشان میدهد روش FMT نیز چندان بی خطر و بدون ریسک هم نیست. پس بنابراین تقویت و پیشرفت عمل غربالگری شخص اهداکننده به منظور محدودکردن و کاستن انتقال میکروارگانیسمهایی که میتوانند منجر به ایجاد عفونتهای ناسازگار و درگیرکننده شوند، امری واجب و ضروری به شمار میرود (71). در یک آزمایش تصادفی با 70 تن از بیماران مبتلا به کولیت اولسراتیو (UC)، میزان شروع دوره بهبودی بیماری در گروهی که تحت درمان FMT بودند و گروهی که با دارونما کنترل میشدند به ترتیب برابر 24 و 5 درصد بود (72). علاوه بر این هیچ تفاوت قابلملاحظهای از لحاظ رخ دادن نتایج و عوارض بین دو گروه مشاهده نشد. لذا FMT نسبت به دارونما، درصد شروع بهبودی را در بیماران UC بهطور فوق العادهای بالاتر میبرد و هیج عارضه ناسازگار و مشکل ساز اضافهای نیز در این مسیر وجود نداشت. Yu و همکارانش میزان بازده و کارایی کپسولهای دهانی FMT را در 22 فرد بزرگسال چاق طی یک آزمایش تصادفی و دو سوکور، سنجیدند (73). نتایج نشان داد که این کپسولها بهخوبی با بدن فرد سازش پیدا کرده و منجر به تغییرات مداوم در میکروبیوم روده شده که مشابه چیزی بود که در اهداکننده لاغر اندام شاهدش بودیم. با این وجود روش FMT نتوانست شاخص توده بدنی (BMI) را در بیماران چاق در مقایسه با گروهی که توسط دارونما کنترل شده بودند، کاهش دهد.
جدول 1: اطلاعات بهدست آمده در مورد میزان درشت مغذی و ریز مغذیها در آزمایشات مرتبط با FMT
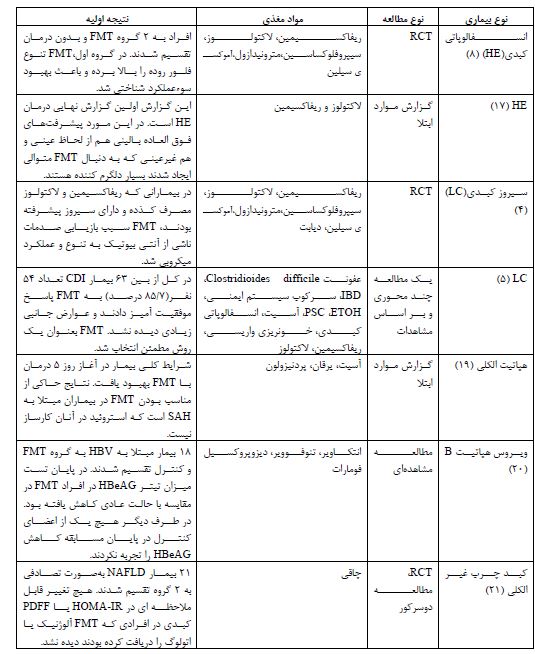
اختصارات: CHB: هپاتیت B مزمن، ETOH: اتانول، FMT: پیوند میکروبیوتای مدفوعی، IBD: بیماری التهابی روده، NAFLD: بیماری کبد چرب غیر الکلی، PDFF: کسر چربی چگالی پروتون، PSC: کلانژیت اسکلروزان اولیه، SAH: هپاتیت شدید الکلی.
پیوند میکروبیوتای مدفوعی در بیماریهای کبدی
انسفالوپاتی کبدی
انسفالوپاتی کبدی (HE) جدیترین عارضه جانبی ناشی از سیروز کبدی بهشمار میرود. HE تکرار شوند یا عودکننده از علل پیشرو و پیشقدم در ابتلای مجدد، آسیب مغزی، و مرگ به حساب میرود. خونریزی بخش فوقانی دستگاه گوارشی و عفونت این بخش باعث عود کردن و برگشت مجدد بیماری در بسیاری از افراد میشود. این بیماران معمولا تحت درمان آنتیبیوتیکی قرار میگیرند که میتواند باعث اختلال در تنظیم میکروبیوتای روده شود و لذا میدان برای HE بازتر خواهد شد (75،74). درمان اصولی و استاندارد موجود برای HE از قبیل لاکتولوز و ریفاکسیمین، میتواند سبب تقویت محیط میکروبیوتای روده شود. با اینحال تاثیری که این دو دارو از لحاظ درمانی دارند نسبتاً ضعیف است. تا به امروز تعداد انگشتشماری از مطالعات منتشر شدهاند که میزان تاثیر و بازدهی روش FMT را روی بیماری HE آنالیز میکنند. در سال 2016، Kao و همکارانش اولین مورد ابتلا به HE درجه 1 تا 2 را گزارش کرده که این شخص تحت درمان FMT قرار گرفته بود (61). نتایج حاصل از FMT پی در پی و متوالی بسیار دلگرم کننده بود. علائم بیماری در فرد هم از لحاظ درونی و هم عینی بهبود پیدا کرده بود. بعدها تعداد بیشتری از پژوهشگران شروع به جستجو و کاوش FMT در بیماری HE نمودند. مطالعهای که روی تاثیر FMT کپسولی روی HE کار میکرد از شاخصهای متفاوتی استفاده کرده و آنان را آزمایش نمود، این شاخصها عبارتند از بیخطر بودن، تحمل، تغییرات ایجاد شده در میکروبیوتا، و عملکرد مغز که پس از انجام درمان با FMT، تنوع مخاط دوازدهه، E-کادهرین دوازدهه، و مکانیسم دفاعی A5 دستخوش افزایش شده بودند، ولی اینترلوکین6 و سرم LBP کاهش پیدا کردند (75). علاوه بر مطالعات بالینی، مطالعات پیش بالینی نیز استفاده از FMT را در مورد HE تایید کردند. Wang و همکارانش (76) برای اینکه بفهمند آیا FMT قادر به جلوگیری از بروز HE هست یا خیر، مدل آزمایشگاهی موش مبتلا به HE را که عملکرد کبدش تحت تاثیر کربن تتراکلرید (CCl4) بهطور حاد دچار اختلال شده بود تعبیه نمودند. موشها یکی پس از دیگری تحت درمان FMT قرار گرفتند و نتایج اثبات کرد که FMT میتواند سبب بهبود رفتار موشها، کاهش درجه HE، و توانایی یادگیری فضایی شود. علاوه بر این FMT از نکروز (مرگ) کبد و آسیب به سد مخاطی روده نیز ممانعت میکند. FMT ممکن است میزان نفوذپذیری روده را تغییر داده و پاسخ TLR کبد را از راه کاهش بیان TLR4 و TLR9 تقویت نماید. در نتیجه مدارک بالینی و پیش بالینی هر دو حاکی از موفقیت آمیز بودن روش FMT در پیش تشخیصی بیماران HE میباشند.
عوارض ناشی از سیروز کبدی
دیس بیوزیس روده در 20 تا 75 درصد از بیماران مبتلا به سیروز ظاهر میشود. ترکیب میکروبیوتای رودهای و عملکرد سد روده، حتی با مصرف قبلی ریفاکسیمین نیز تحت تاثیر قرار میگیرند. علاوه بر این وقوع و شیوع سیروز و عوارض جانبی مربوط به آن با یک سری از ناهنجاریها در میکروبیوتای روده در ارتباط هستند (77). از عوارض جانبی شایع و پر تکرار سیروز کبدی میتوان به پریتونیت (التهاب صفاق) خودبهخودی باکتریایی، آسیت و سپسیس اشاره نمود. در بیماران مبتلا به سیروز، ترکیب خاص و پیچیدهای از میکروبیوتای روده شناسایی و کشف شده است و میزان باکتری Clostridium در سرم بیمارانی که آسیت دارند افزایش یافته است (78). مهمتر از همه اینکه مقدار انتقال باکتری در حضور افزایش فشار خون پورتال (ورید باب) افزایش مییابد. این تغییرات عملکردی و ساختاری عمدتا به اسیدهای چرب زنجیره کوتاه (SCFAs) مدفوعی مرتبط هستند. عدم توازن در میکروبیوتای روده که باعث تشدید پیشرفت بیماری کبد میشود، بهخاطر مصرف آنتیبیوتیکها بیش از پیش شدیدتر میشود. بنابراین بازیابی میکروبیوتای روده میتواند هم سبب کاهش آمونیاک در سرم و هم سطح اندوتوکسمی شده و مانع از بروز عوارض جانبی ناشی از سیروز شود. یک تست امنیت تک فازی به منظور بررسی روش FMT در بازیابی عملکرد میکروبهای روده در بیماران سیروزی اجرا شده که 10 بیمار به گروه FMT و استاندارد مراقبت (SOC) اختصاص یافتند (49). بهخاطر مصرف آنتیبیوتیکها و ریفاکسیمین، ترکیب میکروبی و علائم عملکردی (BA، SCFA، 7 آلفا-دهیدروکسیلاسیون) قبل و بعد از یک جلسه تکی FMT آنالیز شدند. پژوهشگران دریافتند که FMT میتواند باعث تحریک ترشح SCFA ها و تعدیل وضعیت BA و لذا بازیابی توانایی و قدرت متابولیک، مخصوصا در کوتاه مدت پس از انجام FMT شود. تاثیرات طولانیمدت FMT نیازمند کاوش بیشتر هستند. به دلیل محدود بودن اندازه نمونههای مطالعات فعلی در این دست نوشته، در آینده نیاز است که یک سری مطالعات مقیاس بزرگ به منظور تایید هرچه بیشتر ارزش FMT در سیروز انجام شود.
کلانژیت اسکلروزان اولیه
کلانژیت اسکلروزان اولیه (PSC) یک بیماری خود ایمنی و مزمن کبدی با پیشآگهی ضعیف بوده و در اغلب موارد با IBD در ارتباط است. استفاده از پیوند کبد تنها راه درمان مبتلایان به این بیماری است. ثابت شده است که عدم توازن میکروبیوتای روده با پیشرفت بیماری PSC در ارتباط است. یک مدل موشی GF از PSC تهیه شده و اثبات کرد که عدم حضور میکروبیوتای روده باعث تشدید بیماری¬های صفراوی-کبدی میشود که همین موضوع می تواند به اهمیت روش FMT اشاره کند (79). عمل بازیابی میکروبیومی، به خاطر کمبود روشهای درمانی موثر، به یک هدف درمانی برای PSC تبدیل شده است (80). مطالعاتی که پیشتر انجام شد نشان داده که مصرف ونکومایسین از راه دهانی میتواند در درمان بیماران مبتلا به PSC موثر باشد که این دارو تاثیر خود را از راه اصلاح و تعدیل میکروبیوم روده اعمال میکند. از اینرو، FMT ممکن است یک روش درمانی ممکن و میسر تر علیه PSC به شمار رود. روش FMT میتواند سبب تقویت و افزایش تنوع میکروبیومی و بیوشیمی کبد در مبتلایان به PSC شود. اولین مورد استفاده از روش درمانی FMT علیه PSC در سال 2018 توسط Philips (81) منتشر شد. طبق تشخیصها یک مرد 38 ساله به PSC مبتلا بوده و همزمان دچار کلانژیت حاد و عودکننده باکتریایی ولی بدون IBD بوده است. این شخص 4 هفته و هفتهای یک بار تحت درمان FMT اندوسکوپی قرار گرفت و مصرف تمامی آنتی بیوتیکها نیز در طول مدت درمان متوقف شد. تعدادی از مطالعات نشان دادهاند که کاهش در BA ها و آلکالین فسفاتاز (ALP) منجر به پیش تشخیصی بهتر میشود. پس از درمان با FMT، BA و ALP بیمار کاهش یافته و شخص به مدت یکسال بیماری را تجربه نکرد. در مورد میکروبیوتای روده این شخص، کاهش فراوانی Proteobacteria (شاخهای از باکتریها که حاوی تعداد بیشماری از پاتوژنهای انسانی است) و افزایش Firmicutes (شاخهای که دارای تاکسونهای زیادی بوده و احتمالاً دارای خواص ایمونولوژیک سودمندی نیز هستند) مشاهده شد. تمام این نتایج، استفاده از FMT را علیه PSC تقویت و تصدیق کردند. نتایج حاصل از این مطالعات بیانگر این است که روش FMT در درمان PSC کاملاً بی خطر است، اما توانایی FMT در بهبود بیماری و دوره¬های مورد نیاز FMT هنوز تعیین و مشخص نشده است (84-82). برخی از مطالعات از 4 پیوند مدفوعی استفاده کردند در حالیکه سایرین از یک پیوند استفاده نمودند. بررسی روشهای بهینه FMT و نقاط زمانی امری مهم و حائز اهمیت در تعیین میزان بازده FMT در PSC دارند.
کبد چرب (الکلی، غیر الکلی)
بیماران مبتلا به هپاتیت الکلی شدید (SAH) پیشآگهی ضعیفی دارند، میزان مرگ و میر در یکسال اول بالا بوده و یا حدود 60 درصد آنان به پیوند کبد نیاز پیدا میکنند. پس از ترک مصرف الکل و تغییر شیوه زندگی، کبد چرب به پیشرفت خود ادامه خواهد داد. بنابراین گزینههای درمانی این بیماری به شدت محدود و کم هستند. گفته می¬شود که پیشروی بیماری کبدچرب الکلی (ALD) و NAFLD هر دو با عدم توازن میکروبیوتای روده در ارتباط هستند. مطالعات بالینی محدودی میزان کارایی و بازده FMT را در بیماری ALD و NAFLD بررسی کرده اند (85). از روش FMT در یک مطالعه که 64 کودک چاق را که طی سونوگرافی مشخص شده بود مبتلا به NAFLD هستند (87-86)، طی یک آزمایش تصادفی و سه سو کور استفاده شد. پس از مصرف کپسولهای پروبیوتیک، مقدار آلانین آمینوترانسفراز، آسپارتات آمینوترانسفراز،کلسترول، و تریگلیسرید و اندازه دور کمر بهطور قابل ملاحظهای کاهش یافتند، این موضوع بدان معناست که ترکیبات پروبیوتیک در درمان NAFLD اطفال موثر و موفق عمل کردهاند. کپسولهای پروبیوتیک هم در درمان NAFLD موثر و کارآمد هستند. بنابراین روش FMT که ساختار باکتریایی سودمندتر و میکروبیوتای رودهای عادی و نرمالی دارد، بایستی موثر تر از این چیزی که الان میبینیم باشد. Zhou و همکارانش (88) نقش FMT را در درمان استئاتوهپاتیت یا استئاتوز کبدی در موشهای آزمایشگاهی بررسی نمودند. نتایج مطالعات آنان نشان داد که روش FMT میتواند استئاتوهپاتیت را از راه اصلاح اختلالات ایجاد شده در میکروبیوتای روده و نیز کاهش تجمع لیپید در داخل کبد و سایتوکاینهای پپیش التهابی تضعیف و تقلیل کند. در یک مطالعه میکروبیوتای روده بیماران مبتلا به ALD را به موش-های آزمایشگاهی سالم و استریل پیوند زد، که منجر به ایجاد التهاب کبدی شدید ناشی از الکل شد (14). همچنین Cassard و همکاران دریافتند که درمان با پکتین و FMT هر دو مانع از آسیب کبدی ناشی از الکل میشوند (89). این مطالعات بهطور متقاعدکننده و مستدلی نشان دادند که FMT در زمره روشهای پیش بالینی علیه بیماری ALD قرار خواهد گرفت. با اینحال مطالعات نسبتاً کمی وجود دارد که روش FMT را در ALD و NAFLD مزمن مورد بررسی قرار می¬دهند. بهطور قطع تضمین میشود که مطالعات بیشتری روی FMT در بیماریهای کبد چرب انجام بگیرد.
آسیب حاد کبدی
آسیب حاد کبدی (ALI) تحت عنوان آسیب حاد سلول¬های کبدی و نکروز آنان تعریف میشود و عوامل مختلفی در ایجاد آن از جمله مصرف الکل، سمیت پاراستامول، ایسکمیدر کبد، هپاتیت ویروسی و خود ایمنی، و صدمات کبدی ناشی از مصرف دارو می توانند نقش داشته باشند. اگر بیماران به سرعت تشخیص داده نشوند و فورا تحت درمان قرار نگیرند، ALI ممکن است به نارسایی حاد کبدی (ALF) تبدیل شده که این بیماری تلفات به شدت بالایی داشته که میزان آن حداکثر در عرض 90 روز به 40 درصد می¬رسد. بیش از نصف موارد ابتلا به ALF بیماریشان به قدری پیشرفت میکند که نیاز به پیوند کبد پیدا میکنند. بهنظر می-رسد یک پاسخ مازاد و اضافی التهابی و سیستمیک وجود دارد که نقش حیاتی در تبدیل ALI به ALF بازی می-کند. عدم توازن میکروبیوتای روده نه تنها به این پاسخ التهاب سیستمی، بلکه به خود بیماری ALI نیز مربوط میباشد. برای مثال، گزارش شد که Lactobacillus salivarius L101 باعث تسکین و کاهش آسیب کبدی میشود (90). در طول دوره درمان ALI یا ALF، استفاده از پروبیوتیکها معمولا تجویز میشود اما فواید کمی برای زنده ماندن شخص در بردارند. روش FMT یک استراتژی درمانی بالقوه برای ALI و ALF به منظور تنظیم میکروبیوتای روده محسوب میشود. HE اصلی¬ترین و پیشروترین علت مرگ در بیماری ALF است. در یک مدل موشی مبتلا به ALF طی آزمایشاتی مشخص شد روش FMT تاثیرات محافظتی قدرتمندی را روی فعالیت حرکتی موش دارد که با روش استفاده از پروبیوتیک¬ها کاملاً قابل مقایسه بودند. روش FMT بهطور موثری سبب تقویت رفتار و توانایی¬های شناخت فضایی در افراد مبتلا به HE می¬شود. از همه مهمتر، مقدار اندیکاتور یا شاخص¬های بیوشیمیایی ایجاد کننده سمیت کبدی یا هپاتوتوکسیسیته (ALT, AST, ALP, TBIL, DTBIL) و حد واسط¬های التهابی (IL-1β, TNF-α, TLR4, TLR9) نیز در گروه دریافتکننده FMT در مقایسه با گروه کنترل به شدت کاهش یافته بود. کاهش نفوذپذیری روده و نیز کاهش مقدار آمونیاک سرم نیز بهطور همزمان در مدل موشی FMT مشاهده شد. در نتیجه روش FMT موفق شد نکروز کبدی را در ALI از راه کاهش نفوذپذیری روده، پاکسازی آمونیاک سرم، و محدودکردن التهاب سیستمی، متوقف نماید (76). این مطالعات حیوانی یک اصل و خط مشی را برای استفاده بالینی از روش FMT در بیماری ALI و ALF فراهم کرده¬اند.
چشماندازهای آینده
عفونت ناشی از ویروس هپاتیت B(HBV) هنوز هم یک بار سنگین و جدی بر سیستمهای درمانی جهان به شمار می-آید که نرخ شیوع آن تا 7 یا 8 درصد نیز میرسد. اگر این بیماری درمان نشود، ممکن است به سیروز کبدی یا سرطان کبد تغییرشکل دهد. بنابراین، مدیریت و اداره بیماری HBV برای کاهش شیوع سیروز و سرطان کبدی بسیار حیاتی و حائز اهمیت است. Wang و همکارانش با مقایسه فلور طبیعی روده بیماران مبتلا به هپاتیت B مزمن (CHB) با گروه سالم، دریافتند که میزان باکتریوئیدها در بیماران CHB بر اساس توالییابی ناحیه V3-V4 ژن16S rRNA متعلق به میکروبیوتای روده، کاهش پیدا کرده است. علاوه بر این، تغییرات ساختاری میکروبیوتای روده که بهخاطر بیماری کبدی و شدت بیماری ایجاد می¬شود بهطور متقابل تصادفی هستند. این تغییرات احتمالاً روی تغییر شکل بیماری CHB و تبدیل آن به سیروز کبدی، سرطان کبد، یا نارسایی کبدی تاثیر دارند. مطالعاتی که روی موشها انجام شده نیز مشخص کرده که میکروبیوتای روده ممکن است روی پاسخ سیستم ایمنی میزبان و توانایی آن در حذف و نابود کردن عفونت HBV تاثیر داشته باد. بنابراین روش FMT می¬تواند بهعنوان یک روش درمانی بالقوه برای تعدیل و تنظیم سیستم ایمنی در بیماران مبتلا به عفونت مزمن HBV به شمار رود. طی یک مطالعه کنترل شده غیر تصادفی، 14 بیمار با HBe-Ag (آنتی ژن) مثبت تحت درمان با شش چرخه FMT از راه گاستروسکوپی و نیز درمانهای ضد ویروسی (بهطور همزمان) یا همان ALI تحت عنوان آسیل حاد به سلولهای کبدی و نکروز آنان تعریف میشود و این بیماری علل متفاوتی از جمله مصرف الکل، سمیت پاراستامول، ایسکمی در کبد، هپاتیت ویروسی و خود ایمنی، و صدمات کبدی ناشی از مصرف دارو دارد میتواند داشته باشد. اگر بیماران به سرعت تشخیص داده نشوند و فورا تحت درمان قرار نگیرند، ALI ممکن است به نارسایی حاد کبدی (ALF) تبدیل شده که این بیماری تلفات به شدت بالایی داشته که میزان آن حداکثر در عرض 90 روز به 40 درصد می¬رسد. بیش از نصف موارد ابتلا به ALF بیماریشان به قدری پیشرفت میکند که نیاز به پیوند کبد پیدا میکنند. بنظر میرسد یک پاسخ مازاد و اضافی التهابی و سیستمیک وجود دارد که نقشی حیاتی در تبدیل ALI به ALF بازی می¬کند. عدم توازن میکروبیوتای روده نه تنها به این پاسخ التهاب سیستمی، بلکه به خود بیماری ALI نیز مربوط میباشد. برای مثال، گزارش شد که Lactobacillus salivarius L101 باعث تسکین و کاهش آسیب کبدی میشود (90). در طول دوره درمان ALI یا ALF، استفاده از پروبیوتیک¬ها معمولا تجویز میشود اما فواید کمی برای زنده ماندن شخص دربر دارند. روش FMT یک استراتژی درمانی بالقوه برای ALI و ALF به منظور تنظیم میکروبیوتای روده محسوب می¬شود. در مطالعهای که روی 18 بیمار HBe-Agمثبت انجام شد و در افرادیکه درمان FMT داشتند، از هر پنج بیمار دو نفر از آنها کاملاً از HBe-Ag پاک شده بودند ولی هیچ یک از 13 نفر قرار گرفته در گروه کنترل چنین نتیجهای را نشان ندادند. این یافتهها بدان معناست که روش FMT در برابر عفونت HBC موثر عمل میکند. با اینحال تاثیرات طولانی مدت FMT روی عفونت مزمن HBC هنوز کاملا مشخص نشده است (91). به منظور رسیدن به نتایج مستحکم و مطمئن در مورد استفاده از FMT در هپاتیت نیاز به پژوهشهای عمیق و گستردهتری می باشد. کارسینوما یا سرطان سلولهای کبدی (HCC) سومین علت اصلی مرگ و میر ناشی از سرطان در سطح دنیا بوده و قویا با ابتلا به HBV و ویروس هپاتیت C در ارتباط است. مشاهدات تجربی و آزمایشگاهی روی موش-ها نشان داد که عدم توازن میکروبیوتای روده سبب افزایش نرخ ابتلا به HCCشده و میتوان با استفاده از پروبیوتیکها از رشد تومور جلوگیری بهعمل آورد (92). این مطالعات حاکی از آن هستند که تعدیل و اصلاح میکروبیوتای روده ممکن است سبب بهبود نتایج حاصل از بیماران HCC شود. روش FMT پتانسیل و توانایی عظیمی برای بکارگیری در امر کنترل و مدیریت HCC دارد. با اینحال بررسی متونی که داشتیم تا به امروز مطالعه ی بالینی دیده نشد که از درمان HCC با روش FMT صحبت کرده باشد، که بررسی¬های بیشتری را به گوش میرساند. چالشهای فعلی و آزمایشها درحال انجام که FMT را در بیماران مبتلا به بیماریهای کبدی از قبیل HBV و HCC آزمایش میکنند را می-توان در سایت Clinicaltrials.gov مشاهده کرد.
نتیجهگیری
عدم توازن در میکروبیوتای روده بهطور قابل ملاحظه-ای در ایجاد طیف وسیعی از بیماری¬های کبدی نقش دارد. روش FMT یک رویکرد جدید و بدیع به منظور درمان بیماری¬های کبدی بوده که این کار را از راه بازیابی میکروبیوتای سالم روده، کاهش شیوع و تلفات ALI یا HE و نیز افزایش نرخ بقا (زنده ماندن) در بیماران PSC انجام می دهد. روش FMT در مقایسه با روشهای سنتیتر پیشین (پروبیوتیکها) مستقیم ترین راه برای تغییر ترکیب و تنوع میکروبیوتای روده بهشمار میرود. پژوهشهای علم پایه و مطالعات بالینی هر دو اثبات کردهاند که روش FMT میتواند بهطور موثر باعث تقویت و بهبود میکروبیوتای روده در زمان ابتلا به بیماریهای حاد و مزمن کبدی، بازسازی و بازیابی توازن میکروبیوم روده، و تسریع بهبودی فرد بیمار شود. با اینحال تنها تعداد کمی از مطالعات بالینی به بررسی روش FMT در درمان هپاتیت B مزمن و HCC کبدی پرداختهاند. تعداد زیادی از مطالعات کنترل شده تصادفی بهصورت فوری و سریع برای بررسی میزان اثر بخشی FMT در هپاتیت و HCC مورد نیاز هستند، مخصوصاً در بررسی کارآیی طولانی مدت آن، تا بدین طریق بتوان بار حاصل از بیماری را در کشورمان کاهش داد. با اینکه روش FMT یک راه بی خطر، موثر، و ارزان قیمت برای درمان بسیاری از بیماریهاست، اما یک سری محدودیت نیز دارد که از بین آنان میتوان به رضایت شخص بیمار برای انجام این روش اشاره کرد. علاوه بر این روشهای پیوند نیز بایستی بهبود بیشتری بیابند. بنظر می رسد تاسیس بانک میکروبی مدفوعی باید در دستور کار قرار گیرد تا بتوان از این راه منبعی از باکتری¬های سالم مدفوعی را برای بیماران تامین نمود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
میکروبیوم انسان تحت عنوان اجتماعی از میکروبها از قبیل باکتریها، ویروسها، قارچها تعریف میشود که در بدن انسان مستقر هستند. روده بزرگترین اندام گوارشی و ایمنی بدن بوده و حاوی حدوداً 80 درصد از کل میکروبیوتای انسان است (1). بیش از 99 درصد میکروبهای موجود در روده انسان را باکتریها و سایر میکروبها از قبیل ویروسها و قارچها تشکیل میدهند (2). روده تقریباً دارای 1000 گونه باکتریایی است که هر گونه از 2000 ژن تشکیل میشود. بهطور میانگین 2 میلیون ژن در روده وجود دارد که 100 برابر بیشتر از از تعداد ژنی است که معمولاً برای انسان تخمین زده میشود (حدود 20 هزار). برخی از این باکتریها پروبیوتیک هستند اما برخی دیگر نیز پاتوژن یا بیماریزا میباشند. توازن دینامیک یا پویا (در حال تغییر) تعداد گونههای باکتریایی روده باعث حفظ توازن خود روده شده که نقشی مهم در اعمال گوارشی، متابولیک (سوخت و ساز) و ایمنی بدن انسان ایفا میکند. عواملی از قبیل رژیم غذایی، داروها، بیماری، اختلالات متابولیکی و بیماریهای خود ایمنی در برقراری توازن روده تاثیر به سزایی دارند. عدم توازن در فلور نرمال روده زمینهساز شیوع و ایجاد بسیاری از بیماری های رودهای و خارج رودهای از جمله بیماریهای کبدی، دیابت، لوسمی (سرطان خون) و سپسیس میباشد. بنابراین، تغییر و اصلاح میکروبیوتای رودهای میتواند سبب مبارزه با بیماریهایی شود که با دیس بیوزیس رودهای (عدم تعادل فلور روده) در ارتباط هستند. بسیاری از رویکردها به منظور تعدیل و تنظیم ساختار و متابولیسم میکروبیوتای روده مورد استفاده قرار گرفتهاند که از آنها میتوان به رژیم غذایی، پریبیوتیکها، پروبیوتیکها و آنتیبیوتیکها اشاره کرد (4،3). با این که روشهای فوقالذکر توانستند به یک سری از تاثیرات درمانی دست یابند، اما نتایج آن چنان که باید رضایتبخش نبود. انتقال یا پیوند میکروبیوتای مدفوعی (FMT) ممکن است به سالهای بسیار قبل و به سلسله Jin شرقی در کشور چین برگردد که حدود 1700 سال پیش از این بوده است. با اینحال این روش تنها در چندسال اخیر موفق به جلب توجه پزشکان و محققان شده است. FMT را میتوان بهعنوان یک روش یا رژیم درمانی مطمئن برای تنظیم مستقیم میکروبیوتای رودهای بر شمرد. در این روش مواد مدفوعی تغییر یافته و فرآوری شده از اهداکنندگان سالم به بیماران منتقل شده تا بدین طریق ترکیب و تنوع میکروبیوتای روده آنان اصلاح شود. اتفاقنظر گسترده و عمومی این است که FMT میتواند بهطور موفقیت آمیزی باعث درمان بیماری مقاوم و عودکننده ناشی از Clostridium difficile یا CDI شود. علاوه بر این افزایش تعداد دادهها و شواهد حاکی از آن است که FMT در بهبود و اصلاح یبوست عملی غیرقابل کنترل، بیماریهای التهاب روده (IBDs)، چاقی، دیابت نوع 2 و غیره موثر است (5). در ضمن دیس بیوزیس رودهای که در بسیاری از بیماری-های کبدی دیده میشود سبب جلب توجه به سمت پتانسیل و قدرت روش FMT در درمان بیماری¬های کبدی شده است. عدم توازن در میکروبیوتای روده ارتباط نزدیکی با شیوع، ایجاد، و پیشآگهی انواعی از بیماری-های کبدی از قبیل آسیب حاد کبدی، هپاتیت ویروسی، سیروز کبدی، بیماری خودایمنی کبد، بیماری کبد الکلی (ALD) و بیماری کبد چرب غیر الکلی (NAFLD) دارد (6،7). میزان بازده روش FMT در امر تسریع بهبودی بیماری بالاست که این را از راه بازیابی توازن عادی روده در بیماران مبتلا به اختلالات کبدی انجام میدهد (8،9). در این مقاله مروری، عمده توجه ما روی میکروبیوتای روده و ارتباط آن با انواعی از بیماریهای کبدی است. در قدم بعدی نیز در مورد مطالعات بالینی فعلی و آخرین پیشرفتهای حاصل شده در زمینه استفاده از روش FMT در بیماریهای حاد و مزمن کبدی طبق شکل 1، بحث خواهیم کرد.
روش بررسی
پژوهش مطالعه مروری حاضر با استفاده از پایگاههای علمی PubMed و Scopus انجام شد. در این پـایگـاههـا، از کلمات کلیدی همچون، gut microbiota،fecal microbiota transplantation، liver diseases، probiotic استفاده شد. براساس نتایج جستجو از سال ۲۰۱۸ تا ۲۰۲۲ میلادی مرتبط با هدف پژوهش مورد بررسی قرار گرفت.
ارتباط میکروبیوتای روده با بیماریهای کبدی
کبد بزرگترین غده هاضمه یا گوارشی محسوب شده و اندامی مهم در ایمنی بدن انسان به شمار میرود و همچنین ارتباط و تماسی نزدیک با روده دارد. مطالعات مشخص کردهاند که دیس بیوزیس روده در انواعی از بیماری های کبدی بروز میکند (7،6). در ضمن، این دیس بیوزیس روی درجه و شدت چربی کبد (استحاله چربی)، التهاب، فیبروز، و حتی ایجاد سرطان کبد نیز موثر است که این تاثیر را از راه چندین برهمکنش و ارتباط با سیستم ایمنی میزبان و سایر انواع سلولها اعمال میکند. رابطه میان بیماریهای کبدی و میکروبیوتای روده دارای مکانیسم پیچیدهای است که به خوبی مشخص و درک نشده است. بیماریهای کبدی ممکن است منجر به بههم خوردن توازن میکروبیوتای روده شوند و این عدم توازن ممکن است سبب تشدید پیشرفت بیماریهای کبدی گشته که تاثیر این بیماریها به دنبال تشدیدشان متقابلا افزایش خواهد یافت.
تغییر در میکروبیوتای روده و بیماریهای کبد
محور روده-کبد که اولین بار در سال 1987 توصیف شد، این موضوع را مطرح میکند که ارتباط بین روده و کبد یک رابطه دو طرفه و یک فرآیند چرخهای است. تحت شرایط فیزیولوژیک، کبد اسیدهای صفراوی (BAs) و سایر ترکیبات فعال زیستی را به درون روده ترشح کرده تا به جذب و متابولیسم روده کمک کند.
.jpg)
شکل1: استراتژیها و تدابیر اتخاذ شده به منظور بررسی میکروبیوم روده در بیماریهای کبدی. تعدیل و اصلاح میکروبیوتای روده و درمان آن ممکن است نتایج خوبی را در بیماران مبتلا به بیماریهای کبدی در بر داشته باشد. GLP1: آگونیست پپتید1 شبهگلوکان، FXR: گیرنده فارنزوئید X، TGR5: گیرنده شماره 5 ادغام شده با پروتئین Takeda G، FGF19: فاکتور 19 رشد فیبروبلاست، HSC: سلول ستارهای کبد LSEC: سلول اندوتلیال سینوسی کبد.
طی این فرآیند، علاوه بر کبد و متابولیتهای رودهای، اگزوتوکسینها نیز با خون از راه سیستم ورودی به کبد وارد میشوند که این عمل روی هومئوستاز (تعادل) سیستمیک بدن میزبان موثر است. در انسانهای سالم، روده عمدتاً از اپی تلیوم مخاطی رودهای، مخاط روده، و فلور طبیعی روده تشکیل شده و بعنوان یک سد مخاطی عمل میکند. این سد طبیعی روده میتواند بهطور موثر باعث محدودیت دسترسی ترکیبات باکتریایی شود. در مواقع بیماری، از قبیل بروز بیماریهای کبدی، این سد مخاطی روده میتواند صدمه ببیند. تغییرمکان باکتری از روده به سیستم گردش خون و یا از راه محور روده-کبد میتواند منجر به تشدید حالت بیماریزایی شود. بیماری NAFLD یک سندروم بالینی شایع است که توسط فاکتورها و عواملی غیر از مصرف الکل یا هر گونه از دیگر صدمات تایید شده کبدی ایجاد میشود. مطالعات حاکی از آن هستند که تغییر میکروبیوتای روده ممکن است کلید ایجاد و بروز NAFLD باشد. در سالهای نزدیک و حدود 20 سال قبل، گزارش شد که استفاده از پروبیوتیکها میتواند هم باعث جلوگیری از تشکیل توده چربی و هم استحاله چربی در اطراف کبد شود. Roy و همکارانش نشان دادند که میکروبیوتای روده در موشهای بدون میکروب در ایجاد NAFLD دخیل بوده (10) که این موضوع کاملا مستقل از چاق بودن یا نبودن است. علاوه بر این Gomez-Hurtado و همکارانش (11) نشان دادند که تغییرمکان آنتی ژن باکتریایی سبب ایجاد التهاب سیستمیک و سراسری در بیماران مبتلا به NAFLD میشود. سایر بیماریهای کبدی نیز با تغییر در ترکیب جوامع میکروبیوتای ساکن در روده مرتبط هستند (12). در مطالعات مختلف اشاره شده است که دیس بیوزیس میکروبیوتای روده در بیماران NAFLD وجود دارد که میانگین فراوانی Bacterioidetes وAkkermansia muciniphila در آنان کمتر بوده و فراوانی پروتئوباکترها در آنان بیشتر است (13،14). افراد مبتلا به کلانژیت صفراوی اولیه نیز دچار دیس بیوزیس میشوند که تنوع باکتریایی آن نسبت به افراد کنترل سالم کمتر است. بیماران دارای کلانژیت اسکلروزان اولیه (PSC) برخی از جنس¬های باکتریایی را بیشتر داشتند که از این جنسهای میتوان به Veillonella و Enterococcus اشاره نمود و نیز کلستریدیومهای کامنسال در آنان کمتر دیده میشود (15). بیماران مبتلا به آسیب حاد و مزمن کبدی مرتبط با هپاتیت B در مقایسه با افراد سالم میزان گردش DNA باکتریایی بیشتر و تنوع میکروبی کمتری در بدن خود دارند (20-16). علاوه بر این، مطالعهای که توسط Wang و همکارانش انجام شد نشان داد که بیماران دارای سیروز کبدی ترکیب میکروبیوتای رودهای خاص و منحصر بفردی دارند که میزان Prevotella، Streptococcus، Staphylococcus و nterococcus در آنان بیشتر بوده و مقدار Ruminococcus و Clostridium در آنها کمتر میباشد (17). بنابراین، عدم توازن در میکروبیوتای روده در طیف وسیعی از بیماریهای کبدی تشخیص داده شده و ممکن است نقشی حیاتی و محوری در بیماریزایی ایفا نماید.
نتیجه و تاثیر عدم توازن میکروبیوتا در بروز بیماری کبد
به هم خوردن توازن میکروبیوتای روده میتواند آسیب کبدی را تشدید کرده و احتمالاً با پیشرفت یک سری از بیماریهای کبدی مزمن از جمله، ALD، NAFLD (25-18)، سیروز صفراوی اولیه (30-26)، هپاتیت ویروسی (31)، سیروز (32) و خصوصا انسفالوپاتی کبدی (HE) (35-33) در ارتباط است. HE یکی از بیماریهای جدی دستگاه عصبی مرکزی بوده که از نارسایی کبد ناشی میگردد و انواعی از هپاتیتهای مزمن و حاد و یا سیروز جبران نشده میتوانند سبب ایجاد آن شوند، این بیماری مرگ و میر و نیز شیوع بسیار بالایی را از خود نشان میدهد. در حال حاضر مکانیسم دقیق HE نامشخص است. از میان چندین مدل فرضیه، تئوری یا نظریه سمیت آمونیاک شناخته شدهترین مکانیسم این بیماری میباشد. افزایش آمونیاک خون میتواند باعث افزایش شیوع HE و تشدید ادم مغزی شود. این فرآیند رابطه نزدیک و تنگاتنگی با عدم توازن میکروبیوتای روده و محورهای روده-مغزی متغیر دارد (36). میکروبیوتای روده در بیماران مبتلا به سیروز و HE بهطور قابل ملاحظه¬ای با چیزی که در افراد سالم دیده میشود فرق میکند، برای مثال می¬توان به افزایش Escherichia coli و Enterococcus اشاره کرد (37). رشد و ظهور باکتری میتواند منجر به افزایش تولید آمونیاک گردد. عدم توازن میکروبیوتای روده نیز بهطور همزمان منجر به آسیب به سد مخاطی شده که با بالا رفتن نفوذپذیری مخاط روده و تغییرمکان اندوتوکسین باکتریایی همراه خواهد بود. تمامی موارد فوق الذکر جزء فاکتورهای مهمی برای ایجاد HE محسوب میشوند. در طرف دیگر مسمومیت با اندوتوکسین (اندوتوکسمی) با ایجاد نارسایی کبدی ارتباط داشته و سبب ایجاد عوارضی از قبیل HE می¬شود. علاوه بر این اندوتوکسمی نقشی مهم و حیاتی در گردش هایپردینامیک (بسیار پویا) مشاهده شده در مبتلایان به سیروز ایفا می¬کند (38،39). مطالعات متعددی تاکید کردهاند که محور روده-کبد-مغز میتواند تاثیرات حیاتی و محوری روی HE از طریق میکروفلور روده (40،41) اعمال کنند و مکانیسم HE نیز با میکروفلور روده در ارتباط می¬باشد. به عبارت دیگر، کبد 75 تا 80 درصد حجم خون هپاتیک یا کبدی را از راه سیاهرگ یا ورید باب (پورتال) دریافت میکند و سپس این خون وارد سیستم گردش خون خواهد شد. به منظور ممانعت از ورود میکروبها به سیستم گردش خون، تمامیت سد روده¬ای میتواند محتوای لومینال (مواد درون روده) را از محیط داخلی جدا کند. مدارک و شواهد حاکی از آن هستند که آمونیاک و اندوتوکسین با ایجاد و بروز HE در صورت سوء عملکرد سد رودهای در ارتباط هستند (42،43). وقتی عملکرد روده از بین رفت، باکتری¬ها و محصولاتشان از دستگاه گوارش به کبد مهاجرت می-کنند. آمونیاک بهعنوان متابولیت اصلی و عمده حاصل از محصولات باکتریایی، میتواند سمیت زیادی برای کبد (هپاتوتوکسیسیته) ایجاد نماید. در ضمن، سلولهای نوروگلیا نیز توسط آمونیاک فعال میشوند و باعث تولید هرچه بیشتر فاکتورهای پیش التهابی خواهد شد. این فاکتورها باعث صدمه به بافت مغزی شده و به دنبال آن شاهد اختلال شناختی در مغز خواهیم بود. علاوه بر این یک سری از مطالعات بالینی و پیش بالینی حاکی از وجود یک ارتباط دو جهتی یا متقابل بین مغز و میکروبیوتای روده میباشند. مشخص شده است که میکروبهای روده میتوانند سیگنالهایی را از مسیرهای عصبی، درونریز، و مسیرهای با واسطه سیستم ایمنی، به مغز بفرستند. نوع و مقدار اطلاعات و سیگنالهای حاصل از میکروبهای روده که به مغز میروند بهطور عمده به میکروبهای مستقر در آن ناحیه از روده بستگی دارد. لذا تغییر در میکروبیوتای روده میتواند با مختل شدن عملکرد مغز از راه محور روده-مغز همراه باشد. Kang و همکارانش (44) دریافتند که وجود یک حالت دیس بیوزیس در میکروبیوتای روده ممکن است با ایجاد و بروز التهاب سیستمیک و التهاب عصبی در ارتباط باشد که بخاطر سیروز ایجاد شده است. اعمال تغییرات خاص و ویژه در میکروبیوتای روده روی ابعاد و جوانب مختلفی از عملکرد مغز تاثیر میگذارد. این موضوع ممکن است توضیح دهنده و تشریح کننده مکانیسمهای مربوطه HE از یک نقطه نظر و چشم انداز دیگر باشد. در مطالعهای (35) از توالی یابی 16S rRNA به منظور آنالیز میکروبیوتای مدفوعی/بزاقی در بیماران مبتلا به سیروز استفاده کرده و دریافتند که فراوانی نسبی Lactobacillaceae در بیماری انسفالوپاتی کبدی مینیمال یا خفیف (MHE) بالاتر بوده که میتواند در تشخیص بهتر MHE مورد استفاده قرار گیرد.
نقش میکروبیوتای روده در درمان بیماریهای کبدی
مدارک گستردهای وجود دارند که نقش حیاتی و مهم تغییر در جوامع روده، میکروبیوتای آن، و کبد را در ایجاد انواعی از بیماریهای حاد و مزمن کبدی و نیز عوارض جانبی ناشی از آنان تایید میکنند (47-45). عدم توازن میکروبیوتای روده یک نقش کلیدی و حیاتی در پاتوفیزیولوژی این فرآیند ایفاء میکند. در بیماران مبتلا به سیروز حاد کبدی، عدم توازن در میکروبیوتای روده میتواند منجر به التهاب سیستمیک، اندوتوکسمی، و عوارض جانبی مربوطه (التهاب خودبخودی صفاق، عفونت روده و غیره) (48) شود که این موضوع باعث کاهش میزان تاثیر روشهای درمانی شده و ممکن است سبب تشدید آن بیماری و حتی مرگ شود. یک مطالعه کارآزمایی بالینی نشان داد که بیماران مبتلا به سیروز در اغلب موارد با آنتیبیوتیکها درمان میشوند که این آنتیبیوتیکها سبب کاهش گونههای موجود در میکروبیوتای روده و فراوانی آنان میشود. اینکار سبب اختلال در ترکیب و تنوع میکروبیوتای روده و تاثیر روی نتایج درمان میشود (49). بنابراین فاکتورهای میکروبی در بسیاری از بیماریهای کبدی با هر مرحله و شدتی، جزو فاکتورهای مقدم و پیشرو محسوب میشوند. این یافتهها معانی و استدلالهای درمانی مهمی در بر دارند، ما بایستی توجه و ارزش بیشتری به میکروبیوتای روده در زمان درمان بیماریهای کبدی معطوف نماییم. دستکاری و تغییر میکروبیوتا با استفاده از استراتژیهای مختلف از قبیل پریبیوتیکها، پروبیوتیکهای جدید، آنتیبیوتیکها یا FMT بایستی به عنوان یک مقیاس درمانی مهم و قابل اهمیت قلمداد شوند. از لحاظ تاثیر قابلملاحظه FMT باید گفت که این تاثیر ممکن است به قدرتمندترین مقیاس و معیار برای اصلاح میکروبیوتای نامتوازن روده در آینده مبدل گردد.
پیوند میکروبیوتای مدفوعی
FMT یک روش درمانی مبتکرانه بالینی است که مدفوع فرآوری شده و غربالگری شده را از مسیر گوارشی فوقانی یا تحتانی از اهدا کننده یه یک گیرنده منتقل کرده تا به این طریق میکروبیوتای ناقص را بازیابی کرده و عدم توازن باکتریایی را نیز اصلاح نماید. تقریباً 1700 سال قبل در چین، Ge Hong توانست اسهال شدید را با استفاده از مواد مدفوعی (از راه دهان) درمان نماید (50). در سال 1958 بکارگیری و استفاده از مدفوع از راه تنقیه به منظور درمان بیماران مبتلا به انتروکولیت با غشاء کاذب نیز گزارش شد (51). در سال 1983 یک بیمار مبتلا به انتروکولیت مکرر Clostridium difficile پس از دریافت فلور رودهای از راه استفاده از مدفوع درمان شد که این اولین استفاده بالینی از روش FMT بود (52). بعدها FMT بهطور وسیعی در CDI و سایر بیماریهای رودهای و خارج رودهای استفاده شد. بنابراین توجه و تمرکز پژوهشهای اخیر بیشتر به سمت نقش درمانی بالقوه این روش در بیماری حاد و مزمن کبدی حرکت کرده است.
روشهای پیوند میکروبیوتای مدفوعی
پروتکلهای درمانی FMT ممکن است بسته به نوع بیماری بسیار متفاوت و متغیر باشند و چیزی که اهمیت دارد انتخاب و گزینش شخص اهدا کننده است. اهداکنندگان سالم ممکن است افراد غیر خویشاوند، خویشاوندان نزدیک، یا اعضای خانواده باشند. با اینحال دستورالعملها و خطی مشیهای فعلی پیشنهاد میکنند که بهترین منبع اهدا کننده یک شخص غیر خویشاوند است. این موضوع به این دلیل است که خویشاوندان و اعضای خانواده ممکن است محیط زندگی مشترک و نیز رژیم غذایی مشابهی را با فرد گیرنده داشته باشند. در عوض، افراد غیر خویشاوند جوامع بسیار متفاوتی را در میکروبیوتای روده خود دارند. به منظور تضمین موفقیتآمیز بودن عمل پیوند، نیاز است که اهدا کننده تست غربالگری داده و تحت یک سری از مقیاسهای سختگیرانه و دقیق بایدها و نبایدها طبق پروتکل تایید شده قرار گیرد (5). مواد مدفوعی تازه، رقیق و همگن میشوند تا به شکل قابل استفاده برسند (53). مواد مدفوعی منجمد نیز میتوانند در برخی موارد استفاده شوند (54). با اینحال تنوع باکتریایی موجود در محصولات منجمد ممکن است از مواد تازه کمتر باشد. در مطالعهای که اخیراً روی بیماران مبتلا به CDI انجام شد نشان داده شد که مواد مدفوعی منجمد در مقایسه با مواد تازه بازده و تاثیر درمانی کمتری دارند. روش و مسیرهای استفاده مواد نیز متفاوت است. میکروبیوتای مدفوعی را میتوان از راه آندوسکوپی، کپسول و کلونوسکوپی وارد مجرای روده نمود (58-54). با اینحال مسیر بهینه FMT هنوز کاملاً مشخص نشده است. تنقیه ابقایی متداول ترین روش در کشور چین است چرا که مطمئن و ارزان میباشد، اما توانایی کلونیزه شدن و مستقر شدن میکروبیوتا در آن محدود است. کپسول دهانی نیز یک روش غیر تهاجمی بوده و توسط بیماران ترجیح داده می شود ولی هزینه آن بقدری بالاست که معمولاً شخص از انجام آن منصرف می¬شود. علاوه بر این، شایان ذکر است که بدانیم دادههای مهم بایستی در زمان اجرای تست¬های FMT جمعآوری شوند که از این دادهها میتوانند به اطلاعات ریزمغذی و درشت مغذی¬ها اشاره کنند که عبارتند از استفاده از PPI، متفورمین، سابقه دیابت شخص، چاقی، مصرف آنتی بیوتیک، سابقه جراحی GI، IBD و سایر بیماریهای روده (64-59).
علائم متداول و میزان اثر بخشی
تعداد قابل توجهی از آزمایشات بالینی وجود دارند که هدف و تمرکزشان روی بررسی بیماریهایی است که در آنان میتوان از FMT برای افزایش بازده و تاثیرگذاری و نیز امنیت استفاده نمود. تا به امروز، FMT بهعنوان آخرین امید برای درمان CDI شدید شناخته میشود (65). بهعبارتی دیگر، مدارک نشان دادهاند که FMT یک روش درمانی امن و موثر علیه CDI میباشد (62،59). علاوه بر این، FMT برای درمان بسیاری از انواع بیماریها از قبیل بیماریهای رودهای، بیماریهای کبدی، و اختلالات عصبی میتواند موثر عمل کند (69-66). در بسیاری از موارد گزارش شده است که روش FMT کاملاً امن و مطمئن، تطبیق پذیر، و بسیار موثرتر از مقیاسها و روشهای قبلی تنظیم میکروبیوتای روده از جمله پریبیوتیکها، پروبیوتیکها و آنتیبیوتیکها میباشد (53). در مطالعهای گزارش شد که از بین 536 بیمار مبتلا به CDI که تحت درمان FMT قرار داشتند، میزان پاسخ بالینی حداکثر تا 87 درصد بوده است و هیچ اتفاق مشکلساز و غیر منتظرهای نیز مشاهده نشده است (70). یک مطالعه دیگر از کپسولهای مدفوع منجمد برای درمان 20 بیمار مبتلا به CDI استفاده کرد که میزان پاسخگویی و عملکرد آن پس از برگزاری یک یا دو دوره درمان برابر 90 درصد بوده و هیچ عارضه جانبی ناسازگار نیز بروز نکرد. مطالعاتی که در بالا گفته شد حاکی از آن هستند که استفاده و بهکارگیری روش FMT در بیماران CDI موثر و امن میباشد. با اینحال گزارش شده که در سال 2019 دو بیمار دارای CDI پس از درمان با FMT دچار باکتریمی شده و یکی از آنان را به کام مرگ کشاند. این دو بیمار هر دو کپسولهای مدفوعی را از یک اهداکننده مشترک دریافت کردند که نشان میدهد روش FMT نیز چندان بی خطر و بدون ریسک هم نیست. پس بنابراین تقویت و پیشرفت عمل غربالگری شخص اهداکننده به منظور محدودکردن و کاستن انتقال میکروارگانیسمهایی که میتوانند منجر به ایجاد عفونتهای ناسازگار و درگیرکننده شوند، امری واجب و ضروری به شمار میرود (71). در یک آزمایش تصادفی با 70 تن از بیماران مبتلا به کولیت اولسراتیو (UC)، میزان شروع دوره بهبودی بیماری در گروهی که تحت درمان FMT بودند و گروهی که با دارونما کنترل میشدند به ترتیب برابر 24 و 5 درصد بود (72). علاوه بر این هیچ تفاوت قابلملاحظهای از لحاظ رخ دادن نتایج و عوارض بین دو گروه مشاهده نشد. لذا FMT نسبت به دارونما، درصد شروع بهبودی را در بیماران UC بهطور فوق العادهای بالاتر میبرد و هیج عارضه ناسازگار و مشکل ساز اضافهای نیز در این مسیر وجود نداشت. Yu و همکارانش میزان بازده و کارایی کپسولهای دهانی FMT را در 22 فرد بزرگسال چاق طی یک آزمایش تصادفی و دو سوکور، سنجیدند (73). نتایج نشان داد که این کپسولها بهخوبی با بدن فرد سازش پیدا کرده و منجر به تغییرات مداوم در میکروبیوم روده شده که مشابه چیزی بود که در اهداکننده لاغر اندام شاهدش بودیم. با این وجود روش FMT نتوانست شاخص توده بدنی (BMI) را در بیماران چاق در مقایسه با گروهی که توسط دارونما کنترل شده بودند، کاهش دهد.
جدول 1: اطلاعات بهدست آمده در مورد میزان درشت مغذی و ریز مغذیها در آزمایشات مرتبط با FMT

اختصارات: CHB: هپاتیت B مزمن، ETOH: اتانول، FMT: پیوند میکروبیوتای مدفوعی، IBD: بیماری التهابی روده، NAFLD: بیماری کبد چرب غیر الکلی، PDFF: کسر چربی چگالی پروتون، PSC: کلانژیت اسکلروزان اولیه، SAH: هپاتیت شدید الکلی.
پیوند میکروبیوتای مدفوعی در بیماریهای کبدی
انسفالوپاتی کبدی
انسفالوپاتی کبدی (HE) جدیترین عارضه جانبی ناشی از سیروز کبدی بهشمار میرود. HE تکرار شوند یا عودکننده از علل پیشرو و پیشقدم در ابتلای مجدد، آسیب مغزی، و مرگ به حساب میرود. خونریزی بخش فوقانی دستگاه گوارشی و عفونت این بخش باعث عود کردن و برگشت مجدد بیماری در بسیاری از افراد میشود. این بیماران معمولا تحت درمان آنتیبیوتیکی قرار میگیرند که میتواند باعث اختلال در تنظیم میکروبیوتای روده شود و لذا میدان برای HE بازتر خواهد شد (75،74). درمان اصولی و استاندارد موجود برای HE از قبیل لاکتولوز و ریفاکسیمین، میتواند سبب تقویت محیط میکروبیوتای روده شود. با اینحال تاثیری که این دو دارو از لحاظ درمانی دارند نسبتاً ضعیف است. تا به امروز تعداد انگشتشماری از مطالعات منتشر شدهاند که میزان تاثیر و بازدهی روش FMT را روی بیماری HE آنالیز میکنند. در سال 2016، Kao و همکارانش اولین مورد ابتلا به HE درجه 1 تا 2 را گزارش کرده که این شخص تحت درمان FMT قرار گرفته بود (61). نتایج حاصل از FMT پی در پی و متوالی بسیار دلگرم کننده بود. علائم بیماری در فرد هم از لحاظ درونی و هم عینی بهبود پیدا کرده بود. بعدها تعداد بیشتری از پژوهشگران شروع به جستجو و کاوش FMT در بیماری HE نمودند. مطالعهای که روی تاثیر FMT کپسولی روی HE کار میکرد از شاخصهای متفاوتی استفاده کرده و آنان را آزمایش نمود، این شاخصها عبارتند از بیخطر بودن، تحمل، تغییرات ایجاد شده در میکروبیوتا، و عملکرد مغز که پس از انجام درمان با FMT، تنوع مخاط دوازدهه، E-کادهرین دوازدهه، و مکانیسم دفاعی A5 دستخوش افزایش شده بودند، ولی اینترلوکین6 و سرم LBP کاهش پیدا کردند (75). علاوه بر مطالعات بالینی، مطالعات پیش بالینی نیز استفاده از FMT را در مورد HE تایید کردند. Wang و همکارانش (76) برای اینکه بفهمند آیا FMT قادر به جلوگیری از بروز HE هست یا خیر، مدل آزمایشگاهی موش مبتلا به HE را که عملکرد کبدش تحت تاثیر کربن تتراکلرید (CCl4) بهطور حاد دچار اختلال شده بود تعبیه نمودند. موشها یکی پس از دیگری تحت درمان FMT قرار گرفتند و نتایج اثبات کرد که FMT میتواند سبب بهبود رفتار موشها، کاهش درجه HE، و توانایی یادگیری فضایی شود. علاوه بر این FMT از نکروز (مرگ) کبد و آسیب به سد مخاطی روده نیز ممانعت میکند. FMT ممکن است میزان نفوذپذیری روده را تغییر داده و پاسخ TLR کبد را از راه کاهش بیان TLR4 و TLR9 تقویت نماید. در نتیجه مدارک بالینی و پیش بالینی هر دو حاکی از موفقیت آمیز بودن روش FMT در پیش تشخیصی بیماران HE میباشند.
عوارض ناشی از سیروز کبدی
دیس بیوزیس روده در 20 تا 75 درصد از بیماران مبتلا به سیروز ظاهر میشود. ترکیب میکروبیوتای رودهای و عملکرد سد روده، حتی با مصرف قبلی ریفاکسیمین نیز تحت تاثیر قرار میگیرند. علاوه بر این وقوع و شیوع سیروز و عوارض جانبی مربوط به آن با یک سری از ناهنجاریها در میکروبیوتای روده در ارتباط هستند (77). از عوارض جانبی شایع و پر تکرار سیروز کبدی میتوان به پریتونیت (التهاب صفاق) خودبهخودی باکتریایی، آسیت و سپسیس اشاره نمود. در بیماران مبتلا به سیروز، ترکیب خاص و پیچیدهای از میکروبیوتای روده شناسایی و کشف شده است و میزان باکتری Clostridium در سرم بیمارانی که آسیت دارند افزایش یافته است (78). مهمتر از همه اینکه مقدار انتقال باکتری در حضور افزایش فشار خون پورتال (ورید باب) افزایش مییابد. این تغییرات عملکردی و ساختاری عمدتا به اسیدهای چرب زنجیره کوتاه (SCFAs) مدفوعی مرتبط هستند. عدم توازن در میکروبیوتای روده که باعث تشدید پیشرفت بیماری کبد میشود، بهخاطر مصرف آنتیبیوتیکها بیش از پیش شدیدتر میشود. بنابراین بازیابی میکروبیوتای روده میتواند هم سبب کاهش آمونیاک در سرم و هم سطح اندوتوکسمی شده و مانع از بروز عوارض جانبی ناشی از سیروز شود. یک تست امنیت تک فازی به منظور بررسی روش FMT در بازیابی عملکرد میکروبهای روده در بیماران سیروزی اجرا شده که 10 بیمار به گروه FMT و استاندارد مراقبت (SOC) اختصاص یافتند (49). بهخاطر مصرف آنتیبیوتیکها و ریفاکسیمین، ترکیب میکروبی و علائم عملکردی (BA، SCFA، 7 آلفا-دهیدروکسیلاسیون) قبل و بعد از یک جلسه تکی FMT آنالیز شدند. پژوهشگران دریافتند که FMT میتواند باعث تحریک ترشح SCFA ها و تعدیل وضعیت BA و لذا بازیابی توانایی و قدرت متابولیک، مخصوصا در کوتاه مدت پس از انجام FMT شود. تاثیرات طولانیمدت FMT نیازمند کاوش بیشتر هستند. به دلیل محدود بودن اندازه نمونههای مطالعات فعلی در این دست نوشته، در آینده نیاز است که یک سری مطالعات مقیاس بزرگ به منظور تایید هرچه بیشتر ارزش FMT در سیروز انجام شود.
کلانژیت اسکلروزان اولیه
کلانژیت اسکلروزان اولیه (PSC) یک بیماری خود ایمنی و مزمن کبدی با پیشآگهی ضعیف بوده و در اغلب موارد با IBD در ارتباط است. استفاده از پیوند کبد تنها راه درمان مبتلایان به این بیماری است. ثابت شده است که عدم توازن میکروبیوتای روده با پیشرفت بیماری PSC در ارتباط است. یک مدل موشی GF از PSC تهیه شده و اثبات کرد که عدم حضور میکروبیوتای روده باعث تشدید بیماری¬های صفراوی-کبدی میشود که همین موضوع می تواند به اهمیت روش FMT اشاره کند (79). عمل بازیابی میکروبیومی، به خاطر کمبود روشهای درمانی موثر، به یک هدف درمانی برای PSC تبدیل شده است (80). مطالعاتی که پیشتر انجام شد نشان داده که مصرف ونکومایسین از راه دهانی میتواند در درمان بیماران مبتلا به PSC موثر باشد که این دارو تاثیر خود را از راه اصلاح و تعدیل میکروبیوم روده اعمال میکند. از اینرو، FMT ممکن است یک روش درمانی ممکن و میسر تر علیه PSC به شمار رود. روش FMT میتواند سبب تقویت و افزایش تنوع میکروبیومی و بیوشیمی کبد در مبتلایان به PSC شود. اولین مورد استفاده از روش درمانی FMT علیه PSC در سال 2018 توسط Philips (81) منتشر شد. طبق تشخیصها یک مرد 38 ساله به PSC مبتلا بوده و همزمان دچار کلانژیت حاد و عودکننده باکتریایی ولی بدون IBD بوده است. این شخص 4 هفته و هفتهای یک بار تحت درمان FMT اندوسکوپی قرار گرفت و مصرف تمامی آنتی بیوتیکها نیز در طول مدت درمان متوقف شد. تعدادی از مطالعات نشان دادهاند که کاهش در BA ها و آلکالین فسفاتاز (ALP) منجر به پیش تشخیصی بهتر میشود. پس از درمان با FMT، BA و ALP بیمار کاهش یافته و شخص به مدت یکسال بیماری را تجربه نکرد. در مورد میکروبیوتای روده این شخص، کاهش فراوانی Proteobacteria (شاخهای از باکتریها که حاوی تعداد بیشماری از پاتوژنهای انسانی است) و افزایش Firmicutes (شاخهای که دارای تاکسونهای زیادی بوده و احتمالاً دارای خواص ایمونولوژیک سودمندی نیز هستند) مشاهده شد. تمام این نتایج، استفاده از FMT را علیه PSC تقویت و تصدیق کردند. نتایج حاصل از این مطالعات بیانگر این است که روش FMT در درمان PSC کاملاً بی خطر است، اما توانایی FMT در بهبود بیماری و دوره¬های مورد نیاز FMT هنوز تعیین و مشخص نشده است (84-82). برخی از مطالعات از 4 پیوند مدفوعی استفاده کردند در حالیکه سایرین از یک پیوند استفاده نمودند. بررسی روشهای بهینه FMT و نقاط زمانی امری مهم و حائز اهمیت در تعیین میزان بازده FMT در PSC دارند.
کبد چرب (الکلی، غیر الکلی)
بیماران مبتلا به هپاتیت الکلی شدید (SAH) پیشآگهی ضعیفی دارند، میزان مرگ و میر در یکسال اول بالا بوده و یا حدود 60 درصد آنان به پیوند کبد نیاز پیدا میکنند. پس از ترک مصرف الکل و تغییر شیوه زندگی، کبد چرب به پیشرفت خود ادامه خواهد داد. بنابراین گزینههای درمانی این بیماری به شدت محدود و کم هستند. گفته می¬شود که پیشروی بیماری کبدچرب الکلی (ALD) و NAFLD هر دو با عدم توازن میکروبیوتای روده در ارتباط هستند. مطالعات بالینی محدودی میزان کارایی و بازده FMT را در بیماری ALD و NAFLD بررسی کرده اند (85). از روش FMT در یک مطالعه که 64 کودک چاق را که طی سونوگرافی مشخص شده بود مبتلا به NAFLD هستند (87-86)، طی یک آزمایش تصادفی و سه سو کور استفاده شد. پس از مصرف کپسولهای پروبیوتیک، مقدار آلانین آمینوترانسفراز، آسپارتات آمینوترانسفراز،کلسترول، و تریگلیسرید و اندازه دور کمر بهطور قابل ملاحظهای کاهش یافتند، این موضوع بدان معناست که ترکیبات پروبیوتیک در درمان NAFLD اطفال موثر و موفق عمل کردهاند. کپسولهای پروبیوتیک هم در درمان NAFLD موثر و کارآمد هستند. بنابراین روش FMT که ساختار باکتریایی سودمندتر و میکروبیوتای رودهای عادی و نرمالی دارد، بایستی موثر تر از این چیزی که الان میبینیم باشد. Zhou و همکارانش (88) نقش FMT را در درمان استئاتوهپاتیت یا استئاتوز کبدی در موشهای آزمایشگاهی بررسی نمودند. نتایج مطالعات آنان نشان داد که روش FMT میتواند استئاتوهپاتیت را از راه اصلاح اختلالات ایجاد شده در میکروبیوتای روده و نیز کاهش تجمع لیپید در داخل کبد و سایتوکاینهای پپیش التهابی تضعیف و تقلیل کند. در یک مطالعه میکروبیوتای روده بیماران مبتلا به ALD را به موش-های آزمایشگاهی سالم و استریل پیوند زد، که منجر به ایجاد التهاب کبدی شدید ناشی از الکل شد (14). همچنین Cassard و همکاران دریافتند که درمان با پکتین و FMT هر دو مانع از آسیب کبدی ناشی از الکل میشوند (89). این مطالعات بهطور متقاعدکننده و مستدلی نشان دادند که FMT در زمره روشهای پیش بالینی علیه بیماری ALD قرار خواهد گرفت. با اینحال مطالعات نسبتاً کمی وجود دارد که روش FMT را در ALD و NAFLD مزمن مورد بررسی قرار می¬دهند. بهطور قطع تضمین میشود که مطالعات بیشتری روی FMT در بیماریهای کبد چرب انجام بگیرد.
آسیب حاد کبدی
آسیب حاد کبدی (ALI) تحت عنوان آسیب حاد سلول¬های کبدی و نکروز آنان تعریف میشود و عوامل مختلفی در ایجاد آن از جمله مصرف الکل، سمیت پاراستامول، ایسکمیدر کبد، هپاتیت ویروسی و خود ایمنی، و صدمات کبدی ناشی از مصرف دارو می توانند نقش داشته باشند. اگر بیماران به سرعت تشخیص داده نشوند و فورا تحت درمان قرار نگیرند، ALI ممکن است به نارسایی حاد کبدی (ALF) تبدیل شده که این بیماری تلفات به شدت بالایی داشته که میزان آن حداکثر در عرض 90 روز به 40 درصد می¬رسد. بیش از نصف موارد ابتلا به ALF بیماریشان به قدری پیشرفت میکند که نیاز به پیوند کبد پیدا میکنند. بهنظر می-رسد یک پاسخ مازاد و اضافی التهابی و سیستمیک وجود دارد که نقش حیاتی در تبدیل ALI به ALF بازی می-کند. عدم توازن میکروبیوتای روده نه تنها به این پاسخ التهاب سیستمی، بلکه به خود بیماری ALI نیز مربوط میباشد. برای مثال، گزارش شد که Lactobacillus salivarius L101 باعث تسکین و کاهش آسیب کبدی میشود (90). در طول دوره درمان ALI یا ALF، استفاده از پروبیوتیکها معمولا تجویز میشود اما فواید کمی برای زنده ماندن شخص در بردارند. روش FMT یک استراتژی درمانی بالقوه برای ALI و ALF به منظور تنظیم میکروبیوتای روده محسوب میشود. HE اصلی¬ترین و پیشروترین علت مرگ در بیماری ALF است. در یک مدل موشی مبتلا به ALF طی آزمایشاتی مشخص شد روش FMT تاثیرات محافظتی قدرتمندی را روی فعالیت حرکتی موش دارد که با روش استفاده از پروبیوتیک¬ها کاملاً قابل مقایسه بودند. روش FMT بهطور موثری سبب تقویت رفتار و توانایی¬های شناخت فضایی در افراد مبتلا به HE می¬شود. از همه مهمتر، مقدار اندیکاتور یا شاخص¬های بیوشیمیایی ایجاد کننده سمیت کبدی یا هپاتوتوکسیسیته (ALT, AST, ALP, TBIL, DTBIL) و حد واسط¬های التهابی (IL-1β, TNF-α, TLR4, TLR9) نیز در گروه دریافتکننده FMT در مقایسه با گروه کنترل به شدت کاهش یافته بود. کاهش نفوذپذیری روده و نیز کاهش مقدار آمونیاک سرم نیز بهطور همزمان در مدل موشی FMT مشاهده شد. در نتیجه روش FMT موفق شد نکروز کبدی را در ALI از راه کاهش نفوذپذیری روده، پاکسازی آمونیاک سرم، و محدودکردن التهاب سیستمی، متوقف نماید (76). این مطالعات حیوانی یک اصل و خط مشی را برای استفاده بالینی از روش FMT در بیماری ALI و ALF فراهم کرده¬اند.
چشماندازهای آینده
عفونت ناشی از ویروس هپاتیت B(HBV) هنوز هم یک بار سنگین و جدی بر سیستمهای درمانی جهان به شمار می-آید که نرخ شیوع آن تا 7 یا 8 درصد نیز میرسد. اگر این بیماری درمان نشود، ممکن است به سیروز کبدی یا سرطان کبد تغییرشکل دهد. بنابراین، مدیریت و اداره بیماری HBV برای کاهش شیوع سیروز و سرطان کبدی بسیار حیاتی و حائز اهمیت است. Wang و همکارانش با مقایسه فلور طبیعی روده بیماران مبتلا به هپاتیت B مزمن (CHB) با گروه سالم، دریافتند که میزان باکتریوئیدها در بیماران CHB بر اساس توالییابی ناحیه V3-V4 ژن16S rRNA متعلق به میکروبیوتای روده، کاهش پیدا کرده است. علاوه بر این، تغییرات ساختاری میکروبیوتای روده که بهخاطر بیماری کبدی و شدت بیماری ایجاد می¬شود بهطور متقابل تصادفی هستند. این تغییرات احتمالاً روی تغییر شکل بیماری CHB و تبدیل آن به سیروز کبدی، سرطان کبد، یا نارسایی کبدی تاثیر دارند. مطالعاتی که روی موشها انجام شده نیز مشخص کرده که میکروبیوتای روده ممکن است روی پاسخ سیستم ایمنی میزبان و توانایی آن در حذف و نابود کردن عفونت HBV تاثیر داشته باد. بنابراین روش FMT می¬تواند بهعنوان یک روش درمانی بالقوه برای تعدیل و تنظیم سیستم ایمنی در بیماران مبتلا به عفونت مزمن HBV به شمار رود. طی یک مطالعه کنترل شده غیر تصادفی، 14 بیمار با HBe-Ag (آنتی ژن) مثبت تحت درمان با شش چرخه FMT از راه گاستروسکوپی و نیز درمانهای ضد ویروسی (بهطور همزمان) یا همان ALI تحت عنوان آسیل حاد به سلولهای کبدی و نکروز آنان تعریف میشود و این بیماری علل متفاوتی از جمله مصرف الکل، سمیت پاراستامول، ایسکمی در کبد، هپاتیت ویروسی و خود ایمنی، و صدمات کبدی ناشی از مصرف دارو دارد میتواند داشته باشد. اگر بیماران به سرعت تشخیص داده نشوند و فورا تحت درمان قرار نگیرند، ALI ممکن است به نارسایی حاد کبدی (ALF) تبدیل شده که این بیماری تلفات به شدت بالایی داشته که میزان آن حداکثر در عرض 90 روز به 40 درصد می¬رسد. بیش از نصف موارد ابتلا به ALF بیماریشان به قدری پیشرفت میکند که نیاز به پیوند کبد پیدا میکنند. بنظر میرسد یک پاسخ مازاد و اضافی التهابی و سیستمیک وجود دارد که نقشی حیاتی در تبدیل ALI به ALF بازی می¬کند. عدم توازن میکروبیوتای روده نه تنها به این پاسخ التهاب سیستمی، بلکه به خود بیماری ALI نیز مربوط میباشد. برای مثال، گزارش شد که Lactobacillus salivarius L101 باعث تسکین و کاهش آسیب کبدی میشود (90). در طول دوره درمان ALI یا ALF، استفاده از پروبیوتیک¬ها معمولا تجویز میشود اما فواید کمی برای زنده ماندن شخص دربر دارند. روش FMT یک استراتژی درمانی بالقوه برای ALI و ALF به منظور تنظیم میکروبیوتای روده محسوب می¬شود. در مطالعهای که روی 18 بیمار HBe-Agمثبت انجام شد و در افرادیکه درمان FMT داشتند، از هر پنج بیمار دو نفر از آنها کاملاً از HBe-Ag پاک شده بودند ولی هیچ یک از 13 نفر قرار گرفته در گروه کنترل چنین نتیجهای را نشان ندادند. این یافتهها بدان معناست که روش FMT در برابر عفونت HBC موثر عمل میکند. با اینحال تاثیرات طولانی مدت FMT روی عفونت مزمن HBC هنوز کاملا مشخص نشده است (91). به منظور رسیدن به نتایج مستحکم و مطمئن در مورد استفاده از FMT در هپاتیت نیاز به پژوهشهای عمیق و گستردهتری می باشد. کارسینوما یا سرطان سلولهای کبدی (HCC) سومین علت اصلی مرگ و میر ناشی از سرطان در سطح دنیا بوده و قویا با ابتلا به HBV و ویروس هپاتیت C در ارتباط است. مشاهدات تجربی و آزمایشگاهی روی موش-ها نشان داد که عدم توازن میکروبیوتای روده سبب افزایش نرخ ابتلا به HCCشده و میتوان با استفاده از پروبیوتیکها از رشد تومور جلوگیری بهعمل آورد (92). این مطالعات حاکی از آن هستند که تعدیل و اصلاح میکروبیوتای روده ممکن است سبب بهبود نتایج حاصل از بیماران HCC شود. روش FMT پتانسیل و توانایی عظیمی برای بکارگیری در امر کنترل و مدیریت HCC دارد. با اینحال بررسی متونی که داشتیم تا به امروز مطالعه ی بالینی دیده نشد که از درمان HCC با روش FMT صحبت کرده باشد، که بررسی¬های بیشتری را به گوش میرساند. چالشهای فعلی و آزمایشها درحال انجام که FMT را در بیماران مبتلا به بیماریهای کبدی از قبیل HBV و HCC آزمایش میکنند را می-توان در سایت Clinicaltrials.gov مشاهده کرد.
نتیجهگیری
عدم توازن در میکروبیوتای روده بهطور قابل ملاحظه-ای در ایجاد طیف وسیعی از بیماری¬های کبدی نقش دارد. روش FMT یک رویکرد جدید و بدیع به منظور درمان بیماری¬های کبدی بوده که این کار را از راه بازیابی میکروبیوتای سالم روده، کاهش شیوع و تلفات ALI یا HE و نیز افزایش نرخ بقا (زنده ماندن) در بیماران PSC انجام می دهد. روش FMT در مقایسه با روشهای سنتیتر پیشین (پروبیوتیکها) مستقیم ترین راه برای تغییر ترکیب و تنوع میکروبیوتای روده بهشمار میرود. پژوهشهای علم پایه و مطالعات بالینی هر دو اثبات کردهاند که روش FMT میتواند بهطور موثر باعث تقویت و بهبود میکروبیوتای روده در زمان ابتلا به بیماریهای حاد و مزمن کبدی، بازسازی و بازیابی توازن میکروبیوم روده، و تسریع بهبودی فرد بیمار شود. با اینحال تنها تعداد کمی از مطالعات بالینی به بررسی روش FMT در درمان هپاتیت B مزمن و HCC کبدی پرداختهاند. تعداد زیادی از مطالعات کنترل شده تصادفی بهصورت فوری و سریع برای بررسی میزان اثر بخشی FMT در هپاتیت و HCC مورد نیاز هستند، مخصوصاً در بررسی کارآیی طولانی مدت آن، تا بدین طریق بتوان بار حاصل از بیماری را در کشورمان کاهش داد. با اینکه روش FMT یک راه بی خطر، موثر، و ارزان قیمت برای درمان بسیاری از بیماریهاست، اما یک سری محدودیت نیز دارد که از بین آنان میتوان به رضایت شخص بیمار برای انجام این روش اشاره کرد. علاوه بر این روشهای پیوند نیز بایستی بهبود بیشتری بیابند. بنظر می رسد تاسیس بانک میکروبی مدفوعی باید در دستور کار قرار گیرد تا بتوان از این راه منبعی از باکتری¬های سالم مدفوعی را برای بیماران تامین نمود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Sorbara MT, Pamer EG. Microbiome-based therapeutics. Nature Reviews Microbiology 2022; 20(6): 365-80.
2- Ianiro G, Iorio A, Porcari S, Masucci L, Sanguinetti M, Perno CF, et al. How The Gut Parasitome Affects Human Health. Therap Adv Gastroenterol 2022; 15: 17562848221091524.
3- Ghaffari S, Abbasi A, Somi MH, Moaddab SY, Nikniaz L, Kafil HS, Ebrahimzadeh Leylabadlo H. Akkermansia Muciniphila: From Its Critical Role in Human Health to Strategies for Promoting its Abundance in Human Gut Microbiome. Crit Rev in Food Sci Nutr 2022: 1-21.
4- Baghi HB, Naghili B, Shanehbandi D, Leylabadlo HE. Evaluation of a Human Gut-Associated Phage and Gut Dominant Microbial Phyla in the Metabolic Syndrome. Clin Nutr ESPEN 2022; 50: 133-7.
5- Zoghi S, Abbasi A, Heravi FS, Somi MH, Nikniaz Z, Moaddab SY, et al. The Gut Microbiota and Celiac Disease: Pathophysiology, Current Perspective and New Therapeutic Approaches. Crit Rev Food Sci Nutr 2022: 1-21.
6- Davis BC, Bajaj JS. The Human Gut Microbiome in Liver Diseases. Semin Liver Dis 2017; 37(2): 128-40.
7- Mancini A, Campagna F, Amodio P, Tuohy KM. Gut: Liver: Brain Axis: The Microbial Challenge in the Hepatic Encephalopathy. Food funct 2018; 9(3): 1373-88.
8- Bajaj JS, Kassam Z, Fagan A, Gavis EA, Liu E, Cox IJ, et al. Fecal Microbiota Transplant from a Rational Stool Donor Improves Hepatic Encephalopathy: A Randomized Clinical Trial. Hepatology 2017; 66(6): 1727-38
9- Madsen M, Kimer N, Bendtsen F, Petersen AM. Fecal Microbiota Transplantation in Hepatic Encephalopathy: A Systematic Review. Scand J Gastroenterol 2021; 56(5): 560-9.
10- Le Roy T, Llopis M, Lepage P, Bruneau A, Rabot S, Bevilacqua C, et al. Intestinal Microbiota Determines Development of Non-Alcoholic Fatty Liver Disease in Mice. Gut 2013; 62(12): 1787-94
11- Parsaei M, Sarafraz N, Moaddab SY, Leylabadlo HE. The Importance of Faecalibacterium Prausnitzii in Human Health and Diseases. New Microbes and New Infections 2021; 43: 100928.
12- Quesada-Vázquez S, Aragonès G, Del Bas JM, Escoté X. Diet, Gut Microbiota and Non-Alcoholic Fatty Liver Disease: Three Parts of the Same Axis. Cells 2020; 9(1): 176.
13- Leung C, Rivera L, Furness JB, Angus PW. The Role of the Gut Microbiota in NAFLD. Nat Rev Gastroenterol Hepatol 2016; 13(7): 412-25.
14- Wang R, Tang R, Li B, Ma X, Schnabl B, Tilg H. Gut Microbiome, Liver Immunology, and Liver Diseases. Cel Mol Immunol 2021; 18(1): 4-17.
15- Zheng Y, Ran Y, Zhang H, Wang B, Zhou L. The Microbiome in Autoimmune Liver Diseases: Metagenomic and Metabolomic Changes. Front Physiol 2021: 12: 715852.
16- Boursier J, Mueller O, Barret M, Machado M, Fizanne L, Araujo‐Perez F, et al. The Severity of Nonalcoholic Fatty Liver Disease is Associated with Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology 2016; 63(3): 764-75.
17- Wang Y, Pan CQ, Xing H. Advances in Gut Microbiota of Viral Hepatitis Cirrhosis. BioMed Res Int 2019; 2019: 9726786.
18- Leylabadlo HE, Sanaie S, Heravi FS, Ahmadian Z, Ghotaslou R. From Role of Gut Microbiota to Microbial-Based Therapies in Type 2-Diabetes. Infect Genet Evol 2020; 81: 104268.
19- Kaikkonen JE, Würtz P, Suomela E, Lehtovirta M, Kangas AJ, Jula A, et al. Metabolic Profiling of Fatty Liver in Young and Middle-Aged Adults: Cross-Sectional And Prospective Analyses of The Young Finns Study. Hepatology 2017; 65(02): 491-500.
20- Loomba R, Seguritan V, Li W, Long T, Klitgord N, Bhatt A, et al. Gut Microbiome-Based Metagenomic Signature for Non-Invasive Detection of Advanced Fibrosis in Human Nonalcoholic Fatty Liver Disease. Cell Metab 2019; 30(3): 607.
21- Boursier J, Mueller O, Barret M, Machado M, Fizanne L, Araujo-Perez F, et al. The Severity of Nonalcoholic Fatty Liver Disease Is Associated with Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology 2016; 63(3): 764-75.
22- Bluemel S, Williams B, Knight R, Schnabl B. Precision Medicine in Alcoholic and Nonalcoholic Fatty Liver Disease Via Modulating the Gut Microbiota. Am J Physiol Gastrointest Liver Physiol 2016; 311(6): G1018-36.
23- Liu C, Wang YL, Yang YY, Zhang NP, Niu C, Shen XZ, Wu J. Novel Approaches to Intervene Gut Microbiota in the Treatment of Chronic Liver Diseases. FASEB 2021; 35(10): e21871.
24- Kirpich IA, Parajuli D, McClain CJ. The Gut Microbiome in NAFLD and ALD. Clin liver Dis 2015; 6(3): 55-8.
25- Zafari N, Velayati M, Fahim M, Maftooh M, Pourali G, Khazaei M, et al. Role of Gut Bacterial and Non-Bacterial Microbiota in Alcohol-Associated Liver Disease: Molecular Mechanisms, Biomarkers, and Therapeutic Prospective. Life Sciences 2022; 305: 120760.
26- Mattner J. Impact of Microbes on the Pathogenesis of Primary Biliary Cirrhosis (PBC) and Primary Sclerosing Cholangitis (PSC). Int J Mol Sci 2016; 17(11): 1864.
27- Leylabadlo HE, Ghotaslou R, Feizabadi MM, Farajnia S, Moaddab SY, Ganbarov K, et al. The Critical Role of Faecalibacterium Prausnitzii in Human Health: An Overview. Microb pathog 2020; 149: 104344.
28- Miyake Y, Yamamoto K. Role of Gut Microbiota in Liver Diseases. Hepatol Res 2013; 43(2): 139-46.
29- Chen W, Wei Y, Xiong A, Li Y, Guan H, Wang Q, et al. Comprehensive Analysis of Serum and Fecal Bile Acid Profiles and Interaction with Gut Microbiota in Primary Biliary Cholangitis. Clin Rev Allergy Immunol 2020; 58(1): 25-38.
30- Lv L, Jiang H, Chen X, Wang Q, Wang K, Ye J, et al. The Salivary Microbiota of Patients with Primary Biliary Cholangitis is Distinctive and Pathogenic. Front Immunol 2021; 12: 713647.
31- Wang Y, Pan CQ, Xing H. Advances in Gut Microbiota of Viral Hepatitis Cirrhosis. BioMed Res Int 2019; 2019: 9726786.
32- Usami M, Miyoshi M, Yamashita H. Gut Microbiota and Host Metabolism in Liver Cirrhosis. World J Gastroenterol 2015; 21(41): 11597-608.
33- Rai R, Saraswat VA, Dhiman RK. Gut Microbiota: It's Role in Hepatic Encephalopathy. J Clin Exp Hepatol 2015; 5: S29-36.
34- Dhiman RK. Gut Microbiota and Hepatic Encephalopathy. Metabolic Brain Disease 2013; 28(2): 321-6.
35- Bajaj JS, Ridlon JM, Hylemon PB, Thacker LR, Heuman DM, Smith S, et al. Linkage of Gut Microbiome with Cognition in Hepatic Encephalopathy. Am J Physiology-Gastroint Liver Physiol 2012; 302(1): G168-75.
36- Wang HX, Wang YP. Gut Microbiota-Brain Axis. Chin Med J 2016; 129(19): 2373-80.
37- Bajaj JS, Heuman DM, Hylemon PB, Sanyal AJ, White MB, Monteith P, et al. Altered Profile of Human Gut Microbiome is Associated with Cirrhosis and Its Complications. J Hepatol 2014; 60(5): 940-7.
38- Fuke N, Nagata N, Suganuma H, Ota T. Regulation of Gut Microbiota and Metabolic Endotoxemia with Dietary Factors. Nutrients 2019; 11(10): 2277.
39- Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in Gut Microbiota Control Metabolic Endotoxemia-Induced Inflammation in High-Fat Diet–Induced Obesity and Diabetes in Mice. Diabetes 2008; 57(6): 1470-81.
40- Mancini A, Campagna F, Amodio P, Tuohy KM. Gut: Liver: Brain Axis: The Microbial Challenge in the Hepatic Encephalopathy. Food Funct 2018; 9(3): 1373-88.
41- Ding JH, Jin Z, Yang XX, Lou J, Shan WX, Hu YX, et al. Role of Gut Microbiota Via the Gut-Liver-Brain Axis in Digestive Diseases. World J Gastroenterol 2020; 26(40): 6141-62.
42- Dhiman RK. Gut Microbiota and Hepatic Encephalopathy. Metabolic Brain Disease 2013; 28(2): 321-6.
43- Rai R, Saraswat VA, Dhiman RK. Gut Microbiota: It's Role in Hepatic Encephalopathy. J Clin Exp Hepatol 2015; 5(Suppl 1): S29-36.
44- Kang DJ, Betrapally NS, Ghosh SA, Sartor RB, Hylemon PB, Gillevet PM, et al. Gut Microbiota Drive the Development of Neuroinflammatory Response in Cirrhosis in Mice. Hepatology 2016; 64(4): 1232-48
45- Trebicka J, Bork P, Krag A, Arumugam M. Utilizing the Gut Microbiome in Decompensated Cirrhosis and Acute-On-Chronic Liver Failure. Nat Rev Gastroenterol & 2021; 18(3): 167-80.
46- Solé C, Guilly S, Da Silva K, Llopis M, Le-Chatelier E, Huelin P, et al. Alterations in Gut Microbiome in Cirrhosis as Assessed by Quantitative Metagenomics: Relationship with Acute-On-Chronic Liver Failure and Prognosis. Gastroenterology 2021: 160(1): 206-18.
47- Zhang Y, Zhao R, Shi D, Sun S, Ren H, Zhao H, et al. Characterization of the Circulating Microbiome in Acute on Chronic Liver Failure Associated with Hepatitis B. Liver Int 2019; 39(7): 1207-16.
48- Ponziani FR, Gerardi V, Pecere S, D’Aversa F, Lopetuso L, Zocco MAet al. Effect of Rifaximin on Gut Microbiota Composition in Advanced Liver Disease and its Complications. World J Gastroenterol 2015; 21(43): 12322-33.
49- Bajaj JS, Kakiyama G, Savidge T, Takei H, Kassam ZA, Fagan A, et al. Antibiotic-Associated Disruption of Microbiota Composition and Function in Cirrhosis is restored by Fecal Transplant. Hepatology 2018; 68(4): 1549-58
50- Aroniadis OC, Brandt LJ. Fecal Microbiota Transplantation: Past, Present and Future. Curr Opin in Gastroenterol 2013; 29(1): 79-84.
51- Kelly CP. Fecal Microbiota Transplantation—an Old Therapy Comes of Age. N Engl J Med 2013; 368(5): 474-5.
52- Cammarota G, Ianiro G, Gasbarrini A. Fecal Microbiota Transplantation for the Treatment of Clostridium Difficile Infection: A Systematic Review. J Clin Gastroenterol 2014; 48(8): 693-702.
53- Hevia A, Delgado S, Margolles A, Sánchez B. Application of Density Gradient for the Isolation of the Fecal Microbial Stool Component and the Potential Use Thereof. Sci Rep 2015; 5(1): 16807.
54- Du C, Luo Y, Walsh S, Grinspan A. Oral Fecal Microbiota Transplant Capsules Are Safe And Effective For Recurrent Clostridioides Difficile Infection: A Systematic Review And Meta-Analysis. J Clin Gastroenterol 2021; 55(4): 300-8.
55- Allegretti JR, Kassam Z, Mullish BH, Chiang A, Carrellas M, Hurtado J, et al. Effects of Fecal Microbiota Transplantation with Oral Capsules in Obese Patients. Clin Gastroenterol Hepatol 2020; 18(4): 855-63.
56- Sugita K, Yanuma N, Ohno H, Takahashi K, Kawano K, Morita H, Ohmori K. Oral Faecal Microbiota Transplantation for the Treatment of Clostridium Difficile-Associated Diarrhoea in A Dog: A Case Report. BMC Vet Res 2019; 15(1): 11.
57- Rubin TA, Gessert CE, Aas J, Bakken JS. Fecal Microbiome Transplantation for Recurrent Clostridium Difficile Infection: Report on a Case Series. Anaerobe 2013; 19: 22-6.
58- Lee CH, Steiner T, Petrof EO, Smieja M, Roscoe D, Nematallah A, et al. Frozen Vs Fresh Fecal Microbiota Transplantation and Clinical Resolution of Diarrhea in Patients with Recurrent Clostridium Difficile Infection: A Randomized Clinical Trial. JAMA 2016; 315(2): 142-9.
59- Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, et al. Fecal Microbiota Transplantation: Review and Update. J Formos Med Assoc 2019; 118: S23-31.
60- Burz SD, Monnoye M, Philippe C, Farin W, Ratziu V, Strozzi F, et al. Fecal Microbiota Transplant from Human to Mice Gives Insights Into the Role of the Gut Microbiota in Non-Alcoholic Fatty Liver Disease (NAFLD). Microorganisms 2021; 9(1): 199.
61- Madsen M, Kimer N, Bendtsen F, Petersen AM. Fecal Microbiota Transplantation in Hepatic Encephalopathy: A Systematic Review. Scand J Gastroenterol 2021; 56(5): 560-9.
62- Bajaj JS, Fagan A, Gavis EA, Kassam Z, Sikaroodi M, Gillevet PM. Long-Term Outcomes of Fecal Microbiota Transplantation in Patients with Cirrhosis. Gastroenterology 2019; 156(6): 1921-3.
63- Jakhete N, Abutaleb A, Shetty K. Transplant in Acute Alcoholic Hepatitis: A Relative Contraindication. Curr Opin Organ Transplantat 2022; 27(2): 93-7.
64- Kang Y, Cai Y. Gut Microbiota and Hepatitis-B-Virus-Induced Chronic Liver Disease: Implications for Faecal Microbiota Transplantation Therapy. J Hosp Infect 2017; 96(4): 342-8.
65- Van Beurden YH, Nieuwdorp M, Van De Berg PJ, Mulder CJ, Goorhuis A. Current Challenges in the Treatment of Severe Clostridium Difficile Infection: Early Treatment Potential of Fecal Microbiota Transplantation. Therap Adv Gastroenterol 2017; 10(4): 373-81.
66- Aroniadis OC, Brandt LJ. Fecal Microbiota Transplantation: Past, Present and Future. Curr Opin Gastroenterol 2013; 29(1): 79-84.
67- Hazan S. Rapid Improvement in Alzheimer’s Disease Symptoms Following Fecal Microbiota Transplantation: A Case Report. J Int Med Res 2020; 48(6):0300060520925930.
68- Belvoncikova P, Maronek M, Gardlik R. Gut Dysbiosis and Fecal Microbiota Transplantation in Autoimmune Diseases. Int J Mol Sci 2022; 23(18): 10729.
69- Blanchaert C, Strubbe B, Peeters H. Fecal microbiota transplantation in ulcerative colitis. Acta Gastro-Enterol. Belg 2019; 82(4): 519-28.
70- Cammarota G, Ianiro G, Gasbarrini A. Fecal Microbiota Transplantation for the Treatment of Clostridium Difficile Infection: A Systematic Review. J Clin Gastroenterol 2014; 48(8): 693-702
71- DeFilipp Z, Bloom PP, Torres Soto M, Mansour MK, Sater MRA, Huntley MH, et al. Drug-Resistant E. Coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med 2019; 381(21): 2043-50
72- Moayyedi P, Surette MG, Kim PT, Libertucci J, Wolfe M, Onischi C, et al. Fecal Microbiota Transplantation Induces Remission in Patients with Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology 2015; 149(1): 102-9.
73- Sheykhsaran E, Abbasi A, Leylabadlo HE, Sadeghi J, Mehri S, Mazraeh FN, et al. Gut Microbiota and Obesity: An Overview of Microbiota to Microbial-Based Therapies. Postgrad Med J 2022.
74- Dailey FE, Turse EP, Daglilar E, Tahan V. The Dirty Aspects of Fecal Microbiota Transplantation: A Review of Its Adverse Effects and Complications. Curr Opin Pharmacol 2019; 49: 29-33.
75- Bajaj JS, Salzman NH, Acharya C, Sterling RK, White MB, Gavis EA, et al. Fecal Microbial Transplant Capsules are Safe in Hepatic Encephalopathy: A Phase 1, Randomized, Placebo-Controlled Trial. Hepatology 2019; 70(5): 1690-703
76- Wang WW, Zhang Y, Huang XB, You N, Zheng L, Li J. Fecal Microbiota Transplantation Prevents Hepatic Encephalopathy in Rats with Carbon Tetrachloride-Induced Acute Hepatic Dysfunction. World J Gastroenterol 2017; 23(38): 6983-94
77- Quigley EM, Stanton C, Murphy EF. The Gut Microbiota and the Liver. Pathophysiological and Clinical Implications. J Hepatol 2013; 58(5): 1020-7.
78- Santiago A, Pozuelo M, Poca M, Gely C, Nieto JC, Torras X, et al. Alteration of the Serum Microbiome Composition in Cirrhotic Patients with Ascites. Sci Rep 2016; 6: 25001
79- Tabibian JH, O'Hara SP, Trussoni CE, Tietz PS, Splinter PL, Mounajjed T, et al. Absence of the Intestinal Microbiota Exacerbates Hepatobiliary Disease in a Murine Model of Primary Sclerosing Cholangitis. Hepatology 2016; 63(1): 185-96
80- Allegretti JR, Kassam Z, Carrellas M, Mullish BH, Marchesi JR, Pechlivanis A, et al. Fecal Microbiota Transplantation in Patients with Primary Sclerosing Cholangitis: A Pilot Clinical Trial. Official J American College of Gastroenterology ACG 2019; 114(7): 1071-9.
81- Philips CA, Augustine P, Phadke N. Healthy Donor Fecal Microbiota Transplantation for Recurrent Bacterial Cholangitis in Primary Sclerosing Cholangitis—a Single Case Report. J Clin Transl Hepatol 2018; 6(4): 438-41
82- Allegretti JR, Kassam Z, Carrellas M, Mullish BH, Marchesi JR, Pechlivanis A, et al. Fecal Microbiota Transplantation in Patients with Primary Sclerosing Cholangitis: A Pilot Clinical Trial. Am J Gastroenterol 2019;114(7): 1071-79
83- Philips CA, Pande A, Shasthry SM, Jamwal KD, Khillan V, Chandel SS, et al. Healthy Donor Fecal Microbiota Transplantation in Steroid-Ineligible Severe Alcoholic Hepatitis: A Pilot Study. Clin Gastroenterol Hepatol 2017; 15(4): 600-2.
84- Philips CA, Phadke N, Ganesan K, Ranade S, Augustine P. Corticosteroids, Nutrition, Pentoxifylline, or Fecal Microbiota Transplantation for Severe Alcoholic Hepatitis. Indian J Gastroenterol 2018; 37(3): 215-25
85- Jiang L, Lang S, Duan Y, Zhang X, Gao B, Chopyk J, et al. Intestinal Virome in Patients with Alcoholic Hepatitis. Hepatology 2020; 72(6): 2182-96.
86- Lang S, Duan Y, Liu J, et al. Intestinal Fungal Dysbiosis and Systemic Immune Response to Fungi In Patients with Alcoholic Hepatitis. Hepatology 2020; 71(2): 522-38.
87- Famouri F, Shariat Z, Hashemipour M, Keikha M, Kelishadi R. Effects of Probiotics on Nonalcoholic Fatty Liver Disease in Obese Children and Adolescents. J Pediatr Gastroenterol Nutr 2017; 64(3): 413-17.
88- Leylabadlo HE, Heravi FS, Soltani E, Abbasi A, Kafil HS, Parsaei M, et al. The Role of Gut Microbiota in the Treatment of Irritable Bowel Syndrome. Reviews in Medical Microbiology 2022; 33(1): e89-104.
89- Zhuge A, Li S, Yuan Y, Li B, Li L. The Synergy of Dietary Supplements Lactobacillus Salivarius LI01 and Bifidobacterium Longum TC01 in Alleviating Liver Failure in Rats Treated With D-Galactosamine. Food & Function 2021; 12(20): 10239-52.
90- Chauhan A, Kumar R, Sharma S, Mousumi M, Sudheer KV, Baibaswata N, et al. Fecal Microbiota Transplantation in Hepatitis Be Antigen-Positive Chronic Hepatitis B Patients: A Pilot Study. Dig Dis Sci 2021; 66(03): 873-80
91- Leylabadlo HE, Kafil HS, Farajnia S, Shanehbandi D, Moaddab SY, Feizabadi MM, et al. Gut Microbiota in Nonalcoholic Fatty Liver Diseases with and Without Type-2 Diabetes Mellitus. European Journal of Gastroenterology & Hepatology 2021; 33(1S): e548-54.
92- Behzadi E, Mahmoodzadeh Hosseini H, Imani Fooladi AA. The Inhibitory Impacts of Lactobacillus Rhamnosus GG-Derived Extracellular Vesicles on the Growth of Hepatic Cancer Cells. Microb Pathog 2017;110:1-6.
1- Sorbara MT, Pamer EG. Microbiome-based therapeutics. Nature Reviews Microbiology 2022; 20(6): 365-80.
2- Ianiro G, Iorio A, Porcari S, Masucci L, Sanguinetti M, Perno CF, et al. How The Gut Parasitome Affects Human Health. Therap Adv Gastroenterol 2022; 15: 17562848221091524.
3- Ghaffari S, Abbasi A, Somi MH, Moaddab SY, Nikniaz L, Kafil HS, Ebrahimzadeh Leylabadlo H. Akkermansia Muciniphila: From Its Critical Role in Human Health to Strategies for Promoting its Abundance in Human Gut Microbiome. Crit Rev in Food Sci Nutr 2022: 1-21.
4- Baghi HB, Naghili B, Shanehbandi D, Leylabadlo HE. Evaluation of a Human Gut-Associated Phage and Gut Dominant Microbial Phyla in the Metabolic Syndrome. Clin Nutr ESPEN 2022; 50: 133-7.
5- Zoghi S, Abbasi A, Heravi FS, Somi MH, Nikniaz Z, Moaddab SY, et al. The Gut Microbiota and Celiac Disease: Pathophysiology, Current Perspective and New Therapeutic Approaches. Crit Rev Food Sci Nutr 2022: 1-21.
6- Davis BC, Bajaj JS. The Human Gut Microbiome in Liver Diseases. Semin Liver Dis 2017; 37(2): 128-40.
7- Mancini A, Campagna F, Amodio P, Tuohy KM. Gut: Liver: Brain Axis: The Microbial Challenge in the Hepatic Encephalopathy. Food funct 2018; 9(3): 1373-88.
8- Bajaj JS, Kassam Z, Fagan A, Gavis EA, Liu E, Cox IJ, et al. Fecal Microbiota Transplant from a Rational Stool Donor Improves Hepatic Encephalopathy: A Randomized Clinical Trial. Hepatology 2017; 66(6): 1727-38
9- Madsen M, Kimer N, Bendtsen F, Petersen AM. Fecal Microbiota Transplantation in Hepatic Encephalopathy: A Systematic Review. Scand J Gastroenterol 2021; 56(5): 560-9.
10- Le Roy T, Llopis M, Lepage P, Bruneau A, Rabot S, Bevilacqua C, et al. Intestinal Microbiota Determines Development of Non-Alcoholic Fatty Liver Disease in Mice. Gut 2013; 62(12): 1787-94
11- Parsaei M, Sarafraz N, Moaddab SY, Leylabadlo HE. The Importance of Faecalibacterium Prausnitzii in Human Health and Diseases. New Microbes and New Infections 2021; 43: 100928.
12- Quesada-Vázquez S, Aragonès G, Del Bas JM, Escoté X. Diet, Gut Microbiota and Non-Alcoholic Fatty Liver Disease: Three Parts of the Same Axis. Cells 2020; 9(1): 176.
13- Leung C, Rivera L, Furness JB, Angus PW. The Role of the Gut Microbiota in NAFLD. Nat Rev Gastroenterol Hepatol 2016; 13(7): 412-25.
14- Wang R, Tang R, Li B, Ma X, Schnabl B, Tilg H. Gut Microbiome, Liver Immunology, and Liver Diseases. Cel Mol Immunol 2021; 18(1): 4-17.
15- Zheng Y, Ran Y, Zhang H, Wang B, Zhou L. The Microbiome in Autoimmune Liver Diseases: Metagenomic and Metabolomic Changes. Front Physiol 2021: 12: 715852.
16- Boursier J, Mueller O, Barret M, Machado M, Fizanne L, Araujo‐Perez F, et al. The Severity of Nonalcoholic Fatty Liver Disease is Associated with Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology 2016; 63(3): 764-75.
17- Wang Y, Pan CQ, Xing H. Advances in Gut Microbiota of Viral Hepatitis Cirrhosis. BioMed Res Int 2019; 2019: 9726786.
18- Leylabadlo HE, Sanaie S, Heravi FS, Ahmadian Z, Ghotaslou R. From Role of Gut Microbiota to Microbial-Based Therapies in Type 2-Diabetes. Infect Genet Evol 2020; 81: 104268.
19- Kaikkonen JE, Würtz P, Suomela E, Lehtovirta M, Kangas AJ, Jula A, et al. Metabolic Profiling of Fatty Liver in Young and Middle-Aged Adults: Cross-Sectional And Prospective Analyses of The Young Finns Study. Hepatology 2017; 65(02): 491-500.
20- Loomba R, Seguritan V, Li W, Long T, Klitgord N, Bhatt A, et al. Gut Microbiome-Based Metagenomic Signature for Non-Invasive Detection of Advanced Fibrosis in Human Nonalcoholic Fatty Liver Disease. Cell Metab 2019; 30(3): 607.
21- Boursier J, Mueller O, Barret M, Machado M, Fizanne L, Araujo-Perez F, et al. The Severity of Nonalcoholic Fatty Liver Disease Is Associated with Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology 2016; 63(3): 764-75.
22- Bluemel S, Williams B, Knight R, Schnabl B. Precision Medicine in Alcoholic and Nonalcoholic Fatty Liver Disease Via Modulating the Gut Microbiota. Am J Physiol Gastrointest Liver Physiol 2016; 311(6): G1018-36.
23- Liu C, Wang YL, Yang YY, Zhang NP, Niu C, Shen XZ, Wu J. Novel Approaches to Intervene Gut Microbiota in the Treatment of Chronic Liver Diseases. FASEB 2021; 35(10): e21871.
24- Kirpich IA, Parajuli D, McClain CJ. The Gut Microbiome in NAFLD and ALD. Clin liver Dis 2015; 6(3): 55-8.
25- Zafari N, Velayati M, Fahim M, Maftooh M, Pourali G, Khazaei M, et al. Role of Gut Bacterial and Non-Bacterial Microbiota in Alcohol-Associated Liver Disease: Molecular Mechanisms, Biomarkers, and Therapeutic Prospective. Life Sciences 2022; 305: 120760.
26- Mattner J. Impact of Microbes on the Pathogenesis of Primary Biliary Cirrhosis (PBC) and Primary Sclerosing Cholangitis (PSC). Int J Mol Sci 2016; 17(11): 1864.
27- Leylabadlo HE, Ghotaslou R, Feizabadi MM, Farajnia S, Moaddab SY, Ganbarov K, et al. The Critical Role of Faecalibacterium Prausnitzii in Human Health: An Overview. Microb pathog 2020; 149: 104344.
28- Miyake Y, Yamamoto K. Role of Gut Microbiota in Liver Diseases. Hepatol Res 2013; 43(2): 139-46.
29- Chen W, Wei Y, Xiong A, Li Y, Guan H, Wang Q, et al. Comprehensive Analysis of Serum and Fecal Bile Acid Profiles and Interaction with Gut Microbiota in Primary Biliary Cholangitis. Clin Rev Allergy Immunol 2020; 58(1): 25-38.
30- Lv L, Jiang H, Chen X, Wang Q, Wang K, Ye J, et al. The Salivary Microbiota of Patients with Primary Biliary Cholangitis is Distinctive and Pathogenic. Front Immunol 2021; 12: 713647.
31- Wang Y, Pan CQ, Xing H. Advances in Gut Microbiota of Viral Hepatitis Cirrhosis. BioMed Res Int 2019; 2019: 9726786.
32- Usami M, Miyoshi M, Yamashita H. Gut Microbiota and Host Metabolism in Liver Cirrhosis. World J Gastroenterol 2015; 21(41): 11597-608.
33- Rai R, Saraswat VA, Dhiman RK. Gut Microbiota: It's Role in Hepatic Encephalopathy. J Clin Exp Hepatol 2015; 5: S29-36.
34- Dhiman RK. Gut Microbiota and Hepatic Encephalopathy. Metabolic Brain Disease 2013; 28(2): 321-6.
35- Bajaj JS, Ridlon JM, Hylemon PB, Thacker LR, Heuman DM, Smith S, et al. Linkage of Gut Microbiome with Cognition in Hepatic Encephalopathy. Am J Physiology-Gastroint Liver Physiol 2012; 302(1): G168-75.
36- Wang HX, Wang YP. Gut Microbiota-Brain Axis. Chin Med J 2016; 129(19): 2373-80.
37- Bajaj JS, Heuman DM, Hylemon PB, Sanyal AJ, White MB, Monteith P, et al. Altered Profile of Human Gut Microbiome is Associated with Cirrhosis and Its Complications. J Hepatol 2014; 60(5): 940-7.
38- Fuke N, Nagata N, Suganuma H, Ota T. Regulation of Gut Microbiota and Metabolic Endotoxemia with Dietary Factors. Nutrients 2019; 11(10): 2277.
39- Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in Gut Microbiota Control Metabolic Endotoxemia-Induced Inflammation in High-Fat Diet–Induced Obesity and Diabetes in Mice. Diabetes 2008; 57(6): 1470-81.
40- Mancini A, Campagna F, Amodio P, Tuohy KM. Gut: Liver: Brain Axis: The Microbial Challenge in the Hepatic Encephalopathy. Food Funct 2018; 9(3): 1373-88.
41- Ding JH, Jin Z, Yang XX, Lou J, Shan WX, Hu YX, et al. Role of Gut Microbiota Via the Gut-Liver-Brain Axis in Digestive Diseases. World J Gastroenterol 2020; 26(40): 6141-62.
42- Dhiman RK. Gut Microbiota and Hepatic Encephalopathy. Metabolic Brain Disease 2013; 28(2): 321-6.
43- Rai R, Saraswat VA, Dhiman RK. Gut Microbiota: It's Role in Hepatic Encephalopathy. J Clin Exp Hepatol 2015; 5(Suppl 1): S29-36.
44- Kang DJ, Betrapally NS, Ghosh SA, Sartor RB, Hylemon PB, Gillevet PM, et al. Gut Microbiota Drive the Development of Neuroinflammatory Response in Cirrhosis in Mice. Hepatology 2016; 64(4): 1232-48
45- Trebicka J, Bork P, Krag A, Arumugam M. Utilizing the Gut Microbiome in Decompensated Cirrhosis and Acute-On-Chronic Liver Failure. Nat Rev Gastroenterol & 2021; 18(3): 167-80.
46- Solé C, Guilly S, Da Silva K, Llopis M, Le-Chatelier E, Huelin P, et al. Alterations in Gut Microbiome in Cirrhosis as Assessed by Quantitative Metagenomics: Relationship with Acute-On-Chronic Liver Failure and Prognosis. Gastroenterology 2021: 160(1): 206-18.
47- Zhang Y, Zhao R, Shi D, Sun S, Ren H, Zhao H, et al. Characterization of the Circulating Microbiome in Acute on Chronic Liver Failure Associated with Hepatitis B. Liver Int 2019; 39(7): 1207-16.
48- Ponziani FR, Gerardi V, Pecere S, D’Aversa F, Lopetuso L, Zocco MAet al. Effect of Rifaximin on Gut Microbiota Composition in Advanced Liver Disease and its Complications. World J Gastroenterol 2015; 21(43): 12322-33.
49- Bajaj JS, Kakiyama G, Savidge T, Takei H, Kassam ZA, Fagan A, et al. Antibiotic-Associated Disruption of Microbiota Composition and Function in Cirrhosis is restored by Fecal Transplant. Hepatology 2018; 68(4): 1549-58
50- Aroniadis OC, Brandt LJ. Fecal Microbiota Transplantation: Past, Present and Future. Curr Opin in Gastroenterol 2013; 29(1): 79-84.
51- Kelly CP. Fecal Microbiota Transplantation—an Old Therapy Comes of Age. N Engl J Med 2013; 368(5): 474-5.
52- Cammarota G, Ianiro G, Gasbarrini A. Fecal Microbiota Transplantation for the Treatment of Clostridium Difficile Infection: A Systematic Review. J Clin Gastroenterol 2014; 48(8): 693-702.
53- Hevia A, Delgado S, Margolles A, Sánchez B. Application of Density Gradient for the Isolation of the Fecal Microbial Stool Component and the Potential Use Thereof. Sci Rep 2015; 5(1): 16807.
54- Du C, Luo Y, Walsh S, Grinspan A. Oral Fecal Microbiota Transplant Capsules Are Safe And Effective For Recurrent Clostridioides Difficile Infection: A Systematic Review And Meta-Analysis. J Clin Gastroenterol 2021; 55(4): 300-8.
55- Allegretti JR, Kassam Z, Mullish BH, Chiang A, Carrellas M, Hurtado J, et al. Effects of Fecal Microbiota Transplantation with Oral Capsules in Obese Patients. Clin Gastroenterol Hepatol 2020; 18(4): 855-63.
56- Sugita K, Yanuma N, Ohno H, Takahashi K, Kawano K, Morita H, Ohmori K. Oral Faecal Microbiota Transplantation for the Treatment of Clostridium Difficile-Associated Diarrhoea in A Dog: A Case Report. BMC Vet Res 2019; 15(1): 11.
57- Rubin TA, Gessert CE, Aas J, Bakken JS. Fecal Microbiome Transplantation for Recurrent Clostridium Difficile Infection: Report on a Case Series. Anaerobe 2013; 19: 22-6.
58- Lee CH, Steiner T, Petrof EO, Smieja M, Roscoe D, Nematallah A, et al. Frozen Vs Fresh Fecal Microbiota Transplantation and Clinical Resolution of Diarrhea in Patients with Recurrent Clostridium Difficile Infection: A Randomized Clinical Trial. JAMA 2016; 315(2): 142-9.
59- Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, et al. Fecal Microbiota Transplantation: Review and Update. J Formos Med Assoc 2019; 118: S23-31.
60- Burz SD, Monnoye M, Philippe C, Farin W, Ratziu V, Strozzi F, et al. Fecal Microbiota Transplant from Human to Mice Gives Insights Into the Role of the Gut Microbiota in Non-Alcoholic Fatty Liver Disease (NAFLD). Microorganisms 2021; 9(1): 199.
61- Madsen M, Kimer N, Bendtsen F, Petersen AM. Fecal Microbiota Transplantation in Hepatic Encephalopathy: A Systematic Review. Scand J Gastroenterol 2021; 56(5): 560-9.
62- Bajaj JS, Fagan A, Gavis EA, Kassam Z, Sikaroodi M, Gillevet PM. Long-Term Outcomes of Fecal Microbiota Transplantation in Patients with Cirrhosis. Gastroenterology 2019; 156(6): 1921-3.
63- Jakhete N, Abutaleb A, Shetty K. Transplant in Acute Alcoholic Hepatitis: A Relative Contraindication. Curr Opin Organ Transplantat 2022; 27(2): 93-7.
64- Kang Y, Cai Y. Gut Microbiota and Hepatitis-B-Virus-Induced Chronic Liver Disease: Implications for Faecal Microbiota Transplantation Therapy. J Hosp Infect 2017; 96(4): 342-8.
65- Van Beurden YH, Nieuwdorp M, Van De Berg PJ, Mulder CJ, Goorhuis A. Current Challenges in the Treatment of Severe Clostridium Difficile Infection: Early Treatment Potential of Fecal Microbiota Transplantation. Therap Adv Gastroenterol 2017; 10(4): 373-81.
66- Aroniadis OC, Brandt LJ. Fecal Microbiota Transplantation: Past, Present and Future. Curr Opin Gastroenterol 2013; 29(1): 79-84.
67- Hazan S. Rapid Improvement in Alzheimer’s Disease Symptoms Following Fecal Microbiota Transplantation: A Case Report. J Int Med Res 2020; 48(6):0300060520925930.
68- Belvoncikova P, Maronek M, Gardlik R. Gut Dysbiosis and Fecal Microbiota Transplantation in Autoimmune Diseases. Int J Mol Sci 2022; 23(18): 10729.
69- Blanchaert C, Strubbe B, Peeters H. Fecal microbiota transplantation in ulcerative colitis. Acta Gastro-Enterol. Belg 2019; 82(4): 519-28.
70- Cammarota G, Ianiro G, Gasbarrini A. Fecal Microbiota Transplantation for the Treatment of Clostridium Difficile Infection: A Systematic Review. J Clin Gastroenterol 2014; 48(8): 693-702
71- DeFilipp Z, Bloom PP, Torres Soto M, Mansour MK, Sater MRA, Huntley MH, et al. Drug-Resistant E. Coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med 2019; 381(21): 2043-50
72- Moayyedi P, Surette MG, Kim PT, Libertucci J, Wolfe M, Onischi C, et al. Fecal Microbiota Transplantation Induces Remission in Patients with Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology 2015; 149(1): 102-9.
73- Sheykhsaran E, Abbasi A, Leylabadlo HE, Sadeghi J, Mehri S, Mazraeh FN, et al. Gut Microbiota and Obesity: An Overview of Microbiota to Microbial-Based Therapies. Postgrad Med J 2022.
74- Dailey FE, Turse EP, Daglilar E, Tahan V. The Dirty Aspects of Fecal Microbiota Transplantation: A Review of Its Adverse Effects and Complications. Curr Opin Pharmacol 2019; 49: 29-33.
75- Bajaj JS, Salzman NH, Acharya C, Sterling RK, White MB, Gavis EA, et al. Fecal Microbial Transplant Capsules are Safe in Hepatic Encephalopathy: A Phase 1, Randomized, Placebo-Controlled Trial. Hepatology 2019; 70(5): 1690-703
76- Wang WW, Zhang Y, Huang XB, You N, Zheng L, Li J. Fecal Microbiota Transplantation Prevents Hepatic Encephalopathy in Rats with Carbon Tetrachloride-Induced Acute Hepatic Dysfunction. World J Gastroenterol 2017; 23(38): 6983-94
77- Quigley EM, Stanton C, Murphy EF. The Gut Microbiota and the Liver. Pathophysiological and Clinical Implications. J Hepatol 2013; 58(5): 1020-7.
78- Santiago A, Pozuelo M, Poca M, Gely C, Nieto JC, Torras X, et al. Alteration of the Serum Microbiome Composition in Cirrhotic Patients with Ascites. Sci Rep 2016; 6: 25001
79- Tabibian JH, O'Hara SP, Trussoni CE, Tietz PS, Splinter PL, Mounajjed T, et al. Absence of the Intestinal Microbiota Exacerbates Hepatobiliary Disease in a Murine Model of Primary Sclerosing Cholangitis. Hepatology 2016; 63(1): 185-96
80- Allegretti JR, Kassam Z, Carrellas M, Mullish BH, Marchesi JR, Pechlivanis A, et al. Fecal Microbiota Transplantation in Patients with Primary Sclerosing Cholangitis: A Pilot Clinical Trial. Official J American College of Gastroenterology ACG 2019; 114(7): 1071-9.
81- Philips CA, Augustine P, Phadke N. Healthy Donor Fecal Microbiota Transplantation for Recurrent Bacterial Cholangitis in Primary Sclerosing Cholangitis—a Single Case Report. J Clin Transl Hepatol 2018; 6(4): 438-41
82- Allegretti JR, Kassam Z, Carrellas M, Mullish BH, Marchesi JR, Pechlivanis A, et al. Fecal Microbiota Transplantation in Patients with Primary Sclerosing Cholangitis: A Pilot Clinical Trial. Am J Gastroenterol 2019;114(7): 1071-79
83- Philips CA, Pande A, Shasthry SM, Jamwal KD, Khillan V, Chandel SS, et al. Healthy Donor Fecal Microbiota Transplantation in Steroid-Ineligible Severe Alcoholic Hepatitis: A Pilot Study. Clin Gastroenterol Hepatol 2017; 15(4): 600-2.
84- Philips CA, Phadke N, Ganesan K, Ranade S, Augustine P. Corticosteroids, Nutrition, Pentoxifylline, or Fecal Microbiota Transplantation for Severe Alcoholic Hepatitis. Indian J Gastroenterol 2018; 37(3): 215-25
85- Jiang L, Lang S, Duan Y, Zhang X, Gao B, Chopyk J, et al. Intestinal Virome in Patients with Alcoholic Hepatitis. Hepatology 2020; 72(6): 2182-96.
86- Lang S, Duan Y, Liu J, et al. Intestinal Fungal Dysbiosis and Systemic Immune Response to Fungi In Patients with Alcoholic Hepatitis. Hepatology 2020; 71(2): 522-38.
87- Famouri F, Shariat Z, Hashemipour M, Keikha M, Kelishadi R. Effects of Probiotics on Nonalcoholic Fatty Liver Disease in Obese Children and Adolescents. J Pediatr Gastroenterol Nutr 2017; 64(3): 413-17.
88- Leylabadlo HE, Heravi FS, Soltani E, Abbasi A, Kafil HS, Parsaei M, et al. The Role of Gut Microbiota in the Treatment of Irritable Bowel Syndrome. Reviews in Medical Microbiology 2022; 33(1): e89-104.
89- Zhuge A, Li S, Yuan Y, Li B, Li L. The Synergy of Dietary Supplements Lactobacillus Salivarius LI01 and Bifidobacterium Longum TC01 in Alleviating Liver Failure in Rats Treated With D-Galactosamine. Food & Function 2021; 12(20): 10239-52.
90- Chauhan A, Kumar R, Sharma S, Mousumi M, Sudheer KV, Baibaswata N, et al. Fecal Microbiota Transplantation in Hepatitis Be Antigen-Positive Chronic Hepatitis B Patients: A Pilot Study. Dig Dis Sci 2021; 66(03): 873-80
91- Leylabadlo HE, Kafil HS, Farajnia S, Shanehbandi D, Moaddab SY, Feizabadi MM, et al. Gut Microbiota in Nonalcoholic Fatty Liver Diseases with and Without Type-2 Diabetes Mellitus. European Journal of Gastroenterology & Hepatology 2021; 33(1S): e548-54.
92- Behzadi E, Mahmoodzadeh Hosseini H, Imani Fooladi AA. The Inhibitory Impacts of Lactobacillus Rhamnosus GG-Derived Extracellular Vesicles on the Growth of Hepatic Cancer Cells. Microb Pathog 2017;110:1-6.
نوع مطالعه: مروری |
موضوع مقاله:
میکروبیولوژی
دریافت: 1401/4/5 | پذیرش: 1401/7/17 | انتشار: 1401/9/15
دریافت: 1401/4/5 | پذیرش: 1401/7/17 | انتشار: 1401/9/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







