دوره 30، شماره 6 - ( شهریور 1401 )
جلد 30 شماره 6 صفحات 4909-4897 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Akhtarkhavari T, Moghaddam-Matin M. Major Epigenetic Changes in Polycystic Ovary Syndrome. JSSU 2022; 30 (6) :4897-4909
URL: http://jssu.ssu.ac.ir/article-1-5709-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5709-fa.html
اخترخاوری تارا، مقدم متین مریم. تغییرات اپیژنتیکی عمده در سندرم تخمدان پلیکیستیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (6) :4897-4909
متن کامل [PDF 1015 kb]
(727 دریافت)
| چکیده (HTML) (2017 مشاهده)
متن کامل: (967 مشاهده)
مقدمه
سندرم تخمدان پلیکیستیک یکی از شایعترین علل ناباروری در میان زنان است که 5 تا 20 درصد از زنان در سنین باروری را در جهان مبتلا میکند (1). میزان شیوع این سندرم در ایران 1/7 تا 14/6 درصد گزارششده است (2). این بیماری نخستین بار توسط استین و لونتال در سال 1935 میلادی معرفی شد (3). نشانههای بیماری در بین بیماران مختلف متنوع بوده و از علائم بالینی شایع میتوان به اختلالات قاعدگی، هیرسوتیسم، آکنه، هایپرآندروژنیسم، مردانهسازی، کیستهای تخمدانی و مقاومت به انسولین اشاره کرد (4). از علائم آزمایشگاهی نیز میتوان به افزایش دهیدرواپی اندرستن دیون سولفات، اندرستن دیون، تستوسترون،LH (luteinizing hormone) و کاهش هورمونهای استرادیول و(follicle-stimulating hormone) FSH اشاره نمود. علاوهبراین، در اکثر بیماران فعالیت آنزیم 5-α-ردوکتاز نیز افزایش مییابد که این آنزیم در تبدیل تستوسترون به فرم فعالتر آندروژن دخالت دارد. به-طورکلی، این بیماری تعداد زیادی از بافتها را تحت تاثیر قرار میدهد. بهطورمثال، در بافت تخمدان میزان سنتز استروئید بالا رفته و کیفیت تخمکها کاهش مییابد و درنتیجه احتمال ناباروری افزایش مییابد. غده فوق کلیه نیز، استروئید مازاد میسازد که منجر به ایجاد هایپرآندروژنیسم میشود (5). اختلال در بافت چربی، فرد را در معرض ابتلا به چاقی قرار میدهد و عملکرد نامناسب سلولهای بتای پانکراس فرد را در معرض ابتلا به دیابت نوع دو قرار داده و در کبد نیز احتمال ایجاد کبد چرب بالا میرود (7,6). شانس ابتلا به بیماریهای قلبی-عروقی، کارسینوم اندومتر و افزایش فشارخون نیز، در این بیماران بالاتر از جمعیت عمومی است (4). اتیولوژی این بیماری پیچیده بوده و امروزه باوجود پیشرفتهای زیاد، سازوکارهای دخیل در ایجاد آن هنوز بهطور کامل شناخته نشدهاند. تغییرات متعددی در مورد توضیح بیماریزایی این سندرم گزارش شدهاند. در بسیاری از بیماران اختلال در مسیرهای پیامرسانی پاراکراین بین سلولهای اووسیت، گرانولوزا و تکا گزارششده است که مانع از هماهنگی این سه نوع سلول میشود (8). در برخی بیماران توان پاسخگویی فولیکولهای تخمدان به FSH کاهش یافته و باعث عدم بلوغ مناسب این سلولها میشود (9). در برخی بیماران بافت چربی احشایی نیز میتواند پاسخهای التهابی ایجاد کند و با بیان سایتوکاینهای التهابی باعث فراخواندن سلولهای ایمنی شود که این حالت، التهاب خفیف اما مزمنی را در بیمار ایجاد میکند (10). اختلال در کارکرد اندامک میتوکندری نیز در پاتوژنز این سندرم دخیل است. افزایش جهش در ژنوم میتوکندری، کاهش فعالیت فسفوریلاسیون اکسیداتیو، کاهش پتانسیل غشای میتوکندری، کاهش اکسیداسیون سوبسترا، افزایش تولید گونههای واکنشپذیر اکسیژن، کاهش تولید ATP (adenosine triphosphate)، افزایش استرس اکسیداتیو و افزایش آپوپتوز ازجمله تغییرات مرتبط با میتوکندری هستند که در پاتوژنز سندرم تخمدان پلیکیستیک دخیل هستند (6,11). بهطورکلی مطالعات نشان دادهاند که هم عوامل محیطی و هم عوامل ژنتیکی در ایجاد این بیماری نقش داشته و با مطالعه بر روی دو قلوها برای تعیین میزان نقش ژنتیک در این سندرم، میزان توارثپذیری تا 60 درصد گزارش شده است (12). ازجمله مهمترین ژنهای کاندید برای این سندرم میتوان به CYP19،CYP21 ، LH، FSHR، AMH، INSR، CAPN10، ISR1، IRS2، AR، SHBG، TNFα و FTO اشاره کرد (13). امروزه مشخصشده است که علاوه بر عوامل ژنتیکی و محیطی عوامل اپیژنتیکی نیز نقش گستردهای در ایجاد این سندرم دارند. این مطالعه بهمنظور دستهبندی و گردآوری تغییرات اپیژنتیکی مؤثر در سندرم تخمدان پلیکیستیک انجام شد.
روش بررسی
در این مطالعه مروری، از کلیدواژههای سندرم تخمدان پلیکیستیک (Polycystic ovary syndrome)، اپیژنومیکس(Epigenomics) ، جهش اپیژنتیکی(Epimutation) ، متیلاسیون(DNA methylation) DNA، بازآرایی کروماتین (Chromatin remodeling)، اپیداروها(Epidrugs) ، تغییرات هیستونی(Histone modifications) و MicroRNAs برای یافتن مقالات مرتبط در دو پایگاهداده پابمد(PubMed: https://pubmed.ncbi.nlm.nih.gov/) و گوگل اسکولار (Google scholar: https://scholar.google.com) استفاده شد. در این تحقیق فقط مقالات به زبان انگلیسی وارد مطالعه شدند و تعداد 220 مقاله در بازه زمانی سال 2010 تا 2020 میلادی مرتبط با موضوع یافت شدند. در این میان با تمرکز بیشتر بر مقالات منتشرشده در بازه سال 2016 تا 2020 میلادی، از اطلاعات 73 مقاله استفاده شد.
تغییرات اپیژنتیکی عمده در سندرم تخمدان پلیکیستیک
تغییرات اپیژنتیکی، مجموعه عواملی هستند که بر روی بیان ژنها اثر میگذارند اما روی توالی DNA اثری ندارند (14). سازوکارهای اصلی اپیژنتیک به شرح زیر هستند (15): 1- متیلاسیون :DNA وضعیت متیلاسیون DNA پویا بوده و در طی لقاح، تکوین و تمایز میتواند توسط آنزیمهای DNA متیلترانسفراز و دمتیلاز دچار تغییر شود. این نوع تغییر میتواند در طی تقسیم سلولی نیز به ارث برسد (16،17). 2- تغییرات هیستونها: تغییرات متعدد پساترجمهای بر روی هیستونها میتوانند رخ دهند. از آن جمله میتوان به استیلاسیون و داستیلاسیون، فسفوریلاسیون و دفسفوریلاسیون، متیلاسیون و دمتیلاسیون اشاره کرد که بسته به مکان رخداد، اثرات متفاوتی خواهند داشت (18). 3- بازآرایی کروماتین: کمپلکسهای متعددی با کاستن از فشردگی DNA، منجر به در دسترس قرارگرفتن ژنها برای رونویسی شده و درنتیجه بیان ژنها را افزایش میدهند و در فرآیندِ عکس، با از دسترس خارج کردن DNA به روش افزایش فشردگی، باعث کاهش بیان ژنها میشوند (18). 4-microRNAs: مولکولهای RNA کوچک غیرکدکننده هستند که در تنظیم بیان ژن دخالت دارند. در ادامه چند ژن قرار گرفته در این مسیرها توضیح داده میشوند.
تغییرات متیلاسیون
تغییر در متیلاسیون ژنها علاوه بر گردش خون سیستمیک، در بافتهای مبتلا مانند تخمدان، چربی و عضله اسکلتی نیز گزارش شدهاند (19). این تغییرات در ژنهای متعددی دیده میشوند که هر یک از آنها در مسیرها و پدیدههای متعددی دخالت دارند. در شکل 1، مسیرهای مشترک عمده بین این ژنها و بیماریزایی سندرم تخمدان پلیکیستیک نشان دادهشده است.
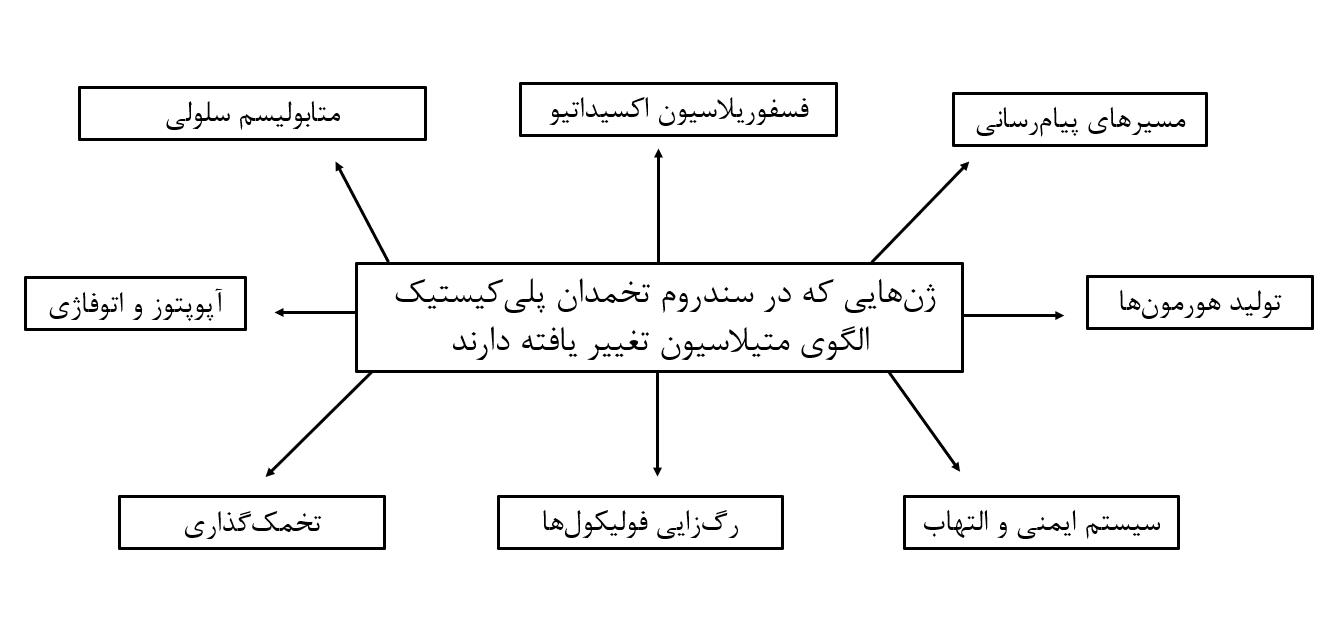
شکل 1: مسیرهای مشترک بین ژنهایی که تغییر الگوی متیلاسیون دارند و بیماریزایی سندرم تخمدان پلیکیستیک
ژنهای دخیل در فسفوریلاسیون اکسیداتیو
در خون زنان مبتلا به سندرم تخمدان پلیکیستیک سطوح اسیدآمینههای آرژنین و آلانین بالا بوده و سطوح اسیدآمینههایی مانند متیونین، سیستئین، تیروزین و هیستیدین کاهش دارد که این حالت، حاکی از بالاتر بودن متابولیسم اکسیداتیو در این بیماران است (20). از میان ژنهایی که در این دسته قرار دارند میتوان به TF و PON1 اشاره کرد. لازم به ذکر است که استرس اکسیداتیو علاوه بر سندرم تخمدان پلیکیستیک، در ناباروری، سقط مکرر و پرهاکلامپسی هم نقش دارد (21).
ژنهای مرتبط با اختلال در تولید هورمونها
ژنهایLHCGR ،FSHR ،AR ،AKR1C3 ،GHRHR ،MAMLD1 ،RETN ،IGF1 ، IRS2 و INS در ایجاد هایپرآندروژنیسم نقش دارند (22) و جهش در NR0B1 نیز، هایپرپلازی مادرزادی آدرنال وابسته به X را ایجاد میکند (23،24).GHRH(growth hormone releasing hormone) نیز در تنظیم تولید هورمون رشد و IGF1 دخالت دارد (25). این ژن بر تنظیم GH اثر دارد و GH میتواند باعث کاهش استرس اکسیداتیو شده و از طرفی شانس باروری را در میان زنان مبتلا بالا ببرد (26). تحقیقات نشان دادهاند که میزان IGF-1 نیز در سرم مبتلایان بالاتر از سایر افراد است (27).
ژنهای دخیل در سیستم ایمنی و التهاب
مسیر دیگری که در بیماریزایی این سندرم دخیل است، سیستم ایمنی است که توسط مطالعات همراهی، هایپومتیلاسیون معنادار در سلولهای مختلف سیستم ایمنی مانند سلولT کشنده، سلولT کمکی، مونوسیت و سلول B نشان داده شده است. علاوهبراین، هم در حیوانات مدل بیماری و هم در بیماران، تغییر در پاسخ ایمنی و حضور نشانگرهای التهابی در بافتهای مبتلا، گزارششده است (28). از طرفی، در بسیاری از بیماران، سطوح بالای آنتیبادیهای آنتیتیروگلوبین دیده شده، که خود نشاندهنده پاسخهای خودایمنی در آنهاست (20). تغییرات اپیژنتیکی در سلولهای ایمنی میتوانند با ایجاد چنین حالاتی در این بیماران مرتبط باشند (29،30). TNF (tumor necrosis factor) نیز، ژن دیگری است که در تنظیم پاسخ ایمنی نقش داشته و FOXO3 نیز در تنظیم فرآیند التهاب دخالت دارد (24،31).
ژنهای دخیل در رگزایی فولیکولها
ژنهای HAPLN1،PTGER1 و AKR1C3 در پدیده رگزایی فولیکولی دخیل هستند (22). تغییر در این پدیده در بیماریزایی سندرم تخمدان پلیکیستیک نقش داشته (32) و در مراحل مختلف رشد فولیکول، تخمکگذاری و پیشبرد مرحله لوتئال دخالت دارد (33).
ژنهای دخیل در تخمکگذاری
از برخی ژنهایی که دچار تغییر الگوی متیلاسیون میشوند و در فرآیند تخمکگذاری و تنظیم فاز لوتئال دخالت دارند میتوان به AKR1C3، TNF، PTGER1،LIF و HPLN1 اشاره نمود. EDN2نیز پروتئینی به نام اندوتلین 2 را کد میکند که یک منقبضکننده عروق بوده و برای رهاشدن فولیکولهای تخمدان ضروری است (22،30).
ژنهای دخیل در متابولیسم سلولی
از میان ژنهایی که در این دسته قرار دارند میتوان بهKLF10 اشاره کرد که در متابولیسم سلولی نقش دارد. میزان بیان این ژن با اندازه آدیپوسیتها ارتباط داشته و بیان آن در بیماران مبتلابه سندرم تخمدان پلیکیستیک بالاتر از سایر افراد است (34).
ژنهای دخیل در مسیرهای پیامرسانی
ژنهای CACNA1A،CAV3 و CASR در پیامرسانی کلسیم مشارکت میکنند که این مسیر برای بلوغ، فعال شدن تخمکها و همچنین لقاح، اهمیت بالایی دارد (35). ژن دیگری به نام TNF نیز، در فعالسازی مسیر NF-κB وMAPK دخیل است (36) که هر دو مسیر نیز در سندرم تخمدان پلیکیستیک دچار بینظمی میشوند (37،38).
ژنهای دخیل در آپوپتوز و اتوفاژی
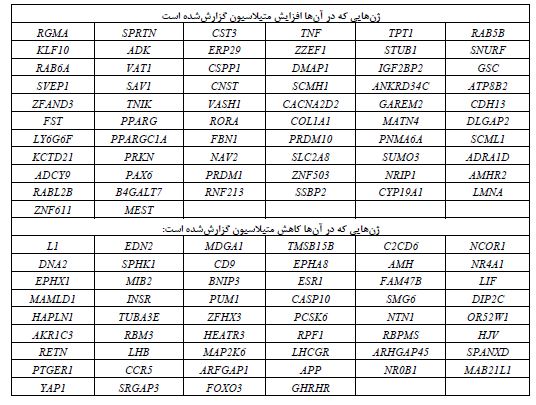
TPT1 در تنظیم چرخه سلولی و آپوپتوز نقش داشته وFOXO3 نیز ژنی است که هم در تنظیم اتوفاژی و هم در تنظیم آپوپتوز دخالت دارد.TNF نیز که در مسیرهای پیامرسانی متعددی نقش دارد، در القاء آپوپتوز نیز دخالت دارد (39،40). از این گذشته، در پایگاه (41)The NHLR GWAS catalog شماری از ژنهایی که تغییر الگوی متیلاسیون در سندرم تخمدان پلیکیستیک نشان دادهاند، از طریق مطالعات همراهی برایشان P≤ 0/05 گزارششده است که نشاندهنده ارتباط معنادار بین این ژنها و سندرم تخمدان پلیکیستیک است. شماری از این ژنها عبارتند از: RAB5B، PPARG، INSR و YAP1 (46-42). در جدول 1، لیستی از ژنهایی که الگوی متیلاسیون آنها در بیماران تغییر دارد، گردآوریشده است (56-47،19،22).
تغییرات microRNAs
ناهنجاری در بیان microRNAs در بافتهای متعددِ افرادِ مبتلا به سندرم تخمدان پلیکیستیک گزارششده است. در شکل 2، شماری از این مولکولهای RNA برحسب نوع بافتی که در آن بیان متفاوت از سایر افراد دارند، نشان داده شدهاند (57,58). اثر برخی از microRNAs بر بیماریزایی سندرم تخمدان پلیکیستیک شناختهشده است. بهطورمثال، کاهش بیان miR-145 میتواند باعث افزایش تکثیر سلول از طریق اثر بر مسیر IRS1/MAPK/ERK شود. miR-92b نیز در تنظیم آپوپتوز دخالت دارد (59). کاهش miR-32a در ایجاد کمبود استروژن دخیل بوده و تغییر در miR-223 نیز در بین افرادی که مقاومت به انسولین دارند، مشاهده میشود. افزایش بیان miR-200b و miR-429 نیز، میتواند از طریق اعمال تنظیم بر هیپوفیز، اثر خود را اعمال کند. کاهش بیان miR-592 هم با افزایش هورمون LH ارتباط دارد (60). miR-16 نیز، یکی از microRNAs است که در قشر تخمدان و سرم مبتلایان کاهش مییابد و نشان داده شده است که این microRNA در القاء تکثیر سلولهای گرانولوزا و مهار آپوپتوز دخیل است (61).
جدول 1: لیستی از ژنهایی که الگوی متیلاسیون آنها در بیماران تغییر دارد.
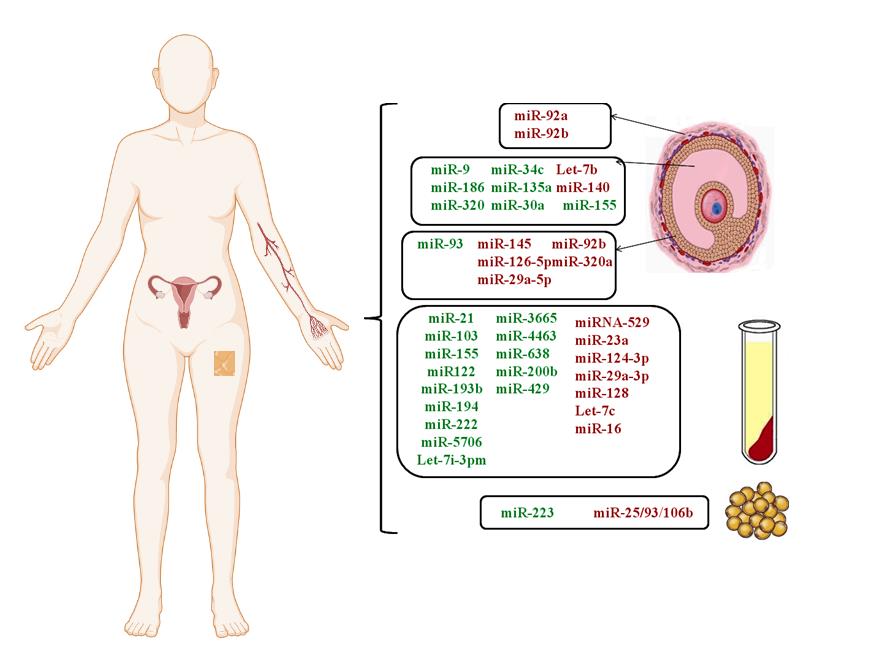
شکل 2: مولکولهای microRNA که میزانشان در سندرم تخمدان پلیکیستیک تغییر میکند.
رنگ سبز نشاندهنده افزایش و رنگ قرمز نشاندهنده کاهش بیان است.
تغییرات هیستونها
استیلاسیون هیستونها
با مطالعه بر روی مدل موشی B6D2F1 ارتباط معناداری بین افزایش تولید گونههای واکنشپذیر اکسیژن و افزایش استیلاسیون هیستونها نشان داده شده است (62). ازجمله تغییرات دیگری که مرتبط با استیلاسیون هیستونها گزارششده، افزایش بیان هیستونداستیلازی است به نام HDAC8 که این آنزیم از لایزین هیستونها، گروههای استیل را حذف کرده و از این طریق در تنظیم بیان ژن نقش دارد. افزایش بیان این هیستونداستیلاز با ایجاد مقاومت به انسولین در بیماران ارتباط دارد (63). در گوسفندِ مدلِ سندرم تخمدان پلیکیستیک نیز افزایش H3K9ac در ژنهای سازنده استروئید و مسیر التهاب باعث افزایش بیان ژنهای این دو مسیر میشود (11,64). با بررسی سلولهای کومولوس، افزایش میزان نشانگر H3K9ac در پروموتر ژنCYP19A1 معنادار گزارش شده است که این نشانگر، موجب فعال شدن رونویسی میشود. این ژن آنزیم آروماتاز را کد میکند که آندروژنها را به 17-β-استرادیول تبدیل میکند. تنظیم این ژن برحسب نوع بافت و به کمک نوع پروموتر انجام میشود. CYP19A1یکی از ژنهای مهم در عملکرد تخمدان، ساخت فولیکولها، رشد و تکوین فولیکولهاست که مقدار و زمان بیان آن بسیار اهمیت دارد و افزایش آن در بین بیماران مبتلا به سندرم تخمدان پلیکیستیک گزارش شده است (65). از طرفی امروزه نشان داده شده که داروهای مهارکننده آروماتاز مانند لتروزول در برخی موارد موفقتر از داروی کلومیفن سیترات در زمینه درمان ناباروری برای این بیماری عمل کرده است (66،67).
متیلاسیون هیستونها
با مطالعه بر روی حیوانات آزمایشگاهی مشخصشده است که در گوسفندِ مدلِ سندرم تخمدانِ پلیکیستیک، نشانگر H3K9me3 در سلولهای گرانولوزا و نشانگر H3K4me2 در سلولهای تکا افزایش مییابد (68). در مطالعات دیگر بر روی همین مدلِ حیوانی، افزایش دو نشانگر H3K9ac و H3K27ac نیز در ژنهای سازنده استروئید و مسیر التهاب نشان داده شدهاند (11،64).
بازآرایی کروماتین
با مطالعه برونتنی سلولهای بنیادیِ بافت چربیِ افرادِ مبتلا به سندرم تخمدان پلیکیستیک، مشخص شدهاست که بازآرایی کروماتین در این بیماران بهگونهای متفاوت از افراد کنترل انجام میشود که باعث افزایش فعالیت ژنهای متابولیسم اسیدهای چرب اشباع و غیراشباع شده و آدیپوژنز، اکسیداسیون لیپید، چرخه کربس و فسفوریلاسیون اکسیداتیو را تحت تاثیر قرار میدهد (69،70).
تغییرات اپیژنتیکی میتوکندری
میتوکندری اندامکی بسیار حساس به تغییرات محیطی است. تا مدتها به امکان رخداد تغییرات اپیژنتیکی در این اندامک توجه نمیشد، ولی امروزه روشن است که این اندامک میتواند از لحاظ اپیژنتیکی تغییر کند. 5-متیل سیتوزین (71) و 5-هیدروکسی سیتوزین میتوانند در میتوکندری ایجاد شوند. علاوهبراین ثابت شده است که دو ایزوفرم از آنزیم DNMT1 میتوانند DNA میتوکندریایی را خصوصاً در جزایر CpG پروموتر D-Loop متیله کنند. در این اندامک هیستون وجود ندارد اما پروتئینی به نام TFAM وجود دارد (72) که میتواند متیله، استیله، و یا فسفوریله شود. تغییرات اپیژنتیکی بر روی ژنهای هستهای دخیل در کارکرد میتوکندری مانند PPARϓ و PGC1α نیز میتوانند بینظمی ایجاد کنند (6). از جمله تغییرات اپیژنتیکی گزارش شده در بین زنان مبتلا به سندرم تخمدان پلیکیستیک میتوان به این موارد اشاره کرد: هایپرمتیلاسیون پروموتر PGC1α که منجر به کاهش تعداد DNA میتوکندریایی میشود که این خود موجب بالا بردن ریسک ابتلا به بیماریهای متابولیکی در بیماران میشود. شماری از ژنهای هستهای دخیل در کارکرد میتوکندری مانند APP، PARK2، INS و EER1 نیز در بین مبتلایان الگوی متیلاسیون متفاوت نشان میدهند. علاوه بر این، در اووسیت زنان مبتلا به تخمدان پلیکیستیک، ژنهای 12S rRNA،16S rRNA، ND4 و ناحیه D-Loop نیز بهطور معناداری حالت هایپرمتیله دارند. تغییرات اپیژنتیکی در میتوکندری منجر به افزایش سطح هموسیستئین در مایع فولیکولی شده که این افزایش در عملکرد میتوکندری اختلال ایجاد کرده و بر کیفیت و تکوین اووسیت اثر منفی خواهد داشت (73).
نتیجهگیری
تغییرات اپیژنتیکی در سندرم تخمدان پلیکیستیک میتوانند در دو سطح رخ دهند که شامل سطح هستهای و سطح میتوکندریایی است. سطح هسته، واجد چهار دسته است. نخست تغییر در الگوی متیلاسیون DNA که میتواند ژنهای دخیل در کنترل مسیرهای پیامرسانی، آپوپتوز و اتوفاژی، تولید هورمونها، فسفوریلاسیون اکسیداتیو، متابولیسم سلول، تخمکگذاری، رگزایی فولیکولها، التهاب و سیستم ایمنی را درگیر کند. دسته دوم تغییرات microRNAs است که افزایش و یا کاهش آنها در بافتهایی نظیر چربی، سرم و فولیکول گزارش شدهاند. دسته سوم تغییرات هیستونها نظیر تغییر الگوی استیلاسیون و متیلاسیون بوده و دسته چهارم تغییر در بازآرایی کروماتین است که منجر به تغییرات ساختمانی میشود. در سطح اندامک میتوکندری نیز ژنوم میتوکندریایی و ژنهای هستهای دخیل در عملکرد این اندامک میتوانند متحمل تغییرات اپیژنتیکی شوند. درمانهای کنونی سندرم تخمدان پلیکیستیک مبتنی بر تغییر سبک زندگی، درمانهای دارویی، مداخلات جراحی و یا ترکیبی از این روشهاست. تاکنون مطالعات وسیعی تغییرات اپیژنتیکی ایجاد شده در بین بیماران را بررسی کردهاند ولی در زمینه اثرات بالینی این تغییرات مطالعات محدودی انجام شده و از طرفی تاکنون مطالعهای به بررسی اثر تصحیح سبک زندگی و یا درمانهای دارویی بر اپیژنوم بیماران نپرداخته است. پیشنهاد میشود مطالعاتی در زمینه مقایسه اپیژنوم بیماران در قبل و بعد از درمان صورت گیرد تا اصلاحات اپیژنتیکی حاصل از درمان آشکار شوند. با بررسی اثر این اصلاحات اپیژنتیکی زمینه برای طراحی اپیداروها در آیندهای نهچندان دور ایجاد خواهد شد.
سپاسگزاری
بدینوسیله مراتب قدردانی خود را از معاونت پژوهش و فناوری دانشگاه فردوسی مشهد اعلام میداریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
سندرم تخمدان پلیکیستیک یکی از شایعترین علل ناباروری در میان زنان است که 5 تا 20 درصد از زنان در سنین باروری را در جهان مبتلا میکند (1). میزان شیوع این سندرم در ایران 1/7 تا 14/6 درصد گزارششده است (2). این بیماری نخستین بار توسط استین و لونتال در سال 1935 میلادی معرفی شد (3). نشانههای بیماری در بین بیماران مختلف متنوع بوده و از علائم بالینی شایع میتوان به اختلالات قاعدگی، هیرسوتیسم، آکنه، هایپرآندروژنیسم، مردانهسازی، کیستهای تخمدانی و مقاومت به انسولین اشاره کرد (4). از علائم آزمایشگاهی نیز میتوان به افزایش دهیدرواپی اندرستن دیون سولفات، اندرستن دیون، تستوسترون،LH (luteinizing hormone) و کاهش هورمونهای استرادیول و(follicle-stimulating hormone) FSH اشاره نمود. علاوهبراین، در اکثر بیماران فعالیت آنزیم 5-α-ردوکتاز نیز افزایش مییابد که این آنزیم در تبدیل تستوسترون به فرم فعالتر آندروژن دخالت دارد. به-طورکلی، این بیماری تعداد زیادی از بافتها را تحت تاثیر قرار میدهد. بهطورمثال، در بافت تخمدان میزان سنتز استروئید بالا رفته و کیفیت تخمکها کاهش مییابد و درنتیجه احتمال ناباروری افزایش مییابد. غده فوق کلیه نیز، استروئید مازاد میسازد که منجر به ایجاد هایپرآندروژنیسم میشود (5). اختلال در بافت چربی، فرد را در معرض ابتلا به چاقی قرار میدهد و عملکرد نامناسب سلولهای بتای پانکراس فرد را در معرض ابتلا به دیابت نوع دو قرار داده و در کبد نیز احتمال ایجاد کبد چرب بالا میرود (7,6). شانس ابتلا به بیماریهای قلبی-عروقی، کارسینوم اندومتر و افزایش فشارخون نیز، در این بیماران بالاتر از جمعیت عمومی است (4). اتیولوژی این بیماری پیچیده بوده و امروزه باوجود پیشرفتهای زیاد، سازوکارهای دخیل در ایجاد آن هنوز بهطور کامل شناخته نشدهاند. تغییرات متعددی در مورد توضیح بیماریزایی این سندرم گزارش شدهاند. در بسیاری از بیماران اختلال در مسیرهای پیامرسانی پاراکراین بین سلولهای اووسیت، گرانولوزا و تکا گزارششده است که مانع از هماهنگی این سه نوع سلول میشود (8). در برخی بیماران توان پاسخگویی فولیکولهای تخمدان به FSH کاهش یافته و باعث عدم بلوغ مناسب این سلولها میشود (9). در برخی بیماران بافت چربی احشایی نیز میتواند پاسخهای التهابی ایجاد کند و با بیان سایتوکاینهای التهابی باعث فراخواندن سلولهای ایمنی شود که این حالت، التهاب خفیف اما مزمنی را در بیمار ایجاد میکند (10). اختلال در کارکرد اندامک میتوکندری نیز در پاتوژنز این سندرم دخیل است. افزایش جهش در ژنوم میتوکندری، کاهش فعالیت فسفوریلاسیون اکسیداتیو، کاهش پتانسیل غشای میتوکندری، کاهش اکسیداسیون سوبسترا، افزایش تولید گونههای واکنشپذیر اکسیژن، کاهش تولید ATP (adenosine triphosphate)، افزایش استرس اکسیداتیو و افزایش آپوپتوز ازجمله تغییرات مرتبط با میتوکندری هستند که در پاتوژنز سندرم تخمدان پلیکیستیک دخیل هستند (6,11). بهطورکلی مطالعات نشان دادهاند که هم عوامل محیطی و هم عوامل ژنتیکی در ایجاد این بیماری نقش داشته و با مطالعه بر روی دو قلوها برای تعیین میزان نقش ژنتیک در این سندرم، میزان توارثپذیری تا 60 درصد گزارش شده است (12). ازجمله مهمترین ژنهای کاندید برای این سندرم میتوان به CYP19،CYP21 ، LH، FSHR، AMH، INSR، CAPN10، ISR1، IRS2، AR، SHBG، TNFα و FTO اشاره کرد (13). امروزه مشخصشده است که علاوه بر عوامل ژنتیکی و محیطی عوامل اپیژنتیکی نیز نقش گستردهای در ایجاد این سندرم دارند. این مطالعه بهمنظور دستهبندی و گردآوری تغییرات اپیژنتیکی مؤثر در سندرم تخمدان پلیکیستیک انجام شد.
روش بررسی
در این مطالعه مروری، از کلیدواژههای سندرم تخمدان پلیکیستیک (Polycystic ovary syndrome)، اپیژنومیکس(Epigenomics) ، جهش اپیژنتیکی(Epimutation) ، متیلاسیون(DNA methylation) DNA، بازآرایی کروماتین (Chromatin remodeling)، اپیداروها(Epidrugs) ، تغییرات هیستونی(Histone modifications) و MicroRNAs برای یافتن مقالات مرتبط در دو پایگاهداده پابمد(PubMed: https://pubmed.ncbi.nlm.nih.gov/) و گوگل اسکولار (Google scholar: https://scholar.google.com) استفاده شد. در این تحقیق فقط مقالات به زبان انگلیسی وارد مطالعه شدند و تعداد 220 مقاله در بازه زمانی سال 2010 تا 2020 میلادی مرتبط با موضوع یافت شدند. در این میان با تمرکز بیشتر بر مقالات منتشرشده در بازه سال 2016 تا 2020 میلادی، از اطلاعات 73 مقاله استفاده شد.
تغییرات اپیژنتیکی عمده در سندرم تخمدان پلیکیستیک
تغییرات اپیژنتیکی، مجموعه عواملی هستند که بر روی بیان ژنها اثر میگذارند اما روی توالی DNA اثری ندارند (14). سازوکارهای اصلی اپیژنتیک به شرح زیر هستند (15): 1- متیلاسیون :DNA وضعیت متیلاسیون DNA پویا بوده و در طی لقاح، تکوین و تمایز میتواند توسط آنزیمهای DNA متیلترانسفراز و دمتیلاز دچار تغییر شود. این نوع تغییر میتواند در طی تقسیم سلولی نیز به ارث برسد (16،17). 2- تغییرات هیستونها: تغییرات متعدد پساترجمهای بر روی هیستونها میتوانند رخ دهند. از آن جمله میتوان به استیلاسیون و داستیلاسیون، فسفوریلاسیون و دفسفوریلاسیون، متیلاسیون و دمتیلاسیون اشاره کرد که بسته به مکان رخداد، اثرات متفاوتی خواهند داشت (18). 3- بازآرایی کروماتین: کمپلکسهای متعددی با کاستن از فشردگی DNA، منجر به در دسترس قرارگرفتن ژنها برای رونویسی شده و درنتیجه بیان ژنها را افزایش میدهند و در فرآیندِ عکس، با از دسترس خارج کردن DNA به روش افزایش فشردگی، باعث کاهش بیان ژنها میشوند (18). 4-microRNAs: مولکولهای RNA کوچک غیرکدکننده هستند که در تنظیم بیان ژن دخالت دارند. در ادامه چند ژن قرار گرفته در این مسیرها توضیح داده میشوند.
تغییرات متیلاسیون
تغییر در متیلاسیون ژنها علاوه بر گردش خون سیستمیک، در بافتهای مبتلا مانند تخمدان، چربی و عضله اسکلتی نیز گزارش شدهاند (19). این تغییرات در ژنهای متعددی دیده میشوند که هر یک از آنها در مسیرها و پدیدههای متعددی دخالت دارند. در شکل 1، مسیرهای مشترک عمده بین این ژنها و بیماریزایی سندرم تخمدان پلیکیستیک نشان دادهشده است.

شکل 1: مسیرهای مشترک بین ژنهایی که تغییر الگوی متیلاسیون دارند و بیماریزایی سندرم تخمدان پلیکیستیک
ژنهای دخیل در فسفوریلاسیون اکسیداتیو
در خون زنان مبتلا به سندرم تخمدان پلیکیستیک سطوح اسیدآمینههای آرژنین و آلانین بالا بوده و سطوح اسیدآمینههایی مانند متیونین، سیستئین، تیروزین و هیستیدین کاهش دارد که این حالت، حاکی از بالاتر بودن متابولیسم اکسیداتیو در این بیماران است (20). از میان ژنهایی که در این دسته قرار دارند میتوان به TF و PON1 اشاره کرد. لازم به ذکر است که استرس اکسیداتیو علاوه بر سندرم تخمدان پلیکیستیک، در ناباروری، سقط مکرر و پرهاکلامپسی هم نقش دارد (21).
ژنهای مرتبط با اختلال در تولید هورمونها
ژنهایLHCGR ،FSHR ،AR ،AKR1C3 ،GHRHR ،MAMLD1 ،RETN ،IGF1 ، IRS2 و INS در ایجاد هایپرآندروژنیسم نقش دارند (22) و جهش در NR0B1 نیز، هایپرپلازی مادرزادی آدرنال وابسته به X را ایجاد میکند (23،24).GHRH(growth hormone releasing hormone) نیز در تنظیم تولید هورمون رشد و IGF1 دخالت دارد (25). این ژن بر تنظیم GH اثر دارد و GH میتواند باعث کاهش استرس اکسیداتیو شده و از طرفی شانس باروری را در میان زنان مبتلا بالا ببرد (26). تحقیقات نشان دادهاند که میزان IGF-1 نیز در سرم مبتلایان بالاتر از سایر افراد است (27).
ژنهای دخیل در سیستم ایمنی و التهاب
مسیر دیگری که در بیماریزایی این سندرم دخیل است، سیستم ایمنی است که توسط مطالعات همراهی، هایپومتیلاسیون معنادار در سلولهای مختلف سیستم ایمنی مانند سلولT کشنده، سلولT کمکی، مونوسیت و سلول B نشان داده شده است. علاوهبراین، هم در حیوانات مدل بیماری و هم در بیماران، تغییر در پاسخ ایمنی و حضور نشانگرهای التهابی در بافتهای مبتلا، گزارششده است (28). از طرفی، در بسیاری از بیماران، سطوح بالای آنتیبادیهای آنتیتیروگلوبین دیده شده، که خود نشاندهنده پاسخهای خودایمنی در آنهاست (20). تغییرات اپیژنتیکی در سلولهای ایمنی میتوانند با ایجاد چنین حالاتی در این بیماران مرتبط باشند (29،30). TNF (tumor necrosis factor) نیز، ژن دیگری است که در تنظیم پاسخ ایمنی نقش داشته و FOXO3 نیز در تنظیم فرآیند التهاب دخالت دارد (24،31).
ژنهای دخیل در رگزایی فولیکولها
ژنهای HAPLN1،PTGER1 و AKR1C3 در پدیده رگزایی فولیکولی دخیل هستند (22). تغییر در این پدیده در بیماریزایی سندرم تخمدان پلیکیستیک نقش داشته (32) و در مراحل مختلف رشد فولیکول، تخمکگذاری و پیشبرد مرحله لوتئال دخالت دارد (33).
ژنهای دخیل در تخمکگذاری
از برخی ژنهایی که دچار تغییر الگوی متیلاسیون میشوند و در فرآیند تخمکگذاری و تنظیم فاز لوتئال دخالت دارند میتوان به AKR1C3، TNF، PTGER1،LIF و HPLN1 اشاره نمود. EDN2نیز پروتئینی به نام اندوتلین 2 را کد میکند که یک منقبضکننده عروق بوده و برای رهاشدن فولیکولهای تخمدان ضروری است (22،30).
ژنهای دخیل در متابولیسم سلولی
از میان ژنهایی که در این دسته قرار دارند میتوان بهKLF10 اشاره کرد که در متابولیسم سلولی نقش دارد. میزان بیان این ژن با اندازه آدیپوسیتها ارتباط داشته و بیان آن در بیماران مبتلابه سندرم تخمدان پلیکیستیک بالاتر از سایر افراد است (34).
ژنهای دخیل در مسیرهای پیامرسانی
ژنهای CACNA1A،CAV3 و CASR در پیامرسانی کلسیم مشارکت میکنند که این مسیر برای بلوغ، فعال شدن تخمکها و همچنین لقاح، اهمیت بالایی دارد (35). ژن دیگری به نام TNF نیز، در فعالسازی مسیر NF-κB وMAPK دخیل است (36) که هر دو مسیر نیز در سندرم تخمدان پلیکیستیک دچار بینظمی میشوند (37،38).
ژنهای دخیل در آپوپتوز و اتوفاژی
TPT1 در تنظیم چرخه سلولی و آپوپتوز نقش داشته وFOXO3 نیز ژنی است که هم در تنظیم اتوفاژی و هم در تنظیم آپوپتوز دخالت دارد.TNF نیز که در مسیرهای پیامرسانی متعددی نقش دارد، در القاء آپوپتوز نیز دخالت دارد (39،40). از این گذشته، در پایگاه (41)The NHLR GWAS catalog شماری از ژنهایی که تغییر الگوی متیلاسیون در سندرم تخمدان پلیکیستیک نشان دادهاند، از طریق مطالعات همراهی برایشان P≤ 0/05 گزارششده است که نشاندهنده ارتباط معنادار بین این ژنها و سندرم تخمدان پلیکیستیک است. شماری از این ژنها عبارتند از: RAB5B، PPARG، INSR و YAP1 (46-42). در جدول 1، لیستی از ژنهایی که الگوی متیلاسیون آنها در بیماران تغییر دارد، گردآوریشده است (56-47،19،22).
تغییرات microRNAs
ناهنجاری در بیان microRNAs در بافتهای متعددِ افرادِ مبتلا به سندرم تخمدان پلیکیستیک گزارششده است. در شکل 2، شماری از این مولکولهای RNA برحسب نوع بافتی که در آن بیان متفاوت از سایر افراد دارند، نشان داده شدهاند (57,58). اثر برخی از microRNAs بر بیماریزایی سندرم تخمدان پلیکیستیک شناختهشده است. بهطورمثال، کاهش بیان miR-145 میتواند باعث افزایش تکثیر سلول از طریق اثر بر مسیر IRS1/MAPK/ERK شود. miR-92b نیز در تنظیم آپوپتوز دخالت دارد (59). کاهش miR-32a در ایجاد کمبود استروژن دخیل بوده و تغییر در miR-223 نیز در بین افرادی که مقاومت به انسولین دارند، مشاهده میشود. افزایش بیان miR-200b و miR-429 نیز، میتواند از طریق اعمال تنظیم بر هیپوفیز، اثر خود را اعمال کند. کاهش بیان miR-592 هم با افزایش هورمون LH ارتباط دارد (60). miR-16 نیز، یکی از microRNAs است که در قشر تخمدان و سرم مبتلایان کاهش مییابد و نشان داده شده است که این microRNA در القاء تکثیر سلولهای گرانولوزا و مهار آپوپتوز دخیل است (61).
جدول 1: لیستی از ژنهایی که الگوی متیلاسیون آنها در بیماران تغییر دارد.


شکل 2: مولکولهای microRNA که میزانشان در سندرم تخمدان پلیکیستیک تغییر میکند.
رنگ سبز نشاندهنده افزایش و رنگ قرمز نشاندهنده کاهش بیان است.
تغییرات هیستونها
استیلاسیون هیستونها
با مطالعه بر روی مدل موشی B6D2F1 ارتباط معناداری بین افزایش تولید گونههای واکنشپذیر اکسیژن و افزایش استیلاسیون هیستونها نشان داده شده است (62). ازجمله تغییرات دیگری که مرتبط با استیلاسیون هیستونها گزارششده، افزایش بیان هیستونداستیلازی است به نام HDAC8 که این آنزیم از لایزین هیستونها، گروههای استیل را حذف کرده و از این طریق در تنظیم بیان ژن نقش دارد. افزایش بیان این هیستونداستیلاز با ایجاد مقاومت به انسولین در بیماران ارتباط دارد (63). در گوسفندِ مدلِ سندرم تخمدان پلیکیستیک نیز افزایش H3K9ac در ژنهای سازنده استروئید و مسیر التهاب باعث افزایش بیان ژنهای این دو مسیر میشود (11,64). با بررسی سلولهای کومولوس، افزایش میزان نشانگر H3K9ac در پروموتر ژنCYP19A1 معنادار گزارش شده است که این نشانگر، موجب فعال شدن رونویسی میشود. این ژن آنزیم آروماتاز را کد میکند که آندروژنها را به 17-β-استرادیول تبدیل میکند. تنظیم این ژن برحسب نوع بافت و به کمک نوع پروموتر انجام میشود. CYP19A1یکی از ژنهای مهم در عملکرد تخمدان، ساخت فولیکولها، رشد و تکوین فولیکولهاست که مقدار و زمان بیان آن بسیار اهمیت دارد و افزایش آن در بین بیماران مبتلا به سندرم تخمدان پلیکیستیک گزارش شده است (65). از طرفی امروزه نشان داده شده که داروهای مهارکننده آروماتاز مانند لتروزول در برخی موارد موفقتر از داروی کلومیفن سیترات در زمینه درمان ناباروری برای این بیماری عمل کرده است (66،67).
متیلاسیون هیستونها
با مطالعه بر روی حیوانات آزمایشگاهی مشخصشده است که در گوسفندِ مدلِ سندرم تخمدانِ پلیکیستیک، نشانگر H3K9me3 در سلولهای گرانولوزا و نشانگر H3K4me2 در سلولهای تکا افزایش مییابد (68). در مطالعات دیگر بر روی همین مدلِ حیوانی، افزایش دو نشانگر H3K9ac و H3K27ac نیز در ژنهای سازنده استروئید و مسیر التهاب نشان داده شدهاند (11،64).
بازآرایی کروماتین
با مطالعه برونتنی سلولهای بنیادیِ بافت چربیِ افرادِ مبتلا به سندرم تخمدان پلیکیستیک، مشخص شدهاست که بازآرایی کروماتین در این بیماران بهگونهای متفاوت از افراد کنترل انجام میشود که باعث افزایش فعالیت ژنهای متابولیسم اسیدهای چرب اشباع و غیراشباع شده و آدیپوژنز، اکسیداسیون لیپید، چرخه کربس و فسفوریلاسیون اکسیداتیو را تحت تاثیر قرار میدهد (69،70).
تغییرات اپیژنتیکی میتوکندری
میتوکندری اندامکی بسیار حساس به تغییرات محیطی است. تا مدتها به امکان رخداد تغییرات اپیژنتیکی در این اندامک توجه نمیشد، ولی امروزه روشن است که این اندامک میتواند از لحاظ اپیژنتیکی تغییر کند. 5-متیل سیتوزین (71) و 5-هیدروکسی سیتوزین میتوانند در میتوکندری ایجاد شوند. علاوهبراین ثابت شده است که دو ایزوفرم از آنزیم DNMT1 میتوانند DNA میتوکندریایی را خصوصاً در جزایر CpG پروموتر D-Loop متیله کنند. در این اندامک هیستون وجود ندارد اما پروتئینی به نام TFAM وجود دارد (72) که میتواند متیله، استیله، و یا فسفوریله شود. تغییرات اپیژنتیکی بر روی ژنهای هستهای دخیل در کارکرد میتوکندری مانند PPARϓ و PGC1α نیز میتوانند بینظمی ایجاد کنند (6). از جمله تغییرات اپیژنتیکی گزارش شده در بین زنان مبتلا به سندرم تخمدان پلیکیستیک میتوان به این موارد اشاره کرد: هایپرمتیلاسیون پروموتر PGC1α که منجر به کاهش تعداد DNA میتوکندریایی میشود که این خود موجب بالا بردن ریسک ابتلا به بیماریهای متابولیکی در بیماران میشود. شماری از ژنهای هستهای دخیل در کارکرد میتوکندری مانند APP، PARK2، INS و EER1 نیز در بین مبتلایان الگوی متیلاسیون متفاوت نشان میدهند. علاوه بر این، در اووسیت زنان مبتلا به تخمدان پلیکیستیک، ژنهای 12S rRNA،16S rRNA، ND4 و ناحیه D-Loop نیز بهطور معناداری حالت هایپرمتیله دارند. تغییرات اپیژنتیکی در میتوکندری منجر به افزایش سطح هموسیستئین در مایع فولیکولی شده که این افزایش در عملکرد میتوکندری اختلال ایجاد کرده و بر کیفیت و تکوین اووسیت اثر منفی خواهد داشت (73).
نتیجهگیری
تغییرات اپیژنتیکی در سندرم تخمدان پلیکیستیک میتوانند در دو سطح رخ دهند که شامل سطح هستهای و سطح میتوکندریایی است. سطح هسته، واجد چهار دسته است. نخست تغییر در الگوی متیلاسیون DNA که میتواند ژنهای دخیل در کنترل مسیرهای پیامرسانی، آپوپتوز و اتوفاژی، تولید هورمونها، فسفوریلاسیون اکسیداتیو، متابولیسم سلول، تخمکگذاری، رگزایی فولیکولها، التهاب و سیستم ایمنی را درگیر کند. دسته دوم تغییرات microRNAs است که افزایش و یا کاهش آنها در بافتهایی نظیر چربی، سرم و فولیکول گزارش شدهاند. دسته سوم تغییرات هیستونها نظیر تغییر الگوی استیلاسیون و متیلاسیون بوده و دسته چهارم تغییر در بازآرایی کروماتین است که منجر به تغییرات ساختمانی میشود. در سطح اندامک میتوکندری نیز ژنوم میتوکندریایی و ژنهای هستهای دخیل در عملکرد این اندامک میتوانند متحمل تغییرات اپیژنتیکی شوند. درمانهای کنونی سندرم تخمدان پلیکیستیک مبتنی بر تغییر سبک زندگی، درمانهای دارویی، مداخلات جراحی و یا ترکیبی از این روشهاست. تاکنون مطالعات وسیعی تغییرات اپیژنتیکی ایجاد شده در بین بیماران را بررسی کردهاند ولی در زمینه اثرات بالینی این تغییرات مطالعات محدودی انجام شده و از طرفی تاکنون مطالعهای به بررسی اثر تصحیح سبک زندگی و یا درمانهای دارویی بر اپیژنوم بیماران نپرداخته است. پیشنهاد میشود مطالعاتی در زمینه مقایسه اپیژنوم بیماران در قبل و بعد از درمان صورت گیرد تا اصلاحات اپیژنتیکی حاصل از درمان آشکار شوند. با بررسی اثر این اصلاحات اپیژنتیکی زمینه برای طراحی اپیداروها در آیندهای نهچندان دور ایجاد خواهد شد.
سپاسگزاری
بدینوسیله مراتب قدردانی خود را از معاونت پژوهش و فناوری دانشگاه فردوسی مشهد اعلام میداریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Liu L, He D, Wang Y, Sheng M. Integrated Analysis of DNA Methylation and Transcriptome Profiling of Polycystic Ovary Syndrome. Mol Med Rep 2020; 21(5): 2138-50.
2- Behboodi Moghadam Z, Fereidooni B, Saffari M, Montazeri A. Polycystic Ovary Syndrome and Its Impact on Iranian Women's Quality of Life: A Population-Based Study. BMC Womens Health 2018; 18(1): 164.
3- Azziz R, Adashi EY. Stein and Leventhal: 80 Years on. Am J Obstet Gynecol 2016; 214(2): 247.
4- Sharma YK, Chauhan S, Singh P, Deo K. Correlation of Cutaneous Manifestations with Body Mass Index, Blood Glucose, and Hormonal Levels in Patients with Polycystic Ovarian Disease. Indian Dermatol Online J 2020; 11(3): 378-81.
5- Rodriguez Paris V, Bertoldo MJ. The Mechanism of Androgen Actions in PCOS Etiology. Med Sci (Basel) 2019; 7(9): 89.
6- Shukla P, Mukherjee S. Mitochondrial Dysfunction: An Emerging Link in the Pathophysiology of Polycystic Ovary Syndrome. Mitochondrion 2020; 52: 24-39.
7- Neshati Z, Matin MM, Bahrami AR, Moghimi A. Differentiation of Mesenchymal Stem Cells to Insulin-Producing Cells and their Impact on Type 1 Diabetic Rats. J Physiol Biochem 2010; 66(2): 181-7.
8- Dumesic DA, Richards JS. Ontogeny of the Ovary in Polycystic Ovary Syndrome. Fertil Steril 2013; 100(1): 23-38.
9- Homer MV, Rosencrantz MA, Shayya RF, Chang RJ. The Effect of Estradiol on Granulosa Cell Responses to FSH in Women with Polycystic Ovary Syndrome. Reprod Biol Endocrinol 2017; 15(1): 13.
10- Rostamtabar M, Esmaeilzadeh S, Tourani M, Rahmani A, Baee M, Shirafkan F, et al. Pathophysiological Roles of Chronic Low-Grade Inflammation Mediators in Polycystic Ovary Syndrome. J Cell Physiol 2021; 236(2): 824-38.
11- Steegers-Theunissen RPM, Wiegel RE, Jansen PW, Laven JSE, Sinclair KD. Polycystic Ovary Syndrome: A Brain Disorder Characterized by Eating Problems Originating during Puberty and Adolescence. Int J Mol Sci 2020; 21(21): 8211.
12- Li S, Zhu D, Duan H, Tan Q. The Epigenomics of Polycystic Ovarian Syndrome: From Pathogenesis to Clinical Manifestations. Gynecol Endocrinol 2016; 32(12): 942-6.
13- Wawrzkiewicz-Jałowiecka A, Kowalczyk K, Trybek P, Jarosz T, Radosz P, Setlak M, et al. In Search of New Therapeutics-Molecular Aspects of the PCOS Pathophysiology: Genetics, Hormones, Metabolism and Beyond. Int J Mol Sci 2020; 21(19): 7054.
14- Nilsson E, Klukovich R, Sadler-Riggleman I, Beck D, Xie Y, Yan W, et al. Environmental Toxicant Induced Epigenetic Transgenerational Inheritance of Ovarian Pathology and Granulosa Cell Epigenome and Transcriptome Alterations: Ancestral Origins of Polycystic Ovarian Syndrome and Primary Ovarian Insufiency. Epigenetics 2018; 13(8): 875-95.
15- Akhtarkhavari T, Behjati F. Role of Epigenetics in Male Infertility. SJMR 2018; 3(3): 177-83. [Persian]
16- Kim M, Costello J. DNA Methylation: An Epigenetic Mark of Cellular Memory. Exp Mol Med 2017; 49(4): e322.
17- Matin MM, Baumer A, Hornby DP. An Analytical Method for the Detection of Methylation Differences at Specific Chromosomal Loci Using Primer Extension and Ion Pair Reverse Phase HPLC. Hum Mutat 2002; 20(4): 305-11.
18- Neganova ME, Klochkov SG, Aleksandrova YR, Aliev G. Histone Modifications in Epigenetic Regulation of Cancer: Perspectives and Achieved Progress. Semin Cancer Biol 2020; 83: 452-71.
19- Vázquez-Martínez ER, Gómez-Viais YI, García-Gómez E, Reyes-Mayoral C, Reyes-Muñoz E, Camacho-Arroyo I, et al. DNA Methylation in the Pathogenesis of Polycystic Ovary Syndrome. Reproduction 2019; 158(1): R27-R40.
20- Ganie MA, Vasudevan V, Wani IA, Baba MS, Arif T, Rashid A. Epidemiology, Pathogenesis, Genetics & Management of Polycystic Ovary Syndrome in India. Indian J Med Res 2019; 150(4): 333-44.
21- Bhardwaj JK, Panchal H, Saraf P. Ameliorating Effects of Natural Antioxidant Compounds on Female Infertility: A Review. Reprod Sci 2020; 28(5): 1227-56.
22- Sagvekar P, Kumar P, Mangoli V, Desai S, Mukherjee S. DNA Methylome Profiling of Granulosa Cells Reveals Altered Methylation in Genes Regulating Vital Ovarian Functions in Polycystic Ovary Syndrome. Clin Epigenetics 2019; 11(1): 61.
23- Buonocore F, Achermann JC. Primary Adrenal Insufficiency: New Genetic Causes and their Long-Term Consequences. Clin Endocrinol (Oxf) 2020; 92(1): 11-20.
24- Webster JD, Vucic D. The Balance of TNF Mediated Pathways Regulates Inflammatory Cell Death Signaling in Healthy and Diseased Tissues. Front Cell Dev Biol 2020; 8: 365.
25- Zhang C, Cui T, Cai R, Wangpaichitr M, Mirsaeidi M, Schally AV, et al. Growth Hormone-Releasing Hormone in Lung Physiology and Pulmonary Disease. Cells 2020; 9(10): 2331.
26- Gong Y, Luo S, Fan P, Jin S, Zhu H, Deng T, et al. Growth Hormone Alleviates Oxidative Stress and Improves Oocyte Quality in Chinese Women with Polycystic Ovary Syndrome: A Randomized Controlled Trial. Sci Rep 2020; 10(1): 18769.
27- Laban M, Shemais T, Elhelw E, El-Hussanin A. Role of Insulin Like Growth Factor in Polycystic Ovary Syndrome. Egypt J Hosp Med. 2018; 72(2): 4005-11.
28- Hiam D, Simar D, Laker R, Altıntaş A, Gibson-Helm M, Fletcher E, et al. Epigenetic Reprogramming of Immune Cells in Women with PCOS Impact Genes Controlling Reproductive Function. J Clin Endocrinol Metab 2019; 104(12): 6155-70.
29- Ohkura N, Yasumizu Y, Kitagawa Y, Tanaka A, Nakamura Y, Motooka D, et al. Regulatory T Cell-Specific Epigenomic Region Variants are a Key Determinant of Susceptibility to Common Autoimmune Diseases. Immunity 2020; 52(6): 1119-32.e4.
30- Cacioppo JA, Lin P-CP, Hannon PR, McDougle DR, Gal A, Ko C. Granulosa Cell Endothelin-2 Expression is Fundamental for Ovulatory Follicle Rupture. Sci Rep 2017; 7(1): 817.
31- Lundell LS, Massart J, Altıntaş A, Krook A, Zierath JR. Regulation of Glucose Uptake and Inflammation Markers by FOXO1 and FOXO3 in Skeletal Muscle. Mol Metab 2019; 20: 79-88.
32- Di Pietro M, Pascuali N, Parborell F, Abramovich D. Ovarian Angiogenesis in Polycystic Ovary Syndrome. Reproduction 2018; 155(5): R199-R209.
33- Zhao J, Li D, Tang H, Tang L. Association of Vascular Endothelial Growth Factor Polymorphisms with Polycystic Ovarian Syndrome Risk: A Meta-Analysis. Reprod Biol Endocrinol 2020; 18(1): 18.
34- Nilsson E, Benrick A, Kokosar M, Krook A, Lindgren E, Källman T, et al. Transcriptional and Epigenetic Changes Influencing Skeletal Muscle Metabolism in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2018; 103(12): 4465-77.
35- Stein P, Savy V, Williams AM, Williams CJ. Modulators of Calcium Signalling at Fertilization. Open Biol 2020; 10(7): 200118.
36- Shi JH, Sun SC. Tumor Necrosis Factor Receptor-Associated Factor Regulation of Nuclear Factor Κb and Mitogen-Activated Protein Kinase Pathways. Front Immunol 2018; 9: 1849.
37- Marker A, Goel M, Das V, Agarwal A. PI3K-Akt-Mtor and MAPK Signaling Pathways in Polycystic Ovarian Syndrome, Uterine Leiomyomas And Endometriosis: An Update. Gynecol Endocrinol 2012; 28(3): 175-81.
38- Zuo T, Zhu M, Xu W, Wang Z, Song H. Iridoids with Genipin Stem Nucleus Inhibit Lipopolysaccharide-Induced Inflammation and Oxidative Stress by Blocking the NF-Κb Pathway in Polycystic Ovary Syndrome. Cell Physiol Biochem 2017; 43(5): 1855-65.
39- Fitzwalter BE, Thorburn A. FOXO3 Links Autophagy to Apoptosis. Autophagy 2018; 14(8): 1467-68
40- Guo F, Yuan Y. Tumor Necrosis Factor Alpha-Induced Proteins in Malignant Tumors: Progress and Prospects. Onco Targets Ther 2020; 13: 3303-18.
41- Buniello A, MacArthur JAL, Cerezo M, Harris LW, Hayhurst J, Malangone C, et al. The NHGRI-EBI GWAS Catalog of Published Genome-Wide Association Studies, Targeted Arrays and Summary Statistics 2019. Nucleic Acids Res 2019; 47(D1): D1005-D1012.
42- Yu J, Ding C, Guan S, Wang C. Association of Single Nucleotide Polymorphisms in the RAB5B Gene 3'UTR Region with Polycystic Ovary Syndrome in Chinese Han Women. Biosci Rep 2019; 39(5): BSR20190292.
43- Liang J, Lan J, Li M, Wang F. Associations of Leptin Receptor and Peroxisome Proliferator-Activated Receptor Gamma Polymorphisms with Polycystic Ovary Syndrome: A Meta-Analysis. Ann Nutr Metab 2019; 75(1): 1-8.
44- Tian Y, Li J, Su S, Cao Y, Wang Z, Zhao S, et al. PCOS-GWAS Susceptibility Variants in THADA, INSR, TOX3, and DENND1A are Associated with Metabolic Syndrome or Insulin Resistance in Women with PCOS. Front Endocrinol (Lausanne) 2020; 11: 274.
45- Daghestani MH. RS1799817 in INSR Associates with Susceptibility to Polycystic Ovary Syndrome. J Med Biochem 2020; 39(2): 149-59.
46- Castillo-Higuera T, Alarcón-Granados MC, Marin-Suarez J, Moreno-Ortiz H, Esteban-Pérez CI, Ferrebuz-Cardozo AJ, et al. A Comprehensive Overview of Common Polymorphic Variants in Genes Related to Polycystic Ovary Syndrome. Reprod Sci 2020; 28(9): 2399-412.
47- Sagvekar P, Mangoli V, Desai S, Patil A, Mukherjee S. LINE1 Cpg-DNA Hypomethylation in Granulosa Cells and Blood Leukocytes is Associated with PCOS and Related Traits. J Clin Endocrinol Metab 2017; 102(4): 1396-405.
48- Sang Q, Zhang S, Zou S, Wang H, Feng R, Li Q, et al. Quantitative Analysis of Follistatin (FST) Promoter Methylation in Peripheral Blood of Patients with Polycystic Ovary Syndrome. Reprod Biomed Online 2013; 26(2): 157-63.
49- Shen HR, Qiu LH, Zhang ZQ, Qin YY, Cao C, Di W. Genome-Wide Methylated DNA Immunoprecipitation Analysis of Patients with Polycystic Ovary Syndrome. PLoS One 2013; 8(5): e64801.
50- Ting W, Yanyan Q, Jian H, Keqin H, Duan M. The Relationship between Insulin Resistance and Cpg Island Methylation of LMNA Gene in Polycystic Ovary Syndrome. Cell Biochem Biophys 2013; 67(3): 1041-47.
51- Wang P, Zhao H, Li T, Zhang W, Wu K, Li M, et al. Hypomethylation of the LH/Choriogonadotropin Receptor Promoter Region is a Potential Mechanism Underlying Susceptibility to Polycystic Ovary Syndrome. Endocrinology 2014; 155(4): 1445-52.
52- Zhao H, Zhao Y, Ren Y, Li M, Li T, Li R, et al. Epigenetic Regulation of an Adverse Metabolic Phenotype in Polycystic Ovary Syndrome: The Impact of the Leukocyte Methylation of Ppargc1a Promoter. Fertil Steril 2017; 107(2): 467-74.e5.
53- Lambertini L, Saul SR, Copperman AB, Hammerstad SS, Yi Z, Zhang W, et al. Intrauterine Reprogramming of the Polycystic Ovary Syndrome: Evidence from a Pilot Study of Cord Blood Global Methylation Analysis. Front Endocrinol (Lausanne) 2017; 8: 352.
54- Jiang LL, Xie JK, Cui JQ, Wei D, Yin BL, Zhang YN, et al. Promoter Methylation of Yes-Associated Protein (YAP1) Gene in Polycystic Ovary Syndrome. Medicine (Baltimore) 2017; 96(2): e5768.
55- Xu J, Bao X, Peng Z, Wang L, Du L, Niu W, et al. Comprehensive Analysis of Genome-Wide DNA Methylation Across Human Polycystic Ovary Syndrome Ovary Granulosa Cell. Oncotarget 2016; 7(19): 27899-909.
56- Pan JX, Tan YJ, Wang FF, Hou NN, Xiang YQ, Zhang JY, et al. Aberrant Expression and DNA Methylation of Lipid Metabolism Genes in PCOS: A New Insight into its Pathogenesis. Clin Epigenetics 2018; 10(1): 6.
57- Dehghan Z, Mohammadi-Yeganeh S, Salehi M. Mirna-155 Regulates Cumulus Cells Function, Oocyte Maturation, and Blastocyst Formation. Biol Reprod 2020; 103(3): 548-59.
58- Arghiani N, Matin MM. Mir-21: A Key Small Molecule with Great Effects in Combination Cancer Therapy. Nucleic Acid Ther 2021; 31(4): 271-83.
59- Shin VY, Siu MT, Liu X, Ng EKO, Kwong A, Chu KM. Mir-92 Suppresses Proliferation and Induces Apoptosis by Targeting EP4/Notch1 Axis in Gastric Cancer. Oncotarget 2018; 9(36): 24209-20.
60- Chen B, Xu P, Wang J, Zhang C. The Role of Mirna in Polycystic Ovary Syndrome (PCOS). Gene 2019; 706: 91-6.
61- Fu X, He Y, Wang X, Peng D, Chen X, Li X, et al. Microrna-16 Promotes Ovarian Granulosa Cell Proliferation and Suppresses Apoptosis Through Targeting PDCD4 in Polycystic Ovarian Syndrome. Cell Physiol Biochem 2018; 48(2): 670-82.
62- Eini F, Novin MG, Joharchi K, Hosseini A, Nazarian H, Piryaei A, et al. Intracytoplasmic Oxidative Stress Reverses Epigenetic Modifications in Polycystic Ovary Syndrome. Reprod Fertil Dev 2017; 29(12): 2313-23.
63- Tian Y, Wong VW, Wong GL, Yang W, Sun H, Shen J, et al. Histone Deacetylase HDAC8 Promotes Insulin Resistance And Β-Catenin Activation in NAFLD-Associated Hepatocellular Carcinoma. Cancer Res 2015; 75(22): 4803-16.
64- Sinha N, Roy S, Huang B, Wang J, Padmanabhan V, Sen A. Developmental Programming: Prenatal Testosterone-Induced Epigenetic Modulation and its Effect on Gene Expression in Sheep Ovary. Biol Reprod 2020; 102(5): 1045-54.
65- Hosseini E, Shahhoseini M, Afsharian P, Karimian L, Ashrafi M, Mehraein F, et al. Role of Epigenetic Modifications in the Aberrant CYP19A1 Gene Expression in Polycystic Ovary Syndrome. Arch Med Sci 2019; 15(4): 887-95.
66- Rocha AL, Oliveira FR, Azevedo RC, Silva VA, Peres TM, Candido AL, et al. Recent Advances in the Understanding and Management of Polycystic Ovary Syndrome. F1000Res 2019; 8(F1000 Faculty Rev): 565.
67- Franik S, Eltrop SM, Kremer JA, Kiesel L, Farquhar C. Aromatase Inhibitors (Letrozole) for Subfertile Women with Polycystic Ovary Syndrome. Cochrane Database Syst Rev 2018; 5(5): Cd010287.
68- Guo X, Puttabyatappa M, Thompson RC, Padmanabhan V. Developmental Programming: Contribution of Epigenetic Enzymes to Antral Follicular Defects in the Sheep Model of PCOS. Endocrinology 2019; 160(10): 2471-84.
69- Leung KL, Sanchita S, Pham CT, Davis BA, Okhovat M, Ding X, et al. Dynamic Changes in Chromatin Accessibility, Altered Adipogenic Gene Expression, and Total Versus De Novo Fatty Acid Synthesis in Subcutaneous Adipose Stem Cells of Normal-Weight Polycystic Ovary Syndrome (PCOS) Women During Adipogenesis: Evidence of Cellular Programming. Clin Epigenetics 2020; 12(1): 181.
70- Bidkhori HR, Farshchian M, Heirani-Tabasi A, Naderi-Meshkin1 H, Dastpak M, Ahmadian Kia N, et al. Comparative Analysis of the Gene Expression Profile of Chemokine Receptors between Adipose-Derived and Bone Marrow-Derived Mesenchymal Stem Cells. Int J Pediatr 2014; 2(2.3): 17.
71- Matsuda S, Yasukawa T, Sakaguchi Y, Ichiyanagi K, Unoki M, Gotoh K, et al. Accurate Estimation of 5-Methylcytosine in Mammalian Mitochondrial DNA. Sci Rep 2018; 8(1): 5801.
72- Farge G, Falkenberg M. Organization of DNA in Mammalian Mitochondria. Int J Mol Sci 2019; 20(11): 2770.
73- Jia L, Zeng Y, Hu Y, Liu J, Yin C, Niu Y, et al. Homocysteine Impairs Porcine Oocyte Quality Via Deregulation of One-Carbon Metabolism and Hypermethylation of Mitochondrial DNA. Biol Reprod 2019; 100(4): 907-16.
1- Liu L, He D, Wang Y, Sheng M. Integrated Analysis of DNA Methylation and Transcriptome Profiling of Polycystic Ovary Syndrome. Mol Med Rep 2020; 21(5): 2138-50.
2- Behboodi Moghadam Z, Fereidooni B, Saffari M, Montazeri A. Polycystic Ovary Syndrome and Its Impact on Iranian Women's Quality of Life: A Population-Based Study. BMC Womens Health 2018; 18(1): 164.
3- Azziz R, Adashi EY. Stein and Leventhal: 80 Years on. Am J Obstet Gynecol 2016; 214(2): 247.
4- Sharma YK, Chauhan S, Singh P, Deo K. Correlation of Cutaneous Manifestations with Body Mass Index, Blood Glucose, and Hormonal Levels in Patients with Polycystic Ovarian Disease. Indian Dermatol Online J 2020; 11(3): 378-81.
5- Rodriguez Paris V, Bertoldo MJ. The Mechanism of Androgen Actions in PCOS Etiology. Med Sci (Basel) 2019; 7(9): 89.
6- Shukla P, Mukherjee S. Mitochondrial Dysfunction: An Emerging Link in the Pathophysiology of Polycystic Ovary Syndrome. Mitochondrion 2020; 52: 24-39.
7- Neshati Z, Matin MM, Bahrami AR, Moghimi A. Differentiation of Mesenchymal Stem Cells to Insulin-Producing Cells and their Impact on Type 1 Diabetic Rats. J Physiol Biochem 2010; 66(2): 181-7.
8- Dumesic DA, Richards JS. Ontogeny of the Ovary in Polycystic Ovary Syndrome. Fertil Steril 2013; 100(1): 23-38.
9- Homer MV, Rosencrantz MA, Shayya RF, Chang RJ. The Effect of Estradiol on Granulosa Cell Responses to FSH in Women with Polycystic Ovary Syndrome. Reprod Biol Endocrinol 2017; 15(1): 13.
10- Rostamtabar M, Esmaeilzadeh S, Tourani M, Rahmani A, Baee M, Shirafkan F, et al. Pathophysiological Roles of Chronic Low-Grade Inflammation Mediators in Polycystic Ovary Syndrome. J Cell Physiol 2021; 236(2): 824-38.
11- Steegers-Theunissen RPM, Wiegel RE, Jansen PW, Laven JSE, Sinclair KD. Polycystic Ovary Syndrome: A Brain Disorder Characterized by Eating Problems Originating during Puberty and Adolescence. Int J Mol Sci 2020; 21(21): 8211.
12- Li S, Zhu D, Duan H, Tan Q. The Epigenomics of Polycystic Ovarian Syndrome: From Pathogenesis to Clinical Manifestations. Gynecol Endocrinol 2016; 32(12): 942-6.
13- Wawrzkiewicz-Jałowiecka A, Kowalczyk K, Trybek P, Jarosz T, Radosz P, Setlak M, et al. In Search of New Therapeutics-Molecular Aspects of the PCOS Pathophysiology: Genetics, Hormones, Metabolism and Beyond. Int J Mol Sci 2020; 21(19): 7054.
14- Nilsson E, Klukovich R, Sadler-Riggleman I, Beck D, Xie Y, Yan W, et al. Environmental Toxicant Induced Epigenetic Transgenerational Inheritance of Ovarian Pathology and Granulosa Cell Epigenome and Transcriptome Alterations: Ancestral Origins of Polycystic Ovarian Syndrome and Primary Ovarian Insufiency. Epigenetics 2018; 13(8): 875-95.
15- Akhtarkhavari T, Behjati F. Role of Epigenetics in Male Infertility. SJMR 2018; 3(3): 177-83. [Persian]
16- Kim M, Costello J. DNA Methylation: An Epigenetic Mark of Cellular Memory. Exp Mol Med 2017; 49(4): e322.
17- Matin MM, Baumer A, Hornby DP. An Analytical Method for the Detection of Methylation Differences at Specific Chromosomal Loci Using Primer Extension and Ion Pair Reverse Phase HPLC. Hum Mutat 2002; 20(4): 305-11.
18- Neganova ME, Klochkov SG, Aleksandrova YR, Aliev G. Histone Modifications in Epigenetic Regulation of Cancer: Perspectives and Achieved Progress. Semin Cancer Biol 2020; 83: 452-71.
19- Vázquez-Martínez ER, Gómez-Viais YI, García-Gómez E, Reyes-Mayoral C, Reyes-Muñoz E, Camacho-Arroyo I, et al. DNA Methylation in the Pathogenesis of Polycystic Ovary Syndrome. Reproduction 2019; 158(1): R27-R40.
20- Ganie MA, Vasudevan V, Wani IA, Baba MS, Arif T, Rashid A. Epidemiology, Pathogenesis, Genetics & Management of Polycystic Ovary Syndrome in India. Indian J Med Res 2019; 150(4): 333-44.
21- Bhardwaj JK, Panchal H, Saraf P. Ameliorating Effects of Natural Antioxidant Compounds on Female Infertility: A Review. Reprod Sci 2020; 28(5): 1227-56.
22- Sagvekar P, Kumar P, Mangoli V, Desai S, Mukherjee S. DNA Methylome Profiling of Granulosa Cells Reveals Altered Methylation in Genes Regulating Vital Ovarian Functions in Polycystic Ovary Syndrome. Clin Epigenetics 2019; 11(1): 61.
23- Buonocore F, Achermann JC. Primary Adrenal Insufficiency: New Genetic Causes and their Long-Term Consequences. Clin Endocrinol (Oxf) 2020; 92(1): 11-20.
24- Webster JD, Vucic D. The Balance of TNF Mediated Pathways Regulates Inflammatory Cell Death Signaling in Healthy and Diseased Tissues. Front Cell Dev Biol 2020; 8: 365.
25- Zhang C, Cui T, Cai R, Wangpaichitr M, Mirsaeidi M, Schally AV, et al. Growth Hormone-Releasing Hormone in Lung Physiology and Pulmonary Disease. Cells 2020; 9(10): 2331.
26- Gong Y, Luo S, Fan P, Jin S, Zhu H, Deng T, et al. Growth Hormone Alleviates Oxidative Stress and Improves Oocyte Quality in Chinese Women with Polycystic Ovary Syndrome: A Randomized Controlled Trial. Sci Rep 2020; 10(1): 18769.
27- Laban M, Shemais T, Elhelw E, El-Hussanin A. Role of Insulin Like Growth Factor in Polycystic Ovary Syndrome. Egypt J Hosp Med. 2018; 72(2): 4005-11.
28- Hiam D, Simar D, Laker R, Altıntaş A, Gibson-Helm M, Fletcher E, et al. Epigenetic Reprogramming of Immune Cells in Women with PCOS Impact Genes Controlling Reproductive Function. J Clin Endocrinol Metab 2019; 104(12): 6155-70.
29- Ohkura N, Yasumizu Y, Kitagawa Y, Tanaka A, Nakamura Y, Motooka D, et al. Regulatory T Cell-Specific Epigenomic Region Variants are a Key Determinant of Susceptibility to Common Autoimmune Diseases. Immunity 2020; 52(6): 1119-32.e4.
30- Cacioppo JA, Lin P-CP, Hannon PR, McDougle DR, Gal A, Ko C. Granulosa Cell Endothelin-2 Expression is Fundamental for Ovulatory Follicle Rupture. Sci Rep 2017; 7(1): 817.
31- Lundell LS, Massart J, Altıntaş A, Krook A, Zierath JR. Regulation of Glucose Uptake and Inflammation Markers by FOXO1 and FOXO3 in Skeletal Muscle. Mol Metab 2019; 20: 79-88.
32- Di Pietro M, Pascuali N, Parborell F, Abramovich D. Ovarian Angiogenesis in Polycystic Ovary Syndrome. Reproduction 2018; 155(5): R199-R209.
33- Zhao J, Li D, Tang H, Tang L. Association of Vascular Endothelial Growth Factor Polymorphisms with Polycystic Ovarian Syndrome Risk: A Meta-Analysis. Reprod Biol Endocrinol 2020; 18(1): 18.
34- Nilsson E, Benrick A, Kokosar M, Krook A, Lindgren E, Källman T, et al. Transcriptional and Epigenetic Changes Influencing Skeletal Muscle Metabolism in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2018; 103(12): 4465-77.
35- Stein P, Savy V, Williams AM, Williams CJ. Modulators of Calcium Signalling at Fertilization. Open Biol 2020; 10(7): 200118.
36- Shi JH, Sun SC. Tumor Necrosis Factor Receptor-Associated Factor Regulation of Nuclear Factor Κb and Mitogen-Activated Protein Kinase Pathways. Front Immunol 2018; 9: 1849.
37- Marker A, Goel M, Das V, Agarwal A. PI3K-Akt-Mtor and MAPK Signaling Pathways in Polycystic Ovarian Syndrome, Uterine Leiomyomas And Endometriosis: An Update. Gynecol Endocrinol 2012; 28(3): 175-81.
38- Zuo T, Zhu M, Xu W, Wang Z, Song H. Iridoids with Genipin Stem Nucleus Inhibit Lipopolysaccharide-Induced Inflammation and Oxidative Stress by Blocking the NF-Κb Pathway in Polycystic Ovary Syndrome. Cell Physiol Biochem 2017; 43(5): 1855-65.
39- Fitzwalter BE, Thorburn A. FOXO3 Links Autophagy to Apoptosis. Autophagy 2018; 14(8): 1467-68
40- Guo F, Yuan Y. Tumor Necrosis Factor Alpha-Induced Proteins in Malignant Tumors: Progress and Prospects. Onco Targets Ther 2020; 13: 3303-18.
41- Buniello A, MacArthur JAL, Cerezo M, Harris LW, Hayhurst J, Malangone C, et al. The NHGRI-EBI GWAS Catalog of Published Genome-Wide Association Studies, Targeted Arrays and Summary Statistics 2019. Nucleic Acids Res 2019; 47(D1): D1005-D1012.
42- Yu J, Ding C, Guan S, Wang C. Association of Single Nucleotide Polymorphisms in the RAB5B Gene 3'UTR Region with Polycystic Ovary Syndrome in Chinese Han Women. Biosci Rep 2019; 39(5): BSR20190292.
43- Liang J, Lan J, Li M, Wang F. Associations of Leptin Receptor and Peroxisome Proliferator-Activated Receptor Gamma Polymorphisms with Polycystic Ovary Syndrome: A Meta-Analysis. Ann Nutr Metab 2019; 75(1): 1-8.
44- Tian Y, Li J, Su S, Cao Y, Wang Z, Zhao S, et al. PCOS-GWAS Susceptibility Variants in THADA, INSR, TOX3, and DENND1A are Associated with Metabolic Syndrome or Insulin Resistance in Women with PCOS. Front Endocrinol (Lausanne) 2020; 11: 274.
45- Daghestani MH. RS1799817 in INSR Associates with Susceptibility to Polycystic Ovary Syndrome. J Med Biochem 2020; 39(2): 149-59.
46- Castillo-Higuera T, Alarcón-Granados MC, Marin-Suarez J, Moreno-Ortiz H, Esteban-Pérez CI, Ferrebuz-Cardozo AJ, et al. A Comprehensive Overview of Common Polymorphic Variants in Genes Related to Polycystic Ovary Syndrome. Reprod Sci 2020; 28(9): 2399-412.
47- Sagvekar P, Mangoli V, Desai S, Patil A, Mukherjee S. LINE1 Cpg-DNA Hypomethylation in Granulosa Cells and Blood Leukocytes is Associated with PCOS and Related Traits. J Clin Endocrinol Metab 2017; 102(4): 1396-405.
48- Sang Q, Zhang S, Zou S, Wang H, Feng R, Li Q, et al. Quantitative Analysis of Follistatin (FST) Promoter Methylation in Peripheral Blood of Patients with Polycystic Ovary Syndrome. Reprod Biomed Online 2013; 26(2): 157-63.
49- Shen HR, Qiu LH, Zhang ZQ, Qin YY, Cao C, Di W. Genome-Wide Methylated DNA Immunoprecipitation Analysis of Patients with Polycystic Ovary Syndrome. PLoS One 2013; 8(5): e64801.
50- Ting W, Yanyan Q, Jian H, Keqin H, Duan M. The Relationship between Insulin Resistance and Cpg Island Methylation of LMNA Gene in Polycystic Ovary Syndrome. Cell Biochem Biophys 2013; 67(3): 1041-47.
51- Wang P, Zhao H, Li T, Zhang W, Wu K, Li M, et al. Hypomethylation of the LH/Choriogonadotropin Receptor Promoter Region is a Potential Mechanism Underlying Susceptibility to Polycystic Ovary Syndrome. Endocrinology 2014; 155(4): 1445-52.
52- Zhao H, Zhao Y, Ren Y, Li M, Li T, Li R, et al. Epigenetic Regulation of an Adverse Metabolic Phenotype in Polycystic Ovary Syndrome: The Impact of the Leukocyte Methylation of Ppargc1a Promoter. Fertil Steril 2017; 107(2): 467-74.e5.
53- Lambertini L, Saul SR, Copperman AB, Hammerstad SS, Yi Z, Zhang W, et al. Intrauterine Reprogramming of the Polycystic Ovary Syndrome: Evidence from a Pilot Study of Cord Blood Global Methylation Analysis. Front Endocrinol (Lausanne) 2017; 8: 352.
54- Jiang LL, Xie JK, Cui JQ, Wei D, Yin BL, Zhang YN, et al. Promoter Methylation of Yes-Associated Protein (YAP1) Gene in Polycystic Ovary Syndrome. Medicine (Baltimore) 2017; 96(2): e5768.
55- Xu J, Bao X, Peng Z, Wang L, Du L, Niu W, et al. Comprehensive Analysis of Genome-Wide DNA Methylation Across Human Polycystic Ovary Syndrome Ovary Granulosa Cell. Oncotarget 2016; 7(19): 27899-909.
56- Pan JX, Tan YJ, Wang FF, Hou NN, Xiang YQ, Zhang JY, et al. Aberrant Expression and DNA Methylation of Lipid Metabolism Genes in PCOS: A New Insight into its Pathogenesis. Clin Epigenetics 2018; 10(1): 6.
57- Dehghan Z, Mohammadi-Yeganeh S, Salehi M. Mirna-155 Regulates Cumulus Cells Function, Oocyte Maturation, and Blastocyst Formation. Biol Reprod 2020; 103(3): 548-59.
58- Arghiani N, Matin MM. Mir-21: A Key Small Molecule with Great Effects in Combination Cancer Therapy. Nucleic Acid Ther 2021; 31(4): 271-83.
59- Shin VY, Siu MT, Liu X, Ng EKO, Kwong A, Chu KM. Mir-92 Suppresses Proliferation and Induces Apoptosis by Targeting EP4/Notch1 Axis in Gastric Cancer. Oncotarget 2018; 9(36): 24209-20.
60- Chen B, Xu P, Wang J, Zhang C. The Role of Mirna in Polycystic Ovary Syndrome (PCOS). Gene 2019; 706: 91-6.
61- Fu X, He Y, Wang X, Peng D, Chen X, Li X, et al. Microrna-16 Promotes Ovarian Granulosa Cell Proliferation and Suppresses Apoptosis Through Targeting PDCD4 in Polycystic Ovarian Syndrome. Cell Physiol Biochem 2018; 48(2): 670-82.
62- Eini F, Novin MG, Joharchi K, Hosseini A, Nazarian H, Piryaei A, et al. Intracytoplasmic Oxidative Stress Reverses Epigenetic Modifications in Polycystic Ovary Syndrome. Reprod Fertil Dev 2017; 29(12): 2313-23.
63- Tian Y, Wong VW, Wong GL, Yang W, Sun H, Shen J, et al. Histone Deacetylase HDAC8 Promotes Insulin Resistance And Β-Catenin Activation in NAFLD-Associated Hepatocellular Carcinoma. Cancer Res 2015; 75(22): 4803-16.
64- Sinha N, Roy S, Huang B, Wang J, Padmanabhan V, Sen A. Developmental Programming: Prenatal Testosterone-Induced Epigenetic Modulation and its Effect on Gene Expression in Sheep Ovary. Biol Reprod 2020; 102(5): 1045-54.
65- Hosseini E, Shahhoseini M, Afsharian P, Karimian L, Ashrafi M, Mehraein F, et al. Role of Epigenetic Modifications in the Aberrant CYP19A1 Gene Expression in Polycystic Ovary Syndrome. Arch Med Sci 2019; 15(4): 887-95.
66- Rocha AL, Oliveira FR, Azevedo RC, Silva VA, Peres TM, Candido AL, et al. Recent Advances in the Understanding and Management of Polycystic Ovary Syndrome. F1000Res 2019; 8(F1000 Faculty Rev): 565.
67- Franik S, Eltrop SM, Kremer JA, Kiesel L, Farquhar C. Aromatase Inhibitors (Letrozole) for Subfertile Women with Polycystic Ovary Syndrome. Cochrane Database Syst Rev 2018; 5(5): Cd010287.
68- Guo X, Puttabyatappa M, Thompson RC, Padmanabhan V. Developmental Programming: Contribution of Epigenetic Enzymes to Antral Follicular Defects in the Sheep Model of PCOS. Endocrinology 2019; 160(10): 2471-84.
69- Leung KL, Sanchita S, Pham CT, Davis BA, Okhovat M, Ding X, et al. Dynamic Changes in Chromatin Accessibility, Altered Adipogenic Gene Expression, and Total Versus De Novo Fatty Acid Synthesis in Subcutaneous Adipose Stem Cells of Normal-Weight Polycystic Ovary Syndrome (PCOS) Women During Adipogenesis: Evidence of Cellular Programming. Clin Epigenetics 2020; 12(1): 181.
70- Bidkhori HR, Farshchian M, Heirani-Tabasi A, Naderi-Meshkin1 H, Dastpak M, Ahmadian Kia N, et al. Comparative Analysis of the Gene Expression Profile of Chemokine Receptors between Adipose-Derived and Bone Marrow-Derived Mesenchymal Stem Cells. Int J Pediatr 2014; 2(2.3): 17.
71- Matsuda S, Yasukawa T, Sakaguchi Y, Ichiyanagi K, Unoki M, Gotoh K, et al. Accurate Estimation of 5-Methylcytosine in Mammalian Mitochondrial DNA. Sci Rep 2018; 8(1): 5801.
72- Farge G, Falkenberg M. Organization of DNA in Mammalian Mitochondria. Int J Mol Sci 2019; 20(11): 2770.
73- Jia L, Zeng Y, Hu Y, Liu J, Yin C, Niu Y, et al. Homocysteine Impairs Porcine Oocyte Quality Via Deregulation of One-Carbon Metabolism and Hypermethylation of Mitochondrial DNA. Biol Reprod 2019; 100(4): 907-16.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







