دوره 30، شماره 7 - ( مهر 1401 )
جلد 30 شماره 7 صفحات 5076-5062 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bagherian M, Banaeifar A, Arshadi S, Azarbayjani M A. Effect of Training Intensity on HIF-1a Gene Expression and Cardiac TG Content in Rats with Non-Alcoholic Fatty Liver Disease. JSSU 2022; 30 (7) :5062-5076
URL: http://jssu.ssu.ac.ir/article-1-5674-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5674-fa.html
باقریان مهدی، بناییفر عبدالعلی، ارشدی سجاد، آذربایجانی محمدعلی. اثر شدت تمرین بر بیان ژن HIF-1aو محتوای تریگلیسیرید قلبی رتهای مبتلا به بیماری کبد چرب غیر الکلی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (7) :5062-5076
واژههای کلیدی: تمرین استقامتی کم شدت، تمرین اینتروال شدید، عامل قابل القا هیپوکسی – 1 آلفا، تریگلیسیرید، بافت قلبی
متن کامل [PDF 1043 kb]
(678 دریافت)
| چکیده (HTML) (2052 مشاهده)
متن کامل: (1473 مشاهده)
مقدمه
امروزه بیماری کبد چرب غیرالکلی (NAFLD)None alcoholic fatty liver disease به علت شیوع بالای آن به یک موضوع مهم بهداشتی تبدیل شده است (1). این بیماری اغلب با مقاومت به انسولین، دیابت نوع 2، چاقی و بیماریهای قلبی عروقی ارتباط دارد (2). همچنین مصرف بیش از حد مواد غذایی از اصلیترین علل تجمع لیپیدهای اضافی در هپاتوسیتهاست و براساس برآوردها بیش از 600 میلیون نفر در سراسر دنیا و 30 درصد جمعیت اروپا دچار اضافه وزن هستند که مستقیماً منجر به رشد و تجمع قطرات چربی و پیشرفت بیماری کبد چرب در آنها شده است (3). در چند سال گذشته شواهد معتبری ارتباط قوی بین NAFLD و افزایش خطر بیماریهای قلبی عروقی (CVD) Cardiovascular Disease را در افراد با یا بدون سندرم متابولیک اثبات کرده است (4). شواهد اپیدمیولوژیک و مطالعات بالینی نهتنها نشان میدهد که NAFLD ممکن است در توسعه و پیشرفت فنوتیپ قلبی عروقی شرکت کند، بلکه CVD با سطح غیر عادی از آسیبهای کبدی مرتبط است. مطالعات متعدد بهطور پیوسته یک ارتباط بین آنزیمهای غیرطبیعی کبد مانند آلانین آمینوترانسفراز (ALT) Alanine aminotransferase و افزایش بروز حوادث قلبی را گزارش کردهاند (6،5). مطالعات نشان داده است اکثر افرادیکه دچار چاقی، مقاومت به انسولین و دیابت هستند دارای هیپرتریگلیسریدمی و افزایش سطح چربی در پلاسما هستند. اسیدهای چرب وقتی وارد قلب میشوند یا برای تولید انرژی استفاده میشوند و یا میتوانند در قطرات چربی در قلب ذخیره شوند. لیپیدهای داخل میوکارد که بیش از ظرفیت ذخیره و اکسیداسیون قلب هستند، میتوانند موجب لیپوتوکسیک lipotoxicity شوندکه باعث کاردیومیوپاتی میشود که به آن کاردیومیوپاتی دیابتی Cardiomyopathy Diabetic میگویند. از ویژگیهای بالینی کاردیومیوپاتی دیابتی، هایپرتروفی قلب و اختلال عملکرد دیاستولیک است که منجر به نارسایی قلبی میشود. اگرچه پاتوژنز کاردیومیوپاتی چند عاملی است، اما دیسلیپیدمی دیابتی و تجمع چربی داخل میوکارد از ویژگیهای اصلی پاتولوژیک هستند که باعث ایجاد سیگنالینگ سلولی و اصلاح پروتئینها و لیپیدها از طریق تولید واسطههای متابولیکی سمی میشوند (7) که در این شرایط به دلیل عدم تعادل بین جذب و اکسیداسیون اسیدهای چرب، تجمع چربی در قلب افزایش مییابد (9،8). توان فیزیولوژیکی جذب چربی و اکسیداسیون چربی توسط قلب مانع از تجمع لیپیدهای اضافی میشود. چند فرایند از جمله: ایسکمی، چاقی، دیابت، سندرم متابولیک و اکثر موارد نارسایی قلبی، بر عملکرد قلب تاثیر میگذارد و میتواند منجر به تغییر اکسیداسیون اسید چرب و همچنین تجمع چربی شوند (10). شواهدی وجود دارد که نشان میدهد افزایش بسیاری از لیپیدها عملکرد قلبی را تغییر داده و منجر به آسیب ساختاری میوکارد، از جمله فیبروز قلب ، آپوپتوز میوسیت و کاهش انقباضات میشود که به نظر م رسد به علت اختلال عملکرد میتوکندری میباشد (10). HIF-1)) Hypoxia-inducible factor 1 یک تنظیم کننده مرکزی برای متابولیسم سلولی در شرایط هیپوکسی است که در هماهنگی با سطح (LD) Lipid droplets باعث تجمع چربی درون سلولی می شود (11) و نقش مهمی در پاسخ به تغییرات در دسترس بودن اکسیژن دارد و شامل دو زیر واحدb و a میباشد (12). HIF-1a تعداد و اندازه LD را افزایش میدهد (13) و چندین پروتئین مرتبط با LD را فعال میشود. علاوه بر این HIF-1a با حمایت از سنتز اسیدهای چرب از طریق متابولیسم گلوتامین (14)، کاهش بتا اکسیداسیون اسیدهای چرب (15) و افزایش سنتز چربی خنثی وابسته به لیپین -1 و تشکیل سنتز قطرات چربی در متابولیسم چربی دخیل است (16). شواهدی وجود دارد که HIF-1a از قلب در برابر ایسکمی حاد از طریق بیان ژنها و متابولیسم گلوکز که برای زمانهای متابولیک بیهوازی ضروری هستند، محافظت میکند (17). همچنین مشاهده شده است برخی خصوصیات HIF-1a در موشهای جوان با پیشرفت نارسایی قلبی همراه بود. مسیرهای HIF-1a ممکن است در ابتدا سودمند باشند با اینحال اگر بهصورت پایدار باشد ممکن است بهطور جدی به نارسایی قلب کمک کند (17) و موجب تجمع تریآسیلگلیسرول در کاردیومیوسیتها شود (18). بیان بیش از حد شکل فعال HIF-1α در کاردیومیوسیتها باعث تجمع چربی درون سلولی تحت نورموکسی میشود (19). تجمع چربی یکی از ویژگیهای مشترک بیماری کبد چرب است. در واقع، بیان HIF-1a در بیماریهای کبد چرب افزایش مییابد (20). دستفانو و همکاران (2015) در پژوهشی به بررسی نقش (HIG2) Hypoxia- Inducible Protein 2 (ژن هدف HIF-1a) در افزایش رسوب تریگلیسیرید کبدی از طریق مهار لیپولیز پرداختند. نتایج این تحقیق نشان داد که بیان پروتئین HIG2 بر روی LDs کبد موشهایی که تحت یک رژیم پر چرب قرار گرفته بودند افزایش یافته و منجر به افزایش رسوب TG در LDs کبد آنها شده است. این در حالی است که کاهش میزان بیان پروتئین HIG2 با استفاده از پیش برنده یوبیکوئیتین، منجر به کاهش محتوا و اندازه TG در کبد موشها شد. این محققان در جمعبندی پژوهش خود اذعان کردند که کاهش محتوای پروتئین HIG2 کبدی منجر به افزایش لیپولیز TG، نوسازی و اکسیداسیون اسید چرب و همچنین بهبود تحمل گلوکز در قیاس با گروه کنترل شده است (21). برخی مطالعات نشان داده اندکه فعالیتهای ورزشی مختلف با توجه به شدت و نوع فعالیت میتواند بر میزان بیان ژن HIF-1a و فاکتورهای موثر در ایجاد هیپوکسی و همچنین محتوای TG بدن تاثیر گذار باشد. مونیر و همکاران (2009) در بررسی اجرای 3 هفته تمرین متناوب تحت شرایط هیپوکسی، کاهش معنادار در بیان ژن HIF-1a در سطح mRNA عضلات اسکلتی دوندگان مرد نخبه را گزارش کردند (22). هالسورت و همکاران (2015) در پژوهشی به بررسی تاثیر نوعی تمرین HIIT بر کاهش چربی کبدی و بهبود عملکرد قلبی در افراد دارای NAFLD پرداختند. این محققان از 23 بیمار NAFLD با بیش از 5% چربی درون کبدی استفاده کردند. پروتکل تمرین شامل سه جلسه 40-30 دقیقهای بود که به مدت 12هفته انجام شد. نتایج نشان داد که تمرینات HIITباعث کاهش چربی کبدی و توده چربی (از 7 ±35به 8 ±33کیلوگرم) آلانین (29±52 به 20± 42 واحد در هر لیتر) و آسپارتاتآمینوترانسفراز AST (18±36 به 15± 33واحد در هر لیتر) و همچنین افزایش پر شدن دیاستولی (84 ±244 به 107 ± 302 میلیلیتر) شده است. این درحالی بود که میزان گلوکز در بین دو گروه تفاوت معناداری نداشت (23). موتا (2016) در پژوهشی به بررسی تاثیر تمرینات HIIT بر روی بهبود متابولیسم و شرایط بیماریزای مزمن موشهای چاق پرداخت. نتایج نشان داد تمرینات HIITمنجر به کاهش قابلتوجهی در توده بدن، قند خون، تحمل گلوکز و پروفایل لیپیدی گردید. همچنین این نوع تمرینات منجر به کاهش سطح پلاسمایی سیتوکین های التهابی، بهبود حساسیت به انسولین، کاهش چربی احشایی و استئاتوز کبدی گردید (24). با توجه به افزایش شیوع بیماری کبد چرب و ارتباط آن با بسیاری از بیماریها از جمله بیماریهای قلبی و عروقی و تایید اثرات مفید تمرینات ورزش بر کاهش عوامل خطر زا در این بیماریها، خلأ پژوهشی که در آن به تاثیر تمرینات ورزشی بر میزان HIF-1a و محتوای TG بافت قلب موشهای مبتلا به کبد چرب غیر الکلی و ماهیتهای مختلف ورزشی و مشخصاً مدت و شدتهای گوناگون ورزش در بروز این پاسخهای سازشی بپردازد احساس میشود. چرا که تمرین استقامتی کم شدت Low Intensity Endurance Training (LIET) و تمرین شدید اینتروال (HIIT) به لحاظ استفاده از سوبسترها و مواد سوختی، متابولیتهای تولیدی، مکانیسمهای ایجاد خستگی، ریکاوری و بسیاری از سازگاریهای سلولی- ملکولی متفاوت هستند. به همین دلیل این مطالعه به دنبال این است که تاثیر تمرین استقامتی کم شدت (LIET) و تمرین اینتروال شدید (HIIT) بر میزان بیان ژن HIF-1a و محتوای TG عضله قلب موشهای مبتلا به کبد چرب غیر الکلی را بررسی نماید.
روش بررسی
این پژوهش تجربی بر روی40 سر رت نر نژاد ویستار با سن 5 هفته و وزن 24/6±155/4 گرم که از موسسه رویان اصفهان خریداری شدند، انجام شد و براساس اصول نگهداری حیوانات آزمایشگاهی و دسترسی آسان به آب و غذا (تعداد 5 رت در هر قفس) و شرایط یکسان چرخه روشنایی و تاریکی 12:12 ساعت با میانگین دمای 20 تا 23 درجه سانتیگراد و رطوبت 50 درصد نگهداری شدند (25). پس از گذشت یک هفته آشنایی رتها با محیط، رتها بهطور تصادفی به گروه تجربی (n=30) با رژیم غذایی پر چرب شامل 60 درصد چربی (90 درصد چربی فرآوری شده حیوانی و 10 درصد روغن دانه سویا، 20 درصد کربوهیدرات و 20 درصد پروتئین) و گروه شم (n=10) با رژیمغذایی شامل: 20 درصد چربی ،70 درصد کربوهیدرات و 10 درصد پروتئین تقسیم شدند (25). پس از گذشت 16 هفته مصرف غذای پرچرب توسط رتهای گروه تجربی، نمونه خونی از انتهای دم آنها گرفته شد و بلافاصله به لولههای محتوی ماده ضد انعقاد EDTA منتقل گردید و در دستگاه سانتریفیوژ قرار گرفت تا پلاسمای مورد نیاز قابلیت تفکیک پیدا کند. سپس تا زمان سنجش آنزیم در دمای 20- درجه به صورت منجمد نگهداری شد. برای سنجش میزان پلاسمایی (ALT) Alanine Transaminase از روش الیزا و کیتهای ساخت شرکت پارس آزمون (ساخت ایران) استفاده شد. بررسی میزان سرمی آنزیمALT به عنوان یکی از نشانگان اصلی بروز کبد چرب، مشخص کرد غذای چرب به خوبی توانسته است بیماری NAFLD را در گروه تجربی القاء نماید. سپس کلیه رتهای گروه تجربی بهطور تصادفی به سه گروه 10 تایی شامل یک گروه کنترل و دو گروه تمرینی (HIIT و LIET) تقسیم شدند و همچنان غذای پر چرب مصرف میکردند. گروه شم در کل پژوهش غذای استاندارد مصرف کردند و همانند گروه کنترل در هیچ برنامه تمرینی شرکت نکردند (25) گروههای تجربی (HIIT و LIET) در پروتکلهای تمرینی ویژه خود به مدت 8 هفته (5 روز هفته) شرکت کردند. قبل از شروع پروتکل تمرین، حیوانات به مدت یک هفته، روزانه 10 تا 15 دقیقه بـا سرعت 10 متر بـر دقیقه برای آشناسازی و تطبیق بر روی تردمیل تمرین کردند (26). جهت تعیین حداکثر سرعت رتها از آزمون 10 مرحلهای استفاده شد. سرعت در مرحله اول 0/3 کیلومتر بر ساعت (5 متر در دقیقه) و در مراحل بعدی، در هر 3 دقیقه 0/3 کیلومتر بر ساعت به سرعت نوار گردان اضافه میشد و سرعتی که در آخرین مرحله، حیوان علیرغم شوک الکتریکی قادر به دویدن نبود به¬عنوان حداکثر سرعت دویدن حیوان ثبت گردید (27). سپس بهجهت نزدیکی سرعت بیشینه گروهها و همچنین محدودیت اجرای پژوهش، میانگین حداکثر سرعت برای کل گروهها در نظر گرفته شد (28). هر دو پروتکل تمرین شامل سه قسمت گرم کردن و سرد کردن (5 دقیقه با 30 درصد سرعت بیشینه ) و تمرین اصلی بود.
پروتکلهای تمرینی: پروتکل تمرینHIIT مجموعهای منظم از تمرینات شدید و کم شدت بود که به ترتیب شامل دو دقیقه دویدن با شدت 75 درصد سرعت بیشینه در هفته اول، 80 درصد سرعت بیشینه در هفته دوم، 85 درصد سرعت بیشینه در هفته سوم و90 درصد سرعت بیشینه در هفته چهارم تا پایان تمرین بود. دفعات استراحت فعال شامل دو دقیقه با شدت 30 درصد سرعت بیشینه از هفته اول تا پایان هفته سوم و 20 درصد از ابتدای هفته چهارم تا انتهای دوره تمرینات بود. در انتهای هر جلسه و پس از آخرین فعالیت شدید، رتها به جای تمرین در شدت پایین، به مدت پنج دقیقه با شدت 30 درصد سرعت بیشینه به سرد کردن میپرداختند. تعداد تکرارها به گونهای تنظیم شد که در هفته اول 2 مرتبه تکرار ؛ هفته دوم 4 مرتبه؛ هفته سوم 6 مرتبه و از هفته چهارم تا پایان 8 مرتبه فعالیت با شدت بالا تکرار شد (جدول 1). پروتکل تمرینی LIET نیز مطابق با مسافت طی شده در گروه HIIT در هر هفته بود که این مسافت را با 45 درصد حداکثر سرعت بیشینه می دویدند. بنابراین گروه LIET در هر جلسه با سرعت ثابت 18 متر در دقیقه میدویدند که در هفته اول 18دقیقه، هفته دوم 30، هفته سوم 36 و از هفته چهارم به بعد 45 دقیقه این مسافت را طی میکردند (جدول 1).
نمونهگیری بافت: 24 ساعت پس از اتمام آخرین جلسه تمرین و پس از 16 ساعت ناشتایی (29)، کلیه حیوانات با تزریق سدیم پنتوباربیتال (40 میلیگرم بر کیلوگرم) بیهوش شدند (30) و پس از استخراج قلب و شستشوی آن با سالین، بافت مربوطه به میکروتیوپ منتقل و علامتگذاری شد و بلافاصله در نیتروژن مایع منجمد شد و تا زمان انجام مراحل آزمایشگاهی در دمای 80- درجه سانتیگراد نگهداری شد (30). به منظور استخراج RNA، ازکیت استخراج ایرایزول RNA، ساخت شرکت زیست فنآوران رنا (کد دسترسی RB1001) استفاده شد. ابتدا میزان 100-50 میلیگرم از بافت فریز شده قلب به حاون استریل منتقل و به همراه 1 میلیلیتر بافر برای ایجاد بافتی همگن کوبیده شد. سپس این محلول به میکروتیوب منتقل شد و 200 میکرو لیتر کلروفرم به آن اضافه گردید و به مدت 15- 10 ثانیه تکان داده و پس از آن به مدت 5 دقیقه برای تفکیک لایه رویی که حاوی RNA بود ثابت نگه داشته شد. سپس این مایع با 1000 میکرولیتر اتانول 100 درصد سرد مخلوط و به مدت 8 دقیقه در داخل فریزر 20- قرار داده شد. سپس تیوپ سانتریفیوژ شد و مایع باقیمانده حذف شد و اتانول 80 درصد به لکههای سفید رنگ باقیمانده در بدنه و کف تیوب اضافه شد و مجددا سانتریفیوژ تکرار شد و پس از خارج کردن اتانول و خشک کردن محتوای داخل تیوپ (در این مرحله روش air-dry مورداستفاده قرار گرفت) 20 تا50 میکرولیتر آب دو بار تقطیر شده، متناسب با میزان رسوب به آن اضافه و با پیپت RNA داخل تیوپ حل شد. سپس 5 ماکرو لیتر از آن به منظور تائید کیفیت بر روی ژل آگارز 1 درصد ران شد تا پس از تائید، از آن در سنتز cDNA استفاده گردد. سنتز cDNA با استفاده از کیت سنتز cDNA (RB) زیست فناوران رنا و مطابق دستورات این شرکت انجام گرفت (جدول2)(31). تعیین بیان mRNA از طریق روش واکنش زنجیرهای پلی مراز Real-time RT-PCR انجام شد و برای کسب شرایط دمای بهینه برای تکثیر، ژن (TBP) Telomere Binding Protein بهعنوان کنترل سنتز cDNA در واکنش زنجیرهای پلیمراز و طبق پیشنهاد شرکت سازنده پرایمر در شرکت زیست فناوران رنا استفاده گردید (31). توالی پرایمرها برای ژن HIF-1a وTBP درجدول 3 ارائه شده است. برای استخراج TG بافت قلب، ابتدا با استفاده از ترازوی دیجیتال، معادل 5/0 گرم (mg500) از بافت قلب جدا شد و در داخل میکروتیوپ قرار گرفت. سپس معادل 1 میلیلیتر ایزوپروپانول به هر میکروتیوپ اضافه شد و با استفاده از سواپ پلاستیکی، بافت قلب داخل میکروتیوپ را فشرده و تا قطعه قطعه کردن و متلاشی شدن کامل بافت جهت تسهیل هموژیناسیون این کار ادامه پیدا کرد. در ادامه، میکروتیوپها برای جداسازی بافتها به مدت 1 دقیقه به وسیله دستگاه هموژانایزر و با قدرت Hz 5000 هموژنیزه شد (HETYCH، مدل UP1000H). پس از آن میکروتیوپها به مدت 5 دقیقه و با دور 4000 سانتریفیوژ شدند تا لایه رویی آن قابل تفکیک شود. در نهایت این لایه برای سنجش TG بر روی دستگاه اتو آنالیزور مورد استفاده قرار گرفت (مدل BT3000)(32).
تجزیه و تحلیل آماری
دادههای جمع آوری شده با استفاده از نرمافزارversion 16 SPSS و آزمون تحلیل واریانس یک راهه و آزمون تعقیبی شفه تجزیه و تحلیل شدند (P<0/05).
ملاحظات اخلاقی
این پژوهش در کمیته اخلاق تحقیقاتی علوم ورزشی و بر اساس انطباق با استاندارهای اخلاق در تحقیقات وزارت علوم با کد IR.SSRI.REC.1397.331 تایید شده است.
جدول 1 : پروتکل تمرینی HIIT و LEIT

جدول 2 : مراحل ساخت cDNA
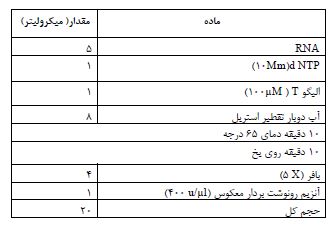
جدول 3: توالی پرایمرها برای ژن HIF-1a و TBP

نتایج
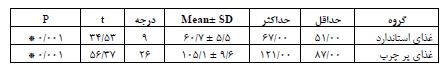
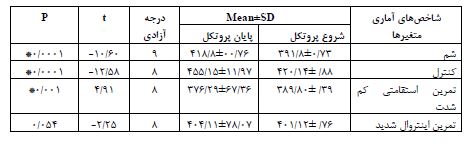
نتایج مقایسه آنزیم ALT: جهت اطمینان از القاء بیماری کبد چرب غیر الکلی در رتهایی که 16 هفته غذای پرچرب استفاده کردند، میزان سرمی آنزیم ALT رتها سنجیده شد و به تفکیک دو گروه غذایی مختلف ارائه شد (جدول 4). تحلیل نتایج نشان داد تفاوت معنیداری در بیان ژن HIF-1a بین گروه کنترل و گروه HIIT (P= 0/001) و گروه کنترل و گروه LIET (P= 0/009) و گروه کنترل و گروه شم (P= 0/0001) وجود دارد، اما تفاوت معنیداری در بیان ژن HIF-1a بین گروه HIIT و(P= 0/873) LIET و گروه شم و(P= 0/919) HIIT و گروه شم و(P= 0/483) LIET مشاهده نشد (نمودار 1). همچنین تحلیل آماری دادهها نشان داد تفاوت معنیداری در میزان محتوای TG بافت قلب بین گروههای مختلف این پژوهش وجود دارد. بر این اساس، تفاوت معنیداری در میزان محتوای TG بافت قلب بین گروه کنترل و گروه HIIT، گروه کنترل و گروه LIET، گروه کنترل و گروه شم، گروه HIITو گروه شم و گروه LIETو گروه شم مشاهده شد (0/0001=P). این در حالی است که تفاوت معنی داری در میزان محتوای TG بافت قلب بین گروه تمرین HIIT و LIET مشاهده نشد(P= 0/066) (نمودار 2). همچنین، بررسیها نشان داد که تفاوت معنیداری در میزان وزن رتهای گروههای مختلف وجود دارد(P= 0/0001) . با توجه به بررسی نتایج جدول (5) مشاهده گردید که بین دو گروه تجربی تمرینی، تنها میانگین وزن رتهای گروه تمرین استقامت کم شدت کاهش معنیداری یافته است (P= 0/0001) در حالیکه این میانگین در گروه تمرین تناوبی شدید تغییر معنیداری نداشته است.(P= 0/005) . همچنین میانگین وزن گروه کنترل و شم در طی این دوره افزایش معنیداری پیدا کرد (P= 0/0001).
جدول 4 نتایج آزمونT جهت مقایسه سطح سرمی آنزیم (U/liter) ALT در دو گروه غذایی مختلف
* نشانه معناداری نسبت به قبل از تمرین (0/05>P)

نمودار 1 تغییرات میانگین بیان ژن HIF-1α بافت قلب موشهای صحرایی نر مبتلا به بیماری کبد چرب غیر الکلی در گروههای مختلف

نمودار 2: تغییرات میانگین میزان TGبافت قلب موشهای صحرایی نر مبتلا به بیماری کبد چرب غیر الکلی در گروههای مختلف
جدول 5: مقایسه وزن رتها قبل و بعد از پروتکلهای تمرینی
*نشانه معناداری نسبت به قبل از تمرین (0/05>P)
بحث
نتایج به دست آمده از پژوهش حاضر نشان داد هشت هفته تمرینHIIT و LIET همراه با رژیم غذایی پرچرب تغییر معنیداری بربیان ژن HIF-1α بافت قلبی موشهای مبتلا به NAFLD داشته است. اگرچه تاکنون پژوهشی به بررسی تأثیر تمرین بر HIF-1a و محتوای TGبافت قلبی نپرداخته است، ولی پیش از این، تأثیر نهایی این ژن در متابولیسم چربی و بـه طور مشخص در کاهش میزان لیپولیز LDsمشخص شده است (33). متابولیسم سلولی بهطور چشمگیری در پاسخ به هیپوکسی با تاثیر بر گلیکولیز بیهوازی تغییر میکند که این امر تا حدی مربوط به افزایش رونویسی HIF-1a و ژنهای گلیکولیکی میباشد (34). برخی مطالعات نیز نشان دادهاند که هیپوکسی باعث کاهش بیان PPARa)) peroxisome-proliferator-activated receptor-α میوکاردیال، اکسیداسیون اسیدهای چرب و (UCP3) uncoupling protein 3 میتوکندری و افزایش متابولیسم کربوهیدرات میشود (35). هیپوکسی همچنین باعث افزایش قابلتوجه تجمع LD میشود و با توجه به تأثیر آن بر بیان لیپین 1،HIF-1α تأثیر قویتری بر محتوای LD نسبت به HIF-2α اعمال میکند. بنابراین، فعالسازی HIF-1a و تا حدی کمتر، فعالسازی HIF-2a برای تحریک تولید لیپین 1 و LD حتی در شرایط نرموکسیک کافی است (36). در واقع افزایش بیان عوامل القاء هیپوکسی (HIFs) همزمان باعث تنظیم مثبت بیان ژنهای مؤثر در سنتز اسید چرب ( Crot)) Carnitine O-Octanoyltransferase، (Cpt1) carnitine palmitoyltransferase-1 و Acsl1)) Acyl-CoA Synthetase Long Chain Family Member 1) و کاهش بیان ژنهـای درگیـر در بتااکسیداسیون میشود (Cpt-1a، Cpt 2، (Acox1) Acyl-CoA Oxidase 1 و (peroxisome-proliferator-activated receptor ( Ppar) (37). از اینرو HIFs از طریق تنظیم مثبت بیان پروتئینهای مرتبط با LD باعث افزایش شکلگیری LD میشود (38). به طوریکه افزایش HIFs در حیوانات منجر به افزایش 4 برابری ذخایر TG بدون تغییر در ژنهای درگیر در نوسازی لیپوژنز، بتااکسیداسیون و لیپولیز شده است (39). در بررسی نوع تمرین و ایجاد هیپوکسی نشان داده شده است که تمرینات استقامتی، سطح HIF-1a را کاهش می دهد در حالیکه افزایش ناگهانی شدت تمرین در مدت کم سطح HIF-1a را بالا میبرد(40). رودریگز و همکاران (2015) در تحقیقی که بر روی 24 موش انجام دادند نشان دادند 8 هفته تمرینات ورزشی برونگرا باعث افزایش بیان HIF-1a و واسطههای (VEGF) Vascular endothelial growth factor و (eNOS)Endothelial Nitric Oxide Synthase در عضلات اسکلتی گردید(41). فلورا (2012) در تحقیق خود به مطالعه تاثیر تمرینات هوازی و بیهوازی با استفاده از تردمیل بر روی HIF-1a و VEGF بافت قلب پرداخت. نتایج نشان داد که هر دو نوع تمرین هوازی و بیهوازی باعث افزایش HIF-1a و VEGF گردید(42). مونیر و همکاران (2009) در بررسی اجرای 3 هفته تمرین تحت شرایط هایپوکسی، کاهش معنادار در بیان ژن HIF-1a در سطح mRNA عضلات اسکلتی دوندگان مرد نخبه گزارش کردند (22). بر اساس نتایج برخی تحقیقات مبنی بر تفاوت بیان HIF-1a در پی شرکت در تمرینهای تناوبی شـدید و تمرینهای استقامتی در حالت پایدار، تاکنون تناقضات زیادی ارایه شده است .بـه نظر میرسد مهمترین دلایل این تناقضات به عوامل متعددی چون وضعیت سلامتی و سطح آمادگی قبلی آزمودنیها، شدت و مدت تمرین، آمادگی جسمانی شرکتکنندگان، وراثت و جنسیت مرتبط باشد (43). نتایج پژوهش حاضر نشان داد، که در مقایسه پروتکلهای تمرینی استقامتی کم شدت و تناوبی شدید تفاوت معنیداری در مقادیر HIF-1aمشاهده نشد، که این میتواند به دلیل استفاده از رژیم غذایی پرچرب در زمان تمرین در مقایسه با سایر پژوهشها که از رژیم غذایی کمچرب استفاده کرده بودند، باشد (44). همچنین نتایج این پـژوهش نشان داد هم تمرینهای استقامتی کم شدت و هم تمرینهای شدید تناوبی باعث کاهش معنی دار محتوای چربی بافت قلبی میشود .بنابراین کاهش هماهنگ میزان بیـان ژن HIF-1a وTG در پی استفاده از پروتکل های تمرینی مختلف، میتواند معرف نقش و ارتباط پروتئینHIF-1a در تنظیم متابولیسم چربی در بافت قلبی به دنبال تمرین ورزشی باشد. در این پژوهش میزان افزایش بیان ژن HIF-1a در گروه کنترل با میزان افزایشTG در آن هماهنگ شده است. همچنین نتایج نشان داد کاهش میزانTG در گروه پروتکل تمرینی HIIT مستقل از کاهش وزن بود. اگرچـه بسیاری فواید سودمند فعالیت طولانی مدت ورزشی در شـدت کم تا متوسط را به کـاهش وزن مـرتبط میدانسـتند، عموماً تأثیرات مفید تمرینهای شدید مستقل از کاهش وزن رخ میدهد (45). به طوریکه حتی یک مرتبه فعالیت ورزشی شدید نیز میتواند بـا ایجاد تغییرات مثبت در مسیرهای متابولیکی، سمزدایی و جلوگیری از تجمع چربی تا حدی از شرایط نامطلوب حاصل از رژیم پر چرب بکاهد (46). در رابطه با این یافتهها، نتایج پژوهش تراپ و همکاران (2008) نیز نشان داد که علیرغم کاهش معنیدار بیان ژن HIG2 و محتوایTG در گروههای مختلف تمرینی با شدت بالا، تغییرات کاهش وزن قابل قبولی در این زمینه مشاهده نگردید (47). همچنین در پژوهش هوگتون و همکاران (2017) که در ارتباط با اثر ورزش و بیماری NAFLD انجام شد، نتایج نشان داد که 12 هفته تمرین درمانی باعث کاهش 16 درصدی TG هپاتوسیتها مستقل از کاهش وزن بیماران گردید (48). همچنین برخی پژوهشها نشان دادهاند که کاهش TG میتواند ناشی از کاهش پروتئین انتقال دهنده تریگلسیرید میکروزومی (MTP) Microsomal triglyceride transfer protein باشد. MTP نقش اساسی و مرکزی در تنظیم ترشحTG و VLDL بازی میکند (49). نتایج حاصل از پژوهش حاضر نشان داد که پس از 8 هفته در گروههای شم و کنترل تغییرات افزایش وزن معنیداری مشاهده شد. همچنین در گروه تمرینی استقامتی کم شدت تغییرات کاهش وزن معنیدار بود، که می تواند بیانگر فعالشدن مسیر لیپولیزی و افزایش بتا اکسیداسیون لیپیدها باشد (44). ولی در گروه تمرینات تناوبی شدید تغییرات وزن معنیدار نشد. دلیل این امر میتواند این باشد که با انجام تمرینات شدید نسبت با تمرینات کم شدت استقامتی، ترشح هورمونهای سمپاتیکی باعث فعالشدن مسیر گلیگولیز بیهوازی شده و مسیر لیپولیزی را بلوکه کرده است (44). در این رابطه در پژوهشی که بودو و همکارانش (2003) به برسی تأثیر تمریناتHIIT بر روی مردان دیابتی نوع 2 پرداختند، دریافتند که پس از 8 هفته تمریناتHIIT هیچ تغییری در وزن افراد رخ نداده است؛ بااینحال، به میزان 44 درصد کاهش بافت چربی احشایی و توده بدنی بیشتر شرکتکنندگان بعد ازHIIT را نشان دادند (50). مارسینکو و همکاران (2015) به بررسی تأثیر تمرینات اینتروال شدید بر بهبود حساسیت انسولینی بافت کبد و چربی پرداخته است. در این پژوهش اثر 6 هفته تمرینات HIIT بر موشهای چاق مورد بررسی قرار گرفت. نتایج نشان داد که مصرف همزمان غذای پرچرب و تمرینات HIIT، علی رغم افزایش مصرف غذا، باعث کاهش میزان گلوکز خون و TG، افزایش حساسیت انسولینی و همچنین افزایش میزان اکسیداسیون کربوهیدراتها میشود. نکته قابلتوجه آن بود که کلیه تغییرات ذکر شده مستقل از تغییرات وزن موشها رخ داد. به نظر میرسد اینگونه تمرینات باعث افزایش فسفوریلاسیون و مهار آنزیم استیلکوآکربوکسیلاز (ACC) Acetyl-CoA carboxylase توسط فعالیت پروتئینکیناز وابسته به AMP (AMPK) AMP-activated protein kinase در عضلات اسکلتی، بافت چربی و کبد میشود. بنابراین مهار ACC باعث تغییر در تنظیم متابولیسم اسید چرب محتوای کبدی، التهاب بافت چربی و مقاومت انسولینی میشود. با اینحال، این محققان اعلام کردند که همچنان مکانیسمهای تاثیر تمرینات HIIT بر این مسیرها به خوبی شناسایی نشدهاند (51). کاهش TG درون قلبی گروه تمرینی را میتوان با مصرف اکسیژن اضافه پس از تمرینات با شدت بالا که درپی رهایش بیشتر کاتکولامینها و در نتیجه افزایش بیشتر فرایندهای دفع لاکتات در آنها رخ میدهد، مرتبط دانست که باعث میشود هزینه انرژی مصرفی تا ساعتها پس از تمرین همچنان زیاد باشد (52) .از طرفی، شواهد نشان میدهند که استفاده از تمرینهایHIIT باعث تغییر در نوع تار و هیپرتروفی بیشتر تارهای نوع دو و نیز افزایش بیان (GLUT4) Glucose transporter 4 در این گونه تارها میشود که به بروز سازگاریهای مثبت و کاهش TG در آنها به طور مستقل از تغییر در وزن بدن منجر می شود (53).
نتیجهگیری
در کل نتایج این پژوهش نشان داد که هشت هفته تمرین استقامتی کم شدت و تمرین تناوبی شدید حتی به همراه مصرف غذای پر چرب در رتهای دارای بیماری کبد چرب غیر الکلی باعث کاهش بیان ژن HIF-1a بهعنوان یکی از اصلیترین ژنهای محدودکننده لیپولیز مرتبط با قطرات چربی میشود و از این طریق باعث کاهش محتوای تری گلیسیرید بافت قلبی در هر دو گروه شده است. بر این اساس، کاهش میزان تری گلیسیرید بافت قلبی در رتهای مبتلاء به بیماری کبد چرب غیر الکلی به خوبی نقش تمرینهای ورزشی را نمایان میسـازد. اگرچه مکانیسـم های احتمالی درگیر در ایـن مسیرها تا حدودی متفاوت اسـت. لذا تغییر سبک زنـدگی بـا هدف افزایش هزینه انرژی به تنهایی و بـدون استفاده از مداخلات دارویی قادر به کاهش ذخایر چربی درون سلولی بافت قلبی میشود .
سپاسگزاری
مقاله حاضر مستخرج از رساله دکترای مصوب گروه فیزیولوژی ورزشی دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد اسلامی واحد تهران جنوب میباشد، لذا بدینوسیله از مسئولین و اساتید محترم دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد اسلامی واحد تهران جنوب و همچنین از همکاری پرسنل پژوهشکده زیست فناوری رویان اصفهان که زمینه انجام تحقیق حاضر را فراهم نمودند، تشکر و قدردانی مینماید.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
امروزه بیماری کبد چرب غیرالکلی (NAFLD)None alcoholic fatty liver disease به علت شیوع بالای آن به یک موضوع مهم بهداشتی تبدیل شده است (1). این بیماری اغلب با مقاومت به انسولین، دیابت نوع 2، چاقی و بیماریهای قلبی عروقی ارتباط دارد (2). همچنین مصرف بیش از حد مواد غذایی از اصلیترین علل تجمع لیپیدهای اضافی در هپاتوسیتهاست و براساس برآوردها بیش از 600 میلیون نفر در سراسر دنیا و 30 درصد جمعیت اروپا دچار اضافه وزن هستند که مستقیماً منجر به رشد و تجمع قطرات چربی و پیشرفت بیماری کبد چرب در آنها شده است (3). در چند سال گذشته شواهد معتبری ارتباط قوی بین NAFLD و افزایش خطر بیماریهای قلبی عروقی (CVD) Cardiovascular Disease را در افراد با یا بدون سندرم متابولیک اثبات کرده است (4). شواهد اپیدمیولوژیک و مطالعات بالینی نهتنها نشان میدهد که NAFLD ممکن است در توسعه و پیشرفت فنوتیپ قلبی عروقی شرکت کند، بلکه CVD با سطح غیر عادی از آسیبهای کبدی مرتبط است. مطالعات متعدد بهطور پیوسته یک ارتباط بین آنزیمهای غیرطبیعی کبد مانند آلانین آمینوترانسفراز (ALT) Alanine aminotransferase و افزایش بروز حوادث قلبی را گزارش کردهاند (6،5). مطالعات نشان داده است اکثر افرادیکه دچار چاقی، مقاومت به انسولین و دیابت هستند دارای هیپرتریگلیسریدمی و افزایش سطح چربی در پلاسما هستند. اسیدهای چرب وقتی وارد قلب میشوند یا برای تولید انرژی استفاده میشوند و یا میتوانند در قطرات چربی در قلب ذخیره شوند. لیپیدهای داخل میوکارد که بیش از ظرفیت ذخیره و اکسیداسیون قلب هستند، میتوانند موجب لیپوتوکسیک lipotoxicity شوندکه باعث کاردیومیوپاتی میشود که به آن کاردیومیوپاتی دیابتی Cardiomyopathy Diabetic میگویند. از ویژگیهای بالینی کاردیومیوپاتی دیابتی، هایپرتروفی قلب و اختلال عملکرد دیاستولیک است که منجر به نارسایی قلبی میشود. اگرچه پاتوژنز کاردیومیوپاتی چند عاملی است، اما دیسلیپیدمی دیابتی و تجمع چربی داخل میوکارد از ویژگیهای اصلی پاتولوژیک هستند که باعث ایجاد سیگنالینگ سلولی و اصلاح پروتئینها و لیپیدها از طریق تولید واسطههای متابولیکی سمی میشوند (7) که در این شرایط به دلیل عدم تعادل بین جذب و اکسیداسیون اسیدهای چرب، تجمع چربی در قلب افزایش مییابد (9،8). توان فیزیولوژیکی جذب چربی و اکسیداسیون چربی توسط قلب مانع از تجمع لیپیدهای اضافی میشود. چند فرایند از جمله: ایسکمی، چاقی، دیابت، سندرم متابولیک و اکثر موارد نارسایی قلبی، بر عملکرد قلب تاثیر میگذارد و میتواند منجر به تغییر اکسیداسیون اسید چرب و همچنین تجمع چربی شوند (10). شواهدی وجود دارد که نشان میدهد افزایش بسیاری از لیپیدها عملکرد قلبی را تغییر داده و منجر به آسیب ساختاری میوکارد، از جمله فیبروز قلب ، آپوپتوز میوسیت و کاهش انقباضات میشود که به نظر م رسد به علت اختلال عملکرد میتوکندری میباشد (10). HIF-1)) Hypoxia-inducible factor 1 یک تنظیم کننده مرکزی برای متابولیسم سلولی در شرایط هیپوکسی است که در هماهنگی با سطح (LD) Lipid droplets باعث تجمع چربی درون سلولی می شود (11) و نقش مهمی در پاسخ به تغییرات در دسترس بودن اکسیژن دارد و شامل دو زیر واحدb و a میباشد (12). HIF-1a تعداد و اندازه LD را افزایش میدهد (13) و چندین پروتئین مرتبط با LD را فعال میشود. علاوه بر این HIF-1a با حمایت از سنتز اسیدهای چرب از طریق متابولیسم گلوتامین (14)، کاهش بتا اکسیداسیون اسیدهای چرب (15) و افزایش سنتز چربی خنثی وابسته به لیپین -1 و تشکیل سنتز قطرات چربی در متابولیسم چربی دخیل است (16). شواهدی وجود دارد که HIF-1a از قلب در برابر ایسکمی حاد از طریق بیان ژنها و متابولیسم گلوکز که برای زمانهای متابولیک بیهوازی ضروری هستند، محافظت میکند (17). همچنین مشاهده شده است برخی خصوصیات HIF-1a در موشهای جوان با پیشرفت نارسایی قلبی همراه بود. مسیرهای HIF-1a ممکن است در ابتدا سودمند باشند با اینحال اگر بهصورت پایدار باشد ممکن است بهطور جدی به نارسایی قلب کمک کند (17) و موجب تجمع تریآسیلگلیسرول در کاردیومیوسیتها شود (18). بیان بیش از حد شکل فعال HIF-1α در کاردیومیوسیتها باعث تجمع چربی درون سلولی تحت نورموکسی میشود (19). تجمع چربی یکی از ویژگیهای مشترک بیماری کبد چرب است. در واقع، بیان HIF-1a در بیماریهای کبد چرب افزایش مییابد (20). دستفانو و همکاران (2015) در پژوهشی به بررسی نقش (HIG2) Hypoxia- Inducible Protein 2 (ژن هدف HIF-1a) در افزایش رسوب تریگلیسیرید کبدی از طریق مهار لیپولیز پرداختند. نتایج این تحقیق نشان داد که بیان پروتئین HIG2 بر روی LDs کبد موشهایی که تحت یک رژیم پر چرب قرار گرفته بودند افزایش یافته و منجر به افزایش رسوب TG در LDs کبد آنها شده است. این در حالی است که کاهش میزان بیان پروتئین HIG2 با استفاده از پیش برنده یوبیکوئیتین، منجر به کاهش محتوا و اندازه TG در کبد موشها شد. این محققان در جمعبندی پژوهش خود اذعان کردند که کاهش محتوای پروتئین HIG2 کبدی منجر به افزایش لیپولیز TG، نوسازی و اکسیداسیون اسید چرب و همچنین بهبود تحمل گلوکز در قیاس با گروه کنترل شده است (21). برخی مطالعات نشان داده اندکه فعالیتهای ورزشی مختلف با توجه به شدت و نوع فعالیت میتواند بر میزان بیان ژن HIF-1a و فاکتورهای موثر در ایجاد هیپوکسی و همچنین محتوای TG بدن تاثیر گذار باشد. مونیر و همکاران (2009) در بررسی اجرای 3 هفته تمرین متناوب تحت شرایط هیپوکسی، کاهش معنادار در بیان ژن HIF-1a در سطح mRNA عضلات اسکلتی دوندگان مرد نخبه را گزارش کردند (22). هالسورت و همکاران (2015) در پژوهشی به بررسی تاثیر نوعی تمرین HIIT بر کاهش چربی کبدی و بهبود عملکرد قلبی در افراد دارای NAFLD پرداختند. این محققان از 23 بیمار NAFLD با بیش از 5% چربی درون کبدی استفاده کردند. پروتکل تمرین شامل سه جلسه 40-30 دقیقهای بود که به مدت 12هفته انجام شد. نتایج نشان داد که تمرینات HIITباعث کاهش چربی کبدی و توده چربی (از 7 ±35به 8 ±33کیلوگرم) آلانین (29±52 به 20± 42 واحد در هر لیتر) و آسپارتاتآمینوترانسفراز AST (18±36 به 15± 33واحد در هر لیتر) و همچنین افزایش پر شدن دیاستولی (84 ±244 به 107 ± 302 میلیلیتر) شده است. این درحالی بود که میزان گلوکز در بین دو گروه تفاوت معناداری نداشت (23). موتا (2016) در پژوهشی به بررسی تاثیر تمرینات HIIT بر روی بهبود متابولیسم و شرایط بیماریزای مزمن موشهای چاق پرداخت. نتایج نشان داد تمرینات HIITمنجر به کاهش قابلتوجهی در توده بدن، قند خون، تحمل گلوکز و پروفایل لیپیدی گردید. همچنین این نوع تمرینات منجر به کاهش سطح پلاسمایی سیتوکین های التهابی، بهبود حساسیت به انسولین، کاهش چربی احشایی و استئاتوز کبدی گردید (24). با توجه به افزایش شیوع بیماری کبد چرب و ارتباط آن با بسیاری از بیماریها از جمله بیماریهای قلبی و عروقی و تایید اثرات مفید تمرینات ورزش بر کاهش عوامل خطر زا در این بیماریها، خلأ پژوهشی که در آن به تاثیر تمرینات ورزشی بر میزان HIF-1a و محتوای TG بافت قلب موشهای مبتلا به کبد چرب غیر الکلی و ماهیتهای مختلف ورزشی و مشخصاً مدت و شدتهای گوناگون ورزش در بروز این پاسخهای سازشی بپردازد احساس میشود. چرا که تمرین استقامتی کم شدت Low Intensity Endurance Training (LIET) و تمرین شدید اینتروال (HIIT) به لحاظ استفاده از سوبسترها و مواد سوختی، متابولیتهای تولیدی، مکانیسمهای ایجاد خستگی، ریکاوری و بسیاری از سازگاریهای سلولی- ملکولی متفاوت هستند. به همین دلیل این مطالعه به دنبال این است که تاثیر تمرین استقامتی کم شدت (LIET) و تمرین اینتروال شدید (HIIT) بر میزان بیان ژن HIF-1a و محتوای TG عضله قلب موشهای مبتلا به کبد چرب غیر الکلی را بررسی نماید.
روش بررسی
این پژوهش تجربی بر روی40 سر رت نر نژاد ویستار با سن 5 هفته و وزن 24/6±155/4 گرم که از موسسه رویان اصفهان خریداری شدند، انجام شد و براساس اصول نگهداری حیوانات آزمایشگاهی و دسترسی آسان به آب و غذا (تعداد 5 رت در هر قفس) و شرایط یکسان چرخه روشنایی و تاریکی 12:12 ساعت با میانگین دمای 20 تا 23 درجه سانتیگراد و رطوبت 50 درصد نگهداری شدند (25). پس از گذشت یک هفته آشنایی رتها با محیط، رتها بهطور تصادفی به گروه تجربی (n=30) با رژیم غذایی پر چرب شامل 60 درصد چربی (90 درصد چربی فرآوری شده حیوانی و 10 درصد روغن دانه سویا، 20 درصد کربوهیدرات و 20 درصد پروتئین) و گروه شم (n=10) با رژیمغذایی شامل: 20 درصد چربی ،70 درصد کربوهیدرات و 10 درصد پروتئین تقسیم شدند (25). پس از گذشت 16 هفته مصرف غذای پرچرب توسط رتهای گروه تجربی، نمونه خونی از انتهای دم آنها گرفته شد و بلافاصله به لولههای محتوی ماده ضد انعقاد EDTA منتقل گردید و در دستگاه سانتریفیوژ قرار گرفت تا پلاسمای مورد نیاز قابلیت تفکیک پیدا کند. سپس تا زمان سنجش آنزیم در دمای 20- درجه به صورت منجمد نگهداری شد. برای سنجش میزان پلاسمایی (ALT) Alanine Transaminase از روش الیزا و کیتهای ساخت شرکت پارس آزمون (ساخت ایران) استفاده شد. بررسی میزان سرمی آنزیمALT به عنوان یکی از نشانگان اصلی بروز کبد چرب، مشخص کرد غذای چرب به خوبی توانسته است بیماری NAFLD را در گروه تجربی القاء نماید. سپس کلیه رتهای گروه تجربی بهطور تصادفی به سه گروه 10 تایی شامل یک گروه کنترل و دو گروه تمرینی (HIIT و LIET) تقسیم شدند و همچنان غذای پر چرب مصرف میکردند. گروه شم در کل پژوهش غذای استاندارد مصرف کردند و همانند گروه کنترل در هیچ برنامه تمرینی شرکت نکردند (25) گروههای تجربی (HIIT و LIET) در پروتکلهای تمرینی ویژه خود به مدت 8 هفته (5 روز هفته) شرکت کردند. قبل از شروع پروتکل تمرین، حیوانات به مدت یک هفته، روزانه 10 تا 15 دقیقه بـا سرعت 10 متر بـر دقیقه برای آشناسازی و تطبیق بر روی تردمیل تمرین کردند (26). جهت تعیین حداکثر سرعت رتها از آزمون 10 مرحلهای استفاده شد. سرعت در مرحله اول 0/3 کیلومتر بر ساعت (5 متر در دقیقه) و در مراحل بعدی، در هر 3 دقیقه 0/3 کیلومتر بر ساعت به سرعت نوار گردان اضافه میشد و سرعتی که در آخرین مرحله، حیوان علیرغم شوک الکتریکی قادر به دویدن نبود به¬عنوان حداکثر سرعت دویدن حیوان ثبت گردید (27). سپس بهجهت نزدیکی سرعت بیشینه گروهها و همچنین محدودیت اجرای پژوهش، میانگین حداکثر سرعت برای کل گروهها در نظر گرفته شد (28). هر دو پروتکل تمرین شامل سه قسمت گرم کردن و سرد کردن (5 دقیقه با 30 درصد سرعت بیشینه ) و تمرین اصلی بود.
پروتکلهای تمرینی: پروتکل تمرینHIIT مجموعهای منظم از تمرینات شدید و کم شدت بود که به ترتیب شامل دو دقیقه دویدن با شدت 75 درصد سرعت بیشینه در هفته اول، 80 درصد سرعت بیشینه در هفته دوم، 85 درصد سرعت بیشینه در هفته سوم و90 درصد سرعت بیشینه در هفته چهارم تا پایان تمرین بود. دفعات استراحت فعال شامل دو دقیقه با شدت 30 درصد سرعت بیشینه از هفته اول تا پایان هفته سوم و 20 درصد از ابتدای هفته چهارم تا انتهای دوره تمرینات بود. در انتهای هر جلسه و پس از آخرین فعالیت شدید، رتها به جای تمرین در شدت پایین، به مدت پنج دقیقه با شدت 30 درصد سرعت بیشینه به سرد کردن میپرداختند. تعداد تکرارها به گونهای تنظیم شد که در هفته اول 2 مرتبه تکرار ؛ هفته دوم 4 مرتبه؛ هفته سوم 6 مرتبه و از هفته چهارم تا پایان 8 مرتبه فعالیت با شدت بالا تکرار شد (جدول 1). پروتکل تمرینی LIET نیز مطابق با مسافت طی شده در گروه HIIT در هر هفته بود که این مسافت را با 45 درصد حداکثر سرعت بیشینه می دویدند. بنابراین گروه LIET در هر جلسه با سرعت ثابت 18 متر در دقیقه میدویدند که در هفته اول 18دقیقه، هفته دوم 30، هفته سوم 36 و از هفته چهارم به بعد 45 دقیقه این مسافت را طی میکردند (جدول 1).
نمونهگیری بافت: 24 ساعت پس از اتمام آخرین جلسه تمرین و پس از 16 ساعت ناشتایی (29)، کلیه حیوانات با تزریق سدیم پنتوباربیتال (40 میلیگرم بر کیلوگرم) بیهوش شدند (30) و پس از استخراج قلب و شستشوی آن با سالین، بافت مربوطه به میکروتیوپ منتقل و علامتگذاری شد و بلافاصله در نیتروژن مایع منجمد شد و تا زمان انجام مراحل آزمایشگاهی در دمای 80- درجه سانتیگراد نگهداری شد (30). به منظور استخراج RNA، ازکیت استخراج ایرایزول RNA، ساخت شرکت زیست فنآوران رنا (کد دسترسی RB1001) استفاده شد. ابتدا میزان 100-50 میلیگرم از بافت فریز شده قلب به حاون استریل منتقل و به همراه 1 میلیلیتر بافر برای ایجاد بافتی همگن کوبیده شد. سپس این محلول به میکروتیوب منتقل شد و 200 میکرو لیتر کلروفرم به آن اضافه گردید و به مدت 15- 10 ثانیه تکان داده و پس از آن به مدت 5 دقیقه برای تفکیک لایه رویی که حاوی RNA بود ثابت نگه داشته شد. سپس این مایع با 1000 میکرولیتر اتانول 100 درصد سرد مخلوط و به مدت 8 دقیقه در داخل فریزر 20- قرار داده شد. سپس تیوپ سانتریفیوژ شد و مایع باقیمانده حذف شد و اتانول 80 درصد به لکههای سفید رنگ باقیمانده در بدنه و کف تیوب اضافه شد و مجددا سانتریفیوژ تکرار شد و پس از خارج کردن اتانول و خشک کردن محتوای داخل تیوپ (در این مرحله روش air-dry مورداستفاده قرار گرفت) 20 تا50 میکرولیتر آب دو بار تقطیر شده، متناسب با میزان رسوب به آن اضافه و با پیپت RNA داخل تیوپ حل شد. سپس 5 ماکرو لیتر از آن به منظور تائید کیفیت بر روی ژل آگارز 1 درصد ران شد تا پس از تائید، از آن در سنتز cDNA استفاده گردد. سنتز cDNA با استفاده از کیت سنتز cDNA (RB) زیست فناوران رنا و مطابق دستورات این شرکت انجام گرفت (جدول2)(31). تعیین بیان mRNA از طریق روش واکنش زنجیرهای پلی مراز Real-time RT-PCR انجام شد و برای کسب شرایط دمای بهینه برای تکثیر، ژن (TBP) Telomere Binding Protein بهعنوان کنترل سنتز cDNA در واکنش زنجیرهای پلیمراز و طبق پیشنهاد شرکت سازنده پرایمر در شرکت زیست فناوران رنا استفاده گردید (31). توالی پرایمرها برای ژن HIF-1a وTBP درجدول 3 ارائه شده است. برای استخراج TG بافت قلب، ابتدا با استفاده از ترازوی دیجیتال، معادل 5/0 گرم (mg500) از بافت قلب جدا شد و در داخل میکروتیوپ قرار گرفت. سپس معادل 1 میلیلیتر ایزوپروپانول به هر میکروتیوپ اضافه شد و با استفاده از سواپ پلاستیکی، بافت قلب داخل میکروتیوپ را فشرده و تا قطعه قطعه کردن و متلاشی شدن کامل بافت جهت تسهیل هموژیناسیون این کار ادامه پیدا کرد. در ادامه، میکروتیوپها برای جداسازی بافتها به مدت 1 دقیقه به وسیله دستگاه هموژانایزر و با قدرت Hz 5000 هموژنیزه شد (HETYCH، مدل UP1000H). پس از آن میکروتیوپها به مدت 5 دقیقه و با دور 4000 سانتریفیوژ شدند تا لایه رویی آن قابل تفکیک شود. در نهایت این لایه برای سنجش TG بر روی دستگاه اتو آنالیزور مورد استفاده قرار گرفت (مدل BT3000)(32).
تجزیه و تحلیل آماری
دادههای جمع آوری شده با استفاده از نرمافزارversion 16 SPSS و آزمون تحلیل واریانس یک راهه و آزمون تعقیبی شفه تجزیه و تحلیل شدند (P<0/05).
ملاحظات اخلاقی
این پژوهش در کمیته اخلاق تحقیقاتی علوم ورزشی و بر اساس انطباق با استاندارهای اخلاق در تحقیقات وزارت علوم با کد IR.SSRI.REC.1397.331 تایید شده است.
جدول 1 : پروتکل تمرینی HIIT و LEIT

جدول 2 : مراحل ساخت cDNA

جدول 3: توالی پرایمرها برای ژن HIF-1a و TBP

نتایج
نتایج مقایسه آنزیم ALT: جهت اطمینان از القاء بیماری کبد چرب غیر الکلی در رتهایی که 16 هفته غذای پرچرب استفاده کردند، میزان سرمی آنزیم ALT رتها سنجیده شد و به تفکیک دو گروه غذایی مختلف ارائه شد (جدول 4). تحلیل نتایج نشان داد تفاوت معنیداری در بیان ژن HIF-1a بین گروه کنترل و گروه HIIT (P= 0/001) و گروه کنترل و گروه LIET (P= 0/009) و گروه کنترل و گروه شم (P= 0/0001) وجود دارد، اما تفاوت معنیداری در بیان ژن HIF-1a بین گروه HIIT و(P= 0/873) LIET و گروه شم و(P= 0/919) HIIT و گروه شم و(P= 0/483) LIET مشاهده نشد (نمودار 1). همچنین تحلیل آماری دادهها نشان داد تفاوت معنیداری در میزان محتوای TG بافت قلب بین گروههای مختلف این پژوهش وجود دارد. بر این اساس، تفاوت معنیداری در میزان محتوای TG بافت قلب بین گروه کنترل و گروه HIIT، گروه کنترل و گروه LIET، گروه کنترل و گروه شم، گروه HIITو گروه شم و گروه LIETو گروه شم مشاهده شد (0/0001=P). این در حالی است که تفاوت معنی داری در میزان محتوای TG بافت قلب بین گروه تمرین HIIT و LIET مشاهده نشد(P= 0/066) (نمودار 2). همچنین، بررسیها نشان داد که تفاوت معنیداری در میزان وزن رتهای گروههای مختلف وجود دارد(P= 0/0001) . با توجه به بررسی نتایج جدول (5) مشاهده گردید که بین دو گروه تجربی تمرینی، تنها میانگین وزن رتهای گروه تمرین استقامت کم شدت کاهش معنیداری یافته است (P= 0/0001) در حالیکه این میانگین در گروه تمرین تناوبی شدید تغییر معنیداری نداشته است.(P= 0/005) . همچنین میانگین وزن گروه کنترل و شم در طی این دوره افزایش معنیداری پیدا کرد (P= 0/0001).
جدول 4 نتایج آزمونT جهت مقایسه سطح سرمی آنزیم (U/liter) ALT در دو گروه غذایی مختلف

* نشانه معناداری نسبت به قبل از تمرین (0/05>P)

نمودار 1 تغییرات میانگین بیان ژن HIF-1α بافت قلب موشهای صحرایی نر مبتلا به بیماری کبد چرب غیر الکلی در گروههای مختلف

نمودار 2: تغییرات میانگین میزان TGبافت قلب موشهای صحرایی نر مبتلا به بیماری کبد چرب غیر الکلی در گروههای مختلف
جدول 5: مقایسه وزن رتها قبل و بعد از پروتکلهای تمرینی

*نشانه معناداری نسبت به قبل از تمرین (0/05>P)
بحث
نتایج به دست آمده از پژوهش حاضر نشان داد هشت هفته تمرینHIIT و LIET همراه با رژیم غذایی پرچرب تغییر معنیداری بربیان ژن HIF-1α بافت قلبی موشهای مبتلا به NAFLD داشته است. اگرچه تاکنون پژوهشی به بررسی تأثیر تمرین بر HIF-1a و محتوای TGبافت قلبی نپرداخته است، ولی پیش از این، تأثیر نهایی این ژن در متابولیسم چربی و بـه طور مشخص در کاهش میزان لیپولیز LDsمشخص شده است (33). متابولیسم سلولی بهطور چشمگیری در پاسخ به هیپوکسی با تاثیر بر گلیکولیز بیهوازی تغییر میکند که این امر تا حدی مربوط به افزایش رونویسی HIF-1a و ژنهای گلیکولیکی میباشد (34). برخی مطالعات نیز نشان دادهاند که هیپوکسی باعث کاهش بیان PPARa)) peroxisome-proliferator-activated receptor-α میوکاردیال، اکسیداسیون اسیدهای چرب و (UCP3) uncoupling protein 3 میتوکندری و افزایش متابولیسم کربوهیدرات میشود (35). هیپوکسی همچنین باعث افزایش قابلتوجه تجمع LD میشود و با توجه به تأثیر آن بر بیان لیپین 1،HIF-1α تأثیر قویتری بر محتوای LD نسبت به HIF-2α اعمال میکند. بنابراین، فعالسازی HIF-1a و تا حدی کمتر، فعالسازی HIF-2a برای تحریک تولید لیپین 1 و LD حتی در شرایط نرموکسیک کافی است (36). در واقع افزایش بیان عوامل القاء هیپوکسی (HIFs) همزمان باعث تنظیم مثبت بیان ژنهای مؤثر در سنتز اسید چرب ( Crot)) Carnitine O-Octanoyltransferase، (Cpt1) carnitine palmitoyltransferase-1 و Acsl1)) Acyl-CoA Synthetase Long Chain Family Member 1) و کاهش بیان ژنهـای درگیـر در بتااکسیداسیون میشود (Cpt-1a، Cpt 2، (Acox1) Acyl-CoA Oxidase 1 و (peroxisome-proliferator-activated receptor ( Ppar) (37). از اینرو HIFs از طریق تنظیم مثبت بیان پروتئینهای مرتبط با LD باعث افزایش شکلگیری LD میشود (38). به طوریکه افزایش HIFs در حیوانات منجر به افزایش 4 برابری ذخایر TG بدون تغییر در ژنهای درگیر در نوسازی لیپوژنز، بتااکسیداسیون و لیپولیز شده است (39). در بررسی نوع تمرین و ایجاد هیپوکسی نشان داده شده است که تمرینات استقامتی، سطح HIF-1a را کاهش می دهد در حالیکه افزایش ناگهانی شدت تمرین در مدت کم سطح HIF-1a را بالا میبرد(40). رودریگز و همکاران (2015) در تحقیقی که بر روی 24 موش انجام دادند نشان دادند 8 هفته تمرینات ورزشی برونگرا باعث افزایش بیان HIF-1a و واسطههای (VEGF) Vascular endothelial growth factor و (eNOS)Endothelial Nitric Oxide Synthase در عضلات اسکلتی گردید(41). فلورا (2012) در تحقیق خود به مطالعه تاثیر تمرینات هوازی و بیهوازی با استفاده از تردمیل بر روی HIF-1a و VEGF بافت قلب پرداخت. نتایج نشان داد که هر دو نوع تمرین هوازی و بیهوازی باعث افزایش HIF-1a و VEGF گردید(42). مونیر و همکاران (2009) در بررسی اجرای 3 هفته تمرین تحت شرایط هایپوکسی، کاهش معنادار در بیان ژن HIF-1a در سطح mRNA عضلات اسکلتی دوندگان مرد نخبه گزارش کردند (22). بر اساس نتایج برخی تحقیقات مبنی بر تفاوت بیان HIF-1a در پی شرکت در تمرینهای تناوبی شـدید و تمرینهای استقامتی در حالت پایدار، تاکنون تناقضات زیادی ارایه شده است .بـه نظر میرسد مهمترین دلایل این تناقضات به عوامل متعددی چون وضعیت سلامتی و سطح آمادگی قبلی آزمودنیها، شدت و مدت تمرین، آمادگی جسمانی شرکتکنندگان، وراثت و جنسیت مرتبط باشد (43). نتایج پژوهش حاضر نشان داد، که در مقایسه پروتکلهای تمرینی استقامتی کم شدت و تناوبی شدید تفاوت معنیداری در مقادیر HIF-1aمشاهده نشد، که این میتواند به دلیل استفاده از رژیم غذایی پرچرب در زمان تمرین در مقایسه با سایر پژوهشها که از رژیم غذایی کمچرب استفاده کرده بودند، باشد (44). همچنین نتایج این پـژوهش نشان داد هم تمرینهای استقامتی کم شدت و هم تمرینهای شدید تناوبی باعث کاهش معنی دار محتوای چربی بافت قلبی میشود .بنابراین کاهش هماهنگ میزان بیـان ژن HIF-1a وTG در پی استفاده از پروتکل های تمرینی مختلف، میتواند معرف نقش و ارتباط پروتئینHIF-1a در تنظیم متابولیسم چربی در بافت قلبی به دنبال تمرین ورزشی باشد. در این پژوهش میزان افزایش بیان ژن HIF-1a در گروه کنترل با میزان افزایشTG در آن هماهنگ شده است. همچنین نتایج نشان داد کاهش میزانTG در گروه پروتکل تمرینی HIIT مستقل از کاهش وزن بود. اگرچـه بسیاری فواید سودمند فعالیت طولانی مدت ورزشی در شـدت کم تا متوسط را به کـاهش وزن مـرتبط میدانسـتند، عموماً تأثیرات مفید تمرینهای شدید مستقل از کاهش وزن رخ میدهد (45). به طوریکه حتی یک مرتبه فعالیت ورزشی شدید نیز میتواند بـا ایجاد تغییرات مثبت در مسیرهای متابولیکی، سمزدایی و جلوگیری از تجمع چربی تا حدی از شرایط نامطلوب حاصل از رژیم پر چرب بکاهد (46). در رابطه با این یافتهها، نتایج پژوهش تراپ و همکاران (2008) نیز نشان داد که علیرغم کاهش معنیدار بیان ژن HIG2 و محتوایTG در گروههای مختلف تمرینی با شدت بالا، تغییرات کاهش وزن قابل قبولی در این زمینه مشاهده نگردید (47). همچنین در پژوهش هوگتون و همکاران (2017) که در ارتباط با اثر ورزش و بیماری NAFLD انجام شد، نتایج نشان داد که 12 هفته تمرین درمانی باعث کاهش 16 درصدی TG هپاتوسیتها مستقل از کاهش وزن بیماران گردید (48). همچنین برخی پژوهشها نشان دادهاند که کاهش TG میتواند ناشی از کاهش پروتئین انتقال دهنده تریگلسیرید میکروزومی (MTP) Microsomal triglyceride transfer protein باشد. MTP نقش اساسی و مرکزی در تنظیم ترشحTG و VLDL بازی میکند (49). نتایج حاصل از پژوهش حاضر نشان داد که پس از 8 هفته در گروههای شم و کنترل تغییرات افزایش وزن معنیداری مشاهده شد. همچنین در گروه تمرینی استقامتی کم شدت تغییرات کاهش وزن معنیدار بود، که می تواند بیانگر فعالشدن مسیر لیپولیزی و افزایش بتا اکسیداسیون لیپیدها باشد (44). ولی در گروه تمرینات تناوبی شدید تغییرات وزن معنیدار نشد. دلیل این امر میتواند این باشد که با انجام تمرینات شدید نسبت با تمرینات کم شدت استقامتی، ترشح هورمونهای سمپاتیکی باعث فعالشدن مسیر گلیگولیز بیهوازی شده و مسیر لیپولیزی را بلوکه کرده است (44). در این رابطه در پژوهشی که بودو و همکارانش (2003) به برسی تأثیر تمریناتHIIT بر روی مردان دیابتی نوع 2 پرداختند، دریافتند که پس از 8 هفته تمریناتHIIT هیچ تغییری در وزن افراد رخ نداده است؛ بااینحال، به میزان 44 درصد کاهش بافت چربی احشایی و توده بدنی بیشتر شرکتکنندگان بعد ازHIIT را نشان دادند (50). مارسینکو و همکاران (2015) به بررسی تأثیر تمرینات اینتروال شدید بر بهبود حساسیت انسولینی بافت کبد و چربی پرداخته است. در این پژوهش اثر 6 هفته تمرینات HIIT بر موشهای چاق مورد بررسی قرار گرفت. نتایج نشان داد که مصرف همزمان غذای پرچرب و تمرینات HIIT، علی رغم افزایش مصرف غذا، باعث کاهش میزان گلوکز خون و TG، افزایش حساسیت انسولینی و همچنین افزایش میزان اکسیداسیون کربوهیدراتها میشود. نکته قابلتوجه آن بود که کلیه تغییرات ذکر شده مستقل از تغییرات وزن موشها رخ داد. به نظر میرسد اینگونه تمرینات باعث افزایش فسفوریلاسیون و مهار آنزیم استیلکوآکربوکسیلاز (ACC) Acetyl-CoA carboxylase توسط فعالیت پروتئینکیناز وابسته به AMP (AMPK) AMP-activated protein kinase در عضلات اسکلتی، بافت چربی و کبد میشود. بنابراین مهار ACC باعث تغییر در تنظیم متابولیسم اسید چرب محتوای کبدی، التهاب بافت چربی و مقاومت انسولینی میشود. با اینحال، این محققان اعلام کردند که همچنان مکانیسمهای تاثیر تمرینات HIIT بر این مسیرها به خوبی شناسایی نشدهاند (51). کاهش TG درون قلبی گروه تمرینی را میتوان با مصرف اکسیژن اضافه پس از تمرینات با شدت بالا که درپی رهایش بیشتر کاتکولامینها و در نتیجه افزایش بیشتر فرایندهای دفع لاکتات در آنها رخ میدهد، مرتبط دانست که باعث میشود هزینه انرژی مصرفی تا ساعتها پس از تمرین همچنان زیاد باشد (52) .از طرفی، شواهد نشان میدهند که استفاده از تمرینهایHIIT باعث تغییر در نوع تار و هیپرتروفی بیشتر تارهای نوع دو و نیز افزایش بیان (GLUT4) Glucose transporter 4 در این گونه تارها میشود که به بروز سازگاریهای مثبت و کاهش TG در آنها به طور مستقل از تغییر در وزن بدن منجر می شود (53).
نتیجهگیری
در کل نتایج این پژوهش نشان داد که هشت هفته تمرین استقامتی کم شدت و تمرین تناوبی شدید حتی به همراه مصرف غذای پر چرب در رتهای دارای بیماری کبد چرب غیر الکلی باعث کاهش بیان ژن HIF-1a بهعنوان یکی از اصلیترین ژنهای محدودکننده لیپولیز مرتبط با قطرات چربی میشود و از این طریق باعث کاهش محتوای تری گلیسیرید بافت قلبی در هر دو گروه شده است. بر این اساس، کاهش میزان تری گلیسیرید بافت قلبی در رتهای مبتلاء به بیماری کبد چرب غیر الکلی به خوبی نقش تمرینهای ورزشی را نمایان میسـازد. اگرچه مکانیسـم های احتمالی درگیر در ایـن مسیرها تا حدودی متفاوت اسـت. لذا تغییر سبک زنـدگی بـا هدف افزایش هزینه انرژی به تنهایی و بـدون استفاده از مداخلات دارویی قادر به کاهش ذخایر چربی درون سلولی بافت قلبی میشود .
سپاسگزاری
مقاله حاضر مستخرج از رساله دکترای مصوب گروه فیزیولوژی ورزشی دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد اسلامی واحد تهران جنوب میباشد، لذا بدینوسیله از مسئولین و اساتید محترم دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد اسلامی واحد تهران جنوب و همچنین از همکاری پرسنل پژوهشکده زیست فناوری رویان اصفهان که زمینه انجام تحقیق حاضر را فراهم نمودند، تشکر و قدردانی مینماید.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Hashimoto E, Taniai M, Tokushige K. Characteristics and Diagnosis of NAFLD /NASH. J Gastroenterology and Hepatology 2013; 28(S4): 64-70.
2- Polyzos SA, Kechagias S, Tsochatzis EA. Nonalcoholic Fatty Liver Disease and Cardiovascular Diseases: Associations and Treatment Considerations. Alimentary pharmacology & therapeutics 2021; 54(8): 1013-25.
3- Stephen S, Baranova A, Younossi ZM. Nonalcoholic Fatty Liver Disease and Bariatric Surgery. Expert Review of Gastroenterology & Hepatology 2012; 6(2): 163-71.
4- Kotronen A, Yki-Järvinen H. Fatty Liver: A Novel Component of the Metabolic Syndrome. Arterioscler Thromb Vasc Biol 2008; 27: 2276-83.
5- Flora R, Freisleben HJ, Ferdinal F, Wanandi SI, Sadikin M. Correlation of Hypoxia Inducible Factor-1αand Vascular Endothelium Growth Factor in Rat Myocardium during Aerobic and Anaerobic Exercise. Medical Journal of Indonesia 2012; 21(3): 133-40.
6- Yardeni D, Toledano R, Novack V, Shalev A, Wolak A, Rotman Y, Etzion O. The Association of Alanine Aminotransferase Levels with Myocardial Perfusion Imaging and Cardiovascular Morbidity. J Cardiovasc Pharmacol Ther 2022; 27: 10742484221074585.
7- Nakamura M, Sadoshima J. Cardiomyopathy in Obesity, Insulin Resistance and Diabetes. J physiol 2020; 598(14): 2977-93.
8- Haemmerle G, Moustafa T, Woelkart G, Büttner S, Schmidt A, Van De Weijer T, et al. ATGL-Mediated Fat Catabolism Regulates Cardiac Mitochondrial Function Via PPAR-Α and PGC-1. Nat Med 2011; 17(9): 1076-85.
9- Salvatore T, Pafundi PC, Galiero R, Albanese G, Di Martino A, Caturano A, et al. The Diabetic Cardiomyopathy: The Contributing Pathophysiological Mechanisms. Front Med 2021; 8: 695792.
10- Shen Y, Xu X, Yue K, Xu G. Effect of Different Exercise Protocols on Metabolic Profiles and Fatty Acid Metabolism in Skeletal Muscle in High Fat Dietn Fed Rats. Obesity 2015; 23(5): 1000-6.
11- Kaelin Jr WG, Ratcliffe PJ. Oxygen Sensing by Metazoans: The Central Role of the HIF Hydroxylase Pathway. Mol Cell 2008; 30(4): 393-402.
12- Jewell UR, Kvietikova IV, Scheid AN, Bauer CH, Wenger RH, Gassmann M. Induction of HIF–1α In Response to Hypoxia is Instantaneous. FASEB J 2001; 15(7): 1312-4.
13- Bostrom P, Magnusson B, Svensson PA, Wiklund O, Borén J, Carlsson LM, et al. Hypoxia Converts Human Macrophages into Triglyceride-Loaded Foam Cells. Arterioscler Thromb Vasc Biol 2006; 26(8): 1871-6.
14- Sun RC, Denko NC. Hypoxic Regulation of Glutamine Metabolism through HIF1 and SIAH2 Supports Lipid Synthesis that is Necessary for Tumor Growth. Cell Metab 2014; 19(2): 285-92.
15- Huang D, Li T, Li X, Zhang L, Sun L, He X, Zhong X, Jia D, Song L, Semenza GL, Gao P. HIF-1-Mediated Suppression of Acyl-Coa Dehydrogenases and Fatty Acid Oxidation is Critical for Cancer Progression. Cell Rep 2014; 8(6): 1930-42.
16- Mylonis I, Sembongi H, Befani C, Liakos P, Siniossoglou S, Simos G. Hypoxia Causes Triglyceride Accumulation by Hif-1-Mediated Stimulation of Lipin 1 Expression. J Cell sci 2012; 125(14): 3485-93.
17- Hölscher M, Schäfer K, Krull S, Farhat K, Hesse A, Silter M, et al. Unfavourable Consequences of Chronic Cardiac HIF-1α Stabilization. Cardiovascular Research 2012; 94(1): 77-86.
18- Perman JC, Boström P, Lindbom M, Lidberg U, StÅhlman M, Hägg D, et al. The VLDL Receptor Promotes Lipotoxicity and Increases Mortality in Mice Following an Acute Myocardial Infarction. The Journal of Clinical Investigation 2011; 121(7): 2625-40.
19- Belanger AJ, Luo Z, Vincent KA, Akita GY, Cheng SH, Gregory RJ, Jiang C. Hypoxia-Inducible Factor 1 Mediates Hypoxia-Induced Cardiomyocyte Lipid Accumulation by Reducing the DNA Binding Activity of Peroxisome Proliferator-Activated Receptor Α/Retinoid X Receptor. Biochemical and Biophysical Research Communications 2007; 364(3): 567-72.
20- Suzuki T, Shinjo S, Arai T, Kanai M, Goda N. Hypoxia and Fatty Liver. World Journal of Gastroenterology: WJG 2014; 20(41): 15087.
21- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, Czech MP. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
22- Mounier R, Pialoux V, Roels B, Thomas C, Millet G, Mercier J, Coudert J, Fellmann N, Clottes E. Effect of Intermittent Hypoxic Training on HIF Gene Expression in Human Skeletal Muscle and Leukocytes. European J Applied Physiology 2009; 105(4): 515-24.
23- Hallsworth K, Thoma C, Hollingsworth KG, Cassidy S, Anstee QM, Day CP, Trenell MI. Modified High-Intensity Interval Training Reduces Liver Fat and Improves Cardiac Function in Non-Alcoholic Fatty Liver Disease: A Randomized Controlled Trial. Clinical science 2015; 129(12): 1097-105.
24- Motta VF, Aguila MB, Mandarim-De-Lacerda CA. High-Intensity Interval Training (Swimming) Significantly Improves the Adverse Metabolism and Comorbidities in Diet-Induced Obese Mice. The Journal of Sports Medicine and Physical Fitness 2015.
25- Cho J, Koh Y, Han J, Kim D, Kim T, Kang H. Adiponectin Mediates the Additive Effects of Combining Daily Exercise with Caloric Restriction for Treatment of Non-Alcoholic Fatty Liver. Int J Obes 2016; 40(11): 1760-7.
26- Marcinko K, Sikkema SR, Samaan MC, Kemp BE, Fullerton MD, Steinberg GR. High Intensity Interval Training Improves Liver and Adipose Tissue Insulin Sensitivity. Mol Metab 2015; 4(12): 903-15.
27- PITHON-CURI TN. Aprogram of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res 2007; 21(3): 751-6.
28- Krug AL, Macedo AG, Zago AS, Rush JW, Santos CF, Amaral SL. High Intensity Resistance Training Attenuates Dexamethasone Induced Muscle Atrophy. Muscle Nerve 2016; 53(5): 779-88.
29- Mattijssen F, Georgiadi A, Andasarie T, Szalowska E, Zota A, Krones-Herzig A, et al. Hypoxia-Inducible Lipid Droplet-Associated (HILPDA) Is A Novel Peroxisome Proliferator-Activated Receptor (PPAR) Target Involved in Hepatic Triglyceride Secretion. J Biol Chem 2014; 289(28): 19279-93.
30- Suk M, Shin Y. Effect of High-Intensity Exercise and High-Fat Diet on Lipid Metabolism in the Liver of Rats. J Exerc Nutrition & Biochem 2015; 19(4): 289-95.
31- Sohrabipour S, Sharifi MR, Talebi A, Sharifi M, Soltani N. GABA Dramatically Improves Glucose Tolerance in Streptozotocin-Induced Diabetic Rats Fed with High-Fat Diet. Eur J Pharmacol 2018; 826: 75-84.
32- Löfgren L, Forsberg GB, Ståhlman M. The BUME Method: A New Rapid and Simple Chloroform-Free Method for Total Lipid Extraction of Animal Tissue. Sci Rep 2016; 10; 6(1): 1-1.
33- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, Czech MP. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
34- Majmundar AJ, Wong WJ, Simon MC. Hypoxia-Inducible Factors and the Response to Hypoxic Stress. Molecular Cell 2010; 40(2): 294-309.
35- Cole MA, Jamil AH, Heather LC, Murray AJ, Sutton ER, Slingo M, et al. On the Pivotal Role of Ppara in Adaptation of the Heart to Hypoxia and Why Fat in the Diet Increases Hypoxic Injury. FASEB J 2016; 30(8): 2684-97
36- Mylonis I, Sembongi H, Befani C, Liakos P, Siniossoglou S, Simos G. Hypoxia Causes Triglyceride Accumulation by HIF-1-Mediated Stimulation of Lipin 1 Expression. J Cell Sci 2012; 125(pt14): 3485-93.
37- Piguet AC, Stroka D, Zimmermann A, Dufour JF. Hypoxia Aggravates Non-Alcoholic Steatohepatitis in Mice Lacking Hepatocellular PTEN. Clin Sci 2010; 118(6): 401-10.
38- Rankin EB, Rha J, Selak MA, Unger TL, Keith B, Liu Q, Haase VH. Hypoxia-Inducible Factor 2 Regulates Hepatic Lipid Metabolism. Mol Cell Biol 2009; 29(16): 4527-38.
39- Mattijssen F, Georgiadi A, Andasarie T, Szalowska E, Zota A, Krones-Herzig A, et al. Hypoxia-Inducible Lipid Droplet-Associated (HILPDA) is a Novel Peroxisome Proliferator-Activated Receptor (PPAR) Target Involved in Hepatic Triglyceride Secretion. J Biol Chem 2014; 289(28): 19279-93.
40- Lunde IG, Anton SL, Bruusgaard JC, Rana ZA, Ellefsen S, Gundersen K. Hypoxia Inducible Factor 1α Links Fast‐Patterned Muscle Activity and Fast Muscle Phenotype in Rats. J physiol 2011; 589(6): 1443-54.
41- Rodriguez-Miguelez P, Lima-Cabello E, Martínez-Flórez S, Almar M, Cuevas MJ, González-Gallego J. Hypoxia-Inducible Factor-1 Modulates the Expression of Vascular Endothelial Growth Factor and Endothelial Nitric Oxide Synthase Induced By Eccentric Exercise. J Appl Physiol 2015; 118(8): 1075-83.
42- Flora R, Freisleben HJ, Ferdinal F, Wanandi SI, Sadikin M. Correlation of Hypoxia Inducible Factor-1Î and Vascular Endothelium Growth Factor In Rat Myocardium During Aerobic And Anaerobic Exercise. Med J Indonesia 2012; 21(3): 133-40.
43- Mounier R, Pialoux V, Roels B, Thomas C, Millet G, Mercier J, Coudert J, Fellmann N, Clottes E. Effect of Intermittent Hypoxic Training on HIF Gene Expression in Human Skeletal Muscle and Leukocytes. Eur J Appl Physiol 2009; 105(4): 515-24.
44- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, et al. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
45- Boutcher SH. High-Intensity Intermittent Exercise and Fat Loss. J Obesity 2011; 2011: 1-10.
46- Charbonneau A, Melancon A, Lavoie C, Lavoie JM. Alterations in Hepatic Glucagon Receptor Density and in Gsα and Giα2 Protein Content with Diet-Induced Hepatic Steatosis: Effects of Acute Exercise. American J Physiology-Endocrinology Metabolism 2005; 289(1): E8-14.
47- Trapp EG, Chisholm DJ, Freund J, Boutcher SH. The Effects of High-Intensity Intermittent Exercise Training on Fat Loss and Fasting Insulin Levels of Young Women. Int J Obes 2008; 32(4): 684-91.
48- Houghton D, Thoma C, Hallsworth K, Cassidy S, Hardy T, Burt AD, et al. Exercise Reduces Liver Lipids and Visceral Adiposity in Patients with Nonalcoholic Steatohepatitis in a Randomized Controlled Trial. Clin Gastroenterol Hepatol 2017; 15(1): 96-102.
49- Chapados NA, Seelaender M, Levy E, Lavoie JM. Effects of Exercise Training on Hepatic Microsomal Triglyceride Transfer Protein Content in Rats. Horm Metab Res 2009; 41(04): 287-93.
50- Boudou P, Sobngwi E, Mauvais-Jarvis F, Vexiau P, Gautier JF. Absence of Exercise-Induced Variations in Adiponectin Levels despite Decreased Abdominal Adiposity and Improved Insulin Sensitivity in Type 2 Diabetic Men. Eur J Endocrinol 2003; 149(5): 421-4.
51- Marcinko K, Sikkema SR, Samaan MC, Kemp BE, Fullerton MD, Steinberg GR. High Intensity Interval Training Improves Liver and Adipose Tissue Insulin Sensitivity. Mol Metab 2015; 4(12): 903-15.
52- Nevill ME, Holmyard DJ, Hall GM, Allsop P, Van Oosterhout A, Burrin JM, Nevill AM. Growth Hormone Responses to Treadmill Sprinting in Sprint-and Endurance-Trained Athletes. Eur J Appl Physiol Occup Physiol 1996; 72(5): 460-7.
53- Verdijk LB, Gleeson BG, Jonkers RA, Meijer K, Savelberg HH, Dendale P, et al. Skeletal Muscle Hypertrophy Following Resistance Training is accompanied by a Fiber Type–Specific Increase in Satellite Cell Content in Elderly Men. J Gerontol Series A: Biol Sci Med Sci 2009; 64(3): 332-9.
1- Hashimoto E, Taniai M, Tokushige K. Characteristics and Diagnosis of NAFLD /NASH. J Gastroenterology and Hepatology 2013; 28(S4): 64-70.
2- Polyzos SA, Kechagias S, Tsochatzis EA. Nonalcoholic Fatty Liver Disease and Cardiovascular Diseases: Associations and Treatment Considerations. Alimentary pharmacology & therapeutics 2021; 54(8): 1013-25.
3- Stephen S, Baranova A, Younossi ZM. Nonalcoholic Fatty Liver Disease and Bariatric Surgery. Expert Review of Gastroenterology & Hepatology 2012; 6(2): 163-71.
4- Kotronen A, Yki-Järvinen H. Fatty Liver: A Novel Component of the Metabolic Syndrome. Arterioscler Thromb Vasc Biol 2008; 27: 2276-83.
5- Flora R, Freisleben HJ, Ferdinal F, Wanandi SI, Sadikin M. Correlation of Hypoxia Inducible Factor-1αand Vascular Endothelium Growth Factor in Rat Myocardium during Aerobic and Anaerobic Exercise. Medical Journal of Indonesia 2012; 21(3): 133-40.
6- Yardeni D, Toledano R, Novack V, Shalev A, Wolak A, Rotman Y, Etzion O. The Association of Alanine Aminotransferase Levels with Myocardial Perfusion Imaging and Cardiovascular Morbidity. J Cardiovasc Pharmacol Ther 2022; 27: 10742484221074585.
7- Nakamura M, Sadoshima J. Cardiomyopathy in Obesity, Insulin Resistance and Diabetes. J physiol 2020; 598(14): 2977-93.
8- Haemmerle G, Moustafa T, Woelkart G, Büttner S, Schmidt A, Van De Weijer T, et al. ATGL-Mediated Fat Catabolism Regulates Cardiac Mitochondrial Function Via PPAR-Α and PGC-1. Nat Med 2011; 17(9): 1076-85.
9- Salvatore T, Pafundi PC, Galiero R, Albanese G, Di Martino A, Caturano A, et al. The Diabetic Cardiomyopathy: The Contributing Pathophysiological Mechanisms. Front Med 2021; 8: 695792.
10- Shen Y, Xu X, Yue K, Xu G. Effect of Different Exercise Protocols on Metabolic Profiles and Fatty Acid Metabolism in Skeletal Muscle in High Fat Dietn Fed Rats. Obesity 2015; 23(5): 1000-6.
11- Kaelin Jr WG, Ratcliffe PJ. Oxygen Sensing by Metazoans: The Central Role of the HIF Hydroxylase Pathway. Mol Cell 2008; 30(4): 393-402.
12- Jewell UR, Kvietikova IV, Scheid AN, Bauer CH, Wenger RH, Gassmann M. Induction of HIF–1α In Response to Hypoxia is Instantaneous. FASEB J 2001; 15(7): 1312-4.
13- Bostrom P, Magnusson B, Svensson PA, Wiklund O, Borén J, Carlsson LM, et al. Hypoxia Converts Human Macrophages into Triglyceride-Loaded Foam Cells. Arterioscler Thromb Vasc Biol 2006; 26(8): 1871-6.
14- Sun RC, Denko NC. Hypoxic Regulation of Glutamine Metabolism through HIF1 and SIAH2 Supports Lipid Synthesis that is Necessary for Tumor Growth. Cell Metab 2014; 19(2): 285-92.
15- Huang D, Li T, Li X, Zhang L, Sun L, He X, Zhong X, Jia D, Song L, Semenza GL, Gao P. HIF-1-Mediated Suppression of Acyl-Coa Dehydrogenases and Fatty Acid Oxidation is Critical for Cancer Progression. Cell Rep 2014; 8(6): 1930-42.
16- Mylonis I, Sembongi H, Befani C, Liakos P, Siniossoglou S, Simos G. Hypoxia Causes Triglyceride Accumulation by Hif-1-Mediated Stimulation of Lipin 1 Expression. J Cell sci 2012; 125(14): 3485-93.
17- Hölscher M, Schäfer K, Krull S, Farhat K, Hesse A, Silter M, et al. Unfavourable Consequences of Chronic Cardiac HIF-1α Stabilization. Cardiovascular Research 2012; 94(1): 77-86.
18- Perman JC, Boström P, Lindbom M, Lidberg U, StÅhlman M, Hägg D, et al. The VLDL Receptor Promotes Lipotoxicity and Increases Mortality in Mice Following an Acute Myocardial Infarction. The Journal of Clinical Investigation 2011; 121(7): 2625-40.
19- Belanger AJ, Luo Z, Vincent KA, Akita GY, Cheng SH, Gregory RJ, Jiang C. Hypoxia-Inducible Factor 1 Mediates Hypoxia-Induced Cardiomyocyte Lipid Accumulation by Reducing the DNA Binding Activity of Peroxisome Proliferator-Activated Receptor Α/Retinoid X Receptor. Biochemical and Biophysical Research Communications 2007; 364(3): 567-72.
20- Suzuki T, Shinjo S, Arai T, Kanai M, Goda N. Hypoxia and Fatty Liver. World Journal of Gastroenterology: WJG 2014; 20(41): 15087.
21- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, Czech MP. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
22- Mounier R, Pialoux V, Roels B, Thomas C, Millet G, Mercier J, Coudert J, Fellmann N, Clottes E. Effect of Intermittent Hypoxic Training on HIF Gene Expression in Human Skeletal Muscle and Leukocytes. European J Applied Physiology 2009; 105(4): 515-24.
23- Hallsworth K, Thoma C, Hollingsworth KG, Cassidy S, Anstee QM, Day CP, Trenell MI. Modified High-Intensity Interval Training Reduces Liver Fat and Improves Cardiac Function in Non-Alcoholic Fatty Liver Disease: A Randomized Controlled Trial. Clinical science 2015; 129(12): 1097-105.
24- Motta VF, Aguila MB, Mandarim-De-Lacerda CA. High-Intensity Interval Training (Swimming) Significantly Improves the Adverse Metabolism and Comorbidities in Diet-Induced Obese Mice. The Journal of Sports Medicine and Physical Fitness 2015.
25- Cho J, Koh Y, Han J, Kim D, Kim T, Kang H. Adiponectin Mediates the Additive Effects of Combining Daily Exercise with Caloric Restriction for Treatment of Non-Alcoholic Fatty Liver. Int J Obes 2016; 40(11): 1760-7.
26- Marcinko K, Sikkema SR, Samaan MC, Kemp BE, Fullerton MD, Steinberg GR. High Intensity Interval Training Improves Liver and Adipose Tissue Insulin Sensitivity. Mol Metab 2015; 4(12): 903-15.
27- PITHON-CURI TN. Aprogram of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res 2007; 21(3): 751-6.
28- Krug AL, Macedo AG, Zago AS, Rush JW, Santos CF, Amaral SL. High Intensity Resistance Training Attenuates Dexamethasone Induced Muscle Atrophy. Muscle Nerve 2016; 53(5): 779-88.
29- Mattijssen F, Georgiadi A, Andasarie T, Szalowska E, Zota A, Krones-Herzig A, et al. Hypoxia-Inducible Lipid Droplet-Associated (HILPDA) Is A Novel Peroxisome Proliferator-Activated Receptor (PPAR) Target Involved in Hepatic Triglyceride Secretion. J Biol Chem 2014; 289(28): 19279-93.
30- Suk M, Shin Y. Effect of High-Intensity Exercise and High-Fat Diet on Lipid Metabolism in the Liver of Rats. J Exerc Nutrition & Biochem 2015; 19(4): 289-95.
31- Sohrabipour S, Sharifi MR, Talebi A, Sharifi M, Soltani N. GABA Dramatically Improves Glucose Tolerance in Streptozotocin-Induced Diabetic Rats Fed with High-Fat Diet. Eur J Pharmacol 2018; 826: 75-84.
32- Löfgren L, Forsberg GB, Ståhlman M. The BUME Method: A New Rapid and Simple Chloroform-Free Method for Total Lipid Extraction of Animal Tissue. Sci Rep 2016; 10; 6(1): 1-1.
33- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, Czech MP. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
34- Majmundar AJ, Wong WJ, Simon MC. Hypoxia-Inducible Factors and the Response to Hypoxic Stress. Molecular Cell 2010; 40(2): 294-309.
35- Cole MA, Jamil AH, Heather LC, Murray AJ, Sutton ER, Slingo M, et al. On the Pivotal Role of Ppara in Adaptation of the Heart to Hypoxia and Why Fat in the Diet Increases Hypoxic Injury. FASEB J 2016; 30(8): 2684-97
36- Mylonis I, Sembongi H, Befani C, Liakos P, Siniossoglou S, Simos G. Hypoxia Causes Triglyceride Accumulation by HIF-1-Mediated Stimulation of Lipin 1 Expression. J Cell Sci 2012; 125(pt14): 3485-93.
37- Piguet AC, Stroka D, Zimmermann A, Dufour JF. Hypoxia Aggravates Non-Alcoholic Steatohepatitis in Mice Lacking Hepatocellular PTEN. Clin Sci 2010; 118(6): 401-10.
38- Rankin EB, Rha J, Selak MA, Unger TL, Keith B, Liu Q, Haase VH. Hypoxia-Inducible Factor 2 Regulates Hepatic Lipid Metabolism. Mol Cell Biol 2009; 29(16): 4527-38.
39- Mattijssen F, Georgiadi A, Andasarie T, Szalowska E, Zota A, Krones-Herzig A, et al. Hypoxia-Inducible Lipid Droplet-Associated (HILPDA) is a Novel Peroxisome Proliferator-Activated Receptor (PPAR) Target Involved in Hepatic Triglyceride Secretion. J Biol Chem 2014; 289(28): 19279-93.
40- Lunde IG, Anton SL, Bruusgaard JC, Rana ZA, Ellefsen S, Gundersen K. Hypoxia Inducible Factor 1α Links Fast‐Patterned Muscle Activity and Fast Muscle Phenotype in Rats. J physiol 2011; 589(6): 1443-54.
41- Rodriguez-Miguelez P, Lima-Cabello E, Martínez-Flórez S, Almar M, Cuevas MJ, González-Gallego J. Hypoxia-Inducible Factor-1 Modulates the Expression of Vascular Endothelial Growth Factor and Endothelial Nitric Oxide Synthase Induced By Eccentric Exercise. J Appl Physiol 2015; 118(8): 1075-83.
42- Flora R, Freisleben HJ, Ferdinal F, Wanandi SI, Sadikin M. Correlation of Hypoxia Inducible Factor-1Î and Vascular Endothelium Growth Factor In Rat Myocardium During Aerobic And Anaerobic Exercise. Med J Indonesia 2012; 21(3): 133-40.
43- Mounier R, Pialoux V, Roels B, Thomas C, Millet G, Mercier J, Coudert J, Fellmann N, Clottes E. Effect of Intermittent Hypoxic Training on HIF Gene Expression in Human Skeletal Muscle and Leukocytes. Eur J Appl Physiol 2009; 105(4): 515-24.
44- DiStefano MT, Danai LV, Flach RJ, Chawla A, Pedersen DJ, Guilherme A, et al. The Lipid Droplet Protein Hypoxia-Inducible Gene 2 Promotes Hepatic Triglyceride Deposition by Inhibiting Lipolysis. J Biol Chem 2015; 290(24): 15175-84.
45- Boutcher SH. High-Intensity Intermittent Exercise and Fat Loss. J Obesity 2011; 2011: 1-10.
46- Charbonneau A, Melancon A, Lavoie C, Lavoie JM. Alterations in Hepatic Glucagon Receptor Density and in Gsα and Giα2 Protein Content with Diet-Induced Hepatic Steatosis: Effects of Acute Exercise. American J Physiology-Endocrinology Metabolism 2005; 289(1): E8-14.
47- Trapp EG, Chisholm DJ, Freund J, Boutcher SH. The Effects of High-Intensity Intermittent Exercise Training on Fat Loss and Fasting Insulin Levels of Young Women. Int J Obes 2008; 32(4): 684-91.
48- Houghton D, Thoma C, Hallsworth K, Cassidy S, Hardy T, Burt AD, et al. Exercise Reduces Liver Lipids and Visceral Adiposity in Patients with Nonalcoholic Steatohepatitis in a Randomized Controlled Trial. Clin Gastroenterol Hepatol 2017; 15(1): 96-102.
49- Chapados NA, Seelaender M, Levy E, Lavoie JM. Effects of Exercise Training on Hepatic Microsomal Triglyceride Transfer Protein Content in Rats. Horm Metab Res 2009; 41(04): 287-93.
50- Boudou P, Sobngwi E, Mauvais-Jarvis F, Vexiau P, Gautier JF. Absence of Exercise-Induced Variations in Adiponectin Levels despite Decreased Abdominal Adiposity and Improved Insulin Sensitivity in Type 2 Diabetic Men. Eur J Endocrinol 2003; 149(5): 421-4.
51- Marcinko K, Sikkema SR, Samaan MC, Kemp BE, Fullerton MD, Steinberg GR. High Intensity Interval Training Improves Liver and Adipose Tissue Insulin Sensitivity. Mol Metab 2015; 4(12): 903-15.
52- Nevill ME, Holmyard DJ, Hall GM, Allsop P, Van Oosterhout A, Burrin JM, Nevill AM. Growth Hormone Responses to Treadmill Sprinting in Sprint-and Endurance-Trained Athletes. Eur J Appl Physiol Occup Physiol 1996; 72(5): 460-7.
53- Verdijk LB, Gleeson BG, Jonkers RA, Meijer K, Savelberg HH, Dendale P, et al. Skeletal Muscle Hypertrophy Following Resistance Training is accompanied by a Fiber Type–Specific Increase in Satellite Cell Content in Elderly Men. J Gerontol Series A: Biol Sci Med Sci 2009; 64(3): 332-9.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1400/11/18 | پذیرش: 1401/3/29 | انتشار: 1401/7/15
دریافت: 1400/11/18 | پذیرش: 1401/3/29 | انتشار: 1401/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







