دوره 30، شماره 8 - ( آبان 1401 )
جلد 30 شماره 8 صفحات 5130-5120 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Karimi M, Gheini M H, Taleahmad F, Roghani M. Effect of Trigonelline on Dendritic Morphology in the Hippocampus and Prefrontal Cortex in Streptozotocin-Induced Diabetic Rats. JSSU 2022; 30 (8) :5120-5130
URL: http://jssu.ssu.ac.ir/article-1-5645-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5645-fa.html
کریمی محسن، قینی محمدحسین، طالع احمد فاطمه، روغنی مهرداد. اثر تریگونلین بر مورفولوژی دندریتی در هیپوکامپ و قشر پرهفرونتال در موش صحرایی دیابتی شده با استرپتوزوتوسین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (8) :5120-5130
متن کامل [PDF 738 kb]
(629 دریافت)
| چکیده (HTML) (1722 مشاهده)
References:
1- Blair M. Diabetes Mellitus Review. Urologic Nursing Journal 2016; 36(1): 27-36.
2- Li Z, Cheng Y, Wang D, Chen H, Chen H, Ming W-k, et al. Incidence Rate of Type 2 Diabetes Mellitus after Gestational Diabetes Mellitus: A Systematic Review and Meta-Analysis of 170,139 Women. J Diabetes Res 2020; 2020: 3076463.
3- Guariguata L, Whiting DR, Hambleton I, Beagley J, Linnenkamp U, Shaw JE. Global Estimates of Diabetes Prevalence for 2013 and Projections for 2035. Diabetes Res Clin Pract 2014; 103(2): 137-49.
4- Martínez-Tellez R, de Jesús Gómez-Villalobos M, Flores G. Alteration in Dendritic Morphology of Cortical Neurons in Rats with Diabetes Mellitus Induced by Streptozotocin. Brain Res 2005; 1048(1-2): 108-15.
5- Joghataie MT, Roghani M, Jalali MR, Baluchnejadmojarad T, Sharayeli M. Dendritic Spine Changes in Medial Prefrontal Cortex of Male Diabetic Rats Using Golgi-Impregnation Method 2007; 10(1): 54-8.
6- Biessels GJ, Kerssen A, De Haan EH, Kappelle LJ. Cognitive Dysfunction and Diabetes: Implications for Primary Care. Prim Care Diabetes 2007; 1(4): 187-93.
7- Maritim AC, Sanders RA, Watkins JB 3rd. Diabetes, Oxidative Stress, and Antioxidants: A Review. J Biochem Mol Toxicol 2003; 17(1): 24-38.
8- Evans JL, Goldfine ID, Maddux BA, Grodsky GM. Oxidative Stress and Stress-Activated Signaling Pathways: A Unifying Hypothesis of Type 2 Diabetes. Endocrine Reviews 2002; 23(5): 599-622.
9- Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free Radicals and Antioxidants in Normal Physiological Functions and Human Disease. Int J Biochem Cell Biol 2007; 39(1): 44-84.
10- Van Dam PS, Cotter MA, Bravenboer B, Cameron NE. Pathogenesis of Diabetic Neuropathy: Focus on Neurovascular Mechanisms. Eur J pharmacol 2013; 719(1-3): 180-6.
11- McEwen BS, Bowles NP, Gray JD, Hill MN, Hunter RG, Karatsoreos IN, et al. Mechanisms of Stress in the Brain. Nat Neurosci 2015; 18(10): 1353-63.
12- Tata DA, Anderson BJ. The Effects of Chronic Glucocorticoid Exposure on Dendritic Length, Synapse Numbers and Glial Volume in Animal Models: Implications for Hippocampal Volume Reductions in Depression. Physiol behav 2010; 99(2): 186-93.
13- Bosi E. Metformin--The Gold Standard in Type 2 Diabetes: What Does the Evidence Tell Us? 2009; 11 Suppl 2: 3-8.
14- Kuan IH, Savage RL, Duffull SB, Walker RJ, Wright DF. The Association between Metformin Therapy and Lactic Acidosis. Drug Safety 2019; 42(12): 1449-69.
15- German Diabetes Association, Matthaei S, Bierwirth R, Fritsche A, Gallwitz B, Häring HU, et al. Medical Antihyperglycaemic Treatment of Type 2 Diabetes Mellitus: Update of the Evidence-Based Guideline of the German Diabetes Association. Exp Clin Endocrinol Diabetes 2009; 117(09): 522-57.
16- Kamble HV, Bodhankar SL. Antihyperglycemic Activity of Trigonelline and Sitagliptin in Nicotinamide-Streptozotocin Induced Diabetes in Wistar Rats. Biomedicine & Aging Pathology 2013; 3(3): 125-30.
17- Subramanian SP, Prasath GS. Antidiabetic And Antidyslipidemic Nature of Trigonelline, a Major Alkaloid of Fenugreek Seeds Studied in High-Fat-Fed and Low-Dose Streptozotocin-Induced Experimental Diabetic Rats. Biomedicine & Preventive Nutrition 2014; 4(4): 475-80.
18- Ashihara H, Deng WW, Nagai C. Trigonelline Biosynthesis and the Pyridine Nucleotide Cycle in Coffea Arabica Fruits: Metabolic Fate of [Carboxyl-14C] Nicotinic Acid Riboside. Phytochemistry Letters 2011; 4(3): 235-9.
19- Christen P. Trigonella Species: In Vitro Culture and Production of Secondary Metabolites. Medicinal and Aromatic Plants XII: Springer 2002; 51: 306-27.
20- Van Dijk AE, Olthof MR, Meeuse JC, Seebus E, Heine RJ, Van Dam RM. Acute Effects of Decaffeinated Coffee and the Major Coffee Components Chlorogenic Acid and Trigonelline on Glucose Tolerance. Diabetes Care 2009; 32(6): 1023-5.
21- Hamadi SA. Effect of Trigonelline and Ethanol Extract of Iraqi Fenugreek Seeds on Oxidative Stress in Alloxan Diabetic Rabbits. J Association of Arab Universities for Basic and Applied Sciences 2012; 12(1): 23-6.
22- Zhou J, Zhou S, Zeng S. Experimental Diabetes Treated with Trigonelline: Effect on Β Cell and Pancreatic Oxidative Parameters. Fundamental & Clinical Pharmacology 2013; 27(3): 279-87.
23- Vellai RD, Chandiran S, Pillai SS. GTF-231, A Mixture of Gymnemic Acid, Trigonelline and Ferulic Acid Significantly Ameliorates Oxidative Stress in Experimental Type 2 Diabetes in Rats. Can J Diabetes 2018; 42(3): 237-44.
24- Hamden K, Bengara A, Amri Z, Elfeki A. Experimental Diabetes Treated with Trigonelline: Effect on Key Enzymes Related to Diabetes and Hypertension, Β-Cell and Liver Function. Mol Cell Biochem 2013; 381(1): 85-94.
25- Mirzaie M, Khalili M, Kiasalari Z, Roghani M. Neuroprotective and Antiapoptotic Potential of Trigonelline in a Striatal 6-Hydroxydopamine Rat Model of Parkinson’s Disease. Neurophysiology 2016; 48(3): 176-83..
26- Gaur V, Bodhankar SL, Mohan V, Thakurdesai PA. Neurobehavioral Assessment of Hydroalcoholic Extract of Trigonella Foenum-Graecum Seeds in Rodent Models of Parkinson’s Disease. Pharm Biol 2013; 51(5): 550-7.
27- Albazal A, Delshad A-A, Roghani M. Melatonin Reverses Cognitive Deficits in Streptozotocin-Induced Type 1 Diabetes in the Rat Through Attenuation of Oxidative Stress and Inflammation. J Chem Neuroanat 2021; 112: 101902.
28- Graham ML, Janecek JL, Kittredge JA, Hering BJ, Schuurman H-J. The Streptozotocin-Induced Diabetic Nude Mouse Model: Differences between Animals from Different Sources. Comp Med 2011; 61(4): 356-60.
29- Torabi T, Azizzadeh Delshad A, Roghani M. Dietary Restriction Prevents Dendritic Changes of Pyramidal Neurons in Hippocampal and Prefrontal Cortex in Diabetic Rat. J Basic and Clinical Pathophysiology 2019; 7(2): 28-32.
30- Lorenzon dos Santos J, Schaan de Quadros A, Weschenfelder C, Bueno Garofallo S, Marcadenti A. Oxidative Stress Biomarkers, Nut-Related Antioxidants, and Cardiovascular Disease. Nutrients 2020; 12(3): 682.
31- Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, Bennett DL, et al. Diabetic Neuropathy. Nature Reviews Disease Primers 2019; 5(1): 41.
32- Dann SG, Selvaraj A, Thomas G. mTor Complex1–S6K1 Signaling: At the Crossroads of Obesity, Diabetes and Cancer. Trends in Molecular Medicine 2007; 13(6): 252-9.
33- Bathina S, Das UN. Dysregulation of Pi3k-Akt-Mtor Pathway in Brain of Streptozotocin-Induced Type 2 Diabetes Mellitus in Wistar Rats. Lipids in Health and Disease 2018; 17(1): 168.
34- Mueller SG, Weiner MW. Selective Effect of Age, Apo E4, and Alzheimer's disease on Hippocampal Subfields. Hippocampus 2009; 19(6): 558-64.
35- Xu G, Perez-Pinzon MA, Sick TJ. Mitochondrial Complex I Inhibition Produces Selective Damage to Hippocampal Subfield CA1 in Organotypic Slice Cultures. Neurotox Res 2003; 5(7): 529-38.
36- Mastrocola R, Restivo F, Vercellinatto I, Danni O, Brignardello E, Aragno M, et al. Oxidative and Nitrosative Stress in Brain Mitochondria of Diabetic Rats. J Endocrinol 2005; 187(1): 37-44.
37- Hong BN, Yi TH, Park R, Kim SY, Kang TH. Coffee Improves Auditory Neuropathy in Diabetic Mice. Neurosci lett 2008; 441(3): 302-6.
38- Gulledge TV, Collette NM, Mackey E, Johnstone SE, Moazami Y, Todd DA, et al. Mast Cell Degranulation and Calcium Influx are Inhibited by an Echinacea Purpurea Extract and the Alkylamide Dodeca-2E, 4E-Dienoic Acid Isobutylamide. J Ethnopharmacology 2018; 212: 166-74.
39- Tohda C, Kuboyama T, Komatsu K. Search for Natural Products Related to Regeneration of the Neuronal Network. Neurosignals 2005; 14(1-2): 34-45.
40- Qiu Z, Wang K, Jiang C, Su Y, Fan X, Li J, et al. Trigonelline Protects Hippocampal Neurons from Oxygen-Glucose Deprivation-Induced Injury through Activating the PI3K/Akt Pathway. Chem Biol Interact 2020; 317: 108946.
متن کامل: (636 مشاهده)
مقدمه
دیابت قندی یک اختلال متابولیک شایع میباشد که به علت ترکیبی از اختلالات، شامل فقدان نسبی انسولین، ایجاد مقاومت به اثرات این هورمون یا تولید بیش از حد گلوکز توسط کبد بروز میکند (1). برآورد میشود که شیوع بیماری دیابت قندی تا سال 2030 به بیش از 366 میلیون نفر برسد. میزان مرگ و میر و ابتلا به دیابت، بهواسطه عوارض متعددی همچون واسکولوپاتی دیابتی، رتینوپاتی، نفروپاتی و نوروپاتی محیطی تعیین میشود (2،3). با توجه به مطالعات انجام شده دیابت، سیستم عصبی مرکزی (CNS) را درگیر میکند و موجب تغییرات پاتولوژیک موسوم به آنسفالوپاتی دیابتی می-گردد و با نقصانهای حقیقی در ادراک و شناخت بیمار و پاتولوژی عصب متمایز میگردد (4،5). شایعترین عوارض مغزی دیابت شامل افت عملکرد شناختی و افسردگی است (6). ﻫﯿﭙﺮگلیسمی، ﻣﻬﻢﺗﺮیﻦ دﻟﯿﻞ اﻟﻘای اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ در ﺣﯿﻦ دیﺎﺑﺖ ﺑﻮده و از ﻃﺮیﻖ مکانیسمﻫﺎی آﻧﺰیﻤﯽ و ﻏﯿﺮ آنزیمی، ﻣﻨﺠﺮ ﺑﻪ ﺗﻮﻟﯿﺪ ﺑﯿﺶ از ﺣﺪ رادیﮑﺎل¬ﻫﺎی آزاد اﮐﺴﯿﮋن میگردد (7). فعالسازی مسیرهای حساس به استرس مثلNF-κB) )،(AGE/RAGE) و پروتئینکیناز C در اثر استرس اکسیداتیو سبب ﻓﻌﺎلﺷﺪن پیامهای مسیر آپوپتوز ﺳﻠﻮﻟﯽ در ﺑﺎﻓﺖ ﻣﻐﺰ و ﻣﺮگ ﻧﻮرونﻫﺎ میشود (8). ﺑﺎﻓﺖ ﻣﻐﺰ دارای اسیدﻫﺎی ﭼﺮب ﻏﯿﺮاﺷﺒﺎع ﻓﺮاوان و سیستم آنتیاکسیدانی ضعیف می¬باشد. و به دلیل مصرف زیاد اکسیژن ﺑﻪ شدت در ﻣﻌﺮض آسیب اکسیداتیو قرار میگیرد (9). ﻗﺸﺮ ﻣﻐﺰ و ﻫﯿﭙﻮﮐﺎمپ بیشتر از ﺳﺎیﺮ ﻣﻨﺎﻃﻖ ﻣﻐﺰ تحت تاثیر اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ و ﭘﺮاﮐﺴﯿﺪاﺳﯿﻮن ﻟﯿﭙﯿﺪی ﻧﺎﺷﯽ از ﻫﯿﭙﺮﮔﻠﯿﺴﻤﯽ می-باشند (10). مواجهه طولانیمدت با استرس اکسیداتیو منجر به یک سری تغییرات نوروپلاستیک در نواحی مغزی حساس به استرس، مانند هیپوکامپ میشود. و پلاستیسیتی عصبی در پاسخ به عوامل محیطی مثل رژیم غذایی و همچنین تحریکات ایمنی و اندوکرین تحت تاثیر قرار میگیرد (11). از نظر بالینی، کاهش حجم هیپوکامپ در مطالعات تصویربرداری مغز در طی افسردگی و دیابت شواهدی مشابه مدلهای حیوانی مواجه شده با استرس را نشان داده است (12). هدف از مراقبت در بیماران مبتلا به دیابت، حذف علائم و جلوگیری و یا به حداقل رساندن سرعت ایجاد عوارض است. به طورکلی شروع زودرس درمان دارویی در بیماران دیابتی، عوارض درازمدت را کاهش میدهد. داروهای جدیدتر شامل آگونیستهای پپتید شبه گلوکاگون، آگونیستهای دوپامین در درمان دیابت مورد استفاده قرار می¬گیرند (13). برخی عوارض جانبی این داروها مانند هیپوگلیسمی، عوارض گوارشی، طعم فلزی دهان، اسیدوز لاکتیک، نارسایی کلیوی، تشدید نارسایی قلبی گزارش شدهاند (14،15). دانشمندان همواره در تلاش برای دستیابی به ترکیبات گیاهی و طبیعی مفید جهت کاهش دیابت بودهاند. از جمله ترکیبات گیاهی با اثرات هیپوگلیسمیک آلکالوئید تریگونلین می¬باشد (16،17). تریگونلین نخستین بار از گیاه شنبلیله (Trigonella foenum-graceum) استخراج شد و در دانه قهوه، خربزه زمستانی، و گونه حیوانی مانند توتیا و ستاره دریایی مشاهده شده است (18،19). با توجه به آزمایشات انجام شده مشخص شد که مصرف تریگونلین بهطور قابلتوجهی سطح گلوکز و انسولین را 15 دقیقه بعد از تست تحمل گلوکز در مقایسه با دارونما کاهش داد (20). همچنین برخی مطالعات نیز اثرات تریگونلین را در کاهش مارکرهای استرس اکسیداتیو در موشهای دیابتی نشان دادهاند (21). نتایج به دست آمده نشان میدهد که تریگونلین اثرات مفیدی را در درمان دیابت از طریق کاهش سطوح گلوکز و چربی خون، افزایش حساسیت به انسولین و میزان انسولین، افزایش فعالیت آنزیمهای آنتیاکسیدان و کاهش پراکسیداسیون لیپیدی اعمال میکند (24-22). مطالعات گوناگونی اثرات حفاظتکننده عصبی تریگونلین را در اختلالات مختلف سیستم عصبی مرکزی و محیطی مورد بررسی قرار دادهاند. تریگونلین دارای اثرات ضداکسیدانی قوی میباشد و با توجه به مطالعات انجام شده یک اثر محافظتی عصبی در بیماری پارکینسون را نشان داده است (25،26). با توجه به اختلالات سیستم عصبی مرکزی مشاهده شده در دیابت و محدود بودن مطالعات انجام شده در این زمینه، ما برای اولین بار اثر پیشگیریکننده و حفاظتی تریگونلین بر تغییرات مورفولوژیک نورونهای هیپوکامپ و قشر پرهفرونتال بهدنبال القای دیابت قندی با استرپتوزوتوسین را مورد بررسی قرار دادیم.
روش بررسی
در این مطالعه تجربی، تعداد 32 سر موش نر، نژاد ویستار، در محدوده وزنی 235-195 گرم بهطور تصادفی به 4 گروه شامل: کنترل، کنترل تحت تیمار با تریگونلین، دیابتی و دیابتی تحت تیمار با تریگونلین تقسیم شدند و در مرکز مطالعات حیوانی دانشگاه شاهد، در دمای 24-22 درجه سانتیگراد نگهداری شدند. حیوانات آزادانه به آب لولهکشی و غذای مخصوص موش (شرکت خوراک دام پارس، کرج) به مدت 10 هفته دسترسی داشتند. تیمار با تریگونلین (حل شده در آب مقطر) به فرم خوراکی به میزان 50 میلیگرم بر کیلوگرم در روز به مدت 7 هفته ادامه یافت. وزن حیوانات و پارامتر میزان گلوکز سرم در ابتدای کار، و در هفتههای 4 و 8 پس از القای دیابت نیز مورد اندازهگیری قرار گرفت. برای بررسی دندریتهای نورونی پس از کشتن حیوانات با روش پرفیوژن از طریق قلب، از روش رنگآمیزی گلژی استفاده گردید.
دیابتی کردن موشها و اندازهگیری گلوکز سرم
در این بررسی از آن دسته موشهایی که در شرایط طبیعی، بدون برقراری حالت روزهداری، میزان گلوکز سرم آنها کمتر از250 میلیگرم بر دسیلیتر بود استفاده شد. در این خصوص از شبکه رترواوربیتال و لوله موئینه برای خونگیری استفاده شد. برای دیابتی نمودن موشها، از داروی استرپتوزوتوسین به صورت تک دوز، داخل صفاقی به میزان 60 میلیگرم بر کیلوگرم حل شده در محلول سالین فیزیولوژیک سرد استفاده شد (27). استرپتوزوتوسین بهعنوان یک داروی شیمیدرمانی در درمان کارسینوم سلول بتای پانکراس بهکار میرود. استرپتوزوتوسین به سلولهای بتای پانکراس آسیب میزند و سبب هیپوانسولینمی و هیپرگلیسمی میگردد (28). اندازهگیری میزان گلوکز سرم توسط روش آنزیمی گلوکز اکسیداز (زیست شیمی) قبل از انجام کار و در هفتههای 4 و 8 با استفاده از اسپکتروفتومتر (اسپکترونیک 20، آمریکا) انجام شد. وزن حیوانات نیز ابتدا در هفته قبل از القای دیابت و سپس در هفتههای 4 و 8 پس از القای دیابت مورد سنجش قرار گرفت.
روش رنگآمیزی گلژی
روش رنگآمیزی نقره گلژی بر پایه تشکیل رسوبات کدر کرومات نقره که بهوسیله واکنش بین پتاسیمدیکرومات و نیترات نقره شکل میگیرد (واکنش سیاه) میباشد (29). پس از انجام پرفیوژن ترانسکاردیال و عبور 50 میلیلیتر محلول سالین نرمال و 100 میلیلیتر محلول فیکساتیو شامل پارافرم آلدئید 4% در بافر فسفات 0/1 مولار، مغز موشها از جمجمه خارج شد و به داخل ظرف حاوی رنگ گلژی شامل پتاسیمدیکرومات، مرکوری کلرید، پتاسیم کرومات، و پتاسیم تنگستات در آب دو بار تقطیر در دمای 25-20 درجه سانتیگراد بهمدت 2 هفته در تاریکی قرار داده شد. و پس از 5-4 بار شستوشو در آب مقطر، در محلول حاوی لیتیوم هیدروکسید و پتاسیم نیترات در آب مقطر به مدت 3-2 روز قرار داده شدند. در مرحله بعدی، برشگیری با استفاده از میکروتوم فریزینگ در دمای 20- درجه سانتیگراد انجام پذیرفت و برشهای بافتی به ضخامت 100 میکرومتر بر روی لام قرار گرفته و پس از طی مراحل آبگیری و شفافسازی در محلولهای اتانول و گزیلول و قرار دادن لامل با استفاده از چسب انتلان، بررسی میکروسکوپی در مورد نمونهها با استفاده از میکروسکوپ Bell در بزرگنمایی کل 400 و 1000 انجام شد. برای بررسی و شمارش خارهای دندریتی، تنها نورونهایی مورد بررسی قرار گرفتند که در روش رنگآمیزی بهطور کامل سیاه رنگ شدند و تمام انشعابات دندریتی در برشها مشاهده گردید. به علاوه، تمام برجستگیهای دندریتی بهصورت نازک یا عصایی شکل دارا یا فاقد برجستگیهای انتهایی در یک طول معین مورد شمارش قرار گرفتند. تعداد متوسط خار در یک طول معین در مورد حداقل10 نورون از دو ناحیه قشر مغز و هیپوکامپ ناحیه (CA1) مورد شمارش قرار گرفت. برای انجام اندازهگیریهای کمی در مورد تصاویر میکروسکوپی نیز از نرمافزار Image tool نسخه 3 استفاده گردید.
تجزیه و تحلیل آماری
برای تجزیه و تحلیل دادههای حاصل از این پژوهش از نرمافزار آماری version 16 SPSS استفاده شد. از نظر آماری، تمامی نتایج به صورت میانگین ± انحراف معیار بیان گردید. در قسمت آمار تحلیلی پس از مشخص نمودن توزیع دادهها، برای مقایسه نتایج هر پارامتر در هر یک از گروهها قبل و بعد از بررسی از آزمون آنووا با اندازهگیری مکرر و برای مقایسه گروهها با هم در هر یک از دورههای زمانی از آزمون آنووا یکطرفه و آزمون توکی استفاده گردید. بهعلاوه سطح معنیدار (p<0/05) برای تمامی آنالیزها در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط کمیته اخلاق دانشگاه شاهد تایید شده است (کد اخلاق IR.SHAHED.REC.1395.205).
نتایج
نتایج حاصل از اثر تریگونلین بر وزن موشها
وزن حیوانات در هفته قبل از بررسی و هفتههای چهارم و هشتم پس از بررسی در تمام گروهها اندازهگیری شد. نتایج بهدست آمده نشان داد که میزان وزن در هفته قبل از بررسی تفاوت معنیدار بین گروهها نشان نمیدهد، در حالیکه در طی هفتههای چهارم و هشتم تفاوت معنیدار بین گروهها مشاهده گردید. در این خصوص، در هفته هشتم، گروه دیابتی یک کاهش بارز و معنیدار(p<0/01) در مقایسه با گروه کنترل نشان داد. همچنین، هر چند در هفته چهارم نیز این کاهش وجود داشت ولی تفاوت موجود به سطح معنیدار نرسید. از طرف دیگر، تفاوت موجود بین دو گروه دیابتی و دیابتی تحت درمان با تریگونلین در هفتههای چهارم و هشتم در حد معنیدار بود (p<0/01) از سوی دیگر، در گروه کنترل تیمار شده با تریگونلین در همین هفتهها تغییر معنیدار در مقایسه با گروه کنترل تیمار نشده مشاهده نشد.
نتایج حاصل از اثر تریگونلین بر میزان گلوکز سرم
در بررسی نتایج حاصل از اثر تریگونلین بر میزان گلوکز سرم با توجه به نمودار2، با اندازهگیری میزان گلوکز سرم در هفتههای قبل از بررسی و هفته چهارم و هشتم پس از بررسی در تمام گروهها مشخص شد که در هفته قبل از بررسی تفاوت معنیدار بین گروهها مشاهده نشد. بهعلاوه، در هفته هشتم میزان گلوکز سرم در دو گروه دیابتی و دیابتی تحت تیمار با تریگونلین بهطور بسیار بارز و معنیدار بیشتر از نتایج هفته قبل از کار بود (p<0/001) در حالیکه گروه کنترل تحت تیمار تفاوت معنیدار را در مقایسه با گروه کنترل نشان نداد. بهعلاوه، تیمار با تریگونلین در گروه دیابتی در همین دوره زمانی کاهش معنیدار در میزان گلوکز سرم در موشها در مقایسه با گروه دیابتی تیمار نشده را نشان داد(p<0/01) .
نتایج حاصل از اثر تریگونلین بر وضعیت مورفولوژیک نورونی هیپوکامپ در روش رنگآمیزی گلژی
با بررسی میکروسکوپی تراکم خارهای دندریتی در نورونهای هرمی شکل ناحیه Cornu Ammonis 1 (CA1) با توجه به نمودار 3 و شکل 1، مشخص شد که تفاوت معنیدار بین گروه کنترل تحت تیمار با تریگونلین و کنترل یافت نمیشود، گروه دیابتی یک کاهش معنیدار از این نظر در مقایسه با گروه کنترل نشان داد (p<0/01). بهعلاوه در گروه دیابتی تیمارشده با تریگونلین کاهش معنیدار خارهای دندریتی در مقایسه با گروه کنترل مشاهده نشد. همچنین در گروه دیابتی تیمارشده با تریگونلین تراکم خارهای دندریتی در حد معنیدار بیشتر از گروه دیابتی بود (p<0/05)
نتایج حاصل از اثر تریگونلین بر وضعیت مورفولوژیک نورونی قشر پرهفرونتال در رنگآمیزی گلژی
در بررسی میکروسکوپ نوری برشهای تهیه شده از ناحیه پرهفرونتال قشر مغز در لایه V با توجه به نمودار 4 و شکل 2، این ناحیه از نظر تراکم خارهای دندریتی مربوط به نورونهای پیرامیدال ناحیه مذکور، مشخص گردید که تفاوت معنیدار بین دو گروه کنترل تحت تیمار با تریگونلین و کنترل یافت نمیشود، گروه دیابتی یک کاهش معنیدار از این نظر در مقایسه با گروه کنترل نشان داد (01/0p<). به علاوه در گروه دیابتی تیمارشده با تریگونلین کاهش معنیدار خارهای دندریتی در مقایسه با گروه کنترل مشاهده نشد. همچنین در گروه دیابتی تیمارشده با تریگونلین تراکم خارهای دندریتی درحد معنیدار بیشتر از گروه دیابتی بود (05/0p<).

نمودار1: میزان تغییرات وزن در هفتههای مختلف در موش صحرایی دیابتی تحت تیمار در مقایسه با گروه دیابتی در همان هفته
* * 01/0p< (در مقایسه با سطح پایه در همان گروه)، ## p<0/01 (در مقایسه با سطح پایه در همان گروه)

نمودار2: میزان تغییرات گلوکز سرم در هفتههای مختلف در موش صحرایی دیابتی تحت تیمار در مقایسه با گروه دیابتی در همان هفته
*** 001/0p< در مقایسه با سطح پایه در همان گروه)، ## p<0/01 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)

نمودار 3: تعداد خارهای دندریتی در واحد طول در نورونهای پیرامیدال ناحیهی CA1 هیپوکامپ در گروههای مختلف
** 01/0p< (در مقایسه با سطح پایه در همان گروه)،# p<0/05 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)
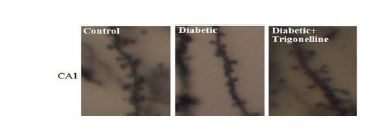
شکل 1: فتومیکروگراف تراکم خارهای دندریتهای راسی نورونهای هرمی ناحیه CA1 هیپوکامپ مغز موش صحرایی گروههای مختلف در هفته هشتم پس از تزریق استرپتوزوتوسین

نمودار 4: تعداد خارهای دندریتی در واحد طول در نورونهای پیرامیدال قشر پرهفرونتال درگروههای مختلف
** 01/0p< (در مقایسه با سطح پایه در همان گروه)، # p<0/05 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)

شکل 2: فتومیکروگراف تراکم خارهای دندریتهای راسی نورونهای هرمی ناحیه پرهفرونتال موش صحرایی در گروههای
مختلف در هفته هشتم پس از تزریق استرپتوزوتوسین
بحث
افزایش قند خون ناشی از دیابت قندی، سبب از بین رفتن تعادل اکسیدانها و آنتیاکسیدانها میشود و باعث ایجاد استرس اکسیداتیو میشود (30). که یکی از علل آسیبرسان به سیستم عصبی مرکزی میباشد که سبب اختلال در عملکرد آن میشود. آسیب به نورونها در طی دیابت نوروپاتی دیابتی محسوب میشود که در حدود 60-50 درصد افراد دیابتی روی میدهد (31). همچنین افزایش قند خون با افزایش سطح فسفریله 4EBPI و P760S6K سبب فعالشدن مسیر mTOR و افزایش فعالیت پروتئینmTOR و آسیب نورونی هیپوکامپ میشود که با بروز آلزایمر رابطه مستقیم دارد (32،33). در این مطالعه ما برای اولین بار اثر تریگونلین را بر مورفولوژی دندریتی در هیپوکامپ و قشر پرهفرونتال در موش صحرایی دیابتی شده با استرپتوزوتوسین مورد بررسی قرار دادیم. با توجه به نتایج بهدست آمده از مطالعه ما، دیابت قندی سبب کاهش معنیداری در تراکم خارهای دندریتی در نورونهای نواحی قشر پرهفرونتال و ناحیه CA1 هیپوکامپ در مغز موش صحرایی گردید. با توجه به مطالعات Muller و همکاران در سال 2009 مشخص شد که دیابت قندی میتواند سبب کاهش حجم هیپوکامپ شود که این کاهش ابتدا در ناحیه CA1 میباشد و به سایر نواحی گسترش پیدا میکند (34). همچنین در مطالعه XU و همکاران در سال 2003 مشخص شد که دیابت قندی با کاهش فعالیت آنزیم سوپراکسیددیسموتاز و افزایش رادیکالهای آزاد سبب آسیب نورونی میشود (35). همچنین در مطالعه Mastrocola و همکاران در سال 2005 مشخص شد که استرس اکسیداتیو ناشی از دیابت قندی سبب ایجاد آسیب و التهاب در پارانشیم بافت مغزی شد (36). نتایج مطالعه ما با مطالعات انجام شده همسو بود. همچنین با توجه به نتایج حاصل از این بررسی مصرف تریگونلین با دوز 50 میلیگرم بر کیلوگرم به مدت 7 هفته سبب افزایش معنیدار در وزن و کاهش معنیدار در سطح گلوکز پلاسما در مقایسه با گروه دیابتی بدون مصرف تریگونلین گردید. همچنین سبب افزایش معنیداری در تراکم خارهای دندریتی قشر پرهفرونتال و ناحیه CA1 هیپوکامپ مغز در مقایسه با گروه دیابتی شد. در مطالعه Hong و همکاران در سال 2008 مشخص شد که تریگونلین میتواند آسیب نوروپاتی شنوایی ناشی از دیابت را کاهش دهد و از اختلالات شنوایی جلوگیری کند (37). در مطالعهNugrahini و همکاران در سال 2020 مشخص شد که تریگونلین در سلولهای سرطانی از تشکیل میکروتوبولها جلوگیری میکند و اثرات ضد گرانولاسیون در پیشرفت بیماریهای آلرژیک دارد (38). در مطالعه Tohada و همکاران در سال 2005 مشخص شد تریگونلین با القای رشد عصبی و بازسازی شبکههای عصبی در مغز آسیب دیده از اختلالات حافظه ناشی از آمیلوئید بتا و اختلالات نورودژنراتیو جلوگیری میکند (39). در مطالعه Qiu و همکاران در سال 2020 مشخص شد که تریگونلین آسیب نورونهای هیپوکامپ ناشی از پرفیوژن اکسیژن-گلوکز را با فعالسازی مسیر سیگنالینگP13K/Akt بهبود بخشید (40). نتایج بهدست آمده از این پژوهش با مطالعات انجام گرفته همسو بود.
نتیجهگیری
دیابت قندی با افزایش استرس اکسیداتیو سبب آسیب نورونی در نواحی هیپوکامپ و قشر پرهفرونتال مغز میشود. تریگونلین دارای خاصیت هیپوگلیسمیک بوده و اثرات ناشی از دیابت بر آسیبهای نورونی بافت هیپوکامپ و قشر پرهفرونتال را کاهش میدهد.
سپاسگزاری
این پژوهش حاصل پایاننامه دانشجویی مقطع دکتری عمومی آقای محسن کریمی مصوب معاونت پژوهشی دانشکده پزشکی دانشگاه شاهد در سال 1395 میباشد. از کارشناسان دانشکده پزشکی دانشگاه شاهد خانم فریبا انصاری و خانم مریم شرایلی در کمک به انجام برخی آزمایشات تشکر میشود.
حامی مالی: دانشگاه شاهد.
تعارض در منافع: وجود ندارد.
دیابت قندی یک اختلال متابولیک شایع میباشد که به علت ترکیبی از اختلالات، شامل فقدان نسبی انسولین، ایجاد مقاومت به اثرات این هورمون یا تولید بیش از حد گلوکز توسط کبد بروز میکند (1). برآورد میشود که شیوع بیماری دیابت قندی تا سال 2030 به بیش از 366 میلیون نفر برسد. میزان مرگ و میر و ابتلا به دیابت، بهواسطه عوارض متعددی همچون واسکولوپاتی دیابتی، رتینوپاتی، نفروپاتی و نوروپاتی محیطی تعیین میشود (2،3). با توجه به مطالعات انجام شده دیابت، سیستم عصبی مرکزی (CNS) را درگیر میکند و موجب تغییرات پاتولوژیک موسوم به آنسفالوپاتی دیابتی می-گردد و با نقصانهای حقیقی در ادراک و شناخت بیمار و پاتولوژی عصب متمایز میگردد (4،5). شایعترین عوارض مغزی دیابت شامل افت عملکرد شناختی و افسردگی است (6). ﻫﯿﭙﺮگلیسمی، ﻣﻬﻢﺗﺮیﻦ دﻟﯿﻞ اﻟﻘای اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ در ﺣﯿﻦ دیﺎﺑﺖ ﺑﻮده و از ﻃﺮیﻖ مکانیسمﻫﺎی آﻧﺰیﻤﯽ و ﻏﯿﺮ آنزیمی، ﻣﻨﺠﺮ ﺑﻪ ﺗﻮﻟﯿﺪ ﺑﯿﺶ از ﺣﺪ رادیﮑﺎل¬ﻫﺎی آزاد اﮐﺴﯿﮋن میگردد (7). فعالسازی مسیرهای حساس به استرس مثلNF-κB) )،(AGE/RAGE) و پروتئینکیناز C در اثر استرس اکسیداتیو سبب ﻓﻌﺎلﺷﺪن پیامهای مسیر آپوپتوز ﺳﻠﻮﻟﯽ در ﺑﺎﻓﺖ ﻣﻐﺰ و ﻣﺮگ ﻧﻮرونﻫﺎ میشود (8). ﺑﺎﻓﺖ ﻣﻐﺰ دارای اسیدﻫﺎی ﭼﺮب ﻏﯿﺮاﺷﺒﺎع ﻓﺮاوان و سیستم آنتیاکسیدانی ضعیف می¬باشد. و به دلیل مصرف زیاد اکسیژن ﺑﻪ شدت در ﻣﻌﺮض آسیب اکسیداتیو قرار میگیرد (9). ﻗﺸﺮ ﻣﻐﺰ و ﻫﯿﭙﻮﮐﺎمپ بیشتر از ﺳﺎیﺮ ﻣﻨﺎﻃﻖ ﻣﻐﺰ تحت تاثیر اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ و ﭘﺮاﮐﺴﯿﺪاﺳﯿﻮن ﻟﯿﭙﯿﺪی ﻧﺎﺷﯽ از ﻫﯿﭙﺮﮔﻠﯿﺴﻤﯽ می-باشند (10). مواجهه طولانیمدت با استرس اکسیداتیو منجر به یک سری تغییرات نوروپلاستیک در نواحی مغزی حساس به استرس، مانند هیپوکامپ میشود. و پلاستیسیتی عصبی در پاسخ به عوامل محیطی مثل رژیم غذایی و همچنین تحریکات ایمنی و اندوکرین تحت تاثیر قرار میگیرد (11). از نظر بالینی، کاهش حجم هیپوکامپ در مطالعات تصویربرداری مغز در طی افسردگی و دیابت شواهدی مشابه مدلهای حیوانی مواجه شده با استرس را نشان داده است (12). هدف از مراقبت در بیماران مبتلا به دیابت، حذف علائم و جلوگیری و یا به حداقل رساندن سرعت ایجاد عوارض است. به طورکلی شروع زودرس درمان دارویی در بیماران دیابتی، عوارض درازمدت را کاهش میدهد. داروهای جدیدتر شامل آگونیستهای پپتید شبه گلوکاگون، آگونیستهای دوپامین در درمان دیابت مورد استفاده قرار می¬گیرند (13). برخی عوارض جانبی این داروها مانند هیپوگلیسمی، عوارض گوارشی، طعم فلزی دهان، اسیدوز لاکتیک، نارسایی کلیوی، تشدید نارسایی قلبی گزارش شدهاند (14،15). دانشمندان همواره در تلاش برای دستیابی به ترکیبات گیاهی و طبیعی مفید جهت کاهش دیابت بودهاند. از جمله ترکیبات گیاهی با اثرات هیپوگلیسمیک آلکالوئید تریگونلین می¬باشد (16،17). تریگونلین نخستین بار از گیاه شنبلیله (Trigonella foenum-graceum) استخراج شد و در دانه قهوه، خربزه زمستانی، و گونه حیوانی مانند توتیا و ستاره دریایی مشاهده شده است (18،19). با توجه به آزمایشات انجام شده مشخص شد که مصرف تریگونلین بهطور قابلتوجهی سطح گلوکز و انسولین را 15 دقیقه بعد از تست تحمل گلوکز در مقایسه با دارونما کاهش داد (20). همچنین برخی مطالعات نیز اثرات تریگونلین را در کاهش مارکرهای استرس اکسیداتیو در موشهای دیابتی نشان دادهاند (21). نتایج به دست آمده نشان میدهد که تریگونلین اثرات مفیدی را در درمان دیابت از طریق کاهش سطوح گلوکز و چربی خون، افزایش حساسیت به انسولین و میزان انسولین، افزایش فعالیت آنزیمهای آنتیاکسیدان و کاهش پراکسیداسیون لیپیدی اعمال میکند (24-22). مطالعات گوناگونی اثرات حفاظتکننده عصبی تریگونلین را در اختلالات مختلف سیستم عصبی مرکزی و محیطی مورد بررسی قرار دادهاند. تریگونلین دارای اثرات ضداکسیدانی قوی میباشد و با توجه به مطالعات انجام شده یک اثر محافظتی عصبی در بیماری پارکینسون را نشان داده است (25،26). با توجه به اختلالات سیستم عصبی مرکزی مشاهده شده در دیابت و محدود بودن مطالعات انجام شده در این زمینه، ما برای اولین بار اثر پیشگیریکننده و حفاظتی تریگونلین بر تغییرات مورفولوژیک نورونهای هیپوکامپ و قشر پرهفرونتال بهدنبال القای دیابت قندی با استرپتوزوتوسین را مورد بررسی قرار دادیم.
روش بررسی
در این مطالعه تجربی، تعداد 32 سر موش نر، نژاد ویستار، در محدوده وزنی 235-195 گرم بهطور تصادفی به 4 گروه شامل: کنترل، کنترل تحت تیمار با تریگونلین، دیابتی و دیابتی تحت تیمار با تریگونلین تقسیم شدند و در مرکز مطالعات حیوانی دانشگاه شاهد، در دمای 24-22 درجه سانتیگراد نگهداری شدند. حیوانات آزادانه به آب لولهکشی و غذای مخصوص موش (شرکت خوراک دام پارس، کرج) به مدت 10 هفته دسترسی داشتند. تیمار با تریگونلین (حل شده در آب مقطر) به فرم خوراکی به میزان 50 میلیگرم بر کیلوگرم در روز به مدت 7 هفته ادامه یافت. وزن حیوانات و پارامتر میزان گلوکز سرم در ابتدای کار، و در هفتههای 4 و 8 پس از القای دیابت نیز مورد اندازهگیری قرار گرفت. برای بررسی دندریتهای نورونی پس از کشتن حیوانات با روش پرفیوژن از طریق قلب، از روش رنگآمیزی گلژی استفاده گردید.
دیابتی کردن موشها و اندازهگیری گلوکز سرم
در این بررسی از آن دسته موشهایی که در شرایط طبیعی، بدون برقراری حالت روزهداری، میزان گلوکز سرم آنها کمتر از250 میلیگرم بر دسیلیتر بود استفاده شد. در این خصوص از شبکه رترواوربیتال و لوله موئینه برای خونگیری استفاده شد. برای دیابتی نمودن موشها، از داروی استرپتوزوتوسین به صورت تک دوز، داخل صفاقی به میزان 60 میلیگرم بر کیلوگرم حل شده در محلول سالین فیزیولوژیک سرد استفاده شد (27). استرپتوزوتوسین بهعنوان یک داروی شیمیدرمانی در درمان کارسینوم سلول بتای پانکراس بهکار میرود. استرپتوزوتوسین به سلولهای بتای پانکراس آسیب میزند و سبب هیپوانسولینمی و هیپرگلیسمی میگردد (28). اندازهگیری میزان گلوکز سرم توسط روش آنزیمی گلوکز اکسیداز (زیست شیمی) قبل از انجام کار و در هفتههای 4 و 8 با استفاده از اسپکتروفتومتر (اسپکترونیک 20، آمریکا) انجام شد. وزن حیوانات نیز ابتدا در هفته قبل از القای دیابت و سپس در هفتههای 4 و 8 پس از القای دیابت مورد سنجش قرار گرفت.
روش رنگآمیزی گلژی
روش رنگآمیزی نقره گلژی بر پایه تشکیل رسوبات کدر کرومات نقره که بهوسیله واکنش بین پتاسیمدیکرومات و نیترات نقره شکل میگیرد (واکنش سیاه) میباشد (29). پس از انجام پرفیوژن ترانسکاردیال و عبور 50 میلیلیتر محلول سالین نرمال و 100 میلیلیتر محلول فیکساتیو شامل پارافرم آلدئید 4% در بافر فسفات 0/1 مولار، مغز موشها از جمجمه خارج شد و به داخل ظرف حاوی رنگ گلژی شامل پتاسیمدیکرومات، مرکوری کلرید، پتاسیم کرومات، و پتاسیم تنگستات در آب دو بار تقطیر در دمای 25-20 درجه سانتیگراد بهمدت 2 هفته در تاریکی قرار داده شد. و پس از 5-4 بار شستوشو در آب مقطر، در محلول حاوی لیتیوم هیدروکسید و پتاسیم نیترات در آب مقطر به مدت 3-2 روز قرار داده شدند. در مرحله بعدی، برشگیری با استفاده از میکروتوم فریزینگ در دمای 20- درجه سانتیگراد انجام پذیرفت و برشهای بافتی به ضخامت 100 میکرومتر بر روی لام قرار گرفته و پس از طی مراحل آبگیری و شفافسازی در محلولهای اتانول و گزیلول و قرار دادن لامل با استفاده از چسب انتلان، بررسی میکروسکوپی در مورد نمونهها با استفاده از میکروسکوپ Bell در بزرگنمایی کل 400 و 1000 انجام شد. برای بررسی و شمارش خارهای دندریتی، تنها نورونهایی مورد بررسی قرار گرفتند که در روش رنگآمیزی بهطور کامل سیاه رنگ شدند و تمام انشعابات دندریتی در برشها مشاهده گردید. به علاوه، تمام برجستگیهای دندریتی بهصورت نازک یا عصایی شکل دارا یا فاقد برجستگیهای انتهایی در یک طول معین مورد شمارش قرار گرفتند. تعداد متوسط خار در یک طول معین در مورد حداقل10 نورون از دو ناحیه قشر مغز و هیپوکامپ ناحیه (CA1) مورد شمارش قرار گرفت. برای انجام اندازهگیریهای کمی در مورد تصاویر میکروسکوپی نیز از نرمافزار Image tool نسخه 3 استفاده گردید.
تجزیه و تحلیل آماری
برای تجزیه و تحلیل دادههای حاصل از این پژوهش از نرمافزار آماری version 16 SPSS استفاده شد. از نظر آماری، تمامی نتایج به صورت میانگین ± انحراف معیار بیان گردید. در قسمت آمار تحلیلی پس از مشخص نمودن توزیع دادهها، برای مقایسه نتایج هر پارامتر در هر یک از گروهها قبل و بعد از بررسی از آزمون آنووا با اندازهگیری مکرر و برای مقایسه گروهها با هم در هر یک از دورههای زمانی از آزمون آنووا یکطرفه و آزمون توکی استفاده گردید. بهعلاوه سطح معنیدار (p<0/05) برای تمامی آنالیزها در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط کمیته اخلاق دانشگاه شاهد تایید شده است (کد اخلاق IR.SHAHED.REC.1395.205).
نتایج
نتایج حاصل از اثر تریگونلین بر وزن موشها
وزن حیوانات در هفته قبل از بررسی و هفتههای چهارم و هشتم پس از بررسی در تمام گروهها اندازهگیری شد. نتایج بهدست آمده نشان داد که میزان وزن در هفته قبل از بررسی تفاوت معنیدار بین گروهها نشان نمیدهد، در حالیکه در طی هفتههای چهارم و هشتم تفاوت معنیدار بین گروهها مشاهده گردید. در این خصوص، در هفته هشتم، گروه دیابتی یک کاهش بارز و معنیدار(p<0/01) در مقایسه با گروه کنترل نشان داد. همچنین، هر چند در هفته چهارم نیز این کاهش وجود داشت ولی تفاوت موجود به سطح معنیدار نرسید. از طرف دیگر، تفاوت موجود بین دو گروه دیابتی و دیابتی تحت درمان با تریگونلین در هفتههای چهارم و هشتم در حد معنیدار بود (p<0/01) از سوی دیگر، در گروه کنترل تیمار شده با تریگونلین در همین هفتهها تغییر معنیدار در مقایسه با گروه کنترل تیمار نشده مشاهده نشد.
نتایج حاصل از اثر تریگونلین بر میزان گلوکز سرم
در بررسی نتایج حاصل از اثر تریگونلین بر میزان گلوکز سرم با توجه به نمودار2، با اندازهگیری میزان گلوکز سرم در هفتههای قبل از بررسی و هفته چهارم و هشتم پس از بررسی در تمام گروهها مشخص شد که در هفته قبل از بررسی تفاوت معنیدار بین گروهها مشاهده نشد. بهعلاوه، در هفته هشتم میزان گلوکز سرم در دو گروه دیابتی و دیابتی تحت تیمار با تریگونلین بهطور بسیار بارز و معنیدار بیشتر از نتایج هفته قبل از کار بود (p<0/001) در حالیکه گروه کنترل تحت تیمار تفاوت معنیدار را در مقایسه با گروه کنترل نشان نداد. بهعلاوه، تیمار با تریگونلین در گروه دیابتی در همین دوره زمانی کاهش معنیدار در میزان گلوکز سرم در موشها در مقایسه با گروه دیابتی تیمار نشده را نشان داد(p<0/01) .
نتایج حاصل از اثر تریگونلین بر وضعیت مورفولوژیک نورونی هیپوکامپ در روش رنگآمیزی گلژی
با بررسی میکروسکوپی تراکم خارهای دندریتی در نورونهای هرمی شکل ناحیه Cornu Ammonis 1 (CA1) با توجه به نمودار 3 و شکل 1، مشخص شد که تفاوت معنیدار بین گروه کنترل تحت تیمار با تریگونلین و کنترل یافت نمیشود، گروه دیابتی یک کاهش معنیدار از این نظر در مقایسه با گروه کنترل نشان داد (p<0/01). بهعلاوه در گروه دیابتی تیمارشده با تریگونلین کاهش معنیدار خارهای دندریتی در مقایسه با گروه کنترل مشاهده نشد. همچنین در گروه دیابتی تیمارشده با تریگونلین تراکم خارهای دندریتی در حد معنیدار بیشتر از گروه دیابتی بود (p<0/05)
نتایج حاصل از اثر تریگونلین بر وضعیت مورفولوژیک نورونی قشر پرهفرونتال در رنگآمیزی گلژی
در بررسی میکروسکوپ نوری برشهای تهیه شده از ناحیه پرهفرونتال قشر مغز در لایه V با توجه به نمودار 4 و شکل 2، این ناحیه از نظر تراکم خارهای دندریتی مربوط به نورونهای پیرامیدال ناحیه مذکور، مشخص گردید که تفاوت معنیدار بین دو گروه کنترل تحت تیمار با تریگونلین و کنترل یافت نمیشود، گروه دیابتی یک کاهش معنیدار از این نظر در مقایسه با گروه کنترل نشان داد (01/0p<). به علاوه در گروه دیابتی تیمارشده با تریگونلین کاهش معنیدار خارهای دندریتی در مقایسه با گروه کنترل مشاهده نشد. همچنین در گروه دیابتی تیمارشده با تریگونلین تراکم خارهای دندریتی درحد معنیدار بیشتر از گروه دیابتی بود (05/0p<).

نمودار1: میزان تغییرات وزن در هفتههای مختلف در موش صحرایی دیابتی تحت تیمار در مقایسه با گروه دیابتی در همان هفته
* * 01/0p< (در مقایسه با سطح پایه در همان گروه)، ## p<0/01 (در مقایسه با سطح پایه در همان گروه)

نمودار2: میزان تغییرات گلوکز سرم در هفتههای مختلف در موش صحرایی دیابتی تحت تیمار در مقایسه با گروه دیابتی در همان هفته
*** 001/0p< در مقایسه با سطح پایه در همان گروه)، ## p<0/01 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)

نمودار 3: تعداد خارهای دندریتی در واحد طول در نورونهای پیرامیدال ناحیهی CA1 هیپوکامپ در گروههای مختلف
** 01/0p< (در مقایسه با سطح پایه در همان گروه)،# p<0/05 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)

شکل 1: فتومیکروگراف تراکم خارهای دندریتهای راسی نورونهای هرمی ناحیه CA1 هیپوکامپ مغز موش صحرایی گروههای مختلف در هفته هشتم پس از تزریق استرپتوزوتوسین

نمودار 4: تعداد خارهای دندریتی در واحد طول در نورونهای پیرامیدال قشر پرهفرونتال درگروههای مختلف
** 01/0p< (در مقایسه با سطح پایه در همان گروه)، # p<0/05 (در مقایسه با گروه دیابتی تیمار نشده در همان هفته)

شکل 2: فتومیکروگراف تراکم خارهای دندریتهای راسی نورونهای هرمی ناحیه پرهفرونتال موش صحرایی در گروههای
مختلف در هفته هشتم پس از تزریق استرپتوزوتوسین
بحث
افزایش قند خون ناشی از دیابت قندی، سبب از بین رفتن تعادل اکسیدانها و آنتیاکسیدانها میشود و باعث ایجاد استرس اکسیداتیو میشود (30). که یکی از علل آسیبرسان به سیستم عصبی مرکزی میباشد که سبب اختلال در عملکرد آن میشود. آسیب به نورونها در طی دیابت نوروپاتی دیابتی محسوب میشود که در حدود 60-50 درصد افراد دیابتی روی میدهد (31). همچنین افزایش قند خون با افزایش سطح فسفریله 4EBPI و P760S6K سبب فعالشدن مسیر mTOR و افزایش فعالیت پروتئینmTOR و آسیب نورونی هیپوکامپ میشود که با بروز آلزایمر رابطه مستقیم دارد (32،33). در این مطالعه ما برای اولین بار اثر تریگونلین را بر مورفولوژی دندریتی در هیپوکامپ و قشر پرهفرونتال در موش صحرایی دیابتی شده با استرپتوزوتوسین مورد بررسی قرار دادیم. با توجه به نتایج بهدست آمده از مطالعه ما، دیابت قندی سبب کاهش معنیداری در تراکم خارهای دندریتی در نورونهای نواحی قشر پرهفرونتال و ناحیه CA1 هیپوکامپ در مغز موش صحرایی گردید. با توجه به مطالعات Muller و همکاران در سال 2009 مشخص شد که دیابت قندی میتواند سبب کاهش حجم هیپوکامپ شود که این کاهش ابتدا در ناحیه CA1 میباشد و به سایر نواحی گسترش پیدا میکند (34). همچنین در مطالعه XU و همکاران در سال 2003 مشخص شد که دیابت قندی با کاهش فعالیت آنزیم سوپراکسیددیسموتاز و افزایش رادیکالهای آزاد سبب آسیب نورونی میشود (35). همچنین در مطالعه Mastrocola و همکاران در سال 2005 مشخص شد که استرس اکسیداتیو ناشی از دیابت قندی سبب ایجاد آسیب و التهاب در پارانشیم بافت مغزی شد (36). نتایج مطالعه ما با مطالعات انجام شده همسو بود. همچنین با توجه به نتایج حاصل از این بررسی مصرف تریگونلین با دوز 50 میلیگرم بر کیلوگرم به مدت 7 هفته سبب افزایش معنیدار در وزن و کاهش معنیدار در سطح گلوکز پلاسما در مقایسه با گروه دیابتی بدون مصرف تریگونلین گردید. همچنین سبب افزایش معنیداری در تراکم خارهای دندریتی قشر پرهفرونتال و ناحیه CA1 هیپوکامپ مغز در مقایسه با گروه دیابتی شد. در مطالعه Hong و همکاران در سال 2008 مشخص شد که تریگونلین میتواند آسیب نوروپاتی شنوایی ناشی از دیابت را کاهش دهد و از اختلالات شنوایی جلوگیری کند (37). در مطالعهNugrahini و همکاران در سال 2020 مشخص شد که تریگونلین در سلولهای سرطانی از تشکیل میکروتوبولها جلوگیری میکند و اثرات ضد گرانولاسیون در پیشرفت بیماریهای آلرژیک دارد (38). در مطالعه Tohada و همکاران در سال 2005 مشخص شد تریگونلین با القای رشد عصبی و بازسازی شبکههای عصبی در مغز آسیب دیده از اختلالات حافظه ناشی از آمیلوئید بتا و اختلالات نورودژنراتیو جلوگیری میکند (39). در مطالعه Qiu و همکاران در سال 2020 مشخص شد که تریگونلین آسیب نورونهای هیپوکامپ ناشی از پرفیوژن اکسیژن-گلوکز را با فعالسازی مسیر سیگنالینگP13K/Akt بهبود بخشید (40). نتایج بهدست آمده از این پژوهش با مطالعات انجام گرفته همسو بود.
نتیجهگیری
دیابت قندی با افزایش استرس اکسیداتیو سبب آسیب نورونی در نواحی هیپوکامپ و قشر پرهفرونتال مغز میشود. تریگونلین دارای خاصیت هیپوگلیسمیک بوده و اثرات ناشی از دیابت بر آسیبهای نورونی بافت هیپوکامپ و قشر پرهفرونتال را کاهش میدهد.
سپاسگزاری
این پژوهش حاصل پایاننامه دانشجویی مقطع دکتری عمومی آقای محسن کریمی مصوب معاونت پژوهشی دانشکده پزشکی دانشگاه شاهد در سال 1395 میباشد. از کارشناسان دانشکده پزشکی دانشگاه شاهد خانم فریبا انصاری و خانم مریم شرایلی در کمک به انجام برخی آزمایشات تشکر میشود.
حامی مالی: دانشگاه شاهد.
تعارض در منافع: وجود ندارد.
References:
1- Blair M. Diabetes Mellitus Review. Urologic Nursing Journal 2016; 36(1): 27-36.
2- Li Z, Cheng Y, Wang D, Chen H, Chen H, Ming W-k, et al. Incidence Rate of Type 2 Diabetes Mellitus after Gestational Diabetes Mellitus: A Systematic Review and Meta-Analysis of 170,139 Women. J Diabetes Res 2020; 2020: 3076463.
3- Guariguata L, Whiting DR, Hambleton I, Beagley J, Linnenkamp U, Shaw JE. Global Estimates of Diabetes Prevalence for 2013 and Projections for 2035. Diabetes Res Clin Pract 2014; 103(2): 137-49.
4- Martínez-Tellez R, de Jesús Gómez-Villalobos M, Flores G. Alteration in Dendritic Morphology of Cortical Neurons in Rats with Diabetes Mellitus Induced by Streptozotocin. Brain Res 2005; 1048(1-2): 108-15.
5- Joghataie MT, Roghani M, Jalali MR, Baluchnejadmojarad T, Sharayeli M. Dendritic Spine Changes in Medial Prefrontal Cortex of Male Diabetic Rats Using Golgi-Impregnation Method 2007; 10(1): 54-8.
6- Biessels GJ, Kerssen A, De Haan EH, Kappelle LJ. Cognitive Dysfunction and Diabetes: Implications for Primary Care. Prim Care Diabetes 2007; 1(4): 187-93.
7- Maritim AC, Sanders RA, Watkins JB 3rd. Diabetes, Oxidative Stress, and Antioxidants: A Review. J Biochem Mol Toxicol 2003; 17(1): 24-38.
8- Evans JL, Goldfine ID, Maddux BA, Grodsky GM. Oxidative Stress and Stress-Activated Signaling Pathways: A Unifying Hypothesis of Type 2 Diabetes. Endocrine Reviews 2002; 23(5): 599-622.
9- Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free Radicals and Antioxidants in Normal Physiological Functions and Human Disease. Int J Biochem Cell Biol 2007; 39(1): 44-84.
10- Van Dam PS, Cotter MA, Bravenboer B, Cameron NE. Pathogenesis of Diabetic Neuropathy: Focus on Neurovascular Mechanisms. Eur J pharmacol 2013; 719(1-3): 180-6.
11- McEwen BS, Bowles NP, Gray JD, Hill MN, Hunter RG, Karatsoreos IN, et al. Mechanisms of Stress in the Brain. Nat Neurosci 2015; 18(10): 1353-63.
12- Tata DA, Anderson BJ. The Effects of Chronic Glucocorticoid Exposure on Dendritic Length, Synapse Numbers and Glial Volume in Animal Models: Implications for Hippocampal Volume Reductions in Depression. Physiol behav 2010; 99(2): 186-93.
13- Bosi E. Metformin--The Gold Standard in Type 2 Diabetes: What Does the Evidence Tell Us? 2009; 11 Suppl 2: 3-8.
14- Kuan IH, Savage RL, Duffull SB, Walker RJ, Wright DF. The Association between Metformin Therapy and Lactic Acidosis. Drug Safety 2019; 42(12): 1449-69.
15- German Diabetes Association, Matthaei S, Bierwirth R, Fritsche A, Gallwitz B, Häring HU, et al. Medical Antihyperglycaemic Treatment of Type 2 Diabetes Mellitus: Update of the Evidence-Based Guideline of the German Diabetes Association. Exp Clin Endocrinol Diabetes 2009; 117(09): 522-57.
16- Kamble HV, Bodhankar SL. Antihyperglycemic Activity of Trigonelline and Sitagliptin in Nicotinamide-Streptozotocin Induced Diabetes in Wistar Rats. Biomedicine & Aging Pathology 2013; 3(3): 125-30.
17- Subramanian SP, Prasath GS. Antidiabetic And Antidyslipidemic Nature of Trigonelline, a Major Alkaloid of Fenugreek Seeds Studied in High-Fat-Fed and Low-Dose Streptozotocin-Induced Experimental Diabetic Rats. Biomedicine & Preventive Nutrition 2014; 4(4): 475-80.
18- Ashihara H, Deng WW, Nagai C. Trigonelline Biosynthesis and the Pyridine Nucleotide Cycle in Coffea Arabica Fruits: Metabolic Fate of [Carboxyl-14C] Nicotinic Acid Riboside. Phytochemistry Letters 2011; 4(3): 235-9.
19- Christen P. Trigonella Species: In Vitro Culture and Production of Secondary Metabolites. Medicinal and Aromatic Plants XII: Springer 2002; 51: 306-27.
20- Van Dijk AE, Olthof MR, Meeuse JC, Seebus E, Heine RJ, Van Dam RM. Acute Effects of Decaffeinated Coffee and the Major Coffee Components Chlorogenic Acid and Trigonelline on Glucose Tolerance. Diabetes Care 2009; 32(6): 1023-5.
21- Hamadi SA. Effect of Trigonelline and Ethanol Extract of Iraqi Fenugreek Seeds on Oxidative Stress in Alloxan Diabetic Rabbits. J Association of Arab Universities for Basic and Applied Sciences 2012; 12(1): 23-6.
22- Zhou J, Zhou S, Zeng S. Experimental Diabetes Treated with Trigonelline: Effect on Β Cell and Pancreatic Oxidative Parameters. Fundamental & Clinical Pharmacology 2013; 27(3): 279-87.
23- Vellai RD, Chandiran S, Pillai SS. GTF-231, A Mixture of Gymnemic Acid, Trigonelline and Ferulic Acid Significantly Ameliorates Oxidative Stress in Experimental Type 2 Diabetes in Rats. Can J Diabetes 2018; 42(3): 237-44.
24- Hamden K, Bengara A, Amri Z, Elfeki A. Experimental Diabetes Treated with Trigonelline: Effect on Key Enzymes Related to Diabetes and Hypertension, Β-Cell and Liver Function. Mol Cell Biochem 2013; 381(1): 85-94.
25- Mirzaie M, Khalili M, Kiasalari Z, Roghani M. Neuroprotective and Antiapoptotic Potential of Trigonelline in a Striatal 6-Hydroxydopamine Rat Model of Parkinson’s Disease. Neurophysiology 2016; 48(3): 176-83..
26- Gaur V, Bodhankar SL, Mohan V, Thakurdesai PA. Neurobehavioral Assessment of Hydroalcoholic Extract of Trigonella Foenum-Graecum Seeds in Rodent Models of Parkinson’s Disease. Pharm Biol 2013; 51(5): 550-7.
27- Albazal A, Delshad A-A, Roghani M. Melatonin Reverses Cognitive Deficits in Streptozotocin-Induced Type 1 Diabetes in the Rat Through Attenuation of Oxidative Stress and Inflammation. J Chem Neuroanat 2021; 112: 101902.
28- Graham ML, Janecek JL, Kittredge JA, Hering BJ, Schuurman H-J. The Streptozotocin-Induced Diabetic Nude Mouse Model: Differences between Animals from Different Sources. Comp Med 2011; 61(4): 356-60.
29- Torabi T, Azizzadeh Delshad A, Roghani M. Dietary Restriction Prevents Dendritic Changes of Pyramidal Neurons in Hippocampal and Prefrontal Cortex in Diabetic Rat. J Basic and Clinical Pathophysiology 2019; 7(2): 28-32.
30- Lorenzon dos Santos J, Schaan de Quadros A, Weschenfelder C, Bueno Garofallo S, Marcadenti A. Oxidative Stress Biomarkers, Nut-Related Antioxidants, and Cardiovascular Disease. Nutrients 2020; 12(3): 682.
31- Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, Bennett DL, et al. Diabetic Neuropathy. Nature Reviews Disease Primers 2019; 5(1): 41.
32- Dann SG, Selvaraj A, Thomas G. mTor Complex1–S6K1 Signaling: At the Crossroads of Obesity, Diabetes and Cancer. Trends in Molecular Medicine 2007; 13(6): 252-9.
33- Bathina S, Das UN. Dysregulation of Pi3k-Akt-Mtor Pathway in Brain of Streptozotocin-Induced Type 2 Diabetes Mellitus in Wistar Rats. Lipids in Health and Disease 2018; 17(1): 168.
34- Mueller SG, Weiner MW. Selective Effect of Age, Apo E4, and Alzheimer's disease on Hippocampal Subfields. Hippocampus 2009; 19(6): 558-64.
35- Xu G, Perez-Pinzon MA, Sick TJ. Mitochondrial Complex I Inhibition Produces Selective Damage to Hippocampal Subfield CA1 in Organotypic Slice Cultures. Neurotox Res 2003; 5(7): 529-38.
36- Mastrocola R, Restivo F, Vercellinatto I, Danni O, Brignardello E, Aragno M, et al. Oxidative and Nitrosative Stress in Brain Mitochondria of Diabetic Rats. J Endocrinol 2005; 187(1): 37-44.
37- Hong BN, Yi TH, Park R, Kim SY, Kang TH. Coffee Improves Auditory Neuropathy in Diabetic Mice. Neurosci lett 2008; 441(3): 302-6.
38- Gulledge TV, Collette NM, Mackey E, Johnstone SE, Moazami Y, Todd DA, et al. Mast Cell Degranulation and Calcium Influx are Inhibited by an Echinacea Purpurea Extract and the Alkylamide Dodeca-2E, 4E-Dienoic Acid Isobutylamide. J Ethnopharmacology 2018; 212: 166-74.
39- Tohda C, Kuboyama T, Komatsu K. Search for Natural Products Related to Regeneration of the Neuronal Network. Neurosignals 2005; 14(1-2): 34-45.
40- Qiu Z, Wang K, Jiang C, Su Y, Fan X, Li J, et al. Trigonelline Protects Hippocampal Neurons from Oxygen-Glucose Deprivation-Induced Injury through Activating the PI3K/Akt Pathway. Chem Biol Interact 2020; 317: 108946.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1400/10/11 | پذیرش: 1401/1/21 | انتشار: 1401/8/15
دریافت: 1400/10/11 | پذیرش: 1401/1/21 | انتشار: 1401/8/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







