دوره 30، شماره 6 - ( شهریور 1401 )
جلد 30 شماره 6 صفحات 4948-4932 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Samiei M H, Jamili S, Nikukar H, Razban V. Isolation and Evaluation of Collagen from the Fish (Thunnus Tonggol) Skin: A Biological Material for Medical Tissue Engineering. JSSU 2022; 30 (6) :4932-4948
URL: http://jssu.ssu.ac.ir/article-1-5572-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5572-fa.html
سمیعی محمدهادی، جمیلی شهلا، نیکوکار حبیب، رزبان وحید. جداسازی و ارزیابی کلاژن از پوست ماهی (هوور دمدراز- Thunnus tonggol) به عنوان یک ماده بیولوژیک برای مهندسی بافت پزشکی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (6) :4932-4948
متن کامل [PDF 940 kb]
(307 دریافت)
| چکیده (HTML) (470 مشاهده)
متن کامل: (697 مشاهده)
مقدمه
کلاژن یک پروتئین فیبری است که یک جزء مهم در ساختارهای حمایتی (غضروفها، تاندونها و ...) مهره داران و بیمهرگان است (1). کلاژن فراوان ترین پروتئین در مهره داران است که نقش مهمی در حفظ یکپارچگی بیولوژیکی و ساختاری بافتها دارد و به ساختار، شکل و ویژگیهای مکانیکی مولکولی بافتهای پیوندی مختلف بدن (به عنوان مثال پوست، استخوانها، رباط ها، تاندونها و غضروفها) کمک میکند. تقریباً 50% از کل کلاژن بدن انسان در پوست وجود دارد که بیشتر آن کلاژن نوع I است (5-2). کلاژنها خانوادهای از پروتئینهای رشتهای هستند که در همه حیوانات چند سلولی یافت میشوند. آنها توسط سلولهای بافت همبند و همچنین انواع سلولهای دیگر ترشح میشوند. این پروتئینها به عنوان یک جزء اصلی در پوست و استخوان و فراوانترین پروتئین در پستانداران هستند که حدود 25% و در بالاترین مقدار حدود 30% از کل پروتئین موجود در بدن حیوانات را تشکیل میدهند. کلاژن سازگاری بیولوژیکی عالی، تجزیه بیولوژیکی و تجدید زیست خوب و آنتیژنیسیته ضعیفی را نشان داده است. چنین ویژگیها و دانشهایی منجر به تولید انبوهی از دستگاههای زیست پزشکی مبتنی بر کلاژن، از جمله سیستمهای انتقال دارو، بخیههای جراحی و کاربردهای مهندسی بافت میشود. علاوه بر این، کلاژن دارای ساختار و ترکیب اسید آمینه به خوبی حفظ شده بین گونهها است، که در هنگام استفاده از کلاژنهای غیر انسانی در زمینه زیست پزشکی به خواص ذکر شده کمک میکند (6-4). استفاده از کلاژن دریایی با توجه به خواص منحصر به فرد آن در مقایسه با کلاژن حاصل از پستانداران مانند نداشتن خطر انتقال بیماریها، محدودیتهای مذهبی کمتر، فرآیند مقرون به صرفهتر، وزن مولکولی کم، سازگاری زیستی و جداسازی آسان و جذب بهتر توسط بدن انسان، در حال رشد سریع است (7). ویژگی اصلی یک مولکول کلاژن معمولی ساختار مارپیچ بلند، محکم و سه رشتهای آن است که از سه زنجیره پلیپپتیدی، به نامهای زنجیره α که در اطراف یکدیگر پیچیده میشوند تشکیل گردیده است. کلاژنها بسیار غنی از اسیدهای آمینه پرولین و گلیسین هستند که هر دو در تشکیل مارپیچ سه رشتهای مهم میباشند. پرولین به دلیل ساختار حلقهای، ساختار مارپیچی را در هر زنجیره α تثبیت میکند، در حالیکه گلیسین به طور منظم در هر باقیمانده سوم در سراسر منطقه مرکزی زنجیره α قرار دارد. گلیسین که کوچکترین اسید آمینه است (فقط یک اتم هیدروژن به عنوان یک زنجیره جانبی دارد)، به سه زنجیره α مارپیچ اجازه میدهد که محکم بسته شوند تا ابر مارپیچ کلاژن نهایی تشکیل شود (9،8). تا کنون 29 نوع کلاژن تشخیص داده شده و تمامی آنها نوعی ساختار مارپیچی سه گانه را نمایش میدهند. کلاژن ماهی نوع I بوده و با توجه به حلالیت فوق العاده زیاد آن در اسید رقیق درمقایسه با کلاژن پستانداران و ماکیان متفاوت و منحصر به فرد است. در مقایسه با کلاژن نوع I گوساله، کلاژن نوع I مهره داران پستتر مشتق شده از ماهیان استخوانی و لامپری، میزان تشابه ساختاری زیادی را بین گونهها با توجه به زنجیره های α1 و α2 نشان میدهد. پیش مادههای کلاژن با اثرگذاری بر ویژگیهای رشد سلولها و تنظیم جنبههای مختلف رفتار و عملکرد سلولی مانند الحاق سلولی، تکثیر و تمایز شناخته میشود. مطالعات گذشته روشن کرده است که ترکیب کلاژن ماهی مشابه کلاژن پستانداران است (10-8). با در نظر گرفتن بهرهبرداری تجاری، کلاژن موجود عمدتاً از حیوانات خشکی زی نظیر گاو، خوک، مرغ و گونههای از موش بهدست می آید. کلاژن ماهی منبع مناسبی برای کاربردهای مختلف است. از کلاژن ماهی به عنوان یک پروتئین نسبتاً ارزان که به راحتی در دسترس بوده و بهطور گستردهای در مقیاس صنعتی و عمدتاً برای تولید مواد خوراکی استفاده میشود. داروسازی ازجمله زمینههای در حال رشدی است که کلاژن با جنبههای مختلف نظیر محصولات آرایشی و درمانی در آن اهمیت ویژهای دارد. علاقه و تقاضا برای استفاده از کلاژن در کاربردهای پزشکی بسیار مشاهده میشود و مواد مبتنی بر کلاژن بهطور گستردهای در پزشکی ترمیمی نیز مورد استفاده قرار میگیرد. همچنین کلاژن در پزشکی برای تهیه انواع کِرِمها، گاز و باندهای ویژه پانسمان و ترمیم زخم و در داروسازی برای تهیه کپسولهای دارویی و قرصها مصرف میشود (16-11). به طورکلی، پوست و استخوان گاو و خوک، به عنوان منابع اصلی استخراج کلاژن و ژلاتین هستند. در سالهای اخیر توجه زیادی به جداسازی کلاژن از موجودات دریایی شده که علت آن عدم محدودیت استفاده از آن در رژیم غذایی و کم بودن خطر ابتلا به بیماریهای مُسری که شامل جنون گاوی، آنفولانزای خوکی و مرغی و همچنین بیماریهای گوارشی شایع در گاوها، خوکها و بوفالوها میباشد (17). علیرغم غربالگری دقیق بیماریهای قابل انتقال، خطر انتقال و وقوع بیماری جنون گاوی، منجر به ایجاد تشویش در بین مصرفکنندگان کلاژن و ژلاتین گاوی شده است. همچنین شیوع بیماریهایی مانند آنسفالوپاتی اسفنجی شکل قابل انتقال (TSE)، بیماری پا و دهان (FMD) در خوکها و گاوها و آنفولانزای خوکی و آنسفالوپاتی اسفنجی شکل گاوی (BSE) در بعضی کشورها جهان از اهمیت بالایی برخوردار است (20-18،11،8). همچنین محدودیتهای مذهبی علیالخصوص در اسلام، یهودیت و هندوها، استفاده و کاربردهای کلاژن مبتنی بر پستانداران را محدود میکند (25-21،15،12). کلاژن به دست آمده از ماهی ممکن است یک گزینه ایمن باشد، زیرا احتمال انتقال بیماریها هنوز نگران کننده نیست. علاوه بر این، محصولات جانبی فرآوری ماهی، مانند پوست، استخوانها و فلس، به طور کامل در دسترس هستند، و استفاده از آنها ضمن اینکه به حل مشکلات آلودگی محیط زیست مرتبط میپردازند، از بهره برداری پایدار از منابع دریایی از طریق ارزش سنجی باقیمانده اطمینان حاصل میکنند (4). شاید جالبترین کلاژنی که در آبزیان کشف شده است الاستودین بوده که از پروتئین باله کوسه ماهی میباشد. این پروتئین وزن مولکولی کمتری در مقایسه با اکثر کلاژنهای محلول دیگر دارد و همچنین مقدار تیروزین و سیستئین بالایی دارد که غیرعادی میباشد. این دو اسید آمینه در تشکیل اتصال شرکت دارند، ولی این پدیده در کلاژن پستانداران دیده نمیشود (26). در آمریکای شمالی پوست خوک، منبـع عمـده مـاده اولیـه بـرای تولید کلاژن نوع اول میباشد. پوست خوک بـه شـکل منجمـد در بستههای بزرگ به کارخانههای تولیـد کـلاژن بـرده مـیشـود. در اروپا نیز مقادیر زیادی پوست خوک بـرای تولیـد کـلاژن نـوع اول بهکار میرود، زیرا که بازده تولید کلاژن نـوع اول از آن بـالا بـوده و نیاز به مدت زمان کمتـری بـرای آمـاده کـردن مـواد اولیـه بـرای استخراج و مشکلات کمتری در ارتباط با فاضلاب کارخانه میباشد (13). با توجه به اهمیت موضوع، تاکنون مطالعات فراوانی توسط محققان بر روی کلاژن انواع ماهیها و بسیاری از موجودات دریایی از گونههای مختلف به عنوان منشاء زیست توده برای جداسازی کلاژن، از یک دیدگاه اساسی یا به عنوان ماده اولیه برای تولید بیوپلیمر و همچنین بررسی خصوصیات فیزیکی و شیمیایی آنها صورت گرفتهاند. در این مطالعات، ماهی و محصولات جانبی آن را به دلیل کم بودن ریسک انتقال بیماری، دسترسی آسان، نبودن محدودیتهای دینی و محتوای بالای کلاژنی به عنوان یک منبع امن معرفی کردهاند (35-27،13،6،3،1). ماهی تن دمدراز (تصویر 1) یکی از ارزشمندترین و مهمترین ماهیانی است که در مناطق گرمسیری تا نیمه گرمسیری اقیانوس هند و آرام زندگی میکند. صید ماهی تن در آبهای ساحلی کشورهای مختلف از جمله اندونزی، پاکستان، مالزی، عمان، یمن، هند و تایلند و ایران انجام میشود. در ایران صید صنعتی در خلیج فارس و دریای عمان صورت میپذیرد که از نظر اقتصادی برای صنایع شیلات بسیار مهم است. ایران رتبه دوم در صید ماهی تن و گونههای مختلف تن ماهیان از اقیانوس هند را دارد. میزان صید ماهی تن و گونههای مختلف تن ماهیان در ایران از 54 هزار تن در سال 1997 به 251 هزار تن در سال 2016 (حدود 4 برابر) افزایش یافته است. توجه به نقش اصلی فعالیتهای شیلات در کشورهایی که در سواحل آبهای آزاد واقع شده اند، در توسعه پایدار صنعت شیلات بسیار مهم است. از این نظر، ایران نمونه خوبی است که در حاشیه خلیج فارس و دریای عمان واقع شده و به اقیانوس هند دسترسی دارد (36).
 تصویر 1: ماهی تن دمدراز Thunnus tonggol
تصویر 1: ماهی تن دمدراز Thunnus tonggol
روش بررسی
در مطالعه بنیادی حاضر، منـابع کلاژنـی شـامل پوسـت ماهی هوور دمدراز از بازار ماهی فروشان بندرعباس تهیه، نمونـههـا بـه صـورت منجمـد بـه آزمایشـگاه مرکز تحقیقات نانوتکنولوژی پزشکی و مهندسی بافت دانشگاه علوم پزشکی شهید صدوقی یزد منتقـل و تـا شـروع آزمایشات به همان حالت نگهداری گردید.
مواد شیمیایی: سود سوزآور(سدیم هیدروکسید)، بوتیل الکل (1- بوتانول)، آکریل آماید، بیس آکریل آماید، سدیم کلراید، تریس (هیدروکسی متیل) آمینومتان، سدیم دوسیل سولفات، آمونیوم پرسولفات، گلیسرول، مرکاپتواتانول، بروم فنل بلو، کومایسی آر 250 از شرکت سیگما آلدریچ تهیه شده و متانول و اسید استیک گلاسیال از شرکت مِرک آلمان و مارکر پروتئین از شرکت سینا ژن (SL7002) تهیه گردید. برای انجام آزمایش تمام مواد در سردخانه با دمای 25- درجه سانتیگراد در آزمایشگاه به مدت یک هفته نگهداری شد. شرایط دمایی در تمام طول فرایند تحقیق 4 درجه سانتیگراد و pH ثابت با مقدار 7/2 و کنترل شده میباشد.
استخراج قلیایی مواد پروتئینی غیر کلاژنی: تمامی مراحل با استفاده از روش ناگایی (19) با اندکی تغییر انجام شد. ابتدا پوست ماهی تهیه و آمادهسازی شده به میزان 100 گرم با استفاده از آب مقطر سرد چندین بار شستشو داده شدند. سپس به آن NaOH 0/1 مولار با نسبت (W/V) 1:20 اضافه گردید. سوسپانسیون بهمدت 24 ساعت توسط استیرر بهم زده شد. محلول نهایی را از صافی رد کرده و با آب مقطر سرد شستشو داده تا pH آن خنثی شود.
چربیزدایی از بافت: نمونهها در محلول بوتیل الکل 10% با نسب1:10 به مدت 24 ساعت مخلوط و بهم زده شدند. هر 8 ساعت محلول تعویض گردید. بافت بدون چربی با آب مقطر سرد به طور کامل شستشو داده شد (19).
آماده سازی کلاژن محلول در اسید (ASC) Acid-soluble collagen از پوست ماهی هوور دمدراز: برای استخراج کلاژن، بافت آماده شده در اسید استیک 0/5 مولار با نسبت (W/V) 1:20 به مدت 72 ساعت روی همزن قرار گرفت. مخلوط از طریق دو لایه پارچه صافی، صاف گردید. سپس سوپرناتانت جمعآوری شده و در دمای 4 درجه سانتیگراد نگهداری شد. باقیمانده به همان روش قبلی مجدداً استخراج گردید. سپس عصاره بهدست آمده در سانتریفوژ یخچالدار به مدت 1 ساعت با سرعت ده هزار دور در دقیقه قرار گرفته و عصارهگیری گردید. هر دو سوپرناتانت به دست آمده در NaCL 0/9 مولار به مدت 30 دقیقه قرار گرفت. سپس به NaCl برای بهدست آمدن یک غلظت نهایی از 2/6 مولار در 0/05 تریس باpH: 7 (هیدروکسی متیل آمینومتان( اضافه شد و 30 دقیقه استیرر گردید. رسوب حاصل بهوسیله سانتریفیوژ یخچالدار به مدت 45 دقیقه با سرعت ده هزار در دقیقه جمعآوری گردید. رسوب بهدست آمده به مدت 6 ساعت در اسید استیک 0/5 مولار حل شد و سپس به مدت 48 ساعت در اسید استیک 0/1 مولار دیالیز D117, D116)) گردید و نهایتاً برای 72 ساعت در آب مقطر سرد دیالیز گردید. هر 6 ساعت آب دیالیز تعویض شد تا زمانیکه به pH خنثی برسد. رسوب دیالیز شده به وسیله فریزدرایر در دمای منفی 55 درجه سانتیگراد و فشار P5 به مدت 48 ساعت خشک گردید و به عنوان کلاژن محلول در اسید معرفی گردید (19).
عملکرد و بازده کلاژن استخراجی: میزان کلاژن محلول در اسید بر اساس وزن خشک ماده اولیه محاسبه شد (37).
Yield % =Weight of lyophilized collagen (g)/ Weight of initial dry skin ×100
در تمامی تستها، نمونهها بهصورت سه تایی در هر دسته مورد بررسی قرار گرفت.
اسپکتروفتومتریUV: جذب اتمی UV کلاژن درمحدوده طول موج 400-200 نانومتر توسط دستگاه اسپکتروفتومترUnico مدلuv4802 انجام شد. کلاژن خالص در اسید استیک 0/5 مولار حل گردید. برای به دست آوردن غلظت مناسب 0/5 میلیگرم/ میلیلیتر حل شد. 200 میکرولیتر از محلول در 800 میکرولیتر از اسید استیک 0/5 مولار حل گردید. سپس مقدار 1 میلیلیتر از محلول همگن شده را داخل ظرف کووت (Cuvette)ریخته و برای تعیین طول موج جذب در دستگاه قرار داده شد (6).
آزمون SDS-PAGE: برای انجام این آزمون از ژل پلیآکریلآمید 30/8 درصد استفاده گردید. در این مرحله از ژل پائین 8% و از ژل بالای 3/5% استفاده شد. کلاژن ماهی هوور در اسیداستیک 4% حل شده و به مدت 10 دقیقه در آب جوش 95 درجه سانتیگراد گذاشته شدند و سپس نمونهها به همراه مارکر پروتئین بر روی ژل و درون چاهکها منتقل گردیدند (38). نهایتاً با ولتاژ 120 ولت به مدت 3 ساعت الکتروفورز انجام شد. بعد از الکتروفورز، ژل با کوماسی آبی 0/1 درصد (وزن/ حجم) در متانول 50% با نسبت (حجم/ حجم) و اسید استیک 10 درصد با نسبت (حجم/ حجم) و آب مقطر 40% (حجم/ حجم) به مدت 20 دقیقه رنگآمیزی گردید. سپس ژل را برای از بین بردن رنگهای اضافی با محلول رنگبر شامل متانول 10% (حجم/ حجم) و استیک اسیدگلاسیال 10درصد با نسبت (حجم/ حجم) و آب مقطر 80 درصد (حجم/ حجم) به مدت 24 ساعت بر روی شیکر، رنگبری صورت پذیرفت.
طیف سنجی مادون قرمزFTIR (Fourier Transform Infrared Spectroscopy): یکی از تکنیکهای مورد استفاده برای تعیین ساختار ثانویه پلی پپتید و پروتئینها است. این تکنیک طیفسنجی، دارای قابلیت عدم تخریب نمونه میباشد. در این روش، گروههای عاملی موجود در ترکیبات مختلف قدرت جذب متفاوت اشعه مادون قرمز با طول موج مختلف را دارا میباشند. اطلاعات طیف بینی مادون قرمز تحت عنوان ارتعاشات واحد ساختاری گروههای عاملی نمودار میشوند. باندهای آمید I و آمید II از باندهای غالب در ساختار پروتئین و پلیپپتید میباشند .حساسترین ناحیه در طیف باند آمیدی I با عدد موج cm-11700-1600 است که متعلق به ارتعاشات کششی پیوند O=C در اتصالات پپتیدی پلیپپتید یا پروتئین میباشد. در مقایسه با آن باندهای آمید II متعلق به ارتعاشات پیوند C-N میباشد (39،6). به منظور بررسی طیفسنجی مادون قرمز، تست FTIR براساس روش زو و همکاران (40) انجام گرفت. طیفهایFTIR در رزولوشن 4 سانتیمتر در محدوده 4000-550 سانتیمتر در دمای اتاق مورد بررسی قرار گرفت. در این رابطه، قرصهای KBr شامل 2 میلیگرم نمونه در حدود100 میلیگرم برماید پتاسیم تهیه گردید. سپس قرصهای حاصله در سل مخصوص دستگاه FTIR (مدل Perkin Elmer Spectrum Two مدل LS55) قرار داده شد و با استفاده از نرمافزار OPUS آنالیزهای مربوطه انجام شده و طیف مربوطه تهیه گردید.
تجزیه وتحلیل اسیدهای آمینه
برای تجزیه و تحلیل اسیدهای آمینه از روشPico. Tag استفاده گردید (6). با کمک این روش مشتق اسید آمینه phenylthiocarbamyl و تعیین مشتقی از اسیدهای آمینه با استفاده از فنیل ایزوتیوسیانات و فاز معکوس با کارایی بالای کروماتوگرافی مایع به ترتیب انجام گردید. در ابتدا کلاژن خشک جداسازی شده از پوست ماهی به میزان 20-10 میلیگرم در اسیدکلریدریک 6 مولار حاوی 1% فنول (v/v) حل گردید. سپس مخلوط تهیه شده در معرض گازN2 قرار گرفت و قبل از هیدرولیز در دمای 110 درجه سانتیگراد برای یک شبانه روز، وکیوم گردید. بعد از هیدرولیز، نمونهها خشک شدند و با 5 میلی لیترآب مقطر رقیق شدند. 25 میکرولیتر از پروتئین خشک و مشتقگیری شدند یعنی 10 میکرولیتر از مخلوط متانول، آب و تری متیل آمین با نسبتهای 2:2:1 اضافه شد. نمونه مخلوط گردید و سپس برای 5 دقیقه خشک شد. پس از آن 20 میکرولیتر از متانول، آب، تریمتیلآمین و فنیلایزوتیوسیانات با نسبتهای 7:1:1:1 به آن اضافه گردید. نمونهها به مدت 20 دقیقه در دمای اتاق حدود 20 الی 25 درجه سانتیگراد زیر وکیوم خشک گردید و سپس در 200 میکرولیتر بافر فسفات با 4/7=pH حل شده و سپس با فیلتر 0/45 میکرون فیلتر گردید. در پایان 20 میکرولیتر از نمونههای فیلتر شده با استفاده از loader (WISPTM)(Millipore Corp, Milford, MA, USA) اتوماتیک به داخل ستون Pico.Tag برای آنالیز آمینو اسید تزریق شدند.
کشت سلولی و تجزیه و تحلیل نتایج کشت: با استفاده از سلولهای فیبروبلاست انسانی اهدایی مرکز تحقیقات نانو بیوتکنولوژی و مهندسی بافت دانشگاه علوم پزشکی شهید صدوقی، در شرایط استاندارد کشت سلولی (41) و با استفاده از محیط کشتDMEM (Dulbecco’s Modified Essential Medium) محتوی FBS (fetal bovine serum) 10 درصد در انکوباتور استاندارد کشت سلولی (درجه حرارت 37 درجه سانتیگراد و CO2 پنج درصد)، مقایسه میزان تکثیر سلولی بین نمونههای کشت کنترل (سه نمونه) و کشت بر کلاژن ماهی هوور دمدراز (سه نمونه) انجام و نتایج با کمک میکروسکوپ نوری و تکنسین با تجربه در کشت سلولی مقایسه گردید. محیط کشت هر 2 تا 3 روز تعویض شده و در دورههای مختلف زمانی نمونهها فیکس شده و پس از رنگآمیزی با هماتوکسیلین و ائوزین، مورد مقایسه و بررسی قرار گرفت.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی شهید صدوقی یزد تایید شده است (کد اخلاقIR.SSU.REC.1397.86 ).
نتایج
کلاژن از پوست ماهی هوور دمدراز به روش ناگایی (19) با اندکی تغییرات استخراج گردید. ارزیابی و میزان کلاژن استخراج شده از پوست ماهی هوور دمدراز 17/3% بود.
اسپکتروفتومتری UV: اسپکتروفتومتری کلاژن پوست ماهی هوور دمدراز انجام شد (تصویر2). میزان جذب UV کلاژن محلول در اسید (ASC) در طول موج 350-200 نانومتر مورد بررسی قرارگرفت. بیشتر پروتئینها حداکثر جذب اشعه ماورائ بنفش در طول موج 280 نانومتر دارند که این مهم به تعداد تیروزین و باقیماندههای تریپتوفان در پروتئینها ارتباط دارد. اسپکتروفتومتری UV حداکثر جذب را در 235 نانومتر نشان داد که این می تواند مربوط به گروههای CONH2، -COOH و C=O در زنجیره پلیپپتیدهای کلاژن باشد (تصویر 2).
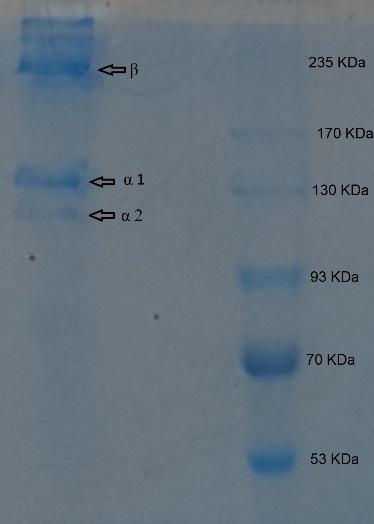
آزمون SDS-PAGE: کلاژن استخراج شده از پوست ماهی هوور دمدراز به وسیله آزمون SDS-PAGE امتحان شد. نتایج حاصل از آزمون SDS- PAGE نشان داد که کلاژن ماهی هوور دمدراز از دو زنجیره) αα1 و α2 (و β تشکیل شده است. همچنین نتیجه حاصل از این آزمون نشان داد که وزن مولکولی α1 حدود 135 کیلو دالتون و وزن ملکولی α2 حدود 125 کیلو دالتون است. (تصویر 3).
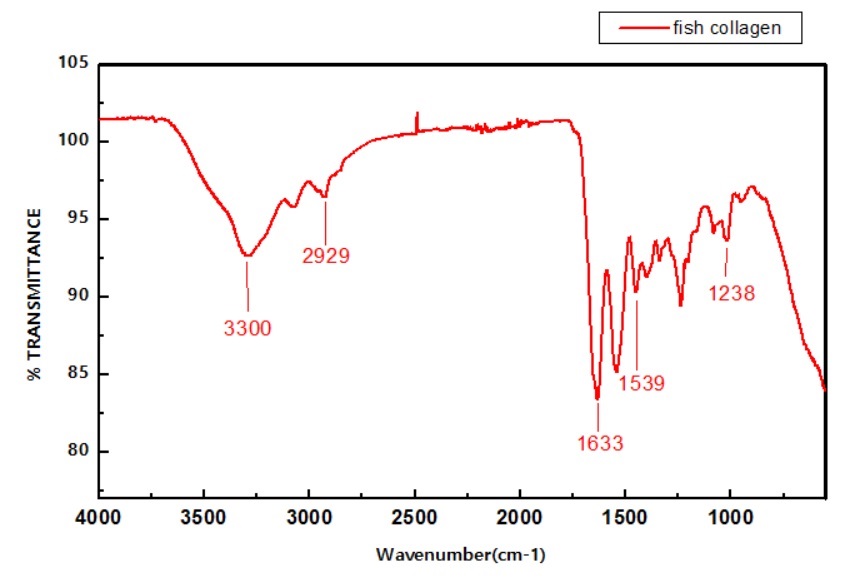
FTIR: طیف FTIR در محدوده 4000-550 در کلاژن محلول در اسید از ماهی هوور دمدراز در تصویر 4 ارائه شده است. گروه آمید A مربوط به فرکانس کشش N-H است. ارتعاش کششی آزاد N-H همراه با پیوند هیدروژن در محدوده cm-1 3300-3440 اتفاق میافتد. باند آمید A در 3300 مشاهده شده است. گروه آمید B باند در 2929 در ارتباط با کشش نامتقارن از CH2 مشخص شد. اوج جذب آمید I در 1633 مشاهده شده است که در ارتباط با ارتعاش کششی C=Oاز باند پیوند هیدروژن جفت شده با COO میباشد که به ساختار دوم پروتئین مربوط است. این ناحیه حساس به تغییرات ساختار ثانویه پروتئین است و اغلب برای تجزیه و تحلیل ساختار ثانویه پروتئین استفاده میشود. باند آمیدII در 1539 پیدا شد و همچنین پیک باند آمید III در 1238 جذب گردیده که این باندها ساختار مارپیچی را نشان میدهند. طیفهای مادون قرمز ثبت شده برای فیلمهای نازک ساخته شده از کلاژن ماهی هوور باندهای متداول برای کلاژن نوع I آمید A، آمید B، آمید I، آمید II و آمید III نشان داد. ویژگی آمید A معمولاً با ارتعاش کششی N-H مربوط است که در محدوده3440-3300cm-1 رخ میدهد. ماکزیمم پیک جذب شده از کلاژن ماهی هوور در 3300 بدست آمده است. هنگامی که گروه N-H از یک پپتید شامل یک پیوند هیدروژنی باشد موقعیت، شروع به تغییر جهت به فرکانسهای پائین میکند. تعداد موجهای مشخصه جذب شده در پیوند آمید I جذب معمولا در محدوده cm-11800 – 1620 میباشد که بهوسیله ارتعاش کششی از C=O در پلیپپتید پروتئین تولید میشود. این ناحیه به تغییرات دوم ساختار پروتئین حساس است و اغلب برای آنالیز ساختار دوم پروتئین استفاده میگردد. پیک جذبی آمید Iدر 1633 بهدست آمد. خم شدن N-H همراه با کشش C-N در محدوده 1650-1590 رخ میدهد و مربوط به باند آمید II میباشد که در 1539 ملاحظه شد. پیک آمید III در محدوده 1400-1200 در کمپلکس با عکسالعملهای داخلی در کلاژن است که شامل ترکیباتی از C-N کششی و N-H در سطح همواری در ارتباط با آمید و همچنین جذبهای ارتعاشی ناشی از تکان CH2 میباشد. طیفهای مادون قرمز برای پروتئین استخراج شده از پوست ماهی هوور به صورت مشخص استخراج کلاژن را تأیید میکند.
ترکیب اسیدهای آمینه کلاژن ماهی هووردمدراز: ترکیب اسیدهای آمینه کلاژن ماهی هوور دمدراز بر اساس باقی مانده (residue) در 1000 در جدول 1 نشان داده شده است. تجزیه و تحلیل اسیدآمینه مقدار بسیار بالایی از گلیسین را در کلاژن استخراج شده از پوست ماهی هوور نشان داد که حدود یک سوم از کل اسیدهای آمینه را شامل می شود. همچنین اسید آمینه پرولین به عنوان یک اسیدآمینه منحصر به فرد در ASC میباشد که دارای مقدار مشخصی 97/2 باقی مانده بر 1000 میباشد. آلانین، گلوتامات، آرژینین و پرولین بیشترین میزان از اسیدهای آمینه را تشکیل میدهند که میتواند به عنوان مشخصات کلاژن بهدست آمده در این مطالعه باشند. در کلاژن استخراج شده سیستئن وجود نداشت و آمینو اسیدهای متیونین، تیروزین و هیستیدین کمترین میزان را دارا بودند. مجموع ایمونواسیدها (پرولین و هیدروکسی پرولین) نیز 173 باقی مانده در 1000 بود.
کشت سلولهای فیبروبلاست: سلولهای فیبروبلاست بر روی کلاژن جداسازی شده از ماهی هوور کشت داده شدند. اتصال سلولی و تکثیر سلولی زیاد سلول بر روی کلاژن ماهی (تصویر 5)، نشان دهنده مناسب بودن کلاژن ماهی هوور برای رشد سلولی و استفاده در مهندسی بافت، یا زیست سازگاری میباشد. سلولها بهخوبی به سطح کلاژن متصل شده و پس از گسترش، شروع به تکثیر کردند. تا زمان تعویض مناسب محیط کشت و تامین فضای رشد، فیبروبلاستها با سرعت و کیفیت مناسبی به رشد و تکثیر ادامه دادند.

تصویر 2: اسپکتروفتومتری UV کلاژن پوست ماهی هوور دمدراز (Thunnus tonggol)
تصویر 3: الگوی الکتروفورز (SDS- PAGE) کلاژن از پوست هوور دمدراز (Thunnus tonggol)
تصویر 4: طیف FTIR کلاژن محلول در اسید از پوست ماهی هوور در بازه (cm-1) 550-4000
جدول 1: ترکیب اسیدهای آمینه در پوست ماهی هوور دمدراز به صورت میزان اسید آمینه در 1000 قسمت رسوب


تصویر 5: رشد و تکثیر سلولهای فیبروبلاست انسانی بر روی کلاژن ماهی هوور با رنگ آمیزی H&E (اسکیل برابر 20 میکرومتر).
بحث
میزان کلاژن جداسازی شده از پوست ماهی هوور دمدراز به مقدار 17/3 درصد بود که این میزان بیشتر از میزان کلاژن حاصل از پوست ماهی قباد (guttatus (Scomberomorus به میزان 14/5 درصد و پوست ماهی سفید (Rutilus kutum) به میزان 15/6 درصد (6) و پوست ماهی Brown stripe red snapper به میزان 9 درصد (42)، Dusky spinefoot،Sea chu ،Eagel ray ، Red stingery و Yanti به ترتیب 5/7,5/3,3/4,3/9 و 5/5 درصد (10) وBalloon fish 4درصد (43)، کیسه شنای Yellowfin tuna به میزان 1/07 درصد (30) و از طرف دیگر کمتر از کلاژن ماهی Malaysian catfish به میزان 18/11 درصد (42)، ماهی هوکی (BlueGrenadier) به میزان 20 درصد و ماهی Japanese sea-bass به میزان 51/4 درصد و ماهی Chub mackerel به میزان 49/8 درصد و ماهی Bullhead shark به میزان50/1 درصد و Ocellate puffer fish به میزان 44/7 درصد بود (8). در این تحقیق طول موج جذب شده کلاژن ماهی هوور در 235 نانومتر مشاهد گردید (تصویر 2) که میزان آن با جذب کلاژن سایر ماهیان مانند: Scomberomorus guttatus،Northern pike ، Black pomfret ، Balloon fish،Walleye pollock و Ictalurus punctaus و Sphyrna lewinنزدیک بود (47-43،10،1). اکثریت پروتئینها بیشترین میزان جذب فرابنفش را در طول موج 280 نانومتر دارا میباشند. فنیل آلانین، تریپتوفان و تیروزین باندهای جذبی بین 290-250 نانومتر دارند (48،47،23،1). به طورکلی، تیروزین و فنیلآلانین کروموفورهای حساسی هستند و نور UV ماوراء بنفش را در 283 نانومتر و 251 نانومتر جذب میکنند (46،23). فنیل آلانین و تیروزین دارای باندهای جذبی بین 250 و 290 نانومتر هستند، در حالیکه کلاژن در این منطقه جذب آشکاری ندارد. جذب مجزا از کلاژن پوست ماهی هوور در نزدیکی 235 نانومتر به دست آمد که میزان آن کمتر از 280 نانومتر است و از خاصیت کلاژن حمایت میکند و در نتیجه پروتئین جداسازی شده کلاژن است. کلاژن جداسازی شده از پوست این ماهی با استفاده از روش الکتروفورز مورد بررسی قرارگرفت (تصویر 3). الگوی الکتروفورز حاصل از کلاژن پوست ماهی نشان داد کلاژن حاصل از پوست ماهی به عنوان یک پلیمر طبیعی از دو زنجیره متفاوت α( α1 و α2) تشکیل گردیده است. با توجه به این موضوع موقعیت ارتعاشی الکتروفورز آلفا 1 متفاوت از آلفا 2 میباشد و زنجیره آلفا 1 دارای فضای ارتعاشی بیشتری بوده که نشان دهنده این است که وزن ملکولی آلفا 2 از آلفا 1 کمتر است. نتایج بهدست آمده از این مطالعه با یافته های سایر محققین مشابهت داشت (54-49،46،44،20،6،1). بررسی الگوی الکتروفورتیک کلاژن استخراجی از ماهی هوور دمدراز نشاندهنده عدم حضور پیوندهای دیسولفید در آن کلاژن است. به طورکلی کلاژن نوع I محتوی مقادیر کمتری از سیستئین (کمتر 2/0درصد) و متیونین (1/33- 1/24درصد) میباشد که نقش اساسی را در تشکیل باندهای دی سولفید ایفا می نمایند. البته کلاژنهای نوع III و VI محتوی مقادیری سیستئین قابل اکسید شدن خواهند بود (55). در نتیجه بر اساس تجزیه و تحلیل انجام شده بر روی الگوهای الکتروفورز و ترکیبات واحدهای تشکیل دهنده میتوان اعلام کرد که کلاژن پوست ماهی هوور از نوع کلاژن نوع I و به عنوان پروتئین اصلی آن میباشد و با مطالعات سایر محققین که نشان داده بخش اعظم کلاژن پوست کلاژن نوع I است در یک راستا میباشد (60-56،50،33،4،3). طیف مادون قرمز مشخصه هر مولکول است و گروههای خاصی از اتمها باعث ایجاد باندهایی میشوند که صرف نظر از ساختار مولکول نزدیک به 1 و در همان فرکانس وجود دارد. دقیقاً وجود این گروههای مشخص است که امکان دستیابی به اطلاعات ساختاری مفید را فراهم میکند. برای گروههای مختلف شیمیایی، طول موج جذب شده از ارتعاشات منحصر به فرد است و به نوع پیوند موجود (C = C، C-H ،C = O ، N-H و (O-H بستگی دارد (61). مادون قرمز میانی (عدد موج 4000 تا 400 سانتیمتر در منفی 1) محدودهای است که بیشترین کاربرد را برای توصیف ترکیبات آلی دارد. تصویر 4 طیف FTIR کلاژن محلول در اسید از پوست ماهی هوور در بازه 4000-550 سانتیمتر را نشان میدهد که مشابه و نزدیک به مطالعات سایر محققین بر روی کلاژن سایر انواع ماهی است (63-61،53،47،45،6). فرکانس کششی N-H با باند گروه آمید A در ارتباط میباشد. باندهای یافت شده مربوط به ارتعاش کششی آزاد N-H و O-H و درمحدوده 3400-3100 رخ میدهد و هنگامی که گروه NH یک پپتید در یک پیوند هیدروژن درگیر شود، موقعیت به فرکانس پایینتر معمولاً در نزدیکی 3300 منتقل میشود (64،53،1). موقعیت باند آمید A در این مطالعه در 3300 پیدا شد که نشان میدهد پیوندهایNH در پیوندهای هیدروژنی نقش دارند. باند آمید B کلاژن استخراجی در 2929 مشاهده گردید که مربوط به کشش نامتقارن CH2 میباشد. سه باند اصلی نشانه کلاژن نیز مشاهده گردید که موقعیت باند آمید I در 1633 مشاهده گردید که مربوط به ساختار ثانویه پروتئین میباشد و در ارتباط با ارتعاش کششی C = O است. باند آمید II در 1539 مشاهده شده و باند آمید III در 1238 مشاهده شد که نشان دهنده ارتعاش کششی C = O، ارتعاشات خمشی N-H و کشش C-H است. باند آمید I که با ساختار ثانویه پروتئین و باند آمید III در ارتباط است وجود ساختار مارپیچ را نشان میدهد و این نتایج وجود ساختار مارپیچی کلاژن استخراجی از ماهی هوور را نشان میدهد (61،57،53،6). پروفایل اسید آمینه کلاژن پوست ماهی هوور در جدول 1 نشان داده شده است که بهصورت باقیمانده در هر 1000 قسمت باقیمانده بیان میشود. نتایج نشان داد فراوانترین اسید آمینه در پوست ماهی هوور گلیسین (309 باقیمانده) و به دنبال آن پرولین (104 باقیمانده)، هیدروکسی پرولین (69 باقیمانده)، آلانین (95 باقیمانده) و اسید گلوتامیک (85 باقیمانده) است. گلیسین، هیدروکسی پرولین و پرولین اسیدهای آمینه مشخص کلاژن هستند که نشاندهنده محتوای بالای کلاژن در پوست ماهی است و کاملاً مشهود است که در کلاژن نوع I گلایسین، آلانین، پرولین و هیدروکسی پرولین به وفور یافت میشود. کمترین اسیدهای آمینه شایع در پوست ماهی هوور، تیروزین، هیستیدین و هیدروکسی لایزین بودند که هر 3 اسیدهای آمینه جزئی در کلاژن هستند. این نتایج نشان میدهد که پوست هوور منبع خوبی برای استخراج کلاژن نوع I است (33،7). بهطور کلی گلیسین موجود نزدیک به یک سوم کل رسوب را به خود اختصاص داده است و به عنوان اسید آمینه اصلی در کلاژن میباشد و میزان آن در سایر پروتئینها ناچیز است (7). در مطالعه و بررسی اسید آمینههای کلاژن استحصال شده از ماهی هوور مقدار زیادی از گلیسین را نشان میدهد که محتوای گلیسین کلاژن از پوست بهطور تقریبی حدود 30% کل اسیدهای آمینه را دارا است. میزان گلیسین موجود در کلاژن پوست ماهی هوور نسبت به گلیسین سایر ماهیان Turbot (33)، Salmon، African catfish و Baltic cod (52) و Seabass، Bighead Carp و ماهی Nibea Japonica (7) و Albacore Tuna (65)، cuttle fish(9) کمتر بوده است ولی نسبت به گلایسین ماهیان Scomberomorus gttatus و Rutilus kutum (6)،Catla catla and Cirrhinus mrigala (12)، (66)Nile perch ، channel catfish (47) و yellowfin tuna (30) بیشتر بوده است و اما با نتایج سایر محققین،Sail fish (67)،Dog Shark (65) و Sea urchin (68)، Minke whale(59)، Silver Carp (14) مشابهت داشت. Yan و همکاران (2008) گزارش کردهاند که محتوای هیدروکسی پرولین پوست ماهی Walleye pollock به مقدار 69 در 1000 باقی مانده است که مقدار آن با هیدروکسی پرولینی که در پژوهش کنونی از پوست ماهی هوور دمدراز بهدست آمده است (69 باقیمانده) مشابه میباشد. آلانین، گلوتامین، آرژنین و پرولین بیشترین میزان از اسیدهای آمینه را دارا میباشند که می تواند به عنوان یافتهها و مشخصات کلاژن در این مطالعه باشند. در کلاژن استخراج شده از پوست ماهی هوور، بر خلاف گونه Bighead Carp (0/2) (7) و Pacific cod (2) (34) و Turbot skin (4/7) (33) آمینو اسید سیستئن وجود نداشت. سیستئین به طور عمده نه در منابع آب شیرین و نه منابع دریایی شناسایی نشده است (48) که نتیجه این تحقیق مشابه نتایج سایر محققین بر روی گونههای Seabass،Nibea Japonica ،Scomberomorus guttatus، Rutilus Kutum،Albacore Tuna،Dog Shark ،Rohu، walleye Pollock (6،7،53،54) میباشد. آمینواسیدهای هیدروکسی لایزین و تیروزین و هیستیدین کمترین میزان را در کلاژن دارا بودند .میزان ایزولوسین بهدست آمده در کلاژن ماهی هوور پائین بود که میزان آن باNibea Japonica ،Bighead Carp (7) Salmonو Baltic cod (52)،Albacor tuna و Rohu (65) مشابهت داشت. ایمینواسیدها (پرولین و هیدروکسی پرولین) به پایداری ساختار کلاژن کمک مینمایند. محتوای بالای ایمینواسیدها به ویژه محتوای هیدروکسی پرولین بسیار با اهمیت میباشد زیرا بر خواص عملکردی کلاژن و همچنین پایداری حرارتی کلاژن تاثیرگذار میباشد. مقادیر ایمینواسیدهای کلاژن از پوست ماهی هوور 173 قسمت در 1000 قسمت رسوب بوده که با ماهی Balloon fish (43) به میزان 179 بسیار نزدیک بود اما نسبت به میزان ایمینواسیدهای کلاژن ماهیان Pacific cod به میزان 157 (34) و Sphyrna lewini به میزان 141/9 (46) و Salmon و Boltic cod به ترتیب به میزان 161 و 156/5(52) بیشتر بود اما نسبت به ماهی Turbot skinبه میزان 233 قسمت در 1000 قسمت باقیمانده (33) کمتر بود و همچنین از پوست پستاندارانی مانند خوک و گاو پایینتر میباشد (53). گروهی از محققین گزارش نمودهاند که کلاژن ماهی دارای مقادیر ایمینواسیدهای کمتری در مقایسه با کلاژن پستانداران بوده و میزان ایمینواسیدهای کلاژن های جانوری با زیستگاه آنها ارتباط دارد (69،30،20). رشد و تکثیر سلولهای فیبروبلاست بر روی کلاژن ماهی به عنوان یک بایو پلیمر طبیعی نشان داد که کلاژن ماهی مانند کلاژن پستانداران میتواند به عنوان یک محیط برای نگهداری و کشت انواع سلول بوده و علاوه بر آن میتواند به عنوان جایگزین کلاژن خوک و گاو که عمدهترین منابع تولید کلاژن میباشند مورد استفاده قرار بگیرد که نتایج این پژوهش با نتایج سایر محققین در یک راستا بود (70،41).
نتیجهگیری
میزان مناسبی کلاژن (ASC) با موفقیت از پوست ماهی هوور دمدراز جدا شد و توسط آزمایشات متفاوت و روشهای مختلف تحلیلی تایید گردید و کلاژن حاصل به عنوان کلاژن نوع I تایید شده است. نتایج بیانگر آن است که میتوان از این کلاژن با کمترین هزینه به عنوان یک جایگزین برای کلاژن حیوانی، در صنایع آرایشی، پزشکی و دارویی با موفقیت استفاده کرد. مطالعات نشان میدهد که ارزش غذایی پوست ماهی نسبتاً زیاد است و میتوان از طریق پردازش ضایعات پوست ماهی به روش محلول در اسید از این منابع به استثنای استفاده گاه به گاه آنها در تهیه پودر ماهی که هدر میرود استفاده نمود. علاوه بر آن رشد مناسب و سریعتر سلولهای فیبروبلاست بر روی کلاژن پوست ماهی، نشانه مناسب بودن این نوع کلاژن بعنوان یک منبع ارزان و در دسترس برای کشت انواع سلول و استفاده برای مهندسی بافتهای انسانی میباشد، گرچه مهندسی بافتهای انسانی راه درازی تا ساخت بافتهای فعال و متناسب بیماران در پیش دارد. فراهم ساختن بهترین و مناسبترین پیشسازهای بافت ازجمله انواع کلاژن مناسب و در دسترس کمکی در راه رسیدن به این هدف ارزشمند است. باوجود فراوانی منابع دریائی، حفاظت از منابع طبیعی دریا هم باید در نظر باشد. در عین حال منابع فراوانی بهعنوان محصولات مازاد دریایی در حال حاضر در دسترس می باشند ک در راه اهداف عالی مهندسی بافت و درمان بیماران صعب العلاج کاربرد دارند. نتایج زیست سازگاری و زیست تخریبپذیری سلولی و استفاده از این نوع کلاژن در مهندسی بافت در مقاله بعدی ارائه خواهد شد.
سپاسگزاری
نویسندگان از مراکز تحقیقاتی پژوهشکده علوم تولیدمثل یزد، خصوصا همکاری مرکز تحقیقات بیولوژی سلولهای بنیادی و مرکز تحقیقات نانوتکنولوژی و مهندسی بافت کمال تشکر و قدردانی را دارند. این مطالعه ماحصل طرح تحقیقاتی شماره 5928 مصوب دانشگاه علوم پزشکی شهید صدوقی یزد میباشد.
حامی مالی: این مطالعه با حمایت گرانت معاونت پژوهشی دانشگاه علوم پزشکی شهید صدوقی در پژوهشکده علوم تولید مثل یزد، مرکز تحقیقات نانوتکنولوژی پزشکی و مهندسی بافت و با همکاری مالی و معنوی دانشگاه آزاد اسلامی واحد علوم و تحقیقات تهران انجام گردیده است.
تعارض در منافع: وجود ندارد.
کلاژن یک پروتئین فیبری است که یک جزء مهم در ساختارهای حمایتی (غضروفها، تاندونها و ...) مهره داران و بیمهرگان است (1). کلاژن فراوان ترین پروتئین در مهره داران است که نقش مهمی در حفظ یکپارچگی بیولوژیکی و ساختاری بافتها دارد و به ساختار، شکل و ویژگیهای مکانیکی مولکولی بافتهای پیوندی مختلف بدن (به عنوان مثال پوست، استخوانها، رباط ها، تاندونها و غضروفها) کمک میکند. تقریباً 50% از کل کلاژن بدن انسان در پوست وجود دارد که بیشتر آن کلاژن نوع I است (5-2). کلاژنها خانوادهای از پروتئینهای رشتهای هستند که در همه حیوانات چند سلولی یافت میشوند. آنها توسط سلولهای بافت همبند و همچنین انواع سلولهای دیگر ترشح میشوند. این پروتئینها به عنوان یک جزء اصلی در پوست و استخوان و فراوانترین پروتئین در پستانداران هستند که حدود 25% و در بالاترین مقدار حدود 30% از کل پروتئین موجود در بدن حیوانات را تشکیل میدهند. کلاژن سازگاری بیولوژیکی عالی، تجزیه بیولوژیکی و تجدید زیست خوب و آنتیژنیسیته ضعیفی را نشان داده است. چنین ویژگیها و دانشهایی منجر به تولید انبوهی از دستگاههای زیست پزشکی مبتنی بر کلاژن، از جمله سیستمهای انتقال دارو، بخیههای جراحی و کاربردهای مهندسی بافت میشود. علاوه بر این، کلاژن دارای ساختار و ترکیب اسید آمینه به خوبی حفظ شده بین گونهها است، که در هنگام استفاده از کلاژنهای غیر انسانی در زمینه زیست پزشکی به خواص ذکر شده کمک میکند (6-4). استفاده از کلاژن دریایی با توجه به خواص منحصر به فرد آن در مقایسه با کلاژن حاصل از پستانداران مانند نداشتن خطر انتقال بیماریها، محدودیتهای مذهبی کمتر، فرآیند مقرون به صرفهتر، وزن مولکولی کم، سازگاری زیستی و جداسازی آسان و جذب بهتر توسط بدن انسان، در حال رشد سریع است (7). ویژگی اصلی یک مولکول کلاژن معمولی ساختار مارپیچ بلند، محکم و سه رشتهای آن است که از سه زنجیره پلیپپتیدی، به نامهای زنجیره α که در اطراف یکدیگر پیچیده میشوند تشکیل گردیده است. کلاژنها بسیار غنی از اسیدهای آمینه پرولین و گلیسین هستند که هر دو در تشکیل مارپیچ سه رشتهای مهم میباشند. پرولین به دلیل ساختار حلقهای، ساختار مارپیچی را در هر زنجیره α تثبیت میکند، در حالیکه گلیسین به طور منظم در هر باقیمانده سوم در سراسر منطقه مرکزی زنجیره α قرار دارد. گلیسین که کوچکترین اسید آمینه است (فقط یک اتم هیدروژن به عنوان یک زنجیره جانبی دارد)، به سه زنجیره α مارپیچ اجازه میدهد که محکم بسته شوند تا ابر مارپیچ کلاژن نهایی تشکیل شود (9،8). تا کنون 29 نوع کلاژن تشخیص داده شده و تمامی آنها نوعی ساختار مارپیچی سه گانه را نمایش میدهند. کلاژن ماهی نوع I بوده و با توجه به حلالیت فوق العاده زیاد آن در اسید رقیق درمقایسه با کلاژن پستانداران و ماکیان متفاوت و منحصر به فرد است. در مقایسه با کلاژن نوع I گوساله، کلاژن نوع I مهره داران پستتر مشتق شده از ماهیان استخوانی و لامپری، میزان تشابه ساختاری زیادی را بین گونهها با توجه به زنجیره های α1 و α2 نشان میدهد. پیش مادههای کلاژن با اثرگذاری بر ویژگیهای رشد سلولها و تنظیم جنبههای مختلف رفتار و عملکرد سلولی مانند الحاق سلولی، تکثیر و تمایز شناخته میشود. مطالعات گذشته روشن کرده است که ترکیب کلاژن ماهی مشابه کلاژن پستانداران است (10-8). با در نظر گرفتن بهرهبرداری تجاری، کلاژن موجود عمدتاً از حیوانات خشکی زی نظیر گاو، خوک، مرغ و گونههای از موش بهدست می آید. کلاژن ماهی منبع مناسبی برای کاربردهای مختلف است. از کلاژن ماهی به عنوان یک پروتئین نسبتاً ارزان که به راحتی در دسترس بوده و بهطور گستردهای در مقیاس صنعتی و عمدتاً برای تولید مواد خوراکی استفاده میشود. داروسازی ازجمله زمینههای در حال رشدی است که کلاژن با جنبههای مختلف نظیر محصولات آرایشی و درمانی در آن اهمیت ویژهای دارد. علاقه و تقاضا برای استفاده از کلاژن در کاربردهای پزشکی بسیار مشاهده میشود و مواد مبتنی بر کلاژن بهطور گستردهای در پزشکی ترمیمی نیز مورد استفاده قرار میگیرد. همچنین کلاژن در پزشکی برای تهیه انواع کِرِمها، گاز و باندهای ویژه پانسمان و ترمیم زخم و در داروسازی برای تهیه کپسولهای دارویی و قرصها مصرف میشود (16-11). به طورکلی، پوست و استخوان گاو و خوک، به عنوان منابع اصلی استخراج کلاژن و ژلاتین هستند. در سالهای اخیر توجه زیادی به جداسازی کلاژن از موجودات دریایی شده که علت آن عدم محدودیت استفاده از آن در رژیم غذایی و کم بودن خطر ابتلا به بیماریهای مُسری که شامل جنون گاوی، آنفولانزای خوکی و مرغی و همچنین بیماریهای گوارشی شایع در گاوها، خوکها و بوفالوها میباشد (17). علیرغم غربالگری دقیق بیماریهای قابل انتقال، خطر انتقال و وقوع بیماری جنون گاوی، منجر به ایجاد تشویش در بین مصرفکنندگان کلاژن و ژلاتین گاوی شده است. همچنین شیوع بیماریهایی مانند آنسفالوپاتی اسفنجی شکل قابل انتقال (TSE)، بیماری پا و دهان (FMD) در خوکها و گاوها و آنفولانزای خوکی و آنسفالوپاتی اسفنجی شکل گاوی (BSE) در بعضی کشورها جهان از اهمیت بالایی برخوردار است (20-18،11،8). همچنین محدودیتهای مذهبی علیالخصوص در اسلام، یهودیت و هندوها، استفاده و کاربردهای کلاژن مبتنی بر پستانداران را محدود میکند (25-21،15،12). کلاژن به دست آمده از ماهی ممکن است یک گزینه ایمن باشد، زیرا احتمال انتقال بیماریها هنوز نگران کننده نیست. علاوه بر این، محصولات جانبی فرآوری ماهی، مانند پوست، استخوانها و فلس، به طور کامل در دسترس هستند، و استفاده از آنها ضمن اینکه به حل مشکلات آلودگی محیط زیست مرتبط میپردازند، از بهره برداری پایدار از منابع دریایی از طریق ارزش سنجی باقیمانده اطمینان حاصل میکنند (4). شاید جالبترین کلاژنی که در آبزیان کشف شده است الاستودین بوده که از پروتئین باله کوسه ماهی میباشد. این پروتئین وزن مولکولی کمتری در مقایسه با اکثر کلاژنهای محلول دیگر دارد و همچنین مقدار تیروزین و سیستئین بالایی دارد که غیرعادی میباشد. این دو اسید آمینه در تشکیل اتصال شرکت دارند، ولی این پدیده در کلاژن پستانداران دیده نمیشود (26). در آمریکای شمالی پوست خوک، منبـع عمـده مـاده اولیـه بـرای تولید کلاژن نوع اول میباشد. پوست خوک بـه شـکل منجمـد در بستههای بزرگ به کارخانههای تولیـد کـلاژن بـرده مـیشـود. در اروپا نیز مقادیر زیادی پوست خوک بـرای تولیـد کـلاژن نـوع اول بهکار میرود، زیرا که بازده تولید کلاژن نـوع اول از آن بـالا بـوده و نیاز به مدت زمان کمتـری بـرای آمـاده کـردن مـواد اولیـه بـرای استخراج و مشکلات کمتری در ارتباط با فاضلاب کارخانه میباشد (13). با توجه به اهمیت موضوع، تاکنون مطالعات فراوانی توسط محققان بر روی کلاژن انواع ماهیها و بسیاری از موجودات دریایی از گونههای مختلف به عنوان منشاء زیست توده برای جداسازی کلاژن، از یک دیدگاه اساسی یا به عنوان ماده اولیه برای تولید بیوپلیمر و همچنین بررسی خصوصیات فیزیکی و شیمیایی آنها صورت گرفتهاند. در این مطالعات، ماهی و محصولات جانبی آن را به دلیل کم بودن ریسک انتقال بیماری، دسترسی آسان، نبودن محدودیتهای دینی و محتوای بالای کلاژنی به عنوان یک منبع امن معرفی کردهاند (35-27،13،6،3،1). ماهی تن دمدراز (تصویر 1) یکی از ارزشمندترین و مهمترین ماهیانی است که در مناطق گرمسیری تا نیمه گرمسیری اقیانوس هند و آرام زندگی میکند. صید ماهی تن در آبهای ساحلی کشورهای مختلف از جمله اندونزی، پاکستان، مالزی، عمان، یمن، هند و تایلند و ایران انجام میشود. در ایران صید صنعتی در خلیج فارس و دریای عمان صورت میپذیرد که از نظر اقتصادی برای صنایع شیلات بسیار مهم است. ایران رتبه دوم در صید ماهی تن و گونههای مختلف تن ماهیان از اقیانوس هند را دارد. میزان صید ماهی تن و گونههای مختلف تن ماهیان در ایران از 54 هزار تن در سال 1997 به 251 هزار تن در سال 2016 (حدود 4 برابر) افزایش یافته است. توجه به نقش اصلی فعالیتهای شیلات در کشورهایی که در سواحل آبهای آزاد واقع شده اند، در توسعه پایدار صنعت شیلات بسیار مهم است. از این نظر، ایران نمونه خوبی است که در حاشیه خلیج فارس و دریای عمان واقع شده و به اقیانوس هند دسترسی دارد (36).
 تصویر 1: ماهی تن دمدراز Thunnus tonggol
تصویر 1: ماهی تن دمدراز Thunnus tonggolروش بررسی
در مطالعه بنیادی حاضر، منـابع کلاژنـی شـامل پوسـت ماهی هوور دمدراز از بازار ماهی فروشان بندرعباس تهیه، نمونـههـا بـه صـورت منجمـد بـه آزمایشـگاه مرکز تحقیقات نانوتکنولوژی پزشکی و مهندسی بافت دانشگاه علوم پزشکی شهید صدوقی یزد منتقـل و تـا شـروع آزمایشات به همان حالت نگهداری گردید.
مواد شیمیایی: سود سوزآور(سدیم هیدروکسید)، بوتیل الکل (1- بوتانول)، آکریل آماید، بیس آکریل آماید، سدیم کلراید، تریس (هیدروکسی متیل) آمینومتان، سدیم دوسیل سولفات، آمونیوم پرسولفات، گلیسرول، مرکاپتواتانول، بروم فنل بلو، کومایسی آر 250 از شرکت سیگما آلدریچ تهیه شده و متانول و اسید استیک گلاسیال از شرکت مِرک آلمان و مارکر پروتئین از شرکت سینا ژن (SL7002) تهیه گردید. برای انجام آزمایش تمام مواد در سردخانه با دمای 25- درجه سانتیگراد در آزمایشگاه به مدت یک هفته نگهداری شد. شرایط دمایی در تمام طول فرایند تحقیق 4 درجه سانتیگراد و pH ثابت با مقدار 7/2 و کنترل شده میباشد.
استخراج قلیایی مواد پروتئینی غیر کلاژنی: تمامی مراحل با استفاده از روش ناگایی (19) با اندکی تغییر انجام شد. ابتدا پوست ماهی تهیه و آمادهسازی شده به میزان 100 گرم با استفاده از آب مقطر سرد چندین بار شستشو داده شدند. سپس به آن NaOH 0/1 مولار با نسبت (W/V) 1:20 اضافه گردید. سوسپانسیون بهمدت 24 ساعت توسط استیرر بهم زده شد. محلول نهایی را از صافی رد کرده و با آب مقطر سرد شستشو داده تا pH آن خنثی شود.
چربیزدایی از بافت: نمونهها در محلول بوتیل الکل 10% با نسب1:10 به مدت 24 ساعت مخلوط و بهم زده شدند. هر 8 ساعت محلول تعویض گردید. بافت بدون چربی با آب مقطر سرد به طور کامل شستشو داده شد (19).
آماده سازی کلاژن محلول در اسید (ASC) Acid-soluble collagen از پوست ماهی هوور دمدراز: برای استخراج کلاژن، بافت آماده شده در اسید استیک 0/5 مولار با نسبت (W/V) 1:20 به مدت 72 ساعت روی همزن قرار گرفت. مخلوط از طریق دو لایه پارچه صافی، صاف گردید. سپس سوپرناتانت جمعآوری شده و در دمای 4 درجه سانتیگراد نگهداری شد. باقیمانده به همان روش قبلی مجدداً استخراج گردید. سپس عصاره بهدست آمده در سانتریفوژ یخچالدار به مدت 1 ساعت با سرعت ده هزار دور در دقیقه قرار گرفته و عصارهگیری گردید. هر دو سوپرناتانت به دست آمده در NaCL 0/9 مولار به مدت 30 دقیقه قرار گرفت. سپس به NaCl برای بهدست آمدن یک غلظت نهایی از 2/6 مولار در 0/05 تریس باpH: 7 (هیدروکسی متیل آمینومتان( اضافه شد و 30 دقیقه استیرر گردید. رسوب حاصل بهوسیله سانتریفیوژ یخچالدار به مدت 45 دقیقه با سرعت ده هزار در دقیقه جمعآوری گردید. رسوب بهدست آمده به مدت 6 ساعت در اسید استیک 0/5 مولار حل شد و سپس به مدت 48 ساعت در اسید استیک 0/1 مولار دیالیز D117, D116)) گردید و نهایتاً برای 72 ساعت در آب مقطر سرد دیالیز گردید. هر 6 ساعت آب دیالیز تعویض شد تا زمانیکه به pH خنثی برسد. رسوب دیالیز شده به وسیله فریزدرایر در دمای منفی 55 درجه سانتیگراد و فشار P5 به مدت 48 ساعت خشک گردید و به عنوان کلاژن محلول در اسید معرفی گردید (19).
عملکرد و بازده کلاژن استخراجی: میزان کلاژن محلول در اسید بر اساس وزن خشک ماده اولیه محاسبه شد (37).
Yield % =Weight of lyophilized collagen (g)/ Weight of initial dry skin ×100
در تمامی تستها، نمونهها بهصورت سه تایی در هر دسته مورد بررسی قرار گرفت.
اسپکتروفتومتریUV: جذب اتمی UV کلاژن درمحدوده طول موج 400-200 نانومتر توسط دستگاه اسپکتروفتومترUnico مدلuv4802 انجام شد. کلاژن خالص در اسید استیک 0/5 مولار حل گردید. برای به دست آوردن غلظت مناسب 0/5 میلیگرم/ میلیلیتر حل شد. 200 میکرولیتر از محلول در 800 میکرولیتر از اسید استیک 0/5 مولار حل گردید. سپس مقدار 1 میلیلیتر از محلول همگن شده را داخل ظرف کووت (Cuvette)ریخته و برای تعیین طول موج جذب در دستگاه قرار داده شد (6).
آزمون SDS-PAGE: برای انجام این آزمون از ژل پلیآکریلآمید 30/8 درصد استفاده گردید. در این مرحله از ژل پائین 8% و از ژل بالای 3/5% استفاده شد. کلاژن ماهی هوور در اسیداستیک 4% حل شده و به مدت 10 دقیقه در آب جوش 95 درجه سانتیگراد گذاشته شدند و سپس نمونهها به همراه مارکر پروتئین بر روی ژل و درون چاهکها منتقل گردیدند (38). نهایتاً با ولتاژ 120 ولت به مدت 3 ساعت الکتروفورز انجام شد. بعد از الکتروفورز، ژل با کوماسی آبی 0/1 درصد (وزن/ حجم) در متانول 50% با نسبت (حجم/ حجم) و اسید استیک 10 درصد با نسبت (حجم/ حجم) و آب مقطر 40% (حجم/ حجم) به مدت 20 دقیقه رنگآمیزی گردید. سپس ژل را برای از بین بردن رنگهای اضافی با محلول رنگبر شامل متانول 10% (حجم/ حجم) و استیک اسیدگلاسیال 10درصد با نسبت (حجم/ حجم) و آب مقطر 80 درصد (حجم/ حجم) به مدت 24 ساعت بر روی شیکر، رنگبری صورت پذیرفت.
طیف سنجی مادون قرمزFTIR (Fourier Transform Infrared Spectroscopy): یکی از تکنیکهای مورد استفاده برای تعیین ساختار ثانویه پلی پپتید و پروتئینها است. این تکنیک طیفسنجی، دارای قابلیت عدم تخریب نمونه میباشد. در این روش، گروههای عاملی موجود در ترکیبات مختلف قدرت جذب متفاوت اشعه مادون قرمز با طول موج مختلف را دارا میباشند. اطلاعات طیف بینی مادون قرمز تحت عنوان ارتعاشات واحد ساختاری گروههای عاملی نمودار میشوند. باندهای آمید I و آمید II از باندهای غالب در ساختار پروتئین و پلیپپتید میباشند .حساسترین ناحیه در طیف باند آمیدی I با عدد موج cm-11700-1600 است که متعلق به ارتعاشات کششی پیوند O=C در اتصالات پپتیدی پلیپپتید یا پروتئین میباشد. در مقایسه با آن باندهای آمید II متعلق به ارتعاشات پیوند C-N میباشد (39،6). به منظور بررسی طیفسنجی مادون قرمز، تست FTIR براساس روش زو و همکاران (40) انجام گرفت. طیفهایFTIR در رزولوشن 4 سانتیمتر در محدوده 4000-550 سانتیمتر در دمای اتاق مورد بررسی قرار گرفت. در این رابطه، قرصهای KBr شامل 2 میلیگرم نمونه در حدود100 میلیگرم برماید پتاسیم تهیه گردید. سپس قرصهای حاصله در سل مخصوص دستگاه FTIR (مدل Perkin Elmer Spectrum Two مدل LS55) قرار داده شد و با استفاده از نرمافزار OPUS آنالیزهای مربوطه انجام شده و طیف مربوطه تهیه گردید.
تجزیه وتحلیل اسیدهای آمینه
برای تجزیه و تحلیل اسیدهای آمینه از روشPico. Tag استفاده گردید (6). با کمک این روش مشتق اسید آمینه phenylthiocarbamyl و تعیین مشتقی از اسیدهای آمینه با استفاده از فنیل ایزوتیوسیانات و فاز معکوس با کارایی بالای کروماتوگرافی مایع به ترتیب انجام گردید. در ابتدا کلاژن خشک جداسازی شده از پوست ماهی به میزان 20-10 میلیگرم در اسیدکلریدریک 6 مولار حاوی 1% فنول (v/v) حل گردید. سپس مخلوط تهیه شده در معرض گازN2 قرار گرفت و قبل از هیدرولیز در دمای 110 درجه سانتیگراد برای یک شبانه روز، وکیوم گردید. بعد از هیدرولیز، نمونهها خشک شدند و با 5 میلی لیترآب مقطر رقیق شدند. 25 میکرولیتر از پروتئین خشک و مشتقگیری شدند یعنی 10 میکرولیتر از مخلوط متانول، آب و تری متیل آمین با نسبتهای 2:2:1 اضافه شد. نمونه مخلوط گردید و سپس برای 5 دقیقه خشک شد. پس از آن 20 میکرولیتر از متانول، آب، تریمتیلآمین و فنیلایزوتیوسیانات با نسبتهای 7:1:1:1 به آن اضافه گردید. نمونهها به مدت 20 دقیقه در دمای اتاق حدود 20 الی 25 درجه سانتیگراد زیر وکیوم خشک گردید و سپس در 200 میکرولیتر بافر فسفات با 4/7=pH حل شده و سپس با فیلتر 0/45 میکرون فیلتر گردید. در پایان 20 میکرولیتر از نمونههای فیلتر شده با استفاده از loader (WISPTM)(Millipore Corp, Milford, MA, USA) اتوماتیک به داخل ستون Pico.Tag برای آنالیز آمینو اسید تزریق شدند.
کشت سلولی و تجزیه و تحلیل نتایج کشت: با استفاده از سلولهای فیبروبلاست انسانی اهدایی مرکز تحقیقات نانو بیوتکنولوژی و مهندسی بافت دانشگاه علوم پزشکی شهید صدوقی، در شرایط استاندارد کشت سلولی (41) و با استفاده از محیط کشتDMEM (Dulbecco’s Modified Essential Medium) محتوی FBS (fetal bovine serum) 10 درصد در انکوباتور استاندارد کشت سلولی (درجه حرارت 37 درجه سانتیگراد و CO2 پنج درصد)، مقایسه میزان تکثیر سلولی بین نمونههای کشت کنترل (سه نمونه) و کشت بر کلاژن ماهی هوور دمدراز (سه نمونه) انجام و نتایج با کمک میکروسکوپ نوری و تکنسین با تجربه در کشت سلولی مقایسه گردید. محیط کشت هر 2 تا 3 روز تعویض شده و در دورههای مختلف زمانی نمونهها فیکس شده و پس از رنگآمیزی با هماتوکسیلین و ائوزین، مورد مقایسه و بررسی قرار گرفت.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی شهید صدوقی یزد تایید شده است (کد اخلاقIR.SSU.REC.1397.86 ).
نتایج
کلاژن از پوست ماهی هوور دمدراز به روش ناگایی (19) با اندکی تغییرات استخراج گردید. ارزیابی و میزان کلاژن استخراج شده از پوست ماهی هوور دمدراز 17/3% بود.
اسپکتروفتومتری UV: اسپکتروفتومتری کلاژن پوست ماهی هوور دمدراز انجام شد (تصویر2). میزان جذب UV کلاژن محلول در اسید (ASC) در طول موج 350-200 نانومتر مورد بررسی قرارگرفت. بیشتر پروتئینها حداکثر جذب اشعه ماورائ بنفش در طول موج 280 نانومتر دارند که این مهم به تعداد تیروزین و باقیماندههای تریپتوفان در پروتئینها ارتباط دارد. اسپکتروفتومتری UV حداکثر جذب را در 235 نانومتر نشان داد که این می تواند مربوط به گروههای CONH2، -COOH و C=O در زنجیره پلیپپتیدهای کلاژن باشد (تصویر 2).
آزمون SDS-PAGE: کلاژن استخراج شده از پوست ماهی هوور دمدراز به وسیله آزمون SDS-PAGE امتحان شد. نتایج حاصل از آزمون SDS- PAGE نشان داد که کلاژن ماهی هوور دمدراز از دو زنجیره) αα1 و α2 (و β تشکیل شده است. همچنین نتیجه حاصل از این آزمون نشان داد که وزن مولکولی α1 حدود 135 کیلو دالتون و وزن ملکولی α2 حدود 125 کیلو دالتون است. (تصویر 3).
FTIR: طیف FTIR در محدوده 4000-550 در کلاژن محلول در اسید از ماهی هوور دمدراز در تصویر 4 ارائه شده است. گروه آمید A مربوط به فرکانس کشش N-H است. ارتعاش کششی آزاد N-H همراه با پیوند هیدروژن در محدوده cm-1 3300-3440 اتفاق میافتد. باند آمید A در 3300 مشاهده شده است. گروه آمید B باند در 2929 در ارتباط با کشش نامتقارن از CH2 مشخص شد. اوج جذب آمید I در 1633 مشاهده شده است که در ارتباط با ارتعاش کششی C=Oاز باند پیوند هیدروژن جفت شده با COO میباشد که به ساختار دوم پروتئین مربوط است. این ناحیه حساس به تغییرات ساختار ثانویه پروتئین است و اغلب برای تجزیه و تحلیل ساختار ثانویه پروتئین استفاده میشود. باند آمیدII در 1539 پیدا شد و همچنین پیک باند آمید III در 1238 جذب گردیده که این باندها ساختار مارپیچی را نشان میدهند. طیفهای مادون قرمز ثبت شده برای فیلمهای نازک ساخته شده از کلاژن ماهی هوور باندهای متداول برای کلاژن نوع I آمید A، آمید B، آمید I، آمید II و آمید III نشان داد. ویژگی آمید A معمولاً با ارتعاش کششی N-H مربوط است که در محدوده3440-3300cm-1 رخ میدهد. ماکزیمم پیک جذب شده از کلاژن ماهی هوور در 3300 بدست آمده است. هنگامی که گروه N-H از یک پپتید شامل یک پیوند هیدروژنی باشد موقعیت، شروع به تغییر جهت به فرکانسهای پائین میکند. تعداد موجهای مشخصه جذب شده در پیوند آمید I جذب معمولا در محدوده cm-11800 – 1620 میباشد که بهوسیله ارتعاش کششی از C=O در پلیپپتید پروتئین تولید میشود. این ناحیه به تغییرات دوم ساختار پروتئین حساس است و اغلب برای آنالیز ساختار دوم پروتئین استفاده میگردد. پیک جذبی آمید Iدر 1633 بهدست آمد. خم شدن N-H همراه با کشش C-N در محدوده 1650-1590 رخ میدهد و مربوط به باند آمید II میباشد که در 1539 ملاحظه شد. پیک آمید III در محدوده 1400-1200 در کمپلکس با عکسالعملهای داخلی در کلاژن است که شامل ترکیباتی از C-N کششی و N-H در سطح همواری در ارتباط با آمید و همچنین جذبهای ارتعاشی ناشی از تکان CH2 میباشد. طیفهای مادون قرمز برای پروتئین استخراج شده از پوست ماهی هوور به صورت مشخص استخراج کلاژن را تأیید میکند.
ترکیب اسیدهای آمینه کلاژن ماهی هووردمدراز: ترکیب اسیدهای آمینه کلاژن ماهی هوور دمدراز بر اساس باقی مانده (residue) در 1000 در جدول 1 نشان داده شده است. تجزیه و تحلیل اسیدآمینه مقدار بسیار بالایی از گلیسین را در کلاژن استخراج شده از پوست ماهی هوور نشان داد که حدود یک سوم از کل اسیدهای آمینه را شامل می شود. همچنین اسید آمینه پرولین به عنوان یک اسیدآمینه منحصر به فرد در ASC میباشد که دارای مقدار مشخصی 97/2 باقی مانده بر 1000 میباشد. آلانین، گلوتامات، آرژینین و پرولین بیشترین میزان از اسیدهای آمینه را تشکیل میدهند که میتواند به عنوان مشخصات کلاژن بهدست آمده در این مطالعه باشند. در کلاژن استخراج شده سیستئن وجود نداشت و آمینو اسیدهای متیونین، تیروزین و هیستیدین کمترین میزان را دارا بودند. مجموع ایمونواسیدها (پرولین و هیدروکسی پرولین) نیز 173 باقی مانده در 1000 بود.
کشت سلولهای فیبروبلاست: سلولهای فیبروبلاست بر روی کلاژن جداسازی شده از ماهی هوور کشت داده شدند. اتصال سلولی و تکثیر سلولی زیاد سلول بر روی کلاژن ماهی (تصویر 5)، نشان دهنده مناسب بودن کلاژن ماهی هوور برای رشد سلولی و استفاده در مهندسی بافت، یا زیست سازگاری میباشد. سلولها بهخوبی به سطح کلاژن متصل شده و پس از گسترش، شروع به تکثیر کردند. تا زمان تعویض مناسب محیط کشت و تامین فضای رشد، فیبروبلاستها با سرعت و کیفیت مناسبی به رشد و تکثیر ادامه دادند.

تصویر 2: اسپکتروفتومتری UV کلاژن پوست ماهی هوور دمدراز (Thunnus tonggol)

تصویر 3: الگوی الکتروفورز (SDS- PAGE) کلاژن از پوست هوور دمدراز (Thunnus tonggol)

تصویر 4: طیف FTIR کلاژن محلول در اسید از پوست ماهی هوور در بازه (cm-1) 550-4000
جدول 1: ترکیب اسیدهای آمینه در پوست ماهی هوور دمدراز به صورت میزان اسید آمینه در 1000 قسمت رسوب


تصویر 5: رشد و تکثیر سلولهای فیبروبلاست انسانی بر روی کلاژن ماهی هوور با رنگ آمیزی H&E (اسکیل برابر 20 میکرومتر).
بحث
میزان کلاژن جداسازی شده از پوست ماهی هوور دمدراز به مقدار 17/3 درصد بود که این میزان بیشتر از میزان کلاژن حاصل از پوست ماهی قباد (guttatus (Scomberomorus به میزان 14/5 درصد و پوست ماهی سفید (Rutilus kutum) به میزان 15/6 درصد (6) و پوست ماهی Brown stripe red snapper به میزان 9 درصد (42)، Dusky spinefoot،Sea chu ،Eagel ray ، Red stingery و Yanti به ترتیب 5/7,5/3,3/4,3/9 و 5/5 درصد (10) وBalloon fish 4درصد (43)، کیسه شنای Yellowfin tuna به میزان 1/07 درصد (30) و از طرف دیگر کمتر از کلاژن ماهی Malaysian catfish به میزان 18/11 درصد (42)، ماهی هوکی (BlueGrenadier) به میزان 20 درصد و ماهی Japanese sea-bass به میزان 51/4 درصد و ماهی Chub mackerel به میزان 49/8 درصد و ماهی Bullhead shark به میزان50/1 درصد و Ocellate puffer fish به میزان 44/7 درصد بود (8). در این تحقیق طول موج جذب شده کلاژن ماهی هوور در 235 نانومتر مشاهد گردید (تصویر 2) که میزان آن با جذب کلاژن سایر ماهیان مانند: Scomberomorus guttatus،Northern pike ، Black pomfret ، Balloon fish،Walleye pollock و Ictalurus punctaus و Sphyrna lewinنزدیک بود (47-43،10،1). اکثریت پروتئینها بیشترین میزان جذب فرابنفش را در طول موج 280 نانومتر دارا میباشند. فنیل آلانین، تریپتوفان و تیروزین باندهای جذبی بین 290-250 نانومتر دارند (48،47،23،1). به طورکلی، تیروزین و فنیلآلانین کروموفورهای حساسی هستند و نور UV ماوراء بنفش را در 283 نانومتر و 251 نانومتر جذب میکنند (46،23). فنیل آلانین و تیروزین دارای باندهای جذبی بین 250 و 290 نانومتر هستند، در حالیکه کلاژن در این منطقه جذب آشکاری ندارد. جذب مجزا از کلاژن پوست ماهی هوور در نزدیکی 235 نانومتر به دست آمد که میزان آن کمتر از 280 نانومتر است و از خاصیت کلاژن حمایت میکند و در نتیجه پروتئین جداسازی شده کلاژن است. کلاژن جداسازی شده از پوست این ماهی با استفاده از روش الکتروفورز مورد بررسی قرارگرفت (تصویر 3). الگوی الکتروفورز حاصل از کلاژن پوست ماهی نشان داد کلاژن حاصل از پوست ماهی به عنوان یک پلیمر طبیعی از دو زنجیره متفاوت α( α1 و α2) تشکیل گردیده است. با توجه به این موضوع موقعیت ارتعاشی الکتروفورز آلفا 1 متفاوت از آلفا 2 میباشد و زنجیره آلفا 1 دارای فضای ارتعاشی بیشتری بوده که نشان دهنده این است که وزن ملکولی آلفا 2 از آلفا 1 کمتر است. نتایج بهدست آمده از این مطالعه با یافته های سایر محققین مشابهت داشت (54-49،46،44،20،6،1). بررسی الگوی الکتروفورتیک کلاژن استخراجی از ماهی هوور دمدراز نشاندهنده عدم حضور پیوندهای دیسولفید در آن کلاژن است. به طورکلی کلاژن نوع I محتوی مقادیر کمتری از سیستئین (کمتر 2/0درصد) و متیونین (1/33- 1/24درصد) میباشد که نقش اساسی را در تشکیل باندهای دی سولفید ایفا می نمایند. البته کلاژنهای نوع III و VI محتوی مقادیری سیستئین قابل اکسید شدن خواهند بود (55). در نتیجه بر اساس تجزیه و تحلیل انجام شده بر روی الگوهای الکتروفورز و ترکیبات واحدهای تشکیل دهنده میتوان اعلام کرد که کلاژن پوست ماهی هوور از نوع کلاژن نوع I و به عنوان پروتئین اصلی آن میباشد و با مطالعات سایر محققین که نشان داده بخش اعظم کلاژن پوست کلاژن نوع I است در یک راستا میباشد (60-56،50،33،4،3). طیف مادون قرمز مشخصه هر مولکول است و گروههای خاصی از اتمها باعث ایجاد باندهایی میشوند که صرف نظر از ساختار مولکول نزدیک به 1 و در همان فرکانس وجود دارد. دقیقاً وجود این گروههای مشخص است که امکان دستیابی به اطلاعات ساختاری مفید را فراهم میکند. برای گروههای مختلف شیمیایی، طول موج جذب شده از ارتعاشات منحصر به فرد است و به نوع پیوند موجود (C = C، C-H ،C = O ، N-H و (O-H بستگی دارد (61). مادون قرمز میانی (عدد موج 4000 تا 400 سانتیمتر در منفی 1) محدودهای است که بیشترین کاربرد را برای توصیف ترکیبات آلی دارد. تصویر 4 طیف FTIR کلاژن محلول در اسید از پوست ماهی هوور در بازه 4000-550 سانتیمتر را نشان میدهد که مشابه و نزدیک به مطالعات سایر محققین بر روی کلاژن سایر انواع ماهی است (63-61،53،47،45،6). فرکانس کششی N-H با باند گروه آمید A در ارتباط میباشد. باندهای یافت شده مربوط به ارتعاش کششی آزاد N-H و O-H و درمحدوده 3400-3100 رخ میدهد و هنگامی که گروه NH یک پپتید در یک پیوند هیدروژن درگیر شود، موقعیت به فرکانس پایینتر معمولاً در نزدیکی 3300 منتقل میشود (64،53،1). موقعیت باند آمید A در این مطالعه در 3300 پیدا شد که نشان میدهد پیوندهایNH در پیوندهای هیدروژنی نقش دارند. باند آمید B کلاژن استخراجی در 2929 مشاهده گردید که مربوط به کشش نامتقارن CH2 میباشد. سه باند اصلی نشانه کلاژن نیز مشاهده گردید که موقعیت باند آمید I در 1633 مشاهده گردید که مربوط به ساختار ثانویه پروتئین میباشد و در ارتباط با ارتعاش کششی C = O است. باند آمید II در 1539 مشاهده شده و باند آمید III در 1238 مشاهده شد که نشان دهنده ارتعاش کششی C = O، ارتعاشات خمشی N-H و کشش C-H است. باند آمید I که با ساختار ثانویه پروتئین و باند آمید III در ارتباط است وجود ساختار مارپیچ را نشان میدهد و این نتایج وجود ساختار مارپیچی کلاژن استخراجی از ماهی هوور را نشان میدهد (61،57،53،6). پروفایل اسید آمینه کلاژن پوست ماهی هوور در جدول 1 نشان داده شده است که بهصورت باقیمانده در هر 1000 قسمت باقیمانده بیان میشود. نتایج نشان داد فراوانترین اسید آمینه در پوست ماهی هوور گلیسین (309 باقیمانده) و به دنبال آن پرولین (104 باقیمانده)، هیدروکسی پرولین (69 باقیمانده)، آلانین (95 باقیمانده) و اسید گلوتامیک (85 باقیمانده) است. گلیسین، هیدروکسی پرولین و پرولین اسیدهای آمینه مشخص کلاژن هستند که نشاندهنده محتوای بالای کلاژن در پوست ماهی است و کاملاً مشهود است که در کلاژن نوع I گلایسین، آلانین، پرولین و هیدروکسی پرولین به وفور یافت میشود. کمترین اسیدهای آمینه شایع در پوست ماهی هوور، تیروزین، هیستیدین و هیدروکسی لایزین بودند که هر 3 اسیدهای آمینه جزئی در کلاژن هستند. این نتایج نشان میدهد که پوست هوور منبع خوبی برای استخراج کلاژن نوع I است (33،7). بهطور کلی گلیسین موجود نزدیک به یک سوم کل رسوب را به خود اختصاص داده است و به عنوان اسید آمینه اصلی در کلاژن میباشد و میزان آن در سایر پروتئینها ناچیز است (7). در مطالعه و بررسی اسید آمینههای کلاژن استحصال شده از ماهی هوور مقدار زیادی از گلیسین را نشان میدهد که محتوای گلیسین کلاژن از پوست بهطور تقریبی حدود 30% کل اسیدهای آمینه را دارا است. میزان گلیسین موجود در کلاژن پوست ماهی هوور نسبت به گلیسین سایر ماهیان Turbot (33)، Salmon، African catfish و Baltic cod (52) و Seabass، Bighead Carp و ماهی Nibea Japonica (7) و Albacore Tuna (65)، cuttle fish(9) کمتر بوده است ولی نسبت به گلایسین ماهیان Scomberomorus gttatus و Rutilus kutum (6)،Catla catla and Cirrhinus mrigala (12)، (66)Nile perch ، channel catfish (47) و yellowfin tuna (30) بیشتر بوده است و اما با نتایج سایر محققین،Sail fish (67)،Dog Shark (65) و Sea urchin (68)، Minke whale(59)، Silver Carp (14) مشابهت داشت. Yan و همکاران (2008) گزارش کردهاند که محتوای هیدروکسی پرولین پوست ماهی Walleye pollock به مقدار 69 در 1000 باقی مانده است که مقدار آن با هیدروکسی پرولینی که در پژوهش کنونی از پوست ماهی هوور دمدراز بهدست آمده است (69 باقیمانده) مشابه میباشد. آلانین، گلوتامین، آرژنین و پرولین بیشترین میزان از اسیدهای آمینه را دارا میباشند که می تواند به عنوان یافتهها و مشخصات کلاژن در این مطالعه باشند. در کلاژن استخراج شده از پوست ماهی هوور، بر خلاف گونه Bighead Carp (0/2) (7) و Pacific cod (2) (34) و Turbot skin (4/7) (33) آمینو اسید سیستئن وجود نداشت. سیستئین به طور عمده نه در منابع آب شیرین و نه منابع دریایی شناسایی نشده است (48) که نتیجه این تحقیق مشابه نتایج سایر محققین بر روی گونههای Seabass،Nibea Japonica ،Scomberomorus guttatus، Rutilus Kutum،Albacore Tuna،Dog Shark ،Rohu، walleye Pollock (6،7،53،54) میباشد. آمینواسیدهای هیدروکسی لایزین و تیروزین و هیستیدین کمترین میزان را در کلاژن دارا بودند .میزان ایزولوسین بهدست آمده در کلاژن ماهی هوور پائین بود که میزان آن باNibea Japonica ،Bighead Carp (7) Salmonو Baltic cod (52)،Albacor tuna و Rohu (65) مشابهت داشت. ایمینواسیدها (پرولین و هیدروکسی پرولین) به پایداری ساختار کلاژن کمک مینمایند. محتوای بالای ایمینواسیدها به ویژه محتوای هیدروکسی پرولین بسیار با اهمیت میباشد زیرا بر خواص عملکردی کلاژن و همچنین پایداری حرارتی کلاژن تاثیرگذار میباشد. مقادیر ایمینواسیدهای کلاژن از پوست ماهی هوور 173 قسمت در 1000 قسمت رسوب بوده که با ماهی Balloon fish (43) به میزان 179 بسیار نزدیک بود اما نسبت به میزان ایمینواسیدهای کلاژن ماهیان Pacific cod به میزان 157 (34) و Sphyrna lewini به میزان 141/9 (46) و Salmon و Boltic cod به ترتیب به میزان 161 و 156/5(52) بیشتر بود اما نسبت به ماهی Turbot skinبه میزان 233 قسمت در 1000 قسمت باقیمانده (33) کمتر بود و همچنین از پوست پستاندارانی مانند خوک و گاو پایینتر میباشد (53). گروهی از محققین گزارش نمودهاند که کلاژن ماهی دارای مقادیر ایمینواسیدهای کمتری در مقایسه با کلاژن پستانداران بوده و میزان ایمینواسیدهای کلاژن های جانوری با زیستگاه آنها ارتباط دارد (69،30،20). رشد و تکثیر سلولهای فیبروبلاست بر روی کلاژن ماهی به عنوان یک بایو پلیمر طبیعی نشان داد که کلاژن ماهی مانند کلاژن پستانداران میتواند به عنوان یک محیط برای نگهداری و کشت انواع سلول بوده و علاوه بر آن میتواند به عنوان جایگزین کلاژن خوک و گاو که عمدهترین منابع تولید کلاژن میباشند مورد استفاده قرار بگیرد که نتایج این پژوهش با نتایج سایر محققین در یک راستا بود (70،41).
نتیجهگیری
میزان مناسبی کلاژن (ASC) با موفقیت از پوست ماهی هوور دمدراز جدا شد و توسط آزمایشات متفاوت و روشهای مختلف تحلیلی تایید گردید و کلاژن حاصل به عنوان کلاژن نوع I تایید شده است. نتایج بیانگر آن است که میتوان از این کلاژن با کمترین هزینه به عنوان یک جایگزین برای کلاژن حیوانی، در صنایع آرایشی، پزشکی و دارویی با موفقیت استفاده کرد. مطالعات نشان میدهد که ارزش غذایی پوست ماهی نسبتاً زیاد است و میتوان از طریق پردازش ضایعات پوست ماهی به روش محلول در اسید از این منابع به استثنای استفاده گاه به گاه آنها در تهیه پودر ماهی که هدر میرود استفاده نمود. علاوه بر آن رشد مناسب و سریعتر سلولهای فیبروبلاست بر روی کلاژن پوست ماهی، نشانه مناسب بودن این نوع کلاژن بعنوان یک منبع ارزان و در دسترس برای کشت انواع سلول و استفاده برای مهندسی بافتهای انسانی میباشد، گرچه مهندسی بافتهای انسانی راه درازی تا ساخت بافتهای فعال و متناسب بیماران در پیش دارد. فراهم ساختن بهترین و مناسبترین پیشسازهای بافت ازجمله انواع کلاژن مناسب و در دسترس کمکی در راه رسیدن به این هدف ارزشمند است. باوجود فراوانی منابع دریائی، حفاظت از منابع طبیعی دریا هم باید در نظر باشد. در عین حال منابع فراوانی بهعنوان محصولات مازاد دریایی در حال حاضر در دسترس می باشند ک در راه اهداف عالی مهندسی بافت و درمان بیماران صعب العلاج کاربرد دارند. نتایج زیست سازگاری و زیست تخریبپذیری سلولی و استفاده از این نوع کلاژن در مهندسی بافت در مقاله بعدی ارائه خواهد شد.
سپاسگزاری
نویسندگان از مراکز تحقیقاتی پژوهشکده علوم تولیدمثل یزد، خصوصا همکاری مرکز تحقیقات بیولوژی سلولهای بنیادی و مرکز تحقیقات نانوتکنولوژی و مهندسی بافت کمال تشکر و قدردانی را دارند. این مطالعه ماحصل طرح تحقیقاتی شماره 5928 مصوب دانشگاه علوم پزشکی شهید صدوقی یزد میباشد.
حامی مالی: این مطالعه با حمایت گرانت معاونت پژوهشی دانشگاه علوم پزشکی شهید صدوقی در پژوهشکده علوم تولید مثل یزد، مرکز تحقیقات نانوتکنولوژی پزشکی و مهندسی بافت و با همکاری مالی و معنوی دانشگاه آزاد اسلامی واحد علوم و تحقیقات تهران انجام گردیده است.
تعارض در منافع: وجود ندارد.
References:
1- Naderi Gharagheshlagh S, Nourani MR, Jamili S, Fatemi MJ, Sharifi AM. Isolation and Characterization of acid-soluble Collagen from the Skin of Scomberomorus guttatus of Persian Gulf. J of Applied Tissue Engineering 2018; 5(3).
2- Alves A, Marques A, Martins E, Silva T, Reis R. Cosmetic Potential of Marine Fish Skin Collagen. Cosmetics 2017; 4: 39.
3- Arumugam GKS, Sharma D, Balakrishnan RM, Ettiyappan JBP. Extraction, Optimization and Characterization of Collagen From Sole Fish Skin. Sustainable Chemistry and Pharmacy 2018; 9: 19-26.
4- Carvalho AM, Marques AP, Silva TH, Reis RL. Evaluation of the Potential of Collagen from Codfish Skin as a Biomaterial for Biomedical Applications. Mar Drugs 2018; 16(12): 495.
5- Nalinanon S, Benjakul S, Kishimura H, Osako K. Type I Collagen from the Skin of Ornate Threadfin Bream (Nemipterus Hexodon): Characteristics and Effect of Pepsin Hydrolysis. Food Chemistry 2011; 125(2): 500-7.
6- Naderi Gharagheshlagh S, Fatemi MJ, Jamili S, Sharifi AM, Nourani MR. Isolation and Characterization of Acid-Soluble Collagen from the Skin of Rutilus Frisii Kutum (Kamensky) of the Caspian Sea. Iranian Journal of Fisheries Sciences 2020; 19(2): 768-79.
7- Jafari H, Lista A, Siekapen MM, Ghaffari-Bohlouli P, Nie L, Alimoradi H, et al. Fish Collagen: Extraction, Characterization, and Applications for Biomaterials Engineering. Polymers 2020; 12(10): 2230.
8- Nagai T. Collagen from Diamondback Squid (Thysanoteuthis Rhombus) Outer Skin. Z Naturforsch C J Biosci 2004; 59(3-4): 271-5.
9- Nagai T, Yamashita E, Taniguchi K, Kanamori N, Suzuki N. Isolation and Characterisation of Collagen from the Outer Skin Waste Material of Cuttlefish (Sepia Lycidas). Food Chemistry 2001; 72(4): 425-9.
10- Bae I, Osatomi K, Yoshida A, Osako K, Yamaguchi A, Hara K. Biochemical Properties of Acid-Soluble Collagens Extracted from the Skins of Underutilised Fishes. Food Chemistry 2008; 108(1): 49-54.
11- Bhagwat PK, Dandge PB. Isolation, Characterization and Valorizable Applications of Fish Scale Collagen in Food and Agriculture Industries. Biocatalysis and Agricultural Biotechnology 2016; 7: 234-40.
12- Mahboob S. Isolation and Characterization of Collagen from Fish Waste Material- Skin, Scales and Fins of Catla Catla and Cirrhinus Mrigala. J Food Sci Technol 2015; 52(7): 4296-305.
13- Nagai T, Suzuki N. Isolation of Collagen from Fish Waste Material — Skin, Bone and Fins. Food Chemistry 2000; 68(3): 277-81.
14- Safandowska M, Pietrucha K. Effect of Fish Collagen Modification on Its Thermal and Rheological Properties. Int J Biol Macromol 2013; 53: 32-7.
15- Sionkowska A, Kozlowska J, editors. Fish Scales as a Biocomposite of Collagen and Calcium Salts. Key Engineering Materials 2014: 185-90.
16- Venkatesan J, Anil S, Kim SK, Shim MS. Marine Fish Proteins and Peptides for Cosmeceuticals: A Review. Mar Drugs 2017; 15(5): 143.
17- Yamada S, Yamamoto K, Ikeda T, Yanagiguchi K, Hayashi Y. Potency of Fish Collagen as a Scaffold for Regenerative Medicine. Biomed Res Int 2014; 2014: 302932.
18- European Food Safety A. The European :union: Summary Report on Surveillance for the Presence of Transmissible Spongiform Encephalopathies (TSE) in 2019. EFSA J 2020; 18(11): e06303.
19- Nagai T, Saito M, Tanoue Y, Kai N, Suzuki N. Characterization of Collagen from Sakhalin Taimen Skin as Useful Biomass. Food Technol Biotechnol 2020; 58(4): 445-54.
20- Nazeer RA, Kavitha R, Ganesh RJ, Naqash SY, Kumar NS, Ranjith R. Detection of collagen through FTIR and HPLC from the body and foot of Donax cuneatus Linnaeus, 1758. J Food Sci Technol 2014; 51(4): 750-5.
21- Beishenaliev A, Lim SS, Tshai KY, Khiew PS, Moh'd Sghayyar HN, Loh HS. Fabrication and Preliminary in Vitro Evaluation of Ultraviolet-Crosslinked Electrospun Fish Scale Gelatin Nanofibrous Scaffolds. J Mater Sci Mater Med 2019; 30(6): 62.
22- Dayton MT. Porcine and Bovine Surgical Products: Jewish, Muslim, and Hindu Perspectives-Invited Critique. Arch Surg 2008; 143(4): 370.
23- Fu W, Liu Z, Feng B, Hu R, He X, Wang H, et al. Electrospun Gelatin/PCL and Collagen/PLCL Scaffolds for Vascular Tissue Engineering. Int J Nanomedicine 2014; 9: 2335-44.
24- Lin P, Hua N, Hsu YC, Kan KW, Chen JH, Lin YH, et al. Oral Collagen Drink for Antiaging: Antioxidation, Facilitation of the Increase of Collagen Synthesis, and Improvement of Protein Folding and DNA Repair in Human Skin Fibroblasts. Oxid Med Cell Longev 2020; 2020: 1-9.
25- Nalinanon S, Benjakul S, Kishimura H, Osako K. Partial Characterization of Collagen from Pharaoh Cuttlefish (Sepia Pharaonis) Skin. International Conference on Nutrition and Food Sciences 2012; 39: 47-51.
26- Nomura Y. Properties and Utiliztion of Shark Collagen. Developments in Food Science 2004; 42: 147-58.
27- Aewsiri T, Benjakul S, Visessanguan W, Tanaka M. Chemical Compositions and Functional Properties of Gelatin from Pre-Cooked Tuna Fin. International J Food Science & Technology 2008; 43(4): 685-93.
28- Claverie M, McReynolds C, Petitpas A, Thomas M, Fernandes SCM. Marine-Derived Polymeric Materials and Biomimetics: An Overview. Polymers 2020; 12(5): 1002.
29- Ge B, Wang H, Li J, Liu H, Yin Y, Zhang N, et al. Comprehensive Assessment of Nile Tilapia Skin (Oreochromis niloticus) Collagen Hydrogels for Wound Dressings. Mar Drugs 2020; 18(4): 178
30- Kaewdang O, Benjakul S, Kaewmanee T, Kishimura H. Characteristics of Collagens from the Swim Bladders of Yellowfin Tuna (Thunnus Albacares). Food Chem 2014; 155: 264-70.
31- Li Y, Wang B, Li B. The in Vitro Bioavailability of Anti-Platelet Peptides in Collagen Hydrolysate from Silver Carp (Hypophthalmichthys Molitrix) Skin. J Food Biochem 2020; 44(6): e13226.
32- Lim YS, Ok YJ, Hwang SY, Kwak JY, Yoon S. Marine Collagen as A Promising Biomaterial for Biomedical Applications. Mar Drugs 2019; 17(8): 467.
33- Sun J, Zhang J, Zhao D, Xue C, Liu Z, Mao X. Characterization of Turbot (Scophthalmus maximus) Skin and the Extracted Acid-Soluble Collagen. Journal of Ocean University of China 2019; 18(3): 687-92.
34- Sun L, Li B, Song W, Si L, Hou H. Characterization of Pacific Cod (Gadus Macrocephalus) Skin Collagen and Fabrication of Collagen Sponge as a Good Biocompatible Biomedical Material. Process Biochemistry 2017; 63: 229-35.
35- Zhou H, Chen R, Wang J, Lu J, Yu T, Wu X, et al. Biphasic Fish Collagen Scaffold for Osteochondral Regeneration. Materials & Design 2020; 197: 108947.
36- Sistani MA, Adeli A, Mira SA. A Value Chain Analysis on Tuna and Tuna-Like Species in Iran. Iranian Journal of Fisheries Sciences 2021; 20(1): 195-208.
37- Radhika Rajasree SR, Gobalakrishnan M, Aranganathan L, Karthih MG. Fabrication and Characterization of Chitosan Based Collagen/ Gelatin Composite Scaffolds from Big Eye Snapper Priacanthus Hamrur Skin for Antimicrobial and Anti Oxidant Applications. Mater Sci Eng C Mater Biol Appl 2020; 107: 110270.
38- Laemmli UK. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature 1970; 227(5259): 680-5.
39- Kong J, Yu S. Fourier Transform Infrared Spectroscopic Analysis of Protein Secondary Structures. Acta Biochim Biophys Sin (Shanghai) 2007; 39(8): 549-59.
40- Xu R, Chen Y, Wan D, Wang J. Identification of Four Sedum Plant Medicines by Fourier Transform Infrared Spectra. Pharmacogn Mag 2012; 8(30): 107-10.
41- Li Q, Mu L, Zhang F, Sun Y, Chen Q, Xie C, et al. A Novel Fish Collagen Scaffold as Dural Substitute. Mater Sci Eng C Mater Biol Appl 2017; 80: 346-51.
42- Kiew PL, Mashitah MD. Isolation and characterization of collagen from the skin of Malaysian catfish (Hybrid Clarias sp.). J Korean Soc Appl Biol Chem 2013; 56(4): 441-50.
43- Huang Y-R, Shiau C-Y, Chen H-H, Huang B-C. Isolation And Characterization of Acid and Pepsin-Solubilized Collagens from the Skin of Balloon Fish (Diodon Holocanthus). Food Hydrocolloids 2011; 25(6): 1507-13.
44- Adibzadeh N, Aminzadeh S, Jamili S, Karkhane AA, Farrokhi N. Purification and Characterization of Pepsin-Solubilized Collagen from Skin of Sea Cucumber Holothuria Parva. Appl Biochem Biotechnol 2014; 173(1): 143-54.
45- Kozlowska J, Sionkowska A, Skopinska-Wisniewska J, Piechowicz K. Northern Pike (Esox Lucius) Collagen: Extraction, Characterization and Potential Application. Int J Biol Macromol 2015; 81: 220-7.
46- Lin YK, Liu DC. Comparison of Physical–Chemical Properties of Type I Collagen from Different Species. Food Chemistry 2006; 99(2): 244-51.
47- Liu H, Li D, Guo S. Studies on Collagen from the Skin of Channel Catfish (Ictalurus Punctaus). Food Chemistry 2007; 101(2): 621-5.
48- Zhang F, Wang A, Li Z, He S, Shao L. Preparation and Characterisation of Collagen from Freshwater Fish Scales. Food and Nutrition Sciences 2011; 2(8): 818-23.
49- AlizadehNodeh M, Moradi Z, Nourani MRJJoATE. Isolation and Purification of Collagen From the Skin of Black Pomfret (Parastromateus Niger) for Tissue Engineering Purpose. J of Applied Tissue Engineering 2014; 1(1): 18-21.
50- Jeong H-S, Venkatesan J, Kim S-K. Isolation and Characterization of Collagen from Marine Fish (Thunnus Obesus). Biotechnology and Bioprocess Engineering 2014; 18(6): 1185-91.
51- Liu D, Zhang X, Li T, Yang H, Zhang H, Regenstein JM, et al. Extraction and Characterization of Acid- and Pepsin-Soluble Collagens from the Scales, Skins and Swim-Bladders of Grass Carp (Ctenopharyngodon Idella). Food Bioscience 2015; 9: 68-74.
52- Tylingo R, Mania S. Isolation and Characterization of Acid Soluble Collagen from the Skin of African Catfish (Clarias gariepinus), Salmon (Salmo salar) and Baltic Cod (Gadus morhua). J Biotechnol Biomater 2016; 6(2): 1-6.
53- Yan M, Li B, Zhao X, Ren G, Zhuang Y, Hou H, et al. Characterization of Acid-Soluble Collagen from the Skin of Walleye Pollock (Theragra Chalcogramma). Food Chemistry 2008; 107(4): 1581-6.
54- Zhang J, Duan R, Tian Y, Konno K. Characterisation of Acid-Soluble Collagen from Skin of Silver Carp (Hypophthalmichthys Molitrix). Food Chemistry 2009; 116(1): 318-22.
55- Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. Characterisation of Acid-Soluble Collagen from Skin and Bone of Bigeye Snapper (Priacanthus Tayenus). Food Chemistry 2005; 89(3): 363-72.
56- Fatemi MJ, Garahgheshlagh SN, Ghadimi T, Jamili S, Nourani MR, Sharifi AM, et al. Investigating the Impact of Collagen-Chitosan Derived From Scomberomorus Guttatus and Shrimp Skin on Second-Degree Burn in Rats Model. Regen Ther 2021; 18: 12-20.
57- Krishnamoorthi J, Ramasamy P, Shanmugam V, Shanmugam A. Isolation and Partial Characterization of Collagen from Outer Skin of Sepia Pharaonis (Ehrenberg, 1831) from Puducherry Coast. Biochem Biophys Rep 2017; 10: 39-45.
58- Muralidharan N, Jeya Shakila R, Sukumar D, Jeyasekaran G. Skin, Bone and Muscle Collagen Extraction from the Trash Fish, Leather Jacket (Odonus Niger) and their Characterization. J Food Sci Technol 2013; 50(6): 1106-13.
59- Nagai T, Suzuki N, Nagashima T. Collagen from Common Minke Whale (Balaenoptera Acutorostrata) Unesu. Food Chem 2008; 111(2): 296-301.
60- Yan M, Qin S, Li J. Study on the Self-Assembly Property of Type I Collagen Prepared from Tilapia (Oreochromis Niloticus) Skin by Different Extraction Methods. International Journal of Food Science & Technology 2015; 50(9): 2088-96.
61- Silva Junior ZS, Botta SB, Ana PA, Franca CM, Fernandes KP, Mesquita-Ferrari RA, et al. Effect of Papain-Based Gel on Type I Collagen--Spectroscopy Applied for Microstructural Analysis. Sci Rep 2015; 5: 11448.
62- Muyonga JH, Cole CGB, Duodu KG. Fourier Transform Infrared (FTIR) Spectroscopic Study of Acid Soluble Collagen and Gelatin from Skins and Bones of Young and Adult Nile Perch (Lates Niloticus). Food Chemistry 2004; 86(3): 325-32.
63- Simpson BK, Nollet LM, Toldrá F, Benjakul S, Paliyath G, Hui Y. Food Biochemistry and Food Processing: John Wiley & Sons; 2012.
64- Kumar B, Rani S. Technical Note on the Isolation and Characterization of Collagen from Fish Waste Material. J Food Sci Technol 2017; 54(1): 276-8.
65- Hema G, Shyni K, Mathew S, Anandan R, Ninan G, Lakshmanan P. A Simple Method for Isolation of Fish Skin Collagen-Biochemical Characterization of Skin Collagen Extracted from Albacore Tuna (Thunnus Alalunga), Dog Shark (Scoliodon Sorrakowah) and Rohu (Labeo Rohita). Annals of Biological Research 2013; 4(1): 271-8.
66- Muyonga JH, Cole CGB, Duodu KG. Characterisation of Acid Soluble Collagen from Skins of Young and Adult Nile Perch (Lates Niloticus). Food Chemistry 2004; 85(1): 81-9.
67- Tamilmozhi S, Veeruraj A, Arumugam M. Isolation and Characterization of Acid and Pepsin-Solubilized Collagen from the Skin of Sailfish (Istiophorus Platypterus). Food Research International 2013; 54(2): 1499-505.
68- Nagai T, Suzuki N. Partial Characterization of Collagen from Purple Sea Urchin (Anthocidaris Crassispina) Test. International Journal of Food Science and Technology 2000; 35(5): 497-501.
69- Jongjareonrak A, Benjakul S, Visessanguan W, Nagai T, Tanaka M. Isolation and Characterisation of Acid and Pepsin-Solubilised Collagens from the Skin of Brownstripe Red Snapper (Lutjanus Vitta). Food Chemistry 2005; 93(3): 475-84.
70- El-Rashidy AA, Gad A, Abu-Hussein AE-HG, Habib SI, Badr NA, Hashem AAJIjobm. Chemical and Biological Evaluation of Egyptian Nile Tilapia (Oreochromis Niloticas) Fish. Scale Collagen 2015; 79: 618-26.
1- Naderi Gharagheshlagh S, Nourani MR, Jamili S, Fatemi MJ, Sharifi AM. Isolation and Characterization of acid-soluble Collagen from the Skin of Scomberomorus guttatus of Persian Gulf. J of Applied Tissue Engineering 2018; 5(3).
2- Alves A, Marques A, Martins E, Silva T, Reis R. Cosmetic Potential of Marine Fish Skin Collagen. Cosmetics 2017; 4: 39.
3- Arumugam GKS, Sharma D, Balakrishnan RM, Ettiyappan JBP. Extraction, Optimization and Characterization of Collagen From Sole Fish Skin. Sustainable Chemistry and Pharmacy 2018; 9: 19-26.
4- Carvalho AM, Marques AP, Silva TH, Reis RL. Evaluation of the Potential of Collagen from Codfish Skin as a Biomaterial for Biomedical Applications. Mar Drugs 2018; 16(12): 495.
5- Nalinanon S, Benjakul S, Kishimura H, Osako K. Type I Collagen from the Skin of Ornate Threadfin Bream (Nemipterus Hexodon): Characteristics and Effect of Pepsin Hydrolysis. Food Chemistry 2011; 125(2): 500-7.
6- Naderi Gharagheshlagh S, Fatemi MJ, Jamili S, Sharifi AM, Nourani MR. Isolation and Characterization of Acid-Soluble Collagen from the Skin of Rutilus Frisii Kutum (Kamensky) of the Caspian Sea. Iranian Journal of Fisheries Sciences 2020; 19(2): 768-79.
7- Jafari H, Lista A, Siekapen MM, Ghaffari-Bohlouli P, Nie L, Alimoradi H, et al. Fish Collagen: Extraction, Characterization, and Applications for Biomaterials Engineering. Polymers 2020; 12(10): 2230.
8- Nagai T. Collagen from Diamondback Squid (Thysanoteuthis Rhombus) Outer Skin. Z Naturforsch C J Biosci 2004; 59(3-4): 271-5.
9- Nagai T, Yamashita E, Taniguchi K, Kanamori N, Suzuki N. Isolation and Characterisation of Collagen from the Outer Skin Waste Material of Cuttlefish (Sepia Lycidas). Food Chemistry 2001; 72(4): 425-9.
10- Bae I, Osatomi K, Yoshida A, Osako K, Yamaguchi A, Hara K. Biochemical Properties of Acid-Soluble Collagens Extracted from the Skins of Underutilised Fishes. Food Chemistry 2008; 108(1): 49-54.
11- Bhagwat PK, Dandge PB. Isolation, Characterization and Valorizable Applications of Fish Scale Collagen in Food and Agriculture Industries. Biocatalysis and Agricultural Biotechnology 2016; 7: 234-40.
12- Mahboob S. Isolation and Characterization of Collagen from Fish Waste Material- Skin, Scales and Fins of Catla Catla and Cirrhinus Mrigala. J Food Sci Technol 2015; 52(7): 4296-305.
13- Nagai T, Suzuki N. Isolation of Collagen from Fish Waste Material — Skin, Bone and Fins. Food Chemistry 2000; 68(3): 277-81.
14- Safandowska M, Pietrucha K. Effect of Fish Collagen Modification on Its Thermal and Rheological Properties. Int J Biol Macromol 2013; 53: 32-7.
15- Sionkowska A, Kozlowska J, editors. Fish Scales as a Biocomposite of Collagen and Calcium Salts. Key Engineering Materials 2014: 185-90.
16- Venkatesan J, Anil S, Kim SK, Shim MS. Marine Fish Proteins and Peptides for Cosmeceuticals: A Review. Mar Drugs 2017; 15(5): 143.
17- Yamada S, Yamamoto K, Ikeda T, Yanagiguchi K, Hayashi Y. Potency of Fish Collagen as a Scaffold for Regenerative Medicine. Biomed Res Int 2014; 2014: 302932.
18- European Food Safety A. The European :union: Summary Report on Surveillance for the Presence of Transmissible Spongiform Encephalopathies (TSE) in 2019. EFSA J 2020; 18(11): e06303.
19- Nagai T, Saito M, Tanoue Y, Kai N, Suzuki N. Characterization of Collagen from Sakhalin Taimen Skin as Useful Biomass. Food Technol Biotechnol 2020; 58(4): 445-54.
20- Nazeer RA, Kavitha R, Ganesh RJ, Naqash SY, Kumar NS, Ranjith R. Detection of collagen through FTIR and HPLC from the body and foot of Donax cuneatus Linnaeus, 1758. J Food Sci Technol 2014; 51(4): 750-5.
21- Beishenaliev A, Lim SS, Tshai KY, Khiew PS, Moh'd Sghayyar HN, Loh HS. Fabrication and Preliminary in Vitro Evaluation of Ultraviolet-Crosslinked Electrospun Fish Scale Gelatin Nanofibrous Scaffolds. J Mater Sci Mater Med 2019; 30(6): 62.
22- Dayton MT. Porcine and Bovine Surgical Products: Jewish, Muslim, and Hindu Perspectives-Invited Critique. Arch Surg 2008; 143(4): 370.
23- Fu W, Liu Z, Feng B, Hu R, He X, Wang H, et al. Electrospun Gelatin/PCL and Collagen/PLCL Scaffolds for Vascular Tissue Engineering. Int J Nanomedicine 2014; 9: 2335-44.
24- Lin P, Hua N, Hsu YC, Kan KW, Chen JH, Lin YH, et al. Oral Collagen Drink for Antiaging: Antioxidation, Facilitation of the Increase of Collagen Synthesis, and Improvement of Protein Folding and DNA Repair in Human Skin Fibroblasts. Oxid Med Cell Longev 2020; 2020: 1-9.
25- Nalinanon S, Benjakul S, Kishimura H, Osako K. Partial Characterization of Collagen from Pharaoh Cuttlefish (Sepia Pharaonis) Skin. International Conference on Nutrition and Food Sciences 2012; 39: 47-51.
26- Nomura Y. Properties and Utiliztion of Shark Collagen. Developments in Food Science 2004; 42: 147-58.
27- Aewsiri T, Benjakul S, Visessanguan W, Tanaka M. Chemical Compositions and Functional Properties of Gelatin from Pre-Cooked Tuna Fin. International J Food Science & Technology 2008; 43(4): 685-93.
28- Claverie M, McReynolds C, Petitpas A, Thomas M, Fernandes SCM. Marine-Derived Polymeric Materials and Biomimetics: An Overview. Polymers 2020; 12(5): 1002.
29- Ge B, Wang H, Li J, Liu H, Yin Y, Zhang N, et al. Comprehensive Assessment of Nile Tilapia Skin (Oreochromis niloticus) Collagen Hydrogels for Wound Dressings. Mar Drugs 2020; 18(4): 178
30- Kaewdang O, Benjakul S, Kaewmanee T, Kishimura H. Characteristics of Collagens from the Swim Bladders of Yellowfin Tuna (Thunnus Albacares). Food Chem 2014; 155: 264-70.
31- Li Y, Wang B, Li B. The in Vitro Bioavailability of Anti-Platelet Peptides in Collagen Hydrolysate from Silver Carp (Hypophthalmichthys Molitrix) Skin. J Food Biochem 2020; 44(6): e13226.
32- Lim YS, Ok YJ, Hwang SY, Kwak JY, Yoon S. Marine Collagen as A Promising Biomaterial for Biomedical Applications. Mar Drugs 2019; 17(8): 467.
33- Sun J, Zhang J, Zhao D, Xue C, Liu Z, Mao X. Characterization of Turbot (Scophthalmus maximus) Skin and the Extracted Acid-Soluble Collagen. Journal of Ocean University of China 2019; 18(3): 687-92.
34- Sun L, Li B, Song W, Si L, Hou H. Characterization of Pacific Cod (Gadus Macrocephalus) Skin Collagen and Fabrication of Collagen Sponge as a Good Biocompatible Biomedical Material. Process Biochemistry 2017; 63: 229-35.
35- Zhou H, Chen R, Wang J, Lu J, Yu T, Wu X, et al. Biphasic Fish Collagen Scaffold for Osteochondral Regeneration. Materials & Design 2020; 197: 108947.
36- Sistani MA, Adeli A, Mira SA. A Value Chain Analysis on Tuna and Tuna-Like Species in Iran. Iranian Journal of Fisheries Sciences 2021; 20(1): 195-208.
37- Radhika Rajasree SR, Gobalakrishnan M, Aranganathan L, Karthih MG. Fabrication and Characterization of Chitosan Based Collagen/ Gelatin Composite Scaffolds from Big Eye Snapper Priacanthus Hamrur Skin for Antimicrobial and Anti Oxidant Applications. Mater Sci Eng C Mater Biol Appl 2020; 107: 110270.
38- Laemmli UK. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature 1970; 227(5259): 680-5.
39- Kong J, Yu S. Fourier Transform Infrared Spectroscopic Analysis of Protein Secondary Structures. Acta Biochim Biophys Sin (Shanghai) 2007; 39(8): 549-59.
40- Xu R, Chen Y, Wan D, Wang J. Identification of Four Sedum Plant Medicines by Fourier Transform Infrared Spectra. Pharmacogn Mag 2012; 8(30): 107-10.
41- Li Q, Mu L, Zhang F, Sun Y, Chen Q, Xie C, et al. A Novel Fish Collagen Scaffold as Dural Substitute. Mater Sci Eng C Mater Biol Appl 2017; 80: 346-51.
42- Kiew PL, Mashitah MD. Isolation and characterization of collagen from the skin of Malaysian catfish (Hybrid Clarias sp.). J Korean Soc Appl Biol Chem 2013; 56(4): 441-50.
43- Huang Y-R, Shiau C-Y, Chen H-H, Huang B-C. Isolation And Characterization of Acid and Pepsin-Solubilized Collagens from the Skin of Balloon Fish (Diodon Holocanthus). Food Hydrocolloids 2011; 25(6): 1507-13.
44- Adibzadeh N, Aminzadeh S, Jamili S, Karkhane AA, Farrokhi N. Purification and Characterization of Pepsin-Solubilized Collagen from Skin of Sea Cucumber Holothuria Parva. Appl Biochem Biotechnol 2014; 173(1): 143-54.
45- Kozlowska J, Sionkowska A, Skopinska-Wisniewska J, Piechowicz K. Northern Pike (Esox Lucius) Collagen: Extraction, Characterization and Potential Application. Int J Biol Macromol 2015; 81: 220-7.
46- Lin YK, Liu DC. Comparison of Physical–Chemical Properties of Type I Collagen from Different Species. Food Chemistry 2006; 99(2): 244-51.
47- Liu H, Li D, Guo S. Studies on Collagen from the Skin of Channel Catfish (Ictalurus Punctaus). Food Chemistry 2007; 101(2): 621-5.
48- Zhang F, Wang A, Li Z, He S, Shao L. Preparation and Characterisation of Collagen from Freshwater Fish Scales. Food and Nutrition Sciences 2011; 2(8): 818-23.
49- AlizadehNodeh M, Moradi Z, Nourani MRJJoATE. Isolation and Purification of Collagen From the Skin of Black Pomfret (Parastromateus Niger) for Tissue Engineering Purpose. J of Applied Tissue Engineering 2014; 1(1): 18-21.
50- Jeong H-S, Venkatesan J, Kim S-K. Isolation and Characterization of Collagen from Marine Fish (Thunnus Obesus). Biotechnology and Bioprocess Engineering 2014; 18(6): 1185-91.
51- Liu D, Zhang X, Li T, Yang H, Zhang H, Regenstein JM, et al. Extraction and Characterization of Acid- and Pepsin-Soluble Collagens from the Scales, Skins and Swim-Bladders of Grass Carp (Ctenopharyngodon Idella). Food Bioscience 2015; 9: 68-74.
52- Tylingo R, Mania S. Isolation and Characterization of Acid Soluble Collagen from the Skin of African Catfish (Clarias gariepinus), Salmon (Salmo salar) and Baltic Cod (Gadus morhua). J Biotechnol Biomater 2016; 6(2): 1-6.
53- Yan M, Li B, Zhao X, Ren G, Zhuang Y, Hou H, et al. Characterization of Acid-Soluble Collagen from the Skin of Walleye Pollock (Theragra Chalcogramma). Food Chemistry 2008; 107(4): 1581-6.
54- Zhang J, Duan R, Tian Y, Konno K. Characterisation of Acid-Soluble Collagen from Skin of Silver Carp (Hypophthalmichthys Molitrix). Food Chemistry 2009; 116(1): 318-22.
55- Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. Characterisation of Acid-Soluble Collagen from Skin and Bone of Bigeye Snapper (Priacanthus Tayenus). Food Chemistry 2005; 89(3): 363-72.
56- Fatemi MJ, Garahgheshlagh SN, Ghadimi T, Jamili S, Nourani MR, Sharifi AM, et al. Investigating the Impact of Collagen-Chitosan Derived From Scomberomorus Guttatus and Shrimp Skin on Second-Degree Burn in Rats Model. Regen Ther 2021; 18: 12-20.
57- Krishnamoorthi J, Ramasamy P, Shanmugam V, Shanmugam A. Isolation and Partial Characterization of Collagen from Outer Skin of Sepia Pharaonis (Ehrenberg, 1831) from Puducherry Coast. Biochem Biophys Rep 2017; 10: 39-45.
58- Muralidharan N, Jeya Shakila R, Sukumar D, Jeyasekaran G. Skin, Bone and Muscle Collagen Extraction from the Trash Fish, Leather Jacket (Odonus Niger) and their Characterization. J Food Sci Technol 2013; 50(6): 1106-13.
59- Nagai T, Suzuki N, Nagashima T. Collagen from Common Minke Whale (Balaenoptera Acutorostrata) Unesu. Food Chem 2008; 111(2): 296-301.
60- Yan M, Qin S, Li J. Study on the Self-Assembly Property of Type I Collagen Prepared from Tilapia (Oreochromis Niloticus) Skin by Different Extraction Methods. International Journal of Food Science & Technology 2015; 50(9): 2088-96.
61- Silva Junior ZS, Botta SB, Ana PA, Franca CM, Fernandes KP, Mesquita-Ferrari RA, et al. Effect of Papain-Based Gel on Type I Collagen--Spectroscopy Applied for Microstructural Analysis. Sci Rep 2015; 5: 11448.
62- Muyonga JH, Cole CGB, Duodu KG. Fourier Transform Infrared (FTIR) Spectroscopic Study of Acid Soluble Collagen and Gelatin from Skins and Bones of Young and Adult Nile Perch (Lates Niloticus). Food Chemistry 2004; 86(3): 325-32.
63- Simpson BK, Nollet LM, Toldrá F, Benjakul S, Paliyath G, Hui Y. Food Biochemistry and Food Processing: John Wiley & Sons; 2012.
64- Kumar B, Rani S. Technical Note on the Isolation and Characterization of Collagen from Fish Waste Material. J Food Sci Technol 2017; 54(1): 276-8.
65- Hema G, Shyni K, Mathew S, Anandan R, Ninan G, Lakshmanan P. A Simple Method for Isolation of Fish Skin Collagen-Biochemical Characterization of Skin Collagen Extracted from Albacore Tuna (Thunnus Alalunga), Dog Shark (Scoliodon Sorrakowah) and Rohu (Labeo Rohita). Annals of Biological Research 2013; 4(1): 271-8.
66- Muyonga JH, Cole CGB, Duodu KG. Characterisation of Acid Soluble Collagen from Skins of Young and Adult Nile Perch (Lates Niloticus). Food Chemistry 2004; 85(1): 81-9.
67- Tamilmozhi S, Veeruraj A, Arumugam M. Isolation and Characterization of Acid and Pepsin-Solubilized Collagen from the Skin of Sailfish (Istiophorus Platypterus). Food Research International 2013; 54(2): 1499-505.
68- Nagai T, Suzuki N. Partial Characterization of Collagen from Purple Sea Urchin (Anthocidaris Crassispina) Test. International Journal of Food Science and Technology 2000; 35(5): 497-501.
69- Jongjareonrak A, Benjakul S, Visessanguan W, Nagai T, Tanaka M. Isolation and Characterisation of Acid and Pepsin-Solubilised Collagens from the Skin of Brownstripe Red Snapper (Lutjanus Vitta). Food Chemistry 2005; 93(3): 475-84.
70- El-Rashidy AA, Gad A, Abu-Hussein AE-HG, Habib SI, Badr NA, Hashem AAJIjobm. Chemical and Biological Evaluation of Egyptian Nile Tilapia (Oreochromis Niloticas) Fish. Scale Collagen 2015; 79: 618-26.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







