دوره 30، شماره 10 - ( دی 1401 )
جلد 30 شماره 10 صفحات 6022-6013 |
برگشت به فهرست نسخه ها
Ethics code: IR.SSU.REC.1399.054
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Kheirollahi K, Hemayati R, Nabavinejad S R. Frequency Distribution of Oral Manifestations in Diabetic and Non-Diabetic Patients Undergoing Hemodialysis. JSSU 2023; 30 (10) :6013-6022
URL: http://jssu.ssu.ac.ir/article-1-5488-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5488-fa.html
خیراللهی خاطره، حمایتی رویا، نبوینژاد سید رسول. مقایسه توزیع فراوانی تظاهرات دهانی در بیماران دیابتی و غیردیابتی تحت همودیالیز. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (10) :6013-6022
متن کامل [PDF 810 kb]
(571 دریافت)
| چکیده (HTML) (1543 مشاهده)
متن کامل: (604 مشاهده)
مقدمه
نارسایی مزمن کلیوی Chronic renal failure (CRF) که در حال حاضر تحت عنوان بیماری مزمن کلیه Chronic kidney disease (CKD) نامگذاری میشود، روندی آهسته، جبرانناپذیر و پیشرونده دارد که طی سالها اتفاق میافتد (1). نارسایی مزمن کلیوی علاوه بر تأثیر بر روی سیستمهای مختلف میتواند موجب تغییراتی در حفره دهان گردد، به طوریکه بیماران مبتلا به بیماری مزمن کلیه در معرض خطر ابتلا به بیماریهای دهان و دندان مانند عقبنشینی اتاقک پالپ (2)، ناهنجاریهای مینای دندان (3)، خشکی دهان (4)، از دست دادن زودهنگام دندانها (5)، افزایش شیوع جرم (6)، و بیماری پریودنتال (7)، در مقایسه با افراد عادی میباشند. گزارش شده سلامت دهان و دندان در بیماران تحت دیالیز و پیوند کلیه ضعیف بوده و تأثیر بالقوهای بر کیفیت زندگی بیماران دارد (8). بیماری مزمن کلیه در اثر بسیاری از بیماریها ایجاد میشود که توده نفرونی کلیهها را از بین میبرند، از جمله دیابت ملیتوس (DM)، فشارخون بالا، گلومرولونفریت، نفریت بینابینی، پیلونفریت و بیماری پلیکیستیک کلیه (9،10). یکی از دلایل عمده بیماری مزمن کلیه نفروپاتی دیابتی است، افراد مبتلا به دیابت ملیتوس بخش عمدهای از بیماران در مرحله نهایی کلیوی End Stage Renal Disease (ESRD) تحت همودیالیز را تشکیل میدهند. دیابت ملیتوس همانندESRD ، برخی از تغییرات پاتولوژیک در حفره دهان را به همراه دارد که خشکی دهان یکی از تظاهرات رایج آن است. در بیماران دیابتی با کنترل قند خون ضعیف، هم ناهنجاری متابولیک و هم استفاده از داروها، ممکن است باعث خشکی دهان شود (4). همچنین درد مخاطی، عفونت های باکتریال، ویروسی، قارچی و بیماریهای پریودنتال در این بیماران گزارش شده است (11). Dande و همکاران در سال 2018 به بررسی شیوع تظاهرات دهانی در بیماران مبتلا به نارسایی مزمن کلیوی دیابتی و غیر دیابتی که تحت همودیالیز قرار داشتند، پرداختند. یافتهها نشان داد تظاهرات دهانی در بیماران CRF دیابتی (14/97 درصد) نسبت به بیماران CRF غیر دیابتی (18/89 درصد) بیشتر بود. شاخص بهداشت دهان و دندان ضعیف، بوی اورمیک، طعم نامطبوع، لبهای شکافدار و مخاط رنگ پریده بهطور معنیداری در گروه دیابتی بیشتر بود (12). در یک مطالعه توسط Honarmand و همکارانش به بررسی تظاهرات دهانی، سطح اوره، میزان PH و کلسیم در بیماران مرحله انتهایی کلیوی روی 30 بیمار پرداخته شد. نتایج نشان داد که سطح اوره و PH در بیماران، در مقایسه با گروه کنترل باالتر بود. هالیتوزیس، خشکی دهان و افزایش جرم شایعترین تظاهرات دهانی بود (13). در مطالعات گذشته تظاهرات دهانی دیابت ملیتوس و همچنین تظاهرات دهانی در بیماران با ESRD بهصورت جداگانه بررسی شده است، از طرفی در مطالعاتی که تظاهرات دهانی دندانی در بیماران با نفروپاتی دیابتی بررسی شده اغلب مواردی مانند عمق پاکت پریودنتال، شاخص DMFT، ترکیبات بزاق و تعداد محدودی از علائم دهانی گزارش شده و همچنین مطالعات اندکی (14) در کشور یافت شد که ایجاد مشکلات و تظاهرات دهانی نظیر خشکی دهان که ممکن است با شدت بیشتر در بیماران دیابتی تحت همودیالیز بروز نماید را بررسی نموده باشند. با توجه به شیوع بیماری دیابت در شهر یزد و افزایش مبتلایان به نارسایی مزمن کلیوی، مطالعه حاضر با هدف مقایسه تظاهرات دهانی در بیماران همودیالیزی دیابتی و غیر دیابتی در مراکز دیالیز وابسته به بیمارستانهای آموزشی دانشگاه علوم پزشکی شهید صدوقی یزد انجام شد.
روش بررسی
این مطالعه از نوع تحلیلی است که به روش مقطعی، با توجه به امکانات موجود بر روی 60 نفر در دو گروه از بیماران تحت درمان همودیالیز در مرحله نهایی بیماری کلیوی، مراجعه کننده به بخشهای همودیالیز بیمارستانهای آموزشی دانشگاه علوم پزشکی شهید صدوقی یزد، در سال ۱۳99 که به روش در دسترس انتخاب شدند، انجام شد. بیماران بر اساس تاریخچه پزشکی و بررسی پرونده پزشکی به دو گروه دیابتی (30 نفر) و غیر دیابتی ( 30نفر) تقسیمبندی شدند. گروه بیماران دیابتی را افرادی تشکیل میدادند که مبتلا به دیابت نوع 2 بوده و به دلیل مشکل کلیوی تحت همودیالیز قرار گرفته بودند. بیمارانی وارد مطالعه شدند که از مدت زمان دیالیز آنها حداقل 2 ماه گذشته بود و بیمارانی که تاریخچه پرتودرمانی به ناحیه سر و گردن داشته یا حین مطالعه در حال مصرف داروهای آنتیهیستامین، آنتیکولینرژیک و ضد افسردگیهای سه حلقهای بودند، وارد مطالعه نشدند (15). در این بیماران در هر دو گروه امکان ابتلا به فشار خون وجود داشت که با توجه دو گروه همسانسازی شده بودند از مطالعه خارج نشدند. علاوه بر تظاهرات دهانی، سن، جنسیت، علت (علل) ایجاد نارسایی کلیوی و مدت زمان همودیالیز بیماران در چک لیست مطالعه ثبت گردید. تظاهرات دهانی بیماران به دو دسته علائم و نشانههای دهانی تقسیم بندی شد. علائم دهانی شامل خشکی دهان و درد مخاطی بود که توسط محقق مشخص و ثبت شد. نشانه های دهانی شامل: بوی اورمیک، زبان باردار، پتشی و پورپورا در مخاط دهان، زخم مخاطی، رنگ پریدگی مخاط، اروژن دندانی و وجود کاندیدیازیس دهانی براساس شواهد بالینی ثبت شد. خشکی دهان با توجه به شکایت بیمار و چسبیدن آبسلانگ به مخاط چسبنده و خشک حین معاینه ثبت شد.همچنین بوسیله شکایت بیماران از مشکل در جویدن، بلع وصحبت کردن مشخص شد. تغییر مزه و درد مخاطی نیز با توجه به شکایت بیمار ثبت شدند. همچنین به منظور ثبت شدت علائم دهانی، هر کدام از بیماران،یک مقیاس آنالوگ بصری (VAS) که دارای درجه بندی از یک تا ده بود را علامتگذاری کردندسپس بیماران برای ثبت نشانههای دهانی معاینه شدند. بوی اورمیک حین صحبت کردن بیمار از فاصله10سانتیمتری از دهان بیمار استشمام میشد. زبان باردار پتشی و پورپورا در مخاط دهان، زخم دهانی (زخمهای تروماتیک از مطالعه حذف شدند) و کاندیدیازیس پس ازمعاینه کامل حفره دهان بهوسیله مشاهده و معیارهای کلینیکی تعیین شدند. کاندیدا سودوممبرانوس بر اساس پلاک زرد یا سفید در سراسر مخاط دهان که با گاز به آسانی برداشته میشد، تشخیص داده شد. کاندیدای اریتماتوز بر اساس پچ اریتماتوز که اکثراً در کام و ناحیه خلفی زبان وجود دارد، تشخیص داده شد (16). با رعایت پروتکلهای بهداشتی و استفاده از وسایل حفاظت شخصی، ابتدا لبها بهصورت لمس دو دستی بررسی و معاینه مخاط داخل دهان بهوسیله آینه دندانپزشکی تحت نور چراغ قوه پزشکی بدین ترتیب انجام شد 1) لثهها و وستیبول 2) کف دهان و سطح ونترال زبان 3) کام سخت، کام نرم، ناحیه لوزهها و حلق 4) در نهایت زبان با یک تکه گاز استریل گرفته و سطوح دورسال و لترال آن از نظر وجود ضایعات دهانی معاینه بالینی شد. دادهها در چکلیست بیماران ثبت گردید.
تجزیه و تحلیل آماری
تجزیه و تحلیل آماری دادهها با استفاده از نرمافزارSPSS version 16 صورت گرفته، جداول و شاخصهای مورد نیاز تهیه و جهت محاسبات آماری از آزمونهای Chi-Square، Fisher Exact و T-test استفاده شد. سطح معنیداری آماری 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
طرح این تحقیق درکمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد در سال 1399 با شماره IR.SSU.REC.1399.054 به تصویب رسیده و جهت رعایت اصول اخلاق در پژوهش، هدف از مطالعه برای بیماران شرح داده شد و از تمام بیماران جهت شرکت در مطالعه رضایتنامه کتبی اخذ شد.
نتایج
در این مطالعه 60 (37 مرد-23 زن) بیمار تحت همودیالیز در دو گروه 30 تایی، یک گروه مبتلا به دیابت و یک گروه بدون ابتلا به دیابت با دامنه سنی 15 تا 88 سال مورد مطالعه قرار گرفتند. نتایج آزمون آماری T-test تفاوت آماری معنیداری بین دو گروه از نظر سن نشان داد (0/0001>P)، اما تفاوت دو گروه از نظر جنسیت و مدت زمان همودیالیز باتوجه به آزمون آماری Chi-Square معنیدار نبود (0/05<P) (جدول1). درصد موارد مثبت انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز، در نمودار 1 آمده است. خشکی دهان (76/7 درصد) در گروه بیماران دیابتی و اروژن دندانی (50 درصد) در گروه بیماران غیردیابتی بیشترین فراوانی را در هر گروه داشت. همانگونه که در جدول 2 مشاهده میگردد، ضریب شانس ابتلای بیماران دیابتی به خشکی دهان 9/04 برابر گروه غیردیابتی میباشد که با تعمیم آن به کل جامعه این ضریب بین 2/8 تا 29/1 برابر خواهد بود. ضریب شانس ابتلای بیماران دیابتی به اروژن دندانی 36/0 برابر گروه غیردیابتی میباشد یعنی فراوانی اروژن در گروه غیردیابتی بیشتر از گروه دیابتی بود و با تعمیم آن به کل جامعه این ضریب بین 0/12 تا 1/07 برابر خواهد بود. اختلاف آماری معنیداری بین دو گروه در ابتلا به خشکی دهان (0/0001>P) و وجود کاندیدیازیس(0/020=P)، مشاهده شد.
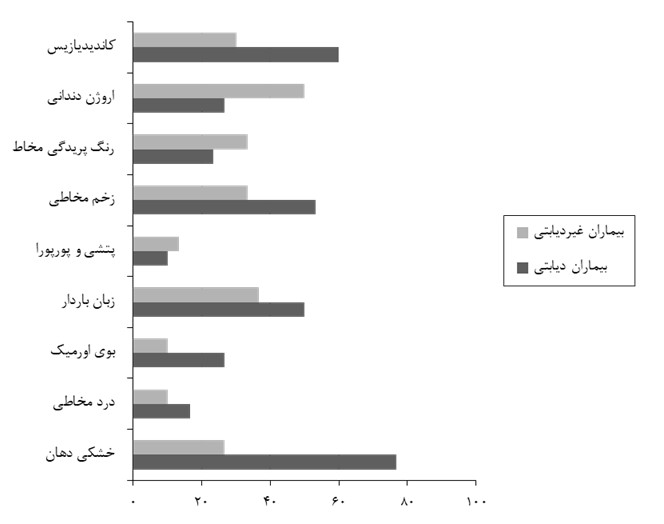
نمودار1: توزیع فراوانی موارد مثبت انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز
جدول1: مقایسه اطلاعات پایه بیماران به تفکیک دو گروه مورد بررسی
.JPG)
* T- test ** Chi-Square test
جدول 2: ضریب شانس انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز
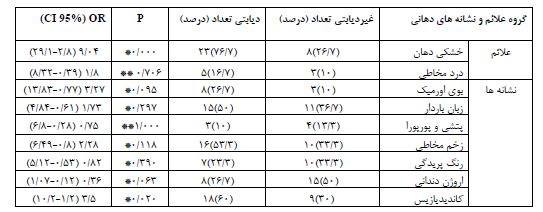
* Chi-Square test ** Fisher Exact test
بحث
سندرم اورمیک ناشی از نارسایی کلیه می تواند سبب ایجاد تظاهرات دهانی متعدد گردد (17). در بیماران مبتلا به ESRD شیوع تظاهرات دهانی تا 90 درصد گزارش شده است. بیش از 30 علامت و نشانه دهانی مختلف مرتبط با CRF و پیوند کلیه از جمله خشکی دهان، بوی اورمیک، مخاط رنگپریده، استوماتیت اورمی و کاندیدیازیس گزارش شده است. دیابت ملیتوس یک عامل خطر مهم برای CRF است. بیماران دیابتی در معرض عوارض حاد و مزمن در حفره دهان مانند خشکی دهان، سوزش دهان، عفونتهای باکتریایی، ویروسی و قارچی به ویژه کاندیدیازیس و همچنین بیماری پریودنتال هستند (11). در مطالعه حاضر مانند تمام مطالعات مشابه، اغلب علائم و نشانه های دهانی در بیماران همودیالیزی مبتلا به دیابت بیش تر از بیماران غیردیابتی عنوان شده است اما در نوع این علائم و نشانهها تفاوت هایی مشاهده شد. به عنوان مثال در مطالعه Chuang و همکاران (4) شیوع پوسیدگی و شدت خشکی دهان، تغییر مزه و درد مخاطی و در مطالعه de la Rosa Garcia و همکاران (18) تنفس اورمیک، مزه بد دهان و خشکی دهان در گروه دیابتی بهطور معناداری بیشتر بود. خشکی دهان در بیماران مبتلا به ESRD یک پدیده مولتی فاکتوریال بوده و عواملی نظیر محدودیت دریافت آب، جریان بزاق پایین، فیبروز و آتروفی پارانشیم غدد بزاقی و تنفس دهانی (19) یا عوارض جانبی داروها (20) در ایجاد آن مؤثر می باشند. اختلال در عملکرد غدد بزاقی که به دلیل درگیری با بیماری میکروواسکولار و نوروپاتی رخ میدهد، شیوع بالای خشکی دهان در بیماران دیابتی را توضیح میدهد (11). خشکی دهان در بیماران CRF دیابتی ممکن است عامل خطری برای ابتلا به کاندیدیازیس، پوسیدگی دندانی، بیماری پریودنتال و عفونتهای باکتریایی شود (12). بر این اساس، علائم خشکی دهان در بیماران دیالیزی دیابتی نیاز به نظارت پزشکی بیشتری دارد. در مطالعه حاضر خشکی دهان شایعترین تظاهر دهانی و در بیماران همودیالیزی مبتلا به دیابت بیشتر از گروه غیردیابتی بود که با نتایج مطالعات مشابه (22, 21, 19, 18, 4) مطابقت دارد. در مطالعه Chuang و همکاران (4) بیماران همودیالیزی مبتلا به دیابت با کنترل ضعیف تا متوسط قند خون، خشکی دهان شدیدتری را نسبت به بیماران با کنترل خوب قند خون نشان دادند. یک تحقیق جامعتر، از جمله بررسی بیوشیمیایی مقدار pH و جریان بزاقی، میتواند اطلاعات بیشتری ارائه دهد. در مطالعه حاضر همانند مطالعات مشابه (23, 14, 4) عفونت کاندیدا در هر دو گروه دیابتی و غیر دیابتی مشاهده شد و شیوع آن در بیماران دیابتی بیشتر از بیماران غیر دیابتی بود. Guggenheimer و همکاران (24) گزارش کردند که شیوع بالای استوماتیت در بیماران دیابتی وابسته به انسولین، با سطح قند خون و سایر عوامل مستعد کننده همراه میباشد. سطوح مخاطی آلوده به کاندیدا (C.albicans) دارای تغییرات التهابی شدیدی هستند که با نفوذ گسترده نوتروفیل مشخص میشود (25). ایمنی سلولی و نوتروفیلها میتوانند کاندیدا را با تشکیل تلههای خارج سلولی neutrophil extracellular traps (NETs) از بین ببرند (26). در بیماران دیابتی توانایی نابودکنندگی اکسیداتیو نوتروفیلها کاهش یافته، بنابراین بدن بیماران دیابتی ممکن است قادر به از بین بردن عوامل بیماریزا مانند افراد غیر دیابتی نباشد (27،21). در مطالعه حاضر در دهان 53/3 درصد از بیماران دیابتی و 33/3 درصد بیماران غیر دیابتی زخم مخاطی مشاهده شد. در حالیکه در مطالعه Dandeو همکاران (12)، زخم دهانی در هر دو گروه دیابتی و غیردیابتی به ترتیب 8/33 و 8/10 بود. زخم دهانی در بیماران مبتلا به نارسایی کلیوی میتواند ناشی از افزایش سطح اوره خون به بیش از ml100/ mg150 و اسید اورمیک تجمع یافته در بافتها (16) و یا به دلیل کاهش ترشحات بزاقی (12) باشد. با توجه به شیوع بالای این عارضه، معاینه دقیق و توجه به سلامت دهان در بیماران تحت همودیالیز ضروریتر از قبل به نظر می رسد. زبان باردار از دیگر تظاهرات دهانی بیماران مورد مطالعه حاضر بود که نیمی از افراد دیابتی و 36/7 درصد افراد غیردیابتی به آن مبتلا بودند. زبان باردار به علت تجمع سلولهای اپیتلیال متفلس شده و لکوسیت های مرده برروی پاپیهای نخی شکل زبان و تجمع باکتریها برروی آن به علت فاکتورهایی نظیر رژیم آبی محدود شده، جریان بزاق کم و بهداشت دهانی ضعیف، در بیماران دیالیزی ایجاد میگردد (28). در این مطالعه همانند مطالعه کیا و همکاران (14) در 50 درصد بیماران دیابتی زبان باردار مشاهده شد اما تعداد بیماران دیابتی مبتلا به زبان باردار در مطالعات de la Rosa Garcia و همکاران (23)، Chuang و همکاران (4) و Murali و همکاران (17) کمتر از مطالعه حاضر بود. این طیف گسترده از نتایج بدست آمده میتواند به علت عفونت کاندیدا و همراهی آن با سیگار کشیدن و تفاوت در فراوانی خشکی دهان باشد. همچنین در هیچیک از این مطالعات روش اندازهگیری زبان باردار ذکر نشده بود. در حالیکه در مطالعات قبلی چندین روش مختلف برای اندازهگیری زبان باردار پیشنهاد شده است. در نتیجه شیوع بیشتر زبان باردار در مطالعه حال حاضر ممکن است به خاطر فراوانی بیشتر خشکی دهان، بهداشت دهانی ضعیفتر این بیماران یا تفاوت در روش اندازهگیری زبان باردار در این مطالعه باشد. بنابراین نیاز به تحقیقات بیشتری در این رابطه وجود دارد. رنگ پریدگی مخاط به علت وجود آنمی نورموکروم- نورموسیتک ناشی از کاهش تولید اریتروپویتین و افزایش همولیز ناشی از دیالیز و سموم اورمیک و در برخی موارد به علت سوء تغذیه، ایجاد میگردد (29). در این مطالعه 33/3 درصد بیماران غیردیابتی و 23/3 درصد بیماران دیابتی مخاط رنگ پریده داشتند. در مطالعه کیا و همکاران (14) و Espinosa و همکاران (30) نیز در گروه غیردیابتی رنگ پریدگی مخاط شیوع بالاتری نسبت به گروه دیابتی داشته که با یافته های مطالعه حاضر همسو میباشد اما در نتایج این دو مطالعه برخلاف مطالعه حاضر، مخاط رنگپریده شایعترین یافته عینی مخاطی در گروه غیر دیابتی بود. که ممکن است این تفاوت ناشی از تفاوت در درصد زنان شرکت کننده در مطالعه باشد به طوریکه در این مطالعه درصد زنان در هر دو گروه بیشتر از مطالعات مشابه میباشد. در مطالعه حاضر همانند مطالعات Dandeو همکاران (12)، Murali و همکاران (17)، de la Rosa Garcia و همکاران (23) بروز بوی اورمیک در گروه دیابتی بالاتر از گروه غیر دیابتی بود. بوی اورمیک یک یافته شناخته شده در بیماران با نارسایی کلیه است (31) بوی اورمیک مرتبط با تجمع اوره در بزاق و تبدیل آن به آمونیاک میباشد (17). بنابراین شیوع بالاتر بوی اورمیک در بیماران با نارسایی مزمن کلیوی ممکن است در ارتباط با سطح بالای اوره بزاق در این افراد باشد (22). علل احتمالی دیگر غلظتهای افزایش یافته فسفات و پروتئین و تغییرات PH بزاق میباشد که میتواند منجر به یک مزه فلزی نامطبوع در دهان فرد شود (1،23). اروژن در بیماران اورمیک با عوامل خارجی و داخلی مختلفی نظیر مصرف نوشیدنیهای اسیدی (همچنین مکملهای آهن و قرصهای جویدنی ویتامین C)، بیماریهایی مانند پرخوری و بیاشتهایی عصبی، تهوع ناشی از مشکلات گوارشی، تهوع ناشی از دیالیز، خشکی دهان و کاهش جریان بزاق (به دلایل متعددی مانند افزایش سن، مصرف داروهای مختلف و ....)، تغییر PH بزاق، تغییر سطح سرمی و بزاقی کلسیم - فسفر و همچنین سطح سرمی هورمون پاراتیروئید در ارتباط است. در این بین نقش بزاق در پیشگیری از ایجاد اروژن دندانی بسیار کلیدی و حائز اهمیت است (32). در این مطالعه شیوع اروژن دندانی در گروه غیردیابتی بیش از گروه دیابتی بود که احتمال میرود این اختلاف، به دلیل تعداد بیشتر افراد کاملاً بیدندان در گروه دیابتی و بالاتر بودن PH و خاصیت بافری بزاق بیماران گروه غیردیابتی باشد. به گزارش Murali و همکاران (17) باتوجه به پاتوژنزهای مختلفی که برای اروژن دندانی وجود دارد بهتر است بررسیهای کاملتری بر روی نقش پارامترهای بزاقی (میزان جریان تحریکی و غیرتحریکی بزاق، مقدار سرمی و بزاقی کلسیم – فسفر و PH بزاق) در جلوگیری از اروژن دندانی صورت پذیرد. در بیماران مبتلا به نارسایی کلیوی، تجمع آمونیاک ممکن است مخاط را تحریک کند و موجب التهاب مخاطی شود. همچنین کاهش پوشش موسین بزاق در مخاط دهان باعث آسیبپذیری به عفونت، التهاب و آسیب بافتی می شود که منجر به درد زبانی و مخاطی میشود (33). نوروپاتی محیطی در بیماران دیابتی باعث درد مخاط دهان در این بیماران میگردد (34). در مطالعه حاضر مانند مطالعه Chuang و همکاران (4) وجود درد مخاطی در افراد دیابتی شایعتر بود. نتایج آنها حاکی از وجود ارتباطی معنیدار بین درد مخاطی با میزان کنترل قند خون بود و بیماران دیابتی با کنترل ضعیف قند خون، شکایت بیشتری از درد مخاط دهان داشتند. در حالیکه در مطالعه حاضر به دلیل تعداد کم بیماران مبتلا به درد مخاطی این تفاوت معنیدار نشد پس این شرایط نیاز به بررسیهای بیشتری در آینده دارد. پتشی و پورپورای مخاطی ممکن است مرتبط با استفاده از داروهای ضد انعقاد نظیر هپارین حین همودیالیز و یا نقص در تعداد و عملکرد پلاکت در بیماران کلیوی و تخریب پلاکت حین دیالیز و عملکرد نامناسب پروستاسیکلینها باشد. شیوع آن در مطالعات مختلف بین 10-1/2 درصد گزارش شده است (14). در مطالعه حاضر شیوع پتشی و پورپورا درگروه غیردیابتی (13/3 درصد) بیشتر از گروه دیابتی (10درصد) بودکه با نتایج مطالعه Kao و همکاران (1) و کیا و همکاران (14) که شیوع مخاط پتشی و پورپورا درگروه غیر دیابتی را بیشتر از گروه دیابتی گزارش نمودهاند، همسو است. بروز این ضایعات بافت نرم نسبت به سایر نشانههای مورد بررسی در هر دو گروه کم بود، که میتواند منعکس کننده وضعیت کنترل شده ضد انعقاد در این بیماران باشد. از محدودیتهای مطالعه حاضر، میتوان به عدم همکاری برخی بیماران، وجود پاندمی ویروس کرونا در زمان اجرای این طرح، کمبود بودجه و عدم امکان سنجش فاکتورهایی مانند میزان PH و کلسیم-فسفر و موسین بزاق، هورمون پاراتیروئید و تیتر HbA1C اشاره کرد.
نتیجهگیری
بر اساس نتایج مطالعه حاضر، اغلب علائم و نشانههای دهانی در بیماران دیابتی تحت همودیالیز بیشتر از گروه غیردیابتی بود. از آنجا که اثر ترکیبی دیابت و نارسایی کلیوی در بیماران دیابتی تحت همودیالیز باعث افزایش عوارض دهانی در این افراد شده، پیشنهاد میشود که معاینات دهانی بیشتری توسط متخصصین بیماریهای دهان روی این بیماران انجام شود.
سپاسگزاری
این مقاله منتج از طرح تحقیقاتی به شماره 7557 مصوب در شورای پژوهشی دانشکده دندانپزشکی دانشگاه علوم پزشکی شهید صدوقی یزد می باشد. نویسندگان خود را موظف میدانند از کلیه بیمارانی که در این طرح شرکت نمودند، تشکر و قدردانی نمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
نارسایی مزمن کلیوی Chronic renal failure (CRF) که در حال حاضر تحت عنوان بیماری مزمن کلیه Chronic kidney disease (CKD) نامگذاری میشود، روندی آهسته، جبرانناپذیر و پیشرونده دارد که طی سالها اتفاق میافتد (1). نارسایی مزمن کلیوی علاوه بر تأثیر بر روی سیستمهای مختلف میتواند موجب تغییراتی در حفره دهان گردد، به طوریکه بیماران مبتلا به بیماری مزمن کلیه در معرض خطر ابتلا به بیماریهای دهان و دندان مانند عقبنشینی اتاقک پالپ (2)، ناهنجاریهای مینای دندان (3)، خشکی دهان (4)، از دست دادن زودهنگام دندانها (5)، افزایش شیوع جرم (6)، و بیماری پریودنتال (7)، در مقایسه با افراد عادی میباشند. گزارش شده سلامت دهان و دندان در بیماران تحت دیالیز و پیوند کلیه ضعیف بوده و تأثیر بالقوهای بر کیفیت زندگی بیماران دارد (8). بیماری مزمن کلیه در اثر بسیاری از بیماریها ایجاد میشود که توده نفرونی کلیهها را از بین میبرند، از جمله دیابت ملیتوس (DM)، فشارخون بالا، گلومرولونفریت، نفریت بینابینی، پیلونفریت و بیماری پلیکیستیک کلیه (9،10). یکی از دلایل عمده بیماری مزمن کلیه نفروپاتی دیابتی است، افراد مبتلا به دیابت ملیتوس بخش عمدهای از بیماران در مرحله نهایی کلیوی End Stage Renal Disease (ESRD) تحت همودیالیز را تشکیل میدهند. دیابت ملیتوس همانندESRD ، برخی از تغییرات پاتولوژیک در حفره دهان را به همراه دارد که خشکی دهان یکی از تظاهرات رایج آن است. در بیماران دیابتی با کنترل قند خون ضعیف، هم ناهنجاری متابولیک و هم استفاده از داروها، ممکن است باعث خشکی دهان شود (4). همچنین درد مخاطی، عفونت های باکتریال، ویروسی، قارچی و بیماریهای پریودنتال در این بیماران گزارش شده است (11). Dande و همکاران در سال 2018 به بررسی شیوع تظاهرات دهانی در بیماران مبتلا به نارسایی مزمن کلیوی دیابتی و غیر دیابتی که تحت همودیالیز قرار داشتند، پرداختند. یافتهها نشان داد تظاهرات دهانی در بیماران CRF دیابتی (14/97 درصد) نسبت به بیماران CRF غیر دیابتی (18/89 درصد) بیشتر بود. شاخص بهداشت دهان و دندان ضعیف، بوی اورمیک، طعم نامطبوع، لبهای شکافدار و مخاط رنگ پریده بهطور معنیداری در گروه دیابتی بیشتر بود (12). در یک مطالعه توسط Honarmand و همکارانش به بررسی تظاهرات دهانی، سطح اوره، میزان PH و کلسیم در بیماران مرحله انتهایی کلیوی روی 30 بیمار پرداخته شد. نتایج نشان داد که سطح اوره و PH در بیماران، در مقایسه با گروه کنترل باالتر بود. هالیتوزیس، خشکی دهان و افزایش جرم شایعترین تظاهرات دهانی بود (13). در مطالعات گذشته تظاهرات دهانی دیابت ملیتوس و همچنین تظاهرات دهانی در بیماران با ESRD بهصورت جداگانه بررسی شده است، از طرفی در مطالعاتی که تظاهرات دهانی دندانی در بیماران با نفروپاتی دیابتی بررسی شده اغلب مواردی مانند عمق پاکت پریودنتال، شاخص DMFT، ترکیبات بزاق و تعداد محدودی از علائم دهانی گزارش شده و همچنین مطالعات اندکی (14) در کشور یافت شد که ایجاد مشکلات و تظاهرات دهانی نظیر خشکی دهان که ممکن است با شدت بیشتر در بیماران دیابتی تحت همودیالیز بروز نماید را بررسی نموده باشند. با توجه به شیوع بیماری دیابت در شهر یزد و افزایش مبتلایان به نارسایی مزمن کلیوی، مطالعه حاضر با هدف مقایسه تظاهرات دهانی در بیماران همودیالیزی دیابتی و غیر دیابتی در مراکز دیالیز وابسته به بیمارستانهای آموزشی دانشگاه علوم پزشکی شهید صدوقی یزد انجام شد.
روش بررسی
این مطالعه از نوع تحلیلی است که به روش مقطعی، با توجه به امکانات موجود بر روی 60 نفر در دو گروه از بیماران تحت درمان همودیالیز در مرحله نهایی بیماری کلیوی، مراجعه کننده به بخشهای همودیالیز بیمارستانهای آموزشی دانشگاه علوم پزشکی شهید صدوقی یزد، در سال ۱۳99 که به روش در دسترس انتخاب شدند، انجام شد. بیماران بر اساس تاریخچه پزشکی و بررسی پرونده پزشکی به دو گروه دیابتی (30 نفر) و غیر دیابتی ( 30نفر) تقسیمبندی شدند. گروه بیماران دیابتی را افرادی تشکیل میدادند که مبتلا به دیابت نوع 2 بوده و به دلیل مشکل کلیوی تحت همودیالیز قرار گرفته بودند. بیمارانی وارد مطالعه شدند که از مدت زمان دیالیز آنها حداقل 2 ماه گذشته بود و بیمارانی که تاریخچه پرتودرمانی به ناحیه سر و گردن داشته یا حین مطالعه در حال مصرف داروهای آنتیهیستامین، آنتیکولینرژیک و ضد افسردگیهای سه حلقهای بودند، وارد مطالعه نشدند (15). در این بیماران در هر دو گروه امکان ابتلا به فشار خون وجود داشت که با توجه دو گروه همسانسازی شده بودند از مطالعه خارج نشدند. علاوه بر تظاهرات دهانی، سن، جنسیت، علت (علل) ایجاد نارسایی کلیوی و مدت زمان همودیالیز بیماران در چک لیست مطالعه ثبت گردید. تظاهرات دهانی بیماران به دو دسته علائم و نشانههای دهانی تقسیم بندی شد. علائم دهانی شامل خشکی دهان و درد مخاطی بود که توسط محقق مشخص و ثبت شد. نشانه های دهانی شامل: بوی اورمیک، زبان باردار، پتشی و پورپورا در مخاط دهان، زخم مخاطی، رنگ پریدگی مخاط، اروژن دندانی و وجود کاندیدیازیس دهانی براساس شواهد بالینی ثبت شد. خشکی دهان با توجه به شکایت بیمار و چسبیدن آبسلانگ به مخاط چسبنده و خشک حین معاینه ثبت شد.همچنین بوسیله شکایت بیماران از مشکل در جویدن، بلع وصحبت کردن مشخص شد. تغییر مزه و درد مخاطی نیز با توجه به شکایت بیمار ثبت شدند. همچنین به منظور ثبت شدت علائم دهانی، هر کدام از بیماران،یک مقیاس آنالوگ بصری (VAS) که دارای درجه بندی از یک تا ده بود را علامتگذاری کردندسپس بیماران برای ثبت نشانههای دهانی معاینه شدند. بوی اورمیک حین صحبت کردن بیمار از فاصله10سانتیمتری از دهان بیمار استشمام میشد. زبان باردار پتشی و پورپورا در مخاط دهان، زخم دهانی (زخمهای تروماتیک از مطالعه حذف شدند) و کاندیدیازیس پس ازمعاینه کامل حفره دهان بهوسیله مشاهده و معیارهای کلینیکی تعیین شدند. کاندیدا سودوممبرانوس بر اساس پلاک زرد یا سفید در سراسر مخاط دهان که با گاز به آسانی برداشته میشد، تشخیص داده شد. کاندیدای اریتماتوز بر اساس پچ اریتماتوز که اکثراً در کام و ناحیه خلفی زبان وجود دارد، تشخیص داده شد (16). با رعایت پروتکلهای بهداشتی و استفاده از وسایل حفاظت شخصی، ابتدا لبها بهصورت لمس دو دستی بررسی و معاینه مخاط داخل دهان بهوسیله آینه دندانپزشکی تحت نور چراغ قوه پزشکی بدین ترتیب انجام شد 1) لثهها و وستیبول 2) کف دهان و سطح ونترال زبان 3) کام سخت، کام نرم، ناحیه لوزهها و حلق 4) در نهایت زبان با یک تکه گاز استریل گرفته و سطوح دورسال و لترال آن از نظر وجود ضایعات دهانی معاینه بالینی شد. دادهها در چکلیست بیماران ثبت گردید.
تجزیه و تحلیل آماری
تجزیه و تحلیل آماری دادهها با استفاده از نرمافزارSPSS version 16 صورت گرفته، جداول و شاخصهای مورد نیاز تهیه و جهت محاسبات آماری از آزمونهای Chi-Square، Fisher Exact و T-test استفاده شد. سطح معنیداری آماری 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
طرح این تحقیق درکمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد در سال 1399 با شماره IR.SSU.REC.1399.054 به تصویب رسیده و جهت رعایت اصول اخلاق در پژوهش، هدف از مطالعه برای بیماران شرح داده شد و از تمام بیماران جهت شرکت در مطالعه رضایتنامه کتبی اخذ شد.
نتایج
در این مطالعه 60 (37 مرد-23 زن) بیمار تحت همودیالیز در دو گروه 30 تایی، یک گروه مبتلا به دیابت و یک گروه بدون ابتلا به دیابت با دامنه سنی 15 تا 88 سال مورد مطالعه قرار گرفتند. نتایج آزمون آماری T-test تفاوت آماری معنیداری بین دو گروه از نظر سن نشان داد (0/0001>P)، اما تفاوت دو گروه از نظر جنسیت و مدت زمان همودیالیز باتوجه به آزمون آماری Chi-Square معنیدار نبود (0/05<P) (جدول1). درصد موارد مثبت انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز، در نمودار 1 آمده است. خشکی دهان (76/7 درصد) در گروه بیماران دیابتی و اروژن دندانی (50 درصد) در گروه بیماران غیردیابتی بیشترین فراوانی را در هر گروه داشت. همانگونه که در جدول 2 مشاهده میگردد، ضریب شانس ابتلای بیماران دیابتی به خشکی دهان 9/04 برابر گروه غیردیابتی میباشد که با تعمیم آن به کل جامعه این ضریب بین 2/8 تا 29/1 برابر خواهد بود. ضریب شانس ابتلای بیماران دیابتی به اروژن دندانی 36/0 برابر گروه غیردیابتی میباشد یعنی فراوانی اروژن در گروه غیردیابتی بیشتر از گروه دیابتی بود و با تعمیم آن به کل جامعه این ضریب بین 0/12 تا 1/07 برابر خواهد بود. اختلاف آماری معنیداری بین دو گروه در ابتلا به خشکی دهان (0/0001>P) و وجود کاندیدیازیس(0/020=P)، مشاهده شد.

نمودار1: توزیع فراوانی موارد مثبت انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز
جدول1: مقایسه اطلاعات پایه بیماران به تفکیک دو گروه مورد بررسی
.JPG)
* T- test ** Chi-Square test
جدول 2: ضریب شانس انواع علائم و نشانههای دهانی در دو گروه بیماران دیابتی و غیردیابتی تحت همودیالیز

* Chi-Square test ** Fisher Exact test
بحث
سندرم اورمیک ناشی از نارسایی کلیه می تواند سبب ایجاد تظاهرات دهانی متعدد گردد (17). در بیماران مبتلا به ESRD شیوع تظاهرات دهانی تا 90 درصد گزارش شده است. بیش از 30 علامت و نشانه دهانی مختلف مرتبط با CRF و پیوند کلیه از جمله خشکی دهان، بوی اورمیک، مخاط رنگپریده، استوماتیت اورمی و کاندیدیازیس گزارش شده است. دیابت ملیتوس یک عامل خطر مهم برای CRF است. بیماران دیابتی در معرض عوارض حاد و مزمن در حفره دهان مانند خشکی دهان، سوزش دهان، عفونتهای باکتریایی، ویروسی و قارچی به ویژه کاندیدیازیس و همچنین بیماری پریودنتال هستند (11). در مطالعه حاضر مانند تمام مطالعات مشابه، اغلب علائم و نشانه های دهانی در بیماران همودیالیزی مبتلا به دیابت بیش تر از بیماران غیردیابتی عنوان شده است اما در نوع این علائم و نشانهها تفاوت هایی مشاهده شد. به عنوان مثال در مطالعه Chuang و همکاران (4) شیوع پوسیدگی و شدت خشکی دهان، تغییر مزه و درد مخاطی و در مطالعه de la Rosa Garcia و همکاران (18) تنفس اورمیک، مزه بد دهان و خشکی دهان در گروه دیابتی بهطور معناداری بیشتر بود. خشکی دهان در بیماران مبتلا به ESRD یک پدیده مولتی فاکتوریال بوده و عواملی نظیر محدودیت دریافت آب، جریان بزاق پایین، فیبروز و آتروفی پارانشیم غدد بزاقی و تنفس دهانی (19) یا عوارض جانبی داروها (20) در ایجاد آن مؤثر می باشند. اختلال در عملکرد غدد بزاقی که به دلیل درگیری با بیماری میکروواسکولار و نوروپاتی رخ میدهد، شیوع بالای خشکی دهان در بیماران دیابتی را توضیح میدهد (11). خشکی دهان در بیماران CRF دیابتی ممکن است عامل خطری برای ابتلا به کاندیدیازیس، پوسیدگی دندانی، بیماری پریودنتال و عفونتهای باکتریایی شود (12). بر این اساس، علائم خشکی دهان در بیماران دیالیزی دیابتی نیاز به نظارت پزشکی بیشتری دارد. در مطالعه حاضر خشکی دهان شایعترین تظاهر دهانی و در بیماران همودیالیزی مبتلا به دیابت بیشتر از گروه غیردیابتی بود که با نتایج مطالعات مشابه (22, 21, 19, 18, 4) مطابقت دارد. در مطالعه Chuang و همکاران (4) بیماران همودیالیزی مبتلا به دیابت با کنترل ضعیف تا متوسط قند خون، خشکی دهان شدیدتری را نسبت به بیماران با کنترل خوب قند خون نشان دادند. یک تحقیق جامعتر، از جمله بررسی بیوشیمیایی مقدار pH و جریان بزاقی، میتواند اطلاعات بیشتری ارائه دهد. در مطالعه حاضر همانند مطالعات مشابه (23, 14, 4) عفونت کاندیدا در هر دو گروه دیابتی و غیر دیابتی مشاهده شد و شیوع آن در بیماران دیابتی بیشتر از بیماران غیر دیابتی بود. Guggenheimer و همکاران (24) گزارش کردند که شیوع بالای استوماتیت در بیماران دیابتی وابسته به انسولین، با سطح قند خون و سایر عوامل مستعد کننده همراه میباشد. سطوح مخاطی آلوده به کاندیدا (C.albicans) دارای تغییرات التهابی شدیدی هستند که با نفوذ گسترده نوتروفیل مشخص میشود (25). ایمنی سلولی و نوتروفیلها میتوانند کاندیدا را با تشکیل تلههای خارج سلولی neutrophil extracellular traps (NETs) از بین ببرند (26). در بیماران دیابتی توانایی نابودکنندگی اکسیداتیو نوتروفیلها کاهش یافته، بنابراین بدن بیماران دیابتی ممکن است قادر به از بین بردن عوامل بیماریزا مانند افراد غیر دیابتی نباشد (27،21). در مطالعه حاضر در دهان 53/3 درصد از بیماران دیابتی و 33/3 درصد بیماران غیر دیابتی زخم مخاطی مشاهده شد. در حالیکه در مطالعه Dandeو همکاران (12)، زخم دهانی در هر دو گروه دیابتی و غیردیابتی به ترتیب 8/33 و 8/10 بود. زخم دهانی در بیماران مبتلا به نارسایی کلیوی میتواند ناشی از افزایش سطح اوره خون به بیش از ml100/ mg150 و اسید اورمیک تجمع یافته در بافتها (16) و یا به دلیل کاهش ترشحات بزاقی (12) باشد. با توجه به شیوع بالای این عارضه، معاینه دقیق و توجه به سلامت دهان در بیماران تحت همودیالیز ضروریتر از قبل به نظر می رسد. زبان باردار از دیگر تظاهرات دهانی بیماران مورد مطالعه حاضر بود که نیمی از افراد دیابتی و 36/7 درصد افراد غیردیابتی به آن مبتلا بودند. زبان باردار به علت تجمع سلولهای اپیتلیال متفلس شده و لکوسیت های مرده برروی پاپیهای نخی شکل زبان و تجمع باکتریها برروی آن به علت فاکتورهایی نظیر رژیم آبی محدود شده، جریان بزاق کم و بهداشت دهانی ضعیف، در بیماران دیالیزی ایجاد میگردد (28). در این مطالعه همانند مطالعه کیا و همکاران (14) در 50 درصد بیماران دیابتی زبان باردار مشاهده شد اما تعداد بیماران دیابتی مبتلا به زبان باردار در مطالعات de la Rosa Garcia و همکاران (23)، Chuang و همکاران (4) و Murali و همکاران (17) کمتر از مطالعه حاضر بود. این طیف گسترده از نتایج بدست آمده میتواند به علت عفونت کاندیدا و همراهی آن با سیگار کشیدن و تفاوت در فراوانی خشکی دهان باشد. همچنین در هیچیک از این مطالعات روش اندازهگیری زبان باردار ذکر نشده بود. در حالیکه در مطالعات قبلی چندین روش مختلف برای اندازهگیری زبان باردار پیشنهاد شده است. در نتیجه شیوع بیشتر زبان باردار در مطالعه حال حاضر ممکن است به خاطر فراوانی بیشتر خشکی دهان، بهداشت دهانی ضعیفتر این بیماران یا تفاوت در روش اندازهگیری زبان باردار در این مطالعه باشد. بنابراین نیاز به تحقیقات بیشتری در این رابطه وجود دارد. رنگ پریدگی مخاط به علت وجود آنمی نورموکروم- نورموسیتک ناشی از کاهش تولید اریتروپویتین و افزایش همولیز ناشی از دیالیز و سموم اورمیک و در برخی موارد به علت سوء تغذیه، ایجاد میگردد (29). در این مطالعه 33/3 درصد بیماران غیردیابتی و 23/3 درصد بیماران دیابتی مخاط رنگ پریده داشتند. در مطالعه کیا و همکاران (14) و Espinosa و همکاران (30) نیز در گروه غیردیابتی رنگ پریدگی مخاط شیوع بالاتری نسبت به گروه دیابتی داشته که با یافته های مطالعه حاضر همسو میباشد اما در نتایج این دو مطالعه برخلاف مطالعه حاضر، مخاط رنگپریده شایعترین یافته عینی مخاطی در گروه غیر دیابتی بود. که ممکن است این تفاوت ناشی از تفاوت در درصد زنان شرکت کننده در مطالعه باشد به طوریکه در این مطالعه درصد زنان در هر دو گروه بیشتر از مطالعات مشابه میباشد. در مطالعه حاضر همانند مطالعات Dandeو همکاران (12)، Murali و همکاران (17)، de la Rosa Garcia و همکاران (23) بروز بوی اورمیک در گروه دیابتی بالاتر از گروه غیر دیابتی بود. بوی اورمیک یک یافته شناخته شده در بیماران با نارسایی کلیه است (31) بوی اورمیک مرتبط با تجمع اوره در بزاق و تبدیل آن به آمونیاک میباشد (17). بنابراین شیوع بالاتر بوی اورمیک در بیماران با نارسایی مزمن کلیوی ممکن است در ارتباط با سطح بالای اوره بزاق در این افراد باشد (22). علل احتمالی دیگر غلظتهای افزایش یافته فسفات و پروتئین و تغییرات PH بزاق میباشد که میتواند منجر به یک مزه فلزی نامطبوع در دهان فرد شود (1،23). اروژن در بیماران اورمیک با عوامل خارجی و داخلی مختلفی نظیر مصرف نوشیدنیهای اسیدی (همچنین مکملهای آهن و قرصهای جویدنی ویتامین C)، بیماریهایی مانند پرخوری و بیاشتهایی عصبی، تهوع ناشی از مشکلات گوارشی، تهوع ناشی از دیالیز، خشکی دهان و کاهش جریان بزاق (به دلایل متعددی مانند افزایش سن، مصرف داروهای مختلف و ....)، تغییر PH بزاق، تغییر سطح سرمی و بزاقی کلسیم - فسفر و همچنین سطح سرمی هورمون پاراتیروئید در ارتباط است. در این بین نقش بزاق در پیشگیری از ایجاد اروژن دندانی بسیار کلیدی و حائز اهمیت است (32). در این مطالعه شیوع اروژن دندانی در گروه غیردیابتی بیش از گروه دیابتی بود که احتمال میرود این اختلاف، به دلیل تعداد بیشتر افراد کاملاً بیدندان در گروه دیابتی و بالاتر بودن PH و خاصیت بافری بزاق بیماران گروه غیردیابتی باشد. به گزارش Murali و همکاران (17) باتوجه به پاتوژنزهای مختلفی که برای اروژن دندانی وجود دارد بهتر است بررسیهای کاملتری بر روی نقش پارامترهای بزاقی (میزان جریان تحریکی و غیرتحریکی بزاق، مقدار سرمی و بزاقی کلسیم – فسفر و PH بزاق) در جلوگیری از اروژن دندانی صورت پذیرد. در بیماران مبتلا به نارسایی کلیوی، تجمع آمونیاک ممکن است مخاط را تحریک کند و موجب التهاب مخاطی شود. همچنین کاهش پوشش موسین بزاق در مخاط دهان باعث آسیبپذیری به عفونت، التهاب و آسیب بافتی می شود که منجر به درد زبانی و مخاطی میشود (33). نوروپاتی محیطی در بیماران دیابتی باعث درد مخاط دهان در این بیماران میگردد (34). در مطالعه حاضر مانند مطالعه Chuang و همکاران (4) وجود درد مخاطی در افراد دیابتی شایعتر بود. نتایج آنها حاکی از وجود ارتباطی معنیدار بین درد مخاطی با میزان کنترل قند خون بود و بیماران دیابتی با کنترل ضعیف قند خون، شکایت بیشتری از درد مخاط دهان داشتند. در حالیکه در مطالعه حاضر به دلیل تعداد کم بیماران مبتلا به درد مخاطی این تفاوت معنیدار نشد پس این شرایط نیاز به بررسیهای بیشتری در آینده دارد. پتشی و پورپورای مخاطی ممکن است مرتبط با استفاده از داروهای ضد انعقاد نظیر هپارین حین همودیالیز و یا نقص در تعداد و عملکرد پلاکت در بیماران کلیوی و تخریب پلاکت حین دیالیز و عملکرد نامناسب پروستاسیکلینها باشد. شیوع آن در مطالعات مختلف بین 10-1/2 درصد گزارش شده است (14). در مطالعه حاضر شیوع پتشی و پورپورا درگروه غیردیابتی (13/3 درصد) بیشتر از گروه دیابتی (10درصد) بودکه با نتایج مطالعه Kao و همکاران (1) و کیا و همکاران (14) که شیوع مخاط پتشی و پورپورا درگروه غیر دیابتی را بیشتر از گروه دیابتی گزارش نمودهاند، همسو است. بروز این ضایعات بافت نرم نسبت به سایر نشانههای مورد بررسی در هر دو گروه کم بود، که میتواند منعکس کننده وضعیت کنترل شده ضد انعقاد در این بیماران باشد. از محدودیتهای مطالعه حاضر، میتوان به عدم همکاری برخی بیماران، وجود پاندمی ویروس کرونا در زمان اجرای این طرح، کمبود بودجه و عدم امکان سنجش فاکتورهایی مانند میزان PH و کلسیم-فسفر و موسین بزاق، هورمون پاراتیروئید و تیتر HbA1C اشاره کرد.
نتیجهگیری
بر اساس نتایج مطالعه حاضر، اغلب علائم و نشانههای دهانی در بیماران دیابتی تحت همودیالیز بیشتر از گروه غیردیابتی بود. از آنجا که اثر ترکیبی دیابت و نارسایی کلیوی در بیماران دیابتی تحت همودیالیز باعث افزایش عوارض دهانی در این افراد شده، پیشنهاد میشود که معاینات دهانی بیشتری توسط متخصصین بیماریهای دهان روی این بیماران انجام شود.
سپاسگزاری
این مقاله منتج از طرح تحقیقاتی به شماره 7557 مصوب در شورای پژوهشی دانشکده دندانپزشکی دانشگاه علوم پزشکی شهید صدوقی یزد می باشد. نویسندگان خود را موظف میدانند از کلیه بیمارانی که در این طرح شرکت نمودند، تشکر و قدردانی نمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
References:
1- Kho HS, Lee SW, Chung SC, Kim YK. Oral Manifestations and Salivary Flow Rate, Ph, and Buffer Capacity in Patients with End-Stage Renal Disease Undergoing Hemodialysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 88(3): 316-9.
2- Jover Cervero A, Bagan JV, Jimenez Soriano Y, Poveda Roda R. Dental Management in Renal Failure: Patients on Dialysis. Med Oral Patol Oral Cir Bucal 2008;13(7): E419-26.
3- Galili D, Berger E, Kaufman E. Pulp Narrowing in Renal End Stage and Transplanted Patients. J Endod 1991; 17(9): 442-3.
4- Chuang SF, Sung JM, Kuo SC, Huang JJ, Lee SY. Oral and Dental Manifestations in Diabetic and Nondiabetic Uremic Patients Receiving Hemodialysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99(6): 689-95.
5- Klassen JT, Krasko BM. The Dental Health Status of Dialysis Patients. J Can Dent Assoc 2002; 68(1): 34-8.
6- Locsey L, Alberth M, Mauks G. Dental Management of Chronic Haemodialysis Patients. Int Urol Nephrol 1986; 18(2): 211-3.
7- Atassi F. Oral Home Care and the Reasons for Seeking Dental Care by Individuals on Renal Dialysis. J Contemp Dent Pract 2002; 3(2): 31-41.
8- Duran I, Erdemir EO. Periodontal Treatment Needs of Patients with Renal Disease Receiving Haemodialysis. Int Dent J 2004; 54(5): 274-8.
9- Souza CM, Braosi AP, Luczyszyn SM, Casagrande RW, Pecoits-Filho R, Riella MC, et al. Oral Health in Brazilian Patients with Chronic Renal Disease. Rev Med Chil 2008; 136(6): 741-6.
10- Borawski J, Wilczynska-Borawska M, Stokowska W, Mysliwiec M. The Periodontal Status of Pre-Dialysis Chronic Kidney Disease and Maintenance Dialysis Patients. Nephrol Dial Transplant 2007; 22(2): 457-64.
11- Manfredi M, McCullough MJ, Vescovi P, Al-Kaarawi ZM, Porter SR. Update on Diabetes Mellitus and Related Oral Diseases. Oral Dis 2004;10(4):187-200.
12- Dande R, Gadbail AR, Sarode S, Gadbail MPM, Gondivkar SM, Gawande M, et al. Oral Manifestations in Diabetic and Nondiabetic Chronic Renal Failure Patients Receiving Hemodialysis. J Contemp Dent Pract 2018; 19(4): 398-403.
13- Honarmand M, Farhad-Mollashahi L, Nakhaee A, Sargolzaie F. Oral Manifestation and Salivary Changes in Renal Patients Undergoing Hemodialysis. J Clin Exp Dent 2017; 9(2): e207-e10.
14- Kia SJ, Khalighi Sigaroudi A, Vadiati Saberi B, Bagheri A. Comparison of Oral Manifestations of Diabetic and Non-Diabetic Uremic Patients Undergoing Hemodialysis. J Ardabil Univ Med Sci 2014; 14(2): 168-75.
15- Jafary-Heidarloo M, Mehrinejad S, Sarrafan N. Evaluation of Frequency of Oral Manifestation in End Stage Renal Disease Patients Undergoing Hemodialysis in Imam Khomeini Hospital in Urmia. Studies in Medical Sciences 2017; 28(6): 410-17. [Persian]
16- Omidpanah N, Akbari J. Oral Manifestations in Patients with End Stage Renal Disease Undergoing Hemodialysis. J Mashhad Dent Sch 2020; 43(4): 312-22.
17- Murali P, Narasimhan M, Periasamy S, Harikrishnan TC. A Comparison of Oral and Dental Manifestations in Diabetic and Non-Diabetic Uremic Patients Receiving Hemodialysis. J Oral Maxillofac Pathol 2012; 16(3): 374-9.
18- de la Rosa Garcia E, Mondragon Padilla A, Aranda Romo S, Bustamante Ramirez MA. Oral Mucosa Symptoms, Signs and Lesions, in End Stage Renal Disease and Non-End Stage Renal Disease Diabetic Patients. Med Oral Patol Oral Cir Bucal 2006;11(6): E467-73.
19- Charra B, Chazot C. Volume Control, Blood Pressure and Cardiovascular Function. Lessons from Hemodialysis Treatment. Nephron Physiol 2003; 93(4): 94-101.
20- Proctor R, Kumar N, Stein A, Moles D, Porter S. Oral and Dental Aspects of Chronic Renal Failure. J Dent Res 2005; 84(3): 199-208.
21- de Leon EM, Jacober SJ, Sobel JD, Foxman B. Prevalence and Risk Factors for Vaginal Candida Colonization in Women with Type 1 and Type 2 Diabetes. BMC Infect Dis 2002; 2: 1.
22- Mozaffari PM, Amirchaghmaghi M, Mortazavi H. Oral Manifestations of Renal Patients Before and after Transplantation: A Review of Literature. Avicenna J Dent Res 2009; 1(1): 1-6.
23- de la Rosa García E, Mondragón Padilla A, Aranda Romo S, Bustamante Ramírez MA. Oral Mucosa Symptoms, Signs and Lesions, in End Stage Renal Disease and Non-End Stage Renal Disease Diabetic Patients. Med Oral Patol Oral Cir Bucal 2006; 11(6): E467-73.
24- Guggenheimer J, Moore PA, Rossie K, Myers D, Mongelluzzo MB, Block HM, et al. Insulin-Dependent Diabetes Mellitus and Oral Soft Tissue Pathologies: II. Prevalence and Characteristics of Candida and Candidal Lesions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 89(5): 570-6.
25- Sano T, Ozaki K, Terayama Y, Kodama Y, Matsuura T. A Novel Diabetic Murine Model of Candida Albicans-Induced Mucosal Inflammation and Proliferation. J Diabetes Res 2014; 2014: 509325.
26- Urban CF, Reichard U, Brinkmann V, Zychlinsky A. Neutrophil Extracellular Traps Capture and Kill Candida Albicans Yeast and Hyphal Forms. Cell Microbiol 2006; 8(4): 668-76.
27- Wilson RM, Tomlinson DR, Reeves WG. Neutrophil Sorbitol Production Impairs Oxidative Killing in Diabetes. Diabet Med 1987; 4(1): 37-40.
28- Little JW, Miller C, Rhodus NL. Dental Management of the Medically Compromised Patient. 9th ed. St.Louis: Elsevier Health Sciences; 2018: 288-305.
29- Glick M. Burket's Oral Medicine. 12th ed. United States America: People's Medical Publishing House; 2015: 567-70.
30- Espinosa A, Cueto-Manzano AM, Velazquez-Alva C, Hernandez A, Cruz N, Zamora B, et al. Prevalence of Malnutrition in Mexican CAPD Diabetic and Nondiabetic Patients. Adv Perit Dial 1996; 12: 302-6.
31- Swapna LA, Koppolu P, Prince J. Oral Health in Diabetic and Nondiabetic Patients with Chronic Kidney Disease. Saudi J Kidney Dis Transpl 2017; 28(5): 1099-105.
32- De Rossi SS, Glick M. Dental Considerations for the Patient with Renal Disease Receiving Hemodialysis. J Am Dent Assoc 1996; 127(2): 211-9.
33- Kaushik A, Reddy SS, Umesh L, Devi BK, Santana N, Rakesh N. Oral and Salivary Changes among Renal Patients Undergoing Hemodialysis: A Cross-Sectional Study. Indian J Nephrol 2013; 23(2):125-9.
34- Collin HL, Niskanen L, Uusitupa M, Töyry J, Collin P, Koivisto AM, et al. Oral Symptoms and Signs in Elderly Patients with Type 2 Diabetes Mellitus. A Focus on Diabetic Neuropathy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90(3): 299-305.
1- Kho HS, Lee SW, Chung SC, Kim YK. Oral Manifestations and Salivary Flow Rate, Ph, and Buffer Capacity in Patients with End-Stage Renal Disease Undergoing Hemodialysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 88(3): 316-9.
2- Jover Cervero A, Bagan JV, Jimenez Soriano Y, Poveda Roda R. Dental Management in Renal Failure: Patients on Dialysis. Med Oral Patol Oral Cir Bucal 2008;13(7): E419-26.
3- Galili D, Berger E, Kaufman E. Pulp Narrowing in Renal End Stage and Transplanted Patients. J Endod 1991; 17(9): 442-3.
4- Chuang SF, Sung JM, Kuo SC, Huang JJ, Lee SY. Oral and Dental Manifestations in Diabetic and Nondiabetic Uremic Patients Receiving Hemodialysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99(6): 689-95.
5- Klassen JT, Krasko BM. The Dental Health Status of Dialysis Patients. J Can Dent Assoc 2002; 68(1): 34-8.
6- Locsey L, Alberth M, Mauks G. Dental Management of Chronic Haemodialysis Patients. Int Urol Nephrol 1986; 18(2): 211-3.
7- Atassi F. Oral Home Care and the Reasons for Seeking Dental Care by Individuals on Renal Dialysis. J Contemp Dent Pract 2002; 3(2): 31-41.
8- Duran I, Erdemir EO. Periodontal Treatment Needs of Patients with Renal Disease Receiving Haemodialysis. Int Dent J 2004; 54(5): 274-8.
9- Souza CM, Braosi AP, Luczyszyn SM, Casagrande RW, Pecoits-Filho R, Riella MC, et al. Oral Health in Brazilian Patients with Chronic Renal Disease. Rev Med Chil 2008; 136(6): 741-6.
10- Borawski J, Wilczynska-Borawska M, Stokowska W, Mysliwiec M. The Periodontal Status of Pre-Dialysis Chronic Kidney Disease and Maintenance Dialysis Patients. Nephrol Dial Transplant 2007; 22(2): 457-64.
11- Manfredi M, McCullough MJ, Vescovi P, Al-Kaarawi ZM, Porter SR. Update on Diabetes Mellitus and Related Oral Diseases. Oral Dis 2004;10(4):187-200.
12- Dande R, Gadbail AR, Sarode S, Gadbail MPM, Gondivkar SM, Gawande M, et al. Oral Manifestations in Diabetic and Nondiabetic Chronic Renal Failure Patients Receiving Hemodialysis. J Contemp Dent Pract 2018; 19(4): 398-403.
13- Honarmand M, Farhad-Mollashahi L, Nakhaee A, Sargolzaie F. Oral Manifestation and Salivary Changes in Renal Patients Undergoing Hemodialysis. J Clin Exp Dent 2017; 9(2): e207-e10.
14- Kia SJ, Khalighi Sigaroudi A, Vadiati Saberi B, Bagheri A. Comparison of Oral Manifestations of Diabetic and Non-Diabetic Uremic Patients Undergoing Hemodialysis. J Ardabil Univ Med Sci 2014; 14(2): 168-75.
15- Jafary-Heidarloo M, Mehrinejad S, Sarrafan N. Evaluation of Frequency of Oral Manifestation in End Stage Renal Disease Patients Undergoing Hemodialysis in Imam Khomeini Hospital in Urmia. Studies in Medical Sciences 2017; 28(6): 410-17. [Persian]
16- Omidpanah N, Akbari J. Oral Manifestations in Patients with End Stage Renal Disease Undergoing Hemodialysis. J Mashhad Dent Sch 2020; 43(4): 312-22.
17- Murali P, Narasimhan M, Periasamy S, Harikrishnan TC. A Comparison of Oral and Dental Manifestations in Diabetic and Non-Diabetic Uremic Patients Receiving Hemodialysis. J Oral Maxillofac Pathol 2012; 16(3): 374-9.
18- de la Rosa Garcia E, Mondragon Padilla A, Aranda Romo S, Bustamante Ramirez MA. Oral Mucosa Symptoms, Signs and Lesions, in End Stage Renal Disease and Non-End Stage Renal Disease Diabetic Patients. Med Oral Patol Oral Cir Bucal 2006;11(6): E467-73.
19- Charra B, Chazot C. Volume Control, Blood Pressure and Cardiovascular Function. Lessons from Hemodialysis Treatment. Nephron Physiol 2003; 93(4): 94-101.
20- Proctor R, Kumar N, Stein A, Moles D, Porter S. Oral and Dental Aspects of Chronic Renal Failure. J Dent Res 2005; 84(3): 199-208.
21- de Leon EM, Jacober SJ, Sobel JD, Foxman B. Prevalence and Risk Factors for Vaginal Candida Colonization in Women with Type 1 and Type 2 Diabetes. BMC Infect Dis 2002; 2: 1.
22- Mozaffari PM, Amirchaghmaghi M, Mortazavi H. Oral Manifestations of Renal Patients Before and after Transplantation: A Review of Literature. Avicenna J Dent Res 2009; 1(1): 1-6.
23- de la Rosa García E, Mondragón Padilla A, Aranda Romo S, Bustamante Ramírez MA. Oral Mucosa Symptoms, Signs and Lesions, in End Stage Renal Disease and Non-End Stage Renal Disease Diabetic Patients. Med Oral Patol Oral Cir Bucal 2006; 11(6): E467-73.
24- Guggenheimer J, Moore PA, Rossie K, Myers D, Mongelluzzo MB, Block HM, et al. Insulin-Dependent Diabetes Mellitus and Oral Soft Tissue Pathologies: II. Prevalence and Characteristics of Candida and Candidal Lesions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 89(5): 570-6.
25- Sano T, Ozaki K, Terayama Y, Kodama Y, Matsuura T. A Novel Diabetic Murine Model of Candida Albicans-Induced Mucosal Inflammation and Proliferation. J Diabetes Res 2014; 2014: 509325.
26- Urban CF, Reichard U, Brinkmann V, Zychlinsky A. Neutrophil Extracellular Traps Capture and Kill Candida Albicans Yeast and Hyphal Forms. Cell Microbiol 2006; 8(4): 668-76.
27- Wilson RM, Tomlinson DR, Reeves WG. Neutrophil Sorbitol Production Impairs Oxidative Killing in Diabetes. Diabet Med 1987; 4(1): 37-40.
28- Little JW, Miller C, Rhodus NL. Dental Management of the Medically Compromised Patient. 9th ed. St.Louis: Elsevier Health Sciences; 2018: 288-305.
29- Glick M. Burket's Oral Medicine. 12th ed. United States America: People's Medical Publishing House; 2015: 567-70.
30- Espinosa A, Cueto-Manzano AM, Velazquez-Alva C, Hernandez A, Cruz N, Zamora B, et al. Prevalence of Malnutrition in Mexican CAPD Diabetic and Nondiabetic Patients. Adv Perit Dial 1996; 12: 302-6.
31- Swapna LA, Koppolu P, Prince J. Oral Health in Diabetic and Nondiabetic Patients with Chronic Kidney Disease. Saudi J Kidney Dis Transpl 2017; 28(5): 1099-105.
32- De Rossi SS, Glick M. Dental Considerations for the Patient with Renal Disease Receiving Hemodialysis. J Am Dent Assoc 1996; 127(2): 211-9.
33- Kaushik A, Reddy SS, Umesh L, Devi BK, Santana N, Rakesh N. Oral and Salivary Changes among Renal Patients Undergoing Hemodialysis: A Cross-Sectional Study. Indian J Nephrol 2013; 23(2):125-9.
34- Collin HL, Niskanen L, Uusitupa M, Töyry J, Collin P, Koivisto AM, et al. Oral Symptoms and Signs in Elderly Patients with Type 2 Diabetes Mellitus. A Focus on Diabetic Neuropathy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90(3): 299-305.
نوع مطالعه: پژوهشي |
موضوع مقاله:
دندانپزشکی
دریافت: 1400/3/31 | پذیرش: 1400/5/24 | انتشار: 1401/10/15
دریافت: 1400/3/31 | پذیرش: 1400/5/24 | انتشار: 1401/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







