دوره 29، شماره 8 - ( آبان 1400 )
جلد 29 شماره 8 صفحات 3988-3976 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fatemi S F, Hashemvarzi S A, Farzaneh Hesari A. Protective effect of interval exercise training with different intensity and alpha-lipoic acid supplement on Nav1.3 protein in soleus muscle of diabetic rats. JSSU 2021; 29 (8) :3976-3988
URL: http://jssu.ssu.ac.ir/article-1-5344-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5344-fa.html
فاطمی سیده فاطمه، هاشمورزی سید عبدالله، فرزانه حصاری امین. اثر محافظتی تمرین تناوبی با شدتهای مختلف و مکمل آلفالیپوئیک اسید بر پروتئین Nav1.3 عضله نعلی موشهای دیابتی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (8) :3976-3988
متن کامل [PDF 832 kb]
(544 دریافت)
| چکیده (HTML) (1202 مشاهده)
متن کامل: (581 مشاهده)
مقدمه
دیابت نوعی بیماری متابولیکی است که سطح بالای قند خون و اختلالات متابولیکی منجر به اختلالات نورولوژیک میشود که بخشهای مختلف سیستم عصبی اعم از اعصاب محیطی و خودمختار را تحتتاثیر قرار میدهد. در اثر آسیبهای ناشی از هایپرگلایسمی به سلولهای عصبی و ایسکمی نورونی ناشی از کاهش جریان عروقی-عصبی، نوروپاتی رخ می¬دهد که بهدنبال آن میتواند عصبزدایی (denervation) ایجاد شود. به دنبال عصبزدایی، آتروفی و تخریب بافتی و همچنین کاهش در اندازه و تعداد فیبر عضلانی و متعاقباً کاهش سرعت انقباض و تنش در عضله اسکلتی دیده میشود (1). دباغ نیکوخصلت و همکاران (2016) ارتباط بین عصبزدایی و نوروپاتی دیابتی در عضلات ساق پا در بیماران دیابتی را گزارش کردند (2). نورونها بهویژه در برابر آسیبهای ناشی از سطح بالای گلوکز آسیبپذیر هستند؛ زیرا جذب گلوکز عصبی بیشتر به غلظت خارج سلولی گلوکز بستگی دارد. از آنجا که اثرات انسولین بهطور قابلتوجهی در سلولهای عصبی ضعیفتر از بافتهای دیگر است، سلول¬های عصبی حساس به انسولین در نظر گرفته میشوند. در دیابت، افزایش قند خون مداوم میتواند منجر به افزایش چهار برابر سطح گلوکز در سلولهای عصبی شود که آنها را در معرض آسیب ناشی از هایپرگلیسمی قرار میدهد (3). کانال¬های ولتاژی سدیم، پروتئینهای سرتاسری در غشای سلولی بسیاری از بافتها هستند که باعث تولید پتانسیل عمل و تنظیم سیگنالهای الکتریکی در سلول میشوند. در فرایندهای فیزیولوژیکی، فعال شدن و غیر فعال شدن این کانالهای یونی، با کنترل پتانسیل عمل در بافتهای مختلف اتفاق می-افتد. کانالهای ولتاژ سدیمی، از دو زیر مجموعه آلفا و بتا تشکیل شدهاند و در پستانداران نه ایزوفرم آلفا شناسایی شده است که Nav1/3، یکی از آنها میباشد (4).
در طی مرحله جنینی، Nav1/3 بهطور گسترده در نورونهای گانگلیون ریشه پشتی بیان میشود. پس از تولد، بیان Nav1/3در سراسر سیستم عصبی به طرز چشمگیری کاهش می¬یابد. با اینحال، گزارش شده است که Nav1/3در نورونهای گانگلیون ریشه پشتی محیطی تحت شرایط پاتولوژیک خاص مانند التهاب که با آسیبهای عصبی محیطی همراه است دوباره بیان می¬شود (5). مطالعات اخیر نشان میدهند که Nav1/3 نقش مهمی در بروز درد و مشکلات نوروپاتی در افراد دیابتی دارد. افزایش بیان کانالهای Nav1/3 در سلول¬های عصبی افراد دیابتی، منجر به افزایش کانالهای سدیمی و کاهش آستانه شلیک شده و در نتیجه باعث افزایش آسیب نورونها میشود (6). مطالعه سوارز و همکاران، نشان داد که بیان Nav1/3 تا شش ماه پس از القاء دیابت در موشها بالا باقی مانده که احتمالاً به دلیل تشدید واکنشهای التهابی در دیابت است (7).
هایپرگلیسمی در بیماران دیابتی منجر به افزایش تولید رادیکالهای آزاد، گلیکاسیون آنزیمهای آنتیاکسیدانی و در نتیجه افزایش آسیب نورونها میشود (8). باتوجه به نقش تایید شده آسیبهای اکسیداتیو در ایجاد مقاومت به انسولین و عوارض آن در جریان بیماری دیابت و همینطور خواص سودمند مواد آنتیاکسیدان، تلاش برای کاهش شدت آسیب اکسیداتیو و در نهایت کاهش فعالسازی مسیرهای دخیل در آسیبهای اکسیداتیو، بهعنوان جزئی از فرایند درمانی بیماران مبتلا به دیابت نوع 2 ضروری به نظر میرسد. آلفالیپوئیک-اسید (α-lipoic acid) یک آنتیاکسیدان زیستی قوی بوده و بهعنوان یک کوفاکتور در کمپلکس آنزیمی دهیدروژناز میتوکندریایی در متابولیسم و تولید انرژی فعالیت دارد که به طور مستقیم باعث مهار رادیکالهای آزاد شده و فعالیت آنزیمهای اکسیدانی در بافت و اعصاب محیطی را افزایش داده و باعث افزایش محافظت عصبی میشود (9). از سوی دیگر، فعالیت ورزشی می¬تواند یک مکانیسم محافظتی غیرتهاجمی و غیردارویی را در برابر بیماریها و ناتوانیهای عصبی-عضلانی ایجاد کند (10). علاوه براین، فعالیت بدنی راهی برای حفظ عملکرد و ساختار سیناپس واحیای نورون¬های آسیب دیده است. مطالعات نشان دادند که تمرین با شدت متوسط اثرات مفیدی بر عوارش ناشی از نوروپاتی محیطی دارد (8). همچنین، یک دوره تمرین تناوبی شدید، عملکرد و حفظ ساختار سیناپسها و بازسازی نورونهای آسیب دیده و میلین آکسونهای نورون¬های آسیب ¬دیده در موش¬های مسن را بهبود بخشید (11). به نظر میرسد که اثر شدتهای مختلف تمرین ورزشی بر شکل عضله و سطح عصبزدایی متفاوت باشد. بنابراین، مشخص شدن مکانیسمهای درگیر در تنظیم تغییرات عصبی-عضلانی و عوامل مرتبط با نوروپاتی با شدت تمرین ورزشی میتواند در درک نقش فعالیت ورزشی منظم در بهبود دیابت کمک کند. از سوی دیگر، با توجه به نقش آنتی-اکسیدانی آلفالیپوئیک¬اسید، بررسی این موضوع که آیا شدت-های مختلف تمرین ورزشی دارای اثرات محافظتی یکسانی در آسیبهای نورونی ناشی از دیابت هستند و اینکه آیا مصرف مکمل آلفالیپوئیک اسید به همراه تمرین ورزشی دارای اثر هم-افزایی بر کنترل مسیرهای درگیر در نوروپاتی دیابتی است، حائز اهمیت میباشد. بنابراین هدف از این مطالعه بررسی تأثیر شدت تمرین ورزشی به همراه مصرف مکمل آلفالیپوئیک اسید بر بیان پروتئین Nav1/3 عضله سولئوس موشهای دیابتی بود.
روش بررسی
این مطالعه تجربی بر روی 35 سر موش نر نژاد ویستار (براساس جدول برآورد حجم کوهن) در مرکز ﭘﺮورش و ﻧﮕﻬﺪاری ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕﺎﻫﯽ هیستوژنوتک تهران انجام شد. معیار ورود به مطالعه شامل وزن 190تا220 گرم و سطح گلوکز پلاسمای بالاتر از 250 میلیگرم در دسیلیتر در گروه دیابت بوده و معیار خروج از مطالعه شامل مرگ در اواسط مطالعه و یا بیمار شدن حیوان و اجرا نکردن دو جلسه پیاپی تمرین هر موش در گروههای تمرینی بود. موشهای مورد مطالعه به تعداد پنج عدد در هر قفس از جنس پلی کربنات (30 × 15 × 15 سانتیمتر) در یک شرایط آب و هوایی کنترل شده (دمای2± 22 سانتیگراد، رطوبت 5±50 درصد، یک سیکل شب و روز 12:12) و با رژیم غذایی استاندارد و آب مورد نیاز در شرایط آزمایشگاهی نگهداری شدند (12). پس از آشنایی موش¬ها با پروتکل تمرینی، پنج سر موش به صورت تصادفی به عنوان گروه سالم جدا شد و 28 موش باقیمانده دیابتی شدند و بهصورت تصادفی در شش گروه: کنترل دیابت (گروهی که در طول مطالعه تمرین و مکمل دریافت نکرد)، تمرین تناوبی شدید (موشهای دیابتی که تمرین تناوبی شدید را انجام دادند)، تمرین تناوبی متوسط (موشهای دیابتی که تمرین تناوبی متوسط را انجام دادند)، مکمل آلفالیپوئیک اسید (موشهای دیابتی که مکمل دریافت کردند)، آلفا لیپوئیک اسید + تمرین تناوبی شدید (موشهای دیابتی که علاوه بر تمرین تناوبی شدید، مکمل هم دریافت کردند)، آلفا لیپوئیک اسید + تمرین تناوبی متوسط (موش¬های دیابتی که علاوه بر تمرین تناوبی متوسط، مکمل هم دریافت کردند) قرار گرفتند. در تمام مراحل پژوهش، آب مورد نیاز حیوان بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی در دسترس آنها بود. در این مطالعه برای دیابتی نمودن موشها از روش استرپتوزوتوسین (Streptozotocin) استفاده شد. به این صورت که با تزریق ml/kg 50 استرپتوزوتوسین به صورت داخل صفاقی، القای دیابت صورت گرفت. به منظور اطمینان از دیابتی شدن موشها، 48 ساعت پس از تزریق قند خون اندازه گیری شد و موشهای با قند خون بالای mg/dl 250 به عنوان موشهای دیابت در نظر گرفته شدند (13). دو هفته بعد از القا دیابت، برنامه تمرینی و مکملدهی انجام شد. گروه¬های تمرینی پنج جلسه در هفته، به مدت شش هفته تمرین تناوبی انجام دادند. قبل از شروع پروتکل تمرینی، آزمودنی¬های گروههای تمرین به منظور آشنایی با چگونگی فعالیت توسط نوارگردان (مخصوص فعالیت بدنی حیوانات آزمایشگاهی، ساخت ایران)، در یک هفته طی پنج جلسه، به مدت پنج دقیقه با سرعت 10-8 متر بر دقیقه با شیب صفر فعالیت داشتند. سپس، سرعت بیشینه دویدن هنگام حداکثر اکسیژن مصرفی برای هر رت و به منظور کنترل شدت تمرین تعیین شد. برای این منظور، بعد از 10 دقیقه گرم کردن با شدت پایین، رتها شروع به دویدن کردند و سرعت نوارگردان هر 2 دقیقه یک بار 2 متر بر دقیقه افزایش یافت تا حیوانات دیگر قادر به دویدن نباشند و به واماندگی برسند. سرعت نهایی رت بهعنوان سرعت بیشینه در زمان رسیدن به حداکثر اکسیژن مصرفی جهت محاسبه شدتهای تمرینی استفاده گردید. از حیوانات هر دو هفته یک بار آزمون وامانده ساز گرفته و شدت تمرین با توجه به مقادیر جدید آزمون تعیین می¬شد. برنامه تمرینی تناوبی با شدت بالا(High-intensity interval training) و تمرین تناوبی با شدت متوسط (Moderate intensity interval training) به مدت شش هفته و پنج جلسه در هفته اجرا شد. در هر دو پروتکل تمرینی، موش¬ها ابتدا پنج دقیقه با سرعت کم (30-40درصد سرعت بیشینه) و با هدف گرم کردن دویدند. هر جلسه تمرینی تناوبی با شدت بالا شامل 10 ست دویدن چهار دقیقهای با شدت 85-90 درصد سرعت بیشینه و 2 دقیقه استراحت فعال (50-60 درصد سرعت بیشینه) بین هر مرحله تمرین بود. پروتکل تمرین تناوبی با شدت متوسط شامل 13 ست دویدن چهار دقیقهای با شدت 70-65 درصد سرعت بیشینه و 2 دقیقه استراحت فعال (50-40 درصد سرعت بیشینه) بین ست¬ها بود (14). به منظور مکملدهی به گروههای مکمل، روزانه ﻣﯿﺰان 20 میلیﮔـﺮم به ازای هر کیلوگرم وزن بدن موش¬ها مکمل آلفالیپوئیک اسید لیپوزومال (مکمل آلفالیپولئیک اسید ساخت شرکت Sigma-Aldrich کشور آمریکا) در متیل سلولز حل شده و یک ساعت بعد از تمرین بهصورت گاواژ و در یک وعده در روز به موش¬ها داده شد (15). برای لیپوزوم کردن از روش آبپوشانی لایه نازک استفاده شد، بدین صورت که ابتدا لسیتین فسفولیپید (L-a- a-phosphatidylcholine) در کلروفرم حل شد و محلول اول به دست آمد. سپس کلسترول در کلروفرم حل شد و محلول دوم به دست آمد. در مرحله بعد، دو محلول به ترتیب با نسبت 4 به 1 با هم ترکیب شدند. سپس این ترکیب در دستگاه روتاری، در دمای 50 درجه و سرعت 150rmp و تحت خلا تبخیر شد و با تشکیل فیلم نازک لیپیدی، تبخیر حداقل به مدت دو ساعت ادامه یافت. سپس آلفالیپولئیک اسید را در آب مقطر حل کرده و به محلول اضافه کردیم. برای هموژنایز کردن سوسپانسیون و تولید نانو وزیکولها، نمونه¬های بهدست آمده به مدت 15 دقیقه با همگن ساز اولتراسوند، همگن شدند. سپس سوسپانسیون هموژن شده در مجاورت نیتروژن قرار گرفت و به مدت یک ساعت تحت حرارت انتقال چربی قرار گرفت. سپس محصول تولید شده سانترفیوژ شد و در نهایت یک سوسپانسیون شفاف از نانولیپوزومها تولید شد و تا زمان استفاده در دمای 4 درجه سانتیگراد نگهداری شد (16). برای بررسی بیان پروتئین Nav1/3 در عضله نعلی از روش ایمنوهیستوشیمی استفاده شد. برای انجام رنگآمیزی شیمیایی و مشخص کردن میزان پروتئین Nav1/3، عضله نعلی با ضخامت 10 میکرومتر برش داده شد. پس از برداشت بافت مورد نظر با استفاده از محلول بوئن یا فرمالین 10% ثابتسازی انجام گرفت. به منظور آبگیری بافت، نمونه را در الکل و سپس برای شفافسازی نمونه در داخل گزیلول قرار گرفت. در مرحله بعد نمونه را داخل پارافین مذاب گذاشته و نمونه آغشته شده با پارافین در داخل قالب پر از پارافین مذاب قرار گرفت. ضمن انجماد پارافین، نمونه نیز در داخل باقیمانده و آماده مقطعگیری میکرد. نمونه همراه با قالب پارافین توسط دستگاه میکروتوم به ضخامت 5 تا 10 میکرون، برش داده شد. برش بر روی لام حاوی ماده آلبومین هست تا بر روی لام بچسبد. لامها درون آون در دمای 90 درجه سانتیگراد به مدت 20 دقیقه قرار گرفت تا پارافینهای موجود در نمونه ذوب گردد. به منظور خارج کردن پارافین داخل نمونه، نمونه¬ها در داخل زایلول قرار گرفت. لامها را داخل رنگ هماتوکسیلین وارد کرده به مدت 15 دقیقه سپس شستشو با آب جاری و بعد در ائوزین چند مرتبه غوطه ور شده و سپس با آب جاری شسته می¬شود و در الکل 70،80، 90 و 100 درصد قرار داده تا خوب آبگیری شود و سپس در گزیلول قرار داده تا الکلگیری و شفاف شود. نمونه با PBS در چهار مرحله و به فاصله پنج دقیقه شسته شدند. بهمنظور بازیابی آنتی¬ژنی بر روی نمونهها اسیدکلریدریک دو نرمال به مدت 30 دقیقه ریخته شد. بافر بورات به منظور خنثیسازی اسید به مدت پنج دقیقه اضافه گردید. سلولها با PBS شسته شدند. تریتون 0/3 درصد به مدت 30 دقیقه به منظور نفوذپذیر کردن غشاء سلولها استفاده گردید. با PBS شستشو داده شدند. سرم بز 10 درصد برای مدت 30 دقیقه به منظور بلوک کردن واکنش آنتی¬بادی ثانویه به صورت رنگ اضافی زمینه اضافه شد. آنتیبادی اولیه (با کد SC-271255 ساخت شرکت Santa cruz کشور آمریکا) رقیق شده (نسبت 1 به 100) با PBS به نمونه اضافه گردید و به مدت یک شب درون یخچال با دمای 2 تا 8 درجه قرار داده شد. روز بعد بافت 4 بار و هر بار به مدت 5 دقیقه با PBS شستشو داده شد. به نمونه آنتی بادی ثانویه (با کد SC-271255 ساخت شرکت Santa cruz کشور آمریکا) با رقت 1 به 150 اضافه گردید و سپس در انکوباتور با دمای 37 درجه به مدت یک ساعت و 30 دقیقه در تاریکی انکوبه شدند. بعد از آن نمونه از انکوباتور به اتاق تاریک منتقل گردید و بعد از 4 بار شستشو، به آنها DAPI اضافه گردید، بلافاصله برداشته شد و روی نمونه PBS ریخته شد. در مرحله آخر تصاویر با میکروسکوپ نوری ساخت شرکت LABOMED کشور آمریکا گرفته شد. برای تجزیه و تحلیل تصاویر و مشخص کردن میزان پروتئین Nav1/3 از نرم افزار Image J استفاده شد که بیان پروتئین را بر اساس درصدی از تصاویر نشان داد. سنجش گلوکز پلاسما به روش گلوکز اکسیداز و به وسیله کیت تشخیص کمی گلوکز پلاسما شرکت پارس آزمون با حساسیت 5 میلیگرم در دسی لیتر انجام شد. انسولین سرم به روش الایزا و مطابق با استانداردهای کیت تجاری (ELIZA Diagnostic insulin Demeditec) ساخت کشور آلمان اندازهگیری شد.
تجزیه و تحلیل آماری
جهت بررسی طبیعی بودن توزیع داده ها از آزمون شاپیرو-ویلک و همگنی واریانس گروهها از آزمون لون استفاده شد. ﺑﻪ ﻣﻨﻈﻮر ﺑﺮرﺳﯽ ﺗﻔﺎوتﻫﺎ از آزﻣﻮن ﺗﺤﻠﯿﻞ واریﺎﻧﺲ یﮏ ﻃﺮﻓﻪ و از آزﻣﻮن ﺗﻌﻘﯿﺒﯽ ﺗﻮﮐﯽ اﺳﺘﻔﺎده ﺷﺪ. ﺳﻄﺢ ﻣﻌﻨﯽداری (0/05= P) در نظر گرفته شد. تمامی عملیات آماری با نرمافزارversion 16 SPSS انجام گرفت.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق کار با حیوانات دانشکده علوم پزشکی دانشگاه آزاد ساری تایید و کد اخلاق (IR.IAU.SARI.REC.1399.158) صادر گردید.
نتایج
نتایج مطالعه حاضر نشان داد که گلوگز پلاسما در تمام گروهها بجز گروه دیابت + تمرین شدید + مکمل افزایش معنیداری نسبت به گروه کنترل سالم داشت (P=0/148). در مقایسه با گروه دیابت، تمرین (P=0/023) و همچنین ترکیب تمرین متوسط + مکمل (P=0/013) و تمرین شدید + مکمل(P=0/001) منجر به کاهش معنادار گلوگز شد. میزان انسولین در تمام گروه¬ها بجز گروه دیابت + تمرین شدید + مکمل کاهش معنی¬داری نسبت به گروه کنترل سالم داشت(P=0/089). در مقایسه با گروه دیابت، تمرین متوسط (P=0/0021)و تمرین متوسط + مکمل(P=0/018) و تمرین شدید + مکمل(P=0/001) منجر به افزایش معنادار انسولین شد (نمودار1). نتایج آزمون تحلیل واریانس یکراهه برای بیان پروتئین Nav1.3 در جدول 1 نشان می¬دهد که بین گروههای مختلف تفاوت معناداری وجود دارد(P=0/0001). نتایج آزمون تعقیبی توکی نیز نشان داد تمرین تناوبی شدید(P=0/0015)، تمرین تناوبی متوسط (P=0/0056)، تمرین تناوبی شدید + آلفالیپوئیک (0/0001>P) و تمرین تناوبی متوسط + آلفالیپوئیک (0/0001>P) سطحNav1.3 را بهطور معنیداری نسبت به گروه دیایت کاهش دادند. گروه¬های تمرین شدید(P=0/0286) ، تمرین متوسط + آلفالیپوئیک(P=0/0002) و تمرین شدید + آلفالیپوئیک (0/0001>P) کاهش معناداری نسبت به گروه آلفالیپوئیک نشان دادند. گروه تمرین شدید + آلفالیپوئیک نیز کاهش معناداری نسبت به گروه تمرین شدید(P=0/0028) داشت. گروه¬های دیابت تمرین شدید + آلفالیپوئیک(P=0/0008) و دیابت تمرین متوسط + آلفالیپوئیک(P=0/0156)کاهش معناداری نسبت به گروه تمرین متوسط نشان دادند (نمودار 1).
جدول1: مقادیر وزن اولیه و ثانویه موشها و میزان گلوگز پلاسما گروههای مختلف تحقیق

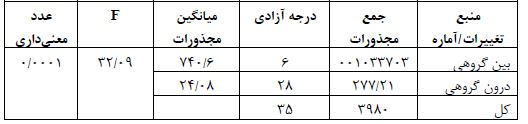
جدول 2: نتایج آزمون تحلیل واریانس یکراهه برای بیان پروتئین NaV1.3 عضله نعلی
سطح معنادار بودن 0/05

نمودار 1: مقایسه آن پروتئین NAv1/3 عضله نعلی موشهای دیابتی متعاقب 6 هفته تمرین متوسط و شدید و مصرف آلفالیپوئیک اسید.
*: تغییرات معنادار نسبت به گروه کنترل. &: تعییرات معنادار نسبت به گروه دیابت. $: تغییرات معنادار نسبت به دیابت+آلفالیپوئیک. #: تغییرات معنادار نسبت به دیابت تمرین شدید. @: تغییرات معنادار نسبت به دیابت تمرین متوسط.
بحث
نتایج مطالعه حاضر نشان داد که یافته¬های پژوهش حاضر نشان داد که دیابت نوع 2 سبب افزایش قابلتوجه گلوکز پلاسما گردید که با افزایش سطوح پروتئینNav1/3 در عضله نعلی نسبت به گروه کنترل سالم همراه بود. مهمترین یافته مطالعه حاضر کاهش معنادار بیان Nav1/3 در موش-هایی بود که تمرین تناوبی را با دو شدت متوسط و بالا، به تنهایی و همراه با مصرف مکمل آلفالیپولئیک اسید انجام دادند. Nav1/3 یکی از ایزوفورمهای کانالهای سدیمی است که در آسیبهای عصبی افزایش مییابد و نقش مهمی در بروز دردهای نوروپاتی دارد که مهار این کانال، باعث بهبود دردهای نوروپاتی میشود. همسو با نتایج مطالعه حاضر، تان و همکاران (2017) نشان دادند که دیابت باعث افزایش بیان Nav1/3 می¬شود و Nav1/3 با اختلال در نرخ تحریک با افزایش دردهای نوروپاتی ارتباط دارد (17). در مطالعه دیگر، محمودی و همکاران (2018) گزارش کردند یک دوره تمرین شنا منجر به کاهش بیان ژن Nav1/3 در رتهای مبتلا به نوروپاتی دیابتی میشود (18). در دیابت، اجزاء متفاوتی از عضله اسکلتی دچار اختلال می شوند. در این میان میتوان به تغییرات ساختاری عصبی عضلانی، کاهش وزیکول¬های حاوی استیلکولین و کاهش نوزایش میتوکندی را در پایانههای عصب حرکتی اشاره کرد. سنتینو و همکاران (2007) نشان دادند که تغیرات ساختاری و بیوشیمیایی القا شده توسط دیابت در بافت عضلانی، منجر به آغاز توالی تغییرات پاتوفیزیولوژیکی در صفحه محرکه انتهایی عضله میشود که میتواند به ضعف عضلانی بیانجامد (19). مطالعه حاضر اولین مطالعهای است که به بررسی اثر شدتهای مختلف تمرین بر بیان پروتئین Nav1/3 عضله نعلی در موشهای دیابتی پرداخته است و در نتیجه مطالعاتی که شاخصهای دیگر نوروپاتی دیابتی را بررسی کردهاند، مورد بررسی قرار گرفت. در این رابطه کلودینگ و همکاران (2012) نشان دادند که تمرین هوازی با شدت متوسط باعث کاهش درد و علائم نوروپاتیک در افراد مبتلا به نوروپاتی محیطی ناشی از دیابت میشود (20). همچنین، روسی و همکاران (2011) گزارش کردند که شدت متوسط تمرین شنا هایپرآلرژیای حرارتی را در موشهای دیابتی کاهش داد (21). یان و همکاران (2012) گزارش کردند که کاهش درد نوروپاتی محیطی موش¬های دیابتی بعد از شش هفته تمرین هوازی با شدت متوسط به دلیل افزایش رهاسازی نوروترنسیمیتر انکفالین و کاهش پروتئینهای پیش¬التهابی در اعصاب محیطی بود (22) طیبی و همکاران (2019) نشان دادند که تمرین تناوبی شدید منجر به بهبود آتروفی عضلانی با تغییر در بیان ژن¬های مرتبط با عصب زدایی gadd45a protein)،ncam1 protein) و افزایش سطح مقطع عضلانی شد (11). مقایسه اثر یک دوره تمرین تناوبی با شدت بالا در مقایسه با تمرین تناوبی با شدت متوسط در زنان چاق دیابتی مبتلا به نوروپاتی در مطالعه نشوا سیدحامد (2014) نشان داد که تمرین تناوبی با شدت بالا، تاثیر چشمگیری بر کاهش علائم ناشی از نوروپاتی در مقایسه با تمرین تناوبی با شدت متوسط دارد (23). در مقابل، اسلوکا و راسمیسن (2010) نشان دادند که فعالیت ورزشی وامانده-ساز منجر به افزایش زمان تاخیر در عقب کشیدن پا در هایپرآلرژیای حرارتی شد (24). اثرات محافظتی تمرین ورزشی از طریق تغییر در بیان ژنهای درگیر در مسیر نوروپاتی محیطی حاصل میشود و در نتیجه نقش مهمی در کنترل این بیماری دارد (1). miRNA-96 از طریق مهار بیان Nav1/3 درد نوروپاتیک را تنظیم می¬کند. دیابت منجر به کاهش miRNA-96 و در نتیجه افزایش NAV1/3 میشود. بنابراین به نظر میرسد که مسیر miRNA-96 مسئول تغییرات Nav1/3 باشد. در تایید این مطلب، محمودی و همکاران (2018) تاثیر یک دوره تمرین شنا بر بیان ژن Nav1/3 در رتهای مبتلا به نوروپاتی محیطی را بررسی کردند و کاهش بیان Nav1/3 و افزایش بیان miRNA-96 را گزارش کردند (18). از طرفی، هایپرگلایسمی مزمن منجر به تحمیل استرس اکسیداتیو و آپوپتوزی به سلول¬ها و بافت-های دیابتی و اختلال در هدایت عصبی عضلانی میشود. بنابراین، کنترل قند خون، می¬تواند از ظهور علائم نوروپاتی و همچنین بدتر شدن علائم نوروپاتی جلوگیری کند (23). با تجمع گلوکز در نورون¬ها، گلوکز اضافی به سوربیتول و فروکتوز تبدیل میشود. سوربیتول باعث ایجاد تأثیرات اسمزی و در نتیجه آسیب عصبی می¬گردد. تجمع فروکتوز نیز با تخلیه میواینوزیتول، که از اجزای فسفولیپیدی غشای سلولی میباشد، باعث کاهش انتقال آکسونی، کاهش تولید انتقال دهنده عصبی شده و کاهش هدایت عصبی می¬شود و در نهایت، نوروپاتی ایجاد میگردد (2). هر دو تمرین با شدت متوسط و زیاد احتمالاً منجر به پاسخ بدن به انسولین از طریق چندین مکانیزم از جمله افزایش سطح ناقل¬های گلوکز به سلول های عضلانی، افزایش گیرندههای انسولین و افزایش توده عضلانی می¬شود (25). در پژوهش حاضر نیز مکمل ALAبه تنهایی منجر به تغییر میزان پروتئین Nav1/3 عضله نعلی نشد. این یافته ها با نتایج مطالعه صادقیان و همکاران (2019) (26) و آگاداس و همکاران (2018) (27) متفاوت است. نتایج مطالعه صادقیان نشان داد که مصرف 100 میلیگرم ALA به مدت پنج هفته منجر به بهبود اختلال عصب حرکتی ناشی از نوروپاتی دیابتی در موشها شد. آگاداس و همکاران نشان دادند که مصرف 60 میلیگرم ALA در روز و به مدت 40 روز علائم نوروپاتی بطور معنیداری کاهش داد. از دلایل احتمالی تفاوت بین مطالعات میتوان به مقدار دوز ALA (در مطالعه حاضر 20 میلیگرم و در مطالعه صادقیان و آگاداس به ترتیب 100 و 60 میلیگرم تجویز شد)، متغیرهای اندازه گیری شده و زمان دیابتی شدن اشاره کرد. مطالعه حاضر نشان داد که مکمل ALAبه تنهایی منجر به کاهش سطح گلوگز خون شد که این یافته¬ها با نتایج مطالعه دریانوش و همکاران (2015) (28) که بهبود حساسیت به انسولین و افزایش تخلیه گلوکز توسـط انسـولین بعد از مصرف هشت هفتهای ALA گزارش کردند مطابقت دارد. تحقیقات انجام شده نشان می دهد ALA علاوه بر اثری که در افزایش فعالیت ذاتی انتقال دهندههای گلوکز دارا میباشد، با افزایش فسفریلاسیون تیروزین در سوبسترای 1 گیرنده انسولین و بهدنبال آن، فعالسازی فسفاتیدیل اینوزیتول-3 کیناز و AKt1، باعث افزایش سرعت جابهجایی انتقال دهندههای گلوکز به غشای پلاسمایی می¬شوند (29). در واقـع آلفالیپوئیـک اسـید، ظرفیـت سیسـتم انتقـال گلوکزرا از طریق تحریک انسولین افزایش می¬دهد و در ضـمن هـر دو مسیر اکسیداتیو و غیراکسـیداتیو متابولیسـم گلـوکز در عضـلات مقاوم به انسولین را تحریک می¬کند (28). نتایج این پژوهش همچنین نشان داد مکمل آلفا لیپوئیک اسید اثر تعاملی و فزاینده با تمرین ورزشی داشت بطوری¬که شش هفته تمرین با شدت متوسط و بالا به همراه مصرف آلفا لیپوئیک اسید منجر به کاهش بیشتر پروتئین Nav1/3 عضله نعلی شد. به نظر میرسد که این اثرات هم¬افزایی به خاصیت آنتیاکسیدانی ALA و بهبود سیستم دفاع اکسیدانی ناشی از تمرین ورزشی مرتبط باشد. هایپرگلیسمی در دیابت باعث ایجاد گونه¬های فعال اکسیژن داخل سلولی، اختلال در عملکرد میتوکندری و آپوپتوز سلولی در نورونهای گانگلیون ریشه پشتی میشود. نورونهای گانگلیون ریشه پشتی بهعنوان هدف اصلی در نوروپاتی محیطی دیابتی مشخص شده¬اند (30). مطالعات اخیر نشان میدهد که تمام مسیرهای درگیر در نوروپاتی دیابت منجر به افزایش استرس اکسیداتیو و سطح گونه¬های فعال اکسیژن سلولی می¬شود (31). استرس اکسیداتیو در سلول¬های عصبی گانگلیون ریشه پشتی شدیدتر است. از طرفی افزایش قندخون در دیابت منجر به گلیکوزیلاسیون آنزیمهای آنتیاکسیدان که منجر به کاهش فعالیت یا در دسترس بودن آنزیم¬های آنتی¬اکسیدان می¬شود. هر چند مکانیسم¬های تاثیر ورزش HIIT هنوز بهطور کامل مشخص نیست ولی به نظر میرسد که این تمرینات باعث افزایش فعالیت آنزیمهای آنتیاکسیدانی، افزایش مقاومت در برابر استرس اکسیداتیو و در نتیجه کاهش آسیب¬های اکسیداتیو نورونهای گانگلیون ریشه پشتی می¬شوند (32). افزایش گونه¬های فعال اکسیژنی در زنجیره انتقال الکترون میتوکندری در نتیجه هایپرگلایسمی میتوانند منجر به افزایش آپوپتوز سلول میشوند. در واقع، استرس اکسایشی ناشی از عدم تعادل بین گونههای فعال اکسیژنی و آنزیمهای آنتی¬اکسیدانی در دیابت اتفاق میافتد و میتواند مرگ سلولی را از طریق مسیرهای مختلف راهاندازی کند. اوچندو و همکاران (2018) نشان دادند که ALA منجر به افزایش سوپراکسید دسموتاز و کاتالاز و کاهش مالوندیآلدهید شد، که عملکرد آنتیاکسیدانی ALA و توانایی آن در مهار فعالیت رادیکالهای آزاد و بهبود حالت ردوکس را تأیید میکند (33). نتایج مطالعه کیم و همکاران بیان میکند که فعالسازی مسیر سیگنالینگ آدنوزین منوفسفات حلقوی (cAMP) بهوسیله ALA افزایش می یابد که این موضوع منجر به افزایش بیان پروتئینهای آنتیآپوپتوزی و مهار فعالسازی کسپازها در نورونها میشود (34). در مجموع درباره اثر تمرین بر میزان Nav1/3 در آزمودنی¬های دیابتی مطالعات محدودی انجام شده است. از محدودیتهای مطالعه حاضر، عدم اندازهگیری miRNA-96 به عنوان مهارکننده Nav1/3 است. همچنین، عدم اندازهگیری آزمایشات رفتاری درد نوروپاتیک به عنوان شاخص عملکرد نورونهای حسی و حرکتی از دیگر محدودیتهای مطالعه حاضر بود.
نتیجهگیری
با توجه به یافتههای تحقیق حاضر، به نظر میرسد دیابت با افزایش بیان پروتئین Nav1/3در عضله نعلی همراه است و تمرین تناوبی شدید و متوسط به همراه مصرف مکمل آلفالیپوئیک اسید سبب کاهش میزان Nav1/3 در عضله نعلی موشهای دیابتی میشود و ممکن است بهعنوان یک راهکار حفاظتی و درمانی در جهت کاهش عوارض نوروپاتی ناشی از دیابت مورد استفاده قرار گیرد. با این وجود، شناخت مکانیسمهای عهدهدار فرآیند نوروپاتی دیابتی نیازمند مطالعات بیشتر در این زمینه است.
سپاسگزاری
این مقاله مستخرج از رساله دکتری در رشته فیزیولوژی ورزشی دانشگاه آزاد ساری و ثبت شده در کمیته اخلاق دانشکده پزشکی دانشگاه آزاد اسلامی واحد ساری ﺑﻮد. نویسندگان از مسؤولان آزمایشگاه فیزیولوژِی ورزشی دانشگاه آزاد واحد ساری جهت همکاری صمیمانه شان تشکر و قدردانی مینمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
دیابت نوعی بیماری متابولیکی است که سطح بالای قند خون و اختلالات متابولیکی منجر به اختلالات نورولوژیک میشود که بخشهای مختلف سیستم عصبی اعم از اعصاب محیطی و خودمختار را تحتتاثیر قرار میدهد. در اثر آسیبهای ناشی از هایپرگلایسمی به سلولهای عصبی و ایسکمی نورونی ناشی از کاهش جریان عروقی-عصبی، نوروپاتی رخ می¬دهد که بهدنبال آن میتواند عصبزدایی (denervation) ایجاد شود. به دنبال عصبزدایی، آتروفی و تخریب بافتی و همچنین کاهش در اندازه و تعداد فیبر عضلانی و متعاقباً کاهش سرعت انقباض و تنش در عضله اسکلتی دیده میشود (1). دباغ نیکوخصلت و همکاران (2016) ارتباط بین عصبزدایی و نوروپاتی دیابتی در عضلات ساق پا در بیماران دیابتی را گزارش کردند (2). نورونها بهویژه در برابر آسیبهای ناشی از سطح بالای گلوکز آسیبپذیر هستند؛ زیرا جذب گلوکز عصبی بیشتر به غلظت خارج سلولی گلوکز بستگی دارد. از آنجا که اثرات انسولین بهطور قابلتوجهی در سلولهای عصبی ضعیفتر از بافتهای دیگر است، سلول¬های عصبی حساس به انسولین در نظر گرفته میشوند. در دیابت، افزایش قند خون مداوم میتواند منجر به افزایش چهار برابر سطح گلوکز در سلولهای عصبی شود که آنها را در معرض آسیب ناشی از هایپرگلیسمی قرار میدهد (3). کانال¬های ولتاژی سدیم، پروتئینهای سرتاسری در غشای سلولی بسیاری از بافتها هستند که باعث تولید پتانسیل عمل و تنظیم سیگنالهای الکتریکی در سلول میشوند. در فرایندهای فیزیولوژیکی، فعال شدن و غیر فعال شدن این کانالهای یونی، با کنترل پتانسیل عمل در بافتهای مختلف اتفاق می-افتد. کانالهای ولتاژ سدیمی، از دو زیر مجموعه آلفا و بتا تشکیل شدهاند و در پستانداران نه ایزوفرم آلفا شناسایی شده است که Nav1/3، یکی از آنها میباشد (4).
در طی مرحله جنینی، Nav1/3 بهطور گسترده در نورونهای گانگلیون ریشه پشتی بیان میشود. پس از تولد، بیان Nav1/3در سراسر سیستم عصبی به طرز چشمگیری کاهش می¬یابد. با اینحال، گزارش شده است که Nav1/3در نورونهای گانگلیون ریشه پشتی محیطی تحت شرایط پاتولوژیک خاص مانند التهاب که با آسیبهای عصبی محیطی همراه است دوباره بیان می¬شود (5). مطالعات اخیر نشان میدهند که Nav1/3 نقش مهمی در بروز درد و مشکلات نوروپاتی در افراد دیابتی دارد. افزایش بیان کانالهای Nav1/3 در سلول¬های عصبی افراد دیابتی، منجر به افزایش کانالهای سدیمی و کاهش آستانه شلیک شده و در نتیجه باعث افزایش آسیب نورونها میشود (6). مطالعه سوارز و همکاران، نشان داد که بیان Nav1/3 تا شش ماه پس از القاء دیابت در موشها بالا باقی مانده که احتمالاً به دلیل تشدید واکنشهای التهابی در دیابت است (7).
هایپرگلیسمی در بیماران دیابتی منجر به افزایش تولید رادیکالهای آزاد، گلیکاسیون آنزیمهای آنتیاکسیدانی و در نتیجه افزایش آسیب نورونها میشود (8). باتوجه به نقش تایید شده آسیبهای اکسیداتیو در ایجاد مقاومت به انسولین و عوارض آن در جریان بیماری دیابت و همینطور خواص سودمند مواد آنتیاکسیدان، تلاش برای کاهش شدت آسیب اکسیداتیو و در نهایت کاهش فعالسازی مسیرهای دخیل در آسیبهای اکسیداتیو، بهعنوان جزئی از فرایند درمانی بیماران مبتلا به دیابت نوع 2 ضروری به نظر میرسد. آلفالیپوئیک-اسید (α-lipoic acid) یک آنتیاکسیدان زیستی قوی بوده و بهعنوان یک کوفاکتور در کمپلکس آنزیمی دهیدروژناز میتوکندریایی در متابولیسم و تولید انرژی فعالیت دارد که به طور مستقیم باعث مهار رادیکالهای آزاد شده و فعالیت آنزیمهای اکسیدانی در بافت و اعصاب محیطی را افزایش داده و باعث افزایش محافظت عصبی میشود (9). از سوی دیگر، فعالیت ورزشی می¬تواند یک مکانیسم محافظتی غیرتهاجمی و غیردارویی را در برابر بیماریها و ناتوانیهای عصبی-عضلانی ایجاد کند (10). علاوه براین، فعالیت بدنی راهی برای حفظ عملکرد و ساختار سیناپس واحیای نورون¬های آسیب دیده است. مطالعات نشان دادند که تمرین با شدت متوسط اثرات مفیدی بر عوارش ناشی از نوروپاتی محیطی دارد (8). همچنین، یک دوره تمرین تناوبی شدید، عملکرد و حفظ ساختار سیناپسها و بازسازی نورونهای آسیب دیده و میلین آکسونهای نورون¬های آسیب ¬دیده در موش¬های مسن را بهبود بخشید (11). به نظر میرسد که اثر شدتهای مختلف تمرین ورزشی بر شکل عضله و سطح عصبزدایی متفاوت باشد. بنابراین، مشخص شدن مکانیسمهای درگیر در تنظیم تغییرات عصبی-عضلانی و عوامل مرتبط با نوروپاتی با شدت تمرین ورزشی میتواند در درک نقش فعالیت ورزشی منظم در بهبود دیابت کمک کند. از سوی دیگر، با توجه به نقش آنتی-اکسیدانی آلفالیپوئیک¬اسید، بررسی این موضوع که آیا شدت-های مختلف تمرین ورزشی دارای اثرات محافظتی یکسانی در آسیبهای نورونی ناشی از دیابت هستند و اینکه آیا مصرف مکمل آلفالیپوئیک اسید به همراه تمرین ورزشی دارای اثر هم-افزایی بر کنترل مسیرهای درگیر در نوروپاتی دیابتی است، حائز اهمیت میباشد. بنابراین هدف از این مطالعه بررسی تأثیر شدت تمرین ورزشی به همراه مصرف مکمل آلفالیپوئیک اسید بر بیان پروتئین Nav1/3 عضله سولئوس موشهای دیابتی بود.
روش بررسی
این مطالعه تجربی بر روی 35 سر موش نر نژاد ویستار (براساس جدول برآورد حجم کوهن) در مرکز ﭘﺮورش و ﻧﮕﻬﺪاری ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕﺎﻫﯽ هیستوژنوتک تهران انجام شد. معیار ورود به مطالعه شامل وزن 190تا220 گرم و سطح گلوکز پلاسمای بالاتر از 250 میلیگرم در دسیلیتر در گروه دیابت بوده و معیار خروج از مطالعه شامل مرگ در اواسط مطالعه و یا بیمار شدن حیوان و اجرا نکردن دو جلسه پیاپی تمرین هر موش در گروههای تمرینی بود. موشهای مورد مطالعه به تعداد پنج عدد در هر قفس از جنس پلی کربنات (30 × 15 × 15 سانتیمتر) در یک شرایط آب و هوایی کنترل شده (دمای2± 22 سانتیگراد، رطوبت 5±50 درصد، یک سیکل شب و روز 12:12) و با رژیم غذایی استاندارد و آب مورد نیاز در شرایط آزمایشگاهی نگهداری شدند (12). پس از آشنایی موش¬ها با پروتکل تمرینی، پنج سر موش به صورت تصادفی به عنوان گروه سالم جدا شد و 28 موش باقیمانده دیابتی شدند و بهصورت تصادفی در شش گروه: کنترل دیابت (گروهی که در طول مطالعه تمرین و مکمل دریافت نکرد)، تمرین تناوبی شدید (موشهای دیابتی که تمرین تناوبی شدید را انجام دادند)، تمرین تناوبی متوسط (موشهای دیابتی که تمرین تناوبی متوسط را انجام دادند)، مکمل آلفالیپوئیک اسید (موشهای دیابتی که مکمل دریافت کردند)، آلفا لیپوئیک اسید + تمرین تناوبی شدید (موشهای دیابتی که علاوه بر تمرین تناوبی شدید، مکمل هم دریافت کردند)، آلفا لیپوئیک اسید + تمرین تناوبی متوسط (موش¬های دیابتی که علاوه بر تمرین تناوبی متوسط، مکمل هم دریافت کردند) قرار گرفتند. در تمام مراحل پژوهش، آب مورد نیاز حیوان بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی در دسترس آنها بود. در این مطالعه برای دیابتی نمودن موشها از روش استرپتوزوتوسین (Streptozotocin) استفاده شد. به این صورت که با تزریق ml/kg 50 استرپتوزوتوسین به صورت داخل صفاقی، القای دیابت صورت گرفت. به منظور اطمینان از دیابتی شدن موشها، 48 ساعت پس از تزریق قند خون اندازه گیری شد و موشهای با قند خون بالای mg/dl 250 به عنوان موشهای دیابت در نظر گرفته شدند (13). دو هفته بعد از القا دیابت، برنامه تمرینی و مکملدهی انجام شد. گروه¬های تمرینی پنج جلسه در هفته، به مدت شش هفته تمرین تناوبی انجام دادند. قبل از شروع پروتکل تمرینی، آزمودنی¬های گروههای تمرین به منظور آشنایی با چگونگی فعالیت توسط نوارگردان (مخصوص فعالیت بدنی حیوانات آزمایشگاهی، ساخت ایران)، در یک هفته طی پنج جلسه، به مدت پنج دقیقه با سرعت 10-8 متر بر دقیقه با شیب صفر فعالیت داشتند. سپس، سرعت بیشینه دویدن هنگام حداکثر اکسیژن مصرفی برای هر رت و به منظور کنترل شدت تمرین تعیین شد. برای این منظور، بعد از 10 دقیقه گرم کردن با شدت پایین، رتها شروع به دویدن کردند و سرعت نوارگردان هر 2 دقیقه یک بار 2 متر بر دقیقه افزایش یافت تا حیوانات دیگر قادر به دویدن نباشند و به واماندگی برسند. سرعت نهایی رت بهعنوان سرعت بیشینه در زمان رسیدن به حداکثر اکسیژن مصرفی جهت محاسبه شدتهای تمرینی استفاده گردید. از حیوانات هر دو هفته یک بار آزمون وامانده ساز گرفته و شدت تمرین با توجه به مقادیر جدید آزمون تعیین می¬شد. برنامه تمرینی تناوبی با شدت بالا(High-intensity interval training) و تمرین تناوبی با شدت متوسط (Moderate intensity interval training) به مدت شش هفته و پنج جلسه در هفته اجرا شد. در هر دو پروتکل تمرینی، موش¬ها ابتدا پنج دقیقه با سرعت کم (30-40درصد سرعت بیشینه) و با هدف گرم کردن دویدند. هر جلسه تمرینی تناوبی با شدت بالا شامل 10 ست دویدن چهار دقیقهای با شدت 85-90 درصد سرعت بیشینه و 2 دقیقه استراحت فعال (50-60 درصد سرعت بیشینه) بین هر مرحله تمرین بود. پروتکل تمرین تناوبی با شدت متوسط شامل 13 ست دویدن چهار دقیقهای با شدت 70-65 درصد سرعت بیشینه و 2 دقیقه استراحت فعال (50-40 درصد سرعت بیشینه) بین ست¬ها بود (14). به منظور مکملدهی به گروههای مکمل، روزانه ﻣﯿﺰان 20 میلیﮔـﺮم به ازای هر کیلوگرم وزن بدن موش¬ها مکمل آلفالیپوئیک اسید لیپوزومال (مکمل آلفالیپولئیک اسید ساخت شرکت Sigma-Aldrich کشور آمریکا) در متیل سلولز حل شده و یک ساعت بعد از تمرین بهصورت گاواژ و در یک وعده در روز به موش¬ها داده شد (15). برای لیپوزوم کردن از روش آبپوشانی لایه نازک استفاده شد، بدین صورت که ابتدا لسیتین فسفولیپید (L-a- a-phosphatidylcholine) در کلروفرم حل شد و محلول اول به دست آمد. سپس کلسترول در کلروفرم حل شد و محلول دوم به دست آمد. در مرحله بعد، دو محلول به ترتیب با نسبت 4 به 1 با هم ترکیب شدند. سپس این ترکیب در دستگاه روتاری، در دمای 50 درجه و سرعت 150rmp و تحت خلا تبخیر شد و با تشکیل فیلم نازک لیپیدی، تبخیر حداقل به مدت دو ساعت ادامه یافت. سپس آلفالیپولئیک اسید را در آب مقطر حل کرده و به محلول اضافه کردیم. برای هموژنایز کردن سوسپانسیون و تولید نانو وزیکولها، نمونه¬های بهدست آمده به مدت 15 دقیقه با همگن ساز اولتراسوند، همگن شدند. سپس سوسپانسیون هموژن شده در مجاورت نیتروژن قرار گرفت و به مدت یک ساعت تحت حرارت انتقال چربی قرار گرفت. سپس محصول تولید شده سانترفیوژ شد و در نهایت یک سوسپانسیون شفاف از نانولیپوزومها تولید شد و تا زمان استفاده در دمای 4 درجه سانتیگراد نگهداری شد (16). برای بررسی بیان پروتئین Nav1/3 در عضله نعلی از روش ایمنوهیستوشیمی استفاده شد. برای انجام رنگآمیزی شیمیایی و مشخص کردن میزان پروتئین Nav1/3، عضله نعلی با ضخامت 10 میکرومتر برش داده شد. پس از برداشت بافت مورد نظر با استفاده از محلول بوئن یا فرمالین 10% ثابتسازی انجام گرفت. به منظور آبگیری بافت، نمونه را در الکل و سپس برای شفافسازی نمونه در داخل گزیلول قرار گرفت. در مرحله بعد نمونه را داخل پارافین مذاب گذاشته و نمونه آغشته شده با پارافین در داخل قالب پر از پارافین مذاب قرار گرفت. ضمن انجماد پارافین، نمونه نیز در داخل باقیمانده و آماده مقطعگیری میکرد. نمونه همراه با قالب پارافین توسط دستگاه میکروتوم به ضخامت 5 تا 10 میکرون، برش داده شد. برش بر روی لام حاوی ماده آلبومین هست تا بر روی لام بچسبد. لامها درون آون در دمای 90 درجه سانتیگراد به مدت 20 دقیقه قرار گرفت تا پارافینهای موجود در نمونه ذوب گردد. به منظور خارج کردن پارافین داخل نمونه، نمونه¬ها در داخل زایلول قرار گرفت. لامها را داخل رنگ هماتوکسیلین وارد کرده به مدت 15 دقیقه سپس شستشو با آب جاری و بعد در ائوزین چند مرتبه غوطه ور شده و سپس با آب جاری شسته می¬شود و در الکل 70،80، 90 و 100 درصد قرار داده تا خوب آبگیری شود و سپس در گزیلول قرار داده تا الکلگیری و شفاف شود. نمونه با PBS در چهار مرحله و به فاصله پنج دقیقه شسته شدند. بهمنظور بازیابی آنتی¬ژنی بر روی نمونهها اسیدکلریدریک دو نرمال به مدت 30 دقیقه ریخته شد. بافر بورات به منظور خنثیسازی اسید به مدت پنج دقیقه اضافه گردید. سلولها با PBS شسته شدند. تریتون 0/3 درصد به مدت 30 دقیقه به منظور نفوذپذیر کردن غشاء سلولها استفاده گردید. با PBS شستشو داده شدند. سرم بز 10 درصد برای مدت 30 دقیقه به منظور بلوک کردن واکنش آنتی¬بادی ثانویه به صورت رنگ اضافی زمینه اضافه شد. آنتیبادی اولیه (با کد SC-271255 ساخت شرکت Santa cruz کشور آمریکا) رقیق شده (نسبت 1 به 100) با PBS به نمونه اضافه گردید و به مدت یک شب درون یخچال با دمای 2 تا 8 درجه قرار داده شد. روز بعد بافت 4 بار و هر بار به مدت 5 دقیقه با PBS شستشو داده شد. به نمونه آنتی بادی ثانویه (با کد SC-271255 ساخت شرکت Santa cruz کشور آمریکا) با رقت 1 به 150 اضافه گردید و سپس در انکوباتور با دمای 37 درجه به مدت یک ساعت و 30 دقیقه در تاریکی انکوبه شدند. بعد از آن نمونه از انکوباتور به اتاق تاریک منتقل گردید و بعد از 4 بار شستشو، به آنها DAPI اضافه گردید، بلافاصله برداشته شد و روی نمونه PBS ریخته شد. در مرحله آخر تصاویر با میکروسکوپ نوری ساخت شرکت LABOMED کشور آمریکا گرفته شد. برای تجزیه و تحلیل تصاویر و مشخص کردن میزان پروتئین Nav1/3 از نرم افزار Image J استفاده شد که بیان پروتئین را بر اساس درصدی از تصاویر نشان داد. سنجش گلوکز پلاسما به روش گلوکز اکسیداز و به وسیله کیت تشخیص کمی گلوکز پلاسما شرکت پارس آزمون با حساسیت 5 میلیگرم در دسی لیتر انجام شد. انسولین سرم به روش الایزا و مطابق با استانداردهای کیت تجاری (ELIZA Diagnostic insulin Demeditec) ساخت کشور آلمان اندازهگیری شد.
تجزیه و تحلیل آماری
جهت بررسی طبیعی بودن توزیع داده ها از آزمون شاپیرو-ویلک و همگنی واریانس گروهها از آزمون لون استفاده شد. ﺑﻪ ﻣﻨﻈﻮر ﺑﺮرﺳﯽ ﺗﻔﺎوتﻫﺎ از آزﻣﻮن ﺗﺤﻠﯿﻞ واریﺎﻧﺲ یﮏ ﻃﺮﻓﻪ و از آزﻣﻮن ﺗﻌﻘﯿﺒﯽ ﺗﻮﮐﯽ اﺳﺘﻔﺎده ﺷﺪ. ﺳﻄﺢ ﻣﻌﻨﯽداری (0/05= P) در نظر گرفته شد. تمامی عملیات آماری با نرمافزارversion 16 SPSS انجام گرفت.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق کار با حیوانات دانشکده علوم پزشکی دانشگاه آزاد ساری تایید و کد اخلاق (IR.IAU.SARI.REC.1399.158) صادر گردید.
نتایج
نتایج مطالعه حاضر نشان داد که گلوگز پلاسما در تمام گروهها بجز گروه دیابت + تمرین شدید + مکمل افزایش معنیداری نسبت به گروه کنترل سالم داشت (P=0/148). در مقایسه با گروه دیابت، تمرین (P=0/023) و همچنین ترکیب تمرین متوسط + مکمل (P=0/013) و تمرین شدید + مکمل(P=0/001) منجر به کاهش معنادار گلوگز شد. میزان انسولین در تمام گروه¬ها بجز گروه دیابت + تمرین شدید + مکمل کاهش معنی¬داری نسبت به گروه کنترل سالم داشت(P=0/089). در مقایسه با گروه دیابت، تمرین متوسط (P=0/0021)و تمرین متوسط + مکمل(P=0/018) و تمرین شدید + مکمل(P=0/001) منجر به افزایش معنادار انسولین شد (نمودار1). نتایج آزمون تحلیل واریانس یکراهه برای بیان پروتئین Nav1.3 در جدول 1 نشان می¬دهد که بین گروههای مختلف تفاوت معناداری وجود دارد(P=0/0001). نتایج آزمون تعقیبی توکی نیز نشان داد تمرین تناوبی شدید(P=0/0015)، تمرین تناوبی متوسط (P=0/0056)، تمرین تناوبی شدید + آلفالیپوئیک (0/0001>P) و تمرین تناوبی متوسط + آلفالیپوئیک (0/0001>P) سطحNav1.3 را بهطور معنیداری نسبت به گروه دیایت کاهش دادند. گروه¬های تمرین شدید(P=0/0286) ، تمرین متوسط + آلفالیپوئیک(P=0/0002) و تمرین شدید + آلفالیپوئیک (0/0001>P) کاهش معناداری نسبت به گروه آلفالیپوئیک نشان دادند. گروه تمرین شدید + آلفالیپوئیک نیز کاهش معناداری نسبت به گروه تمرین شدید(P=0/0028) داشت. گروه¬های دیابت تمرین شدید + آلفالیپوئیک(P=0/0008) و دیابت تمرین متوسط + آلفالیپوئیک(P=0/0156)کاهش معناداری نسبت به گروه تمرین متوسط نشان دادند (نمودار 1).
جدول1: مقادیر وزن اولیه و ثانویه موشها و میزان گلوگز پلاسما گروههای مختلف تحقیق

جدول 2: نتایج آزمون تحلیل واریانس یکراهه برای بیان پروتئین NaV1.3 عضله نعلی

سطح معنادار بودن 0/05

نمودار 1: مقایسه آن پروتئین NAv1/3 عضله نعلی موشهای دیابتی متعاقب 6 هفته تمرین متوسط و شدید و مصرف آلفالیپوئیک اسید.
*: تغییرات معنادار نسبت به گروه کنترل. &: تعییرات معنادار نسبت به گروه دیابت. $: تغییرات معنادار نسبت به دیابت+آلفالیپوئیک. #: تغییرات معنادار نسبت به دیابت تمرین شدید. @: تغییرات معنادار نسبت به دیابت تمرین متوسط.
بحث
نتایج مطالعه حاضر نشان داد که یافته¬های پژوهش حاضر نشان داد که دیابت نوع 2 سبب افزایش قابلتوجه گلوکز پلاسما گردید که با افزایش سطوح پروتئینNav1/3 در عضله نعلی نسبت به گروه کنترل سالم همراه بود. مهمترین یافته مطالعه حاضر کاهش معنادار بیان Nav1/3 در موش-هایی بود که تمرین تناوبی را با دو شدت متوسط و بالا، به تنهایی و همراه با مصرف مکمل آلفالیپولئیک اسید انجام دادند. Nav1/3 یکی از ایزوفورمهای کانالهای سدیمی است که در آسیبهای عصبی افزایش مییابد و نقش مهمی در بروز دردهای نوروپاتی دارد که مهار این کانال، باعث بهبود دردهای نوروپاتی میشود. همسو با نتایج مطالعه حاضر، تان و همکاران (2017) نشان دادند که دیابت باعث افزایش بیان Nav1/3 می¬شود و Nav1/3 با اختلال در نرخ تحریک با افزایش دردهای نوروپاتی ارتباط دارد (17). در مطالعه دیگر، محمودی و همکاران (2018) گزارش کردند یک دوره تمرین شنا منجر به کاهش بیان ژن Nav1/3 در رتهای مبتلا به نوروپاتی دیابتی میشود (18). در دیابت، اجزاء متفاوتی از عضله اسکلتی دچار اختلال می شوند. در این میان میتوان به تغییرات ساختاری عصبی عضلانی، کاهش وزیکول¬های حاوی استیلکولین و کاهش نوزایش میتوکندی را در پایانههای عصب حرکتی اشاره کرد. سنتینو و همکاران (2007) نشان دادند که تغیرات ساختاری و بیوشیمیایی القا شده توسط دیابت در بافت عضلانی، منجر به آغاز توالی تغییرات پاتوفیزیولوژیکی در صفحه محرکه انتهایی عضله میشود که میتواند به ضعف عضلانی بیانجامد (19). مطالعه حاضر اولین مطالعهای است که به بررسی اثر شدتهای مختلف تمرین بر بیان پروتئین Nav1/3 عضله نعلی در موشهای دیابتی پرداخته است و در نتیجه مطالعاتی که شاخصهای دیگر نوروپاتی دیابتی را بررسی کردهاند، مورد بررسی قرار گرفت. در این رابطه کلودینگ و همکاران (2012) نشان دادند که تمرین هوازی با شدت متوسط باعث کاهش درد و علائم نوروپاتیک در افراد مبتلا به نوروپاتی محیطی ناشی از دیابت میشود (20). همچنین، روسی و همکاران (2011) گزارش کردند که شدت متوسط تمرین شنا هایپرآلرژیای حرارتی را در موشهای دیابتی کاهش داد (21). یان و همکاران (2012) گزارش کردند که کاهش درد نوروپاتی محیطی موش¬های دیابتی بعد از شش هفته تمرین هوازی با شدت متوسط به دلیل افزایش رهاسازی نوروترنسیمیتر انکفالین و کاهش پروتئینهای پیش¬التهابی در اعصاب محیطی بود (22) طیبی و همکاران (2019) نشان دادند که تمرین تناوبی شدید منجر به بهبود آتروفی عضلانی با تغییر در بیان ژن¬های مرتبط با عصب زدایی gadd45a protein)،ncam1 protein) و افزایش سطح مقطع عضلانی شد (11). مقایسه اثر یک دوره تمرین تناوبی با شدت بالا در مقایسه با تمرین تناوبی با شدت متوسط در زنان چاق دیابتی مبتلا به نوروپاتی در مطالعه نشوا سیدحامد (2014) نشان داد که تمرین تناوبی با شدت بالا، تاثیر چشمگیری بر کاهش علائم ناشی از نوروپاتی در مقایسه با تمرین تناوبی با شدت متوسط دارد (23). در مقابل، اسلوکا و راسمیسن (2010) نشان دادند که فعالیت ورزشی وامانده-ساز منجر به افزایش زمان تاخیر در عقب کشیدن پا در هایپرآلرژیای حرارتی شد (24). اثرات محافظتی تمرین ورزشی از طریق تغییر در بیان ژنهای درگیر در مسیر نوروپاتی محیطی حاصل میشود و در نتیجه نقش مهمی در کنترل این بیماری دارد (1). miRNA-96 از طریق مهار بیان Nav1/3 درد نوروپاتیک را تنظیم می¬کند. دیابت منجر به کاهش miRNA-96 و در نتیجه افزایش NAV1/3 میشود. بنابراین به نظر میرسد که مسیر miRNA-96 مسئول تغییرات Nav1/3 باشد. در تایید این مطلب، محمودی و همکاران (2018) تاثیر یک دوره تمرین شنا بر بیان ژن Nav1/3 در رتهای مبتلا به نوروپاتی محیطی را بررسی کردند و کاهش بیان Nav1/3 و افزایش بیان miRNA-96 را گزارش کردند (18). از طرفی، هایپرگلایسمی مزمن منجر به تحمیل استرس اکسیداتیو و آپوپتوزی به سلول¬ها و بافت-های دیابتی و اختلال در هدایت عصبی عضلانی میشود. بنابراین، کنترل قند خون، می¬تواند از ظهور علائم نوروپاتی و همچنین بدتر شدن علائم نوروپاتی جلوگیری کند (23). با تجمع گلوکز در نورون¬ها، گلوکز اضافی به سوربیتول و فروکتوز تبدیل میشود. سوربیتول باعث ایجاد تأثیرات اسمزی و در نتیجه آسیب عصبی می¬گردد. تجمع فروکتوز نیز با تخلیه میواینوزیتول، که از اجزای فسفولیپیدی غشای سلولی میباشد، باعث کاهش انتقال آکسونی، کاهش تولید انتقال دهنده عصبی شده و کاهش هدایت عصبی می¬شود و در نهایت، نوروپاتی ایجاد میگردد (2). هر دو تمرین با شدت متوسط و زیاد احتمالاً منجر به پاسخ بدن به انسولین از طریق چندین مکانیزم از جمله افزایش سطح ناقل¬های گلوکز به سلول های عضلانی، افزایش گیرندههای انسولین و افزایش توده عضلانی می¬شود (25). در پژوهش حاضر نیز مکمل ALAبه تنهایی منجر به تغییر میزان پروتئین Nav1/3 عضله نعلی نشد. این یافته ها با نتایج مطالعه صادقیان و همکاران (2019) (26) و آگاداس و همکاران (2018) (27) متفاوت است. نتایج مطالعه صادقیان نشان داد که مصرف 100 میلیگرم ALA به مدت پنج هفته منجر به بهبود اختلال عصب حرکتی ناشی از نوروپاتی دیابتی در موشها شد. آگاداس و همکاران نشان دادند که مصرف 60 میلیگرم ALA در روز و به مدت 40 روز علائم نوروپاتی بطور معنیداری کاهش داد. از دلایل احتمالی تفاوت بین مطالعات میتوان به مقدار دوز ALA (در مطالعه حاضر 20 میلیگرم و در مطالعه صادقیان و آگاداس به ترتیب 100 و 60 میلیگرم تجویز شد)، متغیرهای اندازه گیری شده و زمان دیابتی شدن اشاره کرد. مطالعه حاضر نشان داد که مکمل ALAبه تنهایی منجر به کاهش سطح گلوگز خون شد که این یافته¬ها با نتایج مطالعه دریانوش و همکاران (2015) (28) که بهبود حساسیت به انسولین و افزایش تخلیه گلوکز توسـط انسـولین بعد از مصرف هشت هفتهای ALA گزارش کردند مطابقت دارد. تحقیقات انجام شده نشان می دهد ALA علاوه بر اثری که در افزایش فعالیت ذاتی انتقال دهندههای گلوکز دارا میباشد، با افزایش فسفریلاسیون تیروزین در سوبسترای 1 گیرنده انسولین و بهدنبال آن، فعالسازی فسفاتیدیل اینوزیتول-3 کیناز و AKt1، باعث افزایش سرعت جابهجایی انتقال دهندههای گلوکز به غشای پلاسمایی می¬شوند (29). در واقـع آلفالیپوئیـک اسـید، ظرفیـت سیسـتم انتقـال گلوکزرا از طریق تحریک انسولین افزایش می¬دهد و در ضـمن هـر دو مسیر اکسیداتیو و غیراکسـیداتیو متابولیسـم گلـوکز در عضـلات مقاوم به انسولین را تحریک می¬کند (28). نتایج این پژوهش همچنین نشان داد مکمل آلفا لیپوئیک اسید اثر تعاملی و فزاینده با تمرین ورزشی داشت بطوری¬که شش هفته تمرین با شدت متوسط و بالا به همراه مصرف آلفا لیپوئیک اسید منجر به کاهش بیشتر پروتئین Nav1/3 عضله نعلی شد. به نظر میرسد که این اثرات هم¬افزایی به خاصیت آنتیاکسیدانی ALA و بهبود سیستم دفاع اکسیدانی ناشی از تمرین ورزشی مرتبط باشد. هایپرگلیسمی در دیابت باعث ایجاد گونه¬های فعال اکسیژن داخل سلولی، اختلال در عملکرد میتوکندری و آپوپتوز سلولی در نورونهای گانگلیون ریشه پشتی میشود. نورونهای گانگلیون ریشه پشتی بهعنوان هدف اصلی در نوروپاتی محیطی دیابتی مشخص شده¬اند (30). مطالعات اخیر نشان میدهد که تمام مسیرهای درگیر در نوروپاتی دیابت منجر به افزایش استرس اکسیداتیو و سطح گونه¬های فعال اکسیژن سلولی می¬شود (31). استرس اکسیداتیو در سلول¬های عصبی گانگلیون ریشه پشتی شدیدتر است. از طرفی افزایش قندخون در دیابت منجر به گلیکوزیلاسیون آنزیمهای آنتیاکسیدان که منجر به کاهش فعالیت یا در دسترس بودن آنزیم¬های آنتی¬اکسیدان می¬شود. هر چند مکانیسم¬های تاثیر ورزش HIIT هنوز بهطور کامل مشخص نیست ولی به نظر میرسد که این تمرینات باعث افزایش فعالیت آنزیمهای آنتیاکسیدانی، افزایش مقاومت در برابر استرس اکسیداتیو و در نتیجه کاهش آسیب¬های اکسیداتیو نورونهای گانگلیون ریشه پشتی می¬شوند (32). افزایش گونه¬های فعال اکسیژنی در زنجیره انتقال الکترون میتوکندری در نتیجه هایپرگلایسمی میتوانند منجر به افزایش آپوپتوز سلول میشوند. در واقع، استرس اکسایشی ناشی از عدم تعادل بین گونههای فعال اکسیژنی و آنزیمهای آنتی¬اکسیدانی در دیابت اتفاق میافتد و میتواند مرگ سلولی را از طریق مسیرهای مختلف راهاندازی کند. اوچندو و همکاران (2018) نشان دادند که ALA منجر به افزایش سوپراکسید دسموتاز و کاتالاز و کاهش مالوندیآلدهید شد، که عملکرد آنتیاکسیدانی ALA و توانایی آن در مهار فعالیت رادیکالهای آزاد و بهبود حالت ردوکس را تأیید میکند (33). نتایج مطالعه کیم و همکاران بیان میکند که فعالسازی مسیر سیگنالینگ آدنوزین منوفسفات حلقوی (cAMP) بهوسیله ALA افزایش می یابد که این موضوع منجر به افزایش بیان پروتئینهای آنتیآپوپتوزی و مهار فعالسازی کسپازها در نورونها میشود (34). در مجموع درباره اثر تمرین بر میزان Nav1/3 در آزمودنی¬های دیابتی مطالعات محدودی انجام شده است. از محدودیتهای مطالعه حاضر، عدم اندازهگیری miRNA-96 به عنوان مهارکننده Nav1/3 است. همچنین، عدم اندازهگیری آزمایشات رفتاری درد نوروپاتیک به عنوان شاخص عملکرد نورونهای حسی و حرکتی از دیگر محدودیتهای مطالعه حاضر بود.
نتیجهگیری
با توجه به یافتههای تحقیق حاضر، به نظر میرسد دیابت با افزایش بیان پروتئین Nav1/3در عضله نعلی همراه است و تمرین تناوبی شدید و متوسط به همراه مصرف مکمل آلفالیپوئیک اسید سبب کاهش میزان Nav1/3 در عضله نعلی موشهای دیابتی میشود و ممکن است بهعنوان یک راهکار حفاظتی و درمانی در جهت کاهش عوارض نوروپاتی ناشی از دیابت مورد استفاده قرار گیرد. با این وجود، شناخت مکانیسمهای عهدهدار فرآیند نوروپاتی دیابتی نیازمند مطالعات بیشتر در این زمینه است.
سپاسگزاری
این مقاله مستخرج از رساله دکتری در رشته فیزیولوژی ورزشی دانشگاه آزاد ساری و ثبت شده در کمیته اخلاق دانشکده پزشکی دانشگاه آزاد اسلامی واحد ساری ﺑﻮد. نویسندگان از مسؤولان آزمایشگاه فیزیولوژِی ورزشی دانشگاه آزاد واحد ساری جهت همکاری صمیمانه شان تشکر و قدردانی مینمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Iqbal Z, Azmi S, Yadav R, Ferdousi M, Kumar M, Cuthbertson DJ, et al. Diabetic Peripheral Neuropathy: Epidemiology, Diagnosis, And Pharmacotherapy. Clinical Therapeutics 2018; 40(6): 828-49.
2- Dabbagh Ns, Sari Sv, Salek Zy, Abdollahpour Am, Fathollahi S. Effect of 12 Weeks Resistance Training on Neural Conduction in Type 2 Diabetes Men with Peripheral Neuropathy. Studies In Medical Science 2017; 28(5): 353-62. [Persian]
3- Kobayashi M, Zochodne DW. Diabetic Neuropathy and the Sensory Neuron: New Aspects of Pathogenesis and their Treatment Implications. J Diabetes Investig 2018; 9(6): 1239-54.
4- Sato Y, Shimizu M, Mizunoya W, Wariishi H, Tatsumi R, Buchman VL, et al. Differential Expression of Sarcoplasmic and Myofibrillar Proteins of Rat Soleus Muscle During Denervation Atrophy. Biosci Biotechnol Biochem 2009; 73(8): 1748-56.
5- Bennett DL, Clark AJ, Huang J, Waxman SG, Dib-Hajj SD. The Role of Voltage-Gated Sodium Channels in Pain Signaling. Physiol Rev 2019; 99(2): 1079-151.
6- Xu W, Zhang J, Wang Y, Wang L, Wang X. Changes in the Expression of Voltage-Gated Sodium Channels Nav1. 3, Nav1. 7, Nav1. 8, And Nav1. 9 In Rat Trigeminal Ganglia Following Chronic Constriction Injury. Neuroreport 2016; 27(12): 929-34.
7- Alvarez-Suarez P, Gawor M, Prószyński TJ, Editors. Perisynaptic Schwann Cells-The Multitasking Cells at the Developing Neuromuscular Junctions. Semin Cell Develop Biol 2020; 104: 31-8.
8- Smith MB, Mulligan N. Peripheral Neuropathies and Exercise. Topics in Geriatric Rehabilitation 2014; 30(2): 131-47.
9- El-Kossi AEA, Abdellah MM, Rashad AM, Hamed SA. The Effectiveness of Evening Primrose Oil and Alpha Lipoic Acid in Recovery of Nerve Function in Diabetic Rats. J Clinical & Experimental Investigations 2011; 2(3): 245-53.
10- Oyenihi AB, Ayeleso AO, Mukwevho E, Masola B. Antioxidant Strategies in the Management of Diabetic Neuropathy. Biomed Res Int 2015; (515042): 515042.
11- Tayebi SM, Siahkouhian M, Keshavarz M, Yousefi M. The Effects of High-Intensity Interval Training on Skeletal Muscle Morphological Changes and Denervation Gene Expression of Aged Rats. Montenegrin J Sports Science and Medicine 2019; 8(2): 39-45. [Persian]
12- Mahdian H, Farzanegi P, Farzaneh-Hessari A. The Effect of Combined Therapy with Resveratrol, and Continuous and Interval Exercises on Levels of Apoptotic Biomarkers in Heart Tissue of Male Rats with Non-Alcoholic Fatty Liver. KAUMS Journal (FEYZ) 2018; 22(5): 469-77. [Persian]
13- Holmes A, Coppey LJ, Davidson EP, Yorek MA. Rat Models of Diet-Induced Obesity and High Fat/Low Dose Streptozotocin Type 2 Diabetes: Effect of Reversal of High Fat Diet Compared to Treatment with Enalapril or Menhaden Oil on Glucose Utilization and Neuropathic Endpoints. J Diabetes Res 2015; 117(30) : 41-7
14- Hafstad AD, Lund J, Hadler-Olsen E, Höper AC, Larsen TS, Aasum E. High-And Moderate-Intensity Training Normalizes Ventricular Function and Mechanoenergetics in Mice with Diet-Induced Obesity. Diabetes 2013; 62(7): 2287-94.
15- Dworacka M, Chukanova G, Iskakova S, Kurmambayev Y, Wesołowska A, Frycz BA, et al. New Arguments for Beneficial Effects of Alpha-Lipoic Acid on the Cardiovascular System in the Course of Type 2 Diabetes. European J Pharmaceutical Sciences 2018; 30(117): 41-7.
16- Karimi N, Bohlooli S, Mazani M. Nanoliposomal Formulation of Ecballium Elaterium Extract: Cytotoxic Evaluation Against Human Gastric Adenocarcinoma (AGS) Cell Line. Nanomedicine Research J 2016; 1(1): 9-14. [Persian]
17- Tan Z. Differential Expression of Tetrodotoxin-Sensitive Sodium Currents in Dorsal Root Ganglion Neurons. J Pain 2017; 18(4): S2-S3.
18- Aghdam AM, Shahabi P, Karimi-Sales E, Ghiasi R, Sadigh-Eteghad S, Mahmoudi J, et al. Swimming Exercise Induced Reversed Expression of Mir-96 and its Target Gene Nav1. 3 in Diabetic Peripheral Neuropathy in Rats. Chin J Physiol 2018; 61(2): 124-9.
19- Centeno C, Repici M, Chatton J, Riederer B, Bonny C, Nicod P, et al. Role of the JNK Pathway in NMDA-Mediated Excitotoxicity of Cortical Neurons. Cell Death & Differentiation 2007; 14(2): 240-53.
20- Kluding PM, Pasnoor M, Singh R, Jernigan S, Farmer K, Rucker J, et al. The Effect of Exercise on Neuropathic Symptoms, Nerve Function, And Cutaneous Innervation in People with Diabetic Peripheral Neuropathy. J Diabetes and Its Complications 2012; 26(5): 424-9.
21- Rossi DM, Valenti VE, Navega MT. Exercise Training Attenuates Acute Hyperalgesia in Streptozotocin-Induced Diabetic Female Rats. Clinics 2011; 66(9): 1615-9.
22- Yan J-E, Yuan W, Lou X, Zhu T. Streptozotocin-Induced Diabetic Hyperalgesia in Rats is Associated with Upregulation of Toll-Like Receptor 4 Expression. Neuroscience Letters 2012; 526(1): 54-8.
23- Hamed NS, Raoof NA. Effect of High Intensity Interval Training on Diabetic Obese Women with Polyneuropathy: A Randomized Controlled Clinical Trial. Phys Ther and Rehabil 2014; 1(4): 1-8.
24- Sluka KA, Rasmussen LA. Fatiguing Exercise Enhances Hyperalgesia to Muscle Inflammation. Pain 2010; 148(2): 188-97.
25- Connolly LJ, Nordsborg NB, Nyberg M, Weihe P, Krustrup P, Mohr M. Low-Volume High-Intensity Swim Training is Superior to High-Volume Low-Intensity Training in Relation to Insulin Sensitivity and Glucose Control in Inactive Middle-Aged Women. European J Applied Physiology 2016; 116(10): 1889-97.
26- Galeshkalami NS, Abdollahi M, Najafi R, Baeeri M, Jamshidzade A, Falak R, et al. Alpha-Lipoic Acid and Coenzyme Q10 Combination Ameliorates Experimental Diabetic Neuropathy by Modulating Oxidative Stress and Apoptosis. Life Sciences 2019; 216: 101-10.
27- Agathos E, Tentolouris A, Eleftheriadou I, Katsaouni P, Nemtzas I, Petrou A, et al. Effect of Α-Lipoic Acid on Symptoms and Quality of Life in Patients with Painful Diabetic Neuropathy. J International Medical Res 2018; 46(5): 1779-90.
28- Daryanoosh F, Shkibaie M, Zamanie A, Mohammadi M. Effect of Aerobic Exercise and Alpha Lipoic Acid Supplement on Insulin Resistance in Females with Type 2 Diabetes. J Gorgan University of Medical Sci 2015; 3(55): 75-80.
29- Yaworsky K, Somwar R, Ramlal T, Tritschler H, Klip A. Engagement of the Insulin-Sensitive Pathway in the Stimulation of Glucose Transport by Α-Lipoic Acid in 3T3-L1 Adipocytes. Diabetologia 2000; 43(3): 294-303.
30- Akude E, Zherebitskaya E, Chowdhury SKR, Smith DR, Dobrowsky RT, Fernyhough P. Diminished Superoxide Generation is Associated with Respiratory Chain Dysfunction and Changes in the Mitochondrial Proteome of Sensory Neurons From Diabetic Rats. Diabetes 2011; 60(1): 288-97.
31- Sarvestani NN, Firouzi SS, Falak R, Karimi MY, Gholami MD, Rangbar A, et al. Phosphodiesterase 4 and 7 Inhibitors Produce Protective Effects Against High Glucose-Induced Neurotoxicity in PC12 Cells Via Modulation of the Oxidative Stress, Apoptosis and Inflammation Pathways. Metab Brain Dis 2018; 33(4) :1293-306.
32- Zhang YP, Song CY, Yuan Y, Eber A, Rodriguez Y, Levitt RC, et al. Diabetic Neuropathic Pain Development in Type 2 Diabetic Mouse Model and the Prophylactic and Therapeutic Effects of Coenzyme Q10. Neurobiol Dis 2013; 58: 169-78.
33- Uchendu C, Ambali SF, Ayo JO, Esievo KAN. Chronic Co-Exposure to Chlorpyrifos and Deltamethrin Pesticides Induces Alterations in Serum Lipids and Oxidative Stress in Wistar Rats: Mitigating Role of Alpha-Lipoic Acid. Environ Sci Pollut Res 2018; 25(20): 19605-11.
34- Kim SJ, Nian C, Widenmaier S, Mcintosh CH. Glucose-Dependent Insulinotropic Polypeptide-Mediated Up-Regulation of Β -Cell Antiapoptotic Bcl-2 Gene Expression is Coordinated by Cyclic AMP (Camp) Response Element Binding Protein (CREB) and Camp-Responsive CREB Coactivator 2. Mol Cell Biol 208; 28(5):1644-56.
1- Iqbal Z, Azmi S, Yadav R, Ferdousi M, Kumar M, Cuthbertson DJ, et al. Diabetic Peripheral Neuropathy: Epidemiology, Diagnosis, And Pharmacotherapy. Clinical Therapeutics 2018; 40(6): 828-49.
2- Dabbagh Ns, Sari Sv, Salek Zy, Abdollahpour Am, Fathollahi S. Effect of 12 Weeks Resistance Training on Neural Conduction in Type 2 Diabetes Men with Peripheral Neuropathy. Studies In Medical Science 2017; 28(5): 353-62. [Persian]
3- Kobayashi M, Zochodne DW. Diabetic Neuropathy and the Sensory Neuron: New Aspects of Pathogenesis and their Treatment Implications. J Diabetes Investig 2018; 9(6): 1239-54.
4- Sato Y, Shimizu M, Mizunoya W, Wariishi H, Tatsumi R, Buchman VL, et al. Differential Expression of Sarcoplasmic and Myofibrillar Proteins of Rat Soleus Muscle During Denervation Atrophy. Biosci Biotechnol Biochem 2009; 73(8): 1748-56.
5- Bennett DL, Clark AJ, Huang J, Waxman SG, Dib-Hajj SD. The Role of Voltage-Gated Sodium Channels in Pain Signaling. Physiol Rev 2019; 99(2): 1079-151.
6- Xu W, Zhang J, Wang Y, Wang L, Wang X. Changes in the Expression of Voltage-Gated Sodium Channels Nav1. 3, Nav1. 7, Nav1. 8, And Nav1. 9 In Rat Trigeminal Ganglia Following Chronic Constriction Injury. Neuroreport 2016; 27(12): 929-34.
7- Alvarez-Suarez P, Gawor M, Prószyński TJ, Editors. Perisynaptic Schwann Cells-The Multitasking Cells at the Developing Neuromuscular Junctions. Semin Cell Develop Biol 2020; 104: 31-8.
8- Smith MB, Mulligan N. Peripheral Neuropathies and Exercise. Topics in Geriatric Rehabilitation 2014; 30(2): 131-47.
9- El-Kossi AEA, Abdellah MM, Rashad AM, Hamed SA. The Effectiveness of Evening Primrose Oil and Alpha Lipoic Acid in Recovery of Nerve Function in Diabetic Rats. J Clinical & Experimental Investigations 2011; 2(3): 245-53.
10- Oyenihi AB, Ayeleso AO, Mukwevho E, Masola B. Antioxidant Strategies in the Management of Diabetic Neuropathy. Biomed Res Int 2015; (515042): 515042.
11- Tayebi SM, Siahkouhian M, Keshavarz M, Yousefi M. The Effects of High-Intensity Interval Training on Skeletal Muscle Morphological Changes and Denervation Gene Expression of Aged Rats. Montenegrin J Sports Science and Medicine 2019; 8(2): 39-45. [Persian]
12- Mahdian H, Farzanegi P, Farzaneh-Hessari A. The Effect of Combined Therapy with Resveratrol, and Continuous and Interval Exercises on Levels of Apoptotic Biomarkers in Heart Tissue of Male Rats with Non-Alcoholic Fatty Liver. KAUMS Journal (FEYZ) 2018; 22(5): 469-77. [Persian]
13- Holmes A, Coppey LJ, Davidson EP, Yorek MA. Rat Models of Diet-Induced Obesity and High Fat/Low Dose Streptozotocin Type 2 Diabetes: Effect of Reversal of High Fat Diet Compared to Treatment with Enalapril or Menhaden Oil on Glucose Utilization and Neuropathic Endpoints. J Diabetes Res 2015; 117(30) : 41-7
14- Hafstad AD, Lund J, Hadler-Olsen E, Höper AC, Larsen TS, Aasum E. High-And Moderate-Intensity Training Normalizes Ventricular Function and Mechanoenergetics in Mice with Diet-Induced Obesity. Diabetes 2013; 62(7): 2287-94.
15- Dworacka M, Chukanova G, Iskakova S, Kurmambayev Y, Wesołowska A, Frycz BA, et al. New Arguments for Beneficial Effects of Alpha-Lipoic Acid on the Cardiovascular System in the Course of Type 2 Diabetes. European J Pharmaceutical Sciences 2018; 30(117): 41-7.
16- Karimi N, Bohlooli S, Mazani M. Nanoliposomal Formulation of Ecballium Elaterium Extract: Cytotoxic Evaluation Against Human Gastric Adenocarcinoma (AGS) Cell Line. Nanomedicine Research J 2016; 1(1): 9-14. [Persian]
17- Tan Z. Differential Expression of Tetrodotoxin-Sensitive Sodium Currents in Dorsal Root Ganglion Neurons. J Pain 2017; 18(4): S2-S3.
18- Aghdam AM, Shahabi P, Karimi-Sales E, Ghiasi R, Sadigh-Eteghad S, Mahmoudi J, et al. Swimming Exercise Induced Reversed Expression of Mir-96 and its Target Gene Nav1. 3 in Diabetic Peripheral Neuropathy in Rats. Chin J Physiol 2018; 61(2): 124-9.
19- Centeno C, Repici M, Chatton J, Riederer B, Bonny C, Nicod P, et al. Role of the JNK Pathway in NMDA-Mediated Excitotoxicity of Cortical Neurons. Cell Death & Differentiation 2007; 14(2): 240-53.
20- Kluding PM, Pasnoor M, Singh R, Jernigan S, Farmer K, Rucker J, et al. The Effect of Exercise on Neuropathic Symptoms, Nerve Function, And Cutaneous Innervation in People with Diabetic Peripheral Neuropathy. J Diabetes and Its Complications 2012; 26(5): 424-9.
21- Rossi DM, Valenti VE, Navega MT. Exercise Training Attenuates Acute Hyperalgesia in Streptozotocin-Induced Diabetic Female Rats. Clinics 2011; 66(9): 1615-9.
22- Yan J-E, Yuan W, Lou X, Zhu T. Streptozotocin-Induced Diabetic Hyperalgesia in Rats is Associated with Upregulation of Toll-Like Receptor 4 Expression. Neuroscience Letters 2012; 526(1): 54-8.
23- Hamed NS, Raoof NA. Effect of High Intensity Interval Training on Diabetic Obese Women with Polyneuropathy: A Randomized Controlled Clinical Trial. Phys Ther and Rehabil 2014; 1(4): 1-8.
24- Sluka KA, Rasmussen LA. Fatiguing Exercise Enhances Hyperalgesia to Muscle Inflammation. Pain 2010; 148(2): 188-97.
25- Connolly LJ, Nordsborg NB, Nyberg M, Weihe P, Krustrup P, Mohr M. Low-Volume High-Intensity Swim Training is Superior to High-Volume Low-Intensity Training in Relation to Insulin Sensitivity and Glucose Control in Inactive Middle-Aged Women. European J Applied Physiology 2016; 116(10): 1889-97.
26- Galeshkalami NS, Abdollahi M, Najafi R, Baeeri M, Jamshidzade A, Falak R, et al. Alpha-Lipoic Acid and Coenzyme Q10 Combination Ameliorates Experimental Diabetic Neuropathy by Modulating Oxidative Stress and Apoptosis. Life Sciences 2019; 216: 101-10.
27- Agathos E, Tentolouris A, Eleftheriadou I, Katsaouni P, Nemtzas I, Petrou A, et al. Effect of Α-Lipoic Acid on Symptoms and Quality of Life in Patients with Painful Diabetic Neuropathy. J International Medical Res 2018; 46(5): 1779-90.
28- Daryanoosh F, Shkibaie M, Zamanie A, Mohammadi M. Effect of Aerobic Exercise and Alpha Lipoic Acid Supplement on Insulin Resistance in Females with Type 2 Diabetes. J Gorgan University of Medical Sci 2015; 3(55): 75-80.
29- Yaworsky K, Somwar R, Ramlal T, Tritschler H, Klip A. Engagement of the Insulin-Sensitive Pathway in the Stimulation of Glucose Transport by Α-Lipoic Acid in 3T3-L1 Adipocytes. Diabetologia 2000; 43(3): 294-303.
30- Akude E, Zherebitskaya E, Chowdhury SKR, Smith DR, Dobrowsky RT, Fernyhough P. Diminished Superoxide Generation is Associated with Respiratory Chain Dysfunction and Changes in the Mitochondrial Proteome of Sensory Neurons From Diabetic Rats. Diabetes 2011; 60(1): 288-97.
31- Sarvestani NN, Firouzi SS, Falak R, Karimi MY, Gholami MD, Rangbar A, et al. Phosphodiesterase 4 and 7 Inhibitors Produce Protective Effects Against High Glucose-Induced Neurotoxicity in PC12 Cells Via Modulation of the Oxidative Stress, Apoptosis and Inflammation Pathways. Metab Brain Dis 2018; 33(4) :1293-306.
32- Zhang YP, Song CY, Yuan Y, Eber A, Rodriguez Y, Levitt RC, et al. Diabetic Neuropathic Pain Development in Type 2 Diabetic Mouse Model and the Prophylactic and Therapeutic Effects of Coenzyme Q10. Neurobiol Dis 2013; 58: 169-78.
33- Uchendu C, Ambali SF, Ayo JO, Esievo KAN. Chronic Co-Exposure to Chlorpyrifos and Deltamethrin Pesticides Induces Alterations in Serum Lipids and Oxidative Stress in Wistar Rats: Mitigating Role of Alpha-Lipoic Acid. Environ Sci Pollut Res 2018; 25(20): 19605-11.
34- Kim SJ, Nian C, Widenmaier S, Mcintosh CH. Glucose-Dependent Insulinotropic Polypeptide-Mediated Up-Regulation of Β -Cell Antiapoptotic Bcl-2 Gene Expression is Coordinated by Cyclic AMP (Camp) Response Element Binding Protein (CREB) and Camp-Responsive CREB Coactivator 2. Mol Cell Biol 208; 28(5):1644-56.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1399/10/27 | پذیرش: 1400/2/12 | انتشار: 1400/8/10
دریافت: 1399/10/27 | پذیرش: 1400/2/12 | انتشار: 1400/8/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







