دوره 29، شماره 9 - ( آذر 1400 )
جلد 29 شماره 9 صفحات 4122-4106 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shahmoradi S, Yazdian F, Janghorbani A, Satarian L, Behroozi F, Tabandeh F et al . Investigation of Differentiated Embryonic Stem Cells Growth on Optimized Porous Polymeric Bed with Fuzzy System. JSSU 2021; 29 (9) :4106-4122
URL: http://jssu.ssu.ac.ir/article-1-5189-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5189-fa.html
شاهمرادی صالحه، یزدیان فاطمه، جانقربانی امین، ستاریان لیلا، بهروزی فرناز، تابنده فاطمه و همکاران.. بررسی رشد سلولهای بنیادی جنینی تمایزیافته بر روی بستر پلیمری متخلخل بهینه شده با استفاده از سیستم فازی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (9) :4106-4122
صالحه شاهمرادی 

 ، فاطمه یزدیان*
، فاطمه یزدیان* 

 ، امین جانقربانی
، امین جانقربانی 

 ، لیلا ستاریان
، لیلا ستاریان 

 ، فرناز بهروزی
، فرناز بهروزی 

 ، فاطمه تابنده
، فاطمه تابنده 

 ، بی بی فاطمه حقیرالسادات
، بی بی فاطمه حقیرالسادات 




 ، فاطمه یزدیان*
، فاطمه یزدیان* 

 ، امین جانقربانی
، امین جانقربانی 

 ، لیلا ستاریان
، لیلا ستاریان 

 ، فرناز بهروزی
، فرناز بهروزی 

 ، فاطمه تابنده
، فاطمه تابنده 

 ، بی بی فاطمه حقیرالسادات
، بی بی فاطمه حقیرالسادات 


متن کامل [PDF 1293 kb]
(876 دریافت)
| چکیده (HTML) (2503 مشاهده)
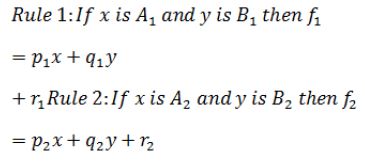
با استفاده از الگوریتم یادگیری تلفیقی ابتدا پارامترهای خطی که همان پارامترهای تالی قواعد هستند را با استفاده از تخمین حداقل مربعات خطا تعیین کرده و سپس بعد از محاسبه خطا با پس انتشار خطا بر اساس الگوریتم گرادیان کاهشی، پارامترهای توابع عضویت لایه¬های داخلی شبکه که همان پارامترهای مقدم قواعد هستند تخمین زده میشوند.
مدلسازی پاسخ سطح با استفاده از نرمافزار Design Expert پس از واردکردن اطلاعات بهدست آمده در نرمافزار مربوطه، تصویر سه بعدی مربوط به دادهها، رابطه تئوری ارائه ¬شده توسط نرم¬افزار و شرایط بهینه برای هر دو حلال پیشبینی شد. تعیین مدل فازی قطر داربست بر اساس ولتاژ و غلظت محلول
برای تعیین مدل فازی قطر داربست براساس غلظت محلول و ولتاژ بایستی کل فضای تغییرات توام این دو متغیر به صورت دادههای ورودی تعیین گردد. به این منظور بازه تغییرات این دو متغیر به¬ترتیب به صورت [0/15- 0/05] گرم PCL بر میلی¬لیتر حلال و [20- 1۰] کیلوولت در نظر گرفته شد. در نهایت از طریق دو روش فازی و پاسخ سطح، رابطه بین دو پارامتر متغیر انتخابی و قطر نانوالیاف به دست آمد و R-squared هر دو حاصل شد. مطابق با شکل 2، روش فازی دارای R-square یک است که نتیجه قابل قبولی میباشد و داربست بهینه برای ادامه فرآیند آزمایشگاهی با استفاده از این روش به دست آمد. شرایط بهینه که براساس کمینه قطر نانوالیاف تولیدی به دست آمد، در جدول 2 مشاهده
می¬شود.

شکل 1: ساختار شبکههای ANFIS (لایه اول: فازی ساز، لایه دوم: لایه ضرب ( محاسبه (t-norm، لایه سوم: لایه هنجارسازی،لایه چهارم لایه نافازی ساز، لایه پنجم: لایه محاسبه خروجی نهایی
جدول 1: مقدار پارامترهای ثابت در ساخت داربست به روش الکتروریسی
.JPG)
جدول 2: شرایط بهینه ساخت داربست بر اساس روش فازی

ضخامت و تخلخل داربست بهینه 1±14 میکرومتر و 84٪ به دست آمد.

شکل 2: نمودار مقادیر پیشبینی شده بر حسب مقادیر آزمایشگاهی فرآیند الکتروریسی.
الف) روش پاسخ سطح و ب) روش فازی. روش فازی از دقت بالاتری برخوردار است و از شرایط بهینه حاصل از این روش برای ادامه آزمایشها استفاده شد.
اصلاح سطح و بهینهسازی
از آنجایی که PCL یک پلیمر آبگریز است، برای بهبود چسبندگی سلولی و تکثیر آنها نیاز به ویژگی آبدوستی است. هیدرولیز قلیایی یکی از راههای اصلاح سطح میباشد که در آن، پیوندهای استری هیدرولیز شده و گروههای کربوکسیلیک آبدوست ایجاد میشود. به همین منظور، سدیمهیدروکسید در آب مقطر حل شد و محلول قلیایی به دست آمد. از آنجایی اصلاح سطح با استفاده از محلول قلیایی متاثر از پارامترهای مختلفی است، برای یافتن شرایط بهینه مربوط به دو پارامتر غلظت محلول قلیایی (با گستره غلظت بین 2 تا 7 مولار) و زمان در معرض قرار گرفتن داربست در محلول (بین 40 تا 160 دقیقه)، تعدادی آزمایش توسط RSM طراحی شد. در پایان داربستهای بهینه شده برای رسیدن به pH هفت سه بار با آب مقطر شستشو داده شدند (28). به منظور سنجش تاثیر اصلاح سطح، زاویه تماس آب با سطح داربست اندازهگیری شد. بدین ترتیب که قطره آب دیونیزه به حجم 4 میکرولیتر بر روی سطح داربست اصلاح سطح شده چکانده شد و با دوربین مخصوص از سطح تماس آب و سطح تصویری ثبت و زاویه تماس محاسبه شد (19).
اندازه¬گیری ضخامت، تخلخل و قطر داربست
برای اندازه¬گیری قطر و ضخامت داربست میکروسکوپ الکترونی روبشی (SEM) و نرمافزار Image J به کار گرفته شدند (29). حجم داربست با استفاده از قطر و ضخامت محاسبه شد. ابتدا وزن داربست توسط ترازوی دیجیتالی تعیین گردید. سپس دانسیته (ρb) داربست از تقسیم جرم بر حجم آن به دست آمد. نهایتاً تخلخل با داشتن دانسیته PCL (ρp=1.145 g/cm3) از رابطه زیر حاصل شد:
Ɛ= 1- ρ_b/ρ_p (5)
میزان جذب آب
درصد جذب آب توسط داربستهای 1×1 سانتیمتر مربع با توجه به رابطه ×100 (w_2- w_1)/w_1 که در آن w_1 و w_2به ترتیب وزن داربست خشک و وزن داربست غوطه¬ور در (PBS) Phosphate-buffered saline است، به دست آمد (30).
نرخ تخریبپذیری
میزان تخریبپذیری با غوطه¬ور ساختن داربست در محلول لیزوزیم و PBS (1 میلیگرم بر میلیلیتر)، نگهداری آن در انکوباتور در دمای 37 درجه سلسیوس و اندازه¬گیری وزن خشک داربست در روزهای 1، 4، 7، 14، 21 و 28 به دست آمد (31). ابتدا وزن داربست در روز صفر (قبل از قرارگیری در محلول) اندازهگیری شد (m_0). سپس در روزهای مشخص شده داربستها ازمحلول خارج، سه بار با آب مقطر شستشو، خشک و توزین شدند (m_f). بنابراین میزان تخریبپذیری از تقسیم اختلاف وزن ثانویه و اولیه (m_f- m_0) بر وزن اولیه به دست آمد (32).
سنجش زیستسازگاری داربست
در این پژوهش از سلولهای بنیادی جنین انسانی که در مطالعه قبلی به سلولهای شبکیه چشم تمایز یافته بودند، استفاده شد ZAHABI 2011. به منظور یافتن میزان زنده¬مانی سلول و تکثیر آنها بر روی دو گروه داربست (داربست بدون اصلاح سطح Un-treated PCL (UPCL) و داربست با اصلاح سطح هیدرولیز Hydrolyzed PCL (HPCL))، ابتدا سلول¬های RPE تمایزیافته استریلیزه با دانسیته 5×104 سلول بر میلیلیتر قرار گرفت و 200 میکرولیتر محیط تازه به آن افزوده شد. پس از زمان مشخص انکویاسیون، محیط کشت خارج شد و 200 میکرولیتر MTT اضافه شد و به مدت 3 تا 4 ساعت درون انکوباتور قرار گرفت و به دلیل مصرف MTT توسط سلولهای زنده، کریستالهای بنفش فورمازان تشکیل شدند. سپس به هر داربست 200 میکرولیتر محلول DMSO افزوده و بر روی شیکر در انکوباتور به مدت 20 دقیقه قرار داده شد تا کریستال¬های فورمازان حل شوند و رسوب سلولی تهنشین شود. از هر چاهک 100 میکرولیتر محلول در پلیت 96 تایی ریخته و با استفاده از دستگاه الایزا، میزان جذب هر چاهک در طول موج 570 نانومتر خوانده شد. این روند با سه بار تکرار و در روزهای اول، چهارم و هفتم انجام گرفت و میزان جذب هر چاهک قرائت گردید (33).
میکروسکوپ الکترونی روبشی
برای تعیین مورفولوژی سلول روی داربستهای مختلف پس از 63 روز، محیطکشت خارج شد و داربست در 2/5 درصد گلوتارآلدهید به مدت دو ساعت قرار داده شد. سپس، گروههای مختلف داربست در سری محلول اتانول دهیدراته شده و در هوای محیط خشک شدند. در نهایت، داربستها با طلا پوشش داده شده و در دستگاه SEM قرار گرفتند (34).
ایمونوسیتوشیمی
پس از تهیه محلول¬های پارافرمالدهید 8 درصد، محلول 1 درصد از 100-Triton X در بافر PBS (PBST 1 درصد: محلول A)، محلول 1درصد BSA در 1 درصد PBST (محلول B) و محلول 1 درصد BSA در PBS آزمون ایمونوسیتوشیمی به روش زیر انجام گرفت. در ابتدا سلول¬ها از روی بسترها جدا شده و با استفاده از دستگاه Cell spin بر روی لامل قرار داده شدند. در ادامه، لامل¬ها در پلیت 24 خانه قرار گرفتند و به هر چاهک 500 میکرولیتر پارافرمالدهید 4 درصد اضافه شد و به مدت 5 دقیقه در دمای اتاق انکوبه شد. سپس پارافرمالدهید 4 درصد خارج و پلیت خشک شد. پس از آن سلولها دوبار با محلول PBS شستشو داده شدند. با هدف نفوذپذیری سلولها، محلول A به مقدار 300 میکرولیتر به پلیت اضافه شد و 15 دقیقه در دمای اتاق نگهداری شد. پس از شستشوی سلولها با PBS، محلول B به مقدار 500 میکرولیتر به ئلیت اضافه شد و به مدت 20 دقیقه در دمای اتاق نگهداری شد. سپس محلول خارج و سلولها با PBS دو مرتبه شسته شدند. 500 میکرولیتر آنتیبادی اولیه اضافه شد و به مدت یک شب در دمای 4 درجه سلسیوس نگهداری شد. سپس محلول رویی تخلیه شد و سه بار با PBS شستشو داده شد. آنتیبادی ثانویه مشابه آنتیبادی اولیه تهیه گردید. با این تفاوت که از PBS/BSA یک درصد برا رقیقسازی استفاده شد. 500 میکرولیتر آنتیبادی ثانویه اضافه گردید و در تاریکی و در دمای اتاق به مدت 45 دقیقه قرار داده شد. در ادامه، آنتیبادی ثانویه خارج شد و محیط سلولها سه مرتبه با PBS شستشو داده شدند. برای رنگآمیزی هسته سلولها در هر چاهک 10 میکرولیتر محلول رنگ DAPI با غلظت 2 میکروگرم بر میلی-لیتر اضافه شد و 10 دقیقه در دمای اتاق در تاریکی نگهداری شد. در پایان لاملهای آمادهشده زیر میکروسکوپ فلورسنت مشاهده شدند (21).
تجزیه و تحلیل آماری
در این پژوهش، داده¬ها به صورت میانگین ± میانگین خطای استاندارد گزارش شدهاند. همه آزمایشها با سه بار تکرار صورت گرفته است. تحلیلهای آماری دادههای با استفاده ازversion 16 SPSS و تست Tukey انجام گرفت. مقدار P-Value کمتر از 0/05 به دست آمد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علومپزشکی شهید صدوقی یزد تایید شده است (کد اخلاق IR.SSU.MEDICINE.REC.1399.094)
نتایج
اصلاح سطح و بهینهسازی
پس از اصلاح سطح به روش هیدرولیز قلیایی مطابق با شرایط آزمایش¬های طراحی شده و اندازه¬گیری زاویه تماس مربوط به هر آزمایش، زمان قرارگیری داربست در محلول قلیایی و غلظت محلول قلیایی بر اساس حداقل زاویه تماس بهینه شد که مقدار آن به ترتیب 97 دقیقه و 3/7 مولار بهدست آمد. زاویه تماس مربوط به دو گروه داربست (داربست بدون اصلاح سطح و داربست هیدرولیز شده در شرایط بهینه) با سه بار تکرار اندازه¬گیری شد (جدول 3). همانطور که مشاهده می¬شود، هیدرولیز قلیایی منجر به کاهش چشمگیر زاویه تماس در مقایسه با داربستهای UPCL شده است. به عبارت دیگر تغییر گروه¬های عاملی در فرآیند هیدرولیز، سبب آب¬دوستی و پخش شدن قطره آب بر روی سطح داربست می-شود که تاثیر مطلوبی بر کشت و تکثیر سلول دارد.
جدول 3: زاویه تماس آب برای دو گروه داربست (هیدرولیز داربست در شرایط بهینه صورت گرفته است)

میزان جذب آب
مقدار آب جذب شده در دوگروه داربست در شکل 3 آمده است. همانطور که مشاهده میشود، HPCL میزان جذب آب بالاتری دارد. به بیان دیگر اصلاح سطح منجر به افزایش قابلیت داربست در به دام انداختن آب میشود که نشاندهنده آبدوستی بالاتر نسبت به گروه UPCL است.
زیستتخریبپذیری
شکل 4 نشان میدهد که اصلاح سطح داربست، وزن داربست را کاهش میدهد. همچنین، نرخ تخریب داربست HPCL نسبت به داربست UPCL در مدت زمان 28 روز افزایش بیشتری دارد.
ویژگیهای نانولولهها
مطابق با شکل 5 مربوط به تصاویر SEM دو گروه داربست، ساختار رشتهها منظم است و بید مشاهده نمیشود. همچنین، شکل 5 (ب) نشان میدهد که اصلاح سطح داربست منجر به کاهش قطر نانوالیاف میشود که تاثیر مطلوبی بر رشد و تکثیر سلول دارد.
زیستسازگاری
به منظور بررسی میزان زندهمانی و تکثیر سلولها بر روی داربست از آنالیز MTT استفاده شد. همانگونه که در شکل 6 مشاهده میشود، رشد و تکثیر سلول¬ها در هر سه گروه (بر روی سطح پلیت، UPCL و HPCL) با گذشت زمان افزایش می¬یابد. سطح پلیت دارای کمترین میزان رشد سلولی است و UPCL میزان جذب نوری بین دو گروه TCP و HPCL دارد. اصلاح سطح داربست پلیمری تاثیر مستقیم و قابلتوجهی بر رشد و تکثیر سلول¬های RPE دارد به طوری که میزان جذب نوری آن از دو گروه دیگر بالاتر است.
مورفولوژی سلول RPE بر روی داربست
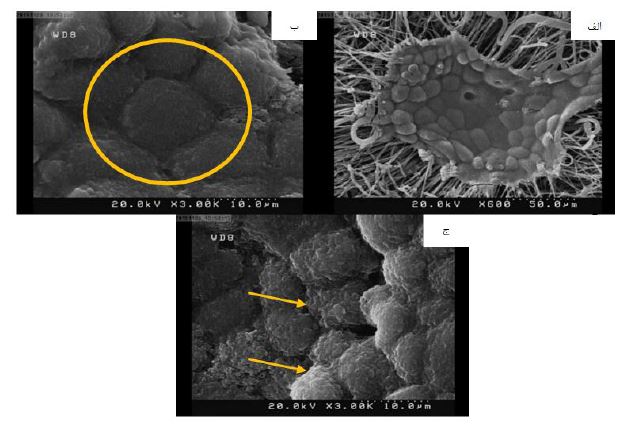
پس از گذشت 63 روز از کشت سلولها بر روی داربست مورفولوژی و چسبندگی سلول بر روی داربستها مشاهده شد (شکل 7). تنها بر روی گروه HPCL سلول وجود داشت (شکل 7 الف) و سلولی بر روی UPCL مشاهده نشد. ساختار شش وجهی (شکل 7 ب) و میکروویلی مربوط به سلولهای RPE (شکل 7 ج که با پیکان نشان داده شده¬اند) در تصاویر حاصل از SEM مشاهده میشود.
آنالیز ایمونوسیتوشیمی
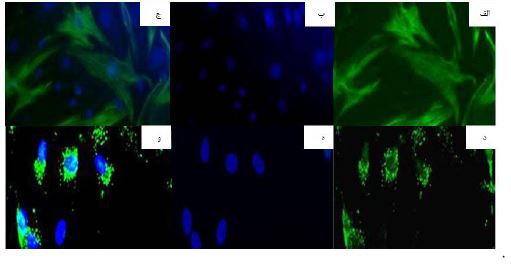
به منظور اثبات هویت سلولهای اپیتلیوم رنگدانه شبکیه بر روی بستر گروه HPCL، بیان پروتئین¬های 65RPE و سیتوکراتین 8/18 که به ترتیب مارکرهای اختصاصی سلولهای RPE و اپیلتیومی هستند، مورد بررسی قرار گرفت. از آنجایی که پروتئین¬های 65RPE در داخل وزیکول¬های درون سلولی و به صورت پراکنده در سیتوپلاسم وجود دارند، پس از انجام ICC این مارکر به صورت میکروزومال در داخل سیتوپلاسم مشاهده شدند. همچنین، سیتوکراتین 8/18 به عنوان فیلامنت حد واسط در مل سیتوپلاسم به صورت رشتههای طویل دیده شدند (شکل 8).
.JPG)
شکل 3: درصد جذب آب توسط دو گروه داربست. اصلاح سطح داربست، افزایش ترشوندگی و آبدوستی آن را در پی دارد که موجب افزایش قدرت جذب آب توسط داربست میشود. تفاوت معنادار (**) بین دو گروه دیده میشود (0/001>P ) .
.JPG)
شکل 4: نرخ زیستتخریبپذیری گروههای مختلف داربست. وزن داربست در طول 28 روز کاهش یافته است. اصلاح سطح داربست، باعث افزایش سرعت زیست-تخریبپذیری میشود. تفاوت بین UPCL و HPCL در 0/01>P (**) معنادار است.

شکل 5: تصاویر میکروسکوپ الکترونی روبشی الف) UPCL، ب) HPCL. در هیچ یک از گروهها ساختار بید مشاهده نمیشود.
اصلاح سطح منجر به کاهش قطر رشتهها میشود.

شکل 6: آنالیز MTT داربستها در زمان هفت روز. با گذشت زمان رشد و تکثیر سلولی در هر سه گروه افزایش مییابد. اصلاح سطح داربست تاثیر چشمگیری در زندهمانی و تکثیر سلولی دارد. تفاوت بین TCP و سایر گروهها در 0/01>P (**) و 0/001>P (***) و همچنین تفاوت بین UPCL و سایر گروهها در 001/0>P (ᵟᵟᵟ) معنادار هستند.
شکل 7: الف) مورفولوژی سلولی بر روی داربست HPCL، ب) ساختار شش وجهی سلولهای RPE قابل مشاهده هستند و ج) میکروویلی روی سطح سلولهای RPE بر روی داربست HPCL با پیکان مشخص شدهاند.
شکل 8: میکروسکوپ فلورسنس بیان پروتئینهای سیتوکراتین 8/18 (الف - ج) و 65RPE (د - و) توسط سلول¬های RPE موجود بر روی بستر گروه HPCL که توسط FITC (الف و د) و DAPI (ب و ه) رنگآمیزی شده اند. تصاویر ادغام¬شده (الف) و (ب) در (ج) و (د) و (ه) در (و) دیده می¬شود.
بحث
پس از بهینهسازی داربستها با استفاده از متغیرهای اثرگذار در ساخت داربست به روش الکتروریسی، قطر بهینه برای داربست 115 نانومتر به دست آمد که در مقایسه با سایر مطالعات برای رشد سلول، مناسب است. ژانگ و همکاران از سه داربست PCL، PCL/Silk fibroin وPCL/Silk fibroin/gelatin برای کشت سلولهای RPE استفاده کردند که به ترتیب دارای اندازه قطرهای 157، 154 و 253 نانومتر بودند (20). در مطالعه پارک و همکاران، میانگین قطر برای نانو رشته¬ها 2 میکرومتر به دست آمد که برای درمان AMD مقدار بزرگی بود (35) علاوه براین، تخلخل داربست با سایر داربستهای مطالعات انجام شده، مقایسه گردید. مک¬هوگ و همکاران از پلی¬استر و PCL با تخلخل 64 درصد و 90 درصد به عنوان داربست استفاده کردند. آنها دریافتند که داربست با تخلخل بالاتر تاثیر بیشتری در تکثیر سلولی و تعداد سلول پس از گذشت 8 هفته از کشت سلول بر روی داربست دارد (36). همچنین، در بررسی که توسط ژانگ و همکاران انجام گرفت، تخلخل برای داربستهای PCL، PCL/Silk fibroin و PCL/Silk fibroin/gelatin به ترتیب 85، 87 و 90 درصد گزارش شد. به منظور ایجاد چسبندگی سلولی مناسب، زاویه تماس داربست PCL محاسبه و به کمک اصلاح سطح کاهش یافت. داربست PCL بدون اصلاح سطح زاویه تماس حدود 118 درجه داشت که آبگریزی بالای آن را نشان میدهد (20). عبدالوفا و همکاران تاثیر افزایش آبدوستی داربست پس از اصلاحسطح را با افزایش میزان به دام انداختن آب و به دنبال آن افزایش وزن داربست را در پژوهش خود نشان دادند (37). بنابراین پس از یافتن شرایط بهینه روش هیدرولیزقلیایی برای رسیدن به حداقل زاویه تماس، سطح داربستها اصلاح شد و زاویه تماس به حدود 12 درجه رسید. گو و همکاران در بررسی خود که بر روی تاثیر اصلاح سطح هیدرولیز قلیایی بر روی داربست پلی ال-لالکتیک اسید انجام دادند، به نتیجه مشابه با این پژوهش دست یافتند. به طوری که میزان جذب آب توسط داربست اصلاح شده تفاوت قابل توجهی با داربست بدون اصلاح سطح داشت که حاکی از افزایش میزان آبدوستی آنهاست (38). در این پژوهش نتایج نشان داد که اصلاحسطح باعث افزایش زیستتخریبپذیری داربست میشود. این یافته توسط سنت و همکاران در پژوهشی دیگر به تایید رسید. آنها نشان دادند که اصلاح سطح داربست ترکیبی پلیگلیسرول سباسات: پلیکاپرولاکتون (به نسبت دو به یک) به روش هیدرولیز قلیایی در محلول 0/1 میلیمولار دو برابر نرخ تخریب زیستی بالاتری نسبت به داربست بدون اصلاح سطح دارد (39). با مقایسه مورفولوژی داربست قبل و بعد از اصلاحسطح مشخص شد که هیدرولیزقلیایی سبب کاهش قطر الیاف میشود که این امر در کشت سلولی موثر است. گایو و همکاران نیز نشان دادند که اصلاحسطح داربست پلی گلایکولیک اسید در محلول یک نرمال سدیم هیدروکسید، منجر به کاهش قطر الیاف داربست میشود. بهطوریکه یک رابطه خطی بین افزایش زمان هیدرولیز و کاهش قطر داربست وجود دارد (40). پارک و همکاران با غوطهور ساختن داربست PCL در محلول قلیایی سدیم هیدروکسید یک نرمال، به دنبال بررسی تاثیر اصلاح سطح داربست بر روی رشد سلولهای استئوبلاست بودند. پس از گذشت زمان 28 روز، نتایج حاصل از MTT نشان داد که اصلاح سطح داربست به روش هیدرولیز قلیایی تاثیر مطلوبی بر روی رشد سلول¬ها به دلیل افزایش آبدوستی و خاصیت ترشوندگی داشته است (35). در مطالعهای که در سال 2020 توسط لین و همکاران انجام گرفت، داربستی از جنس پلیدیمتیل سیلوکسان برای کشت سلولهای بنیادی پرتوانی تمایزیافته به سلولهای رنگدانه شبکیه چشم تهیه شد. ارزیابی بیان ژنها نشان داد که سلولهای RPE رشد یافته بر روی بستر پلیمری مارکرهای ویژه RPE از جمله ZO-1 و PEDF را ازخود نشان دادند (16). همچنین، آزمون ایمونوسیتوشیمی برای سلولهای RPE کشت داده شده بر روی داربست ترکیبی PCL و کیتوسان بیان مارکرهای 65RPE و ZO-1 را نشان داد (41). همچنین رشد و کثیر سلولهای hESC-RPE بر روی بستر پلیمری متخلخل پلیبوتیلن سوکسینات توسط کالجو و همکاران مورد بررسی قرار گرفت. این بسترها قابلیت جذب پروتئین و حفاظت از چسبندگی سلولی را داشتند که این ویژگیها، آن-ها را برای کشت سلول¬های مورد نظر مطلوب کرده است (42). پس از بررسی سایر پژوهشهای مشابه انجام شده، رشد سلولها پس از 63 روز بر روی HPCL بسیار مناسب بود در حالیکه سلولی بر روی داربست UPCL مشاهده نشد. این یافته، نشاندهنده برتری گروه HPCL بر UPCL از جهت مطلوب بودن برای زمان طولانیتر رشد سلولها میباشد. به خصوص که نتایج ICC نیز بیان پروتئینهای 65RPE و سیتوکراتین 8/18 که به ترتیب مارکرهای اختصاصی سلولهای RPE و سلولهای اپیتلیومی هستند، را تایید کرد.
نتیجهگیری
در این تحقیق، ابتدا با مقایسه دو روش فازی و پاسخ سطح، داربست بهینه با حداقل سطح الیاف تهیه شد. سپس با توجه به اینکه PCL طبیعتی آب گریز دارد، سطح آن به روش هیدرولیز قلیایی اصلاح شد و برای رسیدن به حداقل زاویه تماس بهینه گردید. آنالیزهای مختلف بر روی دو داربست UPCL و HPCL انجام گرفت. نتایج MTT حاکی از عدم سمیت داربستها و رشد و تکثیر سلولها بهخصوص بر روی HPCL بود. در پایان سلولهای RPE بر روی هر دو داربست کشت داده شدند. نتایج نشان داد که اصلاح سطح تاثیر مطلوبی بر روی رشد و تکثیر سلولها دارد. در ادامه می-توان با تغییر حلال، ترکیب PCL با سایر پلیمرها به منظور بهبود خواص برای کشت سلول، به کارگیری سایر روشهای مختلف اصلاحسطح و همچنین استفاده از دیگر روش¬های ساخت داربست و به کارگیری مطالعات In vivo تلاشی در جهت نتایج بهتر برای درمان این بیماری انجام داد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
متن کامل: (1681 مشاهده)
مقدمه
تخریب ماکولار در اثر افزایش سن یکی از بیماریهای شبکیه مرتبط با سن است که منجر به نابینایی میشود (1،2). در این بیماری سلولهای اپیتلیوم رنگدانه شبکیهلایه سلولی که از گیرندههای نوری محافظت میکند و بر روی غشای بروخ قرار گرفته است- به صورت برگشتناپذیر تخریب میشوند (6-3). این سلولها وظایف مهمی از جمله ایجاد برهمکنش بین گیرندههای حساس به نور بخش¬های خارجی، فراهم¬کردن یون و مواد غذایی و انتقال متابولیتهای درون سلولی را به عهده دارند. بنابراین درمان این بیماری از اهمیت خاصی برخوردار است (7). علم مهندسی بافت، علمی است که در آن بسیاری از بیماریهای انسان به کمک روشهایی چون کشت سلولها درمان میشوند. به منظور کشت سلولها در خارج از بدن موجود زنده، نیاز به محیطی است که حداکثر شباهت با بدن موجود زنده را داشته باشد. این محیطها که تحت عنوان "داربست" از آنها یاد میشود، خود تحت تاثیر پارامترهایی هستند که بسته به روش تولید، با هم تفاوت دارند (8). داربستها وظایف مهمی در درمان برخی از بیماریها مانند برقراری ارتباط موثر سلولها، چسبندگی، رشد و مهاجرت سلولی دارند. بنابراین ساخت بهترین داربست، از اهمیت برخوردار است (9). یکی از روشهای ساخت داربست، روش الکتروریسی است که در آن ماده مورد نظر، که جنس داربست را تشکیل میدهد، در حلال مناسبی حل شده و توسط دستگاه مربوطه رسیده میشود. پارامترهایی چون ولتاژ دستگاه، فاصله سر سوزنی که محلول از آن خارج می¬شود تا صفحه جمعکننده، دبی محلول خروجی از سرنگ، غلظت ماده حلشونده در محلول اولیه در چگونگی تشکیل داربست نقش دارند (8). پلیمری که به عنوان داربست در مهندسی بافت استفاده میشود، باید دارای ویژگیهایی چون زیستسازگاری، زیستتخریبپذیری، ضخامت مناسب، استحکام لازم برای عمل پیوند، چسبندگی کافی، تکثیر سلولی و تخلخل مناسب باشد (10). یکی از کاربردهای به کارگیری داربستها، استفاده از آنها در درمان سلولهای از بین رفته در بیماری Age Macular Degeneration (AMD) و Retinitis Pigmentosa (RP) مربوط به شبکیه چشم میباشد. روش پیشنهادی برای درمان این دو بیماری، کشت سلولهای Retinal Pigment Epithelium (RPE) بر روی آن¬ها و جایگزینی سلولهای سالم با سلولهای تخریب شده بیمار است (11). پلیلاکتیک کوگلایکولیک اسید (PLGA) و پلی اللاکتیک اسید (PLLA) دو پلیمر سنتزی هستند که در سال 2005 بهعنوان بستری جهت حمایت از سلولهای 407D استفاده شدند و نهایتاً شکل سنگفرش سلولهای RPE را بهخود گرفتند. در همین راستا، محققان با انتخاب نسبت 25:75 از پلیمرهای PLLA:PLGA توانستند داربستی نازک و با تخلخل بالا تهیه کرده و بهعنوان داربست بهینه ارائه دهند. اما از آنجایی که این داربست¬ها با روش ریخته¬گری حلال ساخته شدند، ضخامت آنها بیش از 150 میکرومتر بود، بنابراین سدی ضخیم برای ارتباط RPE و گیرندههای نوری محسوب شد که می¬تواند به لایه بیرونی شبکیه آسیب زده و آن را از بین ببرد. این در حالی است که ضخامت مناسب داربست ایدهآل برای قرارگرفتن به جای غشای بروخ کمتر از ده میکرومتر است (12). همچنین این دو ماده به دلیل برخی محصولات حاصل از تخریبشان، در مواردی زیستسازگار نیستند و موجب هجوم سلولهای ایمنی مانند ماکروفاژها میشوند (13). در سال 2012 کریستینسن و همکاران اصلاح سطحهای مختلفی بر روی داربستهای (PCL)Polycaprolactone انجام دادند. این بسترها بر روی چشمهای 28خوک در فضای زیر شبکیه پیوند زده شدند و پس از 6 هفته مشاهده، بافتشناسی آن صورت گرفت. مشاهده شد که در میان سه نوع داربست مشتق ¬شده از PCL (نانوسیم¬های کوتاه PCL، PCL الکتروریسی شده و داربستهای یکدست PCL)، نانوسیمهای کوتاه PCL بهترین گزینه در پیوند RPC هستند (14). آردان و همکاران در سال 2019 با کشت سلولهای RPE بر روی دو بستر – غشاهای نانولولهای و داربستهای پلیاستر تجاری- و انجام آزمایشهای ایمونوسیتوشیمی و real-time PCR دریافتند که سلولها بر روی غشاهای نانو لولهای بلوغ بهتر و میزان زندهمانی طولانیتری دارند (15). در سال 2020 از داربست پلیدیمتیلسیلوکسان ساخته شده به روش پوششدهی دورانی و لیتوگرافی، برای کشت سلول¬های بنیادی چندتوانی مشتق شده از RPE استفاده شد. در پژوهش لین و همکاران که با هدف درمان AMD انجام گرفت، با انجام آنالیزهای متعددی چون بیان ژن مشخص شد که این گزینه میتواند درمان مناسبی برای بیماری AMD باشد (16). در پژوهشی دیگر، از داربست سویا برای تمایز سلولهای بنیادی استفاده شد. نتایج حاصل از این مطالعه نشان داد که داربست بهکاررفته، بستری مناسب برای رشد و تمایز این سلولها در جهت درمان AMD میباشد (17). در مطالعه¬ای دیگر که به منظور معرفی بستری مناسب برای درمان این بیماری صورت گرفت، از یک هیبرید زیستی چند لایه سه بعدی از جنس فیبرویین ابریشم برای کشت سلول¬های مختلفی چون سلولهای بنیادی مزانشیمی و سلولهای رنگدانه شبکیه چشم استفاده شد. نتایج به دست آمده حاکی از تولید شبکیه مشابه با شبکیه واقعی بود (12). PCL یک طبیعت شیمیایی آبگریز دارد، بنابراین آبدوستی سطح کم است و هنگام برهمکنش با سیالات بیولوژیکی، از تکثیر و چسبندگی سلولی جلوگیری میکند. پس نیازمند ترکیب با مادهای است که خواص آن را بهبود بخشد. در سال 2014 پژوهشی بر روی بهبود آبدوستی و اصلاح سطح با گروههای کاربردی مختلف PCL انجام شد. لوکا و همکاران نشان دادند که روشهای شیمیایی چون آمینولیز و هیدرولیز می¬توانند باعث تغییراتی در ویژگیهای PCL شوند. برای پیبردن به بهترین نتیجه میان فرآیندهای موثر، فیلم PCL در سه محلول مختلف سود 10 مولار (برای معرفی گروه عاملی اسیدی)، پتاسیمهیدورکسید 10 مولار (برای تغییر شیمی و ساختار فیلم) و هگزامتیلندیآمین 10% قرار گرفت. فیلمهای PCL هیدرولیز شده، افزایش چشم¬گیری در آبدوستی و زیستسازگاری نشان دادند، درحالیکه توپوگرافی سطح ثابت بود. همچنین بر اثر آمینولیز مدولیانگ کاهش داشت که سبب بهبود تخریب این ماده شد. بر اثر هیدرولیز و آمینولیز،گروه¬های عاملی اسیدی و آمینی روی سطح PCL قرار گرفتند. این گروهها بهعنوان واکنشهای تخریبی برای نزدیک-کردن شرایط به محیط بدن در طول تخریب¬زیستی شناخته میشوند. واکنش اول منجر به تشکیل گروه¬های کربوکسیلیک و هیدروکسیلیک روی سطح فیلم PCL شده، در حالیکه در واکنش دوم، تشکیل پیوندهای آمیدی و گروه¬های آمینی روی سطح مشاهده شد (18). تاثیر اصلاح ¬سطح داربست¬های PCL روی خواص آن¬ها توسط کاسورن و همکاران در سال 2013 بررسی شد. در این تحقیق، ابتدا داربست¬های PCL در دو مرحله هیدرولیز شدند: قبل و پس از ساخت داربست با استفاده از تکنیک فشار بالای فوق بحرانی کربندیاکسید (که به ترتیب به¬صورت pre-HPCL و post-HPCL نشان داده می¬شوند). پس از آن هر دو داربست توسط روش پلاسما بهمنظور بهبود آب دوستی، اصلاح سطح شدند. مورفولوژی سطح، ترشوندگی و ترکیب شیمیایی همه داربست¬های PCL به¬ترتیب توسط SEM، اندازهگیری زاویه تماس آب و XPS آنالیز شدند. مشاهده شد که پس از هیدرولیز و پلاسما سطح داربست¬ها از حالت بسیار نرم و صاف، به شکل زبر تغییر یافت. حالت pre-HPCL نسبت به post-HPCL دارای زبری و زاویه تماس کمتری بود. زمانی که از پلاسما نیز استفاده ¬شد، زاویه تماس برای داربست pre-HPCL به صفر و آب دوستی به حداکثر مقدار خود رسید (19). در سال 2014 از ترکیب مواد پلیکاپرولاکتون، ژلاتین و فیبروین ابریشمی با غلظت 25% وزنی در حلال فرمیکاسید برای ساخت غشای متشکل از نانوفیبرهای مناسب سلولهای RPE استفاده شد. نتایج حاصل از این پژوهش نشان داد که داربست تولید شده، رشد و تکثیر سلولهای RPE را بدون برانگیختن واکنش التهابی سلولها، افزایش میدهد. با اینحال در این مطالعه، پارامترهای مربوط به الکتروریسی ثابت در نظر گرفته شد، بنابراین بررسی شرایط بهینه حاصل از درصد ترکیبات مختلف مواد استفاده شده برای داربست انجامگرفت (20). برای غلبه بر محدودیتهای PCL در سال 2018 رحمانی و همکاران از ترکیب این پلیمر با ژلاتین استفاده کردند و پس از انجام آزمایشهای متعدد به نسبت بهینه ترکیب این دو ماده دست یافتند. همچنین برای آزمایش صحت نسبت بهینه بهدست آمده، سلولهای RPE را بر روی داربست الکتروریسی از ترکیب PCL و ژلاتین کشت داده و تحلیل¬های مختلفی انجام دادند و به نتایج خوبی دست یافتند (21). در مطالعه¬ای دیگر بر روی داربستهای PCL، شاهمرادی و همکاران از اصلاح سطح به روش هیدرولیز قلیایی برای کشت سلولها و تشکیل لایه RPE بهره گرفتند و با توجه به آنالیزهای سلولی نظیر MTT، ایمونوسیتوشیمی و مشاهده سلول بر روی داربست پس از گذشت زمان با استفاده از SEM داربست بهینه را انتخاب کردند (7). با توجه به اینکه برخیاز پلیمرهای مورد استفاده دارای مقاومت مکانیکی پایین هستند و یا پس از تخریب مواد سمی تولید می¬کنند، در این مطالعه از پلیمر پلیکاپرولاکتون استفاده شد. این پلیمر دارای خواصی نظیر غیرسمی بودن مواد حاصل از تخریب آن، حلالیت خوب در حلالهای آلی، زیستسازگاری مناسب، آنتی ژنیسیته پایین، فرآیندپذیری ساده و آسان میباشد (22). دو حلال انتخابی برای این پلیمر کلروفرم و دی¬متیل¬فرمامید بودند که نیاز دستیابی به محلول مناسب برای الکتروریسی را فراهم کردند. با توجه به اینکه قطر نانوالیاف تولیدی از جمله پارامترهای مهم در کشت سلول روی داربست است (23)، ابتدا از طریق نرمافزار Design Expert طراحی آزمایش¬ها انجام گرفت و سپس شرایط بهینه با کمک سیستم ¬فازی و روش پاسخ سطح بهدست آمد. سیستمهای فازی که بر اساس یک منطق فازی و چند مقدار صورت میگیرد به عنوان تقریبگرهای عام معرفی شدهاند که قابلیت مدلسازی هر سیستمی را دارا بوده و میتواند توصیف کننده روابط بین ورودیها و خروجیهای یک سیستم پیچیده باشد. برای هر متغیر مستقل مساله مورد بررسی چند تابع عضویت در نظر گرفته میشود که این با اعمال مقادیر اندازهگیری شده به این توابع عضویت، درجه تعلق به هر تابع عضویت به صورت زیر عددی بین ۰ تا ۱ تعیین میشود. بر خلاف تابع عضویت در مجموعه¬های غیرفازی که هر مقدار تنها می توانست یکی از دو مقدار صفر یا یک را اختیار کند، در تابع عضویت مجموعه فازی هر عضو می تواند هر مقدار حقیقی را در بازه 0 تا 1 داشته باشد که به آن درجه عضویت در مجموعه فازی گفته میشود. در منطق و سیستمهای فازی از توابع عضویت فازی به متغیر زبانی تعبیر شده است که برای توصیف ورودیها و خروجیها در سیستمهای فازی به کار گرفته می شود. متغیرهای معمولی به صورت عددی و دقیق تعریف میشوند. اما متغیرهای زبانی از کلمات و جملات ساخته شدهاند که دقت آنها از اعداد کمتر و دارای ابهام است. این متغیرهای زبانی ابزاری برای توصیف ویژگیهای سیستمهای پیچیده و یا سخت تعریف هستند. یک سیستم فازی ارتباط بین ورودی خروجی مساله مورد نظر را براساس یک مجموعه قواعد اگر- آنگاه و ماشین استنتاج فازی مدل میکند و در نهایت خروجی این قواعد در طی فرآیند نافازیسازی به صورت یک عدد حقیقی بیان میشود. معمولاً در سیستمهای فازی برای بهینهسازی طراحی بخشهای مختلف مانند مراکز توابع عضویت و ابتدا و انتهای آن از روشهای یادگیری مبتنی بر داده استفاده میکنند. در این مطالعه از سیستم فازی ANFIS برای مدلسازی رابطه بین پارامترهای الکتروریسی و قطر الیاف بهرهگرفته شده است. در این سیستم به منظور دستیابی به نگاشت بهینه بین جفت های ورودی و خروجی، این پارامترها با استفاده از جفت دادههای ورودی و خروجی تعلیم و الگوریتمی که بر اساس گرادیان خطا می باشد، تغییر کرده و بهینه می شوند. پس از انتخاب شرایط بهینه حاصل از سیستم فازی به عنوان داربست مناسب، کشت سلولها و آزمایشهای مختلف بر روی آن صورت گرفت. هدف پایانی در این پژوهش به دست آوردن داربستی با شرایط بهینه است که برای رشد سلول¬های RPE در درمان بیماری AMD استفاده خواهد شد.
روش بررسی
پلی¬کاپرولاکتون (دانسیته 1/135 گرم بر سانتیمتر مکعب و جرم مولکولی 80 کیلودالتون و دمای ذوب 60 درجه -سلسیوس) به شکل پولک، کلروفرم و دیمتیل فرمامید از شرکت سیگما-آلدریچ تهیه شدند. سلولهای بنیادی جنین انسان تمایز یافته (hESC) Human embryonic stem cells به عنوان سلولهای رنگدانه شبکیه چشم استفاده شدند. این سلول¬ها با استفاده از یک پروتکل جدید و موثر که شامل افزودن پیاپی ناگین، فاکتور رشد فیبروبلاست، اسید رتینوییک و خارپشت صوتی بود، تمایز یافتند و مورفولوژی سلولهای رنگدانه شبکیه چشم و مارکرهای مولکولی ویژه را از خود نشان دادند (24).
ساخت داربستها و بهینهسازی آنها بر اساس قطر داربست به منظور به دست آوردن محلول یکنواخت، PCL در مخلوط حلالهای کلروفرم: دیمتیلفرمامید 2:8 به مدت 4 ساعت در دمای اتاق بر روی همزن مغناطیسی قرار گرفت. کلروفرم مایع بیرنگی است که با فرمول شیمیایی CHCl3 شناخته میشود و یکی از حلالهای رایج پلیکاپرولاکتون میباشد. دیمتیلفرمامید نیز یک حلال قطبی با نقطه جوش بالاست و دارای فرمول شیمیایی C3H7NO است. دو حلال به کار رفته در این پژوهش اختلالی در آزمایشها ایجاد نمیکنند (25). با توجه به اینکه نیاز به داربستی مناسب برای رشد سلولهای RPE احساس می¬شود، یافتن شرایط بهینه برای بستر مورد استفاده پس از انجام آزمایشها چالشی کلیدی است. بنابراین پس از طراحی آزمایشها و یافتن قطر کمینه نانوالیاف تولیدی، بهینهسازی شرایط با استفاده از سیستم فازی و روش پاسخ سطح صورت گرفت. با توجه به آن¬که دو پارامتر ولتاژ دستگاه و غلظت محلول اولیه بیشترین تاثیر را بر روی قطر نانوفیبرها دارند، این دو پارامتر بهعنوان متغیر در آزمایشها درنظر گرفته شدند (26). سایر پارامترهای دستگاه ثابت بودند که مقادیر آن¬ها در جدول 1 گزارش شده است: آزمایشهای مربوطه با استفاده از نرمافزار Design Expert در قالب 9 آزمایش طراحی شدند. پس از انجام تمامی آزمایشها، عکس-های مربوط به هر نمونه توسط میکروسکوپ الکترونی روبشی Scanning Electron Microscope (SEM) گرفته و با استفاده از نرمافزار ImageJ قطرهای نانوفیبرهای تولیدی مشخص شد (27). از آنجایی که داربستهای با قطر کمتر برای کشت سلول مناسب هستند، ملاک برای تعیین داربست بهینه با استفاده از منطق فازی، کمبودن قطر داربست در نظر گرفته شد.
مدل¬سازی فازی
در این مقاله با استفاده ازANFIS به مدلسازی رابطه میان متغیرهای ولتاژ دستگاه و غلظت محلول اولیه به عنوان ورودی مدل و قطر محلول به عنوان خروجی مدل پرداخته شد. ساختار ANFIS را مشابه با شکل (۱) می توان به صورت یک شبکه پنج لایه تطبیقپذیر در نظر گرفت: برای سادگی فرض میکنیم که سیستم فازی 2 ورودی و یک خروجی داشته باشد و پایگاه قواعد آن دارای 2 قاعده فازی به صورت زیر باشد که در آن خروجی هر قاعده یک تابع قطعی از ترکیب خطی ورودی¬ها است و مقدم قواعد بر اساس مجموعه¬های فازی و متغیرهای زبانی برای هر یک از متغیرها بیان میشود:
تخریب ماکولار در اثر افزایش سن یکی از بیماریهای شبکیه مرتبط با سن است که منجر به نابینایی میشود (1،2). در این بیماری سلولهای اپیتلیوم رنگدانه شبکیهلایه سلولی که از گیرندههای نوری محافظت میکند و بر روی غشای بروخ قرار گرفته است- به صورت برگشتناپذیر تخریب میشوند (6-3). این سلولها وظایف مهمی از جمله ایجاد برهمکنش بین گیرندههای حساس به نور بخش¬های خارجی، فراهم¬کردن یون و مواد غذایی و انتقال متابولیتهای درون سلولی را به عهده دارند. بنابراین درمان این بیماری از اهمیت خاصی برخوردار است (7). علم مهندسی بافت، علمی است که در آن بسیاری از بیماریهای انسان به کمک روشهایی چون کشت سلولها درمان میشوند. به منظور کشت سلولها در خارج از بدن موجود زنده، نیاز به محیطی است که حداکثر شباهت با بدن موجود زنده را داشته باشد. این محیطها که تحت عنوان "داربست" از آنها یاد میشود، خود تحت تاثیر پارامترهایی هستند که بسته به روش تولید، با هم تفاوت دارند (8). داربستها وظایف مهمی در درمان برخی از بیماریها مانند برقراری ارتباط موثر سلولها، چسبندگی، رشد و مهاجرت سلولی دارند. بنابراین ساخت بهترین داربست، از اهمیت برخوردار است (9). یکی از روشهای ساخت داربست، روش الکتروریسی است که در آن ماده مورد نظر، که جنس داربست را تشکیل میدهد، در حلال مناسبی حل شده و توسط دستگاه مربوطه رسیده میشود. پارامترهایی چون ولتاژ دستگاه، فاصله سر سوزنی که محلول از آن خارج می¬شود تا صفحه جمعکننده، دبی محلول خروجی از سرنگ، غلظت ماده حلشونده در محلول اولیه در چگونگی تشکیل داربست نقش دارند (8). پلیمری که به عنوان داربست در مهندسی بافت استفاده میشود، باید دارای ویژگیهایی چون زیستسازگاری، زیستتخریبپذیری، ضخامت مناسب، استحکام لازم برای عمل پیوند، چسبندگی کافی، تکثیر سلولی و تخلخل مناسب باشد (10). یکی از کاربردهای به کارگیری داربستها، استفاده از آنها در درمان سلولهای از بین رفته در بیماری Age Macular Degeneration (AMD) و Retinitis Pigmentosa (RP) مربوط به شبکیه چشم میباشد. روش پیشنهادی برای درمان این دو بیماری، کشت سلولهای Retinal Pigment Epithelium (RPE) بر روی آن¬ها و جایگزینی سلولهای سالم با سلولهای تخریب شده بیمار است (11). پلیلاکتیک کوگلایکولیک اسید (PLGA) و پلی اللاکتیک اسید (PLLA) دو پلیمر سنتزی هستند که در سال 2005 بهعنوان بستری جهت حمایت از سلولهای 407D استفاده شدند و نهایتاً شکل سنگفرش سلولهای RPE را بهخود گرفتند. در همین راستا، محققان با انتخاب نسبت 25:75 از پلیمرهای PLLA:PLGA توانستند داربستی نازک و با تخلخل بالا تهیه کرده و بهعنوان داربست بهینه ارائه دهند. اما از آنجایی که این داربست¬ها با روش ریخته¬گری حلال ساخته شدند، ضخامت آنها بیش از 150 میکرومتر بود، بنابراین سدی ضخیم برای ارتباط RPE و گیرندههای نوری محسوب شد که می¬تواند به لایه بیرونی شبکیه آسیب زده و آن را از بین ببرد. این در حالی است که ضخامت مناسب داربست ایدهآل برای قرارگرفتن به جای غشای بروخ کمتر از ده میکرومتر است (12). همچنین این دو ماده به دلیل برخی محصولات حاصل از تخریبشان، در مواردی زیستسازگار نیستند و موجب هجوم سلولهای ایمنی مانند ماکروفاژها میشوند (13). در سال 2012 کریستینسن و همکاران اصلاح سطحهای مختلفی بر روی داربستهای (PCL)Polycaprolactone انجام دادند. این بسترها بر روی چشمهای 28خوک در فضای زیر شبکیه پیوند زده شدند و پس از 6 هفته مشاهده، بافتشناسی آن صورت گرفت. مشاهده شد که در میان سه نوع داربست مشتق ¬شده از PCL (نانوسیم¬های کوتاه PCL، PCL الکتروریسی شده و داربستهای یکدست PCL)، نانوسیمهای کوتاه PCL بهترین گزینه در پیوند RPC هستند (14). آردان و همکاران در سال 2019 با کشت سلولهای RPE بر روی دو بستر – غشاهای نانولولهای و داربستهای پلیاستر تجاری- و انجام آزمایشهای ایمونوسیتوشیمی و real-time PCR دریافتند که سلولها بر روی غشاهای نانو لولهای بلوغ بهتر و میزان زندهمانی طولانیتری دارند (15). در سال 2020 از داربست پلیدیمتیلسیلوکسان ساخته شده به روش پوششدهی دورانی و لیتوگرافی، برای کشت سلول¬های بنیادی چندتوانی مشتق شده از RPE استفاده شد. در پژوهش لین و همکاران که با هدف درمان AMD انجام گرفت، با انجام آنالیزهای متعددی چون بیان ژن مشخص شد که این گزینه میتواند درمان مناسبی برای بیماری AMD باشد (16). در پژوهشی دیگر، از داربست سویا برای تمایز سلولهای بنیادی استفاده شد. نتایج حاصل از این مطالعه نشان داد که داربست بهکاررفته، بستری مناسب برای رشد و تمایز این سلولها در جهت درمان AMD میباشد (17). در مطالعه¬ای دیگر که به منظور معرفی بستری مناسب برای درمان این بیماری صورت گرفت، از یک هیبرید زیستی چند لایه سه بعدی از جنس فیبرویین ابریشم برای کشت سلول¬های مختلفی چون سلولهای بنیادی مزانشیمی و سلولهای رنگدانه شبکیه چشم استفاده شد. نتایج به دست آمده حاکی از تولید شبکیه مشابه با شبکیه واقعی بود (12). PCL یک طبیعت شیمیایی آبگریز دارد، بنابراین آبدوستی سطح کم است و هنگام برهمکنش با سیالات بیولوژیکی، از تکثیر و چسبندگی سلولی جلوگیری میکند. پس نیازمند ترکیب با مادهای است که خواص آن را بهبود بخشد. در سال 2014 پژوهشی بر روی بهبود آبدوستی و اصلاح سطح با گروههای کاربردی مختلف PCL انجام شد. لوکا و همکاران نشان دادند که روشهای شیمیایی چون آمینولیز و هیدرولیز می¬توانند باعث تغییراتی در ویژگیهای PCL شوند. برای پیبردن به بهترین نتیجه میان فرآیندهای موثر، فیلم PCL در سه محلول مختلف سود 10 مولار (برای معرفی گروه عاملی اسیدی)، پتاسیمهیدورکسید 10 مولار (برای تغییر شیمی و ساختار فیلم) و هگزامتیلندیآمین 10% قرار گرفت. فیلمهای PCL هیدرولیز شده، افزایش چشم¬گیری در آبدوستی و زیستسازگاری نشان دادند، درحالیکه توپوگرافی سطح ثابت بود. همچنین بر اثر آمینولیز مدولیانگ کاهش داشت که سبب بهبود تخریب این ماده شد. بر اثر هیدرولیز و آمینولیز،گروه¬های عاملی اسیدی و آمینی روی سطح PCL قرار گرفتند. این گروهها بهعنوان واکنشهای تخریبی برای نزدیک-کردن شرایط به محیط بدن در طول تخریب¬زیستی شناخته میشوند. واکنش اول منجر به تشکیل گروه¬های کربوکسیلیک و هیدروکسیلیک روی سطح فیلم PCL شده، در حالیکه در واکنش دوم، تشکیل پیوندهای آمیدی و گروه¬های آمینی روی سطح مشاهده شد (18). تاثیر اصلاح ¬سطح داربست¬های PCL روی خواص آن¬ها توسط کاسورن و همکاران در سال 2013 بررسی شد. در این تحقیق، ابتدا داربست¬های PCL در دو مرحله هیدرولیز شدند: قبل و پس از ساخت داربست با استفاده از تکنیک فشار بالای فوق بحرانی کربندیاکسید (که به ترتیب به¬صورت pre-HPCL و post-HPCL نشان داده می¬شوند). پس از آن هر دو داربست توسط روش پلاسما بهمنظور بهبود آب دوستی، اصلاح سطح شدند. مورفولوژی سطح، ترشوندگی و ترکیب شیمیایی همه داربست¬های PCL به¬ترتیب توسط SEM، اندازهگیری زاویه تماس آب و XPS آنالیز شدند. مشاهده شد که پس از هیدرولیز و پلاسما سطح داربست¬ها از حالت بسیار نرم و صاف، به شکل زبر تغییر یافت. حالت pre-HPCL نسبت به post-HPCL دارای زبری و زاویه تماس کمتری بود. زمانی که از پلاسما نیز استفاده ¬شد، زاویه تماس برای داربست pre-HPCL به صفر و آب دوستی به حداکثر مقدار خود رسید (19). در سال 2014 از ترکیب مواد پلیکاپرولاکتون، ژلاتین و فیبروین ابریشمی با غلظت 25% وزنی در حلال فرمیکاسید برای ساخت غشای متشکل از نانوفیبرهای مناسب سلولهای RPE استفاده شد. نتایج حاصل از این پژوهش نشان داد که داربست تولید شده، رشد و تکثیر سلولهای RPE را بدون برانگیختن واکنش التهابی سلولها، افزایش میدهد. با اینحال در این مطالعه، پارامترهای مربوط به الکتروریسی ثابت در نظر گرفته شد، بنابراین بررسی شرایط بهینه حاصل از درصد ترکیبات مختلف مواد استفاده شده برای داربست انجامگرفت (20). برای غلبه بر محدودیتهای PCL در سال 2018 رحمانی و همکاران از ترکیب این پلیمر با ژلاتین استفاده کردند و پس از انجام آزمایشهای متعدد به نسبت بهینه ترکیب این دو ماده دست یافتند. همچنین برای آزمایش صحت نسبت بهینه بهدست آمده، سلولهای RPE را بر روی داربست الکتروریسی از ترکیب PCL و ژلاتین کشت داده و تحلیل¬های مختلفی انجام دادند و به نتایج خوبی دست یافتند (21). در مطالعه¬ای دیگر بر روی داربستهای PCL، شاهمرادی و همکاران از اصلاح سطح به روش هیدرولیز قلیایی برای کشت سلولها و تشکیل لایه RPE بهره گرفتند و با توجه به آنالیزهای سلولی نظیر MTT، ایمونوسیتوشیمی و مشاهده سلول بر روی داربست پس از گذشت زمان با استفاده از SEM داربست بهینه را انتخاب کردند (7). با توجه به اینکه برخیاز پلیمرهای مورد استفاده دارای مقاومت مکانیکی پایین هستند و یا پس از تخریب مواد سمی تولید می¬کنند، در این مطالعه از پلیمر پلیکاپرولاکتون استفاده شد. این پلیمر دارای خواصی نظیر غیرسمی بودن مواد حاصل از تخریب آن، حلالیت خوب در حلالهای آلی، زیستسازگاری مناسب، آنتی ژنیسیته پایین، فرآیندپذیری ساده و آسان میباشد (22). دو حلال انتخابی برای این پلیمر کلروفرم و دی¬متیل¬فرمامید بودند که نیاز دستیابی به محلول مناسب برای الکتروریسی را فراهم کردند. با توجه به اینکه قطر نانوالیاف تولیدی از جمله پارامترهای مهم در کشت سلول روی داربست است (23)، ابتدا از طریق نرمافزار Design Expert طراحی آزمایش¬ها انجام گرفت و سپس شرایط بهینه با کمک سیستم ¬فازی و روش پاسخ سطح بهدست آمد. سیستمهای فازی که بر اساس یک منطق فازی و چند مقدار صورت میگیرد به عنوان تقریبگرهای عام معرفی شدهاند که قابلیت مدلسازی هر سیستمی را دارا بوده و میتواند توصیف کننده روابط بین ورودیها و خروجیهای یک سیستم پیچیده باشد. برای هر متغیر مستقل مساله مورد بررسی چند تابع عضویت در نظر گرفته میشود که این با اعمال مقادیر اندازهگیری شده به این توابع عضویت، درجه تعلق به هر تابع عضویت به صورت زیر عددی بین ۰ تا ۱ تعیین میشود. بر خلاف تابع عضویت در مجموعه¬های غیرفازی که هر مقدار تنها می توانست یکی از دو مقدار صفر یا یک را اختیار کند، در تابع عضویت مجموعه فازی هر عضو می تواند هر مقدار حقیقی را در بازه 0 تا 1 داشته باشد که به آن درجه عضویت در مجموعه فازی گفته میشود. در منطق و سیستمهای فازی از توابع عضویت فازی به متغیر زبانی تعبیر شده است که برای توصیف ورودیها و خروجیها در سیستمهای فازی به کار گرفته می شود. متغیرهای معمولی به صورت عددی و دقیق تعریف میشوند. اما متغیرهای زبانی از کلمات و جملات ساخته شدهاند که دقت آنها از اعداد کمتر و دارای ابهام است. این متغیرهای زبانی ابزاری برای توصیف ویژگیهای سیستمهای پیچیده و یا سخت تعریف هستند. یک سیستم فازی ارتباط بین ورودی خروجی مساله مورد نظر را براساس یک مجموعه قواعد اگر- آنگاه و ماشین استنتاج فازی مدل میکند و در نهایت خروجی این قواعد در طی فرآیند نافازیسازی به صورت یک عدد حقیقی بیان میشود. معمولاً در سیستمهای فازی برای بهینهسازی طراحی بخشهای مختلف مانند مراکز توابع عضویت و ابتدا و انتهای آن از روشهای یادگیری مبتنی بر داده استفاده میکنند. در این مطالعه از سیستم فازی ANFIS برای مدلسازی رابطه بین پارامترهای الکتروریسی و قطر الیاف بهرهگرفته شده است. در این سیستم به منظور دستیابی به نگاشت بهینه بین جفت های ورودی و خروجی، این پارامترها با استفاده از جفت دادههای ورودی و خروجی تعلیم و الگوریتمی که بر اساس گرادیان خطا می باشد، تغییر کرده و بهینه می شوند. پس از انتخاب شرایط بهینه حاصل از سیستم فازی به عنوان داربست مناسب، کشت سلولها و آزمایشهای مختلف بر روی آن صورت گرفت. هدف پایانی در این پژوهش به دست آوردن داربستی با شرایط بهینه است که برای رشد سلول¬های RPE در درمان بیماری AMD استفاده خواهد شد.
روش بررسی
پلی¬کاپرولاکتون (دانسیته 1/135 گرم بر سانتیمتر مکعب و جرم مولکولی 80 کیلودالتون و دمای ذوب 60 درجه -سلسیوس) به شکل پولک، کلروفرم و دیمتیل فرمامید از شرکت سیگما-آلدریچ تهیه شدند. سلولهای بنیادی جنین انسان تمایز یافته (hESC) Human embryonic stem cells به عنوان سلولهای رنگدانه شبکیه چشم استفاده شدند. این سلول¬ها با استفاده از یک پروتکل جدید و موثر که شامل افزودن پیاپی ناگین، فاکتور رشد فیبروبلاست، اسید رتینوییک و خارپشت صوتی بود، تمایز یافتند و مورفولوژی سلولهای رنگدانه شبکیه چشم و مارکرهای مولکولی ویژه را از خود نشان دادند (24).
ساخت داربستها و بهینهسازی آنها بر اساس قطر داربست به منظور به دست آوردن محلول یکنواخت، PCL در مخلوط حلالهای کلروفرم: دیمتیلفرمامید 2:8 به مدت 4 ساعت در دمای اتاق بر روی همزن مغناطیسی قرار گرفت. کلروفرم مایع بیرنگی است که با فرمول شیمیایی CHCl3 شناخته میشود و یکی از حلالهای رایج پلیکاپرولاکتون میباشد. دیمتیلفرمامید نیز یک حلال قطبی با نقطه جوش بالاست و دارای فرمول شیمیایی C3H7NO است. دو حلال به کار رفته در این پژوهش اختلالی در آزمایشها ایجاد نمیکنند (25). با توجه به اینکه نیاز به داربستی مناسب برای رشد سلولهای RPE احساس می¬شود، یافتن شرایط بهینه برای بستر مورد استفاده پس از انجام آزمایشها چالشی کلیدی است. بنابراین پس از طراحی آزمایشها و یافتن قطر کمینه نانوالیاف تولیدی، بهینهسازی شرایط با استفاده از سیستم فازی و روش پاسخ سطح صورت گرفت. با توجه به آن¬که دو پارامتر ولتاژ دستگاه و غلظت محلول اولیه بیشترین تاثیر را بر روی قطر نانوفیبرها دارند، این دو پارامتر بهعنوان متغیر در آزمایشها درنظر گرفته شدند (26). سایر پارامترهای دستگاه ثابت بودند که مقادیر آن¬ها در جدول 1 گزارش شده است: آزمایشهای مربوطه با استفاده از نرمافزار Design Expert در قالب 9 آزمایش طراحی شدند. پس از انجام تمامی آزمایشها، عکس-های مربوط به هر نمونه توسط میکروسکوپ الکترونی روبشی Scanning Electron Microscope (SEM) گرفته و با استفاده از نرمافزار ImageJ قطرهای نانوفیبرهای تولیدی مشخص شد (27). از آنجایی که داربستهای با قطر کمتر برای کشت سلول مناسب هستند، ملاک برای تعیین داربست بهینه با استفاده از منطق فازی، کمبودن قطر داربست در نظر گرفته شد.
مدل¬سازی فازی
در این مقاله با استفاده ازANFIS به مدلسازی رابطه میان متغیرهای ولتاژ دستگاه و غلظت محلول اولیه به عنوان ورودی مدل و قطر محلول به عنوان خروجی مدل پرداخته شد. ساختار ANFIS را مشابه با شکل (۱) می توان به صورت یک شبکه پنج لایه تطبیقپذیر در نظر گرفت: برای سادگی فرض میکنیم که سیستم فازی 2 ورودی و یک خروجی داشته باشد و پایگاه قواعد آن دارای 2 قاعده فازی به صورت زیر باشد که در آن خروجی هر قاعده یک تابع قطعی از ترکیب خطی ورودی¬ها است و مقدم قواعد بر اساس مجموعه¬های فازی و متغیرهای زبانی برای هر یک از متغیرها بیان میشود:
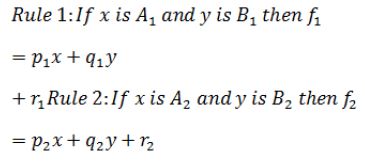
با استفاده از الگوریتم یادگیری تلفیقی ابتدا پارامترهای خطی که همان پارامترهای تالی قواعد هستند را با استفاده از تخمین حداقل مربعات خطا تعیین کرده و سپس بعد از محاسبه خطا با پس انتشار خطا بر اساس الگوریتم گرادیان کاهشی، پارامترهای توابع عضویت لایه¬های داخلی شبکه که همان پارامترهای مقدم قواعد هستند تخمین زده میشوند.
مدلسازی پاسخ سطح با استفاده از نرمافزار Design Expert پس از واردکردن اطلاعات بهدست آمده در نرمافزار مربوطه، تصویر سه بعدی مربوط به دادهها، رابطه تئوری ارائه ¬شده توسط نرم¬افزار و شرایط بهینه برای هر دو حلال پیشبینی شد. تعیین مدل فازی قطر داربست بر اساس ولتاژ و غلظت محلول
برای تعیین مدل فازی قطر داربست براساس غلظت محلول و ولتاژ بایستی کل فضای تغییرات توام این دو متغیر به صورت دادههای ورودی تعیین گردد. به این منظور بازه تغییرات این دو متغیر به¬ترتیب به صورت [0/15- 0/05] گرم PCL بر میلی¬لیتر حلال و [20- 1۰] کیلوولت در نظر گرفته شد. در نهایت از طریق دو روش فازی و پاسخ سطح، رابطه بین دو پارامتر متغیر انتخابی و قطر نانوالیاف به دست آمد و R-squared هر دو حاصل شد. مطابق با شکل 2، روش فازی دارای R-square یک است که نتیجه قابل قبولی میباشد و داربست بهینه برای ادامه فرآیند آزمایشگاهی با استفاده از این روش به دست آمد. شرایط بهینه که براساس کمینه قطر نانوالیاف تولیدی به دست آمد، در جدول 2 مشاهده
می¬شود.

شکل 1: ساختار شبکههای ANFIS (لایه اول: فازی ساز، لایه دوم: لایه ضرب ( محاسبه (t-norm، لایه سوم: لایه هنجارسازی،لایه چهارم لایه نافازی ساز، لایه پنجم: لایه محاسبه خروجی نهایی
جدول 1: مقدار پارامترهای ثابت در ساخت داربست به روش الکتروریسی
.JPG)
جدول 2: شرایط بهینه ساخت داربست بر اساس روش فازی

ضخامت و تخلخل داربست بهینه 1±14 میکرومتر و 84٪ به دست آمد.

شکل 2: نمودار مقادیر پیشبینی شده بر حسب مقادیر آزمایشگاهی فرآیند الکتروریسی.
الف) روش پاسخ سطح و ب) روش فازی. روش فازی از دقت بالاتری برخوردار است و از شرایط بهینه حاصل از این روش برای ادامه آزمایشها استفاده شد.
اصلاح سطح و بهینهسازی
از آنجایی که PCL یک پلیمر آبگریز است، برای بهبود چسبندگی سلولی و تکثیر آنها نیاز به ویژگی آبدوستی است. هیدرولیز قلیایی یکی از راههای اصلاح سطح میباشد که در آن، پیوندهای استری هیدرولیز شده و گروههای کربوکسیلیک آبدوست ایجاد میشود. به همین منظور، سدیمهیدروکسید در آب مقطر حل شد و محلول قلیایی به دست آمد. از آنجایی اصلاح سطح با استفاده از محلول قلیایی متاثر از پارامترهای مختلفی است، برای یافتن شرایط بهینه مربوط به دو پارامتر غلظت محلول قلیایی (با گستره غلظت بین 2 تا 7 مولار) و زمان در معرض قرار گرفتن داربست در محلول (بین 40 تا 160 دقیقه)، تعدادی آزمایش توسط RSM طراحی شد. در پایان داربستهای بهینه شده برای رسیدن به pH هفت سه بار با آب مقطر شستشو داده شدند (28). به منظور سنجش تاثیر اصلاح سطح، زاویه تماس آب با سطح داربست اندازهگیری شد. بدین ترتیب که قطره آب دیونیزه به حجم 4 میکرولیتر بر روی سطح داربست اصلاح سطح شده چکانده شد و با دوربین مخصوص از سطح تماس آب و سطح تصویری ثبت و زاویه تماس محاسبه شد (19).
اندازه¬گیری ضخامت، تخلخل و قطر داربست
برای اندازه¬گیری قطر و ضخامت داربست میکروسکوپ الکترونی روبشی (SEM) و نرمافزار Image J به کار گرفته شدند (29). حجم داربست با استفاده از قطر و ضخامت محاسبه شد. ابتدا وزن داربست توسط ترازوی دیجیتالی تعیین گردید. سپس دانسیته (ρb) داربست از تقسیم جرم بر حجم آن به دست آمد. نهایتاً تخلخل با داشتن دانسیته PCL (ρp=1.145 g/cm3) از رابطه زیر حاصل شد:
Ɛ= 1- ρ_b/ρ_p (5)
میزان جذب آب
درصد جذب آب توسط داربستهای 1×1 سانتیمتر مربع با توجه به رابطه ×100 (w_2- w_1)/w_1 که در آن w_1 و w_2به ترتیب وزن داربست خشک و وزن داربست غوطه¬ور در (PBS) Phosphate-buffered saline است، به دست آمد (30).
نرخ تخریبپذیری
میزان تخریبپذیری با غوطه¬ور ساختن داربست در محلول لیزوزیم و PBS (1 میلیگرم بر میلیلیتر)، نگهداری آن در انکوباتور در دمای 37 درجه سلسیوس و اندازه¬گیری وزن خشک داربست در روزهای 1، 4، 7، 14، 21 و 28 به دست آمد (31). ابتدا وزن داربست در روز صفر (قبل از قرارگیری در محلول) اندازهگیری شد (m_0). سپس در روزهای مشخص شده داربستها ازمحلول خارج، سه بار با آب مقطر شستشو، خشک و توزین شدند (m_f). بنابراین میزان تخریبپذیری از تقسیم اختلاف وزن ثانویه و اولیه (m_f- m_0) بر وزن اولیه به دست آمد (32).
سنجش زیستسازگاری داربست
در این پژوهش از سلولهای بنیادی جنین انسانی که در مطالعه قبلی به سلولهای شبکیه چشم تمایز یافته بودند، استفاده شد ZAHABI 2011. به منظور یافتن میزان زنده¬مانی سلول و تکثیر آنها بر روی دو گروه داربست (داربست بدون اصلاح سطح Un-treated PCL (UPCL) و داربست با اصلاح سطح هیدرولیز Hydrolyzed PCL (HPCL))، ابتدا سلول¬های RPE تمایزیافته استریلیزه با دانسیته 5×104 سلول بر میلیلیتر قرار گرفت و 200 میکرولیتر محیط تازه به آن افزوده شد. پس از زمان مشخص انکویاسیون، محیط کشت خارج شد و 200 میکرولیتر MTT اضافه شد و به مدت 3 تا 4 ساعت درون انکوباتور قرار گرفت و به دلیل مصرف MTT توسط سلولهای زنده، کریستالهای بنفش فورمازان تشکیل شدند. سپس به هر داربست 200 میکرولیتر محلول DMSO افزوده و بر روی شیکر در انکوباتور به مدت 20 دقیقه قرار داده شد تا کریستال¬های فورمازان حل شوند و رسوب سلولی تهنشین شود. از هر چاهک 100 میکرولیتر محلول در پلیت 96 تایی ریخته و با استفاده از دستگاه الایزا، میزان جذب هر چاهک در طول موج 570 نانومتر خوانده شد. این روند با سه بار تکرار و در روزهای اول، چهارم و هفتم انجام گرفت و میزان جذب هر چاهک قرائت گردید (33).
میکروسکوپ الکترونی روبشی
برای تعیین مورفولوژی سلول روی داربستهای مختلف پس از 63 روز، محیطکشت خارج شد و داربست در 2/5 درصد گلوتارآلدهید به مدت دو ساعت قرار داده شد. سپس، گروههای مختلف داربست در سری محلول اتانول دهیدراته شده و در هوای محیط خشک شدند. در نهایت، داربستها با طلا پوشش داده شده و در دستگاه SEM قرار گرفتند (34).
ایمونوسیتوشیمی
پس از تهیه محلول¬های پارافرمالدهید 8 درصد، محلول 1 درصد از 100-Triton X در بافر PBS (PBST 1 درصد: محلول A)، محلول 1درصد BSA در 1 درصد PBST (محلول B) و محلول 1 درصد BSA در PBS آزمون ایمونوسیتوشیمی به روش زیر انجام گرفت. در ابتدا سلول¬ها از روی بسترها جدا شده و با استفاده از دستگاه Cell spin بر روی لامل قرار داده شدند. در ادامه، لامل¬ها در پلیت 24 خانه قرار گرفتند و به هر چاهک 500 میکرولیتر پارافرمالدهید 4 درصد اضافه شد و به مدت 5 دقیقه در دمای اتاق انکوبه شد. سپس پارافرمالدهید 4 درصد خارج و پلیت خشک شد. پس از آن سلولها دوبار با محلول PBS شستشو داده شدند. با هدف نفوذپذیری سلولها، محلول A به مقدار 300 میکرولیتر به پلیت اضافه شد و 15 دقیقه در دمای اتاق نگهداری شد. پس از شستشوی سلولها با PBS، محلول B به مقدار 500 میکرولیتر به ئلیت اضافه شد و به مدت 20 دقیقه در دمای اتاق نگهداری شد. سپس محلول خارج و سلولها با PBS دو مرتبه شسته شدند. 500 میکرولیتر آنتیبادی اولیه اضافه شد و به مدت یک شب در دمای 4 درجه سلسیوس نگهداری شد. سپس محلول رویی تخلیه شد و سه بار با PBS شستشو داده شد. آنتیبادی ثانویه مشابه آنتیبادی اولیه تهیه گردید. با این تفاوت که از PBS/BSA یک درصد برا رقیقسازی استفاده شد. 500 میکرولیتر آنتیبادی ثانویه اضافه گردید و در تاریکی و در دمای اتاق به مدت 45 دقیقه قرار داده شد. در ادامه، آنتیبادی ثانویه خارج شد و محیط سلولها سه مرتبه با PBS شستشو داده شدند. برای رنگآمیزی هسته سلولها در هر چاهک 10 میکرولیتر محلول رنگ DAPI با غلظت 2 میکروگرم بر میلی-لیتر اضافه شد و 10 دقیقه در دمای اتاق در تاریکی نگهداری شد. در پایان لاملهای آمادهشده زیر میکروسکوپ فلورسنت مشاهده شدند (21).
تجزیه و تحلیل آماری
در این پژوهش، داده¬ها به صورت میانگین ± میانگین خطای استاندارد گزارش شدهاند. همه آزمایشها با سه بار تکرار صورت گرفته است. تحلیلهای آماری دادههای با استفاده ازversion 16 SPSS و تست Tukey انجام گرفت. مقدار P-Value کمتر از 0/05 به دست آمد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علومپزشکی شهید صدوقی یزد تایید شده است (کد اخلاق IR.SSU.MEDICINE.REC.1399.094)
نتایج
اصلاح سطح و بهینهسازی
پس از اصلاح سطح به روش هیدرولیز قلیایی مطابق با شرایط آزمایش¬های طراحی شده و اندازه¬گیری زاویه تماس مربوط به هر آزمایش، زمان قرارگیری داربست در محلول قلیایی و غلظت محلول قلیایی بر اساس حداقل زاویه تماس بهینه شد که مقدار آن به ترتیب 97 دقیقه و 3/7 مولار بهدست آمد. زاویه تماس مربوط به دو گروه داربست (داربست بدون اصلاح سطح و داربست هیدرولیز شده در شرایط بهینه) با سه بار تکرار اندازه¬گیری شد (جدول 3). همانطور که مشاهده می¬شود، هیدرولیز قلیایی منجر به کاهش چشمگیر زاویه تماس در مقایسه با داربستهای UPCL شده است. به عبارت دیگر تغییر گروه¬های عاملی در فرآیند هیدرولیز، سبب آب¬دوستی و پخش شدن قطره آب بر روی سطح داربست می-شود که تاثیر مطلوبی بر کشت و تکثیر سلول دارد.
جدول 3: زاویه تماس آب برای دو گروه داربست (هیدرولیز داربست در شرایط بهینه صورت گرفته است)

میزان جذب آب
مقدار آب جذب شده در دوگروه داربست در شکل 3 آمده است. همانطور که مشاهده میشود، HPCL میزان جذب آب بالاتری دارد. به بیان دیگر اصلاح سطح منجر به افزایش قابلیت داربست در به دام انداختن آب میشود که نشاندهنده آبدوستی بالاتر نسبت به گروه UPCL است.
زیستتخریبپذیری
شکل 4 نشان میدهد که اصلاح سطح داربست، وزن داربست را کاهش میدهد. همچنین، نرخ تخریب داربست HPCL نسبت به داربست UPCL در مدت زمان 28 روز افزایش بیشتری دارد.
ویژگیهای نانولولهها
مطابق با شکل 5 مربوط به تصاویر SEM دو گروه داربست، ساختار رشتهها منظم است و بید مشاهده نمیشود. همچنین، شکل 5 (ب) نشان میدهد که اصلاح سطح داربست منجر به کاهش قطر نانوالیاف میشود که تاثیر مطلوبی بر رشد و تکثیر سلول دارد.
زیستسازگاری
به منظور بررسی میزان زندهمانی و تکثیر سلولها بر روی داربست از آنالیز MTT استفاده شد. همانگونه که در شکل 6 مشاهده میشود، رشد و تکثیر سلول¬ها در هر سه گروه (بر روی سطح پلیت، UPCL و HPCL) با گذشت زمان افزایش می¬یابد. سطح پلیت دارای کمترین میزان رشد سلولی است و UPCL میزان جذب نوری بین دو گروه TCP و HPCL دارد. اصلاح سطح داربست پلیمری تاثیر مستقیم و قابلتوجهی بر رشد و تکثیر سلول¬های RPE دارد به طوری که میزان جذب نوری آن از دو گروه دیگر بالاتر است.
مورفولوژی سلول RPE بر روی داربست
پس از گذشت 63 روز از کشت سلولها بر روی داربست مورفولوژی و چسبندگی سلول بر روی داربستها مشاهده شد (شکل 7). تنها بر روی گروه HPCL سلول وجود داشت (شکل 7 الف) و سلولی بر روی UPCL مشاهده نشد. ساختار شش وجهی (شکل 7 ب) و میکروویلی مربوط به سلولهای RPE (شکل 7 ج که با پیکان نشان داده شده¬اند) در تصاویر حاصل از SEM مشاهده میشود.
آنالیز ایمونوسیتوشیمی
به منظور اثبات هویت سلولهای اپیتلیوم رنگدانه شبکیه بر روی بستر گروه HPCL، بیان پروتئین¬های 65RPE و سیتوکراتین 8/18 که به ترتیب مارکرهای اختصاصی سلولهای RPE و اپیلتیومی هستند، مورد بررسی قرار گرفت. از آنجایی که پروتئین¬های 65RPE در داخل وزیکول¬های درون سلولی و به صورت پراکنده در سیتوپلاسم وجود دارند، پس از انجام ICC این مارکر به صورت میکروزومال در داخل سیتوپلاسم مشاهده شدند. همچنین، سیتوکراتین 8/18 به عنوان فیلامنت حد واسط در مل سیتوپلاسم به صورت رشتههای طویل دیده شدند (شکل 8).
.JPG)
شکل 3: درصد جذب آب توسط دو گروه داربست. اصلاح سطح داربست، افزایش ترشوندگی و آبدوستی آن را در پی دارد که موجب افزایش قدرت جذب آب توسط داربست میشود. تفاوت معنادار (**) بین دو گروه دیده میشود (0/001>P ) .
.JPG)
شکل 4: نرخ زیستتخریبپذیری گروههای مختلف داربست. وزن داربست در طول 28 روز کاهش یافته است. اصلاح سطح داربست، باعث افزایش سرعت زیست-تخریبپذیری میشود. تفاوت بین UPCL و HPCL در 0/01>P (**) معنادار است.

شکل 5: تصاویر میکروسکوپ الکترونی روبشی الف) UPCL، ب) HPCL. در هیچ یک از گروهها ساختار بید مشاهده نمیشود.
اصلاح سطح منجر به کاهش قطر رشتهها میشود.

شکل 6: آنالیز MTT داربستها در زمان هفت روز. با گذشت زمان رشد و تکثیر سلولی در هر سه گروه افزایش مییابد. اصلاح سطح داربست تاثیر چشمگیری در زندهمانی و تکثیر سلولی دارد. تفاوت بین TCP و سایر گروهها در 0/01>P (**) و 0/001>P (***) و همچنین تفاوت بین UPCL و سایر گروهها در 001/0>P (ᵟᵟᵟ) معنادار هستند.

شکل 7: الف) مورفولوژی سلولی بر روی داربست HPCL، ب) ساختار شش وجهی سلولهای RPE قابل مشاهده هستند و ج) میکروویلی روی سطح سلولهای RPE بر روی داربست HPCL با پیکان مشخص شدهاند.

شکل 8: میکروسکوپ فلورسنس بیان پروتئینهای سیتوکراتین 8/18 (الف - ج) و 65RPE (د - و) توسط سلول¬های RPE موجود بر روی بستر گروه HPCL که توسط FITC (الف و د) و DAPI (ب و ه) رنگآمیزی شده اند. تصاویر ادغام¬شده (الف) و (ب) در (ج) و (د) و (ه) در (و) دیده می¬شود.
بحث
پس از بهینهسازی داربستها با استفاده از متغیرهای اثرگذار در ساخت داربست به روش الکتروریسی، قطر بهینه برای داربست 115 نانومتر به دست آمد که در مقایسه با سایر مطالعات برای رشد سلول، مناسب است. ژانگ و همکاران از سه داربست PCL، PCL/Silk fibroin وPCL/Silk fibroin/gelatin برای کشت سلولهای RPE استفاده کردند که به ترتیب دارای اندازه قطرهای 157، 154 و 253 نانومتر بودند (20). در مطالعه پارک و همکاران، میانگین قطر برای نانو رشته¬ها 2 میکرومتر به دست آمد که برای درمان AMD مقدار بزرگی بود (35) علاوه براین، تخلخل داربست با سایر داربستهای مطالعات انجام شده، مقایسه گردید. مک¬هوگ و همکاران از پلی¬استر و PCL با تخلخل 64 درصد و 90 درصد به عنوان داربست استفاده کردند. آنها دریافتند که داربست با تخلخل بالاتر تاثیر بیشتری در تکثیر سلولی و تعداد سلول پس از گذشت 8 هفته از کشت سلول بر روی داربست دارد (36). همچنین، در بررسی که توسط ژانگ و همکاران انجام گرفت، تخلخل برای داربستهای PCL، PCL/Silk fibroin و PCL/Silk fibroin/gelatin به ترتیب 85، 87 و 90 درصد گزارش شد. به منظور ایجاد چسبندگی سلولی مناسب، زاویه تماس داربست PCL محاسبه و به کمک اصلاح سطح کاهش یافت. داربست PCL بدون اصلاح سطح زاویه تماس حدود 118 درجه داشت که آبگریزی بالای آن را نشان میدهد (20). عبدالوفا و همکاران تاثیر افزایش آبدوستی داربست پس از اصلاحسطح را با افزایش میزان به دام انداختن آب و به دنبال آن افزایش وزن داربست را در پژوهش خود نشان دادند (37). بنابراین پس از یافتن شرایط بهینه روش هیدرولیزقلیایی برای رسیدن به حداقل زاویه تماس، سطح داربستها اصلاح شد و زاویه تماس به حدود 12 درجه رسید. گو و همکاران در بررسی خود که بر روی تاثیر اصلاح سطح هیدرولیز قلیایی بر روی داربست پلی ال-لالکتیک اسید انجام دادند، به نتیجه مشابه با این پژوهش دست یافتند. به طوری که میزان جذب آب توسط داربست اصلاح شده تفاوت قابل توجهی با داربست بدون اصلاح سطح داشت که حاکی از افزایش میزان آبدوستی آنهاست (38). در این پژوهش نتایج نشان داد که اصلاحسطح باعث افزایش زیستتخریبپذیری داربست میشود. این یافته توسط سنت و همکاران در پژوهشی دیگر به تایید رسید. آنها نشان دادند که اصلاح سطح داربست ترکیبی پلیگلیسرول سباسات: پلیکاپرولاکتون (به نسبت دو به یک) به روش هیدرولیز قلیایی در محلول 0/1 میلیمولار دو برابر نرخ تخریب زیستی بالاتری نسبت به داربست بدون اصلاح سطح دارد (39). با مقایسه مورفولوژی داربست قبل و بعد از اصلاحسطح مشخص شد که هیدرولیزقلیایی سبب کاهش قطر الیاف میشود که این امر در کشت سلولی موثر است. گایو و همکاران نیز نشان دادند که اصلاحسطح داربست پلی گلایکولیک اسید در محلول یک نرمال سدیم هیدروکسید، منجر به کاهش قطر الیاف داربست میشود. بهطوریکه یک رابطه خطی بین افزایش زمان هیدرولیز و کاهش قطر داربست وجود دارد (40). پارک و همکاران با غوطهور ساختن داربست PCL در محلول قلیایی سدیم هیدروکسید یک نرمال، به دنبال بررسی تاثیر اصلاح سطح داربست بر روی رشد سلولهای استئوبلاست بودند. پس از گذشت زمان 28 روز، نتایج حاصل از MTT نشان داد که اصلاح سطح داربست به روش هیدرولیز قلیایی تاثیر مطلوبی بر روی رشد سلول¬ها به دلیل افزایش آبدوستی و خاصیت ترشوندگی داشته است (35). در مطالعهای که در سال 2020 توسط لین و همکاران انجام گرفت، داربستی از جنس پلیدیمتیل سیلوکسان برای کشت سلولهای بنیادی پرتوانی تمایزیافته به سلولهای رنگدانه شبکیه چشم تهیه شد. ارزیابی بیان ژنها نشان داد که سلولهای RPE رشد یافته بر روی بستر پلیمری مارکرهای ویژه RPE از جمله ZO-1 و PEDF را ازخود نشان دادند (16). همچنین، آزمون ایمونوسیتوشیمی برای سلولهای RPE کشت داده شده بر روی داربست ترکیبی PCL و کیتوسان بیان مارکرهای 65RPE و ZO-1 را نشان داد (41). همچنین رشد و کثیر سلولهای hESC-RPE بر روی بستر پلیمری متخلخل پلیبوتیلن سوکسینات توسط کالجو و همکاران مورد بررسی قرار گرفت. این بسترها قابلیت جذب پروتئین و حفاظت از چسبندگی سلولی را داشتند که این ویژگیها، آن-ها را برای کشت سلول¬های مورد نظر مطلوب کرده است (42). پس از بررسی سایر پژوهشهای مشابه انجام شده، رشد سلولها پس از 63 روز بر روی HPCL بسیار مناسب بود در حالیکه سلولی بر روی داربست UPCL مشاهده نشد. این یافته، نشاندهنده برتری گروه HPCL بر UPCL از جهت مطلوب بودن برای زمان طولانیتر رشد سلولها میباشد. به خصوص که نتایج ICC نیز بیان پروتئینهای 65RPE و سیتوکراتین 8/18 که به ترتیب مارکرهای اختصاصی سلولهای RPE و سلولهای اپیتلیومی هستند، را تایید کرد.
نتیجهگیری
در این تحقیق، ابتدا با مقایسه دو روش فازی و پاسخ سطح، داربست بهینه با حداقل سطح الیاف تهیه شد. سپس با توجه به اینکه PCL طبیعتی آب گریز دارد، سطح آن به روش هیدرولیز قلیایی اصلاح شد و برای رسیدن به حداقل زاویه تماس بهینه گردید. آنالیزهای مختلف بر روی دو داربست UPCL و HPCL انجام گرفت. نتایج MTT حاکی از عدم سمیت داربستها و رشد و تکثیر سلولها بهخصوص بر روی HPCL بود. در پایان سلولهای RPE بر روی هر دو داربست کشت داده شدند. نتایج نشان داد که اصلاح سطح تاثیر مطلوبی بر روی رشد و تکثیر سلولها دارد. در ادامه می-توان با تغییر حلال، ترکیب PCL با سایر پلیمرها به منظور بهبود خواص برای کشت سلول، به کارگیری سایر روشهای مختلف اصلاحسطح و همچنین استفاده از دیگر روش¬های ساخت داربست و به کارگیری مطالعات In vivo تلاشی در جهت نتایج بهتر برای درمان این بیماری انجام داد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Martin Df, Maguire Mg, Ying Gs, Grunwald Je, Fine Sl, Jaffe Gj. Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration. N Engl J Med 2011; 364(20): 1897-1908.
2- Thomas Bb, Zhu D, Zhang L, Thomas Pb, Hu Y, Nazari H, et al. Survival and Functionality of Hesc-Derived Retinal Pigment Epithelium Cells Cultured as a Monolayer on Polymer Substrates Transplanted in Rcs Rats. Invest Ophthalmol Vis Sci 2016; 57(6): 2877-87.
3- Sorkio A, Porter Pj, Juuti-Uusitalo K, Meenan Bj, Skottman H, Burke Ga. Surface Modified Biodegradable Electrospun Membranes as a Carrier for Human Embryonic Stem Cell-Derived Retinal Pigment Epithelial Cells. Tissue Eng - Part A 2015; 21(17-18): 2301-14.
4- Pennington Bo, Clegg Do. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J Ocul Pharmacol Ther 2016; 32(5): 261-71.
5- Calejo Mt, Ilmarinen T, Jongprasitkul H, Skottman H, Kellomäki M. Honeycomb Porous Films as Permeable Scaffold Materials for Human Embryonic Stem Cell-Derived Retinal Pigment Epithelium. J Biomed Mater Res - Part A 2016; 104(7): 1646-56.
6- Zadeh Ma, Khoder M, Al-Kinani Aa, Younes Hm, Alany Rg. Retinal Cell Regeneration Using Tissue Engineered Polymeric Scaffolds. Drug Discov Today 2019; 24(8): 1669-78.
7- Shahmoradi S, Yazdian F, Tabandeh F, Soheili Zs, Hatamian Zarami As, Navaei-Nigjeh M. Controlled Surface Morphology and Hydrophilicity of Polycaprolactone Toward Human Retinal Pigment Epithelium Cells. Mater Sci Eng C 2017; 73: 300-9.
8- Ramakrishna S, Fujihara K, Teo We, Lim Tc, Ma Z. An Introduction to Electrospinning and Nanofibers. An Introduction to Electrospinning and Nanofibers 2005.
9- Carletti E, Motta A, Migliaresi C. Scaffolds for Tissue Engineering and 3d Cell Culture. Methods Mol Biol (Clifton, N.J.) 2011; 695: 17-39.
10- Strauss O. The Retinal Pigment Epithelium in Visual Function. Physiol Rev 2005; 85(3): 845-81.
11- Heller Jp, Martin Kr. Enhancing Rpe Cell-Based Therapy Outcomes for Amd: The Role of Bruch’s Membrane. Transl Vis Sci Technol 2014; 3(3): 11.
12- Jemni-Damer N, Guedan-Duran A, Cichy J, Lozano-Picazo P, Gonzalez-Nieto D, Perez-Rigueiro J, et al. First Steps for the Development of Silk Fibroin-Based 3d Biohybrid Retina for Age-Related Macular Degeneration (Amd). J Neural Eng 2020; 17(5): 55003.
13- You Y, Min Bm, Lee Sj, Lee Ts, Park Wh. In Vitro Degradation Behavior of Electrospun Polyglycolide, Polylactide, And Poly(Lactide-Co-Glycolide). J Appl Polym Sci 2005; 95(2): 193-200..
13- Christiansen At, Tao Sl, Smith M, Wnek Ge, Prause Ju, Young Mj, et al. Subretinal Implantation of Electrospun, Short Nanowire, And Smooth Poly(Ε-Caprolactone) Scaffolds to the Subretinal Space of Porcine Eyes. Stem Cells Int 2012; 1-8.
14- Ardan T, Zemanova L, Ellederova Z, Drutovič S, Studenovská H, Popelka S, et al. Nanofibrous Membranes Reveal Better Properties for Culturing of Rpe Cells in Comparison with Commercial Scaffolds. Acta Ophthalmol 2019.
15- Lin YY, Yang YP, Lai WY, Chien CS, Chen SJ, Hwang DK, et al. Development of Polydimethylsiloxane-Based Biomimetic Scaffolds with Cylinder Micropillars for Retinal Pigment Epithelial Cell Cultivation. J Chin Med Assoc 2020; 83(11): 1029-33.
16- Phelan Ma, Kruczek K, Wilson Jh, Brooks Mj, Drinnan Ct, Regent F, et al. Soy Protein Nanofiber Scaffolds for Uniform Maturation of Human Induced Pluripotent Stem Cell-Derived Retinal Pigment Epithelium. Tissue Eng Part C Methods 2020; 26(8): 433-46.
17- De Luca Ac, Terenghi G, Downes S. Chemical Surface Modification of Poly-Ε-Caprolactone Improves Schwann Cell Proliferation For Peripheral Nerve Repair. J Tissue Eng Regen Med 2014; 8(2): 153-63.
18- Kosorn W, Thavornyutikarn B, Janvikul W. Effects of Surface Treatments of Polycaprolactone Scaffolds on their Properties. Advanced Materials Res 2013; 747: 178-81.
19- Xiang P, Wu Kc, Zhu Y, Xiang L, Li C, Chen Dl, et al. A Novel Bruch’s Membrane-Mimetic Electrospun Substrate Scaffold for Human Retinal Pigment Epithelium Cells. Biomaterials 2014; 35(37): 9777-88.
20- Rahmani S, Tabandeh F, Faghihi S, Amoabediny G, Shakibaie M, Noorani B, et al. Fabrication and Characterization of Poly (Ε-Caprolactone)/Gelatin Nanofibrous Scaffolds for Retinal Tissue Engineering. Int J Polym Mater Polym Biomater 2018; 67(1): 27-35.
21- Jiang T, Carbone Ej, Lo Kwh, Laurencin Ct. Electrospinning of Polymer Nanofibers for Tissue Regeneration. Progress in Polymer Science 2015; 46: 1-24.
22- Lu Q, Wang X, Lu S, Li M, Kaplan Dl, Zhu H. Nanofibrous Architecture of Silk Fibroin Scaffolds Prepared with a Mild Self-Assembly Process. Biomaterials 2011; 32(4): 1059-67.
23- Zahabi A, Shahbazi E, Ahmadieh H, Hassani Sn, Totonchi M, Taei A, et al. A New Efficient Protocol for Directed Differentiation of Retinal Pigmented Epithelial Cells from Normal and Retinal Disease Induced Pluripotent Stem Cells. Stem Cells Dev 2012; 21(12): 2262-72..
24- Qin X, Wu D. Effect of Different Solvents on Poly(Caprolactone)(Pcl) Electrospun Nonwoven Membranes. J Therm Anal Calorim 2012; 107(3): 1007-13.
25- Beachley V, Wen X. Effect of Electrospinning Parameters on the Nanofiber Diameter and Length. Mater Sci Eng C 2009; 29(3): 663-8.
26- Ko Ym, Choi Dy, Jung Sc, Kim Bh. Characteristics of Plasma Treated Electrospun Polycaprolactone (Pcl) Nanofiber Scaffold for Bone Tissue Engineering. J Nanosci Nanotechnol. 2015; 15(1): 192-5.
27- Shahmoradi S, Yazdian F, Tabandeh F, Hatamian AS. Investigation and Optimization of Effective Parameters in Fabrication of Scaffolds with Electrospinning for Using in Retina. Int J Anal Pharm Biomed Sci 2015; 4(7): 114-20.
28- Díaz E, Sandonis I, Valle Mb. In Vitro Degradation of Poly (Caprolactone)/Nha Composites. J Nanomater 2014; 2014: 185.
29- Qi H, Ye Z, Ren H, Chen N, Zeng Q, Wu X, et al. Bioactivity Assessment of Plla/Pcl/Hap Electrospun Nanofibrous Scaffolds for Bone Tissue Engineering. Life Sci 2016; 148: 139-44.
30- Zhou Zh, He Sl, Huang Tl, Liu Lh, Liu Qq, Zhao Ym, et al. Degradation Behaviour and Biological Properties of Gelatin/Hyaluronic Acid Composite Scaffolds. Mater Res Innov 2013; 17(6): 420-4.
31- Cummins Ka, Lee Kl, Cooper Ja. Quantification of Entrapped Model Protein Released during Electrospun Nanofiber Degradation. In: 2015 41st Annual Northeast Biomedical Engineering Conference, Nebec 2015; 2015: 1-2.
32- Gautam S, Dinda Ak, Mishra Nc. Fabrication and Characterization of Pcl/Gelatin Composite Nanofibrous Scaffold for Tissue Engineering Applications by Electrospinning Method. Mater Sci Eng C 2013; 33(3): 1228-35.
33- Thumann G, Viethen A, Gaebler A, Walter P, Kaempf S, Johnen S, et al. The in Vitro and in Vivo Behaviour of Retinal Pigment Epithelial Cells Cultured on Ultrathin Collagen Membranes. Biomaterials 2009; 30(3): 287-94.
34- Park Js, Kim JM, Lee Sj, Lee Sg, Jeong YK, Kim Se, et al. Surface Hydrolysis of Fibrous Poly(Ε-Caprolactone) Scaffolds for Enhanced Osteoblast Adhesion and Proliferation. Macromol Res 2007; 15(5): 424-9.
35- Mchugh Kj, Tao Sl, Saint-Geniez M. Porous Poly(Ε-Caprolactone) Scaffolds for Retinal Pigment Epithelium Transplantation. Investig Ophthalmol Vis Sci 2014; 55(3): 1754-62.
36- Abedalwafa M, Wang F, Wang L, Li C. Biodegradable Poly-Epsilon-Caprolactone (Pcl) for Tissue Engineering Applications: A Review. Rev Adv Mater Sci 2013; 34: 123-40.
37- Guo C, Cai N, Dong Y. Duplex Surface Modification of Porous Poly (Lactic Acid) Scaffold. Mater Lett 2013; 94: 11-4.
38- Sant S, Iyer D, Gaharwar Ak, Patel A, Khademhosseini A. Effect of Biodegradation and De Novo Matrix Synthesis on the Mechanical Properties of Valvular Interstitial Cell-Seeded Polyglycerol Sebacate–Polycaprolactone Scaffolds. Acta Biomater 2013; 9(4): 5963-73.
39- Gao J, Niklason L, Langer R. Surface Hydrolysis of Poly(Glycolic Acid) Meshes Increases the Seeding Density of Vascular Smooth Muscle Cells. J Biomed Mater Res 1998; 42(3): 417-24.
40- Heiduschka P, Zimmermann Ja, Plagemann T, Stafiej P, Himmler M, Fuchsluger Ta, et al. Cultivation and Characterisation of Primary Retinal Pigment Epithelium Cells on Nanofibre Scaffolds. Invest Ophthalmol Vis Sci 2019; 60(9): 3937.
41- Calejo Mt, Haapala A, Skottman H, Kellomäki M. Porous Polybutylene Succinate Films Enabling Adhesion of Human Embryonic Stem Cell-Derived Retinal Pigment Epithelial Cells (Hesc-Rpe). Eur Polym J 2019; 118: 78-87.
1- Martin Df, Maguire Mg, Ying Gs, Grunwald Je, Fine Sl, Jaffe Gj. Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration. N Engl J Med 2011; 364(20): 1897-1908.
2- Thomas Bb, Zhu D, Zhang L, Thomas Pb, Hu Y, Nazari H, et al. Survival and Functionality of Hesc-Derived Retinal Pigment Epithelium Cells Cultured as a Monolayer on Polymer Substrates Transplanted in Rcs Rats. Invest Ophthalmol Vis Sci 2016; 57(6): 2877-87.
3- Sorkio A, Porter Pj, Juuti-Uusitalo K, Meenan Bj, Skottman H, Burke Ga. Surface Modified Biodegradable Electrospun Membranes as a Carrier for Human Embryonic Stem Cell-Derived Retinal Pigment Epithelial Cells. Tissue Eng - Part A 2015; 21(17-18): 2301-14.
4- Pennington Bo, Clegg Do. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J Ocul Pharmacol Ther 2016; 32(5): 261-71.
5- Calejo Mt, Ilmarinen T, Jongprasitkul H, Skottman H, Kellomäki M. Honeycomb Porous Films as Permeable Scaffold Materials for Human Embryonic Stem Cell-Derived Retinal Pigment Epithelium. J Biomed Mater Res - Part A 2016; 104(7): 1646-56.
6- Zadeh Ma, Khoder M, Al-Kinani Aa, Younes Hm, Alany Rg. Retinal Cell Regeneration Using Tissue Engineered Polymeric Scaffolds. Drug Discov Today 2019; 24(8): 1669-78.
7- Shahmoradi S, Yazdian F, Tabandeh F, Soheili Zs, Hatamian Zarami As, Navaei-Nigjeh M. Controlled Surface Morphology and Hydrophilicity of Polycaprolactone Toward Human Retinal Pigment Epithelium Cells. Mater Sci Eng C 2017; 73: 300-9.
8- Ramakrishna S, Fujihara K, Teo We, Lim Tc, Ma Z. An Introduction to Electrospinning and Nanofibers. An Introduction to Electrospinning and Nanofibers 2005.
9- Carletti E, Motta A, Migliaresi C. Scaffolds for Tissue Engineering and 3d Cell Culture. Methods Mol Biol (Clifton, N.J.) 2011; 695: 17-39.
10- Strauss O. The Retinal Pigment Epithelium in Visual Function. Physiol Rev 2005; 85(3): 845-81.
11- Heller Jp, Martin Kr. Enhancing Rpe Cell-Based Therapy Outcomes for Amd: The Role of Bruch’s Membrane. Transl Vis Sci Technol 2014; 3(3): 11.
12- Jemni-Damer N, Guedan-Duran A, Cichy J, Lozano-Picazo P, Gonzalez-Nieto D, Perez-Rigueiro J, et al. First Steps for the Development of Silk Fibroin-Based 3d Biohybrid Retina for Age-Related Macular Degeneration (Amd). J Neural Eng 2020; 17(5): 55003.
13- You Y, Min Bm, Lee Sj, Lee Ts, Park Wh. In Vitro Degradation Behavior of Electrospun Polyglycolide, Polylactide, And Poly(Lactide-Co-Glycolide). J Appl Polym Sci 2005; 95(2): 193-200..
13- Christiansen At, Tao Sl, Smith M, Wnek Ge, Prause Ju, Young Mj, et al. Subretinal Implantation of Electrospun, Short Nanowire, And Smooth Poly(Ε-Caprolactone) Scaffolds to the Subretinal Space of Porcine Eyes. Stem Cells Int 2012; 1-8.
14- Ardan T, Zemanova L, Ellederova Z, Drutovič S, Studenovská H, Popelka S, et al. Nanofibrous Membranes Reveal Better Properties for Culturing of Rpe Cells in Comparison with Commercial Scaffolds. Acta Ophthalmol 2019.
15- Lin YY, Yang YP, Lai WY, Chien CS, Chen SJ, Hwang DK, et al. Development of Polydimethylsiloxane-Based Biomimetic Scaffolds with Cylinder Micropillars for Retinal Pigment Epithelial Cell Cultivation. J Chin Med Assoc 2020; 83(11): 1029-33.
16- Phelan Ma, Kruczek K, Wilson Jh, Brooks Mj, Drinnan Ct, Regent F, et al. Soy Protein Nanofiber Scaffolds for Uniform Maturation of Human Induced Pluripotent Stem Cell-Derived Retinal Pigment Epithelium. Tissue Eng Part C Methods 2020; 26(8): 433-46.
17- De Luca Ac, Terenghi G, Downes S. Chemical Surface Modification of Poly-Ε-Caprolactone Improves Schwann Cell Proliferation For Peripheral Nerve Repair. J Tissue Eng Regen Med 2014; 8(2): 153-63.
18- Kosorn W, Thavornyutikarn B, Janvikul W. Effects of Surface Treatments of Polycaprolactone Scaffolds on their Properties. Advanced Materials Res 2013; 747: 178-81.
19- Xiang P, Wu Kc, Zhu Y, Xiang L, Li C, Chen Dl, et al. A Novel Bruch’s Membrane-Mimetic Electrospun Substrate Scaffold for Human Retinal Pigment Epithelium Cells. Biomaterials 2014; 35(37): 9777-88.
20- Rahmani S, Tabandeh F, Faghihi S, Amoabediny G, Shakibaie M, Noorani B, et al. Fabrication and Characterization of Poly (Ε-Caprolactone)/Gelatin Nanofibrous Scaffolds for Retinal Tissue Engineering. Int J Polym Mater Polym Biomater 2018; 67(1): 27-35.
21- Jiang T, Carbone Ej, Lo Kwh, Laurencin Ct. Electrospinning of Polymer Nanofibers for Tissue Regeneration. Progress in Polymer Science 2015; 46: 1-24.
22- Lu Q, Wang X, Lu S, Li M, Kaplan Dl, Zhu H. Nanofibrous Architecture of Silk Fibroin Scaffolds Prepared with a Mild Self-Assembly Process. Biomaterials 2011; 32(4): 1059-67.
23- Zahabi A, Shahbazi E, Ahmadieh H, Hassani Sn, Totonchi M, Taei A, et al. A New Efficient Protocol for Directed Differentiation of Retinal Pigmented Epithelial Cells from Normal and Retinal Disease Induced Pluripotent Stem Cells. Stem Cells Dev 2012; 21(12): 2262-72..
24- Qin X, Wu D. Effect of Different Solvents on Poly(Caprolactone)(Pcl) Electrospun Nonwoven Membranes. J Therm Anal Calorim 2012; 107(3): 1007-13.
25- Beachley V, Wen X. Effect of Electrospinning Parameters on the Nanofiber Diameter and Length. Mater Sci Eng C 2009; 29(3): 663-8.
26- Ko Ym, Choi Dy, Jung Sc, Kim Bh. Characteristics of Plasma Treated Electrospun Polycaprolactone (Pcl) Nanofiber Scaffold for Bone Tissue Engineering. J Nanosci Nanotechnol. 2015; 15(1): 192-5.
27- Shahmoradi S, Yazdian F, Tabandeh F, Hatamian AS. Investigation and Optimization of Effective Parameters in Fabrication of Scaffolds with Electrospinning for Using in Retina. Int J Anal Pharm Biomed Sci 2015; 4(7): 114-20.
28- Díaz E, Sandonis I, Valle Mb. In Vitro Degradation of Poly (Caprolactone)/Nha Composites. J Nanomater 2014; 2014: 185.
29- Qi H, Ye Z, Ren H, Chen N, Zeng Q, Wu X, et al. Bioactivity Assessment of Plla/Pcl/Hap Electrospun Nanofibrous Scaffolds for Bone Tissue Engineering. Life Sci 2016; 148: 139-44.
30- Zhou Zh, He Sl, Huang Tl, Liu Lh, Liu Qq, Zhao Ym, et al. Degradation Behaviour and Biological Properties of Gelatin/Hyaluronic Acid Composite Scaffolds. Mater Res Innov 2013; 17(6): 420-4.
31- Cummins Ka, Lee Kl, Cooper Ja. Quantification of Entrapped Model Protein Released during Electrospun Nanofiber Degradation. In: 2015 41st Annual Northeast Biomedical Engineering Conference, Nebec 2015; 2015: 1-2.
32- Gautam S, Dinda Ak, Mishra Nc. Fabrication and Characterization of Pcl/Gelatin Composite Nanofibrous Scaffold for Tissue Engineering Applications by Electrospinning Method. Mater Sci Eng C 2013; 33(3): 1228-35.
33- Thumann G, Viethen A, Gaebler A, Walter P, Kaempf S, Johnen S, et al. The in Vitro and in Vivo Behaviour of Retinal Pigment Epithelial Cells Cultured on Ultrathin Collagen Membranes. Biomaterials 2009; 30(3): 287-94.
34- Park Js, Kim JM, Lee Sj, Lee Sg, Jeong YK, Kim Se, et al. Surface Hydrolysis of Fibrous Poly(Ε-Caprolactone) Scaffolds for Enhanced Osteoblast Adhesion and Proliferation. Macromol Res 2007; 15(5): 424-9.
35- Mchugh Kj, Tao Sl, Saint-Geniez M. Porous Poly(Ε-Caprolactone) Scaffolds for Retinal Pigment Epithelium Transplantation. Investig Ophthalmol Vis Sci 2014; 55(3): 1754-62.
36- Abedalwafa M, Wang F, Wang L, Li C. Biodegradable Poly-Epsilon-Caprolactone (Pcl) for Tissue Engineering Applications: A Review. Rev Adv Mater Sci 2013; 34: 123-40.
37- Guo C, Cai N, Dong Y. Duplex Surface Modification of Porous Poly (Lactic Acid) Scaffold. Mater Lett 2013; 94: 11-4.
38- Sant S, Iyer D, Gaharwar Ak, Patel A, Khademhosseini A. Effect of Biodegradation and De Novo Matrix Synthesis on the Mechanical Properties of Valvular Interstitial Cell-Seeded Polyglycerol Sebacate–Polycaprolactone Scaffolds. Acta Biomater 2013; 9(4): 5963-73.
39- Gao J, Niklason L, Langer R. Surface Hydrolysis of Poly(Glycolic Acid) Meshes Increases the Seeding Density of Vascular Smooth Muscle Cells. J Biomed Mater Res 1998; 42(3): 417-24.
40- Heiduschka P, Zimmermann Ja, Plagemann T, Stafiej P, Himmler M, Fuchsluger Ta, et al. Cultivation and Characterisation of Primary Retinal Pigment Epithelium Cells on Nanofibre Scaffolds. Invest Ophthalmol Vis Sci 2019; 60(9): 3937.
41- Calejo Mt, Haapala A, Skottman H, Kellomäki M. Porous Polybutylene Succinate Films Enabling Adhesion of Human Embryonic Stem Cell-Derived Retinal Pigment Epithelial Cells (Hesc-Rpe). Eur Polym J 2019; 118: 78-87.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




