دوره 28، شماره 8 - ( آبان 1399 )
جلد 28 شماره 8 صفحات 2921-2905 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Gouranlou F, Ziveh T. Review on Effect of Hemorrhages in Rescuing Casualties from Fatalities. JSSU 2020; 28 (8) :2905-2921
URL: http://jssu.ssu.ac.ir/article-1-5067-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5067-fa.html
گورانلو فریده، زیوه طیبه. اثر بندآورندههای خون درنجات مصدومین حوادث منجر به فوت. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (8) :2905-2921
متن کامل [PDF 1105 kb]
(1213 دریافت)
| چکیده (HTML) (2797 مشاهده)
متن کامل: (7915 مشاهده)
مقدمه
اغلب اولین انتخاب در هنگام خونریزی فشار مستقیم، متراکم ساختن (Compression) و یا استفاده از شریان بند (Toumiquet) است. با این حال ممکن است روشهای مکانیکی بهدلیل اختلالات انعقادی ذاتی (Coagulopathy) بیمار و زخم در محل نامناسب (گردن، زیر بغل و کشاله ران) کارآمد نباشد. روشهای حرارتی مانند لیزرها بهدلیل استفاده مکرر برای کاهش خونریزی، سبب سوختن ناحیه میشود. دارو درمانی نیز بهدلیل تداخلات دارویی میتواند مشکلاتی را ایجاد کند. در همین راستا بندآورندههای موضعی با هدف ارتقاء کارایی و سهولت در استفاده از آنها، وارد بازار شدند. این بندآورندهها به دو گروه کلی طبقهبندی میشوند: عواملی که بهروش بیولوژیکی فعال مانند ترومبین، چسبهای بیولوژیکی و سایر ترکیبات اقدام میکنند و گروه دوم عواملی هستند که از طریق تماس فعال شده و موجب افزایش تجمع پلاکتها میشوند. از این رو لازم است مکانیسمهای عملکرد، اثربخشی و عوارض جانبی احتمالی مربوط به هر عامل را به درستی بررسی کرد و با توجه به شرایط بالینی و وضعیت انعقاد خون بیمار میتوان مناسبترین بندآورنده را انتخاب نمود. امروزه خونریزی غیرقابل کنترل بخش گستردهای از آمار مرگ و میر در حوادث را شامل میشود. از اهداف اصلی در میان نظامیان و غیر نظامیان، درحوادث مختلف، حفظ جان بیمار از طریق توقف یا به حداقل رساندن خون از دست رفته است (1،2). بهعنوان مثال تصادفات جادهای هرساله 1/24 میلیون نفر را در دنیا به کام مرگ میکشاند و چنانچه اقدام مؤثری صورت نپذیرد این آمار تا سال 2020 به 1/9 میلیون خواهد رسید (3). در این میان تصادفات وسایل نقلیه چرخدار و موتوری بهعنوان حوادث مطرح و یکی از پیامدهای غیر قابل اجتناب حمل و نقل جادهای محسوب میشوند (4). مطالعهای در نیجریه نشان داده شد که میزان مرگ و مصدومیتهای ناشی از سوانح ترافیکی در موتورسیکلتسواران و سرنشینان آنها 8/7 برابر بیشتر از سرنشینان سایر وسایط نقلیه بود (5). اغلب این تلفات بهدلیل خونریزی شدید مجروحان، قبل از رسیدن به بیمارستان میباشد. در طی سالیان گذشته، روشهای متفاوتی جهت کنترل خونریزیهای شدید که مشکلات فراوانی برای بیمار بهوجود میآورد، بهکار رفتهاند. در تمدنهای باستانی، مصریان برای جلوگیری از خونریزی مخلوطی از موم، گریس و جو استفاده میکردند. در یونان باستان نیز کائنان و حکیمان از گیاهان بندآورنده بر روی زخمهای مجروحان جنگی استفاده میکردند (6،7). فاکتورهای متعددی برای توقف خونریزی با توجه بهروشهای مورد استفاده و شرایط فیزیولوژی بیمار وجود دارد که بهمنظور کاهش خونریزی، کاهش افت خون، اجتناب از خطرها و هزینههای مرتبط با تزریق خون در جهت کنترل خونریزی اتخاذ میشود. در این میان مواد بندآورنده موضعی که در اشکال مختلف موجود بوده و بهواسطه مکانیسمهای متفاوتی منجر به بند آوردن خون در کوتاهترین زمان ممکن و کمترین میزان تخریب بافت میشوند، از اهمیت بالایی در میان نظامیان و غیرنظامیان برخوردار است. موادی که بهعنوان بندآورنده خون به کار برده میشوند بر پایه پلیمرهای طبیعی نظیر: کلاژن، ژلاتین، اکسید سلولز، کیتین، کیتوسان و موادی بر پایه پلیآمینواسیدها و مصنوعی مانند: پلیسیانواکریلاتها (Poly cyanoacrylate)، پلیاکریلیکاسید (Poly acrylic acid) و پلیآلکیناکسیدها (Poly alkyiene oxide) میباشند (8). بسیاری از پیشرفتها در جهت کنترل خونریزی و تجاری شدن مواد بندآورنده موضعی در سال 2001 در درگیری میان نظامیان افغانستان و عراق معرفی شدند. در این سالها بیش از 52000 نفر از نظامیان ایالات متحده تلف شدند. بهمنظور کاهش این تلفات و عوارض ناشی از آن در سال 2003، مواد بندآورنده موضعی توسط کمیته مراقبتهای تاکتیکی (CoTccc: Committee Tactical combat casuaity care) مورد ارزیابی قرار گرفت و جهت استفاده در میادین نبرد تأیید شد (9،10،11). علیرغم این پیشرفتها، همچنان خونریزی عامل اصلی مرگ و میر در میان نظامیان و دومین عامل مرگ پس از آسیبدیدگی مغزی در میان غیرنظامیان میباشد (9،12،13). از دست دادن خون و بکارگیری روشهای متفاوت جهت جلوگیری از آن همواره یکی از دغدغههای بشر بوده است. چرا که با از دست رفتن 20 تا 25 درصد از حجم خون بسیاری از مکانیسمهای حیاتی بدن از کار افتاده و زمانی که مقدار خون از دست رفته به میزان 35 درصد از حجم کل خون میرسد، نوعی شوک در بدن ایجاد شده و بهدنبال آن اندامهای حیاتی انسان از کار میایستد. بنابراین صرفنظر از عامل ایجاد کننده خونریزی، انسان همواره بهدنبال بکارگیری روشهای متفاوت جهت بندآوردن خون در کوتاهترین زمان ممکن و کمترین عوارض ناشی از آن بوده است (8). اولین مکانیسم در بندآوردن خون هموستازی (Hemostasis) است. هموستازی یا قطع فیزیولوژیک خونریزی به مجموعه عوامل، کنشها و واکنشهایی اطلاق میگردد که نقش آنها توقف خونریزی از محل بریدگیها و آسیبهای رگی است. بهعبارتی هموستازی با تغییر حالت خون از مایع به جامد اولین مرحله از بهبود زخم میباشد. سیستم هموستازی را میتوان به چهار مرحله اصلی تقسیم نمود:
1. فاز عروقی (Vascular): بلافاصله پس از قطع یا پاره شدن یک رگ خونی، جدار آن منقبض میشود و همین امر باعث کاهش آنی جریان خون میشود. هر چه میزان آسیب به رگ بیشتر باشد، این انقباض نیز شدیدتر خواهد بود. انقباض موضعی رگ 20 دقیقه تا نیم ساعت ادامه دارد و در جریان آن تشکیل توده پلاکتی (Platelet plug) و انعقاد خون انجام میشود.
2. فاز پلاکت: پلاکتها در گردشخون زمانی که با سطوح آسیب دیده برخورد کنند فعال شده، شروع به تورم میکنند، شکل غیر منظم به خود گرفته و چسبناک میشوند و به فیبرینهای کلاژنی میچسبند و سبب تجمع پلاکتها و انسداد عروق میگردد. بهعبارتی توده پلاکت با فیبرین و اجزای سلولی (گلبول سفید و قرمز) مخلوط شده و بهمنظور کاهش میزان خون از دست رفته، بسترهای عروقی را مسدود میکند.
3. فاز انعقاد: سومین بخش از مکانیسم هموستازی تشکیل نهفته خون میباشد. که شامل مسیرهای ذاتی یا بیرونی و مشترک میباشد این مسیرها با فاکتور XII بر سطح آسیب دیده عروقی آغاز میشود و در حضور یون کلسیم و فاکتورهای دیگر، سبب تبدیل فیبرینوژن به فیبرین شده و لخته شکل میگیرد (14).
4. فاز تجزیه فیبرینی (Fibrinolytic): مرحله چهارم از هم پاشیده شدن فیبرین پس از عمل بندآوری خون میباشد. زمانی که بستر مویرگها مسدود شد (Sealed) و بندآوری اولیه کامل گردید، لازم است جهت برقراری مجدد جریان خون، لخته ایجاد شده از بین برود. از این رو با فعال شدن پلاسمینوژن و تبدیل آن به پلاسمین (Plasmin)، رشتههای فیبرین، فیبرینوژن و فاکتورهای V و VII هضم میشود و به عبارتی لخته حل میگردد (15،16). این فرایندها بهطور همزمان یا به سرعت و بهدنبال هم رخ میدهند، بهطوری که بلافاصله بهدنبال انقباض عروق، پلاکتها در محل زخم شروع به جمع شدن میکنند. آبشار انعقادی در عرض 10 تا 20 ثانیه پس از آسیب، فعال میشود. لخته خون اولیه در 1 تا 3 دقیقه تشکیل شده و فیبرین بهمنظور ایجاد لخته پایدار به فاصله 5 تا 10 دقیقه تولید میشود. مدیریت در شرایط خاص مانند خونریزی شدید، تنها به کنترل تیم پزشکی بستگی ندارد و نیاز بهپشتیبانی از راه حلهای جدید دارد که باعث کاهش یا کنترل خونریزی میشود. استفاده از بندآورندههای موضعی مناسب میتواند در این شرایط بسیار کارآمد و هدفمند باشد. ویژگیهای عوامل بندآورنده موضعی که بهصورت تجاری موجودند، شامل موارد زیر میباشد: سریع و مؤثر بودن در کنترل و یا توقف خونریزی، توانایی در ایجاد ارتباط مؤثر با سطح خونریزی کننده، عوارض جانبی (Adverse-event) کم، عدم سمیت و کاربرد آسان، آمادهسازی راحت، بهاشکال مختلف در دسترس بودن، قابل استفاده در انواع خونریزیها، سازگار با فیزیولوژی بدن، زیستسازگاری و غیره.
بندآورندههای تجاری بهطور کلی شامل :
1. بندآورندههای موضعی فعال (بیولوژیکی): این عوامل شامل ترومبین و محصولات ترکیبی حاوی ترومبین و مواد چسبنده به بافت ( نظیر: مسدود کنندهها و چسبها) میباشند. این بندآورندهها دارای فعالیت بیولوژیکی بوده و بهطور مستقیم در انتهای آبشار انعقادی موجب تحریک و تشکیل لخته میشوند.
2. بندآورندههای موضعی غیرفعال (مصنوعی): عوامل بندآورنده موضعی غیرفعال شامل کلاژن، سلولز و ژلاتین است. این عوامل با ایجاد ساختار شبکه مانند (Lattice-like) به محل خونریزی چسبیده و تجمع پلاکتها را افزایش میدهند. این بندآورندهها اغلب ساختار فیبر مانند متراکم، ظرفیت جذب بالا و دارای اشکال گوناگون ( نظیر: گاز، ورقه، پودر و اسفنج) میباشند (8).
3.بندآورندههای قابل جذب (Absorbable): بندآورندههایی هستندکه بهدلیل موقعیت قرارگیری آنها، باید برای مدت بیشتری در بدن باقی بمانند. لذا این محصولات باید زیستسازگاری (Biocompatibility) بسیار خوبی داشته باشند تا سبب پاسخهای ایمنی یا التهابی مزمن (Chronic inflammation) و یا عفونت نشوند. این بندآورندهها اغلب در عملهای جراحی در داخل بدن و یا مورد استفاده برای دندانپزشکان قرار میگیرند. محصولات قابل جذب مورد تأُیید سازمان غذا و داروی آمریکا (FDA: Food and Drug Administration) میباشند و شامل چهار ماده مشخص است: اسفنج ژلاتینی قابل جذب – اکسید سلولز – اکسید سلولز بازیابی شده (ROC: Regenerated oxidized cellulose) میکروفیبریلهای کلاژن (Microfibrillary Collagen) (17،18). در میان این دستهبندیها، CoTccc این عوامل را به 3 دسته کلی تقسیم میکند (19،20). که شامل موارد زیر میباشند:
1. نسل اول
این نسل از بندآورندهها در سال 1900 توسط وزارت دفاع آمریکا، ارزیابی شد و سپس در سال 2003 برای استفاده در میدان نبرد میان نظامیان، مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت (21). بندآورندههایی که از این نسل میباشند شامل:
Fibrin Sealant
اولین نسل از بندآورندههای موضعی هستند. درزگیرهای فیبرین (چسب فیبرین) برای اولین بار در سال 1909 در اروپا، مطرح شدند. این مطالعات در سال 1940 پس از استخراج ترومبین خالص، از سر گرفته شد و استفاده از آن در طول جنگ جهانی اول برای کنترل خونریزی متداول شد (7،22). درزگیر فیبرین شامل فیبرینوژن لیوفیلیزه (lyophilized) شده انسان و گاو یا ترومبین انسانی است که گاهی حاوی فاکتور انعقادی غلیظ XIII و آپروتینین (aprotinin) نیز میباشد. فاکتور XIII آنزیمی است که در حضور یونهای کلسیم (عامل تثبیت کننده فیبرین) توسط ترومبین فعال میشود. پس از فعالشدن، فاکتور XIII اتصالات متقابل بین زنجیرههای فیبرین را ایجاد شده و تشکیل لخته را تثبیت میکند. این پانسمانها بهعنوان قدیمیترین نوع بندآورنده موضعی خونریزی هستند که محصولات مختلفی از آنها (با غلظتهای متفاوت از ترکیبات) در بازار وجود دارند. Tisseal یکی از محصولات این پانسمان است، که در سال 1980 در ایالات متحده آمریکا، پس از اثبات کارایی آن، برای استفاده در انسان تصویب شد (23). مکانیسم عمل این پانسمانها بیولوژیکی بوده و بهطور مستقیم در انتهای آبشار انعقادی موجب تحریک و تشکیل لخته میشوند. ترومبین، فیبرینوژن را به مونومرهای فیبرین تبدیل میکند تا یک ماتریس محلول را تشکیل دهد. ترومبین همچنین عامل XIII را به فاکتور XIIIa فعال میکند، که بهصورت کووالانسی ماتریس محلول فیبرین را به هم متصل میکند تا یک لخته پایدار تشکیل شود. هر دو مرحله به حضور یونهای کلسیم نیاز دارند (24). آپروتینین موجود در این محصولات یک مهار کننده پروتئاز (از بافت ریه گاو) است که باعث جلوگیری از تشکیل تریپسینین (trypsinin)، پلاسمین (plasmin) و کالیکرینها (kallikreins) میشود و لیز شدن لخته پلاسمین را به تاخیر میاندازد. محصولات درزگیر فیبرین در بافت پاسخ التهابی یا نکروز ایجاد نمیکنند، همچنین در موارد اختلال انعقادی مؤثر هستند، اما بهدلیل گران بودن، محصولات دیگر جایگزین آنها شدند (7،25).
Dermabond- Omnex
این پانسمانهای بندآورنده خونریزی مبتنی بر سیانوآکریلات (Cyanoacrylate) هستند. یکی از اولین موارد استفاده از پلیمرها برای بندآوردن خون سیانوآکریلاتها هستند که در گروه عوامل سنتزی طبقهبندی شدهاند. سیانوآکریلاتها مونومرهای مایع هستند که در حضور آب به سرعت پلیمر (یونهای هیدروکسیل) تشکیل میدهند و سطوح مجاور را بهیکدیگر متصل میکنند. سیانوآکریلات در سال 1942 توسط شیمیدان معروف هری کوور (Harry Coover) تهیه شد (7،26). این محصول بهعنوان چسب و داروی بندآورنده موضعی خونریزی در جنگ ویتنام، برای کنترل خونریزی زخمهای باز در سربازان، در مدت زمان انتقال آنها به بیمارستان استفاده میشد. اتیل سیانوآکریلات در اثر تجزیه، محصولات جانبی سمی نظیر سیانواستات و فرمالدهید تشکیل میدهد. از اینرو سبب التهاب مداوم شده و بهبود زخم را به تعویق میاندازد. Dermabond محصولی که با تجزیه آهستهتر (2-اکتیل سیانوآکریلات) برای کنترل خونریزی به بازار آمد و توسط سازمان غذا و داروی آمریکا تأیید شد. این پانسمان حداکثر 2 تا 5 دقیقه بعد از استفاده خونریزی را کنترل میکند. اگرچه این محصول نتایج خوبی را دنبال داشت، اما استفاده از آن خطر ترمبوز (Thrombosis) را بهدنبال داشت (27،28). بعد از آن Omnex، محصول دیگری مبتنی بر سیانوآکریلات، به بازار عرضه شد. ایمنی و اثربخشی این محصول بهمراتب بیشتر از Dermabond است. Omnex علاوه بر بندآوری سریع خونریزی، عملکردی مستقل از سیستم انعقادی را دارد. پانسمانهای مبتنی بر سیانوآکریلات برای زخمهای نزدیک به بافت، مفاصل، دست یا پا و یا برای ترمیم سطوح مخاط ضعیف شده قابل استفاده نیستند (7،29).
BioGlue
بندآورنده نسل اول است. پانسمان BioGlue از گلوتارآلدئید (Glutaraldehyde) و محلول آلبومین (Albumin) گاوی تهیه شده است. این پانسمان در سال 1999 برای استفاده در انسان تصویب شد. BioGlue بهصورت تجاری در یک سرنگ با دو محفظه جداگانه قرار دارد که برای استفاده و در زمان کاربرد با یکدیگر مخلوط میشوند. این پانسمان در طی 20 ثانیه چسبندگی ایجاد کرده و 65% قدرت اتصال دارد. BioGlue در 79 عمل جراحی قلب مورد استفاده قرار گرفت که در 78 مورد از آن موفقیتآمیز بود. یک گروه اتریشی تحقیقاتی درباره پانسمان BioGlue انجام دادند و نتیجهگیری شد، این پانسمان قدرت اتصال خوب دارد، اما زیستسازگاری پایین (سمیت سلولی) را نشان داد. آنها همچنین فعالیت التهابی مداوم را در بیماران مشاهده کردند. بنابراین از استفاده از این محصول حمایت نشد (30،31،32).
FloSeal
یکی از اولین بندآورندههای نسل اول FloSeal که مبتنی بر ژلاتین است. ژلاتین اولین بار در سال 1945 بهعنوان یک ماده بندآورنده خونریزی به بازار معرفی شد. ژلاتین از کلاژن حیوانی (خوک، گوسفند یا اسب) تهیه و ساخته میشود. در این نوع از بندآورندهها پیشرفتهای کمی در شکل و ترکیب آن وجود دارد. اگرچه مکانیسم عملکردی مشخصی ندارد، اما تحقیقات نشان داده است که بیشتر از لحاظ شیمیایی بر روی آبشار انعقادی تأثیر دارد. در نتیجه ژلاتینها بهعنوان یک ماتریس فیزیکی برای شروع لخته مؤثر هستند. از ماتریس ژلاتین میتوان به اشکال مختلف اسفنج و پودر استفاده کرد. یک خاصیت مهم در اشکال مختلف ژلاتین، توانایی جذب بیش از 40 برابر وزن خود، خون و مایعات است. گسترش حجم این محصول تا 200٪ در داخل بدن است. این بدان معنی است که حجم محصولات مبتنی بر ژلاتین بیشتر از بندآورندههای موضعی بر اساس کلاژن و سلولز اکسیده شده بازسازی شده، افزایش مییابد. این محصول در سال 1999 مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت (33،34،35).
Microfibrillary Collagen
بندآورندههای موضعی میکروفیبردار کلاژن (TMC:Topical Microfibrillar Collagen) در دهه 1970 توسعه یافته و به بازار عرضه شده است. این بندآورنده با استفاده از کلاژن گاو، اسب یا بز تولید میشود. اولین بار با نام تجاری Avitene first، بهصورت پودر در بازار عرضه شد. محصولات مبتنی بر کلاژن مؤثرتر از محصولات مبتنی بر ژلاتین هستند. محصولات مبتنی بر کلاژن مسیر ذاتی آبشار انعقادی را فعال میکنند، در حالی که بندآورندههای مبتنی بر ژلاتین باعث بهوجود آمدن هموستاز از طریق خواص فیزیکی میشوند. در برخی از آزمایشات بالینی، بندآورندههای موضعی میکروفیبردار کلاژن نسبت به سلولز اکسیده شده، برتر بودند و از نظر آماری کاهش قابلتوجهی در از دست دادن خون نشان میدهند (36،37).
QuikClot (QC)
از محصولات نسل اول که به تایید CoTccc رسیده و با جذب سریع آب کار میکند، QuikClot (QC) میباشد. ماده اصلی این محصول زئولیت است. زئولیت یک ماده معدنی آتشفشانی بیاثر است و عمدتاً از آلومینوسیلیکاتها (شبکه بلوری شامل اکسیژن، آلومینیوم و سیلیس) با ساختمان سهبعدی تشکیل شدهاند (20). زئولیت یک جاذب سطحی است که به سرعت در واکنش گرمازایی، آب را جذب میکند و این خاصیت، سبب سوزش شدید زخم میشود. QC شامل دانههایی است که در داخل زخم در حال خونریزی ریخته میشود. از این رو برداشتن آن پس از قطع خونریزی از روی زخم بسیار مشکل است. QC جدیدتری که بعد از آن وارد بازار شد، استفاده از کیسههایی مخصوص بهعنوان پوشش برای دانههای زئولیت بود که کاربرد مؤثری در بندآوری خونریزیهای عمیق داشته و هنگام شستشوی زخم، به راحتی از زخم جدا شده و زخم ترمیم میشود. بهطور کلی زئولیت موجود در QC، یون کلسیم را آزاد میکند و از طریق واکنش تبادل کاتیون، سدیم و پتاسیم، زئولیت در هنگام تماس با خون، آب خون را جذب میکند و زمان تشکیل لخته را کوتاه میسازد. مکانیسم مهم اثربخشی در بندآورندهای موضعی زئولیتی تبادل کاتیونی در آنها میباشد. در یک گزارش ارائه شده کنترل با QC، از 103 نفر مجروح تحت درمان، 83 نفر از آنها دارای خونریزی از زخمهای خارجی و 20 نفر خونریزی داخل بدن بهدلیل جراحی بوده است. کنترل خونریزی در 92 % از بیماران موفقیتآمیز بوده و تنها در مورد 8 نفر از مصدومان، ناکارآمد بود. با این حال گرمای ایجاد شده در هنگام درمان سبب ایجاد درد و ناراحتی شدید (و گاهی خفیف) میشود و 3 مورد سوختگی ناشی از گرمای ایجاد شده توسط QC گزارش شد که حتی یک مورد از آنها +طی این گزارشات و پژوهشهای انجام شده، گرمای تولید شده توسط QC را حتی تا 80 درجه سانتیگراد مشاهده کردند و نتیجهگیری شد که QC میزان خونریزی را کاهش میدهد اما نمی تواند آن را بهطور کامل متوقف کند (38،39). QuikClot ACS، محصول جدیدتر که بعد از QC بهمنظور ارتقاء آن به بازار ارائه شد. QuikClot ACS میزان خونریزی را کاهش داد اما نمیتوانست آن را بهطور کامل متوقف و گرما را کنترل کند. جانشین این دو محصول، Quik Clot ، بهمنظور به حداقل رساندن مشکل گرما بود. در این محصول، زئولیتهای هیدراته شده در پانسمانهای اسفنجی بستهبندی شدند. در اثر این بهینهسازی، کارآیی بندآوری کاهش یافته و هزینه تولید بالاتر رفت و در نتیجه به دلایل فوق قابلیت استفاده در میادین نبرد را از دست داد (40). کلینوتپیلولیت (Clinoptilolite)، نوعی زئولیت است که برای اولین بار توسط بایر (Bayir) و همکارانش مورد آزمایش قرار گرفت و تأثیر آن به همان اندازه زئولیت های آتشفشانی بود، بدون آنکه باعث افزایش دما شود (41). تحقیقات جدید در مورد نمونههای جدید تر زئولیت باید حمایت شوند زیرا این دسته از بندآورندههای موضعی با هزینه کم و آسانتر تولید میشود.
HemCon(HC)
یکی دیگر از محصولات نسل اول که با بودجهای مستقیم که توسط ارتش آمریکا در سال 2003 ساخته شد. و در دستورالعمل CoTccc بود. HemCon (HC)، از کیتوسان و واحدهای تکراری کیتین تهیه شده است که یک پلیساکارید زیستسازگار طبیعی و بینظیر از پوسته میگو است. اهمیت کیتین در چند مورد میباشد:
1. سازگاری زیستی با بقیه مواد
2. قابلیت هضم آسان
3. غیرسمی بودن
4. قدرت جذب بالا
5. در دسترس بودن
در نوع پانسمانHC ، با بار مثبت جذب گلبولهای قرمز خون با بار منفی شده است و این چسبندگی سبب قطع خونریزی میشود. کیتوسان هیچ خاصیت انعقادی ذاتی ندارد بنابراین مستقل از آبشار انعقادی عمل میکند و اجازه میدهد مکانیسم انعقادی طبیعی بدن همراه با مکانیسم HC اتفاق بیوفتاد و خونریزی سریعتر متوقف شود (20،42). در یک پژوهش انجام شده بر روی 66 مورد از بیمارانی که بر اثر خونریزی خارجی از پانسمان HC استفاده کردند، در 97% از موارد منجر به قطع کامل یا کاهش خونریزی شد و عدم موفقیت در 3% آن بهدلیل وجود زخمهای بسیار عمیق بود. استفاده از این پانسمان در بیمارانی که داروهای ضدانعقاد مصرف میکردند نیز همین نتیجه را داد و عوارض جانبی برای آنها ثبت نشد. لخته شدن و قطع خونریزی بدون هیچگونه گرما در بافت ایجاد شد. تنها نگرانی برای استفاده از محصولات مبتنی بر کیتوسان در بیماران حساس به سختپوستان (میگو) میباشد. طی مطالعهای که وایبل (Waible) و همکارانش در سال 2011 روی افراد حساس به سخت پوستان انجام دادند در هیچکدام از این افراد واکنش آلرژیک به این ماده گزارش نشد. این بررسی در مورد پانسمانهای کیتوسان دلگرم کننده است اما قطعی نمیتواند باشد (43).
Dry Fibrin Sealant (DFS)
پانسمان درزگیر فیبرین خشک یا DFS با همکاری مشترک بین صلیب سرخ و ارتش آمریکا در سال 2003 تهیه شد و بهصورت آزمایشی برای مجروحان جنگی، در جنگ عراق و افغانستان استفاده شد. این پانسمان حاوی پودر فیبرینوژن، ترومبین، فاکتور XIII و کلسیم میباشد و بالابردن غلظت فاکتورهای انعقادی، انعقاد را افزایش میدهد. ولی با وجود استریل کردن این پانسمان، عملاً خطر انتقال ویروسی از بین نمیرود. اگرچه پانسمان DFS در استفاده اولیه خود در میدان نبرد موفقیتآمیز بود اما بهدلیل هزینه بالای تولید و کارآیی پایین آن، محصولات بندآورنده موضعی دیگر جای آن را گرفتند (7،20،44).
Rapid Deployable Hemostat (RDH)
از اولین بندآورندههای موضعی خون است. این پانسمان از جلبک دریایی تهیه شده است. از طریق فعالسازی پلاکتها و پیوندهای متقاطع گلبولهای قرمز خون، خونریزی را کنترل میکند. این محصول نتوانست مورد تأیید سازمان غذا و داروی آمریکا قرار بگیرد.
در سال 2003 CoTccc پانسمانهای نسل دوم را جایگزین این محصولات کرد.
2. نسل دوم
بندآورندههایی که بعد از سال 2003 مورد تایید سازمان غذا و داروی آمریکا قرارگرفت، بعنوان بندآورندههای نسل دوم شناخته شدند که به وضوح مؤثرتر و کاربردی تر از محصولات پیش تولید شده بودند (20). از این نسل میتوان به موارد زیر اشاره کرد:
Celox (CE)
یکی از محصولات نسل دوم که مبتنی بر کیتوزان است. کیتوزان به مجموعهای از پلیمرهای مشتق شده از کیتین (پوسته سختپوستان) اشاره دارد. این پلیمر، کربوهیرات پیچیدهای است که تجزیهپذیر میباشد. کیتوزان در بدن بهاجزای گلوکزآمین و N-استیل گلوکزآمین تجزیه میشود. کیتوزان همانطور که در قبل گفته شد خاصیت بندآوری ذاتی ندارد بنابراین مستقل از مکانیسم های انعقاد فیزیولوژیکی بدن کار می کند. کیتوزان با تعامل الکترواستاتیک مستقیم بین غشای سلولی و گلبول قرمز با بار منفی و کیتوزان با بار مثبت عمل میکند. اگرچه کیتوزان در اصل یک ماده قابل جذب در بدن است، اما پودر بندآورنده CE قابل جذب نیست. بنابراین قبل از بهبود زخم باید از روی محل زخم برداشته شود. بسیاری از مطالعات بالینی نسل دوم، برتری محصولات Celox را در مقایسه با گاز و سایر موارد گزارش میدهند (20،45،46) محصولات دیگری بر همین پایه بهمنظور بهبود کارآیی ارائه شده است که در نسل سوم محصولات طبقهبندی میشود.
Combat Gauze (CG)
این پانسمان از بندآورندههای موضعی نسل دوم و اولین گاز بندآورنده خونریزی مبتنی بر مواد معدنی است. CG، یکپارچه نرم قابل انعطاف از ریون و پلی استر آغشته به کائولن میباشد. کائولن یک سنگ رس سرشار از کائولینیت(Kaolinite) است. دارای سطح قطبی با بار اندک منفی است که نقش مهمی در تحریک مسیر داخلی آبشار انعقادی ایفا میکند. در نتیجه یک فعال کننده مسیر ذاتی میباشد. پانسمان CG، قابل جذب توسط بدن نبوده، بنابراین قبل از ترمیم کامل زخم، باید از آن خارج شود. حذف CG به راحتی انجام میشود و نیاز به مراحل خاصی ندارد (47). محصول جدیدتر از CG در سایز بزرگتر وارد بازار شده است که در دسته قسمت نسل سوم قرار میگیرد.
Wound Stat (WS)
یکی دیگر از محصولات نسل دوم است. یک محصول تجاری حاوی خاک رس و گروه اسمکتیت (Smectite) است. این بندآورنده موضعی توانایی متوقف کردن خونریزی را همزمان با متمرکز کردن فاکتورهای انعقادی بهمنظور ایجاد لخته و شروع مسیر ذاتی انعقادی دارد. WS در مطالعات حیوانی بهعنوان سریعترین و مؤثرترین محصول بندآورنده خونریزی ثابت شده است. با این حال علیرغم توقف سریع خونریزی صدماتی را به رگ ایجاد میکند و باعث انسداد و ترمبوز میشود. بهدلیل همین مسائل در سال 2009 توسط سازمان غذا و داروی آمریکا به حالت تعلیق درآمد (48،49).
Gelitacel – Fibrilla
از بندآورندههای نسل دوم است. این بندآورنده خونریزی متشکل از سلولز بازسازی شده اکسید شده (ROC) میباشد. سلولز ساده اکسیده شده اولین بار در سال 1942 در ایالات متحده آمریکا مطرح و در سال 1960 با تولید اولین نسل از آن بنام Surgicel وارد بازار شد. پانسمانهای ROC تنها پانسمانهایی هستند که از عناصر انسانی یا حیوانات گرفته نشده و منشاء گیاهی دارند. بنابراینROC یک بندآورنده موضعی است که توسط بازسازی سلولز خالص در روی پارچه درهم تنیده (پنبه) تولید میشود و دوباره اکسیده میشود. این محصولات با فعالسازی آبشار انعقادی، خونریزی را کنترل میکنند. واحد عملکردی این پانسمانها اسید آنهیدروگلوکورونیک (anhydroglucuronic acid) است. ماهیت اسیدی ROC میتواند روند التهابی موضعی را افزایش داده و روند بهبودی طبیعی را به تاخیر بیاندازد. هر دو شکل تجاری این پانسمانها نباید از مصرف در محیط آبی قرار بگیرد زیرا خاصیت بندآوردن خونریزی آن از بین میرود (7).
3. نسل سوم
بندآورندههایی که از سال 2008 به بعد بهمنظور کارآیی بیشتر مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت و وارد بازار شدند از این نسل میباشند. در نسل سوم تعدادی از محصولات بهینه شده و بهبود کارآیی نسل دوم میباشد از جمله CGX (Combat Gauze XL) که مصول جدیدتر از CG با سایز بزرگتر و جرم تقریباً دو برابر آن میباشد. از دیگر محصولات این نسل میتوان به موارد زیر اشاره کرد:
Salmon Thrombin – Fibrinogen (STF)
یکی از محصولات نسل سوم است. پانسمان STF حاوی مخلوط اختصاصی ترومبین سالمون لیوفیلیزه (خشک کردن انجمادی در خلاء) و فیبرینوژن است. این مخلوط روی یک پانسمان محلول در آب حاوی دکستران (یک کمپلکس کربوهیدرات است) میباشد. عملکرد STF مشابه به ترومبین انسانی و فیبرینوژن است. پانسمان STF مستقیماً روی رگ در حال خونریزی قرار میگیرد و بلافاصله پس از تماس با خون اجازه میدهد تا هیدراتاسیون ترومبین و فیبرینوژن انجام شود که منجر به تشکیل لخته فیبرین میشود. پروتئینهای مورد استفاده در پانسمانهای STF ارزان بوده، به راحتی در مقادیر زیاد در دسترس هستند، برای مدت طولانی در محیط پایدارند و بیماری را انتقال نمیدهند. ولی با این وجود از زمان DFS (نسل اول پانسمان های فیبرین) نگرانیهایی را برای انتقال بیماری بهدنبال دارند. STF در حال حاضر مورد تایید سازمان غذا و داروی آمریکا نمیباشد (20،50،51).
Mini Sponge Dressing (MSD)
مینی پانسمان اسفنجی (MSD) یک پانسمان جدید از نسل سوم میباشد. این پانسمان با استفاده از وزن سبک، در درون زخم استفاده میشود. MSD اسفنجهای کوچک استوانهای از جنس سلولز هستند که با کیتوزان فشرده شدهاند. این اسفنجهای کوچک قادر به جذب خون تا چندین برابر وزن خود هستند. پانسمانهای MSD با نام XStat به بازار عرضه شدند. این محصول بندآورنده خونریزی مبتنی بر کیتوزان در سال 2014 به تصویب سازمان غذا و داروی آمریکا رسید. XStat برای استفاده در میدان نبرد برای زخمهای ناشی از شلیک گلوله و یا در بیمارستان برای غیرنظامیان در نظر گرفته شده است. این پانسمان را میتوان برای استفاده در حوادث بیابان و زخمهای عمیق ناشی از حمله حیوانات وحشی، اثبات کمان، تبر و سایر موارد نیز در نظر گرفت. این پانسمان برای کنترل خونریزی در زخمهای باریک و قسمتهای اتصالی بدن استفاده میشود. نتایج نشان داد که MSD در مقایسه با CG (کاهش خونریزی) در دستیابی به هموستازی بسیار مؤثر است (52).
Modified Rapid Deployable Hemostat (mRDH)
از پانسمانهای نسل سوم است. این پانسمان بندآورنده خونریزی از جلبک دریایی و نانوالیاف N-استیل گلوکزآمین تشکیل شده است (20).
Ankaferd Bloodstoppe (ABS)
ABS بندآورنده نسل سوم که مبتنی بر مخلوط عصاره گیاهان میباشد. آنکافرد (Ankaferd) یک داروی گیاهی سنتی است که قرنها در آناتولی بهعنوان یک عامل بندآورنده خونریزی مورد استفاده قرار میگرفت. آنکافرد ترکیبی استاندارد از گیاهان Thymus vulgaris ، Glycyrrhiza glabra ، Vitis vinifera ، Alpinia officeinarum و Urtica dioica است که هر کدام از این گیاهان اثراتی روی اندوتلیوم، سلولهای خونی، تکثیر سلولی و عروق دارند. مکانیسم عملکرد ABS مستقل از سیستم بیولوژیکی بدن میباشد. تشکیل پروتئینی ناشی از ABS، سبب تجمع گلبولهای قرمز شده و کمک به لخته شدن خون و کنترل خونریزی میکند. بندآورنده ABS در ترکیه به تصویب رسیده و مناسب برای خونریزی دستگاه گوارش میباشد (53،54).
TraumaDex – BleedArrest
این پانسمانهای بندآورنده خونریزی از نسل سوم میباشند. هر دو پانسمان از مشتقات نشاسته هستند و بهعنوان بندآورندههای موفق شناخته میشوند. محصولات مبتنی بر نشاسته اولین بار در اکتبر سال 2002 مطرح شدند. محتویات این پانسمانها از نشاسته سیبزمینی خالص تهیه شده است. ذرات بسیار ریز این بندآورنده همانند یک اسفنج عمل میکند و آب و پلاسمای خون را در خود جذب میکند. انعقاد فوری در سطح زخم ایجاد میشود و بهدنبال آن فرآیندهای لخته شدن خون بهصورت طبیعی انجام میشود. این محصولات مورد تأیید اداره غذا و داروی آمریکا هستند. اما در جبهههای نبرد کاربردی ندارند (55). محققان میگویند یکی دیگر از مزایای این پودر علاوه بر ارزان بودن این محصولات، باعث ایجاد واکنشهای آلرژیک نمیشوند، همان کاری که بندآورندههای مبتنی بر کلاژن و پروتئینهای حیوانی در برخی بیماران انجام میدهند. محقق برجسته، مارک اچ. اورت (Mark H. Ereth) در مقالهای نوشت: "هیچکدام از محصولات بندآورنده موضعی خونریزی که در طول 40 سال گذشته تولید شده است، به اندازه این پانسمانها عوارض جانبی کمی را نداشته اند" (56).
CoSeal
CoSeal از بندآورندههای نسل سوم که از پلیمر کاملاً مصنوعی تهیه شده است. این پانسمان از مخلوط دو پلیاتیلنگلیکول (Polyethylene glycol) روی بستری قابلجذب حاصل میشود. پلیاتیلنگلیکول سبب جذب آب تا چند برابر اندازه اصلی خود میباشد. CoSeal از طریق تعامل با بافت انسان فعالشده و سبب جذب آب و کنترل خونریزی میشود. از این پانسمان جراحان برای کنترل خونریزی در آناستوموزهای عروقی (Circulatory anastomosis) استفاده میکنند. CoSeal بسیار انعطافپذیر بوده و حدود چهار هفته توسط بدن قابل جذب میباشد. پلیاتیلنگلیکول یک بندآورنده خونریزی مؤثر برای جراحیهای قلبی و عروقی است که در آن افزایش حجم پانسمان جای نگرانی ندارد. CoSeal برای جلوگیری از چسبندگی پریکارد در بیمارانی که ممکن است نیاز به تجدید عمل جراحی داشته باشند، بهویژه در کودکانی که از بیماری مادرزادی قلبی برخوردار هستند، مفید است. مهمترین مزیت CoSeal در سرعت بند آوردن خونریزی میباشد (7،57).
Evithrom – Recothrom
پانسمانهای بندآورنده خونریزی از نسل سوم میباشند. این پانسمانها متشکل از ترومبین هستند. ترومبین یک آنزیم طبیعی است و نقشهای مهمی در هموستاز، التهاب و سیگنالینگ سلولی (Cell signaling) دارد. ترومبین از پروترومبین، در نتیجه فعالشدن مسیرهای انعقادی ذاتی و بیرونی تشکیل شده است و با تبدیل فیبرینوژن به فیبرین تشکیل لخته فیبرین را تقویت میکند. ترومبین بیش از 60 سال بهعنوان کمکی برای هموستاز موضعی استفاده میشود. تا همین اواخر، تنها ترومبین تجاری موجود از پلاسمای گاو (Thrombin-JMI) حاصل میشد. اگرچه Thrombin-JMI ابزار مناسبی برای متوقف کردن خونریزی بوده است، اما شواهد نشان میدهد که ترومبین گاو علاوه بر ایجاد پاسخ ایمنی مهم، افزایش بروز ترومبوز و انعقاد شدید را به همراه دارد. محصولات جدید مبتنی بر ترومبین موضعی در سال 2007 و 2008 از منابع غیر گاوی شامل ترومبین مشتق از پلاسما انسان و ترومبین نوترکیب انسانی تهیه و مورد تأیید سازمان غذا و داروی ایالات متحده آمریکا قرار گرفت. محصولات Evithrom و Recothrom موجود در بازار، نیز از ترومبین نوترکیب انسانی تهیه شدهاند (58،59).
QuikClot Combat Gauze (QCG)
محصول جدید از نسل سوم است. این محصول یک گاز جراحی میباشد که با کائولین پوشانده شده است. کائولین یک ماده معدنی بی اثر از سیلیکات آلومینیوم و یک فعال کننده در مسیر لخته شدن ذاتی میباشد. کائولن با افزایش فعالسازی فاکتورهای XII و XI در هنگام تماس با اندوتلیوم آسیب دیده از طریق آبشار انعقادی، لخته شدن خون را آغاز میکند. این پانسمان زیستتخریبپذیر نیست بنابراین باید قبل از اتمام ترمیم قطعی، از زخم خارج شود. QCG در سال 2008 توسط CoTCCC مورد ارزیابی قرار گرفت و در سال 2013 توسط سازمان غذا و داروی آمریکا برای استفاده موضعی مورد تأیید قرار گرفت. در تحقیقاتی که توسط ران (Ran) و همکارانش انجام شد، 79% اثربخشی این محصول در بندآوری خون را نشان داد. با توجه به اینکه این پانسمان برخلاف QC افزایش دما را در زخم همراه ندارد، برای کنترل خونریزی توصیه میشود (60).
Cellulose – Halloysite Hemostatic Nanocomposite Fibers (CHNFs)
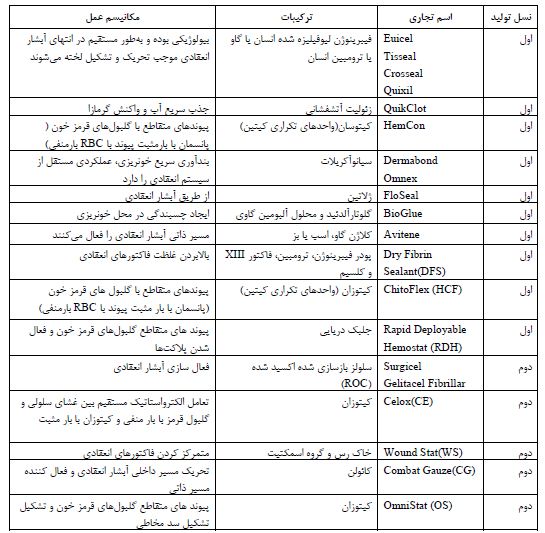
نسل جدید از بندآورندههای موضعی CHNFها میباشند. CHNFها، بندآورندههای خونی الیاف نانوکامپوزیتی سلولز و هالوسیت با عملکرد بالا میباشند. هالوسیت نوعی خاک رس معدنی است که از نظر شیمیایی مشابه کائولینیت بوده و دارای ویژگیهای منحصر بفردی مثل استحکام بالا، آسان پخش شدن در ماتریکس انواع پلیمرهای عایق و رسانا و مهمتر از اینها فراوانی و سازگار بودن آن با محیط زیست میباشد. CHNFها بعد از شستشو عملکرد لخته شدن را دو برابر حفظ میکنند. این در صورتی است که QCG پس از شستشو فعالیت خود را از دست میدهد. این ثبات ذاتی CHNFها برای متوقف کردن خونریزیهای آسیبزای خارجی در میدان جنگ و در اتاق عمل بسیار مهم است زیرا جریان مداوم خون عملکرد QCG را تا 75% کاهش میدهد. از آنجا که هالوسیت نسبت به خاک رس کائولن، 4/2 برابر سریعتر پلاسمای خون را منعقد میکند، این بندآورندهها از برتری بیشتری در برابر QCG برخوردار هستند. از آنجا که این نانوکامپوزیت غیر سیتوتوکسیک (Cytotoxic) (سیتوتوکسیک عواملی هستند که بهطور مستقیم سلول را نابود مینمایند بهطوری که بر مراحل مختلف سنتز و فعالیت اسیدهای نوکلئیک اثر میگذارند و تقسیم سلولی را مهار میکنند) بوده و زمان انعقاد آن بسیار کم است، میتواند بهعنوان یک ناجی برای بیماران تروما (افراد نظامی، بیماران تحت عمل جراحی، درمان خونریزی غیرمنتظره در بیماران دارای اختلال ارثی لخته شدن خون) استفاده شود (61،62). شرح مختصری از مشخصات مربوط به پانسمانهای بندآورنده خونریزی نسل اول، دوم و سوم مربوط به مطالعات انجام گرفته در جدول 1 ارائه شده است:
جدول1: مشخصات مربوط به پانسمان های بندآورنده خونریزی نسل اول ، دوم و سوم

نتیجهگیری
بنا بر اطلاعاتی که در مورد مجروحین و متوفیان حوادث مختلف از رسانهها اعلام میشود، خونریزیهای شدید و دیر رسیدن مجروحین به مراکز درمانی بالاترین عامل افزایش مرگ و میر مجروحین است. در حالیکه میتوان با استفاده از روشها و مواد مختلفی آمار مربوطه را به حداقل رساند. یکی از این مواد، بندآورندهها هستند که انتخاب نوع بندآورنده با توجه بهخواص آنها بسیار اهمیت دارد. اطلاع از خواص بندآورنده و نحوه عملکرد آن موجب میشود تا نمونه مناسب در شرایط مختلف بالینی بهدرستی انتخاب شود. هدف باید متوقف کردن خونریزی در اسرع وقت، برای جلوگیری از خونریزی طولانیمدت باشد. با توجه به مطالعات انجام شده، استفاده از بندآورندههایی که مبتنی بر مواد معدنی در پوشش گاز استریل هستند و در نسل سوم وارد بازار شدند بهدلیل خواص عملکردی بهتر از جمله: هزینه پایین، زمان انعقاد کوتاه، عدم حساسیتهای آلرژیک، سازگار با فیزیولوژی بدن و قابل استفاده در انواع خونریزیها توصیه میشود. در این مقاله سعی شد اثربخشی و کارکردهای هر نسل از این بندآورندهها بیان شود تا دریچهای برای ارتقاء و پیشرفت این محصولات با کمترین هزینه و بیشترین تأثیر باشد.
سپاسگزاری
این مقاله حاصل انجام پایاننامه میباشد. بدینوسیله از دانشگاه صنعتی مالک اشتر با حمایت مالی جهت انجام این تحقیق تشکر و قدردانی میگردد.
حامی مالی: دانشگاه صنعتی مالک اشتر
تعارض در منافع: وجود ندارد.
اغلب اولین انتخاب در هنگام خونریزی فشار مستقیم، متراکم ساختن (Compression) و یا استفاده از شریان بند (Toumiquet) است. با این حال ممکن است روشهای مکانیکی بهدلیل اختلالات انعقادی ذاتی (Coagulopathy) بیمار و زخم در محل نامناسب (گردن، زیر بغل و کشاله ران) کارآمد نباشد. روشهای حرارتی مانند لیزرها بهدلیل استفاده مکرر برای کاهش خونریزی، سبب سوختن ناحیه میشود. دارو درمانی نیز بهدلیل تداخلات دارویی میتواند مشکلاتی را ایجاد کند. در همین راستا بندآورندههای موضعی با هدف ارتقاء کارایی و سهولت در استفاده از آنها، وارد بازار شدند. این بندآورندهها به دو گروه کلی طبقهبندی میشوند: عواملی که بهروش بیولوژیکی فعال مانند ترومبین، چسبهای بیولوژیکی و سایر ترکیبات اقدام میکنند و گروه دوم عواملی هستند که از طریق تماس فعال شده و موجب افزایش تجمع پلاکتها میشوند. از این رو لازم است مکانیسمهای عملکرد، اثربخشی و عوارض جانبی احتمالی مربوط به هر عامل را به درستی بررسی کرد و با توجه به شرایط بالینی و وضعیت انعقاد خون بیمار میتوان مناسبترین بندآورنده را انتخاب نمود. امروزه خونریزی غیرقابل کنترل بخش گستردهای از آمار مرگ و میر در حوادث را شامل میشود. از اهداف اصلی در میان نظامیان و غیر نظامیان، درحوادث مختلف، حفظ جان بیمار از طریق توقف یا به حداقل رساندن خون از دست رفته است (1،2). بهعنوان مثال تصادفات جادهای هرساله 1/24 میلیون نفر را در دنیا به کام مرگ میکشاند و چنانچه اقدام مؤثری صورت نپذیرد این آمار تا سال 2020 به 1/9 میلیون خواهد رسید (3). در این میان تصادفات وسایل نقلیه چرخدار و موتوری بهعنوان حوادث مطرح و یکی از پیامدهای غیر قابل اجتناب حمل و نقل جادهای محسوب میشوند (4). مطالعهای در نیجریه نشان داده شد که میزان مرگ و مصدومیتهای ناشی از سوانح ترافیکی در موتورسیکلتسواران و سرنشینان آنها 8/7 برابر بیشتر از سرنشینان سایر وسایط نقلیه بود (5). اغلب این تلفات بهدلیل خونریزی شدید مجروحان، قبل از رسیدن به بیمارستان میباشد. در طی سالیان گذشته، روشهای متفاوتی جهت کنترل خونریزیهای شدید که مشکلات فراوانی برای بیمار بهوجود میآورد، بهکار رفتهاند. در تمدنهای باستانی، مصریان برای جلوگیری از خونریزی مخلوطی از موم، گریس و جو استفاده میکردند. در یونان باستان نیز کائنان و حکیمان از گیاهان بندآورنده بر روی زخمهای مجروحان جنگی استفاده میکردند (6،7). فاکتورهای متعددی برای توقف خونریزی با توجه بهروشهای مورد استفاده و شرایط فیزیولوژی بیمار وجود دارد که بهمنظور کاهش خونریزی، کاهش افت خون، اجتناب از خطرها و هزینههای مرتبط با تزریق خون در جهت کنترل خونریزی اتخاذ میشود. در این میان مواد بندآورنده موضعی که در اشکال مختلف موجود بوده و بهواسطه مکانیسمهای متفاوتی منجر به بند آوردن خون در کوتاهترین زمان ممکن و کمترین میزان تخریب بافت میشوند، از اهمیت بالایی در میان نظامیان و غیرنظامیان برخوردار است. موادی که بهعنوان بندآورنده خون به کار برده میشوند بر پایه پلیمرهای طبیعی نظیر: کلاژن، ژلاتین، اکسید سلولز، کیتین، کیتوسان و موادی بر پایه پلیآمینواسیدها و مصنوعی مانند: پلیسیانواکریلاتها (Poly cyanoacrylate)، پلیاکریلیکاسید (Poly acrylic acid) و پلیآلکیناکسیدها (Poly alkyiene oxide) میباشند (8). بسیاری از پیشرفتها در جهت کنترل خونریزی و تجاری شدن مواد بندآورنده موضعی در سال 2001 در درگیری میان نظامیان افغانستان و عراق معرفی شدند. در این سالها بیش از 52000 نفر از نظامیان ایالات متحده تلف شدند. بهمنظور کاهش این تلفات و عوارض ناشی از آن در سال 2003، مواد بندآورنده موضعی توسط کمیته مراقبتهای تاکتیکی (CoTccc: Committee Tactical combat casuaity care) مورد ارزیابی قرار گرفت و جهت استفاده در میادین نبرد تأیید شد (9،10،11). علیرغم این پیشرفتها، همچنان خونریزی عامل اصلی مرگ و میر در میان نظامیان و دومین عامل مرگ پس از آسیبدیدگی مغزی در میان غیرنظامیان میباشد (9،12،13). از دست دادن خون و بکارگیری روشهای متفاوت جهت جلوگیری از آن همواره یکی از دغدغههای بشر بوده است. چرا که با از دست رفتن 20 تا 25 درصد از حجم خون بسیاری از مکانیسمهای حیاتی بدن از کار افتاده و زمانی که مقدار خون از دست رفته به میزان 35 درصد از حجم کل خون میرسد، نوعی شوک در بدن ایجاد شده و بهدنبال آن اندامهای حیاتی انسان از کار میایستد. بنابراین صرفنظر از عامل ایجاد کننده خونریزی، انسان همواره بهدنبال بکارگیری روشهای متفاوت جهت بندآوردن خون در کوتاهترین زمان ممکن و کمترین عوارض ناشی از آن بوده است (8). اولین مکانیسم در بندآوردن خون هموستازی (Hemostasis) است. هموستازی یا قطع فیزیولوژیک خونریزی به مجموعه عوامل، کنشها و واکنشهایی اطلاق میگردد که نقش آنها توقف خونریزی از محل بریدگیها و آسیبهای رگی است. بهعبارتی هموستازی با تغییر حالت خون از مایع به جامد اولین مرحله از بهبود زخم میباشد. سیستم هموستازی را میتوان به چهار مرحله اصلی تقسیم نمود:
1. فاز عروقی (Vascular): بلافاصله پس از قطع یا پاره شدن یک رگ خونی، جدار آن منقبض میشود و همین امر باعث کاهش آنی جریان خون میشود. هر چه میزان آسیب به رگ بیشتر باشد، این انقباض نیز شدیدتر خواهد بود. انقباض موضعی رگ 20 دقیقه تا نیم ساعت ادامه دارد و در جریان آن تشکیل توده پلاکتی (Platelet plug) و انعقاد خون انجام میشود.
2. فاز پلاکت: پلاکتها در گردشخون زمانی که با سطوح آسیب دیده برخورد کنند فعال شده، شروع به تورم میکنند، شکل غیر منظم به خود گرفته و چسبناک میشوند و به فیبرینهای کلاژنی میچسبند و سبب تجمع پلاکتها و انسداد عروق میگردد. بهعبارتی توده پلاکت با فیبرین و اجزای سلولی (گلبول سفید و قرمز) مخلوط شده و بهمنظور کاهش میزان خون از دست رفته، بسترهای عروقی را مسدود میکند.
3. فاز انعقاد: سومین بخش از مکانیسم هموستازی تشکیل نهفته خون میباشد. که شامل مسیرهای ذاتی یا بیرونی و مشترک میباشد این مسیرها با فاکتور XII بر سطح آسیب دیده عروقی آغاز میشود و در حضور یون کلسیم و فاکتورهای دیگر، سبب تبدیل فیبرینوژن به فیبرین شده و لخته شکل میگیرد (14).
4. فاز تجزیه فیبرینی (Fibrinolytic): مرحله چهارم از هم پاشیده شدن فیبرین پس از عمل بندآوری خون میباشد. زمانی که بستر مویرگها مسدود شد (Sealed) و بندآوری اولیه کامل گردید، لازم است جهت برقراری مجدد جریان خون، لخته ایجاد شده از بین برود. از این رو با فعال شدن پلاسمینوژن و تبدیل آن به پلاسمین (Plasmin)، رشتههای فیبرین، فیبرینوژن و فاکتورهای V و VII هضم میشود و به عبارتی لخته حل میگردد (15،16). این فرایندها بهطور همزمان یا به سرعت و بهدنبال هم رخ میدهند، بهطوری که بلافاصله بهدنبال انقباض عروق، پلاکتها در محل زخم شروع به جمع شدن میکنند. آبشار انعقادی در عرض 10 تا 20 ثانیه پس از آسیب، فعال میشود. لخته خون اولیه در 1 تا 3 دقیقه تشکیل شده و فیبرین بهمنظور ایجاد لخته پایدار به فاصله 5 تا 10 دقیقه تولید میشود. مدیریت در شرایط خاص مانند خونریزی شدید، تنها به کنترل تیم پزشکی بستگی ندارد و نیاز بهپشتیبانی از راه حلهای جدید دارد که باعث کاهش یا کنترل خونریزی میشود. استفاده از بندآورندههای موضعی مناسب میتواند در این شرایط بسیار کارآمد و هدفمند باشد. ویژگیهای عوامل بندآورنده موضعی که بهصورت تجاری موجودند، شامل موارد زیر میباشد: سریع و مؤثر بودن در کنترل و یا توقف خونریزی، توانایی در ایجاد ارتباط مؤثر با سطح خونریزی کننده، عوارض جانبی (Adverse-event) کم، عدم سمیت و کاربرد آسان، آمادهسازی راحت، بهاشکال مختلف در دسترس بودن، قابل استفاده در انواع خونریزیها، سازگار با فیزیولوژی بدن، زیستسازگاری و غیره.
بندآورندههای تجاری بهطور کلی شامل :
1. بندآورندههای موضعی فعال (بیولوژیکی): این عوامل شامل ترومبین و محصولات ترکیبی حاوی ترومبین و مواد چسبنده به بافت ( نظیر: مسدود کنندهها و چسبها) میباشند. این بندآورندهها دارای فعالیت بیولوژیکی بوده و بهطور مستقیم در انتهای آبشار انعقادی موجب تحریک و تشکیل لخته میشوند.
2. بندآورندههای موضعی غیرفعال (مصنوعی): عوامل بندآورنده موضعی غیرفعال شامل کلاژن، سلولز و ژلاتین است. این عوامل با ایجاد ساختار شبکه مانند (Lattice-like) به محل خونریزی چسبیده و تجمع پلاکتها را افزایش میدهند. این بندآورندهها اغلب ساختار فیبر مانند متراکم، ظرفیت جذب بالا و دارای اشکال گوناگون ( نظیر: گاز، ورقه، پودر و اسفنج) میباشند (8).
3.بندآورندههای قابل جذب (Absorbable): بندآورندههایی هستندکه بهدلیل موقعیت قرارگیری آنها، باید برای مدت بیشتری در بدن باقی بمانند. لذا این محصولات باید زیستسازگاری (Biocompatibility) بسیار خوبی داشته باشند تا سبب پاسخهای ایمنی یا التهابی مزمن (Chronic inflammation) و یا عفونت نشوند. این بندآورندهها اغلب در عملهای جراحی در داخل بدن و یا مورد استفاده برای دندانپزشکان قرار میگیرند. محصولات قابل جذب مورد تأُیید سازمان غذا و داروی آمریکا (FDA: Food and Drug Administration) میباشند و شامل چهار ماده مشخص است: اسفنج ژلاتینی قابل جذب – اکسید سلولز – اکسید سلولز بازیابی شده (ROC: Regenerated oxidized cellulose) میکروفیبریلهای کلاژن (Microfibrillary Collagen) (17،18). در میان این دستهبندیها، CoTccc این عوامل را به 3 دسته کلی تقسیم میکند (19،20). که شامل موارد زیر میباشند:
1. نسل اول
این نسل از بندآورندهها در سال 1900 توسط وزارت دفاع آمریکا، ارزیابی شد و سپس در سال 2003 برای استفاده در میدان نبرد میان نظامیان، مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت (21). بندآورندههایی که از این نسل میباشند شامل:
Fibrin Sealant
اولین نسل از بندآورندههای موضعی هستند. درزگیرهای فیبرین (چسب فیبرین) برای اولین بار در سال 1909 در اروپا، مطرح شدند. این مطالعات در سال 1940 پس از استخراج ترومبین خالص، از سر گرفته شد و استفاده از آن در طول جنگ جهانی اول برای کنترل خونریزی متداول شد (7،22). درزگیر فیبرین شامل فیبرینوژن لیوفیلیزه (lyophilized) شده انسان و گاو یا ترومبین انسانی است که گاهی حاوی فاکتور انعقادی غلیظ XIII و آپروتینین (aprotinin) نیز میباشد. فاکتور XIII آنزیمی است که در حضور یونهای کلسیم (عامل تثبیت کننده فیبرین) توسط ترومبین فعال میشود. پس از فعالشدن، فاکتور XIII اتصالات متقابل بین زنجیرههای فیبرین را ایجاد شده و تشکیل لخته را تثبیت میکند. این پانسمانها بهعنوان قدیمیترین نوع بندآورنده موضعی خونریزی هستند که محصولات مختلفی از آنها (با غلظتهای متفاوت از ترکیبات) در بازار وجود دارند. Tisseal یکی از محصولات این پانسمان است، که در سال 1980 در ایالات متحده آمریکا، پس از اثبات کارایی آن، برای استفاده در انسان تصویب شد (23). مکانیسم عمل این پانسمانها بیولوژیکی بوده و بهطور مستقیم در انتهای آبشار انعقادی موجب تحریک و تشکیل لخته میشوند. ترومبین، فیبرینوژن را به مونومرهای فیبرین تبدیل میکند تا یک ماتریس محلول را تشکیل دهد. ترومبین همچنین عامل XIII را به فاکتور XIIIa فعال میکند، که بهصورت کووالانسی ماتریس محلول فیبرین را به هم متصل میکند تا یک لخته پایدار تشکیل شود. هر دو مرحله به حضور یونهای کلسیم نیاز دارند (24). آپروتینین موجود در این محصولات یک مهار کننده پروتئاز (از بافت ریه گاو) است که باعث جلوگیری از تشکیل تریپسینین (trypsinin)، پلاسمین (plasmin) و کالیکرینها (kallikreins) میشود و لیز شدن لخته پلاسمین را به تاخیر میاندازد. محصولات درزگیر فیبرین در بافت پاسخ التهابی یا نکروز ایجاد نمیکنند، همچنین در موارد اختلال انعقادی مؤثر هستند، اما بهدلیل گران بودن، محصولات دیگر جایگزین آنها شدند (7،25).
Dermabond- Omnex
این پانسمانهای بندآورنده خونریزی مبتنی بر سیانوآکریلات (Cyanoacrylate) هستند. یکی از اولین موارد استفاده از پلیمرها برای بندآوردن خون سیانوآکریلاتها هستند که در گروه عوامل سنتزی طبقهبندی شدهاند. سیانوآکریلاتها مونومرهای مایع هستند که در حضور آب به سرعت پلیمر (یونهای هیدروکسیل) تشکیل میدهند و سطوح مجاور را بهیکدیگر متصل میکنند. سیانوآکریلات در سال 1942 توسط شیمیدان معروف هری کوور (Harry Coover) تهیه شد (7،26). این محصول بهعنوان چسب و داروی بندآورنده موضعی خونریزی در جنگ ویتنام، برای کنترل خونریزی زخمهای باز در سربازان، در مدت زمان انتقال آنها به بیمارستان استفاده میشد. اتیل سیانوآکریلات در اثر تجزیه، محصولات جانبی سمی نظیر سیانواستات و فرمالدهید تشکیل میدهد. از اینرو سبب التهاب مداوم شده و بهبود زخم را به تعویق میاندازد. Dermabond محصولی که با تجزیه آهستهتر (2-اکتیل سیانوآکریلات) برای کنترل خونریزی به بازار آمد و توسط سازمان غذا و داروی آمریکا تأیید شد. این پانسمان حداکثر 2 تا 5 دقیقه بعد از استفاده خونریزی را کنترل میکند. اگرچه این محصول نتایج خوبی را دنبال داشت، اما استفاده از آن خطر ترمبوز (Thrombosis) را بهدنبال داشت (27،28). بعد از آن Omnex، محصول دیگری مبتنی بر سیانوآکریلات، به بازار عرضه شد. ایمنی و اثربخشی این محصول بهمراتب بیشتر از Dermabond است. Omnex علاوه بر بندآوری سریع خونریزی، عملکردی مستقل از سیستم انعقادی را دارد. پانسمانهای مبتنی بر سیانوآکریلات برای زخمهای نزدیک به بافت، مفاصل، دست یا پا و یا برای ترمیم سطوح مخاط ضعیف شده قابل استفاده نیستند (7،29).
BioGlue
بندآورنده نسل اول است. پانسمان BioGlue از گلوتارآلدئید (Glutaraldehyde) و محلول آلبومین (Albumin) گاوی تهیه شده است. این پانسمان در سال 1999 برای استفاده در انسان تصویب شد. BioGlue بهصورت تجاری در یک سرنگ با دو محفظه جداگانه قرار دارد که برای استفاده و در زمان کاربرد با یکدیگر مخلوط میشوند. این پانسمان در طی 20 ثانیه چسبندگی ایجاد کرده و 65% قدرت اتصال دارد. BioGlue در 79 عمل جراحی قلب مورد استفاده قرار گرفت که در 78 مورد از آن موفقیتآمیز بود. یک گروه اتریشی تحقیقاتی درباره پانسمان BioGlue انجام دادند و نتیجهگیری شد، این پانسمان قدرت اتصال خوب دارد، اما زیستسازگاری پایین (سمیت سلولی) را نشان داد. آنها همچنین فعالیت التهابی مداوم را در بیماران مشاهده کردند. بنابراین از استفاده از این محصول حمایت نشد (30،31،32).
FloSeal
یکی از اولین بندآورندههای نسل اول FloSeal که مبتنی بر ژلاتین است. ژلاتین اولین بار در سال 1945 بهعنوان یک ماده بندآورنده خونریزی به بازار معرفی شد. ژلاتین از کلاژن حیوانی (خوک، گوسفند یا اسب) تهیه و ساخته میشود. در این نوع از بندآورندهها پیشرفتهای کمی در شکل و ترکیب آن وجود دارد. اگرچه مکانیسم عملکردی مشخصی ندارد، اما تحقیقات نشان داده است که بیشتر از لحاظ شیمیایی بر روی آبشار انعقادی تأثیر دارد. در نتیجه ژلاتینها بهعنوان یک ماتریس فیزیکی برای شروع لخته مؤثر هستند. از ماتریس ژلاتین میتوان به اشکال مختلف اسفنج و پودر استفاده کرد. یک خاصیت مهم در اشکال مختلف ژلاتین، توانایی جذب بیش از 40 برابر وزن خود، خون و مایعات است. گسترش حجم این محصول تا 200٪ در داخل بدن است. این بدان معنی است که حجم محصولات مبتنی بر ژلاتین بیشتر از بندآورندههای موضعی بر اساس کلاژن و سلولز اکسیده شده بازسازی شده، افزایش مییابد. این محصول در سال 1999 مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت (33،34،35).
Microfibrillary Collagen
بندآورندههای موضعی میکروفیبردار کلاژن (TMC:Topical Microfibrillar Collagen) در دهه 1970 توسعه یافته و به بازار عرضه شده است. این بندآورنده با استفاده از کلاژن گاو، اسب یا بز تولید میشود. اولین بار با نام تجاری Avitene first، بهصورت پودر در بازار عرضه شد. محصولات مبتنی بر کلاژن مؤثرتر از محصولات مبتنی بر ژلاتین هستند. محصولات مبتنی بر کلاژن مسیر ذاتی آبشار انعقادی را فعال میکنند، در حالی که بندآورندههای مبتنی بر ژلاتین باعث بهوجود آمدن هموستاز از طریق خواص فیزیکی میشوند. در برخی از آزمایشات بالینی، بندآورندههای موضعی میکروفیبردار کلاژن نسبت به سلولز اکسیده شده، برتر بودند و از نظر آماری کاهش قابلتوجهی در از دست دادن خون نشان میدهند (36،37).
QuikClot (QC)
از محصولات نسل اول که به تایید CoTccc رسیده و با جذب سریع آب کار میکند، QuikClot (QC) میباشد. ماده اصلی این محصول زئولیت است. زئولیت یک ماده معدنی آتشفشانی بیاثر است و عمدتاً از آلومینوسیلیکاتها (شبکه بلوری شامل اکسیژن، آلومینیوم و سیلیس) با ساختمان سهبعدی تشکیل شدهاند (20). زئولیت یک جاذب سطحی است که به سرعت در واکنش گرمازایی، آب را جذب میکند و این خاصیت، سبب سوزش شدید زخم میشود. QC شامل دانههایی است که در داخل زخم در حال خونریزی ریخته میشود. از این رو برداشتن آن پس از قطع خونریزی از روی زخم بسیار مشکل است. QC جدیدتری که بعد از آن وارد بازار شد، استفاده از کیسههایی مخصوص بهعنوان پوشش برای دانههای زئولیت بود که کاربرد مؤثری در بندآوری خونریزیهای عمیق داشته و هنگام شستشوی زخم، به راحتی از زخم جدا شده و زخم ترمیم میشود. بهطور کلی زئولیت موجود در QC، یون کلسیم را آزاد میکند و از طریق واکنش تبادل کاتیون، سدیم و پتاسیم، زئولیت در هنگام تماس با خون، آب خون را جذب میکند و زمان تشکیل لخته را کوتاه میسازد. مکانیسم مهم اثربخشی در بندآورندهای موضعی زئولیتی تبادل کاتیونی در آنها میباشد. در یک گزارش ارائه شده کنترل با QC، از 103 نفر مجروح تحت درمان، 83 نفر از آنها دارای خونریزی از زخمهای خارجی و 20 نفر خونریزی داخل بدن بهدلیل جراحی بوده است. کنترل خونریزی در 92 % از بیماران موفقیتآمیز بوده و تنها در مورد 8 نفر از مصدومان، ناکارآمد بود. با این حال گرمای ایجاد شده در هنگام درمان سبب ایجاد درد و ناراحتی شدید (و گاهی خفیف) میشود و 3 مورد سوختگی ناشی از گرمای ایجاد شده توسط QC گزارش شد که حتی یک مورد از آنها +طی این گزارشات و پژوهشهای انجام شده، گرمای تولید شده توسط QC را حتی تا 80 درجه سانتیگراد مشاهده کردند و نتیجهگیری شد که QC میزان خونریزی را کاهش میدهد اما نمی تواند آن را بهطور کامل متوقف کند (38،39). QuikClot ACS، محصول جدیدتر که بعد از QC بهمنظور ارتقاء آن به بازار ارائه شد. QuikClot ACS میزان خونریزی را کاهش داد اما نمیتوانست آن را بهطور کامل متوقف و گرما را کنترل کند. جانشین این دو محصول، Quik Clot ، بهمنظور به حداقل رساندن مشکل گرما بود. در این محصول، زئولیتهای هیدراته شده در پانسمانهای اسفنجی بستهبندی شدند. در اثر این بهینهسازی، کارآیی بندآوری کاهش یافته و هزینه تولید بالاتر رفت و در نتیجه به دلایل فوق قابلیت استفاده در میادین نبرد را از دست داد (40). کلینوتپیلولیت (Clinoptilolite)، نوعی زئولیت است که برای اولین بار توسط بایر (Bayir) و همکارانش مورد آزمایش قرار گرفت و تأثیر آن به همان اندازه زئولیت های آتشفشانی بود، بدون آنکه باعث افزایش دما شود (41). تحقیقات جدید در مورد نمونههای جدید تر زئولیت باید حمایت شوند زیرا این دسته از بندآورندههای موضعی با هزینه کم و آسانتر تولید میشود.
HemCon(HC)
یکی دیگر از محصولات نسل اول که با بودجهای مستقیم که توسط ارتش آمریکا در سال 2003 ساخته شد. و در دستورالعمل CoTccc بود. HemCon (HC)، از کیتوسان و واحدهای تکراری کیتین تهیه شده است که یک پلیساکارید زیستسازگار طبیعی و بینظیر از پوسته میگو است. اهمیت کیتین در چند مورد میباشد:
1. سازگاری زیستی با بقیه مواد
2. قابلیت هضم آسان
3. غیرسمی بودن
4. قدرت جذب بالا
5. در دسترس بودن
در نوع پانسمانHC ، با بار مثبت جذب گلبولهای قرمز خون با بار منفی شده است و این چسبندگی سبب قطع خونریزی میشود. کیتوسان هیچ خاصیت انعقادی ذاتی ندارد بنابراین مستقل از آبشار انعقادی عمل میکند و اجازه میدهد مکانیسم انعقادی طبیعی بدن همراه با مکانیسم HC اتفاق بیوفتاد و خونریزی سریعتر متوقف شود (20،42). در یک پژوهش انجام شده بر روی 66 مورد از بیمارانی که بر اثر خونریزی خارجی از پانسمان HC استفاده کردند، در 97% از موارد منجر به قطع کامل یا کاهش خونریزی شد و عدم موفقیت در 3% آن بهدلیل وجود زخمهای بسیار عمیق بود. استفاده از این پانسمان در بیمارانی که داروهای ضدانعقاد مصرف میکردند نیز همین نتیجه را داد و عوارض جانبی برای آنها ثبت نشد. لخته شدن و قطع خونریزی بدون هیچگونه گرما در بافت ایجاد شد. تنها نگرانی برای استفاده از محصولات مبتنی بر کیتوسان در بیماران حساس به سختپوستان (میگو) میباشد. طی مطالعهای که وایبل (Waible) و همکارانش در سال 2011 روی افراد حساس به سخت پوستان انجام دادند در هیچکدام از این افراد واکنش آلرژیک به این ماده گزارش نشد. این بررسی در مورد پانسمانهای کیتوسان دلگرم کننده است اما قطعی نمیتواند باشد (43).
Dry Fibrin Sealant (DFS)
پانسمان درزگیر فیبرین خشک یا DFS با همکاری مشترک بین صلیب سرخ و ارتش آمریکا در سال 2003 تهیه شد و بهصورت آزمایشی برای مجروحان جنگی، در جنگ عراق و افغانستان استفاده شد. این پانسمان حاوی پودر فیبرینوژن، ترومبین، فاکتور XIII و کلسیم میباشد و بالابردن غلظت فاکتورهای انعقادی، انعقاد را افزایش میدهد. ولی با وجود استریل کردن این پانسمان، عملاً خطر انتقال ویروسی از بین نمیرود. اگرچه پانسمان DFS در استفاده اولیه خود در میدان نبرد موفقیتآمیز بود اما بهدلیل هزینه بالای تولید و کارآیی پایین آن، محصولات بندآورنده موضعی دیگر جای آن را گرفتند (7،20،44).
Rapid Deployable Hemostat (RDH)
از اولین بندآورندههای موضعی خون است. این پانسمان از جلبک دریایی تهیه شده است. از طریق فعالسازی پلاکتها و پیوندهای متقاطع گلبولهای قرمز خون، خونریزی را کنترل میکند. این محصول نتوانست مورد تأیید سازمان غذا و داروی آمریکا قرار بگیرد.
در سال 2003 CoTccc پانسمانهای نسل دوم را جایگزین این محصولات کرد.
2. نسل دوم
بندآورندههایی که بعد از سال 2003 مورد تایید سازمان غذا و داروی آمریکا قرارگرفت، بعنوان بندآورندههای نسل دوم شناخته شدند که به وضوح مؤثرتر و کاربردی تر از محصولات پیش تولید شده بودند (20). از این نسل میتوان به موارد زیر اشاره کرد:
Celox (CE)
یکی از محصولات نسل دوم که مبتنی بر کیتوزان است. کیتوزان به مجموعهای از پلیمرهای مشتق شده از کیتین (پوسته سختپوستان) اشاره دارد. این پلیمر، کربوهیرات پیچیدهای است که تجزیهپذیر میباشد. کیتوزان در بدن بهاجزای گلوکزآمین و N-استیل گلوکزآمین تجزیه میشود. کیتوزان همانطور که در قبل گفته شد خاصیت بندآوری ذاتی ندارد بنابراین مستقل از مکانیسم های انعقاد فیزیولوژیکی بدن کار می کند. کیتوزان با تعامل الکترواستاتیک مستقیم بین غشای سلولی و گلبول قرمز با بار منفی و کیتوزان با بار مثبت عمل میکند. اگرچه کیتوزان در اصل یک ماده قابل جذب در بدن است، اما پودر بندآورنده CE قابل جذب نیست. بنابراین قبل از بهبود زخم باید از روی محل زخم برداشته شود. بسیاری از مطالعات بالینی نسل دوم، برتری محصولات Celox را در مقایسه با گاز و سایر موارد گزارش میدهند (20،45،46) محصولات دیگری بر همین پایه بهمنظور بهبود کارآیی ارائه شده است که در نسل سوم محصولات طبقهبندی میشود.
Combat Gauze (CG)
این پانسمان از بندآورندههای موضعی نسل دوم و اولین گاز بندآورنده خونریزی مبتنی بر مواد معدنی است. CG، یکپارچه نرم قابل انعطاف از ریون و پلی استر آغشته به کائولن میباشد. کائولن یک سنگ رس سرشار از کائولینیت(Kaolinite) است. دارای سطح قطبی با بار اندک منفی است که نقش مهمی در تحریک مسیر داخلی آبشار انعقادی ایفا میکند. در نتیجه یک فعال کننده مسیر ذاتی میباشد. پانسمان CG، قابل جذب توسط بدن نبوده، بنابراین قبل از ترمیم کامل زخم، باید از آن خارج شود. حذف CG به راحتی انجام میشود و نیاز به مراحل خاصی ندارد (47). محصول جدیدتر از CG در سایز بزرگتر وارد بازار شده است که در دسته قسمت نسل سوم قرار میگیرد.
Wound Stat (WS)
یکی دیگر از محصولات نسل دوم است. یک محصول تجاری حاوی خاک رس و گروه اسمکتیت (Smectite) است. این بندآورنده موضعی توانایی متوقف کردن خونریزی را همزمان با متمرکز کردن فاکتورهای انعقادی بهمنظور ایجاد لخته و شروع مسیر ذاتی انعقادی دارد. WS در مطالعات حیوانی بهعنوان سریعترین و مؤثرترین محصول بندآورنده خونریزی ثابت شده است. با این حال علیرغم توقف سریع خونریزی صدماتی را به رگ ایجاد میکند و باعث انسداد و ترمبوز میشود. بهدلیل همین مسائل در سال 2009 توسط سازمان غذا و داروی آمریکا به حالت تعلیق درآمد (48،49).
Gelitacel – Fibrilla
از بندآورندههای نسل دوم است. این بندآورنده خونریزی متشکل از سلولز بازسازی شده اکسید شده (ROC) میباشد. سلولز ساده اکسیده شده اولین بار در سال 1942 در ایالات متحده آمریکا مطرح و در سال 1960 با تولید اولین نسل از آن بنام Surgicel وارد بازار شد. پانسمانهای ROC تنها پانسمانهایی هستند که از عناصر انسانی یا حیوانات گرفته نشده و منشاء گیاهی دارند. بنابراینROC یک بندآورنده موضعی است که توسط بازسازی سلولز خالص در روی پارچه درهم تنیده (پنبه) تولید میشود و دوباره اکسیده میشود. این محصولات با فعالسازی آبشار انعقادی، خونریزی را کنترل میکنند. واحد عملکردی این پانسمانها اسید آنهیدروگلوکورونیک (anhydroglucuronic acid) است. ماهیت اسیدی ROC میتواند روند التهابی موضعی را افزایش داده و روند بهبودی طبیعی را به تاخیر بیاندازد. هر دو شکل تجاری این پانسمانها نباید از مصرف در محیط آبی قرار بگیرد زیرا خاصیت بندآوردن خونریزی آن از بین میرود (7).
3. نسل سوم
بندآورندههایی که از سال 2008 به بعد بهمنظور کارآیی بیشتر مورد تأیید سازمان غذا و داروی آمریکا قرار گرفت و وارد بازار شدند از این نسل میباشند. در نسل سوم تعدادی از محصولات بهینه شده و بهبود کارآیی نسل دوم میباشد از جمله CGX (Combat Gauze XL) که مصول جدیدتر از CG با سایز بزرگتر و جرم تقریباً دو برابر آن میباشد. از دیگر محصولات این نسل میتوان به موارد زیر اشاره کرد:
Salmon Thrombin – Fibrinogen (STF)
یکی از محصولات نسل سوم است. پانسمان STF حاوی مخلوط اختصاصی ترومبین سالمون لیوفیلیزه (خشک کردن انجمادی در خلاء) و فیبرینوژن است. این مخلوط روی یک پانسمان محلول در آب حاوی دکستران (یک کمپلکس کربوهیدرات است) میباشد. عملکرد STF مشابه به ترومبین انسانی و فیبرینوژن است. پانسمان STF مستقیماً روی رگ در حال خونریزی قرار میگیرد و بلافاصله پس از تماس با خون اجازه میدهد تا هیدراتاسیون ترومبین و فیبرینوژن انجام شود که منجر به تشکیل لخته فیبرین میشود. پروتئینهای مورد استفاده در پانسمانهای STF ارزان بوده، به راحتی در مقادیر زیاد در دسترس هستند، برای مدت طولانی در محیط پایدارند و بیماری را انتقال نمیدهند. ولی با این وجود از زمان DFS (نسل اول پانسمان های فیبرین) نگرانیهایی را برای انتقال بیماری بهدنبال دارند. STF در حال حاضر مورد تایید سازمان غذا و داروی آمریکا نمیباشد (20،50،51).
Mini Sponge Dressing (MSD)
مینی پانسمان اسفنجی (MSD) یک پانسمان جدید از نسل سوم میباشد. این پانسمان با استفاده از وزن سبک، در درون زخم استفاده میشود. MSD اسفنجهای کوچک استوانهای از جنس سلولز هستند که با کیتوزان فشرده شدهاند. این اسفنجهای کوچک قادر به جذب خون تا چندین برابر وزن خود هستند. پانسمانهای MSD با نام XStat به بازار عرضه شدند. این محصول بندآورنده خونریزی مبتنی بر کیتوزان در سال 2014 به تصویب سازمان غذا و داروی آمریکا رسید. XStat برای استفاده در میدان نبرد برای زخمهای ناشی از شلیک گلوله و یا در بیمارستان برای غیرنظامیان در نظر گرفته شده است. این پانسمان را میتوان برای استفاده در حوادث بیابان و زخمهای عمیق ناشی از حمله حیوانات وحشی، اثبات کمان، تبر و سایر موارد نیز در نظر گرفت. این پانسمان برای کنترل خونریزی در زخمهای باریک و قسمتهای اتصالی بدن استفاده میشود. نتایج نشان داد که MSD در مقایسه با CG (کاهش خونریزی) در دستیابی به هموستازی بسیار مؤثر است (52).
Modified Rapid Deployable Hemostat (mRDH)
از پانسمانهای نسل سوم است. این پانسمان بندآورنده خونریزی از جلبک دریایی و نانوالیاف N-استیل گلوکزآمین تشکیل شده است (20).
Ankaferd Bloodstoppe (ABS)
ABS بندآورنده نسل سوم که مبتنی بر مخلوط عصاره گیاهان میباشد. آنکافرد (Ankaferd) یک داروی گیاهی سنتی است که قرنها در آناتولی بهعنوان یک عامل بندآورنده خونریزی مورد استفاده قرار میگرفت. آنکافرد ترکیبی استاندارد از گیاهان Thymus vulgaris ، Glycyrrhiza glabra ، Vitis vinifera ، Alpinia officeinarum و Urtica dioica است که هر کدام از این گیاهان اثراتی روی اندوتلیوم، سلولهای خونی، تکثیر سلولی و عروق دارند. مکانیسم عملکرد ABS مستقل از سیستم بیولوژیکی بدن میباشد. تشکیل پروتئینی ناشی از ABS، سبب تجمع گلبولهای قرمز شده و کمک به لخته شدن خون و کنترل خونریزی میکند. بندآورنده ABS در ترکیه به تصویب رسیده و مناسب برای خونریزی دستگاه گوارش میباشد (53،54).
TraumaDex – BleedArrest
این پانسمانهای بندآورنده خونریزی از نسل سوم میباشند. هر دو پانسمان از مشتقات نشاسته هستند و بهعنوان بندآورندههای موفق شناخته میشوند. محصولات مبتنی بر نشاسته اولین بار در اکتبر سال 2002 مطرح شدند. محتویات این پانسمانها از نشاسته سیبزمینی خالص تهیه شده است. ذرات بسیار ریز این بندآورنده همانند یک اسفنج عمل میکند و آب و پلاسمای خون را در خود جذب میکند. انعقاد فوری در سطح زخم ایجاد میشود و بهدنبال آن فرآیندهای لخته شدن خون بهصورت طبیعی انجام میشود. این محصولات مورد تأیید اداره غذا و داروی آمریکا هستند. اما در جبهههای نبرد کاربردی ندارند (55). محققان میگویند یکی دیگر از مزایای این پودر علاوه بر ارزان بودن این محصولات، باعث ایجاد واکنشهای آلرژیک نمیشوند، همان کاری که بندآورندههای مبتنی بر کلاژن و پروتئینهای حیوانی در برخی بیماران انجام میدهند. محقق برجسته، مارک اچ. اورت (Mark H. Ereth) در مقالهای نوشت: "هیچکدام از محصولات بندآورنده موضعی خونریزی که در طول 40 سال گذشته تولید شده است، به اندازه این پانسمانها عوارض جانبی کمی را نداشته اند" (56).
CoSeal
CoSeal از بندآورندههای نسل سوم که از پلیمر کاملاً مصنوعی تهیه شده است. این پانسمان از مخلوط دو پلیاتیلنگلیکول (Polyethylene glycol) روی بستری قابلجذب حاصل میشود. پلیاتیلنگلیکول سبب جذب آب تا چند برابر اندازه اصلی خود میباشد. CoSeal از طریق تعامل با بافت انسان فعالشده و سبب جذب آب و کنترل خونریزی میشود. از این پانسمان جراحان برای کنترل خونریزی در آناستوموزهای عروقی (Circulatory anastomosis) استفاده میکنند. CoSeal بسیار انعطافپذیر بوده و حدود چهار هفته توسط بدن قابل جذب میباشد. پلیاتیلنگلیکول یک بندآورنده خونریزی مؤثر برای جراحیهای قلبی و عروقی است که در آن افزایش حجم پانسمان جای نگرانی ندارد. CoSeal برای جلوگیری از چسبندگی پریکارد در بیمارانی که ممکن است نیاز به تجدید عمل جراحی داشته باشند، بهویژه در کودکانی که از بیماری مادرزادی قلبی برخوردار هستند، مفید است. مهمترین مزیت CoSeal در سرعت بند آوردن خونریزی میباشد (7،57).
Evithrom – Recothrom
پانسمانهای بندآورنده خونریزی از نسل سوم میباشند. این پانسمانها متشکل از ترومبین هستند. ترومبین یک آنزیم طبیعی است و نقشهای مهمی در هموستاز، التهاب و سیگنالینگ سلولی (Cell signaling) دارد. ترومبین از پروترومبین، در نتیجه فعالشدن مسیرهای انعقادی ذاتی و بیرونی تشکیل شده است و با تبدیل فیبرینوژن به فیبرین تشکیل لخته فیبرین را تقویت میکند. ترومبین بیش از 60 سال بهعنوان کمکی برای هموستاز موضعی استفاده میشود. تا همین اواخر، تنها ترومبین تجاری موجود از پلاسمای گاو (Thrombin-JMI) حاصل میشد. اگرچه Thrombin-JMI ابزار مناسبی برای متوقف کردن خونریزی بوده است، اما شواهد نشان میدهد که ترومبین گاو علاوه بر ایجاد پاسخ ایمنی مهم، افزایش بروز ترومبوز و انعقاد شدید را به همراه دارد. محصولات جدید مبتنی بر ترومبین موضعی در سال 2007 و 2008 از منابع غیر گاوی شامل ترومبین مشتق از پلاسما انسان و ترومبین نوترکیب انسانی تهیه و مورد تأیید سازمان غذا و داروی ایالات متحده آمریکا قرار گرفت. محصولات Evithrom و Recothrom موجود در بازار، نیز از ترومبین نوترکیب انسانی تهیه شدهاند (58،59).
QuikClot Combat Gauze (QCG)
محصول جدید از نسل سوم است. این محصول یک گاز جراحی میباشد که با کائولین پوشانده شده است. کائولین یک ماده معدنی بی اثر از سیلیکات آلومینیوم و یک فعال کننده در مسیر لخته شدن ذاتی میباشد. کائولن با افزایش فعالسازی فاکتورهای XII و XI در هنگام تماس با اندوتلیوم آسیب دیده از طریق آبشار انعقادی، لخته شدن خون را آغاز میکند. این پانسمان زیستتخریبپذیر نیست بنابراین باید قبل از اتمام ترمیم قطعی، از زخم خارج شود. QCG در سال 2008 توسط CoTCCC مورد ارزیابی قرار گرفت و در سال 2013 توسط سازمان غذا و داروی آمریکا برای استفاده موضعی مورد تأیید قرار گرفت. در تحقیقاتی که توسط ران (Ran) و همکارانش انجام شد، 79% اثربخشی این محصول در بندآوری خون را نشان داد. با توجه به اینکه این پانسمان برخلاف QC افزایش دما را در زخم همراه ندارد، برای کنترل خونریزی توصیه میشود (60).
Cellulose – Halloysite Hemostatic Nanocomposite Fibers (CHNFs)
نسل جدید از بندآورندههای موضعی CHNFها میباشند. CHNFها، بندآورندههای خونی الیاف نانوکامپوزیتی سلولز و هالوسیت با عملکرد بالا میباشند. هالوسیت نوعی خاک رس معدنی است که از نظر شیمیایی مشابه کائولینیت بوده و دارای ویژگیهای منحصر بفردی مثل استحکام بالا، آسان پخش شدن در ماتریکس انواع پلیمرهای عایق و رسانا و مهمتر از اینها فراوانی و سازگار بودن آن با محیط زیست میباشد. CHNFها بعد از شستشو عملکرد لخته شدن را دو برابر حفظ میکنند. این در صورتی است که QCG پس از شستشو فعالیت خود را از دست میدهد. این ثبات ذاتی CHNFها برای متوقف کردن خونریزیهای آسیبزای خارجی در میدان جنگ و در اتاق عمل بسیار مهم است زیرا جریان مداوم خون عملکرد QCG را تا 75% کاهش میدهد. از آنجا که هالوسیت نسبت به خاک رس کائولن، 4/2 برابر سریعتر پلاسمای خون را منعقد میکند، این بندآورندهها از برتری بیشتری در برابر QCG برخوردار هستند. از آنجا که این نانوکامپوزیت غیر سیتوتوکسیک (Cytotoxic) (سیتوتوکسیک عواملی هستند که بهطور مستقیم سلول را نابود مینمایند بهطوری که بر مراحل مختلف سنتز و فعالیت اسیدهای نوکلئیک اثر میگذارند و تقسیم سلولی را مهار میکنند) بوده و زمان انعقاد آن بسیار کم است، میتواند بهعنوان یک ناجی برای بیماران تروما (افراد نظامی، بیماران تحت عمل جراحی، درمان خونریزی غیرمنتظره در بیماران دارای اختلال ارثی لخته شدن خون) استفاده شود (61،62). شرح مختصری از مشخصات مربوط به پانسمانهای بندآورنده خونریزی نسل اول، دوم و سوم مربوط به مطالعات انجام گرفته در جدول 1 ارائه شده است:
جدول1: مشخصات مربوط به پانسمان های بندآورنده خونریزی نسل اول ، دوم و سوم


نتیجهگیری
بنا بر اطلاعاتی که در مورد مجروحین و متوفیان حوادث مختلف از رسانهها اعلام میشود، خونریزیهای شدید و دیر رسیدن مجروحین به مراکز درمانی بالاترین عامل افزایش مرگ و میر مجروحین است. در حالیکه میتوان با استفاده از روشها و مواد مختلفی آمار مربوطه را به حداقل رساند. یکی از این مواد، بندآورندهها هستند که انتخاب نوع بندآورنده با توجه بهخواص آنها بسیار اهمیت دارد. اطلاع از خواص بندآورنده و نحوه عملکرد آن موجب میشود تا نمونه مناسب در شرایط مختلف بالینی بهدرستی انتخاب شود. هدف باید متوقف کردن خونریزی در اسرع وقت، برای جلوگیری از خونریزی طولانیمدت باشد. با توجه به مطالعات انجام شده، استفاده از بندآورندههایی که مبتنی بر مواد معدنی در پوشش گاز استریل هستند و در نسل سوم وارد بازار شدند بهدلیل خواص عملکردی بهتر از جمله: هزینه پایین، زمان انعقاد کوتاه، عدم حساسیتهای آلرژیک، سازگار با فیزیولوژی بدن و قابل استفاده در انواع خونریزیها توصیه میشود. در این مقاله سعی شد اثربخشی و کارکردهای هر نسل از این بندآورندهها بیان شود تا دریچهای برای ارتقاء و پیشرفت این محصولات با کمترین هزینه و بیشترین تأثیر باشد.
سپاسگزاری
این مقاله حاصل انجام پایاننامه میباشد. بدینوسیله از دانشگاه صنعتی مالک اشتر با حمایت مالی جهت انجام این تحقیق تشکر و قدردانی میگردد.
حامی مالی: دانشگاه صنعتی مالک اشتر
تعارض در منافع: وجود ندارد.
References:
1-Nouri S, Sharif MR, Tabatabaei F, Farokhi S. Investigating the Effect of Zinc Chloride to Control External Bleeding in Rats. Nurs Midwifery Stud 2014; 3(3): e22063.
2-Nouri S, Sharif MR, Panahi Y, Ghanei M, Jamali B. Efficacy and Safety of Aluminum Chloride in Controlling External Hemorrhage: An Animal Model Study. Iran Red Crescent Med J 2015; 17(3): e19714.
3-Tavakkoli L, Khanjani N. The Pattern of Road Crashes Emphasizing the Factors involved in their Occurrence in Kerman city 2012-2015. J Saf Promot Inj Prev 2016; 4(2): 101-8.
4-Abbasi M, Sadeghi M, Azami AA, Esmaeili SM, Kavousi J, Aryafard A. Factors Related to Road Traffic Accidents Leading to Injury or Death in Shahroud City. J Saf Promot Inj Prev 2016; 4(2): 83-90.
5-Khorshidi A, Ainy E, Soori H. Epidemiological Pattern of Road Traffic Injuries among Iranian Motorcyclist in 2012. J Saf Promot Inj Prev 2016; 4(1): 47-54
6-Achneck HE, Sileshi B, Jamiolkowski RM, Albala DM, Shapiro ML, Lawson JH. A Comprehensive Review of Topical Hemostatic Agents: Efficacy and Recommendations for Use. Ann Surg 2010; 251(2): 217-28
7-Bruno Monteiro Pereira, José Benedito Bortoto, Gustavo Pereira Fraga. Topical Hemostatic Agents in Surgery: Review and Prospects. Rev Col Bras Cir 2018; 45(5).
8-Samudrala S. Topical Hemostatic agents in Surgery: A Surgeon's Perspective. AORN J 2008 88(3): S2-S11.
9-Brad L. Bennett, Bleeding Control Using Hemostatic Dressings: Lessons Learned. Wilderness & Environmental Medicine 2017; 28: S39-S49.
10-Eastridge BJ, Mabry RL, Seguin P, Death on the Battlefield (2001-2011) Implications for the Future of Combat Casualty Care. J Trauma Acute Care Surg 2012; 73(6): S431-37.
11-Butler FK, Smith DJ, Carmona RH. Implementing and Preserving the Advances in Combat Casualty Care from Iraq and Afghanistan throughout the US Military. J Trauma Acute Care Surg 2015; 79(2): 321-26.
12-Valdez C, Sarani B, Young H, Amdur R, Dunne J, Chawla LS. Timing of Death after Traumatic Injury−A Contemporary Assessment of the Temporal Distribution of Death. J Surg Res 2016; 200(2): 604-9
13-Sobrino J, Shafi S. Timing and Causes of Death after Injuries. Proc (Bayl Univ MedCent) 2013; 26(2): 120-23.
14-Patton LL. Bleeding and Clotting Disorders. Burket’s Oral Medicine: Diagnosis and Treatment. 10th ed. Hamilton (ON): BC Decker 2003; 454-77.
15-Sileshi B, Achneck HE, Lawson JH. Management of Surgical Hemostasis: Topical Agents. Vascular 2008; 16(suppl 1): S22-S28.
16-Bayomi M. Zeolite-Loaded Alginate-Chitosan Hydrogel Beads as a Topical Hemostat [dissertation]. United States University of Maryland; 2015: 1671.
17-Wheat JC, Wolf JS. Advances in Bioadhesives, Tissue Sealants, and Hemostatic Agents. Urol Clin North Am 2009; 36(2): 265-75.
18-Gabay M. Absorbable Hemostatic Agents. American J Health-System Pharmacy 2006; 63(13): 1244-53.
19-H.khoshmohabat, Sh. Paydar, H. Kazemi, B. Dalfardi. Overview of Agents used for Emergency Hemostasis, Trauma Mon 2016; 21(1): e26023.
20-Bennett BL, Littlejohn L. Review of New Topical Hemostatic Dressings for Combat Casualty Care. Mil Med 2014; 179(5): 497-514.
21-Kheirabadi BS, Edens JW, Terrazas IB, Comparison of New Hemostatic Granules/Powders with Currently Deployed Hemostatic Products in a Lethal Model of Extremity Arterial Hemorrhage in Swine. J Trauma 2009; 66: 316-26.
22-de Carvalho MV, Marchi E, Pantoroto M, Rossini M, da Silva DM, Teodoro LF, et al. [Topical Haemostatic agents and Tissue Adhesives]. Rev Col Bras Cir 2013; 40(1): 66-71.
23-Spotnitz WD. Fibrin Sealant: The Only Approved Hemostat, Sealant, and Adhesive- A Laboratory and Clinical Perspective. Hindawi Publishing Corporation 2014; 1: 1-29.
24-Fischer CP, Wood CG, Shen J, Batiller J, Hart JC, Patel B, et al. A Randomized Trial of Aprotinin-Free Fibrin Sealant versus Absorbable Hemostat. Clin Appl Thromb Hemost 2011; 17(6): 572-77.
25-Kraus TW, Mehrabi A, Schemmer P, Kashfi A, Berberat P, Buchler MW. Scientific Evidence for Application of Topical Hemostats, Tissue Glues, and Sealants in Hepatobiliary Surgery. J Am Coll Surg 2005; 200(3): 418-27.
26-Kingsport T. Creator of Super Glue, former Eastman Employee, Dies At 94. Associated Press; 2011.
27-Belletrutti PJ, Romagnuolo J, Hilsden RJ, Chen F, Kaplan B, Love J, et al. Endoscopic Management of Gastric Varices: Efficacy and Outcomes of Gluing with N-Butyl-2-Cyanoacrylate in a North American Patient Population. Can J Gastroenterol 2008; 22(11): 931-6.
28-Marine L, Gupta R, Gornik HL, Kashyap VS. Glue Embolus Complicating the Endovascular Treatment of a Patient with Loeys-Dietz Syndrome. J Vasc Surg 2010; 52(5): 1350-3.
29-Yoshimatsu R, Takeuchi Y, Morishita H, Iida N, Okabe H, Yamagami T, et al. Successful Embolisation of Intrahepatic Portosystemic Venous Shunt Using Coils and N-Butyl Cyanoacrylate Through Two Approach Routes. Br J Radiol 2006; 79(947): e162-5.
30-Biggs G, Hafron J, Feliciano J, Hoenig DM. Treatment of Splenic Injury during Laparoscopic Nephrectomy with Bioglue, a Surgical Adhesive. Urology 2005; 66(4): 882.e3-882.e5.
31-Passage J, Jalali H, Tam RK, Harrocks S, O'Brien MF. Bioglue Surgical Adhesive--An Appraisal of its Indications in Cardiac Surgery. Ann Thorac Surg 2002; 74(2): 432-7.
32-Babin-Ebell J, Bougioukakis P, Urbanski P, Froehner S, Diegeler A. Foreign Material Reaction to Bioglue(R) as a Possible Cause of Cardiac Tamponade. Thorac Cardiovasc Surg 2010; 58(8): 489-91.
33-Oz MC, Rondinone JF, Shargill NS. Floseal Matrix: New Generation Topical Hemostatic Sealant. J Card Surg 2003; 18(6): 486-93.
34-Reuthebuch O, Lachat ML, Vogt P, Schurr U, Turina M. Floseal: A New Hemostyptic Agent in Peripheral Vascular Surgery. Vasa 2000; 29(3): 204-6.
35-Guzzo TJ, Pollock RA, Forney A, Aggarwal P, Matlaga BR, Allaf ME. Safety and Efficacy of a Surgeon-Prepared Gelatin Hemostatic Agent Compared with Floseal for Hemostasis in Laparoscopic Partial Nephrectomy. J Endourol 2009; 23(2): 279-82.
36-De Oliveira FM, de Carvalho MVH, Marchi E, Pinto CAL. Collagen, Fibrinogen and Thrombin Biological Addesive is Effective in Treating Experimental Liver Injuries. Rev Col Bras Cir 2016; 43(4): 254-61.
37-Wagner WR, Pachence JM, Ristich J, Johnson PC. Comparative in Vitro Analysis of Topical Hemostatic Agents. J Surg Res 1996; 66(2): 100-8.
38-Udangawa RN, Mikael PE, Mancinelli C, Novel Cellulose–Halloysite Hemostatic Nanocomposite Fibers with A Dramatic Reduction in Human Plasma Coagulation Time. ACS Appl Mater Interfaces 2019; 11(17): 15447-56.
39-Pusateri AE, Delgado AV, Dick EJ Application of a Granular Mineral-Based Hemostatic Agent (Quikclot) to Reduce Blood Loss after Grade V Liver Injury in Swine. J Trauma 2004; 57(3): 555-62.
40-Arnaud F,Tomori T,Carr W,McKeague A,Teranishi K,Prusaczyk K, et al. Exothermic Reaction in Zeolite Hemostatic Dressing: QuikClot ACS and ACS+. Biomedical Engineering 2008, 36(10): 1708-1713.
41-Bayır A, Eryılmaz M, Demirbilek M, Denkbaş EB, Arzıman I, Durusu M. Comparison of the Topical Haemostatic Efficacy of Nano-Micro Particles of Clinoptilolite and Kaolin in a Rat Model of Hemorrhagic Injury. Eur J Trauma Emerg Surg 2016; 42(1): 77-86.
42-Kozen BG, Kircher SJ, Henao J, Godinez FS, Johnson AS. An Alternative Hemostatic Dressing: Comparison of CELOX, Hemcon, and Quikclot. Acad Emerg Med 2008; 15(1): 74-81.
43-Butler FK, Holcomb JB, Giebner SD, McSwain NE, Bagian J. Tactical Com- Bat Casualty Care 2007: Evolving Concepts and Battlefield Experience. Mil Med 2007; 172 (suppl_1): 1-19.
44-Kheirabadi B. Evaluation of Topical Hemostatic Agents for Combat Wound Treatment. US Army Med Dep J 2011: 25-37.
45-Arul GS, Bowley DM, DiRusso S. The Use of Celox Gauze as an Adjunct to Pelvic Packing in Otherwise Uncontrollable Pelvic Haemorrhage Secondary to Penetrating Trauma. J R Army Med Corps 2012; 158(4): 331-3.
46-Pozza M, Millner RWJ. Celox (Chitosan) for Haemostasis in Massive Traumatic Bleeding: Experience in Afghanistan. Eur J Emerg Med 2011; 18(1): 31-3.
47-Pourshahrestani S, Zeimaran E, Djordjevic I, Kadri NA, Towler MR. Inorganic Hemostats: The State-of-the-Art and Recent Advances. Mater Sci Eng C Mater Biol Appl 2016; 58: 1255-68.
48-Arnaud F, Teranishi K, Tomori T, Carr W, Mccarron R. Comparison of 10 Hemostatic Dressing in a Groin Puncture Model in Swine. J Vasc Surg 2009; 50(3): 632-39.
49-Kheirabadi BS, Scherer MR, Estep JS, Dubick MA, Holcomb JB. Determination of Efficacy of New Hemostatic Dressings in a Model of Extremity Arterial Hemorrhage in Swine. J Trauma 2009; 67(3): 459-60.
50-Floyd CT, Rothwell SW, Martin R, Risdahl J, Olson CE. A Salmon Thrombin-Fibrinogen Dressing Controls Hemorrhage in a Swine Model Compared to Standard Kaolin-Coated Gauze. J Spec Oper Med 2012; 12(1): 49-55.
51-Floyd CT, Rothwell SW, Risdahl J, Martin R, Olson C, Rose N. Salmon Thrombin-Fibrinogen Dressing Allows Greater Survival and Preserves Distal Blood Flow Compared to Standard Kaolin Gauze in Coagulopathic Swine with a Standardized Lethal Femoral Artery Injury. J Spec Oper Med 2012; 12(2): 16-26.
52-Mueller GR, Pineda TJ, Xie HX A Novel Sponge-Based Wound Stasis Dressing to Treat Lethal No compressible Hemorrhage. J Trauma Acute Care Surg 2012; 73(2 Supple 1): S134-9.
53-Chen YI, Barkun AN. Hemostatic Powders in Gastrointestinal Bleeding: A Systematic Review. Gastrointest Endosc Clin N Am 2015; 25(3): 535-52.
54-Beyazit Y, Kekilli M, Haznedaroglu IC, Kayacetin E, Basaranoglu M. Ankaferd Hemostat in the Management of Gastrointestinal Hemorrhages. World J Gastroenterol 2011; 17(35): 3962-70.
55-Burgert J, Gegel B, Neal AR, Kammer KE, Paul ME, Schwartz DJ, et al. The Effects of Arterial Blood Pressure on Rebleeding when Bleedarrest, Celox and Traumadex are used in a Porcine Model of Lethal Femoral Injury. Mil Med 2012; 177(3): 340-4.
56-Ereth MH, Schaff M, Ericson EF, Wetjen NM, Nuttall GA, Oliver WC Jr. Comparative safety and efficacy of topical hemostatic agents in a rat neurosurgical model. Europe 2008, 63(42): 369-72.
57-Pace Napoleone C, Valori A, Crupi G, Ocello S, Santoro F, Vouhé P, et al. An Observational Study of Coseal for the Prevention of Adhesions in Pediatric Cardiac Surgery. Interact Cardiovasc Thorac Surg 2009; 9(6): 978-82.
58-Lawson JH, Lynn KA, Vanmatre RM, Domzalski T, Klemp KF, Ortel TL, et al. Antihuman Factor V Antibodies after Use of Relatively Pure Bovine Thrombin. Ann Thorac Surg 2005; 79(3): 1037-8.
59-Lo CY, Jones C, Glader B, Zehnder JL. Development of Antibodies to Human Thrombin and Factor V in a Pediatric Patient Exposed to Topical Bovine Thrombin. Pediatr Blood Cancer 2010; 55(6): 1195-7.
60-Ran Y, Hadad E, Daher S, Ganor O, Kohn J, Yegorov Y, et al. Quikclot Combat Gauze Use for Hemorrhage Control in Military Trauma: January 2009 Israel Defense Force Experience in the Gaza Strip-A Preliminary Report of 14 Cases. Prehosp Disaster Med 2010; 25(6): 584-8.
61-Pogorielov M, Kalinkevich O, Deineka V, Garbuzova V, Solodovnik A, Kalinkevich A, et al. Haemostatic Chitosan Coated Gauze: in Vitro Interaction with Human Blood and in-Vivo Effectiveness Biomater Res 2015; 19: 22.
62-Udangawa RN, Mikael PE, Mancinelli Ch, Chapman C, Willard CF, Simmons TJ, Linhardt RJ. Novel Cellulose-Halloysite Hemostatic Nanocomposite Fibers with a Dramatic Reduction in Human Plasma Coagulation Time. ACS Appl Mater Interfaces 2019; 11(17): 15447-56.
2-Nouri S, Sharif MR, Panahi Y, Ghanei M, Jamali B. Efficacy and Safety of Aluminum Chloride in Controlling External Hemorrhage: An Animal Model Study. Iran Red Crescent Med J 2015; 17(3): e19714.
3-Tavakkoli L, Khanjani N. The Pattern of Road Crashes Emphasizing the Factors involved in their Occurrence in Kerman city 2012-2015. J Saf Promot Inj Prev 2016; 4(2): 101-8.
4-Abbasi M, Sadeghi M, Azami AA, Esmaeili SM, Kavousi J, Aryafard A. Factors Related to Road Traffic Accidents Leading to Injury or Death in Shahroud City. J Saf Promot Inj Prev 2016; 4(2): 83-90.
5-Khorshidi A, Ainy E, Soori H. Epidemiological Pattern of Road Traffic Injuries among Iranian Motorcyclist in 2012. J Saf Promot Inj Prev 2016; 4(1): 47-54
6-Achneck HE, Sileshi B, Jamiolkowski RM, Albala DM, Shapiro ML, Lawson JH. A Comprehensive Review of Topical Hemostatic Agents: Efficacy and Recommendations for Use. Ann Surg 2010; 251(2): 217-28
7-Bruno Monteiro Pereira, José Benedito Bortoto, Gustavo Pereira Fraga. Topical Hemostatic Agents in Surgery: Review and Prospects. Rev Col Bras Cir 2018; 45(5).
8-Samudrala S. Topical Hemostatic agents in Surgery: A Surgeon's Perspective. AORN J 2008 88(3): S2-S11.
9-Brad L. Bennett, Bleeding Control Using Hemostatic Dressings: Lessons Learned. Wilderness & Environmental Medicine 2017; 28: S39-S49.
10-Eastridge BJ, Mabry RL, Seguin P, Death on the Battlefield (2001-2011) Implications for the Future of Combat Casualty Care. J Trauma Acute Care Surg 2012; 73(6): S431-37.
11-Butler FK, Smith DJ, Carmona RH. Implementing and Preserving the Advances in Combat Casualty Care from Iraq and Afghanistan throughout the US Military. J Trauma Acute Care Surg 2015; 79(2): 321-26.
12-Valdez C, Sarani B, Young H, Amdur R, Dunne J, Chawla LS. Timing of Death after Traumatic Injury−A Contemporary Assessment of the Temporal Distribution of Death. J Surg Res 2016; 200(2): 604-9
13-Sobrino J, Shafi S. Timing and Causes of Death after Injuries. Proc (Bayl Univ MedCent) 2013; 26(2): 120-23.
14-Patton LL. Bleeding and Clotting Disorders. Burket’s Oral Medicine: Diagnosis and Treatment. 10th ed. Hamilton (ON): BC Decker 2003; 454-77.
15-Sileshi B, Achneck HE, Lawson JH. Management of Surgical Hemostasis: Topical Agents. Vascular 2008; 16(suppl 1): S22-S28.
16-Bayomi M. Zeolite-Loaded Alginate-Chitosan Hydrogel Beads as a Topical Hemostat [dissertation]. United States University of Maryland; 2015: 1671.
17-Wheat JC, Wolf JS. Advances in Bioadhesives, Tissue Sealants, and Hemostatic Agents. Urol Clin North Am 2009; 36(2): 265-75.
18-Gabay M. Absorbable Hemostatic Agents. American J Health-System Pharmacy 2006; 63(13): 1244-53.
19-H.khoshmohabat, Sh. Paydar, H. Kazemi, B. Dalfardi. Overview of Agents used for Emergency Hemostasis, Trauma Mon 2016; 21(1): e26023.
20-Bennett BL, Littlejohn L. Review of New Topical Hemostatic Dressings for Combat Casualty Care. Mil Med 2014; 179(5): 497-514.
21-Kheirabadi BS, Edens JW, Terrazas IB, Comparison of New Hemostatic Granules/Powders with Currently Deployed Hemostatic Products in a Lethal Model of Extremity Arterial Hemorrhage in Swine. J Trauma 2009; 66: 316-26.
22-de Carvalho MV, Marchi E, Pantoroto M, Rossini M, da Silva DM, Teodoro LF, et al. [Topical Haemostatic agents and Tissue Adhesives]. Rev Col Bras Cir 2013; 40(1): 66-71.
23-Spotnitz WD. Fibrin Sealant: The Only Approved Hemostat, Sealant, and Adhesive- A Laboratory and Clinical Perspective. Hindawi Publishing Corporation 2014; 1: 1-29.
24-Fischer CP, Wood CG, Shen J, Batiller J, Hart JC, Patel B, et al. A Randomized Trial of Aprotinin-Free Fibrin Sealant versus Absorbable Hemostat. Clin Appl Thromb Hemost 2011; 17(6): 572-77.
25-Kraus TW, Mehrabi A, Schemmer P, Kashfi A, Berberat P, Buchler MW. Scientific Evidence for Application of Topical Hemostats, Tissue Glues, and Sealants in Hepatobiliary Surgery. J Am Coll Surg 2005; 200(3): 418-27.
26-Kingsport T. Creator of Super Glue, former Eastman Employee, Dies At 94. Associated Press; 2011.
27-Belletrutti PJ, Romagnuolo J, Hilsden RJ, Chen F, Kaplan B, Love J, et al. Endoscopic Management of Gastric Varices: Efficacy and Outcomes of Gluing with N-Butyl-2-Cyanoacrylate in a North American Patient Population. Can J Gastroenterol 2008; 22(11): 931-6.
28-Marine L, Gupta R, Gornik HL, Kashyap VS. Glue Embolus Complicating the Endovascular Treatment of a Patient with Loeys-Dietz Syndrome. J Vasc Surg 2010; 52(5): 1350-3.
29-Yoshimatsu R, Takeuchi Y, Morishita H, Iida N, Okabe H, Yamagami T, et al. Successful Embolisation of Intrahepatic Portosystemic Venous Shunt Using Coils and N-Butyl Cyanoacrylate Through Two Approach Routes. Br J Radiol 2006; 79(947): e162-5.
30-Biggs G, Hafron J, Feliciano J, Hoenig DM. Treatment of Splenic Injury during Laparoscopic Nephrectomy with Bioglue, a Surgical Adhesive. Urology 2005; 66(4): 882.e3-882.e5.
31-Passage J, Jalali H, Tam RK, Harrocks S, O'Brien MF. Bioglue Surgical Adhesive--An Appraisal of its Indications in Cardiac Surgery. Ann Thorac Surg 2002; 74(2): 432-7.
32-Babin-Ebell J, Bougioukakis P, Urbanski P, Froehner S, Diegeler A. Foreign Material Reaction to Bioglue(R) as a Possible Cause of Cardiac Tamponade. Thorac Cardiovasc Surg 2010; 58(8): 489-91.
33-Oz MC, Rondinone JF, Shargill NS. Floseal Matrix: New Generation Topical Hemostatic Sealant. J Card Surg 2003; 18(6): 486-93.
34-Reuthebuch O, Lachat ML, Vogt P, Schurr U, Turina M. Floseal: A New Hemostyptic Agent in Peripheral Vascular Surgery. Vasa 2000; 29(3): 204-6.
35-Guzzo TJ, Pollock RA, Forney A, Aggarwal P, Matlaga BR, Allaf ME. Safety and Efficacy of a Surgeon-Prepared Gelatin Hemostatic Agent Compared with Floseal for Hemostasis in Laparoscopic Partial Nephrectomy. J Endourol 2009; 23(2): 279-82.
36-De Oliveira FM, de Carvalho MVH, Marchi E, Pinto CAL. Collagen, Fibrinogen and Thrombin Biological Addesive is Effective in Treating Experimental Liver Injuries. Rev Col Bras Cir 2016; 43(4): 254-61.
37-Wagner WR, Pachence JM, Ristich J, Johnson PC. Comparative in Vitro Analysis of Topical Hemostatic Agents. J Surg Res 1996; 66(2): 100-8.
38-Udangawa RN, Mikael PE, Mancinelli C, Novel Cellulose–Halloysite Hemostatic Nanocomposite Fibers with A Dramatic Reduction in Human Plasma Coagulation Time. ACS Appl Mater Interfaces 2019; 11(17): 15447-56.
39-Pusateri AE, Delgado AV, Dick EJ Application of a Granular Mineral-Based Hemostatic Agent (Quikclot) to Reduce Blood Loss after Grade V Liver Injury in Swine. J Trauma 2004; 57(3): 555-62.
40-Arnaud F,Tomori T,Carr W,McKeague A,Teranishi K,Prusaczyk K, et al. Exothermic Reaction in Zeolite Hemostatic Dressing: QuikClot ACS and ACS+. Biomedical Engineering 2008, 36(10): 1708-1713.
41-Bayır A, Eryılmaz M, Demirbilek M, Denkbaş EB, Arzıman I, Durusu M. Comparison of the Topical Haemostatic Efficacy of Nano-Micro Particles of Clinoptilolite and Kaolin in a Rat Model of Hemorrhagic Injury. Eur J Trauma Emerg Surg 2016; 42(1): 77-86.
42-Kozen BG, Kircher SJ, Henao J, Godinez FS, Johnson AS. An Alternative Hemostatic Dressing: Comparison of CELOX, Hemcon, and Quikclot. Acad Emerg Med 2008; 15(1): 74-81.
43-Butler FK, Holcomb JB, Giebner SD, McSwain NE, Bagian J. Tactical Com- Bat Casualty Care 2007: Evolving Concepts and Battlefield Experience. Mil Med 2007; 172 (suppl_1): 1-19.
44-Kheirabadi B. Evaluation of Topical Hemostatic Agents for Combat Wound Treatment. US Army Med Dep J 2011: 25-37.
45-Arul GS, Bowley DM, DiRusso S. The Use of Celox Gauze as an Adjunct to Pelvic Packing in Otherwise Uncontrollable Pelvic Haemorrhage Secondary to Penetrating Trauma. J R Army Med Corps 2012; 158(4): 331-3.
46-Pozza M, Millner RWJ. Celox (Chitosan) for Haemostasis in Massive Traumatic Bleeding: Experience in Afghanistan. Eur J Emerg Med 2011; 18(1): 31-3.
47-Pourshahrestani S, Zeimaran E, Djordjevic I, Kadri NA, Towler MR. Inorganic Hemostats: The State-of-the-Art and Recent Advances. Mater Sci Eng C Mater Biol Appl 2016; 58: 1255-68.
48-Arnaud F, Teranishi K, Tomori T, Carr W, Mccarron R. Comparison of 10 Hemostatic Dressing in a Groin Puncture Model in Swine. J Vasc Surg 2009; 50(3): 632-39.
49-Kheirabadi BS, Scherer MR, Estep JS, Dubick MA, Holcomb JB. Determination of Efficacy of New Hemostatic Dressings in a Model of Extremity Arterial Hemorrhage in Swine. J Trauma 2009; 67(3): 459-60.
50-Floyd CT, Rothwell SW, Martin R, Risdahl J, Olson CE. A Salmon Thrombin-Fibrinogen Dressing Controls Hemorrhage in a Swine Model Compared to Standard Kaolin-Coated Gauze. J Spec Oper Med 2012; 12(1): 49-55.
51-Floyd CT, Rothwell SW, Risdahl J, Martin R, Olson C, Rose N. Salmon Thrombin-Fibrinogen Dressing Allows Greater Survival and Preserves Distal Blood Flow Compared to Standard Kaolin Gauze in Coagulopathic Swine with a Standardized Lethal Femoral Artery Injury. J Spec Oper Med 2012; 12(2): 16-26.
52-Mueller GR, Pineda TJ, Xie HX A Novel Sponge-Based Wound Stasis Dressing to Treat Lethal No compressible Hemorrhage. J Trauma Acute Care Surg 2012; 73(2 Supple 1): S134-9.
53-Chen YI, Barkun AN. Hemostatic Powders in Gastrointestinal Bleeding: A Systematic Review. Gastrointest Endosc Clin N Am 2015; 25(3): 535-52.
54-Beyazit Y, Kekilli M, Haznedaroglu IC, Kayacetin E, Basaranoglu M. Ankaferd Hemostat in the Management of Gastrointestinal Hemorrhages. World J Gastroenterol 2011; 17(35): 3962-70.
55-Burgert J, Gegel B, Neal AR, Kammer KE, Paul ME, Schwartz DJ, et al. The Effects of Arterial Blood Pressure on Rebleeding when Bleedarrest, Celox and Traumadex are used in a Porcine Model of Lethal Femoral Injury. Mil Med 2012; 177(3): 340-4.
56-Ereth MH, Schaff M, Ericson EF, Wetjen NM, Nuttall GA, Oliver WC Jr. Comparative safety and efficacy of topical hemostatic agents in a rat neurosurgical model. Europe 2008, 63(42): 369-72.
57-Pace Napoleone C, Valori A, Crupi G, Ocello S, Santoro F, Vouhé P, et al. An Observational Study of Coseal for the Prevention of Adhesions in Pediatric Cardiac Surgery. Interact Cardiovasc Thorac Surg 2009; 9(6): 978-82.
58-Lawson JH, Lynn KA, Vanmatre RM, Domzalski T, Klemp KF, Ortel TL, et al. Antihuman Factor V Antibodies after Use of Relatively Pure Bovine Thrombin. Ann Thorac Surg 2005; 79(3): 1037-8.
59-Lo CY, Jones C, Glader B, Zehnder JL. Development of Antibodies to Human Thrombin and Factor V in a Pediatric Patient Exposed to Topical Bovine Thrombin. Pediatr Blood Cancer 2010; 55(6): 1195-7.
60-Ran Y, Hadad E, Daher S, Ganor O, Kohn J, Yegorov Y, et al. Quikclot Combat Gauze Use for Hemorrhage Control in Military Trauma: January 2009 Israel Defense Force Experience in the Gaza Strip-A Preliminary Report of 14 Cases. Prehosp Disaster Med 2010; 25(6): 584-8.
61-Pogorielov M, Kalinkevich O, Deineka V, Garbuzova V, Solodovnik A, Kalinkevich A, et al. Haemostatic Chitosan Coated Gauze: in Vitro Interaction with Human Blood and in-Vivo Effectiveness Biomater Res 2015; 19: 22.
62-Udangawa RN, Mikael PE, Mancinelli Ch, Chapman C, Willard CF, Simmons TJ, Linhardt RJ. Novel Cellulose-Halloysite Hemostatic Nanocomposite Fibers with a Dramatic Reduction in Human Plasma Coagulation Time. ACS Appl Mater Interfaces 2019; 11(17): 15447-56.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







