دوره 29، شماره 10 - ( دی 1400 )
جلد 29 شماره 10 صفحات 4208-4198 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rajabi M, Miresmaeili S M, Montazri F, Nasresfahani M, Zieai S J, Kalantar S M. Evaluating Mirna-222 Expression Level and Its Association with AMH for Early Diagnosis of Pcos-Like Symptoms in Epileptic Patients Plasma Treated with Sodium Valproate: A Case – Control Study. JSSU 2022; 29 (10) :4198-4208
URL: http://jssu.ssu.ac.ir/article-1-4946-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4946-fa.html
رجبی محیا، میراسماعیلی سیدمحسن، منتظری فاطمه، نصراصفهانی مهسا، ضیایی سیدجلال، کلانتر سیدمهدی. ارزیابی میزان بیان 222 -miR و همراهی آن با هورمون AMH جهت تشخیص زود هنگام علایم شبه سندرم تخمدان پلیکیستیک در پلاسما بیماران صرعی تحت درمان با والپرات سدیم: یک مطالعه مورد- شاهدی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (10) :4198-4208
متن کامل [PDF 1181 kb]
(838 دریافت)
| چکیده (HTML) (2306 مشاهده)
متن کامل: (1345 مشاهده)
مقدمه
صرع بیماری عصبی و مزمنی است که حداقل 50 میلیون نفر در سرار دنیا به آن مبتلا هستند، مهمترین مشخصه آن تشنجات بدون تحریک و مکرر است که با دارو کنترل میشود همچنین در موارد مقاوم به دارو نیاز به جراحی پیشنهاد میشود. کنترل حملات صرع با تجویز بیش از 15 نوع داروی ضد صرع دردسترس انجام میشود. در این بیماران یکی از اولویتهای درمانی، داروی سدیموالپرات بوده، که دارای فعالیت ضدتشنجی و تثبیتکننده خلق و خو میباشد همچنین کاربرد فراوانی در نوروپاتوفیزیولوژی شامل: صرع، اختلالات دوقطبی، سردردهای میگرنی، دردهای عصبی مزمن دارد. این دارو با تنظیم سطح گاما بوتیریک اسید و فعالیت کانال سدیمی، سبب مهار فعالیت بیش ازحد نورونها میشود. در مطالعات پیشین ثابت شده است که سدیموالپرات میتواند عوارض جانبی روی هورمونها و نیزتاثیر نامطلوبی روی زندگی فرد ازجمله: افزایش ریسک ابتلا به سندرم تخمدان پلیکیستیک، کاهش املاح معدنی دراستخوانها و کاهش باز جذب کلسیم در استخوانها، کاهش عملکرد جنسی به همراه داشته باشد. همچنین در افراد مسن نیز با ریسک پارکینسون برگشتپذیر و اختلالات شناختی حاصل از آن روبهرو خواهیم بود (1). در بعضی مقالات روانپزشکی و نورولوژی، سندرم تخمدان پلیسیستیک (Polycystic Ovary Syndrome) بهعنوان یکی از عارضههای مصرف دراز مدت والپرواتسدیم شناخته میشود. این سندرم که شایعترین اختلال غدد درونریز در زنان در سن باروری است، که بهصورت اختلال عملکرد تخمکگذاری، سطح بالای آندروژن بالینی (هیرسوتیسم) و بیوشیمیایی (هورمونهای مرتبط) و تخمدانهای پلیکیستیک (با تشخیص سونوگرافی) در بیماران دیده میشود، که در نتیجه آن با عوارض جدی شامل: هیپرپلازی آندومتر به صورت آتیپیک و تیپیک، افزایش خطر کارسینوم آندومتر، احتمالاً سرطان پستان، چاقی، افزایش خطر بیماری قلبی و عروقی و افزایش خطر دیابت شیرین (DM2T) روبهرو هستند، همچنین در نهایت نیز، این بیماران با کاهش نرخ باروری روبهرو خواهند بود (2). افزایش هورمون anti-mullerian hormone)) AMH نیز در بیماران مبتلا به (Polycystic Ovary Syndrome) PCOS گزارش شده و همچنین از آن به عنوان یک نشانگر افزایش ذخیره تخمدانی یاد میشود (3). AMH یک هورمون گلیکوپروتئینی و عضوی از فاکتور رشد-بتا است که توسط سلول گرانولوزای تخمدان تولید میشود. از نقشهای اصلی فیزیولوژیکی AMHمیتوان به تعدیل عملکرد FSH (Follicle-stimulating hormone) دراوایل رشد فولیکولی اشاره کرد. در دوران بلوغ نیز افزایش ترشح آن، از سلولهای گرانولوزای فولیکولهای در حال رشد تخمدان و کاهش سطح آن در طی سالهای باروری را خواهیم داشت. بهطوریکه پس از یائسگی به علت تهی شدن تخمدان از فولیکولهای در حال رشد میزان سرمی آن بسیار ناچیز میباشد (4). سطح سرمی AMH با تعداد فولیکولهای اولیه مرتبط است و در مقایسه با میزان هورمونهایLH(luteinizing hormone)، FSH، استرادیول، Inhibine B(در سومین روز سیکل ماهیانه) از اختصاصیت بالاتری برخوردار است (5). در زنان مبتلا به PCOs سطح هورمون AMH نسبت به زنان سالم افزایش چشمگیری دارد (6). همچنین مطالعات نشان داده است که سطح AMH سرم با تعداد فولیکول آنترال تخمدان (AFC) در زنان مبتلا به PCOS مرتبط است (7). همچنین مطالعات نشان دادکه سطح AMH، ارتباطی قوی با هایپرآندروژنیسم و AFC دارد. بنابراین میتوان از سطح AMH به عنوان یک ابزار جایگزین،PCOM (Polycystic Ovary Morphology) در سونوگرافی به منظور تشخیصPCOS استفاده کرد (8). به نظر میرسد استعدادهای ژنتیکی افراد در خصوص پاسخ به درمان دارویی میتواند متفاوت باشد (9). این تحقیق برای بیماران صرعی مصرف کننده سدیموالپرات جهت ارزیابی مارکر بیولوژی، 222-miRNA همچنین تعیین ارتباط آن با ابتلا به سندرم تخمدان پلیکیستیک طراحی شده که با استفاده از آن به توان قبل از تجویز این دارو بیمار را از نظر ابتلا به این سندرم بررسی کرد. همچنین با بررسی تغییرات پروفایل بیانی 222- miRNA به جای بررسی PCOM (Polycystic Ovary Morphology) در سونوگرافی و ارزیابی پروفایل هورمونی دخیل در این سندرم، حین مصرف دارو در بیماران مصروع عوارض دارو را بررسی و از پیشرفت آن جلوگیری کرد. همچنین میتوان برای بیماران مستعد ابتلا به این سندرم، داروهای دیگری به جای سدیموالپرات تجویز نمود و یا با استفاده از درمانهای کمکی به موقع، سبب پیشگیری از بروز سندرم تخمدان پلیکیستیک با تجویز دارویی همانند متفورمین ریسک ابتلا به این سندرم و یا حتی ریسک عوارض بعدی ناشی از سندرم تخمدان پلیکیستیک را کاهش داد. miRNAها قطعهای از RNAهای کوچک الیگونوکلئوتیدی، که قادر به تنظیم بیان ژن در سطح پس از رونویسی هستند (10) و نقش مهمی در مسیرسیگنالدهی و در نتیجه بروز بیماریها ایفا میکنند (11). بیان miRNA تغییر یافته با اختلالات مختلفی از جمله DM2T، IR، اختلال لیپید، ناباروری، تصلب شرایین، آندومتریوز و سرطان همراه است. با توجه به اینکه PCOS نیز دارای ویژگیهای مشابه است (12)، علاقه به بررسی نقش miRNAها در تشخیص و مدیریت PCOS افزایش مییابد. در سالهای اخیر، مطالعات نشان داده است که miRNA در مایعات مختلف بدن از جمله مایع فولیکولی زنان مبتلا به PCOS وجود دارد. بنابراین، میتواند به عنوان یک نشانگر زیستی بالقوه عمل کند و میتواند به عنوان یک هدف درمانی جدید برای تشخیص و درمان PCOS باشد (13). 222Mir 221 از یک جفت دسته ژن واقع در کروموزوم ) X3.11(Xp رونویسی میشوند که شامل قطعهای حفظ شده و شامل 727 باز میباشد (14). در بسیاری از مطالعات ارتباط شروع و پیشرفت سرطان و دیگر بیماریها با 222-miRNA تایید شده است (15). هایپرآندروژنیسم یکی از ویژگیهای کلیدی در افراد مبتلا به PCOs است و سطح آندروژنهای گردشی چون: تستوسترون، اندرواستندیون، دهیدروتسترون (DHT) در این بیماران بالا میباشد (16). در شماری از مدلهای حیوانی با القای دهیدروآندرواِستندیون، پاتولوژی PCOs مورد بررسی قرار گرفت (17). در گزارش اخیر برروی مدل موشی PCOs مزمن و با القای DHT حالت هایپرآندروژنیک و کیست تخمدان و اختلالات متابولیک شبیه به PCOs در انسان مورد بررسی قرار گرفت (18). محققان با القای دهیدروتسترون در مدل موشی PCOs و بررسی پروفایل بیانی miRNAهای مرتبط دریافتند که 25 microRNA از جمله بیان 222-miRNA پایین و متفاوتی را در بافت کیستیک تخمدان در مقایسه با گروه نرمال داشتند. همچنین محققان بازده سلولهای رحمی که با DHT تیمار شدهاند نیز با کاهش بیان 222-miRNA تاییدکردند. کاهش بیان 222-miRNA در سلولهای Theca تایید شده که موجب افزایش تکثیر سلولی با هدف قرار دادن1P/kip27 در این سلولها میشود (19). بهعلاوه بیش بیان 222-miRNA با کاهش رسپتور استروژن و مسیر سیگنالدهی آن و همچنین ژنهای هدف رسپتور استروژن مرتبط است (20). Sang و همکاران که بیان 222-miRNA در مایع فولیکولی افراد مبتلا به سندرم تخمدان پلی کیستیک گزارش کرده و همچنین microRNAهایی ازجمله: c520miRNA-،222-miRNA،320-miRNA،132- miRNA، 24- miRNA که نقش مهمی در استروئیدوژنزیز و تنظیم غلظت استرادیول دارند، را گزارش کردند (21). بر اساس مطالعات320-miRNA و 132- miRNA در مایع فولیکولی افراد مبتلا به PCOs در مقایسه با افراد سالم کاهش بیان داشتند همچنین 24- miRNA و5p -483 miRNA - نیز در تغییر غلظت پروژسترون در افراد مبتلا بهPCOs نقش ایفا میکنند (22). مطالعات نشان داد که بیان 222- miRNA در بیماران مبتلا به دیابت نوع2 افزایش داشته است (23).
روش بررسی
در این مطالعه موردی-شاهدی، نمونه خون مربوط به 33 زن مبتلا به صرع (از نوع کوچک یا پارشیال ویا فوکال، که توسط پزشک متخصص تشخیص داده شده بود) از میان 109 بیماری که جهت درمان صرع به درمانگاه صرع مسیح یاکلینیک خانواده مراجعه کرده بودند وارد مطالعه شدند. بدین شرح که50 بیمار برای اولین بار تحت درمان با سدیم والپرات قرارگرفتند(new case) و 45 بیمار دیگر قبلاً داروهای دیگری مانند فنوباربیتال یا گاباپنتین مصرف میکردند یا تحت درمان همزمان با چند داروی ضد صرع بودند. گروه بیماران مورد بررسی در محدوده سنی 35-18 سال و از قومیتهای مختلف ایرانی بودند (البته 11 بیمار نیز زیر سن 18سال بوده که از مطالعه حذف شدند). از جمله معیارهای ورود و خروج به این مطالعه عبارتند از:1- بیماران نباید هیچگونه سابقه بیماری کبدی یا کلیوی و یا داروهای مربوط به نارساییهای کبد و کلیه را در حین درمان مصرف کنند (تست کبد نرمال: آلانین آمینوترانسفراز و اسپارتات آمینوترانسفراز بیش از 3 واحد بیشتر از محدوده نرمال بوده و نارسایی کلیویی داشته باشند یعنی کراتینین سرم شان بیش از 1/7 میلیگرم در دسیلیتر باشد). 2- بیماران نباید هیچگونه داروی ضدبارداری در حین مطالعه مصرف کرده باشند (که در حین مطالعه 1نفر به علت حاملگی از مطالعه خارج شد). 3- سابقه بیماری تیروئیدی یا سندرم تخمدان پلیکیستیک نداشته باشند (که 2 بیمار به علت سایقه بیماری تیروئید از مطالعه خارج شدند). بیماران مورد بررسی افراد مصروعی هستند که با سدیم والپرات (500 میلیگرمی رها دارو) با (مقدار دوز نهایی مورد استفاده بیمار: 1000 میلیگرم یعنی قرص 500 میلیگرمی یکی صبح یکی شب مصرف میشود) تحت درماناند و پس از گذشت 6 ماه ابتلا به PCO آنها طبق معیار (NIH) اثبات شد. لازم به ذکر است از 50 بیمار مورد بررسی 10 بیمار به علت تعویض دارو و یا تجویز داروی دیگری همراه با والپرات سدیم و 4 مورد نیز به علت مصرف داروهایی مانند متفورمین از مطالعه حذف شدند. با توجه به هدف مطالعه در حین بررسی 36 نفر باقیمانده 3 نفر به علت عدم پیگیری کامل درمان نیز از مطالعه حذف شدند. در این مطالعه طبق قوانین اخلاقی رضایتنامهای تنظیم و بهصورت آگاهانه توسط افراد بیمار در ابتدا پژوهش تکمیل گردید و چنانچه هر یک از شرکتکنندگان در این پژوهش طی مطالعه تمایل به قطع همکاری داشتند آزادانه از مطالعه خارج شدند. برخی از اطلاعات مورد نیاز در این مطالعه از گزارش آزمایش بیماران یا پرسشنامه پرشده توسط متخصصان استخراج شده است. این موارد شامل سطح هورمون آنتیمولرین (AMH)،BMI (Body mass index)، سن، نوع صرع، فراوانی، سابقه خانوادگی و سن بروز علائم تشنج است.
نمونهگیری خون و استخراج RNA برای بررسی miRNA مورد مطالعه
جهت بررسی حدودCC 5 خون افراد واجد شرایط در لولههای EDTAدار جمعآوری شد و سریعاً لوله در یخ خشک قرار داده شد و در کمتر از یک ساعت نمونهها در دورrpm 3000 به مدت 10 دقیقه سانتریفوژ شدند و بعد از آن پلاسما حاصله به تیوپهای RNase free منتقل و در فریزر80- و تا زمان جمعآوری تمامی نمونهها (6 ماه) نگهداری گردید. به دلیل مقاومتر بودن miRNAها نسبت به RNA نمونهها از دست نمیروند، در این مطالعه miRNAهای مورد نظر از نوع خارج سلولی (ترشحی) میباشند بنابراین به پروتئینهای خارج سلولی نیز متصل بوده، که این خاصیت بر طول مدت نگهداری آنها میافزاید. استخراج RNA به کم.High Pure ROCH miRNA Isolation Kit(05080576001 (Cat.No و مطابق با پروتکل ان صورت گرفت. RNA استخراج شده در فریزر 80- را درفریزر نگهداری میکنیم. جهت ارزیابی مقدار و کیفیت RNA استخراج شده، از دستگاه نانو دراپ (c-Thermo scientific 2000 NanoDrop) استفاده شد. این دستگاه بدون نیاز به کووت و تنها با استفاده از 1 الی 2 میکرولیتر از نمونه قادر است در زمانی کمتر از 10 ثانیه کلیه طول موجهای موجود در طیف مورد نظر را با دقت 1 نانومتر اسکن نماید و غلظت یا جذب نوری ماده مورد نظر را نیز تعیین کند. برای این منظور با استفاده از جذب نمونه در طول موج nm260، غلظت RNA بهدست آمد. برای تعیین میزان خلوص RNA و بررسی احتمال وجود آلودگی با پروتئین نسبت A280/A260 محاسبه شده در نمونهها برابر 2-1/8 بود. این نسبت محاسبه شده توسط دستگاه در محدوده استاندارد است، نشاندهنده عدم آلودگی نمونه به پروتئین است.
روش ساخت cDNA و پرایمرهای آن
در این مطالعه، سنتز cDNA با پرایمرهای stem loop که با استفاده از microRNA databasehttp:// www.mirbase.org)) طراحی و توسط شرکت بن یاخته سنتز شد. سنتز cDNA با استفاده از کیت (Cat.BON.209001)BON-miR 1st-strand cDNA synthesis miRNA، انجام شد. در نهایت واکنش QRT-PCR برای miRNA، با استفاده از کیت (Cat.BON.209002)High-Specificity miRNA QPCR Core BON-miR Reagent Kit، پرایمر فوروارد اختصاصی و پرایمر reverse (universal) مورد نظر انجام شد. در انجام یک واکنش، استفاده از کنترل داخلی به منظور یکسانسازی تغییرات در مقدار cDNA در نمونههای مختلف ضروری است. در کیت حاضر، از پرایمرهای SNORD بهعنوان کنترل داخلی استفاده شد. همچنین دراین از (Cat. No. A325402) AMPLIQON QReal Plus 2x Green High ROX Master Mix به عنوان معرف فلوئورسنت استفاده شد.
پرایمرهای مورداستفاده برای سنتز cDNA
پرایمرهای stem loop اختصاصی 222-miRNA و پرایمر Snord (کنترل داخلی) مورد استفاده دراین مطالعه، توسط شرکت بن یاخته سنتز شد، همچنین توالی این پرایمرها درجدول زیر بیان شد.
جدول 1: توالی پرایمرهای مورداستفاده

بررسی بیان کمی miRNA مورد مطالعه با استفاده از تکنیک Real Time PCR
برای اجرای Real time PCR از پروتکل پیشنهادی شرکت AMPLIQON استفاده شد. زیرا مسترمیکس حاوی سایبرگرین این شرکت مورد استفاده قرارگرفت. پس از مخلوط کردن اجزای واکنش مطابق با دستور العمل کیت BON-miR QPCR انجام شد. کیت مذکور حاوی معرفهای لازم برای انجام واکنش QPCR بر روی cDNA تهیه شده از miRNAها میباشد. دقت معرفها به حدی بالاست که توانایی شناسایی miRNA در مقادیر کم و حتی با یک نوکلئوتید تفاوت را نیز دارا می باشند، واکنش Real time PCR در دستگاه Applied Biosystems StepOne انجام شد. پس از اتمام واکنش، تعیین مقادیر Ct، تحلیل و مقادیر 2^-Δctگزارش شد.
تجزیه وتحلیل آماری
برای بررسی آماری نتایج از نرمافزار SPSS version 16 استفاده شد. از آزمونهای ANOVA ,T-test student ,Tukey ,Corralation برای آنالیز آماری نتایج آزمایشات و ارزیابی آنها استفاده شد. معنیداری نتایج برحسب Pvalue<0/05 سنجیده شد.
ملاحظات اخلاقی
در این تحقیق ملاحظات اخلاقی مورد تایید شورای کمیته اخلاق قرار گرفته است (کداخلاق:IR.SSU.RSI.REC.1396.8).
نتایج
بیان222 -miRNA در نمونه پلاسما افراد مبتلا به صرع در بازههای زمانی قبل ازدرمان، 3 و 6 ماه بعد از درمان اندازهگیری و با کمک نرمافزار SPSS تحلیل شد. بررسیهای آماری مشخص کرد که بیان 222-miRNA در نمونه پلاسما افراد مبتلا به صرع بعد از مصرف دارو نسبت به نمونه پلاسما افراد صرعی قبل از مصرف دارو، کاهش و سطح هورمون AMH افزایش معنیداری داشته است (0/05<P). با تست TUKey و ANOVA بیان 222- mir و دیگر متغیرها در سه بازه زمانی مذکور آنالیز شد.که در نتیجه این آنالیز تغییرات سن و BMI در دوبازه زمانی قبل از درمان و 3 ماه بعد از آن نسبت بازه زمانی 6 ماه معنادارنیست. بیان 222-miRNA و تغییرات هورمونی AMH با توجه به آنالیز صورت گرفته در دو بازه زمانی 3و6 ماه نسبت به قبل از درمان معنادار بوده که شرح بیان 222-miRNA در هر سه گروه در (نمودار1) است. بیان 222-miRNA و همچنین سطح AMH دربازه زمانی3 ماه نسبت به 6 ماه معنیدار نبوده است. نتایج به دست آمده از تست correlation که بین بیان 222-miRNA در سه بازه زمانی و دو متغیر دیگر سن وBMI انجام شد، نشان داد که در نتیجه تغییرات سن و BMI با تغییرات بیان 222-miRNA مرتبط یا همبسته نیست یا به عبارتی این دو عامل بر بیان 222-miRNA تاثیرگذار نیستند و هیچ ارتباط معناداری بین آنها پیدا نشد. اما ارتباط معناداری بین بازه زمانی مصرف دارو، میزان AMH و بیان 222-miRNA یافت شد (جدول3).
جدول 2: مقایسه میانگین وانحراف استاندارد متغیرها در بیماران مبتلا به صرع قبل و بعد از درمان با سدیم والپروات دربازههای 3و 6 ماه
.JPG)
جدول3: همبستگی متغیرهای دموگرافیک و هورمون AMH با میزان بیان 222- miRNA بین بازه های زمانی 3و6 ماه بعدازمصرف دارو وقبل ازآن
.JPG)
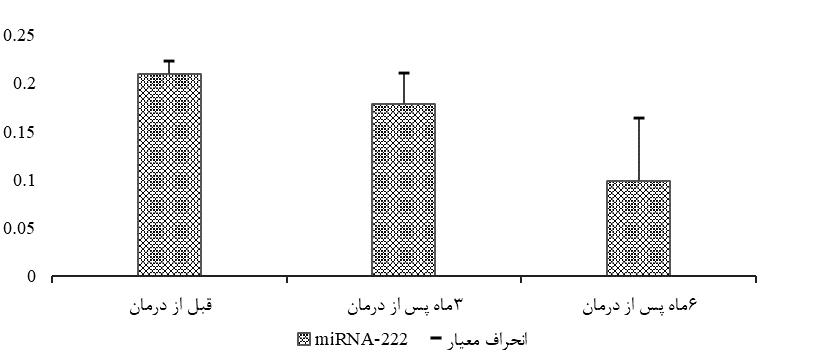
نمودار1: میانگین و انحراف معیار بیان (-ΔCT 2) 222 -miRNA در بیماران مبتلا به صرع قبل و بعد از درمان با سدیم والپروات دربازههای 3و 6 ماه
بحث
نتایج مطالعه حاضر نشان میدهد که AMH به صورت مشهود با کاهش بیان 222-miRNA ارتباط مستقیم دارد. سدیم والپرات یک ترکیب استیک بوده، که به عنوان ضدتشنج در درمان صرع، mood stabilizing agent در درمان مانیا و بیماری دو قطبی، سردردهای میگرنی، دردهای عصبی مزمن، به خوبی عمل میکند. در بیماران مبتلا به صرع یکی از اولویتهای درمانی، داروی سدیم والپرات است، با وجود این، تحقیقات نشان داد در مبتلایان به صرع که این دارو را مصرف میکنند در بعضی موارد عوارضی مانند PCOs گزارش شده است، به نظر میرسد استعدادهای ژنتیکی افراد میتواند روی میزان پاسخ درمانی به این دارو تاثیرگذار باشد. با استفاده از تکنیک microarray که توسط Long و همکاران انجام شد، آنالیز پروفایل بیانی microRNAهای سرم در افراد مبتلا به PCOs مورد بررسی قرار گرفت که در این مطالعه افزایش بیان 8 microRNA شامل: 222-,miRNA 16-miRNA، 186- miRNA،a 19 ,miRNA-24 a ,miRNA- 146miRNA- ، b 106-miRNA ،c 30- miRNA گزارش شد. یافتههای Q-PCR نیزبیش بیان 222miRNA - ، c30- miRNA را درافراد مبتلا به PCOs تایید کرد (24). نتیجه چند آنالیز لجستیک نیز بیان این 2 microRNA را به عنوان بیومارکرهای مهمی در PCOs معرفی کرد (25). در مطالعات اخیر نشان داده شده که سطح بیان ,222-miRNA به طور معناداری در پلاسما و بافت تخمدان زنان مبتلا به PCOs نسبت به سالم کاهش دارد (26). و در نهایت باتوجه به آنالیزهای آماری بیوانفورماتیکی نشان داده شده که ژن هدف این miRNA درگیر در آپپتوزیس، چرخه سلولی و مسیرآندوکرینی شامل مسیرهای: MAPK ,WNT ,JAK-STA میشود (27). در مطالعات انجام شده روی بیماران مبتلا به سندرم تخمدان پلیکیستیک این چنین مطرح شد که افزایش سیگنالینگ گابا در آنها سبب ازدیاد فعالیت سیستم GnRH/LH و در نتیجه ارتباط موثر با پایین دست خودش باشد. خانمهای مبتلا به PCOs در مایع مغزی نخاعی خود دارای سطح GABA بالاتری نسبت به گروه شاهد میباشند. استفاده از والپرات سدیم نیز (که خود افزایش دهنده سطح گابا است) جهت درمان بیماران صرعی نیز تجویز میشود، با ابتلا به PCOs همبستگی دارد. مطالعات نشان داد که، بیان 222-miRNA علاوه بر تاثیر در رشد سرطان سینه، تهاجم و مهاجرت سلولها، با هدف قرار دادن مسیرPTEN/AKT در افزایش توانایی خود نوسازی سلولهای بنیادی نیز نقش ایفا میکند (28). کاهش بیان 222-miRNA با کاهش تنظیمی هیستون داستیلاز که در فعالیت سلولهای NK/c-Jun و فعال کردن فاکتور هستهای 65 NF-κBpنقش دارند موجب پیشرفت سرطان بعضی سرطانها از جمله سرطان کبد نیز میشود (29). Tanaka و همکاران دریافتند که متفورمین با مهار بیان 222-miRNA سبب توقف سلول در فازG1، افزایش فرایند آپوپتوز و تنظیم بالای27P میشود(30). با خاموشکردن 222-miRNA با الیگونوکلئوتید anti-miRNA میتوان به واسطه بیش تنظیمی PTEN رشد سلولهای سرطانی را مهار و تهاجم سلولی را کنترل نمود، همچنین سبب افزایش حساسیت به رادیواکتیو در سلولهای سرطانی به واسطه بیش تنظیمی این پروتئین را خواهیم داشت. بیان 222-miRNA در پلاسما هبستگی معناداری با متاستاز غددلنفاوی و بقای آنها دارد (31). در حقیقت والپرات باعث افزایش آندروژنزیز از طریق مهار سیتوکروم450 Pکه منجر به مهار تبدیل تستورون به استروژن میشود، یک حالت هایپرآندروژنیک را ایجاد میکند. آندروژنزیز در تخمدان در اولین مرحله توسط سلولهای thecal که ژن c450 cytochromeP را بیان میکنند، LH را بهDHEA) dehydroepiandrosterone) و androstenedione تبدیل میکند (32). بیشتر این پیشسازها توسط سلولهای گرانولار که آنزیم 450 aromatase Pرا داشته باشند، تبدیل به استروژن میشوند البته، معمولاً تخمدانها بر خلاف غدد آدرنال مستقیماً آندروژن تولید میکنند، معمولاً بهصورت تستوسترون و آندرواستندیون. c450 یکی از مهمترین آنزیمها، جهت تولید استروئید و بیوژنز آندروژنها است. این آنزیم توسط یک ژن توسط سلولهای thecal کد میشود که هم فعالیت 17,20-lyase و α17 hydroxylase - را دارند، که در تولید کورتیزول، آلدوسترون و DHEA نقش ایفا میکنند (33). افزایش هورمون AMH که خود نشاندهنده افزایش ذخایر فولیکولی در بیماران مبتلا به سندرم تخمدان پلی کیستیک است، اما در این مطالعه با بررسی این هورمون میتوان مانند بیان 222-miRNA به شناسایی افراد مبتلا وکنترل عوارض کمک کرد(34).
نتیجه گیری
مطابق با نتایج مطالعه حاضر، مبنی بر افزایش هورمون AMH که خود نشاندهنده افزایش ذخایر فولیکولی در بیماران مبتلا به سندرم تخمدان پلی کیستیک است و همچنین باتوجه به نتایج تست correlation که بیانگر ارتباط معناداری بین بازه زمانی مصرف دارو، میزان AMH و بیان 222-miRNA بود. پس درنتیجه می توان جهت کنترل بهتر عوارض احتمالی دارو، احتمالاً تعویض به موقع دارو و همچنین تشخیص زود هنگام PCOs(علائم شبه PCOs)، ازارزیابی تغییرات بیان 222-miRNA هم زمان با سنجش AMH استفاده کرد
سپاسگزاری
این پژوهش ماحصل بخش اولیه طرح تحقیقاتی مصوب در مرکزتحقیقات سقط، پژوهشکده علوم تولید مثل یزد میباشد. با سپاس و قدردانی فراوان از استاد بزرگوار دکتر سیدمهدی کلانتر و مدیر مرکز و تمامی پرسنل آزمایشگاه ژنتیک این مرکز از جمله سرکار خانم دکتر فاطمه منتظری و همچنین از آقای دکتر سیدمسعود اعتمادیفر و تمامی پرسنل زحمتکش آزمایشگاه ژنوم تحت مدیریت آقای دکتر منصور صالحی و آزمایشگاه ژنتیک بیمارستان الزهرا اصفهان که در امر نمونهگیری یاری رساندند، کمال تشکر را دارم. از تمامی اساتید راهنما و مشاور نیز سپاسگزار هستم.
حامی مالی:پژوهشکده علوم تولیدمثل یزد
تعارض در منافع : ندارد
صرع بیماری عصبی و مزمنی است که حداقل 50 میلیون نفر در سرار دنیا به آن مبتلا هستند، مهمترین مشخصه آن تشنجات بدون تحریک و مکرر است که با دارو کنترل میشود همچنین در موارد مقاوم به دارو نیاز به جراحی پیشنهاد میشود. کنترل حملات صرع با تجویز بیش از 15 نوع داروی ضد صرع دردسترس انجام میشود. در این بیماران یکی از اولویتهای درمانی، داروی سدیموالپرات بوده، که دارای فعالیت ضدتشنجی و تثبیتکننده خلق و خو میباشد همچنین کاربرد فراوانی در نوروپاتوفیزیولوژی شامل: صرع، اختلالات دوقطبی، سردردهای میگرنی، دردهای عصبی مزمن دارد. این دارو با تنظیم سطح گاما بوتیریک اسید و فعالیت کانال سدیمی، سبب مهار فعالیت بیش ازحد نورونها میشود. در مطالعات پیشین ثابت شده است که سدیموالپرات میتواند عوارض جانبی روی هورمونها و نیزتاثیر نامطلوبی روی زندگی فرد ازجمله: افزایش ریسک ابتلا به سندرم تخمدان پلیکیستیک، کاهش املاح معدنی دراستخوانها و کاهش باز جذب کلسیم در استخوانها، کاهش عملکرد جنسی به همراه داشته باشد. همچنین در افراد مسن نیز با ریسک پارکینسون برگشتپذیر و اختلالات شناختی حاصل از آن روبهرو خواهیم بود (1). در بعضی مقالات روانپزشکی و نورولوژی، سندرم تخمدان پلیسیستیک (Polycystic Ovary Syndrome) بهعنوان یکی از عارضههای مصرف دراز مدت والپرواتسدیم شناخته میشود. این سندرم که شایعترین اختلال غدد درونریز در زنان در سن باروری است، که بهصورت اختلال عملکرد تخمکگذاری، سطح بالای آندروژن بالینی (هیرسوتیسم) و بیوشیمیایی (هورمونهای مرتبط) و تخمدانهای پلیکیستیک (با تشخیص سونوگرافی) در بیماران دیده میشود، که در نتیجه آن با عوارض جدی شامل: هیپرپلازی آندومتر به صورت آتیپیک و تیپیک، افزایش خطر کارسینوم آندومتر، احتمالاً سرطان پستان، چاقی، افزایش خطر بیماری قلبی و عروقی و افزایش خطر دیابت شیرین (DM2T) روبهرو هستند، همچنین در نهایت نیز، این بیماران با کاهش نرخ باروری روبهرو خواهند بود (2). افزایش هورمون anti-mullerian hormone)) AMH نیز در بیماران مبتلا به (Polycystic Ovary Syndrome) PCOS گزارش شده و همچنین از آن به عنوان یک نشانگر افزایش ذخیره تخمدانی یاد میشود (3). AMH یک هورمون گلیکوپروتئینی و عضوی از فاکتور رشد-بتا است که توسط سلول گرانولوزای تخمدان تولید میشود. از نقشهای اصلی فیزیولوژیکی AMHمیتوان به تعدیل عملکرد FSH (Follicle-stimulating hormone) دراوایل رشد فولیکولی اشاره کرد. در دوران بلوغ نیز افزایش ترشح آن، از سلولهای گرانولوزای فولیکولهای در حال رشد تخمدان و کاهش سطح آن در طی سالهای باروری را خواهیم داشت. بهطوریکه پس از یائسگی به علت تهی شدن تخمدان از فولیکولهای در حال رشد میزان سرمی آن بسیار ناچیز میباشد (4). سطح سرمی AMH با تعداد فولیکولهای اولیه مرتبط است و در مقایسه با میزان هورمونهایLH(luteinizing hormone)، FSH، استرادیول، Inhibine B(در سومین روز سیکل ماهیانه) از اختصاصیت بالاتری برخوردار است (5). در زنان مبتلا به PCOs سطح هورمون AMH نسبت به زنان سالم افزایش چشمگیری دارد (6). همچنین مطالعات نشان داده است که سطح AMH سرم با تعداد فولیکول آنترال تخمدان (AFC) در زنان مبتلا به PCOS مرتبط است (7). همچنین مطالعات نشان دادکه سطح AMH، ارتباطی قوی با هایپرآندروژنیسم و AFC دارد. بنابراین میتوان از سطح AMH به عنوان یک ابزار جایگزین،PCOM (Polycystic Ovary Morphology) در سونوگرافی به منظور تشخیصPCOS استفاده کرد (8). به نظر میرسد استعدادهای ژنتیکی افراد در خصوص پاسخ به درمان دارویی میتواند متفاوت باشد (9). این تحقیق برای بیماران صرعی مصرف کننده سدیموالپرات جهت ارزیابی مارکر بیولوژی، 222-miRNA همچنین تعیین ارتباط آن با ابتلا به سندرم تخمدان پلیکیستیک طراحی شده که با استفاده از آن به توان قبل از تجویز این دارو بیمار را از نظر ابتلا به این سندرم بررسی کرد. همچنین با بررسی تغییرات پروفایل بیانی 222- miRNA به جای بررسی PCOM (Polycystic Ovary Morphology) در سونوگرافی و ارزیابی پروفایل هورمونی دخیل در این سندرم، حین مصرف دارو در بیماران مصروع عوارض دارو را بررسی و از پیشرفت آن جلوگیری کرد. همچنین میتوان برای بیماران مستعد ابتلا به این سندرم، داروهای دیگری به جای سدیموالپرات تجویز نمود و یا با استفاده از درمانهای کمکی به موقع، سبب پیشگیری از بروز سندرم تخمدان پلیکیستیک با تجویز دارویی همانند متفورمین ریسک ابتلا به این سندرم و یا حتی ریسک عوارض بعدی ناشی از سندرم تخمدان پلیکیستیک را کاهش داد. miRNAها قطعهای از RNAهای کوچک الیگونوکلئوتیدی، که قادر به تنظیم بیان ژن در سطح پس از رونویسی هستند (10) و نقش مهمی در مسیرسیگنالدهی و در نتیجه بروز بیماریها ایفا میکنند (11). بیان miRNA تغییر یافته با اختلالات مختلفی از جمله DM2T، IR، اختلال لیپید، ناباروری، تصلب شرایین، آندومتریوز و سرطان همراه است. با توجه به اینکه PCOS نیز دارای ویژگیهای مشابه است (12)، علاقه به بررسی نقش miRNAها در تشخیص و مدیریت PCOS افزایش مییابد. در سالهای اخیر، مطالعات نشان داده است که miRNA در مایعات مختلف بدن از جمله مایع فولیکولی زنان مبتلا به PCOS وجود دارد. بنابراین، میتواند به عنوان یک نشانگر زیستی بالقوه عمل کند و میتواند به عنوان یک هدف درمانی جدید برای تشخیص و درمان PCOS باشد (13). 222Mir 221 از یک جفت دسته ژن واقع در کروموزوم ) X3.11(Xp رونویسی میشوند که شامل قطعهای حفظ شده و شامل 727 باز میباشد (14). در بسیاری از مطالعات ارتباط شروع و پیشرفت سرطان و دیگر بیماریها با 222-miRNA تایید شده است (15). هایپرآندروژنیسم یکی از ویژگیهای کلیدی در افراد مبتلا به PCOs است و سطح آندروژنهای گردشی چون: تستوسترون، اندرواستندیون، دهیدروتسترون (DHT) در این بیماران بالا میباشد (16). در شماری از مدلهای حیوانی با القای دهیدروآندرواِستندیون، پاتولوژی PCOs مورد بررسی قرار گرفت (17). در گزارش اخیر برروی مدل موشی PCOs مزمن و با القای DHT حالت هایپرآندروژنیک و کیست تخمدان و اختلالات متابولیک شبیه به PCOs در انسان مورد بررسی قرار گرفت (18). محققان با القای دهیدروتسترون در مدل موشی PCOs و بررسی پروفایل بیانی miRNAهای مرتبط دریافتند که 25 microRNA از جمله بیان 222-miRNA پایین و متفاوتی را در بافت کیستیک تخمدان در مقایسه با گروه نرمال داشتند. همچنین محققان بازده سلولهای رحمی که با DHT تیمار شدهاند نیز با کاهش بیان 222-miRNA تاییدکردند. کاهش بیان 222-miRNA در سلولهای Theca تایید شده که موجب افزایش تکثیر سلولی با هدف قرار دادن1P/kip27 در این سلولها میشود (19). بهعلاوه بیش بیان 222-miRNA با کاهش رسپتور استروژن و مسیر سیگنالدهی آن و همچنین ژنهای هدف رسپتور استروژن مرتبط است (20). Sang و همکاران که بیان 222-miRNA در مایع فولیکولی افراد مبتلا به سندرم تخمدان پلی کیستیک گزارش کرده و همچنین microRNAهایی ازجمله: c520miRNA-،222-miRNA،320-miRNA،132- miRNA، 24- miRNA که نقش مهمی در استروئیدوژنزیز و تنظیم غلظت استرادیول دارند، را گزارش کردند (21). بر اساس مطالعات320-miRNA و 132- miRNA در مایع فولیکولی افراد مبتلا به PCOs در مقایسه با افراد سالم کاهش بیان داشتند همچنین 24- miRNA و5p -483 miRNA - نیز در تغییر غلظت پروژسترون در افراد مبتلا بهPCOs نقش ایفا میکنند (22). مطالعات نشان داد که بیان 222- miRNA در بیماران مبتلا به دیابت نوع2 افزایش داشته است (23).
روش بررسی
در این مطالعه موردی-شاهدی، نمونه خون مربوط به 33 زن مبتلا به صرع (از نوع کوچک یا پارشیال ویا فوکال، که توسط پزشک متخصص تشخیص داده شده بود) از میان 109 بیماری که جهت درمان صرع به درمانگاه صرع مسیح یاکلینیک خانواده مراجعه کرده بودند وارد مطالعه شدند. بدین شرح که50 بیمار برای اولین بار تحت درمان با سدیم والپرات قرارگرفتند(new case) و 45 بیمار دیگر قبلاً داروهای دیگری مانند فنوباربیتال یا گاباپنتین مصرف میکردند یا تحت درمان همزمان با چند داروی ضد صرع بودند. گروه بیماران مورد بررسی در محدوده سنی 35-18 سال و از قومیتهای مختلف ایرانی بودند (البته 11 بیمار نیز زیر سن 18سال بوده که از مطالعه حذف شدند). از جمله معیارهای ورود و خروج به این مطالعه عبارتند از:1- بیماران نباید هیچگونه سابقه بیماری کبدی یا کلیوی و یا داروهای مربوط به نارساییهای کبد و کلیه را در حین درمان مصرف کنند (تست کبد نرمال: آلانین آمینوترانسفراز و اسپارتات آمینوترانسفراز بیش از 3 واحد بیشتر از محدوده نرمال بوده و نارسایی کلیویی داشته باشند یعنی کراتینین سرم شان بیش از 1/7 میلیگرم در دسیلیتر باشد). 2- بیماران نباید هیچگونه داروی ضدبارداری در حین مطالعه مصرف کرده باشند (که در حین مطالعه 1نفر به علت حاملگی از مطالعه خارج شد). 3- سابقه بیماری تیروئیدی یا سندرم تخمدان پلیکیستیک نداشته باشند (که 2 بیمار به علت سایقه بیماری تیروئید از مطالعه خارج شدند). بیماران مورد بررسی افراد مصروعی هستند که با سدیم والپرات (500 میلیگرمی رها دارو) با (مقدار دوز نهایی مورد استفاده بیمار: 1000 میلیگرم یعنی قرص 500 میلیگرمی یکی صبح یکی شب مصرف میشود) تحت درماناند و پس از گذشت 6 ماه ابتلا به PCO آنها طبق معیار (NIH) اثبات شد. لازم به ذکر است از 50 بیمار مورد بررسی 10 بیمار به علت تعویض دارو و یا تجویز داروی دیگری همراه با والپرات سدیم و 4 مورد نیز به علت مصرف داروهایی مانند متفورمین از مطالعه حذف شدند. با توجه به هدف مطالعه در حین بررسی 36 نفر باقیمانده 3 نفر به علت عدم پیگیری کامل درمان نیز از مطالعه حذف شدند. در این مطالعه طبق قوانین اخلاقی رضایتنامهای تنظیم و بهصورت آگاهانه توسط افراد بیمار در ابتدا پژوهش تکمیل گردید و چنانچه هر یک از شرکتکنندگان در این پژوهش طی مطالعه تمایل به قطع همکاری داشتند آزادانه از مطالعه خارج شدند. برخی از اطلاعات مورد نیاز در این مطالعه از گزارش آزمایش بیماران یا پرسشنامه پرشده توسط متخصصان استخراج شده است. این موارد شامل سطح هورمون آنتیمولرین (AMH)،BMI (Body mass index)، سن، نوع صرع، فراوانی، سابقه خانوادگی و سن بروز علائم تشنج است.
نمونهگیری خون و استخراج RNA برای بررسی miRNA مورد مطالعه
جهت بررسی حدودCC 5 خون افراد واجد شرایط در لولههای EDTAدار جمعآوری شد و سریعاً لوله در یخ خشک قرار داده شد و در کمتر از یک ساعت نمونهها در دورrpm 3000 به مدت 10 دقیقه سانتریفوژ شدند و بعد از آن پلاسما حاصله به تیوپهای RNase free منتقل و در فریزر80- و تا زمان جمعآوری تمامی نمونهها (6 ماه) نگهداری گردید. به دلیل مقاومتر بودن miRNAها نسبت به RNA نمونهها از دست نمیروند، در این مطالعه miRNAهای مورد نظر از نوع خارج سلولی (ترشحی) میباشند بنابراین به پروتئینهای خارج سلولی نیز متصل بوده، که این خاصیت بر طول مدت نگهداری آنها میافزاید. استخراج RNA به کم.High Pure ROCH miRNA Isolation Kit(05080576001 (Cat.No و مطابق با پروتکل ان صورت گرفت. RNA استخراج شده در فریزر 80- را درفریزر نگهداری میکنیم. جهت ارزیابی مقدار و کیفیت RNA استخراج شده، از دستگاه نانو دراپ (c-Thermo scientific 2000 NanoDrop) استفاده شد. این دستگاه بدون نیاز به کووت و تنها با استفاده از 1 الی 2 میکرولیتر از نمونه قادر است در زمانی کمتر از 10 ثانیه کلیه طول موجهای موجود در طیف مورد نظر را با دقت 1 نانومتر اسکن نماید و غلظت یا جذب نوری ماده مورد نظر را نیز تعیین کند. برای این منظور با استفاده از جذب نمونه در طول موج nm260، غلظت RNA بهدست آمد. برای تعیین میزان خلوص RNA و بررسی احتمال وجود آلودگی با پروتئین نسبت A280/A260 محاسبه شده در نمونهها برابر 2-1/8 بود. این نسبت محاسبه شده توسط دستگاه در محدوده استاندارد است، نشاندهنده عدم آلودگی نمونه به پروتئین است.
روش ساخت cDNA و پرایمرهای آن
در این مطالعه، سنتز cDNA با پرایمرهای stem loop که با استفاده از microRNA databasehttp:// www.mirbase.org)) طراحی و توسط شرکت بن یاخته سنتز شد. سنتز cDNA با استفاده از کیت (Cat.BON.209001)BON-miR 1st-strand cDNA synthesis miRNA، انجام شد. در نهایت واکنش QRT-PCR برای miRNA، با استفاده از کیت (Cat.BON.209002)High-Specificity miRNA QPCR Core BON-miR Reagent Kit، پرایمر فوروارد اختصاصی و پرایمر reverse (universal) مورد نظر انجام شد. در انجام یک واکنش، استفاده از کنترل داخلی به منظور یکسانسازی تغییرات در مقدار cDNA در نمونههای مختلف ضروری است. در کیت حاضر، از پرایمرهای SNORD بهعنوان کنترل داخلی استفاده شد. همچنین دراین از (Cat. No. A325402) AMPLIQON QReal Plus 2x Green High ROX Master Mix به عنوان معرف فلوئورسنت استفاده شد.
پرایمرهای مورداستفاده برای سنتز cDNA
پرایمرهای stem loop اختصاصی 222-miRNA و پرایمر Snord (کنترل داخلی) مورد استفاده دراین مطالعه، توسط شرکت بن یاخته سنتز شد، همچنین توالی این پرایمرها درجدول زیر بیان شد.
جدول 1: توالی پرایمرهای مورداستفاده

بررسی بیان کمی miRNA مورد مطالعه با استفاده از تکنیک Real Time PCR
برای اجرای Real time PCR از پروتکل پیشنهادی شرکت AMPLIQON استفاده شد. زیرا مسترمیکس حاوی سایبرگرین این شرکت مورد استفاده قرارگرفت. پس از مخلوط کردن اجزای واکنش مطابق با دستور العمل کیت BON-miR QPCR انجام شد. کیت مذکور حاوی معرفهای لازم برای انجام واکنش QPCR بر روی cDNA تهیه شده از miRNAها میباشد. دقت معرفها به حدی بالاست که توانایی شناسایی miRNA در مقادیر کم و حتی با یک نوکلئوتید تفاوت را نیز دارا می باشند، واکنش Real time PCR در دستگاه Applied Biosystems StepOne انجام شد. پس از اتمام واکنش، تعیین مقادیر Ct، تحلیل و مقادیر 2^-Δctگزارش شد.
تجزیه وتحلیل آماری
برای بررسی آماری نتایج از نرمافزار SPSS version 16 استفاده شد. از آزمونهای ANOVA ,T-test student ,Tukey ,Corralation برای آنالیز آماری نتایج آزمایشات و ارزیابی آنها استفاده شد. معنیداری نتایج برحسب Pvalue<0/05 سنجیده شد.
ملاحظات اخلاقی
در این تحقیق ملاحظات اخلاقی مورد تایید شورای کمیته اخلاق قرار گرفته است (کداخلاق:IR.SSU.RSI.REC.1396.8).
نتایج
بیان222 -miRNA در نمونه پلاسما افراد مبتلا به صرع در بازههای زمانی قبل ازدرمان، 3 و 6 ماه بعد از درمان اندازهگیری و با کمک نرمافزار SPSS تحلیل شد. بررسیهای آماری مشخص کرد که بیان 222-miRNA در نمونه پلاسما افراد مبتلا به صرع بعد از مصرف دارو نسبت به نمونه پلاسما افراد صرعی قبل از مصرف دارو، کاهش و سطح هورمون AMH افزایش معنیداری داشته است (0/05<P). با تست TUKey و ANOVA بیان 222- mir و دیگر متغیرها در سه بازه زمانی مذکور آنالیز شد.که در نتیجه این آنالیز تغییرات سن و BMI در دوبازه زمانی قبل از درمان و 3 ماه بعد از آن نسبت بازه زمانی 6 ماه معنادارنیست. بیان 222-miRNA و تغییرات هورمونی AMH با توجه به آنالیز صورت گرفته در دو بازه زمانی 3و6 ماه نسبت به قبل از درمان معنادار بوده که شرح بیان 222-miRNA در هر سه گروه در (نمودار1) است. بیان 222-miRNA و همچنین سطح AMH دربازه زمانی3 ماه نسبت به 6 ماه معنیدار نبوده است. نتایج به دست آمده از تست correlation که بین بیان 222-miRNA در سه بازه زمانی و دو متغیر دیگر سن وBMI انجام شد، نشان داد که در نتیجه تغییرات سن و BMI با تغییرات بیان 222-miRNA مرتبط یا همبسته نیست یا به عبارتی این دو عامل بر بیان 222-miRNA تاثیرگذار نیستند و هیچ ارتباط معناداری بین آنها پیدا نشد. اما ارتباط معناداری بین بازه زمانی مصرف دارو، میزان AMH و بیان 222-miRNA یافت شد (جدول3).
جدول 2: مقایسه میانگین وانحراف استاندارد متغیرها در بیماران مبتلا به صرع قبل و بعد از درمان با سدیم والپروات دربازههای 3و 6 ماه
.JPG)
جدول3: همبستگی متغیرهای دموگرافیک و هورمون AMH با میزان بیان 222- miRNA بین بازه های زمانی 3و6 ماه بعدازمصرف دارو وقبل ازآن
.JPG)

نمودار1: میانگین و انحراف معیار بیان (-ΔCT 2) 222 -miRNA در بیماران مبتلا به صرع قبل و بعد از درمان با سدیم والپروات دربازههای 3و 6 ماه
بحث
نتایج مطالعه حاضر نشان میدهد که AMH به صورت مشهود با کاهش بیان 222-miRNA ارتباط مستقیم دارد. سدیم والپرات یک ترکیب استیک بوده، که به عنوان ضدتشنج در درمان صرع، mood stabilizing agent در درمان مانیا و بیماری دو قطبی، سردردهای میگرنی، دردهای عصبی مزمن، به خوبی عمل میکند. در بیماران مبتلا به صرع یکی از اولویتهای درمانی، داروی سدیم والپرات است، با وجود این، تحقیقات نشان داد در مبتلایان به صرع که این دارو را مصرف میکنند در بعضی موارد عوارضی مانند PCOs گزارش شده است، به نظر میرسد استعدادهای ژنتیکی افراد میتواند روی میزان پاسخ درمانی به این دارو تاثیرگذار باشد. با استفاده از تکنیک microarray که توسط Long و همکاران انجام شد، آنالیز پروفایل بیانی microRNAهای سرم در افراد مبتلا به PCOs مورد بررسی قرار گرفت که در این مطالعه افزایش بیان 8 microRNA شامل: 222-,miRNA 16-miRNA، 186- miRNA،a 19 ,miRNA-24 a ,miRNA- 146miRNA- ، b 106-miRNA ،c 30- miRNA گزارش شد. یافتههای Q-PCR نیزبیش بیان 222miRNA - ، c30- miRNA را درافراد مبتلا به PCOs تایید کرد (24). نتیجه چند آنالیز لجستیک نیز بیان این 2 microRNA را به عنوان بیومارکرهای مهمی در PCOs معرفی کرد (25). در مطالعات اخیر نشان داده شده که سطح بیان ,222-miRNA به طور معناداری در پلاسما و بافت تخمدان زنان مبتلا به PCOs نسبت به سالم کاهش دارد (26). و در نهایت باتوجه به آنالیزهای آماری بیوانفورماتیکی نشان داده شده که ژن هدف این miRNA درگیر در آپپتوزیس، چرخه سلولی و مسیرآندوکرینی شامل مسیرهای: MAPK ,WNT ,JAK-STA میشود (27). در مطالعات انجام شده روی بیماران مبتلا به سندرم تخمدان پلیکیستیک این چنین مطرح شد که افزایش سیگنالینگ گابا در آنها سبب ازدیاد فعالیت سیستم GnRH/LH و در نتیجه ارتباط موثر با پایین دست خودش باشد. خانمهای مبتلا به PCOs در مایع مغزی نخاعی خود دارای سطح GABA بالاتری نسبت به گروه شاهد میباشند. استفاده از والپرات سدیم نیز (که خود افزایش دهنده سطح گابا است) جهت درمان بیماران صرعی نیز تجویز میشود، با ابتلا به PCOs همبستگی دارد. مطالعات نشان داد که، بیان 222-miRNA علاوه بر تاثیر در رشد سرطان سینه، تهاجم و مهاجرت سلولها، با هدف قرار دادن مسیرPTEN/AKT در افزایش توانایی خود نوسازی سلولهای بنیادی نیز نقش ایفا میکند (28). کاهش بیان 222-miRNA با کاهش تنظیمی هیستون داستیلاز که در فعالیت سلولهای NK/c-Jun و فعال کردن فاکتور هستهای 65 NF-κBpنقش دارند موجب پیشرفت سرطان بعضی سرطانها از جمله سرطان کبد نیز میشود (29). Tanaka و همکاران دریافتند که متفورمین با مهار بیان 222-miRNA سبب توقف سلول در فازG1، افزایش فرایند آپوپتوز و تنظیم بالای27P میشود(30). با خاموشکردن 222-miRNA با الیگونوکلئوتید anti-miRNA میتوان به واسطه بیش تنظیمی PTEN رشد سلولهای سرطانی را مهار و تهاجم سلولی را کنترل نمود، همچنین سبب افزایش حساسیت به رادیواکتیو در سلولهای سرطانی به واسطه بیش تنظیمی این پروتئین را خواهیم داشت. بیان 222-miRNA در پلاسما هبستگی معناداری با متاستاز غددلنفاوی و بقای آنها دارد (31). در حقیقت والپرات باعث افزایش آندروژنزیز از طریق مهار سیتوکروم450 Pکه منجر به مهار تبدیل تستورون به استروژن میشود، یک حالت هایپرآندروژنیک را ایجاد میکند. آندروژنزیز در تخمدان در اولین مرحله توسط سلولهای thecal که ژن c450 cytochromeP را بیان میکنند، LH را بهDHEA) dehydroepiandrosterone) و androstenedione تبدیل میکند (32). بیشتر این پیشسازها توسط سلولهای گرانولار که آنزیم 450 aromatase Pرا داشته باشند، تبدیل به استروژن میشوند البته، معمولاً تخمدانها بر خلاف غدد آدرنال مستقیماً آندروژن تولید میکنند، معمولاً بهصورت تستوسترون و آندرواستندیون. c450 یکی از مهمترین آنزیمها، جهت تولید استروئید و بیوژنز آندروژنها است. این آنزیم توسط یک ژن توسط سلولهای thecal کد میشود که هم فعالیت 17,20-lyase و α17 hydroxylase - را دارند، که در تولید کورتیزول، آلدوسترون و DHEA نقش ایفا میکنند (33). افزایش هورمون AMH که خود نشاندهنده افزایش ذخایر فولیکولی در بیماران مبتلا به سندرم تخمدان پلی کیستیک است، اما در این مطالعه با بررسی این هورمون میتوان مانند بیان 222-miRNA به شناسایی افراد مبتلا وکنترل عوارض کمک کرد(34).
نتیجه گیری
مطابق با نتایج مطالعه حاضر، مبنی بر افزایش هورمون AMH که خود نشاندهنده افزایش ذخایر فولیکولی در بیماران مبتلا به سندرم تخمدان پلی کیستیک است و همچنین باتوجه به نتایج تست correlation که بیانگر ارتباط معناداری بین بازه زمانی مصرف دارو، میزان AMH و بیان 222-miRNA بود. پس درنتیجه می توان جهت کنترل بهتر عوارض احتمالی دارو، احتمالاً تعویض به موقع دارو و همچنین تشخیص زود هنگام PCOs(علائم شبه PCOs)، ازارزیابی تغییرات بیان 222-miRNA هم زمان با سنجش AMH استفاده کرد
سپاسگزاری
این پژوهش ماحصل بخش اولیه طرح تحقیقاتی مصوب در مرکزتحقیقات سقط، پژوهشکده علوم تولید مثل یزد میباشد. با سپاس و قدردانی فراوان از استاد بزرگوار دکتر سیدمهدی کلانتر و مدیر مرکز و تمامی پرسنل آزمایشگاه ژنتیک این مرکز از جمله سرکار خانم دکتر فاطمه منتظری و همچنین از آقای دکتر سیدمسعود اعتمادیفر و تمامی پرسنل زحمتکش آزمایشگاه ژنوم تحت مدیریت آقای دکتر منصور صالحی و آزمایشگاه ژنتیک بیمارستان الزهرا اصفهان که در امر نمونهگیری یاری رساندند، کمال تشکر را دارم. از تمامی اساتید راهنما و مشاور نیز سپاسگزار هستم.
حامی مالی:پژوهشکده علوم تولیدمثل یزد
تعارض در منافع : ندارد
References:
1- Shorvon S. Handbook of Epilepsy Treatment. 3th ed. Progress in Neurology and Psychiatry. American: John Wiley & Sons(Wiley); 2010; 4.
2- Lizneva D, Suturina L, Walker W, Brakta S, Gavrilova-Jordan L, Azziz R. Criteria, Prevalence, and Phenotypes of Polycystic Ovary Syndrome. Fertility and Sterility 2016: 106(1): 6-15.
3- Wang L, Fan H, Zou Y, Yuan Q, Hu X, Chen X, et al. Aberrant Expression of Long Non-coding RNAs in Exosomes in Follicle Fluid from PCOS Patients. Front Genet 2021; 11: 1-10.
4- Bedenk J, Vrtačnik-Bokal E, Virant-Klun I. The Role of Anti-Müllerian Hormone (AMH) in Ovarian Disease and Infertility. J Assist Reprod Genet 2020; 37(1): 89-100.
5- Qin L, Zhao S, Yang P, Cao Y, Zhang J, Chen ZJ, et al. Variation Analysis of Anti-Müllerian Hormone Gene in Chinese Women with Polycystic Ovary Syndrome. Endocrine 2021; 72(1): 287-93.
6- Stracquadanio M, Ciotta L, Palumbo MA. Relationship between Serum Anti-Mullerian Hormone and Intrafollicular AMH Levels in PCOS Women. Gynecol Endocrinol 2018; 34(3): 223-8. Available
7- Sova H, Unkila-Kallio L, Tiitinen A, Hippeläinen M, Perheentupa A, Tinkanen H, et al. Hormone Profiling, Including Anti-Müllerian Hormone (AMH), for the Diagnosis of Polycystic Ovary Syndrome (PCOS) and Characterization of PCOS Phenotypes. Gynecol Endocrinol 2019; 35(7): 595-600.
8- Dewailly D, Barbotin AL, Dumont A, Catteau-Jonard S, Robin G. Role of Anti-Müllerian Hormone in the Pathogenesis of Polycystic Ovary Syndrome. Front Endocrinol (Lausanne) 2020; 11: 641.
9- Gerhard L. Impact of Epilepsy and AEDs on Reproductive Health. In: Harden CL, Thomas SV, Tomson T, editors. Epilepsy in Women. 1rd ed. American: John Wiley & Sons(Wiley); 2013; 53-63.
10- Chen X, Liang H, Zhang J, Zen K, Zhang CY. Horizontal Transfer of Micrornas: Molecular Mechanisms and Clinical Applications. Protein Cell 2012; 3(1): 28-37.
11- Wang J, Chen J, Sen S. MicroRNA as Biomarkers and Diagnostics. J Cell Physiol 2016; 231(1): 25-30.
12- Chen Z, Ou H, Wu H, Wu P, Mo Z. Role of microRNA in the Pathogenesis of Polycystic Ovary Syndrome. DNA Cell Biol 2019; 38(8): 754-62.
13- Abdalla M, Deshmukh H, Atkin SL, Sathyapalan T. Mirnas as a Novel Clinical Biomarker and Therapeutic Targets in Polycystic Ovary Syndrome (PCOS): A Review. Life Sci 2020; 259:118174.
14- Han SH, Kim HJ, Gwak JM, Kim M, Chung YR, Park SY. Microrna-222 Expression as a Predictive Marker for Tumor Progression in Hormone Receptor-Positive Breast Cancer. J Breast Cancer 2017; 20(1): 35-44.
15- Kim EJ, Jang M, Choi JH, Park KS, Cho IH. An improved dehydroepiandrosterone-induced rat model of polycystic ovary syndrome (Pcos): Post-pubertal improve pcos’s features. Front Endocrinol (Lausanne) 2018; 9: 1-7.
16- Guedikian AA, Lee AY, Grogan TR, Abbott DH, Largaespada K, Chazenbalk GD, et al. Reproductive and Metabolic Determinants of Granulosa Cell Dysfunction in Normal-Weight Polycystic Ovary. Fertil Steril 2019; 109(3): 508-15.
17- Rababa’h AM, Matani BR, Ababneh MA. The Ameliorative Effects of Marjoram in Dehydroepiandrosterone Induced Polycystic Ovary Syndrome in Rats. Life Sci 2020; 261: 118353.
18- Hossain MM, Cao M, Wang Q, Kim JY, Schellander K, Tesfaye D, et al. Altered Expression of Mirnas in a Dihydrotestosterone-Induced Rat PCOS Model. J Ovarian Res 2013; 6: 1-11.
19- Sun Y, Chen G, He J, Huang ZG, Li SH, Yang YP, et al. Clinical Significance and Potential Molecular Mechanism of Mirna-222-3p in Metastatic Prostate Cancer. Bioengineered 2021; 12(1): 325-40.
20- Hossain MM, Cao M, Wang Q, Kim JY, Schellander K, Tesfaye D, et al. Altered Expression of Mirnas in a Dihydrotestosterone-Induced Rat PCOS Model. J Ovarian Res 2013; 6(1): 36.
21- Sørensen AE, Wissing ML, Salö S, Englund ALM, Dalgaard LT. Micrornas Related to Polycystic Ovary Syndrome (Pcos). Genes (Basel) 2014; 5(3): 684-708.
22- Liu S, Sun X, Wang M, Hou Y, Zhan Y, Jiang Y, et al. A Microrna 221- And 222-Mediated Feedback Loop Maintains Constitutive Activation of Nfκb and STAT3 in Colorectal Cancer Cells. Gastroenterology 2014; 147(4): 847-59.e11.
23- Balasubramanyam M, Aravind S, Gokulakrishnan K, Prabu P, Sathishkumar C, Ranjani H, et al. Impaired Mir-146a Expression Links Subclinical Inflammation and Insulin Resistance in Type 2 Diabetes. Mol Cell Biochem. 2011; 351(1-2): 197-205.
24- Long W, Zhao C, Ji C, Ding H, Cui Y, Guo X, et al. Characterization of Serum Micrornas Profile of PCOS and Identification of Novel Non-Invasive Biomarkers. Cell Physiol Biochem 2014; 33(5): 1304-15.
25- Trikudanathan S. Polycystic Ovarian Syndrome. Medical Clinics of North America 2015; 99: 221-35.
26- Chen B, Xu P, Wang J, Zhang C. The Role of Mirna in Polycystic Ovary Syndrome (PCOS). Gene 2019; 706: 91-6.
27- Imbar T, Eisenberg I. Regulatory Role of Micrornas in Ovarian Function. Fertility and Sterility 2014; 101(6): 1524-30.
28- Li B, Lu Y, Wang H, Han X, Mao J, Li J, et al. Mir-221/222 Enhance the Tumorigenicity of Human Breast Cancer Stem Cells Via Modulation of PTEN/Akt Pathway. Biomed Pharmacother 2016; 79: 93-101.
29- Bae HJ, Jung KH, Eun JW, Shen Q, Kim HS, Park SJ, et al. Microrna-221 Governs Tumor Suppressor HDAC6 to Potentiate Malignant Progression of Liver Cancer. J Hepatol 2015; 63(2): 408-19.
30- Tanaka R, Tomosugi M, Horinaka M, Sowa Y, Sakai T. Metformin Causes G1-Phase Arrest Via Down-Regulation of MIR-221 and Enhances TRAIL Sensitivity Through DR5 Up-Regulation in Pancreatic Cancer Cells. PLoS One 2015; 10(5): e0125779.
31- Fu Z, Qian F, Yang X, Jiang H, Chen Y, Liu S. Circulating Mir-222 in Plasma and its Potential Diagnostic and Prognostic Value in Gastric Cancer. Med Oncol 2014; 31(9): 164.
32- Zore T, Joshi NV, Lizneva D, Azziz R. Polycystic Ovarian Syndrome: Long-Term Health Consequences. Semin Reprod Med 2017; 35(3): 271-81.
33- Dewailly D, Robin G, Peigne M, Decanter C, Pigny P, Catteau-Jonard S. Interactions between Androgens, FSH, Anti-Mullerian Hormone and Estradiol During Folliculogenesis in the Human Normal and Polycystic Ovary. Hum Reprod Update 2016; 22(6): 709-24.
34- Cavallo GP, Cavallo R. New Perspectives on the Pathogenesis of Rhinitis. G Batteriol Virol Immunol 2018; 84(1-12): 107-24.
1- Shorvon S. Handbook of Epilepsy Treatment. 3th ed. Progress in Neurology and Psychiatry. American: John Wiley & Sons(Wiley); 2010; 4.
2- Lizneva D, Suturina L, Walker W, Brakta S, Gavrilova-Jordan L, Azziz R. Criteria, Prevalence, and Phenotypes of Polycystic Ovary Syndrome. Fertility and Sterility 2016: 106(1): 6-15.
3- Wang L, Fan H, Zou Y, Yuan Q, Hu X, Chen X, et al. Aberrant Expression of Long Non-coding RNAs in Exosomes in Follicle Fluid from PCOS Patients. Front Genet 2021; 11: 1-10.
4- Bedenk J, Vrtačnik-Bokal E, Virant-Klun I. The Role of Anti-Müllerian Hormone (AMH) in Ovarian Disease and Infertility. J Assist Reprod Genet 2020; 37(1): 89-100.
5- Qin L, Zhao S, Yang P, Cao Y, Zhang J, Chen ZJ, et al. Variation Analysis of Anti-Müllerian Hormone Gene in Chinese Women with Polycystic Ovary Syndrome. Endocrine 2021; 72(1): 287-93.
6- Stracquadanio M, Ciotta L, Palumbo MA. Relationship between Serum Anti-Mullerian Hormone and Intrafollicular AMH Levels in PCOS Women. Gynecol Endocrinol 2018; 34(3): 223-8. Available
7- Sova H, Unkila-Kallio L, Tiitinen A, Hippeläinen M, Perheentupa A, Tinkanen H, et al. Hormone Profiling, Including Anti-Müllerian Hormone (AMH), for the Diagnosis of Polycystic Ovary Syndrome (PCOS) and Characterization of PCOS Phenotypes. Gynecol Endocrinol 2019; 35(7): 595-600.
8- Dewailly D, Barbotin AL, Dumont A, Catteau-Jonard S, Robin G. Role of Anti-Müllerian Hormone in the Pathogenesis of Polycystic Ovary Syndrome. Front Endocrinol (Lausanne) 2020; 11: 641.
9- Gerhard L. Impact of Epilepsy and AEDs on Reproductive Health. In: Harden CL, Thomas SV, Tomson T, editors. Epilepsy in Women. 1rd ed. American: John Wiley & Sons(Wiley); 2013; 53-63.
10- Chen X, Liang H, Zhang J, Zen K, Zhang CY. Horizontal Transfer of Micrornas: Molecular Mechanisms and Clinical Applications. Protein Cell 2012; 3(1): 28-37.
11- Wang J, Chen J, Sen S. MicroRNA as Biomarkers and Diagnostics. J Cell Physiol 2016; 231(1): 25-30.
12- Chen Z, Ou H, Wu H, Wu P, Mo Z. Role of microRNA in the Pathogenesis of Polycystic Ovary Syndrome. DNA Cell Biol 2019; 38(8): 754-62.
13- Abdalla M, Deshmukh H, Atkin SL, Sathyapalan T. Mirnas as a Novel Clinical Biomarker and Therapeutic Targets in Polycystic Ovary Syndrome (PCOS): A Review. Life Sci 2020; 259:118174.
14- Han SH, Kim HJ, Gwak JM, Kim M, Chung YR, Park SY. Microrna-222 Expression as a Predictive Marker for Tumor Progression in Hormone Receptor-Positive Breast Cancer. J Breast Cancer 2017; 20(1): 35-44.
15- Kim EJ, Jang M, Choi JH, Park KS, Cho IH. An improved dehydroepiandrosterone-induced rat model of polycystic ovary syndrome (Pcos): Post-pubertal improve pcos’s features. Front Endocrinol (Lausanne) 2018; 9: 1-7.
16- Guedikian AA, Lee AY, Grogan TR, Abbott DH, Largaespada K, Chazenbalk GD, et al. Reproductive and Metabolic Determinants of Granulosa Cell Dysfunction in Normal-Weight Polycystic Ovary. Fertil Steril 2019; 109(3): 508-15.
17- Rababa’h AM, Matani BR, Ababneh MA. The Ameliorative Effects of Marjoram in Dehydroepiandrosterone Induced Polycystic Ovary Syndrome in Rats. Life Sci 2020; 261: 118353.
18- Hossain MM, Cao M, Wang Q, Kim JY, Schellander K, Tesfaye D, et al. Altered Expression of Mirnas in a Dihydrotestosterone-Induced Rat PCOS Model. J Ovarian Res 2013; 6: 1-11.
19- Sun Y, Chen G, He J, Huang ZG, Li SH, Yang YP, et al. Clinical Significance and Potential Molecular Mechanism of Mirna-222-3p in Metastatic Prostate Cancer. Bioengineered 2021; 12(1): 325-40.
20- Hossain MM, Cao M, Wang Q, Kim JY, Schellander K, Tesfaye D, et al. Altered Expression of Mirnas in a Dihydrotestosterone-Induced Rat PCOS Model. J Ovarian Res 2013; 6(1): 36.
21- Sørensen AE, Wissing ML, Salö S, Englund ALM, Dalgaard LT. Micrornas Related to Polycystic Ovary Syndrome (Pcos). Genes (Basel) 2014; 5(3): 684-708.
22- Liu S, Sun X, Wang M, Hou Y, Zhan Y, Jiang Y, et al. A Microrna 221- And 222-Mediated Feedback Loop Maintains Constitutive Activation of Nfκb and STAT3 in Colorectal Cancer Cells. Gastroenterology 2014; 147(4): 847-59.e11.
23- Balasubramanyam M, Aravind S, Gokulakrishnan K, Prabu P, Sathishkumar C, Ranjani H, et al. Impaired Mir-146a Expression Links Subclinical Inflammation and Insulin Resistance in Type 2 Diabetes. Mol Cell Biochem. 2011; 351(1-2): 197-205.
24- Long W, Zhao C, Ji C, Ding H, Cui Y, Guo X, et al. Characterization of Serum Micrornas Profile of PCOS and Identification of Novel Non-Invasive Biomarkers. Cell Physiol Biochem 2014; 33(5): 1304-15.
25- Trikudanathan S. Polycystic Ovarian Syndrome. Medical Clinics of North America 2015; 99: 221-35.
26- Chen B, Xu P, Wang J, Zhang C. The Role of Mirna in Polycystic Ovary Syndrome (PCOS). Gene 2019; 706: 91-6.
27- Imbar T, Eisenberg I. Regulatory Role of Micrornas in Ovarian Function. Fertility and Sterility 2014; 101(6): 1524-30.
28- Li B, Lu Y, Wang H, Han X, Mao J, Li J, et al. Mir-221/222 Enhance the Tumorigenicity of Human Breast Cancer Stem Cells Via Modulation of PTEN/Akt Pathway. Biomed Pharmacother 2016; 79: 93-101.
29- Bae HJ, Jung KH, Eun JW, Shen Q, Kim HS, Park SJ, et al. Microrna-221 Governs Tumor Suppressor HDAC6 to Potentiate Malignant Progression of Liver Cancer. J Hepatol 2015; 63(2): 408-19.
30- Tanaka R, Tomosugi M, Horinaka M, Sowa Y, Sakai T. Metformin Causes G1-Phase Arrest Via Down-Regulation of MIR-221 and Enhances TRAIL Sensitivity Through DR5 Up-Regulation in Pancreatic Cancer Cells. PLoS One 2015; 10(5): e0125779.
31- Fu Z, Qian F, Yang X, Jiang H, Chen Y, Liu S. Circulating Mir-222 in Plasma and its Potential Diagnostic and Prognostic Value in Gastric Cancer. Med Oncol 2014; 31(9): 164.
32- Zore T, Joshi NV, Lizneva D, Azziz R. Polycystic Ovarian Syndrome: Long-Term Health Consequences. Semin Reprod Med 2017; 35(3): 271-81.
33- Dewailly D, Robin G, Peigne M, Decanter C, Pigny P, Catteau-Jonard S. Interactions between Androgens, FSH, Anti-Mullerian Hormone and Estradiol During Folliculogenesis in the Human Normal and Polycystic Ovary. Hum Reprod Update 2016; 22(6): 709-24.
34- Cavallo GP, Cavallo R. New Perspectives on the Pathogenesis of Rhinitis. G Batteriol Virol Immunol 2018; 84(1-12): 107-24.
نوع مطالعه: کارآزمایی بالینی |
موضوع مقاله:
ژنتیک
دریافت: 1398/5/7 | پذیرش: 1400/10/10 | انتشار: 1400/10/10
دریافت: 1398/5/7 | پذیرش: 1400/10/10 | انتشار: 1400/10/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







