دوره 28، شماره 6 - ( شهریور 1399 )
جلد 28 شماره 6 صفحات 2765-2755 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jokar M, Zarei F, Sherafati Moghadam M, Alizadeh Palavani H. Effect of 8-Week Endurance Training on the Content of Mtor and SREBP1 Proteins in Subcutaneous Fat Tissue in Obese Type 2 Diabetic Male Sprague-Dawley Rats. JSSU 2020; 28 (6) :2755-2765
URL: http://jssu.ssu.ac.ir/article-1-4936-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4936-fa.html
جوکار مسعود، زارعی فاطمه، شرافتی مقدم محمد، علیزاده پهلوانی حامد. تأثیر 8 هفته تمرین استقامتی بر محتوای پروتئینهای mTOR و SREBP1 در بافت چربی زیرجلدی موشهای صحرایی نر اسپراگوداولی چاق مبتلا به دیابت نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (6) :2755-2765
متن کامل [PDF 782 kb]
(1141 دریافت)
| چکیده (HTML) (2865 مشاهده)
متن کامل: (2524 مشاهده)
مقدمه
بیماری دیابت از جمله بیماریهای متابولیک در حال گسترش است که به خاطر مرگومیر، عوارض بالا و هزینههای درمانی، فشار اقتصادی هنگفتی بر خانواده و اجتماع وارد میکند (1). دیابت نوع 2 به علت فرآیند کاهش متابولیسم بدن، افزایش بافت چربی و کمتحرکی، شیوع بیشتری دارد. این بیماری شامل گروهی از بیماریهای متابولیک است که در اثر نقص در عملکرد و ترشح انسولین ایجاد شده و منجر به افزایش مقدار گلوکز در خون میگردد (2). عوامل مختلفی سلولی و مولکولی در ایجاد این عوارض درگیر هستند که از مهمترین آنها، پروتئینهای تنظیمکننده بافت چربی یعنی پروتئین هدف راپامایسین در پستاندارن (mTOR) Mammalian Target of Rapamycin و پروتئین متصل بهعنصر پاسخ استرول 1 (SREBP1) Sterol Regulatory Element-Binding Protein 1 میباشند (3). نتایج مطالعات نشان میدهند که این پروتئینها، نقش مهمی در این فرایندهای پاتولوژیک ایفا مینمایند. در طی چند سال گذشته، چندین گروه تحقیقاتی مسیر mTORC1 را بهعنوان تنظیمکننده مهم لیپوژنز شناسایی کردهاند. مسیر mTORC1، که انسولین و مواد مغذی را حس میکند، بیوسنتز لیپید را با تنظیم عملکرد SREBP1 در چند مرحله فعال میکند (4). اختلال در تنظیم سیگنالینگ mTORC1 منجر به چاقی/اضافه وزن میشود. اما، با توجه به نقش اصلی mTOR در فرایندهای سلولی، احتمالاً مهار سیستمیک mTOR عوارض جانبی قابلتوجهی خواهد داشت که ممکن است مزایای درمانی مرتبط با استفاده از مهارکنندههای mTOR را تحت تاثیر قرار دهد (5). پروتئین SREBP1 از طریق آبشار سیگنالینگ انسولین میتواند تحریک و فعال شود. انسولین با فعالکردن پروتئینهای پاییندست یعنی، Insulin Receptor Substrate IRS-1/2 و PI3K منجر به فعالشدن پروتئین Protein Kinase B AKT میشود (6). پروتئین AKT پروتئین بالادست mTOR است که میتواند منجر به فعالشدن mTOR شود. mTOR یک پروتئین کلیدی در تنظیم فرآیندهای سلولی از جمله تنظیم سوختوساز و متابولیسم بافت چربی است که این فرآیندها را از طریق تنظیم پروتئین SREBP-1 انجام میدهد (7). پروتئینهای SREBP نقش متمرکزی در متابولیسم سلولها با کنترل سنتز اسیدهای چرب، تریگلیسیرید و کلسترول دارند (8). فعالیت ورزشی منظم تأثیرات مفیدی بر سلامت کلی دارد و نقش فعالیت ورزشی در درمان و پیشگیری از بیماریهای متابولیک مانند چاقی و دیابت نوع 2 به خوبی شناختهشده است. تمرین ورزشی، هومئوستاز گلوکز کل بدن را بهبود بخشیده و حساسیت به انسولین را افزایش میدهد، که این تأثیرات را مربوط به سازگاریهای عضله اسکلتی، بافت چربی میدانند (9). شواهد قوی وجود دارد که فعالیت ورزشی منظم به وزن بدن و از دست دادن چربی، حفظ وزن بدن و کاهش چربی و تناسب متابولیکی در چاقی کمک میکند. تمرینات استقامتی به نظر میرسد در این زمینه بیشترین تأثیر را داشته باشد (10). هدف از انجام تمرینات استقامتی بهکارگیری حداکثر توان در بیشترین ظرفیت اکسیداسیون چربیها و کاهش اکسیداسیون کربوهیدراتها است. در ضمن تمرینات استقامتی در کاهش چربیهای بدن و در نتیجه افزایش متابولیسم بدن تاثیر چشمگیری دارد (11). با این وجود سازوکار مولکولی تأثیرگذاری تمرین ورزشی به خوبی درک نشده است. یکی از مسیرهای مهم تنظیم متابولیسم و سوختوساز بافت چربی مسیر mTOR/SREBP1 است که مقالات بسیار اندکی در این زمینه وجود دارد. با این حال، در تحقیقی Symonds و همکاران (2016) به بررسی تأثیر تمرینات ورزشی بر روی محتوای پروتئینهای mTOR و SREBP در بافت چربی موشهای باردار پرداختند. افزایش معنیداری در محتوای پروتئینهای mTOR و SREBP در گروه تمرین نسبت به گروه کنترل مشاهده شد (12). در تحقیقی دیگر ابراهیمی و همکاران (1396) به بررسی بیان نسبی ژنهای کلیدی متابولیسم لیپید بهدنبال مصرف رژیم غذایی پرچرب و تمرین هوازی در کبد موشهای صحرایی پرداختند. رژیم غذایی پرچرب منجر به افزایش بیان ژن SREBP1 شده بود و بیان SREBP1 در گروه با تغذیه طبیعی با تمرین شدید کاهش پیدا کرده است (13). کشف ارتباط بین mTOR و SREBP1 فصل جدیدی از درک ما از مکانیسمهای مولکولی تنظیم لیپوژنز باز میکند. درک بهتر این مکانیسمها برای توسعه ابزارهای جدید برای درمان بیماریهایی مانند چاقی و دیابت و عوارض آن مهم است. یافتههای اخیر درباره مسیر mTORC1 نشان میدهد که سنتز لیپیدها را با فعالکردن عامل SREBP1 تقویت میکند. مطالعات اخیر نشان میدهد که mTORC1 فعالسازی SREBP1 را در سطوح مختلف تنظیم میکند. بنابراین، شناخت عوامل تاثیرگذار بهخصوص فعالیت ورزشی بر روی پروتئینهای mTOR و SREBP1 میتواند به بیماری چاقی و دیابت نوع 2 کمک شایانی کند؛ بنابراین هدف از پژوهش حاضر، تأثیر تمرین استقامتی بر محتوای پروتئینهای mTOR و SREBP1 بافت چربی موشهای صحرایی نر اسپراگوداولی مبتلا به دیابت نوع 2 چاق میباشد.
روش بررسی
پژوهش حاضر از نوع تجربی-بنیادی میباشد که بهصورت گروه آزمایش و کنترل انجام گرفت؛ در این پژوهش، 16 سر موش صحرایینر 2 ماهه از نژاد اسپراگوداولی از حیوانخانه دانشگاه علوم پزشکی شیراز خریداری شدند. موشهای صحرایی به مدت 4 هفته تحت غذای کنترلشده پرچرب بهصورت پلت (خریداری شده از شرکت بهپرور؛ ترکیبی از پودر غذای استاندارد موش (365 گرم/کیلوگرم)، چربی گوسفندی (310 گرم/کیلوگرم)، مخلوط ویتامینها و مواد معدنی (60 گرم/کیلوگرم)، DL میتونین (3 گرم/کیلوگرم)، پودر مخمر (1 گرم/کیلوگرم) و کلریدسدیم (1 گرم/کیلوگرم)) جهت اضافه وزن به میانگین وزن 20±300 گرم رسیدند (14). موشهای صحرایی در حیوان خانه دانشکده پزشکی دانشگاه علوم پزشکی با دمای 2±22 درجه سانتیگراد، رطوبت 40-50 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری میشدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه علوم پزشکی شیراز مورد توجه قرار گرفت.
روش القاء دیابت
در هفته دهم بعد از به وزن رسیدن موشها برای ایجاد دیابت در موشهای صحرایی، محلول استرپتوزوتوسین (Streptozotocin; STZ) (حلشده در بافر سیترات 0/1 مولار با pH=4/5) بهصورت داخل صفاقی و فقط یک مرتبه با دوز 60 میلیگرم به ازای هر کیلوگرم از وزن بدن بعد از 15 دقیقه تزریق نیکوتینآمید با دوز 110 میلیگرم به ازای هر کیلوگرم از وزن بدن تزریق گردید (15). جهت اطمینان از دیابتی شدن حیوانها، قند خون آنها 72 ساعت پس از تزریق با کمکگلوکومتر و نمونه خونی گرفتهشده از سیاهرگ دمی موشها قند خون اندازهگیری شد؛ قند خون بالای 130 میلیگرم بر دسیلیتر بهعنوان شاخص دیابتی شدن در نظر گرفته شد (16). پس از القاء دیابت موشهای صحرایی به روش تصادفی به 2 گروه: گروه تمرین دیابتی (8 سر) و کنترل دیابتی (8 سر) تقسیم شدند.
پروتکل تمرینی
پس از القای دیابت موشهای صحرایی (هنگام شروع تمرین موشها 3 ماهه بودند) به روش تصادفی به 2 گروه: گروه تمرین دیابتی (8 سر) و کنترل دیابتی (8 سر) تقسیم شدند. موشهای گروههای تمرین برای آشنایی با نوارگردان به مدت یک هفته با سرعت 5 تا 10 متر بر دقیقه، روی نوارگردان (شرکت پیشرو صنعت ساخت کشور ایران) دویدند. برنامه گروه تمرینی بهمدت 8 هفته و هر هفته 4 جلسه بود. موشهای تمرینی در شروع هر جلسه با سرعتی حدود 10 تا 12 متر بر دقیقه گرم کردند. سپس برنامه تمرینی اصلی شامل 30 دقیقه تمرین تداومی با شدتی حدود 50 تا 70 درصد حداکثر سرعت انجام شد. در پایان هر جلسه نیز موشها با سرعتی حدود 10 تا 12 متر بر دقیقه سرد کردند. کل مدت زمان دویدن موشهای صحرایی در هر جلسه بر روی نوارگردان 44 دقیقه بود. شیب نوارگردان صفر درجه و در 8 هفته تغییری نداشت (17). در این مدت، گروه کنترل هیچگونه برنامه تمرینی نداشتند. همچنین موشهای صحرایی هیچگونه درمانی با انسولین را در طول دوره پژوهش نداشتند. آزمون اندازهگیری حداکثر سرعت با سرعت 5 متر در دقیقه شروع و هر 3 دقیقه سرعت تردمیل 5 متر در دقیقه افزایش یافت تا موشهای صحرایی به خستگی (چسبیدن موشها به انتهای تردمیل) برسند. سرعتی که در آن موشهای صحرایی به خستگی رسیدند، بهعنوان حداکثر سرعت در نظر گرفته شد (18).
روش بافتبرداری
برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 24 ساعت پس از آخرین جلسه تمرین، موشها در صورتی که ناشتا نبودند با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس در زمان صبح بافت چربی زیر جلدی از مکان لایه چربی اپیدیدیمال (Epididymal Fat Pad) بدن حیوان برداشته شد و در سرم فیزیولوژیک شستشو داده و سپس بلافاصله در تانک ازت منجمد (برای انتقال به فریزر) و برای سنجشهای بعدی با دمای 80- در فریزر گذاشته شد.
اندازهگیری متغیرهای بیوشیمیایی
با استفاده از روش آزمایشگاهی وسترن-بلات متغیرهای پژوهش اندازهگیری شد. برای استخراج پروتئینهای بافتچربی زیرجلدی از بافر RIPA حاوی 0/05 میلیمولار بافر تریس (pHبرابر 8)، 150 میلیمولار کلرید سدیم، 0/01 درصد EGTA، یک درصد سدیم دودسیل سولفات (Sodium dodecyl sulfate; SDS) بهاضافه 0/1 درصد آنتیپروتئاز کوکتیل (sigma) استفاده شد. به این ترتیب که 100 میلیگرم بافت در 500 میکرولیتر بافر حاوی آنتیپروتئاز توسط یک هموژنایزر دستی هموژن شد و نیم ساعت در دمای 4 درجه سانتیگراد گذاشته شد و سپس در یک سانتریفوژ یخچالدار (bo,sw14rfroil) در دور 12000 و 4 درجه سانتیگراد و بهمدت 10 دقیقه سانتریفوژ شد؛ سپس مایع رویی جمعآوری شده و غلظت پروتئین آن با کیت تعیینکننده پروتئین (Bio-Rad) اندازهگیری گردید (در طول موج 595 نانومتر اندازهگیری شد). در نهایت در 20 درجه زیر صفر نگهداری شد، سپس هموژن بهدست آمده به نسبت 1:1 با نمونه لودینگ بافر (mM50 تریس-کلرید هیدروژن، 2 درصد سدیم دو دسیل سولفات، 10 درصد گلیسرول، 5 درصد بتا-مرکاپتواتانول و 0/005 درصد برموفنول آبی) مخلوط گردید. در ادامه، نمونهها به مدت 5 دقیقه جوشانده شد تا تمام پروتئینها کاملاً دناتوره شوند. پروتئینها با استفاده از الکتروفورز ژل SDS-Polyacrylamide جدا شده و به غشای نیترو سلولز منتقل شدند. غشاء بهمدت 1 ساعت در 5 درصد BSA در Tris-Buffered Saline و 0/1 درصد (Tween 20 TBST) مسدود شد و در آنتیبادی اولیه (500:1) انکوبه شد. انکوباسیون در آنتیبادی ثانویه روز بعد به مدت 1 ساعت در دمای اتاق در 4 درصد TBST انجام شد. پروتئینها با یک واکنش شیمیایی لومینسانس (ECL) و با تجزیه و تحلیل densitometry با نرمافزار Image J (نسخه 112/0/8/1) اندازهگیری شد. آنتیبادی اولیه و ثانویه anti-SREBP1 (SC-13551) و anti-mTOR (SC-293133) شرکت سانتاکروز ساخت کشور آمریکا مورد استفاده قرار گرفتند (19).
تجزیه و تحلیل آماری
ابتدا از آزمون کالموگروف اسمیرنوف (KS) برای تعیین نرمالیتی توزیع دادههای پژوهش استفاده شد. با توجه به نرمال بودن توزیع دادهها در متغیرها، از آزمون پارامتریک t-وابسته و t-مستقل برای مقایسه گروهها استفاده شده است. اطلاعات در قالب جدول مربوطه ارائهشده است. تجزیه و تحلیل دادهها، با استفاده از نرمافزار SPSS.version 19 انجامگرفته است. سطح معنیداری تجزیه و تحلیل آماری تحقیق حاضر، p≤0/05 در نظر گرفته شده است.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شیراز تایید شده است (کد اخلاق IR.SUMS.REC.1396.S1062).
نتایج
در پایان پژوهش، نتایج تحقیق حاضر نشان داد که وزن (گرم) موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری دارد (p<0/003)؛ در مقابل وزن موشهای گروه تمرین بهدنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد (p<0/002). قند خون (میلیگرم بر دسیلیتر) موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری داشت (p<0/001)؛ اما قند خون موشهای گروه تمرین به دنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد (p<0/0001) (جدول 1). در پایان پژوهش، نتایج نشان دادند که به دنبال هشت هفته تمرین استقامتی، افزایش معنیداری در محتوای پروتئین mTOR بین گروههای تمرین دیابتی و کنترل دیابتی در بافت چربی وجود دارد (P=0/001) (شکل 1). همچنین، هشت هفته استقامتی منجر به افزایش معنیداری در محتوای پروتئین SREBP1، بین گروههای تمرین دیابتی و کنترل دیابتی در بافت چربی شد (P=0/0001) (شکل 2).
جدول 1. نتایج آماری t-وابسته برای متغیرهای وزن (گرم) و قند خون (میلیگرم بر دسیلیتر)


شکل 1: مقایسه محتوای پروتئین mTOR در گروههای مورد مطالعه.
A: تصاویر وسترنبلات پروتئین mTOR و β-actin به عنوان لودینگ کنترل در بافت چربی زیر جلدی.
B: نمودار ستونی نشاندهنده مقادیرکمی شده باندهای پروتئین mTOR در مقابل لودینگ کنترل که بهصورت چند برابر از گروه کنترل ارائه شده است.
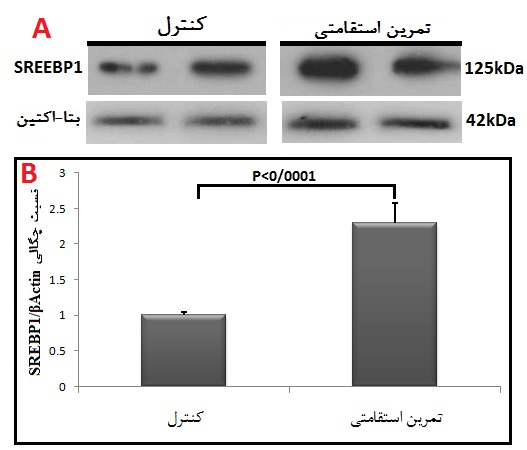
شکل 2: مقایسه محتوای پروتئین SREBP1 در گروههای مورد مطالعه.
A: تصاویر وسترنبلات پروتئین SREBP1 و β-actin به عنوان لودینگ کنترل در بافت چربی زیر جلدی.
B: نمودار ستونی نشاندهنده مقادیرکمی شده باندهای پروتئین SREBP1 در مقابل لودینگ کنترل که بهصورت چند برابر از گروه کنترل ارائه شده است.
بحث
هدف از تحقیق حاضر تأثیر تمرین استقامتی بر وزن و میزان قندخون و همچنین محتوای پروتئینهای mTOR و SREBP1 بافت چربی موشهای صحرایی نر اسپراگوداولی مبتلا به دیابت نوع 2 چاق بود. نتایج تحقیق حاضر، افزایش معنیداری را بین گروههای تمرین استقامتی و کنترل در محتوای پروتئینهای mTOR و SREBP1 نشان داد. وزن موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری را نشان داد. در مقابل وزن موشهای گروه تمرین بهدنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری یافته بود. قند خون گروه کنترل در پایان هفته هشتم نسبت به هفته اول افزایش معنیداری را نشان داد؛ اما قند خون موشهای گروه تمرین به دنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد. فعالیت ورزشی راهکاری مؤثر در جلوگیری یا درمان دیابت نوع 2 است (20). به طور کلی در افراد چاق مبتلا به دیابت نوع 2 تمرکز بر استفاده از تمرینات استقامتی است. تمرین استقامتی نشان داده است که شاخصهای متابولیکی را در افراد چاق یا مبتلا به دیابت نوع 2 در مطالعات انسانی و همچنین مدلهای حیوانی بهبود میدهد (21). از جمله مزایای آثار تمرینات استقامتی میتوان به کاهش وزن و همچنین بهبود حساسیت به انسولین و متابولیسم گلوکز اشاره کرد؛ در این راستا در تحقیقی صالحیکیا و همکاران (1398) به بررسی اثر تمرینات استقامتی بر وزن و قند خون موشهای دیابتی نوع 2 پرداختند. در این تحقیق وزن موشهای دیابتی در هشت هفته تمرین استقامتی نسبت به گروه کنترل تفاوت معنیداری را نشان داد. تمرین استقامتی موجب کاهش معنادار قند خون گروه تمرین استقامتی دیابتی نسبت به گروه کنترل دیابتی شد (22). نتایج این تحقیق با نتایج تحقیق حاضر همراستا است. در هر دو تحقیق وزن و قند خون موشهای صحرایی که مبتلا به دیابت نوع 2 بودند کاهش یافته است. این نشاندهنده این مطلب است که تمرینات استقامتی میتواند عامل بسیار مهم غیر دارویی برای افراد مبتلا به دیابت جهت کاهش وزن و قند خون باشد. در این راستا، در تحقیقی که طلوعی و همکاران (1396) به بررسی تأثیر تمرین هوازی بر وزن و قند خون پرداختند، نشان دادند تمرین استقامتی منجر به بهبود وزن، نسبت دور شکم به لگن، درصد چربی، همچنین گلوکز خون و مقاومت به انسولین در بیماران دیابتی میشود (23). همچنین، نتایج تحقیق حاضر، تغییر معنیداری را بین گروههای تمرین استقامتی و کنترل در محتوای پروتئینهای mTOR و SREBP1 نشان داد؛ تحقیقات بسیار کمی محتوای پروتئینهای mTOR و SREBP1 را در بافت چربی آزمودنیهای مبتلا به دیابت نوع 2 بررسی کردهاند. با این حال در تحقیقی Symonds و همکاران (2016) به بررسی تأثیر تمرینات ورزشی استقامتی بر روی محتوای پروتئینهای mTOR و SREBP در بافت چربی موشهای باردار پرداختند. افزایش معنیداری در محتوای پروتئینهای mTOR و SREBP در گروه تمرین نسبت به گروه کنترل مشاهده شد (12). نتایج تحقیق Symonds و همکاران با نتایج تحقیق حاضر در یک راستا میباشد؛ زیرا محتوای پروتئینهای mTOR و SREBP در هر دو تحقیق بهدنبال انجام تمرینات استقامتی در بافت چربی افزایش یافته است؛ بنابراین، تمرینات استقامتی میتواند با تنظیم سلولی و مولکولی پروتئینهای mTOR و SREBP منجر به متابولیسم و تنظیم بافت چربی شود. نشان داده شده است که mTORC1 برای لیپوژنز در موشها و شرایط کشت سلولی آزمایشگاهی مورد نیاز است (24). یکی از راههای ممکن که mTORC1 میتواند منجر به تنظیم فعالیت SREBP شود، مسیر PI3K/AKT است (25). پروتئین AKT بیان ژنهای مربوط به لیپوژنز را از طریق فعالسازی SREBP1 تنظیم میکند و mTORC1 برای لیپوژنز وابسته به AKT مورد نیاز است. علاوه بر این، تجمع هسته mSREBP1 و همچنین بیان ژنهای هدف SREBP1، شامل Fatty Acid Synthase FASN و ATP Citrate Lyase ACLY توسط راپامایسین مسدود میشود. خاموش کردن پروتئین Regulatory-Associated Protein of Mtor Raptor (پروتئین مرتبط با تنظیمکننده mTOR) در کمپلکس مولکولی mTORC1 موجب بیان واکنش FASN و ACLY در واکنش به فعال شدن AKT میشود و همچنین کاهش وابستگی به AKT در لیپوژنز میشود (26). نقش فعالیت ورزشی در تنظیم سوختوساز بافت چربی و مسیرهای سلولی بسیار حائز اهمیت است. این نتایج در انواع تمرینات ورزشی میتواند نتایج متفاوتی را به دنبال داشته باشد. در تحقیقی هووان و همکاران (2018) به بررسی تأثیر 12 هفته تمرینات ورزشی مقاومتی بر محتوای پروتئین SREBP1 در مردان پرداختند. محتوای پروتئین SREBP1 در گروه تمرین ورزشی مقاومتی نسبت به گروه کنترل معنیدار نبود (27). نتایج این تحقیق با نتایج تحقیق حاضر در یک راستا نمیباشد؛ زیرا در تحقیق حاضر تمرین استقامتی محتوای پروتئین SREBP1 را افزایش و تنظیم کرده است و این در صورتی است که در تحقیق هووان و همکاران تمرینات مقاومتی منجر به تأثیر معنیداری نشده است. نوع تمرین ورزشی بسیار مهم است. نشان داده شده است که تمرینات استقامتی تأثیر بیشتر بر سوختوساز بافت چربی دارند. در مقابل در تحقیقی هدایتیکتولی و همکاران (1389) به بررسی اثر تمرین استقامتی بر بیان پروتئین SREBP1 در موشهای صحرایی تغذیهشده با غذای پرچرب پرداختند. تمرین استقامتی اثر معنیداری بر کاهش بیان ژن این پروتئین داشتند (28). نتایج این تحقیق با نتایج تحقیق حاضر در یک راستا نمیباشد. نتایج تحقیق حاضر افزایش معنیدار محتوای پروتئین SREBP1 را نشان داد. از عوامل تأثیرگذار میتوان به تغذیهشدن موشهای صحرایی با غذای پرچرب در تحقیق هدایتیکتولی و همکاران اشاره کرد. تغذیه میتواند منجر به نتایج متناقضی در تحقیقات شود که در این راستا در تحقیقی Asano و همکاران (2019) به بررسی اثرات رژیم غذایی ژاپنی در ترکیب با تمرین ورزشی بر تجمع چربی احشایی پرداختند. در این تحقیق محتوای پروتئین SREBP1 اندازهگیری شد. تفاوت معنیداری در محتوای پروتئین SREBP1 به دنبال تمرین ورزشی همراه با رژیم غذایی ژاپنی مشاهده نشد (29). نتایج این تحقیق بر خلاف نتایج هدایتیکتولی و همکاران که کاهش را نشان داده بودند، افزایش محتوای پروتئین SREBP1 را نشان دادند. البته شایان ذکر است که در تحقیق Asano و همکاران محتوای پروتئین SREBP1 در بافت چربی احشایی اندازهگیری شده است و این در حالی است که در تحقیق حاضر در بافت چربی زیرجلدی بوده است و نتایج هر دو تحقیق افزایش محتوای پروتئین SREBP1 را نشان داده است. در کل مسیر احتمالی در تحقیق حاضر مسیر mTORC1 است که ممکن است شبکه رونویسی SREBP1 را از طریق تنظیم منفی لیپین Lipin-1 تنظیم کند (30). لیپین-1 یک سوبسترا برای فسفوریلاسیون mTORC1 با سایتهای مختلف است، که شامل هر دو سایتهای حساس به راپامایسین و سایتهای فسفریلهشده توسط mTORC1 است که نسبت به راپامایسین نسبتاً حساس نیستند. فسفریلاسیون لیپین-1 توسط mTORC1 منجر به تنظیم موضع سلولی خود میشود، که شامل لیپین-1 فسفریلهشده ساکن در سیتوپلاسم و لیپین-1 فسفریلهشده مجتمع در هسته است. لیپین-1 منجر به تنظیم پروتئین SREBP1 میشود (31). علیرغم پیشرفتهای اخیر در درک اینکه چگونه mTORC1 چربی را تنظیم میکند تا حدودی نامشخص است. البته، سنجش پروتئینهای mTOR و SREBP1 به تنهایی برای ارزیابی تغییرات و هومئوستاز بافت چربی در پاسخ به بیماری دیابتی و همچنین در پاسخ به تمرینات استقامتی کافی نیست و بهنظر میرسد که نقش سایر پروتئینهای درگیر در فرآیند مسیر سیگنالینگ mTORC1 قابلتوجه باشند.
نتیجهگیری
بهطور کلی، تنظیم سوخت و ساز بافت چربی برای حفظ هومئوستاز سلولی ضروری است. براساس نتایج تحقیق حاضر، تمرین استقامتی توانست وزن موشهای صحرایی و همچنین میزان قند خون را تنظیم کند؛ این نشاندهنده این مطلب است که تمرینات استقامتی میتواند راهبرد بسیار مهمی برای افراد دیابتی باشد. همچنین افزایش محتوای پروتئینهای mTOR و SREBP1 در تحقیق حاضر منجر به فعالشدن مسیر تنظیم متابولیسم چربی توسط تمرینات استقامتی شده است. بنابراین تمرین استقامتی میتواند برای آزمودنیهای چاق و مبتلا به دیابت نوع 2 که در سوخت و ساز بافت چربی دچار نقص هستند مورد استفاده قرار گیرد.
سپاسگزاری
این پژوهش حاصل طرح تحقیقاتی مصوب دانشگاه شیراز و تلاش نویسندگان این تحقیق میباشد که در دانشگاه علوم پزشکی شیراز و دانشگاه شیراز انجام شده است. از تمامی افرادی که در این امر مهم ما را یاری کردند، تشکر میشود.
حامی مالی: ندارد.
تعارض درمنافع: وجود ندارد.
بیماری دیابت از جمله بیماریهای متابولیک در حال گسترش است که به خاطر مرگومیر، عوارض بالا و هزینههای درمانی، فشار اقتصادی هنگفتی بر خانواده و اجتماع وارد میکند (1). دیابت نوع 2 به علت فرآیند کاهش متابولیسم بدن، افزایش بافت چربی و کمتحرکی، شیوع بیشتری دارد. این بیماری شامل گروهی از بیماریهای متابولیک است که در اثر نقص در عملکرد و ترشح انسولین ایجاد شده و منجر به افزایش مقدار گلوکز در خون میگردد (2). عوامل مختلفی سلولی و مولکولی در ایجاد این عوارض درگیر هستند که از مهمترین آنها، پروتئینهای تنظیمکننده بافت چربی یعنی پروتئین هدف راپامایسین در پستاندارن (mTOR) Mammalian Target of Rapamycin و پروتئین متصل بهعنصر پاسخ استرول 1 (SREBP1) Sterol Regulatory Element-Binding Protein 1 میباشند (3). نتایج مطالعات نشان میدهند که این پروتئینها، نقش مهمی در این فرایندهای پاتولوژیک ایفا مینمایند. در طی چند سال گذشته، چندین گروه تحقیقاتی مسیر mTORC1 را بهعنوان تنظیمکننده مهم لیپوژنز شناسایی کردهاند. مسیر mTORC1، که انسولین و مواد مغذی را حس میکند، بیوسنتز لیپید را با تنظیم عملکرد SREBP1 در چند مرحله فعال میکند (4). اختلال در تنظیم سیگنالینگ mTORC1 منجر به چاقی/اضافه وزن میشود. اما، با توجه به نقش اصلی mTOR در فرایندهای سلولی، احتمالاً مهار سیستمیک mTOR عوارض جانبی قابلتوجهی خواهد داشت که ممکن است مزایای درمانی مرتبط با استفاده از مهارکنندههای mTOR را تحت تاثیر قرار دهد (5). پروتئین SREBP1 از طریق آبشار سیگنالینگ انسولین میتواند تحریک و فعال شود. انسولین با فعالکردن پروتئینهای پاییندست یعنی، Insulin Receptor Substrate IRS-1/2 و PI3K منجر به فعالشدن پروتئین Protein Kinase B AKT میشود (6). پروتئین AKT پروتئین بالادست mTOR است که میتواند منجر به فعالشدن mTOR شود. mTOR یک پروتئین کلیدی در تنظیم فرآیندهای سلولی از جمله تنظیم سوختوساز و متابولیسم بافت چربی است که این فرآیندها را از طریق تنظیم پروتئین SREBP-1 انجام میدهد (7). پروتئینهای SREBP نقش متمرکزی در متابولیسم سلولها با کنترل سنتز اسیدهای چرب، تریگلیسیرید و کلسترول دارند (8). فعالیت ورزشی منظم تأثیرات مفیدی بر سلامت کلی دارد و نقش فعالیت ورزشی در درمان و پیشگیری از بیماریهای متابولیک مانند چاقی و دیابت نوع 2 به خوبی شناختهشده است. تمرین ورزشی، هومئوستاز گلوکز کل بدن را بهبود بخشیده و حساسیت به انسولین را افزایش میدهد، که این تأثیرات را مربوط به سازگاریهای عضله اسکلتی، بافت چربی میدانند (9). شواهد قوی وجود دارد که فعالیت ورزشی منظم به وزن بدن و از دست دادن چربی، حفظ وزن بدن و کاهش چربی و تناسب متابولیکی در چاقی کمک میکند. تمرینات استقامتی به نظر میرسد در این زمینه بیشترین تأثیر را داشته باشد (10). هدف از انجام تمرینات استقامتی بهکارگیری حداکثر توان در بیشترین ظرفیت اکسیداسیون چربیها و کاهش اکسیداسیون کربوهیدراتها است. در ضمن تمرینات استقامتی در کاهش چربیهای بدن و در نتیجه افزایش متابولیسم بدن تاثیر چشمگیری دارد (11). با این وجود سازوکار مولکولی تأثیرگذاری تمرین ورزشی به خوبی درک نشده است. یکی از مسیرهای مهم تنظیم متابولیسم و سوختوساز بافت چربی مسیر mTOR/SREBP1 است که مقالات بسیار اندکی در این زمینه وجود دارد. با این حال، در تحقیقی Symonds و همکاران (2016) به بررسی تأثیر تمرینات ورزشی بر روی محتوای پروتئینهای mTOR و SREBP در بافت چربی موشهای باردار پرداختند. افزایش معنیداری در محتوای پروتئینهای mTOR و SREBP در گروه تمرین نسبت به گروه کنترل مشاهده شد (12). در تحقیقی دیگر ابراهیمی و همکاران (1396) به بررسی بیان نسبی ژنهای کلیدی متابولیسم لیپید بهدنبال مصرف رژیم غذایی پرچرب و تمرین هوازی در کبد موشهای صحرایی پرداختند. رژیم غذایی پرچرب منجر به افزایش بیان ژن SREBP1 شده بود و بیان SREBP1 در گروه با تغذیه طبیعی با تمرین شدید کاهش پیدا کرده است (13). کشف ارتباط بین mTOR و SREBP1 فصل جدیدی از درک ما از مکانیسمهای مولکولی تنظیم لیپوژنز باز میکند. درک بهتر این مکانیسمها برای توسعه ابزارهای جدید برای درمان بیماریهایی مانند چاقی و دیابت و عوارض آن مهم است. یافتههای اخیر درباره مسیر mTORC1 نشان میدهد که سنتز لیپیدها را با فعالکردن عامل SREBP1 تقویت میکند. مطالعات اخیر نشان میدهد که mTORC1 فعالسازی SREBP1 را در سطوح مختلف تنظیم میکند. بنابراین، شناخت عوامل تاثیرگذار بهخصوص فعالیت ورزشی بر روی پروتئینهای mTOR و SREBP1 میتواند به بیماری چاقی و دیابت نوع 2 کمک شایانی کند؛ بنابراین هدف از پژوهش حاضر، تأثیر تمرین استقامتی بر محتوای پروتئینهای mTOR و SREBP1 بافت چربی موشهای صحرایی نر اسپراگوداولی مبتلا به دیابت نوع 2 چاق میباشد.
روش بررسی
پژوهش حاضر از نوع تجربی-بنیادی میباشد که بهصورت گروه آزمایش و کنترل انجام گرفت؛ در این پژوهش، 16 سر موش صحرایینر 2 ماهه از نژاد اسپراگوداولی از حیوانخانه دانشگاه علوم پزشکی شیراز خریداری شدند. موشهای صحرایی به مدت 4 هفته تحت غذای کنترلشده پرچرب بهصورت پلت (خریداری شده از شرکت بهپرور؛ ترکیبی از پودر غذای استاندارد موش (365 گرم/کیلوگرم)، چربی گوسفندی (310 گرم/کیلوگرم)، مخلوط ویتامینها و مواد معدنی (60 گرم/کیلوگرم)، DL میتونین (3 گرم/کیلوگرم)، پودر مخمر (1 گرم/کیلوگرم) و کلریدسدیم (1 گرم/کیلوگرم)) جهت اضافه وزن به میانگین وزن 20±300 گرم رسیدند (14). موشهای صحرایی در حیوان خانه دانشکده پزشکی دانشگاه علوم پزشکی با دمای 2±22 درجه سانتیگراد، رطوبت 40-50 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری میشدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه علوم پزشکی شیراز مورد توجه قرار گرفت.
روش القاء دیابت
در هفته دهم بعد از به وزن رسیدن موشها برای ایجاد دیابت در موشهای صحرایی، محلول استرپتوزوتوسین (Streptozotocin; STZ) (حلشده در بافر سیترات 0/1 مولار با pH=4/5) بهصورت داخل صفاقی و فقط یک مرتبه با دوز 60 میلیگرم به ازای هر کیلوگرم از وزن بدن بعد از 15 دقیقه تزریق نیکوتینآمید با دوز 110 میلیگرم به ازای هر کیلوگرم از وزن بدن تزریق گردید (15). جهت اطمینان از دیابتی شدن حیوانها، قند خون آنها 72 ساعت پس از تزریق با کمکگلوکومتر و نمونه خونی گرفتهشده از سیاهرگ دمی موشها قند خون اندازهگیری شد؛ قند خون بالای 130 میلیگرم بر دسیلیتر بهعنوان شاخص دیابتی شدن در نظر گرفته شد (16). پس از القاء دیابت موشهای صحرایی به روش تصادفی به 2 گروه: گروه تمرین دیابتی (8 سر) و کنترل دیابتی (8 سر) تقسیم شدند.
پروتکل تمرینی
پس از القای دیابت موشهای صحرایی (هنگام شروع تمرین موشها 3 ماهه بودند) به روش تصادفی به 2 گروه: گروه تمرین دیابتی (8 سر) و کنترل دیابتی (8 سر) تقسیم شدند. موشهای گروههای تمرین برای آشنایی با نوارگردان به مدت یک هفته با سرعت 5 تا 10 متر بر دقیقه، روی نوارگردان (شرکت پیشرو صنعت ساخت کشور ایران) دویدند. برنامه گروه تمرینی بهمدت 8 هفته و هر هفته 4 جلسه بود. موشهای تمرینی در شروع هر جلسه با سرعتی حدود 10 تا 12 متر بر دقیقه گرم کردند. سپس برنامه تمرینی اصلی شامل 30 دقیقه تمرین تداومی با شدتی حدود 50 تا 70 درصد حداکثر سرعت انجام شد. در پایان هر جلسه نیز موشها با سرعتی حدود 10 تا 12 متر بر دقیقه سرد کردند. کل مدت زمان دویدن موشهای صحرایی در هر جلسه بر روی نوارگردان 44 دقیقه بود. شیب نوارگردان صفر درجه و در 8 هفته تغییری نداشت (17). در این مدت، گروه کنترل هیچگونه برنامه تمرینی نداشتند. همچنین موشهای صحرایی هیچگونه درمانی با انسولین را در طول دوره پژوهش نداشتند. آزمون اندازهگیری حداکثر سرعت با سرعت 5 متر در دقیقه شروع و هر 3 دقیقه سرعت تردمیل 5 متر در دقیقه افزایش یافت تا موشهای صحرایی به خستگی (چسبیدن موشها به انتهای تردمیل) برسند. سرعتی که در آن موشهای صحرایی به خستگی رسیدند، بهعنوان حداکثر سرعت در نظر گرفته شد (18).
روش بافتبرداری
برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 24 ساعت پس از آخرین جلسه تمرین، موشها در صورتی که ناشتا نبودند با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس در زمان صبح بافت چربی زیر جلدی از مکان لایه چربی اپیدیدیمال (Epididymal Fat Pad) بدن حیوان برداشته شد و در سرم فیزیولوژیک شستشو داده و سپس بلافاصله در تانک ازت منجمد (برای انتقال به فریزر) و برای سنجشهای بعدی با دمای 80- در فریزر گذاشته شد.
اندازهگیری متغیرهای بیوشیمیایی
با استفاده از روش آزمایشگاهی وسترن-بلات متغیرهای پژوهش اندازهگیری شد. برای استخراج پروتئینهای بافتچربی زیرجلدی از بافر RIPA حاوی 0/05 میلیمولار بافر تریس (pHبرابر 8)، 150 میلیمولار کلرید سدیم، 0/01 درصد EGTA، یک درصد سدیم دودسیل سولفات (Sodium dodecyl sulfate; SDS) بهاضافه 0/1 درصد آنتیپروتئاز کوکتیل (sigma) استفاده شد. به این ترتیب که 100 میلیگرم بافت در 500 میکرولیتر بافر حاوی آنتیپروتئاز توسط یک هموژنایزر دستی هموژن شد و نیم ساعت در دمای 4 درجه سانتیگراد گذاشته شد و سپس در یک سانتریفوژ یخچالدار (bo,sw14rfroil) در دور 12000 و 4 درجه سانتیگراد و بهمدت 10 دقیقه سانتریفوژ شد؛ سپس مایع رویی جمعآوری شده و غلظت پروتئین آن با کیت تعیینکننده پروتئین (Bio-Rad) اندازهگیری گردید (در طول موج 595 نانومتر اندازهگیری شد). در نهایت در 20 درجه زیر صفر نگهداری شد، سپس هموژن بهدست آمده به نسبت 1:1 با نمونه لودینگ بافر (mM50 تریس-کلرید هیدروژن، 2 درصد سدیم دو دسیل سولفات، 10 درصد گلیسرول، 5 درصد بتا-مرکاپتواتانول و 0/005 درصد برموفنول آبی) مخلوط گردید. در ادامه، نمونهها به مدت 5 دقیقه جوشانده شد تا تمام پروتئینها کاملاً دناتوره شوند. پروتئینها با استفاده از الکتروفورز ژل SDS-Polyacrylamide جدا شده و به غشای نیترو سلولز منتقل شدند. غشاء بهمدت 1 ساعت در 5 درصد BSA در Tris-Buffered Saline و 0/1 درصد (Tween 20 TBST) مسدود شد و در آنتیبادی اولیه (500:1) انکوبه شد. انکوباسیون در آنتیبادی ثانویه روز بعد به مدت 1 ساعت در دمای اتاق در 4 درصد TBST انجام شد. پروتئینها با یک واکنش شیمیایی لومینسانس (ECL) و با تجزیه و تحلیل densitometry با نرمافزار Image J (نسخه 112/0/8/1) اندازهگیری شد. آنتیبادی اولیه و ثانویه anti-SREBP1 (SC-13551) و anti-mTOR (SC-293133) شرکت سانتاکروز ساخت کشور آمریکا مورد استفاده قرار گرفتند (19).
تجزیه و تحلیل آماری
ابتدا از آزمون کالموگروف اسمیرنوف (KS) برای تعیین نرمالیتی توزیع دادههای پژوهش استفاده شد. با توجه به نرمال بودن توزیع دادهها در متغیرها، از آزمون پارامتریک t-وابسته و t-مستقل برای مقایسه گروهها استفاده شده است. اطلاعات در قالب جدول مربوطه ارائهشده است. تجزیه و تحلیل دادهها، با استفاده از نرمافزار SPSS.version 19 انجامگرفته است. سطح معنیداری تجزیه و تحلیل آماری تحقیق حاضر، p≤0/05 در نظر گرفته شده است.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شیراز تایید شده است (کد اخلاق IR.SUMS.REC.1396.S1062).
نتایج
در پایان پژوهش، نتایج تحقیق حاضر نشان داد که وزن (گرم) موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری دارد (p<0/003)؛ در مقابل وزن موشهای گروه تمرین بهدنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد (p<0/002). قند خون (میلیگرم بر دسیلیتر) موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری داشت (p<0/001)؛ اما قند خون موشهای گروه تمرین به دنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد (p<0/0001) (جدول 1). در پایان پژوهش، نتایج نشان دادند که به دنبال هشت هفته تمرین استقامتی، افزایش معنیداری در محتوای پروتئین mTOR بین گروههای تمرین دیابتی و کنترل دیابتی در بافت چربی وجود دارد (P=0/001) (شکل 1). همچنین، هشت هفته استقامتی منجر به افزایش معنیداری در محتوای پروتئین SREBP1، بین گروههای تمرین دیابتی و کنترل دیابتی در بافت چربی شد (P=0/0001) (شکل 2).
جدول 1. نتایج آماری t-وابسته برای متغیرهای وزن (گرم) و قند خون (میلیگرم بر دسیلیتر)


شکل 1: مقایسه محتوای پروتئین mTOR در گروههای مورد مطالعه.
A: تصاویر وسترنبلات پروتئین mTOR و β-actin به عنوان لودینگ کنترل در بافت چربی زیر جلدی.
B: نمودار ستونی نشاندهنده مقادیرکمی شده باندهای پروتئین mTOR در مقابل لودینگ کنترل که بهصورت چند برابر از گروه کنترل ارائه شده است.

شکل 2: مقایسه محتوای پروتئین SREBP1 در گروههای مورد مطالعه.
A: تصاویر وسترنبلات پروتئین SREBP1 و β-actin به عنوان لودینگ کنترل در بافت چربی زیر جلدی.
B: نمودار ستونی نشاندهنده مقادیرکمی شده باندهای پروتئین SREBP1 در مقابل لودینگ کنترل که بهصورت چند برابر از گروه کنترل ارائه شده است.
بحث
هدف از تحقیق حاضر تأثیر تمرین استقامتی بر وزن و میزان قندخون و همچنین محتوای پروتئینهای mTOR و SREBP1 بافت چربی موشهای صحرایی نر اسپراگوداولی مبتلا به دیابت نوع 2 چاق بود. نتایج تحقیق حاضر، افزایش معنیداری را بین گروههای تمرین استقامتی و کنترل در محتوای پروتئینهای mTOR و SREBP1 نشان داد. وزن موشهای صحرایی گروه کنترل در هفته هشتم نسبت به هفته اول افزایش معنیداری را نشان داد. در مقابل وزن موشهای گروه تمرین بهدنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری یافته بود. قند خون گروه کنترل در پایان هفته هشتم نسبت به هفته اول افزایش معنیداری را نشان داد؛ اما قند خون موشهای گروه تمرین به دنبال 8 هفته تمرین استقامتی، نسبت به هفته اول کاهش معنیداری را نشان داد. فعالیت ورزشی راهکاری مؤثر در جلوگیری یا درمان دیابت نوع 2 است (20). به طور کلی در افراد چاق مبتلا به دیابت نوع 2 تمرکز بر استفاده از تمرینات استقامتی است. تمرین استقامتی نشان داده است که شاخصهای متابولیکی را در افراد چاق یا مبتلا به دیابت نوع 2 در مطالعات انسانی و همچنین مدلهای حیوانی بهبود میدهد (21). از جمله مزایای آثار تمرینات استقامتی میتوان به کاهش وزن و همچنین بهبود حساسیت به انسولین و متابولیسم گلوکز اشاره کرد؛ در این راستا در تحقیقی صالحیکیا و همکاران (1398) به بررسی اثر تمرینات استقامتی بر وزن و قند خون موشهای دیابتی نوع 2 پرداختند. در این تحقیق وزن موشهای دیابتی در هشت هفته تمرین استقامتی نسبت به گروه کنترل تفاوت معنیداری را نشان داد. تمرین استقامتی موجب کاهش معنادار قند خون گروه تمرین استقامتی دیابتی نسبت به گروه کنترل دیابتی شد (22). نتایج این تحقیق با نتایج تحقیق حاضر همراستا است. در هر دو تحقیق وزن و قند خون موشهای صحرایی که مبتلا به دیابت نوع 2 بودند کاهش یافته است. این نشاندهنده این مطلب است که تمرینات استقامتی میتواند عامل بسیار مهم غیر دارویی برای افراد مبتلا به دیابت جهت کاهش وزن و قند خون باشد. در این راستا، در تحقیقی که طلوعی و همکاران (1396) به بررسی تأثیر تمرین هوازی بر وزن و قند خون پرداختند، نشان دادند تمرین استقامتی منجر به بهبود وزن، نسبت دور شکم به لگن، درصد چربی، همچنین گلوکز خون و مقاومت به انسولین در بیماران دیابتی میشود (23). همچنین، نتایج تحقیق حاضر، تغییر معنیداری را بین گروههای تمرین استقامتی و کنترل در محتوای پروتئینهای mTOR و SREBP1 نشان داد؛ تحقیقات بسیار کمی محتوای پروتئینهای mTOR و SREBP1 را در بافت چربی آزمودنیهای مبتلا به دیابت نوع 2 بررسی کردهاند. با این حال در تحقیقی Symonds و همکاران (2016) به بررسی تأثیر تمرینات ورزشی استقامتی بر روی محتوای پروتئینهای mTOR و SREBP در بافت چربی موشهای باردار پرداختند. افزایش معنیداری در محتوای پروتئینهای mTOR و SREBP در گروه تمرین نسبت به گروه کنترل مشاهده شد (12). نتایج تحقیق Symonds و همکاران با نتایج تحقیق حاضر در یک راستا میباشد؛ زیرا محتوای پروتئینهای mTOR و SREBP در هر دو تحقیق بهدنبال انجام تمرینات استقامتی در بافت چربی افزایش یافته است؛ بنابراین، تمرینات استقامتی میتواند با تنظیم سلولی و مولکولی پروتئینهای mTOR و SREBP منجر به متابولیسم و تنظیم بافت چربی شود. نشان داده شده است که mTORC1 برای لیپوژنز در موشها و شرایط کشت سلولی آزمایشگاهی مورد نیاز است (24). یکی از راههای ممکن که mTORC1 میتواند منجر به تنظیم فعالیت SREBP شود، مسیر PI3K/AKT است (25). پروتئین AKT بیان ژنهای مربوط به لیپوژنز را از طریق فعالسازی SREBP1 تنظیم میکند و mTORC1 برای لیپوژنز وابسته به AKT مورد نیاز است. علاوه بر این، تجمع هسته mSREBP1 و همچنین بیان ژنهای هدف SREBP1، شامل Fatty Acid Synthase FASN و ATP Citrate Lyase ACLY توسط راپامایسین مسدود میشود. خاموش کردن پروتئین Regulatory-Associated Protein of Mtor Raptor (پروتئین مرتبط با تنظیمکننده mTOR) در کمپلکس مولکولی mTORC1 موجب بیان واکنش FASN و ACLY در واکنش به فعال شدن AKT میشود و همچنین کاهش وابستگی به AKT در لیپوژنز میشود (26). نقش فعالیت ورزشی در تنظیم سوختوساز بافت چربی و مسیرهای سلولی بسیار حائز اهمیت است. این نتایج در انواع تمرینات ورزشی میتواند نتایج متفاوتی را به دنبال داشته باشد. در تحقیقی هووان و همکاران (2018) به بررسی تأثیر 12 هفته تمرینات ورزشی مقاومتی بر محتوای پروتئین SREBP1 در مردان پرداختند. محتوای پروتئین SREBP1 در گروه تمرین ورزشی مقاومتی نسبت به گروه کنترل معنیدار نبود (27). نتایج این تحقیق با نتایج تحقیق حاضر در یک راستا نمیباشد؛ زیرا در تحقیق حاضر تمرین استقامتی محتوای پروتئین SREBP1 را افزایش و تنظیم کرده است و این در صورتی است که در تحقیق هووان و همکاران تمرینات مقاومتی منجر به تأثیر معنیداری نشده است. نوع تمرین ورزشی بسیار مهم است. نشان داده شده است که تمرینات استقامتی تأثیر بیشتر بر سوختوساز بافت چربی دارند. در مقابل در تحقیقی هدایتیکتولی و همکاران (1389) به بررسی اثر تمرین استقامتی بر بیان پروتئین SREBP1 در موشهای صحرایی تغذیهشده با غذای پرچرب پرداختند. تمرین استقامتی اثر معنیداری بر کاهش بیان ژن این پروتئین داشتند (28). نتایج این تحقیق با نتایج تحقیق حاضر در یک راستا نمیباشد. نتایج تحقیق حاضر افزایش معنیدار محتوای پروتئین SREBP1 را نشان داد. از عوامل تأثیرگذار میتوان به تغذیهشدن موشهای صحرایی با غذای پرچرب در تحقیق هدایتیکتولی و همکاران اشاره کرد. تغذیه میتواند منجر به نتایج متناقضی در تحقیقات شود که در این راستا در تحقیقی Asano و همکاران (2019) به بررسی اثرات رژیم غذایی ژاپنی در ترکیب با تمرین ورزشی بر تجمع چربی احشایی پرداختند. در این تحقیق محتوای پروتئین SREBP1 اندازهگیری شد. تفاوت معنیداری در محتوای پروتئین SREBP1 به دنبال تمرین ورزشی همراه با رژیم غذایی ژاپنی مشاهده نشد (29). نتایج این تحقیق بر خلاف نتایج هدایتیکتولی و همکاران که کاهش را نشان داده بودند، افزایش محتوای پروتئین SREBP1 را نشان دادند. البته شایان ذکر است که در تحقیق Asano و همکاران محتوای پروتئین SREBP1 در بافت چربی احشایی اندازهگیری شده است و این در حالی است که در تحقیق حاضر در بافت چربی زیرجلدی بوده است و نتایج هر دو تحقیق افزایش محتوای پروتئین SREBP1 را نشان داده است. در کل مسیر احتمالی در تحقیق حاضر مسیر mTORC1 است که ممکن است شبکه رونویسی SREBP1 را از طریق تنظیم منفی لیپین Lipin-1 تنظیم کند (30). لیپین-1 یک سوبسترا برای فسفوریلاسیون mTORC1 با سایتهای مختلف است، که شامل هر دو سایتهای حساس به راپامایسین و سایتهای فسفریلهشده توسط mTORC1 است که نسبت به راپامایسین نسبتاً حساس نیستند. فسفریلاسیون لیپین-1 توسط mTORC1 منجر به تنظیم موضع سلولی خود میشود، که شامل لیپین-1 فسفریلهشده ساکن در سیتوپلاسم و لیپین-1 فسفریلهشده مجتمع در هسته است. لیپین-1 منجر به تنظیم پروتئین SREBP1 میشود (31). علیرغم پیشرفتهای اخیر در درک اینکه چگونه mTORC1 چربی را تنظیم میکند تا حدودی نامشخص است. البته، سنجش پروتئینهای mTOR و SREBP1 به تنهایی برای ارزیابی تغییرات و هومئوستاز بافت چربی در پاسخ به بیماری دیابتی و همچنین در پاسخ به تمرینات استقامتی کافی نیست و بهنظر میرسد که نقش سایر پروتئینهای درگیر در فرآیند مسیر سیگنالینگ mTORC1 قابلتوجه باشند.
نتیجهگیری
بهطور کلی، تنظیم سوخت و ساز بافت چربی برای حفظ هومئوستاز سلولی ضروری است. براساس نتایج تحقیق حاضر، تمرین استقامتی توانست وزن موشهای صحرایی و همچنین میزان قند خون را تنظیم کند؛ این نشاندهنده این مطلب است که تمرینات استقامتی میتواند راهبرد بسیار مهمی برای افراد دیابتی باشد. همچنین افزایش محتوای پروتئینهای mTOR و SREBP1 در تحقیق حاضر منجر به فعالشدن مسیر تنظیم متابولیسم چربی توسط تمرینات استقامتی شده است. بنابراین تمرین استقامتی میتواند برای آزمودنیهای چاق و مبتلا به دیابت نوع 2 که در سوخت و ساز بافت چربی دچار نقص هستند مورد استفاده قرار گیرد.
سپاسگزاری
این پژوهش حاصل طرح تحقیقاتی مصوب دانشگاه شیراز و تلاش نویسندگان این تحقیق میباشد که در دانشگاه علوم پزشکی شیراز و دانشگاه شیراز انجام شده است. از تمامی افرادی که در این امر مهم ما را یاری کردند، تشکر میشود.
حامی مالی: ندارد.
تعارض درمنافع: وجود ندارد.
References:
1-Mobaraki A, Hejazi SM, Ramadanpour MR. Effect of Eight Weeks Aerobic Periodic Training with Increasing Intensity on Insulin-Like Growth Factor (IGF-1) and Insulin Resistance in Middle-Aged Women with Type 2 Diabetes. J Birjand Uni Medical Sci 2018; 25(4): 317-25.
2-Luo L, Lu AM, Wang Y, Hong A, Chen Y, Hu J, et al. Chronic Resistance Training Activates Autophagy and Reduces Apoptosis of Muscle Cells by Modulating IGF-1 and Its Receptors, Akt/Mtor and Akt/FOXO3a Signaling in Aged Rats. Exp Gerontol 2013; 48(4): 427-36.
3-Li S, Ogawa W, Emi A, Hayashi K, Senga Y, Nomura K, et al. Role of S6K1 in Regulation of SREBP1c Expression in the Liver. Biochem Biophys Res Commun 2011; 412(2): 197-202.
1-Mobaraki A, Hejazi SM, Ramadanpour MR. Effect of Eight Weeks Aerobic Periodic Training with Increasing Intensity on Insulin-Like Growth Factor (IGF-1) and Insulin Resistance in Middle-Aged Women with Type 2 Diabetes. J Birjand Uni Medical Sci 2018; 25(4): 317-25.
2-Luo L, Lu AM, Wang Y, Hong A, Chen Y, Hu J, et al. Chronic Resistance Training Activates Autophagy and Reduces Apoptosis of Muscle Cells by Modulating IGF-1 and Its Receptors, Akt/Mtor and Akt/FOXO3a Signaling in Aged Rats. Exp Gerontol 2013; 48(4): 427-36.
3-Li S, Ogawa W, Emi A, Hayashi K, Senga Y, Nomura K, et al. Role of S6K1 in Regulation of SREBP1c Expression in the Liver. Biochem Biophys Res Commun 2011; 412(2): 197-202.
4-Laplante M, Sabatini DM. Mtor Signaling at a Glance. J Cell Sci 2009; 122(20): 3589-94.
5-Bakan I, Laplante M. Connecting Mtorc1 Signaling to SREBP-1 Activation. Curr Opin Lipidol 2012; 23(3): 226-34.
6-Laplante M, Sabatini DM. Mtor Signaling. Cold Spring Harbor Perspectives in Biology 2012; 4(2): a011593.
7-Yecies JL, Zhang HH, Menon S, Liu S, Yecies D, Lipovsky AI, et al. Akt Stimulates Hepatic SREBP1c and Lipogenesis through Parallel Mtorc1-Dependent and Independent Pathways. Cell Metabolism 2011; 14(1): 21-32.
8-Shao W, Espenshade PJ. Expanding Roles for SREBP in Metabolism. Cell Metabolism 2012; 16(4): 414-9.
9-Pedersen BK, Saltin B. Exercise as Medicine–Evidence for Prescribing Exercise as Therapy in 26 Different Chronic Diseases. Scandinavian J Med Sci in Sports 2015; 25: 1-72.
10-Petridou A, Siopi A, Mougios V. Exercise in the Management of Obesity. Metabolism 2019; 92: 163-69.
11-Jamali E, Asad M, Rassouli A. Effect of Eight-Week Endurance Exercise on Resistin Gene Expression in Visceral Adipose Tissues in Obese Rats. J Shahid Sadoughi Uni Med Sci 2017; 25(1): 20-31.
12-Symonds M, Bloor I, Galvez F, Domfeh E, Maicas B, Poston L, et al. Effect of a Dietary and Exercise Intervention during Pregnancy and Lactation on white Adipose Tissue Gene Profiles and Adiposity with Maternal Obesity. FASEB J 2016; 1214-3.
13-Ebrahimi M, Fathi R, Ansari Pirsaraei Z, Talebi Garakani E. Relative Gene Expression of Key Genes Involved in Lipid Metabolism, Following High Fat Diet and Moderate and High Intensity Aerobic Training in Rat’s Liver. Sport Physiology 2017; 9(34): 201-16.
14-Fathi R, Ebrahimi M, Sanami SK. Effects of High Fat Diet and High Intensity Aerobic Training on Interleukin 6 Plasma Levels in Rats. Pathobiology Res 2015; 18(3): 109-16. [Persian]
15-Safhi MM, Anwer T, Khan G, Siddiqui R, Moni Sivakumar S, Alam MF. The Combination of Canagliflozin and Omega-3 Fatty Acid Ameliorates Insulin Resistance and Cardiac Biomarkers via Modulation of Inflammatory Cytokines in Type 2 Diabetic Rats. Korean J Physiolo Pharmacol 2018; 22(5): 493-501.
16-Khalili A, Nekooeian AA, Khosravi MB. Oleuropein Improves Glucose Tolerance and Lipid Profile in Rats with Simultaneous Renovascular Hypertension and Type 2 Diabetes. J Asian Nat Prod Res 2017; 19(10): 1011-21.
17-Shabani M, Daryanoosh F, Salesi M, Kooshki Jahromi M, Fallahi AA. Effect of Continuous Training on the Level of PPAR-Γ and PRDM16 Proteins in Adipose Tissue in Overweight Diabetes Rats. J Qazvin Uni Med Sci 2018; 22(3): 4-12. [Persian]
18-Garcia NF, Sponton AC, Delbin MA, Parente JM, Castro MM, Zanesco A, et al. Metabolic Parameters and Responsiveness of Isolated Iliac Artery in Ldlr-/-Mice: Role of Aerobic Exercise Training. Am J Cardiovasc Dis 2017; 7(2): 64-71.
19-Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of AKT1, mTor, P70S6K1 and 4E-BP1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study . JRUMS 2018; 17(9): 843-54. [Persian]
20-Savikj M, Gabriel BM, Alm PS, Smith J, Caidahl K, Björnholm M, et al. Afternoon Exercise is More Efficacious than Morning Exercise at Improving Blood Glucose Levels in Individuals with Type 2 Diabetes: A Randomised Crossover Trial. Diabetologia 2018; 62(2): 233-7.
21-Loimaala A, Groundstroem K, Rinne M, Nenonen A, Huhtala H, Parkkari J, et al. Effect of Long-Term Endurance and Strength Training on Metabolic Control and Arterial Elasticity in Patients with Type 2 Diabetes Mellitus. Am J Cardiol 2009; 103(7): 972-7.
22-Salehikia A, Parastesh M. The Effect of Endurance Training on Protein-D Surfactant (SPD) and Insulin Resistance Index in Type 2 Diabetic Rats. J Sabzevar Uni Medical Sci 2019; 26(1): 89-97.
23-Esmaeilzade Toloee ME, Faramarzi M, Norozian P. Effect of Aerobic Training with Ginger Supplementation on some Liver Enzymes (AST,ALT,GGT) and Resistance to Insulin in Obese Women with Type 2 Diabetes. Med J Mashhad Uni Medical Sci 2017; 60(4): 636-47
24-Li S, Brown MS, Goldstein JL. Bifurcation of Insulin Signaling Pathway in Rat Liver: Mtorc1 Required for Stimulation of Lipogenesis, but not Inhibition of Gluconeogenesis. Proc Natl Acad Sci 2010; 107(8): 3441-6.
25-Demoulin JB, Ericsson J, Kallin A, Rorsman C, Rönnstrand L, Heldin CH. Platelet-Derived Growth Factor Stimulates Membrane Lipid Synthesis through Activation of Phosphatidylinositol 3-Kinase and Sterol Regulatory Element-Binding Proteins. J Biological Chem 2004; 279(34): 35392-402.
26-Porstmann T, Santos CR, Griffiths B, Cully M, Wu M, Leevers S, et al. SREBP Activity is Regulated by Mtorc1 and Contributes to Akt-Dependent Cell Growth. Cell Metab 2008; 8(3): 224-36.
27-Haun CT, Mobley CB, Vann CG, Romero MA, Roberson PA, Mumford PW, et al. Soy Protein Supplementation is not Androgenic or Estrogenic in College-Aged Men when Combined with Resistance Exercise Training. Sci Rep 2018; 8(1): 11151.
28-Hedayati katouli A, Azarbayjani M, Banaeifar A, Arshadi S. The Effect of Aerobic Training and Adenosine on the Expression of SREBP-1C and A1 Receptor in Hepatic Fat-Fed Rats. Iranian J Nutrition Sci & Food Technology 2019; 14(1): 1-9. [Persian]
29-Asano M, Iwagaki Y, Sugawara S, Kushida M, Okouchi R, Yamamoto K, et al. Effects of Japanese Diet in Combination with Exercise on Visceral Fat Accumulation. Nutrition 2019; 57: 173-82.
30-Lewis CA, Griffiths B, Santos CR, Pende M, Schulze A. Regulation of the SREBP Transcription Factors by Mtorc1. Biochem Soc Trans 2011; 39: 495-99.
31-Peterson TR, Sengupta SS, Harris TE, Carmack AE, Kang SA, Balderas E, et al. Mtor Complex 1 Regulates Lipin 1 Localization to Control the SREBP Pathway. Cell 2011; 146(3): 408-20.
5-Bakan I, Laplante M. Connecting Mtorc1 Signaling to SREBP-1 Activation. Curr Opin Lipidol 2012; 23(3): 226-34.
6-Laplante M, Sabatini DM. Mtor Signaling. Cold Spring Harbor Perspectives in Biology 2012; 4(2): a011593.
7-Yecies JL, Zhang HH, Menon S, Liu S, Yecies D, Lipovsky AI, et al. Akt Stimulates Hepatic SREBP1c and Lipogenesis through Parallel Mtorc1-Dependent and Independent Pathways. Cell Metabolism 2011; 14(1): 21-32.
8-Shao W, Espenshade PJ. Expanding Roles for SREBP in Metabolism. Cell Metabolism 2012; 16(4): 414-9.
9-Pedersen BK, Saltin B. Exercise as Medicine–Evidence for Prescribing Exercise as Therapy in 26 Different Chronic Diseases. Scandinavian J Med Sci in Sports 2015; 25: 1-72.
10-Petridou A, Siopi A, Mougios V. Exercise in the Management of Obesity. Metabolism 2019; 92: 163-69.
11-Jamali E, Asad M, Rassouli A. Effect of Eight-Week Endurance Exercise on Resistin Gene Expression in Visceral Adipose Tissues in Obese Rats. J Shahid Sadoughi Uni Med Sci 2017; 25(1): 20-31.
12-Symonds M, Bloor I, Galvez F, Domfeh E, Maicas B, Poston L, et al. Effect of a Dietary and Exercise Intervention during Pregnancy and Lactation on white Adipose Tissue Gene Profiles and Adiposity with Maternal Obesity. FASEB J 2016; 1214-3.
13-Ebrahimi M, Fathi R, Ansari Pirsaraei Z, Talebi Garakani E. Relative Gene Expression of Key Genes Involved in Lipid Metabolism, Following High Fat Diet and Moderate and High Intensity Aerobic Training in Rat’s Liver. Sport Physiology 2017; 9(34): 201-16.
14-Fathi R, Ebrahimi M, Sanami SK. Effects of High Fat Diet and High Intensity Aerobic Training on Interleukin 6 Plasma Levels in Rats. Pathobiology Res 2015; 18(3): 109-16. [Persian]
15-Safhi MM, Anwer T, Khan G, Siddiqui R, Moni Sivakumar S, Alam MF. The Combination of Canagliflozin and Omega-3 Fatty Acid Ameliorates Insulin Resistance and Cardiac Biomarkers via Modulation of Inflammatory Cytokines in Type 2 Diabetic Rats. Korean J Physiolo Pharmacol 2018; 22(5): 493-501.
16-Khalili A, Nekooeian AA, Khosravi MB. Oleuropein Improves Glucose Tolerance and Lipid Profile in Rats with Simultaneous Renovascular Hypertension and Type 2 Diabetes. J Asian Nat Prod Res 2017; 19(10): 1011-21.
17-Shabani M, Daryanoosh F, Salesi M, Kooshki Jahromi M, Fallahi AA. Effect of Continuous Training on the Level of PPAR-Γ and PRDM16 Proteins in Adipose Tissue in Overweight Diabetes Rats. J Qazvin Uni Med Sci 2018; 22(3): 4-12. [Persian]
18-Garcia NF, Sponton AC, Delbin MA, Parente JM, Castro MM, Zanesco A, et al. Metabolic Parameters and Responsiveness of Isolated Iliac Artery in Ldlr-/-Mice: Role of Aerobic Exercise Training. Am J Cardiovasc Dis 2017; 7(2): 64-71.
19-Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of AKT1, mTor, P70S6K1 and 4E-BP1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study . JRUMS 2018; 17(9): 843-54. [Persian]
20-Savikj M, Gabriel BM, Alm PS, Smith J, Caidahl K, Björnholm M, et al. Afternoon Exercise is More Efficacious than Morning Exercise at Improving Blood Glucose Levels in Individuals with Type 2 Diabetes: A Randomised Crossover Trial. Diabetologia 2018; 62(2): 233-7.
21-Loimaala A, Groundstroem K, Rinne M, Nenonen A, Huhtala H, Parkkari J, et al. Effect of Long-Term Endurance and Strength Training on Metabolic Control and Arterial Elasticity in Patients with Type 2 Diabetes Mellitus. Am J Cardiol 2009; 103(7): 972-7.
22-Salehikia A, Parastesh M. The Effect of Endurance Training on Protein-D Surfactant (SPD) and Insulin Resistance Index in Type 2 Diabetic Rats. J Sabzevar Uni Medical Sci 2019; 26(1): 89-97.
23-Esmaeilzade Toloee ME, Faramarzi M, Norozian P. Effect of Aerobic Training with Ginger Supplementation on some Liver Enzymes (AST,ALT,GGT) and Resistance to Insulin in Obese Women with Type 2 Diabetes. Med J Mashhad Uni Medical Sci 2017; 60(4): 636-47
24-Li S, Brown MS, Goldstein JL. Bifurcation of Insulin Signaling Pathway in Rat Liver: Mtorc1 Required for Stimulation of Lipogenesis, but not Inhibition of Gluconeogenesis. Proc Natl Acad Sci 2010; 107(8): 3441-6.
25-Demoulin JB, Ericsson J, Kallin A, Rorsman C, Rönnstrand L, Heldin CH. Platelet-Derived Growth Factor Stimulates Membrane Lipid Synthesis through Activation of Phosphatidylinositol 3-Kinase and Sterol Regulatory Element-Binding Proteins. J Biological Chem 2004; 279(34): 35392-402.
26-Porstmann T, Santos CR, Griffiths B, Cully M, Wu M, Leevers S, et al. SREBP Activity is Regulated by Mtorc1 and Contributes to Akt-Dependent Cell Growth. Cell Metab 2008; 8(3): 224-36.
27-Haun CT, Mobley CB, Vann CG, Romero MA, Roberson PA, Mumford PW, et al. Soy Protein Supplementation is not Androgenic or Estrogenic in College-Aged Men when Combined with Resistance Exercise Training. Sci Rep 2018; 8(1): 11151.
28-Hedayati katouli A, Azarbayjani M, Banaeifar A, Arshadi S. The Effect of Aerobic Training and Adenosine on the Expression of SREBP-1C and A1 Receptor in Hepatic Fat-Fed Rats. Iranian J Nutrition Sci & Food Technology 2019; 14(1): 1-9. [Persian]
29-Asano M, Iwagaki Y, Sugawara S, Kushida M, Okouchi R, Yamamoto K, et al. Effects of Japanese Diet in Combination with Exercise on Visceral Fat Accumulation. Nutrition 2019; 57: 173-82.
30-Lewis CA, Griffiths B, Santos CR, Pende M, Schulze A. Regulation of the SREBP Transcription Factors by Mtorc1. Biochem Soc Trans 2011; 39: 495-99.
31-Peterson TR, Sengupta SS, Harris TE, Carmack AE, Kang SA, Balderas E, et al. Mtor Complex 1 Regulates Lipin 1 Localization to Control the SREBP Pathway. Cell 2011; 146(3): 408-20.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1398/5/5 | پذیرش: 1398/5/19 | انتشار: 1399/6/10
دریافت: 1398/5/5 | پذیرش: 1398/5/19 | انتشار: 1399/6/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







