دوره 28، شماره 1 - ( فروردین 1399 )
جلد 28 شماره 1 صفحات 2284-2272 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
khoonmirzaie N, Razi Jalali M, Sahriari A, Tabandeh M R. Effect of Conjugation of Activated Glutaraldehyde-Nanochitosan with L-Asparaginase as an Anti Cancer Enzyme on its Stability and Physicochemical Properties. JSSU 2020; 28 (1) :2272-2284
URL: http://jssu.ssu.ac.ir/article-1-4869-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4869-fa.html
خون میرزایی نبی الله، راضی جلالی محمد، شهریاری علی، تابنده محمدرضا. بررسی تاثیر الحاق مشتق فعال گلوتارآلدئید- نانوکیتوزان به آنزیم ضد سرطان آسپاراژیناز بر پایداری و ویژگیهای فیزیکوشیمیایی آنزیم. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (1) :2272-2284
متن کامل [PDF 347 kb]
(999 دریافت)
| چکیده (HTML) (3229 مشاهده)
متن کامل: (2047 مشاهده)
مقدمه
آنزیم ال آسپاراژیناز (EC 3.5.11) آنزیمی با منشا باکتریایی است که هیدرولیز ال-آسپاراژین به ال-آسپارتیک اسید و آمونیوم را کاتالیز میکند. آنزیم دارای کاربرد بالینی از دو منبع باکتریایی اشریشیاکولای و اروینیا کاروتوورا استحصال میشود. آنزیم در درمان تومورهای وابسته به آسپاراژین بهویژه لنفو سارکوم، لوسمی لنفوبلاستیک حاد و ملانوسارکوما بهطور گسترده مورد استفاده قرار میگیرد (1). سلولهای لوسمی به دلیل فقدان آنزیم ال آسپاراژین سنتتاز، توانایی سنتز آسپاراژین را ندارند و رشد آنها وابسته با آسپاراژین موجود در سرم میباشد. این در حالیست که سلولهای نرمال بهدلیل توانایی سنتز ال آسپاراژین، بهدنبال درمان با آسپاراژیناز کمتر تحت تاثیر قرار میگیرند (3، 2).
تحقیقات نشان داده است که درمان با ال آسپاراژیناز سبب بروز آپوپتوز در سلولهای لوسمی بهدنبال توقف سیکل سلولی در فاز G1 میشود. بهنظر میرسد محصولات عملکرد ال آسپاراژیناز بهویژه یون آمونیوم با فسفوریلاسیون میانجی گرهای آپوپتوز در مرگ سلولهای لوسمی نقش داشته باشند (4). علی رغم کاربرد گسترده آنزیم در درمان لوسمی، منشا پروتئینی نامتجانس آنزیم سبب تحریک ایمنی میزبان، تولید IgE و بروز واکنشهای آلرژیک در بیماران تحت درمان میشود. تولید آنتی بادیهای خنثی کننده سبب کاهش نیمه عمر آنزیم از 24-18 به 5/2 ساعت میشود. بهطور میانگین واکنشهای آلرژیک در 30 درصد بیماران تحت درمان مشاهده میشود. اختلالات کبدی، التهاب پانکراس، هیپر گلیسمی، اختلالات انعقادی و سیستم عصبی مرکزی بهدنبال درمان با آسپاراژیناز مشاهده شده است (5). بهعلاوه آنزیم طبیعی بهدلیل عملکرد پروتئازهای سرمی و واکنش با آنتی بادیهای تولید شده دارای پایداری پایینی در سرم است (6). تکنیکهای متعددی چون مهندسی پروتئین، تغییرات شیمیایی با استفاده از افزودنیها و ایموبیلیزاسیون روشهایی هستند که در سالهای گذشته بهمنظور بهبود نیمه عمر، پایداری سرمی و حذف ایمنیزایی آنزیم آسپاراژیناز مورد استفاده قرار گرفتهاند (7). یکی از روشهایی که در سالهای اخیر در زمینه بهبود
عملکرد آنزیم آسپاراژیناز بهطور وسیعی مورد مطالعه قرار گرفته است الحاق پلیمرهای طبیعی یا سنتزی به آسپاراژیناز میباشد. تاکنون الحاق آنزیم به پلیمرهای مختلف مانند آلبومین، دکستران، پلی اتیلن گلیکول، کیتوزان، فیبروئین ابریشم و سریسین انجام شده است که منجر به بهبود خواص فیزیکوشیمیایی آنزیم شده است (8). برخی از اشکال کانژوگه آنزیم مانند شکل الحاق شده با پلی اتیلن گلیکول تحت عنوان تجاری Pegaspargase در سالهای گذشته به صورت تجاری نیز عرضه شده است با اینحال گزارشهایی مبنی بر بروز التحاب شدید پانکراس، کاربرد این شکل از دارو را محدود ساخته است (9، 6). نکته مهم در فرآیند الحاق پلیمرها به آنزیمها این است که پلیمرها یا آنزیم دارای گروههای فعال محدودی هستند. از این رو جهت الحاق آنزیم به پلیمرهای سنتزی یا طبیعی فعالسازی گروههای موجود بر روی آنزیم یا پلیمرهای مورد کاربرد ضروری میباشد. نوع مشتقات فعال شده تاثیر بسیار زیادی بر ساختار و متعاقباً عملکرد، فعالیت، پایداری و ایمنوژنسیتی آنزیم دارد (10). از این رو تحقیقات بهمنظور تولید اشکال بهینه آسپاراژیناز با استفاده از ترکیبات جدید یا مشتقات شیمیایی متفاوت همچنان در حال انجام میباشد.کیتوزان یک پلیمر طبیعی است که در اثر داستیلاسیون کیتین در شرایط قلیایی تولید میشود. این پلیمر حاوی منومرهای گلوکزآمین، و استیل گلوکز آمین میباشد. کیتوزان دارای گروههای شیمیایی متعدد بهویژه گروههای هیدروکسیل و آمینی میباشد که امکان الحاق آن به گروههای موجود بر روی پروتئینها یا ایجاد مشتقات فعال را فراهم میکنند (12، 11). ویژگیهای فیزیکو شیمیایی، ایمنی زایی بیولوژیک پایین، غیر سمی بودن و سازگاری زیستی کاربرد این ترکیب در سیستمهای رهایش ژن، پپتید، دارو و واکسن و نیز مهندسی پروتئین را توسعه داده است (12، 11). تاکنون مطالعات معدودی در خصوص تغییر خواص فیزیکوشیمیایی آنزیم آسپاراژیناز بهدنبال الحاق با کیتوزان یا مشتقات آن انجام شده است. Qian و همکاران (1996) آنزیم آسپاراژیناز با مقاومت بالاتر در برابر هضم ناشی از تریپسین را با استفاده از الحاق آنزیم به میکروسفرهای کیتوزان تولید کردهاند (13).
Wan و همکاران (2016) با الحاق کیتوزان متصل به نانو وزیکولهای لیپیدی به آسپاراژیناز افزایش نیمه عمر آنزیم، بهبود مقاومت حرارتی و کینتیک آنزیم را گزارش نمودهاند (14). Sukhoverkov و Kudryashova (2015) از هیبریدهای کیتوزان-پلی اتیلن گلیکول و کیتوزان-گلیکول بهمنظور بهبود خواص فیزیکوشیمیایی آنزیم استفاده نمودند و خواص بهتر آنزیم پس از الحاق به هیبرید گلیکول-کیتوزان را مشاهده نمودند (15). در سالهای اخیر تولید نانو کیتوزان به روشهای شیمیایی و فیزیکی سبب بهبود خواص فیزیکوشیمیایی آن و توسعه روشهای مبتنی بر کاربرد نانوکیتوزان در طراحی پروتئین و رهاسازی دارو گردیده است. نانوکیتوزان بهدلیل تراکم مولکولی بالاتر در واحد حجم دارای پایداری مکانیکی و حرارتی بیشتری نسبت به کیتوزان است (16). اخیراً Bahreini و همکاران (2014) از پوشش دهی آنزیم آسپاراژیناز با استفاده از رابط تری پلی فسفات و روش ژلاسیون یونی بهمنظور طراحی یک سیستم رهایش دارو استفاده کردهاند. نتایج این تحقیق نشان دهنده عدم تغییر پایداری حرارتی آنزیم و افزایش نیمه عمر آن بوده است (17). با اینحال اطلاعات دیگری در خصوص کاربرد نانوکیتوزان در بهبود خواص فیزیکوشیمیایی آنزیم آسپاراژیناز در دسترس نمیباشد.
نتایج تحقیقات مرتبط با تثبیت پلیمرها به پروتئینها نشان داده است که چنانچه اتصال آنها به یکدیگر از طریق رابطهای متعدد آلدئیدی (اتصال چند نقطهای) صورت پذیرد پایداری کمپلکس پلیمر-پروتئین در برابر تغییرات ساختار فضایی ناشی از حرارت، حلالهای آلی و فریز و ذوب نمودن و آنزیمهای هضم کننده بیشتر خواهد بود. از این رو استفاده از رابطهای آلدئیدی مانند گلوتارآلدئید در الحاق پلیمرهای متعدد به آنزیمها استفاده شده است و نتایج مناسبی در خصوص بهبود عملکرد آنها بهدنبال داشته است (18). تاکنون مطالعهای که به بررسی خواص فیزیکوشیمیایی آسپاراژیناز کانژوگه با نانوکیتوزان فعال شده با گلوتارآلدئید بپردازد انجام نشده است. با توجه به مطالب فوق هدف از مطالعه حاضر تولید آنزیم آسپاراژیناز کانژوگه با نانوکیتوزان به کمک رابط گلوتارآلدئید و بررسی خواص فیزیکو شیمیایی آن
مانند پایداری در دما و pHهای مختلف، نیمه عمر محیطی، مقاومت در برابر فریز و لیوفیلیزه نمودن و هضم سرمی در شرایط آزمایشگاه میباشد.
روش بررسی
روش مطالعه: مطالعه حاضر یک مطالعه تجربی بهمنظور تولید شکل بهبود یافته آنزیم درمانی آسپاراژیناز می باشد.
تولید نانوکیتوزان
کیتوزان با میانگین وزن مولکولی 30 کیلودالتون و 85% داستیلاسیون (سیگما، آمریکا) با غلظت 5 میلیگرم در میلیلیتر در اسید استیک 3% (4= pH) حل و به مدت 25 دقیقه در دمای اتاق بر روی همزن برقی با سرعت 1000 دور در دقیقه قرار داده شد تا محلول یکنواخت و شفافی ایجاد شود. سپس نمونه به مدت 5 دقیقه سونیکه شد و pH نهایی آن با افزودن سود یک مولار بر روی 6 تنظیم شد. سپس نمونه مورد نظر با سرعت 2000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ و محلول شفاف رویی حاوی نانوکیتوزان جدا سازی گردید (19). نمونه حاوی نانو کیتوزان با استفاده از دستگاه لایوفیلایزر (Christ Alpha1-2 LD plus، آلمان) پودر و جهت ارزیابیهای فیزیکوشیمیایی استفاده شد.
الحاق نانوکیتوزان به گلوتارآلدئید
بهمنظور الحاق گلوتارآلدئید به کیتوزان، 10 میلیلیتر گلوتارآلدئید 1% در بافر فسفات 1/0 مولار با 10 میلیلیتر بافر فسفات حاوی 1 گرم نانوکیتوزان (6=pH) مخلوط و بهمدت 30 دقیقه در دمای C°28 و بر روی همزن برقی با سرعت پایین قرار داده شد. پس از زمان مذکور نمونهها با استفاده از ستونهای دیالیز NAP-5 (Healthcare، آمریکا) در بافر سدیم فسفات 5 میلیمولار 6=pH به مدت 1 ساعت دیالیز شدند (20). نمونهها پس از دیالیز با استفاده از دستگاه لایوفیلایزر (Christ Alpha1-2 LD plus، آلمان) پودر و جهت ارزیابیهای فیزیکوشیمیایی استفاده شدند.
ارزیابی فیزیکوشیمیایی نانو کیتوزان و نانوکیتوزان-گلوتارآلدئید
شکل و اندازه نانوکیتوزان و نانوکیتوزان-گلوتارآلدئید با استفاده از میکروسکوپ الکترونی گذاره (Philips M20 Ultra Twin) و تجزیهگر اندازه ذرات Zetasizer 3000HSA (Malvern Instruments, Southborough,، آمریکا) مورد ارزیابی قرار گرفت. بدین منظور سوسپانسیون نانوکیتوزان یا گلوتارآلدئید-نانوکیتوزان با غلظت ppm100 تهیه و به مدت 90 ثانیه سونیکه شدند. بهمنظور تهیه تصاویر میکروسکوپ الکترونی گذاره (Transmission Electron Microscopy; TEM) از نانو کیتوزان تولید شده، 10 میکرولیتر از نمونهها بر روی پلیتهای پوشش داده شده با کربن قرار داده شد و بهمنظور خشک شدن، روی کاغذ صافی قرار گرفتند. پلیتها در دستگاه میکروسکوپ الکترونی گذاره Philips CM20 ultra twin قرار گرفت و تصاویر با اعمال ولتاژ kV 200 تهیه شدند. میانگین قطر ذرات با شمارش قطر حد اقل 50 ذره با استفاده از نرمافزار تعیین قطر نانوذرات Paxit محاسبه گردید. تصاویر با استفاده از دوربین دیجیتال CCD تهیه شدند.
الحاق نانوکیتوزان-گلوتارآلدئید به آنزیم آسپاراژیناز
در این مطالعه از آنزیم آسپاراژیناز مشتق از باکتری Erwinia carotovora با نام تجاری Erwinase® با غلظت 1000 IU بازای 25 میلی گرم (Porton Biopharma، آمریکا) استفاده شد. بدین منظور آنزیم آسپاراژیناز با غلظت mg/ml5 در سدیم فسفات بافر 100 میلی مولار و 8= pH با کیتوزان–گلوتارآلدئید به نسبت وزنی 1:2، 1:5، 1:10 و 1:20 مخلوط و به مدت 1 ساعت در دمای C°28 بر روی همزن قرار داده شد. سپس 10 میکرو لیتر سدیم سیانو بوروهیدرات 5 مولار به ازای هر یک میلیلیتر از محلول اضافه و نمونه به مدت 3 ساعت دیگر در دمای C°28 بر روی همزن قرار داده شدند. سپس نمونهها به مدت یک ساعت در دمای اتاق نگهداری شدند (21). بهمنظور حذف بقایای واکنش نیافته نانوکیتوزان-گلوتارآلدئید نمونه نهایی به مدت یک شب با استفاده از کیسه های دیالیز با حداقل قطر ذرات 12400 دالتون (سیگما، آمریکا) در بافر سدیم فسفات 5 میلی مولار 6=pH دیالیز شدند. سپس نمونهها با استفاده از لولههای اولترافیلتراسیونVivaspin®(Sartorious، آمریکا) تا 50 برابر تغلیظ و جهت ارزیابیهای بعدی مورد استفاده قرار گرفتند. فعالیت آنزیم کانژوگه پس از تغلیظ در مورد هر نسبت آنزیم به نانوکیتوزان-گلوتارآلدئید ارزیابی و نسبتی که بیشترین فعالیت باقیمانده آنزیم نسبت به پروتئین تام در آن مشاهده شد، بهعنوان نسبت مناسب انتخاب و جهت ارزیابیهای فیزیکوشیمیایی و ایمنوژنسیتی آنزیم مورد استفاده قرار گرفت. در مطالعه حاضر نسبت 1:5 دارای بیشترین فعالیت باقیمانده بود و از آنزیم کانژوگه تولید شده با نسبت مذکور جهت ارزیابیهای بعدی استفاده شد. بهمنظور ارزیابی باقیمانده فعالیت آنزیم، فعالیت اختصاصی آنزیم نسبت به پروتئین تام قبل و بعد از کانژوگه نمودن ارزیابی و درصد فعالیت باقیمانده از فرمول زیر محاسبه گردید.

در فرمول فوق IY درصد باقیمانده فعالیت آنزیم، AT0 فعالیت اختصاصی آنزیم قبل از کانژوگه نمودن، ATt فعالیت اختصاصی آنزیم بعد از کانژوگه نمودن میباشد. ارزیابی فعالیت آنزیم آسپاراژینازبدین منظور 100 میکرولیتر نمونه حاوی آنزیم به مخلوط واکنش شامل 200 میکرولیتر بافر تریس 05/0 مولار 6/8=pH، 7/1 میلیلیتر آسپاراژین 01/0 مولار افزوده و به مدت 10 دقیقه در دمای C° 37 انکوبه شد. سپس واکنش با افزودن 100 میکرو لیتر تری کلرو استیک اسید 5/1 مولار متوقف گردید. 500 میکرولیتر از مایع شفاف رویی پس از سانتریفیوژ با 7 میلیلیتر آب و 1 میلیلیتر معرف نسلرز مخلوط و پس از 10 دقیقه جذب نمونهها در طول موج 480 نانومتر در مقابل شاهد ارزیابی شد. مقدار آمونیوم آزاد شده بر اساس منحنی استاندارد آمونیومسولفات (25/0-1 میکرومول/میلیلیتر) محاسبه گردید. میزان فعالیت آنزیم بر اساس تعریف واحد بین المللی ( مقداری از آنزیم که 1 میکرومول آمونیوم در مدت 1 دقیقه در شرایط واکنش تولید کند) محاسبه و پس از تقسیم بر میزان پروتئین نمونهها بر اساس فعالیت اختصاصی گزارش گردید. اندازه گیری پروتئین با استفاده از روش برادفورد و آلبومین سرم گاوی بهعنوان استاندارد انجام شد (22). ارزیابی وزن مولکولی آنزیم کانژوگه بهمنظور تعیین وزن مولکولی آنزیمهای کانژوگه و غیر کنژوگه از روش SDS-PAGE با ژل 10 درصد استفاده شد.
ارزیابی تاثیر دما و pH بر فعالیت آنزیم کانژوگه
بهمنظور ارزیابی تاثیر دما، فعالیت آنزیمی مطابق روش شرح داده شده در بخش قبلی در دماهای 25، 35، 45، 55، 65 و 70 درجه سانتیگراد و pH ثابت 6/8 محاسبه شد. بهمنظور ارزیابی تاثیر pH، فعالیت آنزیمی مطابق روش شرح داده شده در بخش قبلی درpH های 6، 7، 8، 9، 10،11 و در دمای ثابت 37 درجه سانتیگراد مورد ارزیابی قرار گرفت. بهمنظور ارزیابی فعالیت آنزیم در pH و دماهای مختلف مقدار آنزیم در هر واکنش IU 500 در میلیلیتر و زمان انکوباسیون 10 دقیقه در نظر گرفته شد. به ترتیب از بافرهای سیترات 05/0 مولار جهت pH6، بافر HEPES 05/0 مولار جهت pH 7 تا 8 و بافر تریس 05/0 مولار جهت pH 9 تا 11 استفاده شد. دما یا pH که بالاترین فعالیت آنزیم در آن مشاهده شد بهعنوان 100% فعالیت در نظر گرفته شد و فعالیت آنزیم در سایر دماها و pHها به عنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شد.
ارزیابی نیمه عمر محیطی و پایداری در برابر هضم آنزیمی
بهمنظور ارزیابی پایداری آنزیم در شرایط محیطی محلول آنزیمی با فعالیت IU 500 در میلیلیتر در بافر سدیم فسفات تهیه و در دمای محیط نگهداری گردید. در زمانهای 70-10 ساعت پس از نگهداری در دمای محیط، باقیمانده فعالیت آنزیمها ارزیابی گردید. بهمنظور ارزیابی پایداری آنزیم در برابر هضم آنزیمی، مقدار IU 500 در میلیلیتر از آنزیم با 5/0 میلیلیتر آنزیم تریپسین با فعالیت IU/ml50 در بافر فسفات تازه 6/7=pH مخلوط و در زمانهای 30-5 دقیقه باقیمانده فعالیت آنزیم ارزیابی گردید. زمانی که بالاترین فعالیت آنزیم در آن مشاهده شد بهعنوان 100% فعالیت در نظر گرفته شد و فعالیت باقیمانده آنزیم ها در سایر زمانها بهعنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شدند.
ارزیابی پایداری آنزیم بهدنبال انجماد و ذوب
بهمنظور ارزیابی تاثیر انجماد و ذوب نمودن بر فعالیت آنزیم کانژوگه محلول آنزیم حاوی IU 500 در میلیلیتر آنزیم در بافر فسفات در فریزر 20- منجمد و پس از زمانهای 24-2 ساعت ذوب گردید. در محلول انجماد طبق پروتکل شرکت سازنده 50 میلیگرم مانیتول بازای هر یک میلیلیتر آنزیم اضافه شد. پس از زمانهای فوق مقدار فعالیت باقیمانده آنزیم ارزیابی و زمانی که بالاترین فعالیت آنزیم در آن مشاهده شد به عنوان 100% فعالیت در نظر گرفته شد و فعالیت باقیمانده آنزیمها در سایر زمانها بهعنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شدند.
تجزیه و تحلیل آماری
آنالیز آماری داده ها با استفاده از نرم افزارversion 18 SPSS انجام شد.کلیه دادهها به صورت میانگین ± خطای معیار ارائه شدند. سطح معنیداری همه تست ها 05/0> P در نظر گرفته شد. تفاوت آماری پارامتر های مختلف در شرایط متفاوت با استفاده از آنالیز واریانس با اندازههای تکراری (Repeated Measure) و برای مقایسه تاثیر پارامترها بین دو شکل آنزیم از آزمون t مستقل استفاده شد.
ملاحظات اخلاقی
مطالعه حاضر توسط کمیته اخلاق در پژوهش بر روی آزمودنیها و مشارکت کنندگان انسانی دانشگاه شهید چمران اهواز با کد اخلاق EE / 97.13.3.2.25447 / scu.ac.ir به تایید رسیده است.
نتایج
خواص فیزیکوشیمیایی نانو کیتوزان و نانوکیتوزان-گلوتارآلدئید
نتایج حاصل از ارزیابی مورفولوژی و توزیع ذرات نانوکیتوزان با استفاده از TEM و تجزیه گر اندازه ذرات نشان داد که توزیع اندازه ذرات از 4/68 نانومتر تا 7/252 نانومتر متغیر بود. میانگین قطر ذرات نانوکیتوزان 6/149 بود (تصویر A1 و B1).

تصویر 1. تصویر TEM نانوکیتوزان (A) و نانوکیتوزان-گلوتارآلدئید (B). میانگین قطر ذرات با شمارش قطر حد اقل 50 ذره با استفاده از نرم افزار تعیین قطر نانوذرات Paxit محاسبه گردید. توزیع اندازه ذرات از 4/68 نانومتر تا 7/252 نانومتر متغیر بود.میانگین قطر ذرات نانوکیتوزان 6/149 بود.
الحاق نانوکیتوزان-گلوتارآلدئید به آنزیم آسپاراژیناز
در این مطالعه از نسبت های متفاوت آنزیم به نانوکیتوزان-گلوتارآلدئید در فرآیند الحاق استفاده شد. نتایج حاصل از ارزیابی فعالیت باقیمانده آنزیم در نسبتهای 1:2، 1:5، 1:10 و 1:20 در تصویر 1 نشان داده شده است. با توجه به اینکه در نسبت 1:5 بیشترین فعالیت باقیمانده آنزیم (4/86%) مشاهده شد آنزیم بهدست آمده از این نسبت بهعنوان نمونه مناسب انتخاب و جهت ارزیابیهای فیزیکوشیمیایی استفاده شد. بهمنظور تعیین وزن مولکولی آنزیم کانژوگه نسبت به آنزیم غیر کنژوگه از SDS-PAGE10درصد استفاده شد. نتایج مربوط به SDS-PAGE نشان دهنده تشکیل باند هایی با وزن مولکولی بالا بهدنبال الحاق نانوکیتوزان به آنزیم بود (تصویر 2).

تصویر1: فعالیت باقیمانده آنزیم آسپاراژیناز (IU/ml) پس از الحاق به نانوکیتوزان گلوتارآلدئید در نسبتهای مختلف آنزیم/نانوکیتوزان. بیشترین فعالیت آنزیم در نسبت 1:5 مشاهده شد و از این نسبت جهت ارزیابی های فیزیکوشیمیایی استفاده شد.

تصویر2: آنالیز وزن مولکولی آنزیم آسپاراژیناز طبیعی (ردیف 1) (30 کیلودالتون) و آنزیم الحاق شده با نانوکیتوزان با نسبت 1:5 (ردیف 2) با استفاده از SDS-PAGE 10% و رنگ آمیزی کوماسی آبی. تشکیل اسمیر نشاندهنده الحاق نانوکیتوزان به آنزیم و تشکیل پروتئین با وزن مولکولی متفاوت می باشد.
نتایج تاثیر دما و pH بر فعالیت آنزیم کانژوگه
نتایج تحقیق حاضر نشان دهنده بیشترین فعالیت آنزیم کانژوگه و غیر کانزوگه در دمای 45 درجه سانتیگراد بود. الحاق نانوکیتوزان بهآنزیم آسپاراژیناز سبب افزایش پایداری آنزیم در دماهای مختلف شد. آنزیم کانژوگه در محدوده دمایی وسیعتری (35تا 55) فعالیت بالایی را نشان داد به طوریکه آنزیم کانژوگه در دمای 55 درجه سانتیگراد 80 درصد بالاترین فعالیت آنزیم را حفظ نمود در حالیکه آنزیم غیرکنژوگه 40 درصد ببیشترین فعالیت آنزیم را در دمای 55 درجه سانتیگراد نشان داد (تصویر3). نتایج ارزیابی فعالیت آنزیمهای کانژوگه و غیرکنژوگه در pHهای مختلف (11-4) نشان داد که بهینه فعالیت آنزیمها در pH 8 بود. آنزیم کانژوگه در طیف وسیع تری از pH (9-7) فعال تر بود به طوریکه 80 درصد فعالیت آنزیم کانژوگه در pH 9-7 حفظ شد (تصویر4).
نتایج نیمه عمر و هضم آنزیمی آنزیم کانژوگه
بهمنظور ارزیابی نیمه عمر محیطی، آنزیمها بهمدت 10 تا 70 ساعت در دمای محیط نگهداری و فعالیت آنها ارزیابی شد. نتایج نشان داد که نیمه عمر آنزیمهای طبیعی و کانژوگه به ترتیب 20 و 50 ساعت بود (تصویر5). نتایج ارزیابی پایداری آنزیم در برابر هضم ناشی از تریپسین نشان داد که نیمه عمر آنزیمهای طبیعی و کانژوگه در محیط حاوی تریپسین به ترتیب 10 و 25 دقیقه بود (تصویر6).
نتایج پایداری آنزیم بهدنبال انجماد و ذوب
بهمنظور ارزیابی تاثیر ذوب و انجماد بر فعالیت آنزیم کانژوگه، آنزیم در بافر فسفات منجمد و پس از 2 تا 24 ساعت انجماد فعالیت آن نسبت به آنزیم طبیعی منجمد شده مقایسه گردید. نتایج نشان داد که آنزیم کانژوگه نسبت به آنزیم طبیعی در برابر انجماد مقاومت بیشتری نشان داد بهطوریکه 12 ساعت پس از انجماد فعالیت آنزیم طبیعی به 50 درصد رسید اما فعالیت آنزیم کانژوگه بیش از 70 درصد بود (تصویر7).
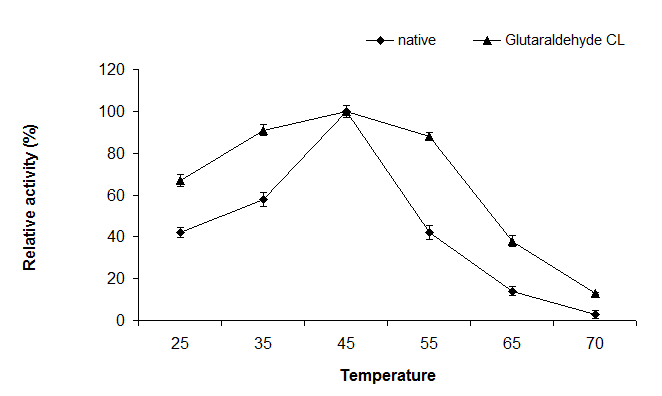
تصویر3: ارزیابی فعالیت آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) در دماهای مختلف. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازه گیریها با سه تکرار انجام شده است.

تصویر4: ارزیابی فعالیت آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) در pH مختلف. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازهگیریها با سه تکرار انجام شده است.

تصویر5: ارزیابی نیمه عمر (پایداری محیطی) آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml)پس از انکوباسیون در دمای محیط به مدت 10 تا 70 ساعت. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بصورت نسبتی از 100 بیان شده است. اندازهگیریها با سه تکرار انجام شده است.

تصویر6: ارزیابی پایداری آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) پس از انکوباسیون در حضور تریپسین به مدت 5 تا 30 دقیقه. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بصورت نسبتی از 100 بیان شده است. اندازه گیریها با سه تکرار انجام شده است.

تصویر7: ارزیابی پایداری آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) پس از انجماد به مدت 2 تا 24 ساعت و رفع انجماد دردمای محیط. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازه گیری ها با سه تکرار انجام شده است.
بحث
در سالهای اخیر استفاده از فناوریهای مبتنی بر نانو بهمنظور تولید فرآوردههای پروتئینی تثبیت شده با نانو مواد توسعه چشمگیری یافته است. تثبیت نانو پلیمرها بر روی آنزیمها منجر به بهبود پایداری آنزیمها در برابر دما و pH و شرایط نگهداری غیر بهینه شده است. با اینحال فرآینده الحاق این نانو پلیمرها به آنزیم ها و نوع ساختار شیمیایی آنها تاثیر قابل توجهی بر خصوصیات فیزیکوشیمیایی و پایداری آنزیمها در شرایط غیر بهینه دارد (11). در مطالعه حاضر پایداری و خواص فیزیکوشیمیایی آنزیم آسپاراژیناز پس از الحاق آن به نانوکیتوزان بهواسطه گروههای گلوتارآلدئید تثبیت شده بر سطح نانوکیتوزان مورد ارزیابی قرار گرفت. در این مطالعه بهمنظور الحاق نانوکیتوزان بهآنزیم آسپاراژیناز از رابط گلوتارآلدئید استفاده شد. ساختار نانوکیتوزان به گونهای است که حاوی گروههای آمینی متعدد میباشد و تثبیت گلوتارآلدئید بر روی نانوکیتوزان به ایجاد جایگاههای اتصالی مناسب برای الحاق به گروههای آمینی اپسیلون و گروه انتهای آمینی آنزیم کمک میکند. در این روش که اصطلاحا به اتصال چند نقطهای اطلاق میشود نانو کیتوزان از طریق چندین گروه آلدئیدی گلوتارآلدئید به گروههای آمینی آنزیم متصل میشود. تاکنون از این روش بهمنظور الحاق پلیمرهای کربوهیدراتی متعدد به آنزیمهایی چون آلفا آمیلاز و پنیسیلین G اسیلاز استفاده شده است (23، 20). در مطالعه حاضر از نسبتهای مختلف آنزیم به نانوکیتوزان بهمنظور ارزیابی بهترین نسبتی که سبب حفظ فعالیت آنزیم میشود استفاده شد. نتایج تحقیق حاضر نشان داد که در نسبت 1:5 آنزیم به نانوکیتوزان بیش از 80 درصد فعالیت آنزیم نسبت به قبل از الحاق به نانوکیتوزان حفظ گردید در حالیکه در نسبتهای بالاتر از نسبت 1:5 بیش از 60 درصد فعالیت آنزیم از دست رفت. مطالعات نشان میدهد که در زمان تولید اشکال کانژوگه پروتئینها با پلیمرهای کربوهیدراتی غلظت پایین پلیمر علیرغم اتصال به پروتئین تاثیری بر کاهش انعطافپذیری پروتئین و پایدار نمودن آن در حضور عوامل ناپایدار کننده ندارد درحالیکه غلظتهای بسیار بالای پلیمر کربوهیدراتی با افزایش ساختارهای غیر قابل انعطاف در پروتئین و پوشاندن جایگاه فعال علیرغم ایجاد پایداری محیطی سبب کاهش فعالیت آنزیم میشوند (22، 15). تحقیقات انجام شده بر روی الحاق پلیمر اکسید شده لوان به آنزیم آسپاراژیناز نشان داده است که در صورتیکه 20-15 گروههای آمینی اپسیلون آنزیم با پلیمر واکنش دهند کاهش فعالیت آنزیم قابل توجه نخواهد بود (24). در مطالعه Tabandeh و Aminlari (2014) الحاق پلی ساکارید اینولین با نسبت 1:2 به آسپاراژیناز سبب حفظ فعالیت آنزیم تا 67% شده است در حالیکه در زمان استفاده از نسبت 1:4 آنزیم به اینولین باقیمانده فعالیت آنزیم 30% گزارش شده است (22). نتایج مشابهی در خصوص الحاق پلیمرهای سنتزی و طبیعی مختلف مانند دکستران سولفات، فیبرویین و سریسین ابریشم و پلیاتیلنگلیکول به آنزیم آسپاراژیناز بهدست آمده است (27، 26، 25). بهعلاوه بهمنظور اتصال واحدهای پلیمری بیشتر به آنزیم ضروریست که فرآیند الحاق بهمنظور ایجاد بیشترین گروههای آمینی باردار بر روی آنزیم در pHبالاتر انجام شد که احتمال تخریب ساختار سه بعدی آنزیم را افزایش میدهد. با توجه به مطالب فوق تولید آسپاراژیناز کانژوگه با نانوکیتوزان-گلوتارآلدئید با نسبت آنزیم به نانوکیتوزان 1:5 در 6=pH توصیه میشود. نتایج SDS-PAGE نشان دهنده تشکیل باندهای پروتئینی در محدوده وزنی 40 تا 150 کیلو دالتون بود. این یافته به همراه حذف باند پروتئینی مربوط به آنزیم طبیعی با وزن مولکولی تقریبی 30 کیلو دالتون نشان دهنده اتصال تعداد متغیری از گروههای نانوکیتوزان به آنزیم و کاهش تحرک الکتروفورتیک آنزیم کانژوگه بر روی ژل می باشد.
نتایج ارزیابی فعالیت آنزیم در دماها و pHهای مختلف نشان داد که بهینه فعالیت آنزیم در دمای C°45 و 8=pH بود. با اینحال آنزیم کانژوگه در محدوده دما و pH وسیع تری نسبت به آنزیم غیرکنژوگه فعالیت داشت. آنزیم کانژوگه در pH 7 و 9 بیش از 80 درصد نسبت بهشرایط بهینه فعالیت داشت در حالیکه فعالیت آنزیم طبیعی در دو pH مذکور کمتر از 70 درصد فعالیت بهینه بود. شرایط مشابهی در خصوص تاثیر دما بر آنزیم کانژوگه مشاهده شد بهطوریکه آنزیم کانژوگه در دمای 55 درجه بیش از 70 درصد فعالیت بهینه را داشت در حالیکه فعالیت آنزیم غیرکانژوگه در همین دما کمتر از 40 درصد فعالیت بهینه بود. نتایج تحقیق حاضر نشان داد که نیمه عمر آنزیم کانژوگه در دمای محیط 20 ساعت و نیمه عمر آنزیم کانژوگه 50 ساعت بود. همچنین آنزیم کانژوگه مقاومت بالایی نسبت به انجماد نشان داد به طوریکه آنزیم کانژوگه 24 ساعت پس از انجماد و ذوب 80 درصد فعالیت اولیه را حفظ نمود در حالیکه آنزیم غیرکنژوگه پس از 24 ساعت انجماد و ذوب 50 درصد فعالیت اولیه را نشان داد. یافتههای مذکور با نتایج تحقیقات سایر محققین پس از الحاق آنزیم آسپاراژیناز به دکستران سولفات، لوان و پلیاتیلنگلیکول-کیتوزان همخوانی داشت (25،22،15). تحقیقات نشان داده است اتصال پلیمرهای کربوهیدراتی مانند دکستران و پلیاتیلنگلیکول با نسبت مناسب به آسپاراژیناز بهدلیل ایجاد پایداری بالا سبب مقاوت در برابر شرایط تخریب کننده مانند دما و pH بالا میشود (25،15). بهعبارت دیگر انرژی فعالسازی تا خوردن پروتئین کاهش و انرژی فعالسازی باز شدن ساختارهای درونی آنزیم کانژوگه بیشتر میشود. مکانیسم دیگری که در خصوص پایداری بیشتر آنزیم کانژوگه در شرایط غیر بهینه میتوان اشاره کرد تشکیل مجتمعهای آنزیمی بهواسطه رابط های پلی ساکاریدی میباشد که سبب محافظت بیشتر آنزیم در برابر تغییرات ساختاری ناشی از عوامل دناتوره کننده مانند حرارت و pH بالا میباشد (28). در تایید این نظریه تحقیقات Marlborough و همکاران نشان داده است که آنزیم آسپاراژیناز با 4 زیرواحد دارای فعالیت و پایداری بیشتری نسبت به آنزیم تک زیرواحدی است (29). به علاوه تحقیقات انجام شده توسط Miller و همکاران (1993) نشان داده است که آسپارتیک اسید در محدوده اسیدی با اثر مهاری بر جایگاه فعال سبب کاهش فعالیت آنزیم میشود. این فرضیه مطرح میباشد که زنجیرههای کربوهیدراتی الحاق شده به آنزیم سبب کاهش اثر مهاری آسپارتیک اسید در شرایط اسیدی شده و به این دلیل آنزیم در طیف وسیع تری از pH دارای فعالیت میباشد (30). یکی از مشکلات اصلی کاربرد آسپاراژیناز در بیماران تحت درمان نیمه عمر پایین آنزیم بهدلیل اثر پروتئازهای سرم و یا واکنش آنزیم با آنتیبادیهای خنثی کننده میباشد (6). نتایج تحقیق حاضر نشان داد که آنزیم کانژوگه با نانوکیتوزان در مقابل هضم ناشی از تریپسین در شرایط آزمایشگاه پایداری بیشتری نسب به آنزیم غیرکنژوگه نشان داد. به طوریکه فعالیت آنزیم طبیعی 30 دقیقه پس از مجاورت با تریپسین به صفر رسید در حالیکه پس از زمان فوق آنزیم کانژوگه همچنان 40 درصد فعالیت اولیه را نشان داد. نتایج مشابهی در خصوص بهبود پایداری آنزیم پس از الحاق سایر پلیمر های کربوهیدراتی گزارش شده است. بهطور مثال Qian و همکاران با تثبیت میکروسفر کیتوزان بر روی آنزیم آسپاراژیناز افزایش فعالیت آنزیم و مقاومت در برابر هضم ناشی از تریپسین را گزارش نمودهاند. این یافته میتواند ناشی از ممانعت فضایی زنجیرههای کربوهیدراتی از دسترسی آنزیمهای پروتئولیز کننده به جایگاههای برش اختصاصی یا تغییر ساختار درونی آنزیم باشد که در اثر تبادلات درون مولکولی ناشی از اتصال پلیمر نانوکیتوزان به پروتئین در ساختار آنزیم القا می شود (14). اخیرا Bahreini و همکاران با استفاده از رابط پلیتریفسفات
الحاق کیتوزان به آنزیم آسپاراژیناز را انجام دادهاند و کاهش فعالیت آنزیم نسبت به مطالعه حاضر بیشتر بوده است (17). الحاق کیتوزان به پروتئینها در محدوده اسیدی (7/5=pH) که بیشترین گروههای آمینی با بار مثبت در سطح کیتوزان وجود دارد انجام میشود. در این pH پلی تری فسفات به شدت باردار منفی بوده و اکثر گروههای موجود بر روی کیتوزان که در این دما به شدت بار دار مثبت میباشد را میپوشاند. خنثی شدن بارهای موجود بر روی کیتوزان سبب کاهش حلالیت و رسوب کیتوزان در محیط میشود که با کاهش حلالیت کیتوزان و کاهش میزان تثبیت بر روی آنزیم همراه میباشد (17). در مطالعه حاضر تشکیل نانوکیتوزان، نانو کیتوزان-گلوتارآلدئید و الحاق نانوکیتوزان به آنزیم در pH اسیدی (6=pH) انجام شد که بهدلیل پوشش نسبی گروه های آمینی، باردار بودن گروههای آمینی باقیمانده نانوکیتوزان سبب حلالیت مناسب کمپلکس آنزیم کیتوزان گردید.
نتیجهگیری
نتایج این تحقیق نشان داد که الحاق نانوکیتوزان فعال شده با گلوتارآلدئید به آنزیم آسپاراژیناز با نسبت 1:5 (آنزیم به نانوکیتوزان) سبب افزایش مقاومت دمایی، محدوده pH بهینه، نیمه عمر، پایداری در برابر پروتئولیز و حفظ فعالیت پس از انجماد گردید. روش ارایه شده در این تحقیق می تواند به منظور تولید شکل پایدار آنزیم آسپاراژیناز با خواص فیزیکوشیمیایی بهتر در آینده مورد استفاده قرار گیرد. ارزیابی سایر ویژگیهای آنزیم تولید شده با این روش بهویژه ارزیابی ایمنوژنسیتی توصیه میشود.
سپاسگزاری
بدینوسیله از حمایت مالی معاونت پژوهش و فناوری دانشگاه شهید چمران اهواز در قالب پژوهانه (GN: SCU.vB98.231) در انجام این تحقیق تشکر و قدردانی میگردد. این مقاله مستخرج از پایاننامه دکترای تخصصی آقای نبیالله خون میرزایی میباشد.
حامی مالی: معاونت پژوهش و فناوری دانشگاه شهید چمران اهواز
تعارض در منافع: وجود ندارد.
تحقیقات نشان داده است که درمان با ال آسپاراژیناز سبب بروز آپوپتوز در سلولهای لوسمی بهدنبال توقف سیکل سلولی در فاز G1 میشود. بهنظر میرسد محصولات عملکرد ال آسپاراژیناز بهویژه یون آمونیوم با فسفوریلاسیون میانجی گرهای آپوپتوز در مرگ سلولهای لوسمی نقش داشته باشند (4). علی رغم کاربرد گسترده آنزیم در درمان لوسمی، منشا پروتئینی نامتجانس آنزیم سبب تحریک ایمنی میزبان، تولید IgE و بروز واکنشهای آلرژیک در بیماران تحت درمان میشود. تولید آنتی بادیهای خنثی کننده سبب کاهش نیمه عمر آنزیم از 24-18 به 5/2 ساعت میشود. بهطور میانگین واکنشهای آلرژیک در 30 درصد بیماران تحت درمان مشاهده میشود. اختلالات کبدی، التهاب پانکراس، هیپر گلیسمی، اختلالات انعقادی و سیستم عصبی مرکزی بهدنبال درمان با آسپاراژیناز مشاهده شده است (5). بهعلاوه آنزیم طبیعی بهدلیل عملکرد پروتئازهای سرمی و واکنش با آنتی بادیهای تولید شده دارای پایداری پایینی در سرم است (6). تکنیکهای متعددی چون مهندسی پروتئین، تغییرات شیمیایی با استفاده از افزودنیها و ایموبیلیزاسیون روشهایی هستند که در سالهای گذشته بهمنظور بهبود نیمه عمر، پایداری سرمی و حذف ایمنیزایی آنزیم آسپاراژیناز مورد استفاده قرار گرفتهاند (7). یکی از روشهایی که در سالهای اخیر در زمینه بهبود
عملکرد آنزیم آسپاراژیناز بهطور وسیعی مورد مطالعه قرار گرفته است الحاق پلیمرهای طبیعی یا سنتزی به آسپاراژیناز میباشد. تاکنون الحاق آنزیم به پلیمرهای مختلف مانند آلبومین، دکستران، پلی اتیلن گلیکول، کیتوزان، فیبروئین ابریشم و سریسین انجام شده است که منجر به بهبود خواص فیزیکوشیمیایی آنزیم شده است (8). برخی از اشکال کانژوگه آنزیم مانند شکل الحاق شده با پلی اتیلن گلیکول تحت عنوان تجاری Pegaspargase در سالهای گذشته به صورت تجاری نیز عرضه شده است با اینحال گزارشهایی مبنی بر بروز التحاب شدید پانکراس، کاربرد این شکل از دارو را محدود ساخته است (9، 6). نکته مهم در فرآیند الحاق پلیمرها به آنزیمها این است که پلیمرها یا آنزیم دارای گروههای فعال محدودی هستند. از این رو جهت الحاق آنزیم به پلیمرهای سنتزی یا طبیعی فعالسازی گروههای موجود بر روی آنزیم یا پلیمرهای مورد کاربرد ضروری میباشد. نوع مشتقات فعال شده تاثیر بسیار زیادی بر ساختار و متعاقباً عملکرد، فعالیت، پایداری و ایمنوژنسیتی آنزیم دارد (10). از این رو تحقیقات بهمنظور تولید اشکال بهینه آسپاراژیناز با استفاده از ترکیبات جدید یا مشتقات شیمیایی متفاوت همچنان در حال انجام میباشد.کیتوزان یک پلیمر طبیعی است که در اثر داستیلاسیون کیتین در شرایط قلیایی تولید میشود. این پلیمر حاوی منومرهای گلوکزآمین، و استیل گلوکز آمین میباشد. کیتوزان دارای گروههای شیمیایی متعدد بهویژه گروههای هیدروکسیل و آمینی میباشد که امکان الحاق آن به گروههای موجود بر روی پروتئینها یا ایجاد مشتقات فعال را فراهم میکنند (12، 11). ویژگیهای فیزیکو شیمیایی، ایمنی زایی بیولوژیک پایین، غیر سمی بودن و سازگاری زیستی کاربرد این ترکیب در سیستمهای رهایش ژن، پپتید، دارو و واکسن و نیز مهندسی پروتئین را توسعه داده است (12، 11). تاکنون مطالعات معدودی در خصوص تغییر خواص فیزیکوشیمیایی آنزیم آسپاراژیناز بهدنبال الحاق با کیتوزان یا مشتقات آن انجام شده است. Qian و همکاران (1996) آنزیم آسپاراژیناز با مقاومت بالاتر در برابر هضم ناشی از تریپسین را با استفاده از الحاق آنزیم به میکروسفرهای کیتوزان تولید کردهاند (13).
Wan و همکاران (2016) با الحاق کیتوزان متصل به نانو وزیکولهای لیپیدی به آسپاراژیناز افزایش نیمه عمر آنزیم، بهبود مقاومت حرارتی و کینتیک آنزیم را گزارش نمودهاند (14). Sukhoverkov و Kudryashova (2015) از هیبریدهای کیتوزان-پلی اتیلن گلیکول و کیتوزان-گلیکول بهمنظور بهبود خواص فیزیکوشیمیایی آنزیم استفاده نمودند و خواص بهتر آنزیم پس از الحاق به هیبرید گلیکول-کیتوزان را مشاهده نمودند (15). در سالهای اخیر تولید نانو کیتوزان به روشهای شیمیایی و فیزیکی سبب بهبود خواص فیزیکوشیمیایی آن و توسعه روشهای مبتنی بر کاربرد نانوکیتوزان در طراحی پروتئین و رهاسازی دارو گردیده است. نانوکیتوزان بهدلیل تراکم مولکولی بالاتر در واحد حجم دارای پایداری مکانیکی و حرارتی بیشتری نسبت به کیتوزان است (16). اخیراً Bahreini و همکاران (2014) از پوشش دهی آنزیم آسپاراژیناز با استفاده از رابط تری پلی فسفات و روش ژلاسیون یونی بهمنظور طراحی یک سیستم رهایش دارو استفاده کردهاند. نتایج این تحقیق نشان دهنده عدم تغییر پایداری حرارتی آنزیم و افزایش نیمه عمر آن بوده است (17). با اینحال اطلاعات دیگری در خصوص کاربرد نانوکیتوزان در بهبود خواص فیزیکوشیمیایی آنزیم آسپاراژیناز در دسترس نمیباشد.
نتایج تحقیقات مرتبط با تثبیت پلیمرها به پروتئینها نشان داده است که چنانچه اتصال آنها به یکدیگر از طریق رابطهای متعدد آلدئیدی (اتصال چند نقطهای) صورت پذیرد پایداری کمپلکس پلیمر-پروتئین در برابر تغییرات ساختار فضایی ناشی از حرارت، حلالهای آلی و فریز و ذوب نمودن و آنزیمهای هضم کننده بیشتر خواهد بود. از این رو استفاده از رابطهای آلدئیدی مانند گلوتارآلدئید در الحاق پلیمرهای متعدد به آنزیمها استفاده شده است و نتایج مناسبی در خصوص بهبود عملکرد آنها بهدنبال داشته است (18). تاکنون مطالعهای که به بررسی خواص فیزیکوشیمیایی آسپاراژیناز کانژوگه با نانوکیتوزان فعال شده با گلوتارآلدئید بپردازد انجام نشده است. با توجه به مطالب فوق هدف از مطالعه حاضر تولید آنزیم آسپاراژیناز کانژوگه با نانوکیتوزان به کمک رابط گلوتارآلدئید و بررسی خواص فیزیکو شیمیایی آن
مانند پایداری در دما و pHهای مختلف، نیمه عمر محیطی، مقاومت در برابر فریز و لیوفیلیزه نمودن و هضم سرمی در شرایط آزمایشگاه میباشد.
روش بررسی
روش مطالعه: مطالعه حاضر یک مطالعه تجربی بهمنظور تولید شکل بهبود یافته آنزیم درمانی آسپاراژیناز می باشد.
تولید نانوکیتوزان
کیتوزان با میانگین وزن مولکولی 30 کیلودالتون و 85% داستیلاسیون (سیگما، آمریکا) با غلظت 5 میلیگرم در میلیلیتر در اسید استیک 3% (4= pH) حل و به مدت 25 دقیقه در دمای اتاق بر روی همزن برقی با سرعت 1000 دور در دقیقه قرار داده شد تا محلول یکنواخت و شفافی ایجاد شود. سپس نمونه به مدت 5 دقیقه سونیکه شد و pH نهایی آن با افزودن سود یک مولار بر روی 6 تنظیم شد. سپس نمونه مورد نظر با سرعت 2000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ و محلول شفاف رویی حاوی نانوکیتوزان جدا سازی گردید (19). نمونه حاوی نانو کیتوزان با استفاده از دستگاه لایوفیلایزر (Christ Alpha1-2 LD plus، آلمان) پودر و جهت ارزیابیهای فیزیکوشیمیایی استفاده شد.
الحاق نانوکیتوزان به گلوتارآلدئید
بهمنظور الحاق گلوتارآلدئید به کیتوزان، 10 میلیلیتر گلوتارآلدئید 1% در بافر فسفات 1/0 مولار با 10 میلیلیتر بافر فسفات حاوی 1 گرم نانوکیتوزان (6=pH) مخلوط و بهمدت 30 دقیقه در دمای C°28 و بر روی همزن برقی با سرعت پایین قرار داده شد. پس از زمان مذکور نمونهها با استفاده از ستونهای دیالیز NAP-5 (Healthcare، آمریکا) در بافر سدیم فسفات 5 میلیمولار 6=pH به مدت 1 ساعت دیالیز شدند (20). نمونهها پس از دیالیز با استفاده از دستگاه لایوفیلایزر (Christ Alpha1-2 LD plus، آلمان) پودر و جهت ارزیابیهای فیزیکوشیمیایی استفاده شدند.
ارزیابی فیزیکوشیمیایی نانو کیتوزان و نانوکیتوزان-گلوتارآلدئید
شکل و اندازه نانوکیتوزان و نانوکیتوزان-گلوتارآلدئید با استفاده از میکروسکوپ الکترونی گذاره (Philips M20 Ultra Twin) و تجزیهگر اندازه ذرات Zetasizer 3000HSA (Malvern Instruments, Southborough,، آمریکا) مورد ارزیابی قرار گرفت. بدین منظور سوسپانسیون نانوکیتوزان یا گلوتارآلدئید-نانوکیتوزان با غلظت ppm100 تهیه و به مدت 90 ثانیه سونیکه شدند. بهمنظور تهیه تصاویر میکروسکوپ الکترونی گذاره (Transmission Electron Microscopy; TEM) از نانو کیتوزان تولید شده، 10 میکرولیتر از نمونهها بر روی پلیتهای پوشش داده شده با کربن قرار داده شد و بهمنظور خشک شدن، روی کاغذ صافی قرار گرفتند. پلیتها در دستگاه میکروسکوپ الکترونی گذاره Philips CM20 ultra twin قرار گرفت و تصاویر با اعمال ولتاژ kV 200 تهیه شدند. میانگین قطر ذرات با شمارش قطر حد اقل 50 ذره با استفاده از نرمافزار تعیین قطر نانوذرات Paxit محاسبه گردید. تصاویر با استفاده از دوربین دیجیتال CCD تهیه شدند.
الحاق نانوکیتوزان-گلوتارآلدئید به آنزیم آسپاراژیناز
در این مطالعه از آنزیم آسپاراژیناز مشتق از باکتری Erwinia carotovora با نام تجاری Erwinase® با غلظت 1000 IU بازای 25 میلی گرم (Porton Biopharma، آمریکا) استفاده شد. بدین منظور آنزیم آسپاراژیناز با غلظت mg/ml5 در سدیم فسفات بافر 100 میلی مولار و 8= pH با کیتوزان–گلوتارآلدئید به نسبت وزنی 1:2، 1:5، 1:10 و 1:20 مخلوط و به مدت 1 ساعت در دمای C°28 بر روی همزن قرار داده شد. سپس 10 میکرو لیتر سدیم سیانو بوروهیدرات 5 مولار به ازای هر یک میلیلیتر از محلول اضافه و نمونه به مدت 3 ساعت دیگر در دمای C°28 بر روی همزن قرار داده شدند. سپس نمونهها به مدت یک ساعت در دمای اتاق نگهداری شدند (21). بهمنظور حذف بقایای واکنش نیافته نانوکیتوزان-گلوتارآلدئید نمونه نهایی به مدت یک شب با استفاده از کیسه های دیالیز با حداقل قطر ذرات 12400 دالتون (سیگما، آمریکا) در بافر سدیم فسفات 5 میلی مولار 6=pH دیالیز شدند. سپس نمونهها با استفاده از لولههای اولترافیلتراسیونVivaspin®(Sartorious، آمریکا) تا 50 برابر تغلیظ و جهت ارزیابیهای بعدی مورد استفاده قرار گرفتند. فعالیت آنزیم کانژوگه پس از تغلیظ در مورد هر نسبت آنزیم به نانوکیتوزان-گلوتارآلدئید ارزیابی و نسبتی که بیشترین فعالیت باقیمانده آنزیم نسبت به پروتئین تام در آن مشاهده شد، بهعنوان نسبت مناسب انتخاب و جهت ارزیابیهای فیزیکوشیمیایی و ایمنوژنسیتی آنزیم مورد استفاده قرار گرفت. در مطالعه حاضر نسبت 1:5 دارای بیشترین فعالیت باقیمانده بود و از آنزیم کانژوگه تولید شده با نسبت مذکور جهت ارزیابیهای بعدی استفاده شد. بهمنظور ارزیابی باقیمانده فعالیت آنزیم، فعالیت اختصاصی آنزیم نسبت به پروتئین تام قبل و بعد از کانژوگه نمودن ارزیابی و درصد فعالیت باقیمانده از فرمول زیر محاسبه گردید.

در فرمول فوق IY درصد باقیمانده فعالیت آنزیم، AT0 فعالیت اختصاصی آنزیم قبل از کانژوگه نمودن، ATt فعالیت اختصاصی آنزیم بعد از کانژوگه نمودن میباشد. ارزیابی فعالیت آنزیم آسپاراژینازبدین منظور 100 میکرولیتر نمونه حاوی آنزیم به مخلوط واکنش شامل 200 میکرولیتر بافر تریس 05/0 مولار 6/8=pH، 7/1 میلیلیتر آسپاراژین 01/0 مولار افزوده و به مدت 10 دقیقه در دمای C° 37 انکوبه شد. سپس واکنش با افزودن 100 میکرو لیتر تری کلرو استیک اسید 5/1 مولار متوقف گردید. 500 میکرولیتر از مایع شفاف رویی پس از سانتریفیوژ با 7 میلیلیتر آب و 1 میلیلیتر معرف نسلرز مخلوط و پس از 10 دقیقه جذب نمونهها در طول موج 480 نانومتر در مقابل شاهد ارزیابی شد. مقدار آمونیوم آزاد شده بر اساس منحنی استاندارد آمونیومسولفات (25/0-1 میکرومول/میلیلیتر) محاسبه گردید. میزان فعالیت آنزیم بر اساس تعریف واحد بین المللی ( مقداری از آنزیم که 1 میکرومول آمونیوم در مدت 1 دقیقه در شرایط واکنش تولید کند) محاسبه و پس از تقسیم بر میزان پروتئین نمونهها بر اساس فعالیت اختصاصی گزارش گردید. اندازه گیری پروتئین با استفاده از روش برادفورد و آلبومین سرم گاوی بهعنوان استاندارد انجام شد (22). ارزیابی وزن مولکولی آنزیم کانژوگه بهمنظور تعیین وزن مولکولی آنزیمهای کانژوگه و غیر کنژوگه از روش SDS-PAGE با ژل 10 درصد استفاده شد.
ارزیابی تاثیر دما و pH بر فعالیت آنزیم کانژوگه
بهمنظور ارزیابی تاثیر دما، فعالیت آنزیمی مطابق روش شرح داده شده در بخش قبلی در دماهای 25، 35، 45، 55، 65 و 70 درجه سانتیگراد و pH ثابت 6/8 محاسبه شد. بهمنظور ارزیابی تاثیر pH، فعالیت آنزیمی مطابق روش شرح داده شده در بخش قبلی درpH های 6، 7، 8، 9، 10،11 و در دمای ثابت 37 درجه سانتیگراد مورد ارزیابی قرار گرفت. بهمنظور ارزیابی فعالیت آنزیم در pH و دماهای مختلف مقدار آنزیم در هر واکنش IU 500 در میلیلیتر و زمان انکوباسیون 10 دقیقه در نظر گرفته شد. به ترتیب از بافرهای سیترات 05/0 مولار جهت pH6، بافر HEPES 05/0 مولار جهت pH 7 تا 8 و بافر تریس 05/0 مولار جهت pH 9 تا 11 استفاده شد. دما یا pH که بالاترین فعالیت آنزیم در آن مشاهده شد بهعنوان 100% فعالیت در نظر گرفته شد و فعالیت آنزیم در سایر دماها و pHها به عنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شد.
ارزیابی نیمه عمر محیطی و پایداری در برابر هضم آنزیمی
بهمنظور ارزیابی پایداری آنزیم در شرایط محیطی محلول آنزیمی با فعالیت IU 500 در میلیلیتر در بافر سدیم فسفات تهیه و در دمای محیط نگهداری گردید. در زمانهای 70-10 ساعت پس از نگهداری در دمای محیط، باقیمانده فعالیت آنزیمها ارزیابی گردید. بهمنظور ارزیابی پایداری آنزیم در برابر هضم آنزیمی، مقدار IU 500 در میلیلیتر از آنزیم با 5/0 میلیلیتر آنزیم تریپسین با فعالیت IU/ml50 در بافر فسفات تازه 6/7=pH مخلوط و در زمانهای 30-5 دقیقه باقیمانده فعالیت آنزیم ارزیابی گردید. زمانی که بالاترین فعالیت آنزیم در آن مشاهده شد بهعنوان 100% فعالیت در نظر گرفته شد و فعالیت باقیمانده آنزیم ها در سایر زمانها بهعنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شدند.
ارزیابی پایداری آنزیم بهدنبال انجماد و ذوب
بهمنظور ارزیابی تاثیر انجماد و ذوب نمودن بر فعالیت آنزیم کانژوگه محلول آنزیم حاوی IU 500 در میلیلیتر آنزیم در بافر فسفات در فریزر 20- منجمد و پس از زمانهای 24-2 ساعت ذوب گردید. در محلول انجماد طبق پروتکل شرکت سازنده 50 میلیگرم مانیتول بازای هر یک میلیلیتر آنزیم اضافه شد. پس از زمانهای فوق مقدار فعالیت باقیمانده آنزیم ارزیابی و زمانی که بالاترین فعالیت آنزیم در آن مشاهده شد به عنوان 100% فعالیت در نظر گرفته شد و فعالیت باقیمانده آنزیمها در سایر زمانها بهعنوان نسبتی از 100 گزارش شدند. همه تستها با سه بار تکرار انجام شدند.
تجزیه و تحلیل آماری
آنالیز آماری داده ها با استفاده از نرم افزارversion 18 SPSS انجام شد.کلیه دادهها به صورت میانگین ± خطای معیار ارائه شدند. سطح معنیداری همه تست ها 05/0> P در نظر گرفته شد. تفاوت آماری پارامتر های مختلف در شرایط متفاوت با استفاده از آنالیز واریانس با اندازههای تکراری (Repeated Measure) و برای مقایسه تاثیر پارامترها بین دو شکل آنزیم از آزمون t مستقل استفاده شد.
ملاحظات اخلاقی
مطالعه حاضر توسط کمیته اخلاق در پژوهش بر روی آزمودنیها و مشارکت کنندگان انسانی دانشگاه شهید چمران اهواز با کد اخلاق EE / 97.13.3.2.25447 / scu.ac.ir به تایید رسیده است.
نتایج
خواص فیزیکوشیمیایی نانو کیتوزان و نانوکیتوزان-گلوتارآلدئید
نتایج حاصل از ارزیابی مورفولوژی و توزیع ذرات نانوکیتوزان با استفاده از TEM و تجزیه گر اندازه ذرات نشان داد که توزیع اندازه ذرات از 4/68 نانومتر تا 7/252 نانومتر متغیر بود. میانگین قطر ذرات نانوکیتوزان 6/149 بود (تصویر A1 و B1).

تصویر 1. تصویر TEM نانوکیتوزان (A) و نانوکیتوزان-گلوتارآلدئید (B). میانگین قطر ذرات با شمارش قطر حد اقل 50 ذره با استفاده از نرم افزار تعیین قطر نانوذرات Paxit محاسبه گردید. توزیع اندازه ذرات از 4/68 نانومتر تا 7/252 نانومتر متغیر بود.میانگین قطر ذرات نانوکیتوزان 6/149 بود.
الحاق نانوکیتوزان-گلوتارآلدئید به آنزیم آسپاراژیناز
در این مطالعه از نسبت های متفاوت آنزیم به نانوکیتوزان-گلوتارآلدئید در فرآیند الحاق استفاده شد. نتایج حاصل از ارزیابی فعالیت باقیمانده آنزیم در نسبتهای 1:2، 1:5، 1:10 و 1:20 در تصویر 1 نشان داده شده است. با توجه به اینکه در نسبت 1:5 بیشترین فعالیت باقیمانده آنزیم (4/86%) مشاهده شد آنزیم بهدست آمده از این نسبت بهعنوان نمونه مناسب انتخاب و جهت ارزیابیهای فیزیکوشیمیایی استفاده شد. بهمنظور تعیین وزن مولکولی آنزیم کانژوگه نسبت به آنزیم غیر کنژوگه از SDS-PAGE10درصد استفاده شد. نتایج مربوط به SDS-PAGE نشان دهنده تشکیل باند هایی با وزن مولکولی بالا بهدنبال الحاق نانوکیتوزان به آنزیم بود (تصویر 2).

تصویر1: فعالیت باقیمانده آنزیم آسپاراژیناز (IU/ml) پس از الحاق به نانوکیتوزان گلوتارآلدئید در نسبتهای مختلف آنزیم/نانوکیتوزان. بیشترین فعالیت آنزیم در نسبت 1:5 مشاهده شد و از این نسبت جهت ارزیابی های فیزیکوشیمیایی استفاده شد.

تصویر2: آنالیز وزن مولکولی آنزیم آسپاراژیناز طبیعی (ردیف 1) (30 کیلودالتون) و آنزیم الحاق شده با نانوکیتوزان با نسبت 1:5 (ردیف 2) با استفاده از SDS-PAGE 10% و رنگ آمیزی کوماسی آبی. تشکیل اسمیر نشاندهنده الحاق نانوکیتوزان به آنزیم و تشکیل پروتئین با وزن مولکولی متفاوت می باشد.
نتایج تاثیر دما و pH بر فعالیت آنزیم کانژوگه
نتایج تحقیق حاضر نشان دهنده بیشترین فعالیت آنزیم کانژوگه و غیر کانزوگه در دمای 45 درجه سانتیگراد بود. الحاق نانوکیتوزان بهآنزیم آسپاراژیناز سبب افزایش پایداری آنزیم در دماهای مختلف شد. آنزیم کانژوگه در محدوده دمایی وسیعتری (35تا 55) فعالیت بالایی را نشان داد به طوریکه آنزیم کانژوگه در دمای 55 درجه سانتیگراد 80 درصد بالاترین فعالیت آنزیم را حفظ نمود در حالیکه آنزیم غیرکنژوگه 40 درصد ببیشترین فعالیت آنزیم را در دمای 55 درجه سانتیگراد نشان داد (تصویر3). نتایج ارزیابی فعالیت آنزیمهای کانژوگه و غیرکنژوگه در pHهای مختلف (11-4) نشان داد که بهینه فعالیت آنزیمها در pH 8 بود. آنزیم کانژوگه در طیف وسیع تری از pH (9-7) فعال تر بود به طوریکه 80 درصد فعالیت آنزیم کانژوگه در pH 9-7 حفظ شد (تصویر4).
نتایج نیمه عمر و هضم آنزیمی آنزیم کانژوگه
بهمنظور ارزیابی نیمه عمر محیطی، آنزیمها بهمدت 10 تا 70 ساعت در دمای محیط نگهداری و فعالیت آنها ارزیابی شد. نتایج نشان داد که نیمه عمر آنزیمهای طبیعی و کانژوگه به ترتیب 20 و 50 ساعت بود (تصویر5). نتایج ارزیابی پایداری آنزیم در برابر هضم ناشی از تریپسین نشان داد که نیمه عمر آنزیمهای طبیعی و کانژوگه در محیط حاوی تریپسین به ترتیب 10 و 25 دقیقه بود (تصویر6).
نتایج پایداری آنزیم بهدنبال انجماد و ذوب
بهمنظور ارزیابی تاثیر ذوب و انجماد بر فعالیت آنزیم کانژوگه، آنزیم در بافر فسفات منجمد و پس از 2 تا 24 ساعت انجماد فعالیت آن نسبت به آنزیم طبیعی منجمد شده مقایسه گردید. نتایج نشان داد که آنزیم کانژوگه نسبت به آنزیم طبیعی در برابر انجماد مقاومت بیشتری نشان داد بهطوریکه 12 ساعت پس از انجماد فعالیت آنزیم طبیعی به 50 درصد رسید اما فعالیت آنزیم کانژوگه بیش از 70 درصد بود (تصویر7).

تصویر3: ارزیابی فعالیت آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) در دماهای مختلف. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازه گیریها با سه تکرار انجام شده است.

تصویر4: ارزیابی فعالیت آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) در pH مختلف. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازهگیریها با سه تکرار انجام شده است.

تصویر5: ارزیابی نیمه عمر (پایداری محیطی) آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml)پس از انکوباسیون در دمای محیط به مدت 10 تا 70 ساعت. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بصورت نسبتی از 100 بیان شده است. اندازهگیریها با سه تکرار انجام شده است.

تصویر6: ارزیابی پایداری آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) پس از انکوباسیون در حضور تریپسین به مدت 5 تا 30 دقیقه. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بصورت نسبتی از 100 بیان شده است. اندازه گیریها با سه تکرار انجام شده است.

تصویر7: ارزیابی پایداری آنزیم طبیعی و آنزیم کانژوگه با نانوکیتوزان-گلوتارآلدئید (IU/ml) پس از انجماد به مدت 2 تا 24 ساعت و رفع انجماد دردمای محیط. بالاترین فعالیت مشاهده شده با عدد 100 و فعالیت در سایر دماها بهصورت نسبتی از 100 بیان شده است. اندازه گیری ها با سه تکرار انجام شده است.
بحث
در سالهای اخیر استفاده از فناوریهای مبتنی بر نانو بهمنظور تولید فرآوردههای پروتئینی تثبیت شده با نانو مواد توسعه چشمگیری یافته است. تثبیت نانو پلیمرها بر روی آنزیمها منجر به بهبود پایداری آنزیمها در برابر دما و pH و شرایط نگهداری غیر بهینه شده است. با اینحال فرآینده الحاق این نانو پلیمرها به آنزیم ها و نوع ساختار شیمیایی آنها تاثیر قابل توجهی بر خصوصیات فیزیکوشیمیایی و پایداری آنزیمها در شرایط غیر بهینه دارد (11). در مطالعه حاضر پایداری و خواص فیزیکوشیمیایی آنزیم آسپاراژیناز پس از الحاق آن به نانوکیتوزان بهواسطه گروههای گلوتارآلدئید تثبیت شده بر سطح نانوکیتوزان مورد ارزیابی قرار گرفت. در این مطالعه بهمنظور الحاق نانوکیتوزان بهآنزیم آسپاراژیناز از رابط گلوتارآلدئید استفاده شد. ساختار نانوکیتوزان به گونهای است که حاوی گروههای آمینی متعدد میباشد و تثبیت گلوتارآلدئید بر روی نانوکیتوزان به ایجاد جایگاههای اتصالی مناسب برای الحاق به گروههای آمینی اپسیلون و گروه انتهای آمینی آنزیم کمک میکند. در این روش که اصطلاحا به اتصال چند نقطهای اطلاق میشود نانو کیتوزان از طریق چندین گروه آلدئیدی گلوتارآلدئید به گروههای آمینی آنزیم متصل میشود. تاکنون از این روش بهمنظور الحاق پلیمرهای کربوهیدراتی متعدد به آنزیمهایی چون آلفا آمیلاز و پنیسیلین G اسیلاز استفاده شده است (23، 20). در مطالعه حاضر از نسبتهای مختلف آنزیم به نانوکیتوزان بهمنظور ارزیابی بهترین نسبتی که سبب حفظ فعالیت آنزیم میشود استفاده شد. نتایج تحقیق حاضر نشان داد که در نسبت 1:5 آنزیم به نانوکیتوزان بیش از 80 درصد فعالیت آنزیم نسبت به قبل از الحاق به نانوکیتوزان حفظ گردید در حالیکه در نسبتهای بالاتر از نسبت 1:5 بیش از 60 درصد فعالیت آنزیم از دست رفت. مطالعات نشان میدهد که در زمان تولید اشکال کانژوگه پروتئینها با پلیمرهای کربوهیدراتی غلظت پایین پلیمر علیرغم اتصال به پروتئین تاثیری بر کاهش انعطافپذیری پروتئین و پایدار نمودن آن در حضور عوامل ناپایدار کننده ندارد درحالیکه غلظتهای بسیار بالای پلیمر کربوهیدراتی با افزایش ساختارهای غیر قابل انعطاف در پروتئین و پوشاندن جایگاه فعال علیرغم ایجاد پایداری محیطی سبب کاهش فعالیت آنزیم میشوند (22، 15). تحقیقات انجام شده بر روی الحاق پلیمر اکسید شده لوان به آنزیم آسپاراژیناز نشان داده است که در صورتیکه 20-15 گروههای آمینی اپسیلون آنزیم با پلیمر واکنش دهند کاهش فعالیت آنزیم قابل توجه نخواهد بود (24). در مطالعه Tabandeh و Aminlari (2014) الحاق پلی ساکارید اینولین با نسبت 1:2 به آسپاراژیناز سبب حفظ فعالیت آنزیم تا 67% شده است در حالیکه در زمان استفاده از نسبت 1:4 آنزیم به اینولین باقیمانده فعالیت آنزیم 30% گزارش شده است (22). نتایج مشابهی در خصوص الحاق پلیمرهای سنتزی و طبیعی مختلف مانند دکستران سولفات، فیبرویین و سریسین ابریشم و پلیاتیلنگلیکول به آنزیم آسپاراژیناز بهدست آمده است (27، 26، 25). بهعلاوه بهمنظور اتصال واحدهای پلیمری بیشتر به آنزیم ضروریست که فرآیند الحاق بهمنظور ایجاد بیشترین گروههای آمینی باردار بر روی آنزیم در pHبالاتر انجام شد که احتمال تخریب ساختار سه بعدی آنزیم را افزایش میدهد. با توجه به مطالب فوق تولید آسپاراژیناز کانژوگه با نانوکیتوزان-گلوتارآلدئید با نسبت آنزیم به نانوکیتوزان 1:5 در 6=pH توصیه میشود. نتایج SDS-PAGE نشان دهنده تشکیل باندهای پروتئینی در محدوده وزنی 40 تا 150 کیلو دالتون بود. این یافته به همراه حذف باند پروتئینی مربوط به آنزیم طبیعی با وزن مولکولی تقریبی 30 کیلو دالتون نشان دهنده اتصال تعداد متغیری از گروههای نانوکیتوزان به آنزیم و کاهش تحرک الکتروفورتیک آنزیم کانژوگه بر روی ژل می باشد.
نتایج ارزیابی فعالیت آنزیم در دماها و pHهای مختلف نشان داد که بهینه فعالیت آنزیم در دمای C°45 و 8=pH بود. با اینحال آنزیم کانژوگه در محدوده دما و pH وسیع تری نسبت به آنزیم غیرکنژوگه فعالیت داشت. آنزیم کانژوگه در pH 7 و 9 بیش از 80 درصد نسبت بهشرایط بهینه فعالیت داشت در حالیکه فعالیت آنزیم طبیعی در دو pH مذکور کمتر از 70 درصد فعالیت بهینه بود. شرایط مشابهی در خصوص تاثیر دما بر آنزیم کانژوگه مشاهده شد بهطوریکه آنزیم کانژوگه در دمای 55 درجه بیش از 70 درصد فعالیت بهینه را داشت در حالیکه فعالیت آنزیم غیرکانژوگه در همین دما کمتر از 40 درصد فعالیت بهینه بود. نتایج تحقیق حاضر نشان داد که نیمه عمر آنزیم کانژوگه در دمای محیط 20 ساعت و نیمه عمر آنزیم کانژوگه 50 ساعت بود. همچنین آنزیم کانژوگه مقاومت بالایی نسبت به انجماد نشان داد به طوریکه آنزیم کانژوگه 24 ساعت پس از انجماد و ذوب 80 درصد فعالیت اولیه را حفظ نمود در حالیکه آنزیم غیرکنژوگه پس از 24 ساعت انجماد و ذوب 50 درصد فعالیت اولیه را نشان داد. یافتههای مذکور با نتایج تحقیقات سایر محققین پس از الحاق آنزیم آسپاراژیناز به دکستران سولفات، لوان و پلیاتیلنگلیکول-کیتوزان همخوانی داشت (25،22،15). تحقیقات نشان داده است اتصال پلیمرهای کربوهیدراتی مانند دکستران و پلیاتیلنگلیکول با نسبت مناسب به آسپاراژیناز بهدلیل ایجاد پایداری بالا سبب مقاوت در برابر شرایط تخریب کننده مانند دما و pH بالا میشود (25،15). بهعبارت دیگر انرژی فعالسازی تا خوردن پروتئین کاهش و انرژی فعالسازی باز شدن ساختارهای درونی آنزیم کانژوگه بیشتر میشود. مکانیسم دیگری که در خصوص پایداری بیشتر آنزیم کانژوگه در شرایط غیر بهینه میتوان اشاره کرد تشکیل مجتمعهای آنزیمی بهواسطه رابط های پلی ساکاریدی میباشد که سبب محافظت بیشتر آنزیم در برابر تغییرات ساختاری ناشی از عوامل دناتوره کننده مانند حرارت و pH بالا میباشد (28). در تایید این نظریه تحقیقات Marlborough و همکاران نشان داده است که آنزیم آسپاراژیناز با 4 زیرواحد دارای فعالیت و پایداری بیشتری نسبت به آنزیم تک زیرواحدی است (29). به علاوه تحقیقات انجام شده توسط Miller و همکاران (1993) نشان داده است که آسپارتیک اسید در محدوده اسیدی با اثر مهاری بر جایگاه فعال سبب کاهش فعالیت آنزیم میشود. این فرضیه مطرح میباشد که زنجیرههای کربوهیدراتی الحاق شده به آنزیم سبب کاهش اثر مهاری آسپارتیک اسید در شرایط اسیدی شده و به این دلیل آنزیم در طیف وسیع تری از pH دارای فعالیت میباشد (30). یکی از مشکلات اصلی کاربرد آسپاراژیناز در بیماران تحت درمان نیمه عمر پایین آنزیم بهدلیل اثر پروتئازهای سرم و یا واکنش آنزیم با آنتیبادیهای خنثی کننده میباشد (6). نتایج تحقیق حاضر نشان داد که آنزیم کانژوگه با نانوکیتوزان در مقابل هضم ناشی از تریپسین در شرایط آزمایشگاه پایداری بیشتری نسب به آنزیم غیرکنژوگه نشان داد. به طوریکه فعالیت آنزیم طبیعی 30 دقیقه پس از مجاورت با تریپسین به صفر رسید در حالیکه پس از زمان فوق آنزیم کانژوگه همچنان 40 درصد فعالیت اولیه را نشان داد. نتایج مشابهی در خصوص بهبود پایداری آنزیم پس از الحاق سایر پلیمر های کربوهیدراتی گزارش شده است. بهطور مثال Qian و همکاران با تثبیت میکروسفر کیتوزان بر روی آنزیم آسپاراژیناز افزایش فعالیت آنزیم و مقاومت در برابر هضم ناشی از تریپسین را گزارش نمودهاند. این یافته میتواند ناشی از ممانعت فضایی زنجیرههای کربوهیدراتی از دسترسی آنزیمهای پروتئولیز کننده به جایگاههای برش اختصاصی یا تغییر ساختار درونی آنزیم باشد که در اثر تبادلات درون مولکولی ناشی از اتصال پلیمر نانوکیتوزان به پروتئین در ساختار آنزیم القا می شود (14). اخیرا Bahreini و همکاران با استفاده از رابط پلیتریفسفات
الحاق کیتوزان به آنزیم آسپاراژیناز را انجام دادهاند و کاهش فعالیت آنزیم نسبت به مطالعه حاضر بیشتر بوده است (17). الحاق کیتوزان به پروتئینها در محدوده اسیدی (7/5=pH) که بیشترین گروههای آمینی با بار مثبت در سطح کیتوزان وجود دارد انجام میشود. در این pH پلی تری فسفات به شدت باردار منفی بوده و اکثر گروههای موجود بر روی کیتوزان که در این دما به شدت بار دار مثبت میباشد را میپوشاند. خنثی شدن بارهای موجود بر روی کیتوزان سبب کاهش حلالیت و رسوب کیتوزان در محیط میشود که با کاهش حلالیت کیتوزان و کاهش میزان تثبیت بر روی آنزیم همراه میباشد (17). در مطالعه حاضر تشکیل نانوکیتوزان، نانو کیتوزان-گلوتارآلدئید و الحاق نانوکیتوزان به آنزیم در pH اسیدی (6=pH) انجام شد که بهدلیل پوشش نسبی گروه های آمینی، باردار بودن گروههای آمینی باقیمانده نانوکیتوزان سبب حلالیت مناسب کمپلکس آنزیم کیتوزان گردید.
نتیجهگیری
نتایج این تحقیق نشان داد که الحاق نانوکیتوزان فعال شده با گلوتارآلدئید به آنزیم آسپاراژیناز با نسبت 1:5 (آنزیم به نانوکیتوزان) سبب افزایش مقاومت دمایی، محدوده pH بهینه، نیمه عمر، پایداری در برابر پروتئولیز و حفظ فعالیت پس از انجماد گردید. روش ارایه شده در این تحقیق می تواند به منظور تولید شکل پایدار آنزیم آسپاراژیناز با خواص فیزیکوشیمیایی بهتر در آینده مورد استفاده قرار گیرد. ارزیابی سایر ویژگیهای آنزیم تولید شده با این روش بهویژه ارزیابی ایمنوژنسیتی توصیه میشود.
سپاسگزاری
بدینوسیله از حمایت مالی معاونت پژوهش و فناوری دانشگاه شهید چمران اهواز در قالب پژوهانه (GN: SCU.vB98.231) در انجام این تحقیق تشکر و قدردانی میگردد. این مقاله مستخرج از پایاننامه دکترای تخصصی آقای نبیالله خون میرزایی میباشد.
حامی مالی: معاونت پژوهش و فناوری دانشگاه شهید چمران اهواز
تعارض در منافع: وجود ندارد.
References:
1- Verma N, Kumar K, Kaur G, Anand S. L-Asparaginase: A Promising Chemotherapeutic Agent. Crit Rev Biotechnol 2007; 27(1): 45-62.
2- Shimizu T, Kubota M, Adachi S, Sano H, Kasai Y, Hashimoto H, et al. Pretreatment of A Human T-Lymphoblastoid Cell Line with L-Asparaginase Reduces Etopside-Induced DNA Strand Breakage and Cytotoxicity. Int J Cancer 1992; 50(4): 644-8.
3- Asselin BL, Ryan D, Frantz CN, Bernal SD, Leavitt P, Golbey RD, et al. In Vitro and in Vivo Killing of Acute Lymphoblastic Leukemia Cells by L-Asparaginase. Cancer Res 1989; 49(15): 4363-68.
4- Ueno T, Ontawa K, Mitusi K, Kodera Y, Hiroto M, Matsushima A, et al. Cell Cycle Arrest Induced by L-Asparaginase. Leukemia 1997; 11(11): 1858-61.
5- Boos J. Pharmacokinetics and Drug Monitoring of L-Asparaginase Treatment. Int J Clin Pharm Ther 1997; 35(3): 96-8.
6- Soares AL, Guimars GM, Polakiewicz B, Pitombo RNM, Abraho-Neto J. Effects of Polyethylene Glycol Attachment on Physicochemical and Biological Stability of E. Coli L-Asparaginase. Inter J Pharm 2002; 237(1-2): 163-70.
7- Brumano LP, Da Silva FV, Costa-Silva TA, Apolinário AC, Santos JH, Kleingesinds EK, et al. Development of L-Asparaginase Biobetters: Current Research Status and Review of the Desirable Quality Profiles. Fron Bioengi Biotech 2019; 10(6): 1-22.
8- Krishnapura PR, Belur PD, Subramanya S. A Critical Review on Properties and Applications of Microbial L-Asparaginases. Crit Rev Microb 2016; 2: 42(5): 720-37.
9- Rizzari C, Citterio M, Zucchetti M, Conter V, Chiesa R, Colombini A, et al. A Pharmacological Study on Pegylated Asparaginase Used In Front-Line Treatment of Children with Acute Lymphoblastic Leukemia. Haematologica 2006; 91: 24-31.
10- Batool T, Makky EA, Jalal M, Yusoff MM. A Comprehensive Review on L-Asparaginase and Its Applications. Appl Biochem Biotechnol 2016; 178: 900-23.
11- Huang KS, Sheu TR, Chao IH. Preparation and Properties of Nanochitosan. Polym Plast Technol Eng 2009; 48(12): 1239-43.
12- Tang ZX, Qiang JQ, Shi L. Preparation of Chitosan Nanoparticles as Carrier for Immobilized Enzyme. Appl Biochem Biotechnol 2007; 136: 77-96.
13- Qian G, Zhou J, Ma J, Wang D, He B. The Chemical Modification of E. Coli L-Asparaginase by N, O-Carboxymethyl Chitosan. Artificial Cells Blood Substitutes and Immobilization. Biotech 1996; 24(6): 567-77.
14- Wan S, He D, Yuan Y, Yan Z, Zhang X, Zhang J. Chitosan-Modified Lipid Nanovesicles for Efficient Systemic Delivery of L-asparaginase. Colloids Surf B: Biointerfaces 2016; 143: 278-84.
15- . Sukhoverkov KV, Kudryashova EV. PEG-Chitosan and Glycolchitosan for Improvement of Biopharmaceutical Properties of Recombinant L-Asparaginase from Erwinia Carotovora. Biochemistry (Mosc) 2015; 80(1): 113-9.
16- Vijayalakshmi K, Devi BM, Sudha PN, Venkatesan J, Anil S. Synthesis Characterization and Applications of Nanochitosan/Sodium Alginate/Microcrystalline Cellulose Film. J Nanomed Nanotechnol 2016; 7(6): 1-11.
17- Bahreini E, Aghaiypour K, Abbasalipourkabir R, Mokarram AR, Taghi Goodarzi M, Saidijam M. Preparation And Nanoencapsulation of L-Asparaginase II in Chitosan-Tripolyphosphate Nanoparticles and in Vitrorelease Study. Nanoscale Res Lett 2014; 9(1): 340-46.
18- Manrich A, Galvão CM, Jesus CD, Giordano RC, Giordano RL. Immobilization of Trypsin on Chitosan Gels: Use of Different Activation Protocols and Comparison with other Supports. Int J Biol Macromol 2008; 43(1): 54-61.
19- Tang ZX, Qian JQ, Shi LE. Preparation of Chitosan Nanoparticles as Carrier for Immobilized Enzyme. Appl Biochem Biotechnol 2007; 136: 77-96.
20- Adriano WS, Filho EHC, Silva JA, Giordano RLC, Gonçalves LRB. Stabilization of Penicillin Gacylase by Immobilization on Glutaraldehyde –A Ctivated Chitosan. Braz J Chem Eng 2005; 22(4): 529-38.
21- Lane CF. Sodium Cyanoborohydride-A Highly Selective Reducing Agent for Organic Functional Groups. Synthesis 1975; 1975(3): 135-46.
22- Tabandeh MR, Aminlari M. Synthesis, Hysicochemical and Immunological Properties of Oxidized Inulin-L- Asparaginase Bioconjugate. J Biotechnol 2009; 141: 189-95.
23- Kln A, Teke M, Onal S, Telefoncu A. Immobilization of Pancreatic Lipase on Chitin and Chitosan. Prep Biochem Biotech 2006; 36(2): 153-63.
24- Vina I, Karsakevich A, Bekers M. Stabilization of Anti-Leukemic Enzyme L-Asparaginase by Immobilization on Polysaccharide Levan. J Mol Catal B: Enzym 2001; 11(4-6): 551-58.
25- Karsakevich AS, Dauvarte AZH, Zvirgzda IK, Lebedeva LV, Vina IA. Effective Complexes of the Antileukemic Enzyme L-Asparaginase and Dextran Sulphate. Jpn J Cancer Res 1986; 32(4): 47-51.
26- Zhang YQ, Tao ML, Shen WD, Zhou YZ, Ding Y, Ma Y, et al. Immobilization of L-Asparaginase on the Microparticles of the Natural Silk Sericin Protein and Its Characters. Biomaterials 2006; 25: 3751-9.
27- Zhang YQ, Zhou WL, Shen WD, Chen YH, Zha XM, Shirai K, et al. Synthesis, Characterization and Immunogenicity of Silk-Fibroin-L-Asparaginase Bioconjugates. J Biotech 2005; 120: 315-26.
28- Shepard D, Donovan M, Raghupathy E, Yeung KK, Owen AJ, Dain JA. Effect of Immobilization on the Stability and Substrate Specificity of Dgalactosidase Isolated from the Invertebrate Turbo Cornutus. Carbohydr Res 1983; 118; 239-45.
29- Marlborough DI, Miller DS, Cammack KA. Comparative Study on Conformational Stability and Subunit Interactions of Two Bacterial Asparaginases. Biochim Biophys Acta 1975; 386(2): 576-89.
30- Miller M, Mohana Rao JK, Wlodawer A, Gribskov MR. Crystal Structure of Erwinia Chrysanthemi L-Asparaginase with Bound L-Aspartate. FEBS Lett 1993; 328(3): 275-79.
1- Verma N, Kumar K, Kaur G, Anand S. L-Asparaginase: A Promising Chemotherapeutic Agent. Crit Rev Biotechnol 2007; 27(1): 45-62.
2- Shimizu T, Kubota M, Adachi S, Sano H, Kasai Y, Hashimoto H, et al. Pretreatment of A Human T-Lymphoblastoid Cell Line with L-Asparaginase Reduces Etopside-Induced DNA Strand Breakage and Cytotoxicity. Int J Cancer 1992; 50(4): 644-8.
3- Asselin BL, Ryan D, Frantz CN, Bernal SD, Leavitt P, Golbey RD, et al. In Vitro and in Vivo Killing of Acute Lymphoblastic Leukemia Cells by L-Asparaginase. Cancer Res 1989; 49(15): 4363-68.
4- Ueno T, Ontawa K, Mitusi K, Kodera Y, Hiroto M, Matsushima A, et al. Cell Cycle Arrest Induced by L-Asparaginase. Leukemia 1997; 11(11): 1858-61.
5- Boos J. Pharmacokinetics and Drug Monitoring of L-Asparaginase Treatment. Int J Clin Pharm Ther 1997; 35(3): 96-8.
6- Soares AL, Guimars GM, Polakiewicz B, Pitombo RNM, Abraho-Neto J. Effects of Polyethylene Glycol Attachment on Physicochemical and Biological Stability of E. Coli L-Asparaginase. Inter J Pharm 2002; 237(1-2): 163-70.
7- Brumano LP, Da Silva FV, Costa-Silva TA, Apolinário AC, Santos JH, Kleingesinds EK, et al. Development of L-Asparaginase Biobetters: Current Research Status and Review of the Desirable Quality Profiles. Fron Bioengi Biotech 2019; 10(6): 1-22.
8- Krishnapura PR, Belur PD, Subramanya S. A Critical Review on Properties and Applications of Microbial L-Asparaginases. Crit Rev Microb 2016; 2: 42(5): 720-37.
9- Rizzari C, Citterio M, Zucchetti M, Conter V, Chiesa R, Colombini A, et al. A Pharmacological Study on Pegylated Asparaginase Used In Front-Line Treatment of Children with Acute Lymphoblastic Leukemia. Haematologica 2006; 91: 24-31.
10- Batool T, Makky EA, Jalal M, Yusoff MM. A Comprehensive Review on L-Asparaginase and Its Applications. Appl Biochem Biotechnol 2016; 178: 900-23.
11- Huang KS, Sheu TR, Chao IH. Preparation and Properties of Nanochitosan. Polym Plast Technol Eng 2009; 48(12): 1239-43.
12- Tang ZX, Qiang JQ, Shi L. Preparation of Chitosan Nanoparticles as Carrier for Immobilized Enzyme. Appl Biochem Biotechnol 2007; 136: 77-96.
13- Qian G, Zhou J, Ma J, Wang D, He B. The Chemical Modification of E. Coli L-Asparaginase by N, O-Carboxymethyl Chitosan. Artificial Cells Blood Substitutes and Immobilization. Biotech 1996; 24(6): 567-77.
14- Wan S, He D, Yuan Y, Yan Z, Zhang X, Zhang J. Chitosan-Modified Lipid Nanovesicles for Efficient Systemic Delivery of L-asparaginase. Colloids Surf B: Biointerfaces 2016; 143: 278-84.
15- . Sukhoverkov KV, Kudryashova EV. PEG-Chitosan and Glycolchitosan for Improvement of Biopharmaceutical Properties of Recombinant L-Asparaginase from Erwinia Carotovora. Biochemistry (Mosc) 2015; 80(1): 113-9.
16- Vijayalakshmi K, Devi BM, Sudha PN, Venkatesan J, Anil S. Synthesis Characterization and Applications of Nanochitosan/Sodium Alginate/Microcrystalline Cellulose Film. J Nanomed Nanotechnol 2016; 7(6): 1-11.
17- Bahreini E, Aghaiypour K, Abbasalipourkabir R, Mokarram AR, Taghi Goodarzi M, Saidijam M. Preparation And Nanoencapsulation of L-Asparaginase II in Chitosan-Tripolyphosphate Nanoparticles and in Vitrorelease Study. Nanoscale Res Lett 2014; 9(1): 340-46.
18- Manrich A, Galvão CM, Jesus CD, Giordano RC, Giordano RL. Immobilization of Trypsin on Chitosan Gels: Use of Different Activation Protocols and Comparison with other Supports. Int J Biol Macromol 2008; 43(1): 54-61.
19- Tang ZX, Qian JQ, Shi LE. Preparation of Chitosan Nanoparticles as Carrier for Immobilized Enzyme. Appl Biochem Biotechnol 2007; 136: 77-96.
20- Adriano WS, Filho EHC, Silva JA, Giordano RLC, Gonçalves LRB. Stabilization of Penicillin Gacylase by Immobilization on Glutaraldehyde –A Ctivated Chitosan. Braz J Chem Eng 2005; 22(4): 529-38.
21- Lane CF. Sodium Cyanoborohydride-A Highly Selective Reducing Agent for Organic Functional Groups. Synthesis 1975; 1975(3): 135-46.
22- Tabandeh MR, Aminlari M. Synthesis, Hysicochemical and Immunological Properties of Oxidized Inulin-L- Asparaginase Bioconjugate. J Biotechnol 2009; 141: 189-95.
23- Kln A, Teke M, Onal S, Telefoncu A. Immobilization of Pancreatic Lipase on Chitin and Chitosan. Prep Biochem Biotech 2006; 36(2): 153-63.
24- Vina I, Karsakevich A, Bekers M. Stabilization of Anti-Leukemic Enzyme L-Asparaginase by Immobilization on Polysaccharide Levan. J Mol Catal B: Enzym 2001; 11(4-6): 551-58.
25- Karsakevich AS, Dauvarte AZH, Zvirgzda IK, Lebedeva LV, Vina IA. Effective Complexes of the Antileukemic Enzyme L-Asparaginase and Dextran Sulphate. Jpn J Cancer Res 1986; 32(4): 47-51.
26- Zhang YQ, Tao ML, Shen WD, Zhou YZ, Ding Y, Ma Y, et al. Immobilization of L-Asparaginase on the Microparticles of the Natural Silk Sericin Protein and Its Characters. Biomaterials 2006; 25: 3751-9.
27- Zhang YQ, Zhou WL, Shen WD, Chen YH, Zha XM, Shirai K, et al. Synthesis, Characterization and Immunogenicity of Silk-Fibroin-L-Asparaginase Bioconjugates. J Biotech 2005; 120: 315-26.
28- Shepard D, Donovan M, Raghupathy E, Yeung KK, Owen AJ, Dain JA. Effect of Immobilization on the Stability and Substrate Specificity of Dgalactosidase Isolated from the Invertebrate Turbo Cornutus. Carbohydr Res 1983; 118; 239-45.
29- Marlborough DI, Miller DS, Cammack KA. Comparative Study on Conformational Stability and Subunit Interactions of Two Bacterial Asparaginases. Biochim Biophys Acta 1975; 386(2): 576-89.
30- Miller M, Mohana Rao JK, Wlodawer A, Gribskov MR. Crystal Structure of Erwinia Chrysanthemi L-Asparaginase with Bound L-Aspartate. FEBS Lett 1993; 328(3): 275-79.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







