دوره 28، شماره 4 - ( تیر 1399 )
جلد 28 شماره 4 صفحات 2606-2595 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mazarzadeh S S, Masoumi H, Rafiee A. A New Computer-Aided Detection System for Pulmonary Nodule in CT Scan Images of Cancerous Patients. JSSU 2020; 28 (4) :2595-2606
URL: http://jssu.ssu.ac.ir/article-1-4570-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4570-fa.html
مازارزاده یزدی سید سهیل، معصومی حسن، رفیعی علی. شناسایی ندولهای ریوی با استفاده از سیستم کمک تشخیص کامپیوتری نوین در تصاویر سیتیاسکن بیماران مشکوک به سرطان. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (4) :2595-2606
متن کامل [PDF 927 kb]
(1127 دریافت)
| چکیده (HTML) (2852 مشاهده)
متن کامل: (41517 مشاهده)
مقدمه
سرطان ریه یکی از متداولترین بدخیمیها در دنیا بهشمار میآید که به صورت رشد غیرقابل کنترل سلولی در بافت ریه میباشد (1) و عامل بیشترین درصد مرگ سرطانی در مردان و دومین علت مرگ سرطانی در زنان (بعد از سرطان پستان) است (2). فقدان شکایت بیمار و علایم بالینی در مراحل اولیه بیماری و نیز پایین بودن حساسیت روشهای آزمایشگاهی مهمترین علل مرگ و میر در سرطان ریه میباشد. از نشانههای شایع سرطانهای ریه، ندولهای ریوی هستند (3). تکنولوژی توموگرافی کامپیوتری Computed tomography (CT) ابزاری مناسب برای تشخیص غدد ریوی میباشد که بهدلیل حجم بالای تصاویر CT، بررسی غددی به قطر چند میلیمتر توسط رادیولوژیست کار بسیار دشواری است؛ از این رو، روشهای تشخیص به کمک کامپیوتر Computer Aided Diagnosis(CAD) به عنوان ابزاری مهم و کاربردی برای کمک به رادیولوژیستها در این امر همه روزه در حال پیشرفت میباشند (4). احتمال بقاء پنج ساله بیماران مبتلا بهسرطان ریه، بعد از عمل جراحی فقط 14% میباشد، در صورتی که تشخیص در مراحل اولیه که اندازه غدد کوچک است شانس نجات بیماران را به 70% الی80%افزایش میدهد (5). ندولهای ریوی میتوانند بهصورت مجزا یا متصل به دیوارهی ریه ظاهر شوند. هرچه ندولهای ریوی دارای مرز منظمتری باشند، خوشخیمتر و هرچه دارای مرز نامنظم و مبهمی باشند، بدخیمتر خواهند بود. در حال حاضر شناسایی نواحی بهصورت ندول یا غیرندول انجام میشود و پزشک متخصص بهطور قطع میتواند ندول یا غیرندول بودن ناحیهای را تشخیص دهد. اما تشخیص خوشخیمی و بدخیمی ندولهای ریوی توسط پزشک، بر مبنای احتمال است و بهطور صددرصد نمیتواند در مورد خوشخیمی یا بدخیمی بودن ندولهای ریوی قضاوت کند و نظر قطعی بدهد (6). ندولهای بدخیم میتوانند بهتعدادی رگ در بافت ریه متصل باشند و هرچه تغذیه خونی ندول توسط رگها بیشتر باشد ندول بدخیمتر خواهد بود. ندولهای بدخیم در ریه مبین وجود سرطان ریه میباشند (7). میتوان از روی سایز تودهها میزان و احتمال خوش خیمی و بدخیمی آنها را تخمین زد، بدین صورت که احتمال بدخیمی ندولهای ریوی با اندازه کوچکتر از 4 میلیمتر 0%، بین 7-4 میلیمتر 1%، بین 20-8 میلیمتر 15% و بزرگتر از 20 میلیمتر 75% میباشد. تودههای بزرگتر از 1 سانتیمتر به راحتی با چشم قابل مشاهده هستند (7). روشهای تشخیص به کمک کامپیوتررا میتوان به دو دسته روشهای مبتنی بر شدت روشنایی Intensity Based و روشهای مبتنی بر مدل Model Based تقسیمبندی کرد. در روش مبتنی بر مدل، اطلاعاتی از قبل در مورد شکل الگوی ندول داریم و لذا روشهایی مانند تطبیق الگو، مدلهای مبتنی بر آناتومی و مورفولوژی (شکلشناسی)، شکل ندولها از این دسته میباشند. الگوی ندولهای ریوی از اطلاعات تجربی و یا دادههای آموزشی بهدست میآید (8). در فرآیند تشخیص، دو نوع خطا ممکن است رخ دهد: خطای منفی مربوط بهمواردی هستند که واقعاً ندول میباشند، اما بهعنوان ندول دستهبندی نمیشوند؛ خطای مثبت ناشی از گزارش نادرست موارد غیرندول (رگ، زخم و...) بهعنوان ندول است. لازمه قابل قبول بودن یک سیستمکمک تشخیصی، داشتن حساسیت بالا و نرخ پایین خطای مثبت است. از جمله مزیتهای مهم روش پیشنهاد شده، تمام ساختارهایی با سطح روشنایی 1 و نزدیک به لبه تصویر حذف میشوند. این امر با محدود کردن فضای جستجو باعث افزایش سرعت و دقت پردازش میگردد و حساسیت آن در تشخیص ندولها و تودههای سرطانی نسبت به حساسیت روشهای کار شده بالاتر خواهد رفت. جداسازی مرزهای نواحی در تصاویر پزشکی همیشه یکی از مسائل مهم بوده است (9). بدین جهت، هدف اصلی در این مطالعه روشهای بخشبندی نواحی و روشهایی که بهصورت دقیقتر مرزهای نواحی سرطانی را شناسایی کند، مورد بررسی قرار گرفت و درصدد ایجاد چارچوبی کاملاً خودکار برای شناسایی دقیقتر و سریعتر تودههای سرطانی در تصاویر سیتیاسکن قفسهسینه برای کمک قابلتوجه به رادیولوژیست انجام گرفت. این چارچوب بخشی اساسی از سیستم شناسایی به کمک کامپیوتر میباشد که شامل دو روش واترشید watershed و اکتیوکانتورActive contour برای بخشبندی نواحی در تصاویر سیتی قفسه سینه است.
روش بررسی
در این طرح پژوهشی، تصاویر سی تی اسکن قفسه سینه از 20 فرد مراجعه کننده بهبیمارستان شهدای کارگر یزد، جهت شناسایی تودههای سرطانی و ندولهای ریوی مورد پردازش قرار گرفت (از تمامی مراجعه کنندگان رضایت کتبی گرفته شد). تصویربرداری CT با استفاده از دستگاه CT-16 slice زیمنس آلمان (SIEMENS Emotion) در حالت استاندارد (kvp=130 , mA=40) انجام شد که ضخامت اسلایس های ریه 1میلی متر با همپوشانی mm 3/0 اسلایسها میباشد. Window width و Window level که میزان روشنایی تصویر و تفکیک بافت ها از یگدیگر هستند در رنج 1200+ تا 600- قرار داشت. هدف اصلی یافتن ویژگیهایی بهمنظور شناسایی دقیق تودههای سرطانی با میزان دقت و حساسیت و تشخیص بالا در تصاویر سی تی قفسه سینه در مدت زمانی کمتر میباشد. همچنین تمامی دادههای محاسبه شده در نرمافزار matlab 2012b انجام شد.در ابتدا، 20 ناحیه از ریه بیماران مورد نظر، شامل 10 تصویر سی تی اسکن ریه بیمار سرطانی و 10 تصویر سی تی اسکن ریه فرد سالم، جهت بخش بندی انتخاب گردید. بخشبندی نواحی در تصاویر سی تی قفسه سینه بهدلیل داشتن نواحی با پس زمینه پیچیده و برخی از نواحی ندولی یا رگی با داشتن لبههای ضعیف، همواره با چالش همراه بودهاند. روشهای موجود، یا نیمه خودکار هستند یا دارای دقت مناسب میباشند و یا در بخشبندی نواحی ندولی که متصل بهرگ میباشند، نتیجه مطلوبی نخواهند داشت (10).
نواحی انتخاب شده، توسط دو روش واترشید و مدل اکتیو کانتور مبتنی بر ناحیه محلی بخشبندی شدند. همچنین این نواحی توسط پزشک متخصص مربوطه با استفاده از قلم نوری بخشبندی گردید. برای ارزیابی نتایج، نتیجه بخشبندی نواحی توسط مدل کانتورهای فعال، با نتیجه بخشبندی که توسط پزشک انجام شد، مقایسه گردید. انتخاب پارامترها در استفاده از مدل کانتورهای فعال مبتنی بر ناحیه محلی، مانند انتخاب ماسک اولیه، تعداد تکرار کانتور و انتخاب شعاع محلی است که در نتیجه منجر به بخشبندی نواحی از پس زمینه میشود. (11). در مطالعه حاضر، برای بخشبندی تمامی نواحی مشکوک به تودههای سرطانی از پارامترهای مشابهی استفاده شده است و انتخاب چنین پارامترهایی بر مبنای نواحی تعیین شدند. ماسک اولیه، دایرهای با شعاع 2 و مرکز آن در ماکزیمم مقدار ناحیه مورد نظر قرار میگیرد، زیرا توده سرطانی دارای ماکزیمم مقدار سطح روشنایی میباشند. تعداد تکرار کانتور به منظور بخشبندی کامل نواحی مورد نظر برابر با 200 انتخاب شد. شعاع محلی، برابر با 1 انتخاب گردید. آستانهگذاریهای مذکور برمبنای این واقعیت بهدست آمد که مقدار هانسفیلد تصاویری که مورد پردازش هستند، دارای مینیمم مقدار0 هانسفیلد و ماکزیمم مقدار 654 هانسفیلد میباشند. همچنین برخی از تودههای سرطانی که در بعضی از این تصاویر وجود دارند، دارای مینیمم مقدار 180- هانسفیلد و ماکزیمم مقدار 2000 هانسفیلد میباشند. در ادامه، نتایج حاصل از بخشبندی نواحی مشکوک بهتوده سرطانی با نتیجه بخشبندی انجام شده توسط پزشک مقایسه شده است.
الگوریتمهای ارائه شده به این منظور شش گام اصلی را شامل میشود (شکل 1).
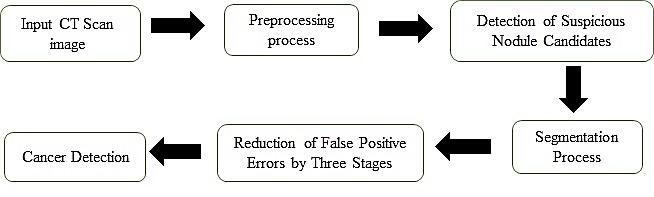
شکل1: شمای کلی از الگوریتم پیشنهادی برای شناسایی ندولهای ریوی منجر به تشخیص سرطان درتصاویر سی تی قفسه سینه
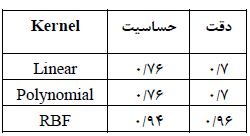
گام اول، مرحله پیشپردازش در تصاویر سیتی قفسهسینه برای آمادهسازی تصاویر برای ورود به بخشهای بعدی الگوریتم میباشد که هدف استخراج لوبهای ریه از تصویر اصلی بهمنظور افزایش سرعت در انجام پردازش و دقت الگوریتم میباشد. تصاویر ورودی الگوریتم، سیتی خام از ریه میباشد. ابتدا اطلاعات خام سیتیاسکن بیماران تبدیل به هانسفیلد شده و در ادامه، لوبهای ریه به گونهای از تصویر اصلی بهدست آمد که ندولهای نزدیک به سطح ریه شناسایی شوند. سپس از روش تنظیم تباین بهمنظور روشنتر شدن محدوده مورد نظر استفاده شد. با اعمال این مرحله به الگوریتم پیشنهادی، عملکرد الگوریتم دستهبندی بهبود مییابد و نتیجه کار بهشدت تحت تأثیر قرار میگیرد. این مرحله قسمتهایی از تصویر را که در امر پردازش الگوریتم مؤثر نیستند، حذف میکند تا اطلاعات غیرمفید تصویر حذف شود و بخشی از تصویر که دارای اطلاعات ارزشمندی میباشد، باقی بماند. بنابراین، فضای مورد جستجو در تصاویر محدود میشود و این امر باعث افزایش سرعت و دقت الگوریتم در شناسایی تودههای سرطانی میگردد. البته قابلتوجه است که این مرحله برای استخراج لوبهای ریه از تصویر اصلی صورت میگیرد.گام دوم، شناسایی نواحی مشکوک بهتودههای سرطانی است. در این راستا با در نظر گرفتن الگوهای مناسب، تودههای سرطانی بهطور کامل و سریع به کمک روش تطبیق با استفاده از همبستگی شناسایی میشوند ولی نرخ خطای مثبت اشتباه این روش بسیار بالا است که نواحی نامربوط بسیاری بهعنوان ندول ریوی و یا توده سرطانی تشخیص داده میشوند. انتخاب شکل و اندازه الگوها نتیجه نهایی تشخیص تودههای سرطانی را رقم میزند. الگوهای مورد استفاده دایره ای و نیمه دایرهای در جهتهای متفاوتی میباشند. انتخاب الگوهای نیمه دایرهای به این منظور است که برخی از تودههای سرطانی متصل به سطح ریه میباشند و چنین تودههایی با انتخاب این الگوها شناسایی شدند. ویژگی مورد نظر ما در شناسایی نواحی مشکوک به تودههای سرطانی، مکان بهترین تطبیق بین تصویر والگوی انتخابی میباشد. در گام سوم، جداسازی خودکار مرزهای نواحی در تصاویر سیتی ریه صورت گرفت. ابتدا روش واترشید مورد استفاده قرار گرفت که به بخشبندی نواحی دارای ویژگیهای ناهمگن میپردازد. نتیجه بخشبندی نواحی توسط مدل واترشید با نتیجه بخشبندی توسط پزشک مورد مقایسه قرار گرفت.در گام چهارم، مدل کانتورهای فعال مبتنی بر ناحیه محلی که قادر به بخشبندی نواحی با ویژگیهای ناهمگن میباشد، استفاده شد. برای ارزیابی نتایج، نتیجه بخشبندی نواحی توسط مدل کانتورهای فعال، با نتیجه بخشبندی انجام شده توسط پزشک مقایسه گردید. یک نمونه از بخشبندیهای صورت گرفته در شکل (2) نشان داده شده است. انتخاب پارامترها در استفاده از مدل کانتورهای فعال مبتنی بر ناحیه محلی مانند انتخاب ماسک اولیه، تعداد تکرار کانتور و انتخاب شعاع محلی به گونهای صورت گرفت که بتوان به نتایج مطلوبی در بخشبندی نواحی دست یافت.در گام پنجم بر اساس این که ندولها و تودههای سرطانی تقریباً کروی شکل میباشند ویژگیهای دوبعدی و سهبعدی از نواحی مشکوک به تودههای سرطانی استخراج گردید (شکل 3). در این راستا، تعداد اسلایسهایی را که توده در آنها تکرار میشود، بهدست آورده شد. همانطورکه در قسمتهای قبلی بیان شد، نواحی نامربوط بسیاری توسط روش تطبیق با استفاده از همبستگی بهعنوان نواحی مشکوک بهتودههای سرطانی شناسایی میشوند. بدین ترتیب در گام ششم، مرحله دستهبندی نواحی به دو گروه سرطانی و غیرسرطانی با استفاده از طبقهبندی کننده ماشینبردار پشتیبان به همراه کرنل خطی، چند جملهای با درجه 3 و کرنل RBF صورت گرفت. بهترین نتیجه الگوریتم طبقه بندی با استفاده از کرنل RBF بهدست آمد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی کازرون تایید شده است.

شکل 2: مقایسه بخشبندی نواحی سرطانی توسط مدل کانتور فعال با نتیجه بخشبندی پزشک.
(الف) بخشبندی ناحیه سرطانی توسط مدل کانتور فعال. (ب) بخشبندی انجام شده توسط پزشک مربوطه
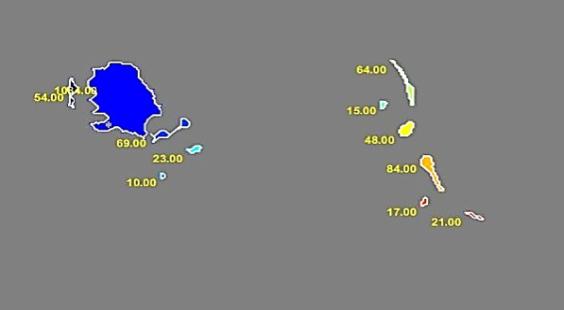
شکل 3: نتیجه نهایی بهدست آمده از مدل اکتیو کانتور برای تشخیص توده سرطانی
نتایج
در مدل استفاده شده برای بخشبندی نواحی، معیار خطا با استفاده از رابطه زیر، محاسبه شد.
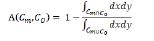
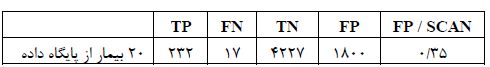
در رابطه ذکر شده، Cm و C0 کانتورهای بخشبندی انجام شده بهترتیب مربوط بهمدل کانتورهای فعال و پزشک میباشند. در این راستا، اشتراک و اجتماع هر دو کانتور بخشبندی انجام شده توسط پزشک و مدل کانتورهای فعال بهدست آمده و سپس معیار خطا (A) محاسبه میشود. در واقع در این رابطه، تعداد پیکسلهایی که هر دو کانتور با یکدیگر اشتراک و اجتماع دارند، بهدست میآید و سپس نسبت آنها محاسبه شده و از مقدار یک کم میشود. هرچه تعداد پیکسلهای اشتراک و اجتماع دو کانتور، نزدیک بهیکدیگر باشند، خطای محاسبه شده به صفر نزدیکتر میباشد (12). در این طرح پژوهشی، متوسط خطای محاسبه شده برای 10 بیمار سرطانی و 10 فرد سالم، به ترتیب برابر با 0/023 و 0/045 بهدست آمد.در تصاویر سی تی قفسه سینه، رگهای خونی و ندولها و تومورهای ریوی در هر کدام از ریهها از یکدیگر مستقل میباشند. بهعنوان مثال، اگر ناحیه مورد بررسی در ریه سمت راست قرار داشته باشد، ادامه ناحیه در دنباله تصاویر سی تی نیز در همان قسمت قرار دارد. بنابراین مطابق شکل (4) برای بخشبندی ناحیه مورد بررسی، کانتور را بر روی لوب ریهای اعمال میکنیم که ناحیه مورد بررسی در آن قرار گرفته است و در این صورت به دلیل کاهش اندازه تصویر، سرعت پردازش الگوریتم در بخشبندی ناحیه مورد نظر توسط کانتور افزایش مییابد و لذا اجرای آن در مدت زمان کم انجام میگیرد. بدین ترتیب، مدت زمان بخشبندی ناحیه مورد بررسی به طور متوسط از 18/36 ثانیه به 5 ثانیه کاهش مییابد. مقادیر فاصله محاسبه شده مربوط به تودهها کمتر یا برابر با مقدار 0/75 میلیمتر میباشد. برای دستهبندی نواحی به دو گروه سرطانی و غیرسرطانی از SVM به همراه سه کرنل خطی، چند جملهای با درجه 3 و کرنل تابع پایه شعاعی استفاده گردید. در هر دسته از 60 درصد نواحی برای آموزش و از40 درصد نواحی برای تست الگوریتم استفاده شد. نتایج اعمال SVM به همراه کرنلهای خطی، چند جملهای با درجه 3 و کرنل RBF در جدول (1) نشان داده شده است. بهترین نتیجه الگوریتم طبقهبندی با استفاده از کرنل RBF و استفاده از پارامتر 0/28=σ برای آن، بهدست آمد. طبقهبندی نواحی به صورتی انجام شدکه در دو دسته نواحی با میزان حساسی تو دقت مطلوبی ازیکدیگرتفکیک شوند. الگوریتم پیشنهادی بر روی10 بیمار از نمونههای انتخابی تست گردید، که خطای مثبت اشتباه (FP)، خطای منفی اشتباه (FN)، خطای مثبت صحیح (TP) و خطای منفی صحیح (TN) و نتایج آن در جدول (2) نشان داده شده است.10 بیمار انتخاب شده شامل 249 ندول میباشند. معیارهای محاسبه شده از الگوریتم پیشنهادی در جدول (3) نشان داده شده است.

شکل 4: در دنباله تصاویر سی تی ساختار مربوط به هر لوب ریه (ندولها و رگهای خونی) از یکدیگر مستقل میباشند.
(الف) تصویر اصلی، (ب) دو لوب ریه مطابق شکل میتوانند از یکدیگر جدا شوند.
جدول 1: نتایج بهدست آمده از طبقهبندی کننده SVM نتایج طبقهبندی SVM به همراه سه کرنل خطی، چند جملهای با درجه 3 و تابع پایه شعاعی با
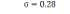
جدول 2: نتایج ارزیابی الگوریتم پیشنهادی. نتایج برای 20 بیمار پایگاه داده بهدست آمده است.
جدول 3: سه معیار حساسیت، تشخیص و دقت برحسب درصد محاسبه شده است. معیارهای محاسبه شده جهت ارزیابی الگوریتم پیشنهادی بر روی 10 بیمار انتخاب شده.
.JPG)
بحث
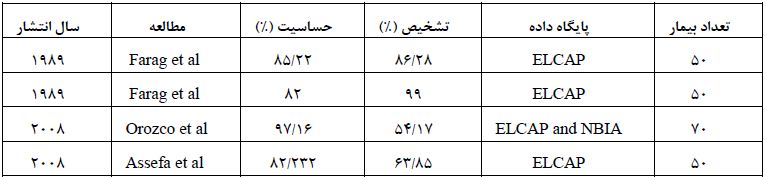
مطالعه و بررسی روشهای تشخیص تودهها در تصاویر سی تی قفسه سینه، میتواند نقش بسزایی در شناسایی اولیه و درمان بیماریهای ریوی ایفا کند (3). برای تشخیص سرطان از غیرسرطان در تصاویر سی تی قفسه سینه، به کارگیری تکنیکهای کارآمد و استخراج ویژگیهای مناسب و کافی الزامی میباشد. برخی از تحقیقات نشان میدهد که عملکرد رادیولوژیستها در حضور سیستم شناسایی به کمک کامپیوتر، بهطور قابل ملاحظهای بهبود یافته است مطالعه حاضر درصدد ایجاد چارچوبی کاملاً خودکار برای شناسایی تودههای سرطانی در تصاویر سی تی اسکن قفسه سینه میباشد. این چارچوب بخشی اساسی از سیستم شناسایی به کمک کامپیوتر میباشد که در شناسایی دقیقتر و سریعتر تودههای سرطانی به رادیولوژیست کمک میکند (12،11). در یک تصویر سی تی بهدست آمده، نواحی مختلفی از ندول و غیرندول دیده میشود. در سیستمهای شناسایی به کمک کامپیوتر ممکن است، دو نوع خطا رخ دهد. این دو نوع خطا عبارتند از خطای منفی اشتباهFalse Negative که در آن بهدلیل عدم وضوح کافی نواحی سرطانی در تصاویر و یا به دلیل عدم توجه یا خستگی رادیولوژیست، یک ناحیهی سرطانی از نظر دور میماند و خطای مثبت اشتباه False Positiveکه در آن یک ناحیهی غیرسرطانی، به عنوان یک ناحیهی سرطانی شناسایی میشود. خطاهای منفی اشتباه باعث میشوند که به صورت نادرست شخص بیمار بهعنوان فرد سالم تلقی شود و از ادامه درمان منصرف گردد. این موضوع به خصوص در مورد تشخیص بیماری سرطان بسیار زیانبار و در بسیار از موارد جبران ناپذیر میباشد. خطاهای مثبت اشتباه باعث میشوند که از یک شخص سالم در ادامهی درمان نمونه برداریها، عکس برداریهای دقیقتر به منظور بررسی بهتر ضایعه و آزمایشات مراحل بعدی انجام گیرد که این موضوع ممکن است باعث ایجاد مشکلات اقتصادی و یا مشکلات روحی برای فرد سالم شود (12). در مقالات سالهای گذشته بر اساس شکل ندولها و همچنین بهکمک استخراج ویژگیهایی از نواحی مشکوک شناسایی شده به عنوان ندولهای ریوی، تا حدودی میزان خطای مثبت اشتباه، کاهش مییابد. در نهایت میزان درصد تشخیص و حساسیت خوبی ندولهای ریوی از رگهای خونی در تصاویر سی تی قفسه سینه شناسایی و طبقهبندی میشوند (12-10). در پژوهش حاضر، برای جداسازی نواحی سرطانی و غیرسرطانی در پس زمینه، از واترشید و مدل کانتور فعال مبتنی بر ناحیه محلی استفاده شد با انتخاب مناسب پارامترهای این کانتور، نتایج مطلوبی در بخشبندی نواحی مشکوک بهتودههای سرطانی در تصاویر سی تی قفسه سینه حاصل گردید. همچنین برای بخشبندی تمام نواحی در تصاویر سی تی ریه از پارامترهای مشابه استفاده شد. در ریه، ما سعی در دستهبندی نواحی تصاویر، به دو دسته دارای ندول و غیرندول هستیم. در این روش ویژگیهای بافتی نقاط کانتور با استفاده از روش مبتنی بر گشتاور محاسبه میشود، لذا منحنی کانتور جهت انطباق بر مرزهای ناحیه مورد نظر، منبسط و یا منقبض میگردد و در نتیجه ناحیهی مورد نظر در تصویر بخشبندی میشود. مشخصههایی که پزشکان، برای تشخیص موارد سرطانی و غیرسرطانی در تصاویر بر آنها تکیه میکنند، برای شناسایی موارد غیرطبیعی در تصاویر توسط یک پزشک کفایت میکند. این مشخصهها شامل ویژگیهای مربوط به شکل شناسی (اندازه قطرهای کوچک و بزرگ، میزان کشیدگی Elongation، میزان مدور بودن (Circularity) و ویژگیهای مربوط به بافت میباشند (10). از دلایل عملکرد مناسب الگوریتمهای بخشبندی نواحی،مات بودن باطن تصویر و وجود نویز در تصویر میباشد. بهدلیل پایین بودن کیفیت بافت تصویر و یا شبیه بودن بافتهای موجود در طرفین مرزهای ندول، ممکن است برخی از تکنیکها دقت و اهمیت لازم برای بخشبندی نواحی را نداشته باشند. در تصاویر سی تی اسکن ریه برخی از نواحی ندولی یا رگی، لبهها و مرزهای تیز و کاملاً دقیق و واضحی ندارند، بنابراین دقت جداسازی و تشخیص مرزهای نواحی بهسختی امکان پذیر میباشد. در مطالعه حاضر، مقایسهای بین نتایج الگوریتم پیشنهادی جهت شناسایی ندولهای ریوی، با برخی از روشهای موجود در این زمینه بر اساس دو معیار حساسیت و تشخیص صورت گرفته است. میزان حساسیت و تشخیص عملکرد الگوریتم پیشنهادی و نتایج به دست آمده در جدول (3)، نسبت به دیگر گروههای تحقیقاتی و پایگاه داده انتخابی (ELCAP) در جدول (4)، بهبود یافته است. برای تمام نواحی مورد مطالعه در این طرح پژوهشی از پارامترهای مشابه استفاده شده است.
جدول 4: مقایسه درصد الگوریتم پیشنهادی با سیر روشهای پیشین.
Williams و Shah در سال ۱۹۲۲، یک الگوریتم سریع برای کمینه کردن انرژی کانتور پیشنهاد دادند، ولی این روش قادر بهبخشبندی دقیق نواحی با مرزهای مقعر نبود (13). برای برطرف کردن مشکلات الگوریتمهای قبلی، در سال ۱۹۹۳، Caselles و همکارانش مدل کانتورهای فعال مهندسی را پیشنهاد دادند. در این روش تشخیص خودکار با استفاده از دو کانتور فعال بر روی تصاویر میباشد ولی دارای محاسبات سخت و پیچیده زیادی بود که این امر سرعت الگوریتم را کاهش میداد و مدت زمان بررسی الگوریتم ها نیز افزایش یافته و کاری زمانبر بود (14). در سال ۲۰۰۲، مدل کانتورهای فعال بر مبنای همگنی ناحیه ارائه شد که در این مدل، سیستم پردازش و شناسایی نواحی مورد نظر دارای حساسیتی به میزان 50 درصد میباشد. مدل ارائه شده در این الگوریتم به گرادیان در تصویر بستگی نداشته و به نویز تصویر حساس نمیباشد و میتواند به صورت قابل قبولی نواحی را شناسایی کند (15). Rubin و همکارانش در سال 2005، با استفاده از سیستم شناسایی کمک کامپیوتری، میزان حساسیت عملکرد یک رادیولوژیست از 50 درصد به 76 درصد افزایش دادند (16). Li و همکارانش نیز در سال 2005دریافتند که میزان حساسیست شناسایی ندولهای ریوی در حضور سیستم آشکارسازی به کمک کامپیوتر، از 52 درصد به 68 درصد افزایش یافته است که این امر یک رشد قابلتوجهی را بههمراه داشت (17). Leeو همکارانش نیز در سال 2005، با مقایسه میزان تشخیص در حضور و عدم حضور سیستم شناسایی به کمک کامپیوتر فهمیدند که این سیستم به رادیولوژیست در تشخیص ندولهای ریوی کمک میکند، اما باعث افزایش نرخ خطای مثبت اشتباه میگردد (18). در مطالعه حاضر با انتخاب تکرار مناسب رشد کانتور، با درصد خطای قابل قبولی عمل جداسازی نسج ریه را از تصاویر سیتی اسکن با متوسط خطای محاسبه شده برای 10 بیمار سرطانی و 10 فرد سالم، به ترتیب برابر با 0/023 و 0/045 بهدست آمد که میزان خطای مطلوبی است. در مقایسه با کارهای انجام شده در این زمینه، به علت استفاده از روشهای نوینب خشبندی و ویژگیهای استخراج شده وکاهش خطای مثبت و زمان محاسبات، روش پیشنهادی دارای کارایی مطلوب میباشد.کشانی و همکاران در سال 1391 در مطالعهای که در بخش علوم کامپیوتر و مهندسی دانشگاه شیراز بر روی 61 اسکن که به چهار گروه تقسیم شده بودند، انجام شد. نواحی ریه را با استفاده از مدل کانتور فعال بدون در نظرگرفتن دیگر تکنیکها بخشبندی کردند که نرخ دستهبندی در این مدل 89 درصد و خطای مثبت کاذب 7/3 بود (19). در سال 2011 شارما و همکارانش، یک سیستم تشخیص خودکار به کمک کامپیوتر را به منظور شناسایی تومورهای ریه با عنوان «شناسایی سرطان ریه با استفاده از تکنیکهای پردازش تصویر» پیشنهاد دادند. در این مدل پردازشی که با تحلیل تصاویر CTقادر بهشناسایی ضایعات توموری است، ناحیه مورد بررسی قطعهبندی و سپس هر یک از قطعات بهمنظور شناسایی توده ندولی بررسی میشوند. با بهرهگیری از این تکنیک، جستوجوی ضایعات سرطانی با صحت 80 درصد برای جراحان و رادیولوژیستها در هنگام مشاهده تصاویر سیتی اسکن 2/5 تا 7 سانتیمتری فراهم شد (20). Dou و همکاران در سال 2016، از توابع سه بعدی حلقوی شبکههای عصبی جهت کاهش نرخ مثبت کاذب در تشخیص ندولهای ریوی استفاده نمودند (21). Zhou و همکاران نیز در سال 2016 توسط مجموعههای Rough، ویژگیهای مهم راانتخاب کرده و یک مدل بهینه سازی گرید را جهت بهبود تابع کرنل ماشین بردار پشتیبان، به منظور شناسایی بهتر ندولها بهدست آوردند (22). Sweetlin و همکاران در سال 2017 نیز به منظور افزایش دقت دسته بندی از ترکیب الگورتم کلونی مورچهها و ماشین بردار پشتیبان استفاده نمودند (23). نتایج بهدست آمده از این مطالعه نشان میدهد که سیستم پیشنهادی ارائه شده در شناسایی ندولهای ریه عملکرد مناسبی داشته است و از طرفی نرخ مثبت کاذب را تا حد قابل قبولی کاهش داده است و با توان بالایی ندولهای محیطی را مورد بررسی قرار میدهد و از طرفی دارای خطای نسبتاً پایینی در شناسایی بخشهای سالم بهعنوان ندولهای سرطانی است.با کمک مدل ارائه شده، درمرحله پیش پردازش قسمتهایی از تصویر که در امر پردازش الگوریتم مؤثر نیستند، حذف میگردد و با تبدیل تصویر به تصویر مقیاس خاکستری زمان پردازش کاهش مییابد و الگوریتم سریعتری تولید میشود. لذا به دلیل کاهش اندازه تصویر، سرعت پردازش الگوریتم در بخشبندی ناحیه مورد نظر توسط کانتور افزایش مییابد و اجرای آن در مدت زمان کمتری صورت میگیرد. بدین ترتیب، با استفاده از مدل کانتور فعال مبتنی بر ناحیه محلی مدت زمان بخشبندی ناحیه مورد بررسی به طور متوسط از 18/36 ثانیه به 5 ثانیه کاهش یافت و به منظور ارزیابی میزان کارایی و دقت این روش، بخشبندی انجام گرفته با تشخیص رادیولوژیست معیار مورد مقایسه قرار گرفت. مقادیر فاصله محاسبه شده مربوط به تودهها کمتر یا برابر با مقدار 0/75 میلیمتر شد که نشان دهنده افزایش سرعت شناسایی ندولهای ریوی با دقت بالا میباشد و این امر کارایی سیستم ارائه شده را نشان میدهد. از محدودیتهای الگوریتم پیشنهادی، پردازش بر روی بیماران سرطانی بوده است و پیشنهاد ما در پژوهشهای آتی استفاده از نمونههای تصادفی در عمل پردازش و تشخیص توده های سرطانی میباشد و با استاندارد Gold staland مقایسه شود.
نتیجهگیری
از ویژگیهای بارز الگوریتم پیشنهادی در این طرح پژوهشی، بخشبندی ندولهای متصل به رگهای خونی، ندولهای متصل به دیواره ریه، ندولهایی با مرزهای نامنظم و ندولهای حفرهدار میباشد. همچنین بخشبندی نواحی ریه و تشخیص و دستهبندی ندولها کاملاً خودکار و بدون نیاز به دخالت کاربر در کوتاهترین زمان ممکن با خطای اندکی صورت میگیرد. به منظور ارزیابی میزان کارایی و دقت این روش در الگوریتم پیشنهادی، نرخ خطای مثبت اشتباه به میزان قابل قبولی کاهش یافت؛ به صورتی که نواحی مشکوک بهندولهای سرطانی از ضایعات غیرسرطانی با دقت بالایی تفکیک شدند. امید است که باتوجهبهمزایا و منافع بهدست آمده از این پژوهش، شرایط بکارگیری از الگوریتم پیشنهادی در مراکز پزشکی فراهم گردد تا در صورت ابتلا به سرطان ریه بیماران با سرعت و دقت بیشتری شناسایی شوند و فرایندهای درمانی با سرعت بیشتری صورت پذیرد.
سپاسگزاری
این مطالعه نتیجه رساله کارشناسی ارشد مصوب دانشکده فنیمهندسی دانشگاه آزاد اسلامی کازرون می باشد. و حامی مالی ندارد بدینوسیله از تمام افرادی که ما را در انجام این مطالعه یاری نمودند از جمله پرسنل بخش سی تی اسکن بیمارستان تامین اجتماعی یزد نهایت تشکر را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
سرطان ریه یکی از متداولترین بدخیمیها در دنیا بهشمار میآید که به صورت رشد غیرقابل کنترل سلولی در بافت ریه میباشد (1) و عامل بیشترین درصد مرگ سرطانی در مردان و دومین علت مرگ سرطانی در زنان (بعد از سرطان پستان) است (2). فقدان شکایت بیمار و علایم بالینی در مراحل اولیه بیماری و نیز پایین بودن حساسیت روشهای آزمایشگاهی مهمترین علل مرگ و میر در سرطان ریه میباشد. از نشانههای شایع سرطانهای ریه، ندولهای ریوی هستند (3). تکنولوژی توموگرافی کامپیوتری Computed tomography (CT) ابزاری مناسب برای تشخیص غدد ریوی میباشد که بهدلیل حجم بالای تصاویر CT، بررسی غددی به قطر چند میلیمتر توسط رادیولوژیست کار بسیار دشواری است؛ از این رو، روشهای تشخیص به کمک کامپیوتر Computer Aided Diagnosis(CAD) به عنوان ابزاری مهم و کاربردی برای کمک به رادیولوژیستها در این امر همه روزه در حال پیشرفت میباشند (4). احتمال بقاء پنج ساله بیماران مبتلا بهسرطان ریه، بعد از عمل جراحی فقط 14% میباشد، در صورتی که تشخیص در مراحل اولیه که اندازه غدد کوچک است شانس نجات بیماران را به 70% الی80%افزایش میدهد (5). ندولهای ریوی میتوانند بهصورت مجزا یا متصل به دیوارهی ریه ظاهر شوند. هرچه ندولهای ریوی دارای مرز منظمتری باشند، خوشخیمتر و هرچه دارای مرز نامنظم و مبهمی باشند، بدخیمتر خواهند بود. در حال حاضر شناسایی نواحی بهصورت ندول یا غیرندول انجام میشود و پزشک متخصص بهطور قطع میتواند ندول یا غیرندول بودن ناحیهای را تشخیص دهد. اما تشخیص خوشخیمی و بدخیمی ندولهای ریوی توسط پزشک، بر مبنای احتمال است و بهطور صددرصد نمیتواند در مورد خوشخیمی یا بدخیمی بودن ندولهای ریوی قضاوت کند و نظر قطعی بدهد (6). ندولهای بدخیم میتوانند بهتعدادی رگ در بافت ریه متصل باشند و هرچه تغذیه خونی ندول توسط رگها بیشتر باشد ندول بدخیمتر خواهد بود. ندولهای بدخیم در ریه مبین وجود سرطان ریه میباشند (7). میتوان از روی سایز تودهها میزان و احتمال خوش خیمی و بدخیمی آنها را تخمین زد، بدین صورت که احتمال بدخیمی ندولهای ریوی با اندازه کوچکتر از 4 میلیمتر 0%، بین 7-4 میلیمتر 1%، بین 20-8 میلیمتر 15% و بزرگتر از 20 میلیمتر 75% میباشد. تودههای بزرگتر از 1 سانتیمتر به راحتی با چشم قابل مشاهده هستند (7). روشهای تشخیص به کمک کامپیوتررا میتوان به دو دسته روشهای مبتنی بر شدت روشنایی Intensity Based و روشهای مبتنی بر مدل Model Based تقسیمبندی کرد. در روش مبتنی بر مدل، اطلاعاتی از قبل در مورد شکل الگوی ندول داریم و لذا روشهایی مانند تطبیق الگو، مدلهای مبتنی بر آناتومی و مورفولوژی (شکلشناسی)، شکل ندولها از این دسته میباشند. الگوی ندولهای ریوی از اطلاعات تجربی و یا دادههای آموزشی بهدست میآید (8). در فرآیند تشخیص، دو نوع خطا ممکن است رخ دهد: خطای منفی مربوط بهمواردی هستند که واقعاً ندول میباشند، اما بهعنوان ندول دستهبندی نمیشوند؛ خطای مثبت ناشی از گزارش نادرست موارد غیرندول (رگ، زخم و...) بهعنوان ندول است. لازمه قابل قبول بودن یک سیستمکمک تشخیصی، داشتن حساسیت بالا و نرخ پایین خطای مثبت است. از جمله مزیتهای مهم روش پیشنهاد شده، تمام ساختارهایی با سطح روشنایی 1 و نزدیک به لبه تصویر حذف میشوند. این امر با محدود کردن فضای جستجو باعث افزایش سرعت و دقت پردازش میگردد و حساسیت آن در تشخیص ندولها و تودههای سرطانی نسبت به حساسیت روشهای کار شده بالاتر خواهد رفت. جداسازی مرزهای نواحی در تصاویر پزشکی همیشه یکی از مسائل مهم بوده است (9). بدین جهت، هدف اصلی در این مطالعه روشهای بخشبندی نواحی و روشهایی که بهصورت دقیقتر مرزهای نواحی سرطانی را شناسایی کند، مورد بررسی قرار گرفت و درصدد ایجاد چارچوبی کاملاً خودکار برای شناسایی دقیقتر و سریعتر تودههای سرطانی در تصاویر سیتیاسکن قفسهسینه برای کمک قابلتوجه به رادیولوژیست انجام گرفت. این چارچوب بخشی اساسی از سیستم شناسایی به کمک کامپیوتر میباشد که شامل دو روش واترشید watershed و اکتیوکانتورActive contour برای بخشبندی نواحی در تصاویر سیتی قفسه سینه است.
روش بررسی
در این طرح پژوهشی، تصاویر سی تی اسکن قفسه سینه از 20 فرد مراجعه کننده بهبیمارستان شهدای کارگر یزد، جهت شناسایی تودههای سرطانی و ندولهای ریوی مورد پردازش قرار گرفت (از تمامی مراجعه کنندگان رضایت کتبی گرفته شد). تصویربرداری CT با استفاده از دستگاه CT-16 slice زیمنس آلمان (SIEMENS Emotion) در حالت استاندارد (kvp=130 , mA=40) انجام شد که ضخامت اسلایس های ریه 1میلی متر با همپوشانی mm 3/0 اسلایسها میباشد. Window width و Window level که میزان روشنایی تصویر و تفکیک بافت ها از یگدیگر هستند در رنج 1200+ تا 600- قرار داشت. هدف اصلی یافتن ویژگیهایی بهمنظور شناسایی دقیق تودههای سرطانی با میزان دقت و حساسیت و تشخیص بالا در تصاویر سی تی قفسه سینه در مدت زمانی کمتر میباشد. همچنین تمامی دادههای محاسبه شده در نرمافزار matlab 2012b انجام شد.در ابتدا، 20 ناحیه از ریه بیماران مورد نظر، شامل 10 تصویر سی تی اسکن ریه بیمار سرطانی و 10 تصویر سی تی اسکن ریه فرد سالم، جهت بخش بندی انتخاب گردید. بخشبندی نواحی در تصاویر سی تی قفسه سینه بهدلیل داشتن نواحی با پس زمینه پیچیده و برخی از نواحی ندولی یا رگی با داشتن لبههای ضعیف، همواره با چالش همراه بودهاند. روشهای موجود، یا نیمه خودکار هستند یا دارای دقت مناسب میباشند و یا در بخشبندی نواحی ندولی که متصل بهرگ میباشند، نتیجه مطلوبی نخواهند داشت (10).
نواحی انتخاب شده، توسط دو روش واترشید و مدل اکتیو کانتور مبتنی بر ناحیه محلی بخشبندی شدند. همچنین این نواحی توسط پزشک متخصص مربوطه با استفاده از قلم نوری بخشبندی گردید. برای ارزیابی نتایج، نتیجه بخشبندی نواحی توسط مدل کانتورهای فعال، با نتیجه بخشبندی که توسط پزشک انجام شد، مقایسه گردید. انتخاب پارامترها در استفاده از مدل کانتورهای فعال مبتنی بر ناحیه محلی، مانند انتخاب ماسک اولیه، تعداد تکرار کانتور و انتخاب شعاع محلی است که در نتیجه منجر به بخشبندی نواحی از پس زمینه میشود. (11). در مطالعه حاضر، برای بخشبندی تمامی نواحی مشکوک به تودههای سرطانی از پارامترهای مشابهی استفاده شده است و انتخاب چنین پارامترهایی بر مبنای نواحی تعیین شدند. ماسک اولیه، دایرهای با شعاع 2 و مرکز آن در ماکزیمم مقدار ناحیه مورد نظر قرار میگیرد، زیرا توده سرطانی دارای ماکزیمم مقدار سطح روشنایی میباشند. تعداد تکرار کانتور به منظور بخشبندی کامل نواحی مورد نظر برابر با 200 انتخاب شد. شعاع محلی، برابر با 1 انتخاب گردید. آستانهگذاریهای مذکور برمبنای این واقعیت بهدست آمد که مقدار هانسفیلد تصاویری که مورد پردازش هستند، دارای مینیمم مقدار0 هانسفیلد و ماکزیمم مقدار 654 هانسفیلد میباشند. همچنین برخی از تودههای سرطانی که در بعضی از این تصاویر وجود دارند، دارای مینیمم مقدار 180- هانسفیلد و ماکزیمم مقدار 2000 هانسفیلد میباشند. در ادامه، نتایج حاصل از بخشبندی نواحی مشکوک بهتوده سرطانی با نتیجه بخشبندی انجام شده توسط پزشک مقایسه شده است.
الگوریتمهای ارائه شده به این منظور شش گام اصلی را شامل میشود (شکل 1).

شکل1: شمای کلی از الگوریتم پیشنهادی برای شناسایی ندولهای ریوی منجر به تشخیص سرطان درتصاویر سی تی قفسه سینه
گام اول، مرحله پیشپردازش در تصاویر سیتی قفسهسینه برای آمادهسازی تصاویر برای ورود به بخشهای بعدی الگوریتم میباشد که هدف استخراج لوبهای ریه از تصویر اصلی بهمنظور افزایش سرعت در انجام پردازش و دقت الگوریتم میباشد. تصاویر ورودی الگوریتم، سیتی خام از ریه میباشد. ابتدا اطلاعات خام سیتیاسکن بیماران تبدیل به هانسفیلد شده و در ادامه، لوبهای ریه به گونهای از تصویر اصلی بهدست آمد که ندولهای نزدیک به سطح ریه شناسایی شوند. سپس از روش تنظیم تباین بهمنظور روشنتر شدن محدوده مورد نظر استفاده شد. با اعمال این مرحله به الگوریتم پیشنهادی، عملکرد الگوریتم دستهبندی بهبود مییابد و نتیجه کار بهشدت تحت تأثیر قرار میگیرد. این مرحله قسمتهایی از تصویر را که در امر پردازش الگوریتم مؤثر نیستند، حذف میکند تا اطلاعات غیرمفید تصویر حذف شود و بخشی از تصویر که دارای اطلاعات ارزشمندی میباشد، باقی بماند. بنابراین، فضای مورد جستجو در تصاویر محدود میشود و این امر باعث افزایش سرعت و دقت الگوریتم در شناسایی تودههای سرطانی میگردد. البته قابلتوجه است که این مرحله برای استخراج لوبهای ریه از تصویر اصلی صورت میگیرد.گام دوم، شناسایی نواحی مشکوک بهتودههای سرطانی است. در این راستا با در نظر گرفتن الگوهای مناسب، تودههای سرطانی بهطور کامل و سریع به کمک روش تطبیق با استفاده از همبستگی شناسایی میشوند ولی نرخ خطای مثبت اشتباه این روش بسیار بالا است که نواحی نامربوط بسیاری بهعنوان ندول ریوی و یا توده سرطانی تشخیص داده میشوند. انتخاب شکل و اندازه الگوها نتیجه نهایی تشخیص تودههای سرطانی را رقم میزند. الگوهای مورد استفاده دایره ای و نیمه دایرهای در جهتهای متفاوتی میباشند. انتخاب الگوهای نیمه دایرهای به این منظور است که برخی از تودههای سرطانی متصل به سطح ریه میباشند و چنین تودههایی با انتخاب این الگوها شناسایی شدند. ویژگی مورد نظر ما در شناسایی نواحی مشکوک به تودههای سرطانی، مکان بهترین تطبیق بین تصویر والگوی انتخابی میباشد. در گام سوم، جداسازی خودکار مرزهای نواحی در تصاویر سیتی ریه صورت گرفت. ابتدا روش واترشید مورد استفاده قرار گرفت که به بخشبندی نواحی دارای ویژگیهای ناهمگن میپردازد. نتیجه بخشبندی نواحی توسط مدل واترشید با نتیجه بخشبندی توسط پزشک مورد مقایسه قرار گرفت.در گام چهارم، مدل کانتورهای فعال مبتنی بر ناحیه محلی که قادر به بخشبندی نواحی با ویژگیهای ناهمگن میباشد، استفاده شد. برای ارزیابی نتایج، نتیجه بخشبندی نواحی توسط مدل کانتورهای فعال، با نتیجه بخشبندی انجام شده توسط پزشک مقایسه گردید. یک نمونه از بخشبندیهای صورت گرفته در شکل (2) نشان داده شده است. انتخاب پارامترها در استفاده از مدل کانتورهای فعال مبتنی بر ناحیه محلی مانند انتخاب ماسک اولیه، تعداد تکرار کانتور و انتخاب شعاع محلی به گونهای صورت گرفت که بتوان به نتایج مطلوبی در بخشبندی نواحی دست یافت.در گام پنجم بر اساس این که ندولها و تودههای سرطانی تقریباً کروی شکل میباشند ویژگیهای دوبعدی و سهبعدی از نواحی مشکوک به تودههای سرطانی استخراج گردید (شکل 3). در این راستا، تعداد اسلایسهایی را که توده در آنها تکرار میشود، بهدست آورده شد. همانطورکه در قسمتهای قبلی بیان شد، نواحی نامربوط بسیاری توسط روش تطبیق با استفاده از همبستگی بهعنوان نواحی مشکوک بهتودههای سرطانی شناسایی میشوند. بدین ترتیب در گام ششم، مرحله دستهبندی نواحی به دو گروه سرطانی و غیرسرطانی با استفاده از طبقهبندی کننده ماشینبردار پشتیبان به همراه کرنل خطی، چند جملهای با درجه 3 و کرنل RBF صورت گرفت. بهترین نتیجه الگوریتم طبقه بندی با استفاده از کرنل RBF بهدست آمد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی کازرون تایید شده است.

شکل 2: مقایسه بخشبندی نواحی سرطانی توسط مدل کانتور فعال با نتیجه بخشبندی پزشک.
(الف) بخشبندی ناحیه سرطانی توسط مدل کانتور فعال. (ب) بخشبندی انجام شده توسط پزشک مربوطه

شکل 3: نتیجه نهایی بهدست آمده از مدل اکتیو کانتور برای تشخیص توده سرطانی
نتایج
در مدل استفاده شده برای بخشبندی نواحی، معیار خطا با استفاده از رابطه زیر، محاسبه شد.
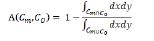
در رابطه ذکر شده، Cm و C0 کانتورهای بخشبندی انجام شده بهترتیب مربوط بهمدل کانتورهای فعال و پزشک میباشند. در این راستا، اشتراک و اجتماع هر دو کانتور بخشبندی انجام شده توسط پزشک و مدل کانتورهای فعال بهدست آمده و سپس معیار خطا (A) محاسبه میشود. در واقع در این رابطه، تعداد پیکسلهایی که هر دو کانتور با یکدیگر اشتراک و اجتماع دارند، بهدست میآید و سپس نسبت آنها محاسبه شده و از مقدار یک کم میشود. هرچه تعداد پیکسلهای اشتراک و اجتماع دو کانتور، نزدیک بهیکدیگر باشند، خطای محاسبه شده به صفر نزدیکتر میباشد (12). در این طرح پژوهشی، متوسط خطای محاسبه شده برای 10 بیمار سرطانی و 10 فرد سالم، به ترتیب برابر با 0/023 و 0/045 بهدست آمد.در تصاویر سی تی قفسه سینه، رگهای خونی و ندولها و تومورهای ریوی در هر کدام از ریهها از یکدیگر مستقل میباشند. بهعنوان مثال، اگر ناحیه مورد بررسی در ریه سمت راست قرار داشته باشد، ادامه ناحیه در دنباله تصاویر سی تی نیز در همان قسمت قرار دارد. بنابراین مطابق شکل (4) برای بخشبندی ناحیه مورد بررسی، کانتور را بر روی لوب ریهای اعمال میکنیم که ناحیه مورد بررسی در آن قرار گرفته است و در این صورت به دلیل کاهش اندازه تصویر، سرعت پردازش الگوریتم در بخشبندی ناحیه مورد نظر توسط کانتور افزایش مییابد و لذا اجرای آن در مدت زمان کم انجام میگیرد. بدین ترتیب، مدت زمان بخشبندی ناحیه مورد بررسی به طور متوسط از 18/36 ثانیه به 5 ثانیه کاهش مییابد. مقادیر فاصله محاسبه شده مربوط به تودهها کمتر یا برابر با مقدار 0/75 میلیمتر میباشد. برای دستهبندی نواحی به دو گروه سرطانی و غیرسرطانی از SVM به همراه سه کرنل خطی، چند جملهای با درجه 3 و کرنل تابع پایه شعاعی استفاده گردید. در هر دسته از 60 درصد نواحی برای آموزش و از40 درصد نواحی برای تست الگوریتم استفاده شد. نتایج اعمال SVM به همراه کرنلهای خطی، چند جملهای با درجه 3 و کرنل RBF در جدول (1) نشان داده شده است. بهترین نتیجه الگوریتم طبقهبندی با استفاده از کرنل RBF و استفاده از پارامتر 0/28=σ برای آن، بهدست آمد. طبقهبندی نواحی به صورتی انجام شدکه در دو دسته نواحی با میزان حساسی تو دقت مطلوبی ازیکدیگرتفکیک شوند. الگوریتم پیشنهادی بر روی10 بیمار از نمونههای انتخابی تست گردید، که خطای مثبت اشتباه (FP)، خطای منفی اشتباه (FN)، خطای مثبت صحیح (TP) و خطای منفی صحیح (TN) و نتایج آن در جدول (2) نشان داده شده است.10 بیمار انتخاب شده شامل 249 ندول میباشند. معیارهای محاسبه شده از الگوریتم پیشنهادی در جدول (3) نشان داده شده است.

شکل 4: در دنباله تصاویر سی تی ساختار مربوط به هر لوب ریه (ندولها و رگهای خونی) از یکدیگر مستقل میباشند.
(الف) تصویر اصلی، (ب) دو لوب ریه مطابق شکل میتوانند از یکدیگر جدا شوند.
جدول 1: نتایج بهدست آمده از طبقهبندی کننده SVM نتایج طبقهبندی SVM به همراه سه کرنل خطی، چند جملهای با درجه 3 و تابع پایه شعاعی با
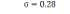

جدول 2: نتایج ارزیابی الگوریتم پیشنهادی. نتایج برای 20 بیمار پایگاه داده بهدست آمده است.

جدول 3: سه معیار حساسیت، تشخیص و دقت برحسب درصد محاسبه شده است. معیارهای محاسبه شده جهت ارزیابی الگوریتم پیشنهادی بر روی 10 بیمار انتخاب شده.
.JPG)
بحث
مطالعه و بررسی روشهای تشخیص تودهها در تصاویر سی تی قفسه سینه، میتواند نقش بسزایی در شناسایی اولیه و درمان بیماریهای ریوی ایفا کند (3). برای تشخیص سرطان از غیرسرطان در تصاویر سی تی قفسه سینه، به کارگیری تکنیکهای کارآمد و استخراج ویژگیهای مناسب و کافی الزامی میباشد. برخی از تحقیقات نشان میدهد که عملکرد رادیولوژیستها در حضور سیستم شناسایی به کمک کامپیوتر، بهطور قابل ملاحظهای بهبود یافته است مطالعه حاضر درصدد ایجاد چارچوبی کاملاً خودکار برای شناسایی تودههای سرطانی در تصاویر سی تی اسکن قفسه سینه میباشد. این چارچوب بخشی اساسی از سیستم شناسایی به کمک کامپیوتر میباشد که در شناسایی دقیقتر و سریعتر تودههای سرطانی به رادیولوژیست کمک میکند (12،11). در یک تصویر سی تی بهدست آمده، نواحی مختلفی از ندول و غیرندول دیده میشود. در سیستمهای شناسایی به کمک کامپیوتر ممکن است، دو نوع خطا رخ دهد. این دو نوع خطا عبارتند از خطای منفی اشتباهFalse Negative که در آن بهدلیل عدم وضوح کافی نواحی سرطانی در تصاویر و یا به دلیل عدم توجه یا خستگی رادیولوژیست، یک ناحیهی سرطانی از نظر دور میماند و خطای مثبت اشتباه False Positiveکه در آن یک ناحیهی غیرسرطانی، به عنوان یک ناحیهی سرطانی شناسایی میشود. خطاهای منفی اشتباه باعث میشوند که به صورت نادرست شخص بیمار بهعنوان فرد سالم تلقی شود و از ادامه درمان منصرف گردد. این موضوع به خصوص در مورد تشخیص بیماری سرطان بسیار زیانبار و در بسیار از موارد جبران ناپذیر میباشد. خطاهای مثبت اشتباه باعث میشوند که از یک شخص سالم در ادامهی درمان نمونه برداریها، عکس برداریهای دقیقتر به منظور بررسی بهتر ضایعه و آزمایشات مراحل بعدی انجام گیرد که این موضوع ممکن است باعث ایجاد مشکلات اقتصادی و یا مشکلات روحی برای فرد سالم شود (12). در مقالات سالهای گذشته بر اساس شکل ندولها و همچنین بهکمک استخراج ویژگیهایی از نواحی مشکوک شناسایی شده به عنوان ندولهای ریوی، تا حدودی میزان خطای مثبت اشتباه، کاهش مییابد. در نهایت میزان درصد تشخیص و حساسیت خوبی ندولهای ریوی از رگهای خونی در تصاویر سی تی قفسه سینه شناسایی و طبقهبندی میشوند (12-10). در پژوهش حاضر، برای جداسازی نواحی سرطانی و غیرسرطانی در پس زمینه، از واترشید و مدل کانتور فعال مبتنی بر ناحیه محلی استفاده شد با انتخاب مناسب پارامترهای این کانتور، نتایج مطلوبی در بخشبندی نواحی مشکوک بهتودههای سرطانی در تصاویر سی تی قفسه سینه حاصل گردید. همچنین برای بخشبندی تمام نواحی در تصاویر سی تی ریه از پارامترهای مشابه استفاده شد. در ریه، ما سعی در دستهبندی نواحی تصاویر، به دو دسته دارای ندول و غیرندول هستیم. در این روش ویژگیهای بافتی نقاط کانتور با استفاده از روش مبتنی بر گشتاور محاسبه میشود، لذا منحنی کانتور جهت انطباق بر مرزهای ناحیه مورد نظر، منبسط و یا منقبض میگردد و در نتیجه ناحیهی مورد نظر در تصویر بخشبندی میشود. مشخصههایی که پزشکان، برای تشخیص موارد سرطانی و غیرسرطانی در تصاویر بر آنها تکیه میکنند، برای شناسایی موارد غیرطبیعی در تصاویر توسط یک پزشک کفایت میکند. این مشخصهها شامل ویژگیهای مربوط به شکل شناسی (اندازه قطرهای کوچک و بزرگ، میزان کشیدگی Elongation، میزان مدور بودن (Circularity) و ویژگیهای مربوط به بافت میباشند (10). از دلایل عملکرد مناسب الگوریتمهای بخشبندی نواحی،مات بودن باطن تصویر و وجود نویز در تصویر میباشد. بهدلیل پایین بودن کیفیت بافت تصویر و یا شبیه بودن بافتهای موجود در طرفین مرزهای ندول، ممکن است برخی از تکنیکها دقت و اهمیت لازم برای بخشبندی نواحی را نداشته باشند. در تصاویر سی تی اسکن ریه برخی از نواحی ندولی یا رگی، لبهها و مرزهای تیز و کاملاً دقیق و واضحی ندارند، بنابراین دقت جداسازی و تشخیص مرزهای نواحی بهسختی امکان پذیر میباشد. در مطالعه حاضر، مقایسهای بین نتایج الگوریتم پیشنهادی جهت شناسایی ندولهای ریوی، با برخی از روشهای موجود در این زمینه بر اساس دو معیار حساسیت و تشخیص صورت گرفته است. میزان حساسیت و تشخیص عملکرد الگوریتم پیشنهادی و نتایج به دست آمده در جدول (3)، نسبت به دیگر گروههای تحقیقاتی و پایگاه داده انتخابی (ELCAP) در جدول (4)، بهبود یافته است. برای تمام نواحی مورد مطالعه در این طرح پژوهشی از پارامترهای مشابه استفاده شده است.
جدول 4: مقایسه درصد الگوریتم پیشنهادی با سیر روشهای پیشین.

Williams و Shah در سال ۱۹۲۲، یک الگوریتم سریع برای کمینه کردن انرژی کانتور پیشنهاد دادند، ولی این روش قادر بهبخشبندی دقیق نواحی با مرزهای مقعر نبود (13). برای برطرف کردن مشکلات الگوریتمهای قبلی، در سال ۱۹۹۳، Caselles و همکارانش مدل کانتورهای فعال مهندسی را پیشنهاد دادند. در این روش تشخیص خودکار با استفاده از دو کانتور فعال بر روی تصاویر میباشد ولی دارای محاسبات سخت و پیچیده زیادی بود که این امر سرعت الگوریتم را کاهش میداد و مدت زمان بررسی الگوریتم ها نیز افزایش یافته و کاری زمانبر بود (14). در سال ۲۰۰۲، مدل کانتورهای فعال بر مبنای همگنی ناحیه ارائه شد که در این مدل، سیستم پردازش و شناسایی نواحی مورد نظر دارای حساسیتی به میزان 50 درصد میباشد. مدل ارائه شده در این الگوریتم به گرادیان در تصویر بستگی نداشته و به نویز تصویر حساس نمیباشد و میتواند به صورت قابل قبولی نواحی را شناسایی کند (15). Rubin و همکارانش در سال 2005، با استفاده از سیستم شناسایی کمک کامپیوتری، میزان حساسیت عملکرد یک رادیولوژیست از 50 درصد به 76 درصد افزایش دادند (16). Li و همکارانش نیز در سال 2005دریافتند که میزان حساسیست شناسایی ندولهای ریوی در حضور سیستم آشکارسازی به کمک کامپیوتر، از 52 درصد به 68 درصد افزایش یافته است که این امر یک رشد قابلتوجهی را بههمراه داشت (17). Leeو همکارانش نیز در سال 2005، با مقایسه میزان تشخیص در حضور و عدم حضور سیستم شناسایی به کمک کامپیوتر فهمیدند که این سیستم به رادیولوژیست در تشخیص ندولهای ریوی کمک میکند، اما باعث افزایش نرخ خطای مثبت اشتباه میگردد (18). در مطالعه حاضر با انتخاب تکرار مناسب رشد کانتور، با درصد خطای قابل قبولی عمل جداسازی نسج ریه را از تصاویر سیتی اسکن با متوسط خطای محاسبه شده برای 10 بیمار سرطانی و 10 فرد سالم، به ترتیب برابر با 0/023 و 0/045 بهدست آمد که میزان خطای مطلوبی است. در مقایسه با کارهای انجام شده در این زمینه، به علت استفاده از روشهای نوینب خشبندی و ویژگیهای استخراج شده وکاهش خطای مثبت و زمان محاسبات، روش پیشنهادی دارای کارایی مطلوب میباشد.کشانی و همکاران در سال 1391 در مطالعهای که در بخش علوم کامپیوتر و مهندسی دانشگاه شیراز بر روی 61 اسکن که به چهار گروه تقسیم شده بودند، انجام شد. نواحی ریه را با استفاده از مدل کانتور فعال بدون در نظرگرفتن دیگر تکنیکها بخشبندی کردند که نرخ دستهبندی در این مدل 89 درصد و خطای مثبت کاذب 7/3 بود (19). در سال 2011 شارما و همکارانش، یک سیستم تشخیص خودکار به کمک کامپیوتر را به منظور شناسایی تومورهای ریه با عنوان «شناسایی سرطان ریه با استفاده از تکنیکهای پردازش تصویر» پیشنهاد دادند. در این مدل پردازشی که با تحلیل تصاویر CTقادر بهشناسایی ضایعات توموری است، ناحیه مورد بررسی قطعهبندی و سپس هر یک از قطعات بهمنظور شناسایی توده ندولی بررسی میشوند. با بهرهگیری از این تکنیک، جستوجوی ضایعات سرطانی با صحت 80 درصد برای جراحان و رادیولوژیستها در هنگام مشاهده تصاویر سیتی اسکن 2/5 تا 7 سانتیمتری فراهم شد (20). Dou و همکاران در سال 2016، از توابع سه بعدی حلقوی شبکههای عصبی جهت کاهش نرخ مثبت کاذب در تشخیص ندولهای ریوی استفاده نمودند (21). Zhou و همکاران نیز در سال 2016 توسط مجموعههای Rough، ویژگیهای مهم راانتخاب کرده و یک مدل بهینه سازی گرید را جهت بهبود تابع کرنل ماشین بردار پشتیبان، به منظور شناسایی بهتر ندولها بهدست آوردند (22). Sweetlin و همکاران در سال 2017 نیز به منظور افزایش دقت دسته بندی از ترکیب الگورتم کلونی مورچهها و ماشین بردار پشتیبان استفاده نمودند (23). نتایج بهدست آمده از این مطالعه نشان میدهد که سیستم پیشنهادی ارائه شده در شناسایی ندولهای ریه عملکرد مناسبی داشته است و از طرفی نرخ مثبت کاذب را تا حد قابل قبولی کاهش داده است و با توان بالایی ندولهای محیطی را مورد بررسی قرار میدهد و از طرفی دارای خطای نسبتاً پایینی در شناسایی بخشهای سالم بهعنوان ندولهای سرطانی است.با کمک مدل ارائه شده، درمرحله پیش پردازش قسمتهایی از تصویر که در امر پردازش الگوریتم مؤثر نیستند، حذف میگردد و با تبدیل تصویر به تصویر مقیاس خاکستری زمان پردازش کاهش مییابد و الگوریتم سریعتری تولید میشود. لذا به دلیل کاهش اندازه تصویر، سرعت پردازش الگوریتم در بخشبندی ناحیه مورد نظر توسط کانتور افزایش مییابد و اجرای آن در مدت زمان کمتری صورت میگیرد. بدین ترتیب، با استفاده از مدل کانتور فعال مبتنی بر ناحیه محلی مدت زمان بخشبندی ناحیه مورد بررسی به طور متوسط از 18/36 ثانیه به 5 ثانیه کاهش یافت و به منظور ارزیابی میزان کارایی و دقت این روش، بخشبندی انجام گرفته با تشخیص رادیولوژیست معیار مورد مقایسه قرار گرفت. مقادیر فاصله محاسبه شده مربوط به تودهها کمتر یا برابر با مقدار 0/75 میلیمتر شد که نشان دهنده افزایش سرعت شناسایی ندولهای ریوی با دقت بالا میباشد و این امر کارایی سیستم ارائه شده را نشان میدهد. از محدودیتهای الگوریتم پیشنهادی، پردازش بر روی بیماران سرطانی بوده است و پیشنهاد ما در پژوهشهای آتی استفاده از نمونههای تصادفی در عمل پردازش و تشخیص توده های سرطانی میباشد و با استاندارد Gold staland مقایسه شود.
نتیجهگیری
از ویژگیهای بارز الگوریتم پیشنهادی در این طرح پژوهشی، بخشبندی ندولهای متصل به رگهای خونی، ندولهای متصل به دیواره ریه، ندولهایی با مرزهای نامنظم و ندولهای حفرهدار میباشد. همچنین بخشبندی نواحی ریه و تشخیص و دستهبندی ندولها کاملاً خودکار و بدون نیاز به دخالت کاربر در کوتاهترین زمان ممکن با خطای اندکی صورت میگیرد. به منظور ارزیابی میزان کارایی و دقت این روش در الگوریتم پیشنهادی، نرخ خطای مثبت اشتباه به میزان قابل قبولی کاهش یافت؛ به صورتی که نواحی مشکوک بهندولهای سرطانی از ضایعات غیرسرطانی با دقت بالایی تفکیک شدند. امید است که باتوجهبهمزایا و منافع بهدست آمده از این پژوهش، شرایط بکارگیری از الگوریتم پیشنهادی در مراکز پزشکی فراهم گردد تا در صورت ابتلا به سرطان ریه بیماران با سرعت و دقت بیشتری شناسایی شوند و فرایندهای درمانی با سرعت بیشتری صورت پذیرد.
سپاسگزاری
این مطالعه نتیجه رساله کارشناسی ارشد مصوب دانشکده فنیمهندسی دانشگاه آزاد اسلامی کازرون می باشد. و حامی مالی ندارد بدینوسیله از تمام افرادی که ما را در انجام این مطالعه یاری نمودند از جمله پرسنل بخش سی تی اسکن بیمارستان تامین اجتماعی یزد نهایت تشکر را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1-Read a, Trojan T. Human Molecular Genetics. 3rd ed Garland Science: Springer-Verilog; 2005.
2-Delgado J, Martinez LM, Sánchez TT, Ramirez A, Iturria C, González-Avila G. Lung Cancer Pathogenesis Associated with Wood Smoke Exposure. Chest 2005; 128(1): 124-31.
3-Van Ginneken B, Ter Haar Romeny BM, Viergever MA. Computer-Aided Diagnosis in Chest Radiography: A Survey. IEEE Trans Med Imaging 2001; 20(12): 1228-41.
4-Brown MS, Goldin JG, Suh RD, McNitt-Gray MF, Sayre JW, Aberle DR. Lung Micronodules: Automated Method for Detection at Thin Section CT Initial Experience. Radiology 2003; 226(1): 256-62.
5-Marieb EN, Hoehn K. Human Anatomy & Physiology. Mount Royal University: Pearson Education; 2007.
6-Weinberg RA. The biology of cancer. 2th ed. New York: Garland Science; 2007: 26-30.
7-Nussbaum RL, McInnes RR, Williard HF, Thompson JS. 8th ed. Thompson & Thompson Genetics in Medicine. Elsevier; 2001; 96(3): 103-15.
8-Kleinerman R, Wang Z, Lubin J, Zhang S, Metayer C, Brenner A. Lung Cancer and Indoor Air Pollution in Rural China. Ann Epidemiol 2000; 10(7): 469.
9-Fontana RS, Sanderson DR, Taylor WF, Woolner LB, Miller WE, Muhm JR, et al. Early Lung Cancer Detection: Results of the Initial (Prevalence) Radiologic and Cytologic Screening in the Mayo Clinic Study. Am Rev Respir Dis 1984; 130(4): 561-5.
10-Ye X, Lin X, Dehmeshki J, Slabaugh G, Beddoe G. Shape-Based Computer-Aided Detection of Lung Nodules in Thoracic CT Images. IEEE Trans Biomed Eng 2009; 56(7): 1810-20.
11-MAJ Klik, EM v Rikxoort, JF Peters, HA Gietema, M Prokop, Bv Ginnek. Improved Classification of Pulmonary Nodules by Automated Detection of Benign Subpleural Lymph Nodes. 3rd IEEE International Symposium on Biomedical Imaging: Nano to Macro, 2006. Arlington, VA, 2006. p. 494-97.
12-Doi K. Overview On research and Development of Computer-Aided Diagnostic Schemes. Semin Ultrasound CT MR 2004; 25(5): 404-10.
13-Williams DJ, Shah M. A Fast Algorithm for Active Contours and Curvature Estimation. CVGIP: Image Understanding 1992; 55(1): 14-26.
14-Caselles V, Catté F, Coll T, Dibos F. A Geometric Model for Active Contours in Image Processing. Numerische Mathematic. 1993; 66(1): 1-31.
15-Vese LA, Chan TF. A Multiphase Level Set Framework for Image Segmentation Using the Mumford and Shah Model. International Journal of Computer Vision 2002; 50(3): 271-93.
16-Rubin GD, Lyo JK, Paik DS, Sherbondy AJ, Chow LC, Leung AN, et al. Pulmonary Nodules on Multi–Detector Row CT Scans: Performance Comparison of Radiologists and Computer-Aided Detection. Radiology 2005; 234(1): 274-83.
17-Li F, Arimura H, Suzuki K, Shiraishi J, Li Q, Abe H, et al. Computer-Aided Detection of Peripheral Lung Cancers Missed at CT: ROC Analyses without and with Localization. Radiology 2005; 237(2): 684-90.
18-Lee IJ, Gamsu G, Czum J, Wu N, Johnson R, Chakrapani S. Lung Nodule Detection on Chest CT: Evaluation of a Computer-Aided Detection (CAD) System. Korean J Radiol 2005; 6(2): 89-93.
19-Keshani M, Azimifar Z, Tajeripour F, Boostani R. Lung Nodule Segmentation and Recognition Using SVM Classifier and Active Contour Modeling: A Complete Intelligent System. Comput Biol Med 2013; 43(4): 287-300.
20-Sharma D, Jindal G. Identifying Lung Cancer Using Image Processing Techniques. In International Conference on Computational Techniques and Artificial Intelligence (ICCTAI) 2011; 17: 115-20.
21-Dou Q, Chen H, Yu L, Qin J, Hang PA. Multilevel Contextual 3-D Cnns for False Positive Reduction in Pulmonary Nodule Detection. IEEE Trans Biomed Eng 2017; 64(7): 1558-67.
22-Zhou T, Lu H, Zhang J, Shi H. Pulmonary Nodule Detection Model Based on SVM and CT Image Feature Level Fusion with Rough Sets. Biomed Res Int 2016; 2016: 8052436.
23-Sweetlin JD, Nehemiah HK, Kannan A. Feature Selection Using Ant Colony Optimization with Tandemrun Recruitment to Diagnose Bronchitis from CT scan Images. Comput Methods Programs Biomed 2017; 145:115-25.
1-Read a, Trojan T. Human Molecular Genetics. 3rd ed Garland Science: Springer-Verilog; 2005.
2-Delgado J, Martinez LM, Sánchez TT, Ramirez A, Iturria C, González-Avila G. Lung Cancer Pathogenesis Associated with Wood Smoke Exposure. Chest 2005; 128(1): 124-31.
3-Van Ginneken B, Ter Haar Romeny BM, Viergever MA. Computer-Aided Diagnosis in Chest Radiography: A Survey. IEEE Trans Med Imaging 2001; 20(12): 1228-41.
4-Brown MS, Goldin JG, Suh RD, McNitt-Gray MF, Sayre JW, Aberle DR. Lung Micronodules: Automated Method for Detection at Thin Section CT Initial Experience. Radiology 2003; 226(1): 256-62.
5-Marieb EN, Hoehn K. Human Anatomy & Physiology. Mount Royal University: Pearson Education; 2007.
6-Weinberg RA. The biology of cancer. 2th ed. New York: Garland Science; 2007: 26-30.
7-Nussbaum RL, McInnes RR, Williard HF, Thompson JS. 8th ed. Thompson & Thompson Genetics in Medicine. Elsevier; 2001; 96(3): 103-15.
8-Kleinerman R, Wang Z, Lubin J, Zhang S, Metayer C, Brenner A. Lung Cancer and Indoor Air Pollution in Rural China. Ann Epidemiol 2000; 10(7): 469.
9-Fontana RS, Sanderson DR, Taylor WF, Woolner LB, Miller WE, Muhm JR, et al. Early Lung Cancer Detection: Results of the Initial (Prevalence) Radiologic and Cytologic Screening in the Mayo Clinic Study. Am Rev Respir Dis 1984; 130(4): 561-5.
10-Ye X, Lin X, Dehmeshki J, Slabaugh G, Beddoe G. Shape-Based Computer-Aided Detection of Lung Nodules in Thoracic CT Images. IEEE Trans Biomed Eng 2009; 56(7): 1810-20.
11-MAJ Klik, EM v Rikxoort, JF Peters, HA Gietema, M Prokop, Bv Ginnek. Improved Classification of Pulmonary Nodules by Automated Detection of Benign Subpleural Lymph Nodes. 3rd IEEE International Symposium on Biomedical Imaging: Nano to Macro, 2006. Arlington, VA, 2006. p. 494-97.
12-Doi K. Overview On research and Development of Computer-Aided Diagnostic Schemes. Semin Ultrasound CT MR 2004; 25(5): 404-10.
13-Williams DJ, Shah M. A Fast Algorithm for Active Contours and Curvature Estimation. CVGIP: Image Understanding 1992; 55(1): 14-26.
14-Caselles V, Catté F, Coll T, Dibos F. A Geometric Model for Active Contours in Image Processing. Numerische Mathematic. 1993; 66(1): 1-31.
15-Vese LA, Chan TF. A Multiphase Level Set Framework for Image Segmentation Using the Mumford and Shah Model. International Journal of Computer Vision 2002; 50(3): 271-93.
16-Rubin GD, Lyo JK, Paik DS, Sherbondy AJ, Chow LC, Leung AN, et al. Pulmonary Nodules on Multi–Detector Row CT Scans: Performance Comparison of Radiologists and Computer-Aided Detection. Radiology 2005; 234(1): 274-83.
17-Li F, Arimura H, Suzuki K, Shiraishi J, Li Q, Abe H, et al. Computer-Aided Detection of Peripheral Lung Cancers Missed at CT: ROC Analyses without and with Localization. Radiology 2005; 237(2): 684-90.
18-Lee IJ, Gamsu G, Czum J, Wu N, Johnson R, Chakrapani S. Lung Nodule Detection on Chest CT: Evaluation of a Computer-Aided Detection (CAD) System. Korean J Radiol 2005; 6(2): 89-93.
19-Keshani M, Azimifar Z, Tajeripour F, Boostani R. Lung Nodule Segmentation and Recognition Using SVM Classifier and Active Contour Modeling: A Complete Intelligent System. Comput Biol Med 2013; 43(4): 287-300.
20-Sharma D, Jindal G. Identifying Lung Cancer Using Image Processing Techniques. In International Conference on Computational Techniques and Artificial Intelligence (ICCTAI) 2011; 17: 115-20.
21-Dou Q, Chen H, Yu L, Qin J, Hang PA. Multilevel Contextual 3-D Cnns for False Positive Reduction in Pulmonary Nodule Detection. IEEE Trans Biomed Eng 2017; 64(7): 1558-67.
22-Zhou T, Lu H, Zhang J, Shi H. Pulmonary Nodule Detection Model Based on SVM and CT Image Feature Level Fusion with Rough Sets. Biomed Res Int 2016; 2016: 8052436.
23-Sweetlin JD, Nehemiah HK, Kannan A. Feature Selection Using Ant Colony Optimization with Tandemrun Recruitment to Diagnose Bronchitis from CT scan Images. Comput Methods Programs Biomed 2017; 145:115-25.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







