دوره 28، شماره 12 - ( اسفند 1399 )
جلد 28 شماره 12 صفحات 3299-3288 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Azami H, Malek-Hosseini S, Mojahed Taghi M, Zareinejad M, Amirghofran Z. Antitumor Activity and Immunomodulatory Effects of Ficus carica Latex. JSSU 2021; 28 (12) :3288-3299
URL: http://jssu.ssu.ac.ir/article-1-4470-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4470-fa.html
اعظمی حمیده، ملکحسینی سعید، مجاهدتقی مریم، زارعی نژاد محمدرسول، امیرغفران زهرا. بررسی اثرات ضد سرطانی و ایمونومدولاتوری شیره انجیر. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (12) :3288-3299
متن کامل [PDF 934 kb]
(992 دریافت)
| چکیده (HTML) (2526 مشاهده)
متن کامل: (4683 مشاهده)
مقدمه
گیاهان دارویی همواره در طول تاریخ نقش بسیار مهمی در بهداشت و سلامت انسان ایفا نمودهاند. امروزه تمایل جهانی بهسمت استفاده از فیتوکمیکالهای طبیعی موجود در گیاهان، میوهها، عصارهها و مشتقات آنها رو به فزونی است. مواد گیاهی طبیعی منبع بسیار مهمی در درمان بیماریهای مختلف از جمله سرطان بودهاند. یکی از گیاهانی که بهطور سنتی برای درمان بیماریهای مختلف از جمله مشکلات گوارشی، التهابات و سرطان استفاده میشد و دارای اثرات محافظتی کبدی و ضدمیکروبی میباشد گیاه انجیر است. درخت انجیر که نام علمی آن Ficus و از خانواده "Moraceae"میباشد دارای 600 گونه است که اغلب انواع آن وحشی یا زینتی هستند (1). گیاه Ficus carica همان انجیر معمولی است که میوه آن را مصرف میکنیم و ایران بهعنوان یکی از بزرگترین تولیدکنندگان آن بهشمار میرود (2). اسـتانهای مهـم تولیـدکننـده انجیر در ایران بـهتـرتیب استان فـارس، لرسـتان، کرمـان، خراسـان، کرمانشاه و سمنان میباشند. ایـن میوه بهطور گستردهای هم بهعنوان یک منبع غذایی و هـم بهعنـوان یـک منبع داروئی در دنیا مصرف میشود. میوه انجیر خـشک و تازه منبـع غنـی از مـواد معـدنی و آنتـیاکـسیدانت مـیباشـد (3). انجیر از نظر طب قدیم ایران گرم و تر است و در مواردی مانند کاهش تب، افزایش تعریق، رفع التهاب مجاری دستگاه تنفسی و کلیه، درمان سرماخوردگی و بیماریهای التهابی، معالجه بیماریهای پوستی و بالاخره سرطان کاربرد داشته است (4). با توجه به محدود بودن مطالعات تجربی و اطلاعات در زمینه اثرات ضد توموری و ایمونومدولاتوری انجیر در این مطالعه تاثیر شیره انجیر سیاه بر چند رده سلولی سرطانی و بر تکثیر لنفوسیتها بررسی گردیده است و بهعلاوه تولید دو سیتوکاین اینترلوکین 4 (IL-4) و اینترفرون گاما (IFNγ) توسط لنفوسیتهای تحریک شده با ماده میتوژن اندازهگیری شده است. اینترلوکین 4 سیتوکاینی است که از زیرگروه لنفوسیتهای Th2 ترشح میشود و در رشد و در رشد و القای فعالیت لنفوسیتهای B در جهت تولید آنتیبادی نقش دارد (5). اینترفرون گاما نیز از زیرگروه Th1 تولید میشود و سیتوکاین اصلی فعالکننده ماکروفاژها برای مقابله با عوامل میکروبی داخل سلولی و سلولهای توموری میباشد (6). مطالعه حاضر میتواند اطلاعات مناسبی را در مورد خواص ایمونومدولاتوری و ضد توموری میوه انجیر در اختیار ما قرار دهد.
روش بررسی
آمادهسازی عصاره شیره انجیر: ابتدا شیره انجیر از درختان انجیر سفید (Ficuscarica) در منطقه استهبان در استان فارس در فصل پاییز جمعآوری گردید. سپس توسط کارشناس گروه فارماکولوژی عصاره متانولی از آن تهیه گردید. عصاره تهیه شده در دی متیل سولفوکسید (DMSO) (سیگما، آمریکا) حل گردید و آنگاه غلظت 20 میلیگرم در میلیلیتر از آن در محیط کشت RPMI (گیبکو، آلمان) تهیه گردید. از محلول بهدست آمده غلظتهای نهایی مختلف از 1-1000 میکروگرم در میلیلیتر در محیط کشت RPMI تهیه گردید.
ردههای سلولی و کشت سلولی: در این مطالعه از پنج رده سلولی سرطانی شامل رده سلولی Fen (سرطان مثانه)، رده سلولی K562 (لوسمی میلوئیدی)، Hela (سرطان سرویکس)، Jurkat (لوسمی لنفوئیدی) و Raji (لنفوم سلولهای B) استفاده گردید. تمام ردههای سلولی فوق در فلاسک کشت سلولی حاوی محیط کشت RPMI 1640 غنی شده با سرم جنین گوساله غیر فعال شده ده درصدی و آنتیبیوتیکهای پنیسیلین به میزان 100 واحد در میلیلیتر و استرپتومایسین بهمیزان 100 میکروگرم در میلیلیتر (شفافارمد، ایران) و در دمای 37 درجه سانتیگراد و محیط مرطوب شامل 5 درصد CO2 کشت داده شدند. برای سلولهایی که حالت چسبنده داشتند مانند Hela و Fen، جهت تهیه سلول از عمل تریپسینه کردن استفاده شد. با تست رنگآمیزی تریپان بلو مشخص شد که 95 درصد سلولها زندهاند.
تست MTT: بهمنظور بررسی اثر مهاری شیره انجیر بر میزان رشد ردههای سلولی، ابتدا تعداد معین شده از هر سلول در هر چاهک با غلظتهای 10 تا 800 میکروگرم در میلیلیتر عصاره به مدت 48 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. سپس 10 میکرولیتر از محلول 5 میکروگرم در میلیلیتر MTT (سیگما) به هر چاهک پلیت اضافه شد. پلیت 4 ساعت در دمای 37 درجه قرار داده شد و در انتها محیط کشت خارج شده و 150 میلیلیتر محلول DMSO جهت حل شدن کریستالهای فورمازان اضافه شد. سلولهای تیمار شده با DMSO (حلالشیره) بهعنوان کنترل منفی و سلولهای تیمار شده با داروی سیتوتوکسیک سیسپلاتین (به میزان 50 میلیگرم در میلیلیتر) بهعنوان کنترل مثبت در نظر گرفته شدند. در انتها جذب نوری چاهکها با دستگاه قرائتکننده الیزا در طول موج 570 نانومتر اندازهگیری شد. درصد مهار رشد برای غلظتهای مختلف عصاره روی هر رده سلولی در مقایسه با کنترل حلال محاسبه و سپس نمودار درصد مهار رشد در مقابل غلظت رسم و با کمک برنامه Curve expert غلظتی از عصاره که پنجاه درصد سلولها از بین رفته باشند (IC50) محاسبه گردید.
تست تکثیر لنفوسیتی: بهمنظور بررسی تأثیر عصاره بر تکثیر لنفوسیتها از روش برومو دی اکسی یوریدین ((BrdU (روشه، آلمان) استفاده گردید. در این روش از برومو دی اکسی یوریدین که آنالوگ تیمیدین است بهعنوان شاخصی برای اندازهگیری میزان تکثیر سـلولی استفاده میشود. این مولکول درمرحلـه سنتز DNA وارد سلولهای جدیـد شـده و بـا آنتیبادی ضد BrdUنوعــی فراورده رنگـــی بـــهوجــود میآورد کـه میـزان جذب نوری آن باروش رنگ سنجی قابــل انـدازهگــیری است. ابتدا خونگیری از پنج فرد داوطلب سالم به میزان 5 سی سی صورت گرفت. سپس لایه لنفوسیتی با استفاده از فایکول جداسازی شد. شمارش سلولی انجام گردید و تعداد سلول در محیط کشت حاوی ده درصد سرم جنین گوساله به نحوی تنظیم گردید که در هر چاهک 105 سلول در حجم 80 میکرولیتر برده شود. سپس 10 میکرولیتر فیتوهماگلوتینین (PHA) (گیبکو) که 1 به 175 رقیق شده بود به هر چاهک بهجز چاهک کنترل منفی اضافه گردید تا لنفوسیتها فعال گردند. همزمان 10 میکرولیتر عصاره با غلظتهای متفاوت اضافه شد و پلیت بهمدت 48 ساعت در انکوباتور گذاشته شد. سپس 10 میکرولیتر BrdU به آن اضافه شد و 18 ساعت در انکوباتور قرار گرفت و در انتها محلول آنتیبادی ضد BrdU اضافه شد. آنگاه جذب نــوری در طـول مـوج 450 نانومتر خوانده شد. سلولهایی که نه فیتو هماگلوتینین و نه عصاره گرفته بودند بهعنوان کنترل منفی و سلولهایی که تنها فیتوهماگلوتینین بدون اضافه نمودن عصاره گرفته بودند بهعنوان کنترل مثبت در نظر گرفته شدند.
بررسی زنده بودن لنفوسیتها به روش رنگآمیزی با پروپیدیوم یدید: لنفوسیتها مشابه تست تکثیر لنفوسیتی در حضور محرک و عصاره به مدت 48 ساعت کشت داده شدند. سپس 10 میکرولیتر محلول پروپیدیوم یدید (1 میکروگرم در میلیلیتر)(سیگما) به لولهها اضافه شده و با دستگاه فلوسایتومتری میزان ورود رنگ پروپیدیوم یدید به درون سلولهای مرده مورد ارزیابی قرار گرفت. سلولهایی که نه فیتوهماگلوتینین و نه عصاره گرفته بودند بهعنوان کنترل منفی و سلولهایی که تنها فیتوهماگلوتینین بدون اضافه نمودن عصاره گرفته بودند بهعنوان کنترل مثبت در نظر گرفته شدند.در این روش به گروهی از سلولهای تحریک شده داروی سیتوتوکسیک سیسپلاتین اضافه گردید.
ارزیابی تولید سیتوکاین¬های اینترفرون گاما و اینترلوکین 4 به روش الیزا: لنفوسیتها مشابه تست تکثیر لنفوسیتی در حضور محرک و عصاره بهمدت 48 ساعت کشت داده شدند. سپس پلیت بهمدت 5 دقیقه با دور 1500 سانتریفوژ شد و سوپ رویی سلولها به آرامی جدا گردید و در دمای 80- درجه ساتیگراد فریز گردید. میزان تولید سیتوکاینهای اینترفرون گاما و اینترلوکین 4 تولید شده از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین با روش الیزا با استفاده از کیت تجاری (ایبیوساینس، آمریکا) و طبق دستورالعمل کیت مورد ارزیابی قرار گرفت. میزان هر یک از سیتوکاینها، با استفاده از منحنی استاندارد تعیین گردید. قابل ذکر است که حساسیت کیتهای مورد استفاده جهت اینترفرون گاما و اینترلوکین 4 به ترتیب 4 و 2 پیکوگرم در میلیلیتر بود.
تجزیه و تحلیل آماری
در این مطالعه تجربی نتایج بهصورت Mean ± SE حداقل دو آزمایش گزارش شده است. معنیدار بودن نتایج با استفاده از نرم افزار گراف پد و آزمونهای آماری استیودنت تی تست و آنالیز واریانس یک طرفه ارزیابی و (0/05≥p) به عنوان تفاوت معنیدار در نظر گرفته شده است.
ملاحظات اخلاقی
این طرح در کمیته اخلاق دانشگاه علوم پزشکی شیراز با کد IR-SUMS.REC.1393.7282 مورد تایید قرار گرفته است.
نتایج
تاثیر عصاره شیره انجیر بر میزان رشد ردههای سلولی به روش MTT: در این مطالعه اثر عصاره شیره انجیر بر ردههای سلولی مختلف بهروش MTTبررسی گردید. همانطور که در نمودار 1 مشاهده میگردد این عصاره با افزایش غلظت تاثیر بیشتری بر مهار رشد سلولها داشته است. همچنین مطابق نمودار مشاهده میگردد که عصاره شیره انجیر تاثیر بیشتری بر مهار رشد سلولهای K562 نسبت به سایر ردههای سلولی داشته است. در جدول 1 نتایج حاصل از محاسبه IC50 نشان داده شده است. در نمودار 2 نیز این نتایج بهصورت هیستوگرام نمایش داده شده است. براساس نمودار 2 و جدول 1، شیره انجیر در غلظت 234 میکروگرم در میلیلیتر قادر به مهار رشد 50 درصد از سلولهای K562 شده است. در مورد سایر ردهها، در غلظت 389 میکروگرم در میلیلیتر رده Jurkat، غلظت 528 میکروگرم در میلیلیتر رده Fen، غلظت 812 میکروگرم در میلیلیتر رده Raji و در غلظت بیش از هزار میکروگرم در میلیلیتر 50 درصد رشد سلولهای رده Hela را مهار نمود. به این ترتیب این شیره دارای بیشرین اثر مهاری بر رشد سلولهای K562 و دارای کمترین اثر مهاری بر رشد سلولهای Hela بود.
تاثیر غلظتهای مختلف عصاره شیره انجیر بر تکثیر لنفوسیتهای خون محیطی به روش Brdu: در این روش لنفوسیتها با فیتوهماگلوتینین که میتوژن محرک سلولهای T است تحریک شدند و در مجاورت غلظتهای مختلف عصاره به مدت 48 ساعت قرار گرفتند. همانگونه که در نمودار 2 نشان داده شده است با افزایش غلظت عصاره، تکثیر لنفوسیتی نیز کاهش یافته است بهطوریکه میزان ایندکس پرولیفراسیون از0/06±1/2 در غلظت 0/1 میکروگرم در میلیلیتر به 0/2±0/13 در غلظت 800 میکروگرم در میلیلیتر عصاره رسیده است.
تاثیر غلظتهای مختلف عصاره شیره انجیر برمیزان زنده بودن لنفوسیتهای خون محیطی به روش رنگآمیزی با پروپیدیوم یدید: در این روش پس از آنکه لنفوسیتها با فیتوهماگلوتینین تحریک شدند در مجاورت غلظتهای مختلف عصاره به مدت 48 ساعت قرار گرفتند و سپس با پروپیدیوم یدید رنگآمیزی و توسط دستگاه فلوسیتومتری مورد آنالیز قرار گرفتند. براساس نمودار 3 همانطور که مشاهده میشود عصاره مورد نظر تنها در غلظت 400 میکروگرم در میلیلیتر و بیشتر از آن بهصورت معناداری (0/05>p) اثر کشندگی در لنفوسیتهای خون محیطی داشته است. در این غلظت 10/4±26/25 درصد از سلولها از بین رفتهاند. همانگونه که در این نمودار نشان داده شده است تفاوت معنیداری در درصد سلولهای مرده (PI positive) بین سلولهای تیمار شده با غلظتهای کمتر از 400 میکروگرم در میلیلیتر عصاره و گروه سلولهای کنترل منفی و مثبت مشاهده نمیگردد. این نتایج نشانگر آن است که عصاره در غلظتهای کمتر از 400 میکروگرم در میلیلیتر دارای اثر مهاری بر رشد سلولها و در غلظتهای بالا تر دارای اثر توکسیک میباشد. در نمودار 4 نمودارهای نقطهای (dot plot) مربوط به یک بار آنالیز سلولهای رنگآمیزی شده با پروپیدیوم یدید بهعنوان نمونه نشان داده شده است.
تاثیر غلظتهای مختلف عصاره شیره انجیر بر میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4: در این روش پس از آنکه لنفوسیتها با فیتوهماگلوتینین تحریک شدند در مجاورت غلظتهای مختلف عصاره بهمدت 48 ساعت قرار گرفتند و سپس میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین بهروش الیزا مورد ارزیابی قرار گرفت. مطابق با نمودار 5، مشاهده میشود که هر سه غلظت 200،100 و 400 میکروگرم در میلیلیتر از شیره انجیر قادر به مهار و کاهش معنادار ترشح اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده در مقایسه با کنترل مثبت بودهاند. بهطوریکه میزان این سیتوکاین از مقدار 2/2±245 پیکوگرم در میلیلیتر در کنترل مثبت به 0/6±15 پیکوگرم در میلیلیتر در غلظت 400 میکروگرم عصاره کاهش یافته است. در مورد اینترلوکین 4 نیز براساس نمودار 6 میزان تولید این سایتوکاین نیز در هر سه غلظت بهطور معناداری نسبت به کنترل مثبت کاهش یافته است. میزان این سیتوکاین که در کنترل مثبت 0/4±47/3 پیکوگرم در میلیلیتر بوده است در غلظت 400 میکروگرم عصاره به 1/2±18/9 پیکوگرم در میلیلیتر رسید.

نمودار 1: اثر مهاری عصاره شیره انجیر بر رده هایسلولی مختلف در زمان 48 ساعت.
جدول 1: میزان IC50 عصاره شیره انجیر بر رشد ردههای سلولی در مقایسه با یکدیگر


نمودار 2: اثر غلظتهای مختلف عصاره شیره انجیر بر تکثیر لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین به روش BrdU. کنترل مثبت حاوی سلول و فیتوهماگلوتینین بدون عصاره میباشد. 0/05>p* و 0/001>***p در مقایسه با کنترل مثبت.

نمودار 3: اثر غلظتهای مختلف عصاره شیره انجیر بر میزان از بین رفتن لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین به روش فلوسیتومتری با رنگآمیزی پروپیدیوم یدید. کنترل منفی (C-)فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد. سیسپلاتین Cis;. p<0/05* و 0/01>P** در مقایسه با کنترل مثبت


نمودار 4: نمودار فلوسایتومتری تاثیر غلظتهای مختلف عصاره شیره انجیر بر بقای لنفوسیتهای خون محیطی رنگآمیزی شده باپروپیدیوم یدید. کنترل منفی فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت حاوی فیتوهماگلوتینین و فاقد عصاره میباشد.
سلولها در مربع سمت چپ بالا به عنوان مرده (PI positive) در نظر گرفته شدهاند.
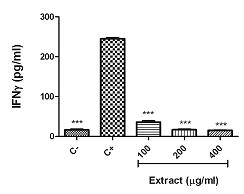
نمودار 5: اثر غلظتهای مختلف عصاره شیره انجیر بر میزان تولید اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین. کنترل منفی (C-) فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد. 0/001> p *** در مقایسه با کنترل مثبت.
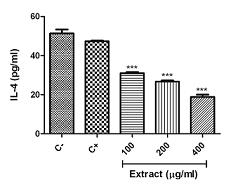
نمودار 6: اثر غلظتهای مختلف شیره گیاه انجیر بر میزان تولید اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین.
کنترل منفی (C-)فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد.
0/001> p *** در مقایسه با کنترل مثبت
بحث
گیاهان دارویی با سابقه طولانی در ایران در درمان بیماریهای مختلف استفاده میشوند. انسان متمدن امروزی با توجه به پیشرفت علم و تولید داروها و مواد شیمیایی بهدلیل عوارض جانبی کمتر و بهره اقتصادی بیشتر و تمایل به استفاده از فرآوردههای طبیعی در درمان بیماریها دوباره در دامن طبیعت به جستجوی گیاهان دارویی و سنتی بازگشته است. تحقیقات مختلف نشان داده است که برخی از گیاهان دارویی دارای خواص ایمونومدولاتوری هستند. هماکنون فرآوردههای متعددی با منشاء گیاهی بهعنوان محرک سیستم ایمنی در اشکال دارویی مختلف در بازار موجود است. همچنین فراوردههایی با خواص ضد التهابی مورد استفاده قرار میگیرند. از طرفی دیگر افزایش تعداد مبتلایان به سرطان در سطح جهان، سرطان را بهعنوان یک معضل بهداشتی در سطح جهانی مطرح نموده و مبارزه با آن را جزء اولویتهای بهداشتی درمانی قرار گرفته است (7). تاکنون تحقیقات گستردهای جهت دستیابی به داروهای ضد سرطان از منابع گیاهی صورت گرفته است، بهعنوان مثال ترکیبات موجود در گیاه پروانش (Vinca rosea) شامل 30 آلکالوئید است که از میان آنها وینکریستین و وینبلاستین کاربرد بالینی پیدا نمودهاند (8). در مطالعهای که متولیزاده اردکانی و همکاران انجام دادهاند کتابهای الحاوی (رازی)، قانون در طب (ابن سینا)، مخزن الادویه (عقیلی خراسانی) و اختیارات بدیعی (انصاری شیرازی) مورد بررسی قرار است و داروهای مورد استفاده در طب سنتی جهت درمان سرطان را استخراج کردهاند. در این مطالعه، 102 گیاه داروئی برای در مان سرطان معرفی شدهاند که یکی از این گیاهان انجیر میباشد (9). میوه تازه و خشک شده انجیر هر دو شامل مقادیر زیادی ترکیبات پلیفنولیک هستند و منبعی غنی از آنتیاکسیدانها برای انسان میباشند (10). در مطالعات مختلف گیاهانی که دارای عملکرد آنتیاکسیدانی بودهاند اثرات ضد سرطانی نیز از خود نشان دادهاند و توانستهاند تکثیر برخی ردههای سلولهای سرطانی را مهار کنند (11-12)، بر همین اساس میتوان بیان داشت که گیاه انجیر با توجه به اثر قوی آنتیاکسیدانی، میتواند اثر ضد سرطانی مناسبی نیز داشته باشد. در مطالعه حاضر شیره انجیر توانست بر رشد ردههای سلولی Fen، K562، Hela، Jurkat و Raji تاثیر بگذارد. نتایج حاصل نشاندهنده رابطه مستقیم میان غلظت عصاره با مهار رشد سلولها بود و البته عصاره شیره انجیر بیشترین تاثیر مهاری را بر رشد سلولهای K562 که یک رده سلولی سرطان لنفوئیدی خون است داشت. بهطوریکه این عصاره در غلظت 234 میکروگرم در میلیلیتر رشد 50 درصد از سلولهای K562 را مهار نمود. کمترین اثر مهاری این شیره بر سلولهای Hela با IC50 بیش از هزار میکروگرم در میلیلیتر بود. در یک مطالعه دیگر که توسط خدارحمی و همکاران انجام گردیده است نیز اثر عصاره شیره درخت انجیر بر رده سلولی Hela مورد بررسی قرارگرفته است و اثرات سیتوتوکسیک این عصاره با IC50 معادل 17 میکروگرم در میلیلیتر گزارش شده است. این تفاوت از یک سو میتواند بهدلیل اختلاف در ترکیبات موثره گیاه که در مناطق مختلف رویش مییابد باشد و از سوی دیگر به احتمال زیاد مرتبط با نوع عصاره است چرا که در مطالعه خدارحمی و همکاران عصاره مورد بررسی شیره درخت انجیر بوده است در حالیکه در مطالعه حاضر شیره میوه انجیر مورد بررسی قرار گرفته است (13). در مطالعهای که قندهاری و همکار انجام دادهاند عصاره انجیر باعث کاهش اندازه تومور پستان در رت گردید (14). در مطالعه تزکان نیز اثر شیره انجیر بر بیان مولکولی به نام Led-7d گزارش شده است که میتواند نشانگر اثر ضد متاستازی این عصاره باشد (15). شیره انجیر در همراهی با اشعه فرابنفش میزان زنده بودن سلولهای ملانومایی A375 را نیز کاهش داده است (16). بهمنظور بررسی تأثیر ایمونومدولاتوری عصاره، ابتدا تاثیر آن بر تکثیر لنفوسیتها بررسی شد که نتایج نشاندهنده کاهش تکثیر لنفوسیتی با افزایش غلظت عصاره بود. به منظور بررسی آنکه این اثر ناشی از مهار تکثیر و رشد لنفوسیتها و یا به دلیل اثرات سیتوتوکسیک عصاره است، زنده بودن لنفوسیتها به روش رنگآمیزی با پروپیدیوم یدید پس از قرار گرفتن در برابر غلظتهای مختلف عصاره بهوسیله دستگاه فلوسیتومتری بررسی و میزان ورود رنگ پروپیدیوم یدید به درون سلولهای مرده مورد ارزیابی قرار گرفت. عصاره مورد نظر تنها در غلظت 400 میکروگرم در میلیلیتر و بیشتر از آن بهصورت معناداری (0/05>p) اثرکشندگی در لنفوسیتهای خون محیطی داشت و تفاوت معنیداری در درصد سلولهای مرده بین سلولهای تیمار شده با غلظتهای کمتر از 400 میکروگرم در میلیلیتر عصاره و گروه سلولهای کنترل مشاهده نگردید. این نتایج نشان میدهد که عصاره در غلظتهای کمتر از 400 میکروگرم در میلیلیتر دارای اثر مهاری بر رشد سلولها و در غلظتهای بالاتر دارای اثر سیتوکسیک میباشد. بر حسب اطلاعات ما تاکنون تاثیر شیره انجیر بر لنفوسیتهای خون محیطی بررسی نشده است اما در یک مطالعه روی نوع دیگری از انجیر اثرات تحریکی مشاهده گردیده است. مطالعهای که در سال 2006 بر روی اثر ایمونومدولاتوری عصاره متانولی ریشه Ficus benghalensis در موشها انجام شده است غلظتهای مختلف عصاره متانولی در موش موجب افزایش فعالیت ایمنی سلولی و همورال شد که این افزیش فعالیت در ارتباط مستقیم با دوز عصاره بود. همچنین در مطالعه آزمایشگاهی، این عصاره قادر به افزایش فعالیت فاگوسیتی سلول های نوتروفیل انسانی بود (17). در یک مطالعه درون تنی که ویکاس و همکاران بر روی موش با گروه شاهد و مداخله انجام دادند بیان شده است که عصاره اتانولی برگ گیاه انجیر اثر تحریکی بر روی فعالیت سیستم ایمنی سلولی و همورال دارد (18). این نتایج نشانگر اثرات متفاوت اجزای مختلف درخت انجیر بر سیستم ایمنی میباشد. ترشح سیتوکینها از اولین نشانه های پاسخ سلولهایT بهمواد محرک ایمنی است. سلولهای T کمکی (T helper) بعد از تمایز به دو گروه Th1 و Th2 در طی پاسخ اولیه سیتوکینهای متفاوتی را تولید میکنند. سلولهایTh1 تولیدکننده اینترفرون گاما میباشند که از عوامل مهم فعالسازی ماکروفاژها میباشد. سلولهای Th2 نیز اینترلوکین 4 میسازند که در پاسخ ایمنی هومورال نقش مهمی را ایفا مینمایند. طیف سیتوکینهای تولید شده توسط زیر گروههای سلولهای T کمکی نقش مهمی در کنترل پاسخهای ایمنی ایفا میکند. در این مطالعه میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین با روش الیزا اندازهگیری شد. نتایج نشان داد که هر سه غلظت 100، 200 و 400 میکروگرم در میلیلیتر از شیره انجیر قادر به مهار و کاهش معنادار ترشح اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده در مقایسه با کنترل مثبت بودند. در مورد اینترلوکین 4 نیز میزان تولید این سایتوکاین در هر سه غلظت بهطور معناداری نسبت بهکنترل مثبت کاهش یافت. قابل ذکر است که به دلیل آنکه غلظت 400 میکروگرم در میلیلیتر عصاره در رنگآمیزی با رنگ پروپیدیوم یدید اثرات توکسیک نشان داد لذا کاهش تولید سایتوکاینها در این غلظت احتمالاً مرتبط با اثرات توکسیک عصاره است. بر حسب اطلاعات ما تاکنون تاثیر شیره انجیر بر لنفوسیتهای خون محیطی بررسی نشده است. در یک مطالعه توسط تیان و همکاران تاثیر پلیساکاریدهای استخراج شده از انجیر بر افزایش تولید اینترلوکین 12 و اینترفرون گاما از سلولهای دندریتیک نشان داده شده است (19). همچنین تاثیر پلی ساکاریدهای انجیر بر افزایش اینترلوکین یک و فاکتور نکروز دهنده تومور (TNF) در ماهی گزارش شده است (20). قابل ذکر است که تاثیر ضد توموری عصاره شیره انجیر در غلظت نسبتاً بالا مشاهده گردید که این امر از یک طرف محدودیت استفاده از آن را میتواند نشان دهد و از طرف دیگر لزوم شناسایی ترکیبات موثره را گوشزد مینماید چراکه امکان دارد ترکیبات موثره در مقادیر کم در عصاره موجود باشند.
نتیجهگیری
در انتها بهعنوان نتیجهگیری میتوان بیان داشت که شیره انجیر دارای اثرات سیتوتوکسیک بر ردههای سلولی سرطانی مورد مطالعه بهخصوص رده لوسمیک K562 بود و لذا میتواند در مطالعات آینده جهت از بین بردن سلولهای سرطانی مورد توجه قرار گیرد. در مورد اثرات ایمونومدولاتوری شیره انجیر نیز میتوان بیان داشت که این عصاره مهارکننده مناسبی برای فعالیت سیستم ایمنی بهخصوص لنفوسیتها میباشد و میتواند در بیماریهای التهابی و مرتبط با سیستم ایمنی مورد توجه و مطالعه بیشتر قرار بگیرد.
سپاسگزاری
این مقاله از پایاننامه دکتری عمومی خانم حمیده اعظمی استخراج و با حمایت مالی دانشگاه علوم پزشکی شیراز (طرح 7282) به انجام رسیده است.
حامی مالی: معاونت پژوهشی دانشگاه علوم پزشکی شیراز
تعارض در منافع: وجود ندارد.
گیاهان دارویی همواره در طول تاریخ نقش بسیار مهمی در بهداشت و سلامت انسان ایفا نمودهاند. امروزه تمایل جهانی بهسمت استفاده از فیتوکمیکالهای طبیعی موجود در گیاهان، میوهها، عصارهها و مشتقات آنها رو به فزونی است. مواد گیاهی طبیعی منبع بسیار مهمی در درمان بیماریهای مختلف از جمله سرطان بودهاند. یکی از گیاهانی که بهطور سنتی برای درمان بیماریهای مختلف از جمله مشکلات گوارشی، التهابات و سرطان استفاده میشد و دارای اثرات محافظتی کبدی و ضدمیکروبی میباشد گیاه انجیر است. درخت انجیر که نام علمی آن Ficus و از خانواده "Moraceae"میباشد دارای 600 گونه است که اغلب انواع آن وحشی یا زینتی هستند (1). گیاه Ficus carica همان انجیر معمولی است که میوه آن را مصرف میکنیم و ایران بهعنوان یکی از بزرگترین تولیدکنندگان آن بهشمار میرود (2). اسـتانهای مهـم تولیـدکننـده انجیر در ایران بـهتـرتیب استان فـارس، لرسـتان، کرمـان، خراسـان، کرمانشاه و سمنان میباشند. ایـن میوه بهطور گستردهای هم بهعنوان یک منبع غذایی و هـم بهعنـوان یـک منبع داروئی در دنیا مصرف میشود. میوه انجیر خـشک و تازه منبـع غنـی از مـواد معـدنی و آنتـیاکـسیدانت مـیباشـد (3). انجیر از نظر طب قدیم ایران گرم و تر است و در مواردی مانند کاهش تب، افزایش تعریق، رفع التهاب مجاری دستگاه تنفسی و کلیه، درمان سرماخوردگی و بیماریهای التهابی، معالجه بیماریهای پوستی و بالاخره سرطان کاربرد داشته است (4). با توجه به محدود بودن مطالعات تجربی و اطلاعات در زمینه اثرات ضد توموری و ایمونومدولاتوری انجیر در این مطالعه تاثیر شیره انجیر سیاه بر چند رده سلولی سرطانی و بر تکثیر لنفوسیتها بررسی گردیده است و بهعلاوه تولید دو سیتوکاین اینترلوکین 4 (IL-4) و اینترفرون گاما (IFNγ) توسط لنفوسیتهای تحریک شده با ماده میتوژن اندازهگیری شده است. اینترلوکین 4 سیتوکاینی است که از زیرگروه لنفوسیتهای Th2 ترشح میشود و در رشد و در رشد و القای فعالیت لنفوسیتهای B در جهت تولید آنتیبادی نقش دارد (5). اینترفرون گاما نیز از زیرگروه Th1 تولید میشود و سیتوکاین اصلی فعالکننده ماکروفاژها برای مقابله با عوامل میکروبی داخل سلولی و سلولهای توموری میباشد (6). مطالعه حاضر میتواند اطلاعات مناسبی را در مورد خواص ایمونومدولاتوری و ضد توموری میوه انجیر در اختیار ما قرار دهد.
روش بررسی
آمادهسازی عصاره شیره انجیر: ابتدا شیره انجیر از درختان انجیر سفید (Ficuscarica) در منطقه استهبان در استان فارس در فصل پاییز جمعآوری گردید. سپس توسط کارشناس گروه فارماکولوژی عصاره متانولی از آن تهیه گردید. عصاره تهیه شده در دی متیل سولفوکسید (DMSO) (سیگما، آمریکا) حل گردید و آنگاه غلظت 20 میلیگرم در میلیلیتر از آن در محیط کشت RPMI (گیبکو، آلمان) تهیه گردید. از محلول بهدست آمده غلظتهای نهایی مختلف از 1-1000 میکروگرم در میلیلیتر در محیط کشت RPMI تهیه گردید.
ردههای سلولی و کشت سلولی: در این مطالعه از پنج رده سلولی سرطانی شامل رده سلولی Fen (سرطان مثانه)، رده سلولی K562 (لوسمی میلوئیدی)، Hela (سرطان سرویکس)، Jurkat (لوسمی لنفوئیدی) و Raji (لنفوم سلولهای B) استفاده گردید. تمام ردههای سلولی فوق در فلاسک کشت سلولی حاوی محیط کشت RPMI 1640 غنی شده با سرم جنین گوساله غیر فعال شده ده درصدی و آنتیبیوتیکهای پنیسیلین به میزان 100 واحد در میلیلیتر و استرپتومایسین بهمیزان 100 میکروگرم در میلیلیتر (شفافارمد، ایران) و در دمای 37 درجه سانتیگراد و محیط مرطوب شامل 5 درصد CO2 کشت داده شدند. برای سلولهایی که حالت چسبنده داشتند مانند Hela و Fen، جهت تهیه سلول از عمل تریپسینه کردن استفاده شد. با تست رنگآمیزی تریپان بلو مشخص شد که 95 درصد سلولها زندهاند.
تست MTT: بهمنظور بررسی اثر مهاری شیره انجیر بر میزان رشد ردههای سلولی، ابتدا تعداد معین شده از هر سلول در هر چاهک با غلظتهای 10 تا 800 میکروگرم در میلیلیتر عصاره به مدت 48 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. سپس 10 میکرولیتر از محلول 5 میکروگرم در میلیلیتر MTT (سیگما) به هر چاهک پلیت اضافه شد. پلیت 4 ساعت در دمای 37 درجه قرار داده شد و در انتها محیط کشت خارج شده و 150 میلیلیتر محلول DMSO جهت حل شدن کریستالهای فورمازان اضافه شد. سلولهای تیمار شده با DMSO (حلالشیره) بهعنوان کنترل منفی و سلولهای تیمار شده با داروی سیتوتوکسیک سیسپلاتین (به میزان 50 میلیگرم در میلیلیتر) بهعنوان کنترل مثبت در نظر گرفته شدند. در انتها جذب نوری چاهکها با دستگاه قرائتکننده الیزا در طول موج 570 نانومتر اندازهگیری شد. درصد مهار رشد برای غلظتهای مختلف عصاره روی هر رده سلولی در مقایسه با کنترل حلال محاسبه و سپس نمودار درصد مهار رشد در مقابل غلظت رسم و با کمک برنامه Curve expert غلظتی از عصاره که پنجاه درصد سلولها از بین رفته باشند (IC50) محاسبه گردید.
تست تکثیر لنفوسیتی: بهمنظور بررسی تأثیر عصاره بر تکثیر لنفوسیتها از روش برومو دی اکسی یوریدین ((BrdU (روشه، آلمان) استفاده گردید. در این روش از برومو دی اکسی یوریدین که آنالوگ تیمیدین است بهعنوان شاخصی برای اندازهگیری میزان تکثیر سـلولی استفاده میشود. این مولکول درمرحلـه سنتز DNA وارد سلولهای جدیـد شـده و بـا آنتیبادی ضد BrdUنوعــی فراورده رنگـــی بـــهوجــود میآورد کـه میـزان جذب نوری آن باروش رنگ سنجی قابــل انـدازهگــیری است. ابتدا خونگیری از پنج فرد داوطلب سالم به میزان 5 سی سی صورت گرفت. سپس لایه لنفوسیتی با استفاده از فایکول جداسازی شد. شمارش سلولی انجام گردید و تعداد سلول در محیط کشت حاوی ده درصد سرم جنین گوساله به نحوی تنظیم گردید که در هر چاهک 105 سلول در حجم 80 میکرولیتر برده شود. سپس 10 میکرولیتر فیتوهماگلوتینین (PHA) (گیبکو) که 1 به 175 رقیق شده بود به هر چاهک بهجز چاهک کنترل منفی اضافه گردید تا لنفوسیتها فعال گردند. همزمان 10 میکرولیتر عصاره با غلظتهای متفاوت اضافه شد و پلیت بهمدت 48 ساعت در انکوباتور گذاشته شد. سپس 10 میکرولیتر BrdU به آن اضافه شد و 18 ساعت در انکوباتور قرار گرفت و در انتها محلول آنتیبادی ضد BrdU اضافه شد. آنگاه جذب نــوری در طـول مـوج 450 نانومتر خوانده شد. سلولهایی که نه فیتو هماگلوتینین و نه عصاره گرفته بودند بهعنوان کنترل منفی و سلولهایی که تنها فیتوهماگلوتینین بدون اضافه نمودن عصاره گرفته بودند بهعنوان کنترل مثبت در نظر گرفته شدند.
بررسی زنده بودن لنفوسیتها به روش رنگآمیزی با پروپیدیوم یدید: لنفوسیتها مشابه تست تکثیر لنفوسیتی در حضور محرک و عصاره به مدت 48 ساعت کشت داده شدند. سپس 10 میکرولیتر محلول پروپیدیوم یدید (1 میکروگرم در میلیلیتر)(سیگما) به لولهها اضافه شده و با دستگاه فلوسایتومتری میزان ورود رنگ پروپیدیوم یدید به درون سلولهای مرده مورد ارزیابی قرار گرفت. سلولهایی که نه فیتوهماگلوتینین و نه عصاره گرفته بودند بهعنوان کنترل منفی و سلولهایی که تنها فیتوهماگلوتینین بدون اضافه نمودن عصاره گرفته بودند بهعنوان کنترل مثبت در نظر گرفته شدند.در این روش به گروهی از سلولهای تحریک شده داروی سیتوتوکسیک سیسپلاتین اضافه گردید.
ارزیابی تولید سیتوکاین¬های اینترفرون گاما و اینترلوکین 4 به روش الیزا: لنفوسیتها مشابه تست تکثیر لنفوسیتی در حضور محرک و عصاره بهمدت 48 ساعت کشت داده شدند. سپس پلیت بهمدت 5 دقیقه با دور 1500 سانتریفوژ شد و سوپ رویی سلولها به آرامی جدا گردید و در دمای 80- درجه ساتیگراد فریز گردید. میزان تولید سیتوکاینهای اینترفرون گاما و اینترلوکین 4 تولید شده از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین با روش الیزا با استفاده از کیت تجاری (ایبیوساینس، آمریکا) و طبق دستورالعمل کیت مورد ارزیابی قرار گرفت. میزان هر یک از سیتوکاینها، با استفاده از منحنی استاندارد تعیین گردید. قابل ذکر است که حساسیت کیتهای مورد استفاده جهت اینترفرون گاما و اینترلوکین 4 به ترتیب 4 و 2 پیکوگرم در میلیلیتر بود.
تجزیه و تحلیل آماری
در این مطالعه تجربی نتایج بهصورت Mean ± SE حداقل دو آزمایش گزارش شده است. معنیدار بودن نتایج با استفاده از نرم افزار گراف پد و آزمونهای آماری استیودنت تی تست و آنالیز واریانس یک طرفه ارزیابی و (0/05≥p) به عنوان تفاوت معنیدار در نظر گرفته شده است.
ملاحظات اخلاقی
این طرح در کمیته اخلاق دانشگاه علوم پزشکی شیراز با کد IR-SUMS.REC.1393.7282 مورد تایید قرار گرفته است.
نتایج
تاثیر عصاره شیره انجیر بر میزان رشد ردههای سلولی به روش MTT: در این مطالعه اثر عصاره شیره انجیر بر ردههای سلولی مختلف بهروش MTTبررسی گردید. همانطور که در نمودار 1 مشاهده میگردد این عصاره با افزایش غلظت تاثیر بیشتری بر مهار رشد سلولها داشته است. همچنین مطابق نمودار مشاهده میگردد که عصاره شیره انجیر تاثیر بیشتری بر مهار رشد سلولهای K562 نسبت به سایر ردههای سلولی داشته است. در جدول 1 نتایج حاصل از محاسبه IC50 نشان داده شده است. در نمودار 2 نیز این نتایج بهصورت هیستوگرام نمایش داده شده است. براساس نمودار 2 و جدول 1، شیره انجیر در غلظت 234 میکروگرم در میلیلیتر قادر به مهار رشد 50 درصد از سلولهای K562 شده است. در مورد سایر ردهها، در غلظت 389 میکروگرم در میلیلیتر رده Jurkat، غلظت 528 میکروگرم در میلیلیتر رده Fen، غلظت 812 میکروگرم در میلیلیتر رده Raji و در غلظت بیش از هزار میکروگرم در میلیلیتر 50 درصد رشد سلولهای رده Hela را مهار نمود. به این ترتیب این شیره دارای بیشرین اثر مهاری بر رشد سلولهای K562 و دارای کمترین اثر مهاری بر رشد سلولهای Hela بود.
تاثیر غلظتهای مختلف عصاره شیره انجیر بر تکثیر لنفوسیتهای خون محیطی به روش Brdu: در این روش لنفوسیتها با فیتوهماگلوتینین که میتوژن محرک سلولهای T است تحریک شدند و در مجاورت غلظتهای مختلف عصاره به مدت 48 ساعت قرار گرفتند. همانگونه که در نمودار 2 نشان داده شده است با افزایش غلظت عصاره، تکثیر لنفوسیتی نیز کاهش یافته است بهطوریکه میزان ایندکس پرولیفراسیون از0/06±1/2 در غلظت 0/1 میکروگرم در میلیلیتر به 0/2±0/13 در غلظت 800 میکروگرم در میلیلیتر عصاره رسیده است.
تاثیر غلظتهای مختلف عصاره شیره انجیر برمیزان زنده بودن لنفوسیتهای خون محیطی به روش رنگآمیزی با پروپیدیوم یدید: در این روش پس از آنکه لنفوسیتها با فیتوهماگلوتینین تحریک شدند در مجاورت غلظتهای مختلف عصاره به مدت 48 ساعت قرار گرفتند و سپس با پروپیدیوم یدید رنگآمیزی و توسط دستگاه فلوسیتومتری مورد آنالیز قرار گرفتند. براساس نمودار 3 همانطور که مشاهده میشود عصاره مورد نظر تنها در غلظت 400 میکروگرم در میلیلیتر و بیشتر از آن بهصورت معناداری (0/05>p) اثر کشندگی در لنفوسیتهای خون محیطی داشته است. در این غلظت 10/4±26/25 درصد از سلولها از بین رفتهاند. همانگونه که در این نمودار نشان داده شده است تفاوت معنیداری در درصد سلولهای مرده (PI positive) بین سلولهای تیمار شده با غلظتهای کمتر از 400 میکروگرم در میلیلیتر عصاره و گروه سلولهای کنترل منفی و مثبت مشاهده نمیگردد. این نتایج نشانگر آن است که عصاره در غلظتهای کمتر از 400 میکروگرم در میلیلیتر دارای اثر مهاری بر رشد سلولها و در غلظتهای بالا تر دارای اثر توکسیک میباشد. در نمودار 4 نمودارهای نقطهای (dot plot) مربوط به یک بار آنالیز سلولهای رنگآمیزی شده با پروپیدیوم یدید بهعنوان نمونه نشان داده شده است.
تاثیر غلظتهای مختلف عصاره شیره انجیر بر میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4: در این روش پس از آنکه لنفوسیتها با فیتوهماگلوتینین تحریک شدند در مجاورت غلظتهای مختلف عصاره بهمدت 48 ساعت قرار گرفتند و سپس میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین بهروش الیزا مورد ارزیابی قرار گرفت. مطابق با نمودار 5، مشاهده میشود که هر سه غلظت 200،100 و 400 میکروگرم در میلیلیتر از شیره انجیر قادر به مهار و کاهش معنادار ترشح اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده در مقایسه با کنترل مثبت بودهاند. بهطوریکه میزان این سیتوکاین از مقدار 2/2±245 پیکوگرم در میلیلیتر در کنترل مثبت به 0/6±15 پیکوگرم در میلیلیتر در غلظت 400 میکروگرم عصاره کاهش یافته است. در مورد اینترلوکین 4 نیز براساس نمودار 6 میزان تولید این سایتوکاین نیز در هر سه غلظت بهطور معناداری نسبت به کنترل مثبت کاهش یافته است. میزان این سیتوکاین که در کنترل مثبت 0/4±47/3 پیکوگرم در میلیلیتر بوده است در غلظت 400 میکروگرم عصاره به 1/2±18/9 پیکوگرم در میلیلیتر رسید.

نمودار 1: اثر مهاری عصاره شیره انجیر بر رده هایسلولی مختلف در زمان 48 ساعت.
جدول 1: میزان IC50 عصاره شیره انجیر بر رشد ردههای سلولی در مقایسه با یکدیگر


نمودار 2: اثر غلظتهای مختلف عصاره شیره انجیر بر تکثیر لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین به روش BrdU. کنترل مثبت حاوی سلول و فیتوهماگلوتینین بدون عصاره میباشد. 0/05>p* و 0/001>***p در مقایسه با کنترل مثبت.

نمودار 3: اثر غلظتهای مختلف عصاره شیره انجیر بر میزان از بین رفتن لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین به روش فلوسیتومتری با رنگآمیزی پروپیدیوم یدید. کنترل منفی (C-)فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد. سیسپلاتین Cis;. p<0/05* و 0/01>P** در مقایسه با کنترل مثبت


نمودار 4: نمودار فلوسایتومتری تاثیر غلظتهای مختلف عصاره شیره انجیر بر بقای لنفوسیتهای خون محیطی رنگآمیزی شده باپروپیدیوم یدید. کنترل منفی فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت حاوی فیتوهماگلوتینین و فاقد عصاره میباشد.
سلولها در مربع سمت چپ بالا به عنوان مرده (PI positive) در نظر گرفته شدهاند.

نمودار 5: اثر غلظتهای مختلف عصاره شیره انجیر بر میزان تولید اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین. کنترل منفی (C-) فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد. 0/001> p *** در مقایسه با کنترل مثبت.

نمودار 6: اثر غلظتهای مختلف شیره گیاه انجیر بر میزان تولید اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین.
کنترل منفی (C-)فاقد عصاره و فیتوهماگلوتینین و کنترل مثبت (C+) حاوی فیتوهماگلوتینین و فاقد عصاره میباشد.
0/001> p *** در مقایسه با کنترل مثبت
بحث
گیاهان دارویی با سابقه طولانی در ایران در درمان بیماریهای مختلف استفاده میشوند. انسان متمدن امروزی با توجه به پیشرفت علم و تولید داروها و مواد شیمیایی بهدلیل عوارض جانبی کمتر و بهره اقتصادی بیشتر و تمایل به استفاده از فرآوردههای طبیعی در درمان بیماریها دوباره در دامن طبیعت به جستجوی گیاهان دارویی و سنتی بازگشته است. تحقیقات مختلف نشان داده است که برخی از گیاهان دارویی دارای خواص ایمونومدولاتوری هستند. هماکنون فرآوردههای متعددی با منشاء گیاهی بهعنوان محرک سیستم ایمنی در اشکال دارویی مختلف در بازار موجود است. همچنین فراوردههایی با خواص ضد التهابی مورد استفاده قرار میگیرند. از طرفی دیگر افزایش تعداد مبتلایان به سرطان در سطح جهان، سرطان را بهعنوان یک معضل بهداشتی در سطح جهانی مطرح نموده و مبارزه با آن را جزء اولویتهای بهداشتی درمانی قرار گرفته است (7). تاکنون تحقیقات گستردهای جهت دستیابی به داروهای ضد سرطان از منابع گیاهی صورت گرفته است، بهعنوان مثال ترکیبات موجود در گیاه پروانش (Vinca rosea) شامل 30 آلکالوئید است که از میان آنها وینکریستین و وینبلاستین کاربرد بالینی پیدا نمودهاند (8). در مطالعهای که متولیزاده اردکانی و همکاران انجام دادهاند کتابهای الحاوی (رازی)، قانون در طب (ابن سینا)، مخزن الادویه (عقیلی خراسانی) و اختیارات بدیعی (انصاری شیرازی) مورد بررسی قرار است و داروهای مورد استفاده در طب سنتی جهت درمان سرطان را استخراج کردهاند. در این مطالعه، 102 گیاه داروئی برای در مان سرطان معرفی شدهاند که یکی از این گیاهان انجیر میباشد (9). میوه تازه و خشک شده انجیر هر دو شامل مقادیر زیادی ترکیبات پلیفنولیک هستند و منبعی غنی از آنتیاکسیدانها برای انسان میباشند (10). در مطالعات مختلف گیاهانی که دارای عملکرد آنتیاکسیدانی بودهاند اثرات ضد سرطانی نیز از خود نشان دادهاند و توانستهاند تکثیر برخی ردههای سلولهای سرطانی را مهار کنند (11-12)، بر همین اساس میتوان بیان داشت که گیاه انجیر با توجه به اثر قوی آنتیاکسیدانی، میتواند اثر ضد سرطانی مناسبی نیز داشته باشد. در مطالعه حاضر شیره انجیر توانست بر رشد ردههای سلولی Fen، K562، Hela، Jurkat و Raji تاثیر بگذارد. نتایج حاصل نشاندهنده رابطه مستقیم میان غلظت عصاره با مهار رشد سلولها بود و البته عصاره شیره انجیر بیشترین تاثیر مهاری را بر رشد سلولهای K562 که یک رده سلولی سرطان لنفوئیدی خون است داشت. بهطوریکه این عصاره در غلظت 234 میکروگرم در میلیلیتر رشد 50 درصد از سلولهای K562 را مهار نمود. کمترین اثر مهاری این شیره بر سلولهای Hela با IC50 بیش از هزار میکروگرم در میلیلیتر بود. در یک مطالعه دیگر که توسط خدارحمی و همکاران انجام گردیده است نیز اثر عصاره شیره درخت انجیر بر رده سلولی Hela مورد بررسی قرارگرفته است و اثرات سیتوتوکسیک این عصاره با IC50 معادل 17 میکروگرم در میلیلیتر گزارش شده است. این تفاوت از یک سو میتواند بهدلیل اختلاف در ترکیبات موثره گیاه که در مناطق مختلف رویش مییابد باشد و از سوی دیگر به احتمال زیاد مرتبط با نوع عصاره است چرا که در مطالعه خدارحمی و همکاران عصاره مورد بررسی شیره درخت انجیر بوده است در حالیکه در مطالعه حاضر شیره میوه انجیر مورد بررسی قرار گرفته است (13). در مطالعهای که قندهاری و همکار انجام دادهاند عصاره انجیر باعث کاهش اندازه تومور پستان در رت گردید (14). در مطالعه تزکان نیز اثر شیره انجیر بر بیان مولکولی به نام Led-7d گزارش شده است که میتواند نشانگر اثر ضد متاستازی این عصاره باشد (15). شیره انجیر در همراهی با اشعه فرابنفش میزان زنده بودن سلولهای ملانومایی A375 را نیز کاهش داده است (16). بهمنظور بررسی تأثیر ایمونومدولاتوری عصاره، ابتدا تاثیر آن بر تکثیر لنفوسیتها بررسی شد که نتایج نشاندهنده کاهش تکثیر لنفوسیتی با افزایش غلظت عصاره بود. به منظور بررسی آنکه این اثر ناشی از مهار تکثیر و رشد لنفوسیتها و یا به دلیل اثرات سیتوتوکسیک عصاره است، زنده بودن لنفوسیتها به روش رنگآمیزی با پروپیدیوم یدید پس از قرار گرفتن در برابر غلظتهای مختلف عصاره بهوسیله دستگاه فلوسیتومتری بررسی و میزان ورود رنگ پروپیدیوم یدید به درون سلولهای مرده مورد ارزیابی قرار گرفت. عصاره مورد نظر تنها در غلظت 400 میکروگرم در میلیلیتر و بیشتر از آن بهصورت معناداری (0/05>p) اثرکشندگی در لنفوسیتهای خون محیطی داشت و تفاوت معنیداری در درصد سلولهای مرده بین سلولهای تیمار شده با غلظتهای کمتر از 400 میکروگرم در میلیلیتر عصاره و گروه سلولهای کنترل مشاهده نگردید. این نتایج نشان میدهد که عصاره در غلظتهای کمتر از 400 میکروگرم در میلیلیتر دارای اثر مهاری بر رشد سلولها و در غلظتهای بالاتر دارای اثر سیتوکسیک میباشد. بر حسب اطلاعات ما تاکنون تاثیر شیره انجیر بر لنفوسیتهای خون محیطی بررسی نشده است اما در یک مطالعه روی نوع دیگری از انجیر اثرات تحریکی مشاهده گردیده است. مطالعهای که در سال 2006 بر روی اثر ایمونومدولاتوری عصاره متانولی ریشه Ficus benghalensis در موشها انجام شده است غلظتهای مختلف عصاره متانولی در موش موجب افزایش فعالیت ایمنی سلولی و همورال شد که این افزیش فعالیت در ارتباط مستقیم با دوز عصاره بود. همچنین در مطالعه آزمایشگاهی، این عصاره قادر به افزایش فعالیت فاگوسیتی سلول های نوتروفیل انسانی بود (17). در یک مطالعه درون تنی که ویکاس و همکاران بر روی موش با گروه شاهد و مداخله انجام دادند بیان شده است که عصاره اتانولی برگ گیاه انجیر اثر تحریکی بر روی فعالیت سیستم ایمنی سلولی و همورال دارد (18). این نتایج نشانگر اثرات متفاوت اجزای مختلف درخت انجیر بر سیستم ایمنی میباشد. ترشح سیتوکینها از اولین نشانه های پاسخ سلولهایT بهمواد محرک ایمنی است. سلولهای T کمکی (T helper) بعد از تمایز به دو گروه Th1 و Th2 در طی پاسخ اولیه سیتوکینهای متفاوتی را تولید میکنند. سلولهایTh1 تولیدکننده اینترفرون گاما میباشند که از عوامل مهم فعالسازی ماکروفاژها میباشد. سلولهای Th2 نیز اینترلوکین 4 میسازند که در پاسخ ایمنی هومورال نقش مهمی را ایفا مینمایند. طیف سیتوکینهای تولید شده توسط زیر گروههای سلولهای T کمکی نقش مهمی در کنترل پاسخهای ایمنی ایفا میکند. در این مطالعه میزان تولید سایتوکاینهای اینترفرون گاما و اینترلوکین 4 از لنفوسیتهای خون محیطی تحریک شده با فیتوهماگلوتینین با روش الیزا اندازهگیری شد. نتایج نشان داد که هر سه غلظت 100، 200 و 400 میکروگرم در میلیلیتر از شیره انجیر قادر به مهار و کاهش معنادار ترشح اینترفرون گاما از لنفوسیتهای خون محیطی تحریک شده در مقایسه با کنترل مثبت بودند. در مورد اینترلوکین 4 نیز میزان تولید این سایتوکاین در هر سه غلظت بهطور معناداری نسبت بهکنترل مثبت کاهش یافت. قابل ذکر است که به دلیل آنکه غلظت 400 میکروگرم در میلیلیتر عصاره در رنگآمیزی با رنگ پروپیدیوم یدید اثرات توکسیک نشان داد لذا کاهش تولید سایتوکاینها در این غلظت احتمالاً مرتبط با اثرات توکسیک عصاره است. بر حسب اطلاعات ما تاکنون تاثیر شیره انجیر بر لنفوسیتهای خون محیطی بررسی نشده است. در یک مطالعه توسط تیان و همکاران تاثیر پلیساکاریدهای استخراج شده از انجیر بر افزایش تولید اینترلوکین 12 و اینترفرون گاما از سلولهای دندریتیک نشان داده شده است (19). همچنین تاثیر پلی ساکاریدهای انجیر بر افزایش اینترلوکین یک و فاکتور نکروز دهنده تومور (TNF) در ماهی گزارش شده است (20). قابل ذکر است که تاثیر ضد توموری عصاره شیره انجیر در غلظت نسبتاً بالا مشاهده گردید که این امر از یک طرف محدودیت استفاده از آن را میتواند نشان دهد و از طرف دیگر لزوم شناسایی ترکیبات موثره را گوشزد مینماید چراکه امکان دارد ترکیبات موثره در مقادیر کم در عصاره موجود باشند.
نتیجهگیری
در انتها بهعنوان نتیجهگیری میتوان بیان داشت که شیره انجیر دارای اثرات سیتوتوکسیک بر ردههای سلولی سرطانی مورد مطالعه بهخصوص رده لوسمیک K562 بود و لذا میتواند در مطالعات آینده جهت از بین بردن سلولهای سرطانی مورد توجه قرار گیرد. در مورد اثرات ایمونومدولاتوری شیره انجیر نیز میتوان بیان داشت که این عصاره مهارکننده مناسبی برای فعالیت سیستم ایمنی بهخصوص لنفوسیتها میباشد و میتواند در بیماریهای التهابی و مرتبط با سیستم ایمنی مورد توجه و مطالعه بیشتر قرار بگیرد.
سپاسگزاری
این مقاله از پایاننامه دکتری عمومی خانم حمیده اعظمی استخراج و با حمایت مالی دانشگاه علوم پزشکی شیراز (طرح 7282) به انجام رسیده است.
حامی مالی: معاونت پژوهشی دانشگاه علوم پزشکی شیراز
تعارض در منافع: وجود ندارد.
References:
1- Badgujar SB, Patel VV, Bandivdekar AH, Mahajan RT. Traditional Uses, Phytochemistry and Pharmacology of Ficus Carica: A Review. Pharm Biol 2014; 52(11): 1487-503
2- Barolo MI, Ruiz Mostacero N, López SN. Ficus Carica L. (Moraceae): An Ancient Source of Food and Health. Food Chem 2014; 161: 119-27.
3- Vinson JA, Zubik L, Bose P, Samman N, Proch J. Dried Fruits: Excellent in Vitro and in Vivo Antioxidants. J Am College Nutr 2005; 24: 44-50.
4- Badgujar SB, Patel VV, Bandivdekar AH, Mahajan RT. Traditional Uses, Phytochemistry and Pharmacology of Ficus Carica: A Review. Pharm Biol 2014; 52(11): 1487-503.
5- Touzot M, Cacoub P, Bodaghi B, Soumelis V, Saadoun D. IFN-α Induces IL-10 Production and Tilt the Balance Between Th1 and Th17 in Behçet Disease. Autoimmun Rev 2015; 14(5): 370-5.
6- Walsh GM. Biologics Targeting IL-5, IL-4 or IL-13 for the Treatment of Asthma- An Update. Expert Rev Clin Immunol 2017; 13(2): 143-49.
7- Mousavi SM, Montazeri A, Mohagheghi MA, Jarrahi AM, Harirchi I, Najafi M, et al. Breast Cancer in Iran: An Epidemiological Review. Breast J 2007; 13(4): 383-91.
8- Esmaeilbeig M, Kouhpayeh SA, Amirghofran Z. An Investigation of the Growth Inhibitory Capacity of Several Medicinal Plants from Iran on Tumor Cell Lines. Iran J Cancer Prev. 2015; 8(5): e4032.
9- Motavalizadeh Ardakani A, Hashemi M, Safakish M, Alam Bagheri A, Baradaran Shekohi S, Mosadegh M. Cancer Therapy in Iranian Traditional Medicine. J Trad Med Islam Iran 2012; 3(S1): 1-15.[Persian]
10- Marrelli M, Menichini F, Statti GA, Bonesi M, Duez P, Menichini F, Conforti F. Changes in the Phenolic and Lipophilic Composition, In the Enzyme Inhibition and Antiproliferative Activity of Ficus Carica L. Cultivar Dottato Fruits During Maturation. Food Chem Toxicol 2012; 50(3-4): 726-33.
11- Ju EM, Lee SE, Hwang HJ, Kim JH. Antioxidant and Anticancer Activity of Extract from Betula Platyphylla Var. Japonica. Life Sci 2004; 74(8): 1013-26.
12- Son Y-O, Kim J, Lim J-C, Chung Y, Chung G-H, Lee JC. Ripe Fruits of Solanum Nigrum L. Inhibits Cell Growth and Induces Apoptosis in MCF-7 cells. Food Chem Toxicol 2003; 41(10): 1421-8
13- Khodarahmi GA, Ghasemi N, Hassanzadeh F, Safaie M. Cytotoxic Effects of Different Extracts and Latex of Ficus Carica L. on Hela Cell Line. Iran J Pharmaceut Res 2011; 10(2): 273.
14- Ghandehari F, Fatemi M. The Effect of Ficus Carica Latex on 7, 12-Dimethylbenz (A) Anthracene-Induced Breast Cancer in Rats. Avicenna J Phytomed 2018; 8(4): 286-295.
15- Tezcan G, Tunca B, Bekar A, Yalcin M, Sahin S, Budak F, et al. Ficus Carica Latex Prevents Invasion Through Induction of Let-7d Expression in GBM Cell Lines. Cell Mol Neurobiol 2015; 35(2): 175-87.
16- Menichini G, Alfano C, Provenzano E, Marrelli M, Statti GA, Somma F, Menichini F, Conforti F. Fig Latex (Ficus Carica L. Cultivar Dottato) in Combination with UV Irradiation Decreases the Viability of A375 Melanoma Cells in Vitro. Anticancer Agents Med Chem 2012; 12(8): 959-65.
17- Gabhe S, Tatke P, Khan T. Evaluation of the Immunomodulatory Activity of the Methanol Extract of Ficus Benghalensis Roots in Rats. Indian J Pharmacol 2006; 38(4): 271.
18- Patil VV, Bhangale SC, Patil VR. Studies on Immunomodulatory Activity of Ficus Carica. Int J Pharm Pharm Sci 2010; 2(4): 97-9.
19- Tian J, Zhang Y, Yang X, Rui K, Tang X, Ma J, Chen J, Xu H, Lu L, Wang S. Ficus Carica Polysaccharides Promote the Maturation and Function of Dendritic Cells. Int J Mol Sci 2014; 15(7): 12469-79.
20- Yang X, Guo JL, Ye JY, Zhang YX, Wang W. The Effects of Ficus Carica Polysaccharide on Immune Response and Expression of Some Immune-Related Genes in Grass Carp, Ctenopharyngodon Idella. Fish Shellfish Immunol 2015; 42(1): 132-7.
1- Badgujar SB, Patel VV, Bandivdekar AH, Mahajan RT. Traditional Uses, Phytochemistry and Pharmacology of Ficus Carica: A Review. Pharm Biol 2014; 52(11): 1487-503
2- Barolo MI, Ruiz Mostacero N, López SN. Ficus Carica L. (Moraceae): An Ancient Source of Food and Health. Food Chem 2014; 161: 119-27.
3- Vinson JA, Zubik L, Bose P, Samman N, Proch J. Dried Fruits: Excellent in Vitro and in Vivo Antioxidants. J Am College Nutr 2005; 24: 44-50.
4- Badgujar SB, Patel VV, Bandivdekar AH, Mahajan RT. Traditional Uses, Phytochemistry and Pharmacology of Ficus Carica: A Review. Pharm Biol 2014; 52(11): 1487-503.
5- Touzot M, Cacoub P, Bodaghi B, Soumelis V, Saadoun D. IFN-α Induces IL-10 Production and Tilt the Balance Between Th1 and Th17 in Behçet Disease. Autoimmun Rev 2015; 14(5): 370-5.
6- Walsh GM. Biologics Targeting IL-5, IL-4 or IL-13 for the Treatment of Asthma- An Update. Expert Rev Clin Immunol 2017; 13(2): 143-49.
7- Mousavi SM, Montazeri A, Mohagheghi MA, Jarrahi AM, Harirchi I, Najafi M, et al. Breast Cancer in Iran: An Epidemiological Review. Breast J 2007; 13(4): 383-91.
8- Esmaeilbeig M, Kouhpayeh SA, Amirghofran Z. An Investigation of the Growth Inhibitory Capacity of Several Medicinal Plants from Iran on Tumor Cell Lines. Iran J Cancer Prev. 2015; 8(5): e4032.
9- Motavalizadeh Ardakani A, Hashemi M, Safakish M, Alam Bagheri A, Baradaran Shekohi S, Mosadegh M. Cancer Therapy in Iranian Traditional Medicine. J Trad Med Islam Iran 2012; 3(S1): 1-15.[Persian]
10- Marrelli M, Menichini F, Statti GA, Bonesi M, Duez P, Menichini F, Conforti F. Changes in the Phenolic and Lipophilic Composition, In the Enzyme Inhibition and Antiproliferative Activity of Ficus Carica L. Cultivar Dottato Fruits During Maturation. Food Chem Toxicol 2012; 50(3-4): 726-33.
11- Ju EM, Lee SE, Hwang HJ, Kim JH. Antioxidant and Anticancer Activity of Extract from Betula Platyphylla Var. Japonica. Life Sci 2004; 74(8): 1013-26.
12- Son Y-O, Kim J, Lim J-C, Chung Y, Chung G-H, Lee JC. Ripe Fruits of Solanum Nigrum L. Inhibits Cell Growth and Induces Apoptosis in MCF-7 cells. Food Chem Toxicol 2003; 41(10): 1421-8
13- Khodarahmi GA, Ghasemi N, Hassanzadeh F, Safaie M. Cytotoxic Effects of Different Extracts and Latex of Ficus Carica L. on Hela Cell Line. Iran J Pharmaceut Res 2011; 10(2): 273.
14- Ghandehari F, Fatemi M. The Effect of Ficus Carica Latex on 7, 12-Dimethylbenz (A) Anthracene-Induced Breast Cancer in Rats. Avicenna J Phytomed 2018; 8(4): 286-295.
15- Tezcan G, Tunca B, Bekar A, Yalcin M, Sahin S, Budak F, et al. Ficus Carica Latex Prevents Invasion Through Induction of Let-7d Expression in GBM Cell Lines. Cell Mol Neurobiol 2015; 35(2): 175-87.
16- Menichini G, Alfano C, Provenzano E, Marrelli M, Statti GA, Somma F, Menichini F, Conforti F. Fig Latex (Ficus Carica L. Cultivar Dottato) in Combination with UV Irradiation Decreases the Viability of A375 Melanoma Cells in Vitro. Anticancer Agents Med Chem 2012; 12(8): 959-65.
17- Gabhe S, Tatke P, Khan T. Evaluation of the Immunomodulatory Activity of the Methanol Extract of Ficus Benghalensis Roots in Rats. Indian J Pharmacol 2006; 38(4): 271.
18- Patil VV, Bhangale SC, Patil VR. Studies on Immunomodulatory Activity of Ficus Carica. Int J Pharm Pharm Sci 2010; 2(4): 97-9.
19- Tian J, Zhang Y, Yang X, Rui K, Tang X, Ma J, Chen J, Xu H, Lu L, Wang S. Ficus Carica Polysaccharides Promote the Maturation and Function of Dendritic Cells. Int J Mol Sci 2014; 15(7): 12469-79.
20- Yang X, Guo JL, Ye JY, Zhang YX, Wang W. The Effects of Ficus Carica Polysaccharide on Immune Response and Expression of Some Immune-Related Genes in Grass Carp, Ctenopharyngodon Idella. Fish Shellfish Immunol 2015; 42(1): 132-7.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ایمونولوژی
دریافت: 1396/11/18 | پذیرش: 1397/2/22 | انتشار: 1399/12/10
دریافت: 1396/11/18 | پذیرش: 1397/2/22 | انتشار: 1399/12/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







