BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://jssu.ssu.ac.ir/article-1-4394-fa.html
فرآیند پلیمریزاسیون غیرآلی سل-ژل Sol-gelیکی از تکنیکهای رایج جهت سنتز سیستمهای دارورسانی است (1). زروژلهایXerogels سیلیکایی نانوساختار حاصل، آمورف، بسیار متخلخل و فعال هستند و بهعنوان حامل، جهت رهایش کنترل شده ترکیبات زیست فعال بررسی شدهاند (2،3). این مواد مزیتهای بیشماری دارند؛ از جمله دمای پایین فرآیند سنتز، خنثی بودن از لحاظ شیمیایی، تورم ناچیز در محلولهای آلی و آبی، پایداری حرارتی (4،5) و زیستسازگاری؛ چون درون بدن به Si(OH)4، تخریب و توسط کلیهها، حذف میشوند (6،7). علیرغم این مزیتها، زروژلهای سیلیکایی با پلیمرهای زیستسازگار کامپوزیت میشوند تا برخی خواص مکانیکی آنها مانند چقرمگی و انعطافپذیری کم بهبود یابد (8). تترااورتوسیلیکات Tetraethylortosilicate (TEOS)، یک آغازگر رایج برای تشکیل شبکه سیلیکایی در مسیر هیدرولیز Hydrolysis – تراکم Condensationو غنی از گروههای هیدروکسیل سیلان است (9،10) ترکیبات زیستفعال، میتوانند قبل از تشکیل ژل، درون سل اضافه شوند و پس از تشکیل ژل، در میان شبکه متخلخل سیلیکایی به دام بیفتند. تشکیل ژل سیلیکایی میتواند با تغییر پارامترهای فیزیکی-شیمیایی (دما، pH و نوع کاتالیزگر) کنترل شود، که قرارگرفتن مولکولها یا سلولها را در شبکه تسهیل میکند (1،3). کاتالیزگر اسیدی، باعث تخلخل کمتر، استحکام مکانیکی بهتر و رهایش آهستهتر میشود (3،11). کیتوسان یکی از پلیساکاریدهایی است که میتواند در فرآیند سل- ژل استفاده شود، چون در محلول اسیدی حل میشود و گروههای هیدروکسیل (–OH) و آمین (–NH2) دارد، که با گروههای عاملی فعال و غیرآلی سیلیکا پیوند برقرار میکنند (12،13). کیتوسان، خواصی مانند زیستتخریبپذیری، زیستسازگاری و فعالیت ضد میکروبی دارد و رشد سلولهای فیبروبلاست پوست را بهبود میبخشد؛ بنابراین کاربرد فراوانی جهت ترمیم زخم و حاملهای رهایش دارو دارد (16-14). در زروژلهای کیتوسان-سیلیکا بهروش سل-ژل، پیوندهای کوالانسی بین گروههای سیلان سیلیکا و آمین یا هیدروکسیل کیتوسان تشکیل میشود (4). سیلیکا مانند یک عامل کراس لینک کننده، خواص مکانیکی ضعیف و پایداری شیمیایی و حرارتی کم کیتوسان و تثبیت ترکیبات شیمیایی را بهبود میدهد. زروژلهای هیبرید بهشکل داربست جهت ترمیم زخم، رهایش دارو، زیست حسگرها و مهندسی بافت بسیار استفاده میشوند (17-22 ،12). در این مطالعه، هدف از ساخت فیلم زروژل کیتوسان-سیلیکا، ساخت یک سیستم دارورسان جهت پوشش زخم بود بنابراین زروژلهای کیتوسان-سیلیکا به روش سل-ژل و به شکل فیلم سنتز شدند. پس از تایید پیوندهای کوالانسی ایجاد شده بین زنجیرههای کیتوسان و شبکه سیلیکا، خواص فیزیکی و مکانیکی و سمیت سلولی نمونهها بررسی شدند. رهایش داروی مدل از زروژلها و ارتباط آن با خواص ساختاری نمونهها نیز بررسی شد. لیدوکایین هیدروکلراید (داروی مدل آبدوست) یک بیحس کننده موضعی و دارای یک گروه آمین و یک بخش آروماتیک است که از دریافت سیگنال در اعصاب محیطی، ممانعت میکند (23،24). برطبق نتایج، در نمونه هیبرید کیتوسان- سیلیکای حاوی دارو، شکنندگی فیلم سیلیکای خالص و استحکام پایین فیلم کیتوسان خالص بهبود یافتند. استفاده از پلیمر، رهایش دارو را از فیلم سیلیکایی، آهستهتر و کنترل شدهتر کرد. در نتیجه، میتوان این فیلم هیبریدی نانو متخلخل و زیستسازگار را به عنوان یک سیستم دارورسانی و به شکل پوشش زخم جهت کاربرد زیست پزشکی مناسب دانست.
روش بررسی
مواد
کیتوسان (وزن مولکولی متوسط، درجه داستیلیشن 85-75 درصد) از کمپانی سیگما-آلدریچ و سایر مواد شیمیایی مورد استفاده از جمله تترااتیل اورتوسیلیکات (TEOS)، اسید استیک و نمکهای مایع شبیهساز زخم Pseudo extracellular fluid (PECF) (NaCl، KCl، NaHCO3 و NaH2PO4) از کمپانی مرک خریداری شدند. همچنین، داروی استفاده شده، یعنی لیدوکایین هیدروکلراید از کمپانی دارو پخش (تهران، ایران) تهیه شد. بافر فسفات سالین (1× PBS) و محیط کشت Dulbecco`s modified Eagle`s medium (DMEM) از کمپانی تکنولوژیهای زنده گیبکو-بیآرال تهیه و سلولهای فیبروبلاست از بانک سلولی ایران (انیستیتو پاستور، ایران) خریداری شدند.
آمادهسازی غشای کیتوسان- سیلیکا
محلول هیدرولیز، با حل کردنTEOS ، در اسید استیک (2% حجمی) و اتانول بهدست میآید؛ نسبت TEOS و اسید استیک و اتانول، 1:1:4 است. محلول حاصل به مدت 24 ساعت جهت هیدرولیز، همزده میشود. پس از آن، محلول TEOS میتواند روی بستر گسترانیده و فیلمهای سیلیکایی تشکیل دهد. برای سنتز فیلمهای هیبرید، محلول 4 درصد وزنی کیتوسان در اسید استیک (2% حجمی) ساخته میشود که در این مرحله، pH تخریب دارو نیز در نظر گرفته شد (25). سپس محلول کیتوسان و TEOS با نسبت دو به یک، بهمدت 30 دقیقه مخلوط و همزده میشود و یک محلول هموژن را تشکیل میدهد. برای سنتز فیلم هیبریدی حاوی دارو، مقدار مناسبی از محلول دارو هم بهمحلول یکنواخت مذکور (1:3) اضافه شده و در دمای اتاق بهمدت 1 ساعت همزده میشود. محلول دارو حاوی 5 درصد وزنی دارو (لیدوکایین هیدروکلراید) در آب دیونیزه است؛ یعنی در 100 میلیگرم نمونههای نهایی سیلیکایی خالص و سیلیکا-کیتوسان حاوی دارو، بهترتیب، حدود 64/3 و 34/3 میلیگرم دارو وجود دارد. محلول کیتوسان– TEOS- دارو روی بستر گسترانیده و بهمدت یک شبانه روز در دمای اتاق خشک شد. پس از تبخیر حلالها، یک فیلم بسیار نازک بهروش سل-ژل حاصل شد. اطلاعات مربوط به آمادهسازی هر نمونه در جدول 1 آورده شده است. نمونههای سیلیکا در کیسه نایلون قرار داده شده و به کمک تشعشع گاما (kGy 25 و نرخkGy/h 6) سترون شدند (27 ،26).
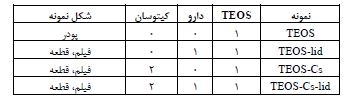
جدول 1) نسبتهای حجمی به کار رفته در آمادهسازی هر نمونه سیلیکایی و شکل آنها
ارزیابی خواص فیزیکی و شیمیایی
طیف سنجی مادون قرمز Fourier transformed infrared spectroscopy (FTIR)
به منظور بررسی برهمکنشهای موجود بین گروههای عاملی برای سیلیکای خالص از روش FTIR و برای نمونههای هیبریدی از روشATR-FTIR استفاده شد؛ چون سیلیکای خالص بسیار شکننده و قابل آمادهسازی به شکل فیلم نبود. طیف FTIR از cm-1 400 تا 4000 توسط طیف سنج مدل PerkinElmer ساخت کشور آمریکا و طیف ATR-FTIR توسط طیف سنج مدل Bruker ساخت کشور انگلستان مورد بررسی قرار گرفت.
میکروسکوپ الکترونی روبشی نشر میدانی Field emission scanning electron microscopy (FE-SEM)
به منظور بررسی مورفولوژی زروژل سیلیکایی و ساختار سطح مقطع آنها، نمونهها با میکروسکوپ FE-SEM (HITACHI S4160، ژاپن) در ولتاژ Kv 15 روبش شدند. از آنجایی زروژلهای سیلیکایی شکننده هستند، جهت تصویربرداری از مقطع عرضی، به آسانی در دمای اتاق شکسته میشوند و نیاز بهعملیات آمادهسازی خاصی ندارند. همه نمونهها توسط یک لایه از طلا پوشش داده شدند. برای بررسی مورفولوژی سلولها، ابتدا سلولها روی سطح تثبیت شدند. برای تثبیت آنها از یک میلیلیتر محلول گلوتارآلدهید (4 درصد حجمی) در بافر فسفات با pH= 7/4 استفاده شد، که نمونهها باید بهمدت 30-20 دقیقه درون آن غوطه ور باشند. سپس به آرامی با آب دو بار تقطیر، دو بار شستشو داده شدند. پس از آن هر 5 دقیقه بهصورت پشت سر هم با اتانول (50، 60، 70، 80، 96 و 100 درصد)، خشک شدند. سپس در زیر هود قرار گرفته تا حلالهای باقیمانده نیز از آنها خارج شود و در یخچال نگهداری شدند. بعد از آن نمونهها مورد تصویربرداری قرار گرفتند.
میکروسکوپ نیروی اتمی Atomic force microscopy (AFM)
برای بررسی خواص سطحی نظیر توپوگرافی و زبری سطح و میزان و اندازه تخلخلها، از میکروسکوپ AFM(مدلNano wizard II، آلمان) استفاده شد. زبری سطح از دسته خواصی است که میتواند بر چسبندگی سلول و باکتری تاًثیر بگذارد، لذا بررسی زبری سطح از اهمیت بالایی برخوردار است. زروژلهای TEOS-lid، TEOS-Cs و TEOS-Cs-lid مورد بررسی قرار گرفتند و تصاویر در حالت غیر تماسی و در سطح 5× 5 میکرومترمربع گرفته شدند. نتایج با استفاده از نرمافزار مربوط (Auto-probe®) تعیین و گزارش شدند.
آزمون برونار- ایمت- تلر Brunauer Emmett Teller (BET)
اندازه تخلخل متوسط و مساحت سطح زروژلهای سیلیکایی با روش BET (Micromeritics Gimini، آمریکا) تخمین زده شدند. این آزمون براساس جذب گاز نیتروژن است.
آزمون ترشوندگی (WCA)
خواص سطحی (فیزیکی و شیمیایی) زخم پوش عامل تعیین کننده در چسبندگی و رشد سلولهاست. لذا ترشوندگی سطح زروژلها مورد مطالعه قرار گرفته شد. زاویه تماس ایستای فیلمهای سیلیکایی توسط دستگاه زاویه سنج مدل G10 ساخت کشور آلمان تعیین شد. بهمنظور تعیین زاویه تماسی از حلال آب یون زدایی شده استفاده شد. در دمای محیط، قطره حلال بهطور جداگانه روی سطح فیلم توسط سرنگ مجهز به موتور ریخته شد. دادهها با استفاده از نرمافزار مربوط (MagicDroplet®) تخمین زده شدند و این آزمون حداقل سه بار برای هر نمونه تکرار، سپس میانگین دادهها، گزارش شد.
آزمون مکانیکی کششی Tensile mechanical testing
بهمنظور ارزیابی خواص مکانیکی غشاءهای کیتوسان- سیلیکا، با استفاده از دستگاه آزمون کششی مدلSTM-20 ، ساخت ایران، مدول الاستیک، استحکام کششی و کرنش در نقطه شکست نمونهها، مطابق با استاندارد ASTM-D882 تعیین شدند. فک به صورت گیره دوتایی با فاصله اولیه 30 میلیمتر و سرعت حرکت 25 میلیمتر بر دقیقه انتخاب شد. نمونهها بهصورت مستطیلهای 50 × 10 میلیمتر آماده شدند.
آزمون سمیت سلولی
جهت بررسی سمیت سلولی زروژلهای سنتز شده بهروش سل- ژل، از آزمون سمیت سلولی (MTT، غیر مستقیم)، با استفاده از رده سلولی A431 ، فیبروبلاست انسانی، انجام شد. جهت این آزمون، عصارهگیری مطابق با استاندارد ISO 10993-12، پس از 1، 3 و 7 روز در دمای 37 درجه سانتیگراد انجام شد (28). در عصارهگیری به ازای هر 0/6 سانتیمتر مربع از سطح مقطع نمونه، 0/1 میلیلیتر محیط به ظرف حاوی نمونه افزوده شد و برای مدت 7 روز درون انکوباتور حاوی گاز دیاکسیدکربن 5% و دمای کشت 37 درجه سانتیگراد قرار گرفت. حجم مشابهی از محیط کشت نیز بهعنوان شاهد در نظر گرفته شد. جهت عصارهگیری از پودر نیز، به میزان یک میلیلیتر از محیط کشت سلولی به 1 میلیگرم از پودر استریل اضافه و درون انکوباتور با شرایط فوق قرار داده شد. برای بررسی میزان تکثیر سلولی از آزمون دیمتیلتیازل دیفنیلتترازولیوم بروماید (MTT) استفاده شد. بدین ترتیب که ابتدا سلولهای فیبروبلاست درون محیط DMEM، تکمیل شده با 10 درصد سرم جنین گاوی، U/ml 100 پنیسیلین و U/ml 100 استروپتومایسین پاساژ داده شدند تا به عدد 105 برسند. سپس 4 10×1 سلول فیبروبلاست، درون پلیت کشت سلولی 96 چاهکی ریخته شد و سپس بهمدت 24 ساعت در انکوباتور 37 درجه سانتیگراد با اتمسفر حاوی 5 درصد CO2 قرار گرفت تا سلولها به کف پلیت بچسبند. پس از آن، محیط کشت در روزهای 1، 3 و 7 با عصاره گرفته شده از هر نمونه تعویض شد. پس از 24 ساعت عصارهها خارج شدند و 100 میکرولیتر MTT با غلظت 0/5 میلیگرم بر میلیلیتر به هر چاهک حاوی سلول اضافه شد. پس از گذشت 4 ساعت، محلول روی سلولها خارج شد و DMSO به آنها اضافه گردید تا بلورهای فرمازان بنفش رنگ ایجاد شده را حل کند. سپس مقدار غلظت ماده حل شده، با دستگاه الایزا، در طول موج 545 نانومتر اندازهگیری شد. چاهک دارای سلولهای زنده بیشتر چگالی نوری (OD) بالاتری نسبت به چاهک با سلول کمتر نشان میدهد. بنابراین میتوان از رابطه (1-2) و (2-2) فعالیت میتوکندری فیبروبلاستها و در نتیجه میزان زندهمانی سلولها را مشخص و با نمونه شاهد مقایسه کرد. هر نمونه سه بار مورد آزمون قرار گرفته و داده نهایی بهصورت عدد میانگین ± انحراف از معیار گزارش شد (30 ،29).
(1-2)

(2-2)
آزمون برون تن رهایش دارو Drug Release In vitro
در این آزمون، رهایش دارو (لیدوکایین هیدروکلراید)، از زروژلهای TEOS-lid و TEOS-Cs-lid مورد بررسی قرار گرفت. طول موج جذب ماکزیمم لیدوکایین هیدروکلراید، 263 نانومتر است (6). ابتدا منحنی استاندارد دارو، با دستگاه UV-vis اندازهگیری و رسم شد. این منحنی اندازه جذب بر حسب غلظت دارو را نشان میدهد و از قانون بیر-لمبرت تبعیت کرده و خطی است. 100 میلیگرم از هر نمونه توزین شد و درون کیسه دیالیز (سیگما، آلمان) شست و شو داده شده، قرار گرفت. سیستم حاصل درون محیط رهایش غوطهور گردید. محیط رهایش، مایع شبیهساز زخم (PECF) انتخاب شد، که با حلکردن NaCl (3/4 گرم)، NaHCO3 (12/5 گرم)، KCl (1/1 گرم) و NaHPO4.3H2O (1/75 گرم) در 500 میلیلیتر آب مقطر، با pH متوسط 0/5 ±8/0 بهدست آمد (31). ارلنهای حاوی نمونه، در دستگاه انکوباتور شیکر (Shaker incubator) (37 درجه سانتیگراد، حداقل سرعت ممکن) در دمای ثابت 37 درجه سانتیگراد قرار داده شدند و در بازههای زمانی مشخص، 2 میلیلیتر از محیط رهایش برداشته و با حجم یکسان، محیط تازه جایگزین شد تا شرایط حمام (Sink conditions) حفظ شود. اندازه جذب نور در حجم مشخصی از نمونهها، با دستگاه اسپکتوفوتومتر UV-vis در طول موج جذب ماکزیمم لیدوکائین هیدروکلراید (263 نانومتر) اندازهگیری، و از روی منحنی استاندارد، غلظت دارو محاسبه شد. به کمک فرمول (3-2) این غلظتها اصلاح شدند و درصد تجمعی دارو محاسبه شد (32). هر آزمون 3 بار تکرار شد.
(3-2)
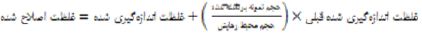
تجزیه و تحلیل آماری
دادهها بهصورت عدد متوسط ± انحراف از معیار از سه آزمون مستقل گزارش شدهاند که در غیر این صورت در متن اشاره شده است. تفاوتها از طریق آزمون تحلیل واریانس یکطرفه (یک عامله) One-way analysis of variance (ANOVA) با استفاده از نرمافزار SPSS version 16 مقایسه و وجود یا عدم وجود تفاوت معنیدار بین آنها مشخص شد. زمانی که 0/05˂p آنگاه تفاوت معنیدار است.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه تهران تایید شده است
نتایج
طیف سنجی مادون قرمز (FTIR)
نتایج FTIR زروژلهای تهیه شده بهروش سل- ژل در شکل 2 نمایش داده شدهاند؛ در نمودار FTIR زروژل سیلیکایی خالص، پیکهایی در 1250-1000، 798 و cm-1 459 دارد، که تقریباً با نتایج مطالعه آهولا Ahola و همکارانش در سال 2000 همخوانی دارد؛ این پیکها بهترتیب ناشی از ارتعاشات متقارن و غیرمتقارن کششی و خمشی پیوند Si-O-Si است (10 ،7)، که در دادههای FTIR نمونههای TEOS-Cs و TEOS-Cs-lid نیز وجود دارند. همچنین باند جذبی در cm-1 957، مربوط به ارتعاشات خمشی Si-OH است (10،33). گروههای سیلانول (Si-OH) باقیمانده در بسیاری از مواد تهیه شده بهروش سل-ژل یافت میشوند که حاکی از عدم کامل بودن مرحله تراکم پلیمریزاسیون است (34). پیکهای موجود در cm-1 3800-3000 ، cm-1 1632 و cm-1 574 بهترتیب مربوط بهپیوند O-H و تغییر شکل گروه H-O-H است، که میتواند آب جذب شده در ساختار یا هیدرولیز ناقص TEOS را نشان دهد؛ در صورتی که اسید ضعیف باشد قادر به هیدرولیز کامل ساختار آلکوکسید (TEOS) نیست (3). دو باند آخری، در cm-1 1632 و cm-1 572، ممکن است به علت واکنش میان پیوندهای هیدروژن و گروههای سیلانول باشد (5). باند مشخصه دیگر در cm-1 798 (مربوط بهساختار حلقه 4 تایی SiO4) و cm-1 614 واقع شده است. که در نمودار FTIR نمونههای TEOS-Cs و TEOS-Cs-lid علاوه بر پیکهای مشخصه زروژل TEOS (35)، پیکهای دیگری در cm-1 1110-1000، cm-1 3600-3200، حدود cm-1 1260 و cm-1 760 وجود دارند که مربوط به همپوشانی باندهای جذبی ارتعاشات Si-O-Si، Si-O-R، C-O و Si-C هستند (18) (همچنین ارتعاشات کششی گروههای هیدروکسیل متصل بهاتمهای کربن (36). این پیوندهای قوی کوالانسی بیشتر از پیوند ضعیف Si-N در بین سیلانها و کیتوسان تشکیل میشود. یک پیک جذبی قوی در cm-1 3000-2800 وجود دارد که مربوط به ارتعاشات کششی C-H است. البته نمودار FTIR زروژلهای هیبرید، باندهای مشخصه کیتوسان حدود cm-1 1530 (ارتعاشات تغییر شکل –NH2)، حدود cm-1 1638 (C=O-NHR، پیوند آمید نوع یک)، cm-1 1420 و cm-1 1380 (ارتعاشات خمشی C-H)، cm-1 1310 (ارتعاشات نامتقارن کششی C-O-C) و cm-1 1080 (ارتعاش کششی C-O در CH-OH) را نیز نشان میدهند (36). البته بعضی از پیکهای مشخصه با پیکهای TEOS همپوشانی دارند. علاوه بر این، پیکهای حدود cm-1 780 (حلقه آروماتیک را نشان میدهد)، cm-1 1240 (C-N) و cm-1 1640 (R-CO-NHR) باندهای مشخصه لیدوکائین هیدروکلراید هستند که بهعلت همپوشانی با پیکهای دیگر، در شکل 1 قابل تشخیص نیستند. نتایج حاصل از این آزمون تشکیل پیوند در شبکه سیلیکا و بین سیلیکا و کیتوسان را تایید میکند.
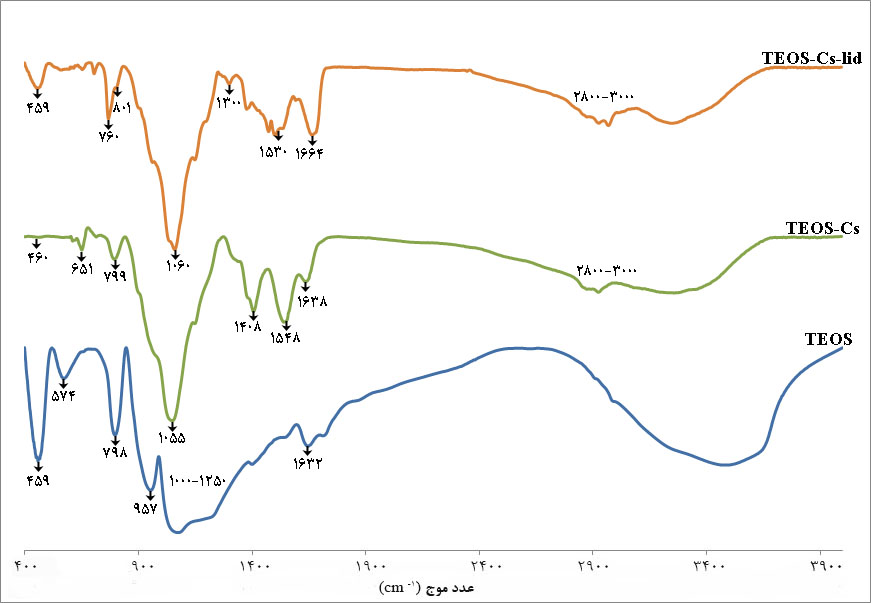
شکل 1: اسپکتروگرافهای FTIR فیلمهای TEOS، TEOS-Cs و TEOS-Cs-lid.
میکروسکوپ الکترونی روبشی (SEM)
شکل 2، بهترتیب ریزگرافهای SEM سطح بالایی و ساختار سطح مقطع نمونههای TEOS، TEOS-lid، TEOS-Cs و TEOS-Cs-lid را نشان میدهد. از آنجایی که قدرت اشعه FE-SEM بالا بود و نمونههای حاوی کیتوسان را تخریب میکرد، تصاویر کیتوسان- سیلیکا نمیتوانست با بزرگنمایی بیشتر گرفته شود و اندازه تخلخلها در این تصاویر SEM قابل تخمین نیستند. بنابراین با توجه به این ریزگرافها میتوان نتیجه گرفت که تخلخل در نمونهها، در صورت وجود دارای ابعاد نانو هستند، که برای اثبات این فرضیه نیاز به آزمون BET وجود دارد. همچنین از این تصاویر میتوان دریافت که نمونه حاوی کیتوسان سطح صافتری نسبت به نمونه سیلیکای خالص دارد.
آزمون میکروسکوپی نیروی اتمی (AFM)
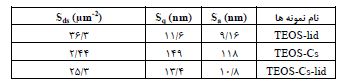
توپوگرافی سطح پوشش هیبریدی بر پایه TEOS، با استفاده از تکنیک AFM مورد مطالعه قرار گرفت (شکل 3). پارامترهای زبری نمونههای هیبرید سل-ژل در جدول 2 آورده شدهاند و سطح نمونههای TEOS-lid، TEOS-Cs و TEOS-Cs-lid را توصیف میکنند. پارامترهای Sa، Sq و Sds بهترتیب، زبری متوسط، میانگین ریشه توان دوم زبری (RMS) و تعداد یا دانسیته قله هستند. همانطور که مشاهده میشود، این نتایج، نتایج حاصل از تصاویر میکروسکوپ الکترونی را تکمیل میکنند. با اینکه حضور کیتوسان زبری سطح نمونه سیلیکایی را کاهش داده است، در نمونههای حاوی داروی لیدوکایین، جوانههایی را مشاهده میکنیم که احتمالاً جوانههای SiO2 هستند.
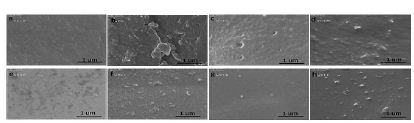
شکل 2: ریزگرافهای SEM سطح بالایی (a، b، c و d) و ساختار مقطع (e، f، g و h) نمونههای TEOS، TEOS-lid، TEOS-Cs و TEOS-Cs-lid (بهترتیب).
.JPG)
شکل 3: تصاویر AFM سطح نمونههای (a) TEOS-lid، (b) TEOS-Cs و (c) TEOS-Cs-lid.
آزمون برونار- ایمت- تلر (BET)
نتایج آزمون BET از زروژلهای TEOS-lid، TEOS-Cs و TEOS-Cs-lid در جدول 3 آورده شدهاند. زروژلهای TEOS خالص تهیه شده، بهعلت شکننده بودن، قابل آمادهسازی بهشکل فیلم جهت بررسی با آزمون BET نبودند. نتایج حاصل از این آزمون وجود نانو تخلخلها را در نمونههایی سیلیکایی تایید میکند. قطر متوسط این نانوتخلخلها کمتر از 5 نانومتر اندازهگیری شده است. همچنین مساحت سطحی نمونههای سیلیکایی حاوی دارو به مراتب بسیار از نمونه فاقد دارو کمتر است که با در نظر گرفتن نتایج میکروسکوپ الکترونی و نیروی اتمی بهعلت حضور جوانه متراکم سیلیکایی در سطح نمونه حاوی دارو است.
زاویه تماسی آب (WCA)
برای ارزیابی بهتر رفتار سطح، زاویه تماسی ایستای آب برای فیلمهای TEOS-lid، TEOS-Cs و TEOS-Cs-lid بلافاصله پس از چکاندن قطره آب روی فیلمها اندازه گرفته شد. نتایج بهدست آمده در جدول 4 جهت مقایسه ارائه شدهاند. نتایج درون جدول بیانگر کاهش نمونههای سیلیکایی با افزودن کیتوسان یا داروی لیدوکایین هستند.
آزمون مکانیکی تست کششی (Tensile mechanical testing)
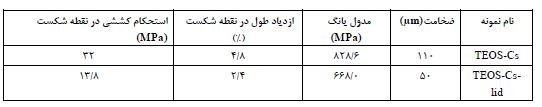
از آنجایی که دلیل عمده تولید مواد کامپوزیت آلی- غیرآلی، تقویت عملکرد مکانیکی آنهاست. ارزیابی مکانیکی کامپوزیتهای پلیمری حاصل، دارای اهمیت است. تست مکانیکی کششی یک روش رایج برای بررسی خواص مکانیکی غشاهای تولید شده است که پارامترهای اصلی مدول یانگ، استحکام مکانیکی و ازدیاد طول (%) را محاسبه میکند. این پارامترها در نمونههای در جدول 5 خلاصه شده اند. نمونههای TEOS و TEOS-lid (بدون کیتوسان) بسیار نازک و شکننده بودند لذا امکان آمادهسازی آنها برای ارزیابی با این تست وجود نداشت (37). همانطور که از جدول پیداست نمونههای سیلیکایی دارای مدول یانگ نسبتاً بالایی حدود 828 مگاپاسکال در نمونههای کیتوسان-سیلیکا هستند که با حضور دارو به 668 کاهش مییابد. اما این نمونهها، ازدیاد طول در نقطه شکست بسیار کمی بین 2 تا 5 درصد دارند.
جدول 2: پارامترهای زبری نمونههای هیبرید سل-ژل
جدول 3: قطر متوسط تخلخل و مساحت سطح نمونههای هیبرید سل-ژل به روش آزمون BET
.JPG)
جدول 4: زاویه تماسی ایستای آب فیلمهای TEOS-lid، TEOS-Cs و TEOS-Cs-lid
.JPG)
جدول 5: پارامترهای تست مکانیکی کششی فیلمهای نازک TEOS-Cs و TEOS-Cs-lid
µm میکرومتر.Mpa مگاپاسکال
آزمون رهایش دارو
منحنی استاندارد لیدوکایین هیدروکلراید که در شکل 4 ارائه شده است، تقریباً خطی (R2=0/9993 ) است. معادله خطی منحنی (y=0/001x+0/0041)، میزان جذب نور UV و غلظت دارو را به هم مرتبط میکند. برای رسم منحنی استاندارد و مطالعه رهایش دارو، میزان جذب نور هر نمونه در طول موج 263 نانومتر اندازهگیری شده است. نتایج آزمون رهایش برون تن داروی لیدوکایین هیدروکلراید از نمونههای حاوی داروی TEOS-lid و TEOS-Cs-lid در شکل 5 نشان داده شده است؛ و نتایج حاکی از آن است که افزودن کیتوسان رهایش انفجاری اولیه را تا حدی کاهش میدهد. همچنین پس از 72 ساعت، حدود 70 درصد از محتوای داروی نمونه حاوی کیتوسان آزاد میشود.
بررسی زیستسازگاری با آزمون MTT
توسط آزمون غیر مستقیم MTT، سمیت سلولی برون تن زروژلهای سیلیکایی تحقیق شد. گروه پایه TEOS (یعنی TEOS، TEOS-lid، TEOS-Cs و TEOS-Cs-lid) طبق پروتکل استاندارد ISO 10993-5 برای 24 ساعت، عصارهگیری شدند. سپس عصاره آنها به هر چاهک ظرف کشت سلولی اضافه شدند. این چاهکها، حاوی رده سلولهای فیبربلاست A431 بودند که از قبل، کشت و پاساژ داده شده و در این آزمون پس از 1، 3 و 7 روز در معرض عصاره نمونهها قرار گرفته و سپس مورد بررسی قرار گرفتند. سطح آبگریز نمونه سیلیکای خالص و چاهک ظرف کشت، بهترتیب نمونههای شاهد مثبت و منفی بودند.نتایج این آزمون، در تمام نمونهها زندهمانی بالای 80 درصد را نشان داد که بیانگر زیستسازگاری نمونههاست؛ بین نتایج MTT نمونهها، تفاوت معناداری مشاهده نشد (P>0/05 ). آزمون برای هرنمونه، سه بار تکرار و نتیجه آخر بهصورت میانگین ± انحراف از معیار گزارش شده است.
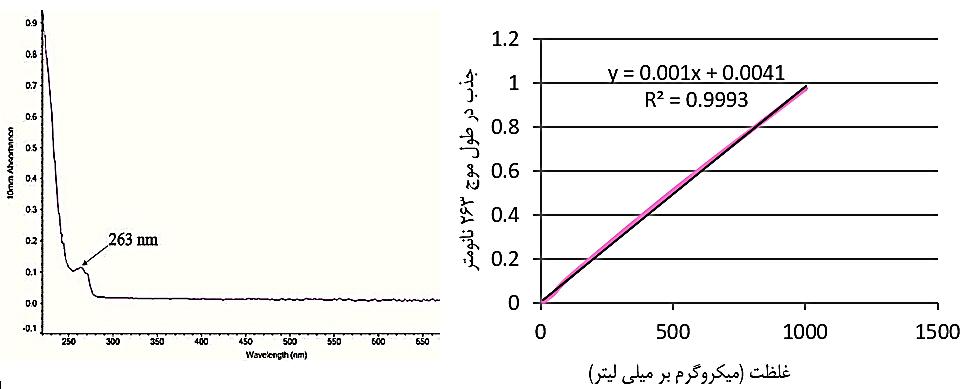
شکل 4: منحنی استاندارد و ماکزیمم طول موج جذب لیدوکایین هیدروکلراید
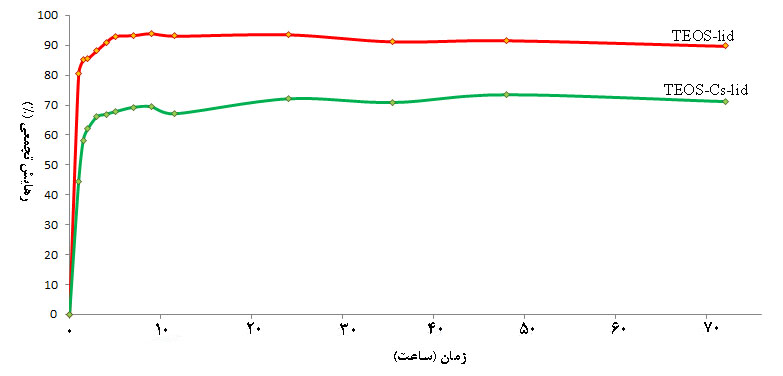
شکل 5: نتایج آزمون رهایش برون تن داروی لیدوکایین هیدروکلراید از نمونههای حاوی داروی TEOS-lid و TEOS-Cs-lid
بحث
در این تحقیق، بیوپلیمر کیتوسان به محلول TEOS اضافه شد؛ در راستای مطالعات پیشین، کیتوسان قادر است برخی از خواص فیزیکی (مانند انعطافپذیری) زروژلهای سیلیکایی را بهبود دهد. نتایج FTIR زروژلهای تهیه شده بهروش سل- ژل که در شکل 2 نمایش داده شدهاند، واکنش سل- ژل را که در نمونههای هیبرید کیتوسان سیلیکا اتفاق افتاده است، تایید کردهاند. پیکهای cm-1 1110-1000، cm-1 3600-3200، حدود cm-1 1260 و cm-1 760 مربوط به همپوشانی باندهای جذبی ارتعاشات Si-O-Si، Si-O-R، C-O و Si-C هستند (18) (همچنین ارتعاشات کششی گروههای هیدروکسیل متصل به اتمهای کربن (36). این پیوندهای قوی کوالانسی بیشتر از پیوند ضعیف Si-N در بین سیلانها و کیتوسان تشکیل میشود. بهمنظور بررسی ریخت Morphology سطح فیلمهای سیلیکایی و ساختار سطح مقطع آنها، از روش FE-SEMاستفاده شد. با توجه به مطالعات قبلی زروژلهای کاتالیز شده اسیدی بسیار ساختار متراکمتری دارند و علت کمتر بودن شاخههای جانبی پلیمرها است که در حین فرآیند خشک شدن میتوانند بهسهولت در هم نفوذ کنند (38). شکل FE-SEM همچنین نشان میدهد که سطح و ساختار زروژلهای TEOS، با افزودن کیتوسان به ترکیب نمونه هیبریدی، صافتر و شلتر (Looser) شده است چون کیتوسان، پلی ساکاریدی است که مقدار زیادی گروههای هیدروکسیل دارد که در واکنشهای مرحله تراکم فرآیند سل-ژل دخالت دارند. در حین این واکنش پیوند هیدروژنی میان گروههای سیلانول و هیدروکسیل تشکیل شده و از رشد خوشه Clustersهای سیلیکایی ممانعت میکند. علاوه بر این ذرههای جوانه زنی سیلیکا، بهعنوان یک فاز متراکم و در شکل کرههای سفید غیرآلی در ریزساختار نمونههای TEOS-lid و TEOS-Cs-lid مشاهده میشوند که در نمونه TEOS-Cs-lid کوچکتر هستند (39). این ممکن است بهعلت اضافه کردن لیدوکائین هیدروکلراید به محلول سل باشد که ویسکوزیته را کاهش داده و نفوذ Diffusion گروههای سیلانول را تسهیل کرده است. از طرفی خاصیت اسیدی محلول هیدرولیز را افزایش میدهد. گروههای سیلانول در حین هیدرولیز آغازگر (TEOS) تشکیل میشوند. در نهایت، با توجه به شکل 2، هیچ جدایش فازی در نمونهها مشاهده نمیشود و ذرههای سیلیکایی بهطور یکنواخت در نمونه TEOS-Cs-lid پراکنده شدهاند که میتواند واکنش خوب میان زنجیرههای پلیمری کیتوسان و سیلیکا را در راستای نتایج FTIR نشان دهد (11،40). از تصویر AFM نمونه TEOS-Cs نیز میتوان دریافت که شبکه سیلیکایی درون زنجیرههای پلیمری کیتوسان یکنواخت توزیع شده است که با نتایج FTIR نیز قابل تایید است. در حالی که نمونههای حاوی دارو، برجستگیهایی دارند که احتمالاً نشاندهنده تودههای SiO2 است (37). این برجستگیها در تصاویر FE-SEM نیز نمایان هستند. با توجه به جدول 2 و شکل 3، میتوان ادعا کرد که سطح TEOS-Cs صافتر دو نمونه دیگر است که میتواند بهعلت ممانعت کیتوسان از تشکیل تودههای سیلیکایی باشد. بههمین ترتیب، میتوان سطح زبرتر نمونه TEOS-lid را نسبت به TEOS-Cs-lid توضیح داد. اینطور بهنظر میرسد که افزودن لیدوکایین هیدروکلراید، ویسکوزیته سل را کاهش داده که در نتیجه آن حرکت زنجیرههای پلیمری تسهیل میشود. این امر موجب سهولت واکنشهای مرحله تراکم، و تجمع بیشتر ذرات سیلیکایی میشود. همچنین نتایج AFM، احتمال وجود ساختاری در حد نانو در نمونهها را نشان میدهند که با آزمون BET، بررسی شد. از آنجایی که تخلخل زروژلهای حاوی دارو نقش حیاتی در سینتیک رهایش آنها دارند، قطر متوسط تخلخلها، مساحت سطح نمونهها با روش BET اندازهگیری شد. از مطالعات قبلی و نتایج این آزمون، میتوان بهطور واضح مشاهده کرد که اندازه متوسط قطر تخلخلها با افزودن کیتوسان بهترکیب کاسته شده در حالی که مساحت سطح افزایش یافته است (41،36). آیرز (Ayers) و همکارانش گزارش کردند که پیوندهای هیدروژنی بین کیتوسان و سیلیکا، باعث کاهش واکنشهای گروههای هیدروکسیل در مرحله تراکم و کاهش انقباض ژل میشود. البته افزایش بیشتر محتوای کیتوسان مساحت سطح را کاهش میدهد چون تمامی کیتوسان بهطور کامل حل نمیشود (42). نکته جالب توجه دیگر، این است که قطر متوسط تخلخل نمونه TEOS-Cs-lid بیشتر از نمونه TEOS-Cs است. معمولاً در حین خشک شدن ژلهای سیلیکا، با تراکم گروههای سیلانول درون تخلخلها، ساختار ژل منقبض میشود و در نتیجه اندازه تخلخل کاهش مییابد. اما ذرههای چگال سیلیکایی، استحکام ژل را افزوده و مکانهای دسترسی گروههای سیلانول را برای واکنشهای تراکم درونی، کاهش میدهد. در نتیجه، انقباض ژل در حین خشک شدن، کمتر میشود (42،43). همچنین، با توجه بهمطالعات و نتایج آزمونهای دیگر، مساحت سطح کم نمونه TEOS-lid نشاندهنده ساختاری با تخلخل کمتر (43،44) و ناخالصیهای جامد (42) است. با ارزیابی زاویه تماسی ایستای آب برای فیلمهای TEOS-lid، TEOS-Cs و TEOS-Cs-lid میتوان مشاهده کرد که، با افزودن کیتوسان به فرمولاسیون پایه TEOS، زاویه تماسی آب کاهش پیدا میکند یعنی سطح آبدوستتر میشود. علت این امر، ممکن است با حضور گروههای هیدروکسیل بیشتر رو سطح، که در واقع مکانهایی برای ایجاد پیوند هیدروژنی با آب هستند، قابل توجیه باشد. از طرف دیگر، پیوندهای هیدروژنی بین زنجیرههای سیلیکا و کیتوسان، باعث کاهش آبدوستی نسبت به کیتوسان خالص هم هست (45). بهعلاوه زروژل حاوی دارو آبدوستتر از زروژلهای بدون دارو هستند. این آبدوستی به علت ذرههای سیلیکا (زبری بیشتر سطح) یا ماهیت آبدوست لیدوکایین هیدروکلراید است. شبکه سخت و انعطاف ناپذیر (Rigid) Si-O موجب کاهش درصد ازدیاد طول در نقطه شکست و افزایش مدول یانگ (کهمرتبط با سفت بودن ماده است (45)) و استحکام کششی فیلم کیتوسان خالص شد. این امر بهعلت افزایش پیوندهای هیدروژنی درون ماده هیبرید است (46-49). پس با توجه بهمنحنی تنش-کرنش نمونهها، فیلمهای نازک TEOS-Cs و TEOS-Cs-lid انعطاف پذیری نسبتاً پایینی دارند. از طرف دیگر، زروژل TEOS-Cs-lid ضخامت، مدول یانگ و استحکام کمتر، و ازدیاد طول بیشتری نسبت به فیلم TEOS-Cs دارد. در واقع افزودن دارو (لیدوکایین هیدروکلراید) مدول یانگ و ازدیاد طول ماتریس سیلیکایی را کاهش داده است، که ممکن است بهترتیب، بهدلیل خاصیت روانسازی دارو و تشکیل ذرات متراکم سیلیکایی در ساختار فیلم حاوی دارو باشد (37). لیدوکایین هیدروکلراید یک عامل بیحسی موضعی است که کانال یون سدیم را میبندد. این دارو بهطور گستردهای، برای کاهش درد استفاده میشود. اما این دارو، طول عمر نسبتاً کوتاهی (تنها 1/5 تا 2 ساعت) دارد. چون گروه آمید و در نتیجه متابولیسم سریعی در کبد دارد. بنابراین زخم پوشی که این دارو را بهطور پیوسته و ثابت رها کند، میتواند بهطور موثری سازگاری بیمار را بهبود بخشد و عوارض جانبی مضر را از بین ببرد. با توجه به نتایج آزمون رهایش، پس از 72 ساعت، رهایش تجمعی دارو، به 86 درصد از نمونه TEOS-lid و 71 درصد از نمونه TEOS-Cs-lid رسیده است، رهایش انفجاری در نمونه دوم، به طرز قابلتوجهی کاسته شده است. نتایج نمونه TEOS-Cs-lid نشان میدهد که افزودن کیتوسان به کنترل بهتر رهایش دارو کمک کرده است. همچنین رهایش انفجاری اولیه از نمونههای سیلیکایی ممکن است مربوط به حل شدن داروهای قرار گرفته در سطوح خارجی زروژلها و تورم نمونهها پس از غوطهوری در محیط PECF باشد. پس از آن، یک رفتار رهایش دارای ثبات در مرحله دوم مشاهده میشود که احتمالاً مربوط بهداروی به دام افتاده در حفرات زروژلهاست. قابل ذکر است که نمونههای TEOS-lid پس از 24 ساعت، به قطعات کوچکتر خرد میشوند اما نمونههای TEOS-Cs-lid تا انتهای زمان آزمون بهشکل اولیه باقی میمانند. منحنی رهایش شکل5 را میتوان با دو رویکرد مختلف توضیح داد:
1.1.1. اثر خواص ساختاری زروژل روی رهایش دارو با در نظر گرفتن نتایج بهدست آمده از آزمونهای SEM، AFM و BET، افزودن کیتوسان به ماتریس سیلیکایی منجر بهکاهش اندازه متوسط تخلخل و زبری سطح نمونه شده است. پس انتظار داریم که کاهش این دو پارامتر، نرخ رهایش را کمتر کنند که با نتایج بهدست آمده حاصل شد.
1.1.2. فعل و انفعالات بین دارو، کیتوسان و شبکه سیلیکایی سه فعل و انفعال، روی نرخ رهایش دارو اثر میگذارد:
1) فعل و انفعالات الکتروستاتیک،
2) پیوند هیدروژنی
3) فعل و انفعالات آبگریز (6).
فعل و انفعالات الکتروستاتیک، بین زروژلهای سیلیکایی، لیدوکایین هیدروکلراید و کیتوسان وجود دارد. زروژلهای سیلیکایی از واحدهای سیلوکسان متصل بههم تشکیل شدهاند. اگر برای سنتز آنها از آغازگر ارگانوسیلان استفاده شده باشد، گروههای عاملی در سطح آنها اغلب، گروههای سیلانول و آلی است. گزارش شده است که فرآیند سل ژل تکمرحلهای با کاتالیزگر اسیدی، گروههای سیلانول کمتری روی سطح نمونه سیلیکا را ایجاد میکند. بهعلاوه، این گروهها بسته بهماهیت محیط اطرافشان (اگر محلول باشند) تغییر میکنند. بنابراین، بار سطحی زروژل سیلیکایی، به pH محلول (که از 6 تا 11 بهسرعت تغییر میکند) بستگی دارد. pH محیط PECF، تقریباً 8 است، پس زروژل در این محلول، بار منفی دارد. از طرف دیگر، لیدوکایین هیدروکلراید بیشتر بهصورت کاتیونهایش در محیط وجود دارد. در نتیجه، یک جاذبه الکتروستاتیک بین زروژلهای خالص سیلیکا و دارو است. با توجه به موارد ذکر شده، افزودن کیتوسان (که یک پلیمر کاتیونی است)، بایستی نرخ رهایش داروی لیدوکایین هیدروکلراید را از ترکیب هیبریدی افزایش دهد که در شکل 5 اینطور مشاهده نمیشود. پس برهمکنش دیگری اثر فعل و انفعالات الکتروستاتیک را خنثی میکند. پیوند هیدروژنی، یک برهمکنش بسیار رایج موجود بین دارو و زمینه سل ژل است. از آنجایی که گروههای سیلانول بیشتری در ماتریس سیلیکایی خالص نسبت به هیبرید TEOS-Cs-lid هستند، احتمالاً دارو پیوند هیدروژنی قویتری با سطح نمونههای خالص برقرار میکند. از طرف دیگر، پیوند هیدروژنی کیتوسان و گروههای سیلانول، منجر به حل شدن آهستهتر ماتریس و حفظ ساختار بهتر و در نتیجه کنترل بیشتر نرخ رهایش دارو و کاهش مقدار رهایش انفجاری اولیه میشود. این فرضیات، با دادههای حاصل از آزمایش، تایید شدند. برهمکنشهای آبگریز، نیز بین لیدوکایین هیدروکلراید و زروژلها اتفاق میافتند. با پیوند کوالانسی گروههای آلی بهشبکه سیلیکایی، آبگریزی افزایش پیدا میکند. آبگریزی بیشتر زمینه، رفتار رهایش دارو به گونهای کنترل میکند که رهایش دارو، در محیط آبی کاسته میشود. همانطور که در شکل 5 مشاهده میشود، رهایش از هیبرید TEOS-Cs-lid کمتر از ماتریس سیلیکای خالص حاوی دارو، است و بهمدت 72 ساعت بهطول میانجامد. برای آنکه ثابت شود نمونههای بهدست آمده، جهت کاربردهای پزشکی مناسب هستند، آزمون غیرمستقیم MTT انجام شد؛ با در نظر گرفتن پروتکل استاندارد MTT، یک نمونه مشخص زمانی برای سلول سمی محسوب میشود که درصد زندهمانی سلول، کمتر از 70 درصد باشد. بنابراین، با توجه به شکل 6، به وضوح مشاهده میشود که تمام زروژلهای سیلیکایی و میزان داروی آزاد شده از آنها، زیستسازگار بوده و روی سلولهای فیبروبلاست اثر سمیت ندارد.
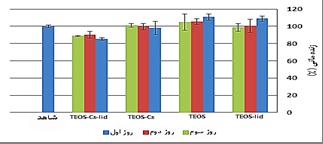
شکل 6: نتایج MTT زروژلهای سیلیکایی
نتیجهگیری
سیلیکای خالص و فیلم کیتوسان-سیلیکا (حاوی دارو و بدون آن)، با آغازگر تترا اورتوسیلیکات (TEOS)، بهروش سلژل، طی مسیر هیدرولیز و تراکم در شرایط اسیدی ساخته شد. با استفاده از آزمون FTIR، حضور پیوندهای شیمیایی موجود در ساختار (برای مثال پیوند کوالانت بین زنجیره کیتوسان (فاز آلی) و شبکه سیلیکا (فاز غیرآلی) در نمونههای هیبرید) ثابت شد. خواص مورفولوژی ساختار و سطح نمونهها با استفاده از آزمونهای SEM و AFM بررسی گردید. نتایج حاصل از آزمون SEM، نشان داد که نمونههای هیبرید، بهشدت متخلخل و به آزمون تکمیلی BET، نانو ساختار هستند. با توجه به نتایج AFM، میتوان ادعا کرد که حضور کیتوسان زبری سطح را کاهش میدهد و اندازه تخلخل را نیز کاهش میدهد. همچنین نرخ رهایش دارو از قطعات سیلیکای خالص و کیتوسان-سیلیکا ارزیابی گردید، که هر دو یک انفجار اولیه در 1 ساعت اول نشان دادند و بازده دارورسانی نمونهها بهترتیب 86% و 71 % بود؛ مشاهدات حاکی از کاهش اندازه تخلخل و در نتیجه کاهش نرخ رهایش با افزودن کیتوسان به ماتریس سیلیکای خالص بود. خواص مکانیکی کششی این فیلم کیتوسان-سیلیکا نیز نشان داد، که با افزودن دارو، استحکام کششی، از 32 به 14/4 مگاپاسکال کاسته میشود. در پایان، سمیت سلولی فیلمهای سیلیکایی توسط آزمون MTT، ارزیابی و نتایج حاکی از زیستسازگاری مناسب لایههای سیلیکا و کیتوسان- سیلیکا بود، که در نتیجه ساختارهای ذکر شده را بهگزینه مناسبی برای کاربردهای پزشکی، تبدیل میکند.
سپاسگزاری
این مقاله حاصل پایاننامه شهرزاد زیرک حسن کیاده در مقطع کارشناسی ارشد در رشته مهندسی پزشکی گرایش مهندسی بافت میباشد. از تمامی افرادی که ما را در این پروژه یاری کردهاند، سپاسگزاری میکنیم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
1-Owens GJ, Singh RK, Foroutan F, Alqaysi M, Han C-M, Mahapatra C, et al. Sol–Gel Based Materials for Biomedical Applications. Progress in Materials Sci 2016; 77: 1-79.
2-Teoli D, Parisi L, Realdon N, Guglielmi M, Rosato A, Morpurgo M. Wet Sol–Gel Derived Silica for Controlled Release of Proteins. J Controlled Release 2006; 116(3): 295-303.
3-Prokopowicz M. Silica-Polyethylene Glycol Matrix Synthesis by Sol-Gel Method and Evaluation for Diclofenac Diethyloammonium Release. Drug Delivery 2007; 14(3): 129-38.
4-Spirk S, Findenig G, Doliska A, Reichel VE, Swanson NL, Kargl R, et al. Chitosan–Silane Sol–Gel Hybrid thin Films with Controllable Layer Thickness and Morphology. Carbohydrate Polymers 2013; 93(1): 285-90.
5-Jeon HJ, Yi SC, Oh SG. Preparation and Antibacterial Effects of Ag–Sio2 Thin Films by Sol–Gel Method. Biomaterials 2003; 24(27): 4921-8.
6-Wu Z, Joo H, Lee TG, Lee K. Controlled Release of Lidocaine Hydrochloride from the Surfactant-Doped Hybrid Xerogels. J Controlled Release 2005; 104(3): 497-505.
7-Ahola M, Kortesuo P, Kangasniemi I, Kiesvaara J, Yli-Urpo A. Silica Xerogel Carrier Material for Controlled Release of Toremifene Citrate. International J Pharmaceutics 2000; 195(1-2): 219-27.
8-Mofakham EB, Ghaee A, Mashak A, Razzaghi-Abyaneh M. Progesterone Release from PDMS-Modified Silica Xerogels Containing Ag Nanoparticles. Silicon 2019; 11(2): 703-11.
9-Shchipunov YA, Karpenko Tyy. Hybrid Polysaccharide− Silica Nanocomposites Prepared by the Sol− Gel Technique. Langmuir 2004; 20(10): 3882-7.
10-Silva GS, Oliveira PC, Giordani DS, Castro HF. Chitosan/Siloxane Hybrid Polymer: Synthesis, Characterization and Performance as a Support for Immobilizing Enzyme. J Brazilian Chem Society 2011; 22(8): 1407-17.
11-Zhuang GL, Tseng HH, Wey MY. Preparation of PPO-Silica Mixed Matrix Membranes by In-Situ Sol–Gel Method for H2/CO2 Separation. International J Hydrogen Energy 2014; 39(30): 17178-90.
12-Smitha S, Shajesh P, Mukundan P, Warrier K. Sol-Gel Synthesis of Biocompatible Silica-Chitosan Hybrids and Hydrophobic Coatings. J Materials Res 2008; 23(8): 2053-60.
13-Toskas G, Cherif C, Hund RD, Laourine E, Mahltig B, Fahmi A, et al. Chitosan (PEO)/Silica Hybrid Nanofibers as a Potential Biomaterial for Bone Regeneration. Carbohydrate Polymers 2013; 94(2): 713-22.
14-Silva SS, Santos MI, Coutinho O, Mano J, Reis R. Physical Properties and Biocompatibility of Chitosan/Soy Blended Membranes. J Materials Science: Materials in Med 2005; 16(6): 575-9.
15-Silva SS, Mano JF, Reis RL. Soft Constructs for Skin Tissue Engineering. Biomimetic Approaches for Biomaterials Development 2012: 537-57.
16-Varshosaz J, Jaffari F, Karimzadeh S. Development of Bioadhesive Chitosan Gels for Topical Delivery of Lidocaine. Scientia Pharmaceutica 2006; 74(4): 209-23.
17-Wang G, Xu JJ, Chen HY, Lu ZH. Amperometric Hydrogen Peroxide Biosensor with Sol–Gel/Chitosan Network-Like Film as Immobilization Matrix. Biosensors and Bioelectronics 2003; 18(4): 335-43.
18-Tan X, Li M, Cai P, Luo L, Zou X. An Amperometric Cholesterol Biosensor based on Multiwalled Carbon Nanotubes and Organically Modified Sol-Gel/Chitosan Hybrid Composite Film. Analytical Biochemistry 2005; 337(1): 111-20.
19-Liu X, Xie L, Li H. Electrochemical Biosensor based on Reduced Graphene Oxide and au Nanoparticles Entrapped in Chitosan/Silica Sol–Gel Hybrid Membranes for Determination of Dopamine and Uric Acid. J Electroanalytical Chem 2012; 682: 158-63.
20-Miao Y, Tan S. Amperometric Hydrogen Peroxide Biosensor with Silica Sol–Gel/Chitosan Film as Immobilization Matrix. Analytica Chimica Acta 2001; 437(1): 87-93.
21-Shirosaki Y, Tsuru K, Hayakawa S, Osaka A, Lopes MA, Santos JD, et al. Physical, Chemical and in Vitro Biological Profile of Chitosan Hybrid Membrane as a Function of Organosiloxane Concentration. Acta Biomaterialia 2009; 5(1): 346-55.
22-Costache MC, Qu H, Ducheyne P, Devore DI. Polymer–Xerogel Composites for Controlled Release Wound Dressings. Biomaterials 2010; 31(24): 6336-43.
23-Krishnan C, Garnett M, Hsiao B, Chu B. Solute-Solvent Interactions from Impedance Measurements:‘Π–Way’conduction and Water Structure-Enforced Ion Pair Formation in Aqueous Lidocaine Hydrochloride. Int J Electrochem Sci 2009; 4: 1085-99.
24-Rajendiran N, Mohandoss T, Saravanan J . Guest:host interactions of lidocaine and prilocaine with natural cyclodextrins: spectral and molecular modeling studies. Spectrochim Acta A Mol Biomol Spectrosc 2014, 11; 132: 387-96
25-Wisher D. Martindale: The Complete Drug Reference. J Med Libr Assoc 2012;100(1):75-6.
26-Singh D, Singh R. Papain Incorporated Chitin Dressings for Wound Debridement Sterilized by Gamma Radiation. Radiation Physics and Chem 2012; 81(11): 1781-5.
27-Soler DM, Rodríguez Y, Correa H, Moreno A, Carrizales L. Pilot Scale-Up and Shelf Stability of Hydrogel Wound Dressings Obtained by Gamma Radiation. Radiation Physics and Chem 2012; 81(8): 1249-53.
28-ISO E. 10993-12: 2008–Biological Evaluation of Medical Devices–Part 12: Sample Preparation and Reference Materials (ISO 10993-12: 2007). German Version: DIN EN ISO 2008: 10993-12.
29-Picot J. Human Cell Culture Protocols. Springer Sci & Business Media; 2005.
30-Mirahmadi F, Tafazzoli-Shadpour M, Shokrgozar MA, Bonakdar S. Enhanced Mechanical Properties of Thermosensitive Chitosan Hydrogel by Silk Fibers for Cartilage Tissue Engineering. Materials Science and Engineering: C 2013; 33(8): 4786-94.
31-Asma C, Meriem E, Mahmoud B, Djaafer B. Physicochemical Characterization of Gelatin-Cmc Composite Edibles Films from Polyion-Complex Hydrogels. J Chilean Chemical Society 2014; 59(1): 2279-83.
32-Mangindaan D, Chen CT, Wang MJ. Integrating Sol–Gel with Cold Plasmas Modified Porous Polycaprolactone Membranes for the Drug-Release of Silver-Sulfadiazine and Ketoprofen. Applied Surface Sci 2012; 262: 114-9.
33-Rhee S-H, Choi JY, Kim HM. Preparation of a Bioactive and Degradable Poly (Ε-Caprolactone)/Silica Hybrid through aSol–Gel Method. Biomaterials 2002; 23(24): 4915-21.
34-Silva SS, Ferreira RA, Fu L, Carlos LD, Mano JF, Reis RL, et al. Functional Nanostructured Chitosan–Siloxane Hybrids. J Materials Chem 2005; 15(35-36): 3952-61.
35- Copello GJ, Mebert AM, Raineri M, Pesenti MP, Diaz LE. Removal of Dyes from Water Using Chitosan Hydrogel/Sio2 and Chitin Hydrogel/Sio2 Hybrid Materials Obtained by the Sol–Gel Method. J Hazardous Materials 2011; 186(1): 932-9.
36-Budnyak TM, Pylypchuk IV, Tertykh VA, Yanovska ES, Kolodynska D. Synthesis and Adsorption Properties of Chitosan-Silica Nanocomposite Prepared by Sol-Gel Method. Nanoscale Research Letters 2015; 10(1): 1-10.
37-Atanacio AJ, Latella BA, Barbé CJ, Swain MV. Mechanical Properties and Adhesion Characteristics of Hybrid Sol–Gel Thin Films. Surface And Coatings Technology 2005; 192(2-3): 354-64.
38-Ibrahim WAW, Ismail WNW, Keyon ASA, Sanagi MM. Preparation and Characterization of a New Sol–Gel Hybrid Based Tetraethoxysilane-Polydimethylsiloxane as a Stir Bar Extraction Sorbent Materials. J Sol-Gel Sci and Technology 2011; 58(3): 602-11.
39-El Nahrawy A, Hammadi AA, Turky G, Elnasharty M, Youssef A. Synthesis and Characterization of Hybrid Chitosan/Calcium Silicate Nanocomposite Prepared Using Sol-Gel Method. Intl J Adv Eng, Technol Comput Sci 2015; 2(1): 9-14.
40-Trujillo S, Pérez‐Román E, Kyritsis A, Gómez Ribelles JL, Pandis C. Organic–Inorganic Bonding in Chitosan–Silica Hybrid Networks: Physical Properties. J Polymer Science Part B: Polymer Physics 2015; 53(19): 1391-400.
41-Lee EJ, Jun SH, Kim HE, Kim HW, Koh YH, Jang JH. Silica Xerogel-Chitosan Nano-Hybrids for Use as Drug Eluting Bone Replacement. J Materials Science: Materials in Med 2010; 21(1): 207-14.
42-Ayers MR, Hunt AJ. Synthesis and Properties of Chitosan–Silica Hybrid Aerogels. J Non-Crystalline Solids 2001; 285(1-3): 123-7.
43-Smitha S, Mukundan P, Pillai PK, Warrier K. Silica–Gelatin Bio-Hybrid and Transparent Nano-Coatings through Sol–Gel Technique. Materials Chem and Physics 2007; 103(2-3): 318-22.
44-Nampi PP, Mohan VS, Sinha AK, Varma H. High Surface Area Sol–Gel Nano Silica as a Novel Drug Carrier Substrate for Sustained Drug Release. Materials Research Bulletin 2012; 47(6): 1379-84.
45-Lima KO, Biduski B, Da Silva WMF, Ferreira SM, Montenegro LMP, Dias ARG, et al. Incorporation of Tetraethylorthosilicate (TEOS) in Biodegradable Films based on Bean Starch (Phaseolus Vulgaris). European Polymer J 2017; 89: 162-73.
46-Lemos EM, Carvalho SM, Patrício PS, Donnici CL, Pereira MM. Comparison of the Effect of Sol-Gel and Coprecipitation Routes on the Properties and Behavior of Nanocomposite Chitosan-Bioactive Glass Membranes for Bone Tissue Engineering. J Nanomaterials 2015; 2015.
47-Cho SJ, Bae IS, Jeong HD, Boo JH. A Study on Electrical and Mechanical Properties of Hybrid-Polymer Thin Films by a Controlled TEOS Bubbling Ratio. Applied Surface Sci 2008; 254(23): 7817-20.
48-Lee EJ, Shin DS, Kim HE, Kim HW, Koh YH, Jang JH. Membrane of Hybrid Chitosan–Silica Xerogel for Guided Bone Regeneration. Biomaterials 2009; 30(5): 743-50.
49-Yeh JT, Chen CL, Huang KS. Synthesis and Properties of Chitosan/Sio2 Hybrid Materials. Materials Letters 2007; 61(6): 1292-5.
دریافت: 1396/8/20 | پذیرش: 1397/2/22 | انتشار: 1399/8/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







