دوره 31، شماره 9 - ( آذر 1402 )
جلد 31 شماره 9 صفحات 7003-6988 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammadgholi M, Pourbahman F. Targeted Strategies Against Coronavirus Using Nanotechnology. JSSU 2023; 31 (9) :6988-7003
URL: http://jssu.ssu.ac.ir/article-1-6026-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6026-fa.html
محمدقلی محسن، پوربهمن فاطمه. تدابیر هدفمند به منظور مقابله با ویروس کرونا با بهکارگیری فنآوری نانو. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (9) :6988-7003
متن کامل [PDF 1365 kb]
(146 دریافت)
| چکیده (HTML) (230 مشاهده)
متن کامل: (204 مشاهده)
مقدمه
در اواخر دسامبر سال 2019 شیوع نوع جدیدی از کروناویروس از شهر ووهان (Wuhan) مرکز استان هوبئی (Hubei) در کشور چین آغاز شد. این ویروس که سبب بروز عفونت متوسط تا شدید سامانه تنفسی در انسان میشد، در زمان کوتاهی با سرعت زیاد در تمام جهان گسترش یافت. این ویروس که کووید-19 (COVID-19) نام گرفت با مرگ بیش از شش میلیون نفر در سراسر دنیا سبب نگرانی جهانی شد. براساس گزارش پژوهشگران این ویروس بهطور مداوم در حال تکامل است و میتواند از طریق ناقلین بدون علامت منتشر بشود، که این امر تهدید کننده سلامت جهانی است. کروناویروسها جزء ویروسهای پوششدار حاوی ژنوم تک رشتهای و غیر قطعهای با قطبیت مثبت و حامل یکی از بزرگترین ژنومها در میان خانوادههای ویروسی با ژنوم ریبونوکلئیک (RNA) میباشند که در حدود 29 پروتئین را رمزگذاری میکند. کرونا ویروسها متعلق به سرده کرونا ویرینهها و از خانواده کروناویریدهها هستند که آنها نیز در راسته نیدروویرالها قرار دارند. سرده کرونا ویرینه شامل چهار گونه: آلفا، بتا، گاما و دلتا کرونا ویروسها میباشد، که سویه مولد بیماری کووید-19 بر اساس تجزیه توالی ژنوم، در زیرگروه گونه بتاکروناویروسها طبقهبندی میشود (تصویر 1)(1).
بیماریزایی کووید-19: قطر ویروس کووید-19بین 50 تا 200 نانومتر و ژنوم آن حاوی 29881 جفت باز است. ژنوم این ویروس حداقل چهار پروتئین ساختاری به نامهای نوکلئوکپسید (Nucleocapsid)، سنبله (Spike)، پوشش (Envelope) و غشایی (Membrane) را رمز میکند. در این میان، تنها پروتئین سنبله ورود ویروس به سلول میزبان را میانجیگری میکند (4). ویروس کووید-19 از طریق تعامل با آنزیم نوع 2 مبدل آنژیوتانسین (Angiotensin-converting enzyme 2) وارد سلولهای میزبان میشود. ACE2 پروتئینی است که در بسیاری از بافتها و اندامهای انسان بیان میگردد، دارای فعالیتهای زیستی گستردهای میباشد و جز مهمی از سامانه رنین-آنژیوتانسین-آلدوسترون است که قادر به تبدیل آنژیوتانسین نوع I و نوع II به آنژیوتانسین (7-1) میباشد. کووید-19 از طریق پروتئین سنبله (Spike) خود به ACE2متصل میشود. این اتصال باعث ایجاد یک تغییر ساختاری در پروتئین سنبله (Spike)، میشود که به آن اجازه میدهد تا توسط نوعی پروتئاز تراغشایی در سلول میزبان به نام پروتئاز تراغشایی، سـرین ۲ (TMPRSS2) بریده شود. برش پروتئین سنبله موجب همجوشی (Fusion) غشای سلولهای ویروسی و میزبان و در نتیجه ورود ویروس به داخل سلول میشود. کووید-19 میتواند از دو مسیر وارد سلول شود: ورود از طریق اتصال به سطح سلول و اندوسیتوز. پس از ورود ویروس به سلول میزبان آلوده، ژنوم ویروسی آزاد شده، تکثیر شده و در ذرات ویروسی جدید بستهبندی میشود (تصویر 3و 2) (5,6).
• تشخیص کووید-19: جداسازی ویروس کرونا در کشت سلولی به دلیل فقدان ردههای سلولی و آنتی سرمهای تجاری در دسترس برای کشت، عدم زمان کافی برای رسیدن به نتایج، مؤید دشواری کار، نیاز به تخصص و به دلایل ایمنی بهطور معمول برای اهداف تشخیصی انجام نمیشود. با اینحال، جداسازی ویروس در کشتهای سلولی به منظور خالصسازی آنها جهت شناسایی و تولید واکسنها و عوامل درمانی حیاتی است (9). توموگرافی کامپیوتری (CT) قفسهسینه نیز یکی از اولین روشهای تصویربرداری زنده برای تشخیص بیماریهای مرتبط با سینه پهلو (Pneumonia) است. این روش محدودیتهای ویژه خود را دارد. به عنوان مثال، در یک مطالعه چند مورد با واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR) مثبت هیچگونه ناهنجاری ریوی را در پرتونگاری قفسه سینه نشان ندادند. برعکس، در مطالعه دیگری، موارد منفی RT-PCR یافتههایی را در CT قفسه سینه نشان دادند. علاوه بر این، CT قفسه سینه به تنهایی میتواند منجر به نتایج مثبت کاذب شود زیرا میتواند با سایر عفونتها مانند آنفولانزا، سارس و مرس همپوشانی داشته باشد (10). چندین آزمایش سرولوژیکی مبنی بر ایمنی سنجی با آنزیمهای نشاندار (ELISA) و ایمونوکروماتوگرافی توسط شرکتهای مختلف در سراسر جهان توسعه یافتهاند. آنتیبادیهای ایمونوگلوبین M (IgM) و ایمونوگلوبین G (IgG) شناساییشده در ELISA دارای ویژگی (Specificity) بیش از ۹۵ درصد در تشخیص کووید-19 دارند. بیشتر آزمایشهای مولکولی، برخلاف آزمایشهای سرولوژیکی، در آزمایشگاه تخصصی، با استفاده از تجهیزات پیشرفته و کارکنان بسیار ماهر انجام میشود، بنابراین استفاده از آنها محدود است. RT-PCR استاندارد طلایی برای تشخیص کووید-19 در نظر گرفته میشود تصویر 4 (11).

تصویر 1: آرایهبندی ویروس کووید-19 از راسته تا گونه (2).

تصویر 2: مراحل تکثیر و عفونت ویروس با ژنوم RNA تک رشتهای (3).
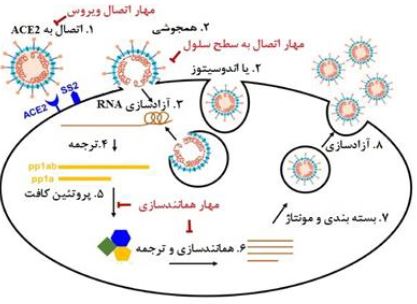
تصویر 3: چرخه تکثیر ویروس کووید-19 (7).
پس از همجوشی ویروس با غشای سلولی، RNA ویروسی به داخل سیتوپلاسم آزاد و به دو پلی پروتئین غیرساختاری pp1a وpp1ab ترجمه میشود. پروتئینهای pp1a وpp1ab تحت خود پروتئین کافت تشکیل مجتمع همانندسازی و تکثیر ویروس را فراهم میآورند (8).
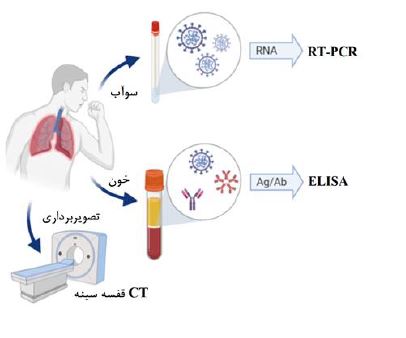
تصویر 4: نمایش طرح کلی از روشهای تحلیلی مختلف موجود برای تشخیص کووید-19(10).
• راهبردهای درمان کرونا بیماری کرونا: مراحل چرخه زندگی ویروس، که اهداف بالقوهای برای درمان دارویی هستند، نیازمند ارزیابی داروهایی هستند که قادر به هدف قرار دادن فعالیتهای سلولی مانند مسدود کردن ورود، اندوسیتوز و همجوشی سنبله با غشای سلولی، مهار آنزیمهای ویروسی، سرکوب التهاب و مهار اجزای ویروسی، از جمله پوشش، غشا، نوکلئوکپسید، و سایر پروتئینهای منضم ویروس هستند (12). همجوشی پروتئین سنبله با گیرنده ACE2 سلول کاهش پاسخ این گیرنده به محرک خارجی را به دنبال دارد. مسدود کنندههای گیرنده آنژیوتانسین (Angiotensin Receptor Blockers)، مهارکنندههای آنزیم تبدیل کننده آنژیوتانسین (Angiotensin Converting Enzyme Inhibitors) و استاتینها که بیان ACE2 را افزایش میدهند ممکن است در درمان کرونا کارایی داشته باشند. اندوسیتوز، کافت پروتئینهای ساختاری ویروسی را در پی دارد که داروهای کلروکین و هیدروکسی کلروکین با اختلال در این عملکرد ممکن است اثر ضد ویروسی ایجاد کنند (13). جدای از کلروکین و هیدروکسیکلروکین، بافیلومایسین، دیفیلین و سالیفنیل هالامید نیز به عنوان نامزدهای ضد ویروسی با طیف گستردهای که از طریق مهار اسیدی شدن اندوزوم میزبان عمل میکنند، مورد توجه علمی زیادی قرار گرفتهاند (14). کاموستات و نافاموستات با هدف قرار دادن TMPRSS2 سلول میزبان که برای فعالسازی پروتئین کافت گلیکوپروتئینS مورد نیاز است موجب مهار همجوشی ویروس با سلول میزبان میشوند (15). داروهایی مانند لوپیناویر، ریتوناویر و داروناویر که از شکست پلی پروتئین به پروتئینهای ساختاری جلوگیری میکنند، مهارکنندههای پروتئاز نامیده میشوند نیز ممکن است در برابر ویروس کرونا مؤثر باشند. راهبرد دیگر برای مبارزه با ویروس کووید-19 شامل هدف قرار دادن مرحله رونویسی معکوس با مهارکنندههای RNA پلیمراز وابسته به RNA (RDRP) مانند رمدسیویر، فاویپیراویر، ریباویرین و آربیدول میباشد. این آنزیم برای تکثیر و رونویسی ویروس ضروری است (16). همچنین، نشان داده شده است که آنتیبادیهای مونوکلونال ضد کووید-19 که پروتئین سنبله را هدف قرار میدهند دارای مزایای بالینی در درمان کرونا هستند (17). سطوح بیش از حد سیتوکین سرم (طوفان سیتوکینی) که منجر به آسیب اندامهای متعدد در بیمارانی که به صورت شدید با کرونا درگیر شدهاند، میشود. بنابراین، پیشگیری و درمان طوفانهای سیتوکینی میتواند جایگزین خوبی برای جلوگیری از پیشرفت کووید-19 باشد. مطالعات بالینی نشان داده است که علت اصلی التهاب افزایش سطح اینترلوکین-6 (IL-6) است. کمپلکس تولید شده از اتصال IL-6 با گیرنده محلول یا گیرنده غشایی IL-6 فعال میشود و پاسخ التهابی را فعال میکند. توسیلیزوماب (آنتیبادی مونوکلونال علیه IL-6) میتواند انتقال پیامی را که باعث پاسخهای التهابی میشود را با اثرگذاری انتخابی بر روی گیرندههای IL-6 مسدود کند. با این حال، جنبههای هزینه و ایمنی میتواند مانع استفاده از توسیلیزوماب در درمان کووید-19 شود. بر اساس مطالعهای که منتشر شده است، ساریلوماب، آنتاگونیست دیگر گیرنده IL-6، ممکن است به بهبودی سریع در بیماران مبتلا به کووید-19 که با التهاب شدید بدنی مشخص میشوند، کمک کند تصویر 5 (18).
یشگیری از بیماری کرونا: واکسنهای غیرفعال یا ضعیف شده دارای مزایایی مانند تحریک گیرندههای شناسایی الگو (Pattern Recognition Receptors) و ایمنی زایی بالا هستند. در این حالت ویروسها زنده و قابل تکثیر هستند اما غیرسمی هستند. با اینحال، به دلیل خطر ویروس¬های زنده، نظارت طولانیمدت برای ارزیابی ایمنی واکسن مورد نیاز است. اخیرا، ویروس کووید-19 نوترکیب از قطعات DNA ویروسی با استفاده از ژنومیکهای مصنوعی سنتز شده است. بر اساس این یافتهها، میتوان کمی سریعتر به نسل واکسنهای ضعیفشده علیه ویروس کووید-19 نزدیک شد. مزایای واکسنهای نوترکیب عبارتند از بیان کافی پروتئین هدف، پایداری طولانیمدت و القای پاسخهای ایمنی قوی که موجب میشود از آنها برای افرادی که سامانه ایمنی ضعیفی دارند نیز استفاده کرد. واکسنهای نوترکیب به ویروسهای زنده اجازه میدهند تا با استفاده از حامل غیربیماریزا ژنهای عوامل بیماریزای خود را وارد سلولهای میزبان کنند، در نتیجه این ژنها به پروتئین مورد نظر ترجمه شده و پاسخ ایمنی مورد نظر را تحریک میکنند. قابل ذکر است، در برخی مواقع، روش بهکارگیری تمام سلول عامل بیماریزا نمیتواند محافظت لازم را بدون واکنشهای جانبی از جمله التهاب، پاسخهای حساسیتزا و خودایمنی فراهم کند. واکسنهای زیرواحد مبتنی بر قطعات میکروارگانیسمها توانایی غلبه بر این چالشها را دارند. واکسنهای زیر واحد فقط شامل اجزای آنتیژنی عامل بیماریزا هستند که برای برانگیختن پاسخهای ایمنی مؤثر مورد نیاز هستند. یک پلیساکارید، یک اسیدنوکلئیک یا یک پروتئین همگی میتوانند به عنوان آنتیژن استفاده شوند. از این میان تنها واکسنهای زیرواحد پروتئینی علیه ویروس کووید-19 ساخته میشود. در بین پروتئینهای ساختاری و غیرساختاری کووید-19، پروتئین سنبله به دلیل آنتیژنیسیته بالا و قدرت برای القای پاسخهای ایمنی قوی، یک هدف ایدهآل برای توسعه واکسن است. هنگامی که ویروسها از طریق عفونت وارد سلول میزبان میشوند، آنتیژن رمزگذاری شده توسط اسید نوکلئیک بیان میشود که باعث واکنش سلولی با آنتیبادی میشود. بر اساس این اصل، واکسیناسیون با اسیدنوکلئیک یکی دیگر از روشهای ایمنسازی مؤثر است که از اسیدهای نوکلئیک سنتز شده مصنوعی برای برانگیختن پاسخ ایمنی استفاده میکند، مانند پاسخی که توسط واکسنهای ضعیف شده ایجاد میشود. ویژگیهای ایمنی بهبودیافته که فرآیند عفونی را تقلید میکنند، از مزایای بالقوه واکسنهای بر پایه اسید نوکلئیک هستند تصویر 6 (18).

تصویر 5: اهداف درمانی داروهای در نظر گرفته شده برای استفاده مجدد در برابر کووید-19. 1.
ویروس از طریق ادغام پروتئینهای S ویروسی با گیرنده سلولی ACE2 وارد سلول میشود و به دنبال آن کاهش ACE2 ایجاد میشود. مسدودکنندههای گیرنده آنژیوتانسین (ARBs)، مهارکنندههای آنزیم مبدل آنژیوتانسین (ACEIs) و استاتینها بیان ACE2 را افزایش میدهند، بنابراین ممکن است در این شرایط کارایی داشته باشند. 3. همجوشی با اندوسیتوز ویروس ادامه مییابد، که در آن pH پایین اندوزومی به لیز پروتئینهای ساختاری ویروسی کمک میکند. اختلال در این محیط اسیدی توسط بازهای دیپروتیک مانند کلروکین و هیدروکسی کلروکین ممکن است اثر ضد ویروسی ایجاد کند. 4، 5. آزادسازی اسید نوکلئیک به سیتوپلاسم و ترجمه پروتئینهای ویروسی با استفاده از ریبوزومهای میزبان، 6. پروتئولیز توسط آنزیم پروتئاز اصلی ویروسی باعث میشود پروتئینهای عملکردی به عنوان مثال RDRP. بنابراین، مهار آنزیم اصلی پروتئاز توسط مهارکنندههایی مانند لوپیناویر، ریتوناویر و داروناویر ممکن است در برابر ویروس مؤثر باشد. 7. RDRP برای تکثیر و رونویسی ویروس ضروری است. مهارکنندههای RDRP، رمدسیویر، فاویپیراویر، ریباویرین و آربیدول ممکن است در برابر کروناویروسها موثر باشند. 7، 8. ترجمه و پروتئین کافت به پروتئینهای ساختاری و به دنبال آن بستهبندی، ویریونهای دست نخورده را میسازد که از سلول خارج میشوند (13).

تصویر 6: خلاصهای از انواع استراتژی برای توسعه واکسن علیه کووید-19(19).
• اهمیت سامانههای نانو در دارورسانی: فنآوری نانو دارای توان تسهیل توسعه سامانههای دارورسانی متنوع برای درمان عفونتهای کووید-19را به دلیل اندازه کوچک، ویژگیهای ساختاری و توانایی تقلید رفتار سلول یا اجزای سلولی انسان دارا میباشد. طیف گستردهای از اجزای فعال دارویی، از جمله ترکیبات ضد ویروسی، زیستی و اسید نوکلئیکی میتوانند توسط نانوحاملها بارگیری و تحویل داده شوند (12). سامانههای نانو توانایی گریز از پاسخهای ایمنی که درمان را دشوار میکنند، فراهم میآورند. به علت افزایش اثر نفوذپذیری و ماندگاری میتوانند داروها را بهصورت دقیق به اهداف موردنظر برسانند که تجمع پایینتر داروها در اندامهای غیر هدف و درنتیجه کاهش اثرات سمی آنها را به دارد. دارای مساحت سطح بالایی هستند که موجب بارگیری بیشتر دارو و اصلاحپذیری آنها با عوامل گوناگون با طیف ساختاری گسترده میشود. با این وجود، گرچه نانو فرمولاسیون میتواند عوارض جانبی داروها را کاهش دهد، اما باید عوارض جانبی خود آنها را نیز در نظر گرفت. سمیت نانوذرات ساخته شده از مواد مختلف میتواند در سطوح مولکولی، سلولی و بافتی رخ دهد (20). نانوذرات با اتصال به پوشش ویروسی یا پروتئین آنها از تعامل با سلول میزبان و در نتیجه از تکثیر سلولی جلوگیری میکند. برای این منظور، نانوذرات با ژنوم ویروسی یا پروتئین هسته ادغام میشوند و از تکثیر و و اتصال ویروس جلوگیری میکنند. نانوذرات پلیمری اثرات تراتوژنیسیته ندارند، غیرسمی بوده و دارای زیست سازگاری میباشند. مواد ناشی از تجزیه آنها در سلولها هیچ اثر سمی برجای نمیگذارد. از پلیمرهای خودسامان یافته (Self-assembled) میتوان برای به دام انداختن داروهای نامحلول استفاده کرد. طوریکه اجازه انتشار کنترل شده داروها را به دلیل ساختار پایدار آنها بدهد. نانوذرات پلیمری حاوی کیتوسان به دلیل ویژگیهای غیرسمی، زیستسازگاری و توانایی باز کردن پیوندهای قوی بین سلولهای بافت پوششی و قدرت تبدیل به ظاهر و اندازههای دلخواه، توجه ویژهای را برای درمان از طریق داخل بینی به خود جلب کردند. نانوامولسیونها ماهیت سمی ندارند و باعث تحریک نمیشوند. علاوه بر این، آنها دارای توانایی افزایش فراهمی زیستی داروها هستند، پایداری فیزیکی دارند و میتوانند به حل شدن داروهای چربی دوست کمک کنند. آنها همچنین دارای قطرات ریز با مساحت سطح بالایی هستند که ظرفیت جذب بیشتری را فراهم میکنند و میتوانند در اشکال دارویی مختلف از جمله مایعات، کرمها، فومها و اسپریها فرموله شوند. لیپوزومها وزیکولهای لیپیدی سلول مانندی هستند که دارای دولایه فسفولیپیدی منظم هستند و دارای مزایای زیادی مانند عدم سمیت، عدم ایمنیزایی، تغییر توزیع دارو در داخل بدن، امکان رهش مداوم داروها، طولانی شدن زمان عمل دارو، افزایش شاخص درمان دارویی، به حداقل رساندن عوارض جانبی دارو و به دام انداختن مولکولهای آبدوست، آبگریز، یونی هستند. لازم به ذکر است که با تنظیم مواد لیپیدی میتوان اندازه ذرات و شیمی سطح آنها را کنترل کرد. دندریمرها سامانههای دارورسانی مصنوعی و شاخهدار با تنوع شکل هستند که معمولاً برای تجویز داروهای نامحلول استفاده میشوند. وزن مولکولی آنها قابل تنظیم است. علاوه بر این، آنها را میتوان با گروههای عاملی مختلف مزدوج کرد و آنها را به یک ماده منحصربهفرد برای تحویل دارو تبدیل کرد. بهطور خلاصه که با توجه به ویژگیهای زیستی برجسته آنها، بهطور گسترده در کاربردهای زیست پزشکی و دارویی استفاده میشوند. نانوسوسپانسیونها نیز اثربخشی خود را در دارورسانی داروهای نامحلول در آب و نامحلول در چربی نشان دادهاند. آنها به دلیل یکپارچگی خود برجسته و نسبت به سایر روشهای بهکارگیری قابل اعتماد هستند. علاوه بر این، سرعت انحلال و حلالیت اشباع داروها را بهبود میبخشند (21). نانوذرات ویروس مانند (Virus-like Nano Particles) نانوذرات کروی شکلی هستند که از چندین مولکول با اندازههای بین 20 تا 200 نانومتر تشکیل شدهاند. این نانوذرات از خودآرایی پروتئینهای مشتق شده از کپسیدهای ویروسی حاصل میشوند. آنها به عنوان نانو مواد جالبی معرفی شدند که حاوی مواد ژنتیکی نیستند اما توانایی تقلید دقیق ویروس یا آنتیژن واقعی از نظر ساختار و تعیین کنندههای آنتیژنی را دارند. این امر سبب میشود که این نانومواد برای سلولهای ارائهدهنده آنتیژن بسیار رباینده باشند که به راحتی قابل شناسایی هستند و در نتیجه میتوانند پاسخ ایمنی را تحریک کنند. یکی دیگر از مزایای نانوذرات ویروس مانند پتانسیل بالای آنها برای استفاده به عنوان یک ناقل در ژن درمانی است، بهطوری که میتوان از آنها به عنوان یک سامانه هوشمند برای تحویل دقیق ژن به محل جهش یا ترمیم ژنها با هدف تغییر بیان ژن یا رمزگذاری یک ژن استفاده کرد. علاوه بر این، درمان امیدوارکننده با این نانوذرات بر این واقعیت متکی است که آنها به راحتی میتوانند از تخریب آنزیمی در مقایسه با تجویز ویروئیدهای بدون پوشش جلوگیری کنند. همچنین آنها اندازه بسیار کوچکی دارند که به آنها اجازه نفوذ به هسته سلولی را میدهد. نانوذرات پروتئین خود سامان یافته (Self-assembled Nano Particles) نوع جدیدی از نانوذرات هستند که از الیگومریزاسیون پروتئینهای مونومر با قطری بین 20 تا 100 نانومتر بهدست میآیند. این نانوذرات را میتوان با استفاده از بسیاری از زیست مواد مهندسی کرد که پپتیدها مطلوبترین آنها هستند، زیرا نانوذرات مبتنی بر پروتئین میتواند به راحتی برای کاربردهای متعدد توسعه یافته و اصلاح شود. آنها در تحویل دارو با توجه به توانایی متمایزی که برای عبور از غشای سلولی دارند میتوانند بهطور ویژه و ایمن داروها، ژنها و اسیدهای نوکلئیک را بهطور مستقیم به هسته سلول تحویل دهند (تصویر 7) (22).

تصویر 7: مهار اسیدی شدن آندوزوم برای توقف ورود سیتوزولی ویروس¬ها(14).
• اهمیت سامانههای نانو در تشخیص: نانو مواد به دلیل ماهیت بسیار پایدار در محیطهای مختلف و زیست سازگاری با سیالات فیزیولوژیکی میتوانند به عنوان مبدل انتخاب و مورد استفاده قرار گیرند. علاوه بر این، نانومواد شیمی سطحی را فراهم میکنند که میتواند برای زیست مزدوج سازی مولکولها و همچنین انرژی سطحی بالا و اثر تقویتی قوی روی پیامها مفید باشد. نانوذرات فلزی مانند نانوذرات طلا و نقره، نانومواد مبتنی بر کربن (نانولولهها و گرافن)، بلورهای فوتونی، نانوژلها و میکروژلها به دلیل مزایایی که دارند برای کاربردهای حسگر زیستی استفاده میشوند. قبلا ثابت شده است که ذرات مبتنی بر نانو کربن بستر مناسبی برای تشخیص باکتری با استفاده از تکنیکهای مختلف مانند الکتروشیمی و پیزوالکتریک و همچنین برای تهیه کیتهای مبتنی بر میکروسیال فراهم میکنند (23).
• آزمایش در بالین بیمار: آزمایش تشخیصی بر بالین بیمار یا آزمون در نقطه مراقبت (Point-Of-Care Testing) به عنوان آزمایشی تعریف میشود که با استفاده از کیت یا نوار در خانه یا در مکانی که از بیمار مراقبت میشود انجام میشود. حیاتیترین جز این آزمون، حسگر زیستی است که برای انجام یک سنجش زیست شیمیایی برای شناسایی بیماریزا استفاده میشود. مزایای استفاده از آزمون در نقطه مراقبت عبارتند از: (1) حداقل فضای مورد نیاز برای تست و ذخیرهسازی. (2) تجزیه و تحلیل در مقیاس وسیع. (3) آزمایش را میتوان در مکآنهای مختلف انجام داد و (4) انعطافپذیری در رفع نیازهای مختلف پزشکی. آزمون در نقطه مراقبت تشخیص را بدون ارسال نمونه به آزمایشگاههای تخصصی امکانپذیر میکند. آزمایش جریان جانبی (Lateral Flow Test) برای تشخیص کووید-19 یکی از این روشهای آزمون در نقطه مراقبت است (23). نوارهای جریان جانبی از یک غشای کاغذ مانند تشکیل شده است که عموماً از نیتروسلولز پوشیده شده با دو خط تشکیل شده است: خط اول آنتیبادی مزدوج با نانوذرات طلاست که به عنوان خط آزمایش شناخته میشود. خط دوم خط گرفتن آنتیبادی است که به عنوان خط کنترل شناخته میشود. نمونه بر روی غشا که به عنوان لایه نمونه نیز شناخته میشود، رسوب میکند و مواد مورد تجزیه در سراسر نوار حرکت میکنند تا زمانی که با عمل موئینگی به خط اول برسند. همانطور که مواد مورد تجزیه از طریق اولین خط آزمایش حرکت میکنند، آنتیژنهای موجود در ماده مورد تجزیه به مزدوج متصل میشوند و این کمپلکس از طریق غشا به جلو حرکت میکند. هنگامی که به خط دوم میرسد، با آنتیبادیهای جذب متصل میشود و یک خط رنگی ظاهر می شود. علاوه بر ایمونوگلوبولینها اسید نوکلئیک با رشته های DNA یا RNA یا آپتامر که یک DNA تک رشتهای یا رشته RNA است نیز میتواند برای آزمونهای جریان جانبی استفاده شود. مزدوج شدن آنتیبادیها با نانوذرات طلا دستگاه را قابل اعتمادتر و حساستر میکند (23).
• استفاده از رنگسنجی در تشخیص ویروس کرونا: نانوذرات طلا معمولاً در سنجشهای هیبریداسیون رنگ سنجی استفاده میشوند. یکی از این سنجشها، سنجش رنگ سنجی مبنی بر پیوند دیسولفید است که توسط کیم (Kim) و همکاران طراحی شده است. نانوذرات طلا به دو دلیل در توسعه نانوسنجشها به شدت مورد مطالعه قرار گرفتهاند: سهولت اصلاح سطح الکترواستاتیک با بخشهای مختلف مانند آنتیژنها و آنتیبادیها و تغییر تشدید پلاسمون سطحی (Surface Plasmon Resonance) و تغییرات رنگ. سنجشهای رنگسنجی از ویژگیهای نوری نانوذرات طلا و الیگونوکلئوتیدهای آنتیسنس برای فسفوپروتئین N کووید-19 خاص بهرهبرداری میکنند که توسط تیول برای ترکیب آن اصلاح شدند. در صورتی که توالی RNA هدف از کووید-19 وجود داشته باشد، الیگونوکلئوتیدهای آنتیسنس اصلاحشده با تیول روی مجموعه نانوذرات طلا و آنها را پوشانده و تغییری در تشدید پلاسمون سطحی مشاهده میشود. با افزودن ریبونوکلئاز H، رشته RNA از هیبرید RNA-DNA جدا میشود، که منجر به تشکیل یک رسوب قابل تشخیص بصری می¬شود که توسط تجمع در بین نانوذرات طلا تسهیل میشود(25, 23).
• ایمنی سنجی بر اساس نانوذرات مغناطیسی: نانوذرات مغناطیسی (Magnetic Nanoparticles) نیز برای رسیدن به هدف به عنوان حامل استفاده میشوند. گزارش شده است که از این نانوذرات برای تشخیص RNA کووید-19 و پاسخ آنتیبادی میزبان استفاده میشود. نشان داده شده است که نانوذرات اکسید آهن پوشش داده شده با سیلیس میل ترکیبی قوی با RNA کووید-19دارند، زیرا این نانوذرات باعث باز شدن ویروس میشوند. در این روش از آهنربا برای جداسازی نانوذرات پوشش داده شده با RNA از محلول نمونه استفاده میشود. سنجش دقیق نیاز به استخراج و جداسازی کارآمد و خودکار اسیدهای نوکلئیک از نمونهها دارد تا از نتایج منفی کاذب جلوگیری شود. این روش ساده و مقرون به صرفه است و به استخراج موثر RNA از نمونههای بیمار کمک میکند (27).
• نانوزیست حسگرها: بهطور کلی، بسترهای حسگر زیستی برای تشخیص کووید-19 بر اساس سه جنبه مهم استوار است: هدف برای شناسایی (به عنوان مثال، RNA و پروتئین های ویروسی، یا ایمونوگلوبولینهای انسانی)، روشهای شناسایی (بر اساس آپتامرها، آنتیبادیها، کاوشگرهای اسید نوکلئیک، گیرندهها) و تقویت پیامها و سامانههای انتقال (بر اساس تشدید پلاسمون سطحی، الکتروشیمیایی، نوری، سامانههای مکانیکی و پیامهای فلورسنت). برهمکنش بین آنتیبادی و آنتیژن یا گیرنده و لیگاند مربوطه را میتوان از طریق تغییرات ساختاری پروتئین-های حسگر شناسایی کرد. علاوه بر این، تشخیص مبنی بر واکنشهای آنزیمی یکی از مهمترین روشهای تشخیص است (تصویر 10و9 و 8 و7) (28).
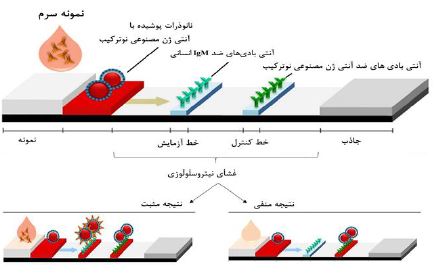
تصویر 8: تصویری از نوارهای ایمنی سنجی جریان جانبی، نشان دهنده اجزای مختلف آن و نتایج مورد انتظار در تستهای مثبت و منفی.
در یک آزمایش مثبت، نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب بهIgM ضد کووید-19 متصل میشوند. آنتیبادیهای کووید-19 در سرم بیماران آلوده وجود دارد و مجموعهای را تشکیل میدهد که توسط IgM ضد آنتیبادیهای کووید-19 بیحرکت در خط آزمایش که قرمز رنگ میشود، جذب میشود. نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب بیش از حد از خط آزمایش به خط کنترل مهاجرت میکنند، جایی که آنتیبادیهای ضد آنتیژنهای مصنوعی نوترکیب بیحرکت آنها را میگیرند و باعث ایجاد خط قرمز دوم میشوند. در یک آزمایش منفی، IgM ضد آنتیبادیهای کووید-19 در سرم بیمار وجود ندارند، هیچ کمپلکسی با نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب ایجاد نمیشود که مانع از تعامل با آنتیبادیهای ضد IgM میشود و از تشکیل رنگ در خط آزمایش (بدون رنگ) جلوگیری میکند. در خط کنترل، مزدوجهای نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب توسط آنتیبادیهای ضد آنتیژنهای مصنوعی نوترکیب تثبیتشده جذب میشوند و باعث ایجاد خط قرمز میشوند (24)

تصویر 9: یک سوآب بینی حاوی نمونه آزمایشی با یک لوله آزمایش ساده آزمایشگاهی مخلوط میشود.
لوله آزمایش حاوی مایعی مخلوط با نانوذرات طلا است که به مولکولی متصل شده است که به ویروس کرونا متصل میشود. اگر ویروس وجود داشته باشد، نانوذرات طلا، محلول را به رنگ آبی تیره (ته لوله) تبدیل میکند و رسوب مشاهده میشود. در صورت عدم وجود ویروس، محلول رنگ بنفش اصلی خود را حفظ میکند (26).
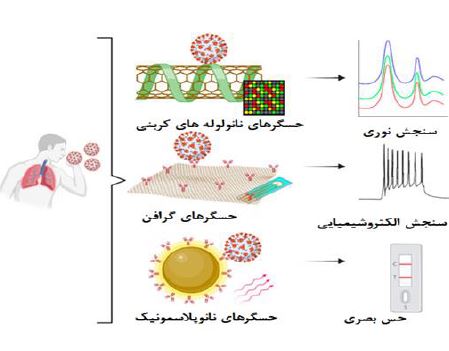
تصویر 10: نانوحسگرهای مبنی بر گرافن، نانولولههای کربنی یا نانومواد پلاسمونیک و کاربرد آنها برای تشخیص کووید-19(29).
اهمیت سامانههای نانو در واکسیناسیون: چندین نانو واکسن برای کووید-19 ایجاد شده است که آنها را می توان بر اساس اجزای عملکردی خود به سه دسته اصلی طبقه بندی کرد: ویروس، بر پایه پروتئین و بر پایه اسید نوکلئیک. نانو واکسنها برای بهبود کارایی واکسن و راهبردهای ایمنسازی از طریق سازوکارهای مختلف مرتبط با نانوذرات مانند محافظت از آنتیژنها در برابر تخریب، کنترل تحویل آنتیژنها از قالب نانوذرات و تنظیم جذب و پردازش آنتیژن توسط سلولهای ارائهدهنده آنتیژن طراحی شدهاند. نانوواکسنها از طریق کپسولهسازی آنتیژنهای ویروس کووید-19 یا قرار دادن آنها بر روی سطح نانوذرات ساخته میشوند و نانوذراتی با ساختار ایمنی مشابه تولید میکنند. مونتاژ مبتنی بر ساختار متداولترین روش در تولید نانو واکسنهای ویروس کرونا است. الگوی مونتاژ برای کنترل پایداری ترمودینامیکی نانوذرات مونتاژ شده و جلوگیری از تجمع بسیار مهم است. نانوذرات طلا معمولادر نانو واکسنها استفاده میشوند، زیرا علاوه بر اینکه حامل آنتیژن هستند میتوانند به عنوان عامل کمکی (Adjuvant) در ایمنسازی عمل کنند. نانوذرات ویروس مانند، از نظر ساختاری شبیه به ذرات ویروس، اما بدون ژنوم ویروسی هستند، معمولا در ساخت واکسن استفاده میشوند. آنها را میتوان با انکوباسیون نانوذرات طلا به عنوان هسته با پروتئینهای کووید-19 مانند پروتئین سنبله که به طور خود به خود سطح را عاملدار میکنند، ساخت. این واکسنها میتوانند تحویل آنتیژن لنفاوی را افزایش دهند و پاسخ سلولی و هومورال را در مقایسه با آنتیژنهای آزاد افزایش دهند (25).
1. نانوذرات کپسوله شده با آنتیژن
• نانوذرات لیپیدی: نانوذرات لیپیدی (Lipid Nano Particles) برای تحویل محمولههای اسید نوکلئیک (DNA و RNA) رمزکننده آنتیژنهای واکسن استفاده میشوند. کپسوله سازی در نانوذرات لیپیدی هم برای محافظت از محموله mRNA از تخریب سریع توسط Rnaseها و هم برای تسهیل تحویل سلولی mRNA که به دلیل محدودیتهای اندازه و بار چالش برانگیز است، عمل میکند. یکی از اجزای کلیدی نانوذرات لیپیدی، یک لیپید قابل یونیزاسیون است که در pH پایین دارای بار مثبت است تا امکان محصور کردن mRNA با بار منفی را فراهم کند، در حالیکه در pH فیزیولوژیکی خنثی است. نانوذرات لیپیدی از طریق اندوسیتوز وارد سلولها میشوند و در pH پایین اندوزومها، لیپید قابل یونیزاسیون دارای بار مثبت میشود و میتواند غشای اندوزومی را مختل کند و اجازه میدهد محموله mRNA برای ترجمه پروتئین در سیتوپلاسم آزاد شود. آنها اغلب حاوی یک لیپید پژیله شده (PEGylated) برای به حداقل رساندن اپسونیزاسیون (Opsonization) در داخل بدن و چربیهای کمکی مختلف و کلسترول برای حمایت از تشکیل ذرات هستند. MRNA-LNPها کاملاً مصنوعی هستند و بدون نیاز به سلولهای زنده ساخته میشوند و امکان تولید سریع واکسنها را در مقیاس وسیع پس از در دسترس بودن ژنوم ویروسی فراهم میکنند. اولین دو واکسن کووید-19 که برای استفاده تأیید شد، نانوذرات لیپیدی رها کننده mRNA رمزکننده پروتئین سنبله مهندسی شده بودند. هم ذرات mRNA و هم ذرات لیپیدی حاوی خواص ایمنی تحریککننده قوی هستند که نیاز به فرمولاسیون اضافی با عامل کمکی را نفی میکند. در واقع، ایمنیزایی ذاتی mRNA میتواند مشکل ساز باشد. هر دو واکسنهای مدرنا (Moderna) و فایزر (Pfizer) از mRNA حاوی نوکلئوزیدهای اصلاحشده استفاده میکنند که برای محدود کردن ایمنیزایی mRNA طراحی شدهاند و امکان دوزهای بالاتر واکسن و افزایش ظرفیت ترجمه را فراهم میکنند (30).
• نانو ذرات پلیمری: پلیمرهایی مانند کیتوسان، پلی (لاکتیک-کو-گلیکولیک اسید)، یا پلیاتیلن ایمین (PEI) به طور گسترده در گذشته برای تهیه واکسنهای نانوذراتی برای سایر کروناویروسها استفاده شدهاند. کیتوزان، یک پلیساکارید طبیعی، برای محصور کردن پروتئینهای RBD (Receptor-Binding Domain) کووید-19 مورد استفاده قرار گرفت. کیتوزان با بار مثبت می تواند بهصورت الکترواستاتیکی با موکوس با بار منفی سیالیک اسید تعامل داشته باشد و چسبندگی نانوذرات را در سطوح اپیتلیال راه هوایی پس از تجویز داخل بینی تسهیل کند. علاوه بر این، سطح نانوذرات کیتوزان با قندهای مانوز آراسته شده است. تشخیص مانوز توسط ایمنی ذاتی میتواند منجر به افزایش جابجایی نانوذرات به شبکه سلولهای دندریتیک فولیکولی و رسوب در مراکز اصلی غدد لنفاوی شود (30).
2. نانوذرات ارائه دهنده آنتیژن
• ذرات ویروس مانند: نانوذرات ویروس مانند مجموعههایی در اندازه نانو از پروتئینهای ساختاری ویروسی هستند که میتوانند به عنوان وسیله انتقال آنتیژن واکسن عمل کنند. آنها ویژگیهای مولکولی و ریخت شناختی ویریونهای ویروسی اصلی را تقلید می کنند، در حالیکه فاقد مواد ژنتیکی هستند که آنها را غیر عفونی و غیر قابل تکثیر میکند. چندین واکسن بر پایه نانوذرات ویروس مانند کووید-19 در حال توسعه بالینی و پیش بالینی هستند و NCT04636697 پیشرفتهترین آنها در آزمایشهای بالینی است که توسط شرکت کانادایی مدیکاگو (Medicago) توسعه یافته است. کیفیت و میزان پاسخ های آنتیبادی به دنبال یک دوز واحد از واکسن بر پایه نانوذرات ویروس مانند در مقایسه با آنتیژن محلول بیشتر است (30).
• میسلها: میسلها ساختارهای دوگانه دوست (Amphiphilic) خود سامان یافته هستند که میتوانند پروتئینهای کووید-19 را تحویل دهند، نمونهای از آنها واکسن نوواواکس (Novavax) است که در حال حاضر در مرحله پایانی کارآزمایی بالینی قرار دارد(30).
• نانوذرات پروتئین خود سامان یافته: بسترهای نانوذرات مبنی بر پروتئین نیز برای تحویل واکسنهای پروتئینی زیر واحد کووید-19 توسعه یافتهاند. یک نانوذره فریتین خود سامان یافته پوشیده با پروتئین سنبله کووید-19 (NCT04784767) در حال حاضر در مرحله آزمایش بالینی فاز 1 است (30).
• لیپوزومها: لیپوزومها مجموعههای نانوساختاری از فسفولیپیدهای دوگانه دوست با یک یا چند لایه دولایه لیپیدی هستند که غشایی را تشکیل میدهند که بر خلاف نانوذرات، یک هسته آبی را محصور میکنند. لیپوزومها برای تحویل آنتیژنهای واکسن کووید-19 استفاده شدهاند. در یک کارآزمایی بالینی، زیر واحدهای RBD به سطح لیپوزومها متصل شدند تا واکسنهای RBD-لیپوزومی را تشکیل دهند (تصویر 12و 11) (30)
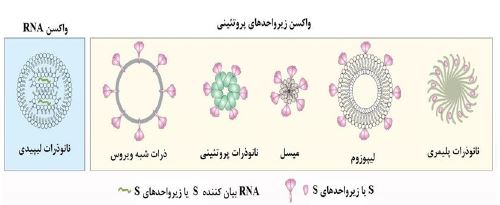
تصویر 11: انواع مختلف بسترهای نانوذراتی که برای طراحی واکسنهای کووید-۱۹ مورد استفاده قرار میگیرند (30).
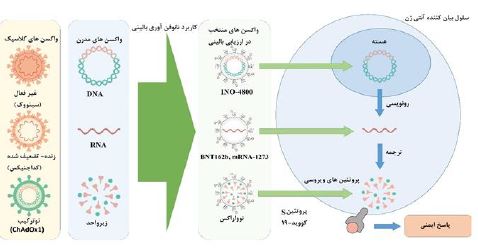
تصویر 12: واکسن کلاسیک، واکسن مدرن و واکسن تولید شده با به کارگیری نانو فنآوری علیه ویروس کووید-19(18).
نتیجهگیری
ورود فنآوری نانو به حوزههای مختلف از جمله پزشکی موجب ظهور پیشرفتهای شگفت انگیزی شده است که بیشک بدون ویژگیهای فیزیکوشیمیایی سامانه¬های نانو میسر نمی-شد. حوزه درمان، تشخیص و پیشگیری از بیماریها از جمله بیماری نوظهور کرونا که تمام دنیا را متأثر کرد از این رهآورد بیتأثیر نماند. طیف گسترده سامانه¬های نانو با ویژگیهای متفاوت امکان انتقال انواع ذرات، میکروارگانیسمها، ملکولهای شیمیایی مانند داروها و زیست ملکولها شامل ساختارهای پروتئینی، نوکلئوتیک اسیدی و پلیساکاریدی به انواع سلولها و بافتها را فراهم نموده است. با دخالت نانو فنآوری در حوزه پیشگیری، هم در تولید واکسن و هم ماسک موجب محافظت قطعی در برابر ویروس خطرناک عامل این بیماری شد. واکسنهایی که اثربخشی آنها مورد تأیید سازمانهای جهانی بهداشت قرار گرفتند و به بالین راه یافتند، نیز از این فنآوری بهره بردهاند. در حوزه تشخیص هم به کمک تکنیکهای پرقدرت مانند PCR-RT و ELISA آمد و هم موجب فراهم آمدن کیتهایی با سرعت سنجش بالا و قدرت تشخیص قابل رقابت با روشهای طلایی شد. در زمینه درمان نیز به منظور دارورسانی داروهای از پیش موجود مورد آزمون قرارگرفت. همچنین، نانوموادی در مورد آزمایش قرار گرفتند که دارای زیستسازگاری و ویژگی ضد ویروسی با خطر کمتر مقاومت دارویی هستند. از اینرو میتوان مداخله نانو فنآوری به حوزه پیشگیری، تشخیص و مقابله با ویروس کرونا را موفق دانست و برای ریشه کنی نه تنها این ویروس بلکه سایر عوامل بیماریزا امیدوار کننده دانست (تصویر 13).
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
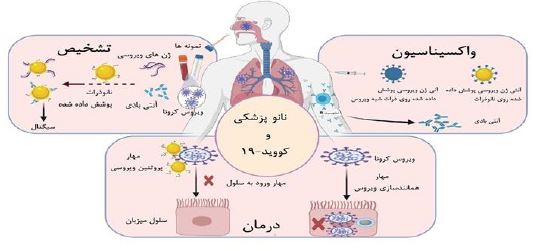
تصویر 13: نانوپزشکی به عنوان یک رویکرد امیدوارکننده برای تشخیص، درمان و پیشگیری از کووید-19 (25).
در اواخر دسامبر سال 2019 شیوع نوع جدیدی از کروناویروس از شهر ووهان (Wuhan) مرکز استان هوبئی (Hubei) در کشور چین آغاز شد. این ویروس که سبب بروز عفونت متوسط تا شدید سامانه تنفسی در انسان میشد، در زمان کوتاهی با سرعت زیاد در تمام جهان گسترش یافت. این ویروس که کووید-19 (COVID-19) نام گرفت با مرگ بیش از شش میلیون نفر در سراسر دنیا سبب نگرانی جهانی شد. براساس گزارش پژوهشگران این ویروس بهطور مداوم در حال تکامل است و میتواند از طریق ناقلین بدون علامت منتشر بشود، که این امر تهدید کننده سلامت جهانی است. کروناویروسها جزء ویروسهای پوششدار حاوی ژنوم تک رشتهای و غیر قطعهای با قطبیت مثبت و حامل یکی از بزرگترین ژنومها در میان خانوادههای ویروسی با ژنوم ریبونوکلئیک (RNA) میباشند که در حدود 29 پروتئین را رمزگذاری میکند. کرونا ویروسها متعلق به سرده کرونا ویرینهها و از خانواده کروناویریدهها هستند که آنها نیز در راسته نیدروویرالها قرار دارند. سرده کرونا ویرینه شامل چهار گونه: آلفا، بتا، گاما و دلتا کرونا ویروسها میباشد، که سویه مولد بیماری کووید-19 بر اساس تجزیه توالی ژنوم، در زیرگروه گونه بتاکروناویروسها طبقهبندی میشود (تصویر 1)(1).
بیماریزایی کووید-19: قطر ویروس کووید-19بین 50 تا 200 نانومتر و ژنوم آن حاوی 29881 جفت باز است. ژنوم این ویروس حداقل چهار پروتئین ساختاری به نامهای نوکلئوکپسید (Nucleocapsid)، سنبله (Spike)، پوشش (Envelope) و غشایی (Membrane) را رمز میکند. در این میان، تنها پروتئین سنبله ورود ویروس به سلول میزبان را میانجیگری میکند (4). ویروس کووید-19 از طریق تعامل با آنزیم نوع 2 مبدل آنژیوتانسین (Angiotensin-converting enzyme 2) وارد سلولهای میزبان میشود. ACE2 پروتئینی است که در بسیاری از بافتها و اندامهای انسان بیان میگردد، دارای فعالیتهای زیستی گستردهای میباشد و جز مهمی از سامانه رنین-آنژیوتانسین-آلدوسترون است که قادر به تبدیل آنژیوتانسین نوع I و نوع II به آنژیوتانسین (7-1) میباشد. کووید-19 از طریق پروتئین سنبله (Spike) خود به ACE2متصل میشود. این اتصال باعث ایجاد یک تغییر ساختاری در پروتئین سنبله (Spike)، میشود که به آن اجازه میدهد تا توسط نوعی پروتئاز تراغشایی در سلول میزبان به نام پروتئاز تراغشایی، سـرین ۲ (TMPRSS2) بریده شود. برش پروتئین سنبله موجب همجوشی (Fusion) غشای سلولهای ویروسی و میزبان و در نتیجه ورود ویروس به داخل سلول میشود. کووید-19 میتواند از دو مسیر وارد سلول شود: ورود از طریق اتصال به سطح سلول و اندوسیتوز. پس از ورود ویروس به سلول میزبان آلوده، ژنوم ویروسی آزاد شده، تکثیر شده و در ذرات ویروسی جدید بستهبندی میشود (تصویر 3و 2) (5,6).
• تشخیص کووید-19: جداسازی ویروس کرونا در کشت سلولی به دلیل فقدان ردههای سلولی و آنتی سرمهای تجاری در دسترس برای کشت، عدم زمان کافی برای رسیدن به نتایج، مؤید دشواری کار، نیاز به تخصص و به دلایل ایمنی بهطور معمول برای اهداف تشخیصی انجام نمیشود. با اینحال، جداسازی ویروس در کشتهای سلولی به منظور خالصسازی آنها جهت شناسایی و تولید واکسنها و عوامل درمانی حیاتی است (9). توموگرافی کامپیوتری (CT) قفسهسینه نیز یکی از اولین روشهای تصویربرداری زنده برای تشخیص بیماریهای مرتبط با سینه پهلو (Pneumonia) است. این روش محدودیتهای ویژه خود را دارد. به عنوان مثال، در یک مطالعه چند مورد با واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR) مثبت هیچگونه ناهنجاری ریوی را در پرتونگاری قفسه سینه نشان ندادند. برعکس، در مطالعه دیگری، موارد منفی RT-PCR یافتههایی را در CT قفسه سینه نشان دادند. علاوه بر این، CT قفسه سینه به تنهایی میتواند منجر به نتایج مثبت کاذب شود زیرا میتواند با سایر عفونتها مانند آنفولانزا، سارس و مرس همپوشانی داشته باشد (10). چندین آزمایش سرولوژیکی مبنی بر ایمنی سنجی با آنزیمهای نشاندار (ELISA) و ایمونوکروماتوگرافی توسط شرکتهای مختلف در سراسر جهان توسعه یافتهاند. آنتیبادیهای ایمونوگلوبین M (IgM) و ایمونوگلوبین G (IgG) شناساییشده در ELISA دارای ویژگی (Specificity) بیش از ۹۵ درصد در تشخیص کووید-19 دارند. بیشتر آزمایشهای مولکولی، برخلاف آزمایشهای سرولوژیکی، در آزمایشگاه تخصصی، با استفاده از تجهیزات پیشرفته و کارکنان بسیار ماهر انجام میشود، بنابراین استفاده از آنها محدود است. RT-PCR استاندارد طلایی برای تشخیص کووید-19 در نظر گرفته میشود تصویر 4 (11).

تصویر 1: آرایهبندی ویروس کووید-19 از راسته تا گونه (2).

تصویر 2: مراحل تکثیر و عفونت ویروس با ژنوم RNA تک رشتهای (3).

تصویر 3: چرخه تکثیر ویروس کووید-19 (7).
پس از همجوشی ویروس با غشای سلولی، RNA ویروسی به داخل سیتوپلاسم آزاد و به دو پلی پروتئین غیرساختاری pp1a وpp1ab ترجمه میشود. پروتئینهای pp1a وpp1ab تحت خود پروتئین کافت تشکیل مجتمع همانندسازی و تکثیر ویروس را فراهم میآورند (8).

تصویر 4: نمایش طرح کلی از روشهای تحلیلی مختلف موجود برای تشخیص کووید-19(10).
• راهبردهای درمان کرونا بیماری کرونا: مراحل چرخه زندگی ویروس، که اهداف بالقوهای برای درمان دارویی هستند، نیازمند ارزیابی داروهایی هستند که قادر به هدف قرار دادن فعالیتهای سلولی مانند مسدود کردن ورود، اندوسیتوز و همجوشی سنبله با غشای سلولی، مهار آنزیمهای ویروسی، سرکوب التهاب و مهار اجزای ویروسی، از جمله پوشش، غشا، نوکلئوکپسید، و سایر پروتئینهای منضم ویروس هستند (12). همجوشی پروتئین سنبله با گیرنده ACE2 سلول کاهش پاسخ این گیرنده به محرک خارجی را به دنبال دارد. مسدود کنندههای گیرنده آنژیوتانسین (Angiotensin Receptor Blockers)، مهارکنندههای آنزیم تبدیل کننده آنژیوتانسین (Angiotensin Converting Enzyme Inhibitors) و استاتینها که بیان ACE2 را افزایش میدهند ممکن است در درمان کرونا کارایی داشته باشند. اندوسیتوز، کافت پروتئینهای ساختاری ویروسی را در پی دارد که داروهای کلروکین و هیدروکسی کلروکین با اختلال در این عملکرد ممکن است اثر ضد ویروسی ایجاد کنند (13). جدای از کلروکین و هیدروکسیکلروکین، بافیلومایسین، دیفیلین و سالیفنیل هالامید نیز به عنوان نامزدهای ضد ویروسی با طیف گستردهای که از طریق مهار اسیدی شدن اندوزوم میزبان عمل میکنند، مورد توجه علمی زیادی قرار گرفتهاند (14). کاموستات و نافاموستات با هدف قرار دادن TMPRSS2 سلول میزبان که برای فعالسازی پروتئین کافت گلیکوپروتئینS مورد نیاز است موجب مهار همجوشی ویروس با سلول میزبان میشوند (15). داروهایی مانند لوپیناویر، ریتوناویر و داروناویر که از شکست پلی پروتئین به پروتئینهای ساختاری جلوگیری میکنند، مهارکنندههای پروتئاز نامیده میشوند نیز ممکن است در برابر ویروس کرونا مؤثر باشند. راهبرد دیگر برای مبارزه با ویروس کووید-19 شامل هدف قرار دادن مرحله رونویسی معکوس با مهارکنندههای RNA پلیمراز وابسته به RNA (RDRP) مانند رمدسیویر، فاویپیراویر، ریباویرین و آربیدول میباشد. این آنزیم برای تکثیر و رونویسی ویروس ضروری است (16). همچنین، نشان داده شده است که آنتیبادیهای مونوکلونال ضد کووید-19 که پروتئین سنبله را هدف قرار میدهند دارای مزایای بالینی در درمان کرونا هستند (17). سطوح بیش از حد سیتوکین سرم (طوفان سیتوکینی) که منجر به آسیب اندامهای متعدد در بیمارانی که به صورت شدید با کرونا درگیر شدهاند، میشود. بنابراین، پیشگیری و درمان طوفانهای سیتوکینی میتواند جایگزین خوبی برای جلوگیری از پیشرفت کووید-19 باشد. مطالعات بالینی نشان داده است که علت اصلی التهاب افزایش سطح اینترلوکین-6 (IL-6) است. کمپلکس تولید شده از اتصال IL-6 با گیرنده محلول یا گیرنده غشایی IL-6 فعال میشود و پاسخ التهابی را فعال میکند. توسیلیزوماب (آنتیبادی مونوکلونال علیه IL-6) میتواند انتقال پیامی را که باعث پاسخهای التهابی میشود را با اثرگذاری انتخابی بر روی گیرندههای IL-6 مسدود کند. با این حال، جنبههای هزینه و ایمنی میتواند مانع استفاده از توسیلیزوماب در درمان کووید-19 شود. بر اساس مطالعهای که منتشر شده است، ساریلوماب، آنتاگونیست دیگر گیرنده IL-6، ممکن است به بهبودی سریع در بیماران مبتلا به کووید-19 که با التهاب شدید بدنی مشخص میشوند، کمک کند تصویر 5 (18).
یشگیری از بیماری کرونا: واکسنهای غیرفعال یا ضعیف شده دارای مزایایی مانند تحریک گیرندههای شناسایی الگو (Pattern Recognition Receptors) و ایمنی زایی بالا هستند. در این حالت ویروسها زنده و قابل تکثیر هستند اما غیرسمی هستند. با اینحال، به دلیل خطر ویروس¬های زنده، نظارت طولانیمدت برای ارزیابی ایمنی واکسن مورد نیاز است. اخیرا، ویروس کووید-19 نوترکیب از قطعات DNA ویروسی با استفاده از ژنومیکهای مصنوعی سنتز شده است. بر اساس این یافتهها، میتوان کمی سریعتر به نسل واکسنهای ضعیفشده علیه ویروس کووید-19 نزدیک شد. مزایای واکسنهای نوترکیب عبارتند از بیان کافی پروتئین هدف، پایداری طولانیمدت و القای پاسخهای ایمنی قوی که موجب میشود از آنها برای افرادی که سامانه ایمنی ضعیفی دارند نیز استفاده کرد. واکسنهای نوترکیب به ویروسهای زنده اجازه میدهند تا با استفاده از حامل غیربیماریزا ژنهای عوامل بیماریزای خود را وارد سلولهای میزبان کنند، در نتیجه این ژنها به پروتئین مورد نظر ترجمه شده و پاسخ ایمنی مورد نظر را تحریک میکنند. قابل ذکر است، در برخی مواقع، روش بهکارگیری تمام سلول عامل بیماریزا نمیتواند محافظت لازم را بدون واکنشهای جانبی از جمله التهاب، پاسخهای حساسیتزا و خودایمنی فراهم کند. واکسنهای زیرواحد مبتنی بر قطعات میکروارگانیسمها توانایی غلبه بر این چالشها را دارند. واکسنهای زیر واحد فقط شامل اجزای آنتیژنی عامل بیماریزا هستند که برای برانگیختن پاسخهای ایمنی مؤثر مورد نیاز هستند. یک پلیساکارید، یک اسیدنوکلئیک یا یک پروتئین همگی میتوانند به عنوان آنتیژن استفاده شوند. از این میان تنها واکسنهای زیرواحد پروتئینی علیه ویروس کووید-19 ساخته میشود. در بین پروتئینهای ساختاری و غیرساختاری کووید-19، پروتئین سنبله به دلیل آنتیژنیسیته بالا و قدرت برای القای پاسخهای ایمنی قوی، یک هدف ایدهآل برای توسعه واکسن است. هنگامی که ویروسها از طریق عفونت وارد سلول میزبان میشوند، آنتیژن رمزگذاری شده توسط اسید نوکلئیک بیان میشود که باعث واکنش سلولی با آنتیبادی میشود. بر اساس این اصل، واکسیناسیون با اسیدنوکلئیک یکی دیگر از روشهای ایمنسازی مؤثر است که از اسیدهای نوکلئیک سنتز شده مصنوعی برای برانگیختن پاسخ ایمنی استفاده میکند، مانند پاسخی که توسط واکسنهای ضعیف شده ایجاد میشود. ویژگیهای ایمنی بهبودیافته که فرآیند عفونی را تقلید میکنند، از مزایای بالقوه واکسنهای بر پایه اسید نوکلئیک هستند تصویر 6 (18).

تصویر 5: اهداف درمانی داروهای در نظر گرفته شده برای استفاده مجدد در برابر کووید-19. 1.
ویروس از طریق ادغام پروتئینهای S ویروسی با گیرنده سلولی ACE2 وارد سلول میشود و به دنبال آن کاهش ACE2 ایجاد میشود. مسدودکنندههای گیرنده آنژیوتانسین (ARBs)، مهارکنندههای آنزیم مبدل آنژیوتانسین (ACEIs) و استاتینها بیان ACE2 را افزایش میدهند، بنابراین ممکن است در این شرایط کارایی داشته باشند. 3. همجوشی با اندوسیتوز ویروس ادامه مییابد، که در آن pH پایین اندوزومی به لیز پروتئینهای ساختاری ویروسی کمک میکند. اختلال در این محیط اسیدی توسط بازهای دیپروتیک مانند کلروکین و هیدروکسی کلروکین ممکن است اثر ضد ویروسی ایجاد کند. 4، 5. آزادسازی اسید نوکلئیک به سیتوپلاسم و ترجمه پروتئینهای ویروسی با استفاده از ریبوزومهای میزبان، 6. پروتئولیز توسط آنزیم پروتئاز اصلی ویروسی باعث میشود پروتئینهای عملکردی به عنوان مثال RDRP. بنابراین، مهار آنزیم اصلی پروتئاز توسط مهارکنندههایی مانند لوپیناویر، ریتوناویر و داروناویر ممکن است در برابر ویروس مؤثر باشد. 7. RDRP برای تکثیر و رونویسی ویروس ضروری است. مهارکنندههای RDRP، رمدسیویر، فاویپیراویر، ریباویرین و آربیدول ممکن است در برابر کروناویروسها موثر باشند. 7، 8. ترجمه و پروتئین کافت به پروتئینهای ساختاری و به دنبال آن بستهبندی، ویریونهای دست نخورده را میسازد که از سلول خارج میشوند (13).

تصویر 6: خلاصهای از انواع استراتژی برای توسعه واکسن علیه کووید-19(19).
• اهمیت سامانههای نانو در دارورسانی: فنآوری نانو دارای توان تسهیل توسعه سامانههای دارورسانی متنوع برای درمان عفونتهای کووید-19را به دلیل اندازه کوچک، ویژگیهای ساختاری و توانایی تقلید رفتار سلول یا اجزای سلولی انسان دارا میباشد. طیف گستردهای از اجزای فعال دارویی، از جمله ترکیبات ضد ویروسی، زیستی و اسید نوکلئیکی میتوانند توسط نانوحاملها بارگیری و تحویل داده شوند (12). سامانههای نانو توانایی گریز از پاسخهای ایمنی که درمان را دشوار میکنند، فراهم میآورند. به علت افزایش اثر نفوذپذیری و ماندگاری میتوانند داروها را بهصورت دقیق به اهداف موردنظر برسانند که تجمع پایینتر داروها در اندامهای غیر هدف و درنتیجه کاهش اثرات سمی آنها را به دارد. دارای مساحت سطح بالایی هستند که موجب بارگیری بیشتر دارو و اصلاحپذیری آنها با عوامل گوناگون با طیف ساختاری گسترده میشود. با این وجود، گرچه نانو فرمولاسیون میتواند عوارض جانبی داروها را کاهش دهد، اما باید عوارض جانبی خود آنها را نیز در نظر گرفت. سمیت نانوذرات ساخته شده از مواد مختلف میتواند در سطوح مولکولی، سلولی و بافتی رخ دهد (20). نانوذرات با اتصال به پوشش ویروسی یا پروتئین آنها از تعامل با سلول میزبان و در نتیجه از تکثیر سلولی جلوگیری میکند. برای این منظور، نانوذرات با ژنوم ویروسی یا پروتئین هسته ادغام میشوند و از تکثیر و و اتصال ویروس جلوگیری میکنند. نانوذرات پلیمری اثرات تراتوژنیسیته ندارند، غیرسمی بوده و دارای زیست سازگاری میباشند. مواد ناشی از تجزیه آنها در سلولها هیچ اثر سمی برجای نمیگذارد. از پلیمرهای خودسامان یافته (Self-assembled) میتوان برای به دام انداختن داروهای نامحلول استفاده کرد. طوریکه اجازه انتشار کنترل شده داروها را به دلیل ساختار پایدار آنها بدهد. نانوذرات پلیمری حاوی کیتوسان به دلیل ویژگیهای غیرسمی، زیستسازگاری و توانایی باز کردن پیوندهای قوی بین سلولهای بافت پوششی و قدرت تبدیل به ظاهر و اندازههای دلخواه، توجه ویژهای را برای درمان از طریق داخل بینی به خود جلب کردند. نانوامولسیونها ماهیت سمی ندارند و باعث تحریک نمیشوند. علاوه بر این، آنها دارای توانایی افزایش فراهمی زیستی داروها هستند، پایداری فیزیکی دارند و میتوانند به حل شدن داروهای چربی دوست کمک کنند. آنها همچنین دارای قطرات ریز با مساحت سطح بالایی هستند که ظرفیت جذب بیشتری را فراهم میکنند و میتوانند در اشکال دارویی مختلف از جمله مایعات، کرمها، فومها و اسپریها فرموله شوند. لیپوزومها وزیکولهای لیپیدی سلول مانندی هستند که دارای دولایه فسفولیپیدی منظم هستند و دارای مزایای زیادی مانند عدم سمیت، عدم ایمنیزایی، تغییر توزیع دارو در داخل بدن، امکان رهش مداوم داروها، طولانی شدن زمان عمل دارو، افزایش شاخص درمان دارویی، به حداقل رساندن عوارض جانبی دارو و به دام انداختن مولکولهای آبدوست، آبگریز، یونی هستند. لازم به ذکر است که با تنظیم مواد لیپیدی میتوان اندازه ذرات و شیمی سطح آنها را کنترل کرد. دندریمرها سامانههای دارورسانی مصنوعی و شاخهدار با تنوع شکل هستند که معمولاً برای تجویز داروهای نامحلول استفاده میشوند. وزن مولکولی آنها قابل تنظیم است. علاوه بر این، آنها را میتوان با گروههای عاملی مختلف مزدوج کرد و آنها را به یک ماده منحصربهفرد برای تحویل دارو تبدیل کرد. بهطور خلاصه که با توجه به ویژگیهای زیستی برجسته آنها، بهطور گسترده در کاربردهای زیست پزشکی و دارویی استفاده میشوند. نانوسوسپانسیونها نیز اثربخشی خود را در دارورسانی داروهای نامحلول در آب و نامحلول در چربی نشان دادهاند. آنها به دلیل یکپارچگی خود برجسته و نسبت به سایر روشهای بهکارگیری قابل اعتماد هستند. علاوه بر این، سرعت انحلال و حلالیت اشباع داروها را بهبود میبخشند (21). نانوذرات ویروس مانند (Virus-like Nano Particles) نانوذرات کروی شکلی هستند که از چندین مولکول با اندازههای بین 20 تا 200 نانومتر تشکیل شدهاند. این نانوذرات از خودآرایی پروتئینهای مشتق شده از کپسیدهای ویروسی حاصل میشوند. آنها به عنوان نانو مواد جالبی معرفی شدند که حاوی مواد ژنتیکی نیستند اما توانایی تقلید دقیق ویروس یا آنتیژن واقعی از نظر ساختار و تعیین کنندههای آنتیژنی را دارند. این امر سبب میشود که این نانومواد برای سلولهای ارائهدهنده آنتیژن بسیار رباینده باشند که به راحتی قابل شناسایی هستند و در نتیجه میتوانند پاسخ ایمنی را تحریک کنند. یکی دیگر از مزایای نانوذرات ویروس مانند پتانسیل بالای آنها برای استفاده به عنوان یک ناقل در ژن درمانی است، بهطوری که میتوان از آنها به عنوان یک سامانه هوشمند برای تحویل دقیق ژن به محل جهش یا ترمیم ژنها با هدف تغییر بیان ژن یا رمزگذاری یک ژن استفاده کرد. علاوه بر این، درمان امیدوارکننده با این نانوذرات بر این واقعیت متکی است که آنها به راحتی میتوانند از تخریب آنزیمی در مقایسه با تجویز ویروئیدهای بدون پوشش جلوگیری کنند. همچنین آنها اندازه بسیار کوچکی دارند که به آنها اجازه نفوذ به هسته سلولی را میدهد. نانوذرات پروتئین خود سامان یافته (Self-assembled Nano Particles) نوع جدیدی از نانوذرات هستند که از الیگومریزاسیون پروتئینهای مونومر با قطری بین 20 تا 100 نانومتر بهدست میآیند. این نانوذرات را میتوان با استفاده از بسیاری از زیست مواد مهندسی کرد که پپتیدها مطلوبترین آنها هستند، زیرا نانوذرات مبتنی بر پروتئین میتواند به راحتی برای کاربردهای متعدد توسعه یافته و اصلاح شود. آنها در تحویل دارو با توجه به توانایی متمایزی که برای عبور از غشای سلولی دارند میتوانند بهطور ویژه و ایمن داروها، ژنها و اسیدهای نوکلئیک را بهطور مستقیم به هسته سلول تحویل دهند (تصویر 7) (22).

تصویر 7: مهار اسیدی شدن آندوزوم برای توقف ورود سیتوزولی ویروس¬ها(14).
• اهمیت سامانههای نانو در تشخیص: نانو مواد به دلیل ماهیت بسیار پایدار در محیطهای مختلف و زیست سازگاری با سیالات فیزیولوژیکی میتوانند به عنوان مبدل انتخاب و مورد استفاده قرار گیرند. علاوه بر این، نانومواد شیمی سطحی را فراهم میکنند که میتواند برای زیست مزدوج سازی مولکولها و همچنین انرژی سطحی بالا و اثر تقویتی قوی روی پیامها مفید باشد. نانوذرات فلزی مانند نانوذرات طلا و نقره، نانومواد مبتنی بر کربن (نانولولهها و گرافن)، بلورهای فوتونی، نانوژلها و میکروژلها به دلیل مزایایی که دارند برای کاربردهای حسگر زیستی استفاده میشوند. قبلا ثابت شده است که ذرات مبتنی بر نانو کربن بستر مناسبی برای تشخیص باکتری با استفاده از تکنیکهای مختلف مانند الکتروشیمی و پیزوالکتریک و همچنین برای تهیه کیتهای مبتنی بر میکروسیال فراهم میکنند (23).
• آزمایش در بالین بیمار: آزمایش تشخیصی بر بالین بیمار یا آزمون در نقطه مراقبت (Point-Of-Care Testing) به عنوان آزمایشی تعریف میشود که با استفاده از کیت یا نوار در خانه یا در مکانی که از بیمار مراقبت میشود انجام میشود. حیاتیترین جز این آزمون، حسگر زیستی است که برای انجام یک سنجش زیست شیمیایی برای شناسایی بیماریزا استفاده میشود. مزایای استفاده از آزمون در نقطه مراقبت عبارتند از: (1) حداقل فضای مورد نیاز برای تست و ذخیرهسازی. (2) تجزیه و تحلیل در مقیاس وسیع. (3) آزمایش را میتوان در مکآنهای مختلف انجام داد و (4) انعطافپذیری در رفع نیازهای مختلف پزشکی. آزمون در نقطه مراقبت تشخیص را بدون ارسال نمونه به آزمایشگاههای تخصصی امکانپذیر میکند. آزمایش جریان جانبی (Lateral Flow Test) برای تشخیص کووید-19 یکی از این روشهای آزمون در نقطه مراقبت است (23). نوارهای جریان جانبی از یک غشای کاغذ مانند تشکیل شده است که عموماً از نیتروسلولز پوشیده شده با دو خط تشکیل شده است: خط اول آنتیبادی مزدوج با نانوذرات طلاست که به عنوان خط آزمایش شناخته میشود. خط دوم خط گرفتن آنتیبادی است که به عنوان خط کنترل شناخته میشود. نمونه بر روی غشا که به عنوان لایه نمونه نیز شناخته میشود، رسوب میکند و مواد مورد تجزیه در سراسر نوار حرکت میکنند تا زمانی که با عمل موئینگی به خط اول برسند. همانطور که مواد مورد تجزیه از طریق اولین خط آزمایش حرکت میکنند، آنتیژنهای موجود در ماده مورد تجزیه به مزدوج متصل میشوند و این کمپلکس از طریق غشا به جلو حرکت میکند. هنگامی که به خط دوم میرسد، با آنتیبادیهای جذب متصل میشود و یک خط رنگی ظاهر می شود. علاوه بر ایمونوگلوبولینها اسید نوکلئیک با رشته های DNA یا RNA یا آپتامر که یک DNA تک رشتهای یا رشته RNA است نیز میتواند برای آزمونهای جریان جانبی استفاده شود. مزدوج شدن آنتیبادیها با نانوذرات طلا دستگاه را قابل اعتمادتر و حساستر میکند (23).
• استفاده از رنگسنجی در تشخیص ویروس کرونا: نانوذرات طلا معمولاً در سنجشهای هیبریداسیون رنگ سنجی استفاده میشوند. یکی از این سنجشها، سنجش رنگ سنجی مبنی بر پیوند دیسولفید است که توسط کیم (Kim) و همکاران طراحی شده است. نانوذرات طلا به دو دلیل در توسعه نانوسنجشها به شدت مورد مطالعه قرار گرفتهاند: سهولت اصلاح سطح الکترواستاتیک با بخشهای مختلف مانند آنتیژنها و آنتیبادیها و تغییر تشدید پلاسمون سطحی (Surface Plasmon Resonance) و تغییرات رنگ. سنجشهای رنگسنجی از ویژگیهای نوری نانوذرات طلا و الیگونوکلئوتیدهای آنتیسنس برای فسفوپروتئین N کووید-19 خاص بهرهبرداری میکنند که توسط تیول برای ترکیب آن اصلاح شدند. در صورتی که توالی RNA هدف از کووید-19 وجود داشته باشد، الیگونوکلئوتیدهای آنتیسنس اصلاحشده با تیول روی مجموعه نانوذرات طلا و آنها را پوشانده و تغییری در تشدید پلاسمون سطحی مشاهده میشود. با افزودن ریبونوکلئاز H، رشته RNA از هیبرید RNA-DNA جدا میشود، که منجر به تشکیل یک رسوب قابل تشخیص بصری می¬شود که توسط تجمع در بین نانوذرات طلا تسهیل میشود(25, 23).
• ایمنی سنجی بر اساس نانوذرات مغناطیسی: نانوذرات مغناطیسی (Magnetic Nanoparticles) نیز برای رسیدن به هدف به عنوان حامل استفاده میشوند. گزارش شده است که از این نانوذرات برای تشخیص RNA کووید-19 و پاسخ آنتیبادی میزبان استفاده میشود. نشان داده شده است که نانوذرات اکسید آهن پوشش داده شده با سیلیس میل ترکیبی قوی با RNA کووید-19دارند، زیرا این نانوذرات باعث باز شدن ویروس میشوند. در این روش از آهنربا برای جداسازی نانوذرات پوشش داده شده با RNA از محلول نمونه استفاده میشود. سنجش دقیق نیاز به استخراج و جداسازی کارآمد و خودکار اسیدهای نوکلئیک از نمونهها دارد تا از نتایج منفی کاذب جلوگیری شود. این روش ساده و مقرون به صرفه است و به استخراج موثر RNA از نمونههای بیمار کمک میکند (27).
• نانوزیست حسگرها: بهطور کلی، بسترهای حسگر زیستی برای تشخیص کووید-19 بر اساس سه جنبه مهم استوار است: هدف برای شناسایی (به عنوان مثال، RNA و پروتئین های ویروسی، یا ایمونوگلوبولینهای انسانی)، روشهای شناسایی (بر اساس آپتامرها، آنتیبادیها، کاوشگرهای اسید نوکلئیک، گیرندهها) و تقویت پیامها و سامانههای انتقال (بر اساس تشدید پلاسمون سطحی، الکتروشیمیایی، نوری، سامانههای مکانیکی و پیامهای فلورسنت). برهمکنش بین آنتیبادی و آنتیژن یا گیرنده و لیگاند مربوطه را میتوان از طریق تغییرات ساختاری پروتئین-های حسگر شناسایی کرد. علاوه بر این، تشخیص مبنی بر واکنشهای آنزیمی یکی از مهمترین روشهای تشخیص است (تصویر 10و9 و 8 و7) (28).

تصویر 8: تصویری از نوارهای ایمنی سنجی جریان جانبی، نشان دهنده اجزای مختلف آن و نتایج مورد انتظار در تستهای مثبت و منفی.
در یک آزمایش مثبت، نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب بهIgM ضد کووید-19 متصل میشوند. آنتیبادیهای کووید-19 در سرم بیماران آلوده وجود دارد و مجموعهای را تشکیل میدهد که توسط IgM ضد آنتیبادیهای کووید-19 بیحرکت در خط آزمایش که قرمز رنگ میشود، جذب میشود. نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب بیش از حد از خط آزمایش به خط کنترل مهاجرت میکنند، جایی که آنتیبادیهای ضد آنتیژنهای مصنوعی نوترکیب بیحرکت آنها را میگیرند و باعث ایجاد خط قرمز دوم میشوند. در یک آزمایش منفی، IgM ضد آنتیبادیهای کووید-19 در سرم بیمار وجود ندارند، هیچ کمپلکسی با نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب ایجاد نمیشود که مانع از تعامل با آنتیبادیهای ضد IgM میشود و از تشکیل رنگ در خط آزمایش (بدون رنگ) جلوگیری میکند. در خط کنترل، مزدوجهای نانوذرات مزدوج با آنتیژنهای مصنوعی نوترکیب توسط آنتیبادیهای ضد آنتیژنهای مصنوعی نوترکیب تثبیتشده جذب میشوند و باعث ایجاد خط قرمز میشوند (24)

تصویر 9: یک سوآب بینی حاوی نمونه آزمایشی با یک لوله آزمایش ساده آزمایشگاهی مخلوط میشود.
لوله آزمایش حاوی مایعی مخلوط با نانوذرات طلا است که به مولکولی متصل شده است که به ویروس کرونا متصل میشود. اگر ویروس وجود داشته باشد، نانوذرات طلا، محلول را به رنگ آبی تیره (ته لوله) تبدیل میکند و رسوب مشاهده میشود. در صورت عدم وجود ویروس، محلول رنگ بنفش اصلی خود را حفظ میکند (26).

تصویر 10: نانوحسگرهای مبنی بر گرافن، نانولولههای کربنی یا نانومواد پلاسمونیک و کاربرد آنها برای تشخیص کووید-19(29).
اهمیت سامانههای نانو در واکسیناسیون: چندین نانو واکسن برای کووید-19 ایجاد شده است که آنها را می توان بر اساس اجزای عملکردی خود به سه دسته اصلی طبقه بندی کرد: ویروس، بر پایه پروتئین و بر پایه اسید نوکلئیک. نانو واکسنها برای بهبود کارایی واکسن و راهبردهای ایمنسازی از طریق سازوکارهای مختلف مرتبط با نانوذرات مانند محافظت از آنتیژنها در برابر تخریب، کنترل تحویل آنتیژنها از قالب نانوذرات و تنظیم جذب و پردازش آنتیژن توسط سلولهای ارائهدهنده آنتیژن طراحی شدهاند. نانوواکسنها از طریق کپسولهسازی آنتیژنهای ویروس کووید-19 یا قرار دادن آنها بر روی سطح نانوذرات ساخته میشوند و نانوذراتی با ساختار ایمنی مشابه تولید میکنند. مونتاژ مبتنی بر ساختار متداولترین روش در تولید نانو واکسنهای ویروس کرونا است. الگوی مونتاژ برای کنترل پایداری ترمودینامیکی نانوذرات مونتاژ شده و جلوگیری از تجمع بسیار مهم است. نانوذرات طلا معمولادر نانو واکسنها استفاده میشوند، زیرا علاوه بر اینکه حامل آنتیژن هستند میتوانند به عنوان عامل کمکی (Adjuvant) در ایمنسازی عمل کنند. نانوذرات ویروس مانند، از نظر ساختاری شبیه به ذرات ویروس، اما بدون ژنوم ویروسی هستند، معمولا در ساخت واکسن استفاده میشوند. آنها را میتوان با انکوباسیون نانوذرات طلا به عنوان هسته با پروتئینهای کووید-19 مانند پروتئین سنبله که به طور خود به خود سطح را عاملدار میکنند، ساخت. این واکسنها میتوانند تحویل آنتیژن لنفاوی را افزایش دهند و پاسخ سلولی و هومورال را در مقایسه با آنتیژنهای آزاد افزایش دهند (25).
1. نانوذرات کپسوله شده با آنتیژن
• نانوذرات لیپیدی: نانوذرات لیپیدی (Lipid Nano Particles) برای تحویل محمولههای اسید نوکلئیک (DNA و RNA) رمزکننده آنتیژنهای واکسن استفاده میشوند. کپسوله سازی در نانوذرات لیپیدی هم برای محافظت از محموله mRNA از تخریب سریع توسط Rnaseها و هم برای تسهیل تحویل سلولی mRNA که به دلیل محدودیتهای اندازه و بار چالش برانگیز است، عمل میکند. یکی از اجزای کلیدی نانوذرات لیپیدی، یک لیپید قابل یونیزاسیون است که در pH پایین دارای بار مثبت است تا امکان محصور کردن mRNA با بار منفی را فراهم کند، در حالیکه در pH فیزیولوژیکی خنثی است. نانوذرات لیپیدی از طریق اندوسیتوز وارد سلولها میشوند و در pH پایین اندوزومها، لیپید قابل یونیزاسیون دارای بار مثبت میشود و میتواند غشای اندوزومی را مختل کند و اجازه میدهد محموله mRNA برای ترجمه پروتئین در سیتوپلاسم آزاد شود. آنها اغلب حاوی یک لیپید پژیله شده (PEGylated) برای به حداقل رساندن اپسونیزاسیون (Opsonization) در داخل بدن و چربیهای کمکی مختلف و کلسترول برای حمایت از تشکیل ذرات هستند. MRNA-LNPها کاملاً مصنوعی هستند و بدون نیاز به سلولهای زنده ساخته میشوند و امکان تولید سریع واکسنها را در مقیاس وسیع پس از در دسترس بودن ژنوم ویروسی فراهم میکنند. اولین دو واکسن کووید-19 که برای استفاده تأیید شد، نانوذرات لیپیدی رها کننده mRNA رمزکننده پروتئین سنبله مهندسی شده بودند. هم ذرات mRNA و هم ذرات لیپیدی حاوی خواص ایمنی تحریککننده قوی هستند که نیاز به فرمولاسیون اضافی با عامل کمکی را نفی میکند. در واقع، ایمنیزایی ذاتی mRNA میتواند مشکل ساز باشد. هر دو واکسنهای مدرنا (Moderna) و فایزر (Pfizer) از mRNA حاوی نوکلئوزیدهای اصلاحشده استفاده میکنند که برای محدود کردن ایمنیزایی mRNA طراحی شدهاند و امکان دوزهای بالاتر واکسن و افزایش ظرفیت ترجمه را فراهم میکنند (30).
• نانو ذرات پلیمری: پلیمرهایی مانند کیتوسان، پلی (لاکتیک-کو-گلیکولیک اسید)، یا پلیاتیلن ایمین (PEI) به طور گسترده در گذشته برای تهیه واکسنهای نانوذراتی برای سایر کروناویروسها استفاده شدهاند. کیتوزان، یک پلیساکارید طبیعی، برای محصور کردن پروتئینهای RBD (Receptor-Binding Domain) کووید-19 مورد استفاده قرار گرفت. کیتوزان با بار مثبت می تواند بهصورت الکترواستاتیکی با موکوس با بار منفی سیالیک اسید تعامل داشته باشد و چسبندگی نانوذرات را در سطوح اپیتلیال راه هوایی پس از تجویز داخل بینی تسهیل کند. علاوه بر این، سطح نانوذرات کیتوزان با قندهای مانوز آراسته شده است. تشخیص مانوز توسط ایمنی ذاتی میتواند منجر به افزایش جابجایی نانوذرات به شبکه سلولهای دندریتیک فولیکولی و رسوب در مراکز اصلی غدد لنفاوی شود (30).
2. نانوذرات ارائه دهنده آنتیژن
• ذرات ویروس مانند: نانوذرات ویروس مانند مجموعههایی در اندازه نانو از پروتئینهای ساختاری ویروسی هستند که میتوانند به عنوان وسیله انتقال آنتیژن واکسن عمل کنند. آنها ویژگیهای مولکولی و ریخت شناختی ویریونهای ویروسی اصلی را تقلید می کنند، در حالیکه فاقد مواد ژنتیکی هستند که آنها را غیر عفونی و غیر قابل تکثیر میکند. چندین واکسن بر پایه نانوذرات ویروس مانند کووید-19 در حال توسعه بالینی و پیش بالینی هستند و NCT04636697 پیشرفتهترین آنها در آزمایشهای بالینی است که توسط شرکت کانادایی مدیکاگو (Medicago) توسعه یافته است. کیفیت و میزان پاسخ های آنتیبادی به دنبال یک دوز واحد از واکسن بر پایه نانوذرات ویروس مانند در مقایسه با آنتیژن محلول بیشتر است (30).
• میسلها: میسلها ساختارهای دوگانه دوست (Amphiphilic) خود سامان یافته هستند که میتوانند پروتئینهای کووید-19 را تحویل دهند، نمونهای از آنها واکسن نوواواکس (Novavax) است که در حال حاضر در مرحله پایانی کارآزمایی بالینی قرار دارد(30).
• نانوذرات پروتئین خود سامان یافته: بسترهای نانوذرات مبنی بر پروتئین نیز برای تحویل واکسنهای پروتئینی زیر واحد کووید-19 توسعه یافتهاند. یک نانوذره فریتین خود سامان یافته پوشیده با پروتئین سنبله کووید-19 (NCT04784767) در حال حاضر در مرحله آزمایش بالینی فاز 1 است (30).
• لیپوزومها: لیپوزومها مجموعههای نانوساختاری از فسفولیپیدهای دوگانه دوست با یک یا چند لایه دولایه لیپیدی هستند که غشایی را تشکیل میدهند که بر خلاف نانوذرات، یک هسته آبی را محصور میکنند. لیپوزومها برای تحویل آنتیژنهای واکسن کووید-19 استفاده شدهاند. در یک کارآزمایی بالینی، زیر واحدهای RBD به سطح لیپوزومها متصل شدند تا واکسنهای RBD-لیپوزومی را تشکیل دهند (تصویر 12و 11) (30)

تصویر 11: انواع مختلف بسترهای نانوذراتی که برای طراحی واکسنهای کووید-۱۹ مورد استفاده قرار میگیرند (30).

تصویر 12: واکسن کلاسیک، واکسن مدرن و واکسن تولید شده با به کارگیری نانو فنآوری علیه ویروس کووید-19(18).
نتیجهگیری
ورود فنآوری نانو به حوزههای مختلف از جمله پزشکی موجب ظهور پیشرفتهای شگفت انگیزی شده است که بیشک بدون ویژگیهای فیزیکوشیمیایی سامانه¬های نانو میسر نمی-شد. حوزه درمان، تشخیص و پیشگیری از بیماریها از جمله بیماری نوظهور کرونا که تمام دنیا را متأثر کرد از این رهآورد بیتأثیر نماند. طیف گسترده سامانه¬های نانو با ویژگیهای متفاوت امکان انتقال انواع ذرات، میکروارگانیسمها، ملکولهای شیمیایی مانند داروها و زیست ملکولها شامل ساختارهای پروتئینی، نوکلئوتیک اسیدی و پلیساکاریدی به انواع سلولها و بافتها را فراهم نموده است. با دخالت نانو فنآوری در حوزه پیشگیری، هم در تولید واکسن و هم ماسک موجب محافظت قطعی در برابر ویروس خطرناک عامل این بیماری شد. واکسنهایی که اثربخشی آنها مورد تأیید سازمانهای جهانی بهداشت قرار گرفتند و به بالین راه یافتند، نیز از این فنآوری بهره بردهاند. در حوزه تشخیص هم به کمک تکنیکهای پرقدرت مانند PCR-RT و ELISA آمد و هم موجب فراهم آمدن کیتهایی با سرعت سنجش بالا و قدرت تشخیص قابل رقابت با روشهای طلایی شد. در زمینه درمان نیز به منظور دارورسانی داروهای از پیش موجود مورد آزمون قرارگرفت. همچنین، نانوموادی در مورد آزمایش قرار گرفتند که دارای زیستسازگاری و ویژگی ضد ویروسی با خطر کمتر مقاومت دارویی هستند. از اینرو میتوان مداخله نانو فنآوری به حوزه پیشگیری، تشخیص و مقابله با ویروس کرونا را موفق دانست و برای ریشه کنی نه تنها این ویروس بلکه سایر عوامل بیماریزا امیدوار کننده دانست (تصویر 13).
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.

تصویر 13: نانوپزشکی به عنوان یک رویکرد امیدوارکننده برای تشخیص، درمان و پیشگیری از کووید-19 (25).
References:
1- Sharma A, Ahmad Farouk I, Lal SK. COVID-19: A Review on the Novel Coronavirus Disease Evolution, Transmission, Detection, Control and Prevention. Viruses 2021; 13(2): 202.
2- Pillaiyar T, Meenakshisundaram S, Manickam M. Recent Discovery and Development of Inhibitors Targeting Coronaviruses. Drug Discovery Today 2020; 25(4): 668-88.
3- Intro to Viruses. Available at: https:// www.khanacademy.org/science/biology/biology-of-viruses/virus-biology/a/intro-to-viruses. Accessed August 3,2021
4- Li C, Zhao C, Bao J, Tang B, Wang Y, Gu B. Laboratory Diagnosis of Coronavirus Disease-2019 (COVID-19). Clinica Chimica Acta 2020; 510: 35-46.
5- Ni W, Yang X, Yang D, Bao J, Li R, Xiao Y, et al. Role of Angiotensin-Converting Enzyme 2 (ACE2) in COVID-19. Critical Care 2020; 24(1): 1-0.
6- Li C, He Q, Qian H, Liu J. Overview of the Pathogenesis Of COVID‑19. Experimental and Therapeutic Medicine 2021; 22(3): 1-10.
7- Su H, Xu Y, Jiang H. Drug Discovery and Development Targeting the Life Cycle of SARS-Cov-2. Front Microbiol 2021; 1(2): 151-65.
8- V'kovski P, Kratzel A, Steiner S, Stalder H, Thiel V. Coronavirus Biology and Replication: Implications for SARS-Cov-2. Nat Rev Microbiol 2021; 19(3): 155-170.
9- Loeffelholz MJ, Tang YW. Laboratory Diagnosis of Emerging Human Coronavirus Infections–The State of the Art. Emerg Microbes Infect 2020; 9(1): 747-56.
10- Rai P, Kumar BK, Deekshit VK, Karunasagar I, Karunasagar I. Detection Technologies and Recent Developments in the Diagnosis of COVID-19 Infection. Appl Microbiol Biotechnol 2021; 105(2): 441-55.
11- Pizzol JLD, Hora VPD, Reis AJ, Vianna J, Ramis I, Groll AV, et al. Laboratory Diagnosis for Covid-19: A Mini-Review. Rev Soc Bras Med Trop 2020; 53: e20200451.
12- Witika BA, Makoni PA, Mweetwa LL, Ntemi PV, Chikukwa MTR, Matafwali SK, et al. Nano-Biomimetic Drug Delivery Vehicles: Potential Approaches for COVID-19 Treatment. Molecules 2020; 25(24): 5952.
13- Singh TU, Parida S, Lingaraju MC, Kesavan M, Kumar D, Singh RK. Drug Repurposing Approach to Fight COVID-19. Pharmacol Rep 2020; 72(6): 1479-508.
14- Yang KC, Lin JC, Tsai HH, Hsu CY, Shih V, Hu CJ. Nanotechnology Advances in Pathogen-And Host-Targeted Antiviral Delivery: Multipronged Therapeutic Intervention for Pandemic Control. Drug Deliv Transl Res 2021; 11(4): 1420-37.
15- Hempel T, Raich L, Olsson S, Azouz NP, Klingler AM, Hoffmann M, et al. Molecular Mechanism of Inhibiting the SARS-Cov-2 Cell Entry Facilitator TMPRSS2 with Camostat and Nafamostat. Chem Sci 2021; 12(3): 983-92.
16- Frediansyah A, Tiwari R, Sharun K, Dhama K, Harapan H. Antivirals for COVID-19: A Critical Review. Clin Epidemiol Glob Health 2021; 9: 90-8.
17- Tuccori M, Ferraro S, Convertino I, Cappello E, Valdiserra G, Blandizzi C, et al. Anti-SARS-Cov-2 Neutralizing Monoclonal Antibodies: Clinical Pipeline. MAbs 2020; 12(1): 1854149.
18- Yang D. Application of Nanotechnology in the COVID-19 Pandemic. Int J Nanomedicine 2021; 16: 623-49.
19- Calina D, Docea AO, Petrakis D, Egorov AM, Ishmukhametov AA, Gabibov AG, et al. Towards Effective COVID‑19 Vaccines: Updates, Perspectives and Challenges. Int J Mol Med 2020; 46(1): 3-16.
20- Vahedifard F, Chakravarthy K. Nanomedicine for COVID-19: The Role of Nanotechnology in the Treatment and Diagnosis of COVID-19. Emergent Mater 2021; 4(1): 75-99.
21- Abd Elkodous M, Olojede SO, Morsi M, El-Sayyad GS. Nanomaterial-Based Drug Delivery Systems as Promising Carriers for Patients with COVID-19. RSC Adv 2021; 11(43): 26463-80.
22- Itani R, Tobaiqy M, Al Faraj A. Optimizing Use of Theranostic Nanoparticles as a Life-Saving Strategy for Treating COVID-19 Patients. Theranostics 2020; 10(13): 5932-42.
23- Gupta R, Sagar P, Priyadarshi N, Kaul S, Sandhir R, Rishi V, et al. Nanotechnology-Based Approaches for the Detection of SARS-Cov-2. Frontiers in Nanotechnology 2020; 2: 589832.
24- Tomás AL, de Almeida MP, Cardoso F, Pinto M, Pereira E, Franco R, et al. Development of a Gold Nanoparticle-Based Lateral-Flow Immunoassay for Pneumocystis Pneumonia Serological Diagnosis at Point-Of-Care. Front Microbiol 2019; 10: 2917.
25- Abd Ellah NH, Gad SF, Muhammad K, E Batiha G, Hetta HF. Nanomedicine as a Promising Approach for Diagnosis, Treatment and Prophylaxis Against COVID-19. Nanomedicine (Lond) 2020; 15(21): 2085-102.
26- Pan D, Frieman M. Advanced Nanotechnology Provides “Naked Eye” Visual Detection of Virus in 10 Minutes. University of Maryland School of Medicine. May 28, 2020. https://www.medschool.umaryland.edu/
27- Kang J, Tahir A, Wang H, Chang J. Applications of Nanotechnology in Virus Detection, Tracking, and Infection Mechanisms. Wiley Interdiscip Rev Nanomed Nanobiotechnol 2021; 13(4): e1700.
28- Iravani S. Nano-And Biosensors for the Detection of SARS-Cov-2: Challenges and Opportunities. Materials Advances 2020; 1(9): 3092-103.
29- Bardhan NM, Jansen P, Belcher AM. Graphene, Carbon Nanotubes and Plasmonic Nanosensors for Detection of Viral Pathogens: Opportunities for Rapid Testing in Pandemics Like COVID-19. Front Nanotechnol 2021; 3: 1-5.
30- Vu MN, Kelly HG, Kent SJ, Wheatley AK. Current and Future Nanoparticle Vaccines for COVID-19. EBioMedicine 2021; 74: 103699.
1- Sharma A, Ahmad Farouk I, Lal SK. COVID-19: A Review on the Novel Coronavirus Disease Evolution, Transmission, Detection, Control and Prevention. Viruses 2021; 13(2): 202.
2- Pillaiyar T, Meenakshisundaram S, Manickam M. Recent Discovery and Development of Inhibitors Targeting Coronaviruses. Drug Discovery Today 2020; 25(4): 668-88.
3- Intro to Viruses. Available at: https:// www.khanacademy.org/science/biology/biology-of-viruses/virus-biology/a/intro-to-viruses. Accessed August 3,2021
4- Li C, Zhao C, Bao J, Tang B, Wang Y, Gu B. Laboratory Diagnosis of Coronavirus Disease-2019 (COVID-19). Clinica Chimica Acta 2020; 510: 35-46.
5- Ni W, Yang X, Yang D, Bao J, Li R, Xiao Y, et al. Role of Angiotensin-Converting Enzyme 2 (ACE2) in COVID-19. Critical Care 2020; 24(1): 1-0.
6- Li C, He Q, Qian H, Liu J. Overview of the Pathogenesis Of COVID‑19. Experimental and Therapeutic Medicine 2021; 22(3): 1-10.
7- Su H, Xu Y, Jiang H. Drug Discovery and Development Targeting the Life Cycle of SARS-Cov-2. Front Microbiol 2021; 1(2): 151-65.
8- V'kovski P, Kratzel A, Steiner S, Stalder H, Thiel V. Coronavirus Biology and Replication: Implications for SARS-Cov-2. Nat Rev Microbiol 2021; 19(3): 155-170.
9- Loeffelholz MJ, Tang YW. Laboratory Diagnosis of Emerging Human Coronavirus Infections–The State of the Art. Emerg Microbes Infect 2020; 9(1): 747-56.
10- Rai P, Kumar BK, Deekshit VK, Karunasagar I, Karunasagar I. Detection Technologies and Recent Developments in the Diagnosis of COVID-19 Infection. Appl Microbiol Biotechnol 2021; 105(2): 441-55.
11- Pizzol JLD, Hora VPD, Reis AJ, Vianna J, Ramis I, Groll AV, et al. Laboratory Diagnosis for Covid-19: A Mini-Review. Rev Soc Bras Med Trop 2020; 53: e20200451.
12- Witika BA, Makoni PA, Mweetwa LL, Ntemi PV, Chikukwa MTR, Matafwali SK, et al. Nano-Biomimetic Drug Delivery Vehicles: Potential Approaches for COVID-19 Treatment. Molecules 2020; 25(24): 5952.
13- Singh TU, Parida S, Lingaraju MC, Kesavan M, Kumar D, Singh RK. Drug Repurposing Approach to Fight COVID-19. Pharmacol Rep 2020; 72(6): 1479-508.
14- Yang KC, Lin JC, Tsai HH, Hsu CY, Shih V, Hu CJ. Nanotechnology Advances in Pathogen-And Host-Targeted Antiviral Delivery: Multipronged Therapeutic Intervention for Pandemic Control. Drug Deliv Transl Res 2021; 11(4): 1420-37.
15- Hempel T, Raich L, Olsson S, Azouz NP, Klingler AM, Hoffmann M, et al. Molecular Mechanism of Inhibiting the SARS-Cov-2 Cell Entry Facilitator TMPRSS2 with Camostat and Nafamostat. Chem Sci 2021; 12(3): 983-92.
16- Frediansyah A, Tiwari R, Sharun K, Dhama K, Harapan H. Antivirals for COVID-19: A Critical Review. Clin Epidemiol Glob Health 2021; 9: 90-8.
17- Tuccori M, Ferraro S, Convertino I, Cappello E, Valdiserra G, Blandizzi C, et al. Anti-SARS-Cov-2 Neutralizing Monoclonal Antibodies: Clinical Pipeline. MAbs 2020; 12(1): 1854149.
18- Yang D. Application of Nanotechnology in the COVID-19 Pandemic. Int J Nanomedicine 2021; 16: 623-49.
19- Calina D, Docea AO, Petrakis D, Egorov AM, Ishmukhametov AA, Gabibov AG, et al. Towards Effective COVID‑19 Vaccines: Updates, Perspectives and Challenges. Int J Mol Med 2020; 46(1): 3-16.
20- Vahedifard F, Chakravarthy K. Nanomedicine for COVID-19: The Role of Nanotechnology in the Treatment and Diagnosis of COVID-19. Emergent Mater 2021; 4(1): 75-99.
21- Abd Elkodous M, Olojede SO, Morsi M, El-Sayyad GS. Nanomaterial-Based Drug Delivery Systems as Promising Carriers for Patients with COVID-19. RSC Adv 2021; 11(43): 26463-80.
22- Itani R, Tobaiqy M, Al Faraj A. Optimizing Use of Theranostic Nanoparticles as a Life-Saving Strategy for Treating COVID-19 Patients. Theranostics 2020; 10(13): 5932-42.
23- Gupta R, Sagar P, Priyadarshi N, Kaul S, Sandhir R, Rishi V, et al. Nanotechnology-Based Approaches for the Detection of SARS-Cov-2. Frontiers in Nanotechnology 2020; 2: 589832.
24- Tomás AL, de Almeida MP, Cardoso F, Pinto M, Pereira E, Franco R, et al. Development of a Gold Nanoparticle-Based Lateral-Flow Immunoassay for Pneumocystis Pneumonia Serological Diagnosis at Point-Of-Care. Front Microbiol 2019; 10: 2917.
25- Abd Ellah NH, Gad SF, Muhammad K, E Batiha G, Hetta HF. Nanomedicine as a Promising Approach for Diagnosis, Treatment and Prophylaxis Against COVID-19. Nanomedicine (Lond) 2020; 15(21): 2085-102.
26- Pan D, Frieman M. Advanced Nanotechnology Provides “Naked Eye” Visual Detection of Virus in 10 Minutes. University of Maryland School of Medicine. May 28, 2020. https://www.medschool.umaryland.edu/
27- Kang J, Tahir A, Wang H, Chang J. Applications of Nanotechnology in Virus Detection, Tracking, and Infection Mechanisms. Wiley Interdiscip Rev Nanomed Nanobiotechnol 2021; 13(4): e1700.
28- Iravani S. Nano-And Biosensors for the Detection of SARS-Cov-2: Challenges and Opportunities. Materials Advances 2020; 1(9): 3092-103.
29- Bardhan NM, Jansen P, Belcher AM. Graphene, Carbon Nanotubes and Plasmonic Nanosensors for Detection of Viral Pathogens: Opportunities for Rapid Testing in Pandemics Like COVID-19. Front Nanotechnol 2021; 3: 1-5.
30- Vu MN, Kelly HG, Kent SJ, Wheatley AK. Current and Future Nanoparticle Vaccines for COVID-19. EBioMedicine 2021; 74: 103699.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







