دوره 31، شماره 10 - ( دی 1402 )
جلد 31 شماره 10 صفحات 7168-7156 |
برگشت به فهرست نسخه ها
Ethics code: 8352
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sadeghi Nodoushan F, Hakimian F, Haghiralsadat B F. Magnetic Iron Oxide Nanoparticles Coated with Polyethylene and Gold as a Suitable Carrier for Doxorubicin and its Effect on Mcf-7 Breast Cancer Cells. JSSU 2024; 31 (10) :7156-7168
URL: http://jssu.ssu.ac.ir/article-1-5959-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5959-fa.html
صادقی ندوشن فاطمه، حکیمیان فاطمه، حقیرالسادات بیبی فاطمه. نانوذرات مغناطیسی اکسید آهن پوشیده شده با پلیاتیلن و طلا بهعنوان حامل مناسب برای دوکسوروبیسن و تاثیر آن بر سلول سرطان پستان Mcf-7). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (10) :7156-7168
متن کامل [PDF 960 kb]
(186 دریافت)
| چکیده (HTML) (282 مشاهده)
References:
1- Boyle P, Levin B. World Cancer Report 2008. IARC Press, International Agency for Research on Cancer; 2008.
2- Sadjadi A, Nouraie M, Ghorbani A, Alimohammadian M, Malekzadeh R. Epidemiology of Breast Cancer in the Islamic Republic of Iran: First Results from a Population-Based Cancer Registry. East Mediterr Health J 2009; 15(6): 1426-31.
3- Brody JG, Rudel RA. Environmental Pollutants and Breast Cancer. Environ Health Perspect 2003; 111(8): 1007-19.
4- Anand P, Kunnumakkara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, et al. Cancer is a Preventable Disease that Requires Major Lifestyle Changes. Pharm Res 2008; 25(9): 2097-116.
5- Davies C, Godwin J, Gray R, Clarke M, Cutter D, Darby S, et al. Relevance of Breast Cancer Hormone Receptors and other Factors to the Efficacy of Adjuvant Tamoxifen: Patient-Level Meta-Analysis of Randomised Trials. Lancet 2011; 378(9793): 771-84.
6- Group EBCTC. Effects of Chemotherapy and Hormonal Therapy for Early Breast Cancer on Recurrence and 15-Year Survival: An Overview of the Randomised Trials. Lancet 2005; 365(9472): 1687-717.
7- Kaufmann SH, Earnshaw WC. Induction of Apoptosis by Cancer Chemotherapy. Exp Cell Res 2000; 256(1): 42-9.
8- Jain D. Cardiotoxicity of Doxorubicin and other Anthracycline Derivatives. J Nucl Cardiol 2000; 7(1): 53-62.
9- Figg WD, McLeod HL. Handbook of Anticancer Pharmacokinetics and Pharmacodynamics. Springer Science & Business Media; 2004.
10- Sun R, Liu Y, Li SY, Shen S, Du XJ, Xu CF, et al. Co-Delivery of All-Trans-Retinoic Acid and Doxorubicin for Cancer Therapy with Synergistic Inhibition of Cancer Stem Cells. Biomaterials 2015; 37: 405-14.
11- Gobbo OL, Sjaastad K, Radomski MW, Volkov Y, Prina-Mello A. Magnetic Nanoparticles in Cancer Theranostics. Theranostics 2015; 5(11): 1249-63.
12- Revia RA, Zhang M. Magnetite Nanoparticles for Cancer Diagnosis, Treatment, and Treatment Monitoring: Recent Advances. Mater Today(Kidlington) 2016; 19(3): 157-68.
13- Haume K, Rosa S, Grellet S, Śmiałek MA, Butterworth KT, Solov'yov AV, et al. Gold Nanoparticles for Cancer Radiotherapy: A Review. Cancer Nanotechnol 2016; 7(1): 8.
14- Zhang S, Liu X, Zhou L, Peng W. Magnetite Nanostructures: One-Pot Synthesis, Superparamagnetic Property and Application in Magnetic Resonance Imaging. Materials Letters 2012; 68: 243-6.
15- Netto CG, Toma HE, Andrade LH. Superparamagnetic Nanoparticles as Versatile Carriers and Supporting Materials for Enzymes. Journal of Molecular Catalysis B Enzymatic 2013; 85: 71-92.
16- Zarei-Ghobadi M, Mozhgani SH, Dashtestani F, Yadegari A, Hakimian F, Norouzi M, et al. A Genosensor for Detection of HTLV-I Based on Photoluminescence Quenching of Fluorescent Carbon Dots in Presence of Iron Magnetic Nanoparticle-Capped Au. Sci Rep 2018; 8(1): 15593.
17- Moosavi zadeh SM, Baghiani M, Majdizadeh M, Haghiralsadat F, Moosavi zadeh SM. Experimental
Study: Experimental Evaluation of Phospholipid System Containing Doxorubicin HCL for Use in Chemotherapy. J Shahid Sadoughi Uni Med Sci 2019; 26(11): 945-56.
18- Al Sabbagh C, Tsapis N, Novell A, Calleja-Gonzalez P, Escoffre JM, Bouakaz A, et al. Formulation and Pharmacokinetics of Thermosensitive Stealth® Liposomes Encapsulating 5-Fluorouracil. Pharm Res 2015; 32(5): 1585-603.
19- Shen F, Chu S, Bence AK, Bailey B, Xue X, Erickson PA, et al. Quantitation of Doxorubicin Uptake, Efflux, and Modulation of Multidrug Resistance (MDR) in MDR Human Cancer Cells. J Pharmacol Exp Ther 2008; 324(1): 95-102.
20- Aljarrah K, Mhaidat NM, Al-Akhras MA, Aldaher AN, Albiss B, Aledealat K, et al. Magnetic Nanoparticles Sensitize MCF-7 Breast Cancer Cells to Doxorubicin-Induced Apoptosis. World J Surg Oncol 2012; 10: 62.
21- Nigam S, Barick KC, Bahadur D. Development of Citrate-Stabilized Fe3O4 Nanoparticles: Conjugation and Release of Doxorubicin for Therapeutic Applications. Journal of Magnetism and Magnetic Materials 2011; 323(2): 237-43.
22- Rana S, Shetake NG, Barick KC, Pandey BN, Salunke HG, Hassan PA. Folic Acid Conjugated Fe 3 O 4 Magnetic Nanoparticles for Targeted Delivery of Doxorubicin. Dalton Trans 2016; 45(43): 17401-8.
23- Shen S, Wu L, Liu J, Xie M, Shen H, Qi X, et al. Core–Shell Structured Fe3O4@ Tio2-Doxorubicin Nanoparticles for Targeted Chemo-Sonodynamic Therapy of Cancer. Int J Pharm 2015; 486(1-2): 380-8.
24- Jia Y, Yuan M, Yuan H, Huang X, Sui X, Cui X, et al. Co-Encapsulation of Magnetic Fe3O4 Nanoparticles and Doxorubicin Into Biodegradable PLGA Nanocarriers for Intratumoral drug Delivery. Int J Nanomedicine 2012; 7: 1697-708.
25- Semkina A, Abakumov M, Grinenko N, Abakumov A, Skorikov A, Mironova E, et al. Core–Shell–Corona Doxorubicin-Loaded Superparamagnetic Fe3O4 Nanoparticles for Cancer Theranostics. Colloids Surf B Biointerfaces 2015; 136: 1073-80.
26- Asghar K, Qasim M, Dharmapuri G, Das D. Investigation on a Smart Nanocarrier with a Mesoporous Magnetic Core and Thermo-Responsive Shell for Co-Delivery of Doxorubicin and Curcumin: A New Approach Towards Combination Therapy of Cancer. RSC adv 2017; 7(46): 28802-18.
متن کامل: (355 مشاهده)
مقدمه
آﻣﺎر ﺳﺮﻃﺎن ﺑﺎ ﺑﺎﻻ رﻓﺘﻦ ﭘﺎیﺪار ﻧﺮخ رﺷﺪ و ﭘﯿﺮی، ﺑﻪﻃﻮر ﭘﯿﻮﺳﺘﻪ در ﺣﺎل اﻓﺰایﺶ اﺳﺖ. در ایﻦ ﻣﯿﺎن ﺳﺮﻃﺎن ﭘﺴﺘﺎن ﺷﺎیﻊ ﺗﺮیﻦ ﺑﺪﺧﯿﻤﯽ ﻣﺮگآور در زﻧﺎن اﺳﺖ ﺑﻪطوری ﮐﻪ از ﻫﺮ 9 زن یﮏ ﻧﻔﺮ در ﻃﻮل ﻋﻤﺮ ﺧﻮد به ایﻦ ﺳﺮﻃﺎن مبتلا ﻣﯽشود (1). اما متاسفانه زﻧﺎن ایﺮاﻧﯽ ﺣﺪود یﮏ دﻫﻪ زودﺗﺮ ﻧﺴﺒﺖ ﺑه ﻣﯿﺎﻧﮕﯿﻦ ﺟﻬﺎﻧﯽ ﺑﻪ ﺳﺮﻃﺎن پستان ﻣﺒﺘﻼ ﻣﯽﺷﻮﻧﺪ (2). ﺳﺮﻃﺎن ﭘﺴﺘﺎن در ﻣﺮاﺣﻞ اوﻟﯿﻪ ﻧﺸﺎﻧﻪای ﺑﻪ ﻫﻤﺮاه ﻧﺪارد اﻣﺎ ﺑﺎ رﺷﺪ ﺗﻮﻣﻮر ﺗﻐﯿﯿﺮات ﻗﺎﺑﻞﻣﻼﺣﻈﻪای رخ ﻣﯽدﻫﺪ ﮐﻪ وﺟﻮد یﮏ ﺗﻮده ﺳﻔﺖ ﻗﺎﺑﻞ ﻟﻤﺲ در ﭘﺴﺘﺎن و یﺎ در ﻧﺎﺣﯿﻪ آﮔﺰیﻼ (زیﺮ ﺑﻐﻞ)، درد در ﭘﺴﺘﺎن و یﺎ ﻧﻮک ﭘﺴﺘﺎن، ﺗﻐﯿﯿﺮ در ﻓﺮم و یﺎ اﻧﺪازه ﭘﺴﺘﺎن، ﺗﻐﯿﯿﺮات ﭘﻮﺳﺘﯽ ﭘﺴﺘﺎن، ﺗﺮﺷﺢ ﻣﺎیﻊ، ﺑﻪ ﺧﺼﻮص ﻣﺎیﻌﺎت ﺧﻮﻧﯽ ازنوک ﭘﺴﺘﺎن از ﺟﻤﻠﻪ ایﻦ ﺗﻐﯿﯿﺮات اﺳﺖ (3). ریزﻓﺎﮐﺘﻮرﻫﺎیﯽ ﻣﺎﻧﻨﺪ اﻓﺰایﺶ ﺳﻦ، زﻣﯿﻨﻪﻫﺎی وراﺛﺘﯽ، ﻫﻮرﻣﻮن ﻫﺎی ﺟﻨﺴﯽ، ﺳﺒﮏ زﻧﺪﮔﯽ و ﻧﮋاد، ﻣﯽﺗﻮاﻧﺪ ﺧﻄﺮ اﺑﺘﻼ ﺑﻪ ایﻦ ﺑﯿﻤﺎری خطرناک را اﻓﺰایﺶ دﻫﺪ (4). ﺑﻪ ﻣﻨﻈﻮر درﻣﺎن ﺳﺮﻃﺎنﻫﺎ، ﻣﻌﻤﻮﻻً از ﺳﻪ روش ﺟﺮاﺣﯽ، رادیﻮدرﻣﺎﻧﯽ و ﺷﯿﻤﯽدرﻣﺎﻧﯽ اﺳﺘﻔﺎده ﻣﯽﺷﻮد ﮐﻪ در ایﻦ ﺑﯿﻦ ﺷﯿﻤﯽدرﻣﺎﻧﯽ ﺑﺎ وﺟﻮد داﺷﺘﻦ ﻣﺤﺪودیﺖﻫﺎیﯽ از ﻗﺒﯿﻞ، ﻫﺪﻓﻤﻨﺪ ﻧﺒﻮدن داروﻫﺎی ﺷﯿﻤﯽدرﻣﺎﻧﯽ، ﻧﯿﺎزﻣﻨﺪ ﺑﻮدن ﺑﻪ دوزﻫﺎی ﺑﺎﻻی دارو ﺑﺮای ﻣﺒﺎرزه ﺑﺎ ﺳﻠﻮلﻫﺎی ﺳﺮﻃﺎﻧﯽ، ﻣﻘﺎوﻣﺖ دارویﯽ و ﻋﻮارض ﺟﺎﻧﺒﯽ ﻣﺘﻌﺪد، ﻫﻨﻮز ﻫﻢ ﺑﻪﻋﻨﻮان یﮑﯽ از روشﻫﺎی درﻣﺎﻧﯽ ﻣﻮﺛﺮ در درمان ﺳﻠﻮلﻫﺎی ﺳﺮﻃﺎﻧﯽ ﺑﻪﺷﻤﺎر ﻣﯽآیﺪ (5). در استراتژی شیمیدرمانی از داروهای سایتوتوکسیک مثل دوکسوروبیسین با اثرگذاری مستقیم و غیر مستقیم بر چرخه سلولی استفاده میشود (6). دوکسوروبیسین متعلق به خانواده آنتیبیوتیکهای آنتراسایکلینی است که در حلالهایی مانند آب، نرمالسالین و متانول محلول است ولی در استن، بنزن، کلروفرم و اتیلین نا محلول است (7). دوکسوروبیسین تمایل بالایی برا ی اتصال به مولکول DNA دارد که با ایجاد اختلال در عملکرد آنزیم توپوایزومراز II موجب اختلال در فرآیند هماندسازی میگردد و با افزایش تولید رادیکالهای آزاد مرگ سلولی و آپوپتوز را باعث میشود (8). اگر چه استفاده از داروهایی نظیر دوکسوروبیسین در شیمیدرمانی، میتواند تا حدودی از پیشرفت سرطان جلوگیری نماید ولی عوارض جانبی زیاد و بروز مقاومت چندگانه، استفاده از آنها را در مهار سرطان با چالشی بزرگ روبهرو گردانیده است (9,10). از این رو فناوری نانو در داروسازی به دنبال استفاده از نانوحامل نظیر نانوذرات مغناطیسی اکسید آهن میباشد که در سطح مولکولی با بدن وارد تعامل میشوند، تا از این طریق با انتقال دارو به بافت موردنظر، کارایی درمان را افزایش و عوارض جانبی را کاهش دهد (11,12). ﻧﺎﻧﻮذرات ﺑﻪ دﻟﻴـﻞ ﺧـﻮاص ﻓﻴﺰﻳﻜﻮﺷـﻴﻤﻴﺎﻳﻲ و ﺳـﺎﻳﺰ منحصربه فرد ﻓﺮﺻﺖﻫﺎی زﻳﺎدی را در ﭘﻴﺸﺮﻓﺖ ﻋﻠـﻮم ﻣﺨﺘﻠـﻒ اﻳﺠـﺎد ﻛـﺮدهاﻧـﺪ. ﻧﺎﻧﻮذرات ﻓﻠﺰی ﻣﺎﻧﻨﺪ ﻛﺒﺎﻟﺖ، ﻧﻴﻜﻞ و آﻫﻦ دارای ﻛﺎرﺑﺮدﻫﺎی زﻳﺴـﺘﻲ ﻣﺘﻨﻮﻋﻲ ﻣﻲﺑﺎﺷﻨﺪ وﻟﻲ ﺑﻪ ﺳﺮﻋﺖ در ﺣﻀـﻮر اﻛﺴـﻴﮋن و آب اﻛﺴـﻴﺪ ﻣﻲﺷﻮﻧﺪ (13). ﻳﻜﻲ از ﻣﺆﺛﺮﺗﺮﻳﻦ روشﻫـﺎ ﺑـﺮای ﺟﻠـﻮﮔﻴﺮی از اﻳـﻦ اﻣـﺮ اﻳﺠﺎد ﻳﻚ ﻻﻳﻪ از ذراﺗﻲ ﻣﺎﻧﻨﺪ ﺳﻴﻠﻴﺲ و ﻃﻼ ﺑﺮ روی آﻧﻬـﺎ و ﺗﺸـﻜﻴﻞ ﺳﺎﺧﺘﺎر ﻫﺴﺘﻪ ﻻﻳﻪ ﻣﻲﺑﺎﺷﺪ ﻛﻪ آﻧﻬﺎ را ﭘﺎﻳﺪار ﻣـﻲﺳـﺎزد. ﺑـﻪ ﻋﻨـﻮان ﻣﺜﺎل ﻧﺎﻧﻮذرات آﻫﻦ ﻗﺪرت ﻣﻐﻨﺎﻃﻴﺴﻲ ﺑﺎﻻﺗﺮی ﻧﺴﺒﺖ ﺑﻪ ﺣﺎﻟﺖ اﻛﺴﻴﺪ ﺧﻮد دارﻧﺪ و ﻣﻲﺗﻮاﻧﻨﺪ ﺑﻪ ﻋﻨﻮان ﻳﻚ اﺑﺮ ﭘﺎراﻣﻐﻨﺎﻃﻴﺲ ﻣـﻮرد اﺳـﺘﻔﺎده ﻗﺮار ﺑﮕﻴﺮﻧﺪ (14). از ﻃﺮف دﻳﮕﺮ اﮔﺮﭼﻪ ﻧﺎﻧﻮذرات ﺑﺎ داﺷـﺘﻦ وﻳﮋﮔـﻲ اﺑـﺮ ﭘﺎرا ﻣﻐﻨﺎﻃﻴﺴﻲ، ﺟﺬب ﻳﻜﺪﻳﮕﺮ ﻧﻤﻲﺷﻮﻧﺪ، وﻟﻲ ﺑﻪ دﻟﻴﻞ اﻧﺮژی ﺑﺎﻻﻳﻲ ﻛﻪ دارﻧﺪ ﺑﻪ ﺗﺠﻤﻊ و اﻧﺒﺎﺷﺘﮕﻲ ﺗﻤﺎﻳﻞ دارﻧﺪ. ﺑﻨﺎﺑﺮاﻳﻦ اﻳﺠﺎد ﭘﻮﺷﺶ ﺑﺮ روی اﻳﻦ ﻧﺎﻧﻮذرات ﻧﻪﺗﻨﻬﺎ از ﺗﺠﻤﻊ آﻧﻬﺎ ﺟﻠﻮﮔﻴﺮی ﻣـﻲﻛﻨـﺪ. ﺑﻠﻜـﻪ وﻳﮋﮔﻲﻫﺎی ﺧﺎص و ﻣﻨﺎﺳﺒﻲ را ﻣﺎﻧﻨﺪ ﺳـﺎزﮔﺎری زﻳﺴـﺘﻲ و ﭘﺎﻳـﺪاری، اﻳﺠﺎد ﻣﻲﻛﻨـﺪ. ﻧـﺎﻧﻮذرات ﻣﻐﻨﺎﻃﻴﺴـﻲ ﺑـﺎ ﺳـﻄﻮح اﺻـﻼح ﺷـﺪه در زﻣﻴﻨﻪﻫﺎی ﻣﺨﺘﻠﻒ ﻣﺎﻧﻨﺪ ﺗﺼﻮﻳﺮﺑﺮداری ﺑﺎ ﺗﺸﺪﻳﺪ ﻣﻐﻨﺎﻃﻴﺴـﻲ (MRI)، اﻳﻤﻴﻨﻮاﺳﻲ و اﻧﺘﻘﺎل دارو ﻛﺎرآﻣﺪ ﻣﻲﺑﺎﺷﻨﺪ و ﺗﻮﺟﻪ ﺑﺴـﻴﺎری را ﺑﻪ ﺧﻮد ﺟﻠﺐ ﻛﺮدهاﻧﺪ (14). اﻣﺮوزه روشﻫﺎی ﻣﺨﺘﻠﻔﻲ ﺑﺮای ﺗﻮﻟﻴﺪ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﻴﺴﻲ ﻣﺎﻧﻨﺪ روش ﻫــﻢ رﺳــﻮﺑﻲ، ﻫﻴــﺪروﺗﺮﻣﺎل، sol-gel، ﻣﻴﻜﺮواﻣﻮﻟــﻮژن و روشﻫــﺎی اﺳﺘﻔﺎده از ﭘﻠﻴﻤﺮﻫﺎ وﺟﻮد دارد ﻛﻪ در اﻳﻦ ﺑﻴﻦ، ﻫﻢ رﺳـﻮﺑﻲ ﻳﻜـﻲ از ﻣﺘﺪاوﻟﺘﺮﻳﻦ و ﻗﺎﺑﻞ ﻛﻨﺘﺮل ﺗﺮﻳﻦ روشﻫﺎ ﻣﻲﺑﺎﺷـﺪ. در اﻳـﻦ ﭘﺮوﺳـﻪ از ﻣﻮاد ﻗﻠﻴﺎﻳﻲ و ﺑﻪ ﻃﻮر ﻣﻌﻤﻮل از ﺳـﺪﻳﻢ ﻫﻴﺪروﻛﺴـﻴﺪ و ﻳـﺎ آﻣﻮﻧﻴـﺎک ﺑﺮای ﺗﻮﻟﻴﺪ ﻧﺎﻧﻮذرات اﻛﺴﻴﺪ آﻫﻦ اﺳﺘﻔﺎده ﻣـﻲشود. ﺳـﺎﻳﺰ ﻧـﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ در اﻳﻦ روش ﺑﻪ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔـﻲ از ﺟﻤﻠـﻪ ﻧﺴـﺒﺖ ﻣـﻮﻟﻲ ﻧﻤﻚﻫﺎی آﻫﻦ، ﻧﻮع ﻧﻤﻚ و ﻣﺎده ﻗﻠﻴﺎﻳﻲ ﻣﻮرد اﺳﺘﻔﺎده، ﻧﺴﺒﺖ ﺗﺮﻛﻴﺐ آﻧﻬﺎ، ﺳﺮﻋﺖ ﻣﺨﻠﻮط ﻛـﺮدن، ﻣﻴـﺰان pH، درﺟـﻪ ﺣـﺮارت و ﺣﻀـﻮر ﻧﻴﺘﺮوژن ﺑﺴﺘﮕﻲ دارد (15). در ﺑﻴﻦ ﻓﻠﺰات ﻣﺨﺘﻠﻔﻲ ﻛﻪ ﺑـﺮای اﻳﺠـﺎد ﻳـﻚ ﻻﻳﻪ ﺑﺮ روی ﻧﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ اﺳﺘﻔﺎده ﻣﻲﮔﺮدﻧﺪ، ﻓﻠﺰات ﺟﺪﻳـﺪی ﻣﺎﻧﻨﺪ ﻧﺎﻧﻮذرات ﻃﻼ ﺑـﻪ دﻟ ﻴـ ﻞ ﺳـﺎزﮔﺎر ی زﻳﺴـﺘ ﻲ، ﭘﺎﻳـ ﺪاری و روش ﺳﻨﺘﺰ ﺷﻨﺎﺧﺘﻪ ﺷﺪه، ﺗﻮﺟﻪ ﺑﻴﺸﺘﺮی را ﺑـﻪ ﺧـﻮد ﺟﻠـﺐ ﻛـﺮدهاﻧـﺪ ﻧﺎﻧﻮذرات ﺑﺎ ﭘﻮﺷﺶ ﻃﻼ ﺳﺎزﮔﺎری زﻳﺴﺘﻲ ﻗﺎﺑﻞﺗـﻮﺟﻬﻲ دارﻧـﺪ و ﺑـﻪ راﺣﺘﻲ ﺑﺎ ﺑﻴﻮﻣﻮﻟﻜﻮلﻫﺎﻳﻲ ﻣﺎﻧﻨﺪ ﭘﻠﻲﭘﭙﺘﻴﺪﻫﺎ، اﺳـﻴﺪﻫـﺎی ﻧﻮﻛﻠﺌﻴـﻚ و ﭘﻠﻲ ﺳﺎﻛﺎرﻳﺪﻫﺎ واﻛـﻨﺶ ﻣـﻲدﻫـﺪ (16) ﺑﻨـﺎﺑﺮاﻳﻦ ﺗﺮﻛﻴـﺐ ﻧـﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ ﺑﺎ ﻧﺎﻧﻮذرات ﻃﻼ ﺑﺎ ﺳﺎﺧﺘﺎر ﻫﺴﺘﻪ ﻻﻳﻪ ﭘﺘﺎﻧﺴﻴﻞ زﻳﺎدی را در زﻣﻴﻨﻪﻫﺎی ﻣﺨﺘﻠﻒ ﺑﻴﻮﻟﻮژﻳﻜﻲ اﻳﺠﺎد ﻣﻲﻛﻨﺪ. پژوهش حاضر با هدف سنتز نانوذرات مغناطیسی حاوی دوکسوروبیسین انجام گرفته است که در طی آن، نانوذرات از جهت کارایی درونگیری دارو، رهایش دارو، اندازه ذرات، بار سطحی نانوذرات، برهمکنش میان دارو و نانوسامانه، مورفولوژی ذرات و رهایش 72ساعته دارو در PHها و شرایط دمایی مختلف مورد بررسی قرار گرفت.
روش بررسی
پژوهش حاضر نوعی مطالعه بنیادی _ کاربردی میباشد که به روش تجربی _ آزمایشگاهی به انجام رسیده و مراحل آن به شرح ذیل میباشد:
!-موادشیمیایی: داروی دوکسوروبیسین هیدروکلراید بهصورت ویالهای تزریقی با غلظت 2 میلیگرم بر میلیلیتر متعلق به شرکت GmbH cell pharm آلمان و, FeCl3-6H2O ,FeCl2-4H2O پلیاتیلینایمین متعلق به شرکت Merck آلمان، تهیه و خریداری شد.
2-ترسیم نمودار کالیبراسیون دوکسوروبیسین: به منظور رسم نمودار کالیبراسیون دارو و بهدست آوردن معادله خط آن، غلظتهای مختلفی از استوک داروی دوکسوروبیسین در آب و PBS(phosphate Buffered Saline) به روش سری استاندارد ساخته شد. سپس جذب نوری آنها توسط دستگاه اسپکتوفوتومتر در طول موج ماکزیمم دوکسوروبیسین nm)415)، با تکرار 3 تایی (محدوده تابعیت رابطه جذب و غلظت از قانون Beer –Lambar) گرفته شده و سپس نمودار کالیبراسیون رسم و معادله خط و ضریب رگراسیون آن محاسبه گردید (17).
3-ﺳﻨﺘﺰ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﯿﺴﯽ: ﺳﻨﺘﺰ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﯿﺴﯽ ﺑﺎ اﺳﺘﻔﺎده از روش ﻫﻢ رﺳﻮﺑﯽ ﺷﯿﻤﯿﺎیﯽ ﺻﻮرت گرفت. ﺑﺮای ایﻦ ﻣﻨﻈﻮر 0/04 ﮔﺮم FeCl2-4H2O و 0/1 ﮔﺮم FeCl3-6H2O در 20 ﻣﯿﻠﯽﻟﯿﺘﺮ آب دیﻮﻧﯿﺰه ﺣﻞ ﺷﺪ. ﻣﺤﻠﻮل ﺑﺪﺳﺖ آﻣﺪه ﺑﻪ ﻣﺪت 10 دﻗﯿﻘﻪ در 50 درﺟﻪ ﺳﺎﻧﺘﯿﮕﺮاد ﺗﺤﺖ گاز 2N ﺑﻪ وﺳﯿﻠﻪ اﺳﺘﯿﺮر ﻫﻢ زده ﺷﺪ. ﺳﭙﺲ 5 ﻣﯿﻠﯽﻟﯿﺘﺮ NaOH 0.3) ﻣﻮﻻر) در حالیکه به شدت به هم زده میشود، به تدریج افزوده شود تا رنگ آن از نارنجی به سیاه تغییر کند سپس مخلوط به دست آمده به مدت یک ساعت دیگر به هم زده شد تا به تدریج دما، به دمای اتاق کاهش یابد. سپس محصولات سیاه را با آهن ربای دائمی جدا گردید. رسوب را 3 بار با 70 میلیلیتر آب دیونیزه شسته شد برای جلوگیری از تجمع Fe3O4 0/02 گرم تترااتیل آمونیوم پرکلرات به نانوذره سنتز شده اضافه گردید. سپس در دمای 50 درجه سانتیگراد برای مدت 16 ساعت در محفظه خشک کن خلاء خشک شد.
4_پوشش دار کردن سطح نانو ذرات مغناطیسی با پلیمر پلیاتیلینایمین: بعد از سنتز نانوذرات مغناطیسی آهن به روش هم رسوبی، نانو ذرات مغناطیسی و پلی اتیلین ایمین به نسبت جرمی (1:2) در دمای اتاق به مدت 24 ساعت در PH=9 انکوبه شدند. نانو ذرات مغناطیسی با پوشش پلیاتیلین ایمین بهوسیله آب مقطر و متیل الکل حداقل 3 بار شسته شدند و به وسیله سانتریفیوژ جدا شدند. سپس نانوذرات اصلاح شده در دمای 60 درجه سانتیگراد به مدت 24 ساعت خشک شدند. پلی اتیلین ایمین به وسیله نیروی الکترواستاتیک به نانوذره متصل و بارهای منفی روی سطح ذرات به بارهای مثبت تبدیل میشوند.
5_ اتصال ذرات طلا بر روی نانوذرات مغناطیسی اکسیدآهن پوششدار شده با پلی اتیلین ایمین: 4 میلیلیتر از mM)) HAucl4 به محلول نانوذره مغناطیسی آهن پوششدار شده با پلیاتیلین ایمین اضافه شد سپس تا زمان جوش آمدن به هم زدیم سپس 6 میلی لیتر سدیم سیترات یک درصد به مخلوط واکنش اضافه گردید و سپس مخلوط را به هم زده تا رنگ آن از سیاه به نارنجی تغییر کند. مخلوط واکنش بهمدت 5 دقیقه در حالت هم زدن جوشانده شد.
6 -بارگیری داروی دوکسوروبیسین در نانوذرهمغناطیسی اکسیدآهن: داروی دوکسوروبیسین قابل حل در آب هستند بارگیری دوکسوروبیسین با حل کردن mg5 نانو ذرات اکسید آهن با پوشش پلیاتیلینایمین در ml 5 محلول آبی دوکسوروبیسن انجام گردید. مخلوط نانو ذرات اکسید آهن در دوکسوروبیسین با سرعت rpm 200 در در 0C 37 برای 24 ساعت هم زده شد، نانو ذرات مغناطیسی از محلول توسط مگنت حذف شدند و سپس نانو ذرات مغناطیسی بارگیری شده با دارو خشک گردید.
7- تعیین بازده بارگذاری داروها در نانوذرهمغناطیسی اکسید آهن: برای تعیین میزان انکپسولاسیون نانو ذرات پس از اولین سانترفیوژ در اولین مرحله شستشو، از مایع رویی نمونه برداری شده و در طولموج مشخص دارو، میزان جذب مایع رویی خوانش شده و به این صورت غلظت داروی درونگیری نشده در نانو ذرات بر پایه نمودار استاندارد غلظت، دوکسوروبیسین/آب بهدست آمد. در ادامه کار این غلظت را از غلظت اولیه دارو تفریق کرده تا میزان داروی لود شده در نانو ذرات مغناطیسی بدست آید.
8-تعیین اندازه ذرات و پتانسیل زتا: پتانسیل زتای (Potential-Zeta) فرمولاسیون نانوذرات مغناطیسی اکسیدآهن حاوی دارو و اندازه نانوذرات حاصل از این فرمولاسیون، با استفاده از دستگاه زتا سایزر شرکت Malvern Instruments مدل Nano-zetaSizer در دمای اتاق و زاویه °90 اندازهگیری گردید.
9-تصویربرداری از نانوذرهمغناطیسی اکسید آهن: از نانوذرهمغناطیسی اکسید آهن با استفاده از میکروسکوپ الکترونی روبشی به منظور بررسی شکل و ساختار نانوذرهمغناطیسی اکسید آهن تولیدی حامل دارو تصویر گرفته شد. همچنین جهت بررسی چند لایه بودن و ساختار غشاء نانوذرهمغناطیسی اکسید آهن، از نانوذرهمغناطیسی اکسید آهن تصاویری با استفاده از میکروسکوپ الکترونی گذاره برودتی تهیه گردید.
10- بررسی نحوه رهایش داروی دوکسوروبیسین از فرمولاسیونهای نانوذرهمغناطیسی در محیط برونتن: برای بررسی روند رهایش دارو از نانوذرهمغناطیسی در محیط برونتن، ابتدا باید محیط مشابه از لحاظ pH که بتواند شرایط یکسان با pH خون را برقرار کند، انتخاب شود. بدین منظور بافر فسفات در 7/4pH انتخاب شد. بررسی رهایش داروی دوکسوروبیسین از نانوذرهمغناطیسی، بوسیله کیسه دیالیز در pH=7.4 و دمای C° 37 شرایط فیزیولوژیک بافت و PH=5.6 و دما C 420شرایط بافت تومور مورد سنجش قرار گرفت (18). بدین منظور، حجم مشخصی از نانوذره حاوی دارو، داخل کیسه دیالیز سلولزی ریخته شد. محیط دیالیز در زمانهای متفاوت جمعآوری و فورا با همان حجم از بافر فسفات تازه جایگزین شد. نمونهها با استفاده از اسپکتروسکوپی فرابنفش -مرئی در طول موج ماکزیمم مربوط به هر دارو، آنالیز شدند. با توجه به منحنی استاندارد داروی دوکسوروبیسین در بافر فسفات، میزان رهایش دارو در زمانهای مختلف اندازهگیری شد.
12-آزمایش سمیت سلولی به روش MTT: به منظور اندازهگیری سمیت سلولی، ابتدا سلولهای MCF_7وMCF-10A بهطور جداگانه (cell/well104) در پلیت 96تایی به مدت 24 ساعت کشت داده شدند. بعد از 24 ساعت، سلولها با 200 میکرولیتر محیط کشت جدید تیمار شدند که حاوی غلظتهای متفاوتی از داروهای آزاد و فرمولاسیون نانوذره مغناطیسی اکسید اهن به شرح زیر است:
1. دوکسوروبیسین آزاد (0،5،10،20،40،80،160 میکروگرم بر میلیلیتر)
2. دوکسوروبیسین محصور شده در نانوذره مغناطیسی اکسید آهن (،5،10،20،40،80،160،0 میکروگرم بر میلیلیتر) 6. سلولهای تیمار نشده با داروهای آزاد و فرمولاسیونهای نانوذره مغناطیسی اکسید آهن بهعنوان گروه کنترل در نظر گرفته شدند. طول مدت انکوباسیون سلولها با داروهای آزاد و فرمولاسیونهای نانو ذرات مغناطیسی 24، 48 و 72 ساعت است. سپس 20 میکرولیتر ((4,5-Dimethyl-2 thiazolyl )-2,5-diphenyl-2H-tetrazolium bromid )MTT (5mg/ml به هر چاهک پلیت 96 خانهایی اضافه شد و به مدت 3 ساعت انکوبه شدند. بعد از آن مایع رویی خارج شد و به منظور حل کردن کریستالهای نامحلول فورمازان تشکیل شده در ته چاهک، 180 میکرولیتر حلال DMSO اضافه گردید. جذب در طولموج 570 nm با استفاده از اسپکتروفتومتر میکروپلیت EPOCH (synergy Bio Tek USA) ثبت گردید. درصد بقا سلولهای مورد بررسی، با استفاده از فرمول 2-2 محاسبه شد.
فرمول 2-2
100× میانگین جذب گروه کنترل منفی/ میانگین جذب هر گروه = درصد بقا سلولی
برپایه این اندازهگیریها، میزان The half maximal inhibitory concentration) IC50) غلظت مورد نیاز از دارو برای 50% مهار رشد سلولی نسبت به گروه کنترل) با استفاده از نرمافزار گراف پد پریسم محاسبه شد.
ﺗﺠﺰیﻪ و ﺗﺤﻠﯿﻞ آﻣﺎری
ﺑﺮای ﺑﺮرﺳﯽ آﻣﺎری ﻧﺘﺎیﺞ از ﻧﺮم اﻓﺮاز prism و روش ﺗﯽ - ﺗﺴﺖ (و یﺎ ﻣﻦ ویﺘﻨﯽ) و ANOVA (و یﺎ ﮐﺮوﺳﮑﺎل واﻟﯿﺲ) اﺳﺘﻔﺎده ﺷﺪ و ﻣﻌﻨﺎداری ﻧﺘﺎیﺞ ﺑﺮ ﺣﺴﺐ 0.05≥P-value ﺳﻨﺠﯿﺪه شد.
نتایج
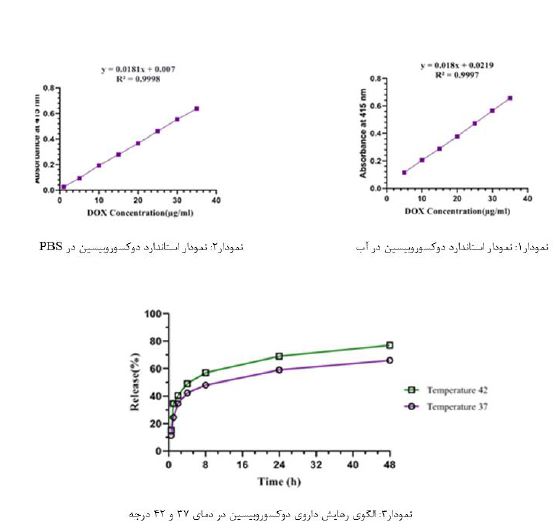
بررسی بازده درونگیری و الگوی رهایش دارو در نانوذره مغناطیسی اکسیدآهن حاوی دوکسوروبیسین: بازده درونگیری دارو درون نانوذره مغناطیسی با استفاده از معادله خط دوکسوروبیسین در آب (نمودار1)،71/93 درصد محاسبه گردید. همچنین با استناد به معاده خط دوکسوروبیسین دربافر PBS (نمودار2)، نمودارهای رهایش دارو در شرایط سالم و شرایط سلول سرطانی طی 48 ساعت رسم گردید. همانطور که در نمودارهای رهایش مشخص است (نمودار3)، الگوی رهایش دارو در شرایط سلولهای سالم (C°37،PH=7.4) و سلول سرطانی (C°42،(PH=5.4 آهستهرهش است. شیب و حداکثر رهایش دارو در شرایط سرطانی نسبت به شرایط نرمال مقداری بیشتر است که این موضوع نشان میدهد، نانوحامل ساخته شده در شرایط سرطانی بهصورت نیمههدفمند عمل میکند. همچنین این بررسی نشان میدهد که حداکثر رهایش دارو توسط نانوذره مغناطیسی اکسید آهن در شرایط سالم و سرطانی به ترتیب 48 و 66 درصد است.
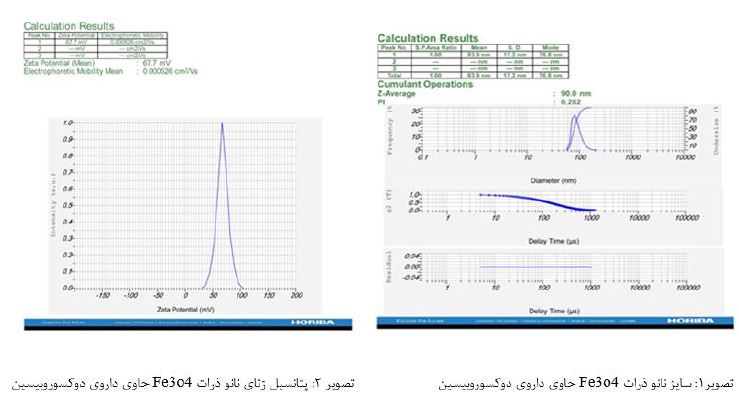
اندازه و پتانسیل زتا ذرات فرمولاسیون بهینه: دادههای به دست آمده از دستگاه DLS ،اندازه نانوذره حاوی دوکسوروبیسین را nm 90 (تصویر1) و میزان شارژ سطحی (پتانسیل زتا) mV 67.7نشان میدهد(تصویر 2).
بررسی تصویر میکروسکوپ الکترونی از نانوسامانه بهینه: تصویر میکروسکوپ الکترونی SEM (تصویر 3) حکایت از این واقعیت دارد که نانوسامانه حاوی داروی دوکسوروبیسین ضمن برخوداری از ویژگیهای ظاهری مطلوب، دارای توزیع اندازه مناسب و ساختار کروی هستند، همچنین بر اساس شکل مشخص میشود که ذرات دارای مورفولوژی همگن و یکنواختی هستند و مرز میان ذرات قابل تشخیص است. همچنین این تصویر نشان میدهد که چسبندگی میان ذرات مشاهده نمیشود و همچنین اندازهگیری قطر نانوذره با میکروسکوپ، تاببدی بر صحت قطر اندازهگیری شده با دستگاه DLSE میباشد.
بررسی ورود نانوسامانه بهینه حاوی دوکسوروبیسین به سلول سرطانی: براساس تصویر 4 مشخص میشود در این تست از رنگ DAPI به منظور رنگآمیزی هسته استفاده شد. به این صورت که DAPI به مناطق غنی از A-T در مولکول DNA متصل میشود؛ بنابراین پس از رنگآمیزی، هسته سلولها با استفاده از میکروسکوپ فلوئورسنت قابل مشاهده است و به رنگ آبی دیده میشود همچنین دوکسوروبیسین نیز دارای خاصیت فلوروسنت بوده و در زیر میکروسکوپ به رنگ قرمز دیده میشود. همانگونه که در تصاویر مشاهده میشود. (تصویر4). نشان دهنده ورود سلولی داروی دوکسوروبیسین به درون سلولهای سرطانی MCF-7 است که رنگ قرمز ناشی از آن در درون سلول قابل مشاهده است. رنگ آبی مشاهده شده در این تصویر نشاندهنده هسته سلولهای سرطانی است و ادغام این دو رنگ در زیر میکروسکوپ فلوروسنت ورود دوکسوروبیسین به درون هسته سلول را به رنگ بنفش به خوبی نشان داده است.

تصویر3: تصاویر SEM از فرمولاسیون بهینه نانوذره مغناطیسی اکسیدآهن بارگذاری شده بادوکسوروبیسین
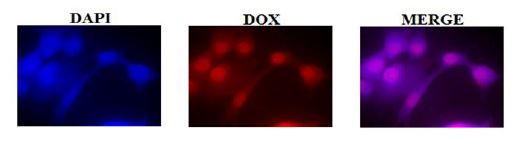
تصویر4: بررسی ورود سلولی سامانه ی مغناطیسی حاوی داروی دوکسوروبیسین به درون سلولهای سرطانی MCF-7
بحث
پژوهش حاضر ضمن ساخت نانوسامانه مغناطیسی اکسید آهن حاوی داروی ضدسرطان دوکسوروبیسین به بررسی ویژگیهای فیزیکوشیمیایی آن میپردازد که نتایج آن نشان میدهد که این نانو سامانه دارای راندمان انکپسولاسیون 93.71 درصد و رهایش کنترل شده دارو در شرایط سلولهای سالم و سرطانی میباشد. آنالیز نانوذره با دستگاه DLS تایید میکند که فرمولاسیون نانوذره مغناطیسی دارای اندازه nm 90 و پتانسیل زتای mV 67.7 است. همچنین بررسی سمیت سلولی این نانوذره حاوی دارو نشان می دهد که در غلظت یکسان، میزان سمیت دوکسوروبیسن انکپسوله شده در مقایسه با دوکسوروبیسین آزاد بر روی رده سلولی MCF-7 سرطان پستان افزایش محسوسی یافته است. تاکنون پژوهشهای متعددی بر روی نانوذرات مغناطیسی اکسید آهن انجام گرفته است که به بخشی از آن اشاره می شود. Silva و همکاران در سال 2013، از پوشش طلا در سطح نانو ذرات fe3o4 استفاده شد. تجزیه و تحلیل عناصر گونههای محلول نشان داد که پوشش طلای هستههای مگنتیت مقاومت قابل توجهی در برابر انحلال آهن میدهد. توانایی مهندسی پوشش طلا در سطوح ذرات امکان عملکرد بیولوژیکی کنترل شده را فراهم میکند. Zhang در سال 2015 نشان داد که استفاده از پوشش پلیاتیلینایمین (PEI) در نانو ذرات مغناطیسی Fe3O4 علاوه بر ایجاد مورفولوژی کروی و افزایش اندازه نانو ذرات میتواند باعث مثبتتر شدن پتانسیل زتا شده و باعث افزایش پایداری کولوئیدی طولانی مدت و ثبات مناسب و در نتیجه افزایش میزان بارگذاری دارو در نانو ذرات مغناطیسی شود. Drescoدر سال1999، در این مطالعه نیز با استفاده از پوشش طلا و پلیاتیلینایمین اندازه نانو ذرات در محدوده ی 90-100 نانومتر در راستای بهینه سازی میزان بارگذاری، سایز و پتانسیل زتا تغییر کرد که قابل قبول بود. نانو ذرات مگنتیت زیست سازگار هستند و پوشاندن آن با طلا و پلیاتیلینایمین علاوه بر تغییر موثر در خواص و زیست سازگاری آن قابلیت بارگیری دارو و انتقال هدفمند آن به سلولهای mcf-7 را تسهیل میکند، همچنین از تجمع یا اگریگه شدن نانو ذرات کاسته شده و نانو ذرات اصلاح شده سوسپانسیون پایدارتری را تشکیل میدهند. Shenو همکاران در سال 2009 در مطالعهای که در مورد بررسی مقاومت سلولهای سرطانی MDA-MB نسبت به داروی آزاد Dox انجام دادند، دریافتند که یک ژن به نام MDRI که توسط سلولهای انسان کد میشود، عامل مقاومت سلولهای سرطانی نسبت به داروی Dox است این ژن یک نوع پرتئین ترانسپورتر غشایی به نام گلیکوپرتئین P راکد میکند که نقش پمپاژ کردن دارو را به خارج از سلول ایفا میکند و همین عامل موجب مقاومت سلولها نسبت به Doxمیشود (19) سمیت زود هنگام نانو ذرات حامل Dox این فرضیه را تایید میکند که مسیر ورود و مکانیسم عملکردی آنها از Dox آزاد متفاوت است نانو ذرات حامل Dox احتمالاً از طریق مکانیسم اندوسیتوز وارد سلول میشوند و احتمالاً این مکانیسم شانس غلبه بر مقاومت سلولهای سرطانی نسبت به داروی Dox را افزایش میدهد. نتایج تحقیقات انجام شده توسط Aljarrah و همکاران در سال 2012 نشان میدهد که نانو ذرات اکسید آهن به تنهایی نمیتوانند رشد سلولهای MCF7 را مهار کنند چون نانو ذرات مغناطیسی به تنهایی قادر به تولید ROS نیستند Aljarrah و همکاران نتیجه گرفتند که با پیش تیمار سلولهای MCF7 با نانو ذرات مغناطیسی و با قراردادن سلولها در معرض میدان مغناطیسی استاتیک (SMF) قبل از این که سلولها با Dox تیمار شوند، افزایش قابل ملاحظهای در قطعه قطعه شدن DNA در مرحله G1 مشاهده شد نتایج نشان میدهد که این تیمار، نقش مهمی در حساس کردن سلولهای سرطانی نسبت به القاء مرگ آپوپتوتیک سلولها با داروی دوکسوروبیسین دارد این گروه تحقیقاتی دریافتند که میدان مغناطیسی استاتیک (SMF) به تنهایی قادر به القاء مرگ سلول سرطانی نیست میدان مغناطیسی استاتیک تنها در حضور نانوذرات اکسید آهن وDox موجب مهار رشد سلولها میشود پتانسیل آپوپتوتیک میدان مغناطیسی استاتیک، به دلیل توانایی آن در القاء تغییر شکل سلول میباشد (20). Nigam و همکاران در سال2011 نانوذرات مغناطیسی Fe3O4 حاوی داروی داکسوروبیسین را که با اسید سیتریک پوشیده شده بود را سنتز کردند که این نانوذرات توانایی آزادسازی داروی شیمیایی مورد نظر را در محیط اسیدی توموری به مقدار قابلتوجهی داشت. علاوه بر این با دارا بودن پایداری بهینه ،میزام لود مناسب و زیستسازگاری سلولی این سیستم تحویل دارو را بهعنوان یک نامزد مناسب در کاربردهای پزشکی نشان داد (21,22). در مطالعهای دیگر که توسطShen و همکاران در سال 2015 بررسی شد یک سیستم تحویل داروی حساس به PH و مغناطیسی (DDS) مبتنی بر نانوذرات ابر پارامغناطیسی PEGylated Fe3O4 سنتز شد. این نانوذرات با روکش سیتریک و سپس با پلیاتیلگلایکول پوشیده شدند. دوکسوروبیسین بهعنوان یک داروی شیمیدرمانی به این سامانه اضافه شد. این نانوذرات دارای مغناطیس قوی با قابلیت بارگذاری دارو تا 89% در اندازه های نسبتاً یکنواخت سنتز شد. در این مطالعه نشان داده شد که این سامانهها به خوبی زندهمانی سلولهای سرطانی را کاهش داده اما کمی پایینتر از تاثیر داکسوروبیسین آزاد بر روی سلولهای سرطانی را نشان داد (23). در مطالعهای که در سال2012 توسط Jia انجام شد کمپلکس نانوذرات DOX Fe3O4-PLGA- سنتز شد که میزان بارگذاری بالایی را نشان داد، همچنین دارای رهایش پایدار و ثابت بود که در PH اسیدی رهایش سریعتری داشت. این نانوذرات در محیط آزمایشگاهی بر روی سلولهای سرطانی ریه موش اعمال شدند که آپوپتوز سلولهای سرطانی را به همراه داشت (24). در مطالعهای دیگر که توسط Semkina و همکاران در سال 2015 انجام شد نانو ذرات مغناطیسی حاوی داروی داکسوروبیسین را سنتز کردند که دارای پوسته BSA بر روی هسته مغناطیسی Fe3O4 به همراه اتصال پلیاتیلنگلایکول بود. این نانوذرات ظرفیت بارگذاری 8 درصد وزنی خود را داشته همچنین رهایش داروی داکسوروبیسین در PH=5.5 نسبت به PH=7.4 به نسبت بیشتر بود (25). مطالعهای که در سال2017 توسط Asghar k انجام شد، به سنتز و توصیف یک نانوحامل جدید و هوشمند با هسته مغناطیسی و پوسته حرارتی پاسخگو برای تحویل مشترک دوکسوروبیسین آب دوست (Dox) و کورکومین آبگریز (Cur) بهعنوان یک درمان ترکیبی برای درمان سرطان پرداخته شد کارایی کپسولهسازی Dox و Cur به ترتیب 96 و 90 درصد بود. مطالعات آزادسازی وابسته به دما رهایش آهسته ولی پایداری را گزارش کرد. سنجش MTT بر روی سلولهای طبیعی و HeLa ماهیت غیر سمی نانوکامپوزیتها را نشان داد. این نانو ذرات بارگذاری شده در مقایسه با Dox و CUR آزاد، فعالیت ضد سرطانی در شرایط آزمایشگاهی را نشان میدهد. چنین سیستم تحویل هوشمند همراه با هم میتواند پتانسیلی برای تحویل دارویی کنترل شده و هدفمند در تشخیص را سرطان داشته باشد (26) بنابر موارد فوق در این پژوهش نیز نانوذرات حاوی دارو تاثیر به مراتب بیشتری را بر روی سلولهای سرطانی نسبت به حالت آزاد دارو بر روی سلولهای سرطانی MCF-7 نشان دادند که با مطالعات گذشته هم راستا بود. از جمله مولفههای دیگر موثر در میزان بارگذاری دارو میزان PH است که افزایش آن منجر به افزایش میزان بارگذاری دارو در نانوذره میشود.
نتیجه گیری
امروزه اگرچه شیمیدرمانی یکی از رایجترین روشهای آنتینئوپلاستی بهشمار میآید، اما به دلیل غیر هدفمند بودن، مصرف زیاد دارو و عوارض جانبی، استفاده از این روش را با چالشهای بسیاری روبه رو گردانیده است. بنابراین دستیابی به استراتژیهای نوین به منظور بهبود سیستم دارورسانی به سلولهای سرطانی که بتواند جایگزینی مناسب برای سیستمهای دارورسان معمول باشد، میتواند بسیاری از چالشهای پیش روی علم پزشکی را برطرف نماید. در پژوهش حاضر، داروی ضد سرطان دوکسوروبیسین به منظور افزایش شاخصههای درمانی آن و در نتیجه عملکرد بهتر دارو در شرایط حاکم بر محیط سلولهای سرطانی، درون نانوذرات مغناطیسی اکسید آهن بارگذاری شده است. هر چند بررسی سمیت و آزمایشهای درون تنی و برونتنی این نانوذره حاوی داروی دوکسوروبیسین قبل از هرگونه استفاده بالینی از آن ضروری است. با استناد به نتایج این مطالعه، فرمولاسیونی برای ساخت این نانوذره پیشنهاد شد که ضمن برخوداری از الگوی رهایش کنترل شده در شرایط سلول سالم و سرطانی، دارای شاخصههای فیزیکوشیمیایی مطلوب از جمله، بار الکتریکی، میزان درونپوشانی بالا و اندازهای در حدودnm 90 است که میتواند به عنوان ترکیبی ضد توموری پیشنهاد شود.
سپاسگزاری
این مقاله حاصل بخشی از پایاننامه خانم فاطمه صادقی دانشجو کارشناسی ارشد زیستفناوری پزشکی پردیس پزشکی دانشگاه علوم پزشکی یزد میباشد. که در دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید صدوقی یزد انجام گرفته و از این مرکز در خصوص تسهیل بهرهمندی از فضای آزمایشگاهی و دستگاهی تشکر میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
ﭘﺮوﭘﻮزال ایﻦ ﺗﺤﻘﯿﻖ ﺗﻮﺳﻂ داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ ﺷﻬﯿﺪ ﺻﺪوﻗﯽ یﺰد ﺗﺎیﯿﺪ ﺷﺪه اﺳﺖ. (کد اخلاق IR.SSU.MEDICINE.REC.1399.092)
مشارکت نویسندگان
بیبی فاطمه حقیرالسادات در ارائه ایده، فاطمه صادقی ندوشن در طراحی مطالعه، فاطمه صادقی ندوشن در جمعآوری دادهها، بیبی فاطمه حقیرالسادات و فاطمه حکیمیان در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
آﻣﺎر ﺳﺮﻃﺎن ﺑﺎ ﺑﺎﻻ رﻓﺘﻦ ﭘﺎیﺪار ﻧﺮخ رﺷﺪ و ﭘﯿﺮی، ﺑﻪﻃﻮر ﭘﯿﻮﺳﺘﻪ در ﺣﺎل اﻓﺰایﺶ اﺳﺖ. در ایﻦ ﻣﯿﺎن ﺳﺮﻃﺎن ﭘﺴﺘﺎن ﺷﺎیﻊ ﺗﺮیﻦ ﺑﺪﺧﯿﻤﯽ ﻣﺮگآور در زﻧﺎن اﺳﺖ ﺑﻪطوری ﮐﻪ از ﻫﺮ 9 زن یﮏ ﻧﻔﺮ در ﻃﻮل ﻋﻤﺮ ﺧﻮد به ایﻦ ﺳﺮﻃﺎن مبتلا ﻣﯽشود (1). اما متاسفانه زﻧﺎن ایﺮاﻧﯽ ﺣﺪود یﮏ دﻫﻪ زودﺗﺮ ﻧﺴﺒﺖ ﺑه ﻣﯿﺎﻧﮕﯿﻦ ﺟﻬﺎﻧﯽ ﺑﻪ ﺳﺮﻃﺎن پستان ﻣﺒﺘﻼ ﻣﯽﺷﻮﻧﺪ (2). ﺳﺮﻃﺎن ﭘﺴﺘﺎن در ﻣﺮاﺣﻞ اوﻟﯿﻪ ﻧﺸﺎﻧﻪای ﺑﻪ ﻫﻤﺮاه ﻧﺪارد اﻣﺎ ﺑﺎ رﺷﺪ ﺗﻮﻣﻮر ﺗﻐﯿﯿﺮات ﻗﺎﺑﻞﻣﻼﺣﻈﻪای رخ ﻣﯽدﻫﺪ ﮐﻪ وﺟﻮد یﮏ ﺗﻮده ﺳﻔﺖ ﻗﺎﺑﻞ ﻟﻤﺲ در ﭘﺴﺘﺎن و یﺎ در ﻧﺎﺣﯿﻪ آﮔﺰیﻼ (زیﺮ ﺑﻐﻞ)، درد در ﭘﺴﺘﺎن و یﺎ ﻧﻮک ﭘﺴﺘﺎن، ﺗﻐﯿﯿﺮ در ﻓﺮم و یﺎ اﻧﺪازه ﭘﺴﺘﺎن، ﺗﻐﯿﯿﺮات ﭘﻮﺳﺘﯽ ﭘﺴﺘﺎن، ﺗﺮﺷﺢ ﻣﺎیﻊ، ﺑﻪ ﺧﺼﻮص ﻣﺎیﻌﺎت ﺧﻮﻧﯽ ازنوک ﭘﺴﺘﺎن از ﺟﻤﻠﻪ ایﻦ ﺗﻐﯿﯿﺮات اﺳﺖ (3). ریزﻓﺎﮐﺘﻮرﻫﺎیﯽ ﻣﺎﻧﻨﺪ اﻓﺰایﺶ ﺳﻦ، زﻣﯿﻨﻪﻫﺎی وراﺛﺘﯽ، ﻫﻮرﻣﻮن ﻫﺎی ﺟﻨﺴﯽ، ﺳﺒﮏ زﻧﺪﮔﯽ و ﻧﮋاد، ﻣﯽﺗﻮاﻧﺪ ﺧﻄﺮ اﺑﺘﻼ ﺑﻪ ایﻦ ﺑﯿﻤﺎری خطرناک را اﻓﺰایﺶ دﻫﺪ (4). ﺑﻪ ﻣﻨﻈﻮر درﻣﺎن ﺳﺮﻃﺎنﻫﺎ، ﻣﻌﻤﻮﻻً از ﺳﻪ روش ﺟﺮاﺣﯽ، رادیﻮدرﻣﺎﻧﯽ و ﺷﯿﻤﯽدرﻣﺎﻧﯽ اﺳﺘﻔﺎده ﻣﯽﺷﻮد ﮐﻪ در ایﻦ ﺑﯿﻦ ﺷﯿﻤﯽدرﻣﺎﻧﯽ ﺑﺎ وﺟﻮد داﺷﺘﻦ ﻣﺤﺪودیﺖﻫﺎیﯽ از ﻗﺒﯿﻞ، ﻫﺪﻓﻤﻨﺪ ﻧﺒﻮدن داروﻫﺎی ﺷﯿﻤﯽدرﻣﺎﻧﯽ، ﻧﯿﺎزﻣﻨﺪ ﺑﻮدن ﺑﻪ دوزﻫﺎی ﺑﺎﻻی دارو ﺑﺮای ﻣﺒﺎرزه ﺑﺎ ﺳﻠﻮلﻫﺎی ﺳﺮﻃﺎﻧﯽ، ﻣﻘﺎوﻣﺖ دارویﯽ و ﻋﻮارض ﺟﺎﻧﺒﯽ ﻣﺘﻌﺪد، ﻫﻨﻮز ﻫﻢ ﺑﻪﻋﻨﻮان یﮑﯽ از روشﻫﺎی درﻣﺎﻧﯽ ﻣﻮﺛﺮ در درمان ﺳﻠﻮلﻫﺎی ﺳﺮﻃﺎﻧﯽ ﺑﻪﺷﻤﺎر ﻣﯽآیﺪ (5). در استراتژی شیمیدرمانی از داروهای سایتوتوکسیک مثل دوکسوروبیسین با اثرگذاری مستقیم و غیر مستقیم بر چرخه سلولی استفاده میشود (6). دوکسوروبیسین متعلق به خانواده آنتیبیوتیکهای آنتراسایکلینی است که در حلالهایی مانند آب، نرمالسالین و متانول محلول است ولی در استن، بنزن، کلروفرم و اتیلین نا محلول است (7). دوکسوروبیسین تمایل بالایی برا ی اتصال به مولکول DNA دارد که با ایجاد اختلال در عملکرد آنزیم توپوایزومراز II موجب اختلال در فرآیند هماندسازی میگردد و با افزایش تولید رادیکالهای آزاد مرگ سلولی و آپوپتوز را باعث میشود (8). اگر چه استفاده از داروهایی نظیر دوکسوروبیسین در شیمیدرمانی، میتواند تا حدودی از پیشرفت سرطان جلوگیری نماید ولی عوارض جانبی زیاد و بروز مقاومت چندگانه، استفاده از آنها را در مهار سرطان با چالشی بزرگ روبهرو گردانیده است (9,10). از این رو فناوری نانو در داروسازی به دنبال استفاده از نانوحامل نظیر نانوذرات مغناطیسی اکسید آهن میباشد که در سطح مولکولی با بدن وارد تعامل میشوند، تا از این طریق با انتقال دارو به بافت موردنظر، کارایی درمان را افزایش و عوارض جانبی را کاهش دهد (11,12). ﻧﺎﻧﻮذرات ﺑﻪ دﻟﻴـﻞ ﺧـﻮاص ﻓﻴﺰﻳﻜﻮﺷـﻴﻤﻴﺎﻳﻲ و ﺳـﺎﻳﺰ منحصربه فرد ﻓﺮﺻﺖﻫﺎی زﻳﺎدی را در ﭘﻴﺸﺮﻓﺖ ﻋﻠـﻮم ﻣﺨﺘﻠـﻒ اﻳﺠـﺎد ﻛـﺮدهاﻧـﺪ. ﻧﺎﻧﻮذرات ﻓﻠﺰی ﻣﺎﻧﻨﺪ ﻛﺒﺎﻟﺖ، ﻧﻴﻜﻞ و آﻫﻦ دارای ﻛﺎرﺑﺮدﻫﺎی زﻳﺴـﺘﻲ ﻣﺘﻨﻮﻋﻲ ﻣﻲﺑﺎﺷﻨﺪ وﻟﻲ ﺑﻪ ﺳﺮﻋﺖ در ﺣﻀـﻮر اﻛﺴـﻴﮋن و آب اﻛﺴـﻴﺪ ﻣﻲﺷﻮﻧﺪ (13). ﻳﻜﻲ از ﻣﺆﺛﺮﺗﺮﻳﻦ روشﻫـﺎ ﺑـﺮای ﺟﻠـﻮﮔﻴﺮی از اﻳـﻦ اﻣـﺮ اﻳﺠﺎد ﻳﻚ ﻻﻳﻪ از ذراﺗﻲ ﻣﺎﻧﻨﺪ ﺳﻴﻠﻴﺲ و ﻃﻼ ﺑﺮ روی آﻧﻬـﺎ و ﺗﺸـﻜﻴﻞ ﺳﺎﺧﺘﺎر ﻫﺴﺘﻪ ﻻﻳﻪ ﻣﻲﺑﺎﺷﺪ ﻛﻪ آﻧﻬﺎ را ﭘﺎﻳﺪار ﻣـﻲﺳـﺎزد. ﺑـﻪ ﻋﻨـﻮان ﻣﺜﺎل ﻧﺎﻧﻮذرات آﻫﻦ ﻗﺪرت ﻣﻐﻨﺎﻃﻴﺴﻲ ﺑﺎﻻﺗﺮی ﻧﺴﺒﺖ ﺑﻪ ﺣﺎﻟﺖ اﻛﺴﻴﺪ ﺧﻮد دارﻧﺪ و ﻣﻲﺗﻮاﻧﻨﺪ ﺑﻪ ﻋﻨﻮان ﻳﻚ اﺑﺮ ﭘﺎراﻣﻐﻨﺎﻃﻴﺲ ﻣـﻮرد اﺳـﺘﻔﺎده ﻗﺮار ﺑﮕﻴﺮﻧﺪ (14). از ﻃﺮف دﻳﮕﺮ اﮔﺮﭼﻪ ﻧﺎﻧﻮذرات ﺑﺎ داﺷـﺘﻦ وﻳﮋﮔـﻲ اﺑـﺮ ﭘﺎرا ﻣﻐﻨﺎﻃﻴﺴﻲ، ﺟﺬب ﻳﻜﺪﻳﮕﺮ ﻧﻤﻲﺷﻮﻧﺪ، وﻟﻲ ﺑﻪ دﻟﻴﻞ اﻧﺮژی ﺑﺎﻻﻳﻲ ﻛﻪ دارﻧﺪ ﺑﻪ ﺗﺠﻤﻊ و اﻧﺒﺎﺷﺘﮕﻲ ﺗﻤﺎﻳﻞ دارﻧﺪ. ﺑﻨﺎﺑﺮاﻳﻦ اﻳﺠﺎد ﭘﻮﺷﺶ ﺑﺮ روی اﻳﻦ ﻧﺎﻧﻮذرات ﻧﻪﺗﻨﻬﺎ از ﺗﺠﻤﻊ آﻧﻬﺎ ﺟﻠﻮﮔﻴﺮی ﻣـﻲﻛﻨـﺪ. ﺑﻠﻜـﻪ وﻳﮋﮔﻲﻫﺎی ﺧﺎص و ﻣﻨﺎﺳﺒﻲ را ﻣﺎﻧﻨﺪ ﺳـﺎزﮔﺎری زﻳﺴـﺘﻲ و ﭘﺎﻳـﺪاری، اﻳﺠﺎد ﻣﻲﻛﻨـﺪ. ﻧـﺎﻧﻮذرات ﻣﻐﻨﺎﻃﻴﺴـﻲ ﺑـﺎ ﺳـﻄﻮح اﺻـﻼح ﺷـﺪه در زﻣﻴﻨﻪﻫﺎی ﻣﺨﺘﻠﻒ ﻣﺎﻧﻨﺪ ﺗﺼﻮﻳﺮﺑﺮداری ﺑﺎ ﺗﺸﺪﻳﺪ ﻣﻐﻨﺎﻃﻴﺴـﻲ (MRI)، اﻳﻤﻴﻨﻮاﺳﻲ و اﻧﺘﻘﺎل دارو ﻛﺎرآﻣﺪ ﻣﻲﺑﺎﺷﻨﺪ و ﺗﻮﺟﻪ ﺑﺴـﻴﺎری را ﺑﻪ ﺧﻮد ﺟﻠﺐ ﻛﺮدهاﻧﺪ (14). اﻣﺮوزه روشﻫﺎی ﻣﺨﺘﻠﻔﻲ ﺑﺮای ﺗﻮﻟﻴﺪ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﻴﺴﻲ ﻣﺎﻧﻨﺪ روش ﻫــﻢ رﺳــﻮﺑﻲ، ﻫﻴــﺪروﺗﺮﻣﺎل، sol-gel، ﻣﻴﻜﺮواﻣﻮﻟــﻮژن و روشﻫــﺎی اﺳﺘﻔﺎده از ﭘﻠﻴﻤﺮﻫﺎ وﺟﻮد دارد ﻛﻪ در اﻳﻦ ﺑﻴﻦ، ﻫﻢ رﺳـﻮﺑﻲ ﻳﻜـﻲ از ﻣﺘﺪاوﻟﺘﺮﻳﻦ و ﻗﺎﺑﻞ ﻛﻨﺘﺮل ﺗﺮﻳﻦ روشﻫﺎ ﻣﻲﺑﺎﺷـﺪ. در اﻳـﻦ ﭘﺮوﺳـﻪ از ﻣﻮاد ﻗﻠﻴﺎﻳﻲ و ﺑﻪ ﻃﻮر ﻣﻌﻤﻮل از ﺳـﺪﻳﻢ ﻫﻴﺪروﻛﺴـﻴﺪ و ﻳـﺎ آﻣﻮﻧﻴـﺎک ﺑﺮای ﺗﻮﻟﻴﺪ ﻧﺎﻧﻮذرات اﻛﺴﻴﺪ آﻫﻦ اﺳﺘﻔﺎده ﻣـﻲشود. ﺳـﺎﻳﺰ ﻧـﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ در اﻳﻦ روش ﺑﻪ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔـﻲ از ﺟﻤﻠـﻪ ﻧﺴـﺒﺖ ﻣـﻮﻟﻲ ﻧﻤﻚﻫﺎی آﻫﻦ، ﻧﻮع ﻧﻤﻚ و ﻣﺎده ﻗﻠﻴﺎﻳﻲ ﻣﻮرد اﺳﺘﻔﺎده، ﻧﺴﺒﺖ ﺗﺮﻛﻴﺐ آﻧﻬﺎ، ﺳﺮﻋﺖ ﻣﺨﻠﻮط ﻛـﺮدن، ﻣﻴـﺰان pH، درﺟـﻪ ﺣـﺮارت و ﺣﻀـﻮر ﻧﻴﺘﺮوژن ﺑﺴﺘﮕﻲ دارد (15). در ﺑﻴﻦ ﻓﻠﺰات ﻣﺨﺘﻠﻔﻲ ﻛﻪ ﺑـﺮای اﻳﺠـﺎد ﻳـﻚ ﻻﻳﻪ ﺑﺮ روی ﻧﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ اﺳﺘﻔﺎده ﻣﻲﮔﺮدﻧﺪ، ﻓﻠﺰات ﺟﺪﻳـﺪی ﻣﺎﻧﻨﺪ ﻧﺎﻧﻮذرات ﻃﻼ ﺑـﻪ دﻟ ﻴـ ﻞ ﺳـﺎزﮔﺎر ی زﻳﺴـﺘ ﻲ، ﭘﺎﻳـ ﺪاری و روش ﺳﻨﺘﺰ ﺷﻨﺎﺧﺘﻪ ﺷﺪه، ﺗﻮﺟﻪ ﺑﻴﺸﺘﺮی را ﺑـﻪ ﺧـﻮد ﺟﻠـﺐ ﻛـﺮدهاﻧـﺪ ﻧﺎﻧﻮذرات ﺑﺎ ﭘﻮﺷﺶ ﻃﻼ ﺳﺎزﮔﺎری زﻳﺴﺘﻲ ﻗﺎﺑﻞﺗـﻮﺟﻬﻲ دارﻧـﺪ و ﺑـﻪ راﺣﺘﻲ ﺑﺎ ﺑﻴﻮﻣﻮﻟﻜﻮلﻫﺎﻳﻲ ﻣﺎﻧﻨﺪ ﭘﻠﻲﭘﭙﺘﻴﺪﻫﺎ، اﺳـﻴﺪﻫـﺎی ﻧﻮﻛﻠﺌﻴـﻚ و ﭘﻠﻲ ﺳﺎﻛﺎرﻳﺪﻫﺎ واﻛـﻨﺶ ﻣـﻲدﻫـﺪ (16) ﺑﻨـﺎﺑﺮاﻳﻦ ﺗﺮﻛﻴـﺐ ﻧـﺎﻧﻮذرات اﻛﺴﻴﺪآﻫﻦ ﺑﺎ ﻧﺎﻧﻮذرات ﻃﻼ ﺑﺎ ﺳﺎﺧﺘﺎر ﻫﺴﺘﻪ ﻻﻳﻪ ﭘﺘﺎﻧﺴﻴﻞ زﻳﺎدی را در زﻣﻴﻨﻪﻫﺎی ﻣﺨﺘﻠﻒ ﺑﻴﻮﻟﻮژﻳﻜﻲ اﻳﺠﺎد ﻣﻲﻛﻨﺪ. پژوهش حاضر با هدف سنتز نانوذرات مغناطیسی حاوی دوکسوروبیسین انجام گرفته است که در طی آن، نانوذرات از جهت کارایی درونگیری دارو، رهایش دارو، اندازه ذرات، بار سطحی نانوذرات، برهمکنش میان دارو و نانوسامانه، مورفولوژی ذرات و رهایش 72ساعته دارو در PHها و شرایط دمایی مختلف مورد بررسی قرار گرفت.
روش بررسی
پژوهش حاضر نوعی مطالعه بنیادی _ کاربردی میباشد که به روش تجربی _ آزمایشگاهی به انجام رسیده و مراحل آن به شرح ذیل میباشد:
!-موادشیمیایی: داروی دوکسوروبیسین هیدروکلراید بهصورت ویالهای تزریقی با غلظت 2 میلیگرم بر میلیلیتر متعلق به شرکت GmbH cell pharm آلمان و, FeCl3-6H2O ,FeCl2-4H2O پلیاتیلینایمین متعلق به شرکت Merck آلمان، تهیه و خریداری شد.
2-ترسیم نمودار کالیبراسیون دوکسوروبیسین: به منظور رسم نمودار کالیبراسیون دارو و بهدست آوردن معادله خط آن، غلظتهای مختلفی از استوک داروی دوکسوروبیسین در آب و PBS(phosphate Buffered Saline) به روش سری استاندارد ساخته شد. سپس جذب نوری آنها توسط دستگاه اسپکتوفوتومتر در طول موج ماکزیمم دوکسوروبیسین nm)415)، با تکرار 3 تایی (محدوده تابعیت رابطه جذب و غلظت از قانون Beer –Lambar) گرفته شده و سپس نمودار کالیبراسیون رسم و معادله خط و ضریب رگراسیون آن محاسبه گردید (17).
3-ﺳﻨﺘﺰ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﯿﺴﯽ: ﺳﻨﺘﺰ ﻧﺎﻧﻮذرات ﻣﻐﻨﺎﻃﯿﺴﯽ ﺑﺎ اﺳﺘﻔﺎده از روش ﻫﻢ رﺳﻮﺑﯽ ﺷﯿﻤﯿﺎیﯽ ﺻﻮرت گرفت. ﺑﺮای ایﻦ ﻣﻨﻈﻮر 0/04 ﮔﺮم FeCl2-4H2O و 0/1 ﮔﺮم FeCl3-6H2O در 20 ﻣﯿﻠﯽﻟﯿﺘﺮ آب دیﻮﻧﯿﺰه ﺣﻞ ﺷﺪ. ﻣﺤﻠﻮل ﺑﺪﺳﺖ آﻣﺪه ﺑﻪ ﻣﺪت 10 دﻗﯿﻘﻪ در 50 درﺟﻪ ﺳﺎﻧﺘﯿﮕﺮاد ﺗﺤﺖ گاز 2N ﺑﻪ وﺳﯿﻠﻪ اﺳﺘﯿﺮر ﻫﻢ زده ﺷﺪ. ﺳﭙﺲ 5 ﻣﯿﻠﯽﻟﯿﺘﺮ NaOH 0.3) ﻣﻮﻻر) در حالیکه به شدت به هم زده میشود، به تدریج افزوده شود تا رنگ آن از نارنجی به سیاه تغییر کند سپس مخلوط به دست آمده به مدت یک ساعت دیگر به هم زده شد تا به تدریج دما، به دمای اتاق کاهش یابد. سپس محصولات سیاه را با آهن ربای دائمی جدا گردید. رسوب را 3 بار با 70 میلیلیتر آب دیونیزه شسته شد برای جلوگیری از تجمع Fe3O4 0/02 گرم تترااتیل آمونیوم پرکلرات به نانوذره سنتز شده اضافه گردید. سپس در دمای 50 درجه سانتیگراد برای مدت 16 ساعت در محفظه خشک کن خلاء خشک شد.
4_پوشش دار کردن سطح نانو ذرات مغناطیسی با پلیمر پلیاتیلینایمین: بعد از سنتز نانوذرات مغناطیسی آهن به روش هم رسوبی، نانو ذرات مغناطیسی و پلی اتیلین ایمین به نسبت جرمی (1:2) در دمای اتاق به مدت 24 ساعت در PH=9 انکوبه شدند. نانو ذرات مغناطیسی با پوشش پلیاتیلین ایمین بهوسیله آب مقطر و متیل الکل حداقل 3 بار شسته شدند و به وسیله سانتریفیوژ جدا شدند. سپس نانوذرات اصلاح شده در دمای 60 درجه سانتیگراد به مدت 24 ساعت خشک شدند. پلی اتیلین ایمین به وسیله نیروی الکترواستاتیک به نانوذره متصل و بارهای منفی روی سطح ذرات به بارهای مثبت تبدیل میشوند.
5_ اتصال ذرات طلا بر روی نانوذرات مغناطیسی اکسیدآهن پوششدار شده با پلی اتیلین ایمین: 4 میلیلیتر از mM)) HAucl4 به محلول نانوذره مغناطیسی آهن پوششدار شده با پلیاتیلین ایمین اضافه شد سپس تا زمان جوش آمدن به هم زدیم سپس 6 میلی لیتر سدیم سیترات یک درصد به مخلوط واکنش اضافه گردید و سپس مخلوط را به هم زده تا رنگ آن از سیاه به نارنجی تغییر کند. مخلوط واکنش بهمدت 5 دقیقه در حالت هم زدن جوشانده شد.
6 -بارگیری داروی دوکسوروبیسین در نانوذرهمغناطیسی اکسیدآهن: داروی دوکسوروبیسین قابل حل در آب هستند بارگیری دوکسوروبیسین با حل کردن mg5 نانو ذرات اکسید آهن با پوشش پلیاتیلینایمین در ml 5 محلول آبی دوکسوروبیسن انجام گردید. مخلوط نانو ذرات اکسید آهن در دوکسوروبیسین با سرعت rpm 200 در در 0C 37 برای 24 ساعت هم زده شد، نانو ذرات مغناطیسی از محلول توسط مگنت حذف شدند و سپس نانو ذرات مغناطیسی بارگیری شده با دارو خشک گردید.
7- تعیین بازده بارگذاری داروها در نانوذرهمغناطیسی اکسید آهن: برای تعیین میزان انکپسولاسیون نانو ذرات پس از اولین سانترفیوژ در اولین مرحله شستشو، از مایع رویی نمونه برداری شده و در طولموج مشخص دارو، میزان جذب مایع رویی خوانش شده و به این صورت غلظت داروی درونگیری نشده در نانو ذرات بر پایه نمودار استاندارد غلظت، دوکسوروبیسین/آب بهدست آمد. در ادامه کار این غلظت را از غلظت اولیه دارو تفریق کرده تا میزان داروی لود شده در نانو ذرات مغناطیسی بدست آید.
8-تعیین اندازه ذرات و پتانسیل زتا: پتانسیل زتای (Potential-Zeta) فرمولاسیون نانوذرات مغناطیسی اکسیدآهن حاوی دارو و اندازه نانوذرات حاصل از این فرمولاسیون، با استفاده از دستگاه زتا سایزر شرکت Malvern Instruments مدل Nano-zetaSizer در دمای اتاق و زاویه °90 اندازهگیری گردید.
9-تصویربرداری از نانوذرهمغناطیسی اکسید آهن: از نانوذرهمغناطیسی اکسید آهن با استفاده از میکروسکوپ الکترونی روبشی به منظور بررسی شکل و ساختار نانوذرهمغناطیسی اکسید آهن تولیدی حامل دارو تصویر گرفته شد. همچنین جهت بررسی چند لایه بودن و ساختار غشاء نانوذرهمغناطیسی اکسید آهن، از نانوذرهمغناطیسی اکسید آهن تصاویری با استفاده از میکروسکوپ الکترونی گذاره برودتی تهیه گردید.
10- بررسی نحوه رهایش داروی دوکسوروبیسین از فرمولاسیونهای نانوذرهمغناطیسی در محیط برونتن: برای بررسی روند رهایش دارو از نانوذرهمغناطیسی در محیط برونتن، ابتدا باید محیط مشابه از لحاظ pH که بتواند شرایط یکسان با pH خون را برقرار کند، انتخاب شود. بدین منظور بافر فسفات در 7/4pH انتخاب شد. بررسی رهایش داروی دوکسوروبیسین از نانوذرهمغناطیسی، بوسیله کیسه دیالیز در pH=7.4 و دمای C° 37 شرایط فیزیولوژیک بافت و PH=5.6 و دما C 420شرایط بافت تومور مورد سنجش قرار گرفت (18). بدین منظور، حجم مشخصی از نانوذره حاوی دارو، داخل کیسه دیالیز سلولزی ریخته شد. محیط دیالیز در زمانهای متفاوت جمعآوری و فورا با همان حجم از بافر فسفات تازه جایگزین شد. نمونهها با استفاده از اسپکتروسکوپی فرابنفش -مرئی در طول موج ماکزیمم مربوط به هر دارو، آنالیز شدند. با توجه به منحنی استاندارد داروی دوکسوروبیسین در بافر فسفات، میزان رهایش دارو در زمانهای مختلف اندازهگیری شد.
12-آزمایش سمیت سلولی به روش MTT: به منظور اندازهگیری سمیت سلولی، ابتدا سلولهای MCF_7وMCF-10A بهطور جداگانه (cell/well104) در پلیت 96تایی به مدت 24 ساعت کشت داده شدند. بعد از 24 ساعت، سلولها با 200 میکرولیتر محیط کشت جدید تیمار شدند که حاوی غلظتهای متفاوتی از داروهای آزاد و فرمولاسیون نانوذره مغناطیسی اکسید اهن به شرح زیر است:
1. دوکسوروبیسین آزاد (0،5،10،20،40،80،160 میکروگرم بر میلیلیتر)
2. دوکسوروبیسین محصور شده در نانوذره مغناطیسی اکسید آهن (،5،10،20،40،80،160،0 میکروگرم بر میلیلیتر) 6. سلولهای تیمار نشده با داروهای آزاد و فرمولاسیونهای نانوذره مغناطیسی اکسید آهن بهعنوان گروه کنترل در نظر گرفته شدند. طول مدت انکوباسیون سلولها با داروهای آزاد و فرمولاسیونهای نانو ذرات مغناطیسی 24، 48 و 72 ساعت است. سپس 20 میکرولیتر ((4,5-Dimethyl-2 thiazolyl )-2,5-diphenyl-2H-tetrazolium bromid )MTT (5mg/ml به هر چاهک پلیت 96 خانهایی اضافه شد و به مدت 3 ساعت انکوبه شدند. بعد از آن مایع رویی خارج شد و به منظور حل کردن کریستالهای نامحلول فورمازان تشکیل شده در ته چاهک، 180 میکرولیتر حلال DMSO اضافه گردید. جذب در طولموج 570 nm با استفاده از اسپکتروفتومتر میکروپلیت EPOCH (synergy Bio Tek USA) ثبت گردید. درصد بقا سلولهای مورد بررسی، با استفاده از فرمول 2-2 محاسبه شد.
فرمول 2-2
100× میانگین جذب گروه کنترل منفی/ میانگین جذب هر گروه = درصد بقا سلولی
برپایه این اندازهگیریها، میزان The half maximal inhibitory concentration) IC50) غلظت مورد نیاز از دارو برای 50% مهار رشد سلولی نسبت به گروه کنترل) با استفاده از نرمافزار گراف پد پریسم محاسبه شد.
ﺗﺠﺰیﻪ و ﺗﺤﻠﯿﻞ آﻣﺎری
ﺑﺮای ﺑﺮرﺳﯽ آﻣﺎری ﻧﺘﺎیﺞ از ﻧﺮم اﻓﺮاز prism و روش ﺗﯽ - ﺗﺴﺖ (و یﺎ ﻣﻦ ویﺘﻨﯽ) و ANOVA (و یﺎ ﮐﺮوﺳﮑﺎل واﻟﯿﺲ) اﺳﺘﻔﺎده ﺷﺪ و ﻣﻌﻨﺎداری ﻧﺘﺎیﺞ ﺑﺮ ﺣﺴﺐ 0.05≥P-value ﺳﻨﺠﯿﺪه شد.
نتایج
بررسی بازده درونگیری و الگوی رهایش دارو در نانوذره مغناطیسی اکسیدآهن حاوی دوکسوروبیسین: بازده درونگیری دارو درون نانوذره مغناطیسی با استفاده از معادله خط دوکسوروبیسین در آب (نمودار1)،71/93 درصد محاسبه گردید. همچنین با استناد به معاده خط دوکسوروبیسین دربافر PBS (نمودار2)، نمودارهای رهایش دارو در شرایط سالم و شرایط سلول سرطانی طی 48 ساعت رسم گردید. همانطور که در نمودارهای رهایش مشخص است (نمودار3)، الگوی رهایش دارو در شرایط سلولهای سالم (C°37،PH=7.4) و سلول سرطانی (C°42،(PH=5.4 آهستهرهش است. شیب و حداکثر رهایش دارو در شرایط سرطانی نسبت به شرایط نرمال مقداری بیشتر است که این موضوع نشان میدهد، نانوحامل ساخته شده در شرایط سرطانی بهصورت نیمههدفمند عمل میکند. همچنین این بررسی نشان میدهد که حداکثر رهایش دارو توسط نانوذره مغناطیسی اکسید آهن در شرایط سالم و سرطانی به ترتیب 48 و 66 درصد است.
اندازه و پتانسیل زتا ذرات فرمولاسیون بهینه: دادههای به دست آمده از دستگاه DLS ،اندازه نانوذره حاوی دوکسوروبیسین را nm 90 (تصویر1) و میزان شارژ سطحی (پتانسیل زتا) mV 67.7نشان میدهد(تصویر 2).


بررسی تصویر میکروسکوپ الکترونی از نانوسامانه بهینه: تصویر میکروسکوپ الکترونی SEM (تصویر 3) حکایت از این واقعیت دارد که نانوسامانه حاوی داروی دوکسوروبیسین ضمن برخوداری از ویژگیهای ظاهری مطلوب، دارای توزیع اندازه مناسب و ساختار کروی هستند، همچنین بر اساس شکل مشخص میشود که ذرات دارای مورفولوژی همگن و یکنواختی هستند و مرز میان ذرات قابل تشخیص است. همچنین این تصویر نشان میدهد که چسبندگی میان ذرات مشاهده نمیشود و همچنین اندازهگیری قطر نانوذره با میکروسکوپ، تاببدی بر صحت قطر اندازهگیری شده با دستگاه DLSE میباشد.
بررسی ورود نانوسامانه بهینه حاوی دوکسوروبیسین به سلول سرطانی: براساس تصویر 4 مشخص میشود در این تست از رنگ DAPI به منظور رنگآمیزی هسته استفاده شد. به این صورت که DAPI به مناطق غنی از A-T در مولکول DNA متصل میشود؛ بنابراین پس از رنگآمیزی، هسته سلولها با استفاده از میکروسکوپ فلوئورسنت قابل مشاهده است و به رنگ آبی دیده میشود همچنین دوکسوروبیسین نیز دارای خاصیت فلوروسنت بوده و در زیر میکروسکوپ به رنگ قرمز دیده میشود. همانگونه که در تصاویر مشاهده میشود. (تصویر4). نشان دهنده ورود سلولی داروی دوکسوروبیسین به درون سلولهای سرطانی MCF-7 است که رنگ قرمز ناشی از آن در درون سلول قابل مشاهده است. رنگ آبی مشاهده شده در این تصویر نشاندهنده هسته سلولهای سرطانی است و ادغام این دو رنگ در زیر میکروسکوپ فلوروسنت ورود دوکسوروبیسین به درون هسته سلول را به رنگ بنفش به خوبی نشان داده است.

تصویر3: تصاویر SEM از فرمولاسیون بهینه نانوذره مغناطیسی اکسیدآهن بارگذاری شده بادوکسوروبیسین

تصویر4: بررسی ورود سلولی سامانه ی مغناطیسی حاوی داروی دوکسوروبیسین به درون سلولهای سرطانی MCF-7
بحث
پژوهش حاضر ضمن ساخت نانوسامانه مغناطیسی اکسید آهن حاوی داروی ضدسرطان دوکسوروبیسین به بررسی ویژگیهای فیزیکوشیمیایی آن میپردازد که نتایج آن نشان میدهد که این نانو سامانه دارای راندمان انکپسولاسیون 93.71 درصد و رهایش کنترل شده دارو در شرایط سلولهای سالم و سرطانی میباشد. آنالیز نانوذره با دستگاه DLS تایید میکند که فرمولاسیون نانوذره مغناطیسی دارای اندازه nm 90 و پتانسیل زتای mV 67.7 است. همچنین بررسی سمیت سلولی این نانوذره حاوی دارو نشان می دهد که در غلظت یکسان، میزان سمیت دوکسوروبیسن انکپسوله شده در مقایسه با دوکسوروبیسین آزاد بر روی رده سلولی MCF-7 سرطان پستان افزایش محسوسی یافته است. تاکنون پژوهشهای متعددی بر روی نانوذرات مغناطیسی اکسید آهن انجام گرفته است که به بخشی از آن اشاره می شود. Silva و همکاران در سال 2013، از پوشش طلا در سطح نانو ذرات fe3o4 استفاده شد. تجزیه و تحلیل عناصر گونههای محلول نشان داد که پوشش طلای هستههای مگنتیت مقاومت قابل توجهی در برابر انحلال آهن میدهد. توانایی مهندسی پوشش طلا در سطوح ذرات امکان عملکرد بیولوژیکی کنترل شده را فراهم میکند. Zhang در سال 2015 نشان داد که استفاده از پوشش پلیاتیلینایمین (PEI) در نانو ذرات مغناطیسی Fe3O4 علاوه بر ایجاد مورفولوژی کروی و افزایش اندازه نانو ذرات میتواند باعث مثبتتر شدن پتانسیل زتا شده و باعث افزایش پایداری کولوئیدی طولانی مدت و ثبات مناسب و در نتیجه افزایش میزان بارگذاری دارو در نانو ذرات مغناطیسی شود. Drescoدر سال1999، در این مطالعه نیز با استفاده از پوشش طلا و پلیاتیلینایمین اندازه نانو ذرات در محدوده ی 90-100 نانومتر در راستای بهینه سازی میزان بارگذاری، سایز و پتانسیل زتا تغییر کرد که قابل قبول بود. نانو ذرات مگنتیت زیست سازگار هستند و پوشاندن آن با طلا و پلیاتیلینایمین علاوه بر تغییر موثر در خواص و زیست سازگاری آن قابلیت بارگیری دارو و انتقال هدفمند آن به سلولهای mcf-7 را تسهیل میکند، همچنین از تجمع یا اگریگه شدن نانو ذرات کاسته شده و نانو ذرات اصلاح شده سوسپانسیون پایدارتری را تشکیل میدهند. Shenو همکاران در سال 2009 در مطالعهای که در مورد بررسی مقاومت سلولهای سرطانی MDA-MB نسبت به داروی آزاد Dox انجام دادند، دریافتند که یک ژن به نام MDRI که توسط سلولهای انسان کد میشود، عامل مقاومت سلولهای سرطانی نسبت به داروی Dox است این ژن یک نوع پرتئین ترانسپورتر غشایی به نام گلیکوپرتئین P راکد میکند که نقش پمپاژ کردن دارو را به خارج از سلول ایفا میکند و همین عامل موجب مقاومت سلولها نسبت به Doxمیشود (19) سمیت زود هنگام نانو ذرات حامل Dox این فرضیه را تایید میکند که مسیر ورود و مکانیسم عملکردی آنها از Dox آزاد متفاوت است نانو ذرات حامل Dox احتمالاً از طریق مکانیسم اندوسیتوز وارد سلول میشوند و احتمالاً این مکانیسم شانس غلبه بر مقاومت سلولهای سرطانی نسبت به داروی Dox را افزایش میدهد. نتایج تحقیقات انجام شده توسط Aljarrah و همکاران در سال 2012 نشان میدهد که نانو ذرات اکسید آهن به تنهایی نمیتوانند رشد سلولهای MCF7 را مهار کنند چون نانو ذرات مغناطیسی به تنهایی قادر به تولید ROS نیستند Aljarrah و همکاران نتیجه گرفتند که با پیش تیمار سلولهای MCF7 با نانو ذرات مغناطیسی و با قراردادن سلولها در معرض میدان مغناطیسی استاتیک (SMF) قبل از این که سلولها با Dox تیمار شوند، افزایش قابل ملاحظهای در قطعه قطعه شدن DNA در مرحله G1 مشاهده شد نتایج نشان میدهد که این تیمار، نقش مهمی در حساس کردن سلولهای سرطانی نسبت به القاء مرگ آپوپتوتیک سلولها با داروی دوکسوروبیسین دارد این گروه تحقیقاتی دریافتند که میدان مغناطیسی استاتیک (SMF) به تنهایی قادر به القاء مرگ سلول سرطانی نیست میدان مغناطیسی استاتیک تنها در حضور نانوذرات اکسید آهن وDox موجب مهار رشد سلولها میشود پتانسیل آپوپتوتیک میدان مغناطیسی استاتیک، به دلیل توانایی آن در القاء تغییر شکل سلول میباشد (20). Nigam و همکاران در سال2011 نانوذرات مغناطیسی Fe3O4 حاوی داروی داکسوروبیسین را که با اسید سیتریک پوشیده شده بود را سنتز کردند که این نانوذرات توانایی آزادسازی داروی شیمیایی مورد نظر را در محیط اسیدی توموری به مقدار قابلتوجهی داشت. علاوه بر این با دارا بودن پایداری بهینه ،میزام لود مناسب و زیستسازگاری سلولی این سیستم تحویل دارو را بهعنوان یک نامزد مناسب در کاربردهای پزشکی نشان داد (21,22). در مطالعهای دیگر که توسطShen و همکاران در سال 2015 بررسی شد یک سیستم تحویل داروی حساس به PH و مغناطیسی (DDS) مبتنی بر نانوذرات ابر پارامغناطیسی PEGylated Fe3O4 سنتز شد. این نانوذرات با روکش سیتریک و سپس با پلیاتیلگلایکول پوشیده شدند. دوکسوروبیسین بهعنوان یک داروی شیمیدرمانی به این سامانه اضافه شد. این نانوذرات دارای مغناطیس قوی با قابلیت بارگذاری دارو تا 89% در اندازه های نسبتاً یکنواخت سنتز شد. در این مطالعه نشان داده شد که این سامانهها به خوبی زندهمانی سلولهای سرطانی را کاهش داده اما کمی پایینتر از تاثیر داکسوروبیسین آزاد بر روی سلولهای سرطانی را نشان داد (23). در مطالعهای که در سال2012 توسط Jia انجام شد کمپلکس نانوذرات DOX Fe3O4-PLGA- سنتز شد که میزان بارگذاری بالایی را نشان داد، همچنین دارای رهایش پایدار و ثابت بود که در PH اسیدی رهایش سریعتری داشت. این نانوذرات در محیط آزمایشگاهی بر روی سلولهای سرطانی ریه موش اعمال شدند که آپوپتوز سلولهای سرطانی را به همراه داشت (24). در مطالعهای دیگر که توسط Semkina و همکاران در سال 2015 انجام شد نانو ذرات مغناطیسی حاوی داروی داکسوروبیسین را سنتز کردند که دارای پوسته BSA بر روی هسته مغناطیسی Fe3O4 به همراه اتصال پلیاتیلنگلایکول بود. این نانوذرات ظرفیت بارگذاری 8 درصد وزنی خود را داشته همچنین رهایش داروی داکسوروبیسین در PH=5.5 نسبت به PH=7.4 به نسبت بیشتر بود (25). مطالعهای که در سال2017 توسط Asghar k انجام شد، به سنتز و توصیف یک نانوحامل جدید و هوشمند با هسته مغناطیسی و پوسته حرارتی پاسخگو برای تحویل مشترک دوکسوروبیسین آب دوست (Dox) و کورکومین آبگریز (Cur) بهعنوان یک درمان ترکیبی برای درمان سرطان پرداخته شد کارایی کپسولهسازی Dox و Cur به ترتیب 96 و 90 درصد بود. مطالعات آزادسازی وابسته به دما رهایش آهسته ولی پایداری را گزارش کرد. سنجش MTT بر روی سلولهای طبیعی و HeLa ماهیت غیر سمی نانوکامپوزیتها را نشان داد. این نانو ذرات بارگذاری شده در مقایسه با Dox و CUR آزاد، فعالیت ضد سرطانی در شرایط آزمایشگاهی را نشان میدهد. چنین سیستم تحویل هوشمند همراه با هم میتواند پتانسیلی برای تحویل دارویی کنترل شده و هدفمند در تشخیص را سرطان داشته باشد (26) بنابر موارد فوق در این پژوهش نیز نانوذرات حاوی دارو تاثیر به مراتب بیشتری را بر روی سلولهای سرطانی نسبت به حالت آزاد دارو بر روی سلولهای سرطانی MCF-7 نشان دادند که با مطالعات گذشته هم راستا بود. از جمله مولفههای دیگر موثر در میزان بارگذاری دارو میزان PH است که افزایش آن منجر به افزایش میزان بارگذاری دارو در نانوذره میشود.
نتیجه گیری
امروزه اگرچه شیمیدرمانی یکی از رایجترین روشهای آنتینئوپلاستی بهشمار میآید، اما به دلیل غیر هدفمند بودن، مصرف زیاد دارو و عوارض جانبی، استفاده از این روش را با چالشهای بسیاری روبه رو گردانیده است. بنابراین دستیابی به استراتژیهای نوین به منظور بهبود سیستم دارورسانی به سلولهای سرطانی که بتواند جایگزینی مناسب برای سیستمهای دارورسان معمول باشد، میتواند بسیاری از چالشهای پیش روی علم پزشکی را برطرف نماید. در پژوهش حاضر، داروی ضد سرطان دوکسوروبیسین به منظور افزایش شاخصههای درمانی آن و در نتیجه عملکرد بهتر دارو در شرایط حاکم بر محیط سلولهای سرطانی، درون نانوذرات مغناطیسی اکسید آهن بارگذاری شده است. هر چند بررسی سمیت و آزمایشهای درون تنی و برونتنی این نانوذره حاوی داروی دوکسوروبیسین قبل از هرگونه استفاده بالینی از آن ضروری است. با استناد به نتایج این مطالعه، فرمولاسیونی برای ساخت این نانوذره پیشنهاد شد که ضمن برخوداری از الگوی رهایش کنترل شده در شرایط سلول سالم و سرطانی، دارای شاخصههای فیزیکوشیمیایی مطلوب از جمله، بار الکتریکی، میزان درونپوشانی بالا و اندازهای در حدودnm 90 است که میتواند به عنوان ترکیبی ضد توموری پیشنهاد شود.
سپاسگزاری
این مقاله حاصل بخشی از پایاننامه خانم فاطمه صادقی دانشجو کارشناسی ارشد زیستفناوری پزشکی پردیس پزشکی دانشگاه علوم پزشکی یزد میباشد. که در دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید صدوقی یزد انجام گرفته و از این مرکز در خصوص تسهیل بهرهمندی از فضای آزمایشگاهی و دستگاهی تشکر میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
ﭘﺮوﭘﻮزال ایﻦ ﺗﺤﻘﯿﻖ ﺗﻮﺳﻂ داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ ﺷﻬﯿﺪ ﺻﺪوﻗﯽ یﺰد ﺗﺎیﯿﺪ ﺷﺪه اﺳﺖ. (کد اخلاق IR.SSU.MEDICINE.REC.1399.092)
مشارکت نویسندگان
بیبی فاطمه حقیرالسادات در ارائه ایده، فاطمه صادقی ندوشن در طراحی مطالعه، فاطمه صادقی ندوشن در جمعآوری دادهها، بیبی فاطمه حقیرالسادات و فاطمه حکیمیان در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Boyle P, Levin B. World Cancer Report 2008. IARC Press, International Agency for Research on Cancer; 2008.
2- Sadjadi A, Nouraie M, Ghorbani A, Alimohammadian M, Malekzadeh R. Epidemiology of Breast Cancer in the Islamic Republic of Iran: First Results from a Population-Based Cancer Registry. East Mediterr Health J 2009; 15(6): 1426-31.
3- Brody JG, Rudel RA. Environmental Pollutants and Breast Cancer. Environ Health Perspect 2003; 111(8): 1007-19.
4- Anand P, Kunnumakkara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, et al. Cancer is a Preventable Disease that Requires Major Lifestyle Changes. Pharm Res 2008; 25(9): 2097-116.
5- Davies C, Godwin J, Gray R, Clarke M, Cutter D, Darby S, et al. Relevance of Breast Cancer Hormone Receptors and other Factors to the Efficacy of Adjuvant Tamoxifen: Patient-Level Meta-Analysis of Randomised Trials. Lancet 2011; 378(9793): 771-84.
6- Group EBCTC. Effects of Chemotherapy and Hormonal Therapy for Early Breast Cancer on Recurrence and 15-Year Survival: An Overview of the Randomised Trials. Lancet 2005; 365(9472): 1687-717.
7- Kaufmann SH, Earnshaw WC. Induction of Apoptosis by Cancer Chemotherapy. Exp Cell Res 2000; 256(1): 42-9.
8- Jain D. Cardiotoxicity of Doxorubicin and other Anthracycline Derivatives. J Nucl Cardiol 2000; 7(1): 53-62.
9- Figg WD, McLeod HL. Handbook of Anticancer Pharmacokinetics and Pharmacodynamics. Springer Science & Business Media; 2004.
10- Sun R, Liu Y, Li SY, Shen S, Du XJ, Xu CF, et al. Co-Delivery of All-Trans-Retinoic Acid and Doxorubicin for Cancer Therapy with Synergistic Inhibition of Cancer Stem Cells. Biomaterials 2015; 37: 405-14.
11- Gobbo OL, Sjaastad K, Radomski MW, Volkov Y, Prina-Mello A. Magnetic Nanoparticles in Cancer Theranostics. Theranostics 2015; 5(11): 1249-63.
12- Revia RA, Zhang M. Magnetite Nanoparticles for Cancer Diagnosis, Treatment, and Treatment Monitoring: Recent Advances. Mater Today(Kidlington) 2016; 19(3): 157-68.
13- Haume K, Rosa S, Grellet S, Śmiałek MA, Butterworth KT, Solov'yov AV, et al. Gold Nanoparticles for Cancer Radiotherapy: A Review. Cancer Nanotechnol 2016; 7(1): 8.
14- Zhang S, Liu X, Zhou L, Peng W. Magnetite Nanostructures: One-Pot Synthesis, Superparamagnetic Property and Application in Magnetic Resonance Imaging. Materials Letters 2012; 68: 243-6.
15- Netto CG, Toma HE, Andrade LH. Superparamagnetic Nanoparticles as Versatile Carriers and Supporting Materials for Enzymes. Journal of Molecular Catalysis B Enzymatic 2013; 85: 71-92.
16- Zarei-Ghobadi M, Mozhgani SH, Dashtestani F, Yadegari A, Hakimian F, Norouzi M, et al. A Genosensor for Detection of HTLV-I Based on Photoluminescence Quenching of Fluorescent Carbon Dots in Presence of Iron Magnetic Nanoparticle-Capped Au. Sci Rep 2018; 8(1): 15593.
17- Moosavi zadeh SM, Baghiani M, Majdizadeh M, Haghiralsadat F, Moosavi zadeh SM. Experimental
Study: Experimental Evaluation of Phospholipid System Containing Doxorubicin HCL for Use in Chemotherapy. J Shahid Sadoughi Uni Med Sci 2019; 26(11): 945-56.
18- Al Sabbagh C, Tsapis N, Novell A, Calleja-Gonzalez P, Escoffre JM, Bouakaz A, et al. Formulation and Pharmacokinetics of Thermosensitive Stealth® Liposomes Encapsulating 5-Fluorouracil. Pharm Res 2015; 32(5): 1585-603.
19- Shen F, Chu S, Bence AK, Bailey B, Xue X, Erickson PA, et al. Quantitation of Doxorubicin Uptake, Efflux, and Modulation of Multidrug Resistance (MDR) in MDR Human Cancer Cells. J Pharmacol Exp Ther 2008; 324(1): 95-102.
20- Aljarrah K, Mhaidat NM, Al-Akhras MA, Aldaher AN, Albiss B, Aledealat K, et al. Magnetic Nanoparticles Sensitize MCF-7 Breast Cancer Cells to Doxorubicin-Induced Apoptosis. World J Surg Oncol 2012; 10: 62.
21- Nigam S, Barick KC, Bahadur D. Development of Citrate-Stabilized Fe3O4 Nanoparticles: Conjugation and Release of Doxorubicin for Therapeutic Applications. Journal of Magnetism and Magnetic Materials 2011; 323(2): 237-43.
22- Rana S, Shetake NG, Barick KC, Pandey BN, Salunke HG, Hassan PA. Folic Acid Conjugated Fe 3 O 4 Magnetic Nanoparticles for Targeted Delivery of Doxorubicin. Dalton Trans 2016; 45(43): 17401-8.
23- Shen S, Wu L, Liu J, Xie M, Shen H, Qi X, et al. Core–Shell Structured Fe3O4@ Tio2-Doxorubicin Nanoparticles for Targeted Chemo-Sonodynamic Therapy of Cancer. Int J Pharm 2015; 486(1-2): 380-8.
24- Jia Y, Yuan M, Yuan H, Huang X, Sui X, Cui X, et al. Co-Encapsulation of Magnetic Fe3O4 Nanoparticles and Doxorubicin Into Biodegradable PLGA Nanocarriers for Intratumoral drug Delivery. Int J Nanomedicine 2012; 7: 1697-708.
25- Semkina A, Abakumov M, Grinenko N, Abakumov A, Skorikov A, Mironova E, et al. Core–Shell–Corona Doxorubicin-Loaded Superparamagnetic Fe3O4 Nanoparticles for Cancer Theranostics. Colloids Surf B Biointerfaces 2015; 136: 1073-80.
26- Asghar K, Qasim M, Dharmapuri G, Das D. Investigation on a Smart Nanocarrier with a Mesoporous Magnetic Core and Thermo-Responsive Shell for Co-Delivery of Doxorubicin and Curcumin: A New Approach Towards Combination Therapy of Cancer. RSC adv 2017; 7(46): 28802-18.
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1402/1/2 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
دریافت: 1402/1/2 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







