دوره 31، شماره 2 - ( اردیبهشت 1402 )
جلد 31 شماره 2 صفحات 6454-6440 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ahmadi H, Raeeszadeh M, Mohammadiazar S. Comparison between Hydroalcoholic (Ethanolic and Methanolic) of Broccoli Floret (Brassica Oleracea) Extract by GC-MS Method and its Antioxidant Effect by DPPH Method. JSSU 2023; 31 (2) :6440-6454
URL: http://jssu.ssu.ac.ir/article-1-5683-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5683-fa.html
احمدی حدیث، رئیسزاده مهدیه، محمدی آذر سیروان. مقایسه بین ترکیبات عصاره هیدروالکلی (اتانولی و متانولی) گلچه بروکلی (Brassica oleracea) با روش GC-MS و اثر آنتیاکسیدانی آنها با روش DPPH. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (2) :6440-6454
متن کامل [PDF 910 kb]
(193 دریافت)
| چکیده (HTML) (244 مشاهده)
متن کامل: (366 مشاهده)
مقدمه
افزایش روزافزون مصرف گیاهان دارویی در درمان بیماریها، سبب جایگاه ویژه طب مکمل شده است (1). رادیکال آزاد به اتم، مولکول یا یونی گفته میشود که دارای الکترون جفت نشده باشند. رادیکالهای آزاد شامل گونههای واکنشگر اکسیژن (ROS) مثل آنیونهای سوپر اکسید، هیدروکسیل و پراکسید هیدروژن هستند که در تنشها افزایش مییابند (2). در سالهای اخیر ثابت شده است که رادیکالهای آزاد مهمترین عوامل اکسید کننده مواد غذایی بوده اند به نحوی که با یک روند تخریبی باعث از بین رفتن ارزش غذایی و تغییر در ترکیبات شیمیایی آنها میشود (3,4). همچنین علاوه بر اثرات نامطلوب در محصولات غذایی با از بینبردن ویتامینها و اسیدهای چرب ضروری بدن و ایجاد ترکیبات سمی، میتوانند منجر به اثرات نامطلوب از قبیل بیماریهای التهابی، دیابت ملیتوس، ایسکمی قلبی و مغزی، سرطان، نقص ایمنی و پیری در انسان شوند (3,5,6). در این میان آنتیاکسیدانها ترکیباتی هستند که بهطور مؤثر میتوانند از اکسایش ماکرومولکولهایی نظیر لیپیدها، پروتئینها و اسیدهای نوکلئیک جلوگیری نمایند، عمل فوق از طریق مهار مرحله شروع یا مرحله گسترش واکنشهای زنجیرهای اکسایش یا تولید رادیکالهای آزاد صورت میگیرد (7). آنتیاکسیدانها به دو دسته شیمیایی و طبیعی تقسیم میشوند، آنتیاکسیدانهای شیمیایی که بیشترین استفاده را در صنایع غذایی دارند شامل (BHA) Butylated hydroxyanisole، Butylatedhydroxytoluene (BHT)، (TBHQ) Tert-Butylhydroquinone و PG)) Propylgallate هستند که به علت سرطانزایی و اثر منفی این ترکیبات بر سلامت انسان، کاربرد آنها محدود شده است (8)؛ بنابراین از سال 1980 آنتیاکسیدانهای طبیعی جایگزین انواع سنتزی شدند (9). آنتیاکسیدانهای طبیعی در مواجه گیاهان با گونههای فعال اکسیژن و بخشی دیگر بهطور طبیعی طی دوره تکمیل مراحل رشد و نمو گیاهان تولید میگردند. گیاهان با دارا بودن ترکیبات فنلی و بسیاری ترکیبات دیگر دارای پتانسیل آنتیاکسیدانی هستند (10). در میان آنتیاکسیدانهای طبیعی، ترکیبات فنلی نقش مهارکننده رادیکالهای آزاد مشتق شده از اکسیژن ( بهوسیله دادن یک اتم هیدروژن یا یک الکترون) به رادیکال آزاد دارند. این ترکیبات شامل فلاونوئیدها، اسیدهای فنولیک و تاننها بهعنوان شرکت کننده اصلی در فعالیت آنتیاکسیدانی در گیاهان مطرح هستند. همچنین این آنتیاکسیدانها فعالیتهای بیولوژیکی مختلفی نیز مانند اثرات ضد التهاب، ضدتصلب شرایین و ضد سرطانی دارند، که میتواند به فعالیت آنتیاکسیدانی آنها مربوط باشد (11). سبزیجات چلیپائی متعلق به خانواده Cruciferae بهخصوص جنس Brassica نظیر بروکلی، گل کلم، کلمپیچ و کلم بروکسل دارای اثرات محافظتی ارزشمندی و مهمی در برابر استرس اکسیداتیو هستند. کلم بروکلی Brassica oleracea بومی کشور ایتالیا بوده و در ایران در نواحی شمالی کشت میشود. کلم بروکلی یکی از سبزیهای مهم و با ارزش غذایی بالاست که سرشار از ویتامینها، آنتیاکسیدانها و ترکیبات ضدسرطانی است، خواص ضدسرطانی کلم بروکلی به سبب وجود ویتامین E (آلفاتوکوفرول)، ویتامین C (آسکوربیک)، فلاونوئیدها (کوئرستین و کامپفرول)، کاروتنوئیدها (کاروتن و لوتئین) و گلوکوسیناتها است (12,13). پلیفنلهای موجود در کلم بروکلی با فعالیت آنتیاکسیدانی بالا میتوانند بهعنوان خنثیکنندههای بسیار قوی رادیکال آزاد اکسیژن باشند (14). سولفورفان(1-isothiocyanato-4-(methylsulfinyl) butane) نیز با نقش آنتیاکسیدانی خود مقاومت به تنشهای اکسیداتیو را زیاد نموده و از آسیبهای احتمالی سلول با افزایش ظرفیت آنتیاکسیدانی بدن، جلوگیری میکند (15). در حالحاضر، بسیاری از عصارههای گیاهی برای تولید غذاهای سالم استفاده میشود. این امر سبب شده است که علاقه مصرفکنندگان و صنایع به مسیرهای پایدار و غیر سمی برای تولید آنها افزایش یابد (16). اگرچه تعیین مواد مؤثره تشکیلدهنده گیاهان به لحاظ فارماکولوژیک حائز اهمیت است، ولی لازم است در ابتدا اثربخشی عصارههای به دست آمده از آنها و خصوصیات اجزای تشکیل دهنده، برای انتخاب بهترین نوع حلال، مشخص شود (17). استخراج ترکیبات فعال گیاهی به شدت به ویژگی آبگریزی یا چربی دوستی مولکولهای هدف بستگی دارد، از اینرو استفاده مناسب از حلالهای آلی رایج مطرح میباشد. هم چنین انواع روشهای استخراج حرارتی و غیرحرارتی ابتکاری نیز برای غلبه بر آسیبهای ترکیبات آنتیاکسیدان و فعال گیاهی توصیه شده است (18). مثلا استفاده از میکروویو برای استخراج ترکیبات فنولی بروکلی کارآمدتر از خیساندن با صرف زمان کمتر و بازده بهتر گزارش شده است (19). پارامترهای مختلفی از جمله راندمان استخراج عصاره، شرایط استخراج و هم چنین نوع حلالها و جاذبهای مورد نظر، برای دریافت بهترین راندمان ترکیبات موثره گیاهی حائز اهمیت میباشد (20). با توجه به ترکیبات فیتوشیمیایی موثر در گیاه بروکلی و ارزش بالای ایت ترکیبات در کاهش آسیبهای اکسیداتیو، بنابراین هدف از مطالعه، مقایسه غلظت مواد مؤثره عصاره هیدرومتانولی و هیدرواتانولی بروکلی و بررسی عملکرد آنتیاکسیدانی در شرایط برونتن بود.
روش بررسی
روش تهیه عصاره بروکلی: کلم بروکلی جمعآوریشده از مزارع کشاورزی لرستان، بعد از تائید توسط مرکز هرباریوم دانشگاه کردستان (Herb No.30072) در حرارت 25 درجه سانتیگراد و در شرایط سایه خشک شد. بعد از آسیاب کردن در داخل ظروف مخصوص نگهداری شد. سپس 300 گرم پودر با یک لیتر اتانول 80 درصد و همچنین متانول 80 درصد به مدت 48 ساعت به روش ماسیراسیون قرار گرفت. پس از صاف کردن، عصاره با استفاده از روتاری تحت خلا تغلیظ شد (22, 21).
اندازهگیری ترکیبات فنولی تام: میزان تام ترکیبات فنولی با روش فولین سیوکالتو اندازهگیری شد و نتایج بر حسب میلیگرم اسید گالیک در گرم عصاره بیان شد (23). روش فولین سیوکالتو از متداولترین روشهای اندازهگیری ترکیبات فنولی میباشد و اساس کار در اینروش، احیاء معرف فولین توسط ترکیبات فنولی در محیط قلیایی و ایجاد کمپلکس آبی رنگ است که حداکثر جذب را در طول موج 760 نانومتر نشان میدهد، بهطور خلاصه در اینروش، 20 میکرولیتر از عصارهها با غلظت (1 میلیگرم بر میلی لیتر) درون لوله آزمایش با 160/1 میلیلیتر آب مقطر و 100 میکرولیتر معرف فولین سیوکالتو مخلوط شدند، سپس از گذشت 1 تا 8 دقیقه، 300 میکرولیتر محلول کربنات سدیم (20% وزنی/حجمی) به محتوای لوله آزمایش افزوده شد، لولههای آزمایش بعد از تکان دادن، درون حمام آب با دمای 40 درجه سانتیگراد قرار گرفته و پس از گذشت 30 دقیقه جذب آنها با دستگاه اسپکتروفتومتر در طول موج 760 نانومتر خوانده شد، برای رسم منحنی استاندارد گالیک اسید، محلول پایهای از این ماده با غلظت 1000 میکروگرم بر میلیلیتر تهیه شد و سپس از این محلول پایه غلظتهای مختلف (100، 200، 400، 600، 800 میکروگرم بر میلیلیتر) آماده گردید و پس از انجام مراحل مختلف مطابق روش ذکر شده در بالا مقدار جذب نمونهها خوانده شد، بعد از رسم منحنی کالیبراسیون گالیک اسید، با قراردادن مقدار جذب عصاره در معادله خطی مربوط به منحنی استاندارد، مقدار فنل تام موجود در عصاره محاسبه گردید. در نهایت، دادهها بر اساس میلیگرم گالیک اسید بر گرم عصاره تعیین شد (24).
اندازهگیری میزان فلاونوئید کل: مقادیر فلاونوئیدها در نمونه عصارههای گیاهی به روش کلریدآلومینیوم اندازهگیری شد. ابتدا 0/1 میلیلیتر کلرید آلومینیوم 10 درصد را با 0/1 میلیلیتر استات پتاسیم یک مولار مخلوط کرده و سپس به آنها 2/8 میلیلیتر آب مقطر دو بار تقطیر اضافه گردید. در مرحله بعد 0/5 میلیلیتر از محلول هر عصاره با 1/5 میلیلیتر اتانول مخلوط گردیده بود، به مخلوط کلریدآلومینیوم، استات پتاسیم و آب اضافه گردید و مخلوط نهایی حاصل برای هر عصاره (با حجم 5 میلیلیتر) برای مدت 30 دقیقه در دمای اتاق قرار داده شد و سپس جذب مخلوط واکنش در طول موج 415 نانومتر توسط اسپکتروفتومتر مدل Lambda 45-UV/Visible اندازهگیری شد. مقدار فلاونوئید کل بهصورت معادل میلیگرم کوئرستین بر گرم وزن خشک محاسبه و بیان گردید. ارزیابی برای هر کدام از عصارهها در سه تکرار انجام شد (25).
اثر بازدارندگی از رادیکال آزاد با استفاده از روش DPPH
DPPH (1،1-dipheayl-2-pierylhydrazyl) به مقدار 0/2 میلیلیتر از عصاره کلم بروکلی با غلظت های25، 50، 100، 200، 400، 600، 800 و 1000 میکروگرم بر میلی لیتر) به 3/8 میلیلیتر از محلول اتانول حاوی 0/04 میلیگرم رادیکال DPPH (سیگما المان) اضافه شد و مخلوط به مدت 30 دقیقه در درجه حرارت اتاق در محیط تاریک قرار داده شد و سپس جذب نمونههای مورد آزمون با استفاده از دستگاه اسپکتروفتومتر (JENWAY-انگلیس) در طول موج 517 نانومتر در برابر شاهد اندازهگیری شد و در نمونه شاهد 0/2 میلیلیتر اتانول به جای نمونه، مورد استفاده قرار گرفت و درصد بازدارندگی رادیکال آزاد بر حسب فرمول زیر محاسبه شد (26). سپس نتایج به صورت IC50 (مقداری از آنتی اکسیدان که لازم است تا غلظت DPPH را به 50 درصد اولیه برساند) بیان گردید ( هر نمونه 3 بار اندازهگیری شد (27).
%DPPH= جذب نوری شاهد/جذب نوری نمونه- جذب نوری شاهد×100
جداسازی و شناسایی ترکیبات با استفاده از دستگاه GC-MS: نمونه استخراج شده توسط متانول یا اتانول پس از آبگیری با سدیم سولفات بدون آب، توسط دستگاه کروماتوگرافی گازی متصل به طیفسنج جرمی Agilent 7890B GC System/ 5977A MSD آنالیز شد، حجم نمونه تزریق شده به دستگاه یک میکرولیتر، ستون بهکار رفته HP-5 ms (30m×0/25mm ،0/25 Micron و دمای محل و دمای اکسیلاری ۲۸۰ درجه سانتیگراد) تنظیم شد. دمای اولیه ستون 50 درجه سانتیگراد بود که با سرعت 10 درجه سانتیگراد در دقیقه تا رسیدن به دمای ۲۶۰ درجه افزایش یافت، زمان توقف در این دما ۱۰ دقیقه درنظر گرفتهشد. دستگاه طیفسنج جرمی در مد یونیزاسیون الکترونی تنظیم شد، انرژی یونش ۷۰ الکترون ولت و دامنه جرمی بررسی شده ۵۰ تا ۵۵۰ amu بود. دمای منبع یونیزاسیون و چهار قطبی به ترتیب در ۲۳۰ و ۱۵۰ درجه سانتیگراد تنظیم گردید. از گاز حامل هلیوم با درصد خلوص ۹۹۹/۹۹ درصد، فشار psi 34 و شدت جریان یک میلیلیتر در دقیقه استفاده گردید. شناسایی ترکیبات به کمک مقایسه طیفهای جرمی آنها با دادههای پایگاههای اطلاعاتی دستگاه شامل NIST و Wiley و همچنین مقایسه اندیسهای بازداری و الگوی شکست گزارش شده برای آنها صورت پذیرفت (28). با توجه به نقطه جوش زیر 400 درجه سانتیگراد سولفورفان، عدم وجود جز واکنشپذیر با ستون همراه عصاره مانند اسید، باز و یا آب، عدم شرایط تجزیهپذیری عصاره در دمای ستون و با توجه به مطالعات متعدد قبلی از روش GC-MS استفاده شد (29). همچنین با استفاده از پیک استاندارد سولفارفان شرکت سیگما- آلدریچ ( CAS# 4478-93-7; Catalog#s4441 ) محل تشکیل پیک و غلظت آن در دو نوع عصاره مشخص شد.
تجزیه و تحلیل آماری
نتایج آزمایشات با استفاده از نرمافزار آماری version 16 SPSS در سطح آماری کمتر از 0/05 مورد تجزیه و تحلیل قرارگرفت. میانگین و انحراف معیار برای هر عصاره در سه تکرار مجزا تعیین شد. برای مقایسه مقادیر بهدست آمده از آزمون t-test مستقل استفاده شد. IC50 از نمودار خطی با ضریب رگرسیون بالای 9/0 تهیه گردید.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط کمیته اخلاق دانشگاه علوم پزشکی کردستان تایید شده است (کد اخلاق IR.MUK.REC.1397.5001)
نتایج
جدول 1 مقادیر فنول کل (برحسب میلیگرم اسید گالیک بر گرم وزن خشک) و فلاونوئید کل (برحسب میلیگرم کوئرستین بر گرم وزن خشک) برای عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی را نشان میدهد. بیشترین محتوای فنول کل مربوط به عصاره هیدرومتانولی به میزان 5/40±41/52 اسید گالیک بر گرم وزن خشک و کمترین میزان فنول هم مربوط به عصاره هیدرواتانولی به میزان 0/37±33/3 اسید گالیک بر گرم وزن خشک تعیین شد. با توجه به مقادیر p اختلاف آماری معنی داری بین فنول کل دو عصاره وجود ندارد. بیشترین محتوای فلانوئید کل مربوط به عصاره هیدرومتانولی 1/93±40/36 کوئرستین بر گرم وزن خشک و کمترین میزان فلانوئید هم مربوط به عصاره هیدرواتانولی به میزان 1/49±28/79 کوئرستین بر گرم وزن خشک بود و این تفاوت بین دو نوع نوع عصاره معنیدار شد (p<0/01). در جدول 2، مقادیر مهار رادیکالهای آزاد DPPH توسط غلظتهای مختلف عصارههای اتانولی و متانولی کلم بروکلی در مقایسه با اسید آسکوربیک به عنوان استاندارد آورده شده است. میزانIC50 عصاره هیدرواتانولی 23/40 میکروگرم بر میلیلیتر و هیدرومتانولی 19/76 میکروگرم بر میلیلیتر شد (نمودار1). غلظت مؤثر بین میانگین دادههای عصارههای هیدرواتانولی و هیدرومتانولی دارای اختلاف آماری معنیداری شد (0/05>p). به نحوی که بیشترین فعالیت مهار رادیکالهای آزاد مربوط به عصاره هیدرومتانولی بود. با توجه به نتایج درصد مهار رادیکال آزاد در طول موج nm 517 در بین میانگین عصاره هیدرواتانولی و متانولی اختلاف معنیداری وجود داشت (p<0/01). . درصد مهار در عصاره هیدرومتانولی92/1% و درعصاره هیدرواتانولی %72/8بود (جدول 3). نمودار 2 و جدول 4 نشان دهنده ترکیبات تشکیل دهنده عصاره اتانولی بروکلی با روش GC-MS بود. با توجه به جدول در زمان بازدارندگی 683/18 دقیقه ترکیب سوفارفان با 1/41 درصد جداسازی شد. در حالی که نمودار 3 و جدول 5 نشان دهنده جداسازی این ترکیب با 14/86درصد است. با توجه به نتایج ارائه شده در جدول 6، بین میانگین مقادیر سولفارفان عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی اختلاف معنیداری وجود داشت (p<0.01).
جدول 1: مقادیر فنول و فلاوونوئید کل عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی

حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنی دار است (p<0/05) .Q : Quercetin GAE,: Gallic acid dw,: Dry weight
جدول 2: درصد مهار رادیکال های آزاد عصاره ها در تست DPPH

حروف غیرمشابه نشان اختلاف آماری معنی دار است (0/05>p).

نمودار 1: نمودار رگرسیون IC50 درعصارههای مختلف بروکلی
جدول3: میانگین درصد مهار رادیکال آزاد در عصارههای مختلف بروکلی

حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنیدار است (p<0.05).
.JPG)
نمودار 2: گراف ترکیبات شیمیایی عصاره هیدرواتانولی کلم بروکلی
جدول 4: ترکیبات شیمیایی عصاره هیدرواتانولی کلم بروکلی


نمودار 3: گراف ترکیبات شیمیایی عصاره هیدرومتانولی کلم بروکلی
جدول 5: ترکیبات شیمیایی عصاره هیدرومتانولی کلم بروکلی

جدول 6: مقایسه ترکیبات شیمیایی فعال سولفوره (سولفارفان)
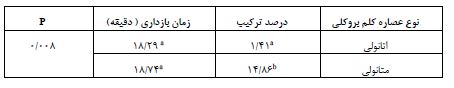
حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنیدار است.
بحث
افزایش روزافزون ترکیبات طبیعی در درمان و پیشگیری از بیماریها امروزه حائز اهمیت میباشد. در این راستا تعیین مواد مؤثره تشکیل دهنده گیاهان به لحاظ فارماکولوژیک بسیار با ارزش است. بنابراین انتخاب بهترین حلال و بهترین نوع عصاره برای جداسازی بیشترین ماده مؤثره میتواند اهمیت ویژهای داشته باشد. فلاونوئیدها و سایر ترکیبات فنلی معمولاً بهعنوان متابولیتهای ثانویه گیاهی شناخته میشوند که دارای یک حلقه معطر حاوی حداقل یک گروه هیدروکسیل هستند. بیش از 8000 ترکیب فنلی بهعنوان مواد طبیعی از گیاهان گزارش شده است. بسیار جالب توجه است که نیمی از این ترکیبات فنلی فلاونوئیدهایی هستند که بهصورت آگلیکون، گلیکوزیدها و مشتقات متیله ارائه میشوند (30,31). نتایج نشان داد که مقادیر فنول، فلاوونوئید در عصاره هیدرومتانولی بروکلی نسبت به هیدرواتانولی بیشتر است. در این راستا درصد مهار رادیکالی در آزمون DPPH برای عصاره هیدرومتانولی نسبت به هیدرواتانولی دارای اختلاف آماری معنیداری شد. کاهش مقدار IC50 در عصاره متانولی نسبت به اتانولی نشان بر افزایش پتانسیل آنتیاکسیدانی عصاره متانولی دارد. در مطالعه سان و همکاران به ارتباط خطی معنیدار محتوای فلاوونوئیدی عصاره بروکلی با خاصیت آنتیاکسیدانی آن اشاره شد (32). مطالعه اخیر همراستا با این مطالعه دلیل بر افزایش عملکرد آنتیاکسیدانی عصاره متانولی است. اتانول بهعنوان یک حلال خوب برای استخراج پلیفنلها شناخته شده است و برای مصرف انسان بیخطر است؛ اما متانول را برای استخراج و تجزیهوتحلیل فیتوشیمیایی نمونههای گیاهی به دلیل طیف گستردهای از ترکیبات با قطبیتهای مختلف (غیر قطبی به قطبی) معمولاً با وزن مولکولی پایین پیشنهاد میشود. همچنین در استخراج کامل که با تکنیک خیساندن انجام میشود، متانول نسبت به اتانول ارجحیت دارد. عابدینپور و کوهی کمالی در مطالعهای در سال 1394، ویژگی آنتیاکسیدانی عصاره فنولی کلم بروکلی با آنتیاکسیدانهای طبیعی و مصنوعی و تأثیر آنها بر اکسیداسیون روغن آفتابگردان را مورد ارزیابی قرار دادند، نتایج نشان داد که در تمامی شاخصهای ارزیابی شده، غلظت 1000 و 500 پیپیام عصاره کلم بروکلی در پایداری اکسیداتیو روغن آفتابگردان طی مدت زمان نگهداری مؤثرتر از BHA و آلفاتوکوفرول عمل نموده و در غلظت 200 پیپیام از آلفاتوکوفرول مؤثرتر بوده است (33). در مطالعه گواهی و همکاران به تغییرات غلظت فلاوونوئیدها و خواص آنتیاکسیدانی عصاره در روشهای مختلف عصارهگیری اشاره شده است. به نحوی که بازده ترکیبات آنتیاکسیدان در روش بن ماری بیشتر از خیساندن است (34). احمد و همکاران در نتایج آزمایشهای خود پیرامون ترکیبات فیتوشیمیایی بروکلی اعلام نمودند، عصارهی الکلی برگ گیاه کلم پیچ حاوی بیشترین میزان ترکیبات فنلی نسبت به حلال کلروفرم، اتر و عصاره آبی آن است و خاصیت بالای مهار رادیکالهای آزاد در کلم را به وجود گروههای هیدروکسیل در ترکیبات فنلی آن نسبت دادند (35). گوو و همکاران مشاهده کردهاند که از بین عصارهی آبی، متانولی و استونی استخراج شده از گل، ساقه و برگهای کلم بروکلی کشت شده در تایوان، عصارهی استونی هر سه قسمت، مهار رادیکالهای آزاد پایینتری را نشان داد (36). گاولیک-دزیکی، طی بررسیهای آزمایشگاهی اعلام کرده است، ترکیبات فنلی در عصارهی جوشیدهی کلم بروکلی نسبت به عصارهی خام آن به میزان قابل توجهی کاهش مییابد (37). مورنو و همکاران، درباره مشخصات شیمیایی و بیولوژیکی بروکلی تحقیق مروری کردند، مطالعات آنها نشان داد که سبزیجات براسیکا بهطورکلی و مخصوصاً بروکلی، از انسانها در مقابل سرطان محافظت میکند، و این اثر بروکلی به سبب منابع غنی گلوکوزینولاتها و همچنین حاوی محتوای بالایی از فلاونوئیدها، ویتامینها و مواد مغذی معدنی آن است (38). در نتایج به دست آمده از عصاره هیدرواتانولی و متانولی بروکلی با روش GC-MS بین میانگین مقادیر ترکیبات شیمیایی فعال سولفوره عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی اختلاف معنیداری وجود داشت، درصد ترکیبات شیمیایی فعال سولفوره (سولفورفان) عصاره متانولی (14/86%) و عصاره اتانولی (1/41%) شد و این اختلاف معنیدار بود. از طرف دیگر در مقایسه ترکیبات عصاره هیدرومتانولی و هیدرواتانولی بروکلی با GC-MS، ترکیب Phenol, 2,3,5-trimethyl- $$ Isopseudocumenol $$ 1-Hydroxy-2,3,5-trimethylbenzene $$ 2,3,5-Trimethylphenol جز ترکیبات فنولی جداسازی شده در تحقیق حاضر است که اثر آنتی اکسیدانی قوی عصاره هیدرومتانولی نسبت به هیدرواتانولی را میتوان به آن نیز نسبت داد. عوامل مختلفی از جمله گونه گیاه، ناحیه پرورش جغرافیایی، نوع حلال و روش استخراج بر درصد ترکیبات فیتوشیمیای موثر است (39). با توجه به اینکه مقدار مواد فعال در گیاهان طبیعی همیشه نسبتاً کم است. فرآیند استخراج و جداسازی آزمایشگاهی مناسب ، گلوگاه کاربرد محصولات طبیعی در توسعه دارو بوده است (40). فرج در تحقیق خود جهت تعیین درصد سولفورفان بر روی گونههای مختلف بروکلی، اعلام داشت، درصد سولفورفان استخراج شده از عصاره بروکلی در گونههای مختلف بسیار متفاوت میباشد (41). هم چنین اسوامی و همکاران به تاثیر حلالهای مختلف در تغییر درصد ترکیبات فعال آنتیاکسیدان و آنتیمیکروبیال گیاهی با متد GC-MS اشاره کردند (42). عزیزی و همکاران، در گزارش تحقیقی پیرامون جداسازی ترکیبات فیتوشیمیایی و سولفورفان بروکلی مقادیر سولفورفان در عصاره متانولی با روش GC-MS برابر با 21/43 درصد گزارش دادند که نسبت به مطالعه اخیر بیشتر بود. این تفاوت به سبب سن گیاه نمونه گیری و منطقه مورد نظر میتواند مربوط باشد. به نحوی که در این مطالعه بیشترین غلظت سولفورفان را در زمان 7 روزگی گیاه نسبت داده شده است (43). براساس نتایج مطالعات گذشته، جداسازی ترکیبات با حلال متانول نسبت به اتانول ارجحیت دارد (44)؛ اما در صورت انجام مطالعات حیوانی، باید از محلول هیدروالکلی متانول استفاده نمود و به سبب جلوگیری از مسمومیت، کاملاً متانول آن را تبخیر کرد (45). با توجه به اهمیت پتانسیل آنتیاکسیدانی عصاره بروکلی در مداخلات تجربی آسیبهای اکسیداتیو از جمله فریز اسپرم (46)، مسمومیت با فلزات سنگین آرسنیک (47) و سرب (49, 48)، مسمومیت با سم دیازینون اشاره شده است. در تحقیق جدی و مهاجری در مطالعهای، به عملکرد مثبت عصاره بروکلی در استرس اکسیداتیو القا شده توسط استامینوفن در کلیه موش اشاره کردند (50). گوئررو بلتران و همکاران به سولفورفان بهعنوان جزء اصلی و طبیعی بروکلی که مانع مرگ و التهاب سلولها در کاهش عوارض اکسیداتیو ناشی از نفروپاتی دیابتیک اشاره شده است (51). سایر روشهای تعیین خاصیت آنتیاکسیدانی برونتن مانند FRAP و ...در تکمیل دادهها از محدودیتهای تحقیق بود. همچنین مقایسه روشهای دیگر عصارهگیری، استفاده از حلالهای استونی، کلروفرمی با استفاده از روش HPLC با GC-MS در مطالعات آینده توصیه میگردد.
نتیجهگیری
اهمیت کاربرد آنتیاکسیدانها در صنایع دارویی، غذایی و آرایشی بهداشتی، جداسازی آنها از ترکیبات گیاهی با پتانسیل عمل بالا، دارای جایگاه ویژهای است. نتایج بهدست آمده نشان بر افزایش غلظت ترکیبات فنولی، فلاوونوئیدی، مهار رادیکالهای آزاد با DPPH و درصد سولفارفان در عصاره هیدرومتانولی نسبت به هیدرواتانولی بود. در این راستا توصیه بر حلال متانول در روش جداسازی ترکیات آنتیاکسیدانی عصاره بروکلی در مطالعات برونتن و درونتن میباشد. همچنین با وجود آسیبهای اکسیداتی روزمره، استفاده از بروکلی در رژیم غذایی و فراوردههای دارویی برای پیشگیری از بیماریها توصیه میشود.
سپاسگزاری
مقاله مستخرج از پایاننامه دکتری عمومی دامپزشکی است. از معاونت پژوهش دانشگاه آزاد اسلامی سنندج جهت همکاری در انجام آن تشکر و سپاسگزاری میشود.
حامی مالی: هزینههای تحقیق توسط نویسنده و با همکاری معاونت پژوهشی دانشگاه آزاد اسلامی سنندج تامین شدهاست.
تعارض در منافع: وجود ندارد.
افزایش روزافزون مصرف گیاهان دارویی در درمان بیماریها، سبب جایگاه ویژه طب مکمل شده است (1). رادیکال آزاد به اتم، مولکول یا یونی گفته میشود که دارای الکترون جفت نشده باشند. رادیکالهای آزاد شامل گونههای واکنشگر اکسیژن (ROS) مثل آنیونهای سوپر اکسید، هیدروکسیل و پراکسید هیدروژن هستند که در تنشها افزایش مییابند (2). در سالهای اخیر ثابت شده است که رادیکالهای آزاد مهمترین عوامل اکسید کننده مواد غذایی بوده اند به نحوی که با یک روند تخریبی باعث از بین رفتن ارزش غذایی و تغییر در ترکیبات شیمیایی آنها میشود (3,4). همچنین علاوه بر اثرات نامطلوب در محصولات غذایی با از بینبردن ویتامینها و اسیدهای چرب ضروری بدن و ایجاد ترکیبات سمی، میتوانند منجر به اثرات نامطلوب از قبیل بیماریهای التهابی، دیابت ملیتوس، ایسکمی قلبی و مغزی، سرطان، نقص ایمنی و پیری در انسان شوند (3,5,6). در این میان آنتیاکسیدانها ترکیباتی هستند که بهطور مؤثر میتوانند از اکسایش ماکرومولکولهایی نظیر لیپیدها، پروتئینها و اسیدهای نوکلئیک جلوگیری نمایند، عمل فوق از طریق مهار مرحله شروع یا مرحله گسترش واکنشهای زنجیرهای اکسایش یا تولید رادیکالهای آزاد صورت میگیرد (7). آنتیاکسیدانها به دو دسته شیمیایی و طبیعی تقسیم میشوند، آنتیاکسیدانهای شیمیایی که بیشترین استفاده را در صنایع غذایی دارند شامل (BHA) Butylated hydroxyanisole، Butylatedhydroxytoluene (BHT)، (TBHQ) Tert-Butylhydroquinone و PG)) Propylgallate هستند که به علت سرطانزایی و اثر منفی این ترکیبات بر سلامت انسان، کاربرد آنها محدود شده است (8)؛ بنابراین از سال 1980 آنتیاکسیدانهای طبیعی جایگزین انواع سنتزی شدند (9). آنتیاکسیدانهای طبیعی در مواجه گیاهان با گونههای فعال اکسیژن و بخشی دیگر بهطور طبیعی طی دوره تکمیل مراحل رشد و نمو گیاهان تولید میگردند. گیاهان با دارا بودن ترکیبات فنلی و بسیاری ترکیبات دیگر دارای پتانسیل آنتیاکسیدانی هستند (10). در میان آنتیاکسیدانهای طبیعی، ترکیبات فنلی نقش مهارکننده رادیکالهای آزاد مشتق شده از اکسیژن ( بهوسیله دادن یک اتم هیدروژن یا یک الکترون) به رادیکال آزاد دارند. این ترکیبات شامل فلاونوئیدها، اسیدهای فنولیک و تاننها بهعنوان شرکت کننده اصلی در فعالیت آنتیاکسیدانی در گیاهان مطرح هستند. همچنین این آنتیاکسیدانها فعالیتهای بیولوژیکی مختلفی نیز مانند اثرات ضد التهاب، ضدتصلب شرایین و ضد سرطانی دارند، که میتواند به فعالیت آنتیاکسیدانی آنها مربوط باشد (11). سبزیجات چلیپائی متعلق به خانواده Cruciferae بهخصوص جنس Brassica نظیر بروکلی، گل کلم، کلمپیچ و کلم بروکسل دارای اثرات محافظتی ارزشمندی و مهمی در برابر استرس اکسیداتیو هستند. کلم بروکلی Brassica oleracea بومی کشور ایتالیا بوده و در ایران در نواحی شمالی کشت میشود. کلم بروکلی یکی از سبزیهای مهم و با ارزش غذایی بالاست که سرشار از ویتامینها، آنتیاکسیدانها و ترکیبات ضدسرطانی است، خواص ضدسرطانی کلم بروکلی به سبب وجود ویتامین E (آلفاتوکوفرول)، ویتامین C (آسکوربیک)، فلاونوئیدها (کوئرستین و کامپفرول)، کاروتنوئیدها (کاروتن و لوتئین) و گلوکوسیناتها است (12,13). پلیفنلهای موجود در کلم بروکلی با فعالیت آنتیاکسیدانی بالا میتوانند بهعنوان خنثیکنندههای بسیار قوی رادیکال آزاد اکسیژن باشند (14). سولفورفان(1-isothiocyanato-4-(methylsulfinyl) butane) نیز با نقش آنتیاکسیدانی خود مقاومت به تنشهای اکسیداتیو را زیاد نموده و از آسیبهای احتمالی سلول با افزایش ظرفیت آنتیاکسیدانی بدن، جلوگیری میکند (15). در حالحاضر، بسیاری از عصارههای گیاهی برای تولید غذاهای سالم استفاده میشود. این امر سبب شده است که علاقه مصرفکنندگان و صنایع به مسیرهای پایدار و غیر سمی برای تولید آنها افزایش یابد (16). اگرچه تعیین مواد مؤثره تشکیلدهنده گیاهان به لحاظ فارماکولوژیک حائز اهمیت است، ولی لازم است در ابتدا اثربخشی عصارههای به دست آمده از آنها و خصوصیات اجزای تشکیل دهنده، برای انتخاب بهترین نوع حلال، مشخص شود (17). استخراج ترکیبات فعال گیاهی به شدت به ویژگی آبگریزی یا چربی دوستی مولکولهای هدف بستگی دارد، از اینرو استفاده مناسب از حلالهای آلی رایج مطرح میباشد. هم چنین انواع روشهای استخراج حرارتی و غیرحرارتی ابتکاری نیز برای غلبه بر آسیبهای ترکیبات آنتیاکسیدان و فعال گیاهی توصیه شده است (18). مثلا استفاده از میکروویو برای استخراج ترکیبات فنولی بروکلی کارآمدتر از خیساندن با صرف زمان کمتر و بازده بهتر گزارش شده است (19). پارامترهای مختلفی از جمله راندمان استخراج عصاره، شرایط استخراج و هم چنین نوع حلالها و جاذبهای مورد نظر، برای دریافت بهترین راندمان ترکیبات موثره گیاهی حائز اهمیت میباشد (20). با توجه به ترکیبات فیتوشیمیایی موثر در گیاه بروکلی و ارزش بالای ایت ترکیبات در کاهش آسیبهای اکسیداتیو، بنابراین هدف از مطالعه، مقایسه غلظت مواد مؤثره عصاره هیدرومتانولی و هیدرواتانولی بروکلی و بررسی عملکرد آنتیاکسیدانی در شرایط برونتن بود.
روش بررسی
روش تهیه عصاره بروکلی: کلم بروکلی جمعآوریشده از مزارع کشاورزی لرستان، بعد از تائید توسط مرکز هرباریوم دانشگاه کردستان (Herb No.30072) در حرارت 25 درجه سانتیگراد و در شرایط سایه خشک شد. بعد از آسیاب کردن در داخل ظروف مخصوص نگهداری شد. سپس 300 گرم پودر با یک لیتر اتانول 80 درصد و همچنین متانول 80 درصد به مدت 48 ساعت به روش ماسیراسیون قرار گرفت. پس از صاف کردن، عصاره با استفاده از روتاری تحت خلا تغلیظ شد (22, 21).
اندازهگیری ترکیبات فنولی تام: میزان تام ترکیبات فنولی با روش فولین سیوکالتو اندازهگیری شد و نتایج بر حسب میلیگرم اسید گالیک در گرم عصاره بیان شد (23). روش فولین سیوکالتو از متداولترین روشهای اندازهگیری ترکیبات فنولی میباشد و اساس کار در اینروش، احیاء معرف فولین توسط ترکیبات فنولی در محیط قلیایی و ایجاد کمپلکس آبی رنگ است که حداکثر جذب را در طول موج 760 نانومتر نشان میدهد، بهطور خلاصه در اینروش، 20 میکرولیتر از عصارهها با غلظت (1 میلیگرم بر میلی لیتر) درون لوله آزمایش با 160/1 میلیلیتر آب مقطر و 100 میکرولیتر معرف فولین سیوکالتو مخلوط شدند، سپس از گذشت 1 تا 8 دقیقه، 300 میکرولیتر محلول کربنات سدیم (20% وزنی/حجمی) به محتوای لوله آزمایش افزوده شد، لولههای آزمایش بعد از تکان دادن، درون حمام آب با دمای 40 درجه سانتیگراد قرار گرفته و پس از گذشت 30 دقیقه جذب آنها با دستگاه اسپکتروفتومتر در طول موج 760 نانومتر خوانده شد، برای رسم منحنی استاندارد گالیک اسید، محلول پایهای از این ماده با غلظت 1000 میکروگرم بر میلیلیتر تهیه شد و سپس از این محلول پایه غلظتهای مختلف (100، 200، 400، 600، 800 میکروگرم بر میلیلیتر) آماده گردید و پس از انجام مراحل مختلف مطابق روش ذکر شده در بالا مقدار جذب نمونهها خوانده شد، بعد از رسم منحنی کالیبراسیون گالیک اسید، با قراردادن مقدار جذب عصاره در معادله خطی مربوط به منحنی استاندارد، مقدار فنل تام موجود در عصاره محاسبه گردید. در نهایت، دادهها بر اساس میلیگرم گالیک اسید بر گرم عصاره تعیین شد (24).
اندازهگیری میزان فلاونوئید کل: مقادیر فلاونوئیدها در نمونه عصارههای گیاهی به روش کلریدآلومینیوم اندازهگیری شد. ابتدا 0/1 میلیلیتر کلرید آلومینیوم 10 درصد را با 0/1 میلیلیتر استات پتاسیم یک مولار مخلوط کرده و سپس به آنها 2/8 میلیلیتر آب مقطر دو بار تقطیر اضافه گردید. در مرحله بعد 0/5 میلیلیتر از محلول هر عصاره با 1/5 میلیلیتر اتانول مخلوط گردیده بود، به مخلوط کلریدآلومینیوم، استات پتاسیم و آب اضافه گردید و مخلوط نهایی حاصل برای هر عصاره (با حجم 5 میلیلیتر) برای مدت 30 دقیقه در دمای اتاق قرار داده شد و سپس جذب مخلوط واکنش در طول موج 415 نانومتر توسط اسپکتروفتومتر مدل Lambda 45-UV/Visible اندازهگیری شد. مقدار فلاونوئید کل بهصورت معادل میلیگرم کوئرستین بر گرم وزن خشک محاسبه و بیان گردید. ارزیابی برای هر کدام از عصارهها در سه تکرار انجام شد (25).
اثر بازدارندگی از رادیکال آزاد با استفاده از روش DPPH
DPPH (1،1-dipheayl-2-pierylhydrazyl) به مقدار 0/2 میلیلیتر از عصاره کلم بروکلی با غلظت های25، 50، 100، 200، 400، 600، 800 و 1000 میکروگرم بر میلی لیتر) به 3/8 میلیلیتر از محلول اتانول حاوی 0/04 میلیگرم رادیکال DPPH (سیگما المان) اضافه شد و مخلوط به مدت 30 دقیقه در درجه حرارت اتاق در محیط تاریک قرار داده شد و سپس جذب نمونههای مورد آزمون با استفاده از دستگاه اسپکتروفتومتر (JENWAY-انگلیس) در طول موج 517 نانومتر در برابر شاهد اندازهگیری شد و در نمونه شاهد 0/2 میلیلیتر اتانول به جای نمونه، مورد استفاده قرار گرفت و درصد بازدارندگی رادیکال آزاد بر حسب فرمول زیر محاسبه شد (26). سپس نتایج به صورت IC50 (مقداری از آنتی اکسیدان که لازم است تا غلظت DPPH را به 50 درصد اولیه برساند) بیان گردید ( هر نمونه 3 بار اندازهگیری شد (27).
%DPPH= جذب نوری شاهد/جذب نوری نمونه- جذب نوری شاهد×100
جداسازی و شناسایی ترکیبات با استفاده از دستگاه GC-MS: نمونه استخراج شده توسط متانول یا اتانول پس از آبگیری با سدیم سولفات بدون آب، توسط دستگاه کروماتوگرافی گازی متصل به طیفسنج جرمی Agilent 7890B GC System/ 5977A MSD آنالیز شد، حجم نمونه تزریق شده به دستگاه یک میکرولیتر، ستون بهکار رفته HP-5 ms (30m×0/25mm ،0/25 Micron و دمای محل و دمای اکسیلاری ۲۸۰ درجه سانتیگراد) تنظیم شد. دمای اولیه ستون 50 درجه سانتیگراد بود که با سرعت 10 درجه سانتیگراد در دقیقه تا رسیدن به دمای ۲۶۰ درجه افزایش یافت، زمان توقف در این دما ۱۰ دقیقه درنظر گرفتهشد. دستگاه طیفسنج جرمی در مد یونیزاسیون الکترونی تنظیم شد، انرژی یونش ۷۰ الکترون ولت و دامنه جرمی بررسی شده ۵۰ تا ۵۵۰ amu بود. دمای منبع یونیزاسیون و چهار قطبی به ترتیب در ۲۳۰ و ۱۵۰ درجه سانتیگراد تنظیم گردید. از گاز حامل هلیوم با درصد خلوص ۹۹۹/۹۹ درصد، فشار psi 34 و شدت جریان یک میلیلیتر در دقیقه استفاده گردید. شناسایی ترکیبات به کمک مقایسه طیفهای جرمی آنها با دادههای پایگاههای اطلاعاتی دستگاه شامل NIST و Wiley و همچنین مقایسه اندیسهای بازداری و الگوی شکست گزارش شده برای آنها صورت پذیرفت (28). با توجه به نقطه جوش زیر 400 درجه سانتیگراد سولفورفان، عدم وجود جز واکنشپذیر با ستون همراه عصاره مانند اسید، باز و یا آب، عدم شرایط تجزیهپذیری عصاره در دمای ستون و با توجه به مطالعات متعدد قبلی از روش GC-MS استفاده شد (29). همچنین با استفاده از پیک استاندارد سولفارفان شرکت سیگما- آلدریچ ( CAS# 4478-93-7; Catalog#s4441 ) محل تشکیل پیک و غلظت آن در دو نوع عصاره مشخص شد.
تجزیه و تحلیل آماری
نتایج آزمایشات با استفاده از نرمافزار آماری version 16 SPSS در سطح آماری کمتر از 0/05 مورد تجزیه و تحلیل قرارگرفت. میانگین و انحراف معیار برای هر عصاره در سه تکرار مجزا تعیین شد. برای مقایسه مقادیر بهدست آمده از آزمون t-test مستقل استفاده شد. IC50 از نمودار خطی با ضریب رگرسیون بالای 9/0 تهیه گردید.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط کمیته اخلاق دانشگاه علوم پزشکی کردستان تایید شده است (کد اخلاق IR.MUK.REC.1397.5001)
نتایج
جدول 1 مقادیر فنول کل (برحسب میلیگرم اسید گالیک بر گرم وزن خشک) و فلاونوئید کل (برحسب میلیگرم کوئرستین بر گرم وزن خشک) برای عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی را نشان میدهد. بیشترین محتوای فنول کل مربوط به عصاره هیدرومتانولی به میزان 5/40±41/52 اسید گالیک بر گرم وزن خشک و کمترین میزان فنول هم مربوط به عصاره هیدرواتانولی به میزان 0/37±33/3 اسید گالیک بر گرم وزن خشک تعیین شد. با توجه به مقادیر p اختلاف آماری معنی داری بین فنول کل دو عصاره وجود ندارد. بیشترین محتوای فلانوئید کل مربوط به عصاره هیدرومتانولی 1/93±40/36 کوئرستین بر گرم وزن خشک و کمترین میزان فلانوئید هم مربوط به عصاره هیدرواتانولی به میزان 1/49±28/79 کوئرستین بر گرم وزن خشک بود و این تفاوت بین دو نوع نوع عصاره معنیدار شد (p<0/01). در جدول 2، مقادیر مهار رادیکالهای آزاد DPPH توسط غلظتهای مختلف عصارههای اتانولی و متانولی کلم بروکلی در مقایسه با اسید آسکوربیک به عنوان استاندارد آورده شده است. میزانIC50 عصاره هیدرواتانولی 23/40 میکروگرم بر میلیلیتر و هیدرومتانولی 19/76 میکروگرم بر میلیلیتر شد (نمودار1). غلظت مؤثر بین میانگین دادههای عصارههای هیدرواتانولی و هیدرومتانولی دارای اختلاف آماری معنیداری شد (0/05>p). به نحوی که بیشترین فعالیت مهار رادیکالهای آزاد مربوط به عصاره هیدرومتانولی بود. با توجه به نتایج درصد مهار رادیکال آزاد در طول موج nm 517 در بین میانگین عصاره هیدرواتانولی و متانولی اختلاف معنیداری وجود داشت (p<0/01). . درصد مهار در عصاره هیدرومتانولی92/1% و درعصاره هیدرواتانولی %72/8بود (جدول 3). نمودار 2 و جدول 4 نشان دهنده ترکیبات تشکیل دهنده عصاره اتانولی بروکلی با روش GC-MS بود. با توجه به جدول در زمان بازدارندگی 683/18 دقیقه ترکیب سوفارفان با 1/41 درصد جداسازی شد. در حالی که نمودار 3 و جدول 5 نشان دهنده جداسازی این ترکیب با 14/86درصد است. با توجه به نتایج ارائه شده در جدول 6، بین میانگین مقادیر سولفارفان عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی اختلاف معنیداری وجود داشت (p<0.01).
جدول 1: مقادیر فنول و فلاوونوئید کل عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی

حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنی دار است (p<0/05) .Q : Quercetin GAE,: Gallic acid dw,: Dry weight
جدول 2: درصد مهار رادیکال های آزاد عصاره ها در تست DPPH

حروف غیرمشابه نشان اختلاف آماری معنی دار است (0/05>p).

نمودار 1: نمودار رگرسیون IC50 درعصارههای مختلف بروکلی
جدول3: میانگین درصد مهار رادیکال آزاد در عصارههای مختلف بروکلی

حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنیدار است (p<0.05).
.JPG)
نمودار 2: گراف ترکیبات شیمیایی عصاره هیدرواتانولی کلم بروکلی
جدول 4: ترکیبات شیمیایی عصاره هیدرواتانولی کلم بروکلی


نمودار 3: گراف ترکیبات شیمیایی عصاره هیدرومتانولی کلم بروکلی
جدول 5: ترکیبات شیمیایی عصاره هیدرومتانولی کلم بروکلی

جدول 6: مقایسه ترکیبات شیمیایی فعال سولفوره (سولفارفان)

حروف غیرمشابه به صورت ستونی نشان اختلاف آماری معنیدار است.
بحث
افزایش روزافزون ترکیبات طبیعی در درمان و پیشگیری از بیماریها امروزه حائز اهمیت میباشد. در این راستا تعیین مواد مؤثره تشکیل دهنده گیاهان به لحاظ فارماکولوژیک بسیار با ارزش است. بنابراین انتخاب بهترین حلال و بهترین نوع عصاره برای جداسازی بیشترین ماده مؤثره میتواند اهمیت ویژهای داشته باشد. فلاونوئیدها و سایر ترکیبات فنلی معمولاً بهعنوان متابولیتهای ثانویه گیاهی شناخته میشوند که دارای یک حلقه معطر حاوی حداقل یک گروه هیدروکسیل هستند. بیش از 8000 ترکیب فنلی بهعنوان مواد طبیعی از گیاهان گزارش شده است. بسیار جالب توجه است که نیمی از این ترکیبات فنلی فلاونوئیدهایی هستند که بهصورت آگلیکون، گلیکوزیدها و مشتقات متیله ارائه میشوند (30,31). نتایج نشان داد که مقادیر فنول، فلاوونوئید در عصاره هیدرومتانولی بروکلی نسبت به هیدرواتانولی بیشتر است. در این راستا درصد مهار رادیکالی در آزمون DPPH برای عصاره هیدرومتانولی نسبت به هیدرواتانولی دارای اختلاف آماری معنیداری شد. کاهش مقدار IC50 در عصاره متانولی نسبت به اتانولی نشان بر افزایش پتانسیل آنتیاکسیدانی عصاره متانولی دارد. در مطالعه سان و همکاران به ارتباط خطی معنیدار محتوای فلاوونوئیدی عصاره بروکلی با خاصیت آنتیاکسیدانی آن اشاره شد (32). مطالعه اخیر همراستا با این مطالعه دلیل بر افزایش عملکرد آنتیاکسیدانی عصاره متانولی است. اتانول بهعنوان یک حلال خوب برای استخراج پلیفنلها شناخته شده است و برای مصرف انسان بیخطر است؛ اما متانول را برای استخراج و تجزیهوتحلیل فیتوشیمیایی نمونههای گیاهی به دلیل طیف گستردهای از ترکیبات با قطبیتهای مختلف (غیر قطبی به قطبی) معمولاً با وزن مولکولی پایین پیشنهاد میشود. همچنین در استخراج کامل که با تکنیک خیساندن انجام میشود، متانول نسبت به اتانول ارجحیت دارد. عابدینپور و کوهی کمالی در مطالعهای در سال 1394، ویژگی آنتیاکسیدانی عصاره فنولی کلم بروکلی با آنتیاکسیدانهای طبیعی و مصنوعی و تأثیر آنها بر اکسیداسیون روغن آفتابگردان را مورد ارزیابی قرار دادند، نتایج نشان داد که در تمامی شاخصهای ارزیابی شده، غلظت 1000 و 500 پیپیام عصاره کلم بروکلی در پایداری اکسیداتیو روغن آفتابگردان طی مدت زمان نگهداری مؤثرتر از BHA و آلفاتوکوفرول عمل نموده و در غلظت 200 پیپیام از آلفاتوکوفرول مؤثرتر بوده است (33). در مطالعه گواهی و همکاران به تغییرات غلظت فلاوونوئیدها و خواص آنتیاکسیدانی عصاره در روشهای مختلف عصارهگیری اشاره شده است. به نحوی که بازده ترکیبات آنتیاکسیدان در روش بن ماری بیشتر از خیساندن است (34). احمد و همکاران در نتایج آزمایشهای خود پیرامون ترکیبات فیتوشیمیایی بروکلی اعلام نمودند، عصارهی الکلی برگ گیاه کلم پیچ حاوی بیشترین میزان ترکیبات فنلی نسبت به حلال کلروفرم، اتر و عصاره آبی آن است و خاصیت بالای مهار رادیکالهای آزاد در کلم را به وجود گروههای هیدروکسیل در ترکیبات فنلی آن نسبت دادند (35). گوو و همکاران مشاهده کردهاند که از بین عصارهی آبی، متانولی و استونی استخراج شده از گل، ساقه و برگهای کلم بروکلی کشت شده در تایوان، عصارهی استونی هر سه قسمت، مهار رادیکالهای آزاد پایینتری را نشان داد (36). گاولیک-دزیکی، طی بررسیهای آزمایشگاهی اعلام کرده است، ترکیبات فنلی در عصارهی جوشیدهی کلم بروکلی نسبت به عصارهی خام آن به میزان قابل توجهی کاهش مییابد (37). مورنو و همکاران، درباره مشخصات شیمیایی و بیولوژیکی بروکلی تحقیق مروری کردند، مطالعات آنها نشان داد که سبزیجات براسیکا بهطورکلی و مخصوصاً بروکلی، از انسانها در مقابل سرطان محافظت میکند، و این اثر بروکلی به سبب منابع غنی گلوکوزینولاتها و همچنین حاوی محتوای بالایی از فلاونوئیدها، ویتامینها و مواد مغذی معدنی آن است (38). در نتایج به دست آمده از عصاره هیدرواتانولی و متانولی بروکلی با روش GC-MS بین میانگین مقادیر ترکیبات شیمیایی فعال سولفوره عصاره هیدرواتانولی و هیدرومتانولی کلم بروکلی اختلاف معنیداری وجود داشت، درصد ترکیبات شیمیایی فعال سولفوره (سولفورفان) عصاره متانولی (14/86%) و عصاره اتانولی (1/41%) شد و این اختلاف معنیدار بود. از طرف دیگر در مقایسه ترکیبات عصاره هیدرومتانولی و هیدرواتانولی بروکلی با GC-MS، ترکیب Phenol, 2,3,5-trimethyl- $$ Isopseudocumenol $$ 1-Hydroxy-2,3,5-trimethylbenzene $$ 2,3,5-Trimethylphenol جز ترکیبات فنولی جداسازی شده در تحقیق حاضر است که اثر آنتی اکسیدانی قوی عصاره هیدرومتانولی نسبت به هیدرواتانولی را میتوان به آن نیز نسبت داد. عوامل مختلفی از جمله گونه گیاه، ناحیه پرورش جغرافیایی، نوع حلال و روش استخراج بر درصد ترکیبات فیتوشیمیای موثر است (39). با توجه به اینکه مقدار مواد فعال در گیاهان طبیعی همیشه نسبتاً کم است. فرآیند استخراج و جداسازی آزمایشگاهی مناسب ، گلوگاه کاربرد محصولات طبیعی در توسعه دارو بوده است (40). فرج در تحقیق خود جهت تعیین درصد سولفورفان بر روی گونههای مختلف بروکلی، اعلام داشت، درصد سولفورفان استخراج شده از عصاره بروکلی در گونههای مختلف بسیار متفاوت میباشد (41). هم چنین اسوامی و همکاران به تاثیر حلالهای مختلف در تغییر درصد ترکیبات فعال آنتیاکسیدان و آنتیمیکروبیال گیاهی با متد GC-MS اشاره کردند (42). عزیزی و همکاران، در گزارش تحقیقی پیرامون جداسازی ترکیبات فیتوشیمیایی و سولفورفان بروکلی مقادیر سولفورفان در عصاره متانولی با روش GC-MS برابر با 21/43 درصد گزارش دادند که نسبت به مطالعه اخیر بیشتر بود. این تفاوت به سبب سن گیاه نمونه گیری و منطقه مورد نظر میتواند مربوط باشد. به نحوی که در این مطالعه بیشترین غلظت سولفورفان را در زمان 7 روزگی گیاه نسبت داده شده است (43). براساس نتایج مطالعات گذشته، جداسازی ترکیبات با حلال متانول نسبت به اتانول ارجحیت دارد (44)؛ اما در صورت انجام مطالعات حیوانی، باید از محلول هیدروالکلی متانول استفاده نمود و به سبب جلوگیری از مسمومیت، کاملاً متانول آن را تبخیر کرد (45). با توجه به اهمیت پتانسیل آنتیاکسیدانی عصاره بروکلی در مداخلات تجربی آسیبهای اکسیداتیو از جمله فریز اسپرم (46)، مسمومیت با فلزات سنگین آرسنیک (47) و سرب (49, 48)، مسمومیت با سم دیازینون اشاره شده است. در تحقیق جدی و مهاجری در مطالعهای، به عملکرد مثبت عصاره بروکلی در استرس اکسیداتیو القا شده توسط استامینوفن در کلیه موش اشاره کردند (50). گوئررو بلتران و همکاران به سولفورفان بهعنوان جزء اصلی و طبیعی بروکلی که مانع مرگ و التهاب سلولها در کاهش عوارض اکسیداتیو ناشی از نفروپاتی دیابتیک اشاره شده است (51). سایر روشهای تعیین خاصیت آنتیاکسیدانی برونتن مانند FRAP و ...در تکمیل دادهها از محدودیتهای تحقیق بود. همچنین مقایسه روشهای دیگر عصارهگیری، استفاده از حلالهای استونی، کلروفرمی با استفاده از روش HPLC با GC-MS در مطالعات آینده توصیه میگردد.
نتیجهگیری
اهمیت کاربرد آنتیاکسیدانها در صنایع دارویی، غذایی و آرایشی بهداشتی، جداسازی آنها از ترکیبات گیاهی با پتانسیل عمل بالا، دارای جایگاه ویژهای است. نتایج بهدست آمده نشان بر افزایش غلظت ترکیبات فنولی، فلاوونوئیدی، مهار رادیکالهای آزاد با DPPH و درصد سولفارفان در عصاره هیدرومتانولی نسبت به هیدرواتانولی بود. در این راستا توصیه بر حلال متانول در روش جداسازی ترکیات آنتیاکسیدانی عصاره بروکلی در مطالعات برونتن و درونتن میباشد. همچنین با وجود آسیبهای اکسیداتی روزمره، استفاده از بروکلی در رژیم غذایی و فراوردههای دارویی برای پیشگیری از بیماریها توصیه میشود.
سپاسگزاری
مقاله مستخرج از پایاننامه دکتری عمومی دامپزشکی است. از معاونت پژوهش دانشگاه آزاد اسلامی سنندج جهت همکاری در انجام آن تشکر و سپاسگزاری میشود.
حامی مالی: هزینههای تحقیق توسط نویسنده و با همکاری معاونت پژوهشی دانشگاه آزاد اسلامی سنندج تامین شدهاست.
تعارض در منافع: وجود ندارد.
References:
1- Jafari Z, Dehghan M, korani Z. Investigating the Anatomical Structure and Effective Ingredients of Broccoli (Brassica Oleracea) in Two Different Climates. Developmental Biology 2020; 12(1): 69-77.
2- Atanassova M, Georgieva S, Ivancheva K. Total Phenolic and Total Flavonoid Contents, Antioxidant Capacity and Biological Contaminants in Medicinal Herbs. Journal of the University of Chemical Technology & Metallurgy 2011; 46(1): 81-8.
3- Robards K, Kerr AF, Patsalides E. Rancidity and Its Measurement in Edible Oils and Snack Foods. A Review. Analyst 1988; 113(2): 213-24.
4- Henry CJK, Heppell N. Nutritional Losses and Gains during Processing: Future Problems and Issues. Proceedings of the Nutrition Society 2002; 61(1): 148-45.
5- Antolovich M, Prenzler PD, Patsalides E, McDonald S, Robards K. Methods for Testing Antioxidant Activity. Analyst 2002; 127(1): 183-98.
6- Paryab M, Raeeszadeh M. The Study of the Rate and Reasons of Medical Herb Use by the Patients Visiting the Specialized Treatment Centers in Fars Province in 2014. Community Health Journal 2016; 10(2): 62-71.
7- Zheng W, Wang SY. Antioxidant Activity and Phenolic Compounds in Selected Herbs. Journal of Agricultural and Food chemistry 2001; 49(11): 5165-70.
8- Ayoughi F, Barzegar M, Sahari M, Naghdi Badi H. Antioxidant Effect of Dill (Anethum Graveolens Boiss.) Oil in Crude Soybean Oil and Comparison with Chemical Antioxidants. J Med Plants 2009; 8(30): 71-83.
9- Tajali, F, Hemati Kakhki A, Khatamirad M, Garzani S, Garzani S. Study Antioxidantion Properties of Saffron Petal. In 18 Th National Congress on Food Tecnology. Mashhad: IR Iran 2008; 15-6.
10- Kamkar A. The Study of Antioxidant Activity of Essential Oil and Extract of Iranian Anethum Graveloens. Quarterly of Horizon of Medical Sciences 2009; 15(2): 11-16.
11- Sonboli A, Mojarrad M, Nejad Ebrahimi S, Enayat S. Free Radical Scavenging Activity and Total Phenolic Content of Methanolic Extracts from Male Inflorescence of Salix Aegyptiaca Grown in Iran. Iran J Pharm Res 2010; 3(9): 293-6.
12- Deng Z, Rong Y, Teng Y, Mu J, Zhuang X, Tseng M Broccoli-Derived Nanoparticle Inhibits Mouse Colitis by Activating Dendritic Cell AMP-Activated Protein Kinase. Mol Ther 2017; 25(7): 1641-54.
13- Koh E, Wimalasiri KMS, Chassy AW, Mitchell AE. Content of Ascorbic Acid, Quercetin, Kaempferol and Total Phenolics in Commercial Broccoli. Journal of food composition and analysis 2009; 22(7-8): 637-43.
14- Verma S, Mishra SN. Putrescine Alleviation of Growth in Salt Stressed Brassica Juncea by Inducing Antioxidative Defense System. J plant physiol 2005; 162(6): 669-77.
15- Nandini DB, Rao RS, Deepak BS, Reddy PB. Sulforaphane in Broccoli: the Green Chemoprevention!! Role in Cancer Prevention and Therapy. J Oral Maxillofac Pathol 2020; 24(2): 405.
16- Giacometti J, Kovačević DB, Putnik P, Gabrić D, Bilušić T, Krešić G, et al. Extraction of Bioactive Compounds and Essential Oils from Mediterranean Herbs by Conventional and Green Innovative Techniques: a Review. Food Research International 2018; 113: 245-62.
17- Ashrafpour M, Rezaei H, sefidgar A, Baradaran M, Sharifi H. Survey of the Antibacterial Properties of Aqueous Ethanolic and Methanolic Extraction of Artemisia Annua Around the City of Babol. Journal of Ilam University of Medical Sciences 2016; 23(6): 129-41.
18- Nonato CD, Camilo CJ, Leite DO, da Nobrega MG, Ribeiro-Filho J, de Menezes IR, Comparative analysis of chemical profiles and antioxidant activities of essential oils obtained from species of Lippia L. by chemometrics. Food Chemistry 2022; 384: 132614.
19- Rodríguez García S L, Raghavan V. Microwave-Assisted Extraction of Phenolic Compounds From Broccoli (Brassica Oleracea) Stems, Leaves, and Florets: Optimization, Characterization, and Comparison with Maceration Extraction. Recent Progress in Nutrition 2022; 2(2): 1-23.
20- Yu X, Ma F, Zhang L, Li P. Extraction and Quantification of Sulforaphane and Indole-3-Carbinol from Rapeseed Tissues Using Quechers Coupled with UHPLC-MS/MS. Molecules 2020; 25(9): 2149.
21- Bhagat SV, Varma ME, Patil RN. Study of Free Radical Scavenging Activity and Phytochemicals of the Methanol Extract of Broccoli (Brassica Oleracea). Research Journal of Pharmaceutical, Biological and Chemical Sciences 2012; 3(4): 623-28.
22- Raeeszadeh M, Mortazavi P. The Study of the Effect of Hydroalcholic Extracts of Broccoli on Lead Induced Oxidative Stress in Kidney of Mice. Razi Journal of Medical Sciences 2018; 25(9): 17-25. [Persian]
23- Karawya MS, Ammar NM, Hifnawy MS, Al-Okbi SY, Mohamed DA, El-Anssary AA. Phytochemical Study and Evaluation of the Anti-Inflammatory Activity of Some Medicinal Plants Growing in Egypt. Med J Islamic World Acad Sci 2010; 18(4): 139-50.
24- Singleton VL, Rossi JA. Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents. Am J Enol Vitic 1965; 16(3): 144-58.
25- Pourmorad F, Hosseinimehr SJ, Shahabimajd N. Antioxidant Activity, Phenol and Flavonoid Contents of Some Selected Iranian Medicinal Plants. African journal of biotechnology 2006; 5(11): 1142-45.
26- Cheng Z, Moore J, Yu L. High-Throughput Relative DPPH Radical Scavenging Capacity Assay. Journal of agricultural and food chemistry 2006; 54(20): 7429-36.
27- Raeeszadeh M, Beheshtipour J, Jamali R, Akbari A.The Antioxidant Properties of Alfalfa (Medicago Sativa L.) and Its Biochemical, Antioxidant, Anti-Inflammatory, and Pathological Effects on Nicotine-Induced Oxidative Stress in the Rat Liver. Oxid Med Cell Longev 2022; 2022: 2691577.
28- Ye J. Application of Gas Chromatography-Mass Spectrometry in Research of Traditional Chinese Medicine. Chemical Papers 2009; 63(5): 506-11.
29- Chiang WCK, Pusateri DJ , Leitz REA. Gas Chromatography/Mass Spectrometry Method for the Determination of Sulforaphane and Sulforaphane Nitrile in Broccoli. Journal of Agricultural and Food Chemistry 1998; 46(3): 1018-21.
30- Kumar S, Pandey AK. Chemistry and Biological Activities of Flavonoids: An Overview. Scientific World Journal 2013; 2013: 162750.
31- Ahmed S. I, Hayat M. Q, Tahir M, Mansoor Q, Ismail M, Keck K, Bates R. B.Pharmacologically Active Flavonoids from the Anticancer, Antioxidant and Antimicrobial Extracts of Cassia Angustifolia Vahl. BMC Complement Altern Med 2016; 16(1): 460.
32- Sun T, Powers JR, Tang J. Evaluation of the Antioxidant Activity of Asparagus, Broccoli and their Juices. Food chemistry 2007; 105(1): 101-6.
33- Raeeszadeh M, Karimi P, Khademi N, Mortazavi P. The Effect of Broccoli Extract in Arsenic-Induced Experimental Poisoning on the Hematological, Biochemical, And Electrophoretic Parameters of the Liver and Kidney of Rats. Evidence-Based Complementary And Alternative Medicine 2022; 20221-9.
34- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, and Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Scientific Journal of Ilam University of Medical Sciences 2019; 27(3): 91-100. [Persian]
35- Ahmed MF, Rao AS, Ahemad SR, Ibrahim M. Phytochemical Studies and Antioxidant Activities of Brassica Oleracea L. Var. Capitata. Int J Pharm Pharm Sci 2012; 4(3): 374-8.
36- Guo Jt, Lee Hl, Chiang Sh, Lin Fi, Chang Cy. Antioxidant Properties of the Extracts from Different Parts of Broccoli in Taiwan. Journal of food and drug analysis 2001; 9(2): 95-101.
37- Gawlik-Dziki U. Effect of Hydrothermal Treatment on the Antioxidant Properties of Broccoli (Brassica Oleracea Var. Botrytis Italica) Florets. Food Chem 2008; 109(2): 393-401.
38- Moreno DA, Carvajal M, López-Berenguer C, García-Viguera C. Chemical and Biological Characterisation of Nutraceutical Compounds of Broccoli. J Pharm Biomed Anal 2006; 41(5): 1508-22.
39- da Silva BV, Barreira JC, Oliveira MBP. Natural Phytochemicals and Probiotics as Bioactive Ingredients for Functional Foods: Extraction, Biochemistry and Protected-Delivery Technologies. Trends in Food Science & Technology 2016; 50: 144-58.
40- Zhang QW, Lin LG, Ye WC. Techniques for Extraction and Isolation of Natural Products: a Comprehensive Review. Chinese Medicine 2018; 13(1): 1-26.
41- Farag MA, Motaal AAA. Sulforaphane Composition, Cytotoxic and Antioxidant Activity of Crucifer Vegetables. Journal of Advanced Research 2010; 1(1): 65-70.
42- Swamy MK, Arumugam G, Kaur R, Ghasemzadeh A, Yusoff MM, Sinniah UR. GC-MS Based Metabolite Profiling, Antioxidant and Antimicrobial Properties of Different Solvent Extracts of Malaysian Plectranthus Amboinicus Leaves. Evid Based Complement Alternat Med 2017; 2017: 1517683.
43- Azizi Naser S, Amiri‐Besheli B, Sharifi‐Mehr S. The Isolation and Determination of Sulforaphane From Broccoli Tissues by Reverse Phase‐High Performance Liquid Chromatography. Journal of the Chinese Chemical Society 2011; 58(7): 906-10.
44- Barani M, Mirzaei M, Torkzadeh-Mahani M, Adeli-Sardou M. Evaluation of Carum-Loaded Niosomes on Breast Cancer Cells: Physicochemical Properties, in Vitro Cytotoxicity, Flow Cytometric, DNA Fragmentation and Cell Migration Assay. Sci Rep 2019; 9(1): 1-10.
45- Dai J, Mumper RJ. Plant Phenolics: Extraction, Analysis and their Antioxidant and Anticancer Properties. Molecules 2010; 15(10): 7313-52.
46- Raeeszadeh M, Nadia Khademi, Akbari A. The Effects of Broccoli and Caraway Extracts on Serum Oxidative Markers, Testicular Structure and Function, and Sperm Quality before and after Sperm Cryopreservation. Cryobiology 2021; 99: 11-19.
47- Raeeszadeh M, Karimi P, Khademi N, Mortazavi P. The Effect of Broccoli Extract in Arsenic-Induced Experimental Poisoning on the Hematological, Biochemical, and Electrophoretic Parameters of the Liver and Kidney of Rats. Evidence-Based Complementary and Alternative Medicine 2022; 2022: 1-9.
48- Raeeszadeh M, Mortazavi P. The Study of the Prominent Nephroprotective Effect of Methanolic Broccoli (Brassica Olaracea, Var. Italica) Extract on Oxidative-Lead Damage in Mice Kidney: Biochemical Parameters and Phatological Changes. Indian Journal of Experimental Biology (IJEB) 2021; 59(9): 626-32.
49- Qaderi Forough M, Raeeszadeh M, Amiri A. Dose-Response Changes of Brassica Oleracea Var. Italica Hydroalcholic Extract in the Control of Oxidative Stress by Induction of Diazinon on the Cells of Testicular Tissue in Male Adult Rat. JRUMS 2017; 16(7): 593-604.
50- Jeddi H. Study on the Effects of Ethanolic Extract of Broccoli on Oxidative Stress Induced by Acetaminophen in Rat Kidney. Veterinary Clinical Pathology The Quarterly Scientific Journal 2017; 11(2 (42) Summer): 145-57.
51- Guerrero-Beltrán CE, Mukhopadhyay P, Horváth B, Rajesh M, Tapia E, García-Torres I, Pacher P. Sulforaphane, a Natural Constituent of Broccoli, Prevents Cell Death and Inflammation in Nephropathy. The Journal of Nutritional Biochemistry 2012; 23(5): 494-500.
1- Jafari Z, Dehghan M, korani Z. Investigating the Anatomical Structure and Effective Ingredients of Broccoli (Brassica Oleracea) in Two Different Climates. Developmental Biology 2020; 12(1): 69-77.
2- Atanassova M, Georgieva S, Ivancheva K. Total Phenolic and Total Flavonoid Contents, Antioxidant Capacity and Biological Contaminants in Medicinal Herbs. Journal of the University of Chemical Technology & Metallurgy 2011; 46(1): 81-8.
3- Robards K, Kerr AF, Patsalides E. Rancidity and Its Measurement in Edible Oils and Snack Foods. A Review. Analyst 1988; 113(2): 213-24.
4- Henry CJK, Heppell N. Nutritional Losses and Gains during Processing: Future Problems and Issues. Proceedings of the Nutrition Society 2002; 61(1): 148-45.
5- Antolovich M, Prenzler PD, Patsalides E, McDonald S, Robards K. Methods for Testing Antioxidant Activity. Analyst 2002; 127(1): 183-98.
6- Paryab M, Raeeszadeh M. The Study of the Rate and Reasons of Medical Herb Use by the Patients Visiting the Specialized Treatment Centers in Fars Province in 2014. Community Health Journal 2016; 10(2): 62-71.
7- Zheng W, Wang SY. Antioxidant Activity and Phenolic Compounds in Selected Herbs. Journal of Agricultural and Food chemistry 2001; 49(11): 5165-70.
8- Ayoughi F, Barzegar M, Sahari M, Naghdi Badi H. Antioxidant Effect of Dill (Anethum Graveolens Boiss.) Oil in Crude Soybean Oil and Comparison with Chemical Antioxidants. J Med Plants 2009; 8(30): 71-83.
9- Tajali, F, Hemati Kakhki A, Khatamirad M, Garzani S, Garzani S. Study Antioxidantion Properties of Saffron Petal. In 18 Th National Congress on Food Tecnology. Mashhad: IR Iran 2008; 15-6.
10- Kamkar A. The Study of Antioxidant Activity of Essential Oil and Extract of Iranian Anethum Graveloens. Quarterly of Horizon of Medical Sciences 2009; 15(2): 11-16.
11- Sonboli A, Mojarrad M, Nejad Ebrahimi S, Enayat S. Free Radical Scavenging Activity and Total Phenolic Content of Methanolic Extracts from Male Inflorescence of Salix Aegyptiaca Grown in Iran. Iran J Pharm Res 2010; 3(9): 293-6.
12- Deng Z, Rong Y, Teng Y, Mu J, Zhuang X, Tseng M Broccoli-Derived Nanoparticle Inhibits Mouse Colitis by Activating Dendritic Cell AMP-Activated Protein Kinase. Mol Ther 2017; 25(7): 1641-54.
13- Koh E, Wimalasiri KMS, Chassy AW, Mitchell AE. Content of Ascorbic Acid, Quercetin, Kaempferol and Total Phenolics in Commercial Broccoli. Journal of food composition and analysis 2009; 22(7-8): 637-43.
14- Verma S, Mishra SN. Putrescine Alleviation of Growth in Salt Stressed Brassica Juncea by Inducing Antioxidative Defense System. J plant physiol 2005; 162(6): 669-77.
15- Nandini DB, Rao RS, Deepak BS, Reddy PB. Sulforaphane in Broccoli: the Green Chemoprevention!! Role in Cancer Prevention and Therapy. J Oral Maxillofac Pathol 2020; 24(2): 405.
16- Giacometti J, Kovačević DB, Putnik P, Gabrić D, Bilušić T, Krešić G, et al. Extraction of Bioactive Compounds and Essential Oils from Mediterranean Herbs by Conventional and Green Innovative Techniques: a Review. Food Research International 2018; 113: 245-62.
17- Ashrafpour M, Rezaei H, sefidgar A, Baradaran M, Sharifi H. Survey of the Antibacterial Properties of Aqueous Ethanolic and Methanolic Extraction of Artemisia Annua Around the City of Babol. Journal of Ilam University of Medical Sciences 2016; 23(6): 129-41.
18- Nonato CD, Camilo CJ, Leite DO, da Nobrega MG, Ribeiro-Filho J, de Menezes IR, Comparative analysis of chemical profiles and antioxidant activities of essential oils obtained from species of Lippia L. by chemometrics. Food Chemistry 2022; 384: 132614.
19- Rodríguez García S L, Raghavan V. Microwave-Assisted Extraction of Phenolic Compounds From Broccoli (Brassica Oleracea) Stems, Leaves, and Florets: Optimization, Characterization, and Comparison with Maceration Extraction. Recent Progress in Nutrition 2022; 2(2): 1-23.
20- Yu X, Ma F, Zhang L, Li P. Extraction and Quantification of Sulforaphane and Indole-3-Carbinol from Rapeseed Tissues Using Quechers Coupled with UHPLC-MS/MS. Molecules 2020; 25(9): 2149.
21- Bhagat SV, Varma ME, Patil RN. Study of Free Radical Scavenging Activity and Phytochemicals of the Methanol Extract of Broccoli (Brassica Oleracea). Research Journal of Pharmaceutical, Biological and Chemical Sciences 2012; 3(4): 623-28.
22- Raeeszadeh M, Mortazavi P. The Study of the Effect of Hydroalcholic Extracts of Broccoli on Lead Induced Oxidative Stress in Kidney of Mice. Razi Journal of Medical Sciences 2018; 25(9): 17-25. [Persian]
23- Karawya MS, Ammar NM, Hifnawy MS, Al-Okbi SY, Mohamed DA, El-Anssary AA. Phytochemical Study and Evaluation of the Anti-Inflammatory Activity of Some Medicinal Plants Growing in Egypt. Med J Islamic World Acad Sci 2010; 18(4): 139-50.
24- Singleton VL, Rossi JA. Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents. Am J Enol Vitic 1965; 16(3): 144-58.
25- Pourmorad F, Hosseinimehr SJ, Shahabimajd N. Antioxidant Activity, Phenol and Flavonoid Contents of Some Selected Iranian Medicinal Plants. African journal of biotechnology 2006; 5(11): 1142-45.
26- Cheng Z, Moore J, Yu L. High-Throughput Relative DPPH Radical Scavenging Capacity Assay. Journal of agricultural and food chemistry 2006; 54(20): 7429-36.
27- Raeeszadeh M, Beheshtipour J, Jamali R, Akbari A.The Antioxidant Properties of Alfalfa (Medicago Sativa L.) and Its Biochemical, Antioxidant, Anti-Inflammatory, and Pathological Effects on Nicotine-Induced Oxidative Stress in the Rat Liver. Oxid Med Cell Longev 2022; 2022: 2691577.
28- Ye J. Application of Gas Chromatography-Mass Spectrometry in Research of Traditional Chinese Medicine. Chemical Papers 2009; 63(5): 506-11.
29- Chiang WCK, Pusateri DJ , Leitz REA. Gas Chromatography/Mass Spectrometry Method for the Determination of Sulforaphane and Sulforaphane Nitrile in Broccoli. Journal of Agricultural and Food Chemistry 1998; 46(3): 1018-21.
30- Kumar S, Pandey AK. Chemistry and Biological Activities of Flavonoids: An Overview. Scientific World Journal 2013; 2013: 162750.
31- Ahmed S. I, Hayat M. Q, Tahir M, Mansoor Q, Ismail M, Keck K, Bates R. B.Pharmacologically Active Flavonoids from the Anticancer, Antioxidant and Antimicrobial Extracts of Cassia Angustifolia Vahl. BMC Complement Altern Med 2016; 16(1): 460.
32- Sun T, Powers JR, Tang J. Evaluation of the Antioxidant Activity of Asparagus, Broccoli and their Juices. Food chemistry 2007; 105(1): 101-6.
33- Raeeszadeh M, Karimi P, Khademi N, Mortazavi P. The Effect of Broccoli Extract in Arsenic-Induced Experimental Poisoning on the Hematological, Biochemical, And Electrophoretic Parameters of the Liver and Kidney of Rats. Evidence-Based Complementary And Alternative Medicine 2022; 20221-9.
34- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, and Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Scientific Journal of Ilam University of Medical Sciences 2019; 27(3): 91-100. [Persian]
35- Ahmed MF, Rao AS, Ahemad SR, Ibrahim M. Phytochemical Studies and Antioxidant Activities of Brassica Oleracea L. Var. Capitata. Int J Pharm Pharm Sci 2012; 4(3): 374-8.
36- Guo Jt, Lee Hl, Chiang Sh, Lin Fi, Chang Cy. Antioxidant Properties of the Extracts from Different Parts of Broccoli in Taiwan. Journal of food and drug analysis 2001; 9(2): 95-101.
37- Gawlik-Dziki U. Effect of Hydrothermal Treatment on the Antioxidant Properties of Broccoli (Brassica Oleracea Var. Botrytis Italica) Florets. Food Chem 2008; 109(2): 393-401.
38- Moreno DA, Carvajal M, López-Berenguer C, García-Viguera C. Chemical and Biological Characterisation of Nutraceutical Compounds of Broccoli. J Pharm Biomed Anal 2006; 41(5): 1508-22.
39- da Silva BV, Barreira JC, Oliveira MBP. Natural Phytochemicals and Probiotics as Bioactive Ingredients for Functional Foods: Extraction, Biochemistry and Protected-Delivery Technologies. Trends in Food Science & Technology 2016; 50: 144-58.
40- Zhang QW, Lin LG, Ye WC. Techniques for Extraction and Isolation of Natural Products: a Comprehensive Review. Chinese Medicine 2018; 13(1): 1-26.
41- Farag MA, Motaal AAA. Sulforaphane Composition, Cytotoxic and Antioxidant Activity of Crucifer Vegetables. Journal of Advanced Research 2010; 1(1): 65-70.
42- Swamy MK, Arumugam G, Kaur R, Ghasemzadeh A, Yusoff MM, Sinniah UR. GC-MS Based Metabolite Profiling, Antioxidant and Antimicrobial Properties of Different Solvent Extracts of Malaysian Plectranthus Amboinicus Leaves. Evid Based Complement Alternat Med 2017; 2017: 1517683.
43- Azizi Naser S, Amiri‐Besheli B, Sharifi‐Mehr S. The Isolation and Determination of Sulforaphane From Broccoli Tissues by Reverse Phase‐High Performance Liquid Chromatography. Journal of the Chinese Chemical Society 2011; 58(7): 906-10.
44- Barani M, Mirzaei M, Torkzadeh-Mahani M, Adeli-Sardou M. Evaluation of Carum-Loaded Niosomes on Breast Cancer Cells: Physicochemical Properties, in Vitro Cytotoxicity, Flow Cytometric, DNA Fragmentation and Cell Migration Assay. Sci Rep 2019; 9(1): 1-10.
45- Dai J, Mumper RJ. Plant Phenolics: Extraction, Analysis and their Antioxidant and Anticancer Properties. Molecules 2010; 15(10): 7313-52.
46- Raeeszadeh M, Nadia Khademi, Akbari A. The Effects of Broccoli and Caraway Extracts on Serum Oxidative Markers, Testicular Structure and Function, and Sperm Quality before and after Sperm Cryopreservation. Cryobiology 2021; 99: 11-19.
47- Raeeszadeh M, Karimi P, Khademi N, Mortazavi P. The Effect of Broccoli Extract in Arsenic-Induced Experimental Poisoning on the Hematological, Biochemical, and Electrophoretic Parameters of the Liver and Kidney of Rats. Evidence-Based Complementary and Alternative Medicine 2022; 2022: 1-9.
48- Raeeszadeh M, Mortazavi P. The Study of the Prominent Nephroprotective Effect of Methanolic Broccoli (Brassica Olaracea, Var. Italica) Extract on Oxidative-Lead Damage in Mice Kidney: Biochemical Parameters and Phatological Changes. Indian Journal of Experimental Biology (IJEB) 2021; 59(9): 626-32.
49- Qaderi Forough M, Raeeszadeh M, Amiri A. Dose-Response Changes of Brassica Oleracea Var. Italica Hydroalcholic Extract in the Control of Oxidative Stress by Induction of Diazinon on the Cells of Testicular Tissue in Male Adult Rat. JRUMS 2017; 16(7): 593-604.
50- Jeddi H. Study on the Effects of Ethanolic Extract of Broccoli on Oxidative Stress Induced by Acetaminophen in Rat Kidney. Veterinary Clinical Pathology The Quarterly Scientific Journal 2017; 11(2 (42) Summer): 145-57.
51- Guerrero-Beltrán CE, Mukhopadhyay P, Horváth B, Rajesh M, Tapia E, García-Torres I, Pacher P. Sulforaphane, a Natural Constituent of Broccoli, Prevents Cell Death and Inflammation in Nephropathy. The Journal of Nutritional Biochemistry 2012; 23(5): 494-500.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فارماکولوژی
دریافت: 1400/11/25 | پذیرش: 1401/3/29 | انتشار: 1402/2/15
دریافت: 1400/11/25 | پذیرش: 1401/3/29 | انتشار: 1402/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







