دوره 33، شماره 8 - ( آبان 1404 )
جلد 33 شماره 8 صفحات 9330-9317 |
برگشت به فهرست نسخه ها
Ethics code: IR.AJUMS.REC.1397.709
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hemmati E, Shanehsaz Z, Hashemzadeh M, Amirkhani A, Valian Baghgandomi F. Evaluation of the Effects of 70% Ethanol and Formalin Tablets on Dental Anesthesia Cartridges. JSSU 2025; 33 (8) :9317-9330
URL: http://jssu.ssu.ac.ir/article-1-6487-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6487-fa.html
همتی ارشاد، شانهساز زینب، هاشمزاده محمد، امیرخانی علیرضا، والیان باغ گندمی فائزه. بررسی اثر اتانول ۷۰٪ و قرص فرمالین بر کارتریجهای بیحسی دندانپزشکی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (8) :9317-9330
متن کامل [PDF 804 kb]
(140 دریافت)
| چکیده (HTML) (375 مشاهده)
References:
1- Silverman SJ. Infectious Disease and the Dental Office. Int Dent J 1987; 37(2): 87 93.
2- Cotton JA, Terezhalmy GT, Molinavi JA. Practical Infection Control in Dentistry. 2nd ed. Philadelphia: William & Wilkins 1996: 123-36.
3- Kuroda A, Takasaki K, Inoue T, Ojima T, Takashima E. Study on Hospital Infection Control in the Dental Clinic Environment. Bull Tokyo Dent Coll 1985; 26(3): 201 6.
4- Ijadi Mohammadi M, Asnaashari M, Hosseini MR. Survey of Knowledge and Performance of Dental Students at Shahid Beheshti Dental School Regarding Infection Control in Endodontic Procedures. J Dent Sch Shahid Beheshti Univ Med Sci 2003; 21(1): 35 41. [Persian]
5- Andersen BM, Bånrud H, Bøe E, Bjordal O, Drangsholt F. Comparison of UVC Light and Chemicals for Disinfection of Surfaces in Hospital Isolation Units. Infect Control Hosp Epidemiol 2006; 27(7): 729-34.
6- Shannon IL, Wescott WB. Alcohol Contamination of Local Anesthetic Cartridges. J Acad Gen Dent 1974; 22: 20-1.
7- Stutz N, Becker D, Jappe U, John SM, Ladwig A, Spornraft‐Ragaller P, et al. Nurses’ Perceptions of the Benefits and Adverse Effects of Hand Disinfection: Alcohol‐Based Hand Rubs Vs Hygienic Handwashing. Br J Dermatol 2009; 160(3): 565-72.
8- Ashofteh Yazdi K, Fathollah Zadeh B, Daneshvar S. Study of the Aerobic Contamination of Four Disposable Materials (Anesthetic Cartridge, Saliva Ejector Tip, Gutta Percha and Cotton Roll. J Dent Med 2005; 18(2): 81-6.
9- Basson NJ, Bester L, Van der Bijl P. External Bacterial Contamination of Local Anaesthetic Cartridges. SADJ 1999; 54(6): 253-6.
10- Buxton R. Blood Agar Plates and Hemolysis Protocols. Washington (DC): American Society for Microbiology; C2014 Available at: https://www.asmscience.org/content/education/protocol/protocol.2885. Accessed Oct 11, 2015.
11- Koneman EW, Allen SD, Janda WM, Procop GW, Schreckenberger PC, Woods GL. Koneman’s Color Atlas and Textbook of Diagnostic Microbiology. 7th ed. Philadelphia: Lippincott Williams & Wilkins; 2020: 376-82.
12- United States Pharmacopeia–National Formulary (USP–NF). 2024 ed. Rockville (MD): United States Pharmacopeial Convention; 2024. Available at: https://online.uspnf.com. Accessed Oct 11, 2025.
13- Vasudeva A, Sinha DJ, Tyagi SP, Singh NN, Garg P, Upadhyay D. Disinfection of Dentinal Tubules with 2% Chlorhexidine Gel, Calcium Hydroxide and Herbal Intracanal Medicaments Against Enterococcus Faecalis: An In-Vitro Study. Singapore Dent J 2017; 38: 39-44.
14- Rutala WA, Weber DJ. Guideline for disinfection and sterilization in healthcare facilities. Atlanta (GA): Centers for Disease Control and Prevention; 2008 Available at: https://www.cdc.gov/ infectioncontrol/ guidelines/disinfection/index.html. Accessed Oct 11, 2015.
15- Kohn WG, Collins AS, Cleveland JL, Harte JA, Eklund KJ, Malvitz DM. Guidelines for Infection Control in Dental Health-Care Settings—2003. MMWR Recomm Rep 2003; 52(RR-17): 1-61.
16- Gates WD, Goldschmidt M, Kramer D. Microbial Contamination in Four Commercially Available Denture Adhesives. J Prosthet Dent 1994; 71(2): 154-8.
17- Rosa AC, Brusca MI, Manto MC, Mosca CO, Nostri N. Effects of Handling and Storage on Sterile Dental Instruments. Acta Odontol Latinoam 2001; 14(1-2): 35-9.
18- De-Paiva CR, Bandeira RL, de Moura AL, Toda C, de Jesus GP. Evaluation of Disinfection Methods for Anesthetic Cartridges. J Oral Diagnosis 2002; 7(1): 1-7.
19- Shannon IL, Feller RP. Contamination of Local Anesthetic Carpules by Storage in Alcohol. Anesth Prog 1972; 19(1): 6-8.
20- Parnell JE. The Effect of Prolonged Storage of Local Anesthetic Cartridges in Alcohol. J Houston Dist Dent Soc 1970; 42(3): 6-9.
21- Kelly JR, Dalm GW. Stability of Epinephrine in Dental Anesthetic Solutions: Implications for Autoclave Sterilization and Elevated Temperature Storage. Mil Med 1985; 150(2): 112-4.
22- Bridenbaugh LD, Moore DC. Does Repeated Heat Sterilization of Local Anesthetic Drugs Affect Potency? Anesthesiology 1964; 25: 372-6.
23- Bridenbaugh LD, Moore DC. Is Heat Sterilization of Local Anesthetic Drugs A Necessity? JAMA 1958; 168(10): 1334-7.
24- Chutter RJ. The Rationale and Method for Autoclaving Anesthetic Cartridges for Surgical Trays. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105(1): e1-4.
25- Astra Pharmaceutical Products Inc. Basic data sheet. Worcester (MA): Astra Pharmaceutical Products Inc; 1998. Available from: https:// www.astrazeneca.com/. Accessed Oct 11, 2025
26- Graham Chemical Corp. Basic Data Sheet. Springfield Gardens (NY): Graham Chemical Corp; 1998. Available at: https:// www.grahamchemical.com/. Accessed Oct 11, 2025.
27- Khorakian F, Movahed T, Ghazvini K, Karbasi S, Tabrizi Nouri S, Bahramian L, et al. Evaluation of Frequency of Microbial Contamination in Clinical Setting Surface in Dental School of Mashhad University of Medical Sciences. J Mashhad Dental School 2017; 41(3): 209-18. [Persian]
28- Patiño-Marín N, Villa García LD, Aguirre López EC, Medina-Solís CE, Martínez Zumarán A, Martínez Rider R, et al. Sterilization and Disinfection: Ensuring Infection Control in Dental Practices. Cureus 2025; 17(2): e79041.
متن کامل: (86 مشاهده)
مقدمه
کنترل عفونت به لحاظ رابطه نزدیکی که با درمانهای دندانپزشکی دارد همواره در محافل علمی و حقوقی دنیا مورد توجه خاص بوده است (1). یکــی از نیازهــای مطــرح درکنتــرل عفونــت محیــط دندانپزشــکی ضــد عفونــی کــردن ســطوح و ابــزار غیــر بحرانــی و نیمــه بحرانــی در فواصــل بیــن بیمــاران اســت (2). مسأله نظارت بر سیستم های استریل کننده شناخته شده است و مقالات متعددی در این مورد و نیز انواع شاخصهای نظارت با عنوانهای بیولوژیکی شیمیایی چند منظوره یا تک شاخصی وجود دارد (3). اما در رابطه با آلودگی میکروبی یا ویروسی در مواد مصرفی در دندانپزشکی (بهخصوص مواد یکبار مصرف) کمتر تحقیقی انجام پذیرفته است. با وجود پیشرفتهای وسیع در زمینه کنترل عفونت طی سالهای اخیر، هنوز مشکلات زیادی در سطح دانشکدهها، کلینیکها و مطبها وجود دارد. یکی از این کمبودها در این زمینه عدم وجود ارزیابی عفونتهای میکروبی در دانشکدهها میباشد (4). در دندانپزشکی، تزریقهای بیحسی از طریق کارتریجهای بیحسی دندانپزشکی انجام میشود. این کارتریجها امروزه تحت عنوان کارپولهای دندانپزشکی نامیده میشوند و به عنوان فاکتوری برای دسترسی به بیحسی موضعی در مطبهای دندانپزشکی یک مزیت بزرگ محسوب میشوند (5). با توجه به اینکه کارپول بیحسی موضعی مصرف عمومی در رشتههای گوناگون دندانپزشکی دارد ؛ آلودگی سطح خارجی این کارتریجها میتواند از موارد چالشبرانگیز این علم باشد. از طرف دیگر کارخانجات داروسازی تنها استریل بودن ماده بیحسی را تضمین میکنند و هیچگونه تضمینی نسبت به استریلیتی سطح خارجی آن نداشته و به استفاده از مواد ضد عفونی کننده همچون ایزوپروپیل الکل 90% و یا الکل اتیلیک 70% قبل از کاربری توصیه میکنند (6). مواد شیمیایی مانند الکل از ضدعفونی کننده های رایج هستند که بهصورت محلول استفاده میشوند، اما استفاده از این مواد شیمیایی وقتگیر بوده و با آزاد کردن ترکیبات آلی فرار مضر میباشند. بهعلاوه مطالعات نشان دادهاند که مواد شیمیایی به تنهایی موثر و کارآمد نمیباشند (7). پژوهشهای پیشین نیز به بررسی آلودگی میکروبی مواد مصرفی دندانپزشکی، از جمله کارپولها، پرداختهاند. به عنوان مثال، یزدی و همکاران (8) در مطالعه خود به آلودگی میکروبی کارپولها و سایر مواد مصرفی اشاره کردند. همچنین، Basson و همکاران (9) نیز به بررسی آلودگی میکروبی سطح خارجی کارتریجهای بیحسی پرداختند و وجود باکتریهایی را بر روی آنها گزارش کردند. با توجه به مطالب ذکر شده، انتخــاب ضدعفونــی کننــده مناســب و بهکارگیــری روشهــای اســتاندارد گندزدایــی مــیتوانــد در کاهــش عفونــت نقــش موثــری داشــته باشــد. هدف از مطالعه حاضر بررسی اثر مواد مختلف ضد عفونی کننده بر مواد بیحسی دندانپزشکی و تاثیرشان بر آلودگیهای میکروبی مواد بیحسی دندانپزشکی میباشد.
روش بررسی
مطالعه حاضر بهصورت تجربی-آزمایشگاهی (in vitro) بوده که جهت انجام از سه برند ایرانی،اسپانیایی و کلمبیایی هر کدام 9 عدد کارپول تهیه شد.بخشی از این کارپولها به عنوان گروه کنترل و بدون اعمال ضدعفونیکننده جهت بررسی آلودگی میکروبی اولیه مورد کشت قرار گرفتند. مابقی کارپولها پس از اعمال اتانول 70% یا فرمالین، جهت ارزیابی اثربخشی این مواد ضدعفونی کننده، کشت میکروبی شدند. این مراحل در آزمایشگاه گروه میکروبشناسی دانشکده پزشکی صورت گرفت .پس از انجام تستهای میکروبی ، کارپولها جهت ادامه بررسی از جهت نفوذ اتانول 70% و فرمالین به دانشکده داروسازی منتقل شدند.
روش اجرای تحقیق:
در این تحقیق آزمایشگاهی؛ تعداد 27 کارپول به منظور بررسی تاثیر مواد ضدعفونی کننده اتانول 70% (شرکت جهان الکل ایران) و قرصهای فرمالین (شرکت Merck آلمان) بر آلودگیهای میکروبی مواد بیحسی دندانپزشکی و همچنین نفوذ این مواد به کارپولها بهکار گرفته شدند. تعداد 9 عدد کارپول ایرانی (شرکت داروپخش ایران)، 9 عدد کارپول اسپانیایی (شرکت Inibsa اسپانیا) و 9 عدد کارپول کلمبیایی (شرکت New Stetic S.A کلمبیا) در مجموع مورد ارزیابی قرار گرفتند. تمامی کارپولها مستقیماً از بستهبندی اصلی و استریل خود خارج شده و با رعایت کامل اصول آسپتیک، از هرگونه تماس غیرضروری با سطوح یا دستها تا پیش از شروع فرآیند آزمایش جلوگیری بهعمل آمد. این اقدام به منظور به حداقل رساندن احتمال آلودگی ثانویه در مراحل ابتدایی مطالعه صورت گرفت. محیطهای کشت بلاد آگار، مککانکی آگار و Tryptic Soy Broth( TSB) از شرکت Merck آلمان تهیه شدند. برای انجام آزمایش از سواپهای استریل، لولههای آزمایش، اتوکلاو، انکوباتور و دستگاه HPLC ،کروماتوگراف مایع با کارایی بالا ٬مدل LC-2000 از شرکت JASCO، مجهز به آشکارساز UV/VIS استفاده شد. گروهبندی نمونهها بهصورت زیر انجام شد:
A1 : سه کارپول ایرانی (کنترل بدون ضدعفونی)
:A2 سه کارپول ایرانی غوطهور در اتانول ۷۰٪
A3 : سه کارپول ایرانی قرار گرفته در ظرف حاوی قرص فرمالین
B1 : سه کارپول اسپانیایی (کنترل بدون ضدعفونی)
B2 : سه کارپول اسپانیایی غوطهور در اتانول ۷۰٪
B3 : سه کارپول اسپانیایی در ظرف حاوی قرص فرمالین
C1 : سه کارپول کلمبیایی (کنترل بدون ضدعفونی)
C2 : سه کارپول کلمبیایی غوطهور در اتانول ۷۰٪
C3 : سه کارپول کلمبیایی در ظرف حاوی قرص فرمالین
محیطهای کشت بلاد آگار، مک کانکی آگار و TSB طبق دستورالعملهای استاندارد آمادهسازی شدند (12-10). قبل از انجام آزمایش، لولههای آزمایش در اتوکلاو با دمای 121 درجه سانتیگراد به مدت 15 دقیقه و سواپها نیز بهطور جداگانه در لولههای آزمایش قرار داده و در مدت زمان و درجه حرارت ذکر شده استریل شدند.
ارزیابی آلودگی میکروبی اولیه در گروههای کنترل (A1 B1, C1): پیش از اعمال هرگونه ماده ضدعفونی کننده، از هر ۹ کارپول متعلق به گروههای کنترل (A1, B1, C1) نمونهبرداری اولیه انجام شد تا آلودگی میکروبی سطحی آنها مشخص گردد. این فرآیند با استفاده از سه سواپ استریل) با نوک مرطوب شده با سالین استریل از سه قسمت مجزای هر کارپول انجام گرفت: شامل سطح لوله شیشهای استوانهای، سرپوش آلومینیومی دیافراگم، و پیستون پلاستیکی. هر سواپ بلافاصله پس از نمونهبرداری، به یک لوله حاوی ۵ میلیلیتر محیط کشت تریپتیکاز سوی براث (TSB) منتقل شد. این ۹ کارپول، پس از نمونهبرداری اولیه، هیچگونه ماده ضدعفونی دیگری دریافت نکردند و صرفاً در شرایط محیطی مشابه (دمای ۲۵ درجه سانتیگراد) به مدت ۲۴ ساعت نگهداری شدند. هدف از این بخش، تعیین میزان آلودگی میکروبی پایهای کارپولهای هر برند قبل از هرگونه مداخله بود.
گروههای اتانول ) A2, B2, C2, مجموعاًn=9: (کارپولهای این گروهها مستقیماً و بدون نمونهبرداری اولیه، تحت فرآیند ضدعفونی با اتانول قرار گرفتند. کارپولها تحت شرایط استریل از بستهبندی خارج شده و بهطور کامل در ظروف استریل حاوی ۱۰ میلیلیتر اتانول ۷۰% در دمای اتاق )۲۵ درجه سانتیگراد) بهمدت ۲۴ ساعت غوطهور شدند.
گروههای فرمالین A3, B3, C3, (مجموعاً n=9: )کارپولهای این گروهها نیز مستقیماً و بدون نمونهبرداری اولیه، تحت فرآیند ضدعفونی با قرص فرمالین قرار گرفتند. در شرایط استریل، کارپولها در ظروف دربسته (پتری دیش استریل) که حاوی یک قرص فرمالین ۲ گرمی بود، در همان دمای ۲۵ درجه سانتیگراد و به مدت ۲۴ ساعت در معرض بخارات فرمالین قرار گرفتند. در تمامی گروه های اتانول و فرمالین، مدت زمان تماس با ماده ضد عفونی کننده به صورت مداوم ۲۴ ساعت بود و هیچ گونه تغییری در این بازه زمانی صورت نگرفت. پس از گذشت ۲۴ ساعت از زمان اعمال مواد ضدعفونیکننده برای گروههای اتانول و فرمالین، از هر کارپول در این گروهها، نمونهبرداری ثانویه انجام شد. این نمونهبرداری با استفاده از سه سواپ استریل جدید از همان سه قسمت ذکر شده (سطح لوله شیشهای استوانهای، سرپوش آلومینیومی دیافراگم، و پیستون پلاستیکی) صورت گرفت. سواپهای حاصل بلافاصله به لولههای حاوی ۵ میلیلیتر TSB جداگانه منتقل و به عنوان نمونه “بعد از ضدعفونی” ثبت گردیدند.
کشت و شناسایی میکروبی: سواپهای جمعآوری شده از هر دو مرحله (نمونهبرداری اولیه از گروههای کنترل و نمونهبرداری پس از ضدعفونی از گروههای اتانول و فرمالین) که در لولههای حاوی TSB قرار داده شده بودند، بهمدت ۲۴ ساعت در دمای ۳۷ درجه سانتیگراد بهصورت ساکن (static incubation) انکوبه شدند. این مرحله به منظور غنیسازی و افزایش تعداد میکروارگانیسمهای احتمالی موجود در نمونهها انجام گرفت. پس از مرحله غنیسازی در TSB، به منظور ارزیابی دقیق آلودگی میکروبی، با استفاده از سواپ استریل، از هر لوله TSB به روش کشت خطی (Streak culture) بر روی پلیتهای حاوی محیط کشت بلاد آگار (Blood Agar) و مککانکی آگار (MacConkey Agar) کشت داده شد. انتخاب این محیطها به منظور امکان رشد و تفکیک انواع مختلف باکتریها (شامل باکتریهای گرم مثبت و گرم منفی) صورت گرفت .پلیتهای بلاد آگار و مککانکی آگار پس از کشت، بهمدت ۲۴ ساعت در دمای ۳۷ درجه سانتیگراد در انکوباتور انکوبه شدند. پس از انکوباسیون، کلنیهای میکروبی رشد یافته با استفاده از رنگآمیزی گرم مورد بررسی قرار گرفتند و از آنجا که شناسایی گونه های باکتری رشد یافته جز اهداف کار نبود تستهای بیوشیمیایی کامل برای شناسایی گونهها انجام نگرفت (15-13). در مرحله بعد با استفاده از تکنیک (HPLC) کروماتوگرافی مایع با کارایی بالا٬ میزان نفوذ این مواد ضد عفونی کننده بعد از ۲۴ ساعت در درون کارپولها مورد بررسی قرار گرفت.۱۰۰ میکرولیتر از نمونه (محتویات کارپولهای تحت ضدعفونی) یا محلولهای استاندارد اتانول و فرمالین به یک میکروتیوب 1/5 میلیلیتری منتقل شد.۲۰۰ میکرولیتر از حلال استونیتریل به نمونهها اضافه و به مدت ۲ دقیقه بهخوبی هم زده شد تا ترکیبات مزاحم یا پروتئینهای احتمالی رسوب کنند.نمونهها تحت نیروی گریز از مرکز ۱۵۰۰g و به مدت ۵ دقیقه در دمای اتاق سانتریفیوژ شدند. محلول رویی (فاز شفاف حاوی آنالیتها) به دقت از رسوب جدا شده و به یک میکروتیوب تمیز جدید منتقل گردید. برای حصول اطمینان کامل از حذف تمامی ذرات و رسوبات، محلول رویی مجدداً تحت همان شرایط (۱۵۰۰g، ۵ دقیقه) سانتریفیوژ شد. در نهایت، ۵۰ میکرولیتر از محلول رویی کاملاً شفاف و عاری از رسوب، به دستگاه HPLC تزریق گردید.
شرایط کروماتوگرافی: فاز متحرک متشکل از مخلوط استونیتریل و بافر فسفات با نسبت حجمی ۴۰:۶۰ )به ترتیب( بود. هر دو جزء فاز متحرک پیش از استفاده توسط فیلتر 0/45 میکرومتری صاف نرم افزار آشده و سپس به مدت ۱۵ دقیقه در حمام اولتراسونیک برای هواگیری قرار داده شدند. در خصوص فاز ساکن ستون کروماتوگرافی معکوس C18 ec Nucleodur® با ابعاد ۲۵۰ میلیمتر طول و 4/6 میلیمتر قطر داخلی، و اندازه ذرات ۵ میکرون (تولید شرکت MACHEREY-NAGEL EURL فرانسه) استفاده شد. شناسایی و اندازهگیری فرمالین در طول موج ۲۲۱ نانومتر و اتانول در طول موج ۲۴۲ نانومتر با استفاده از آشکارساز UV/VIS انجام گرفت. سرعت جریان فاز متحرک 1/5 میلیلیتر در دقیقه تنظیم گردید. فرآیند کروماتوگرافی در دمای معمول آزمایشگاه صورت پذیرفت. پیش از هر تزریق نمونه، ستون با جریان فاز متحرک به تعادل رسیده تا خط پایه پایدار و مناسبی برای آنالیز به دست آید.
تجزیه و تحلیل آماری
دادهها با استفاده از نرمافزار آماری version 16 SPSS و آزمون آماری Kruskal-Wallis test تجزیه و تحلیل شدند به علت کم بودن تعداد نمونهها از آنالیز آماری غیرپارامتری Kruskal-Wallis test برای بررسی و مقایسه استفاده شد.
نتایج
در این مطالعه، کشت میکروبی از ۲۷ کارپول تهیه شده از سه برند اسپانیایی، کلمبیایی و ایرانی انجام شد. این کارپولها به سه گروه اصلی تقسیمبندی شده بودند: ۹ نمونه کنترل (بدون قرارگیری در معرض ضدعفونی کننده)، ۹ نمونه ضدعفونی شده با اتانول70% و ۹ نمونه ضدعفونی شده با قرص فرمالین. برای ارزیابی آلودگی میکروبی از روش کشت خطی به دنبال غنیسازی در TSB استفاده شد. از میان ۹ کارپول گروه کنترل که در هیچ ماده ضدعفونیکنندهای قرار نگرفته و صرفاً برای بررسی آلودگی اولیه نمونهبرداری شده بودند، ۲ مورد (شامل یک کارپول ایرانی و یک کارپول کلمبیایی) دارای کشت میکروبی مثبت بودند. این یافته نشاندهنده وجود آلودگی میکروبی اولیه در سطح این کارپولها پیش از هرگونه اعمال ضدعفونی است. در مقابل، نتایج حاکی از آن بود که تمامی ۱۸ کارپول ضدعفونی شده (شامل ۹ نمونه ضدعفونی شده با اتانول 70% و ۹ نمونه ضدعفونی شده با قرص فرمالین( پس از ۲۴ ساعت، کشت میکروبی منفی را نشان دادند. این یافته بهوضوح اثربخشی کامل هر دو ماده ضدعفونیکننده اتانول و فرمالین را در شرایط آزمایشگاهی این مطالعه، در حذف آلودگیهای میکروبی سطحی کارپولهای بیحسی دندانپزشکی، نشان میدهد. تحت شرایط کروماتوگرافی مطالعه حاضر، پیک فرمالین در زمان 0/16± 7/45 (انحراف معیار±میانگین) و پیک اتانول (استاندارد داخلی) در زمان 0/12±6/53 دقیقه مشاهده میشود و نیز به ترتیب نمونههای استاندارد با غلظت 0/1 و 100 میکروگرم در میلیلیتر نشان داده شده است. در نمودارهای زیر کروماتوگرام حاوی فرمالین و اتانول نشان داده شده است. با استفاده از روش استخراج نمونه مورد استفاده، حداقل حد تعیین مقدار کمی بر اساس پیک معادل 10 برابر نسبت پاسخ دستگاه به نوسانات زمینهای که تکرارپذیری مناسبی داشته باشد 0.1 میکرو گرم در میلیلیتر تعیین شد. منحنی استاندارد تعیین مقدار فرمالین و اتانول به ترتیب در نمودارهای 5 و 6 ارائه شده است. مقادیر تعیین شده فرمالین و اتانول در ویال داروها بهترتیب در جداول 1 و 2 گزارش شده است. مقایسه تفاوت معنیداری را در مقادیر فرمالین در گروهها (P=0.0036) و مقادیر اتانول در گروهها (P=0.0037) نشان داد. نتایج حاکی از آن است که نمونههای اسپانیایی کمترین و نمونه کلمبیایی و ایرانی بیشترین مقدار از فرمالین و الکل را دارا بودند.

نمودار1: کروماتوگرام استاندارد فرمالین با غلظت 0.1 میکروگرم در میلیلیتر (حد تعیین مقدار کمی)
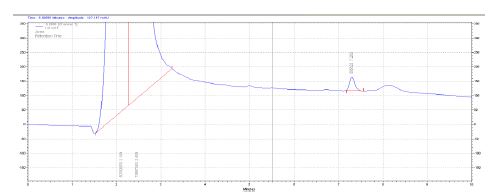
نمودار2: کروماتوگرام استاندارد فرمالین با غلظت 100 میکروگرم در میلیلیتر
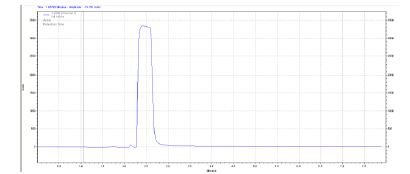
نمودار3: کروماتوگرام استاندارد اتانول با غلظت 0.1 میکروگرم در میلیلیتر (حد تعیین مقدار کمی)
.JPG)
نمودار4: کروماتوگرام استاندارد اتانول با غلظت 100 میکروگرم در میلیلیتر

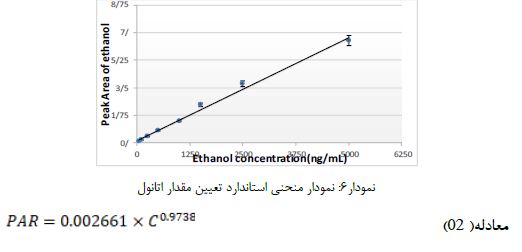
نمودار6: نمودار منحنی استاندارد تعیین مقدار اتانول

بحث
با توجه به اینکه برخی از گونههای میکروبی اسپورهای مقاومی دارند ممکن است در صورت عدم استریلیزاسیون مناسب، آلودگی میکروبی باقی بماند. Gates و همکاران آلودگی میکروبی را در چهار نوع تجاری پودرهای چسب دنچر بررسی کردند. تمام پودرها حاوی میکروارگانیسم بودند و رشد باکتریال و همینطور رشد قارچ مشاهده شد (16).در مطالعهای که Rosa و همکاران در رابطه با نگهداری وسایل دندانپزشکی بهصورت استریل انجام دادند، نتیجه گرفتند که اگر وسایل پس از استریلیزاسیون در بستهها و پاکتهای مخصوص فور یا اتوکلاو در کابینتهای دربسته نگهداری شوند تا صد و هشتاد روز همچنان استریل باقی می مانند و در صورتیکه پارگی یا بازشدگی بستهها پیش بیاید استریلیتی از بین میرود و این آلودگی به مرور زمان بیشتر میشود (17). لذا در مطالعه حاضر اقدام به بررسی اثر دو نوع ماده ضدعفونی کننده بر کارتریجهای بیحسی دندانپزشکی شد. در مرحله اول اثر ضد میکروبی مواد ضد عفونی کننده مورد بررسی قرار گرفت. سپس میزان نفوذ این مواد به درون کارپولها با استفاده از دستگاهHPLC مورد ارزیابی قرارگرفت. از میان 9 نمونه گرفته شده که در هیچ ماده ضدعفونی کننده قرار نگرفته بودند 2 کارپول آلوده بودند که شامل یک کارپول ایرانی و یک کارپول کلمبیایی بود. این یافته بیانگر احتمال وجود آلودگی میکروبی در کارپولهای بدون ضدعفونی کننده است. همچنین تمامی 18 کارپول ضد عفونی شده (۹عدد با اتانول ۷۰% و ۹ عدد با فرمالین ) از لحاظ کشت میکروبی منفی بودند . این نتیجه٬ اثربخشی قابلتوجه اتانول ۷۰% و فرمالین را در از بین بردن آلودگی های میکروبی سطحی کارپولها تایید میکند. این یافته با نتایج مطالعات اخیر مانند “Evaluation of disinfection methods for anesthetic cartridges” در سال 2016 که اثربخشی الکل 70% را در ضدعفونی کارتریجها نشان داده است، همسو میباشد.*از این تعداد نمونه و پاسخها مشخص میشود که روند ساخت کارپولها دارای اشکال میباشد. همچنین چون شرایط نمونهگیری کاملا استریل بود میتوان نتیجه گرفت که این آلودگیها از محیط به آنها اضافه نشده است. بنابراین مواد و وسایل دندانپزشکی باید به نحوی طراحی، ساخته و ارائه شوند که انتقال آلوده کنندهها به بیمار وحتی پرسنل محیط کار دندانپزشکی به حداقل برسد و سیستم بستهبندی برای وسایل استریل دندانپزشکی باید اطمینانبخش باشد (18). تجزیه و تحلیل با استفاده از HPLC نشان داد که تفاوت آماری معنیداری در میزان نفوذ فرمالین (P=0.0036) و اتانول (P=0.0037) بین برندهای مختلف کارپول وجود دارد. کارپولهای اسپانیایی کمترین میزان نفوذ فرمالین را نشان دادند ( 0/1≤µg/ml)، در حالیکه کارپولهای کلمبیایی (میانگین µg/ml10) و ایرانی (میانگین µg/ml60) میزان نفوذ بسیار بالاتری داشتند. بهطور مشابه، کارپولهای اسپانیایی کمترین میزان نفوذ اتانول را داشتند (میانگین µg/ml20) در حالیکه کارپولهای کلمبیایی (میانگین µg/37) و ایرانی (میانگین µg/ml87) میزان نفوذ بیشتری را نشان دادند. بهطورکلی، نتایج حاکی از آن است که کارپولهای اسپانیایی کمترین و کارپولهای کلمبیایی و ایرانی بیشترین مقدار نفوذ فرمالین و الکل را در بازه زمانی 24 ساعته داشتهاند. این تفاوت در نفوذ میتواند تحت تاثیر عوامل متعددی از جمله تفاوت در مواد سازنده، ضخامت دیواره، یا ساختار دیافراگم کارپولها باشد که نیازمند بررسی بیشتر در مطالعات آتی است. Yazdi و همکاران نیز به بررسی آلودگی میکروبی چهار ماده مصرفی دندانپزشکی شامل گوتاپرکا، ساکشن، کارپول و رول پنبه پرداختند. از 48 مورد کارپول، 1 مورد آلوده به کوکسی گرم مثبت کواگولاز منفی بود. در 2 مورد استرپتوکوک ویریدانس و در 2 مورد آلودگی به باسیل گرم مثبت سرئوس مشهود بود؛ همچنین از 48 مورد گوتاپرکا، 2 مورد آلودگی به باسیل گرم مثبت سرئوس نشان داده شد. بهنظر میرسد آلودگی بیشتر در نمونههای یزدی و همکاران، به دلیل حجم نمونه بزرگتر آنها نسبت به مطالعه ما باشد(8)Shannon در مطالعهای به بررسی آلودگی میکروبی سطح خارجی کارتریجهای بیحسی پرداخت و غلظت متوسط الکل را پس از 12 هفته غوطهوری در الکل۷۰%، 7/57 میکروگرم در روز گزارش کرد (۱۹). Parnell در سال 1969 در آمریکا، یک مطالعه مشابه غوطهورسازی کارپول بیحسی موضعی در ایزوپروپیل الکل 91% بهمدت پنجاه روزانجام داد که نتیجه میانگین بیش از 5/0% ایزوپروپیل الکل 91% در هر کارپول بیحسی بود (20). میزان نفوذ الکل در این دو مطالعه از مطالعه ما بیشتر بوده است که میتواند به علت مدت زمان طولانیتر غوطهورسازی کارپولها درون الکل باشد. Kelly و Dalm ثبات اپینفرین موجود در محلولهای بیحسی موضعی در استریلیزاسیون به روش اتوکلاو را بررسی کردند و گزارش کردند که حدود 5% اپی نفرین در صورت قرار گرفتن در اتوکلاو حدود 30 دقیقه تحت دمای 121 درجه از دست میرود (12). Bridenbaugh در آمریکا مطالعه مشابهی در سال 1964 به منظور هدف قرار دادن اثرات استرلیزاسیون گرما روی تواناییهای داروهای بیحسی موضعی صورت گرفت. آنها گزارشی که در سال 1958 انجام داده بودند بهروزرسانی کردند؛ به این شکل که اینبار به جای دمای 121 درجه سانتیگراد در دمای 135 درجه سانتیگراد برای مدت 30 دقیقه در اتوکلاو قرار دادند. آنها در این مطالعه از 6 ماده بیحسی موضعی رایج استفاده کردند و اظهار داشتند که این 6 ماده می توانند حداقل 6 بار برای مدت 3 ساعت بدون آسیب رسیدن به توانایی خود اتوکلاو شوند (22). Bridenbaugh در سال 1958 در آمریکا مطالعهای در مورد اینکه آیا استرلیزاسیون گرمایی برای داروهای بیحسی موضعی لازم است یا خیر انجام داد. برای این مطالعه آنها 121 پرسش نامه به بیمارستانها ارسال کردند و 101 پرسشنامه پس از پاسخ دریافت کردند. در این بررسی مشاهده شد که 33 بیمارستان از روش اتوکلاوینگ و 68 بیمارستان دیگر از روش استرلیزاسیون سرما استفاده میکنند. آنها گزارش دادند که ماده بیحسی معمول میتواند حداقل یک بار اتوکلاو شود بدون اینکه اثرات قابلتوجهی در توانایی آن ایجاد شود و استریلیزاسیون به روش گرما برای دارو و تجهیزات مورد استفاده اجباری است (23). Reinald و Chutter در سال 2008 در آمریکا یک مطالعه تحت عنوان روش اتوکلاوینگ کارتریج بیحسی برای سینی های جراحی در انجام دادند که در این مطالعه از اتوکلاو کردن کارتریج استفاده شد. برای این کار از لیدوکایین 2% و اپی نفرین 1/100000 استفاده شد. پس از انجام پروسه اتوکلاوینگ دیده شد که 5% اپی نفرین از دست رفت، با این وجود شروع سریع و تاثیرگذار و طول مدت بیحسی مشابه قبل است (24). نتایج این مطالعه که بعد از غوطهورسازی در اتانول 70% و قرصهای فرمالین صورت گرفت، نشت و نفوذ این مواد را به داخل کارپول بیحسی تایید میکنند که کارپولهای شرکت اسپانیایی کمترین وکارپولهای شرکت کلمبیایی و ایرانی بیشترین میزان نفوذ را دارا بودند. میزان نفوذ در کارپولها ممکن است در ارتباط با کیفیت ساخت کارپولها از لحاظ دیافراگم و پیستون پلاستیکی و همینطور زمان انجام آزمایش باشد. بهطورکلی تولیید کنندگان لیدوکایین به حداقل زمان ده دقیقه غوطهورسازی در محلول ضد عفونی کننده پیشنهاد می کنند (25،26). نتایج مطالعه حاضر نشان داد که میزان آلودگی میکروبی مثبت در کارپولهای بیحسی دندانپزشکی، بهویژه مربوط به کارپول برند ایرانی و کلمبیایی بوده است. این یافته، اهمیت کنترل عفونت در محیط دندانپزشکی را بیش از پیش آشکار میسازد. همانطور که در مطالعه “بررسی فراوانی آلودگی میکروبی سطوح محیط کار کلینیکی در دانشکده دندانپزشکی، دانشگاه علوم پزشکی مشهد در سال (2014) توسط خوراکیان و همکاران نیز تأکید شده است، سطوحی که بهطور شایع هنگام کار دندانپزشکی لمس میشوند میتوانند به عنوان منبع انتقال عفونت عمل کرده و موجب ایجاد عفونت متقاطع گردند (۲۷). آلودگی مواد مورد استفاده در چند مرحله از فرآیند تولید تا مصرف امکانپذیر است. با توجه به اهمیتی که کارپول از نظر استفاده در عمل تزریق مستقیم به نسوج بدن دارد و میتواند باعث آلودگی احتمالی گردد، ساخت و مواد اولیه آن حتیالامکان باید استریل و عاری از عفونت باشد. بستهبندی و لفافه آلومینیومی کارپولها میتواند از آلوده شدن آنها جلوگیری کند؛ اما از آنجا که کارپولها در بستههای چهارتایی ارائه میشوند و برای تحویل یا استفاده میبایست از هم مجزا شوند، در نتیجه احتمال پاره شدن لفافه در این مسیر همیشه وجود دارد. آلودگیهای یافت شده در این قسمت، مؤید این ظن است که با پاره شدن لفافه آلومینیومی، کارپولها احتمالاً با دست و یا آلودگیهای محیطی آلوده شده باشند. این موضوع ضرورت بررسیهای میکروبیولوژیکی دقیقتر و پروتکلهای سختگیرانهتر کنترل کیفیت را در فرآیندهای تولید، بستهبندی و نگهداری کارپولها برجسته میسازد. این امر بر اهمیت رعایت اصول گندزدایی و استریلیزاسیون در دندانپزشکی تاکید دارد، چرا که عفونت میتواند از طرق مختلفی به بیماران و پرسنل منتقل شود. در راستای اهمیت کنترل آلودگی، مطالعه حاضر به بررسی اثربخشی اتانول 70% و قرص فرمالین در کنترل این آلودگیها پرداخت. مشاهده کشت میکروبی منفی در تمامی 18 کارپول ضدعفونی شده با اتانول 70% یا قرص فرمالین پس از 24 ساعت، بهطور قاطع اثربخشی بالای این دو ماده را در حذف آلودگیهای باکتریایی سطحی کارپولها نشان میدهد. این نتایج با اصول کلی ضدعفونی که در مقالات مروری نظیر Patino-Marin و همکاران (۲۸) همخوانی دارد که تمیز کردن و ضدعفونی ابزارهای دندانپزشکی را قبل از استفاده مجدد برای جلوگیری از انتقال آلودگی حیاتی میدانند. همچنین، در مقالات ذکر شده، بر این نکته تأکید شده است که برای حصول حداکثر اثربخشی، فرآیند ضدعفونی باید پس از تمیز کردن اولیه و حذف آلودگیهای قابل مشاهده انجام شود، که این رویکرد در روش کار ما نیز رعایت گردید. تفاوت در میزان نفوذ مواد ضدعفونیکننده به درون کارپولها بر اساس برند، که کارپولهای اسپانیایی کمترین نفوذ و کارپولهای کلمبیایی و ایرانی بیشترین نفوذ را نشان دادند، میتواند به تفاوت در ساختار مواد پلیمری یا طراحی کارپولها مرتبط باشد. این یافته از جنبه بالینی حائز اهمیت است، زیرا نفوذ کمتر مواد ضدعفونیکننده به داخل کارپول، خطر تعامل این مواد با داروی بیحسی و ایجاد عوارض جانبی احتمالی را کاهش میدهد، هرچند که در مطالعه حاضر میزان نفوذ در تمامی برندها در محدوده ایمن قرار داشت و پایینتر از آستانه سمیت برای بیحسکنندههای دندانی بود. این نتایج، مؤید این مطلب است که صرف تجاری بودن برای اطمینان از استریل بودن این وسایل کافی نیست. با توجه به احتمال بیماریزا بودن باکتریهای یافت شده و ضعف سیستم ایمنی بیماران مراجعهکننده به مطبهای دندانپزشکی، ضمن استفاده از مواد و وسایل با برچسب اطمینان استریل، از مواد ضدعفونیکننده مناسب قبل از استفاده از این وسایل نیز استفاده گردد. با این تفاسیر، با توجه به اثربخشی مواد ضدعفونیکننده مورد بررسی در مطالعه حاضر، میتوان نتیجه گرفت که با رعایت پروتکلهای مناسب ضدعفونی، میتوان بهطور موثری از انتقال آلودگیهای باکتریایی از طریق کارپولهای بیحسی جلوگیری کرد و به حفظ سلامت بیماران و پرسنل کمک شایانی نمود.
محدودیتهای مطالعه: در مطالعه حاضر، به دلیل محدودیت در دسترسی به دادههای کشتهای میکروبی پیش از اعمال ضدعفونیکنندهها بر تمامی نمونهها، امکان مقایسه کمی و کیفی جامع آلودگی میکروبی قبل و بعد از ضدعفونی در تمامی نمونهها فراهم نگردید. علاوه بر این، در این مطالعه، شناسایی دقیق سویههای باکتریایی جدا شده انجام نشد و صرفاً بر اساس نتایج کشت مثبت یا منفی گزارش گردید. این امر ارزیابی دقیق پاتوژنیسیته یا منبع آلودگی اولیه را دشوار میسازد. حجم نمونه در هر گروه )فقط سه کارپول) نسبتاً کوچک بود که میتواند در تعمیمپذیری نتایج میکروبی به جمعیتهای بزرگتر محدودیت ایجاد کند.
محدودیتهای شرایط آزمایشگاهی: مدت زمان 24 ساعت برای مواجهه با ضدعفونیکنندهها، اگرچه برای ارزیابی نفوذ مواد مناسب بود، اما ممکن است در عمل بالینی برای ضدعفونی سریع کارپولها در تمامی پروتکلها قابل اجرا نباشد.
محدودیتهای مربوط به روش HPLC: هرچند نفوذ مواد ضدعفونیکننده به درون کارپولها مورد ارزیابی قرار گرفت، اما تأثیر طولانیمدت این نفوذ بر پایداری، اثربخشی یا ایمنی مواد بیحسکننده درون کارپول بررسی نشد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد که احتمال آلودگی باکتریایی در سطح کارپولهای بیحسی دندانپزشکی وجود دارد؛ بهطوریکه دو نمونه از کارپولهای کنترل (بدون ضدعفونی) کشت باکتریایی مثبت را نشان دادند. این یافته حاکی از آن است که اتانول ۷۰% و قرص فرمالین اثر ضدعفونیکنندگی مثبتی روی این آلودگی باکتریایی دارند، چراکه تمامی ۱۸ کارپول مورد بررسی پس از ضدعفونی با این مواد، کشت میکروبی منفی از خود نشان دادند. همچنین نتایج مطالعه، نفوذ این مواد ضدعفونیکننده را به داخل کارپول بیحسی تأیید می کنند، اما حد توکسیسیته (سمیت) این دو ماده برای بدن کم بود و لذا اثر سمی نخواهد داشت. در نتیجه، صرف تجاری بودن برای اطمینان از استریل بودن کامل این وسایل کافی نیست.با توجه به احتمال بیماریزا بودن باکتریهای یافت شده و آسیبپذیری سیستم ایمنی بیماران مراجعهکننده به مطبهای دندانپزشکی، ضمن استفاده از مواد و وسایل با برچسب اطمینان استریل، به نظر میرسد استفاده از مواد ضدعفونیکننده مناسب قبل از استفاده از این وسایل نیز کاملاً ضروری باشد.
سپاسگزاری
این مقاله منتج از پایاننامه دانشجویی به شماره B-97/030 در شورای پژوهشی دانشگاه علوم پزشکی جندیشاپور اهواز میباشد. نویسندگان خود را ملزم میدانند از والدین شرکت کننده در این مطالعه تشکر و قدردانی نمایند.
حامی مالی: دانشگاه علوم پزشکی جندیشاپور اهواز
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه در کمیته اخلاق در پژوهش دانشگاه علوم پزشکی جندیشاپور اهواز با شناسه IR.AJUMS.RES.1397.709 ثبت شده است.
مشارکت نویسندگان
ارشاد همتی در ارائه ایده، محمد هاشمزاده در طراحی مطالعه، زینب شانه ساز در جمعآوری دادهها و تجزیه و تحلیل دادهها، علیرضا امیرخانی و فائزه والیان باغ گندمی در تدوین پیشنویس مقاله مشارکت داشته و همه نویسندگان در ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
کنترل عفونت به لحاظ رابطه نزدیکی که با درمانهای دندانپزشکی دارد همواره در محافل علمی و حقوقی دنیا مورد توجه خاص بوده است (1). یکــی از نیازهــای مطــرح درکنتــرل عفونــت محیــط دندانپزشــکی ضــد عفونــی کــردن ســطوح و ابــزار غیــر بحرانــی و نیمــه بحرانــی در فواصــل بیــن بیمــاران اســت (2). مسأله نظارت بر سیستم های استریل کننده شناخته شده است و مقالات متعددی در این مورد و نیز انواع شاخصهای نظارت با عنوانهای بیولوژیکی شیمیایی چند منظوره یا تک شاخصی وجود دارد (3). اما در رابطه با آلودگی میکروبی یا ویروسی در مواد مصرفی در دندانپزشکی (بهخصوص مواد یکبار مصرف) کمتر تحقیقی انجام پذیرفته است. با وجود پیشرفتهای وسیع در زمینه کنترل عفونت طی سالهای اخیر، هنوز مشکلات زیادی در سطح دانشکدهها، کلینیکها و مطبها وجود دارد. یکی از این کمبودها در این زمینه عدم وجود ارزیابی عفونتهای میکروبی در دانشکدهها میباشد (4). در دندانپزشکی، تزریقهای بیحسی از طریق کارتریجهای بیحسی دندانپزشکی انجام میشود. این کارتریجها امروزه تحت عنوان کارپولهای دندانپزشکی نامیده میشوند و به عنوان فاکتوری برای دسترسی به بیحسی موضعی در مطبهای دندانپزشکی یک مزیت بزرگ محسوب میشوند (5). با توجه به اینکه کارپول بیحسی موضعی مصرف عمومی در رشتههای گوناگون دندانپزشکی دارد ؛ آلودگی سطح خارجی این کارتریجها میتواند از موارد چالشبرانگیز این علم باشد. از طرف دیگر کارخانجات داروسازی تنها استریل بودن ماده بیحسی را تضمین میکنند و هیچگونه تضمینی نسبت به استریلیتی سطح خارجی آن نداشته و به استفاده از مواد ضد عفونی کننده همچون ایزوپروپیل الکل 90% و یا الکل اتیلیک 70% قبل از کاربری توصیه میکنند (6). مواد شیمیایی مانند الکل از ضدعفونی کننده های رایج هستند که بهصورت محلول استفاده میشوند، اما استفاده از این مواد شیمیایی وقتگیر بوده و با آزاد کردن ترکیبات آلی فرار مضر میباشند. بهعلاوه مطالعات نشان دادهاند که مواد شیمیایی به تنهایی موثر و کارآمد نمیباشند (7). پژوهشهای پیشین نیز به بررسی آلودگی میکروبی مواد مصرفی دندانپزشکی، از جمله کارپولها، پرداختهاند. به عنوان مثال، یزدی و همکاران (8) در مطالعه خود به آلودگی میکروبی کارپولها و سایر مواد مصرفی اشاره کردند. همچنین، Basson و همکاران (9) نیز به بررسی آلودگی میکروبی سطح خارجی کارتریجهای بیحسی پرداختند و وجود باکتریهایی را بر روی آنها گزارش کردند. با توجه به مطالب ذکر شده، انتخــاب ضدعفونــی کننــده مناســب و بهکارگیــری روشهــای اســتاندارد گندزدایــی مــیتوانــد در کاهــش عفونــت نقــش موثــری داشــته باشــد. هدف از مطالعه حاضر بررسی اثر مواد مختلف ضد عفونی کننده بر مواد بیحسی دندانپزشکی و تاثیرشان بر آلودگیهای میکروبی مواد بیحسی دندانپزشکی میباشد.
روش بررسی
مطالعه حاضر بهصورت تجربی-آزمایشگاهی (in vitro) بوده که جهت انجام از سه برند ایرانی،اسپانیایی و کلمبیایی هر کدام 9 عدد کارپول تهیه شد.بخشی از این کارپولها به عنوان گروه کنترل و بدون اعمال ضدعفونیکننده جهت بررسی آلودگی میکروبی اولیه مورد کشت قرار گرفتند. مابقی کارپولها پس از اعمال اتانول 70% یا فرمالین، جهت ارزیابی اثربخشی این مواد ضدعفونی کننده، کشت میکروبی شدند. این مراحل در آزمایشگاه گروه میکروبشناسی دانشکده پزشکی صورت گرفت .پس از انجام تستهای میکروبی ، کارپولها جهت ادامه بررسی از جهت نفوذ اتانول 70% و فرمالین به دانشکده داروسازی منتقل شدند.
روش اجرای تحقیق:
در این تحقیق آزمایشگاهی؛ تعداد 27 کارپول به منظور بررسی تاثیر مواد ضدعفونی کننده اتانول 70% (شرکت جهان الکل ایران) و قرصهای فرمالین (شرکت Merck آلمان) بر آلودگیهای میکروبی مواد بیحسی دندانپزشکی و همچنین نفوذ این مواد به کارپولها بهکار گرفته شدند. تعداد 9 عدد کارپول ایرانی (شرکت داروپخش ایران)، 9 عدد کارپول اسپانیایی (شرکت Inibsa اسپانیا) و 9 عدد کارپول کلمبیایی (شرکت New Stetic S.A کلمبیا) در مجموع مورد ارزیابی قرار گرفتند. تمامی کارپولها مستقیماً از بستهبندی اصلی و استریل خود خارج شده و با رعایت کامل اصول آسپتیک، از هرگونه تماس غیرضروری با سطوح یا دستها تا پیش از شروع فرآیند آزمایش جلوگیری بهعمل آمد. این اقدام به منظور به حداقل رساندن احتمال آلودگی ثانویه در مراحل ابتدایی مطالعه صورت گرفت. محیطهای کشت بلاد آگار، مککانکی آگار و Tryptic Soy Broth( TSB) از شرکت Merck آلمان تهیه شدند. برای انجام آزمایش از سواپهای استریل، لولههای آزمایش، اتوکلاو، انکوباتور و دستگاه HPLC ،کروماتوگراف مایع با کارایی بالا ٬مدل LC-2000 از شرکت JASCO، مجهز به آشکارساز UV/VIS استفاده شد. گروهبندی نمونهها بهصورت زیر انجام شد:
A1 : سه کارپول ایرانی (کنترل بدون ضدعفونی)
:A2 سه کارپول ایرانی غوطهور در اتانول ۷۰٪
A3 : سه کارپول ایرانی قرار گرفته در ظرف حاوی قرص فرمالین
B1 : سه کارپول اسپانیایی (کنترل بدون ضدعفونی)
B2 : سه کارپول اسپانیایی غوطهور در اتانول ۷۰٪
B3 : سه کارپول اسپانیایی در ظرف حاوی قرص فرمالین
C1 : سه کارپول کلمبیایی (کنترل بدون ضدعفونی)
C2 : سه کارپول کلمبیایی غوطهور در اتانول ۷۰٪
C3 : سه کارپول کلمبیایی در ظرف حاوی قرص فرمالین
محیطهای کشت بلاد آگار، مک کانکی آگار و TSB طبق دستورالعملهای استاندارد آمادهسازی شدند (12-10). قبل از انجام آزمایش، لولههای آزمایش در اتوکلاو با دمای 121 درجه سانتیگراد به مدت 15 دقیقه و سواپها نیز بهطور جداگانه در لولههای آزمایش قرار داده و در مدت زمان و درجه حرارت ذکر شده استریل شدند.
ارزیابی آلودگی میکروبی اولیه در گروههای کنترل (A1 B1, C1): پیش از اعمال هرگونه ماده ضدعفونی کننده، از هر ۹ کارپول متعلق به گروههای کنترل (A1, B1, C1) نمونهبرداری اولیه انجام شد تا آلودگی میکروبی سطحی آنها مشخص گردد. این فرآیند با استفاده از سه سواپ استریل) با نوک مرطوب شده با سالین استریل از سه قسمت مجزای هر کارپول انجام گرفت: شامل سطح لوله شیشهای استوانهای، سرپوش آلومینیومی دیافراگم، و پیستون پلاستیکی. هر سواپ بلافاصله پس از نمونهبرداری، به یک لوله حاوی ۵ میلیلیتر محیط کشت تریپتیکاز سوی براث (TSB) منتقل شد. این ۹ کارپول، پس از نمونهبرداری اولیه، هیچگونه ماده ضدعفونی دیگری دریافت نکردند و صرفاً در شرایط محیطی مشابه (دمای ۲۵ درجه سانتیگراد) به مدت ۲۴ ساعت نگهداری شدند. هدف از این بخش، تعیین میزان آلودگی میکروبی پایهای کارپولهای هر برند قبل از هرگونه مداخله بود.
گروههای اتانول ) A2, B2, C2, مجموعاًn=9: (کارپولهای این گروهها مستقیماً و بدون نمونهبرداری اولیه، تحت فرآیند ضدعفونی با اتانول قرار گرفتند. کارپولها تحت شرایط استریل از بستهبندی خارج شده و بهطور کامل در ظروف استریل حاوی ۱۰ میلیلیتر اتانول ۷۰% در دمای اتاق )۲۵ درجه سانتیگراد) بهمدت ۲۴ ساعت غوطهور شدند.
گروههای فرمالین A3, B3, C3, (مجموعاً n=9: )کارپولهای این گروهها نیز مستقیماً و بدون نمونهبرداری اولیه، تحت فرآیند ضدعفونی با قرص فرمالین قرار گرفتند. در شرایط استریل، کارپولها در ظروف دربسته (پتری دیش استریل) که حاوی یک قرص فرمالین ۲ گرمی بود، در همان دمای ۲۵ درجه سانتیگراد و به مدت ۲۴ ساعت در معرض بخارات فرمالین قرار گرفتند. در تمامی گروه های اتانول و فرمالین، مدت زمان تماس با ماده ضد عفونی کننده به صورت مداوم ۲۴ ساعت بود و هیچ گونه تغییری در این بازه زمانی صورت نگرفت. پس از گذشت ۲۴ ساعت از زمان اعمال مواد ضدعفونیکننده برای گروههای اتانول و فرمالین، از هر کارپول در این گروهها، نمونهبرداری ثانویه انجام شد. این نمونهبرداری با استفاده از سه سواپ استریل جدید از همان سه قسمت ذکر شده (سطح لوله شیشهای استوانهای، سرپوش آلومینیومی دیافراگم، و پیستون پلاستیکی) صورت گرفت. سواپهای حاصل بلافاصله به لولههای حاوی ۵ میلیلیتر TSB جداگانه منتقل و به عنوان نمونه “بعد از ضدعفونی” ثبت گردیدند.
کشت و شناسایی میکروبی: سواپهای جمعآوری شده از هر دو مرحله (نمونهبرداری اولیه از گروههای کنترل و نمونهبرداری پس از ضدعفونی از گروههای اتانول و فرمالین) که در لولههای حاوی TSB قرار داده شده بودند، بهمدت ۲۴ ساعت در دمای ۳۷ درجه سانتیگراد بهصورت ساکن (static incubation) انکوبه شدند. این مرحله به منظور غنیسازی و افزایش تعداد میکروارگانیسمهای احتمالی موجود در نمونهها انجام گرفت. پس از مرحله غنیسازی در TSB، به منظور ارزیابی دقیق آلودگی میکروبی، با استفاده از سواپ استریل، از هر لوله TSB به روش کشت خطی (Streak culture) بر روی پلیتهای حاوی محیط کشت بلاد آگار (Blood Agar) و مککانکی آگار (MacConkey Agar) کشت داده شد. انتخاب این محیطها به منظور امکان رشد و تفکیک انواع مختلف باکتریها (شامل باکتریهای گرم مثبت و گرم منفی) صورت گرفت .پلیتهای بلاد آگار و مککانکی آگار پس از کشت، بهمدت ۲۴ ساعت در دمای ۳۷ درجه سانتیگراد در انکوباتور انکوبه شدند. پس از انکوباسیون، کلنیهای میکروبی رشد یافته با استفاده از رنگآمیزی گرم مورد بررسی قرار گرفتند و از آنجا که شناسایی گونه های باکتری رشد یافته جز اهداف کار نبود تستهای بیوشیمیایی کامل برای شناسایی گونهها انجام نگرفت (15-13). در مرحله بعد با استفاده از تکنیک (HPLC) کروماتوگرافی مایع با کارایی بالا٬ میزان نفوذ این مواد ضد عفونی کننده بعد از ۲۴ ساعت در درون کارپولها مورد بررسی قرار گرفت.۱۰۰ میکرولیتر از نمونه (محتویات کارپولهای تحت ضدعفونی) یا محلولهای استاندارد اتانول و فرمالین به یک میکروتیوب 1/5 میلیلیتری منتقل شد.۲۰۰ میکرولیتر از حلال استونیتریل به نمونهها اضافه و به مدت ۲ دقیقه بهخوبی هم زده شد تا ترکیبات مزاحم یا پروتئینهای احتمالی رسوب کنند.نمونهها تحت نیروی گریز از مرکز ۱۵۰۰g و به مدت ۵ دقیقه در دمای اتاق سانتریفیوژ شدند. محلول رویی (فاز شفاف حاوی آنالیتها) به دقت از رسوب جدا شده و به یک میکروتیوب تمیز جدید منتقل گردید. برای حصول اطمینان کامل از حذف تمامی ذرات و رسوبات، محلول رویی مجدداً تحت همان شرایط (۱۵۰۰g، ۵ دقیقه) سانتریفیوژ شد. در نهایت، ۵۰ میکرولیتر از محلول رویی کاملاً شفاف و عاری از رسوب، به دستگاه HPLC تزریق گردید.
شرایط کروماتوگرافی: فاز متحرک متشکل از مخلوط استونیتریل و بافر فسفات با نسبت حجمی ۴۰:۶۰ )به ترتیب( بود. هر دو جزء فاز متحرک پیش از استفاده توسط فیلتر 0/45 میکرومتری صاف نرم افزار آشده و سپس به مدت ۱۵ دقیقه در حمام اولتراسونیک برای هواگیری قرار داده شدند. در خصوص فاز ساکن ستون کروماتوگرافی معکوس C18 ec Nucleodur® با ابعاد ۲۵۰ میلیمتر طول و 4/6 میلیمتر قطر داخلی، و اندازه ذرات ۵ میکرون (تولید شرکت MACHEREY-NAGEL EURL فرانسه) استفاده شد. شناسایی و اندازهگیری فرمالین در طول موج ۲۲۱ نانومتر و اتانول در طول موج ۲۴۲ نانومتر با استفاده از آشکارساز UV/VIS انجام گرفت. سرعت جریان فاز متحرک 1/5 میلیلیتر در دقیقه تنظیم گردید. فرآیند کروماتوگرافی در دمای معمول آزمایشگاه صورت پذیرفت. پیش از هر تزریق نمونه، ستون با جریان فاز متحرک به تعادل رسیده تا خط پایه پایدار و مناسبی برای آنالیز به دست آید.
تجزیه و تحلیل آماری
دادهها با استفاده از نرمافزار آماری version 16 SPSS و آزمون آماری Kruskal-Wallis test تجزیه و تحلیل شدند به علت کم بودن تعداد نمونهها از آنالیز آماری غیرپارامتری Kruskal-Wallis test برای بررسی و مقایسه استفاده شد.
نتایج
در این مطالعه، کشت میکروبی از ۲۷ کارپول تهیه شده از سه برند اسپانیایی، کلمبیایی و ایرانی انجام شد. این کارپولها به سه گروه اصلی تقسیمبندی شده بودند: ۹ نمونه کنترل (بدون قرارگیری در معرض ضدعفونی کننده)، ۹ نمونه ضدعفونی شده با اتانول70% و ۹ نمونه ضدعفونی شده با قرص فرمالین. برای ارزیابی آلودگی میکروبی از روش کشت خطی به دنبال غنیسازی در TSB استفاده شد. از میان ۹ کارپول گروه کنترل که در هیچ ماده ضدعفونیکنندهای قرار نگرفته و صرفاً برای بررسی آلودگی اولیه نمونهبرداری شده بودند، ۲ مورد (شامل یک کارپول ایرانی و یک کارپول کلمبیایی) دارای کشت میکروبی مثبت بودند. این یافته نشاندهنده وجود آلودگی میکروبی اولیه در سطح این کارپولها پیش از هرگونه اعمال ضدعفونی است. در مقابل، نتایج حاکی از آن بود که تمامی ۱۸ کارپول ضدعفونی شده (شامل ۹ نمونه ضدعفونی شده با اتانول 70% و ۹ نمونه ضدعفونی شده با قرص فرمالین( پس از ۲۴ ساعت، کشت میکروبی منفی را نشان دادند. این یافته بهوضوح اثربخشی کامل هر دو ماده ضدعفونیکننده اتانول و فرمالین را در شرایط آزمایشگاهی این مطالعه، در حذف آلودگیهای میکروبی سطحی کارپولهای بیحسی دندانپزشکی، نشان میدهد. تحت شرایط کروماتوگرافی مطالعه حاضر، پیک فرمالین در زمان 0/16± 7/45 (انحراف معیار±میانگین) و پیک اتانول (استاندارد داخلی) در زمان 0/12±6/53 دقیقه مشاهده میشود و نیز به ترتیب نمونههای استاندارد با غلظت 0/1 و 100 میکروگرم در میلیلیتر نشان داده شده است. در نمودارهای زیر کروماتوگرام حاوی فرمالین و اتانول نشان داده شده است. با استفاده از روش استخراج نمونه مورد استفاده، حداقل حد تعیین مقدار کمی بر اساس پیک معادل 10 برابر نسبت پاسخ دستگاه به نوسانات زمینهای که تکرارپذیری مناسبی داشته باشد 0.1 میکرو گرم در میلیلیتر تعیین شد. منحنی استاندارد تعیین مقدار فرمالین و اتانول به ترتیب در نمودارهای 5 و 6 ارائه شده است. مقادیر تعیین شده فرمالین و اتانول در ویال داروها بهترتیب در جداول 1 و 2 گزارش شده است. مقایسه تفاوت معنیداری را در مقادیر فرمالین در گروهها (P=0.0036) و مقادیر اتانول در گروهها (P=0.0037) نشان داد. نتایج حاکی از آن است که نمونههای اسپانیایی کمترین و نمونه کلمبیایی و ایرانی بیشترین مقدار از فرمالین و الکل را دارا بودند.

نمودار1: کروماتوگرام استاندارد فرمالین با غلظت 0.1 میکروگرم در میلیلیتر (حد تعیین مقدار کمی)

نمودار2: کروماتوگرام استاندارد فرمالین با غلظت 100 میکروگرم در میلیلیتر

نمودار3: کروماتوگرام استاندارد اتانول با غلظت 0.1 میکروگرم در میلیلیتر (حد تعیین مقدار کمی)
.JPG)
نمودار4: کروماتوگرام استاندارد اتانول با غلظت 100 میکروگرم در میلیلیتر


نمودار6: نمودار منحنی استاندارد تعیین مقدار اتانول

بحث
با توجه به اینکه برخی از گونههای میکروبی اسپورهای مقاومی دارند ممکن است در صورت عدم استریلیزاسیون مناسب، آلودگی میکروبی باقی بماند. Gates و همکاران آلودگی میکروبی را در چهار نوع تجاری پودرهای چسب دنچر بررسی کردند. تمام پودرها حاوی میکروارگانیسم بودند و رشد باکتریال و همینطور رشد قارچ مشاهده شد (16).در مطالعهای که Rosa و همکاران در رابطه با نگهداری وسایل دندانپزشکی بهصورت استریل انجام دادند، نتیجه گرفتند که اگر وسایل پس از استریلیزاسیون در بستهها و پاکتهای مخصوص فور یا اتوکلاو در کابینتهای دربسته نگهداری شوند تا صد و هشتاد روز همچنان استریل باقی می مانند و در صورتیکه پارگی یا بازشدگی بستهها پیش بیاید استریلیتی از بین میرود و این آلودگی به مرور زمان بیشتر میشود (17). لذا در مطالعه حاضر اقدام به بررسی اثر دو نوع ماده ضدعفونی کننده بر کارتریجهای بیحسی دندانپزشکی شد. در مرحله اول اثر ضد میکروبی مواد ضد عفونی کننده مورد بررسی قرار گرفت. سپس میزان نفوذ این مواد به درون کارپولها با استفاده از دستگاهHPLC مورد ارزیابی قرارگرفت. از میان 9 نمونه گرفته شده که در هیچ ماده ضدعفونی کننده قرار نگرفته بودند 2 کارپول آلوده بودند که شامل یک کارپول ایرانی و یک کارپول کلمبیایی بود. این یافته بیانگر احتمال وجود آلودگی میکروبی در کارپولهای بدون ضدعفونی کننده است. همچنین تمامی 18 کارپول ضد عفونی شده (۹عدد با اتانول ۷۰% و ۹ عدد با فرمالین ) از لحاظ کشت میکروبی منفی بودند . این نتیجه٬ اثربخشی قابلتوجه اتانول ۷۰% و فرمالین را در از بین بردن آلودگی های میکروبی سطحی کارپولها تایید میکند. این یافته با نتایج مطالعات اخیر مانند “Evaluation of disinfection methods for anesthetic cartridges” در سال 2016 که اثربخشی الکل 70% را در ضدعفونی کارتریجها نشان داده است، همسو میباشد.*از این تعداد نمونه و پاسخها مشخص میشود که روند ساخت کارپولها دارای اشکال میباشد. همچنین چون شرایط نمونهگیری کاملا استریل بود میتوان نتیجه گرفت که این آلودگیها از محیط به آنها اضافه نشده است. بنابراین مواد و وسایل دندانپزشکی باید به نحوی طراحی، ساخته و ارائه شوند که انتقال آلوده کنندهها به بیمار وحتی پرسنل محیط کار دندانپزشکی به حداقل برسد و سیستم بستهبندی برای وسایل استریل دندانپزشکی باید اطمینانبخش باشد (18). تجزیه و تحلیل با استفاده از HPLC نشان داد که تفاوت آماری معنیداری در میزان نفوذ فرمالین (P=0.0036) و اتانول (P=0.0037) بین برندهای مختلف کارپول وجود دارد. کارپولهای اسپانیایی کمترین میزان نفوذ فرمالین را نشان دادند ( 0/1≤µg/ml)، در حالیکه کارپولهای کلمبیایی (میانگین µg/ml10) و ایرانی (میانگین µg/ml60) میزان نفوذ بسیار بالاتری داشتند. بهطور مشابه، کارپولهای اسپانیایی کمترین میزان نفوذ اتانول را داشتند (میانگین µg/ml20) در حالیکه کارپولهای کلمبیایی (میانگین µg/37) و ایرانی (میانگین µg/ml87) میزان نفوذ بیشتری را نشان دادند. بهطورکلی، نتایج حاکی از آن است که کارپولهای اسپانیایی کمترین و کارپولهای کلمبیایی و ایرانی بیشترین مقدار نفوذ فرمالین و الکل را در بازه زمانی 24 ساعته داشتهاند. این تفاوت در نفوذ میتواند تحت تاثیر عوامل متعددی از جمله تفاوت در مواد سازنده، ضخامت دیواره، یا ساختار دیافراگم کارپولها باشد که نیازمند بررسی بیشتر در مطالعات آتی است. Yazdi و همکاران نیز به بررسی آلودگی میکروبی چهار ماده مصرفی دندانپزشکی شامل گوتاپرکا، ساکشن، کارپول و رول پنبه پرداختند. از 48 مورد کارپول، 1 مورد آلوده به کوکسی گرم مثبت کواگولاز منفی بود. در 2 مورد استرپتوکوک ویریدانس و در 2 مورد آلودگی به باسیل گرم مثبت سرئوس مشهود بود؛ همچنین از 48 مورد گوتاپرکا، 2 مورد آلودگی به باسیل گرم مثبت سرئوس نشان داده شد. بهنظر میرسد آلودگی بیشتر در نمونههای یزدی و همکاران، به دلیل حجم نمونه بزرگتر آنها نسبت به مطالعه ما باشد(8)Shannon در مطالعهای به بررسی آلودگی میکروبی سطح خارجی کارتریجهای بیحسی پرداخت و غلظت متوسط الکل را پس از 12 هفته غوطهوری در الکل۷۰%، 7/57 میکروگرم در روز گزارش کرد (۱۹). Parnell در سال 1969 در آمریکا، یک مطالعه مشابه غوطهورسازی کارپول بیحسی موضعی در ایزوپروپیل الکل 91% بهمدت پنجاه روزانجام داد که نتیجه میانگین بیش از 5/0% ایزوپروپیل الکل 91% در هر کارپول بیحسی بود (20). میزان نفوذ الکل در این دو مطالعه از مطالعه ما بیشتر بوده است که میتواند به علت مدت زمان طولانیتر غوطهورسازی کارپولها درون الکل باشد. Kelly و Dalm ثبات اپینفرین موجود در محلولهای بیحسی موضعی در استریلیزاسیون به روش اتوکلاو را بررسی کردند و گزارش کردند که حدود 5% اپی نفرین در صورت قرار گرفتن در اتوکلاو حدود 30 دقیقه تحت دمای 121 درجه از دست میرود (12). Bridenbaugh در آمریکا مطالعه مشابهی در سال 1964 به منظور هدف قرار دادن اثرات استرلیزاسیون گرما روی تواناییهای داروهای بیحسی موضعی صورت گرفت. آنها گزارشی که در سال 1958 انجام داده بودند بهروزرسانی کردند؛ به این شکل که اینبار به جای دمای 121 درجه سانتیگراد در دمای 135 درجه سانتیگراد برای مدت 30 دقیقه در اتوکلاو قرار دادند. آنها در این مطالعه از 6 ماده بیحسی موضعی رایج استفاده کردند و اظهار داشتند که این 6 ماده می توانند حداقل 6 بار برای مدت 3 ساعت بدون آسیب رسیدن به توانایی خود اتوکلاو شوند (22). Bridenbaugh در سال 1958 در آمریکا مطالعهای در مورد اینکه آیا استرلیزاسیون گرمایی برای داروهای بیحسی موضعی لازم است یا خیر انجام داد. برای این مطالعه آنها 121 پرسش نامه به بیمارستانها ارسال کردند و 101 پرسشنامه پس از پاسخ دریافت کردند. در این بررسی مشاهده شد که 33 بیمارستان از روش اتوکلاوینگ و 68 بیمارستان دیگر از روش استرلیزاسیون سرما استفاده میکنند. آنها گزارش دادند که ماده بیحسی معمول میتواند حداقل یک بار اتوکلاو شود بدون اینکه اثرات قابلتوجهی در توانایی آن ایجاد شود و استریلیزاسیون به روش گرما برای دارو و تجهیزات مورد استفاده اجباری است (23). Reinald و Chutter در سال 2008 در آمریکا یک مطالعه تحت عنوان روش اتوکلاوینگ کارتریج بیحسی برای سینی های جراحی در انجام دادند که در این مطالعه از اتوکلاو کردن کارتریج استفاده شد. برای این کار از لیدوکایین 2% و اپی نفرین 1/100000 استفاده شد. پس از انجام پروسه اتوکلاوینگ دیده شد که 5% اپی نفرین از دست رفت، با این وجود شروع سریع و تاثیرگذار و طول مدت بیحسی مشابه قبل است (24). نتایج این مطالعه که بعد از غوطهورسازی در اتانول 70% و قرصهای فرمالین صورت گرفت، نشت و نفوذ این مواد را به داخل کارپول بیحسی تایید میکنند که کارپولهای شرکت اسپانیایی کمترین وکارپولهای شرکت کلمبیایی و ایرانی بیشترین میزان نفوذ را دارا بودند. میزان نفوذ در کارپولها ممکن است در ارتباط با کیفیت ساخت کارپولها از لحاظ دیافراگم و پیستون پلاستیکی و همینطور زمان انجام آزمایش باشد. بهطورکلی تولیید کنندگان لیدوکایین به حداقل زمان ده دقیقه غوطهورسازی در محلول ضد عفونی کننده پیشنهاد می کنند (25،26). نتایج مطالعه حاضر نشان داد که میزان آلودگی میکروبی مثبت در کارپولهای بیحسی دندانپزشکی، بهویژه مربوط به کارپول برند ایرانی و کلمبیایی بوده است. این یافته، اهمیت کنترل عفونت در محیط دندانپزشکی را بیش از پیش آشکار میسازد. همانطور که در مطالعه “بررسی فراوانی آلودگی میکروبی سطوح محیط کار کلینیکی در دانشکده دندانپزشکی، دانشگاه علوم پزشکی مشهد در سال (2014) توسط خوراکیان و همکاران نیز تأکید شده است، سطوحی که بهطور شایع هنگام کار دندانپزشکی لمس میشوند میتوانند به عنوان منبع انتقال عفونت عمل کرده و موجب ایجاد عفونت متقاطع گردند (۲۷). آلودگی مواد مورد استفاده در چند مرحله از فرآیند تولید تا مصرف امکانپذیر است. با توجه به اهمیتی که کارپول از نظر استفاده در عمل تزریق مستقیم به نسوج بدن دارد و میتواند باعث آلودگی احتمالی گردد، ساخت و مواد اولیه آن حتیالامکان باید استریل و عاری از عفونت باشد. بستهبندی و لفافه آلومینیومی کارپولها میتواند از آلوده شدن آنها جلوگیری کند؛ اما از آنجا که کارپولها در بستههای چهارتایی ارائه میشوند و برای تحویل یا استفاده میبایست از هم مجزا شوند، در نتیجه احتمال پاره شدن لفافه در این مسیر همیشه وجود دارد. آلودگیهای یافت شده در این قسمت، مؤید این ظن است که با پاره شدن لفافه آلومینیومی، کارپولها احتمالاً با دست و یا آلودگیهای محیطی آلوده شده باشند. این موضوع ضرورت بررسیهای میکروبیولوژیکی دقیقتر و پروتکلهای سختگیرانهتر کنترل کیفیت را در فرآیندهای تولید، بستهبندی و نگهداری کارپولها برجسته میسازد. این امر بر اهمیت رعایت اصول گندزدایی و استریلیزاسیون در دندانپزشکی تاکید دارد، چرا که عفونت میتواند از طرق مختلفی به بیماران و پرسنل منتقل شود. در راستای اهمیت کنترل آلودگی، مطالعه حاضر به بررسی اثربخشی اتانول 70% و قرص فرمالین در کنترل این آلودگیها پرداخت. مشاهده کشت میکروبی منفی در تمامی 18 کارپول ضدعفونی شده با اتانول 70% یا قرص فرمالین پس از 24 ساعت، بهطور قاطع اثربخشی بالای این دو ماده را در حذف آلودگیهای باکتریایی سطحی کارپولها نشان میدهد. این نتایج با اصول کلی ضدعفونی که در مقالات مروری نظیر Patino-Marin و همکاران (۲۸) همخوانی دارد که تمیز کردن و ضدعفونی ابزارهای دندانپزشکی را قبل از استفاده مجدد برای جلوگیری از انتقال آلودگی حیاتی میدانند. همچنین، در مقالات ذکر شده، بر این نکته تأکید شده است که برای حصول حداکثر اثربخشی، فرآیند ضدعفونی باید پس از تمیز کردن اولیه و حذف آلودگیهای قابل مشاهده انجام شود، که این رویکرد در روش کار ما نیز رعایت گردید. تفاوت در میزان نفوذ مواد ضدعفونیکننده به درون کارپولها بر اساس برند، که کارپولهای اسپانیایی کمترین نفوذ و کارپولهای کلمبیایی و ایرانی بیشترین نفوذ را نشان دادند، میتواند به تفاوت در ساختار مواد پلیمری یا طراحی کارپولها مرتبط باشد. این یافته از جنبه بالینی حائز اهمیت است، زیرا نفوذ کمتر مواد ضدعفونیکننده به داخل کارپول، خطر تعامل این مواد با داروی بیحسی و ایجاد عوارض جانبی احتمالی را کاهش میدهد، هرچند که در مطالعه حاضر میزان نفوذ در تمامی برندها در محدوده ایمن قرار داشت و پایینتر از آستانه سمیت برای بیحسکنندههای دندانی بود. این نتایج، مؤید این مطلب است که صرف تجاری بودن برای اطمینان از استریل بودن این وسایل کافی نیست. با توجه به احتمال بیماریزا بودن باکتریهای یافت شده و ضعف سیستم ایمنی بیماران مراجعهکننده به مطبهای دندانپزشکی، ضمن استفاده از مواد و وسایل با برچسب اطمینان استریل، از مواد ضدعفونیکننده مناسب قبل از استفاده از این وسایل نیز استفاده گردد. با این تفاسیر، با توجه به اثربخشی مواد ضدعفونیکننده مورد بررسی در مطالعه حاضر، میتوان نتیجه گرفت که با رعایت پروتکلهای مناسب ضدعفونی، میتوان بهطور موثری از انتقال آلودگیهای باکتریایی از طریق کارپولهای بیحسی جلوگیری کرد و به حفظ سلامت بیماران و پرسنل کمک شایانی نمود.
محدودیتهای مطالعه: در مطالعه حاضر، به دلیل محدودیت در دسترسی به دادههای کشتهای میکروبی پیش از اعمال ضدعفونیکنندهها بر تمامی نمونهها، امکان مقایسه کمی و کیفی جامع آلودگی میکروبی قبل و بعد از ضدعفونی در تمامی نمونهها فراهم نگردید. علاوه بر این، در این مطالعه، شناسایی دقیق سویههای باکتریایی جدا شده انجام نشد و صرفاً بر اساس نتایج کشت مثبت یا منفی گزارش گردید. این امر ارزیابی دقیق پاتوژنیسیته یا منبع آلودگی اولیه را دشوار میسازد. حجم نمونه در هر گروه )فقط سه کارپول) نسبتاً کوچک بود که میتواند در تعمیمپذیری نتایج میکروبی به جمعیتهای بزرگتر محدودیت ایجاد کند.
محدودیتهای شرایط آزمایشگاهی: مدت زمان 24 ساعت برای مواجهه با ضدعفونیکنندهها، اگرچه برای ارزیابی نفوذ مواد مناسب بود، اما ممکن است در عمل بالینی برای ضدعفونی سریع کارپولها در تمامی پروتکلها قابل اجرا نباشد.
محدودیتهای مربوط به روش HPLC: هرچند نفوذ مواد ضدعفونیکننده به درون کارپولها مورد ارزیابی قرار گرفت، اما تأثیر طولانیمدت این نفوذ بر پایداری، اثربخشی یا ایمنی مواد بیحسکننده درون کارپول بررسی نشد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد که احتمال آلودگی باکتریایی در سطح کارپولهای بیحسی دندانپزشکی وجود دارد؛ بهطوریکه دو نمونه از کارپولهای کنترل (بدون ضدعفونی) کشت باکتریایی مثبت را نشان دادند. این یافته حاکی از آن است که اتانول ۷۰% و قرص فرمالین اثر ضدعفونیکنندگی مثبتی روی این آلودگی باکتریایی دارند، چراکه تمامی ۱۸ کارپول مورد بررسی پس از ضدعفونی با این مواد، کشت میکروبی منفی از خود نشان دادند. همچنین نتایج مطالعه، نفوذ این مواد ضدعفونیکننده را به داخل کارپول بیحسی تأیید می کنند، اما حد توکسیسیته (سمیت) این دو ماده برای بدن کم بود و لذا اثر سمی نخواهد داشت. در نتیجه، صرف تجاری بودن برای اطمینان از استریل بودن کامل این وسایل کافی نیست.با توجه به احتمال بیماریزا بودن باکتریهای یافت شده و آسیبپذیری سیستم ایمنی بیماران مراجعهکننده به مطبهای دندانپزشکی، ضمن استفاده از مواد و وسایل با برچسب اطمینان استریل، به نظر میرسد استفاده از مواد ضدعفونیکننده مناسب قبل از استفاده از این وسایل نیز کاملاً ضروری باشد.
سپاسگزاری
این مقاله منتج از پایاننامه دانشجویی به شماره B-97/030 در شورای پژوهشی دانشگاه علوم پزشکی جندیشاپور اهواز میباشد. نویسندگان خود را ملزم میدانند از والدین شرکت کننده در این مطالعه تشکر و قدردانی نمایند.
حامی مالی: دانشگاه علوم پزشکی جندیشاپور اهواز
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه در کمیته اخلاق در پژوهش دانشگاه علوم پزشکی جندیشاپور اهواز با شناسه IR.AJUMS.RES.1397.709 ثبت شده است.
مشارکت نویسندگان
ارشاد همتی در ارائه ایده، محمد هاشمزاده در طراحی مطالعه، زینب شانه ساز در جمعآوری دادهها و تجزیه و تحلیل دادهها، علیرضا امیرخانی و فائزه والیان باغ گندمی در تدوین پیشنویس مقاله مشارکت داشته و همه نویسندگان در ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Silverman SJ. Infectious Disease and the Dental Office. Int Dent J 1987; 37(2): 87 93.
2- Cotton JA, Terezhalmy GT, Molinavi JA. Practical Infection Control in Dentistry. 2nd ed. Philadelphia: William & Wilkins 1996: 123-36.
3- Kuroda A, Takasaki K, Inoue T, Ojima T, Takashima E. Study on Hospital Infection Control in the Dental Clinic Environment. Bull Tokyo Dent Coll 1985; 26(3): 201 6.
4- Ijadi Mohammadi M, Asnaashari M, Hosseini MR. Survey of Knowledge and Performance of Dental Students at Shahid Beheshti Dental School Regarding Infection Control in Endodontic Procedures. J Dent Sch Shahid Beheshti Univ Med Sci 2003; 21(1): 35 41. [Persian]
5- Andersen BM, Bånrud H, Bøe E, Bjordal O, Drangsholt F. Comparison of UVC Light and Chemicals for Disinfection of Surfaces in Hospital Isolation Units. Infect Control Hosp Epidemiol 2006; 27(7): 729-34.
6- Shannon IL, Wescott WB. Alcohol Contamination of Local Anesthetic Cartridges. J Acad Gen Dent 1974; 22: 20-1.
7- Stutz N, Becker D, Jappe U, John SM, Ladwig A, Spornraft‐Ragaller P, et al. Nurses’ Perceptions of the Benefits and Adverse Effects of Hand Disinfection: Alcohol‐Based Hand Rubs Vs Hygienic Handwashing. Br J Dermatol 2009; 160(3): 565-72.
8- Ashofteh Yazdi K, Fathollah Zadeh B, Daneshvar S. Study of the Aerobic Contamination of Four Disposable Materials (Anesthetic Cartridge, Saliva Ejector Tip, Gutta Percha and Cotton Roll. J Dent Med 2005; 18(2): 81-6.
9- Basson NJ, Bester L, Van der Bijl P. External Bacterial Contamination of Local Anaesthetic Cartridges. SADJ 1999; 54(6): 253-6.
10- Buxton R. Blood Agar Plates and Hemolysis Protocols. Washington (DC): American Society for Microbiology; C2014 Available at: https://www.asmscience.org/content/education/protocol/protocol.2885. Accessed Oct 11, 2015.
11- Koneman EW, Allen SD, Janda WM, Procop GW, Schreckenberger PC, Woods GL. Koneman’s Color Atlas and Textbook of Diagnostic Microbiology. 7th ed. Philadelphia: Lippincott Williams & Wilkins; 2020: 376-82.
12- United States Pharmacopeia–National Formulary (USP–NF). 2024 ed. Rockville (MD): United States Pharmacopeial Convention; 2024. Available at: https://online.uspnf.com. Accessed Oct 11, 2025.
13- Vasudeva A, Sinha DJ, Tyagi SP, Singh NN, Garg P, Upadhyay D. Disinfection of Dentinal Tubules with 2% Chlorhexidine Gel, Calcium Hydroxide and Herbal Intracanal Medicaments Against Enterococcus Faecalis: An In-Vitro Study. Singapore Dent J 2017; 38: 39-44.
14- Rutala WA, Weber DJ. Guideline for disinfection and sterilization in healthcare facilities. Atlanta (GA): Centers for Disease Control and Prevention; 2008 Available at: https://www.cdc.gov/ infectioncontrol/ guidelines/disinfection/index.html. Accessed Oct 11, 2015.
15- Kohn WG, Collins AS, Cleveland JL, Harte JA, Eklund KJ, Malvitz DM. Guidelines for Infection Control in Dental Health-Care Settings—2003. MMWR Recomm Rep 2003; 52(RR-17): 1-61.
16- Gates WD, Goldschmidt M, Kramer D. Microbial Contamination in Four Commercially Available Denture Adhesives. J Prosthet Dent 1994; 71(2): 154-8.
17- Rosa AC, Brusca MI, Manto MC, Mosca CO, Nostri N. Effects of Handling and Storage on Sterile Dental Instruments. Acta Odontol Latinoam 2001; 14(1-2): 35-9.
18- De-Paiva CR, Bandeira RL, de Moura AL, Toda C, de Jesus GP. Evaluation of Disinfection Methods for Anesthetic Cartridges. J Oral Diagnosis 2002; 7(1): 1-7.
19- Shannon IL, Feller RP. Contamination of Local Anesthetic Carpules by Storage in Alcohol. Anesth Prog 1972; 19(1): 6-8.
20- Parnell JE. The Effect of Prolonged Storage of Local Anesthetic Cartridges in Alcohol. J Houston Dist Dent Soc 1970; 42(3): 6-9.
21- Kelly JR, Dalm GW. Stability of Epinephrine in Dental Anesthetic Solutions: Implications for Autoclave Sterilization and Elevated Temperature Storage. Mil Med 1985; 150(2): 112-4.
22- Bridenbaugh LD, Moore DC. Does Repeated Heat Sterilization of Local Anesthetic Drugs Affect Potency? Anesthesiology 1964; 25: 372-6.
23- Bridenbaugh LD, Moore DC. Is Heat Sterilization of Local Anesthetic Drugs A Necessity? JAMA 1958; 168(10): 1334-7.
24- Chutter RJ. The Rationale and Method for Autoclaving Anesthetic Cartridges for Surgical Trays. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105(1): e1-4.
25- Astra Pharmaceutical Products Inc. Basic data sheet. Worcester (MA): Astra Pharmaceutical Products Inc; 1998. Available from: https:// www.astrazeneca.com/. Accessed Oct 11, 2025
26- Graham Chemical Corp. Basic Data Sheet. Springfield Gardens (NY): Graham Chemical Corp; 1998. Available at: https:// www.grahamchemical.com/. Accessed Oct 11, 2025.
27- Khorakian F, Movahed T, Ghazvini K, Karbasi S, Tabrizi Nouri S, Bahramian L, et al. Evaluation of Frequency of Microbial Contamination in Clinical Setting Surface in Dental School of Mashhad University of Medical Sciences. J Mashhad Dental School 2017; 41(3): 209-18. [Persian]
28- Patiño-Marín N, Villa García LD, Aguirre López EC, Medina-Solís CE, Martínez Zumarán A, Martínez Rider R, et al. Sterilization and Disinfection: Ensuring Infection Control in Dental Practices. Cureus 2025; 17(2): e79041.
نوع مطالعه: پژوهشي |
موضوع مقاله:
دندانپزشکی
دریافت: 1404/5/11 | پذیرش: 1404/6/9 | انتشار: 1404/8/15
دریافت: 1404/5/11 | پذیرش: 1404/6/9 | انتشار: 1404/8/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







