دوره 33، شماره 6 - ( شهریور 1404 )
جلد 33 شماره 6 صفحات 9123-9106 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nowruzi B. A Review of the Biological Activity of Cyanobacterial Metabolites. JSSU 2025; 33 (6) :9106-9123
URL: http://jssu.ssu.ac.ir/article-1-6405-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6405-fa.html
نوروزی بهاره. مروری بر فعالیت زیستی متابولیتهای سیانوباکتریها. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (6) :9106-9123
واژههای کلیدی: متابولیتهای سیانوباکتری، سنتز نانوذرات، طراحی دارو، دارورسانی هدفمند، فعلیت ضد میکروبی
متن کامل [PDF 974 kb]
(190 دریافت)
| چکیده (HTML) (538 مشاهده)
متن کامل: (204 مشاهده)
مقدمه
سیانوباکتریها گروه قابلتوجهی از باکتریهای گرم منفی هستند که نقش مهمی در تکامل اشکال اولیه حیات بر روی زمین ایفا کردهاند. این میکروارگانیسمها در سراسر جهان و در اکوسیستمهای مختلفی مانند خاکها، آبهای شیرین و اقیانوسها، و همچنین محیطهای دشوار را مستعمره میسازند. سیانوباکتریها تنها گروه از موجودات پروکاریوتی هستند که قادر به انجام فتوسنتز اکسیژنی هستند. از اینرو، باور بر این است که آنها مسئول اکسیژنرسانی به جو و اقیانوسها بودهاند. این باکتریها انرژی خورشیدی را با کارآیی بهطور قابلتوجهی بالا (3 تا 9 درصد) جذب میکنند که این امر از تثبیت مقادیر زیادی نیتروژن و کربن غیرآلی پشتیبانی میکند. وجود گسترده سیانوباکتریها در بیوسفر با دسترسی به نور به دلیل تنوع مسیرهای بیوسنتزی، تنوع فیلوژنتیکی و پتانسیل تولید ترکیبات مختلف است که آنها را از رقبای احتمالی محافظت میکند (1). به دلیل تنوع شیمیایی ترکیبات تولیدشده توسط سیانوباکتریها، مسیرهای سنتزی پیچیده و متنوعی در تولید آنها دخیل هستند که بسته به نوع ماده تولیدی متفاوت است. بیشتر این بیومولکولها عمدتاً توسط پلیکتید سنتاز (PKS)، پلیپپتید سنتاز غیرریبوزومی (NRPS) و ترکیب این دو مسیر (PKS-NRPS) سنتز میشوند. علاوه بر این، این ترکیبات میتوانند دستخوش تغییرات شیمیایی مانند هالوژنه شدن، متیله شدن و اکسیداسیون قرار گیرند. بهعلاوه، برخی از ترکیبات میتوانند توسط ریبوزومها سنتز شده و سپس بهصورت پس از ترجمهای اصلاح شوند. در کل دو نوع مسیر بیوسنتزی، پپتیدها را تولید می کنند: این دو مسیر یا توسط آنزیمهای چند دمین بسیار بزرگ NRPS یا توسط سنتز ریبوزومی، پردازش و اصلاحات بعد از ترجمه، انجامپذیر است. NRPSها، شامل بخشهایی هستند که هر کدام مسئول اضافه کردن اسیدآمینهای خاص هستند. ترتیب این مودولها، بر طبق قانون است، به این ترتیب که پی در پی بودن مودولها مرتبط با ترتیب اسیدهای آمینه در محصول نهایی است. کوچکترین بخش از یک اسید آمینه فعالکننده دمین آدنیلیشن Adenylation (A) domains A))، یک دمین پروتئینی حامل پپتیدیل (PCP) Peptidyl carrier protein (PCP) حمل کننده کوفاکتور فسفوپنتانئین Phosphopantetheine و یک دمین C تراکمی، تشکیل شده است. NRPSها میتوانند تقریباً 300 سوبسترای پروتئینی و غیرپروتئینی را بپذیرند و ممکن است شامل دمینهای بیشتری باشند که منجر به اصلاحات و اپیمریزه کردن سوبستراهای اسید آمینهای میشود. در مقابل، بیوسنتز ریبوزومی پپتیدها، محدود به 20 اسید آمینه پروتئینی است. با اینحال، تنوع بالا و پتانسیل بیوسنتزی و فعال زیستی در این گروه از پپتیدها، بسیار قابلتوجه است. در سالهای اخیر پژوهشها نشان دادهاند که ترکیبات تولیدشده توسط سیانوباکترها میتوانند بهعنوان جایگزینهای مؤثری برای آنتیبیوتیکها در مقابله با عفونتهای ویروسی و باکتریایی عمل کنند (2). در میان گروههای ترکیبات سنتز شده توسط سیانوباکتریها با فعالیت ضد میکروبی میتوان پلیکتیدها، آلکالوئیدها، پپتیدها، ترپنها، لیپیدها و پلیفنولها را نام برد. هر یک از این گروه از ترکیبات دارای مکانیسم عمل خاصی هستند که با متابولیسم باکتری بیماریزا اختلال ایجاد میکنند. مکانیسمهای اصلی عملکرد این مولکولها عبارتاند از: (i) مهار پمپهای افلاکس (مانند آلکالوئیدها)، (ii) مهار ترجمه از طریق جلوگیری از اتصال tRNA به mRNA (مانند پلیکتیدها)؛(iii) تنظیم منفی تکثیر و رونویسی DNA از طریق مهار پلیمرازهای مربوطه (مانند آلکالوئیدها)؛ (iv) بیثباتسازی دیواره سلولی باکتری و اختلال در زنجیره انتقال الکترون (مانند پپتیدها و لیپیدها)؛ گروههای ترکیبات تولید شده توسط سیانوباکترها با فعالیت ضدویروسی شامل پروتئینها، کربوهیدراتها، سولفوگلیکولیپیدها، پلیکتیدها، آلکالوئیدها، لیپیدها و پلیفنولها هستند. مکانیسمهای شناساییشده برای اثرگذاری متابولیتهای دارای پتانسیل ضدویروسی به شرح زیر میباشد: (i) مهار اتصال پروتئین ویروسی به سلول میزبان؛ (ii) مهار تکثیر ویروس؛ (iii) اتصال به گیرندههای سلول میزبان برای جلوگیری از گسترش عفونت (3). تحقیقات پیشین به وضوح نشان دادهاند که سیانوباکتریها و متابولیتها آنها میتوانند درمانی محتمل برای طیف گستردهای از بیماریهای انسانی از جمله سرطان، دیابت، اختلالات دستگاه عصبی مرکزی، عفونتهای ویروسی و مواردی مانند آن باشند (4). ریزجلبکها به دلیل افزایش سریع زیست توده، عدم نیاز به زمینهای زراعی و فراوانی متابولیتها با ارزش هستند. علاوه بر این، ریزجلبکها را میتوان در فاضلابهای غیر صنعتی نیز کشت کرد که یک جنبه مهم اقتصادی است. مواد فعال زیستی مشتق شده از متابولیسم ثانویه مانند پروتئینها، پلیساکاریدها، لیپیدها، ویتامینها و رنگدانهها پتانسیل زیادی را برای بسیاری از کاربردها نشان دادهاند. علاوه بر این، کاربردهای زیستپزشکی برای نشان دادن پتانسیل ریزجلبکها برای مصارف پزشکی مورد توجه قرار گرفته است (5). بنابراین، هدف از این مقاله مروری، خلاصه و بحث گزارشهای قبلی درباره فعالیتهای ضدویروسی و ضدباکتریایی سیانوباکتریها و متابولیتهای آنهاست. علاوه بر این، در این مقاله جدیدترین روشهای زیستشناسی مولکولی پیشرفته که از سیانوباکتریها برای سنتز نانوذرات با خواص ضد میکروبی استفاده شده است را به همراه طراحی دارو و دارورسانی هدفمند مورد بررسی قرار میدهد.
متابولیتهای ضد ویروسی سیانوباکتریها: ویروس کرونا که متعلق به خانواده کروناویریده و زیر مجموعه کروناویرینه است، برای بیمارانی که دچار ضعف ایمنی هستند، بسیار خطرناک است، این ویروس، به شدت بر سیستم تنفسی و گوارشی انسانها و حیوانات تأثیر میگذارد (6). بر اساس تحقیقات پیشین، شش سویه از ویروس کرونا شناسایی شد. در بین این شش سویه، چهار سویه از ویروس کرونا، غشای مخاطی انسانها را درگیر میکند و دو سویه دیگر منجر به سندرم تنفسی حاد شدید(SARS‐CoV) و سندرم تنفسی خاورمیانه (MERS‐CoV) میشوند (7). سندرم تنفسی حاد شدید در اثر سویه جدید، SARS‐CoV‐2 گسترش یافته است. شیوع این ویروس، جمعیت جهان را با میزان مرگ و میر بالای خود مورد تهدید قرار داد. در ابتدا، افراد مبتلا از علائمی مثل بدن درد، گلو درد، اسهال، التهاب ملتحمه، سر درد، از دست دادن احساس چشایی و بویایی، بثورات و تغییر رنگ پوست انگشتان دست یا پا رنج میبردند و در نهایت بیمارانی که در مراحل پایانی بودند، علائم تنگی نفس یا درد قفسهسینه را نشان دادند (8). بنابراین داروهای ضدویروسی بهطور فوری برای درمان افرادی که تحت تأثیر قرار گرفتهاند، نیاز است که بتواند میزان مرگومیر را کاهش دهد. این اواخر داروهای ریتوناویر، لوپیناویر، آوودین، ریباویرین، فاویپیراویر و رمدسیویر نیز بهعنوان درمان جایگزین برای افراد مبتلا به ویروسهای SARS استفاده شدهاند. این داروها تا پیش از این توسط سازمان غذا و داروی آمریکا (FDA) برای بیماریهای دیگر تأیید شدهاند، اما در حال حاضر نیز برای کاهش ویروسهای جدید نیز استفاده میشوند. در ابتدا داروهای کلروکین (CQ) و هیدروکسی کلروکین (HCQ) برای درمان آرتریت روماتوئید، لوپوس و پورفیریا کوتانئا تاردا (PCT) پیشنهاد شدند؛ اما بعدها این داروها برای بیماری ویروسی مالاریا نیز توصیه شدند (9). به همین نحو، اورانوفین برای درمان آرتریت روماتوئیدی تجویز میشد، ولی در حال حاضر برای ویروس جدید کرونا نیز پیشنهاد میشود. درمان ویروس با داروهای CQ و HCQ منجر به بهبودی بیشتر افراد مبتلا به کووید-19 شد. با این وجود، نقش CQو HCQ در کووید-19 هنوز نامشخص است، این درحالی است که کشف داروهای جدید یا ارزیابی داروهای منسوخ شده، فرآیندی هزینهبر و زمانبر است (10). در نتیجه، در تولید داروهای درمانی و بررسی استفاده احتمالی از داروهای کشف شده، نیاز است که از دادههای کامپیوتری کمک گرفته شود. با استفاده از ارزیابیهای مبتنی بر کامپیوتر، میتوانیم در صرف وقت و هزینه صرفهجویی کنیم (11). امروزه میدانیم سیانوباکتری ها نه تنها میتوانند بهصورت الگویی برای دارورسانی عمل کنند، بلکه منبعی از مولکولهای ارزشمند که فعالیتهای درمانی را نشان میدهند نیز هستند (12). در حال حاضر، سازمان بهداشت جهانی گزارش داد که هیچگونه واکسن یا داروی ضد ویروسی قابلتوجهی برای کاهش و پیشگری از ویروس جدید کووید-19 بهویژه سویه دلتا وجود ندارد. بهطور معمول افراد حتی پس از تزریق واکسن، به ویروس کرونای نوع دلتا مبتلا میشوند. بنابراین، تحقیقاتی به منظور شناسایی گزینههای ضد ویروسی نوین در حال آزمایش هستند که ورود آنها به بازار بسیار اهمیت دارد (13). یکی از مشکلات جهانی روز دنیا، افزایش سریع تعداد سویههای باکتریایی مقاوم به تمام آنتیبیوتیکهای شناختهشده از جمله باکتریهایی مانند E. coli و Klebsiella است. قطعا، میتوان گفت که داروهای موجود در بازار، دیگر در برابر همه باکتریها مؤثر نیستند. مشکل مقاومت آنتیبیوتیکی از سوی سازمان جهانی بهداشت بهعنوان یکی از ده تهدید اصلی جهانی برای بشر شناسایی شده است. دادههای موجود نشان میدهد که سالانه بیش از 27/1 میلیون نفر در سراسر جهان بر اثر عفونتهای ناشی از باکتریهای مقاوم به دارو جان خود را از دست میدهند (14).
کاربردهای زیستپزشکی نانوذرات بیوسنتز شده توسط سیانوباکتریها: حضور بیومولکولهای طبیعی موجود در این جلبکها، زیستسازگاری این نانوذرات را نسبت به سایر روشهای سنتزی بهبود میبخشد و از اینرو، امکان استفاده از آنها را در کاربردهای پزشکی فراهم میکند. علاوه بر این، پارامترهای رشد و محتوای متابولیتها را میتوان بهراحتی تغییر داد تا مورفولوژی نانوذرات متنوعی برای استفاده در زمینههای مختلف بهدست آید (15). مشکل اصلی در سنتز نانوذرات به روش زیستی، توزیع نامنظم اندازه یا شکلهای ناهمگون آنهاست. این مسئله میتواند ارزیابی محصول را در زمینه تعاملات مولکولی در بافتها و اندامها دشوار سازد. دلیل این تفاوتها به پیچیدگی مولکولهای شرکتکننده در فرآیند سنتز برمیگردد که با میزانهای مختلفی یونهای فلزی را کاهش میدهند. با اینحال، میتوان این مشکل را با بهکارگیری برخی ردههای خاص از متابولیتهای ثانویه کاهش داد و همزمان به درک بهتر نقش آنها در فرآیند سنتز دست یافت. در حال حاضر، عدم درک کافی از مکانیسم سنتز زیستی و همچنین اثرات بلندمدت نانوذرات، از دیگر محدودیتهای این روش بهشمار میآیند (16). مقاومت آنتیبیوتیکی در حال حاضر یکی از جدیترین تهدیدات برای سلامت انسان در سطح جهان بهشمار میآید. مصرف بیش از حد آنتیبیوتیکها باعث ظهور سویههای باکتریایی مقاوم به چندین دارو میشود که درمان آنها با داروهای موجود دشوار است. از اینرو، بهعنوان یک جایگزین، استفاده از نانوذرات بهعنوان عوامل ضدباکتریایی جدید با فعالیت باکتریکشی قوی پیشنهاد شده است. نانوذرات تولید شده قادرند دیواره و غشای سلولی باکتریها را تغییر دهند، به سیتوپلاسم نفوذ کنند و گونههای فعال اکسیژن تولید نمایند که این فرایند به آنزیمها، لیپیدها و DNA آسیب بیشتری وارد میکند. مولکولهای زیستی موجود در سطح نانوذرات میتوانند فعالیت ضدباکتریایی آنها را افزایش دهند، اگرچه نقش دقیق این مولکولها هنوز بهطور کامل درک نشده است. این نانوذرات بهطور مؤثر باکتریهای گرم مثبت و گرم منفی، از جمله سویههای حساس و مقاوم به چندین دارو را هدف قرار میدهند (17). فعالیت ضدباکتریایی نانوذرات ممکن است در سویههای مختلف از یک گونه باکتریایی متفاوت باشد که احتمالاً این تفاوت به انتقال افقی ژنها مرتبط است. در نتیجه، باکتریها ممکن است از طریق دریافت بخشهای ژنی که حاوی آنزیمهای مقاوم به عوامل ضدباکتریایی هستند، نسبت به نانوذرات مقاوم شوند. نقش روش تولید و شکل نانوذرات در فعالیت ضدباکتریایی آنها در جدول 1 نشان داده شده است. فعالیت ضدباکتریایی بیشتر با نانوذرات نقره آزمایش شده است، اما نانوذرات طلا و اکسید روی نیز بهخاطر خواص ضدباکتریایی مورد بررسی قرار گرفتهاند. همچنین، استفاده از گونههای مختلف میکروجلبک برای سنتز نانوذرات به تولید اشکال متنوعی منجر میشود که این امر نشاندهنده پتانسیل بالای میکروجلبکها برای تولید عوامل ضدباکتریایی است (18) (جدول 1). دیاتومها نوعی کربوهیدرات به نام کریسولامینارین تولید میکنند که از واحدهای گلوکز با پیوندهای β(1,3) و β(1,6) تشکیل شده است. این ماده میتواند در شرایط عادی حدود ۷ درصد از کل کربن موجود در دیاتومها را به خود اختصاص دهد و در شرایطی که مواد مغذی بسیار کم باشد، این مقدار تا ۸۰ درصد هم میرسد. کربوهیدراتها دارای گروههای کاهندهای مثل هیدروکسی و کربوکسی هستند که میتوانند به اتمهای فلزی متصل شده و آنها را کاهش دهند؛ به همین دلیل، میتوانند بهعنوان عوامل کاهنده عمل کنند (19). علاوه بر این، کربوهیدراتها به دلیل پیوندهای هیدروژنی بین مولکولی و درون مولکولی میتوانند به پایداری نانوذرات تشکیلشده کمک کنند و از چسبیدن و تجمع بیشتر آنها جلوگیری کنند. این ویژگی باعث میشود که کربوهیدراتها بهعنوان پوششی محافظ برای نانوذرات عمل کنند. در یک مطالعه، از کربوهیدراتهای ترشحی C. vulgaris برای تولید نانوذراتFeOOH استفاده شد. در این روش، کربوهیدراتها در فرایند تشکیل هسته نانوذرات با اتصال به یونهای آهن دخالت داشتند و مانع از بزرگ شدن بیش از حد ذرات در مرحله رشد میشدند. نتایج نشان داد که کربوهیدراتها بیشتر به دلیل خاصیت کاهندهشان مؤثر هستند تا بهعنوان پوششدهنده نانوذرات بهدستآمده کروی بودند و اندازهای بین 8 تا 17 نانومتر داشتند (20). پلیساکاریدهای ترشحی ازBotryococcus braunii و Chlorella pyrenoidosa نیز برای سنتز نانوذرات نقره مورد آزمایش قرار گرفتند. این پلیساکاریدها هم بهعنوان عامل کاهنده و هم بهعنوان عامل پوششی عمل کرده و از طریق گروههای کربوکسیل و هیدروکسیل به سطح نانوذرات نقره متصل شدند. اندازه نانوذرات بهدستآمده حدود ۵ تا ۱۵ نانومتر گزارش شد. همچنین، نانوذرات طلای سنتزشده با پلیساکاریدهای Chlorella sp. با نانوذرات طلایی که با استفاده از سیترات ساخته شده بودند، مقایسه شدند (21). هر دو نوع نانوذرات اندازه کنترلشدهای داشتند؛ با اینحال، نانوذرات طلای حاصل از پلیساکاریدها در بازهی pH بین ۲ تا ۱۲ پایدار بودند، در حالیکه نانوذرات طلای سیتراتی فقط در شرایط pH قلیایی پایداری داشتند. اندازه نانوذرات طلا با پلیساکاریدها بهطور قابلتوجهی بزرگتر بود (حدود ۳۰ تا ۴۰ نانومتر) در مقایسه با نانوذرات سیتراتی (۱۰ تا ۱۵ نانومتر). علاوه بر این، نانوذرات طلای سیتراتی در غلظتهای بسیار پایینتر NaCl (۳۰ برابر کمتر) تجمع میکردند که نشاندهنده پایداری سطح نانوذرات طلا با پوشش پلیساکاریدهای میکروجلبکی بود (22).
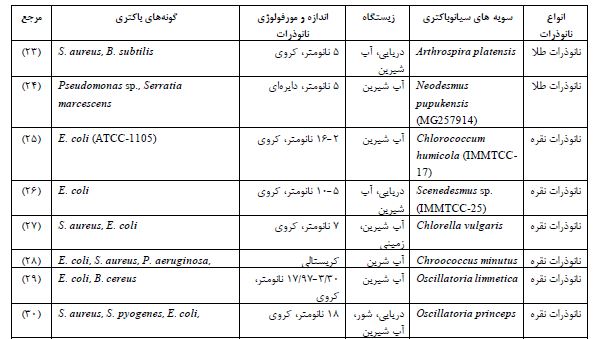
جدول 1: فعالیت ضد باکتریال نانوذرت بیوسنتز شده توسط سویههای مختلف سیانوباکتریها
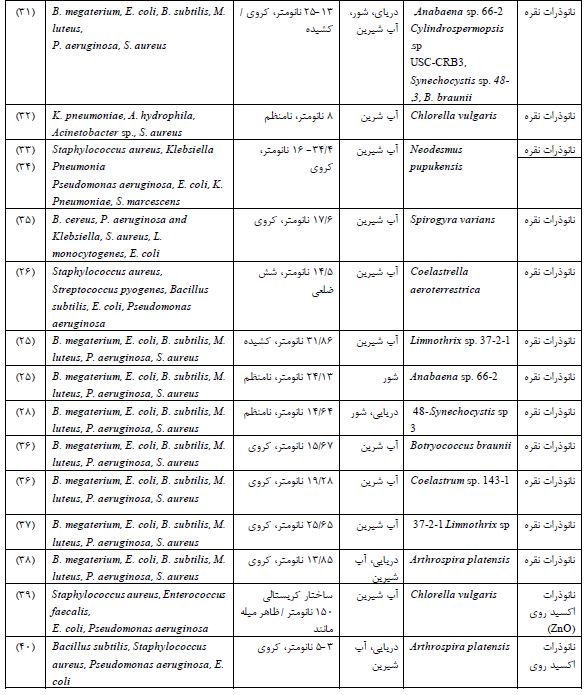
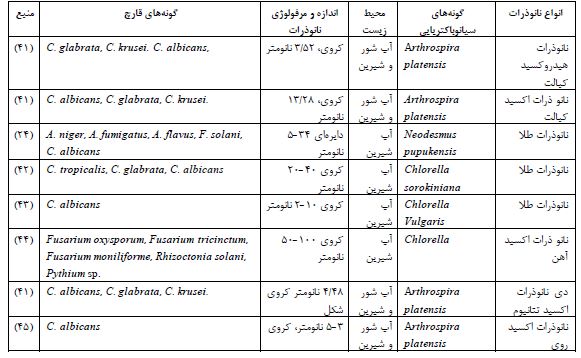
جدول 2: انواع نانوذرات ضد قارچی بیوسنتز شده توسط سیانوباکتریها
مکانیزم فعالیت ضدسرطانی نانوذرات سنتز شده از میکروجلبکها به تولید رادیکالهای آزاد اکسیژن مربوط میشود. در یک مطالعه اخیر توسط حمیده و همکاران، نانوذرات نقره توسط سویه آب شیرین Coelastrella aeroterrestrica سنتز شد و فعالیت ضدسرطانی آنها در برابر چهار رده سلولی بدخیم با نانوذرات نقره شیمیایی و داروی ضدسرطان ۵-فلوئوروراسیل مقایسه شد. نتایج نشان داد که نانوذرات نقره میکروجلبکی نه تنها، بالاترین فعالیت ضدپرولیفراسیو را در برابر ردههای سلولی MCF-7، MDA، HCT-116 و HepG2 نشان دادند، بلکه سمیت کمتری را در برابر ردههای سلولی غیرسرطانی در مقایسه با دوکسوروبیسین (Doxorubicin)، سیسپلاتین (Cisplatin) یا پاکلیتاکسل(Paclitaxel) در طول 72 ساعت نشان دادند. این فعالیت به اندازه کوچک، ثبات بالا و شیمی سطحی نانوذرات نسبت داده شد. اگر چه مکانیزم داخل سلولهای سرطانی و ویژگی فارماکوکنتیک نانوذرات نقره هنوز مورد بررسی قرار نگرفته است (26). تأثیر نانوکامپوزیتهای مختلف سنتز شده از میکروجلبکها بر ردههای سلولی سرطانی نیز مورد آزمایش قرار گرفت. در دو مطالعه جداگانه، عصاره S. obliquus برای ترکیب نانوذرات نقره با نانوذرات PtFe2O4 و نانوذرات GaFe2O4 استفاده شد (46). ویژگیهای سیتوتوکسیک نانوکامپوزیتهای PtFe2O4 به پیوند متقاطع بین Pt و DNA مربوط میشود که باعث اختلال در رونویسی و تکثیر، تولید گونههای فعال اکسیژن، پراکسیداسیون چربیها و تجزیه بیشتر گلوتاتیون توسط نانوذرات نقره میشود. بهطور مشابه، گالیم موجود در نانوکامپوزیتهای GaFe2O4 میتواند متابولیسم آهن را تغییر دهد، که منجر به ایجاد شکافت در کروماتین و تشکیل بدنههای آپوپتوتیک میشود که باعث مرگ سلولی میگردد. نانوکامپوزیتهای PtFe2O4 فعالیت ضدسرطانی برجستهتری نسبت به نانوکامپوزیتهای GaFe2O4 نشان دادند، اما این فعالیت همچنان کمتر از سیسپلاتین بود که یک داروی ضدسرطان برای درمان سرطان معده است و بهعنوان کنترل استفاده میشود. همچنین، نانوکامپوزیتهای MgFe2O4 با استفاده از عصاره C. vulgaris سنتز شدند که فعالیت ضدسرطانی خود را از طریق همان مسیر آپوپتوزی مشابه نشان دادند. نقش MgO در این نانوکامپوزیتها به بهبود ویژگیهای مغناطیسی و اختلال در غشای سلولی نسبت داده شد. برای بهبود فعالیت نانوکامپوزیتها و توصیف اثرات آنها در ردههای سلولی سرطانی و غیرسرطانی مختلف، نیاز به مطالعات بیشتری است. دیگر نانوذرات گزارششده که با استفاده از میکروجلبکها برای آزمایش فعالیت ضدسرطانی سنتز شدهاند (47). میکروجلبکها میتوانند به عنوان منبعی از ترکیبات با ارزش عمل کنند که نهتنها در سنتز داروهای ضدسرطان نقش دارند، بلکه خود نیز خواص ضدسرطانی از خود نشان میدهند. با این حال، عملکرد صحیح آنها نیازمند حفظ ساختارشان است که ممکن است به دلیل عوامل شیمیایی یا فیزیکی آسیب ببیند. در یک مطالعه توسط اینان و همکاران، عصارههای روغن میکروجلبکهای دریایی C. variabilis وC. pyrenoidosa در نانوذرات با استفاده از تکنیک الکترواسپری پوشش داده شدند. عصارههای روغنی پوشش دادهشده، سازگاری زیستی بالاتری نشان دادند، در حالیکه تنها عصاره روغنی C. variabilis خواص ضدسرطانی بهبود یافتهای نسبت به فرم غیرپوشش دادهشده از خود نشان داد. این فعالیت بهطور وابسته به دوز تغییر کرد و تغییراتی در مورفولوژی سلولها مشاهده شد. تحقیقات در زمینه بهینهسازی تکنیکهای پوششدهی میتواند منجر به توسعه داروهای ضدسرطان جدید از منبع میکروجلبکی شود (48). نقش پروتئینها در سنتز نانوذرات معمولاً با استفاده از تکنیکهای مبتنی بر طیفسنجی مادون قرمز تبدیل فوری (FTIR) بررسی میشود. نقش کاهشی پروتئینها در فرایند تبدیل گروه −CHO به −COOH مشخص میشود، در حالیکه گروههای NH2معمولاً وظیفه پوششدهی نانوذرات را از طریق اسیدهای آمینهای مانند سیستئین، تیروزین و تریپتوفان بهعهده دارند. همچنین طیفهای استخراج شده از Acutodesmus dimorphus و نانوذرات نقره مقایسه شدند و نشان داده شد که پیوندهای آمیدی در تثبیت نانوذرات نقره توسط پپتیدها و پروتئینها نقش دارند (49). نانوذرات بهدستآمده بهصورت کروی با اندازهای بین ۲ تا ۲۰ نانومتر بودند. علاوه بر این، تداخل قلههای طیفی بین عصاره آمادهشده و محصول نهایی نشاندهنده نقش پوشش در تثبیت نانوذرات و جلوگیری از تجمع آنها است. سطح نانوذرات میتواند با استفاده از پلیساکاریدهای سولفاتهشده و پروتئینها تغییر یافته و پیوندی میان نانوذرات و مولکولهای پوششدهنده ایجاد کند. پروتئینها همچنین تمایل زیادی به اتصال به یونهای فلزی دارند که بهعنوان عوامل کاهنده عمل میکنند (50). نتایج مشابهی برای نانوذرات AgCl ازChlorella vulgaris و نانوذرات Ti از میکروجلبک دریایی Phaeodactylum tricornutum گزارش شده است. با وجود آنکه مکانیزم دقیق سنتز نانوذرات بهطور کامل شناخته نشده است، استفاده از روش طراحی تجربی آماری و روششناسی سطح پاسخ برای تولید در مقیاس بزرگ در آینده مورد مطالعه قرار گرفته است (33). محتوای اسیدهای چرب ترکیبی از اسیدهای چرب اشباع و غیراشباع با زنجیرههای کربنی بلندتر، از جمله اسیدهای چرب امگا، تشکیل شده است. چربیهای اشباع در بدنهای لیپیدی خنثی ذخیره میشوند، در حالی که چربیهای غیراشباع با لیپیدهای قطبی در غشاها اتصال یافته و سیالیت غشا را تحت شرایط کشت متغیر حفظ میکنند (50). بخش کلی لیپیدها میتواند 20 تا 50 درصد از زیستتوده خشک را شامل شود، که این مقدار بسته به گونه میکروجلبک و شرایط کشت مانند دسترسی به مواد مغذی، شوری، شدت نور و فاز رشد متغیر است (51). در هنگام کمبود مواد مغذی، میزان لیپیدهای خنثی و پلیساکاریدها میتواند با کاهش پروتئینها افزایش یابد. بیشترین توجه به استخراج لیپیدها معطوف میشود و پس از آن تولید بیودیزل در اولویت قرار دارد، در حالیکه اسیدهای چرب چنداشباعشده به دلیل ارزش تغذیهای خود مورد استفاده قرارمیگیرند. برخلاف آب که معمولاً برای سنتز استفاده میشود، برای کار با لیپیدها نیاز به حلکنندههای مختلفی است. کومار و همکارانش از عصاره اتانولی برای سنتز نانوذراتAg/AgCl ازChlorella sp.، Lyngbya putealis، ocystis sp. وScenedesmus vacuolatus استفاده کردند (33). در طول فرایند بهینهسازی، گونه Oocystis sp.نتواست نانوذره تولید کند، در حالیکه عصارهChlorella sp. منجر به سنتز نانوذرات Ag/AgCl با کوچکترین اندازه شد. این مطالعه نشان داد که لیپیدها و پروتئینها به همراه حرکتهای کششی گروه هیدروکسیل در تشکیل نانوذرات Ag/AgCl با اندازه ۱۰ تا۲۰ نانومتر نقش دارند. در مطالعهای دیگر، لیپیدها و کربوهیدراتها بهطور جداگانه از Acutodesmus obliquus استخراج شده و برای سنتز نقاط کربن به روش حرارتی مایکروویو استفاده شدند. محصولات بهدستآمده اندازهای بین 1/2 تا 11 نانومتر داشتند. منبع کربن بر رفتار فلورسانسی تأثیری نداشت، اما تعاملات دقیق در طول سنتز بررسی نشد. خواص اپتیکی با اضافه کردن استون تغییر کرد که نشاندهنده پتانسیل استفاده از حلالهای مختلف برای سنتز است. نقش لیپیدها عمدتاً بهعنوان عاملهای پوششی در نظر گرفته شده است (52).
دارورسانی هدفمند با نانوذرات: دارورسانی هدفمند یک راهبرد است که داروها را بهصورت انتخابی به مناطق خاصی از بدن منتقل میکند تا اثرگذاری آنها را به حداکثر برساند و عوارض جانبی را کاهش دهد. در این راستا میکرورباتهایی برای بارگذاری دارو، انتقال هدفمند، و درمان ترکیبی شیمیدرمانی و فوتوترمالتراپی طراحی شدند (53). بهعنوان مثال میکرورباتهای حاوی داروی دوکسوروبیسین با استفاده از میکروجلبک دریایی Thalassiosira weissflogii به عنوان قالب ساخته شدند تا جایگزینی برای نانوذرات سیلیکای مزومتخلخل باشد. نانوذرات مغناطیسی Fe3O4 روی سطح این قالب چسبیده شدند تا امکان حرکت میکرورباتها را با نیروی مغناطیسی فراهم کنند. با اعمال یک میدان مغناطیسی خارجی، میتوان حرکت این میکرورباتها را با تغییر فرکانس میدان کنترل کرد و آنها را از میان مسیرهای باریک با اندازههای مختلف عبور داد. این میکرورباتها بهصورت خوشهای عمل میکنند و میتوانند بار دارویی زیادی را به محل موردنظر برسانند و سپس دارو را بهصورت حساس به pH آزاد کنند. این میکرورباتها روی سلولهای سرطان سینه انسانی MCF-7 آزمایش شدند و کارایی خود را در انتقال دارو نشان دادند. البته برای تأیید کاربرد آنها، نیاز به مطالعات بیشتری در شرایط زنده in Vivo است (54). در مطالعه دیگری، از میکروجلبک دریاییT. weissflogii بهعنوان الگو برای انتقال داروهای حاوی کورکومین استفاده شد تا خواص ضدسرطان و ضدباکتری آن بررسی شود. ساختار نانو T. weissflogii مانند یک قفس عمل کرده و داروی کورکومین را جذب میکند. این جذب با کمک تعاملات گروههای شیمیایی روی سطح جلبک تثبیت میشود. پتانسیل استفاده از T. weissflogii برای سیستمهای دارورسانی نشان میدهد که میتواند در آینده برای درمان انواع بیماریها کاربرد داشته باشد (55). میکروجلبکها نهتنها میتوانند بهعنوان الگو برای انتقال دارو استفاده شوند، بلکه میتوانند منبع مولکولهای ارزشمندی باشند که خواص درمانی دارند. عصاره روغنی میکروجلبکهای آب شیرین Botryococcus braunii و Microcystis aeruginosa که غنی از اسیدهای چرب غیراشباع هستند، در نانوذراتی که با آلژینات/پلیوینیلیدین (PVA) بهصورت الکترواسپری بارگذاری شدند، آزمایش شدند تا فعالیت ضدباکتری آنها بررسی شود. این کپسولهسازی خواص بیولوژیکی فعال و آنتیاکسیدانی روغن را حفظ کرده و نشان میدهد که میتوان از آنها برای ذخیرهسازی و کاربردهای تجاری استفاده کرد (56).
طراحی دارو با نانوذرات: در حال حاضر، در مقابله با شیوع بیماری COVID-19، شرکتهای داروسازی در حال تلاش برای توسعه درمانهای ضد ویروسی جدید برای ویروس SARS-CoV-2 هستند. در این زمینه، طراحی دارو به کمک کامپیوتر بسیار مفید است، زیرا این روش به محققان کمک میکند تا بدون صرف زمان و هزینه زیاد، داروهایی که میتوانند ویروس را مهار کند، شناسایی کنند CADD. بهعنوان یک روش منطقی و هدفمند در طراحی داروها شناخته میشود و نقش مهمی در کشف داروهای جدید ایفا میکند (57). این رویکرد امیدوارکننده در بیوانفورماتیک از سیستمهای کامپیوتری استفاده میکند که میتوانند مانند انسان فکر کنند و به شناسایی اثرات دقیق داروها کمک کنند. برای بهبود کیفیت مراقبت از بیمار، از سوابق پزشکی الکترونیکی که با اطلاعات ژنومی خاص بیمار ادغام شده است، استفاده میشود. با وجود تمام دادهها، هنوز هیچ داروی دقیقی برای COVID-19 توصیه نشده است. این رویکرد تحقیقاتی به جستجوی روشهای درمانی جدید در شرایط اضطراری پاندمی کمک میکند که مراقبت و درمان مناسبی را برای افراد مبتلا ارائه میدهد (58). قبل از اینکه بتوانیم شبکهای برای اتصال مولکولی بسازیم و یا اتصال مولکولی را انجام دهیم، باید حفرهای که دارو به آن وصل میشود را شناسایی کنیم. این حفره در واقع بخشی از پروتئین است که لیگاند میتواند به آن بچسبد. حفره فعال، که توسط تعدادی از آمینواسیدها (باقیماندهها) احاطه شده است جایی است که لیگاند به پروتئین متصل میشود. بدون شناسایی این حفره، نمیتوانیم بگوییم کدام بخش از پروتئین برای دارو مهم است (59). پس از شناسایی حفره، اطلاعاتی مانند نمرات مربوط به حفره و حجم آن نیز به ما داده میشود. نمره حفره، یک معیار است که نشاندهنده قابلیت و کیفیت حفره برای اتصال مولکولهای دارویی میباشد. این اطلاعات کمک میکند تا بدانیم کدام حفره برای اتصال دارو مناسبتر است. در نهایت، حفرهای که حجم بیشتری دارد برای ایجاد شبکه انتخاب میشود (60). این روش برای قفل کردن محل اتصال لیگاند در مولکول پروتئین استفاده میشود. این به این معناست که محققان میخواهند مطمئن شوند که لیگاند (دارو) در محل مناسب خود در پروتئین قرار گیرد. اینکار برای مطالعه چگونگی تعامل دارو با پروتئین بسیار مهم است. لیگاندهایی که آماده شدهاند، به مولکول هدف (پروتئین) متصل میشوند. این اتصال میتواند به ما کمک کند تا بفهمیم لیگاند چگونه با پروتئین ارتباط برقرار میکند و چه اثراتی خواهد داشت. حفره اتصال در ساختار بلوری اطراف لیگاند نمایش داده میشود. ساختار بلوری به ما این امکان را میدهد که نحوه قرارگیری لیگاند در پروتئین را مشاهده کنیم. ماژول "گلاید" ابزاری است که برای تولید حجم شبکهای استفاده میشود که لیگاند در آن قرار میگیرد. این شبکه بهعنوان یک فضای مجازی عمل میکند که لیگاند در آن قرار میگیرد. در مرکز حفرهای که لیگاند به آن متصل میشود، یک شبکه سهبعدی تولید میشود. این شبکه به محققان کمک میکند تا بررسی کنند لیگاند چگونه میتواند در این فضای مشخص قرار گیرد. مختصات X، Y و Z به ما کمک میکند تا ابعاد و موقعیت شبکه را در فضای سهبعدی تعریف کنیم. این مختصات به شکلگیری یک جعبه شبکهای کمک میکند که میتوان در آن لیگاندها را بررسی کرد. در این مرحله، نمرات خام (ارزیابی اولیه از عملکرد لیگاند) و فیلترهای هندسی (قوانینی که مشخص میکنند لیگاند چگونه باید در حفره قرار گیرد) بررسی میشوند. هدف این است که گزینههایی که نامناسب هستند حذف شوند تا فقط بهترین و مناسبترین لیگاندها برای مطالعه باقی بمانند (61). اتصال مولکولی بهطور گستردهای برای پیشبینی ساختار دقیق و پیچیده بین پروتئین و لیگاند استفاده میشود. غربالگری مجازی، یک روش رایانهای است که به کمک آن میتوان لیگاندهای مختلف را بررسی کرد تا بهترین گزینه برای اتصال به پروتئین شناسایی شود. در اینجا از توابع انرژی و نمرهدهی استفاده میشود. نمرهدهی به ما نشان میدهد که کدام لیگاندها بهتر و قویتر به پروتئین متصل میشوند. در اتصال مولکولی، هدف این است که بتوانیم بین حالتهای صحیح و مناسب اتصال و حالتهایی که کارآمد نیستند تمایز قائل شویم. این کمک میکند که فقط بهترین و مؤثرترین حالتها را برای طراحی دارو انتخاب کنیم (62). اتصال مولکولی به محققان این امکان را میدهد که بهینهترین شرایط را برای عملکرد آنزیمها و نحوه اتصال لیگاند به پروتئین پیدا کنند. به عبارت دیگر، هدف این است که اتصال مولکولی به گونهای باشد که بیشترین تأثیرگذاری را داشته باشد. محدودیتهای تجربی و تئوری مرزهایی را برای تعیین انرژی آزاد لیگاند در اتصال ایجاد میکنند که در پیشبینیها و شبیهسازیها اهمیت دارند. پیشبینیهای اتصال مولکولی به شناسایی پتانسیل دارویی مولکولهای لیگاند کمک میکنند این روش هنگامی که اطلاعات دقیقی از نوع تعاملات خاص بین اتمهای لیگاند و پروتئین وجود ندارد، راهکارهایی کاربردی ارائه میدهد (63). در این روش از طراحی دارو با کمک کامپیوتر استفاده میشود تا نقاط تماس گروههای متوکسیل، هیدروکسیل و دیگر بخشهای لیگاند با نقاط اتصال روی پروتئین هدف شناسایی شوند. طراحی دارو با کمک کامپیوتر، قدرت اتصال، ویژگیهای فیزیکوشیمیایی، انرژی اتصال، امتیاز و غیره را ارزیابی میکند (64). در این مرحله، این روش نسبت به روشهای مبتنی بر ساختار، موفقیت بیشتری دارد. این فرآیند بیشتر روی ویژگیهای زیستی لیگاند تمرکز دارد و طراحی دارو بر اساس لیگاند یک راهکار مهم برای پیدا کردن مهارکننده (لیگاند) دقیق برای پروتئین هدف محسوب میشود (65). در مراحل ابتدایی توسعه دارو، محققان نیاز دارند بدانند که چه عواملی میتوانند بر عملکرد دارو در بدن تأثیر بگذارند. به همین دلیل از شاخصهای فیزیکوشیمیایی استفاده میکنند که به آنها کمک میکند تا متغیرهای کلیدی را شناسایی کنند. برخی از خواص فیزیکوشیمیایی مهم که از طریق فرآیند ADME محاسبه میشوند شامل نفوذپذیری، حلالیت، لیپوفیلیسیته، یکپارچگی و پایداری هستند. در مراحل اولیه، برخی از اثرات مضر که میتوانند بر ایمنی و اثرگذاری دارو تأثیر بگذارند، بهخوبی شناسایی نشده بودند. این امر میتواند به مشکلاتی در استفاده از دارو منجر شود. از زمان شروع کشف دارو با استفاده از روشهای in-silico برای پیشبینی خواص فارماکوکینتیک دقیق مولکولها به کار رفته است (66). به منظور تشخیص ویژگیهای فیزیکی ویریون، و میل ترکیبی مولکولهای دارو، CADD حائز اهمیت است، زیرا میتواند به دانشمندان تجربی/بالینی کمک کند تا بازدارندههای موثری را با استفاده از روشهای آزمایشگاهی شناسایی کنند. بسیاری از آنزیمهای احتمالی و مسیرهای سیگنالی که مخصوص سویه SARS-CoV-2 هستند با کمک فناوری پیشرفته ایجاد شدهاند. با این حال، تنها چند مانع در توسعه دارو برای سویه دلتا SARS-CoV-2 وجود دارند. موانع اصلی در این راه در دسترس نبودن گزینههای دارویی مؤثر و بودجه کافی برای انجام تحقیقات است. امروزه راهبردهای مهم کشف دارو در صنعت داروسازی، بهویژه تحقیقات ویروسی در اولویت قرار دارند. حتی با وجود این شرایط هنوز درمان دارویی خاصی وجود ندارد. در حال حاضر، داروهای مورد تأیید FDA مانند CQ و HCQ، به عنوان گزینه درمانی جایگزین برای افراد آلوده به سویه SARS‐CoV‐2‐ استفاده میشوند. با اینحال، مطالعات فارماکولوژیک بیشتری در مورد مولکولهای سیانوباکتری پیشنهاد شده، برای درمان ویروس کرونا نیاز است.
روش بررسی
در این مقاله مروری، بیش از 200 نشریه معتبر در رابطه با ترکیبات طبیعی موجود در سیانوباکتریها ازجمله ترکیبات ضد باکتریایی، ضد قارچی، ضد سرطانی و همچنین استفاده از عصاره سیانوباکتریها و نانوذرات بیوسنتز شده از آنها در درمان بیماریها از پایگاههای اطلاعاتی مانندScience Direct، Scopus، Web of Sciences و فهرست مجلات با دسترسی آزاد جستجو گردید. برای جستجو از کلیدواژههایی مانند «سیانوباکتریها»، «ترکیبات فعال زیستی»، «دارورسانی هدفمند»، «نانوذرات»، «پلی ساکاریدها»، «ضد باکتریال»، «ضد قارچ»، «ضد سرطان» و «طراحی دارو» استفاده گردید.
نتیجهگیری
به منظور کاهش شدت بیماری های عفونی، جایگزینهای ضد میکروبی مستخرج از ترکیبات طبیعی ضروری هستند، زیرا از این جایگزینها میتوان برای پیشگیری از شیوع و همهگیری بیماریها بسیار موثر هستند. در این زمینه، متابولیتهای ثانویه بالقوه بهدستآمده از گونههای مختلف سیانوباکتریها میتوانند به بهبود یک مدل درمانی برای مقابله با عفونتهای ویروسی شایع و پاندمیهای جهشیافته امروزی و آینده کمک کنند. میکروجلبکها بدون شک کاندیداهای بسیار مناسبی برای سنتز انواع نانوذرات با خواص ضد ویروسی، ضد باکتریایی و ضد قارچی بهشمار میآیند، زیرا محتوای غنی از متابولیتهای ثانویه دارند که بهعنوان عوامل کاهنده و پوششدهنده عمل میکنند. با اینحال، این فرایند ممکن است با محدودیتهایی روبهرو شود، از جمله بازده پایین، نیاز به بهینهسازی شرایط یا زمان زیادی که برای تکمیل سنتز لازم است. برای توضیح کامل تولید نانوذرات، لازم است مکانیزم دقیق عملکرد متابولیتها مورد بررسی قرار گیرد. دامنه وسیع نانوذراتی که از میکروجلبکها سنتز میشوند و در بخش پزشکی کاربرد دارند، پتانسیل متابولیتها برای تاثیرگذاری بر ویژگیهای فیزیکوشیمیایی نانوذرات را نشان میدهد. تحقیقات بیشتر لازم است تا مسائل مرتبط با سینتیک، بقای سلولی و بازده نانوذرات با روشهای سنتزی معمولی و استفاده از میکروجلبکها مورد بررسی قرار گیرد. بنابر این تغییر در شرایط سنتز ممکن است به گسترش دانش در مورد نقش متابولیتها در ویژگیهای نانوذرات منجر شود. با توجه به اینکه امروزه محققان ایرانی درون کشور توانسته اند به تکنولوژی کشت انبوه سویههای سیانوباکتریایی و تهیه هرباریوم جلبکی البرز با بیش از دویست سویه مجزا دست یابند، میتوان انواع مختلف میکروجلبکها و پیشمادهها را برای کاربردهای بیومدیکال آزمایش کرد. علاوه بر این، تکنیکهای مختلف در تهیه عصارهها و هدفگذاری متابولیتهای خاص میتواند نقش آنها در سنتز نانوذرات را روشن کند. بنابراین، تحقیقات آینده در زمینه سنتز نانوذرات با استفاده از میکروجلبکها میتواند به بهینهسازی فرایند کمک کند و به درک عمیقتری از ارتباط بین سنتز، ویژگیها و عملکرد نانوذرات منجر شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
سیانوباکتریها گروه قابلتوجهی از باکتریهای گرم منفی هستند که نقش مهمی در تکامل اشکال اولیه حیات بر روی زمین ایفا کردهاند. این میکروارگانیسمها در سراسر جهان و در اکوسیستمهای مختلفی مانند خاکها، آبهای شیرین و اقیانوسها، و همچنین محیطهای دشوار را مستعمره میسازند. سیانوباکتریها تنها گروه از موجودات پروکاریوتی هستند که قادر به انجام فتوسنتز اکسیژنی هستند. از اینرو، باور بر این است که آنها مسئول اکسیژنرسانی به جو و اقیانوسها بودهاند. این باکتریها انرژی خورشیدی را با کارآیی بهطور قابلتوجهی بالا (3 تا 9 درصد) جذب میکنند که این امر از تثبیت مقادیر زیادی نیتروژن و کربن غیرآلی پشتیبانی میکند. وجود گسترده سیانوباکتریها در بیوسفر با دسترسی به نور به دلیل تنوع مسیرهای بیوسنتزی، تنوع فیلوژنتیکی و پتانسیل تولید ترکیبات مختلف است که آنها را از رقبای احتمالی محافظت میکند (1). به دلیل تنوع شیمیایی ترکیبات تولیدشده توسط سیانوباکتریها، مسیرهای سنتزی پیچیده و متنوعی در تولید آنها دخیل هستند که بسته به نوع ماده تولیدی متفاوت است. بیشتر این بیومولکولها عمدتاً توسط پلیکتید سنتاز (PKS)، پلیپپتید سنتاز غیرریبوزومی (NRPS) و ترکیب این دو مسیر (PKS-NRPS) سنتز میشوند. علاوه بر این، این ترکیبات میتوانند دستخوش تغییرات شیمیایی مانند هالوژنه شدن، متیله شدن و اکسیداسیون قرار گیرند. بهعلاوه، برخی از ترکیبات میتوانند توسط ریبوزومها سنتز شده و سپس بهصورت پس از ترجمهای اصلاح شوند. در کل دو نوع مسیر بیوسنتزی، پپتیدها را تولید می کنند: این دو مسیر یا توسط آنزیمهای چند دمین بسیار بزرگ NRPS یا توسط سنتز ریبوزومی، پردازش و اصلاحات بعد از ترجمه، انجامپذیر است. NRPSها، شامل بخشهایی هستند که هر کدام مسئول اضافه کردن اسیدآمینهای خاص هستند. ترتیب این مودولها، بر طبق قانون است، به این ترتیب که پی در پی بودن مودولها مرتبط با ترتیب اسیدهای آمینه در محصول نهایی است. کوچکترین بخش از یک اسید آمینه فعالکننده دمین آدنیلیشن Adenylation (A) domains A))، یک دمین پروتئینی حامل پپتیدیل (PCP) Peptidyl carrier protein (PCP) حمل کننده کوفاکتور فسفوپنتانئین Phosphopantetheine و یک دمین C تراکمی، تشکیل شده است. NRPSها میتوانند تقریباً 300 سوبسترای پروتئینی و غیرپروتئینی را بپذیرند و ممکن است شامل دمینهای بیشتری باشند که منجر به اصلاحات و اپیمریزه کردن سوبستراهای اسید آمینهای میشود. در مقابل، بیوسنتز ریبوزومی پپتیدها، محدود به 20 اسید آمینه پروتئینی است. با اینحال، تنوع بالا و پتانسیل بیوسنتزی و فعال زیستی در این گروه از پپتیدها، بسیار قابلتوجه است. در سالهای اخیر پژوهشها نشان دادهاند که ترکیبات تولیدشده توسط سیانوباکترها میتوانند بهعنوان جایگزینهای مؤثری برای آنتیبیوتیکها در مقابله با عفونتهای ویروسی و باکتریایی عمل کنند (2). در میان گروههای ترکیبات سنتز شده توسط سیانوباکتریها با فعالیت ضد میکروبی میتوان پلیکتیدها، آلکالوئیدها، پپتیدها، ترپنها، لیپیدها و پلیفنولها را نام برد. هر یک از این گروه از ترکیبات دارای مکانیسم عمل خاصی هستند که با متابولیسم باکتری بیماریزا اختلال ایجاد میکنند. مکانیسمهای اصلی عملکرد این مولکولها عبارتاند از: (i) مهار پمپهای افلاکس (مانند آلکالوئیدها)، (ii) مهار ترجمه از طریق جلوگیری از اتصال tRNA به mRNA (مانند پلیکتیدها)؛(iii) تنظیم منفی تکثیر و رونویسی DNA از طریق مهار پلیمرازهای مربوطه (مانند آلکالوئیدها)؛ (iv) بیثباتسازی دیواره سلولی باکتری و اختلال در زنجیره انتقال الکترون (مانند پپتیدها و لیپیدها)؛ گروههای ترکیبات تولید شده توسط سیانوباکترها با فعالیت ضدویروسی شامل پروتئینها، کربوهیدراتها، سولفوگلیکولیپیدها، پلیکتیدها، آلکالوئیدها، لیپیدها و پلیفنولها هستند. مکانیسمهای شناساییشده برای اثرگذاری متابولیتهای دارای پتانسیل ضدویروسی به شرح زیر میباشد: (i) مهار اتصال پروتئین ویروسی به سلول میزبان؛ (ii) مهار تکثیر ویروس؛ (iii) اتصال به گیرندههای سلول میزبان برای جلوگیری از گسترش عفونت (3). تحقیقات پیشین به وضوح نشان دادهاند که سیانوباکتریها و متابولیتها آنها میتوانند درمانی محتمل برای طیف گستردهای از بیماریهای انسانی از جمله سرطان، دیابت، اختلالات دستگاه عصبی مرکزی، عفونتهای ویروسی و مواردی مانند آن باشند (4). ریزجلبکها به دلیل افزایش سریع زیست توده، عدم نیاز به زمینهای زراعی و فراوانی متابولیتها با ارزش هستند. علاوه بر این، ریزجلبکها را میتوان در فاضلابهای غیر صنعتی نیز کشت کرد که یک جنبه مهم اقتصادی است. مواد فعال زیستی مشتق شده از متابولیسم ثانویه مانند پروتئینها، پلیساکاریدها، لیپیدها، ویتامینها و رنگدانهها پتانسیل زیادی را برای بسیاری از کاربردها نشان دادهاند. علاوه بر این، کاربردهای زیستپزشکی برای نشان دادن پتانسیل ریزجلبکها برای مصارف پزشکی مورد توجه قرار گرفته است (5). بنابراین، هدف از این مقاله مروری، خلاصه و بحث گزارشهای قبلی درباره فعالیتهای ضدویروسی و ضدباکتریایی سیانوباکتریها و متابولیتهای آنهاست. علاوه بر این، در این مقاله جدیدترین روشهای زیستشناسی مولکولی پیشرفته که از سیانوباکتریها برای سنتز نانوذرات با خواص ضد میکروبی استفاده شده است را به همراه طراحی دارو و دارورسانی هدفمند مورد بررسی قرار میدهد.
متابولیتهای ضد ویروسی سیانوباکتریها: ویروس کرونا که متعلق به خانواده کروناویریده و زیر مجموعه کروناویرینه است، برای بیمارانی که دچار ضعف ایمنی هستند، بسیار خطرناک است، این ویروس، به شدت بر سیستم تنفسی و گوارشی انسانها و حیوانات تأثیر میگذارد (6). بر اساس تحقیقات پیشین، شش سویه از ویروس کرونا شناسایی شد. در بین این شش سویه، چهار سویه از ویروس کرونا، غشای مخاطی انسانها را درگیر میکند و دو سویه دیگر منجر به سندرم تنفسی حاد شدید(SARS‐CoV) و سندرم تنفسی خاورمیانه (MERS‐CoV) میشوند (7). سندرم تنفسی حاد شدید در اثر سویه جدید، SARS‐CoV‐2 گسترش یافته است. شیوع این ویروس، جمعیت جهان را با میزان مرگ و میر بالای خود مورد تهدید قرار داد. در ابتدا، افراد مبتلا از علائمی مثل بدن درد، گلو درد، اسهال، التهاب ملتحمه، سر درد، از دست دادن احساس چشایی و بویایی، بثورات و تغییر رنگ پوست انگشتان دست یا پا رنج میبردند و در نهایت بیمارانی که در مراحل پایانی بودند، علائم تنگی نفس یا درد قفسهسینه را نشان دادند (8). بنابراین داروهای ضدویروسی بهطور فوری برای درمان افرادی که تحت تأثیر قرار گرفتهاند، نیاز است که بتواند میزان مرگومیر را کاهش دهد. این اواخر داروهای ریتوناویر، لوپیناویر، آوودین، ریباویرین، فاویپیراویر و رمدسیویر نیز بهعنوان درمان جایگزین برای افراد مبتلا به ویروسهای SARS استفاده شدهاند. این داروها تا پیش از این توسط سازمان غذا و داروی آمریکا (FDA) برای بیماریهای دیگر تأیید شدهاند، اما در حال حاضر نیز برای کاهش ویروسهای جدید نیز استفاده میشوند. در ابتدا داروهای کلروکین (CQ) و هیدروکسی کلروکین (HCQ) برای درمان آرتریت روماتوئید، لوپوس و پورفیریا کوتانئا تاردا (PCT) پیشنهاد شدند؛ اما بعدها این داروها برای بیماری ویروسی مالاریا نیز توصیه شدند (9). به همین نحو، اورانوفین برای درمان آرتریت روماتوئیدی تجویز میشد، ولی در حال حاضر برای ویروس جدید کرونا نیز پیشنهاد میشود. درمان ویروس با داروهای CQ و HCQ منجر به بهبودی بیشتر افراد مبتلا به کووید-19 شد. با این وجود، نقش CQو HCQ در کووید-19 هنوز نامشخص است، این درحالی است که کشف داروهای جدید یا ارزیابی داروهای منسوخ شده، فرآیندی هزینهبر و زمانبر است (10). در نتیجه، در تولید داروهای درمانی و بررسی استفاده احتمالی از داروهای کشف شده، نیاز است که از دادههای کامپیوتری کمک گرفته شود. با استفاده از ارزیابیهای مبتنی بر کامپیوتر، میتوانیم در صرف وقت و هزینه صرفهجویی کنیم (11). امروزه میدانیم سیانوباکتری ها نه تنها میتوانند بهصورت الگویی برای دارورسانی عمل کنند، بلکه منبعی از مولکولهای ارزشمند که فعالیتهای درمانی را نشان میدهند نیز هستند (12). در حال حاضر، سازمان بهداشت جهانی گزارش داد که هیچگونه واکسن یا داروی ضد ویروسی قابلتوجهی برای کاهش و پیشگری از ویروس جدید کووید-19 بهویژه سویه دلتا وجود ندارد. بهطور معمول افراد حتی پس از تزریق واکسن، به ویروس کرونای نوع دلتا مبتلا میشوند. بنابراین، تحقیقاتی به منظور شناسایی گزینههای ضد ویروسی نوین در حال آزمایش هستند که ورود آنها به بازار بسیار اهمیت دارد (13). یکی از مشکلات جهانی روز دنیا، افزایش سریع تعداد سویههای باکتریایی مقاوم به تمام آنتیبیوتیکهای شناختهشده از جمله باکتریهایی مانند E. coli و Klebsiella است. قطعا، میتوان گفت که داروهای موجود در بازار، دیگر در برابر همه باکتریها مؤثر نیستند. مشکل مقاومت آنتیبیوتیکی از سوی سازمان جهانی بهداشت بهعنوان یکی از ده تهدید اصلی جهانی برای بشر شناسایی شده است. دادههای موجود نشان میدهد که سالانه بیش از 27/1 میلیون نفر در سراسر جهان بر اثر عفونتهای ناشی از باکتریهای مقاوم به دارو جان خود را از دست میدهند (14).
کاربردهای زیستپزشکی نانوذرات بیوسنتز شده توسط سیانوباکتریها: حضور بیومولکولهای طبیعی موجود در این جلبکها، زیستسازگاری این نانوذرات را نسبت به سایر روشهای سنتزی بهبود میبخشد و از اینرو، امکان استفاده از آنها را در کاربردهای پزشکی فراهم میکند. علاوه بر این، پارامترهای رشد و محتوای متابولیتها را میتوان بهراحتی تغییر داد تا مورفولوژی نانوذرات متنوعی برای استفاده در زمینههای مختلف بهدست آید (15). مشکل اصلی در سنتز نانوذرات به روش زیستی، توزیع نامنظم اندازه یا شکلهای ناهمگون آنهاست. این مسئله میتواند ارزیابی محصول را در زمینه تعاملات مولکولی در بافتها و اندامها دشوار سازد. دلیل این تفاوتها به پیچیدگی مولکولهای شرکتکننده در فرآیند سنتز برمیگردد که با میزانهای مختلفی یونهای فلزی را کاهش میدهند. با اینحال، میتوان این مشکل را با بهکارگیری برخی ردههای خاص از متابولیتهای ثانویه کاهش داد و همزمان به درک بهتر نقش آنها در فرآیند سنتز دست یافت. در حال حاضر، عدم درک کافی از مکانیسم سنتز زیستی و همچنین اثرات بلندمدت نانوذرات، از دیگر محدودیتهای این روش بهشمار میآیند (16). مقاومت آنتیبیوتیکی در حال حاضر یکی از جدیترین تهدیدات برای سلامت انسان در سطح جهان بهشمار میآید. مصرف بیش از حد آنتیبیوتیکها باعث ظهور سویههای باکتریایی مقاوم به چندین دارو میشود که درمان آنها با داروهای موجود دشوار است. از اینرو، بهعنوان یک جایگزین، استفاده از نانوذرات بهعنوان عوامل ضدباکتریایی جدید با فعالیت باکتریکشی قوی پیشنهاد شده است. نانوذرات تولید شده قادرند دیواره و غشای سلولی باکتریها را تغییر دهند، به سیتوپلاسم نفوذ کنند و گونههای فعال اکسیژن تولید نمایند که این فرایند به آنزیمها، لیپیدها و DNA آسیب بیشتری وارد میکند. مولکولهای زیستی موجود در سطح نانوذرات میتوانند فعالیت ضدباکتریایی آنها را افزایش دهند، اگرچه نقش دقیق این مولکولها هنوز بهطور کامل درک نشده است. این نانوذرات بهطور مؤثر باکتریهای گرم مثبت و گرم منفی، از جمله سویههای حساس و مقاوم به چندین دارو را هدف قرار میدهند (17). فعالیت ضدباکتریایی نانوذرات ممکن است در سویههای مختلف از یک گونه باکتریایی متفاوت باشد که احتمالاً این تفاوت به انتقال افقی ژنها مرتبط است. در نتیجه، باکتریها ممکن است از طریق دریافت بخشهای ژنی که حاوی آنزیمهای مقاوم به عوامل ضدباکتریایی هستند، نسبت به نانوذرات مقاوم شوند. نقش روش تولید و شکل نانوذرات در فعالیت ضدباکتریایی آنها در جدول 1 نشان داده شده است. فعالیت ضدباکتریایی بیشتر با نانوذرات نقره آزمایش شده است، اما نانوذرات طلا و اکسید روی نیز بهخاطر خواص ضدباکتریایی مورد بررسی قرار گرفتهاند. همچنین، استفاده از گونههای مختلف میکروجلبک برای سنتز نانوذرات به تولید اشکال متنوعی منجر میشود که این امر نشاندهنده پتانسیل بالای میکروجلبکها برای تولید عوامل ضدباکتریایی است (18) (جدول 1). دیاتومها نوعی کربوهیدرات به نام کریسولامینارین تولید میکنند که از واحدهای گلوکز با پیوندهای β(1,3) و β(1,6) تشکیل شده است. این ماده میتواند در شرایط عادی حدود ۷ درصد از کل کربن موجود در دیاتومها را به خود اختصاص دهد و در شرایطی که مواد مغذی بسیار کم باشد، این مقدار تا ۸۰ درصد هم میرسد. کربوهیدراتها دارای گروههای کاهندهای مثل هیدروکسی و کربوکسی هستند که میتوانند به اتمهای فلزی متصل شده و آنها را کاهش دهند؛ به همین دلیل، میتوانند بهعنوان عوامل کاهنده عمل کنند (19). علاوه بر این، کربوهیدراتها به دلیل پیوندهای هیدروژنی بین مولکولی و درون مولکولی میتوانند به پایداری نانوذرات تشکیلشده کمک کنند و از چسبیدن و تجمع بیشتر آنها جلوگیری کنند. این ویژگی باعث میشود که کربوهیدراتها بهعنوان پوششی محافظ برای نانوذرات عمل کنند. در یک مطالعه، از کربوهیدراتهای ترشحی C. vulgaris برای تولید نانوذراتFeOOH استفاده شد. در این روش، کربوهیدراتها در فرایند تشکیل هسته نانوذرات با اتصال به یونهای آهن دخالت داشتند و مانع از بزرگ شدن بیش از حد ذرات در مرحله رشد میشدند. نتایج نشان داد که کربوهیدراتها بیشتر به دلیل خاصیت کاهندهشان مؤثر هستند تا بهعنوان پوششدهنده نانوذرات بهدستآمده کروی بودند و اندازهای بین 8 تا 17 نانومتر داشتند (20). پلیساکاریدهای ترشحی ازBotryococcus braunii و Chlorella pyrenoidosa نیز برای سنتز نانوذرات نقره مورد آزمایش قرار گرفتند. این پلیساکاریدها هم بهعنوان عامل کاهنده و هم بهعنوان عامل پوششی عمل کرده و از طریق گروههای کربوکسیل و هیدروکسیل به سطح نانوذرات نقره متصل شدند. اندازه نانوذرات بهدستآمده حدود ۵ تا ۱۵ نانومتر گزارش شد. همچنین، نانوذرات طلای سنتزشده با پلیساکاریدهای Chlorella sp. با نانوذرات طلایی که با استفاده از سیترات ساخته شده بودند، مقایسه شدند (21). هر دو نوع نانوذرات اندازه کنترلشدهای داشتند؛ با اینحال، نانوذرات طلای حاصل از پلیساکاریدها در بازهی pH بین ۲ تا ۱۲ پایدار بودند، در حالیکه نانوذرات طلای سیتراتی فقط در شرایط pH قلیایی پایداری داشتند. اندازه نانوذرات طلا با پلیساکاریدها بهطور قابلتوجهی بزرگتر بود (حدود ۳۰ تا ۴۰ نانومتر) در مقایسه با نانوذرات سیتراتی (۱۰ تا ۱۵ نانومتر). علاوه بر این، نانوذرات طلای سیتراتی در غلظتهای بسیار پایینتر NaCl (۳۰ برابر کمتر) تجمع میکردند که نشاندهنده پایداری سطح نانوذرات طلا با پوشش پلیساکاریدهای میکروجلبکی بود (22).
جدول 1: فعالیت ضد باکتریال نانوذرت بیوسنتز شده توسط سویههای مختلف سیانوباکتریها


جدول 2: انواع نانوذرات ضد قارچی بیوسنتز شده توسط سیانوباکتریها

مکانیزم فعالیت ضدسرطانی نانوذرات سنتز شده از میکروجلبکها به تولید رادیکالهای آزاد اکسیژن مربوط میشود. در یک مطالعه اخیر توسط حمیده و همکاران، نانوذرات نقره توسط سویه آب شیرین Coelastrella aeroterrestrica سنتز شد و فعالیت ضدسرطانی آنها در برابر چهار رده سلولی بدخیم با نانوذرات نقره شیمیایی و داروی ضدسرطان ۵-فلوئوروراسیل مقایسه شد. نتایج نشان داد که نانوذرات نقره میکروجلبکی نه تنها، بالاترین فعالیت ضدپرولیفراسیو را در برابر ردههای سلولی MCF-7، MDA، HCT-116 و HepG2 نشان دادند، بلکه سمیت کمتری را در برابر ردههای سلولی غیرسرطانی در مقایسه با دوکسوروبیسین (Doxorubicin)، سیسپلاتین (Cisplatin) یا پاکلیتاکسل(Paclitaxel) در طول 72 ساعت نشان دادند. این فعالیت به اندازه کوچک، ثبات بالا و شیمی سطحی نانوذرات نسبت داده شد. اگر چه مکانیزم داخل سلولهای سرطانی و ویژگی فارماکوکنتیک نانوذرات نقره هنوز مورد بررسی قرار نگرفته است (26). تأثیر نانوکامپوزیتهای مختلف سنتز شده از میکروجلبکها بر ردههای سلولی سرطانی نیز مورد آزمایش قرار گرفت. در دو مطالعه جداگانه، عصاره S. obliquus برای ترکیب نانوذرات نقره با نانوذرات PtFe2O4 و نانوذرات GaFe2O4 استفاده شد (46). ویژگیهای سیتوتوکسیک نانوکامپوزیتهای PtFe2O4 به پیوند متقاطع بین Pt و DNA مربوط میشود که باعث اختلال در رونویسی و تکثیر، تولید گونههای فعال اکسیژن، پراکسیداسیون چربیها و تجزیه بیشتر گلوتاتیون توسط نانوذرات نقره میشود. بهطور مشابه، گالیم موجود در نانوکامپوزیتهای GaFe2O4 میتواند متابولیسم آهن را تغییر دهد، که منجر به ایجاد شکافت در کروماتین و تشکیل بدنههای آپوپتوتیک میشود که باعث مرگ سلولی میگردد. نانوکامپوزیتهای PtFe2O4 فعالیت ضدسرطانی برجستهتری نسبت به نانوکامپوزیتهای GaFe2O4 نشان دادند، اما این فعالیت همچنان کمتر از سیسپلاتین بود که یک داروی ضدسرطان برای درمان سرطان معده است و بهعنوان کنترل استفاده میشود. همچنین، نانوکامپوزیتهای MgFe2O4 با استفاده از عصاره C. vulgaris سنتز شدند که فعالیت ضدسرطانی خود را از طریق همان مسیر آپوپتوزی مشابه نشان دادند. نقش MgO در این نانوکامپوزیتها به بهبود ویژگیهای مغناطیسی و اختلال در غشای سلولی نسبت داده شد. برای بهبود فعالیت نانوکامپوزیتها و توصیف اثرات آنها در ردههای سلولی سرطانی و غیرسرطانی مختلف، نیاز به مطالعات بیشتری است. دیگر نانوذرات گزارششده که با استفاده از میکروجلبکها برای آزمایش فعالیت ضدسرطانی سنتز شدهاند (47). میکروجلبکها میتوانند به عنوان منبعی از ترکیبات با ارزش عمل کنند که نهتنها در سنتز داروهای ضدسرطان نقش دارند، بلکه خود نیز خواص ضدسرطانی از خود نشان میدهند. با این حال، عملکرد صحیح آنها نیازمند حفظ ساختارشان است که ممکن است به دلیل عوامل شیمیایی یا فیزیکی آسیب ببیند. در یک مطالعه توسط اینان و همکاران، عصارههای روغن میکروجلبکهای دریایی C. variabilis وC. pyrenoidosa در نانوذرات با استفاده از تکنیک الکترواسپری پوشش داده شدند. عصارههای روغنی پوشش دادهشده، سازگاری زیستی بالاتری نشان دادند، در حالیکه تنها عصاره روغنی C. variabilis خواص ضدسرطانی بهبود یافتهای نسبت به فرم غیرپوشش دادهشده از خود نشان داد. این فعالیت بهطور وابسته به دوز تغییر کرد و تغییراتی در مورفولوژی سلولها مشاهده شد. تحقیقات در زمینه بهینهسازی تکنیکهای پوششدهی میتواند منجر به توسعه داروهای ضدسرطان جدید از منبع میکروجلبکی شود (48). نقش پروتئینها در سنتز نانوذرات معمولاً با استفاده از تکنیکهای مبتنی بر طیفسنجی مادون قرمز تبدیل فوری (FTIR) بررسی میشود. نقش کاهشی پروتئینها در فرایند تبدیل گروه −CHO به −COOH مشخص میشود، در حالیکه گروههای NH2معمولاً وظیفه پوششدهی نانوذرات را از طریق اسیدهای آمینهای مانند سیستئین، تیروزین و تریپتوفان بهعهده دارند. همچنین طیفهای استخراج شده از Acutodesmus dimorphus و نانوذرات نقره مقایسه شدند و نشان داده شد که پیوندهای آمیدی در تثبیت نانوذرات نقره توسط پپتیدها و پروتئینها نقش دارند (49). نانوذرات بهدستآمده بهصورت کروی با اندازهای بین ۲ تا ۲۰ نانومتر بودند. علاوه بر این، تداخل قلههای طیفی بین عصاره آمادهشده و محصول نهایی نشاندهنده نقش پوشش در تثبیت نانوذرات و جلوگیری از تجمع آنها است. سطح نانوذرات میتواند با استفاده از پلیساکاریدهای سولفاتهشده و پروتئینها تغییر یافته و پیوندی میان نانوذرات و مولکولهای پوششدهنده ایجاد کند. پروتئینها همچنین تمایل زیادی به اتصال به یونهای فلزی دارند که بهعنوان عوامل کاهنده عمل میکنند (50). نتایج مشابهی برای نانوذرات AgCl ازChlorella vulgaris و نانوذرات Ti از میکروجلبک دریایی Phaeodactylum tricornutum گزارش شده است. با وجود آنکه مکانیزم دقیق سنتز نانوذرات بهطور کامل شناخته نشده است، استفاده از روش طراحی تجربی آماری و روششناسی سطح پاسخ برای تولید در مقیاس بزرگ در آینده مورد مطالعه قرار گرفته است (33). محتوای اسیدهای چرب ترکیبی از اسیدهای چرب اشباع و غیراشباع با زنجیرههای کربنی بلندتر، از جمله اسیدهای چرب امگا، تشکیل شده است. چربیهای اشباع در بدنهای لیپیدی خنثی ذخیره میشوند، در حالی که چربیهای غیراشباع با لیپیدهای قطبی در غشاها اتصال یافته و سیالیت غشا را تحت شرایط کشت متغیر حفظ میکنند (50). بخش کلی لیپیدها میتواند 20 تا 50 درصد از زیستتوده خشک را شامل شود، که این مقدار بسته به گونه میکروجلبک و شرایط کشت مانند دسترسی به مواد مغذی، شوری، شدت نور و فاز رشد متغیر است (51). در هنگام کمبود مواد مغذی، میزان لیپیدهای خنثی و پلیساکاریدها میتواند با کاهش پروتئینها افزایش یابد. بیشترین توجه به استخراج لیپیدها معطوف میشود و پس از آن تولید بیودیزل در اولویت قرار دارد، در حالیکه اسیدهای چرب چنداشباعشده به دلیل ارزش تغذیهای خود مورد استفاده قرارمیگیرند. برخلاف آب که معمولاً برای سنتز استفاده میشود، برای کار با لیپیدها نیاز به حلکنندههای مختلفی است. کومار و همکارانش از عصاره اتانولی برای سنتز نانوذراتAg/AgCl ازChlorella sp.، Lyngbya putealis، ocystis sp. وScenedesmus vacuolatus استفاده کردند (33). در طول فرایند بهینهسازی، گونه Oocystis sp.نتواست نانوذره تولید کند، در حالیکه عصارهChlorella sp. منجر به سنتز نانوذرات Ag/AgCl با کوچکترین اندازه شد. این مطالعه نشان داد که لیپیدها و پروتئینها به همراه حرکتهای کششی گروه هیدروکسیل در تشکیل نانوذرات Ag/AgCl با اندازه ۱۰ تا۲۰ نانومتر نقش دارند. در مطالعهای دیگر، لیپیدها و کربوهیدراتها بهطور جداگانه از Acutodesmus obliquus استخراج شده و برای سنتز نقاط کربن به روش حرارتی مایکروویو استفاده شدند. محصولات بهدستآمده اندازهای بین 1/2 تا 11 نانومتر داشتند. منبع کربن بر رفتار فلورسانسی تأثیری نداشت، اما تعاملات دقیق در طول سنتز بررسی نشد. خواص اپتیکی با اضافه کردن استون تغییر کرد که نشاندهنده پتانسیل استفاده از حلالهای مختلف برای سنتز است. نقش لیپیدها عمدتاً بهعنوان عاملهای پوششی در نظر گرفته شده است (52).
دارورسانی هدفمند با نانوذرات: دارورسانی هدفمند یک راهبرد است که داروها را بهصورت انتخابی به مناطق خاصی از بدن منتقل میکند تا اثرگذاری آنها را به حداکثر برساند و عوارض جانبی را کاهش دهد. در این راستا میکرورباتهایی برای بارگذاری دارو، انتقال هدفمند، و درمان ترکیبی شیمیدرمانی و فوتوترمالتراپی طراحی شدند (53). بهعنوان مثال میکرورباتهای حاوی داروی دوکسوروبیسین با استفاده از میکروجلبک دریایی Thalassiosira weissflogii به عنوان قالب ساخته شدند تا جایگزینی برای نانوذرات سیلیکای مزومتخلخل باشد. نانوذرات مغناطیسی Fe3O4 روی سطح این قالب چسبیده شدند تا امکان حرکت میکرورباتها را با نیروی مغناطیسی فراهم کنند. با اعمال یک میدان مغناطیسی خارجی، میتوان حرکت این میکرورباتها را با تغییر فرکانس میدان کنترل کرد و آنها را از میان مسیرهای باریک با اندازههای مختلف عبور داد. این میکرورباتها بهصورت خوشهای عمل میکنند و میتوانند بار دارویی زیادی را به محل موردنظر برسانند و سپس دارو را بهصورت حساس به pH آزاد کنند. این میکرورباتها روی سلولهای سرطان سینه انسانی MCF-7 آزمایش شدند و کارایی خود را در انتقال دارو نشان دادند. البته برای تأیید کاربرد آنها، نیاز به مطالعات بیشتری در شرایط زنده in Vivo است (54). در مطالعه دیگری، از میکروجلبک دریاییT. weissflogii بهعنوان الگو برای انتقال داروهای حاوی کورکومین استفاده شد تا خواص ضدسرطان و ضدباکتری آن بررسی شود. ساختار نانو T. weissflogii مانند یک قفس عمل کرده و داروی کورکومین را جذب میکند. این جذب با کمک تعاملات گروههای شیمیایی روی سطح جلبک تثبیت میشود. پتانسیل استفاده از T. weissflogii برای سیستمهای دارورسانی نشان میدهد که میتواند در آینده برای درمان انواع بیماریها کاربرد داشته باشد (55). میکروجلبکها نهتنها میتوانند بهعنوان الگو برای انتقال دارو استفاده شوند، بلکه میتوانند منبع مولکولهای ارزشمندی باشند که خواص درمانی دارند. عصاره روغنی میکروجلبکهای آب شیرین Botryococcus braunii و Microcystis aeruginosa که غنی از اسیدهای چرب غیراشباع هستند، در نانوذراتی که با آلژینات/پلیوینیلیدین (PVA) بهصورت الکترواسپری بارگذاری شدند، آزمایش شدند تا فعالیت ضدباکتری آنها بررسی شود. این کپسولهسازی خواص بیولوژیکی فعال و آنتیاکسیدانی روغن را حفظ کرده و نشان میدهد که میتوان از آنها برای ذخیرهسازی و کاربردهای تجاری استفاده کرد (56).
طراحی دارو با نانوذرات: در حال حاضر، در مقابله با شیوع بیماری COVID-19، شرکتهای داروسازی در حال تلاش برای توسعه درمانهای ضد ویروسی جدید برای ویروس SARS-CoV-2 هستند. در این زمینه، طراحی دارو به کمک کامپیوتر بسیار مفید است، زیرا این روش به محققان کمک میکند تا بدون صرف زمان و هزینه زیاد، داروهایی که میتوانند ویروس را مهار کند، شناسایی کنند CADD. بهعنوان یک روش منطقی و هدفمند در طراحی داروها شناخته میشود و نقش مهمی در کشف داروهای جدید ایفا میکند (57). این رویکرد امیدوارکننده در بیوانفورماتیک از سیستمهای کامپیوتری استفاده میکند که میتوانند مانند انسان فکر کنند و به شناسایی اثرات دقیق داروها کمک کنند. برای بهبود کیفیت مراقبت از بیمار، از سوابق پزشکی الکترونیکی که با اطلاعات ژنومی خاص بیمار ادغام شده است، استفاده میشود. با وجود تمام دادهها، هنوز هیچ داروی دقیقی برای COVID-19 توصیه نشده است. این رویکرد تحقیقاتی به جستجوی روشهای درمانی جدید در شرایط اضطراری پاندمی کمک میکند که مراقبت و درمان مناسبی را برای افراد مبتلا ارائه میدهد (58). قبل از اینکه بتوانیم شبکهای برای اتصال مولکولی بسازیم و یا اتصال مولکولی را انجام دهیم، باید حفرهای که دارو به آن وصل میشود را شناسایی کنیم. این حفره در واقع بخشی از پروتئین است که لیگاند میتواند به آن بچسبد. حفره فعال، که توسط تعدادی از آمینواسیدها (باقیماندهها) احاطه شده است جایی است که لیگاند به پروتئین متصل میشود. بدون شناسایی این حفره، نمیتوانیم بگوییم کدام بخش از پروتئین برای دارو مهم است (59). پس از شناسایی حفره، اطلاعاتی مانند نمرات مربوط به حفره و حجم آن نیز به ما داده میشود. نمره حفره، یک معیار است که نشاندهنده قابلیت و کیفیت حفره برای اتصال مولکولهای دارویی میباشد. این اطلاعات کمک میکند تا بدانیم کدام حفره برای اتصال دارو مناسبتر است. در نهایت، حفرهای که حجم بیشتری دارد برای ایجاد شبکه انتخاب میشود (60). این روش برای قفل کردن محل اتصال لیگاند در مولکول پروتئین استفاده میشود. این به این معناست که محققان میخواهند مطمئن شوند که لیگاند (دارو) در محل مناسب خود در پروتئین قرار گیرد. اینکار برای مطالعه چگونگی تعامل دارو با پروتئین بسیار مهم است. لیگاندهایی که آماده شدهاند، به مولکول هدف (پروتئین) متصل میشوند. این اتصال میتواند به ما کمک کند تا بفهمیم لیگاند چگونه با پروتئین ارتباط برقرار میکند و چه اثراتی خواهد داشت. حفره اتصال در ساختار بلوری اطراف لیگاند نمایش داده میشود. ساختار بلوری به ما این امکان را میدهد که نحوه قرارگیری لیگاند در پروتئین را مشاهده کنیم. ماژول "گلاید" ابزاری است که برای تولید حجم شبکهای استفاده میشود که لیگاند در آن قرار میگیرد. این شبکه بهعنوان یک فضای مجازی عمل میکند که لیگاند در آن قرار میگیرد. در مرکز حفرهای که لیگاند به آن متصل میشود، یک شبکه سهبعدی تولید میشود. این شبکه به محققان کمک میکند تا بررسی کنند لیگاند چگونه میتواند در این فضای مشخص قرار گیرد. مختصات X، Y و Z به ما کمک میکند تا ابعاد و موقعیت شبکه را در فضای سهبعدی تعریف کنیم. این مختصات به شکلگیری یک جعبه شبکهای کمک میکند که میتوان در آن لیگاندها را بررسی کرد. در این مرحله، نمرات خام (ارزیابی اولیه از عملکرد لیگاند) و فیلترهای هندسی (قوانینی که مشخص میکنند لیگاند چگونه باید در حفره قرار گیرد) بررسی میشوند. هدف این است که گزینههایی که نامناسب هستند حذف شوند تا فقط بهترین و مناسبترین لیگاندها برای مطالعه باقی بمانند (61). اتصال مولکولی بهطور گستردهای برای پیشبینی ساختار دقیق و پیچیده بین پروتئین و لیگاند استفاده میشود. غربالگری مجازی، یک روش رایانهای است که به کمک آن میتوان لیگاندهای مختلف را بررسی کرد تا بهترین گزینه برای اتصال به پروتئین شناسایی شود. در اینجا از توابع انرژی و نمرهدهی استفاده میشود. نمرهدهی به ما نشان میدهد که کدام لیگاندها بهتر و قویتر به پروتئین متصل میشوند. در اتصال مولکولی، هدف این است که بتوانیم بین حالتهای صحیح و مناسب اتصال و حالتهایی که کارآمد نیستند تمایز قائل شویم. این کمک میکند که فقط بهترین و مؤثرترین حالتها را برای طراحی دارو انتخاب کنیم (62). اتصال مولکولی به محققان این امکان را میدهد که بهینهترین شرایط را برای عملکرد آنزیمها و نحوه اتصال لیگاند به پروتئین پیدا کنند. به عبارت دیگر، هدف این است که اتصال مولکولی به گونهای باشد که بیشترین تأثیرگذاری را داشته باشد. محدودیتهای تجربی و تئوری مرزهایی را برای تعیین انرژی آزاد لیگاند در اتصال ایجاد میکنند که در پیشبینیها و شبیهسازیها اهمیت دارند. پیشبینیهای اتصال مولکولی به شناسایی پتانسیل دارویی مولکولهای لیگاند کمک میکنند این روش هنگامی که اطلاعات دقیقی از نوع تعاملات خاص بین اتمهای لیگاند و پروتئین وجود ندارد، راهکارهایی کاربردی ارائه میدهد (63). در این روش از طراحی دارو با کمک کامپیوتر استفاده میشود تا نقاط تماس گروههای متوکسیل، هیدروکسیل و دیگر بخشهای لیگاند با نقاط اتصال روی پروتئین هدف شناسایی شوند. طراحی دارو با کمک کامپیوتر، قدرت اتصال، ویژگیهای فیزیکوشیمیایی، انرژی اتصال، امتیاز و غیره را ارزیابی میکند (64). در این مرحله، این روش نسبت به روشهای مبتنی بر ساختار، موفقیت بیشتری دارد. این فرآیند بیشتر روی ویژگیهای زیستی لیگاند تمرکز دارد و طراحی دارو بر اساس لیگاند یک راهکار مهم برای پیدا کردن مهارکننده (لیگاند) دقیق برای پروتئین هدف محسوب میشود (65). در مراحل ابتدایی توسعه دارو، محققان نیاز دارند بدانند که چه عواملی میتوانند بر عملکرد دارو در بدن تأثیر بگذارند. به همین دلیل از شاخصهای فیزیکوشیمیایی استفاده میکنند که به آنها کمک میکند تا متغیرهای کلیدی را شناسایی کنند. برخی از خواص فیزیکوشیمیایی مهم که از طریق فرآیند ADME محاسبه میشوند شامل نفوذپذیری، حلالیت، لیپوفیلیسیته، یکپارچگی و پایداری هستند. در مراحل اولیه، برخی از اثرات مضر که میتوانند بر ایمنی و اثرگذاری دارو تأثیر بگذارند، بهخوبی شناسایی نشده بودند. این امر میتواند به مشکلاتی در استفاده از دارو منجر شود. از زمان شروع کشف دارو با استفاده از روشهای in-silico برای پیشبینی خواص فارماکوکینتیک دقیق مولکولها به کار رفته است (66). به منظور تشخیص ویژگیهای فیزیکی ویریون، و میل ترکیبی مولکولهای دارو، CADD حائز اهمیت است، زیرا میتواند به دانشمندان تجربی/بالینی کمک کند تا بازدارندههای موثری را با استفاده از روشهای آزمایشگاهی شناسایی کنند. بسیاری از آنزیمهای احتمالی و مسیرهای سیگنالی که مخصوص سویه SARS-CoV-2 هستند با کمک فناوری پیشرفته ایجاد شدهاند. با این حال، تنها چند مانع در توسعه دارو برای سویه دلتا SARS-CoV-2 وجود دارند. موانع اصلی در این راه در دسترس نبودن گزینههای دارویی مؤثر و بودجه کافی برای انجام تحقیقات است. امروزه راهبردهای مهم کشف دارو در صنعت داروسازی، بهویژه تحقیقات ویروسی در اولویت قرار دارند. حتی با وجود این شرایط هنوز درمان دارویی خاصی وجود ندارد. در حال حاضر، داروهای مورد تأیید FDA مانند CQ و HCQ، به عنوان گزینه درمانی جایگزین برای افراد آلوده به سویه SARS‐CoV‐2‐ استفاده میشوند. با اینحال، مطالعات فارماکولوژیک بیشتری در مورد مولکولهای سیانوباکتری پیشنهاد شده، برای درمان ویروس کرونا نیاز است.
روش بررسی
در این مقاله مروری، بیش از 200 نشریه معتبر در رابطه با ترکیبات طبیعی موجود در سیانوباکتریها ازجمله ترکیبات ضد باکتریایی، ضد قارچی، ضد سرطانی و همچنین استفاده از عصاره سیانوباکتریها و نانوذرات بیوسنتز شده از آنها در درمان بیماریها از پایگاههای اطلاعاتی مانندScience Direct، Scopus، Web of Sciences و فهرست مجلات با دسترسی آزاد جستجو گردید. برای جستجو از کلیدواژههایی مانند «سیانوباکتریها»، «ترکیبات فعال زیستی»، «دارورسانی هدفمند»، «نانوذرات»، «پلی ساکاریدها»، «ضد باکتریال»، «ضد قارچ»، «ضد سرطان» و «طراحی دارو» استفاده گردید.
نتیجهگیری
به منظور کاهش شدت بیماری های عفونی، جایگزینهای ضد میکروبی مستخرج از ترکیبات طبیعی ضروری هستند، زیرا از این جایگزینها میتوان برای پیشگیری از شیوع و همهگیری بیماریها بسیار موثر هستند. در این زمینه، متابولیتهای ثانویه بالقوه بهدستآمده از گونههای مختلف سیانوباکتریها میتوانند به بهبود یک مدل درمانی برای مقابله با عفونتهای ویروسی شایع و پاندمیهای جهشیافته امروزی و آینده کمک کنند. میکروجلبکها بدون شک کاندیداهای بسیار مناسبی برای سنتز انواع نانوذرات با خواص ضد ویروسی، ضد باکتریایی و ضد قارچی بهشمار میآیند، زیرا محتوای غنی از متابولیتهای ثانویه دارند که بهعنوان عوامل کاهنده و پوششدهنده عمل میکنند. با اینحال، این فرایند ممکن است با محدودیتهایی روبهرو شود، از جمله بازده پایین، نیاز به بهینهسازی شرایط یا زمان زیادی که برای تکمیل سنتز لازم است. برای توضیح کامل تولید نانوذرات، لازم است مکانیزم دقیق عملکرد متابولیتها مورد بررسی قرار گیرد. دامنه وسیع نانوذراتی که از میکروجلبکها سنتز میشوند و در بخش پزشکی کاربرد دارند، پتانسیل متابولیتها برای تاثیرگذاری بر ویژگیهای فیزیکوشیمیایی نانوذرات را نشان میدهد. تحقیقات بیشتر لازم است تا مسائل مرتبط با سینتیک، بقای سلولی و بازده نانوذرات با روشهای سنتزی معمولی و استفاده از میکروجلبکها مورد بررسی قرار گیرد. بنابر این تغییر در شرایط سنتز ممکن است به گسترش دانش در مورد نقش متابولیتها در ویژگیهای نانوذرات منجر شود. با توجه به اینکه امروزه محققان ایرانی درون کشور توانسته اند به تکنولوژی کشت انبوه سویههای سیانوباکتریایی و تهیه هرباریوم جلبکی البرز با بیش از دویست سویه مجزا دست یابند، میتوان انواع مختلف میکروجلبکها و پیشمادهها را برای کاربردهای بیومدیکال آزمایش کرد. علاوه بر این، تکنیکهای مختلف در تهیه عصارهها و هدفگذاری متابولیتهای خاص میتواند نقش آنها در سنتز نانوذرات را روشن کند. بنابراین، تحقیقات آینده در زمینه سنتز نانوذرات با استفاده از میکروجلبکها میتواند به بهینهسازی فرایند کمک کند و به درک عمیقتری از ارتباط بین سنتز، ویژگیها و عملکرد نانوذرات منجر شود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
References:
1- Chankeshwara NN, Pant M, Pant K. The Cyanobacterial Renaissance: Bioactive Discoveries and Future Prospects. Bio-prospecting of Novel Microbial Bioactive Compounds for Sustainable Development: Springer 2025; 187-201.
2- Laxmi, Singh S, Singh A, Asthana RK. Molecular Biology of Non-Ribosomal Peptide (NRP) and Polyketide (PK) Biosynthesis in Cyanobacteria. Cyanobacterial Biotechnology in the 21st Century: Springer 2023; 133-47.
3- Perera R, Herath K, Sanjeewa KA, Jayawardena TU. Recent Reports on Bioactive Compounds from Marine Cyanobacteria in Relation to Human Health Applications. Life 2023; 13(6): 1411.
4- Prabhu S, Vijayakumar S, Praseetha P. Cyanobacterial Metabolites as Novel Drug Candidates in Corona Viral Therapies: A Review. Chronic Dis Transl Med 2022; 8(03): 172-83.
5- Santiago‐Díaz P, Rico M, Rivero A, Santana‐Casiano M. Bioactive Metabolites of Microalgae from Canary Islands for Functional Food and Feed Uses. Chemistry & Biodiversity 2022; 19(9): e202200230.
6- Sahin A-R, Erdogan A, Agaoglu PM, Dineri Y, Cakirci AY, Senel ME, et al. 2019 Novel Coronavirus (COVID-19) Outbreak: A Review of the Current Literature. EJMO 2020; 4(1): 1-7.
7- Zhu Z, Lian X, Su X, Wu W, Marraro GA, Zeng Y. From SARS and MERS to COVID-19: A Brief Summary and Comparison of Severe Acute Respiratory Infections Caused by Three Highly Pathogenic Human Coronaviruses. Respir Res 2020; 21: 224.
8- Singhal T. A Review of Coronavirus Disease-2019 (COVID-19). indian J pediatr 2020; 87(4): 281-6.
9- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and Chloroquine Effectively Inhibit the Recently Emerged Novel Coronavirus (2019-Ncov) in Vitro. Cell Res 2020; 30(3): 269-71.
10- Al-Bari AA. Facts and Myths: Efficacies of Repurposing Chloroquine and Hydroxychloroquine for the Treatment of COVID-19. Curr Drug Targets 2020; 21(16): 1703-21.
11- Al-Shar'i N, Musleh S. Identification of CHK1 Kinase Inhibitors Using Structure-Based Pharmacophore Modelling and Molecular Docking. Indian J Pharmac Sci 2020; 82(3).
12- İnan B, Özçimen D. Preparation and Characterization of Microalgal Oil Loaded Alginate/Poly (Vinyl Alcohol) Electrosprayed Nanoparticles. Food and Bioproducts Processing 2021; 129: 105-14.
13- Prasad A, Muthamilarasan M, Prasad M. Synergistic Antiviral Effects Against SARS-Cov-2 By Plant-Based Molecules. Plant Cell Reports 2020; 39(9): 1109-14.
14- Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Global Burden of Bacterial Antimicrobial Resistance in 2019: A Systematic Analysis. Lancet 2022; 399(10325): 629-55.
15- Yuan X, Gao X, Liu C, Liang W, Xue H, Li Z, et al. Application of Nanomaterials in the Production of Biomolecules in Microalgae: A Review. Marine Drugs 2023; 21(11): 594.
16- Ashour M, Omran AM. Recent Advances in Marine Microalgae Production: Highlighting Human Health Products from Microalgae in View of the Coronavirus Pandemic (COVID-19). Fermentation 2022; 8(9): 466.
17- Vishwanath R, Negi B. Conventional and Green Methods of Synthesis of Silver Nanoparticles and their Antimicrobial Properties. Current Research in Green and Sustainable Chemistry 2021; 4: 100205.
18- Haglan AM, Abbas HS, Akköz C, Karakurt S, Aşikkutlu B, Güneş E. Characterization and Antibacterial Efficiency of Silver Nanoparticles Biosynthesized by Using Green Algae Enteromorpha Intestinalis. International Nano Letters 2020; 10: 197-205.
19- Wang F, Yang R, Guo Y, Zhang C. Isolation, Characterization and Immunomodulatory Activity Evaluation of Chrysolaminarin from the Filamentous Microalga Tribonema Aequale. Marine Drugs 2022; 21(1): 13.
20- Mondal A, Mukherjee A, Pal R. Phycosynthesis of Nanoiron Particles and their Applications-A Review. Biocatalysis and Agricultural Biotechnology 2024; 55: 102986.
21- Rosman NSR, Harun NA, Idris I, Ismail WIW. Eco-Friendly Silver Nanoparticles (Agnps) Fabricated by Green Synthesis Using the Crude Extract of Marine Polychaete, Marphysa Moribidii: Biosynthesis, Characterisation, and Antibacterial Applications. Heliyon 2020; 6(11): e05462.
22- Jakhu S, Sharma Y, Sharma K, Vaid K, Dhar H, Kumar V, et al. Production and Characterization of Microalgal Exopolysaccharide as a Reducing and Stabilizing Agent for Green Synthesis of Gold-Nanoparticle: A Case Study with a Chlorella Sp. from Himalayan High-Altitude Psychrophilic Habitat. J Applied Phycology 2021; 33(6): 3899-914.
23- Ameen F, Abdullah MM, Al-Homaidan AA, Al-Lohedan HA, Al-Ghanayem AA, Almansob A. Fabrication of Silver Nanoparticles Employing the Cyanobacterium Spirulina Platensis and Its Bactericidal Effect Against Opportunistic Nosocomial Pathogens of the Respiratory Tract. Journal of Molecular Structure 2020; 1217: 128392.
24- Omomowo I, Adenigba V, Ogunsona S, Adeyinka G, Oluyide O, Adedayo A, et al. Antimicrobial and Antioxidant Activities of Algal-Mediated Silver and Gold Nanoparticles. IOP Conference Series: Mater Sci Eng 2020: IOP Publishing.
25- Bhuyar P, Rahim MHA, Sundararaju S, Ramaraj R, Maniam GP, Govindan N. Synthesis of Silver Nanoparticles Using Marine Macroalgae Padina Sp. and Its Antibacterial Activity Towards Pathogenic Bacteria. Beni-Suef University J Basic and Applied Sciences 2020; 9: 1-15.
26- Hamida RS, Ali MA, Almohawes ZN, Alahdal H, Momenah MA, Bin-Meferij MM. Green Synthesis of Hexagonal Silver Nanoparticles Using a Novel Microalgae Coelastrella Aeroterrestrica Strain BA_Chlo4 and Resulting Anticancer, Antibacterial, and Antioxidant Activities. Pharmaceutics 2022; 14(10): 2002.
27- Algotiml R, Gab-Alla A, Seoudi R, Abulreesh HH, El-Readi MZ, Elbanna K. Anticancer and Antimicrobial Activity of Biosynthesized Red Sea Marine Algal Silver Nanoparticles. Sci Rep 2022; 12(1): 2421.
28- Sahoo CR, Maharana S, Mandhata CP, Bishoyi AK, Paidesetty SK, Padhy RN. Biogenic Silver Nanoparticle Synthesis with Cyanobacterium Chroococcus Minutus Isolated from Baliharachandi Sea-Mouth, Odisha, And in Vitro Antibacterial Activity. Saudi J Biological Sci 2020; 27(6): 1580-6.
29- Husain S, Verma SK, Azam M, Sardar M, Haq Q, Fatma T. Antibacterial Efficacy of Facile Cyanobacterial Silver Nanoparticles Inferred by Antioxidant Mechanism. Materials Science and Engineering: C 2021; 122: 111888.
30- Bishoyi AK, Sahoo CR, Sahoo AP, Padhy RN. Bio-Synthesis of Silver Nanoparticles with the Brackish Water Blue-Green Alga Oscillatoria Princeps and Antibacterial Assessment. Applied Nanoscience 2021; 11: 389-98.
31- Ulagesan S, Nam T-J, Choi Y-H. Biogenic Preparation and Characterization of Pyropia Yezoensis Silver Nanoparticles (Py Agnps) and their Antibacterial Activity Against Pseudomonas Aeruginosa. Bioprocess Biosyst Eng 2021; 44(3): 443-52.
32- Bachheti, Rakesh Kumar, Limenew Abate, Archana Bachheti, Alle Madhusudhan, and Azamal Husen. Algae-, Fungi-, and Yeast-Mediated Biological Synthesis of Nanoparticles and their Various Biomedical Applications. In Handbook of greener synthesis of nanomaterials and compounds 2021; 701-34.
33- Kumar L, Mohan L, Anand R, Bharadvaja N. Chlorella Minutissima-Assisted Silver Nanoparticles Synthesis and Evaluation of Its Antibacterial Activity. Syst Microbiol Biomanuf 2024; 4(1): 230-9.
34- Razali Z, Norrizah J, Abdullah S, editors. Impact of Temperature and Ph on Antioxidant Activity of Green Silver Nanoparticles Fabricated from Ananas Comosus Peel Extracts. IOP Conf Ser: Earth and Environ Sci; 2022.
35- Khan MS, Ranjani S, Hemalatha S. Synthesis and Characterization of Kappaphycus Alvarezii Derived Silver Nanoparticles and Determination of Antibacterial Activity. Materials Chemistry and Physics 2022; 282: 125985.
36- Fatima R, Priya M, Indurthi L, Radhakrishnan V, Sudhakaran R. Biosynthesis of Silver Nanoparticles Using Red Algae Portieria Hornemannii and Its Antibacterial Activity Against Fish Pathogens. Microbial pathogenesis 2020; 138: 103780.
37- Garg D, Sarkar A, Chand P, Bansal P, Gola D, Sharma S, et al. Synthesis of Silver Nanoparticles Utilizing Various Biological Systems: Mechanisms and Applications—A Review. Progr Biomater 2020; 9: 81-95.
38- Das CA, Kumar VG, Dhas TS, Karthick V, Govindaraju K, Joselin JM, et al. Antibacterial Activity of Silver Nanoparticles (Biosynthesis): A Short Review on Recent Advances. Biocatalysis and Agricultural Biotechnology 2020; 27: 101593.
39- Taghizadeh S-M, Lal N, Ebrahiminezhad A, Moeini F, Seifan M, Ghasemi Y, et al. Green and Economic Fabrication of Zinc Oxide (Zno) Nanorods as a Broadband UV Blocker and Antimicrobial Agent. Nanomaterials 2020; 10(3): 530.
40- El-Belely EF, Farag MM, Said HA, Amin AS, Azab E, Gobouri AA, et al. Green Synthesis of Zinc Oxide Nanoparticles (Zno-Nps) Using Arthrospira Platensis (Class: Cyanophyceae) and Evaluation of their Biomedical Activities. Nanomaterials 2021; 11(1): 95.
41- Schmid B, Coelho L, Schulze PS, Pereira H, Santos T, Maia IB, et al. Antifungal Properties of Aqueous Microalgal Extracts. Bioresource Technology Reports 2022; 18: 101096.
42- Gürsoy N, Öztürk BY, Dağ İ. Synthesis of Intracellular and Extracellular Gold Nanoparticles with a Green Machine and Its Antifungal Activity. Turk J Biology 2021; 45(2): 196-213.
43- Hatipoğlu A. Rapid Green Synthesis of Gold Nanoparticles: Synthesis, Characterization, and Antimicrobial Activities. Prog Nutr 2021; 23(3): e2021242.
44- Win TT, Khan S, Bo B, Zada S, Fu P. Green Synthesis and Characterization of Fe3O4 Nanoparticles Using Chlorella-K01 Extract for Potential Enhancement of Plant Growth Stimulating and Antifungal Activity. Scientific Reports 2021; 11(1): 21996.
45- Hameed H, Waheed A, Sharif MS, Saleem M, Afreen A, Tariq M, et al. Green Synthesis of Zinc Oxide (Zno) Nanoparticles from Green Algae and their Assessment in Various Biological Applications. Micromachines 2023; 14(5): 928.
46- Fani A, Varmazyar S, Akbari F, Garfami M, Mohaghegh R, Balkhi S, et al. Green Synthesis of A Novel Ptfe2o4@ Ag Nanocomposite: Implications for Cytotoxicity, Gene Expression and Anti-Cancer Studies in Gastric Cancer Cell Line. J Cluster Science 2023; 34(1): 535-46.
47- Sharif AP, Habibi K, Bijarpas Zk, Tolami HF, Alkinani TA, Jameh M, et al. Cytotoxic Effect of A Novel Gafe2o4@ Ag Nanocomposite Synthesized by Scenedesmus Obliquus on Gastric Cancer Cell Line and Evaluation of BAX, Bcl-2 and CASP8 Genes Expression. J Cluster Science 2023; 34(2): 1065-75.
48- İnan B, Mutlu B, Karaca GA, Koç RÇ, Özçimen D. Bioprospecting Antarctic Microalgae as Anticancer Agent Against PC-3 and AGS Cell Lines. Biochemical Engineering J 2023; 195: 108900.
49- Mukherjee A, Sarkar D, Sasmal S. A Review of Green Synthesis of Metal Nanoparticles Using Algae. Front Microbiol 2021; 12: 693899.
50- Caliskan G, Mutaf T, Agba HC, Elibol M. Green Synthesis and Characterization of Titanium Nanoparticles Using Microalga, Phaeodactylum Tricornutum. Geomicrobiol J 2022; 39(1): 83-96.
51- Karimi K, Saidi M, Moradi P, Taheri Najafabadi A. Biodiesel Production from Nannochloropsis Microalgal Biomass‐Derived Oil: An Experimental and Theoretical Study Using the RSM‐CCD Approach. The Canadian J Chem Engin 2023; 101(10): 5600-10.
52- Gusain D, Renuka N, Guldhe A, Bux F. Use of Microalgal Lipids and Carbohydrates for the Synthesis of Carbon Dots Via Hydrothermal Microwave Treatment. Inorganic Chemistry Communications 2021; 134: 109021.
53- Gong D, Celi N, Xu L, Zhang D, Cai J. Cus Nanodots-Loaded Biohybrid Magnetic Helical Microrobots with Enhanced Photothermal Performance. Materials Today Chemistry 2022; 23: 100694.
54- Li M, Wu J, Lin D, Yang J, Jiao N, Wang Y, et al. A Diatom-Based Biohybrid Microrobot with a High Drug-Loading Capacity and Ph-Sensitive Drug Release for Target Therapy. Acta Biomaterialia 2022; 154: 443-53.
55- Phogat S, Saxena A, Kapoor N, Aggarwal C, Tiwari A. Diatom Mediated Smart Drug Delivery System. J Drug Delivery Sci Technology 2021; 63: 102433.
56- Briceño S, Chavez-Chico EA, González G. Diatoms Decorated with Gold Nanoparticles by In-Situ and Ex-Situ Methods for in Vitro Gentamicin Release. Materials Science and Engineering: C 2021; 123: 112018.
57- Boby ML, Fearon D, Ferla M, Filep M, Koekemoer L, Robinson MC, et al. Open Science Discovery of Potent Non-Covalent SARS-Cov-2 Main Protease Inhibitors. BioRxiv 2020: 2020.10. 29.339317.
58- Liu X, Wang X-J. Potential Inhibitors Against 2019-Ncov Coronavirus M Protease from Clinically Approved Medicines. J Genet Genomics 2020; 47(2): 119-21.
59- Nowruzi B, Sarvari G, Blanco S. Applications of Cyanobacteria in Biomedicine. Handbook of Algal Science, Technology and Medicine: Elsevier; 2020: 441-53.
60- Wijewickrama M, Greene A, Cock I. Therapeutics from Cyanobacteria: A Review of Cyanobacteria-Derived Compounds as Anti-Cancer Drug Leads. Pharmacognosy Rev 2023; 17(34): 230-46.
61- So YJ, Lee JU, Yang GS, Yang G, Kim SW, Lee JH, et al. The Potentiality of Natural Products and Herbal Medicine as Novel Medications for Parkinson’s Disease: A Promising Therapeutic Approach. Int J Mol Sci 2024; 25(2): 1071.
62- Sezen Karaoğlan E, Hancı H, Koca M, Kazaz C. Some Bioactivities of Isolated Apigenin-7-O-Glucoside and Luteolin-7-O-Glucoside. Appl Sci 2023; 13(3): 1503.
63- Tuli HS, Bhatia GK, Sood S, Debnath P, Aggarwal D, Upadhyay SK. In Silico Analysis and Molecular Docking Studies of Plumbagin and Piperine Ligands as Potential Inhibitors of Alpha-Glucosidase Receptor. Biointerface Research in Applied Chemistry 2021;11(2): 9629-37.
64- Oyedemi SO, Nwaogu G, Chukwuma CI, Adeyemi OT, Matsabisa MG, Swain SS, et al. Quercetin Modulates Hyperglycemia by Improving the Pancreatic Antioxidant Status and Enzymes Activities Linked with Glucose Metabolism in Type 2 Diabetes Model of Rats: In Silico Studies of Molecular Interaction of Quercetin with Hexokinase and Catalase. J Food Biochem 2020; 44(2): e13127.
65- Kalaimathi K, Thiyagarajan G, Vijayakumar S, Bhavani K, Karthikeyan K, Rani JMJ, et al. Molecular Docking and Network Pharmacology-Based Approaches to Explore the Potential of Terpenoids for Mycobacterium Tuberculosis. Pharmacological Research-Modern Chinese Medicine 2021; 1: 100002.
66- Aviz-Amador A, Contreras-Puentes N, Mercado-Camargo J. Virtual Screening Using Docking and Molecular Dynamics of Cannabinoid Analogs Against CB1 and CB2 Receptors. Computational Biology and Chemistry 2021; 95: 107590.
1- Chankeshwara NN, Pant M, Pant K. The Cyanobacterial Renaissance: Bioactive Discoveries and Future Prospects. Bio-prospecting of Novel Microbial Bioactive Compounds for Sustainable Development: Springer 2025; 187-201.
2- Laxmi, Singh S, Singh A, Asthana RK. Molecular Biology of Non-Ribosomal Peptide (NRP) and Polyketide (PK) Biosynthesis in Cyanobacteria. Cyanobacterial Biotechnology in the 21st Century: Springer 2023; 133-47.
3- Perera R, Herath K, Sanjeewa KA, Jayawardena TU. Recent Reports on Bioactive Compounds from Marine Cyanobacteria in Relation to Human Health Applications. Life 2023; 13(6): 1411.
4- Prabhu S, Vijayakumar S, Praseetha P. Cyanobacterial Metabolites as Novel Drug Candidates in Corona Viral Therapies: A Review. Chronic Dis Transl Med 2022; 8(03): 172-83.
5- Santiago‐Díaz P, Rico M, Rivero A, Santana‐Casiano M. Bioactive Metabolites of Microalgae from Canary Islands for Functional Food and Feed Uses. Chemistry & Biodiversity 2022; 19(9): e202200230.
6- Sahin A-R, Erdogan A, Agaoglu PM, Dineri Y, Cakirci AY, Senel ME, et al. 2019 Novel Coronavirus (COVID-19) Outbreak: A Review of the Current Literature. EJMO 2020; 4(1): 1-7.
7- Zhu Z, Lian X, Su X, Wu W, Marraro GA, Zeng Y. From SARS and MERS to COVID-19: A Brief Summary and Comparison of Severe Acute Respiratory Infections Caused by Three Highly Pathogenic Human Coronaviruses. Respir Res 2020; 21: 224.
8- Singhal T. A Review of Coronavirus Disease-2019 (COVID-19). indian J pediatr 2020; 87(4): 281-6.
9- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and Chloroquine Effectively Inhibit the Recently Emerged Novel Coronavirus (2019-Ncov) in Vitro. Cell Res 2020; 30(3): 269-71.
10- Al-Bari AA. Facts and Myths: Efficacies of Repurposing Chloroquine and Hydroxychloroquine for the Treatment of COVID-19. Curr Drug Targets 2020; 21(16): 1703-21.
11- Al-Shar'i N, Musleh S. Identification of CHK1 Kinase Inhibitors Using Structure-Based Pharmacophore Modelling and Molecular Docking. Indian J Pharmac Sci 2020; 82(3).
12- İnan B, Özçimen D. Preparation and Characterization of Microalgal Oil Loaded Alginate/Poly (Vinyl Alcohol) Electrosprayed Nanoparticles. Food and Bioproducts Processing 2021; 129: 105-14.
13- Prasad A, Muthamilarasan M, Prasad M. Synergistic Antiviral Effects Against SARS-Cov-2 By Plant-Based Molecules. Plant Cell Reports 2020; 39(9): 1109-14.
14- Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Global Burden of Bacterial Antimicrobial Resistance in 2019: A Systematic Analysis. Lancet 2022; 399(10325): 629-55.
15- Yuan X, Gao X, Liu C, Liang W, Xue H, Li Z, et al. Application of Nanomaterials in the Production of Biomolecules in Microalgae: A Review. Marine Drugs 2023; 21(11): 594.
16- Ashour M, Omran AM. Recent Advances in Marine Microalgae Production: Highlighting Human Health Products from Microalgae in View of the Coronavirus Pandemic (COVID-19). Fermentation 2022; 8(9): 466.
17- Vishwanath R, Negi B. Conventional and Green Methods of Synthesis of Silver Nanoparticles and their Antimicrobial Properties. Current Research in Green and Sustainable Chemistry 2021; 4: 100205.
18- Haglan AM, Abbas HS, Akköz C, Karakurt S, Aşikkutlu B, Güneş E. Characterization and Antibacterial Efficiency of Silver Nanoparticles Biosynthesized by Using Green Algae Enteromorpha Intestinalis. International Nano Letters 2020; 10: 197-205.
19- Wang F, Yang R, Guo Y, Zhang C. Isolation, Characterization and Immunomodulatory Activity Evaluation of Chrysolaminarin from the Filamentous Microalga Tribonema Aequale. Marine Drugs 2022; 21(1): 13.
20- Mondal A, Mukherjee A, Pal R. Phycosynthesis of Nanoiron Particles and their Applications-A Review. Biocatalysis and Agricultural Biotechnology 2024; 55: 102986.
21- Rosman NSR, Harun NA, Idris I, Ismail WIW. Eco-Friendly Silver Nanoparticles (Agnps) Fabricated by Green Synthesis Using the Crude Extract of Marine Polychaete, Marphysa Moribidii: Biosynthesis, Characterisation, and Antibacterial Applications. Heliyon 2020; 6(11): e05462.
22- Jakhu S, Sharma Y, Sharma K, Vaid K, Dhar H, Kumar V, et al. Production and Characterization of Microalgal Exopolysaccharide as a Reducing and Stabilizing Agent for Green Synthesis of Gold-Nanoparticle: A Case Study with a Chlorella Sp. from Himalayan High-Altitude Psychrophilic Habitat. J Applied Phycology 2021; 33(6): 3899-914.
23- Ameen F, Abdullah MM, Al-Homaidan AA, Al-Lohedan HA, Al-Ghanayem AA, Almansob A. Fabrication of Silver Nanoparticles Employing the Cyanobacterium Spirulina Platensis and Its Bactericidal Effect Against Opportunistic Nosocomial Pathogens of the Respiratory Tract. Journal of Molecular Structure 2020; 1217: 128392.
24- Omomowo I, Adenigba V, Ogunsona S, Adeyinka G, Oluyide O, Adedayo A, et al. Antimicrobial and Antioxidant Activities of Algal-Mediated Silver and Gold Nanoparticles. IOP Conference Series: Mater Sci Eng 2020: IOP Publishing.
25- Bhuyar P, Rahim MHA, Sundararaju S, Ramaraj R, Maniam GP, Govindan N. Synthesis of Silver Nanoparticles Using Marine Macroalgae Padina Sp. and Its Antibacterial Activity Towards Pathogenic Bacteria. Beni-Suef University J Basic and Applied Sciences 2020; 9: 1-15.
26- Hamida RS, Ali MA, Almohawes ZN, Alahdal H, Momenah MA, Bin-Meferij MM. Green Synthesis of Hexagonal Silver Nanoparticles Using a Novel Microalgae Coelastrella Aeroterrestrica Strain BA_Chlo4 and Resulting Anticancer, Antibacterial, and Antioxidant Activities. Pharmaceutics 2022; 14(10): 2002.
27- Algotiml R, Gab-Alla A, Seoudi R, Abulreesh HH, El-Readi MZ, Elbanna K. Anticancer and Antimicrobial Activity of Biosynthesized Red Sea Marine Algal Silver Nanoparticles. Sci Rep 2022; 12(1): 2421.
28- Sahoo CR, Maharana S, Mandhata CP, Bishoyi AK, Paidesetty SK, Padhy RN. Biogenic Silver Nanoparticle Synthesis with Cyanobacterium Chroococcus Minutus Isolated from Baliharachandi Sea-Mouth, Odisha, And in Vitro Antibacterial Activity. Saudi J Biological Sci 2020; 27(6): 1580-6.
29- Husain S, Verma SK, Azam M, Sardar M, Haq Q, Fatma T. Antibacterial Efficacy of Facile Cyanobacterial Silver Nanoparticles Inferred by Antioxidant Mechanism. Materials Science and Engineering: C 2021; 122: 111888.
30- Bishoyi AK, Sahoo CR, Sahoo AP, Padhy RN. Bio-Synthesis of Silver Nanoparticles with the Brackish Water Blue-Green Alga Oscillatoria Princeps and Antibacterial Assessment. Applied Nanoscience 2021; 11: 389-98.
31- Ulagesan S, Nam T-J, Choi Y-H. Biogenic Preparation and Characterization of Pyropia Yezoensis Silver Nanoparticles (Py Agnps) and their Antibacterial Activity Against Pseudomonas Aeruginosa. Bioprocess Biosyst Eng 2021; 44(3): 443-52.
32- Bachheti, Rakesh Kumar, Limenew Abate, Archana Bachheti, Alle Madhusudhan, and Azamal Husen. Algae-, Fungi-, and Yeast-Mediated Biological Synthesis of Nanoparticles and their Various Biomedical Applications. In Handbook of greener synthesis of nanomaterials and compounds 2021; 701-34.
33- Kumar L, Mohan L, Anand R, Bharadvaja N. Chlorella Minutissima-Assisted Silver Nanoparticles Synthesis and Evaluation of Its Antibacterial Activity. Syst Microbiol Biomanuf 2024; 4(1): 230-9.
34- Razali Z, Norrizah J, Abdullah S, editors. Impact of Temperature and Ph on Antioxidant Activity of Green Silver Nanoparticles Fabricated from Ananas Comosus Peel Extracts. IOP Conf Ser: Earth and Environ Sci; 2022.
35- Khan MS, Ranjani S, Hemalatha S. Synthesis and Characterization of Kappaphycus Alvarezii Derived Silver Nanoparticles and Determination of Antibacterial Activity. Materials Chemistry and Physics 2022; 282: 125985.
36- Fatima R, Priya M, Indurthi L, Radhakrishnan V, Sudhakaran R. Biosynthesis of Silver Nanoparticles Using Red Algae Portieria Hornemannii and Its Antibacterial Activity Against Fish Pathogens. Microbial pathogenesis 2020; 138: 103780.
37- Garg D, Sarkar A, Chand P, Bansal P, Gola D, Sharma S, et al. Synthesis of Silver Nanoparticles Utilizing Various Biological Systems: Mechanisms and Applications—A Review. Progr Biomater 2020; 9: 81-95.
38- Das CA, Kumar VG, Dhas TS, Karthick V, Govindaraju K, Joselin JM, et al. Antibacterial Activity of Silver Nanoparticles (Biosynthesis): A Short Review on Recent Advances. Biocatalysis and Agricultural Biotechnology 2020; 27: 101593.
39- Taghizadeh S-M, Lal N, Ebrahiminezhad A, Moeini F, Seifan M, Ghasemi Y, et al. Green and Economic Fabrication of Zinc Oxide (Zno) Nanorods as a Broadband UV Blocker and Antimicrobial Agent. Nanomaterials 2020; 10(3): 530.
40- El-Belely EF, Farag MM, Said HA, Amin AS, Azab E, Gobouri AA, et al. Green Synthesis of Zinc Oxide Nanoparticles (Zno-Nps) Using Arthrospira Platensis (Class: Cyanophyceae) and Evaluation of their Biomedical Activities. Nanomaterials 2021; 11(1): 95.
41- Schmid B, Coelho L, Schulze PS, Pereira H, Santos T, Maia IB, et al. Antifungal Properties of Aqueous Microalgal Extracts. Bioresource Technology Reports 2022; 18: 101096.
42- Gürsoy N, Öztürk BY, Dağ İ. Synthesis of Intracellular and Extracellular Gold Nanoparticles with a Green Machine and Its Antifungal Activity. Turk J Biology 2021; 45(2): 196-213.
43- Hatipoğlu A. Rapid Green Synthesis of Gold Nanoparticles: Synthesis, Characterization, and Antimicrobial Activities. Prog Nutr 2021; 23(3): e2021242.
44- Win TT, Khan S, Bo B, Zada S, Fu P. Green Synthesis and Characterization of Fe3O4 Nanoparticles Using Chlorella-K01 Extract for Potential Enhancement of Plant Growth Stimulating and Antifungal Activity. Scientific Reports 2021; 11(1): 21996.
45- Hameed H, Waheed A, Sharif MS, Saleem M, Afreen A, Tariq M, et al. Green Synthesis of Zinc Oxide (Zno) Nanoparticles from Green Algae and their Assessment in Various Biological Applications. Micromachines 2023; 14(5): 928.
46- Fani A, Varmazyar S, Akbari F, Garfami M, Mohaghegh R, Balkhi S, et al. Green Synthesis of A Novel Ptfe2o4@ Ag Nanocomposite: Implications for Cytotoxicity, Gene Expression and Anti-Cancer Studies in Gastric Cancer Cell Line. J Cluster Science 2023; 34(1): 535-46.
47- Sharif AP, Habibi K, Bijarpas Zk, Tolami HF, Alkinani TA, Jameh M, et al. Cytotoxic Effect of A Novel Gafe2o4@ Ag Nanocomposite Synthesized by Scenedesmus Obliquus on Gastric Cancer Cell Line and Evaluation of BAX, Bcl-2 and CASP8 Genes Expression. J Cluster Science 2023; 34(2): 1065-75.
48- İnan B, Mutlu B, Karaca GA, Koç RÇ, Özçimen D. Bioprospecting Antarctic Microalgae as Anticancer Agent Against PC-3 and AGS Cell Lines. Biochemical Engineering J 2023; 195: 108900.
49- Mukherjee A, Sarkar D, Sasmal S. A Review of Green Synthesis of Metal Nanoparticles Using Algae. Front Microbiol 2021; 12: 693899.
50- Caliskan G, Mutaf T, Agba HC, Elibol M. Green Synthesis and Characterization of Titanium Nanoparticles Using Microalga, Phaeodactylum Tricornutum. Geomicrobiol J 2022; 39(1): 83-96.
51- Karimi K, Saidi M, Moradi P, Taheri Najafabadi A. Biodiesel Production from Nannochloropsis Microalgal Biomass‐Derived Oil: An Experimental and Theoretical Study Using the RSM‐CCD Approach. The Canadian J Chem Engin 2023; 101(10): 5600-10.
52- Gusain D, Renuka N, Guldhe A, Bux F. Use of Microalgal Lipids and Carbohydrates for the Synthesis of Carbon Dots Via Hydrothermal Microwave Treatment. Inorganic Chemistry Communications 2021; 134: 109021.
53- Gong D, Celi N, Xu L, Zhang D, Cai J. Cus Nanodots-Loaded Biohybrid Magnetic Helical Microrobots with Enhanced Photothermal Performance. Materials Today Chemistry 2022; 23: 100694.
54- Li M, Wu J, Lin D, Yang J, Jiao N, Wang Y, et al. A Diatom-Based Biohybrid Microrobot with a High Drug-Loading Capacity and Ph-Sensitive Drug Release for Target Therapy. Acta Biomaterialia 2022; 154: 443-53.
55- Phogat S, Saxena A, Kapoor N, Aggarwal C, Tiwari A. Diatom Mediated Smart Drug Delivery System. J Drug Delivery Sci Technology 2021; 63: 102433.
56- Briceño S, Chavez-Chico EA, González G. Diatoms Decorated with Gold Nanoparticles by In-Situ and Ex-Situ Methods for in Vitro Gentamicin Release. Materials Science and Engineering: C 2021; 123: 112018.
57- Boby ML, Fearon D, Ferla M, Filep M, Koekemoer L, Robinson MC, et al. Open Science Discovery of Potent Non-Covalent SARS-Cov-2 Main Protease Inhibitors. BioRxiv 2020: 2020.10. 29.339317.
58- Liu X, Wang X-J. Potential Inhibitors Against 2019-Ncov Coronavirus M Protease from Clinically Approved Medicines. J Genet Genomics 2020; 47(2): 119-21.
59- Nowruzi B, Sarvari G, Blanco S. Applications of Cyanobacteria in Biomedicine. Handbook of Algal Science, Technology and Medicine: Elsevier; 2020: 441-53.
60- Wijewickrama M, Greene A, Cock I. Therapeutics from Cyanobacteria: A Review of Cyanobacteria-Derived Compounds as Anti-Cancer Drug Leads. Pharmacognosy Rev 2023; 17(34): 230-46.
61- So YJ, Lee JU, Yang GS, Yang G, Kim SW, Lee JH, et al. The Potentiality of Natural Products and Herbal Medicine as Novel Medications for Parkinson’s Disease: A Promising Therapeutic Approach. Int J Mol Sci 2024; 25(2): 1071.
62- Sezen Karaoğlan E, Hancı H, Koca M, Kazaz C. Some Bioactivities of Isolated Apigenin-7-O-Glucoside and Luteolin-7-O-Glucoside. Appl Sci 2023; 13(3): 1503.
63- Tuli HS, Bhatia GK, Sood S, Debnath P, Aggarwal D, Upadhyay SK. In Silico Analysis and Molecular Docking Studies of Plumbagin and Piperine Ligands as Potential Inhibitors of Alpha-Glucosidase Receptor. Biointerface Research in Applied Chemistry 2021;11(2): 9629-37.
64- Oyedemi SO, Nwaogu G, Chukwuma CI, Adeyemi OT, Matsabisa MG, Swain SS, et al. Quercetin Modulates Hyperglycemia by Improving the Pancreatic Antioxidant Status and Enzymes Activities Linked with Glucose Metabolism in Type 2 Diabetes Model of Rats: In Silico Studies of Molecular Interaction of Quercetin with Hexokinase and Catalase. J Food Biochem 2020; 44(2): e13127.
65- Kalaimathi K, Thiyagarajan G, Vijayakumar S, Bhavani K, Karthikeyan K, Rani JMJ, et al. Molecular Docking and Network Pharmacology-Based Approaches to Explore the Potential of Terpenoids for Mycobacterium Tuberculosis. Pharmacological Research-Modern Chinese Medicine 2021; 1: 100002.
66- Aviz-Amador A, Contreras-Puentes N, Mercado-Camargo J. Virtual Screening Using Docking and Molecular Dynamics of Cannabinoid Analogs Against CB1 and CB2 Receptors. Computational Biology and Chemistry 2021; 95: 107590.
نوع مطالعه: مروری |
موضوع مقاله:
میکروبیولوژی
دریافت: 1403/12/15 | پذیرش: 1404/2/16 | انتشار: 1404/6/15
دریافت: 1403/12/15 | پذیرش: 1404/2/16 | انتشار: 1404/6/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







